Сравнительный анализ методов контролируемой пациентом аналгезии в абдоминальной хирургии
на правах рукописи
Романова Татьяна Леонидовна
Сравнительный анализ методов контролируемой
пациентом аналгезии в абдоминальной хирургии
14.00.37 – анестезиология и реаниматология
Автореферат
диссертации на соискание
ученой степени кандидата медицинских наук
Москва-2007
Работа выполнена в ГОУ ВПО Московская медицинская академия им. И.М.Сеченова
Научный руководитель:
доктор медицинских наук Овечкин Алексей Михайлович
Официальные оппоненты:
Доктор медицинских наук, профессор Свиридов Сергей Викторович
Доктор медицинских наук, профессор Бутров Андрей Валерьевич
Ведущая организация:
Российская медицинская академия последипломного образования
Защита состоится «__»___________ 2007 года в «___» часов на заседании диссертационного совета Д.208.040.11 Московской Медицинской Академии им.И.М.Сеченова (119992, Москва, ул.Трубецкая 8, кор.2)
С диссертацией можно ознакомиться в библиотеке Московской Медицинской Академии им.И.М.Сеченова (117997, Москва, Нахимовский проспект 49)
Автореферат разослан «___»_________2007 г.
Ученый секретарь диссертационного совета, Тельпухов
доктор медицинских наук, профессор Владимир Иванович
Введение
Актуальность темы
В последние годы существенно возросло количество расширенных хирургических вмешательств на органах брюшной полости, сопровождающихся массивным повреждением тканей и выраженной воспалительной реакцией. Применение современных медицинских технологий позволяет оперировать пациентов с ранее неизлечимыми заболеваниями. В связи с этим возрастает интерес к проблеме совершенствования методов и средств лечения послеоперационного болевого синдрома. Несмотря на значительное количество препаратов и способов их введения, по мнению ряда авторов, качество послеоперационного обезболивания в настоящее время остается неудовлетворительным [Осипова Н.А.,1994, Лебедева Р.Н.,1996, Овечкин А.М.,2000, Semple P., 1991, Ferrante M., 1998, Cousins M.,1991]. От выраженного болевого синдрома в послеоперационном периоде страдают от 30 до 75% пациентов [Harmer M., 1991, Mitsuhata H. et al, 1993, Neugebauer E.,1998, Carr D., Goudas L.,1999, Macianture P.E.,2001]. Отсутствие адекватного обезболивания может служить причиной развития таких осложнений как пневмония, дыхательная недостаточность, нарушения функций сердечно-сосудистой системы в виде аритмий, инфаркта миокарда, тромбоэмболии легочной артерии, вызвать психо-эмоциональную напряженность, нарушение сна, замедленное восстановление перистальтики, дестабилизацию метаболизма, что неблагоприятно повлияет на исход хирургического вмешательства [Bromage P., Camporesi E., 1980, Kehlet H., 1989, Mangano D., 1991, Kehlet H., Holte K., 2001, Kehlet H., Dahl J. B., 1993]. Предлагаются различные методы и рекомендации по лечению боли, но оптимального способа послеоперационного обезболивания в настоящее время нет. Все известные методы обладают различными недостатками. Перспективным направлением оптимизации эффективности обезболивания является технология контролируемой пациентом аналгезии (КПА) (Patient-Controlled Analgesia, PCA), которая позволяет проводить индивидуальную обезболивающую терапию c учетом вариабельности восприятия боли. Это дает возможность пациенту самому определять интенсивность болевого синдрома, необходимость и частоту применения аналгетика, самостоятельно осуществлять его введения с помощью программируемого шприцевого перфузора [Лебедева Р.Н., Никода В.В.,1998, Dahlstrom B. et al, 1982, Lechman K.A.,1995, Ferrante F.M.,1998]. В результате пациент получает немедленный и независимый от персонала доступ к контролю над болью [Шнейдер М.,1998]. Это дает ощущение комфорта, снижает внутреннее беспокойство, формирует положительные эмоции, расширяет возможности для активизации больных и играет положительную роль в благоприятном течении послеоперационного периода [Лебедева Р.Н., Никода В.В.,1998, Weis O.F., Sriwatanakul K., Alloza J.L. et al.,1983, Lehman K.A..,1991, Nottcut W.G., Morgan M.,1990, Macinture P.E., 2001, Kluger M.T., Owen H.,1991]. Контролируемая пациентом аналгезия (КПА) широко применяется во многих странах мира и рассматривается в качестве стандартного метода обезболивания в послеоперационном периоде. Однако в России данный метод используется в ограниченном числе медицинских учреждений.
Анализ современной научной литературы показал недостаточное количество исследований, посвященных данной проблеме. Учитывая вышеизложенное, изучение контролируемой пациентом аналгезии как современного метода обезболивания в абдоминальной хирургии является актуальным и практически значимым.
Цель и задачи исследования
Целью исследования явилась оптимизация применения различных методик контролируемой пациентом послеоперационной анальгезии у больных, перенесших абдоминальные операции различной трвматичности, направленная на улучшение результатов оперативного лечения и ускорение реабилитации.
Для достижения этой цели были поставлены следующие задачи:
- Оценить эффективность методики контролируемой пациентом послеоперационной аналгезии у пациентов, перенесших операции на органах брюшной полости.
- Провести сравнительный анализ эффективности контролируемой пациентом внутривенной аналгезии и контролируемой пациентом эпидуральной аналгезии в завсимости от степени травматичности хирургического вмешательства.
- Изучить влияние различных вариантов контролируемой пациентом аналгезии на частоту кардиальных и респираторных осложнений послеоперационного периода, а также выраженность катаболических процессов.
Научная новизна.
В данной работе впервые исследована и доказана возможность использования нестероидных противовоспалительных преапаратов для контролируемой пациентом внутривенной аналгезии у пациентов, перенесших операции на органах брюшной полости.
Впервые проведен сравнительный анализ эффективности двух наиболее распространенных методик КПА – внутривенной и эпидуральной у пациентов, перенесших абдоминальные операции различной степени травматичности.
Впервые продемонстрировано комплексное положительное влияние методик КПА (преимущественно, эпидуральной КПА) на течение послеоперационного периода, проявляющееся снижением частоты нарушений ритма сердца, сокращением сроков послеоперационного пареза кишечника, быстрым восстановлением нормальной функции дыхательной системы, а также подавлением послеоперационного белкового катаболизма.
Впервые обоснована целесообразность сочетанного применения эпидуральной аналгезии и НПВП с целью оптимизации вышеуказанных положительных эффектов.
Практическая значимость работы.
Результаты, полученные в ходе проведенных исследований, имеют большое значение для практической медицины.
Прежде всего, разработан и обоснован дифференцированный подход к выбору той или иной методики КПА в зависимости от травматичности хирургического вмешательства.
Определены оптимальные режимы проведения внутривенной и эпидуральной КПА, в частности, величины болюсных доз, длительность периода «замыкания» аппарата КПА, скорость фоновой инфузии и т.д.
Разработана оптимальная методика обезболивания у пациентов, перенесших операции на органах брюшной полости высокой травматичности, сочетающая режим эпидуральной КПА с внутривенным введением мощного НПВП – ксефокама.
Внедрение результатов работы в практику.
Разработанные в ходе исследований методики послеоперационного обезболивания используются в работе отделения анестезиологии и реанимации ГКБ №79 г.Москвы. Теоретические данные, полученные в ходе исследований применяются в лекционном курсе кафедры анестезиологии и реаниматологии ММА им..М.Сеченова.
Апробация диссертации
Основные результаты работы были доложены на:
- II-м съезде анестезиологов-реаниматологов Южного федерального округа «Стандарты и индивидуальные подходы в анестезиологии, реаниматологии и интенсивной терапии», Анапа, 28-30 сентября 2005 года
- IV-й Всероссийской научно-практической конференции «Стандарты и протоколы в анестезиологии и интенсивной терапии», Геленджик, 14-17 мая 2006 года
- Всероссийском съезде «Современные направления и пути развития анестезиологии-реаниматологии в Российской Федерации», Москва, 7-10 ноября 2006 года
Положения диссертации, выносимые на защиту
- Контролируемая пациентом аналгезия является эффективным методом послеоперационного обезболивания у пациентов, перенесших хирургические вмешательства на органах брюшной полости
- Выбор методики КПА определяется степенью травматичности перенесенного хирургического вмешательства – внутривенная КПА показана после операций средней травматичности, эпидуральная КПА – после операций высокой травматичности
- Контролируемая пациентом аналгезия оказывает положительное влияние на течение послеоперационного периода, снижая частоту присущих данному периоду осложнений
Публикации
По теме диссертации опубликовано 5 печатных работ.
Структура и объем диссертации
Диссертационная работа изложена на 137 страницах машинописного текста, состоит из введения, обзора литературы (глава 1), четырех глав экспериментальной части, выводов, практических рекомендаций, списка литературы, включающего 219 источников. Работа содержит 23 рисунка и 42 таблицы.
СОДЕРЖАНИЕ РАБОТЫ.
Характеристика больных, методов анестезии и аналгезии.
Объектом клинического исследования стал 251 пациент, находившийся в ГКБ №79 г.Москвы за период 2005-2006 гг. и оперированный как в плановом, так и в экстренном порядке по поводу патологии органов брюшной полости и малого таза с использованием лапаротомного доступа (табл.1).
Таблица 1. Демографическая характеристика
пациентов, включенных в исследование.
| Возраст | 18-30 | 31-45 | 45-60 | 61-75 | >75 |
| м Пол ж | 4 5 | 32 50 | 14 64 | 17 29 | 20 16 |
| Всего:251 | 9 | 82 | 78 | 46 | 36 |
По физическому статусу абсолютное большинство пациентов относилось к II-III классу по ASA. Для выполнения поставленных в исследовании задач все пациенты были методом случайной выборки разделены на группы (таблица 2).
Таблица 2. Характеристика групп пациентов,
включенных в исследование.
| Исследуемые группы | Контрольная группа | |
| Операции средней травматичности (гистерэктомии, холецистэктомии) | ||
| Оценка эффективности КПВА (ксефокам) (n=27) | 1.Промедол 20 мг внутримышечно 2-4 раза в сутки (n=24); 2.Ксефокам 16 мг/сутки внутривенно болюсно (n=22); | |
| Операции высокой травматичности (нижне- и верхнеабдоминальные) | ||
| Оценка эффективности КПВА (ксефокам) (n=23) | Промедол 20 мг внутримышечно 2-4 раза в сутки (n=15) | |
| Операции высокой и средней степени травматичности (нижне- и верхнеабдоминальные) | ||
| 1.Оценка эффективности КПЭА (наропин+фентанил) (n= 52); 2.Оценка эффективности КПЭА (наропин+фентанил) в сочетании с болюсным введением ксефокама 16мг/сутки. (n=30). | 1.Эпидуральная аналгезия (наропин + фентанил) в болюсном режиме (n=26); 2. Промедол внутримышечно 20мг 2-4 раза в сутки (n=32); | |
Оценка эффективности внутривенной контролируемой пациентом аналгезии с использованием НПВС осуществлялась у 50 больных, разделенных на 2 группы- операции средней травматичности (гистерэктомии, холецистэктомии) и операции высокой травматичности. Контрольную группу составили 61 пациент, среди них 24 пациентам после операций средней и 15 после вмешательств высокой травматичности получали внутримышечно промедол 40-80 мг/сутки, у 22 пациентов использовался болюсный режим введения ксефокама по 16 мг/сутки.
Оценка эффективности контролируемой пациентом эпидуральной аналгезии (КПЭА) с использованием наропина и фентанила была проведена у 52 больных, у 30 пациентов КПЭА сочеталась с болюсным введением ксефокама по 16 мг/сутки. Контрольную труппу составили 26 пациентов, которым эпидуральная аналгезия проводилась в болюсном режиме, и 32 пациента получали внутримышечно промедол по 40-60 мг/сутки.
При операциях в данном исследовании применялись следующие методы анестезии – общая анестезия (ОА), спинальная анестезия (СА). Общая анестезия (198 больных) проводилась препаратами для нейролептаналгезии на фоне ИВЛ кислородно-закистой смесью либо с добавлением ингаляционных анестетиков (фторотан, сиваран), либо с использованием постоянной внутривенной инфузии пропофола через диприфузор. Пункция субарахноидального пространства при проведении спинальной анестезии проводилась по стандартной методике на уровне LIII-IV иглой типа Pencil Point диаметром 25-27G. В качестве анестетика использовали 0,5% раствор спинального маркаина либо спинального маркаина хэви в количестве 3-4 мл. (53 больных при гистерэктомиях).
Для проведения КПЭА и ЭА в болюсном режиме эпидуральное пространство катетеризировалось по стандартной методике с помощью набора “Minipack-1” (“SIMS Portex”) иглой диаметром 16G. Эпидуральный катетер фиксировали к коже самоклеющим фиксирующим устройством “Epi-Fix” (Maersk Medical), проводилось введение тест-дозы (2% раствор лидокаина – 4 мл), дальнейшее введение препаратов проводилось в послеоперационном периоде.
Исследование эффективности послеоперационного обезболивания по методу КПА осуществлялось при помощи инфузионной помпы “Aitecs SP-14S PCA”. Данный прибор представляет собой шприцевой перфузор со встроенным микропроцессором, который позволяет пациенту посредством нажатия на кнопку на выносном пульте осуществлять аутоаналгезию в соответствии с программой, обеспечивающей доставку определенного количества препарата (болюсной дозой) и препятствующей передозировке через наличие таких параметров, как локаут–интервал и максимально допустимая доза.
Таблица 3. Структура хирургических вмешательств
| Тип хирургического вмешательства | Число пациентов |
| I. Операции средней травматичности | |
| 1.Холецистэктомия | 46 |
| 2.Гистерэктомия | 74 |
| II. Операции высокой травматичности | |
| 1.Гастрэктомия | 5 |
| 2.Резекция желудка | 8 |
| 3.Резекция желудка с холецистэктомией | 2 |
| 3. Прошивание кровоточащей язвы желудка, ваготомия | 11 |
| 4. Оментобурсостомия | 11 |
| 5.Наложение цистоеюноанастомоза | 8 |
| 6.Гемиколэктомия | 16 |
| 7.Резекция сигмовидной кишки | 11 |
| 8.Резекция тонкой кишки | 9 |
| 9.Передняя резекция прямой кишки | 9 |
| 9.Пилоропластика, ваготомия | 11 |
| 10.Рассечение спаек, назоинтестинальная интубация кишечника | 8 |
| 11. Лапаротомия, аппендэктомия, санация, дренирование брюшной полости | 8 |
| 13.Панкреато-дуоденальная резекция | 3 |
| 14. Билио-дигестивный анастомоз | 10 |
| 15. Экстирпация пищевода с пластикой | 1 |
| Итого: | 251 |
Методы исследования.
Оценка уровня интенсивности болевых ощущений проводилась при помощи 10-бальной визуально-аналоговой шкалы (ВАШ) в течение 2-3 суток после операции: первые 5 часов каждый час, а в последующем каждые три часа с соответствующими отметками в карте послеоперационного наблюдения. Кроме этого, оценивали среднюю интенсивность боли за 1-е сутки, за 2-е сутки. Выявляли наличие и интенсивность так называемых «прорывающихся болей», интенсивность которых не менее чем в два раза превышала среднюю интенсивность болевых ощущений в течение суток. Проводилась оценка адекватности обезболивания: основным критерием являлся уровень боли < 4 баллов по ВАШ при кашле. Во всех группах подсчитывался процент пациентов, у которых обезболивание можно было считать адекватным.
Подсчитывали количество пациентов, нуждающихся в дополнительном обезболивании и средние дозы промедола на одного больного. В контрольных группах оценивался временной интервал от просьбы об обезболивании до введения аналгетика.
У пациентов, получающих в послеоперационном периоде различные виды КПА, использовалась компьютерная программа «Aitecs PCA administration database V 2.6.0.3.» SEP-12S Plus. Она позволяла получить подробную информацию о почасовом потреблении аналгетика в течение суток, подсчитать количество просьб пациента, попадающих на локаут- интервал, процентное отношение доставленного количества препарата к требуемому. Полученные результаты были сопоставлены с динамикой болевого синдрома в течение суток.
Для изучения влияния метода послеоперационного обезболивания на частоту и тяжесть кардиальных осложнений использовали систему холтеровского мониторирования CardioDay с рекодером CardioMem, что позволяло провести почасовой анализ ЧСС, нарушений сердечного ритма и эпизодов ишемии миокарда. Полученные данные сопоставлялись с выраженностью болевого синдрома и почасовым потреблением аналгетика.
Для оценки функционального состояния дыхательной системы использовали нагрузочный спирометр Portex, который позволяет измерить максимальную инспираторную емкость легких. Определяли этот показатель до операции, через 30 минут после поступления в ОРИТ, через 3 часа, через 6 часов, в конце 1-х суток и перед переводом в отделение. Это позволило выявить зависимость величины снижения респираторных функций и сроков их восстановления при различных видах послеоперационного обезболивания. Кроме того, оценивалась частота и тяжесть пневмоний, ателектазов, респираторного дистресс-синдрома, проводилась рентгенография грудной клетки на 2-е сутки и при переводе в отделение.
У всех пациентов, включенных в данное исследование, проводился подсчет азота мочевины суточной мочи, который достоверно отражает уровень белкового катаболизма, так как мочевина содержит около 4/5 общего азота мочи (Barendregt K., Soeters P.B., Allison S.P.,2003). Мочевина в суточной моче определялась ферментативно-уреазным методом в ммоль/л, далее вычисление содержания азота проводилось по следующим формулам:
К М/10 =концентр. мочевины (мг/дл)
К- концентрация мочевины ( ммоль/л);
М- молярная масса мочевины (г/моль)
m=Mn
m-масса вещества (г); M- молярная масса (г/моль); n- количество вещества (моль);
n(мочевины)=n(азота); M((NH2)2CO) = 60 г/моль; M(N2)= 28 г/моль
m ((NH2)2CO)/M ((NH2)2CO)= m (N2)/M (N2)
m (N2)(мг/дл)= m (NH2)2CO) M (N2)/ M (NH2)2CO)
m (N2)(мг/дл)= m (NH2)2CO) 28/60= m (NH2)2CO)/2,14= КМ/102,14=К6/2,14
N2 (суточный, мг/сут)= m (N2)(мг/дл) V (мочи за сутки, дл)= К6/2,14 (мочи за сутки, дл)
N2 (суточный, г/сут)=К6V (мочи, дл)/2,141000
Статистическая обработка полученных результатов проводилась на IBM PC с использованием программы «Statistica for Windows 4.3».
Анализ эффективности внутривенной контролируемой пациентом аналгезии с использованием НПВП и оценка ее влияния на течение послеоперационного периода.
Препаратом выбора в нашем исследовании являлся ксефокам, который, в отличие от диклофенака, кеторолака и ряда других НПВП, может вводиться как внутримышечно, так и внутривенно. Характеристика основных параметров КПВА представлена в таблице 4.
Таблица 4. Характеристика основных параметров КПВА ксефокамом
| Концентрация ксефокама (мг/мл) | 0,32-0,5 |
| Нагрузочная доза (мг) | 2,56-5,12 |
| Болюсная доза (мг) | 1,28-2,56 |
| Локаут-интервал (мин) | 10-15 |
| Скорость постоянной инфузии (мл/ч) | 0,1 |
| Максимально допустимая доза за 4 часа (мг) | 15 |
| Максимально допустимая доза за сутки (мг) | 24 |
При операциях средней травматичности адекватное обезболивание (менее 4 баллов по ВАШ при кашле) было достигнуто у 52% больных в первые и у 66,7% - во вторые сутки после операции. Средняя интенсивность боли составила: за первые 5 часов 2,96±0,07 в покое, 3,9±0,08 при кашле; в первые сутки – 2,93±0,09 в покое, 3,85±0,14 при кашле, во вторые сутки – 2,3±0,12 и 3,7±0,13, за двое суток 2,62±0,1 и 3,77±0,10 (таблица 5). Дополнительное обезболивание потребовалось 48% больных в первые (доза промедола составила 12,8±3,1 мг на одну больную) и 11% - во вторые сутки (доза промедола – 2,4 ±1,09 мг на одну больную).
В группе пациентов, которым проводилось внутримышечное введение промедола по 40-60 мг в сутки, средняя величина интенсивности болевого синдрома была выше и составила за 5 часов 3,20± 0,12 в покое и 4,30±0,11 при кашле, за 1-е сутки 3,58±0,14 и 4,27±0,13, за 2-е сутки 3,3±0,14 и 4,22±0,16, за двое суток 3,40±0,13 и 4,30±0,12 (таблица 5). Адекватное обезболивание было достигнуто у 25% пациентов в 1-е сутки и у 37,5 % - во 2-е сутки. У 35% больных интенсивность болей усиливалась на 2-е сутки, причем процент больных, отмечающих наличие «прорывающихся» болей достигал 33,3 %.
При операциях высокой травматичности адекватное обезболивание было достигнуто у 34,7% больных в 1-е сутки и у 43,4 % во 2-е сутки после операции.
Средняя интенсивность боли составила в первые 5 часов 3,52±0,14 в покое и 4,38±0,22 при кашле, за 1-е сутки- 3,82±0,16 и 4,26±0,22, за 2-е сутки- 3,29±0,10 и 3,99±0,13, за двое суток- 3,60±0,13 и 4,20±0,10 (таблица 5). 60,8% пациентов отмечали наличие «прорывающихся болей» в 1-е сутки (средняя интенсивность 5,1±0,8 баллов) и 21,7% (средняя интенсивность 5,2±1,4 балла)- во 2-е сутки. Дополнительное обезболивание было необходимо у 65,2% больных (средний расход промедола 26,95±5,36 мг) и 30,4 % (средний расход промедола 12,2±4,5 мг) во вторые сутки.
В контрольной группе адекватное обезболивание в 1-е сутки было достигнуто у 30% пациентов, во 2-е – у 40%. Средняя интенсивность болей была выше и составляла за 5 часов 3,78±0,17 в покое и 4,95±0,18 при кашле, за 1-е сутки 4,10±0,11 и 4,89±0,14, за 2-е сутки 3,71±0,17 и 4,73±0,25, за двое суток – 3,90±0,13 и 4,80±0,17; «прорывающиеся боли» отмечались у 21,7 % (средняя интенсивность 6,2±0,8 балла) в 1-е сутки, у 40 % - на 2-е сутки (6,5±0,3 балла).
Большинство пациентов, давших высокую оценку КПВА, подчеркнули, что главным положительным свойством метода они считают возможность самостоятельного обезболивания, что устраняет ощущение беспомощности и зависимости от медицинского персонала, а также улучшает психологическую адаптацию к условиям послеоперационной палаты.
Влияние КПВА ксефокамом на функциональную реабилитацию пациентов и частоту послеоперационных осложнений. Мы исследовали содержание мочевины в моче с последующим подсчетом количеств выделенного азота за сутки по вышеприведенной формуле. Было установлено, что у пациентов, которые получали ксефокам, потери азота в 1-е сутки после среднетравматичных операций составили 4,1±0,72 г/сутки, у пациентов контрольной группы – 9,5±1,4 г/сутки, после высокотравматичных операций – 10,5±1,8 г/сутки, в контрольной группе – 15,1±1,7 г/сутки (таблица 6). Таким образом, в нашем исследовании потери азота были ниже у пациентов основной группы по сравнению с контрольной на 57% при среднетравматичныхт вмешательствах, на 30% при высокотравматичных вмешательствах. Следует отметить, что катаболическая реакция в первые двое суток после операции является неизбежной, однако снижение ее выраженности наряду с максимально ранним восстановлением энтерального питания значительно сокращает сроки реабилитации пациентов и пребывание их в отделении реанимации. Возможность кормления зависит от сроков восстановления перистальтики, на которые также положительно влияла КПВА ксефокамом.
Таблица 5. Динамика интенсивности послеоперационного болевого синдрома при различных методах обезболивания
| Средняя интенсивность боли | |||||||||
| Метод обезболивания вид оперативного вмешательства | За 5 часов | За 1-е сутки | За 2-е сутки | За двое суток | |||||
| Покой | Кашель | Покой | Кашель | Покой | Кашель | Покой | Кашель | ||
| КПА ксефокам (среднетравматичные вмешательства) | 2,96± 0,07 | 3,90±0,08 | 2,93±0,09 | 3,85±0,14 | 2,30±0,12 | 3,70±0,13 | 2,62±0, 10 | 3,77±0,10 | |
| Контрольная группа Промедол в/м 40-80мг | 3,20± 0,12 | 4,30±0,11 | 3,58±0,14 | 4,37±0,13 | 3,30± 0,14 | 4,22±0,16 | 3,40± 0,13 | 4,30±0,12 | |
| p<0,005 | |||||||||
| КПА ксефокам (высокотравматичные вмешательства) | 3,52±0,14 | 4,38± 0, 22 | 3,82±0, 16 | 4,26±0,22 | 3,29±0,10 | 3,99±013 | 3,60±0,13 | 4,20±0,14 | |
| Промедол в/м 40-80мг | 3,78±0,17 | 4,95±0,18 | 4,10±0,11 | 4,89±0,14 | 3,71±0,17 | 4,73±025 | 3,90±0,13 | 4,80±0,17 | |
Таблица 6. Потери азота и сроки восстановления
перистальтики на фоне КПВА.
| Среднетравматичные вмешательства | Высокотравматичные вмешательства | |||
| КПВА | контроль | КПВА | контроль | |
| Потери азота в 1-е сутки (г) | 4,1±0,72 * | 9,5±1,4 | 10,5±1,8 * | 15,1±1,7 |
| Сроки восстановления перистальтики (час) | 23,52±2,36 ** | 31,4±3,43 | 46,4±4,26 * | 59,43±6,29 |
* р<0,001 по сравнению с контрольной группой 2; ** р<0,005 по сравнению с контрольной группой
Более ранние сроки восстановления перистальтики у больных, получавших ксефокам, объясняются системным противовоспалительным и опиоидсберегающим эффектом данного препарата. Таким образом, полученные результаты свидетельствуют о том, что наряду с ограничением выраженности катаболической фазы послеоперационного периода уменьшаются сроки разрешения пареза кишечника, что в конечном итоге определяет период выздоровления.
Анализ данных холтеровского мониторирования и результатов нагрузочной спирометрии не выявил достоверных различий по частоте послеоперационных жизнеугрожающих нарушений ритма, а также скорости восстановления нормальных функций дыхательной системы между пациентами исследуемых и контрольных групп.
Анализируя полученные данные, можно сделать вывод, что при введении ксефокама по технологии КПВА пациентам, перенесшим операции средней травматичности, интенсивность болевого синдрома ниже, а процент достижения адекватного обезболивания выше, чем при использовании в качестве базисной терапии послеоперационного болевого синдрома промедола внутримышечно болюсно.
При анализе результатов применения КПВА ксефокамом в группе больных, перенесших высокотравматичные вмешательства, обращает на себя внимание достаточно низкий процент пациентов, у которых обезболивание было признано адекватным. Единственным положительным отличием основной группы от контрольной было значительное снижение потребности в промедоле (pис.1).

Рис.1. Средний расход промедола (мг/сут) при применении различных методов обезболивания: 1 – КПВА среднетравматичные операции; 2 –
контрольная группа 1; 3 – контрольная группа 2; 4 – КПВА высокотравматичные вмешательства; 5 – контрольная группа
Таким образом, представленные данные дают возможность сделать вывод, что КПВА с использованием ксефокама является эффективным методом послеоперационного обезболивания при абдоминальных вмешательствах средней травматичности, а после высокотравматичныъх операций характеризуется достаточно низкой эффективностью.
Контролируемая пациентом эпидуральная аналгезия, оценка эффективности и ее роли в профилактике послеоперационных осложнений.
КПЭА наилучшим образом сочетает в себе все преимущества эпидурального пути введения препаратов с возможностью удовлетворять индивидуальные потребности пациентов в обезболивании. В качестве препарата мы выбрали наиболее современный местный анестетик – наропин, который наряду с выраженной аналгетической активностью является наименее кардио- и нейротоксичным. Мы провели исследование по подбору оптимальных режимов дозирования и концентраций препарата при введении по технологии КПА (таблица 7).
Адекватное обезболивание при проведении КПЭА было достигнуто у 90,3% пациентов в 1-е и у 84,6% пациентов во 2-е сутки после операции.
Средняя интенсивность боли при проведении КПЭА без постоянной инфузии составила за 5 часов 1,49±0,15 и 2,57±0,15; за 1-е сутки 1,35±0,14 и 2,80±0,19; за 2-е сутки 1,30±0,16 и 2,60±0,12; за двое суток 1,36±0,1 и 2,69±0,12 в покое и при кашле соответственно (таблица 8). У пациентов, которым в программу КПА была включена постоянная инфузия, средняя интенсивность боли составила за 5 часов 1,38±0,17 и 2,48±0,13; за 1-е сутки 1,30±0,12 и 2,67±0,14; за 2-е сутки 1,27±0,14 и 2,50±0,16; за двое суток 1,30±0,12 и 2,60±0,19 в покое и при кашле соответственно.
Таблица 7. Характеристика основных параметров КПЭА
| Концентрация наропина (мг/мл) фентанила (мг/мл) | 3,75-5,0 0,03 |
| Нагрузочная доза (мг) | 15-30,0 |
| Болюсная доза (мг) | 11,2-25,0 |
| Локаут-интервал (мин) | 10-15 |
| Скорость постоянной инфузии (мг/ч) | 0,375-5,0 |
| Максимально допустимая доза за 4 часа (мг) | 150 |
| Максимально допустимая доза за сутки (мг) | 672 |
У пациентов, которым проводилась КПЭА в сочетании с внутривенным болюсным введением ксефокама адекватное обезболивание было достигнуто в 93,3% в 1-е и 86,7% во 2-е сутки. Средняя интенсивность боли составила за 5 часов 0,68±0,09 и 1,78±0,16; за 1-е сутки 1,10±0,10 и 2,39±0,13; за 2-е сутки 1,07±0,14 и 2,58±0,18; за двое суток 1,07±0,12 и 2,42±0,15 в покое и при кашле соответственно.
В группе пациентов, которым проводилась КПЭА без фоновой инфузии не было отмечено случаев развития моторной блокады, гипотензия со снижением артериального давления более, чем на 20% от исходного уровня возникла у 25% пациентов, причем у 9% коррекция проводилась только увеличением объема инфузии, у 16% инфузией дофамина в дозе 5-7 мкг/кг в мин в 1-е сутки, на 2-е сутки гемодинамика у всех пациентов стабилизировалась. При проведении КПЭА с фоновой инфузией моторная блокада степени B-1 развилась у 30% пациентов, у 70% возникала гипотензия, требующая во всех случаях ионотропной поддержки, причем у 40% она сохранялась на протяжении 2-х суток. У пациентов, которым проводилась КПЭА в сочетании с ксефокамом, развития моторной блокады отмечено не было, гипотензия развилась у 18% пациентов в 1-е сутки, причем только у 10,7% возникла необходимость в инфузии дофамина.
У пациентов, которым обезболивание проводилось методом внутримышечного введения промедола, адекватное обезболивание достигнуто в 34,3% в 1-е и 46,9% во 2-е сутки. Средняя интенсивность болей составила 3,82±0,12 и 4,9±0,16 за 5 часов; 4,10±0,14 и 4,80±0,17 за 1-е сутки; 3,80±0,17 и 4,40±0,18 за 2-е сутки; 4,0±0,13 и 4,6±0,18 за двое суток в покое и при кашле соответственно (таблица 8)..
Таким образом, среднее значение интенсивности болевого синдрома было наиболее низким в группе, получающей КПЭА в сочетании с ксефокамом.
Таблица 8. Динамика интенсивности послеоперационного
болевого синдрома при использовании КПЭА
| Метод обезболи-вания | Средняя интенсивность боли | |||||||
| За 5 часов | За 1-е сутки | За 2-е сутки | За двое суток | |||||
| Покой | Кашель | Покой | Кашель | Покой | Кашель | Покой | Кашель | |
| КПЭА без инфузии (n=25) | 1,49± 0,15 | 2,57± 0,15 | 1,35± 0,14 | 2,80± 0,19 | 1,30± 0,16 | 2,60± 0,12 | 1,36± 0,1 | 2,69± 0,12 |
| КПЭА с инфузией (n=27) | 1,38± 0,17 | 2,48± 0,13 | 1,30± 0,12 | 2,67± 0,14 | 1,27± 0,14 | 2,50± 0,16 | 1,30± 0,12 | 2,6± 0,19 |
| КПЭА+ксефокам (n=30) | 0,68± 0,09 | 1,78± 0,16 | 1,10± 0,10 | 2,39± 0,13 | 1,07± 0,14 | 2,58± 0,18 | 1,07± 0,12 | 2,42±0,15 |
| Контрольная группа Промедол внутри-мышечно 20-40мг (n=26) | 3,82± 0,12 | 4,90± 0,16 | 4,10± 0,14 | 4,80± 0,17 | 3,80± 0,17 | 4,40± 0,18 | 4,0± 0,13 | 4,60± 0,18 |
р <0,001 по отношению к контрольной группе
Следует отметить, что КПЭА получила высокую оценку со стороны пациентов и большинство из них выбрали бы данный метод обезболивания при необходимости оперативных вмешательств в будущем.
Влияние метода обезболивания на выраженность катаболической фазы послеоперационного периода. У пациентов, которым проводилась КПЭА, потери азота составили 9,3±1,3 г/сутки, при сочетании КПЭА с внутривенным введением ксефокама – 2,75±0,45 г/сутки; при проведении обезболивания по методу внутримышечного введения промедола – 12,5±1,4 г/сутки (таблица 9). Полученные данные свидетельствуют о том, что совместное назначение КПЭА с ксефокамом сопровождается снижением потерь на 78% по сравнению с контрольной группой. При проведении только КПЭА этот показатель всего на 26% меньше, чем у пациентов, получающих промедол внутримышечно. Использование КПЭА приводило и к более раннему восстановлению перистальтики по сравнению с контрольной группой (таблица 9).
Таблица 9. Потери азота и сроки восстановления
перистальтики на фоне КПЭА.
| Высокотравматичные вмешательства | |||
| КПЭА | КПЭА + ксефокам | Контрольная группа (промедол в/м) | |
| Потери азота в 1-е сутки (г) | 9,3±1,3 | 2,8±0,5 | 12,5±1,4 |
| Сроки восстановления перистальтики (час) | 25,76±2,6 | 22,49±4,3 | 65,11±5,6 |
р<0,001 по сравнению с контрольной группой
Таким образом, комбинированное использование наропина и фентанила по технологии КПЭА с внутривенным болюсным введением ксефокама приводило к нормализации белкового обмена в максимально ранние сроки послеоперационного периода за счет суммирования выраженного стимулирующего влияния эпидурально вводимых анестетиков на восстановление перистальтики с азотсберегающим эффектом ксефокама. Данную методику послеоперационного обезболивания мы считаем оптимальной для пациентов, перенесших полостные операции высокой травматичности.
Влияние КПЭА на развитие послеоперационных осложнений. В нашем исследовании мы оценивали частоту возникновения кардиальных, легочных осложнений. Среди пациентов, получавших в послеоперационном периоде КПЭА, жизнеопасных аритмий (ранние, парные ЖЭ, пробежки желудочковой тахикардии ЖТ, бигеминии) зафиксировано не было (таблица 10). Среди пациентов контрольной группы, получающих внутримышечно промедол, за 1-е сутки после операции у 20% регистрировался синусовый ритм с тенденцией к тахикардии, у 28% - частые НЖЭС (до 100-250 за сутки), у 20% - пробежки НЖТ (до 12-15 за сутки), у 20% - значительное количество ЖЭ (до 1165 за сутки), в том числе парных, пробежки ЖТ, у 12% - пароксизмы мерцания предсердий, причем у 2 пациентов возникла необходимость введения противоаритмических препаратов. На 2-е сутки синусовая тахикардия сохранялась у 44% больных, у 32% НЖЭС, у 16% одиночные и парные ЖЭ, у 8% пароксизмы мерцательной аритмии и преходящие нарушения проводимости. У пациентов, получающих в послеоперационном периоде промедол внутримышечно, был отмечен самый высокий процент развития эпизодов тахикардии, синусовой аритмии, наиболее частая наджелудочковая и предсердная экстрасистолия, пароксизмы НЖТ и мерцательной аритмии (в том числе клинически значимые), парные ЖЭ и пробежки ЖТ. При сопоставлении почасовых показателей, характеризующих сердечный ритм с динамикой оценки боли по ВАШ отмечена выраженная корреляция возникновения аритмий с увеличением интенсивности болевого синдрома, среднее значение которого в исследуемых группах было значительно ниже по сравнению с контрольными. Кроме того, мы выявили статистически значимую разницу по частоте возникновения жизнеугрожающих нарушений сердечного ритма (ЖЭ и ЖТ) у пациентов, получающих КПЭА по сравнению с теми, у которых в послеоперационном периоде обезболивание проводилось в/м введением промедола. При оценке динамики сегмента ST достоверных различий между основной и контрольными группами выявлено не было.
Таблица 10. Частота нарушений сердечного ритма у пациентов с КПЭА
| Вид аритмии | КПЭА | КПЭА+ксефокам | Промедол в/м | |||
| 1-е | 2-е | 1-е | 2-е | 1-е | 2-е | |
| Синусовый ритм | 37% | 55% | 43% | 54% | 20% | 44% |
| Синусовая аритмия+НЖЭС | 43% | - | 25% | - | - | - |
| НЖЭС | - | 26% | 11% | 18% | 28% | 32% |
| Пробежки НЖТ | 11% | 12% | 14% | 25% | 20% | |
| ЖЭ одиночные | 9% | 7% | 7% | 3% | - | 16% |
| ЖЭ+бигеминия | - | - | - | - | - | - |
| ЖЭ+пробежкиЖТ | - | -* | - | -* | 20% | - |
| Пароксизм мерцания предсердий | - | - | - | - | 12% | 8% |
* p<0,05 по сравнению с контрольной группой
При оценке функционального состояния дыхательной системы (данные представлены в таблице 11 и на рисунке 2) было установлено, что в исследуемых группах (КПЭА и КПЭА+ксефокам) объем вдоха возвращался к исходному уровню гораздо быстрее, чем в контрольных. При этом значительный прирост объема происходил во временном интервале от 3 до 6 часов и соответствовал стабилизации уровня болей на достаточно низком уровне за счет действия нагрузочной дозы и первых пробных нажатий при помощи медицинского персонала. Самые низкие результаты получены в группе, получающей в качестве основного аналгетика промедол. В данном случае наряду с большей интенсивностью болевого синдрома имела значение и седация, которая не только замедляла нормализацию механической функции легких, но и активизацию пациентов в целом и имела особо важное значение ко 2-м суткам, когда пациенты основных групп могли свободно двигаться, откашливаться и переводились в профильное отделение.
Таблица 11. Динамика восстановления инспираторной емкости легких в послеоперационном периоде (% от исходного значения)
| Период времени | КПЭА | КПЭА+ксефокам | Промедол в/м |
| До операции | 2060,5±364,5 (100%) | 1893,2±345,8 (100%) | 2223,4±430,7 (100%) |
| Через 30 мин после поступления | 534,8± 84,6 (26 %) | 512,8±95,8 (27 %) | 346,1±82,22 (16 %) |
| Через 3 часа | 762,7±143,1 (37 %) | 664,7±124,2 (35 %) | 577,9±115,5 (27 %) |
| Через 6 часов | 1071,4±189,5 (52 %) | 1198,9±225,2 (63 %) | 778,1±150,7 (35 %) |
| К концу 1-х суток | 1674,7±249,3 (78 %) | 1670,9±312,1 (88 %) | 1229,3±267,4 (58 %) |
| При переводе в отделение | 1910,1±310,4 (92 %) | 1833,2±346,7 (97 %) | 1590,9±328,9 (73 %) |
Таким образом, мы обнаружили, что скорость нормализации послеоперационных вентиляционных нарушений в значительной степени зависит от метода обезболивания. Летальность в основной группе составила 5,8%, в контрольной – 18,8%.
Таким образом, по данной части исследований можно сделать выводы, что КПЭА: а) является эффективным методом послеоперационного обезболивания при абдоминальных вмешательствах средней и высокой травматичности и позволяет достичь адекватного обезболивания у 90,3% пациентов в 1-е сутки и у 84,6% во 2-е сутки, б) КПЭА снижает частоту развития потенциально опасных нарушений ритма сердца и способствует раннему восстановлению нормальной функции легких, в) комбинированное использование КПЭА с ксефокамом способно повысить качество обезболивания и обеспечить раннюю нормализацию белкового обмена
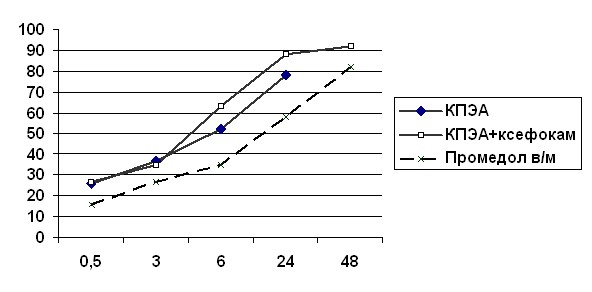
Рис.2. Динамика восстановления инспираторной емкости легких в послеоперационном периоде
(в процентах от исходного уровня)
выводы
- Контролируемая пациентом аналгезия является эффективным и безопасным методом послеоперационного обезболивания в абдоминальной хирургии;
- Контролируемая пациентом внутривенная аналгезия с использованием ксефокама позволяет достичь адекватного обезболивания в 52% случаев (1-е сутки после операции) и 66,7% случаев (2-е сутки) у пациентов, перенесших хирургические вмешательства средней травматичности;
- Применение данной методики обезболивания у пациентов, перенесших операции высокой травматичности, характеризуется низкой эффективностью (34,7% в первые сутки и 43,4 - во вторые сутки) и может быть оправдано лишь при наличии противопоказаний к проведению эпидуральной аналгезии;
- После операций высокой травматичности, контролируемая пациентом эпидуральная аналгезия позволяет достичь адекватного обезболивания в 90,3 % случаев (1-е сутки после операции) и 86,7 % случаев (2-е сутки), что позволяет рассматривать ее как метод выбора у данной категории пациентов;
- Контролируемая пациентом эпидуральная анальгезия (особенно, в сочетании с внутривенным введением ксефокама) оказывает положительное влияние на течение послеоперационного периода, что проявляется: а) сокращением сроков пареза кишечника, б) снижением послеоперационных потерь азота, в) снижением частоты послеоперационных нарушений ритма сердца, г) быстрым восстановлением нормальной функции дыхания.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Ксефокам является оптимальным нестероидным противовоспалительным препаратом для применения в режиме КПВА;
- Рекомендуемая концентрация препарата составляет 0,32-0,5 мг/мл, болюсная доза находится в пределах 1,28-2,56 мг, локаут-интервал 10-15 минут, нагрузочная доза 2,56-5,12 мг, скорость постоянной инфузии устанавливается на минимальном уровне;
- Ропивакаин является наиболее пригодным препаратом для длительного эпидурального введения в раннем послеоперационном периоде;
- Сочетание его с фентанилом позволяет добиться адекватного обезболивания на фоне уменьшения дозы местного анестетика и снизить вероятность развития побочных эффектов;
- Наиболее оптимальное соотношение по критерию эффективность-безопасность достигалось при использовании наропина в концентрации 0,375-0,5% в сочетании с фентанилом 0,03 мг/мл;
- Рекомендуемая болюсная доза составила для наропина 11,2-25,0 мг, локаут-интервал-10-15 минут,
- Целесообразно введение в программу КПА нагрузочной дозы в размере 15-30,0 мг наропина, скорость постоянной инфузии 0,375-0,5 мг/час является необходимым условием поддержания проходимости катетера;
- Для уменьшения частоты и интенсивности «прорывающихся болей» может быть установлена скорость постоянной инфузии 5 мг/час. Однако при этом увеличивается доза вводимого наропина и фентанила, что влечет за собой повышение частоты развития таких побочных эффектов, как моторная блокада и гипотензия и требует более тщательного мониторинга;
- Сочетание КПЭА с болюсным внутривенным введением ксефокама по 16 мг/сутки позволяет добиться улучшения качества обезболивания и снизить вероятность развития гипотензии за счет уменьшения дозы эпидурально вводимых препаратов и суммирования эффектов аналгетиков с различным механизмом действия.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ.
- Романова Т.Л., Овечкин А.М., Николаев И.В. Использование различных вариантов контролируемой пациентом анальгезии (КПА) для послеоперационного обезболивания в абдоминальной хирургии. // Вестник интенсивной терапии.- Ж.-М. – 2005. - №5. – С.123-125.
- Овечкин А.М., Федоровский Н.М., Романова Т.Л. Мультимодальная анальгезия в послеоперационном периоде: стандарты и протоколы. // Вестник интенсивной терапии. Ж.-М. – 2006. - №5. – С.66-69.
- Овечкин А.М., Романова Т.Л. Послеоперационное обезболивание: оптимизация подходов с точки зрения доказательной медицины. // Русский медицинский журнал. – 2006. - №12. – С.865-872.
- Романова Т.Л., Николаев И.В. Сравнительный анализ эффективности различных вариантов послеоперационной контролируемой пациентом анальгезии в абдоминальной хирургии. // Сборн. материалов Всероссийского съезда «Современные направления и пути развития анестезиологии-реаниматологии в Российской Федерации», Москва, 7-10 ноября 2006. – С.104-106.
- Романова Т.Л., Николаев И.В., Овечкин А.М., Абрамсон П.И., Москаленко Н.П. Влияние различных вариантов контролируемой пациентом аналгезии на частоту и характер послеоперационных осложнений в абдоминальной хирургии. // Регионарная анестезия и лечение острой боли.-Ж.-М. – 2007. - №1. – С.
Список сокращений
ВАШ – визуально-аналоговая шкала
ЖТ – желудочковая тахикардия
ЖЭ – желудочковые экстрасистолы
КПА – контролируемая пациентом аналгезия
КПВА – контролируемая пациентом внутривенная аналгезия
КПЭА – контролируемая пациентом эпидуральная аналгезия
МА – местный анестетик
НЖТ – наджелудочковая тахикардия
НЖЭС – наджелудочковая экстрасистолия
НПВП – нестероидные противовспалительный препараты
ОА – общая анестезия
ПБС – послеоперационный болевой синдром
ПЭ – предсердные экстрасистолы
СА – спинальная анестезия
ЭА – эпидуральная анестезия

