Восстановление печени при ее массивной резекции и токсическом повреждении в эксперименте
На правах рукописи
КОЧЕРГИН МАКСИМ ВАДИМОВИЧ
ВОССТАНОВЛЕНИЕ ПЕЧЕНИ ПРИ ЕЕ МАССИВНОЙ РЕЗЕКЦИИ И ТОКСИЧЕСКОМ ПОВРЕЖДЕНИИ В ЭКСПЕРИМЕНТЕ
14.00.27 – ХИРУРГИЯ
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук
Москва - 2009
Работа выполнена в ГОУ ВПО Московская медицинская академия
им. И.М. Сеченова
Научный руководитель:
доктор медицинских наук,
профессор Гальперин Эдуард Израилевич
Официальные оппоненты:
доктор медицинских наук,
профессор Липницкий Евгений Михайлович
доктор медицинских наук,
профессор Буриев Илья Михайлович
Ведущая организация:
ФГУ «Институт хирургии им. А.В. Вишневского».
Защита диссертации состоится «___» ____________2009 г. в __ ч на заседании Диссертационного совета Д.208.040.03 при ГОУ ВПО Московская медицинская академия им. И.М. Сеченова (119991, г. Москва, ул. Трубецкая, д. 8, стр. 2).
С диссертацией можно ознакомиться в ГЦНМБ ГОУ ВПО Московская медицинская академия им. И.М. Сеченова (117998, г. Москва, Нахимовский проспект, д. 49).
Автореферат разослан «___»___________2009 г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук,
профессор Шулутко Александр Михайлович
ОБЩАЯ ХАРАКТЕРИСТИКА ДИССЕРТАЦИИ
Актуальность проблемы
Повреждение печени при ее обширной резекции, токсическом или вирусном поражении связано с риском развития острой печеночной недостаточности (ОПН). ОПН является серьезным ограничивающим фактором в хирургии печени, может осложнять течение ряда внепеченочных заболеваний и сопровождается высокой летальностью [Э.И.Гальперин, 2005; С.В.Журавель, 2004; С.М.Чудных, 2000]. Эффективность современных способов лечения ОПН является достаточно низкой и, хотя большие надежды возлагаются на трансплантацию печени, в экстренных ситуациях такая операция трудно осуществима [С.В.Журавель, 2004; H.Bismuth, 1996].
В ряде экспериментальных работ было показано, что супернатанты (надосадочный слой, получаемый при центрифугировании гомогената печени) из регенерирующей и неонатальной печени способны усиливать регенерацию и улучшать функциональное состояние печени после ее повреждения [J. Terblanche и др., 1980; Н.Л.Сванадзе, 1984; D.R. LaBrecque и др., 1991; A.Francavilla и др., 1994; A.P.Margeli и др., 2003; K.N.Tzirogiannis и др., 2005]. Однако в данных работах имелись значительные различия в подходах к получению супернатантов, оценке их действия на печень и их очистке от балластных веществ.
Источниками супернатантов служили: печень неонатальных животных, печень животных после ее резекции, а также печень животных после ее токсического повреждения. Однако ни в одной из работ не производили сравнения супернатантов, полученных из разных источников.
Изучение действия супернатантов на печень проводили на моделях с интактной печенью, частичной деваскуляризацией печени, резекцией печени различного объема, а также с химическим повреждением печени гепатотоксинами [T.E.Starzl и др., 1979; Н.Л.Сванадзе, 1984; A.Francavilla и др., 1987; M.H. Mei и др., 1993; A.P.Margeli и др., 2003]. Эти модели часто были сложными и дорогими с позиций их пригодности для оценки действия супернатантов на печень.
Методы оценки действия супернатантов включали оценку синтеза ДНК по включению меченного тритием тимидина, подсчет числа митозов в печени, определение активности АЛТ и АСТ в сыворотке крови, а также определение содержания холестерина и желчных кислот в желчи [Н.Л.Сванадзе, 1984; D.R. LaBrecque и др., 1987; A.Francavilla и др., 1994; S.E.Theocharis и др., 1998; K.N.Tzirogiannis и др., 2005]. Как правило, исследователи использовали сочетание нескольких тестов, и ни в одной из работ не производили сравнения оценочных методов с целью выбора наиболее простого и информативного теста.
Исследования по изучению восстановления печени показали, что исключение из процесса одного из факторов регенерации в большинстве случаев приводит к нарушению всего процесса регенерации [A. Blindenbacher и др., 2003; M.M. Markiewski и др., 2004; A. Natarajan и др., 2007; Y. Yamada и др., 1998; A. Wullaert и др., 2007]. В связи с этим, мы предположили, что для восстановления печени после повреждения необходима сбалансированная совокупность присутствующих в регенерирующей или неонатальной печени активных ингредиентов. Получение такой совокупности в составе супернатанта для дальнейшей его очистки требует выявления оптимального источника получения достаточно большого количества супернатантов, разработки простой и дешевой модели повреждения печени, а также выбора быстрого и информативного метода оценки действия супернатантов на печень.
Цель работы:
- улучшить состояние печени после ее обширной резекции или токсического повреждения под действием супернатантов, полученных из регенерирующей или неонатальной печени в эксперименте.
Задачи исследования:
- разработать простую и дешевую модель повреждения печени, удобную для изучения действия супернатантов;
- определить быстрый и информативный метод оценки действия супернатантов на поврежденную печень;
- оценить действие супернатантов, полученных из печени крысы после ее 70% резекции, из печени крысы после ее токсического повреждения, а также из печени неонатального поросенка;
- установить оптимальный источник получения супернатантов для их последующей очистки от балластных веществ.
Научная новизна работы
Супернатанты, полученные из печени крысы после ее 70% резекции или токсического повреждения, а также супернатант, полученный из печени неонатального поросенка, позволяют улучшить состояние пораженной печени и ускорить ее восстановление.
Супернатант из печени неонатального поросенка обладает той же восстановительной способностью, что и супернатант, полученный из регенерирующей печени крысы.
Максимальное действие супернатантов, полученных из печени крысы после ее резекции или токсического повреждения, начинает проявляться спустя 24 – 36 ч, тогда как действие супернатанта из печени неонатального поросенка – через 48 ч. К этому времени эффекты всех трех супернатантов практически одинаковы.
Практическое значение работы
Разработана модель токсического повреждения печени мышей, которая позволяет получать результаты, сходные с таковыми на двух других крысиных моделях, являясь при этом наиболее простой и дешевой.
Установлена более высокая информативность метода оценки состояния печени по активности АСТ и АЛТ в крови по сравнению с методом оценки по остаточной концентрации ИЦЗ в крови.
Показано, что оптимальным источником получения супернатанта, пригодного для последующей очистки, является печень неонатального поросенка, использование которой позволяет получать супернатант в больших количествах.
Основные положения, выносимые на защиту
- Модели 70% резекции печени у крыс, повреждения печени тиоацетамидом у крыс и мышей являются адекватными для изучения возможности восстановления поврежденной печени при действии супернатантов.
- Наиболее простой и дешевой является модель повреждения печени тиоацетамидом у мышей.
- Определение активности АСТ и АЛТ в сыворотке крови животных является информативным методом оценки действия супернатантов при повреждении печени.
- Введение супернатантов из печени крысы после 70% резекции и неонатальной печени поросенка животным после повреждения печени приводит к значимому уменьшению степени повреждения печени и позволяет ускорить ее восстановление.
- Эффекты супернатантов, полученных из печени крысы после 70% резекции, печени крысы после токсического повреждения и печени неонатального поросенка, являются примерно одинаковыми.
- Оптимальным источником получения супернатанта является печень неонатального поросенка, использование которой позволяет получать супернатант в больших количествах.
Апробация работы
По материалам диссертации опубликовано две работы.
Материалы диссертации доложены на Всероссийской научной конференции с международным участием «Успенские чтения» (Тверь, 2008).
Апробация работы проведена на совместном заседании курса хирургической гепатологии при кафедре хирургии ФППОВ ММА им. И.М. Сеченова и отдела хирургии печени НИЦ ММА им. И.М. Сеченова.
Структура и объем работы
Диссертация изложена на 157 страницах машинописного текста, состоит из введения, обзора литературы, материалов и методов исследования, результатов с их обсуждением, заключения, выводов и списка литературы, содержащего 255 источников (12 отечественных и 243 зарубежных). Диссертация иллюстрирована 45 таблицами и 47 рисунками.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Проведено несколько серий экспериментов на крысах, мышах и поросятах. Общие данные по проведенным экспериментам представлены в таблице.
Общие данные по проведенным экспериментам
| № п/п | Группы опытов | Вид животного | Вес | N |
| 1 | Получение супернатанта из печени крысы после ее 70% резекции | Крыса | 130-160 г | 25 |
| 2 | Получение супернатанта из печени крысы после ее повреждения ТАА | Крыса | 130-160 г | 25 |
| 3 | Получение супернатанта из печени неонатального поросенка | Поросенок | 1,5-2 кг | 10 |
| 4 | Разработка модели 70% резекции печени | Крыса | 130-160 г | 47 |
| 5 | Разработка модели повреждения печени ТАА | Крыса | 130-160 г | 111 |
| 6 | Разработка модели повреждения печени ТАА | Мышь | 18-20 г | 92 |
| 7 | Восстановление печени при действии супернатантов на модели 70% резекции печени | Крыса | 130-160 г | 41 |
| 8 | Восстановление печени при действии супернатантов на модели токсического повреждения ТАА | Крыса | 130-160 г | 33 |
| 9 | Восстановление печени при действии супернатантов на модели токсического повреждения ТАА | Мышь | 18-20 г | 264 |
| Всего | Крысы | 282 | ||
| Мыши | 356 | |||
| Поросята | 10 | |||
Забор печени для приготовления супернатантов
Забор печени производили у самцов половозрелых крыс и самцов 2 – 3-дневных поросят. Для получения в супернатанте из печени крысы высокой концентрации активных веществ проводили 70% резекцию печени или создавали повреждение печени тиоацетамидом (ТАА).
70% резекцию печени у крыс проводили по методике G.M. Higgens и R.M. Anderson (1931): под эфирным наркозом удаляли срединную и левую латеральную доли печени после перевязки их сосудисто-секреторной ножки. Через 48 ч после операции животных забивали декапитацией и канюлировали воротную вену. Оставшуюся часть печени забирали после промывания холодным физиологическим раствором.
Для создания токсического повреждения печени у крыс производили однократное внутрибрюшинное введение ТАА в дозе 400 мг/кг. Через 24 ч после введения ТАА животных забивали, обескровливали и производили забор печени. Однако небольшой размер печени крысы, который дополнительно уменьшался после ее резекции, позволял получить лишь небольшое количество супернатанта. В связи с этим для получения больших количеств супернатанта с высоким содержанием активных веществ в качестве второго его источника использовали печень 2 – 3-дневного поросенка. Для забора последней под внутрибрюшинным наркозом 5 мл 5% р-ра гексенала выполняли лапаротомию в правом подреберье и производили мобилизацию печени. Затем проводили перфузию печени холодным физиологическим раствором, пересекали нижнюю полую вену и печеночно-двенадцатиперстную связку со всеми ее элементами и производили забор печени на фоне продолжающейся перфузии.
Приготовление супернатанта
После забора печени производили приготовление супернатанта. При этом основной задачей было получить естественную сбалансированную совокупность биологически активных веществ, способную ускорить восстановление поврежденной печени.
Донорскую печень гомогенизировали с дистиллированной водой в соотношении 1:3 при 8000 об/мин в течение 1 мин. С целью отделения клеточных ядер и фрагментов клеточных мембран полученный гомогенат центрифугировали в течение 20 мин при 3000 об/мин и 4°С. Для инактивации ферментов и других термолабильных белков надосадочную жидкость прогревали в течение 15 мин при 100°С и охлаждали. Затем с целью осаждения балластных белков к одному объему супернатанта добавляли 6 объемов 95,5% этанола. Полученную смесь выдерживали на холоде в течение 2 ч, а затем повторно центрифугировали в течение 20 мин при 3000 об/мин и 4°С. Полученный преципитат растворяли в дистиллированной воде и снова центрифугировали при тех же условиях. Полученный супернатант хранили в морозильной камере при -20°С.
Разработка модели повреждения печени
При разработке модели повреждения печени использовали крыс и мышей. На крысах были разработаны модель 70% резекции печени и модель токсического повреждения печени ТАА, на мышах – модель токсического повреждения печени ТАА. В качестве оценочного метода с самого начала использовали определение активности АСТ и АЛТ в сыворотке крови, так как последняя, как было показано [A.P. Margeli и др., 2003], положительно коррелирует с выраженностью повреждения печени при гистологическом исследовании. Для наглядности дополнительно рассчитывали индексы повреждения печени по АСТ и АЛТ. Расчет индекса повреждения печени как по АСТ, так и по АЛТ проводили по формуле:
((Результат в группе с повреждением печени) – (Результат в интактной группе)) / Результат в интактной группе.
Общий индекс повреждения печени рассчитывали по формуле:
(Индекс повреждения печени по АСТ + Индекс повреждения печени по АЛТ) / 2.
При разработке модели 70% резекции печени у крыс сравнивали активность АСТ и АЛТ в крови у интактных крыс и крыс через 6, 12 и 18 ч после 70% резекции.
При разработке модели повреждения печени ТАА у крыс активность трансаминаз оценивали у интактных крыс, крыс после однократного введения ТАА в дозе 400 мг/кг и двукратного введения ТАА в дозах
400, 800, 1000 и 1200 мг/мл. У крыс с двукратным введением ТАА в дозе 400 мг/кг забор крови осуществляли через 12 и
18 ч. Во всех остальных группах забор крови осуществляли через 12 ч после второго введения ТАА.
Модель повреждения печени ТАА у мышей была разработана по аналогии с моделью токсического повреждения печени у крыс, исходя из соображений максимально упростить модель и уменьшить ее стоимость. Оценку активности АСТ и АЛТ производили у интактных мышей и у мышей после однократного введения ТАА в дозах 150 и 250 мг/кг. Забор крови осуществляли через 12, 24, 36 и 48 ч.
Выбор метода оценки состояния печени
Оценка состояния печени по активности АСТ и АЛТ в сыворотке крови
Для определения активности АСТ и АЛТ в сыворотке крови животных использовали наборы реактивов «Диаком АСТ» и «Диаком АЛТ» соответственно (производство ЗАО «ДИАКОМ-ВНЦМДЛ», Москва, Россия). Определение активности АСТ и АЛТ основывалось на регистрации уменьшения оптической плотности опытного образца по сравнению с контролем при 340 нм.
Разработка метода оценки состояния печени по остаточной концентрации индоцианового зеленого в крови
Метод оценки функции печени по остаточной концентрации индоцианового зеленого (ИЦЗ) в крови широко используется в клинической практике [McCormack и др., 2008]. Кроме того, имеются сообщения о возможности его применения у мелких животных [F.Inage и др.,1997; L.F.Rikkers и др., 1974]. Исходя из этого, мы сравнили остаточные концентрации ИЦЗ на 7-й минуте после его введения в крови крыс после повреждения печени ТАА с таковыми интактных крыс и по аналогии с расчетом индексов повреждения по АСТ и АЛТ рассчитали индекс повреждения по ИЦЗ. Выведение ИЦЗ из организма осуществляется исключительно печенью с желчью. В связи с этим при ухудшении состояния печени выведение ИЦЗ уменьшается, и его концентрация в плазме крови увеличивается. Использовали порошок ИЦЗ ICG-PULSION® во флаконах по 5 и 10 мг (производство PULSION Medical Systems AG, Мюнхен, Германия). Введение раствора крысам проводили в концентрации 5 мг/мл под эфирным наркозом в нижнюю полую вену. До введения, а также через 7 мин после введения производили забор образцов крови. Кровь в объеме 0,5–1 мл собирали в градуированные пробирки с цитратом натрия. Содержание цитрата натрия по отношению к крови составляло 1:5. Пробирки с кровью и цитратом натрия аккуратно переворачивали несколько раз, центрифугировали и получали плазму. После этого измеряли оптическое поглощение образцов с помощью спектрофотометра СФ-46 (производство фирмы «Ломо», Санкт-Петербург, Россия) при длине волны =800 нм. Концентрацию ИЦЗ в образцах определяли по калибровочной кривой.
Сравнение методов оценки состояния печени по активности АСТ и АЛТ и по остаточной концентрации ИЦЗ в крови
Сравнение методов оценки состояния печени по активности АЛТ и АСТ и по концентрации ИЦЗ проводили путем оценки достоверности различий между опытной и контрольной группами, расчета индексов повреждения печени для каждого из указанных методов, а также путем оценки корреляционной связи между уровнями активности АСТ и АЛТ и концентрацией ИЦЗ.
Оценка действия супернатантов
На следующем этапе была оценена возможность восстановления поврежденной печени под действием супернатантов, полученных из резецированной печени крысы, печени крысы после ее токсического повреждения, а также печени неонатального поросенка. Действие супернатантов во всех экспериментах оценивали путем сравнения активности АСТ и АЛТ в опытной и контрольной группах, а также по рассчитанному индексу восстановления печени. Расчет последнего как по АСТ, так и по АЛТ производили по формуле:
((Результат в контрольной группе) – (Результат в опытной группе)) / Результат в контрольной группе.
Общий индекс восстановления печени рассчитывали по формуле:
(Индекс восстановления печени по АСТ + Индекс восстановления печени по АЛТ) / 2.
На модели 70% резекции печени у крыс супернатант вводили внутрибрюшинно однократно в дозе 3,8 мл/150 г веса непосредственно после резекции печени. Животным контрольной группы непосредственно после 70% резекции печени вводили 3,8 мл физиологического раствора. Забор крови осуществляли через 12 ч после операции.
На модели токсического повреждения печени крыс ТАА супернатант вводили внутрибрюшинно в дозе 3,8 мл/150 г веса через 2 ч после каждого введения ТАА. Животным контрольной группы вводили эквивалентное количество физиологического раствора. Забор крови осуществляли через 12 ч после второго введения ТАА.
На модели токсического повреждения печени мышей ТАА супернатант вводили внутрибрюшинно однократно в дозе 0,46 мл/20 г веса через 2 ч после введения ТАА. Животным контрольной группы вводили эквивалентное количество физиологического раствора. Забор крови осуществляли через 36 и 48 ч после введения ТАА.
Статистическая обработка данных
Статистическую обработку полученных данных проводили с помощью программного обеспечения SPSS 9.0 для Windows.
Для определения метода статистической обработки результатов оценили распределение уровней активности АСТ и АЛТ. В связи с некомпактным и асимметричным распределением переменных значения активности АСТ и АЛТ были проранжированы, и достоверность различий средних рангов между группами определяли с помощью дисперсионного анализа.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Модели повреждения печени
Модель 70% резекции печени у крыс
70% резекция печени приводила к достоверному увеличению активности АСТ и АЛТ в крови через 12 ч по сравнению с интактными крысами (р<0,001). Активность трансаминаз через 12 ч была выше таковой через 6 и 18 ч (рис.1), при этом различие было недостоверным в первом случае (р>0,05) и достоверным во втором случае (р<0,001 для АСТ и р=0,008 для АЛТ).

Рис. 1. Активность АСТ и АЛТ в сыворотке крови у интактных крыс (0) и у крыс в различное время после 70% резекции печени
На основании полученных результатов было решено производить забор крови через 12 ч. Общий индекс повреждения печени через 12 ч составил 9,33.
Таким образом, модель 70% резекции печени у крыс заключалась в удалении 70% паренхимы с забором крови через 12 ч.
Модель повреждения печени ТАА у крыс
Однократное введение ТАА с забором крови через 12 ч приводило к повышению активности АСТ и АЛТ в крови по сравнению с интактными крысами, однако различие между группами было недостоверным. Общий индекс повреждения печени (0,25) был значительно ниже такового для модели 70% резекции печени (9,33). С увеличением кратности введения ТАА до 2 раз в дозе 400 мг/кг и забором крови через 12 ч активность АСТ и АЛТ в группе крыс с двукратным введением ТАА была достоверно выше таковой в группе интактных крыс (р<0,001). Общий индекс повреждения печени также был значительно выше, чем при однократном введении ТАА (17,4 по сравнению с 0,25). Активность АСТ и АЛТ в крови крыс через 18 ч была несколько ниже, чем через 12 ч, причем различие было недостоверным (р>0,05). Кроме того, среднеквадратические отклонения и статистические погрешности средних рангов активности АСТ и АЛТ были выше в группе с забором крови через 18 ч. Исходя из этого, было решено проводить забор крови у крыс через 12 ч после второго введения ТАА.
При двукратном введении ТАА в дозе 800 мг/кг активность АСТ и АЛТ была несколько выше таковой при введении ТАА в дозе 400 мг/кг, однако различие между группами было недостоверным (р>0,1). Кроме того, в группе с введением ТАА в дозе 800 мг/кг среднеквадратическое отклонение было выше, чем в группе с введением ТАА в дозе 400 мг/кг. При введении ТАА в дозе 1000 мг/кг активность АСТ была достоверно ниже (р=0,001) таковой при введении ТАА в дозе 400 мг/кг. Активность АЛТ при введении ТАА в дозе 1000 мг/кг была также ниже таковой при введении ТАА в дозе 400 мг/кг, однако достоверность различий была низкой (р=0,52). В группе с введением ТАА в дозе 1200 мг/кг летальность через 12 ч составила 100%, в связи с чем сравнение с данной группой не проводилось. Исходя из полученных данных, в качестве оптимальной была выбрана доза ТАА 400 мг/кг (рис. 2).

Рис.2. Активность АСТ и АЛТ в сыворотке крови у интактных крыс (0) и у крыс после двукратного внутрибрюшинного введения ТАА в различных дозах
Таким образом, модель токсического повреждения печени у крыс заключалась в двукратном внутрибрюшинном введении ТАА с интервалом 24 ч в дозе 400 мг/кг с забором крови через 12 ч после второго введения ТАА.
Модель повреждения печени ТАА у мышей
Оценка активности АСТ и АЛТ у интактных мышей и у мышей через 24 ч после введения ТАА в дозах 150 и 250 мг/кг показала, что введение ТАА в обеих дозах приводило к достоверному увеличению активности АСТ и АЛТ в крови (р<0,001) по сравнению с интактными животными. Однако различие активности АСТ и АЛТ в группах с введением ТАА в дозах 150 и 250 мг/кг было недостоверным (р>0,05). Кроме того, индекс повреждения печени был несколько выше при введении ТАА в дозе 150 мг/кг (13,2 по сравнению с 12,24). На основании полученных результатов была выбрана доза ТАА 150 мг/кг.
Оценка активности трансаминаз в различные моменты времени (рис. 3) показала, что активность АСТ и АЛТ через 24 ч была выше таковой через 12 ч, при этом различие было недостоверным для АСТ (р>0,05) и достоверным для АЛТ (p<0,001). В то же время активность АСТ и АЛТ через 36 и 48 ч была достоверно выше таковой через 12 и 24 ч (p<0,001). В связи с этим забор крови стали производить через 36 и 48 ч.
Таким образом, модель повреждения печени ТАА у мышей заключалась в однократном внутрибрюшинном введении ТАА в дозе 150 мг/кг с забором крови через 36 и 48 ч.

Рис.3. Активность АСТ и АЛТ в сыворотке крови у интактных мышей (0) и у мышей после внутрибрюшинного введения ТАА в дозе 150 мг/кг в различные моменты времени
Выбор метода оценки состояния печени
При оценке состояния печени по остаточной концентрации ИЦЗ в крови было установлено, что при введении ТАА в дозе 400 мг/кг остаточная концентрация ИЗЦ в крови крыс была достоверно выше (р<0,05) таковой у интактных крыс (рис. 4), а индекс повреждения печени по ИЦЗ составил 0,4.

Рис. 4. Содержание ИЦЗ через 7 мин после введения в крови у интактных крыс и у крыс после двукратного внутрибрюшинного введения ТАА в дозе 400 мг/кг
Для сравнения двух оценочных методов измерили активность АСТ и АЛТ в тех же группах животных (рис. 5), после чего сравнили достоверности различий и индексы повреждения для двух методов.

Рис. 5. Активность АСТ и АЛТ в крови у интактных крыс и у крыс после двукратного внутрибрюшинного введения ТАА в дозе 400 мг/кг
Достоверность различий между группами была выше при оценке по активности АСТ и АЛТ (р<0,001) по сравнению с оценкой по остаточной концентрации ИЦЗ (р<0,05). Так как количество экспериментальных животных для обоих оценочных методов было одинаковым, большая достоверность различий соответствовала большей силе связи. После этого мы оценили корреляцию рангов активности АСТ и АЛТ с уровнем ИЦЗ, рассчитав коэффициент корреляции Спирмана. Уровень ИЦЗ, отражающий выделительную функцию печени, положительно коррелировал с активностью АСТ и АЛТ, отражающими степень повреждения печени (р=0,13 и р=0,02 соответственно). При этом корреляционная связь АСТ с АЛТ оказалась значительно сильнее, чем их связи с ИЦЗ, что соответствует предположению о том, что активность АСТ и АЛТ является более точным маркером степени повреждения печени. Учитывая полученные результаты и большую сложность метода оценки остаточной концентрации ИЦЗ в лабораторных условиях, в качестве основного метода оценки состояния печени было выбрано определение активности АСТ и АЛТ в сыворотке крови.
Восстановление поврежденной печени под действием супернатантов
Сначала оценили эффект супернатанта из резецированной печени крысы на трех разработанных моделях, чтобы на основании полученных результатов выбрать одну наиболее подходящую модель для проведения последующих экспериментов.
Оценка действия супернатанта из печени крысы после 70% резекции (СК-Р)
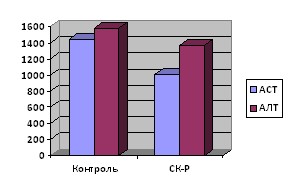
На модели 70% резекции печени введение СК-Р приводило к снижению активности АСТ и АЛТ в сыворотке крови по сравнению с контролем (рис. 6), при этом различие было достоверным для АСТ (р<0,05) и низкодостоверным для АЛТ (р=0,053). Общий индекс восстановления печени составил 0,21.

Рис. 6. Активность АСТ и АЛТ в сыворотке крови крыс опытной (введение СК-Р) и контрольной групп на модели 70% резекции печени
На модели токсического повреждения печени у крыс введение СК-Р также приводило к снижению активности трансаминаз в сыворотке крови по сравнению с контролем (рис. 7), при этом различие между группами было высокодостоверным (р<0,001), а общий индекс восстановления печени составил 0,31.

Рис. 7. Активность АСТ и АЛТ в сыворотке крови крыс опытной (введение СК-Р) и контрольной групп на модели повреждения печени ТАА
На модели токсического повреждения печени у мышей введение СК-Р приводило к снижению активности АСТ и АЛТ в крови по сравнению с контролем (рис. 8). При этом различие было высокодостоверным (р0,001) и через 36, и через 48 ч. Индекс восстановления печени через 48 ч (0,31) был выше такового через 36 ч (0,21), что свидетельствовало о более выраженном эффекте супернатанта через 48 ч. Кроме того, индекс восстановления печени через 36 ч был равен таковому на модели 70% резекции печени, а индекс восстановления печени через 48 ч был равен таковому на модели токсического повреждения печени крыс ТАА.

а б
Рис. 8. Активность АСТ и АЛТ в сыворотке крови у мышей опытной (введение СК-Р) и контрольной групп на модели повреждения печени ТАА через 36 ч (а) и 48 ч (б)
Таким образом, введение супернатанта из регенерирующей печени крысы приводило к восстановлению печени после ее 70% резекции и токсического повреждения.
На основании полученных результатов для последующих экспериментов была выбрана модель повреждения печени ТАА у мышей. Такой выбор обосновывался следующими соображениями: из трех полученных моделей повреждения печени данная модель является наиболее простой, так как не требует выполнения резекции печени (в отличие от модели 70% резекции печени) и требует лишь однократного внутрибрюшинного введения ТАА (в отличие от модели токсического повреждения печени у крыс) в более низкой дозе; индексы восстановления печени для СК-Р на модели токсического повреждения печени у мышей были сходны с таковыми на модели 70% резекции печени у крыс (при заборе крови через 36 ч) и на модели токсического повреждения печени у крыс (при заборе крови через 48 ч); расход супернатантов на модели токсического повреждения печени у мышей был меньше такового на двух других моделях; кроме того, использование мышей вместо крыс позволяет сделать модель более дешевой.
Оценка действия супернатанта из печени крысы после ее повреждения ТАА (СК-ТАА)
Введение СК-ТАА, как и введение СК-Р, приводило к достоверному снижению активности АСТ и АЛТ в крови животных через 36 ч по сравнению с контролем (рис. 9а). При этом достоверность различий с контрольной группой была выше при введении СК-ТАА (р<0,001), чем при введении СК-Р (p<0,05). При сравнении активности АСТ и АЛТ в двух опытных группах оказалось, что последняя в группе с введением СК-ТАА была достоверно ниже таковой в группе с введением СК-Р (p<0,001). Таким образом, эффект СК-ТАА через 36 ч был более выраженным по сравнению с СК-Р, что дополнительно подтверждалось при сравнении индексов восстановления печени (0,54 для СК-ТАА по сравнению с 0,17 для СК-Р).
Через 48 ч картина была несколько иной (рис. 9б). Так же как и через 36 ч, активность АСТ и АЛТ в обеих опытных группах (при введении СК-ТАА и СК-Р) была достоверно ниже таковой в контрольной группе (р<0,001 для СК-Р по сравнению с контролем; р=0,006 для АСТ и р<0,001 для АЛТ в группе СК-ТАА по сравнению с контролем). В то же время при сравнении двух опытных групп активность АСТ и АЛТ была несколько ниже в группе с введением СК-Р, однако различие было недостоверным (р>0,1).
Таким образом, эффекты СК-ТАА и СК-Р через 48 ч были сопоставимы, что дополнительно подтверждалось при сравнении индексов восстановления печени через 48 ч (0,35 для СК-ТАА и 0,4 для СК-Р).


а б
Рис. 9. Активность АСТ и АЛТ в сыворотке крови у мышей опытных (введение СК-ТАА и введение СК-Р) и контрольной групп на модели повреждения печени ТАА через 36 ч (а) и 48 ч (б)
Оценка действия супернатанта из печени неонатального поросенка (СП)
Активность АСТ и АЛТ в группе с введением СП через 36 ч была несколько ниже таковой в контрольной группе (рис.10а), однако различие было недостоверным (р>0,05). В то же время в опытной группе с введением СК-Р активность АСТ и АЛТ была достоверно ниже таковой в контрольной группе (р<0,001), что согласуется с полученными ранее данными. Активность АСТ и АЛТ в крови животных с введением СК-Р через 36 ч была также достоверно ниже таковой в группе с введением СП (р<0,05). Слабо выраженный эффект СП через 36 ч дополнительно подтверждался при сравнении индексов восстановления печени (0,05 для СП по сравнению с 0,18 для СК-Р).
В отличие от показателей через 36 ч активность АСТ и АЛТ через
48 ч в группе с введением СП была достоверно ниже таковой в контрольной группе (р0,001; рис. 10б). Показатели в опытной группе с введением СК-Р были также достоверно ниже таковых в контрольной группе (р0,001), что согласовалось с полученными ранее данными. При сравнении групп с введением СП и СК-Р через 48 ч активности АСТ и АЛТ были сопоставимы, а различие между группами было недостоверным (р>0,05).
Таким образом, эффект СП проявлялся лишь через 48 ч после введения ТАА и был сопоставим с таковым СК-Р, что дополнительно подтверждалось при сравнении индексов восстановления печени (0,35 для СП по сравнению с 0,36 для СК-Р).


а б
Рис.10. Активность АСТ и АЛТ в сыворотке крови у мышей опытных (введение СП и введение СК-Р) и контрольной групп на модели повреждения печени ТАА через 36 ч (а) и 48 ч (б)
Результаты сравнения показали, что эффекты супернатантов, полученных из печени крысы после ее 70% резекции или токсического повреждения, проявляются уже через 36 ч, при этом эффект супернатанта из печени крысы после ее токсического повреждения превосходит таковой супернатанта из резецированной печени крысы. Эффект супернатанта из печени неонатального поросенка через 36 ч еще слабо выражен. Однако через 48 ч эффекты всех трех супернатантов уже сходны между собой (индексы восстановления печени 0,36; 0,35 и 0,35 для СК-Р, СК-ТАА и СП соответственно).
Таким образом, супернатанты, полученные из печени крысы после ее 70% резекции или токсического повреждения, а также супернатант, полученный из печени неонатального поросенка, усиливают восстановление пораженной печени уже через 36–48 ч, о чем свидетельствуют достоверно более низкие уровни активности АСТ и АЛТ в опытных группах по сравнению с контролем.
Исходя из того, что эффекты трех изучаемых супернатантов через
48 ч были приблизительно одинаковы, в качестве наиболее оптимального источника супернатанта была выбрана печень неонатального поросенка. Использование последней позволяет получать значительно большие количества супернатанта, чем при использовании печени крысы, а также исключает необходимость предварительного повреждения печени путем ее резекции или введения гепатотоксина. Последнее обстоятельство может иметь большое значение при необходимости получения супернатанта в больших количествах.
Выводы
- Супернатанты, полученные из резецированной печени крысы, печени крысы после токсического повреждения и печени неонатального поросенка, обладают способностью улучшать состояние печени после ее 70% резекции или повреждения ТАА.
- Разработанная модель повреждения печени у мышей с внутрибрюшинным введением ТАА в дозе 150 мг/кг и забором крови через 48 ч является простой, дешевой и удобной для оценки действия различных супернатантов.
- Остаточная концентрация ИЦЗ в крови на 7-й минуте достоверно отражает степень повреждения печени при действии на нее ТАА.
- Метод оценки действия супернатантов по активности АСТ и АЛТ в сыворотке крови является простым, информативным и удобным для изучения повреждения печени и возможности улучшения ее состояния при действии супернатантов. Активность АСТ и АЛТ в крови является более точным маркером повреждения печени, чем остаточная концентрация ИЦЗ.
- Оптимальным источником получения супернатанта является печень неонатального поросенка. Ее использование позволяет получать большие количества супернатанта и исключает необходимость предварительного повреждения печени.
Публикации по теме диссертации
- Гальперин Э.И., Дюжева Т.Г., Платонова Л.В., Атауллаханов Р.И., Ионочкина Н.Н., Погосян Г.С., Кочергин М.В. Уменьшение повреждения печени при ее обширной резекции и токсическом поражении в эксперименте //Анналы хирургической гепатологии. – 2008. – Т.13., №1. – С. 51–56.
- Дюжева Т.Г., Платонова Л.В., Кочергин М.В., Ионочкина Н.Н. Восстановление функции печени в ранние сроки после повреждения //Социальные аспекты хирургической помощи населению в современной России: Материалы Всероссийской научной конференции с международным участием (Успенские чтения, выпуск 5). – Тверь, 2008. – С. 173–174.
Список сокращений и обозначений
| АЛТ | – аланинаминотрансфераза |
| АСТ | – аспартатаминотрансфераза |
| ИЦЗ | – индоциановый зеленый |
| ОПН | – острая печеночная недостаточность |
| СК-Р | – супернатант из печени крысы после 70% резекции |
| СК-ТАА | – супернатант из печени крысы после ее повреждения тиоацетамидом |
| СП | – супернатант из печени неонатального поросенка |
| ТАА | – тиоацетамид |

