Радиочастотная термоаблация в комбинированном лечении пациентов с метастазами колоректального рака в печень (экспериментально-клиническое исследование)
На правах рукописи
Набережнев Дмитрий Иванович
РАДИОЧАСТОТНАЯ ТЕРМОАБЛАЦИЯ
В КОМБИНИРОВАННОМ ЛЕЧЕНИИ ПАЦИЕНТОВ
С МЕТАСТАЗАМИ КОЛОРЕКТАЛЬНОГО
РАКА В ПЕЧЕНЬ
(экспериментально-клиническое исследование)
14.00.27 – хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Воронеж – 2009
Работа выполнена в Государственном учреждении высшего профессионального образования «Белгородский государственный университет» Федерального агентства по образованию
Научный руководитель доктор медицинских наук, профессор
Куликовский Владимир Федорович
Научный консультант доктор медицинских наук, профессор
Должиков Александр Анатольевич
Официальные оппоненты: доктор медицинских наук, профессор,
заслуженный деятель науки Российской
Федерации Затолокин Василий Данилович
кандидат медицинских наук
Шамаева Татьяна Евгеньевна
Ведущая организация: Федеральное государственное учреждение «Институт хирургии им. А.В. Вишневского Росмедтехнологий»
Защита состоится «____»____________2009 года в _____часов на заседании диссертационного совета Д 208.009.01 при Государственном образовательном учреждении высшего профессионального образования «Воронежская государственная медицинская академия им. Н.Н. Бурденко Федерального агентства по здравоохранению и социальному развитию» по адресу: 394036, Россия, г. Воронеж, ул. Студенческая, д.10.
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Воронежская государственная медицинская академия им. Н.Н. Бурденко Федерального агентства по здравоохранению и социальному развитию».
Автореферат разослан «____»_____________2009 г.

Ученый секретарь
диссертационного совета А.А. Глухов
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Ежегодно в мире диагностируется до миллиона новых случаев колоректального рака, при этом у 25% пациентов метастатическое поражение печени выявляется при первичном обращении к врачу, а у 50% в различные сроки от момента постановки диагноза и выполнения радикального хирургического лечения, являясь причиной смерти у половины больных с данной патологией
(Б.И. Долгушин, Ю.И. Патютко и соавт., 2007).
На сегодняшний день «золотым стандартом» в лечении пациентов с колоректальными метастазами в печень являются операции резекции печени
(В.А. Вишневский и соавт., 2003), которые позволяют добиться 5-летней выживаемости у 22-55% больных (Г.И. Воробьев и соавт., 2004). Вместе с тем, необходимо отметить, что развитие хирургии и анестезиологии не повлияло на показатель резектабельности колоректальных метастазов, который по-прежнему составляет 20%, а уровень летальности и послеоперационных осложнений составляет 7 и 43% соответственно (В.Д. Федоров и соавт., 2003).
Применяемые в клинической практике нехирургические методы лечения злокачественных новообразований печени, такие как системная химиотерапия, технологии местного направленного воздействия, не являются универсальными, имеют большое количество недостатков, а использование любого из методов лечения в качестве монотерапии не позволяет перешагнуть 5-летний рубеж выживаемости (Elias D. et al, 2005).
В последнее десятилетие наибольшую популярность приобретает метод радиочастотной термоаблации опухолей. Результаты лечения при этом методе приближаются к хирургическим, общий уровень осложнений не превышает
7-10%, а уровень летальности составляет 0,5% (Lobik L. et al, 2005).
На сегодняшний день подробно исследован механизм необратимых деструктивных процессов в зоне радиочастотного воздействия. Вместе с тем, целый ряд эффектов радиочастотной термоаблации нуждается в дальнейшем изучении. Это касается динамики морфологических изменений в зависимости от тканевых особенностей как пораженного органа, так и опухоли, условий кровотока, системных эффектов термодеструкции.
В соответствии с указанным нами сформулированы цель и задачи исследования.
Цель исследования
На основе комплексного экспериментального и клинического исследований определить особенности изменений метастазов колоректальных раков и структур печени после радиочастотной термоаблации для разработки рациональной тактики применения данного метода и улучшения результатов лечения больных с метастазами колоректального рака в печень.
Задачи исследования
1. Изучить в эксперименте динамику морфологических изменений печени после радиочастотной термоаблации в различных временных режимах, а также при сохраненном кровотоке и на фоне кратковременной ишемии печени.
2. Провести анализ эффективности применения радиочастотной термоаблации при лечении метастазов колоректального рака в печень в зависимости от размеров и локализации опухолевых узлов.
3. Изучить патоморфологические изменения метастатических очагов и окружающих структур печени на различных сроках после радиочастотной термоаблации в клинике.
4. На основании полученных данных разработать рациональную тактику применения радиочастотной термоаблации в лечении больных с метастазами колоректального рака в печень.
Научная новизна
На основании экспериментальных исследований, выполненных на неизмененной печеночной ткани, выявлен зональный характер изменений структур печени, зависящий от удаленности от рабочей части активного электрода. При радиочастотной аблации на фоне кратковременной ишемии двукратно увеличивается объем очага деструкции, что возникает за счет вторичных нарушений кровообращения, связанных с термическим воздействием.
Установлено, что эффекты термоаблации зависят от степени выраженности фиброзных изменений в метастатических очагах, влияющих на биоимпеданс тканей и величину зоны термической деструкции.
На основании экспериментальных, клинических, морфологических сопоставлений выработана рациональная тактика использования радиочастотной термоаблации в лечении колоректальных метастазов в печень.
Научно-практическая значимость
Результаты исследования позволяют оптимизировать подходы к использованию радиочастотной термоаблации в лечении метастазов колоректального рака в печень, что приведет к увеличению продолжительности и улучшению качества жизни больных с данной патологией. В работе приведена сравнительная характеристика патоморфологических изменений метастазов колоректального рака и нормальной паренхимы печени в эксперименте и клинической практике. Результаты исследования могут найти применение в практике отделений гепатохирургии, колопроктологии, интервенционной радиологии и в учебном процессе.
Положения, выносимые на защиту
1. Деструктивное воздействие радиочастотной термоаблации на структуры печени в экспериментальной модели определяется как непосредственным термическим повреждением клеток, так и эффектами перераспределения нагретой крови в условиях сохраненного внутрипеченочного кровотока.
2. При временной ишемии достоверно увеличивается объем зоны деструкции, что происходит за счет сочетания термического воздействия радиочастотной термоаблации и ишемического повреждения, а также вторичных нарушений кровообращения.
3. Особеностями тканевых изменений в зоне радиочастотной термоаблации является этапность их развития, возможность замедленной резорбции некротических масс при сравнительно ранней их инкапсуляции, влияние степени фиброзных изменений на полноту термодеструкции.
4. Результаты клинического применения радиочастотной термоаблации в лечении метастазов колоректального рака в печень зависят от размера метастазов и их локализации; неблагоприятными факторами являются размер больше 5 см и билобарная локализация.
Апробация работы и публикации
Результаты проведенных исследований заслушаны на научной конференции с международным участием «Актуальные проблемы колопроктологии», посвященной 40-летию ГНЦ колопроктологии (Москва, 2005), Межрегиональной конференции «Актуальные вопросы современной хирургии» (Курск, 2005), Всероссийской конференции к 85-летию член-кор. РАМН О.К. Хмельницкого (СПб., 2005), XII Центрально-Европейском конгрессе колопроктологов (Москва, 2008), на заседании Белгородского областного общества хирургов (2008). Апробация диссертации проведена 16.12.2008 г. на совместном заседании кафедры общей хирургии, кафедры госпитальной хирургии, кафедры факультетской хирургии, кафедры онкологии, кафедры оперативной хирургии и топографической анатомии, кафедры транспортной медицины Воронежской государственной медицинской академии имени Н.Н. Бурденко. По теме диссертации опубликовано 8 печатных работ, из них 1 в изданиях, рекомендованных ВАК РФ.
Реализация и внедрение результатов исследования
Основные результаты исследования внедрены в клиническую практику межрегионального центра колопроктологии БОКБ им. Святителя Иоасафа. Материалы диссертации используются при проведении лекций, семинаров и практических занятий по курсу гистологии, патологической анатомии, хирургии со студентами медицинского факультета БелГУ, интернами, курсантами и клиническими ординаторами на кафедре клинических дисциплин ИПМО БелГУ.
Структура и объём диссертации
Диссертация изложена на 140 страницах машинописного текста и состоит из введения, обзора литературы, главы материала и методов исследования, результатов собственных исследований, заключения, выводов, практических рекомендаций, указателя литературы. Работа иллюстрирована 12 таблицами и
57 рисунками. Указатель литературы включает 188 источников, в том числе –
31 отечественных и 157 иностранных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы экспериментального исследования
Экспериментальное исследование выполнено на 93 половозрелых крысах обоего пола линии Wistar массой 150-180 г. Болезненные процедуры и оперативные вмешательства выполнялись под эфирным наркозом. Распределение материала экспериментального исследования представлено в табл. 1.
Таблица 1
Распределение материала экспериментального исследования по сериям
| Серия эксперимента (срок после РЧА) | В условиях сохраненного кровотока (длительность РЧА) | Кратковременная ишемия печени | |
| 1 минута | 2 минуты | ||
| Непосредственно после РЧА | 3 | 3 | 3 |
| 1 сутки | 5 | 5 | 5 |
| 3 суток | 5 | 5 | 5 |
| 7 суток | 5 | 5 | 5 |
| 14 суток | 5 | 5 | 5 |
| 21 сутки | 5 | 5 | 5 |
| 30 суток | 3 | 3 | 3 |
| Всего животных | 31 | 31 | 31 |
Для экспериментальной радиочастотной термоаблации (РЧА) использован стандартный генератор фирменного производства «Cool-tipTM RF Ablation System (Radionics, USA)», одиночный электрод длиной 15,0 см с рабочей частью длиной 1,0 см. Операции выполнены под ингаляционным эфирным наркозом. Параректальным разрезом справа послойно вскрывали брюшную полость на протяжении 1,5 см. В рану выводили переднюю левую долю печени, под которую помещали пассивный электрод. Игольчатый электрод вводили на всю длину его рабочей части в среднюю часть толщи доли тангенциально ее поверхности. После РЧА электрод удаляли, подвергнутую воздействию долю печени погружали в брюшную полость, которую затем послойно ушивали.
Временная ишемия печени создавалась путем наложения провизорной лигатуры на проксимальную часть гепатопанкреатодуоденальной связки с остановкой кровотока по печеночным артериям и по воротной вене. В данной части эксперимента изучен 1 временной режим РЧА – 2 минуты. Время от наложения лигатуры до начала РЧА (время введения электрода) составляло 30 секунд, время последующего воздействия – 2 минуты, время от прекращения воздействия до снятия лигатуры – 30 секунд. Таким образом, общее время ишемии печени составляло 3 минуты.
Животных выводили из эксперимента сразу после воздействия и через 1, 3, 7, 14, 21 и 30 суток после РЧА путем передозировки эфирного наркоза. В начале оценивали макроскопическую картину зоны воздействия и прилежащих органов. Затем полностью иссекали печень вместе с желудком, двенадцатиперстной кишкой и большим сальником. После промывки в физрастворе материал полностью фиксировали иммерсионным способом в 10%-м растворе формалина, заливали в парафин по стандартной методике.
После фиксации в течение 24-48 часов долю печени, подвергнутую РЧА, серийно разрезали на пластины толщиной 3 мм перпендикулярно линии введения электрода и оценивали макроскопическую картину зоны воздействия, затем выполняли вырезку материала для гистологического исследования. Гистологические срезы толщиной 5-7 мкм окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизон, для выявления гликогена проводили ШИК-реакцию.
Для измерения зоны повреждения и микроскопического изучения срезы производили перпендикулярно направлению введения электрода. Объем зоны вычисляли на основании величин ее наибольшей и наименьшей ширины по формуле эллипсоида.
Фотопротоколирование микроскопических картин производили с использованием комплекса из микроскопа «Биомед-2», стандартного адаптера, цифровых фотокамер «RoverShot 5,1 z» и «Nikon Coolpix 4500» и ПЭВМ «Celeron 2000». Полученные изображения использованы для компьютерной микроморфометрии с применением пакета программ для анализа изображений «WCIF Image J» (National Institute of Health, USA).
При статистическом анализе определяли средние величины, их ошибки, доверительные интервалы. Значимость отличий определяли по критерию t Стьюдента, критерию 2 и Фишера.
Клиническое исследование
Клиническая часть работы основана на анализе лечения 48 больных с метастазами колоректального рака в печень в возрасте от 30 до 79 лет (средний возраст составил 47,2 лет). В 30 случаях отдаленное метастазирование было выявлено одновременно с постановкой основного диагноза, в 18 случаях в различные сроки после выявления первичной опухоли и выполнения радикального хирургического лечения.
Все больные с метастатическим поражением печени распределены на группы в зависимости от размеров и локализации (табл. 2, 3).
Таблица 2
Распределение больных в зависимости от размеров метастазов
| Размер метастаза | Число больных | |
| Абс. | % | |
| Менее 5 см | 31 | 64,6 |
| Более 5см | 17 | 35,4 |
| Всего | 48 | 100 |
Таблица 3
Распределение больных в зависимости от локализации метастазов
| Локализация метастазов | Число больных | |
| Абс. | % | |
| Правая доля | 21 | 43,8 |
| Левая доля | 10 | 20,8 |
| Билобарное расположение | 17 | 35,4 |
| Всего | 48 | 100 |
Всем пациентам выполнялся общеклинический комплекс обследования, ЭКГ, рентгенография органов грудной клетки, УЗИ органов брюшной полости и малого таза, СКТ печени с внутривенным контрастированием. Во всех случаях проводилась морфологическая верификация диагноза на материале пункционных биопсий или интраоперационно.
В результате проведенного обследования противопоказаний к проведению РЧА выявлено не было.
РЧА под УЗИ-контролем выполнена в 10 случаях. В 38 она осуществлялась интраоперационно, что связано как с высокой частотой синхронного выявления метастазов, так и с повторными вмешательствами на толстой кишке по поводу рецидива опухоли и выполнением реконструктивно-восстановительных операций. Для проведения РЧА использовался радиочастотный генератор «Cool-tipTM RF Ablation System (Radionics, USA)», одноразовые активные и пассивные электроды.
Генератору задавался режим максимальной мощности с временным интервалом воздействия 12 минут. В случаях «трудного» позиционирования электрода, когда зона планируемого некроза после однократного воздействия не охватывала всю опухоль плюс 10 мм окружающей ткани, проводились дополнительные аппликации по принципу последовательных перекрывающихся зон гипертермии.
Контроль эффективности деструкции метастатических очагов осуществляли путем выполнения УЗИ, спиральной компьютерной томографии с внутривенным контрастированием в сроки от 3 месяцев до 2 лет, однократной и повторной пункционной биопсии очагового образования непосредственно после проведения термоаблации, а также в различные сроки послеоперационного периода. Данное исследование выполнено в 23 случаях проведения термоаблации во время лапаротомии (в 17 наблюдениях однократно, в 6 – повторно).
Проведено также патоморфологическое исследование текущего и ретроспективного материала пункционных биоптатов метастатических опухолей до РЧА, непосредственно после нее и в сроки от 5 суток до двух лет после термодеструкции. Материал исследован по стандартной методике с окраской срезов гематоксилином и эозином.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Результаты экспериментального исследования
В результате экспериментальных исследований выявлены существенные особенности воздействия РЧА на структуры печени, зависящие от времени воздействия и условий кровотока.
Непосредственно после РЧА в течение 1 минуты наблюдается формирование макроскопически различимых концентрических зон воздействия: это центральная зона с очагами обугливания, малокровная промежуточная зона, нечетко очерченная периферическая зона полнокровия.
Через 1 сутки после воздействия наблюдается четкая дифференциация четырех зон. При микроскопическом исследовании обнаружено, что структура зон в очаге термоаблации не соответствует ожидаемой прямой зависимости степени повреждения от близости к электроду. Центральная зона образована своеобразно построенными кавернозными полостями неправильной лабиринтообразной конфигурации, с неравномерным кровенаполнением и диссоциированно расположенными некротизированными гепатоцитами. Стенки полостей образованы элементами синусоидных капилляров и гепатоцитами, имеющими сдавленный вид и пикноморфно измененными. Кнаружи расположена зона некробиотически измененных и некротизированных гепатоцитов, частично разрушенных синусоидов при выраженном малокровии. Наиболее выражена реакция на повреждение в виде диффузной нейтрофильной инфильтрации в следующей зоне. Периферическая зона четко очерчена за счет диффузного полнокровия, дистрофические изменения гепатоцитов выражены умеренно. Максимальный диаметр очага аблации через сутки после минутного воздействия составлял 11,0 мм (в среднем 10,0 мм), объем 412,0 мм3.
Через 3 суток после термодеструкции утрачивается четкое разделение на
4 зоны за счет слияния центра и ближайших участков. Наибольший диаметр очага деструкции составлял 15,0 мм, средний объем увеличен до 681,0 мм3
(от 551,0 до 585,0). При гистологическом исследовании выявлено слияние центральной и ближайшей к ней зоны некробиотических изменений за счет прогрессирования в них некроза. Особенностью развития повреждений гепатоцитов, которая видна в динамике эксперимента, является их этапность.
Снаружи от некротических и некробиотических зон наблюдаются начальные признаки формирования грануляционной ткани. Ее особенностью является незначительное количество новообразованных капилляров.
В серии эксперимента 7 суток после РЧА обнаружена стабилизация объема некроза ткани печени, частичная элиминация некротических масс и выраженные процессы организации очага деструкции. Наибольший диаметр зоны деструкции в среднем составлял 11,2+0,84 мм, объем – 356,2 мм3.
Последующие сроки – 14, 21 и 30 суток – характеризуются типичной динамикой организации и отграничения очага термодеструкции фиброзной капсулой.
Макроскопические и патогистологические изменения при 2-минутной длительности РЧА в сравнении с предыдущей серией эксперимента имеют преимущественно количественный характер. Характер же их и динамика во времени практически идентичны.
Через 3 суток диаметр (20,4 мм) очага деструкции вдвое больше, чем в аналогичной серии эксперимента с воздействием в течение 1 минуты, объем же превышает таковой в предыдущей серии в 5 раз (3711,3 мм3).
На 7-е сутки эксперимента максимальный средний диаметр не отличается, составляя 11,4 мм. Однако более показательной является величина объема, которая в 2 раза больше, чем в сравниваемой 1-минутной серии эксперимента, и составляет 603,1 мм3. Это связано с различной конфигурацией очагов деструкции. При 1-минутном воздействии она более эллиптичная, о чем свидетельствуют меньшие величины малого диаметра, существенно отражающиеся на объеме.
В серии с временной ишемией печени выявлены существенные отличия морфологических изменений после РЧА. Важным являлось отсутствие пригорания влажных тканей к активному электроду, что способствовало равномерному воздействию, стабильности прогревания тканей и низким значениям импеданса тканей, которые поддерживались на уровне 90-100 Ом. В серии без обескровливания печени течение термодеструкции было нестабильным. В ходе вмешательства наблюдалось пригорание участков тканей к электроду, закипание тканей и газообразование вплоть до разрывов доли печени, нестабильность температуры и импеданса тканей, достигавшего 150-180 Ом.
Через 1 сутки после РЧА на фоне ишемии печени максимальный диаметр очага деструкции достигал в среднем 23, 2 мм, что почти в 2 раза больше, чем без ишемии печени. Объем составлял в среднем 5515,9 мм3. Через 3 суток после РЧА максимальный размер поврежденной зоны на фоне ишемии достигал в среднем 31,8 мм, объем – 10054,0 мм3.
При микроскопическом исследовании установлено, что основной причиной отличий в развитии изменений печени после РЧА на фоне ишемии являются вторично возникающие повреждения кровеносных сосудов с распространенным тромбозом. Если в течение первых суток быстрое формирование сплошной зоны некроза с достоверно большим объемом, в сравнении с манипуляциями на интактной печени, связано с искусственно вызванной лигированием гепато-дуоденальной связки ишемией, то к 3-м суткам превалируют вторичные нарушения кровообращения.
Микроскопически на данном сроке эксперимента как в непосредственной близости к зоне аблации, так и очагово в отдаленных участках в сосудах портальных трактов выявлялись обтурирующие, преимущественно смешанные и фибриновые тромбы с некротическими изменениями и выраженной воспалительной инфильтрацией в прилежащих участках печени.
На сроке 7 суток после РЧА диаметр очага деструкции составлял в среднем 24,6 мм, объем – 5629,3 мм3. Прилежащие к очагу аблации сосуды и сосуды ближайших портальных трактов обтурированы фибриновыми и фибриново-лейкоцитарными тромбами. На периферии выражено формирование грануляционной ткани, ширина слоя которой достигала 200 мкм. В целом указанные изменения в сопоставлении с предыдущей серией эксперимента характеризуют как большую выраженность и значительно более раннюю завершенность некроза, так и раннее наступление резорбции и организации очага термического повреждения печени.
В последующие сроки происходила преимущественно инкапсуляция некротических масс, выраженная уже на 14-е сутки. Полной резорбции некротических тканей не наблюдалось и в сроки 21-30 суток после РЧА. При сходной с предыдущими сериями эксперимента динамике уменьшения диаметра и объема очага деструкции на всех сроках сохранялись достоверно (p<0,05) большие их величины при РЧА на фоне ишемии печени. Через 14 суток диаметр составлял 18, 4 мм, объем 2358,8 мм3, на 21-е – 15,4 мм и 1297,9 мм3, на 30-е – 12,3 мм и 491,9 мм3.
Количественные отличия показателей объема деструкции представлены на рис. 1.
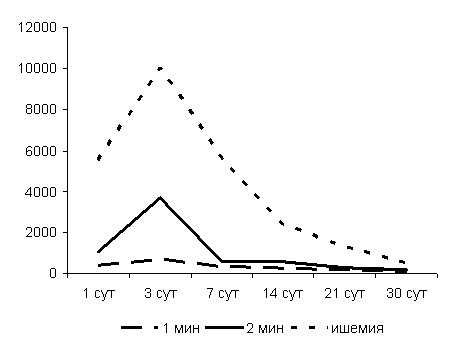
Рис. 1. Динамика изменений объема (мм3) очага термоаблации в зависимости
от времени воздействия и при 2-минутном воздействии на фоне ишемии печени
Результаты клинического исследования
Анализ результатов клинического применения РЧА в лечении метастазов колоректальных раков в печень осуществлялся в 2 группах: 1) случаи с солитарными унилобарными метастазами до 5,0 см (29 пациентов); 2) случаи с солитарными унилобарными метастазами больше 5,0 см в диаметре и множественными метастазами вне зависимости от их размера (19 пациентов).
Первая группа была представлена 29 пациентами: мужчин 20 (69%) в возрасте от 41 до 72 лет (средний возраст 58,1 год), женщин 9 (31%) в возрасте от 39 до 65 лет (средний возраст 57,6 лет). В 16 случаях имелись синхронные (55%), в 13 (45%) метахронные метастазы. В 16 случаях синхронного метастазирования РЧА выполнялась одновременно с удалением первичной опухоли. В 3 случаях метахронного метастазирования РЧА также выполнялась с использованием лапаротомного доступа, в двух случаях во время реконструктивно-восстановительной колопластики, в одном случае в связи с местным рецидивом опухоли в зоне коло-анального анастомоза.
Размер метастаза, локализация, выгодные условия позиционирования позволили в 10 случаях метахронного метастазирования выполнить РЧА под
УЗ-навигацией. В одном из 10 случаев после РЧА под контролем УЗИ выполнена левосторонняя гемиколэктомия с формированием концевой колостомы и брюшноанальная резекция прямой кишки в связи с малигнизацией полипов в соответствующих отделах.
Вторая группа представлена 19 наблюдениями: 6 мужчин (31,5%) в возрасте от 64 до 78 лет (средний возраст 71,6 лет), 13 женщин (68,4%) в возрасте от 30 до 72 лет (средний возраст 49,5 лет). По срокам развития метастазы распределились так: синхронные – 14 случаев (73,7%) и метахронные – 5 случаев (26,3%). В 13 наблюдениях синхронного метастазирования очаговые образования были солитарные, имея билобарную локализацию и размер более 5,0 см в диаметре. В одном случае выявлен синхронный, унилобарный, солитарный метастаз с максимальным размером до 8,5 см в диаметре.
Всем больным в данной группе РЧА выполнялась интраоперационно, во время удаления первичной опухоли. Применяли электроды с соответствующей длиной рабочей части по принципу перекрывающихся гипертермических зон. Количество аппликаций в среднем составило 10 (от 6 до 12).
В 5 случаях метастазирование имело метахронный характер. В 3 случаях метастазы были солитарные, с размерами более 5 см и имели билобарное расположение. Данным пациентам РЧА выполнена под УЗ-навигацией с использованием принципа перекрывающихся гипертермических зон. В 2 наблюдениях выявлено множественное метахронное метастазирование. В одном случае при размерах более 5,0 см и билобарной локализации метастазов, а также в связи с рецидивом опухоли в зоне колоректального анастомоза РЧА выполнялась интраоперационно.
В одном наблюдении у пациента с множественными билобарными метахронными метастазами размерами до 5,0 см в диаметре РЧА производилась параллельно с правосторонней гемигепатэктомией.
При применении РЧА для лечения метастазов колоректальных раков наблюдались следующие осложнения: развитие абсцесса в зоне РЧА – 2 пациента, ожог кожи в зоне пассивного электрода – у одного пациента. В одном случае абсцесс был дренирован под контролем УЗИ, в другом случае потребовалась лапаротомия с санацией и дренированием брюшной полости ввиду развившегося желчного перитонита. Летальных исходов не было, все больные выписаны в удовлетворительном состоянии.
Таким образом, в обеих группах частота осложнений составила 8,3%.
Максимальный срок наблюдения за больными в обеих группах после РЧА составляет 5 лет (28 пациентов). Медиана выживаемости составила 32,5 месяцев. Погодичная продолжительность жизни представлена на рис. 2.
При анализе по группам выявлены существенные отличия, которые напрямую связаны с клиническими характеристиками метастатического поражения печени (количество, размер, локализация метастазов в печени).
В первой группе годичного срока выживаемости достигли все больные. Средняя продолжительность жизни в данной группе в 5-летний срок наблюдения составляет 45,7 месяцев, медиана – 60 месяцев. Во второй группе в течение первого года умерло 5 больных (26,3%), трехлетнего срока выживаемости достигли только 3 пациента (15,8%). Средняя продолжительность жизни в течение срока наблюдения за данной группой составила 15 месяцев, медиана –
18,6 месяцев.

Рис. 2. Выживаемость больных по годам после РЧА (%)
Данные о продолжительности жизни по годам в сравниваемых группах представлены на рис. 3.

Рис. 3. Сравнение продолжительности жизни больных по группам
Среди факторов, влияющих на результаты лечения, анализ которых оказался возможным в исследованных нами группах, существенными оказались размер метастатических очагов и их локализация (моно- или билобарная).
Размер и локализация метастазов влияли на показатели продолжительности жизни следующим образом. Средняя продолжительность жизни и медиана оказались наибольшими при размерах метастазов менее 5 см (45,0 месяцев и 60 месяцев соответственно), общая выживаемость по годам составила: 1 год – 100%, 3 года – 74,2%, 5 лет – 54,8% (р<0,05). Аналогичным образом на показатели выживаемости по годам влияла монолобарная локализация метастазов. Однако средняя продолжительность жизни и медиана выживаемости оказались ниже: 39,9 и 40 месяцев соответственно. Это свидетельствует о прогностическом значении размера метастазов.
При размере метастазов более 5 см и их билобарной локализации наблюдались одинаковые показатели средней продолжительности жизни, медианы и годичной выживаемости: 16,4 мес, 15 мес и 70,6%.
Данные о причинах летальных исходов за период наблюдения были нами получены в 20 случаях. Среди них половину составили случаи местного прогрессирования метастатического процесса в результате отказа пациентов от дальнейшего лечения. В остальных наблюдениях смерть наступила в результате генерализации опухолевого процесса.
Исследование морфологических изменений очагов метастатических поражений печени после РЧА выполнено на материале, взятом непосредственно после РЧА при открытых операциях на печени, материале пункционных биопсий в сроки от 5 суток до 2 лет и операционном материале при выполнении резекций печени, а в 1 случае – гемигепатэктомии.
Термоаблация выполнялась в соответствии с имеющимися рекомендациями – с захватом около 1 см неизмененной ткани печени. Но при строении метастазов в виде конгломерата узлов при интраоперационном морфологическом исследовании выявлено, что наибольшей резистентностью к термодеструкции обладает фиброзная опухолевая строма, выраженное формирование которой вообще характерно для колоректальных раков. Также, как и в экспериментальной модели, мы наблюдали формирование своеобразных кавернозных полостей, заполненных кровянистыми массами, фрагментами опухолевой слизи и некротическим детритом. Высоко вероятно, что такие скрытые от радиочастотного воздействия фиброзной тканью участки опухоли со сложной геометрической формой могут остаться незамеченными и в дальнейшем послужить источником продолженного роста и прогрессирования метастатического поражения.
Спустя 3 месяца после полной термодеструкции метастатических очагов при компьютерной томографии определяется четкая сформированная граница очага. Морфологически в пункционных биоптатах она представлена пластом молодой грануляционной ткани, фибринозными массами, крупными очагами лейкоцитарной инфильтрации. Как и в эксперименте, имеются признаки персистирования некротических масс, их неполной резорбции. В определенной степени это связано с ранним формированием фиброзной малососудистой капсулы, что ограничивает резорбционные и элиминационные возможности нейтрофилов и лимфогистиоцитарных элементов.
В случае продолженного роста опухоли через 3 месяца после РЧА (клиническая характеристика случая представлена выше) нами также выявлены выраженные фиброзные изменения в ткани опухоли, что еще раз свидетельствует об их «маскирующей» роли от деструктивных воздействий.
Через 1,5 года капсула очага РЧА представлена толстым слоем фиброзной гиалинизированной ткани, практически не содержащей кровеносных сосудов, со скудным клеточным составом, в том числе незначительной лейкоцитарной инфильтрацией. В полости очага и по внутренней поверхности капсулы сохраняются хлопьевидные массы коагуляционного некроза. Наличие в очаге РЧА фибринозных масс и клеточного детрита установлено нами при пункционном биопсийном исследовании и через 2 года после РЧА.
Полученные результаты и их сопоставление с имеющимися в литературе данными позволили сделать следующие выводы.
ВЫВОДЫ
1. Действие радиочастотной термоаблации на структуры печени в условиях сохраненного печеночного кровотока в различных временных режимах связано как с непосредственным влиянием на клеточные элементы, так и с перераспределением нагретой крови и тканевой жидкости. При РЧА на фоне кратковременной ишемии печени объем очага деструкции в 1,5-2 раза больше, чем при аналогичной длительности и времени воздействия в условиях сохраненного кровотока. Термодеструкция на фоне ишемии отличается большей равномерностью и полнотой во всех зонах очага воздействия.
2. Эффективность применения радиочастотной аблации зависит от размеров и локализации метастатических очагов. При солитарных унилобарных метастазах размером до 5,0 см средняя продолжительность жизни в пятилетний срок наблюдения составляет 45,7 месяцев. Самостоятельными неблагоприятными факторами прогноза при солитарных метастазах является их размер – более
5,0 см и множественность очагов вне зависимости от размера. Трехлетняя выживаемость в этих случаях составляет 15,8%, пятилетняя – не наблюдалась.
3. Степень воздействия РЧА на структуры внутрипеченочных метастазов колоректальных раков и ткань печени помимо его времени и мощности зависит от морфологических особенностей зоны деструкции, условий кровотока. Выраженные фиброзные изменения опухоли являются фактором снижения эффективности термоаблации, а сохранение и неравномерность кровотока может явиться фактором теплоотведения и неоднородности радиочастотного воздействия, что также снижает его эффективность.
4. Закономерными в очагах РЧА являются отсроченная гибель тканевых структур, ранняя инкапсуляция некротических масс, опережающая их резорбцию. Это определяет длительное существование тканевого детрита в зоне воздействия, что выявлено как в экспериментальных моделях, так и при исследовании биоптатов очаговых образований печени в сроки до 2 лет после радиочастотной термоаблации.
5. Радиочастотная термоаблация является эффективным методом лечения метастатических поражений печени как в комплексе лечебных мероприятий, прежде всего при выполнении открытых хирургических вмешательств на печени, так и самостоятельно, при небольших солитарных метастазах. Пятилетняя продолжительность жизни при использовании РЧА в комплексе лечения достигает 35,4%.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. С учетом отсроченности некротических изменений в зоне радиочастотной аблации выполнение контрольных пункционных биопсий целесообразно начинать не ранее 3 месяцев после вмешательства.
2. Эффективность термоаблации в раннем послеоперационном периоде необходимо оценивать на основании данных магнитно-резонансной и спиральной компьютерной томографии с внутривенным контрастированием.
3. При морфологической оценке контрольных биоптатов печени следует помнить о сохранении инкапсулированных некротических масс в течение длительного времени. Детального изучения для исключения остаточных опухолевых структур требуют очаги фиброзных изменений.
4. В качестве основных факторов прогноза эффективности радиочастотной термоаблации следует учитывать количество, размер и локализацию метастазов. Для больных с солитарными унилобарными метастазами размерами до 5,0 см радиочастотную аблацию можно считать не циторедуктивным, а радикальным способом лечения.
5. При возникновении продолженного роста опухоли в зоне ранее произведенной термоаблации эффективность ее повторного применения резко снижается вследствие фиброзных изменений, связанных как с опухолевым ростом, так и предшествовавшей деструкцией тканей. Предпочтительными для таких пациентов являются операции резекции печени.
Список работ, опубликованных по теме диссертации
1. Радиочастотная термоаблация при метастатических опухолях печени. Некоторые экспериментальные и клинико-морфологические аспекты / В.Ф. Куликовский, Д.И. Набережнев, В.Д. Луценко, П.М. Быков // Человек и его здоровье: научно-практический вестник. – Курск, 2005. – №4. – С. 38-44.
2. Куликовский В.Ф. Динамика морфологических изменений печени после радиочастотной термоаблации в эксперименте / В.Ф. Куликовский, Д.И. Набережнев, В.Д. Луценко // Материалы Всероссийской конференции к 85-летию член-кор. РАМН О.К. Хмельницкого. – СПб., 2005. – С.134-135.
3. Куликовский В.Ф. Морфологические аспекты радиочастотной термоаблации метастатических опухолей печени / В.Ф. Куликовский, Д.И. Набережнев, В.Д. Луценко // Актуальные вопросы современной хирургии: материалы Межрегиональной конференции. – Курск, 2005. – С. 64 – 66.
4. Куликовский В.Ф. Первый опыт использования радиочастотной аблации в лечении больных с метастазами колоректального рака в печень / В.Ф. Куликовский, Д.И. Набережнев // Актуальные проблемы колопроктологии: материалы научной конференции. – М., 2005. – С. 247 – 248.
5. Набережнев Д.И. Воздействие радиочастотной термоаблации на структуру интактной и ишемизированной печени / Д.И. Набережнев, В.Ф. Куликовский, В.Д. Луценко // Бюллетень Волгоградского научного центра РАМН. – 2006. – №1. – С. 34 – 37.
6. Набережнев Д.И. Особенности изменений интактной и ишемизированной печени при радиочастотной термоаблации / Д.И. Набережнев // Российский журнал гастроэнтерологии, гепатологии и колопроктологии – 2006. – №1 (приложение). – С. 20.
7. Prevention of postablation tumour relapse / V.F. Kulikovsky, N.V. Olejnik, D.I. Naberezhnev, A.V. Naumov // XII Central European Congress of Coloproctology «Proktologia». – 2008. – V.1, №9. – P.79.
8. Куликовский В.Ф. Динамика морфологических изменений печени при радиочастотной термоаблации в эксперименте / В.Ф. Куликовский, Д.И. Набережнев // Вестник экспериментальной и клинической хирургии. – 2009. – Т.2, №1. – С. 51 – 59.
Подписано в печать 15.05.2009. Формат 6084/16.
Гарнитура Times. Усл. п. л. 1,0. Тираж 100 экз. Заказ 100.
Оригинал-макет подготовлен и тиражирован в издательстве
Белгородского государственного университета
308015 г. Белгород, ул. Победы, 85

