Кызы химиотерапия без антрациклинов в комбинации с трастузумабом при раке молочной железы с гиперэкспрессией her-2. характеристика молекулярно-биологических маркеров
На правах рукописи
ЗЕЙНАЛОВА КАМАЛА РУФАТ КЫЗЫ
ХИМИОТЕРАПИЯ БЕЗ АНТРАЦИКЛИНОВ В КОМБИНАЦИИ
С ТРАСТУЗУМАБОМ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
С ГИПЕРЭКСПРЕССИЕЙ HER-2.
ХАРАКТЕРИСТИКА МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИХ МАРКЕРОВ
14.01.12 – Онкология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва 2011
Работа выполнена в Учреждении Российской академии медицинских наук Российском онкологическом научном центре им. Н.Н.Блохина РАМН.
Научные руководители:
член-корреспондент РАН,
доктор медицинских наук, профессор М. Р. Личиницер
доктор медицинских наук Е. В. Степанова
- Официальные оппоненты:
член-корреспондент РАМН,
доктор медицинских наук, профессор Н.Е. Кушлинский
доктор медицинских наук, профессор С.В. Одинцов
Ведущее учреждение: ФГУ «Московский научно-исследовательский онкологический институт им. П.А.Герцена Минздравсоцразвития»
Защита состоится «____»___________2011 г. в______часов на заседании Диссертационного совета Д.001.017.01 при Российском онкологическом научном центре им. Н.Н.Блохина РАМН (115478, г. Москва, Каширское шоссе, 24).
С диссертацией можно ознакомиться в библиотеке Российского онкологического научного центра им. Н.Н.Блохина РАМН.
Автореферат разослан «___»___________2011 г.
Ученый секретарь Диссертационного Совета,
доктор медицинских наук, профессор Ю.В. Шишкин
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Рак молочной железы (РМЖ) с гиперэкспрессией HER-2 (HER-2(+)) обычно характеризуется резким снижением апоптоза, усилением пролиферации, гипоэкспрессией рецепторов эстрогенов и прогестерона, усиленным ангиогенезом, меньшей чувствительностью к противоопухолевой терапии (химиотерапии, эндокринотерапии, лучевой терапии). РМЖ с HER2(+) статусом имеют более агрессивное течение и более высокую резистентность к проводимой терапии.
До настоящего времени не проведено комплексной оценки ко-экспрессии HER-2 и других молекулярно-биологических маркеров (апоптоза, ангиогенеза, пролиферации, метастазирования) при РМЖ и оценки их влияния на течение заболевания.
В последние годы для лечения HER-2(+) опухолей успешно используется Трастузумаб (Герцептин – рекомбинантные моноклональные антитела против HER-2). Наиболее эффективным является его применение в комбинации с цитотоксической химиотерапией. Однако нет единого мнения о наиболее рациональных комбинациях при местно-распространенном и метастатическом HER-2(+) РМЖ.
Известно, что комбинации Доксорубицина и Трастузумаба достаточно оэффективны, но с учетом высокой кардиотоксичности, в настоящее время их использование вне рамок клинических исследований не рекомендуется. В связи с этим существует необходимость разработки режимов применения Трастузумаба с химиотерапией, не содержащей антрациклины.
В последнее время накапливается все больше данных о том, что определение молекулярно-биологических маркеров дает дополнительную информацию о возможной эффективности использования химиотерапии и Трастузумаба. Комплексное изучение новых режимов лечения и оценка значения молекулярно-биологических маркеров, характеризующих апоптоз, пролиферацию, ангиогенез и метастазирование, представляется актуальным.
Цель исследования
Повышение эффективности лекарственной терапии больных HER-2(+) РМЖ.
Задачи исследования
1. Разработать новые режимы химиотерапии без антрациклинов в сочетании с Трастузумабом (Доцетаксел + Карбоплатин, Паклитаксел + Винорельбин) при HER-2(+) РМЖ.
2. Определить влияние экспрессии молекулярно-биологических маркеров апоптоза, ангиогенеза, пролиферации, метастазирования на результаты лечения больных метастатическим HER-2(+) РМЖ.
3. Определить влияние экспрессии молекулярно-биологических маркеров апоптоза, ангиогенеза, пролиферации, метастазирования на результаты лечения больных местно-распространенным HER-2(+) РМЖ.
4. Оценить переносимость комбинации Трастузумаба с неантрациклиновыми режимами химиотерапии при HER-2(+) РМЖ.
Научная новизна
Впервые в мире проведен широкий спектр молекулярно-биологических исследований, характеризующих пролиферацию, апоптоз, ангиогенез и метастазирование у больных HER-2(+) РМЖ. Проведено сопоставление полученных результатов с клиническим течением болезни. Впервые оценены новые режимы химиотерапии без антрациклинов в сочетании с Трастузумабом. Впервые изучены молекулярно-биологические маркеры эффективности лечения, резистентности к Трастузумабу.
Практическая значимость
Новые характеристики злокачественных опухолей, полученные при изучении молекулярно-биологических маркеров, имеют фундаментальное значение, позволяя выделить группу больных с более неблагоприятным прогнозом, меньшей чувствительностью к терапии. Разработаны новые эффективные комбинации Трастузумаба и химиотерапии без антрациклинов у больных РМЖ с гиперэкспрессией HER-2.
Апробация работы
Диссертация обсуждена 14 января 2011 года на совместной научной конференции с участием отделения химиотерапии и комбинированного лечения злокачественных опухолей, отделения химиотерапии, отделения клинической фармакологии, хирургического отделения опухолей молочных желез, хирургического отделения опухолей женской репродуктивной системы, хирургического отделения диагностики опухолей, отдела патологической анатомии НИИ КО РОНЦ им. Н.Н.Блохина РАМН и лаборатории экспериментальной диагностики и биотерапии опухолей НИИ ЭДИТО РОНЦ им. Н.Н.Блохина РАМН.
Публикации
По теме диссертации опубликовано 6 печатных работ.
Положения, выносимые на защиту
- Молекулярно-биологическая характеристика рака молочной железы с гиперэкспрессией HER-2. Роль исследованных молекулярных маркеров в прогнозе заболевания и возможности их использования для оптимизации лечебной тактики.
- Разработка новых эффективных режимов химиотерапии без антрациклинов в комбинации с Трастузумабом при местно-распространенном и метастатическом HER-2(+) РМЖ.
Объем и структура диссертации
Диссертация изложена на 148 страницах машинописного текста. Состоит из введения, оглавления, списка сокращений, обзора литературы, характеристики материала и методов исследования, результатов собственных наблюдений, обсуждения, выводов, приложений, библиографии. Результаты работы отражены в 17 таблицах. Текст иллюстрирован 30 рисунками. В библиографическом указателе 5 источников отечественной и 272 иностранной литературы.
СОДЕРЖАНИЕ ИССЛЕДОВАНИЯ
Материалы и методы
В исследование включено 73 больных HER-2(+) РМЖ: 37 больных – метастатическим и 36 – местно-распространенным.
У 37 больных метастатическим РМЖ в I линии лечения изучена эффек-
тивность химиотерапии на основе таксанов в комбинации с Трастузумабом (частота общего эффекта, время до прогрессирования, общая выживаемость).
У больных местно-распространенным РМЖ в неоадъювантной терапии изучена клиническая (у 36 больных), морфологическая (у 32 больных) эффективность и безопасность применения (у 36 больных) различных безантрациклиновых режимов химиотерапии в комбинации с Трастузумабом.
У 60 больных (37 – метастатическим и 23 – местно-распространенным) HER-2(+) РМЖ в ткани первичной опухоли молочной железы иммуногистохимическим методом была оценена экспрессия 9 различных молекулярно-биологических маркеров, ассоциированных с апоптозом (Bcl-2, pAkt, PTEN, MUC4), ангиогенезом (VEGFа), пролиферацией (Ki67, EGFR, Topo2a), метастазированием (S100A4). Характеристика молекулярно-биологических маркеров дана в таблице 1.
Таблица 1
Панель изученных молекулярно-биологических маркеров
| Маркер | Клон | Производитель | Характеристика |
| Ki-67 | MIB-1 | Dako | Пролиферативная активность опухоли |
| Bcl-2 | 124 | Dako | Ингибитор апоптоза |
| EGFR | 31G7 | Zymed | Рецептор эпидермального фактора роста |
| pAkt | Phosphor T308 | Abcam | Антиапоптотический белок |
| PTEN | VP-P985 | Vector | Индуктор апоптоза |
| MUC4 | 1G8 | Santa Cruz Biotech | Супрессор апоптоза |
| Topo2a | Ki-S1 | Dako | Фермент, влияющий на топологию ДНК |
| VEGFа | С-1 | Santa Cruz Biotech | Стимулятор ангиогенеза |
| S100A4 | 8828MTS | Нидерланды | Индуктор метастазирования опухоли |
Полученные данные сопоставлены с результатами терапии с включением Трастузумаба (частотой объективного клинического эффекта, степенью морфологической регрессии, временем до прогрессирования, безрецидивной и общей выживаемостью).
Режимы лечения больных метастатическим (I линия)
и местно-распространенном HER-2(+) РМЖ
В комбинации с Трастузумабом (4 мг/кг -> 2 мг/кг еженедельно или 8 мг/кг –> 6 мг/кг каждые 3 недели) больные получали химиотерапию в одном из режимов:
Доцетаксел 100 мг/м2 (или Паклитаксел 80-175 мг/м2) – 29 больных.
Доцетаксел 50-75 мг/м2 (или Паклитаксел 135 мг/м2) + Карбоплатин AUC 5 – 29 больных.
Паклитаксел 135-150 мг/м2 + Винорельбин 25 мг/м2 – 15 больных.
Обследование больных
До начала химиотерапии во всех случаях диагноз рака молочной железы подтвержден морфологически. У всех больных до начала I линии лечения (метастатическим РМЖ) или неоадъювантного лечения (местно-распространенным РМЖ) в биопсийном материале определялся статус РЭ и РП, HER-2, пролиферативная активность опухоли. В случае гиперэкспрессии HER-2 “++” изучали амплификацию гена her-2 с помощью FISH исследования.
До начала и после завершения лечения проводилось измерение опухолевых очагов по стандартной методике и описание неизмеряемых проявлений болезни.
В исследование не включались больные с серьезными сердечно-сосудистыми заболеваниями (стенокардию, инфаркт миокарда) в анамнезе, а также значимыми изменениями на ЭКГ и при эхокардиографии (ФВЛЖ 50%).
Достигнутый эффект оценивался в соответствии со стандартными REСIST критериями (версия 1.0) после каждых 2-3 циклов лечения.
Токсичность оценивалась в соответствии с критериями токсичности NCI-CTC (версия 3.0). Оценка кардиотоксичности проводилась по данным эхокардиографии, выполняемой перед началом лечения и далее каждые 3 месяца.
Методика морфологического исследования
Морфологический эффект (степень лечебного патоморфоза) анализировали в соответствии с классификацией Chevallier B.[1993]:
Класс 1 – полное исчезновение элементов опухоли на гистологических срезах при макроскопическом и микроскопическом исследовании.
Класс 2 – сохранение только рака in situ в ткани молочной железы без инвазивного компонента опухоли и при полном исчезновении опухолевых клеток в ткани лимфоузлов.
Класс 3 – сохранение инвазивной опухоли с дистрофическими стромальными изменениями в виде фиброза, склероза в ткани молочной железы и/или лимфоузлов.
Класс 4 – полное или значительное сохранение опухоли без признаков лечебного патоморфоза.
Полная морфологическая регрессия устанавливается при классе 1 – 2.
Случаи с предоперационной лучевой терапией в анализ морфологического эффекта не включали.
Иммуногистохимический метод определения экспрессии
молекулярно-биологических маркеров в опухоли
Иммуногистохимический анализ проводили на срезах с парафиновых блоков опухолей, предназначенных для стандартного морфологического исследования в лаборатории экспериментальной диагностики и биотерапии опухолей НИИ ЭДИТО РОНЦ им. Н.Н.Блохина РАМН. Использованные в работе антитела представлены в таблице 1. Критерии оценки результатов соответствовали принятым в лаборатории и мировой практике.
Статистический анализ результатов
Статистический анализ проводили на персональном компьютере с использованием программы “SPSS” (v19.0. for Windows). Для проверки статистической значимости различий значений признаков в группах использовали тесты «хи-квадрат» (2). Различия считались статистически значимыми при р<0,05 (95% точности). Корреляционный анализ проводился с помощью коэффициента корреляции Пирсона и коэффициента ранговой корреляции Спирмена. Выживаемость расчитывалась методом Каплана-Мейера, различия оценивались логранковым тестом.
РЕЗУЛЬТАТЫ
Эффективность таксанов в комбинации с Трастузумабом в I линии
лечения метастатического HER-2(+) рака молочной железы
Характеристика 37 больных метастатическим HER-2(+) РМЖ, получавших в I линии лечения в комбинации с Трастузумабом химиотерапию на основе таксанов, представлена в таблице 2.
Таблица 2
Характеристика больных метастатическим HER-2(+)
раком молочной железы
| Характеристика | Число больных (%) |
| Возраст, годы диапазон медиана | 29-77 54 |
| Менопауза да нет | 24 (64,9) 13 (35,1) |
| Рецепторный статус негативный позитивный | 19 (51,4) 18 (48,6) |
| Локализация отдаленных метастазов висцеральные (печень, легкие) невисцеральные смешанные (висцеральные + невисцеральные) | 9 (24,3) 15 (40,5) 13 (35,2) |
Результаты лечения представлены в таблице 3.
Таблица 3
Эффективность I линии лечения 37 больных метастатическим HER-2(+) раком молочной железы
| Показатель | Результаты |
| Общий эффект (ПР + ЧР), число больных (%) по невисцеральным метастастазам по висцеральным метастазам по смешанным метастазам | 25 (67,6%): 9 3 13 |
| Стабилизация ( 6 мес.), число больных (%) по невисцеральным метастастазам по висцеральным метастазам по смешанным метастазам | 10 (27%): 4 1 5 |
| Контроль болезни (ПР+ЧР+СБ > 6 мес.) | 35 (94,6%) |
| Прогрессирование (< через 6 мес.) | 2 (5,4%) |
| Медиана времени до прогрессирования общая группа (37 больных) случаи с ПР+ЧР (25 больных) случаи со СБ > 6 мес (10 больных) случаи с ПРГ (2 больных) | 19,1 мес 19,6 мес 19,4 мес 4,1 мес |
| 1-летняя общая выживаемость, % | 97,3% |
| 2-летняя общая выживаемость, % | 67,6% |
При медиане времени наблюдения 23,3 мес. прогрессирование болезни после I линии лечения отмечено у 24 из 37 больных. Медиана времени до прогрессирования составила 19,1 мес. (от 2,9 до 57,4 мес.). Медиана общей выживаемости не достигнута (на момент анализа 23 из 37 больных живы).
Результаты лечения больных метастатическим HER-2(+)
раком молочной железы в сопоставлении с экспрессией
молекулярно-биологических маркеров в опухоли
Из 37 больных метастатическим HER-2(+) РМЖ, получивших в I линии лечения в комбинации с Трастузумабом химиотерапию таксанами, оценка экспрессии 6 молекулярно-биологических маркеров (Ki67, Bcl-2, MUC4, pAkt, Topo2a и S100A4) выполнена у всех больных, еще 3 молекулярно-биологических маркеров (VEGF, PTEN, EGFR) – у 36 больных.
Данные по частоте экспрессии маркеров приведены в таблице 4.
Таблица 4
Экспрессия молекулярно-биологических маркеров в опухоли больных метастатическим HER-2(+) раком молочной железы
| Маркер | Общее число больных | Частота экспрессии маркера | ||
| Высокая (+) число больных (%) | Умеренная (+/-) число больных (%) | Низкая/отсутствие (-) число больных (%) | ||
| Ki-67 | 37 | 19 (51,4) | 9 (24,3) | 9 (24,3) |
| Bcl-2 | 37 | 12 (32,4) | 6 (16,2) | 19 (51,4) |
| PTEN | 36 | 20 (55,6) | 9 (25) | 7 (19,4) |
| VEGF | 36 | 11 (30,5) | 10 (27,8) | 15 (41,7) |
| MUC4 | 37 | 22 (59,5) | 4 (10,8) | 11 (29,7) |
| pAkt | 37 | 19 (51,4) | – | 18 (48,6) |
| Topo2a | 37 | 15 (40,6) | 10 (27) | 12 (32,4) |
| EGFR | 36 | 3 (8,3) | 3 (8,3) | 30 (83,4) |
| S100A4 | 37 | 24 (64,9) | 8 (21,6) | 5 (13,5) |
В нашем исследовании в опухоли большинства больных метастатическим HER-2(+) РМЖ наблюдались: высокая пролиферативная активность, высокая экспрессия индуктора апоптоза PTEN, высокая экспрессия супрессора апоптоза MUC4, высокая экспрессия индуктора метастазирования S100A4, отсутствие экспрессии гиперэкспрессии.
Высокая пролиферативная активность опухоли – экспрессия Ki-67 в > 40% ядер HER-2(+) опухолевых клеток, имела прямую взаимосвязь с высокой экспрессией Topo2a (р=0,035; r, rs=0,45) и гиперэкспрессией MUC4 (р=0,049; r, rs=0,40). Высокая и умеренно выраженная экспрессия PTEN прямо коррелировала с высокой экспрессией Topo2a (р=0,0001; r, rs=0,70), высокая экспрессия PTEN наблюдалась в опухоли с высокой экспрессией pAkt (р=0,018; r, rs=0,45). Выявлена прямая корреляция между гиперэкспрессией VEGF и Topo2a (р=0,043; r, rs=0,44), S100A4 (р=0,014; r, rs=0,52). Отмечена прямая взаимосвязь между гиперэкспрессией MUC4 и Topo2a (р=0,007; r, rs=0,45), pAkt (р=0,038; r, rs=0,37).
При гиперэкспрессии РЭ в опухоли достоверно чаще наблюдалась высокая и умеренная экспрессия Bcl-2 (в 73,3%), нежели в отсутствие РЭ в опухоли (31,8%) (р=0,020; r, rs=0,41). РЭ(+) опухоли по сравнению с РЭ(-) чаще имели высокий метастатический потенциал (высокая экспрессия S100A4) – 86,7% против 50% (р=0,035; r, rs=0,38).
Ни у одного из 15 больных с РЭ(+) опухолью не наблюдалось гиперэкспрессии EGFR, тогда как среди 21 случая РЭ(-) опухолей гиперэкспрессия EGFR отмечена в 28,6% наблюдений (р=0,030; r, rs=-0,38).
В опухоли больных с количеством зон метастазирования больше 2-х по сравнению с опухолью больных с минимальным количеством зон метастазирования (1-2 зоны) достоверно чаще наблюдалась высокая экспрессия S100A4 – 85,7% против 37,5% случаев (р=0,005; r, rs=0,5) и отмечена тенденция к достоверно более частой высокой экспрессии VEGF – 60% против 18,2% случаев (р=0,051; r, rs=0,42).
При анализе показателей эффективности лечения в зависимости от экспрессии молекулярных маркеров выявлен ряд закономерностей.
Медиана времени до прогрессирования после I линии химиотерапии таксанами + Трастузумаб у больных с нормальной и умеренно повышенной экспрессией VEGF (VEGF(-)) в опухоли была выше, чем у пациентов с высокой экспрессией VEGF (VEGF(+)) – 28,6 мес. (95% ДИ 15,0-42,2) против 16,6 мес. (95% ДИ 14,0-19,2), р=0,039 (рис. 1).
В опухоли больных со временем до прогрессирования болезни > 1 года чаще наблюдалась высокая экспрессия Bcl-2 (Bcl-2(+)), нежели низкая и умеренно выраженная экспрессия маркера (Bcl-2(-)) – в 66,7% и 33,3% случаев. Тогда как, в опухоли больных со временем до прогрессирования < 1 года наблюдалась только низкая и умеренно выраженная экспрессия Bcl-2 – в 100% случаев (р=0,0001; r, rs=0,59) и ни в одном случае не отмечено высокой экспрессии маркера. Медиана времени до прогрессирования у больных с Bcl-2(-) (с низкой и умеренно высокой экспрессией) опухолью составила 15,7 мес. (95% ДИ 11,8-19,6), с Bcl-2(+) (с высокой экспрессией) опухолью – 28,6 мес. (95% ДИ 13,1-44,2), р=0,067 (рис. 2).

Рис. 1. Время до прогрессирования в зависимости от экспрессии VEGF
в опухоли больных метастатическим HER-2(+) раком молочной железы

Рис. 2. Время до прогрессирования в зависимости от экспрессии Bcl-2
в опухоли у больных метастатическим HER2(+) раком молочной железы
При времени до прогрессирования < 2 лет преобладали следующие характеристики опухоли: высокий уровень Ki67 – в 77,3%, высокая экспрессия VEGF – в 37,9% и Topo2a – в 75,9% случаев. В свою очередь, при времени до прогрессирования болезни > 2 лет частота высокой экспрессии этих маркеров была существенно ниже – Ki67 (в 33,3%), р=0,064; r, rs= -0,39, VEGF (в 0%), р=0,076; r, rs= -0,36 и Topo2a (37,5%), р=0,083; r, rs= -0,34. Эти различия были значимы, но не достигли статистической достоверности.
При дополнительном анализе молекулярно-биологической характеристики первичной опухоли больных с выраженным эффектом (ПР + ЧР + СБ > 6 мес.) и временем до прогрессирования > 2 лет (8 больных) также выявлены высокая и умеренно выраженная экспрессия Bcl-2 – в 62,5%, PTEN – в 50% случаев; отсутствие гиперэкспрессии MUC4 – в 62,5%, pAkt – в 62,5%, EGFR – в 87,5% случаев.
Выявлена тенденция к более длительной продолжительности эффекта у больных с высокой и умеренно высокой экспрессией Bcl-2 (26,0 мес.; 95% ДИ 12,9-39,1) по сравнению с больными с Bcl-2(-) опухолью (9,9 мес.; 95% ДИ 6,1-13,7) p=0,06 (рис. 3).
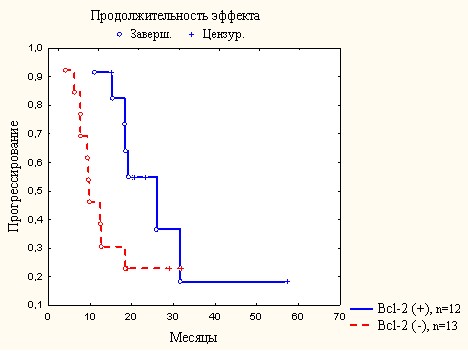
Рис. 3. Продолжительность эффекта после I линии лечения в зависимости
от экспрессии Bcl-2 в опухоли больных метастатическим HER2(+)
раком молочной железы.
Резюме: в нашей работе показана высокая эффективность химиотерапии I линии на основе таксанов в комбинации с Трастузумабом в лечении больных метастатическим HER-2(+) РМЖ: общий эффект составил 67,6% при медиане длительности эффекта 18,3 мес., медиана времени до прогрессирования составила 19,1 мес.
Выделены маркеры, которые могут быть использованы для отбора больных с неблагоприятным прогнозом, и возможно требующих новых подходов в лечении при метастатическом HER-2(+) РМЖ.
Факторами укорочения времени до прогрессирования на I линии лечения таксанами и Трастузумабом – являются гиперэкспрессия VEGF, Ki67, Topo2a, маркером агрессивного метастазирования и значительной распространенности болезни – S100A4. Также показано, что фактором длительного безрецидивного периода болезни и продолжительности достигнутого эффекта на терапии таксанами и Трастузумабом, может служить гиперэкспрессия Bcl-2.
Эффективность неоадъювантных режимов химиотерапии
без антрациклинов в комбинации с Трастузумабом у больных
местно-распространенным HER-2(+) раком молочной железы
Все 36 больных местно-распространенным HER-2(+) РМЖ IIIA-C стадий на I этапе в комбинации с Трастузумабом получили неоадъювантную химиотерапию в одном из указанных режимов:
Паклитаксел 100 мг/м2 + Винорельбин 25 мг/м2 1 раз/2 недели (7-8 циклов);
Паклитаксел 135 мг/м2 + Винорельбин 25 мг/м2 1 р/3 недели (6-8 циклов);
Доцетаксел 50 мг/м2 + Карбоплатин AUC 5 1 р/3 недели (4-6 циклов);
Доцетаксел 75 мг/м2 + Карбоплатин AUC 5 1 раз/3 недели (4-6 циклов).
4 больных после химиотерапии и Трастузумаба дополнительно получили предоперационную лучевую терапию). После окончания химиотерапии + Трастузумаб 36 больным выполнена операция: 35 – радикальная мастэктомия, 1 – радикальная резекция. Характеристика 36 пациентов дана в таблице 5.
Таблица 5
Характеристика 36 больных местно-распространенным HER-2(+) раком молочной железы
| Характеристика | число больных (%) |
| Возраст, годы диапазон медиана | 26-76 51 |
| Менопауза да нет | 19 (52,8) 17 (47,2) |
| Стадия IIIa IIIb IIIc | 2 (5,5) 14 (38,9) 20 (55,6) |
| Стадия по TNM T3N1-2 T2-3N3 T4N0 T4N1-2 T4N3 | 2 (5,6) 4 (11,1) 1 (2,7) 13 (36,1) 16 (44,4) |
| Размер опухоли в молочной железе до начала лечения < 2 cм 2-5 см > 5 см | 2 (5,5) 20 (55,6) 11 (30,6) |
| Статус рецепторов гормонов положительный отрицательный | 18 (50) 18 (50) |
Большинство больных имели значительные проявления болезни – IIIB и IIIС cтадию (в 38,9% и 55,6%). Больные, получавшие различные режимы химиотерапии были сопоставимы по возрасту, менструальному статусу, размеру первичной опухоли в молочной железе, распространенности болезни.
Непосредственные результаты после неоадъювантной химиотерапии + Трастузумаб представлены в таблицах 6 и 7.
Таблица 6
Клинический эффект после неоадъювантной химиотерапии +
Трастузумаб
| Эффект (REСIST критерии) | П 100 мг/м2 + В (n=8) n (%) | П 135 мг/м2 + В (n=5) n (%) | Д 50 мг/м2 + К (n=5) n (%) | Д 75 мг/м2 + К (n=18) n (%) |
| ПР + ЧР | 6 (75) | 5 (100) | 5 (100) | 15 (83,3) |
| ПР | 2 (25) | 1 (20) | 0 | 4 (22,2) |
| ЧР | 4 (50) | 4 (80) | 5 (100) | 11 (61,1) |
| СБ | 2 (25) | 0 | 0 | 3 (16,7) |
| ПРГ | 0 | 0 | 0 | 0 |
П — Паклитаксел, В — Винорельбин, Д — Доцетаксел, К — Карбоплатин.
В случае дополнительной лучевой терапии клинический эффект оценивался до облучения
Таблица 7
Морфологический эффект после неоадъювантной химиотерапии + Трастузумаб + операции
| Эффект (классификация Сhevallier) | П 100 мг/м2 + В (n=7/8) n (%) | П 135 мг/м2 + В (n=4/5) n (%) | Д 50 мг/м2 + К (n=4/5) n (%) | Д 75 мг/м2 + К (n=17/18) n (%) |
| Полный морфологический эффект: Класс 1 Класс 2 | 2 (28,6) 0 2 (28,6) | 2 (50) 0 2 (50) | 0 0 0 | 10 (58,8) 8 (47,0%) 2 (11,8%) |
| Без полного морфологического эффекта: Класс 3 | 5 (71,4) | 2 (50) | 4 (100) | 7 (41,2) |
| Класс 4 | 0 | 0 | 0 | 0 |
П — Паклитаксел, В — Винорельбин, Д — Доцетаксел, К — Карбоплатин
Наиболее эффективным при неоадъювантной терапии является режим Доцетаксел 75 мг/м2 + Карбоплатин AUC 5 + Трастузумаб каждые 3 недели (4-6 циклов). Клинический эффект составил 83,3% при ПР в 22,2% случаев. У 1 больной дополнительно проведена предоперационная локорегионарная ЛТ. Радикальная операция (РМЭ с сохранением грудных мышц/радикальная резекция молочной железы) выполнена у всех 18 больных. Полный морфологический эффект установлен у 10 (58,8%) больных: у 8 (47%) пациентов – класс 1, у 2 (11,8%) – класс 2. При медиане наблюдения 22,7 мес (от 10,6 до 36,2 мес) все больные живы; прогрессирование наступило у 4 из 18 пациентов.
При сопоставлении клинических и морфологических данных выявлено, что полная морфологическая регрессия опухоли достигнута не только у больных с выраженным клиническим эффектом, но и с клинической стабилизацией болезни (табл. 8). Не только опухоли малых размеров (< 5 см), но и больших размеров (> 5 см) реально имели доказательства полной морфологической регрессии.
Таблица 8
Характеристика больных в группах с различным
морфологическим эффектом после неоадъювантной терапии
| Характеристика | Полный морфологический эффект (I-II класса, n=14) n (%) | Неполный морфологический эффект (III класса, n=18) n (%) |
| 1 | 2 | 3 |
| T стадия T2-3 T4 | 3 (21,4) 11 (78,6) | 3 (16,7) 15 (83,3) |
| N стадия N0 N1-2 N3 | 1 (7,1) 7 (50) 6 (42,9) | 0 7 (38,9) 11 (61,1) |
| Размер опухоли в молочной железе < 5 cм > 5 см | 9 (64,3) 3 (21,4) | 12 (66,7) 5 (27,8) |
| Статус рецепторов гормонов положительный отрицательный | 5 (35,7) 9 (64,3) | 9 (50) 9 (50) |
| Среднее количество циклов неоадъювантной терапии | 6 | 6 |
Окончание табл. 8
| 1 | 2 | 3 |
| Клинический эффект* ПР (регрессия на 100%) ЧР (регрессия >50%) ЧР (регрессия 30-50%) CБ (регрессия < 30%) | 5 (35,7) 5 (35,7) 1 (7,1) 3 (21,5) | 2 (11,1) 9 (50) 6 (33,3) 1 (5,6) |
| Медиана наблюдения после неоадъювантной терапии и операции, мес. Безрецидивная выживаемость на момент наблюдения 1-летняя выживаемость, % 2-летняя выживаемость, % | 22,0 92,9 35,7 | 28,4 83,3 38,9 |
* – по данным маммографии и УЗИ
При медиане времени наблюдения 25,7 мес. для всех больных, получивших неадъювантную химиотерапию + Трастузумаб, медиана безрецидивной выживаемости не достигнута.
На момент анализа прогрессирование болезни отмечено у 9 из 36 больных с неполной морфологической регрессией опухоли и у 1 из 14 больных с полной морфологической регрессией опухоли. Данный факт свидетельствует о предсказательной значимости достижения полной морфологической регрессии в отношении безрецидивной выживаемости.
Безопасность применения неоадъювантных режимов химиотерапии
без антрациклинов в комбинации с Трастузумабом
При анализе токсичности схемы Паклитаксел + Винорельбин + Трастузумаб 2-недельный режим оказался весьма неприемлемым по переносимости, ввиду не только частой, но и продолжительной нейтропении III-IV степени, явившейся причиной увеличения интервалов между циклами лечения и коррекции доз препаратов. При 3-недельном режиме все больные завершили лечение без редукции доз препаратов и практически без изменения интервалов между циклами химиотерапии. Нейтропения III-IV степени наблюдалась в 59,4% циклов.
При проведении неоадъювантной терапии в режиме: Доцетаксел 75 мг/м2 + Карбоплатин AUC 5 + Трастузумаб нейтропения III-IV степени длитель-
ностью 4-6 дней отмечена в 67,7% циклов (фебрильная нейтропения — в 12,9%). Должные интервалы между циклами удавалось сохранять. У 4 из 18 больных по причине фебрильной нейтропении с инфекционными осложнения-
ми выполнена редукция дозы Карбоплатина (до AUC4), что, тем не менее, не повлияло на клиническую и морфологическую эффективность лечения.
При комбинации Трастузумаба со всеми изученными режимами химиотерапии не отмечено развития не только клинически значимой кардиотоксичности, но и снижения ФВЛЖ > 20 ед (табл. 9).
Таблица 9
Характеристика токсичности III-IV степени различных режимов неоадъювантной химиотерапии в сочетании с Трастузумабом
| Токсичность, степень | П 100 мг/м2 + В (56 циклов) (%циклов) | П 135 мг/м2 + В (32 цикла) (%циклов) | Д 50 мг/м2 + К (25 циклов) (%циклов) | Д 75 мг/м2 + К (93 цикла) (%циклов) |
| Нейтропения III IV | 58,9 14,3 | 34,4 25 | 0 0 | 41,9 25,8 |
| Фебрильная нейтропения | 0 | 0 | 0 | 12,9 |
| Повышение трансаминаз (АЛТ, АСТ) III IV | 0 0 | 0 0 | 0 0 | 1,1 1,1 |
| Миалгия III | 0 | 0 | 0 | 1,1 |
| Астения III | 1,8 | 0 | 0 | 4,3 |
| снижение ФВЛЖ < 10 ед. 10-19 ед. > 20 ед. | 3 1 0 | 2 0 0 | 1 0 0 | 3 1 0 |
П — Паклитаксел; В — Винорельбин; Д — Доцетаксел; К – Карбоплатин
Резюме:
- режим неоадъювантной терапии Доцетаксел + Карбоплатин (AUC 5) + Трастузумаб является достаточно хорошо переносимым и высокоэффективным, позволяющим достичь высокой частоты полных морфологических регрессий опухоли при дозе Доцетаксела 75 мг/м2.
- режим неоадъювантной терапии Паклитаксел 100-135 мг/м2 + Винорельбин 25 мг/м2 каждые 2-3 недели + Трастузумаб является эффективным, но для достижения более высокой частоты полных морфологических регрессий опухоли при умеренной токсичности перспективно использование г-КСФ.
Результаты лечения больных местно-распространенным HER-2(+) раком молочной железы в зависимости от экспрессии в опухоли молекулярно-биологических маркеров
У 23 больных местно-распространенным HER-2(+) РМЖ была изучена экспрессия 9 молекулярно-биологических маркеров: Ki67, Bcl-2, EGFR, VEGF, MUC4, pAkt, PTEN, Topo2a и S100A4 при выполнении иммуногисто-
химического анализа образцов опухолевой ткани молочной железы, полученной до начала неоадъювантной химиотерапии + Трастузумаб.
Данные по частоте экспрессии маркеров у больных местно-распространенным HER-2(+) РМЖ приведены в таблице 10.
Таблица 10
Частота экспрессии молекулярно-биологических маркеров в ткани опухоли, полученной до начала неоадъювантной терапии
| Маркер | Общее число больных | Частота экспрессии маркера | ||
| высокая (+) n (%) | умеренная (+/-) n (%) | низкая/отсутствие (-) n (%) | ||
| Ki-67 | 23 | 12 (52,2) | 4 (17,4) | 7 (30,4) |
| Bcl-2 | 23 | 10 (43,5) | 0 | 13 (56,5) |
| PTEN | 23 | 7 (30,4) | 8 (34,8) | 8 (34,8) |
| VEGF | 23 | 9 (39,2) | 7 (30,4) | 7 (30,4) |
| MUC4 | 23 | 8 (34,8) | 6 (26,1) | 9 (39,1) |
| pAkt | 23 | 15 (65,2) | 1 (4,4) | 7 (30,4) |
| Topo2a | 23 | 15 (65,2) | 5 (21,8) | 3 (13,0) |
| EGFR | 23 | 6 (26,1) | 0 | 17 (73,9) |
| S100A4 | 23 | 13 (56,5) | 0 | 10 (43,5) |
При анализе частоты экспрессии маркеров обращает на себя внимание:
- высокий пролиферативный индекс – в 52,2% случаев Ki67 > 40%;
- высокая частота гиперэкспрессии в клетках опухоли факторов неблагоприятного течения болезни Topo2a (в 65,2%), pAkt (в 65,2%), индуктора метастазирования опухоли S100A4 (в 56,5%);
- у большинства (73,9%) больных уровень EGFR опухоли был нормальным.
Соотношение морфологического эффекта и экспрессии различных молекулярно-биологических маркеров представлено в таблице 11.
Таблица 11
Частота экспрессии маркеров в опухоли до начала неоадъювантной
терапии, в группах с различным морфологическим эффектом
| Уровень экспрессии маркеров | Полный морфологический эффект (класс 1 + класс 2) (n=11) | Неполный морфологический эффект (класс 3) (n=10) |
| 1 | 2 | 3 |
| Ki67 низкая умеренная высокая | 2 (18,2%) 3 (27,3%) 6 (54,5%) | 4 (40%) 1 (10%) 5 (50%) |
| Bcl-2 отсутствие/низкая умеренная высокая | 6 (54,5%) 0 5 (45,5%) | 7 (70%) 0 3 (30%) |
| EGFR отсутствие/низкая умеренная высокая | 8 (72,7%) 0 3 (27,3%) | 7 (70%) 0 3 (30%) |
| VEGF отсутствие/низкая умеренная высокая | 3 (27,3%) 2 (18,2%) 6 (54,5%) | 3 (30%) 4 (40%) 3 (30%) |
| MUC4 отсутствие/низкая умеренная высокая | 4 (36,4%) 3 (27,2%) 4 (36,4%) | 4 (40%) 2 (20%) 4 (40%) |
Окончание табл. 11
| 1 | 2 | 3 |
| pAkt отсутствие/низкая умеренная высокая | 1 (9,1%) 2 (18,2%) 8 (72,7%) | 3 (30%) 1 (10%) 6 (60%) |
| PTEN отсутствие/низкая умеренная высокая | 3 (27,3%) 5 (45,4%) 3 (27,3%) | 5 (50%) 2 (20%) 3 (30%) |
| Topo2a отсутствие/низкая умеренная высокая | 2 (18,2%) 2 (18,2%) 7 (63,6%) | 1 (10%) 3 (30%) 6 (60%) |
| S100A4 отсутствие/низкая умеренная высокая | 3 (27,3%) 2 (18,2%) 6 (54,5%) | 3 (30%) 1 (10%) 6 (60%) |
Статистически значимой предсказательной взаимосвязи между экспрессией молекулярно-биологических маркеров и морфологическим эффектом после неоадъювантной терапии получено не было. Равно как, не отмечено какой-либо значимой взаимосвязи между экспрессией маркеров и другими клинико-морфологическими особенностями опухоли и больных.
Вместе с тем, при медиане наблюдения 31,2 мес. выявлена тенденция к увеличению безрецидивной выживаемости больных с низкой и умеренно выраженной экспрессией MUC4 (медиана не достигнута; средняя – 31,3 мес; 95% ДИ 28,5-34,1) по сравнению с больными с высокой экспрессией MUC4 в опухоли (медиана не достигнута; средняя – 22,3 мес; 95% ДИ 16,3-28,3) p=0,058. В группе с низкой и умеренно выраженной экспрессией Topo2a отмечена тенденция к лучшей безрецидивной выживаемости по сравнению с группой больных с высокой экспрессией Topo2а (p=0,048); медианы и средние величины не рассчитываются, поскольку все наблюдения в группе Topo2a(-) являются цензурированными (без случаев прогрессирования).
ВЫВОДЫ
- Комбинация Трастузумаба с таксанами в I линии лечения больных метастатическим РМЖ с гиперэкспрессией HER-2 позволяет добиться высокого непосредственного эффекта (67,6%), длительного времени до прогрессирования (19,1 мес.) и высокого процента 1-летней (97,3%) и
2-летней (67,6%) общей выживаемости. - Высокая экспрессия VEGF (интенсивное окрашивание цитоплазмы >25% клеток) коррелирует со значительным уменьшением медианы времени до прогрессирования (p=0,039).
- При времени до прогрессирования болезни < 2 лет высокий уровень Ki67 (> 40%), высокая экспрессия VEGF (окрашивание цитоплазмы > 25% опухолевых клеток) и Topo2a (> 4 баллов окрашивание опухолевых клеток) наблюдались чаще, чем у пациентов со временем до прогрессирования болезни > 2 лет: Ki67 (в 77,3% и 33,3%), VEGF (в 37,9% и 0%), и Topo2a (в 75,9% и 37,5%).
- При изучении экспрессии Bcl-2 в опухоли больных со временем до прогрессирования болезни > 1 года частота высокой экспрессии Bcl-2 (окрашивание цитоплазмы > 50% клеток) составила 66,7%, при времени до прогрессирования болезни < 1 года высокая экспрессия Bcl-2 не отмечена (p=0,0001; r,rs=0,59).
- Высокая и умеренно высокая экспрессия Bcl-2 (окрашивание цитоплазмы > 1% клеток) в опухоли является маркером длительного эффекта (ПР + ЧР), достигнутого при химиотерапии таксанами в комбинации Трастузумабом у больных метастатическим HER-2(+) рака молочной железы.
- При неоадъювантной терапии местно-распространенного HER-2(+) рака молочной железы IIIA-IIIC стадии доказана высокая эффективность комбинации режимов химиотерапии без антрациклинов. Наиболее эффективен режим лечения Доцетаксел 75 мг/м2 + Карбоплатин AUC 5 + Трастузумаб. По клиническим данным, частота ПР + ЧР составила 83,3%. Частота полной морфологической регрессии опухоли достигнута в 58,8% случаев. Побочные эффекты были умеренные.
- У больных местно-распространенным HER-2(+) раком молочной железы высокая экспрессия MUC4 и Topo2a коррелирует с укорочением безрецидивного периода после неоадъювантной химиотерапии + Трастузумаб + операция (p < 0,05 для каждого маркера).
 СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Зейналова К.Р. Герцептин при раке молочной железы с гиперэкспрессией HER-2: от настоящего к будущему / И.П. Ганьшина,
К.Р. Зейналова // Фарматека. 2008. № 18. С. 8-12.
2. Зейналова К.Р. Трастузумаб в комбинации с Доцетакселом и Карбоплатином в неоадьювантной терапии местнораспространенного рака молочной железы с гиперэкспрессией НЕR-2 (клинико-морфологическое исследование) / К.Р. Зейналова, Я.В. Вишневская, И.П. Ганьшина // Российский биотерапевтический журнал. 2009. № 3. С. 103-106.
3. Зейналова К.Р. Метастазы рака молочной железы с гиперэкспрессией Her2 в головной мозг / Е.В. Лубенникова, К.Р. Зейналова, И.П. Ганьшина // Российская Научно-практическая конференция с международным участием в Барнаул, Россия. 09 – 10 июня 2009. – С. 251.
4. Zeynalova K. High pathological complete response rate of neo-adjuvant combination of Docetaxel, Сarboplatin and Trastuzumab in patients with HER2 – overexpressing Breast Cancer: Preliminary Results / M. Lichinitser, K.Zeynalova, I.Ganshina, Y. Vyshnevskaya // EBCC-7, Barсelona, Spain. 2427 Marсh. 2010. – Poster № 120
5. Зейналова К.Р. Достижение полной морфологической регрессии при применении Трастузумаба у больных неоперабельным местно-распространенным HER-2(+) раком молочной железы / К.Р. Зейналова, Я.В.Вишневская, И.П. Ганьшина // Опухоли женской репродуктивной системы. – 2011. – №1.- С. 56-62.
6. Зейналова К.Р. Молекулярно-биологическая характеристика метастатического рака молочной железы с гиперэкспрессией HER-2 / К.Р. Зейналова, Е.В. Степанова // Российский биотерапевтический журнал. 2011. № 2. С. 61-66.

