Механизмы гибели клеток при действии новых производных нафтоиндолдионов
На правах рукописи
Глазунова Валерия Александровна
МЕХАНИЗМЫ ГИБЕЛИ КЛЕТОК ПРИ ДЕЙСТВИИ
НОВЫХ ПРОИЗВОДНЫХ НАФТОИНДОЛДИОНОВ
14.00.14 - онкология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва
2009
Работа выполнена в Учреждении Российской академии медицинских наук
Российском онкологическом научном центре
имени Н. Н. Блохина РАМН, Москва
Научный руководитель
доктор медицинских наук А. А. Штиль
Официальные оппоненты:
доктор биологических наук, профессор Богуш Т. А.
доктор биологических наук, профессор Горбачева Л. Б.
Ведущее учреждение: Московская медицинская академия имени И.М.Сеченова.
Защита диссертации состоится 24 декабря 2009 г. на заседании Диссертационного ученого совета Д.001.017.01
РОНЦ им. Н.Н.Блохина РАМН по адресу:
115478, Москва, Каширское шоссе, 24.
С диссертацией можно ознакомиться в библиотеке
РОНЦ им. Н.Н.Блохина РАМН.
Автореферат разослан ____ _________ 2009 г.
Ученый секретарь специализированного Ученого Совета
доктор медицинских наук
профессор Ю.В. Шишкин
Общая характеристика работы
Актуальность проблемы
Антрациклиновые антибиотики, их синтетические производные и аналоги принадлежат к числу ведущих классов современных противоопухолевых препаратов. Адриамицин (доксорубицин), рубомицин, даунорубицин и др. широко применяются в химиотерапии опухолевых заболеваний. Однако антрациклины имеют ряд недостатков – высокая кумулятивная токсичность, мутагенность, кардиотоксичность, миело- и иммунодепрессивное действие. Химические модификации антрациклиновых антибиотиков, направленные на создание препаратов с улучшенными терапевтическими свойствами - актуальная задача ряда научных дисциплин, в частности, биоорганической химии и молекулярной онкологии.
Особенно важным требованием к новым производным антрациклинов является способность преодолевать множественную лекарственную устойчивость (МЛУ) опухолевых клеток. Молекулярные транспортеры, например, Р-гликопротеин, способны уменьшать концентрацию антрациклинов и их производных в опухолевых клетках и снижать терапевтический эффект. К началу настоящего исследования были созданы препараты нового поколения – производные нафто-[2,3-f]индол-5,10-диона с повышенной цитотоксичностью для клеток с МЛУ (Shchekotikhin et al., 2006). Следовательно, дальнейшая оптимизация соединений этого химического класса перспективна. Однако транспорт из клеток – не единственный механизм ограничения цитотоксичности химических соединений. Взаимодействие с внутриклеточными мишенями обусловливает многообразие путей реализации гибели клеток при действии производных нафтоиндолдионов. Эти соединения способны интеркалировать в ДНК и нарушать структуру дуплекса, следствием чего являются нарушения репликации, транскрипции, ингибирование топоизомераз I и II. Поэтому механизмы гибели клеток при действии нафтоиндолдионов обусловлены повреждениями ДНК.
Важнейший сенсор повреждений ДНК - белок р53. Активация его многочисленных функций в ответ на повреждение ДНК приводит к нарушениям клеточного цикла и программированной гибели (апоптозу) клеток. Делеции и мутации р53 – наиболее часто встречающиеся генетические нарушения в злокачественных опухолях. Дисфункция р53, приводящая к инактивации или ограничению р53-зависимого апоптоза, может обусловить недостаточную выраженность цитотоксического сигналинга, запускаемого противоопухолевым препаратом, позволяя клетке пережить воздействие. Требуется идентификация внутриклеточной мишени новых производных нафтоиндолдионов и выяснение механизмов гибели - регулируемых р53 и независимых от этого фактора - в ответ на действие новых соединений. Таким механизмом может быть митохондриальный путь апоптоза: инактивация анти-апоптотических генов семейства Bcl-2, гиперэкспрессия PUMA, NOXA и др.
Таким образом, актуальность проблемы обусловлена необходимостью углубления знаний о молекулярных механизмах цитотоксичности новых химических соединений – производных нафтоиндолдионов как представителей класса, перспективного для создания новых эффективных противоопухолевых препаратов.
Цель исследования – установить механизмы гибели опухолевых клеток человека при действии новых производных нафтоиндолдионов.
Задачи:
1) из химической библиотеки новых производных нафтоиндолдионов отобрать соединения, токсичные для клеток с экспрессией Р-гликопротеина и нефункционирующим р53, и определить диапазон концентраций, в которых делеция р53 приводит к выживанию клеток;
2) исследовать взаимодействие наиболее активного соединения с возможной внутриклеточной мишенью – ДНК: тип связывания, константа равновесия комплексообразованиия;
3) изучить основные механизмы гибели клеток при действии отобранного нового производного нафтоиндолдионов.
Положения, выносимые на защиту:
- Делеция р53 обеспечивает выживание опухолевых клеток в ответ на действие новых производных нафтоиндолдионов.
- Новые производные нафтоиндолдионов вызывают апоптоз с участием митохондриальных механизмов.
Научная новизна
- впервые исследованы новые оригинальные производные нафтоиндолдионов, вызывающие гибель опухолевых клеток, в том числе клеток с молекулярными детерминантами лекарственной устойчивости – Р-гликопротеином и нефункционирующим р53;
- впервые идентифицирована внутриклеточная мишень наиболее активного нового соединения - 3-аминометил-производного 4,11-дигидроксинафто[2,3-f]индол-5,10-диона, отобранного по данным скрининга химической мини-библиотеки;
- впервые установлены отдельные механизмы передачи внутриклеточных сигналов, регулирующих выживание и гибель клеток при действии 3-аминометил-производного 4,11-дигидроксинафто[2,3-f]индол-5,10-диона;
- исследована роль р53 и отдельных механизмов митохондриального пути гибели в цитотоксичности избранного соединения.
Научно-практическая значимость исследования
Изучение механизмов цитотоксического действия новых производных нафтоиндолдионов с оптимизированными свойствами позволит обосновать использование этого класса противоопухолевых препаратов для лечения онкологических заболеваний.
Апробация работы
Диссертация обсуждена 3 июня 2009 г. на совместной конференции лабораторий механизмов гибели опухолевых клеток, молекулярной эндокринологии, регуляции клеточных и вирусных онкогенов, механизмов регуляции иммунитета, биохимии опухолей, канцерогенных веществ, вирусного канцерогенеза, механизмов прогрессии эпителиальных опухолей, биохимической фармакологии, медицинской химии, лаборатории электронной микроскопии отдела патологической анатомии опухолей РОНЦ им. Н.Н.Блохина РАМН.
Публикации
По материалам диссертации опубликованы 4 журнальных статьи и тезисы 7 конференций.
Структура и объем диссертации
Диссертация изложена на ….страницах машинописи и состоит из введения, глав “Обзор литературы”, “Материалы и методы исследования”, “Результаты исследования”, заключения и выводов. Работа содержит … рисунков и … таблиц. Библиографический материал включает ссылки на … источников литературы.
Материалы и методы исследования
Линии клеток, культивирование и исследуемые соединения
В экспериментах использованы линии клеток человека: К562 (лейкоз) и сублиния K562i/S9 с конститутивной экспрессией Р-гликопротеина (предоставлены I.Roninson, Университет штата Иллинойс, Чикаго, США), HCT116 (рак толстой кишки), HCT116 p53KO (сублиния с делецией обеих аллелей гена p53; получена B.Vogelstein в Johns Hopkins University и предоставлена Б.П.Копниным, РОНЦ им.Н.Н.Блохина РАМН) и HCT116WafСonALacZ (сублиния с стабильной экспрессией конструкции, несущей химерный р53-зависимый промотор и ген-репортер бета-галактозидазу; получена и предоставлена П.М.Чумаковым, Институт молекулярной биологии им.В.А.Энгельгардта РАН). Клетки культивировали в модифицированной Дальбекко среде Игла с добавлением 5% эмбриональной телячьей сыворотки, 2 мМ L-глутамина, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина при 370С, 5% СО2. В экспериментах использовали культуры в логарифмической фазе роста. Новые производные нафтоиндолдионов синтезированы в лаборатории химической трансформации антибиотиков (серия ЛХТА) НИИ по изысканию новых антибиотиков им. Г.Ф.Гаузе РАМН. Cоединения растворяли в диметилсульфоксиде. N-ацетилцистеин растворяли в воде непосредственно перед экспериментами. Использовали реактивы фирмы Sigma кроме специально оговоренных случаев.
Исследование выживания клеток
Для изучения цитотоксичности новых соединений использован метод оценки жизнеспособности клеток по восстановлению дегидрогеназами 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромида (МТТ) в формазан. Клетки рассевали в 96-луночные планшеты (104 в 190 мкл среды). Через 16 часов в лунки вносили исследуемые соединения, растворенные немедленно перед внесением. Каждую концентрацию соединений изучали в 2-3 повторностях. Культуры инкубировали при 370С, 5% СО2 72 часа, затем добавляли 50 мкг МТТ и инкубировали 2 часа и растворяли формазан в диметилсульфоксиде. Оптическую плотность раствора формазана определяли спектрофотометрически при длине волны возбуждения 540 нм. Оптическую плотность в контрольных (без нафтоиндолдионов) лунках принимали за 100%. Показатели оптической плотности в лунках с каждой концентрацией испытуемых препаратов усредняли и вычисляли процент выживших клеток при той или иной концентрации. Цитотоксичность новых соединений выражали как концентрацию, вызывавшую гибель 50% клеток (IC50).
Для изучения долговременного выживания в присутствии соединений серии ЛХТА клетки линий HCT116 и HCT116p53KO рассеивали в 6-луночные планшеты, вносили соединения в увеличивающихся концентрациях или оставляли необработанными (контроль). Инкубировали при 370С, 5% СО2 72 часа, затем сменили культуральную среду на свежую (без препарата). Культуры наблюдали 11 суток, отмечая восстановление логарифмического роста или гибель. В первые 5 суток после удаления препарата проводили ежедневный подсчет выживших клеток методом исключения трипанового синего.
Внутриклеточное накопление производных нафтоиндолдионов
Клетки НСТ116 и НСТ116р53КО обрабатывали ЛХТА-1116 1-24 час., снимали с подложки и измеряли флуоресценцию клеток на проточном цитофлуориметре FACSCalibur™ (Becton Dickinson, США) (5000-10000 событий для каждого образца).
Расчет константы связывания производных нафтоиндолдионов с ДНК
Константу связывания с ДНК определяли по Скэтчарду как изменение интенсивности флуоресценции ЛХТА-1116 при добавлении ДНК: /[ДНК] = 1/Ka-/Ka; [ДНК]своб.=[ДНК]t-[ДНК]b=[ДНК]t-[вещество]t*(I-Io)/(Imax-Io); [вещество]своб =[вещество]t*(Imax-I)/(Imax-Io); [вещество]связ.=[вещество]t*(I-Io)/(Imax-Io); =[ вещество] связ./[вещество]t=[ДНК]связ./[вещество]t. В данных уравнениях Ka – константа связывания, Io, Imax, I – значения интенсивности флуоресценции, минимальной, максимальной и текущей соответственно, [вещество] и [DNA] – концентрации исследуемого соединения и ДНК, индексы связ. и своб. - концентрации соединения, связанного с ДНК и свободного.
Активность репортера бета-галактозидазы
Экспрессия гена бета-галактозидазы в векторе, интегрированном в репортерной сублинии HCT116WafConALacZ, регулируется областью, содержащей минимальный промотор цитомегаловируса и р53-респонсивный элемент (Sablina et al., 1998). Клетки HCT116WafConALacZ обрабатывали ЛХТА-1116 или оставляли необработанными (контроль), лизировали в буфере, содержащем субстрат бета-галактозидазы – О-нитрофенил-бета-D-галактопиранозид и инкубировали 20 мин. при 370С. Измеряли оптическую плотность при 414 нм и 690 нм. Разность измерений нормировали на общее количество белка в образцах.
Исследование клеточного цикла
К клеткам линии НСТ116 добавляли ЛХТА-1116 или оставляли необработанными (контроль). После окончания инкубации клетки лизировали в буфере, содержащем 0,1% цитрата Na, 0,3% NP-40, 100 мкг/мл РНКазы A и 50 мкг/мл пропидия иодида. Флуоресценцию исследовали на проточном цитофлуориметре.
Определение экспрессии генов методом обратной транскрипции и полимеразной цепной реакции (ПЦР)
Клетки помещали в 6-луночные планшеты (105 клеток в 3 мл среды на лунку) и добавляли ЛХТА-1116, как описано в разделе “Результаты исследования”. После окончания инкубации клетки лизировали реагентом TRIzol (Invitrogen, CША). Тотальную РНК выделяли фенол-хлороформной экстракцией. Обратную транскрипцию и ПЦР проводили, используя реактивы Fermentas (Литва). К образцу тотальной РНК добавляли 50 нг “случайных” (random) гексамеров и 10 мкМ смеси 4-х дезоксинуклеотидтрифосфатов, инкубировали 10 мин. при 650С, затем вносили в пробу ингредиенты до следующих конечных концентраций: 1хбуфер для обратной транскрипции, 5 мM MgCl2, 10 мM дитиотрейтола, 5 ЕД обратной транскриптазы. Пробы инкубировали 10 мин. при комнатной температуре, затем 50 мин. при 420С и 15 мин. при 700С. Полученную кДНК растворяли в воде и хранили при -200С.
ПЦР проводили следующим образом: на 25 мкл (общий объем пробы) вносили: 3 мкл водного раствора кДНК, 2,5 мкл 10х буфера для ПЦР, 0,2 мM смеси четырех дезоксинуклеотидтрифосфатов, 1,5 мM MgCl2, 1 ЕД Taq-полимеразы. Для амплификации использовали следующие праймеры:
| Ген | Последовательность праймеров | Кол-во циклов |
| SLUG | 5’-GCC TCC AAA AAG CCA AAC TA-3’ 5’-CAC AGT GAT GGG GCT GAT G -3’ | 35 |
| Snail | 5’-CCC AAT CGG AAG CCT AAC TAC AG-3’ 5’-CAG GTG GGC CTG GCT GTA -3’ | 35 |
| NOXA | 5’-GTG CCC TTG GAA ACG GAA GA-3’ 5’-CCA GCC GCC CAG TCT AAT CA-3’ | 27 |
| PUMA | 5’- CAG ACT GTG AAT CCT GTG CT-3’ 5’-ACA GTA TCT TAC AGG CTG GG-3’ | 27 |
| 2-микроглобулин | 5’-ACC CCC ACT GAA AAA GAT GA-3’ 5’-ATC TTC AAA CCT CCA TGA TG-3’ | 24 |
| -актин | 5’-GGC ATC GTG ATG GAC TCC G-3’ 5’-GCT GGA AGG TGG ACA GCG A-3’ | 24 |
Длительность и температурный режим циклов ПЦР: денатурация для 1-го цикла – 1 минута (940С), для каждого последующего – 10 сек. (940С), отжиг праймеров - 10 сек. (600С), элонгация - 30 сек. (720С). Для SLUG и SNAIL температура отжига 520С. Электрофорез продуктов ПЦР проводили в 1% агарозном геле. Продукты реакции выявляли в ультрафиолетовом свете после окрашивания гелей бромистым этидием (0,5 мкг/мл).
Электронная микроскопия
Клетки HCT116 и HCT116p53KO рассеивали в 6-луночные планшеты, вносили ЛХТА-1116 или оставляли необработанными (контроль). Клетки инкубировали при 370С, 5% СО2 24 часа, открепляли от подложки и фиксировали 1% раствором глутаральдегида. Дальнейшие стадии (проводка в спиртах, добавление 1% OsO4, дегидратация, заключение в эЭпон-812, приготовление ультратонких срезов, контрастирование ацетатом свинца) выполняли в лаборатории электронной микроскопии и гистохимии РОНЦ им.Н.Н.Блохина РАМН (Н.А.Филиппова). Препараты просматривали на электронном микроскопе JEM-1200 EX-11 (Япония).
Результаты исследования
В работе изучены 113 новых производных нафтоиндолдионов. Для решения вопроса о способности новых соединений преодолевать МЛУ, опосредованную P-гликопротеином, сравнивали цитотоксичность соединений для клеток линии К562 (дикий тип) и Р-гликопротеин-положительной сублинии K562i/S9. Экспрессия Р-гликопротеина в указанной сублинии достигнута без селекции на выживание в присутствии токсического агента. Это позволяет утверждать, что механизмом лекарственной устойчивости клеток K562i/S9 является Р-гликопротеин, а не иные факторы, возможно, сопутствующие процессу селекции. Более 70 новых соединений оказались токсичны для клеток K562i/S9 в концентрациях <10 мкМ. Эти соединения отобраны для следующего этапа исследования, в котором критерием ответа на токсическое воздействие являлся статус р53.
Cравнение выживаемости клеток НСТ116 и НСТ116р53КО в присутствии наиболее активных производных выявило четко выраженное «окно эффекта р53» в диапазоне 0,4-3,2 мкМ. Окно эффекта р53 – диапазон концентраций препарата, для которых статус р53 клеток (дикий тип или нефункционирующий белок) определял выживаемость. Из исследованных соединений выбрано для углубленного изучения 10 наиболее активных с IC50 < 2 мкМ. Затем количество исследуемых новых производных нафтоиндолдионов было сокращено до 4-х соединений из одного модификационного ряда 3-аминометил-производных 4,11-дигидроксинафто[2,3-f]индол-5,10-диона. Для всех соединений, подвергнутых скринингу, отмечена закономерность: в определенном диапазоне (“окне”) концентраций токсичность препаратов для клеток рака толстой кишки с нефункционирующим р53 (сублиния НСТ116р53КО) была достоверно ниже, чем для клеток с диким типом р53 (НСТ116).
Рис.1. Структура ЛХТА-1116.
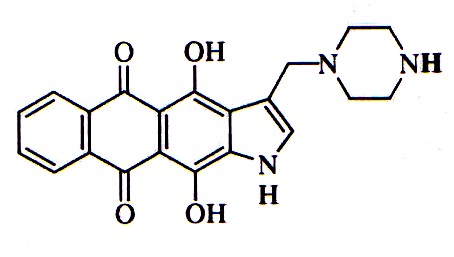
Для детального анализа механизмов гибели клеток выбрано 3-аминометилпроизводное 4,11-дигидроксинафто[2,3-f]индол-5,10-диона (ЛХТА-1116; рис.1). Этот выбор обусловлен тем, что 1) ЛХТА-1116 вызывал гибель клеток всех исследуемых клеточных линий в субмикромолярных концентрациях, 2) соединение стабильно при длительном хранении, что позволило получать высоко воспроизводимые результаты, 3) испытания на перевивных опухолях лабораторных мышей показали перспективность ЛХТА-1116 как одного из наиболее эффективных и, предположительно, пригодных для внедрения в практику соединений из серии новых нафтоиндолдионов.
На следующем этапе исследования предстояло установить, обусловливает ли инактивация р53 не просто отсроченную гибель, а позволяет клеткам пережить токсическое воздействие и восстановить рост популяции. Для этого изучили долговременную выживаемость клеток с диким типом р53 (НСТ116) и сублинии с нефункционирующим р53 (НСТ116р53КО) (рис. 2, 3).

Рис.2. Выживаемость клеток НСТ116 после 24-часовой инкубации с ЛХТА-1116.

Рис. 3. Выживаемость клеток НСТ116р53КО после 24-часовой инкубации с ЛХТА-1116.
Оказалось, что клетки НСТ116, инкубированные 24 часа с 0,4-1,6 мкМ ЛХТА-1116, погибли уже после 5 сут. инкубации в среде без соединения, тогда как клетки НСТ116р53КО пережили воздействие, и к 11-м суткам отмечен логарифмический рост популяции этих клеток.
Таким образом, мы установили, что инактивация р53 обусловливает не просто отсроченную гибель, а позволяет клеткам пережить однократное токсическое воздействие и восстановить пролиферативный потенциал. Следовательно, р53 принадлежит существенная роль в регуляции баланса “выживание-гибель” при действии ЛХТА-1116.

Не исключено, что повышение выживаемости клеток НСТ116р53КО в присутствии ЛХТА-1116 может быть связано с уменьшением внутриклеточного накопления этого соединения. Однако достоверных различий накопления ЛХТА-1116 в этих клетках и в линии НСТ116 не установлено. Максимум накопления препарата в клетках обеих линий приходился на 1,5 часа после внесения препарата, затем несколько снижался и стабилизировался по крайней мере до 16 часов инкубации (рис. 4).
Рис. 4. Внутриклеточное накопление ЛХТА-1116.
При измерении флуоресценции и поглощения света ЛХТА-1116 в комплексе с двухцепочечной ДНК установлено, что данное соединение является интеркалятором. Константа равновесия комплексообразования и плотность посадки молекул ЛХТА-1116 на дуплекс зависят от концентрации лиганда. Для относительно малых концентраций ЛХТА-1116 по отношению к концентрации ДНК константа равновесия комплексообразования составила 1х106 М-1, одна молекула связанного препарата приходится на 48 пар нуклеотидов. При увеличении концентрации ЛХТА-1116 константа равновесия комплексообразования увеличилась до 7,7х107 М-1, одна молекула связанного препарата приходится на 11 пар нуклеотидов.
Таким образом, ЛХТА-1116 – ДНК-интеркалатор и, следовательно, вызывает повреждение ДНК. Сенсор повреждений ДНК – транскрипционный фактор р53. Для изучения трансактивации гена-репортера бета-галактозидазы клетки НСТ116WafConALacZ инкубировали с ЛХТА-1116. Соединение вызывало активацию репортера в концентрациях 3,2 мкМ и 6,4 мкМ (рис. 5).

.
Рис. 5. Р53-зависимая активация гена-репортера в клетках НСТ116WafСonALacZ при действии ЛХТА-1116.
Таким образом, в цитотоксических концен-трациях ЛХТА-1116 активирует р53-зависимую транскрипцию гена-репортера. Это позволяет утверждать, что роль р53 в гибели клеток, вызываемой новыми производными нафтоиндолдионов, связана с регуляцией генной транскрипции. Возникает вопрос о том, какие именно гены активируются посредством р53 в ответ на действие ЛХТА-1116. Ответ на это вопрос может быть получен после выяснения типа гибели клеток.
Чтобы определить, является ли гибель клеток при действии ЛХТА-1116 апоптотической, использованы два экспериментальных подхода. Во-первых, исследована целостность ДНК под действием ЛХТА-1116. Анализ плоидности при действии 1,6-6,4 мкМ ЛХТА-1116 на клетки НСТ116 выявил нарушение целостности (деградацию) ДНК. Так, при действии 6,4 мкМ ЛХТА-1116 24 часа ~ 50% ядер обнаружены в суб-G1 области, что свидетельствует о фрагментации ДНК – признаке апоптоза (рис. 6).

Рис. 6. Распределение фаз цикла клеток НСТ116 при действии ЛХТА-1116 (6,4 мкМ, 24 часа).
а, контроль; б, ЛХТА-1116.
Во-вторых, при действии 1,6 мкМ ЛХТА-1116 24 часа обнаружены клетки с фрагментацией ядра, характерной для апоптоза. При действии 6,4 мкМ ЛХТА-1116 нами выявлены ультра-структурные признаки некроза (рис. 7). В обоих случаях обнаружены вакуоли лизосомального типа, возможно, содержащие ЛХТА-1116.



А Б В
Рис. 7. Ультраструктурные нарушения при действии ЛХТА-1116.
А, интактные клетки, Б, клетки через 24 часа после добавления 1,6 мкМ ЛХТА-1116 (стрелками показана фрагментация ядер и вакуоли), В, клетки через 24 часа после добавления 6,4 мкМ ЛХТА-1116 (некроз как исход апоптоза).
На основе приведенных данных можно утверждать, что апоптоз – ведущий механизм гибели клеток при действии ЛХТА-1116.
Изучение сочетанного действия ЛХТА-1116 с другими соединениями показало, что комбинация ЛХТА-1116 с ингибитором поли(АДФ-рибозо)полимеразы ЕВ-47 и пан-каспазным ингибитором z-VAD-FMC не вызвала изменений выживания клеток. Эти результаты указывают, что гибель клеток при действии ЛХТА-116 не связана с активацией каспазозависимых сигнальных каскадов. Напротив, комбинация ЛХТА-1116 с антиоксидантом N-ацетил-L-цистеином потенцировала гибель клеток. Этот эффект проявляется независимо от статуса р53.
Мы предположили участие митохондриального пути гибели клеток в ответ на действие ЛХТА-1116. Первоначально кандидатами выбраны PUMA и NOXA – гены проапоптотических белков семейства Bcl-2, для которых р53 является важнейшим транскрипционным регулятором (Yu and Zhang, 2008). Индукцию этих генов, а также генов p53 и р21 анализировали при действии 1,6 мкМ ЛХТА-1116. В качестве внутреннего контроля ПЦР использовали кДНК актина и 2-микроглобулина. Существенных отличий в уровнях мРНК указанных генов в клетках с р53 дикого типа и нокаутом р53 не было. Следующим объектом исследования стали гены SLUG и SNAIL, играющие важную роль в апоптотических каскадах, инициируемых повреждением ДНК (Wu и соавт., 2005). Мы установили, что в клетках с р53 дикого типа мРНК SLUG практически отсутствует. Напротив, активация SLUG выражена в клетках с инактивированным р53 в ответ на ЛХТА-1116 через 1-12 час. после внесения
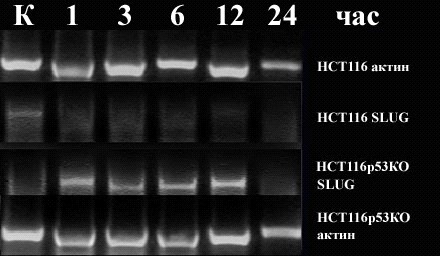
препарата (рис. 8).
Рис. 8. Экспрессия SLUG при действии 1,6 мкМ ЛХТА-1116.
Таким образом, наиболее вероятным механизмом защиты клеток с нефункционирующим р53 от апоптоза, индуцируемого новым производным нафтоиндолдионов ЛХТА-1116, является продукт анти-апоптотического гена SLUG, играющий важную роль как в нормальном онтогенезе, так и в опухолевой трансформации. В клетках с интактным р53 экспрессия SLUG, вероятно, репрессирована посредством р53, тем самым отменяя ограничивающее действие белка SLUG на проапоптотические гены (например, PUMA и BAX). В этих условиях митохондриальный путь апоптоза, индуцированный повреждением ДНК, функционирует. В клетках же с нефункционирующим р53 в ответ на повреждение ДНК, помимо р53-независимых путей гибели, активируется (дерепрессируется) ген SLUG, продукт которого способен блокировать митохондриальный апоптоз, обусловливая долговременное выживание опухолевых клеток.
Результаты исследования позволяют утверждать, что новые производные нафтоиндолдионов перспективны для дальнейших предклинических испытаний. Выявление молекулярных механизмов гибели опухолевых клеток при действии наиболее активных соединений этого химического класса важно как практически ориентированное фундаментальное исследование в молекулярной и клеточной онкологии.
Выводы
1. Среди производных нафтоиндолдионов выявлены соединения, вызывающие гибель культивируемых опухолевых клеток человека, в том числе клеток с молекулярными детерминантами лекарственной устойчивости - экспрессией Р-гликопротеина и нефункционирующим р53.
2. Одной из внутриклеточных мишеней, важных для цитотоксичности 3-аминометил-производного 4,11-дигидроксинафто[2,3-f]индол-5,10-диона, является двухцепочечная ДНК, с которой соединение образует высокоаффинные интеркаляционные комплексы. Константа равновесия комплексообразования и количество мест связывания определяются соотношением концентраций соединения и ДНК.
3. 3-Аминометил-производное 4,11-дигидроксинафто[2,3-f]индол-5,10-диона в микромолярных концентрациях вызывает апоптоз клеток с диким типом р53. Делеция р53 обусловливает долговременное выживание клеток после воздействия субтоксических концентраций соединения; при более высоких концентрациях гибель клеток осуществляется независимо от статуса р53.
4. Молекулярный механизм ограничения апоптоза в клетках с делецией р53 связан с увеличением экспрессии гена SLUG.
5. Антиоксидант N-ацетилцистеин потенцирует гибель клеток при действии 3-аминометил-производного 4,11-дигидроксинафто[2,3-f]индол-5,10-диона независимо от статуса р53.
Автор выражает благодарность доктору химических наук А.Е.Щекотихину и профессору М.Н.Преображенской за предоставление новых производных нафтоиндолдионов.
Публикации по теме диссертации
- A.E. Shchekotikhin, L.G. Dezhenkova, O.Yu. Susova, V.A. Glazunova, A.A. Shtil, M.N. Naphtho[2,3-f]indole-5,10-dione derived analogues of tryptamine, the new type of cytotoxic topo I inhibitors. Proceedings of 3d International Symposium on Targeted Anticancer Therapies. Amsterdam, The Netherlands. 2005. P.48-49.
- A. E. Shchekotikhin, V. A. Glazunova, Y. N. Luzikov, V. N. Buyanov, O. Y. Susova, A. A. Shtil, M. N. Preobrazhenskaya. Synthesis and structure-activity relationship studies of 4,11-diaminonaphtho[2,3-f]indole-5,10-diones. Bioorganic and Medicinal Chemistry. 2006. V.14. P.5241-5251.
- V.A. Glazunova, A.A.Shtil. The role of p53 in cytotoxicity of new analogues of mitoxantrone. Problems in Oncology. 2006. V. 52. P. 11.
- A. E. Shchekotikhin, L. G. Dezhenkova, O. Y.Susova, V. A. Glazunova, Y. N. Luzikov, Y. N. Sinkevich, V. N. Buyanov, A. A. Shtil, M. N. Preobra-zhenskaya. Naphthoindole-based analogues of tryptophan and tryptamine: synthesis and cytotoxic properties. Bioorganic and Medicinal Chemistry. 2007. V.15. P. 2651-2659.
- V.A. Glazunova, A.A.Shtil. The role of p53 in cytotoxicity of new derivatives of naphthoindolediones. Materials of VIII International Conference of Young Oncologists. Kiev. 2007. P. 15.
- L.G. Dezhenkova, O.Yu. Susova, V.A. Glazunova, A.E. Shchekotikhin, A.A. Shtil, M.N. Preobrazhenskaya. Naphtoindolediones, new>
- Глазунова В.А., Штиль А.А. Митохондриальные механизмы апоптоза в ответ на повреждение ДНК. Молекулярная биология. 2008. Т. 42. № 5. C. 765-771.
- Shchekotikhin A.E., Dezhenkova L.G., Susova O.Y., Glazunova V.A., Shtil A.A., Preobrazhenskaya M.N., Huang H.-S. Novel naphthoindoledione derived topoisomerase I inhibitors potent for multidrug resistant tumor cells. Proceedings of 6th International Symposium on Targeted Anticancer Therapies. Bethesda, USA. 2008. P. 42.
- Щекотихин А.Е., Глазунова В.А., Деженкова Л.Г., Штиль А.А., Преображенская М.Н. Новые нафтоиндолдионы, вызывающие гибель опухолевых клеток с множественной лекарственной устойчивостью. Российский биотерапевтический журнал. 2008. Т.7. № 1. c. 55-56.
- Shchekotikhin A.E., Dezhenkova L.G., Susova O.Y., Glazunova V.A., Shtil A.A., Preobrazhenskaya M.N., Huang H.-S. Novel naphthoindoledione derived topoisomerase I inhibitors potent for multidrug resistant tumor cell. Annals of Oncology. 2008. V.19. P. vii 28.
- Shchekotikhin A. E., Glazunova V. A., Dezhenkova L. G., Luzikov Y. N., Sinkevich Y., Kovalenko L. V., Buyanov V. N., Balzarini J., Huang F.-C., Lin J.-J., Huang H.-S., Shtil A. A., Preobrazhenskaya M. N. Synthesis and cytotoxic properties of 4,11-bis[(aminoethyl)amino]anthra-[2,3-b]thiophene-5,10-diones, novel analogues of antitumor anthracene-9,10-diones. Bioorganic and Medicinal Chemistry. 2009. V.17. № 5. Р. 1861-1869.

