Применение лазерных технологий в лечении острого деструктивного панкреатита
На правах рукописи
Гульмурадова
Наргис Ташпулатовна
ПРИМЕНЕНИЕ ЛАЗЕРНЫХ ТЕХНОЛОГИЙ В ЛЕЧЕНИИ
ОСТРОГО ДЕСТРУКТИВНОГО ПАНКРЕАТИТА
14.01.17 – Хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва - 2011
Работа выполнена в ФГУ «Государственный научный центр лазерной медицины Федерального медико-биологического агентства» России
Научный консультант:
доктор медицинских наук, профессор А.В Гейниц
Официальные оппоненты:
доктор медицинских наук, профессор И.М Буриев
доктор медицинских наук, профессор А.Д Тимошин
доктор медицинских наук, профессор В.В Цвиркун
Ведущее учреждение ФГБУ «Институт хирургии им. А.В. Вишневского» Минздравсоцразвития России.
Защита состоится «__»_______________2011 года в ____ часов на заседании диссертационного совета Д.208.022.01 при Государственном научном центре лазерной медицины ФМБА России по адресу: 121165. г. Москва, ул. Студенческая, дом 40, строение 1.
С диссертацией можно ознакомиться в библиотеке ГНЦ лазерной медицины ФМБА России и на сайте организации: www.lasermedicine-ssc.org
Автореферат разослан «__»_____________________2011 г
Ученый секретарь
диссертационного совета,
д.м.н., профессор В.А. Дербенев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Острый деструктивный панкреатит (ОДП) является одной из наиболее сложных проблем современной абдоминальной хирургии, а актуальность разработок новых подходов к его лечению обусловлена значительным ростом заболеваемости, увеличением частоты развития осложнений и высокой летальностью (Вашетко Р.В. и соавт., 2000; Кубышкин В.А. и соавт., 2000; Савельев В.С. и соавт, 2000-2006; Толстой А.Д. и соавт., 2005; Шалимов А.А. и соавт., 2006; Cannor S. et al., 2005; Lese M. et al., 2005; Bruno M., 2010).
Медицинское и социально-экономическое значение проблемы в наши дни в России усугубляется также и значительным увеличением заболеваемости среди лиц трудоспособного возраста (Костюченко А.Л., Филин В.И., 2000; Борисов А.Е., 2007; Fan S.T.,1990; Beger H.G.et.al., 2008).
Несмотря на определенные успехи в диагностике, хирургическом лечении и профилактике осложнений, уровень летальности при ОДП, в зависимости от причины и формы заболевания, тяжести поражения поджелудочной железы, срока выполнения и объема оперативного лечения, полноценности детоксикационной терапии, сопутствующих заболеваний и возраста пациентов, варьирует от 32,2% до 75% (Нестеренко Ю.А. и соавт., 1997; Борисов А.Е. и соавт., 2000; Савельев В.С. и соавт., 2000, 2006; Гарелик Г.В. и соавт., 2007; Ciocirlan M., Ponchlon T., 2004).
Необходимо отметить, что многие современные исследователи считают, что оценка иммунного статуса позволяет раскрыть наиболее важные особенности механизмов реагирования иммунной системы на воспалительный очаг. Однако данные о проявлениях панкреатогенного иммунодефицита в литературе достаточно противоречивы. В частности, отмечено как снижение, так и повышение содержания иммуноглобулинов A, M, G, а также угнетение и чрезмерное повышение активности фагоцитов (Ермолов А.Е. и соавт., 2005). Результаты исследований относительно стимуляции иммунитета при лазерном воздействии весьма противоречивы, поскольку разные авторы используют различные виды излучения, дозы и режимы воздействия (Плетнев С.Д., 1996; Москвин С.В., Буйлин В.А., 2000). Анализ литературы, проведенный нами, убеждает в противоречивости сведений об активации ПОЛ и угнетении системы антиоксидантной защиты при остром панкреатите (Парзян Г.Р.,2000; Шуляк С.А., 2005).
Большинство авторов отмечает высокий риск и техническую сложность проведения операций в условиях воспаленных и инфильтрированных тканей, и рекомендуют при прогрессирующем ферментативном перитоните и формировании жидкостных образований осуществлять мини-инвазивные и лапароскопические хирургические вмешательства, пункции и дренирование под УЗИ/КТ контролем. Хирургическую некрсеквестрэктомию проводить в конце 2-3-й недели заболевания после устранения основных признаков эндотоксемии, отграничения и секвестрации некротизированных участков железы (Топчиашвили З.А. и соавт., 1990; Кубышкин В.А., 1996; Толстой А.Д. и соавт., 2000; Савельев В.С. и соавт., 2006; Винник Ю.С. и соавт., 2009; Brisinda G., 1999; Chang Y.C. et al., 2006; Davies J. et al., 2006; Werner J., 2011).
Однако высокая летальность, большая частота послеоперационных осложнений, технические сложности ранних некрэктомий, трудности выполнения некрсеквестрэктомии при инфицированных панкреонекрозах настоятельно требуют проведения дальнейших более углубленных исследований по разработке эффективных способов хирургического лечения. Анализ литературы демонстрирует наличие единичных работ, рассматривающих возможности применения низкоинтенсивного лазерного излучения (НИЛИ) в комплексном лечении острого деструктивного панкреатита (Гейниц А.В. и соавт., 2008; Затевахин И.И. и соавт., 2007; Шуляк С.А., 2005; Oshiro T., 1987).
До настоящего времени не раскрыты патофизиологические механизмы благотворного влияния НИЛИ на течение острого панкреатита.
Также имеются лишь единичные сообщения о применении СО2 – лазера в хирургическом лечении заболеваний поджелудочной железы (Скобелкин О.К. и соавт., 1989; Гейниц А.В. и соавт., 2011). Указанные факты свидетельствуют об актуальности и необходимости разработки новых подходов к лечению ОДП.
Цель исследования
Целью настоящего исследования является улучшение диагностики и результатов лечения больных с острым деструктивным панкреатитом на основе применения современных лазерных технологий.
Задачи исследования
- Разработать диагностический алгоритм при остром панкреатите с применением лабораторных тестов, лучевых (УЗИ, КТ, РТМ) и эндоскопических методов (ФГДС, видеолапароскопия) диагностики.
- Изучить информативность УЗИ, КТ и РТМ в диагностике острого деструктивного панкреатита и его осложнений.
- Изучить состояние и влияние НИЛИ на клеточный и гуморальные звенья иммунитета и ПОЛ при различных формах острого панкреатита.
- Оценить эффективность применения сеансов ВЛОК и антиоксидантной терапии в комплексном лечении острого отечного панкреатита.
- Оценить эффективность низкоинтенсивной лазерной и антиоксидантной терапии в комплексном лечении острого деструктивного панкреатита.
- Изучить возможности комбинированного применения высоко-энергетического лазерного излучения (СО2- и полупроводникового лазера) в хирургическом лечении постнекротических кист поджелудочной железы.
Научная новизна. Впервые изучена и патогенетически обоснована эффективность проведения сеансов внутривенного лазерного облучения крови (ВЛОК) и местного транскутанного лазерного облучения парапанкреатических зон в комплексном лечении различных форм острого панкреатита. Впервые изучена информативность компьютерной глубинной радиотермометрии в диагностике деструктивных форм панкреатита. Оценены возможности комбинированного применения высокоэнергетического лазерного излучения в хирургическом лечении постнекротических кист поджелудочной железы.
На основе проведенных исследований разработан диагностический и лечебный алгоритм при ОДП с применением современных лазерных технологий. Всесторонне изучено состояние клеточного и гуморального звеньев иммунитета и ПОЛ при различных формах ОП. Выявлено, что панкреонекроз сопровождается активацией процессов липопероксидации, угнетением системы антиоксидантной защиты, развитием тяжелой эндотоксемии, достоверным повышением количества лейкоцитов, содержания В–лимфоцитов, иммуноглобулина G, снижением количества Т–лимфоцитов и маркеров активации Т-лимфоцитов, ФАН, что указывает на наличие тяжелого вторичного иммунодефицита. Проведение сеансов НИЛИ на фоне комплексного лечения ОП способствовало восстановлению уровней лейкоцитов, ФАН, Т- и В-лимфоцитов и их субпопуляций, уменьшению степени аутоагрессии. Установлено, что применение ВЛОК и местного транскутанного лазерного облучения парапанкреатических зон, благодаря иммуномодулирующему, антиоксидантному и противовоспалительному эффектам НИЛИ, способствует ускорению купирования воспалительного процесса в ПЖ, предотвращению инфицирования очагов деструкции, сокращению сроков стационарного лечения и снижению летальности при панкреонекрозе.
Практическая значимость. Разработанный и внедренный диагностический алгоритм включающего лабораторные тесты, динамическое УЗИ, КТ и диагностическую лапароскопию, а также компьютерную глубинную радиотермометрию при ОДП позволил своевременно диагностировать осложнения и определить дальнейшую лечебную тактику.
Применение различных видов дренирующих вмешательств, видеолапароскопическое дренирование брюшной полости, дренирование перипанкреатических жидкостных образований и абсцессов под УЗ наведением, позволяет адекватно эвакуировать токсический выпот с высоким содержанием ферментов и продуктов аутолиза поджелудочной железы, тем самым предотвращая развитие септических осложнений.
Комплексное воздействие сеансов НИЛИ при ОП способствует восстановлению иммунной системы, уменьшению степени ферментной аутоагрессии, предотвращению инфицирования очагов некроза и купированию воспалительного процесса в ПЖ. Разработана и обоснована целесообразность применения СО2- и полупроводникового лазеров в хирургическом лечении постнекротических кист ПЖ, обеспечивающие надежность гемостаза профилактику развития рецидива кисты.
Разработка и внедрение методики НИЛИ в комплексном лечении осложненных форм ОДП существенно повысили эффективность и улучшили результаты лечения.
Основные положения работы, выносимые на защиту:
- Диагностическая программа при ОП с применением лабораторных тестов, динамического УЗИ, КТ, РТМ и видеолапароскопии позволяет с высокой точностью верифицировать формы заболевания, фазы течения, оценить масштабы панкреонекроза, наличие местных и системных осложнений и, тем самым, оптимизировать тактику лечения.
- Острый деструктивный панкреатит (панкреонекроз) сопровождается генерализованной активацией процессов липопероксидации, истощением системы антиоксидантной защиты, резким нарастанием эндотоксемии, повышением количества лейкоцитов, В-лимфоцитов, иммуноглобулина G, снижением количества Т-лимфоцитов и их субпопуляций, являющихся следствием тяжелого вторичного иммунодефицита.
- Комплексное воздействие НИЛИ, независимо от клинико-морфологических форм ОП, способствует нормализации количества лейкоцитов, восстановлению уровней Т- и В-лимфоцитов и их субпопуляций, уменьшению степени аутоагресии. Подобный иммуномодулирующий эффект лазерной терапии ускоряет купирование патологического процесса в ПЖ.
- Включение низкоинтенсивной лазерной терапии в сочетании с антиоксидантной терапией в схему комплексного лечения ООП способствует эффективному подавлению секреторной активности и ферментной аутоагрессии поджелудочной железы, сокращает сроки выздоровления больных.
- Комплексная терапия стерильного панкреонекроза с проведением сеансов ВЛОК и местной транскутанной лазеротерапии парапанкреатических зон, мини-инвазивных и эндоскопических вмешательств позволяет в большинстве случаев предотвратить инфицирование очагов деструкции, снизить летальность по сравнению с контрольной группой на 13,2%.
- У больных с инфицированным панкреонекрозом применение НИЛИ после хирургической санации гнойно-некротического очага оказывает иммуномодулирующее влияние на клеточное звено иммунитета. Благодаря применению мини-инвазивных вмешательств, лазерной, современной антибактериальной терапии и экстракорпоральных методов детоксикации при инфицированном панкреонекрозе удалось снизить летальность с 42,8 до 23,1%.
Апробация работы. Основные результаты работы доложены и обсуждены на XIII и XIV международных конгрессах финских лазерных ассоциаций совместно с Европейской медицинской лазерной ассоциацией (EMLA), Хельсинки, 2008, 2010 гг.; ХIХ международной научно-технической конференции: «Лазеры в науке, технике и медицине», Адлер, 2008; Всероссийской научно-практической конференции с международным участием: «Современные алгоритмы диагностики и стандарты лечения в клинической медицине», Москва, 2008; Научно-практической конференции с международным участием, посвященный 25-летию ФГУ «ГНЦ лазерной медицины ФМБА России», Москва, 8-9 июня 2011; XVIII Международном конгрессе ассоциации хирургов-гепатологов стран СНГ “Актуальные проблемы хирургической гепатологии”, посвященный памяти академика РАМН профессора В.Д. Федорова, Москва, 14-16 сентября 2011; в V съезде иммунологов России и VIII съезде аллерголов и иммунологов СНГ, г. Москва 15-18 сентября 2011.
Внедрение результатов исследования.
Разработанные методики диагностики и лечения больных с острым панкреатитом внедрены в практику отделения лазерной хирургии печени, поджелудочной железы и желчевыводящих путей ФГУ «ГНЦ ЛМ ФМБА России» и в IV хирургическом отделении ГКБ №51 г. Москвы.
Публикации
По теме диссертации опубликованы 22 научных работ.
Структура и объём диссертации
Диссертация состоит из введения, 5 глав, заключения, выводов, практических рекомендаций и указателя литературы, содержащего ссылки на 250 отечественных и 127 зарубежных источников. Текст изложен на 243 страницах компьютерного текста, иллюстрирован 30 таблицами, 4 диаграммами и 12 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования. Настоящее исследование выполнено на клинической базе ФГУ ГНЦ ЛМ ФМБА России в ГКБ №51 г. Москвы в период с октября 2007 по январь 2010 гг. и основано на результатах обследования и лечения 252 пациентов – 177 (70,2%) мужчин и 75 (29,8%) женщин, в возрасте от 16 до 89 лет с подтвержденным диагнозом: «острый панкреатит» (ОП).
В данном исследовании мы использовали клинико-морфологическую классификацию острого панкреатита и его осложнений, принятую на международном конгрессе в Атланте (Атланта, 1992), адаптированную Савельевым В.С. и соавт. (2000) согласно решению IX Всероссийского съезда хирургов. В соответствии с указанной классификацией, в настоящем исследовании больных с отечным панкреатитом со средне-легким течением заболевания было 79 (31,4%) человек; стерильным панкреонекрозом – 119 (47,2%); а инфицированным панкреонекрозом – 54 (21,4%) больных.
Для сравнительной оценки эффективности применения разработанного в ФГУ ГНЦ ЛМ ФМБА России метода лечения все больные ОП были нами разделены на 2 группы. В контрольную группу (n=128) вошли больные, которым проводили стандартную, комплексную терапию, согласно протоколам диагностики и лечения ОП, утвержденным департаментом здравоохранения г. Москвы (от 02.01.2005, №181). Базовая консервативная терапия при отечном панкреатите включала обеспечение аспирации содержимого желудка, местную гипотермию, введение аналгетиков, спазмолитиков, десенсибилизирующих, антисекреторных (сандостатин, ультоп) препаратов, а также инфузионной терапии в объёме 30 мл/кг массы тела пациента в сочетании с форсированием диуреза в течение 48-72 ч. Базисный лечебный комплекс при ОДП проводили в ОРИТ и предусматривал инфузионно-детоксикационную терапию в объёме 40-60 мл/кг массы тела и современную антибактериальную терапию (цефалоспорины III и IV поколения, карбопенемы и др.), с целью обезболивания и разрешения пареза проводили катетеризацию перидурального пространства. По показаниям применяли экстракорпоральные методы детоксикации – гемофильтрацию. Хирургические методы лечения заключались в выполнении мини-инвазивных, эндоскопических и традиционных «открытых» операций. При этом пункционное дренирование под контролем УЗИ проводили лишь при ограниченных жидкостных скоплениях, перипанкреатических псевдокистах и абсцессах, не содержащих крупных секвестров. Видеолапароскопическую санацию и дренирование брюшной полости осуществляли при разлитом ферментативном перитоните. ЭПСТ проводили при билиарном ОДП – острой блокаде камнем большого дуоденального сосочка (БДС). Холецистостомию под УЗИ контролем выполняли при картине ферментативного холангита и холецистита. Показаниями для традиционных хирургических вмешательств были неограниченный, инфицированный панкреонекроз, перипанкреатические абсцессы с крупными секвестрами, забрюшинная флегмона, панкреонекроз билиарного генеза с холедохолитиазом, механическая желтуха и аррозивное кровотечение.
Традиционная операция предусматривала проведение верхнесрединной лапаротомии, люмботомии, некрсеквестрэктомии, абдоминизации поджелудочной железы, оментобурсостомии (по показаниям – холецистэктомия, холедохо- или холецистостомия), дренирование забрюшинной клечатки и брюшной полости. Все пациенты с ОДП после разрешения пареза ЖКТ получали энтеральную нутритивную терапию (Берламин-модуляр, нутризон и др.) через зонд, введенный за связку Трейца, а также ферментативную заместительную терапию (креон, по 25 т.ед х 3 раза в сутки).
У пациентов основной группы (n=124) дополнительно применяли ВЛОК в сочетании с антиоксидантной терапией и транскутанное комбинированное облучение парапанкреатических зон с использованием современной отечественной лазерной аппаратуры: Мулат-ВЛОК, Мустанг-2000, Милта-Ф (НПО «Техника», Россия). Оперативное лечение постнекротических кист, а также лазерную вапоризацию некротизированных участков поджелудочной железы проводили СО2-лазером «Ланцет-2 и полупроводниковым лазерным аппаратом «Аткус-15».
В основной группе с первых суток госпитализации лечение больных начинали с сеансов НИЛИ-ВЛОК, полупроводниковым лазерным аппаратом «Мулат» мощностью 5 мВт, экспозицией 40 мин, общим количеством сеансов 10 на фоне антиоксидантной терапии мексидолом (5%-4,0 в/м в сут.). Наряду с ВЛОК пациентам проводили транскутанное одномоментное лазерное облучение аппаратами «Милта-Ф» и «Мустанг» (длина волны - 0,89 мВт), с излучающими импульсными головками ЛО-2 и ЛО-3, в проекции парапанкреатических зон, по разработанной нами методике.
В основной группе (n=124) отечной формой заболевания страдали 39 (31.4%), стерильным панкреонекрозом – 59 (47,6%), а инфицированным панкреонерозом – 26 (21,0%) больных.
В контрольной группе (n=128), ООП страдали 40 (31,3%), стерильным панкреонекрозом - 60 (46,9%), а инфицированным панкреонекрозом – 28 (21,8%) пациентов. Среди 173 обследованных нами больных с ОДП – жировой панкреонекроз был отмечен у 29 (16.8%) больных, геморрагический панкреонекроз у 51 (29,5%), а смешанный панкреонекроз у 93 (53,7%). Все пациенты, как в основной, так и в контрольной группах, были сопоставимы по полу и возрасту (табл.1).
Таблица 1
Распределение больных по полу и возрасту
| Возраст | Основная группа (n=124) | Контрольная группа (n=128) | Всего | |||
| Муж | Жен | Муж | Жен | Абс | % | |
| 16-20 лет | 4 | - | 4 | 1 | 9 | 3.6 |
| 21-30 лет | 14 | 3 | 15 | 4 | 36 | 14.3 |
| 31-40 лет | 21 | 6 | 22 | 7 | 56 | 22.2 |
| 41-50 лет | 23 | 7 | 22 | 8 | 60 | 23.8 |
| 51-60 лет | 15 | 5 | 13 | 5 | 38 | 15.1 |
| 61-70 лет | 9 | 5 | 8 | 7 | 29 | 11.5 |
| Старше 70 лет | 3 | 9 | 4 | 8 | 24 | 9.5 |
| абс, % | 89 (71,8%) | 35 (28,2%) | 88(68,75%) | 40 (31,25%) | 252 | 100% |
Среди обследованных подавляющее большинство (75,9%) были в трудоспособном возрасте (21-60 лет).
Ведущими этиологическими факторами развития ОП были в основном: алкоголь – 100 пациентов (39,7%), погрешность в диете – 89 больных (35,3%), а желчнокаменная болезнь – 40 пациентов (15,9%).
Удельный вес ОП, развившегося вследствие других этиологических факторов (идиопатический, послеоперационный) составил 9,1%. Клинический симптомо-комплекс при госпитализации больных при ООП складывался из характерного интенсивного болевого синдрома, тошноты, многократной рвоты и метеоризма, разрешающихся при консервативной терапии. Прогрессирование признаков динамической кишечной непроходимости, токсической энцефалопатии, гипертермии, тахикардии (более 110-120 в мин), наличие положительных перитонеальных симптомов, дыхательной, печеночной недостаточности и механической желтухи свидетельствовали о значительной деструкции поджелудочной железы и распространении процесса в перипанкреатическую клетчатку (табл.2)
Сопутствующие заболевания, отягощающие течение основного заболевания, были выявлены у 184 (73.0%) пациентов, в основном у лиц пожилого и старческого возраста. Доминирующими были заболевания сердечно-сосудистой системы (60,1%). Часто встречались заболевания ЖКТ (24%), сахарный диабет (9,4%), ожирение различной степени (6,5%). У лиц пожилого и старческого возраста, как правило, отмечалось сочетание 2-3 хронических сопутствующих заболеваний.
Таблица 2
Характеристика клинических симптомов острого панкреатита
| Клинические симптомы | ООП (n=79) | ОДП (n=173) | ||
| Абс | % | Абс | % | |
| Болевой синдром | 79 | 100 | 173 | 100 |
| Тошнота и рвота | 62 | 78,5 | 156 | 90,2 |
| Напряжение брюшной стенки | 31 | 39,2 | 149 | 86,1 |
| Динамическая кишечная непроходимость | 19 | 24,1 | 144 | 83,2 |
| Симптом Воскресенского | 55 | 69,6 | 139 | 80,3 |
| Перитонеальные симптомы | 4 | 5,1 | 109 | 63,0 |
| Парапанкреатический инфильтрат | - | - | 133 | 76,9 |
| Панкреатогенный шок | - | - | 72 | 41,6 |
| Механическая желтуха | 5 | 6,3 | 19 | 10,9 |
| Токсическая энцефалопатия | 4 | 5,1 | 71 | 41,0 |
| Тахикардия (ЧСС более 90 уд в мин) | 46 | 58,2 | 171 | 98,8 |
| Дыхательная недостаточность | 6 | 7,6 | 98 | 56,6 |
| Почечная недостаточность | 8 | 10,1 | 69 | 39,9 |
| Гипертермия | 20 | 25,4 | 157 | 90,8 |
| Реактивный плеврит | - | - | 21 | 12,1 |
В сроки до 24 часов обратились за медицинской помощью 116 больных (46%), свыше 24 часов 136 больных (54%). При этом среди больных с отечной формой заболевания запоздалое обращение (в сроки свыше 24 ч.) имело место в 68,4% случаев, а среди пациентов с ОДП - 47,4%.
Оценку тяжести состояния больных с панкреонекрозом проводили по шкале APACHE II, суммируя количество баллов. По количеству набранных баллов, больные были распределены на 4 основные группы, соответствующие легкой (4-9 баллов), средней (10-14 баллов), тяжелой (15-19 баллов) и крайне тяжелой (свыше 20 баллов) степени тяжести, по принципу одинаковой прогностической вероятности развития осложнений и летальных исходов (табл.3).
Таблица 3
Распределение больных с острым деструктивным панкреатитом (панкреонекрозом) по степени тяжести (шкала APACHE II) на момент поступления (n=173)
| Степень тяжести (в баллах по APACHE II) | Основная группа | Контрольная группа | Всего | |||
| Абс | % | Абс | % | Абс | % | |
| Легкая (4-9 баллов) | 15 | 17.6 | 14 | 15.9 | 29 | 16.8 |
| Средняя (10-14 баллов) | 27 | 31.8 | 29 | 33.0 | 56 | 32.4 |
| Тяжелая (15-19 баллов) | 29 | 34,1 | 30 | 34,1 | 59 | 34.1 |
| Крайне тяжелая (>20 баллов) | 14 | 16,5 | 15 | 17,0 | 29 | 16,7 |
| Всего | 85 | 100 | 88 | 100 | 173 | 100 |
Как видно из табл. 3, среди 173 больных с панкреонекрозом, в момент госпитализации 29 больных (16,7%) имели легкую степень тяжести, 56 (32,4% среднюю, 59 (34,1%) тяжелую, а 29 (16,8%) крайнюю степень тяжести. Таким образом, 88 (50,8%) из них имели прогностически неблагоприятную сумму баллов, что мы учитывали при динамической оценке результатов лечения, прогнозировании течения заболевания.
Методы исследования. Больным ОП мы проводили общепринятые клинические и биохимические исследования крови (общий белок, глюкоза крови, мочевина, креатинин, билирубин, АСТ, АЛТ, ЩФ), показатели коагулограммы (фибриноген, протромбиновое время, протромбиновый индекс), уровень гематокрита, уделяли особое внимание определению содержания амилазы крови. Все исследования проведены в клинических и биохимических лабораториях ГКБ №51 г. Москвы, по стандартным методикам, предусмотренным Приказом МЗ РФ № 290 от 1992 г. «Об унификации клинических и лабораторных методов исследования».
Наряду с традиционными исследованиями, с целью определения тяжести эндогенной интоксикации у пациентов в плазме крови определяли уровень средних молекул (СМ). Содержание СМ проводили по методике Рябова Г.А. и соавт. (1985) в лаборатории ФГУ «ГНЦ ЛМ ФМБА, России». Нормальный показатель содержания СМ в плазме крови составлял 0.4±0,04 ед. опт. плотности.
Для прогнозирования течения заболевания и оценки эффективности комплексного лечения определяли степень активности процессов перекисного окисления липидов (ПОЛ) и антиоксидантной активности SH групп и СМ на 1,3,7 и 14 сутки лечения. Исследования проводили в лаборатории ФГУ «ГНЦ ЛМ ФМБА, России». Определение содержания малонового диальдегида проводили по методике Mihara М., Unhiyama. M (1978). Нормативный показатель составил 1,45±0,24 нмоль/мг. Определение белковых сульфгидрильных групп (SH-групп) проводили по методике Эллмана с использованием дитионитробензойной кислоты. Нормативный показатель соответствовал – 0,37±0,08мµ. Содержание белковых карбонильных групп определяли спекторофотометрически с использованием 2,4- динитрофенилгидразина по методике Levine R.L., Garland D. (1990). Нормативный показатель составил 0,70±0,1 нмоль/мг.
Оценку иммунного статуса проводили в лабораториях «XXI век» г.Москвы и отделении иммунологии и регуляторных механизмов в хирургии им. академика Б.В. Петровского РАМН. При оценке клеточного иммунитета для определения количества лейкоцитов и лимфоцитов у всех пациентов проводили общий клинический анализ крови на гематологическом анализаторе Sysmex 2000 (Sysmex, Япония). Иммунофенотипирование лимфоцитов выполняли на лазерном проточном цитофлоуметре CYTOMICS FC 500 (Beckman Coulter, США). Определение субпопуляций лимфоцитов проводили с помощью многоцветного окрашивания мечеными моноклональными антителами (Beckman Coulter, США).
С помощью иммунотурбидиметрического метода на биохимическом анализаторе “OLYMPUS AU 640”(наборы реактивов этой же фирмы) проводили следующие исследования: содержание СРБ; определение компонентов комплемента С3 и С4; определение иммуноглобулинов IgА, IgM и IgG (у 1/3 больных уровень иммуноглобулинов в сыворотке крови определяли методом радиальной иммунодиффузии).
Фагоцитарную активность нейтрофилов (неспецифический клеточный иммунитет) исследовали с использованием проточной лазерной цитометрии с применением двухцветного реагента Simultest, Phagotest.
Нами были использованы следующие инструментальные методы: УЗИ, ФГДС, рентгенологическое исследование брюшной полости и грудной клетки, ЭРХПГ, видеолапароскопия, компьютерная томография, глубинная микроволновая радиотермометрия, фистулография.
УЗИ проводили на аппаратах фирмы «Алока» (Япония) и ««Voluson Expert E8» компании «General Electrics (США), оснащенных пункционным датчиком. УЗИ начинали с оценки размеров головки, тела и хвоста поджелудочной железы, ее контуров, эхогенности, эхоструктуры, диаметра Вирсунгова протока, состояния парапанкреатической клетчатки, наличия свободной жидкости в брюшной и плевральной полостях. Оценивали также размеры и эхогенность паренхимы печени, состояние и размеры внутрипеченочных протоков, общего желчного протока и желчного пузыря.
В целях точной верификации объема панкреонекроза, оценки его органной и внеорганной распространенности, а также для дальнейшего прогнозирования течения заболевания проводили КТ на спиральном томографе «General Electrics» (США). Исследования выполняли после предварительного перорального контрастирования пищеварительного тракта раствором урографина по стандартной методике, с внутривенным контрастным усилением, путем в/в введения 40-50 мл рентгеноконтрастных препаратов «Омнипак» 350 (Визипак-300). Морфологическую степень тяжести острого панкреатита определяли с использованием томографического индекса степени тяжести (СТ Severity INDEX = CTSI), разработанного группой Balthazar E. et.аl. (1985) со счетом баллов от 1 до 10. По данным КТ с контрастным усилением выделяют пять степеней тяжести поражения поджелудочной железы, которые могут быть суммированы в виде шкалы интегральной оценки распространенности и характера поражения при ОДП. Для расчета СТSI к баллам степени поражения поджелудочной железы прибавляли баллы степени некроза: 2 балла – при поражении менее 1/3 объема паренхимы, 4 балла – при некрозе более 1/3, но менее 1/2 объема; 6 баллов – при поражении более 1/2 объема железы (табл.4). Рентгенологическое исследование проводили на аппарате «Siemens» (Германия). ФГДС выполняли фиброгастродуоденоскопом фирмы «Olympus TJF 30» (Япония) с обязательным осмотром БДС с боковой оптикой.
Видеолапароскопию выполняли по стандартной методике, в условиях общей анестезии, с применением аппаратуры фирмы «Karl-Storz» (Германия).
Глубинную микроволновую радиотермометрию производили аппаратом РТМ-01-РЭМ (Россия), позволяющим проводить измерения интенсивности собственного электромагнитного излучения тканей больного в диапазоне сверхвысоких частот, прямо пропорционально отражающей температуру тканей.
Данные по температуре обрабатывали и отображали на мониторе в виде термограмм или полей температур. Для выявления инфильтрата или скоплений жидкости у больных с ОДП использовали инфракрасный датчик, который фиксировал температуру кожи по тепловому излучению в инфракрасном диапазоне, согласно специально заданной программе «поджелудочная железа». Температуру измеряли транскутанно в проекции головки, тела и хвоста поджелудочной железы и поясничных областей. РТМ диагностику проводили пациентам на 3-5 сутки госпитализации.
Таблица 4
Определение тяжести острого деструктивного панкреатита
с помощью КТ (Balthazar E. et.аl., 1985)
| Состояние ПЖ и перипанкреатической клетчатки | КТ индекс | Баллы | Площадь некроза | Баллы |
| Нормальное состояние ПЖ | А | 0 | 0 | 0 |
| Локальное или диффузное увеличение ПЖ+гиподенсивные включения, с нечеткими контурами, расширение панкреатического протока | В | 1 | <30% | 2 |
| Значительные изменения ткани ПЖ (В)+ воспалительные изменения в перипанкреатической клетчатке | С | 2 | 50% | 4 |
| Вышеуказанные изменения С+ единичные жидкостные образования вне ПЖ | Д | 3 | >50% | 6 |
| Д+ два или более жидкостных образований или газ в панкреатической/перипанкреатической области | Е | 4 | - | - |
Статистическую обработку результатов исследований осуществляли на ПЭВМ IBM PC DX-2-80 методом вариационной статистики (Л.С.Каминский 1964, А.П. Боровиков и соавт. //Statistica). Статистический анализ и обработка данных проведен “Windows”.– 2003 с использованием пакета программ “Excell-5”. Результаты рассматривали как достоверные, если вероятность случайного их происхождения по t-критерию Стьюдента была менее 5% (р<0,05).
Результаты собственных исследований. Острый отечный панкреатит (ООП), как правило, на фоне проводимой комплексной консервативной терапии имел абортивное течение. Появление метеоризма (83,2%), на фоне напряжения брюшной стенки (86,1%), формирование инфильтрации в парапанкреатической клетчатке (76,9%), токсической энцефалопатии (41,6%) или реактивного плеврита (12,1%) указывали на развитие панкреонекроза и распространение процесса на забрюшинную клетчатку (табл.2). При этом развитие дыхательной (56,6%) и почечной (39,9%) недостаточности были следствием тяжелой эндотоксемии. Для 54 (21,4%) больных инфицированным панкреонекрозом (ИПН) было характерно двухфазное течение заболевания: после относительной стабилизации состояния больного, через 2-3 недели отмечалось развитие гнойных осложнений.
Переход стерильного панкреонекроза в инфицированный, как правило, сопровождался ухудшением состояния пациента, нарастанием интоксикации, появлением симптомов полиорганной недостаточности (ПОН), формированием пальпируемого инфильтрата в верхней половине живота, появлением перитонеальных симптомов, лихорадки, озноба, желтухи и смешанной энцефалопатии.
Однако диагностическая значимость вышеуказанных клинических симптомов, по нашим наблюдениям, была невысокой, поскольку были неспецифичны. Для улучшения диагностики мы применяли ряд инструментальных (УЗИ и лапароскопию, ФГДС, КТ) и лабораторных исследований.
Результаты лабораторных исследований у больных с различными клинико-морфологическими формами ОП не выявили достоверных отличий в уровне общего белка, мочевины и глюкозы крови (табл.5).
Таблица 5
Исходные биохимические показатели крови в зависимости от формы заболевания
| Показатели | Норма | Группа больных | Отечный панкреатит (n=79) | ОДП (n=173) |
| Общий белок | 64-83 г/л | Контрольная | 72.1±3.7 | 68.7±1.9 |
| Основная | 73.6±3.6 | 69.8±2.4 | ||
| Общий билирубин | 3.4-17.1 ммоль/л | Контрольная | 36.1±1.9* | 41.1±2.8** |
| Основная | 35.1±1.8* | 39.4±2.4** | ||
| АсАТ | 0-35 Ед/л | Контрольная | 38.4±2.0* | 96±2.8** |
| Основная | 41.9±2.3* | 116±5.8** | ||
| АлАТ | 0-31 Ед/л | Контрольная | 48.1±0.4* | 108±4.3** |
| Основная | 39.5±0.5* | 92.1±6.3** | ||
| Креатинин | 70-110 ммоль/л | Контрольная | 106.2±2.1 | 146±4.6** |
| Основная | 101.8±2.3 | 148±6.1** | ||
| Мочевина | 2.5-6.5 ммоль/л | Контрольная | 6.9±0.9 | 7.2±2.6 |
| Основная | 6.2±0.8 | 7.5±3.1 | ||
| Амилаза крови | 10-100 ЕД/л | Контрольная | 264±4.1* | 389±4,7* |
| Основная | 263±4.8* | 371±4.4* | ||
| Глюкоза | 3.8-5.8 ммоль/л | Контрольная | 5.9±2.1 | 6.8±1.2 |
| Основная | 5.8±1.9 | 7.2±1.3 |
Примечание: *-p<0,05, **p <0,001 по сравнению с нормой.
Однако отечный панкреатит сопровождался существенным повышением общего билирубина, увеличением уровня АсАт и АлАт, при этом сдвиги были более выраженными у больных с панкреонекрозом (ОДП). Таким образом, приведенные лабораторные тесты свидетельствовали о наличии функциональной недостаточности печени на фоне токсического гепатита. У всех больных с отечной формой и большинства пациентов с панкреонекрозами было также установлено повышение уровня амилазы крови от 130 до 2710 ЕД/л. Лишь в 9 (5,2%) наблюдениях у лиц с тотальным панкреонекрозом показатели амилазы крови были в пределах нормы. Проявлением функциональной недостаточности почек было обнаружение повышение уровня креатинина крови до 148±6,1 ммоль/л (р < 0,05) у больных с панкреонекрозом.
У больных с отечным панкреатитом (контрольная и основная группы) в первые сутки наблюдения мы выявляли изменения факторов ПОЛ, проявляющихся в снижении уровня SH-групп (0,32±0,09 и 0,35±0,06) и в достоверном повышении уровня СМ (0,68±0,02 и 0,65±0,02), МДА (2,120±,09 и 2,18±0,17) и КБ (0,86±0,05 и 0,81±0,06). Эти сдвиги указывали на интенсификацию процесса ПОЛ, играющего важную роль о патогенезе ОП. У больных ОДП отмечали достоверно высокие цифры продуктов ПОЛ и маркера эндотоксемии (СМ) в сравнении с данными у больных ОП (контрольная и основная группы), а именно снижение уровня SН-группы (0,28±0,04 и 0,27±0,05), резкое повышение (в 2 раза и более) уровня СМ (0,8±60,03 и 0,82±0,04), МДА (3,91±0,13 и 4,06±0,18) и на 45-50% повышение уровня КБ (0,93±0,05 и 0,94±0,06) (табл.6).
Таблица 6
Исходные параметры эндогенной интоксикации и ПОЛ у больных основной и контрольной групп.
| Показатели | Группы больных | Отечный панкреатит | ОДП |
| Средние молекулы (норма 0,4±0,04 ед/л) | Контрольная | 0,68±0,02* | 0,86±0,03** |
| Основная | 0,65±0,02* | 0,82±0,04** | |
| Малоновый диальдегид (норма 1,45±0,24 ммоль/л) | Контрольная | 2,12±0,09* | 3,91±0,13** |
| Основная | 2,18±0,17* | 4,06±0,18** | |
| SH- группы (норма 0,37±0,08мµ) | Контрольная | 0,32±0,09 | 0,28±0,04** |
| Основная | 0,35±0,06 | 0,27±0,05** | |
| Карбонилы (норма 0,70±0,1 нмоль/л) | Контрольная | 0,86±0,04* | 0,93±0,05** |
| Основная | 0,81±0,06* | 0,94±0,06** |
Примечание: достоверность различия *р<0,05 по сравнению с нормой;
**р<0,05 по сравнению с отечной формой заболевания.
Следовательно, уже на стадии острого отечного панкреатита мы наблюдали определенные изменения, а на стадии панкреонекроза – более существенное усиление процессов липопероксидации. Накопление и поддерживание в сыворотке крови на довольно высоком уровне МДА и КБ совпадает с высоким уровнем СМ. Такой параллелизм изменений свидетельствует о несомненном участии продуктов ПОЛ в общей совокупности токсических соединений, циркулирующих в крови больных с панкреонекрозом и поддерживающих высокую степень эндотоксемии.
В патогенезе прогрессирования острого панкреатита ведущую роль отводят иммунным нарушениям. У больных с панкреонекрозом развиваются выраженные изменения со стороны клеточного и гуморальных звеньев иммунитета, а также ФАН, которые существенно отягощают течение заболевания.
Нами были проведены исследования иммунного статуса у 57 пациентов с ОП из числа, которых 32 больным проводили сеансы НИЛИ (основная группа). Среди обследованных отечной формой ОП (I группа) было 13 больных; стерильным панкреонекрозом и ферментативным перитонитом (II группа) – 25 пациентов; инфицированным панкреонекрозом (III группа) – 19 больных. У пациентов I гр. проводили только комплексное консервативное лечение, у больных II гр. – комплексное консервативное лечение и лапароскопическое дренирование брюшной полости, у III гр. – традиционное хирургическое лечение. Мониторинг исследований иммунного статуса проводили до и после проведения курса сеансов НИЛИ.
Результаты наших исследований свидетельствуют, что при отечной форме ОП наблюдается достоверное повышение количества лейкоцитов (11,3±0.67), лимфопения, снижение содержания Т-лимфоцитов и их субпопуляций. (рис.1). О развитии иммунодефицита уже на 2-3 сутки заболевания указывало повышение показателя лейкоцитарно-Т-лимфоцитарного индекса до 13.61±4.8 (при норме 5,8±4,6) и содержания В–лимфоцитов (р<0,05). Упомянутые сдвиги клеточного иммунитета, характерные для панкреатогенной токсемии, мы наблюдали при всех формах ОП. Фагоцитарная активность нейтрофилов (ФАН) и концентрация иммуноглобулинов классов A, M и G в сыворотке крови при отечной форме заболевания были в пределах нормы.

Рис.1. Исходные иммунограммы у больных отечным панкреатитом (I группа), стерильным (II группа) инфицированным (III группа) панкреонекрозом.
У пациентов со стерильным панкреонекрозом и ферментативным перитонитом (n=25) также был обнаружен высокий лейкоцитарно-Т- лимфоцитарный индекс (13,7±5,2) на фоне снижения показателей Т-лимфоцитов (СД3+) как в относительном, так и в абсолютном значениях в сравнении с показателями здоровых доноров: 57,0±2,01%, 0,79±0,031х10^9/л и 66,9±2,4%, 1,168±0,073х10^9/л соответственно. Было отмечено также снижение Т-хелперов и Т-цитотоксических клеток: СД4+ – 32,73±1,89%, 0,31±0,042х10^9/л и СД8+ – 24,32±1,51% и 0,203±0,014x10^9/л. Маркеры активации Т-лимфоцитов во II группе были низкими и составили СД3/HLA-DR+8,31±0,97%, 0,08±0,01x10^9/л (р<0,05). Достоверное увеличение относительных показателей В-лимфоцитов (СД19+) – 19,16±1.2%, содержания естественных киллеров СД3/СД16/56 до 16,9±1,2% на фоне снижения абсолютного значения лимфоцитов (0,94±0,09x10^9/л) и ФАН (81,67±1,3%) (р<0,05) указывали на развитие выраженного иммунодефицита, обусловленного тяжелой токсемией.
При инфицированном панкреонекрозе (n=19) исходные иммунологические сдвиги были сопоставимы с показателями иммунного статуса при отечной форме, хотя клинически данная группа была наиболее тяжелой. Для III группы была характерна пан Т-лимфоцитемия, СД3+ (72,35±2,3% и 0,989±0,242x10^9 г/л), наиболее низкие показатели маркеров активации Т-лимфоцитов (СД3/HLA-DR+ - 8,09±1.2% и 0,09±0,03x10^9/л), ФАН (80,2±1,2%), повышение содержания иммуноглобулина G-(14,21±1,3 г/л) (р<0,05), которые явились неблагоприятными прогностическими признаками инфицирования очагов деструкции.
Таким образом, панкреонекроз сопровождается активацией ПОЛ, угнетением системы антиоксидантной защиты, тяжелой эндотоксемией и развитием выраженного вторичного иммунодефицита.
УЗИ при остром панкреатите в качестве скринингового метода оценки состояния поджелудочной железы, билиарной системы, брюшной и плевральных полостей проводили всем поступившим больным.
У большинства больных с отечной формой ОП (74,7%) было установлено тотальное увеличение размеров железы, реже наблюдалось сегментарное увеличение железы за счет одного из отделов, при этом сегментарное увеличение головки ПЖ было выявлено у 9 (11,4%) больных, тела – у 5 (6,3%), хвоста – у 6 (7,6%) пациентов (табл.7).
При отечной форме ОП были обнаружены изменения эхогенности паренхимы железы. Пониженная эхогенность у данной категории пациентов была выявлена у 68 (86,1%), повышенная – у 7 (8,9%) больных. Неровные и нечеткие контуры железы обнаружены у 21(26,6%), инфильтрат в проекции ПЖ у 17 (24,5%) пациентов. Неоднородность эхоструктуры железы было также установлена у 22 (27,8%) пациентов.
Для панкреонекроза (173 больных) было характерным тотальное увеличение размеров железы. Контуры железы в большинстве случаев (94.8%) были нечеткими и неровными. У всех пациентов с ОДП было выявлено изменение эхогенности паренхимы железы, которая была пониженной у 129 (74,6%), а повышенной – 44 (25,4%) больных.
Таблица 7
Частота встречаемости ультрасонографических признаков острого панкреатита
| Признаки | ООП (n=79) | ОДП (n=173) | ||
| Абс | % | Абс | % | |
| Увеличение размеров ПЖ: тотальное сегментарное: головка тело хвост | 59 9 5 6 | 74,7 11,4 6,3 7,6 | 173 | 100 |
| Неровные и нечеткие контуры ПЖ | 21 | 26,6 | 164 | 94,8 |
| Эхогенность: пониженная Повышенная | 68 7 | 86,1 8,9 | 129 44 | 74,6 25,4 |
| Неоднородность эхоструктуры железы | 22 | 27,8 | 166 | 95,9 |
| Формирование жидкостных образований в проекции ПЖ | 3 | 3,8 | 143 | 82,7 |
| Инфильтрат в проекции ПЖ | 17 | 21,5 | 141 | 81,5 |
| Свободная жидкость в брюшной полости | - | - | 130 | 75,1 |
| Инфильтрация и неоднородность забрюшинной клетчатки | 25 | 31,6 | 73 | 42,2 |
| Выпот в плевральных полостях | - | - | 47 | 27,2 |
| Парез ЖКТ | 46 | 58,2 | 162 | 93,6 |
| Расширение Вирсунгова протока | 3 | 3,8 | 9 | 5,2 |
Неоднородность эхоструктуры ПЖ была определена у 166 (95,9%) больных. Воспалительный инфильтрат в проекции ПЖ обнаружен у 141 (81,5%).
У больных с ОДП жидкостные скопления в сальниковой сумке (рис.2) (оментобурсит) и в забрюшинной клетчатке были обнаружены у 143 (82,7%) пациентов, выпот в брюшной полости – у 130 (75,1%), в плевральных полостях – у 47 (27,2%) пациентов. Инфильтрация и неоднородность забрюшинной клетчатки установлены у 73 (42,2%) больных. Расширение Вирсунгова протока имело место у 9 (5,2%) пациентов.
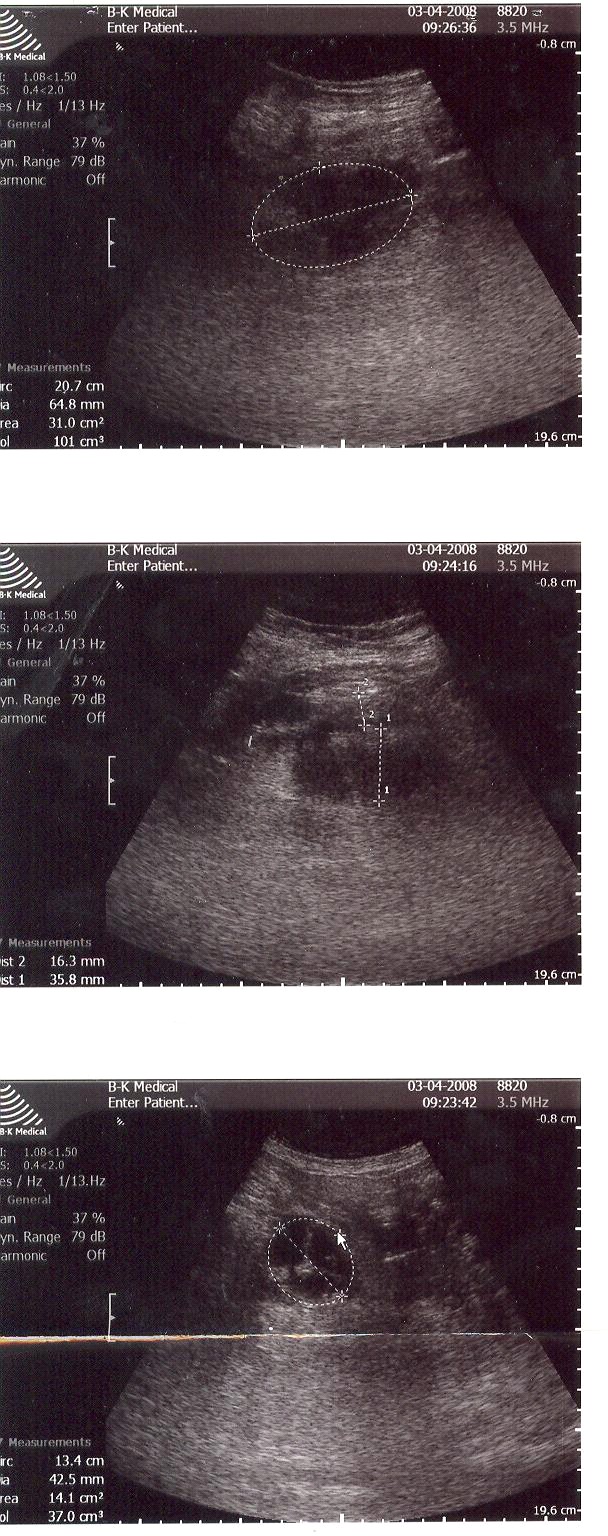
Рис.2 УЗИ картина оментобурсита,
у б-го М. с субтотальным геморрагическим панкреонекрозом.
В процессе лечения больных важное значение мы придавали динамическому УЗИ, которое позволяло оценить течение заболевания, эффективность проводимой терапии, а также проводить, что крайне важно, раннюю диагностику осложнений панкреонекроза. При анализе информативности динамического УЗИ в диагностике ОП чувствительность метода составила 91,7%, специфичность – 97,2%, точность – 93,2%.
Таким образом, полученные результаты свидетельствуют о том, что метод УЗИ является высоко информативным, доступным и безопасным методом диагностики острого панкреатита.
Однако УЗИ обладает меньшей разрешающей способностью в плане топической диагностики при инфицированных формах панкреонекроза, что обусловливает необходимость проведения КТ у данной категории пациентов.
При анализе КТ-семиотики ОДП у 98 больных (в т. ч. среди 50 пациентов основной и у 48-контрольной группы) у всех пациентов были обнаружены прямые признаки панкреонекроза – диффузное увеличение ПЖ, нечеткость контуров и негомогенность паренхимы железы, наличие очагов некроза и снижение денситометрической плотности. Расширение Вирсунгова протока имело место лишь у 21 (21,4%) пациента (табл.8).
Таблица 8
КТ - семиотика острого деструктивного панкреатита (n=98)
| КТ – признаки | Кол-во наблюдений | |
| Абс. | % | |
| 1 Прямые признаки: | ||
| диффузное увеличение ПЖ | 98 | 100 |
| нечеткость контуров ПЖ | 98 | 100 |
| негомогенность паренхимы ПЖ | 98 | 100 |
| очаги некроза ПЖ | 98 | 100 |
| снижение денситометрической плотности ПЖ | 98 | 100 |
| расширение Вирунгова протока | 21 | 21,4 |
| 2. Косвенные признаки: выпот в брюшной полости | 91 | 92,8 |
| нечеткая визуализация и деформация крупных близлежащих сосудов | 59 | 60,2 |
| ЖКБ, холедохолитиаз Реактивный плеврит | 9 25 | 9,2 25,5 |
Из косвенных признаков панкреонекроза наличие свободной жидкости в брюшной полости мы наблюдали у 91 (92,8%), нечеткость визуализации и деформацию крупных близлежащих сосудов - у 59 (60,2%), появление свободной жидкости в плевральной полости - у 25 (25,5%) больных. ЖКБ и холедохолитиаз были обнаружены у 9 (9,2%) пациентов. Внутривенное контрастное усиление позволяло четко верифицировать объем некроза поджелудочной железы.
Среди обследованных 98 больных, объем некроза более 50% (субтотально-тотальный панкреонекроз) был обнаружен у 34 (34,7%), в т.ч. в основной группе у 16 (32,0%), а контрольной группе у 18 (37,5%) пациентов (рис.3).
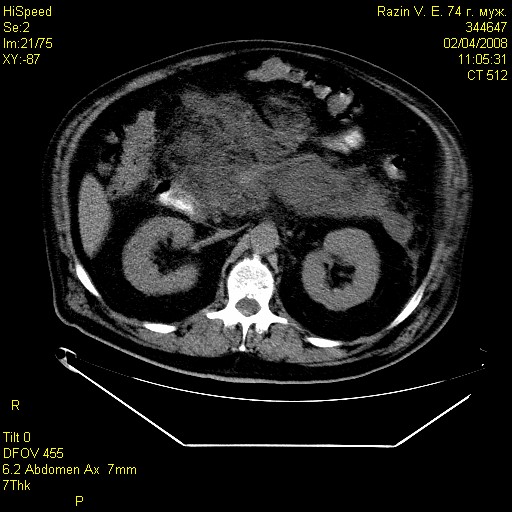
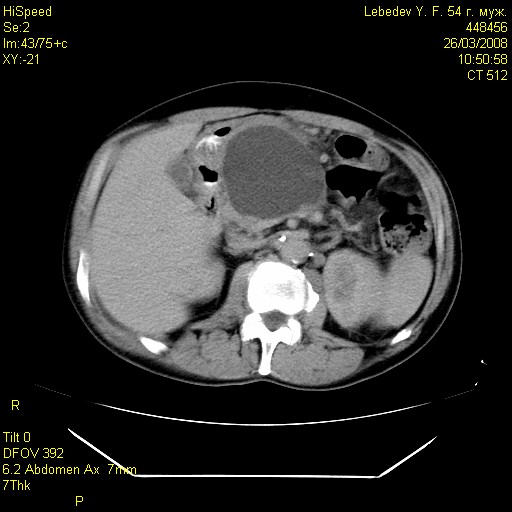
Рис. 3 Рис. 4.
Больной Р. Больной Л.
КТ картина тотального геморрагического КТ картина постнекротической кисты
панкреонекроза, парапанкреатита, параколита. головки поджелудочной железы.
Объем некроза в пределах 30-50% выявлен у 42 (42,9%), а объем некроза менее 30% был отмечен у 22 (22,4%) пациентов. С помощью КТ нам удавалось установить локализацию, размеры и толщину стенок постнекротических кист поджелудочной железы (рис.4)
Среди 98 обследованных, легкая степень тяжести (индекс CTSI-0-3) была определена у 10 (10,2%), средняя степень (индекс CTSI-4-6) у 16 (16,3%), тяжелая степень тяжести (индекс CTSI -7-10) у 72 (73,5%) пациентов, при этом у больных панкреонекрозом при значении индекса 0-3 и 4-6 случаев летального исхода не было. А в группе больных (72), имевших индекс CTSI 7-10, умерло 11 больных (15,3%). Следует отметить, что скончались пациенты, имевшие объем зоны некроза поджелудочной железы более 50%.
Таким образом, КТ с внутривенным контрастным усилением является наиболее чувствительным методом топической диагностики панкреонекроза и его осложнений. КТ позволяет не только достоверно определить размеры деструкции ПЖ и окружающей клетчатки, но и прогнозировать летальность в зависимости от объёма зоны некроза.
Среди 173 больных панкреонекрозом у 105 (60,7%) мы провели лечебно-диагностическую лапароскопию по стандартной методике. Показаниями к этой процедуре служили доказанное УЗИ наличие свободной жидкости в брюшной полости и симптомов разлитого перитонита. При обнаружении панкреатогенного ферментативного перитонита проводили ургентную видеолапароскопию, эвакуацию выпота электроотсосом, ревизию органов брюшной полости и малого таза с обязательным посевом выпота на стерильность и определением уровня амилазы. В большинстве случаев уровень амилазы в перитонеальной жидкости колебался в пределах от 785 до 2700 Ед/л, а в посевах на стерильность роста микрофлоры не обнаружено.
В ходе диагностической лапароскопии нами были выявлены следующие прямые признаки панкреонекроза: геморрагический выпот в брюшной полости у 75 (71,4%) больных, при этом у 26 (24,8%) количество жидкости составило более 1 литра. Серозный выпот (до 500 мл) в брюшной полости обнаружен у 30 (28,6%), бляшки стеатонекроза на брюшине, большом и в малом сальнике были выявлены у 25 (23,8%), а геморрагическая имбибиция забрюшинной клетчатки у 22 (20,9%) пациентов (табл.9).
Таблица 9
Лапароскопическая семиотика панкреонекроза (n=105)
| Признаки панкреонекроза | Количество больных | |
| Абс. | % | |
| 1 Прямые симптомы: -бляшки стеатонекроза на брюшине | 25 | 23,8 |
| - геморрагический выпот в объеме - до 500 мл | 75 21 | 71,4 20,0 |
| - 500 мл – 1л | 28 | 26,6 |
| -более 1 л | 26 | 24,8 |
| -серозный выпот (до 500 мл) | 30 | 28,6 |
| -геморрагическая имбибиция забрюшинной клетчатки | 22 | 20,9 |
| -стекловидный отек забрюшинной клетчатки | 33 | 31,4 |
| 2.Косвенные признаки: -отек и гиперемия малого сальника и брюшины верхнего этажа | 69 | 65,7 |
| - парез желудка и поперечной ободочной кишки | 86 | 81,9 |
| -увеличенный (застойный) желчный пузырь | 14 | 13,3 |
Косвенные признаки панкреонекроза: отек и гиперемия малого сальника и брюшины верхнего этажа имели место у 69 (65,7%) больных, парез желудка и поперечной ободочной кишки у 86 (81,9%), увеличенный и застойный желчный пузырь у 14 (13,3%) пациентов. Процедуру завершали дренированием брюшной полости с установлением силиконовых трубок в малый таз, в подпеченочное пространство к Винслову отверстию и по ходу латеральных каналов. При благоприятном течении заболевания дренажи из брюшной полости удаляли в среднем на 3-5 сутки.
ФГДС была проведена 54 больным с отечным панкреатитом и 137 больным с ОДП в качестве дополнительного метода исследования, для визуальной оценки состояния слизистой пищевода, желудка, ДПК и БДС. Важное значение при ОП ФГДС приобретает как метод точной диагностики сопутствующей патологии БДС. Так, среди 191 обследованного больного, папилит был обнаружен у 21 (10,9%), ущемленный камень в БДС у 4 (2,1%). В последних 4 случаях исследование было завершено ЭПСТ с экстракцией ущемленного камня.
После выполнения ФГДС, пациентам с выявленной сопутствующей язвенной болезнью ДПК (n=2) и острыми эрозивно-язвенными поражениями желудка и ДПК (n=46), на фоне противоязвенной терапии применяли меры профилактики желудочно-кишечного кровотечения.
Глубинная радиоволновая радиотермометрия была проведена 30 пациентам с панкреонекрозом на 3-5 сутки после видеолапароскопического дренирования брюшной полости. К сожалению, из-за различий в выраженности подкожно-жировой клетчатки передней брюшной стенки и поясничных областей у пациентов, термограммы часто имели расхождение с данными УЗИ и КТ. Информативность данного исследования была низкой. Лишь у 6 (20%) из 30 обследованных больных с крупноочаговым панкреонекрозом и парапанкреатическим инфильтратом была установлена термоассиметрия и очаг низкой температуры (рис.5)
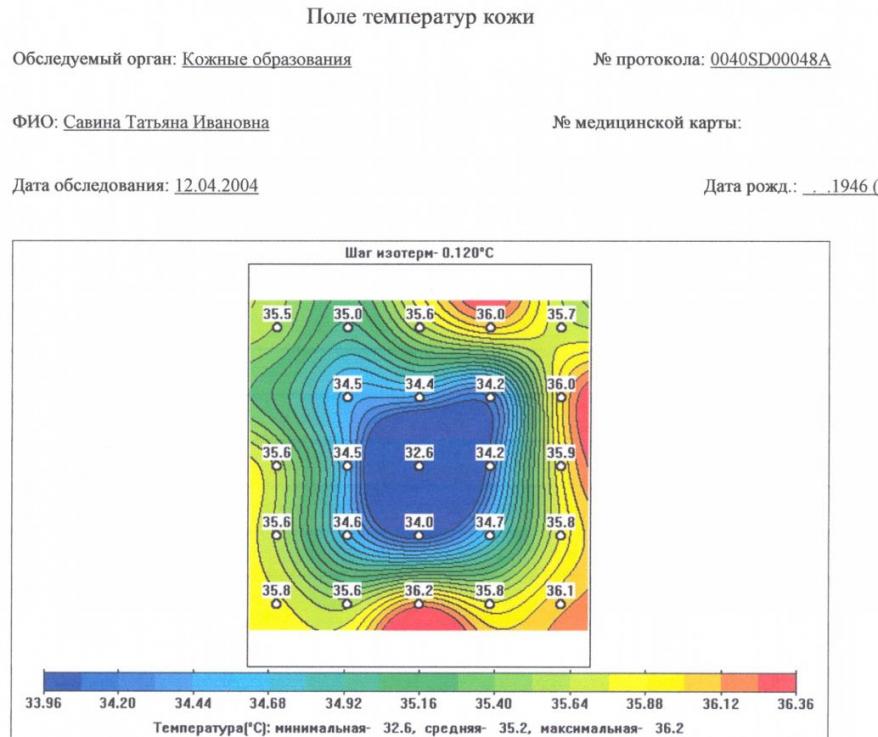
Рис. 5. Глубинная термограмма проекции головки поджелудочной железы больного с субтотальным геморрагическим панкреонекрозом, оментобурситом, 5 сутки после видеолапароскопического дренирования брюшной полости. Средняя температура в проекции поджелудочной железы составила – 35,2°С, минимальная -32.6°С, максимальная – 36.2°С
Результаты лечения острого отечного панкреатита
При выполнении работы мы изучали эффективность лазерной и антиоксидантной терапии у 39 больных ООП, которым было проведено комплексное лечение с применением сеансов НИЛИ-ВЛОК и антиоксидантного препарата Мексидол (5%-4,0 в/м или в составе инфузии однократно в течение 8- сут.).
Контрольная группа включала 40 пациентов ООП, которым проводили комплексную консервативную терапию, в соответствии с протоколами диагностики и лечения острого панкреатита.
Благодаря противовоспалительному и ПОЛ-ингибирующему эффектам комплексной лазерной и антиоксидантной терапии, в основной группе больных страдавших ООП, купирование клинических проявлений заболевания было достигнуто на 3-4 сутки (табл.10), а нормализация размеров и эхогенности паренхимы ПЖ наступала на 6-7 сутки от начала лечения, т.е. на 7,1 суток раньше, чем у пациентов, которым проводили традиционную консервативную терапию. При этом в контрольной группе у 2 (5%) больных развился панкреонекроз.
Лабораторный контроль показателей уровня эндогенной интоксикации и ПОЛ показал, что у больных обеих групп имелась исходно выраженная интоксикация, которая сопровождалась повышением уровня средних молекул (0,68±0,02 и 0,65±0,06 мм), МДА (2,12±0,09 и 2,18±0,17 ммоль/л), карбонилов (0,90±0,04 и 0,91±0,14 нмоль/мг) и снижением уровня SH-групп (0,32±0,9 и 0,35±0,06 мµ).
Таблица 10
Динамика клинической симптоматики ООП на фоне проводимой терапии
| Симптомы | Контрольная группа (n=40) | Основная группа (n=39) | ||||||
| 1 сут | 3 сут | 7 сут | 14 сут | 1 Сут | 3 сут | 7 сут | 14 сут | |
| Болевой синдром | 40 100% | 23 57,5% | 9 22,5% | - | 39 100% | - | - | - |
| Тошнота и рвота | 32 80% | 16 48,5% | 5 15,2% | - | 30 76,9% | - | - | - |
| Желтуха | 3 7.5% | 2 5.0% | 1 2.5 | - | 2 5,1% | - | - | - |
| Метеоризм | 9 22,5% | 5 12,5% | 5 12,5% | - | 10 25,6% | - | - | - |
| Болезненность при пальпации | 40 100% | 21 52,5% | 13 32,5% | - | 39 100% | 4 10,3% | - | - |
| Симптом Воскресенского | 28 70,0% | 17 42,5% | 3 7,5% | - | 27 69,2% | 3 7,7% | - | - |
| Лихорадка | 11 27,5% | 9 22,5% | 5 12,5% | - | 9 23,1% | - | - | - |
| Прогрессирующее течение с развитием Панкреонекроза | - | - | 2 5,0% | 2 5,0% | - | - | - | - |
Динамические лабораторные исследования показали, что в контрольной группе больных улучшение показателей отмечались на 3-7 сутки, которые практически нормализовались к 14 суткам (табл. 11).
В основной группе больных на фоне проводимой терапии на 3 сутки было выявлено достоверное снижение, а на 7 сутки - полная нормализация содержания средних молекул, МДА, карбонилов и антиоксидантной активности SH-групп.
Таблица 11
Динамика параметров эндогенной интоксикации у больных контрольной и основной групп
| Показатели | Группы больных | Сроки наблюдения, сут. | |||
| 1 | 3 | 7 | 14 | ||
| Средние молекулы (норма-0,4±0,04ед.) | Контр. Осн. | 0,68±0,02 0,65±0,02 | 0,53±0,01* 0,37±0,02* | 0,42±0,06* 0,34±0,02* | 0,39±0,06* 0,24±0,04** |
| МДА (норма-1,45± 0,24 ммоль/л) | Контр. Осн. | 2,12±0,09 2,18±0,17 | 1,8±0,07* 1,45±0,14* | 1,61±0,14* 1,36±0,09* | 1,52±0,31** 1,31±0,16** |
| SH-группы (норма-0,37±0,08 мµ) | Контр. Осн. | 0,32±0,09 0,35±0,06 | 0,38±0,03* 0,56±0,09* | 0,32±0,07 0,38±0,06* | 0,30±0,003* 0,34±0,07* |
| Карбонилы (норма-0,70±0,1 нмоль/мг) | Контр. Осн. | 0,86±0,04 0,81±0,06 | 0,83±0,12* 0,78±0,12* | 0,76±0,03* 0,68±0,08* | 0,65±0,05** 0,56±0,07* |
Примечание: *р0,05; **р0,01 между показателями по сравнению с первоначальным.
Таким образом, сочетанное применение Мексидола, сеансов НИЛИ-ВЛОК и транскутанной лазерной терапии обеспечивали потенцирование эффекта действия каждого метода, благодаря чему нормализация уровня показателей ПОЛ и средних молекул наступила на 8,3 суток раньше, чем у пациентов контрольной группы, которым проводили лишь базисную комплексную консервативную терапию.
По нашим данным, сеансы НИЛИ у пациентов с острым отечным панкреатитом способствовали нормализации уровня лейкоцитов, лимфоцитов, и лейкоцитарно-Т-лимфоцитарного индекса, что является показателем адекватности иммунного ответа на фоне выздоровления пациентов (рис.6). При этом отмечено достоверное повышение Т–лимфоцитов (76,7±3,4%), и их субпопуляций: Т-хелперов до 47,2±3.2% и Т-цитотоксических клеток до 29,9±2,41% и 0,66±0,131x10^9/л в сравнении с данными у больных контрольной группы. Показатели фагоцитарной активности и иммуноглобулинов оставались в пределах нормы.

Рис.6 Иммунограмма больных с отечным панкреатитом после применения НИЛИ.
Результаты наших исследований свидетельствуют о том, что базисное (традиционное) лечение, потенцированное сеансами НИЛИ и антиоксидантной терапией при ООП, позволяет ускорить купирование патологического процесса в ПЖ, уменьшить частоту развития осложнений, сокращая тем самым сроки выздоровления больных.
Результаты лечения острого деструктивного панкреатита.
Всем больным (173) с ОДП (панкреонекрозом) проводилась стандартная комплексная терапия, согласно протоколам диагностики и лечения острого панкреатита, в условиях отделения реанимации и интенсивной терапии (ОРИТ) ГКБ № 51. У пациентов основной группы (n= 85) дополнительно применяли ВЛОК и местную лазеротерапию по разработанной схеме ФГУ «ГНЦ лазерной медицины ФМБА России».
Таблица 12
Осложнения острого деструктивного панкреатита (n=173)
| Осложнения | Основная группа (n=85) | Контрольная группа (n=88) | Всего | |||
| Абс | % | Абс | % | Абс. | % | |
| Ферментативный перитонит | 46 | 54,1 | 53 | 60,2 | 99 | 57,2 |
| Оментобурсит | 31 | 36,5 | 28 | 31,8 | 59 | 34,1 |
| Легочные осложнения (пневмония, реактивный плеврит, респираторный дисстресс синдром) | 35 | 41,2 | 39 | 44,2 | 74 | 42,8 |
| Постнекротические кисты ПЖ | 14 | 16,5 | 10 | 11,4 | 24 | 13,9 |
| Эндотоксический шок | 18 | 21,2 | 21 | 23,9 | 39 | 22,5 |
| Сепсис, полиорганная недостаточность | 13 | 15,3 | 12 | 13,6 | 25 | 14,5 |
| Печеночно-почечная недостаточность | 10 | 11,8 | 13 | 14,8 | 23 | 13,2 |
| Абсцесс сальниковой сумки и поджелудочной железы | 8 | 9,4 | 7 | 7,9 | 15 | 8,7 |
| Забрюшинная флегмона | 7 | 8,2 | 8 | 9,1 | 15 | 8,7 |
| Гнойный перитонит | 6 | 7,1 | 8 | 9,1 | 14 | 8,1 |
| Механическая желтуха | 4 | 4,7 | 3 | 3,4 | 7 | 4,0 |
| Панкреатодигистивные свищи | 3 | 3,5 | 4 | 4,5 | 7 | 4,0 |
| Аррозивное кровотечение | 2 | 2,4 | 1 | 1,1 | 3 | 1,7 |
| Острый инфаркт миокарда | 2 | 2,4 | 1 | 1,1 | 3 | 1,7 |
| Острая сердечная недостаточность | 7 | 8,2 | 12 | 13,6 | 19 | 10,9 |
| Илиофеморальный венозный тромбоз | 2 | 2,4 | - | - | 2 | 1,2 |
| Психозы смешанного генеза | 16 | 18,8 | 19 | 21,6 | 35 | 20,2 |
Среди больных ОДП поздняя госпитализация в сроки более 24 ч (47.4%) от момента заболевания и распространенность поражения ПЖ у большинства пациентов ОДП способствовали развитию осложнений, приведенных в табл. 12. Как видно, ферментативный перитонит развился у 99 (57,2%), оментобурсит – у 59 (34,1%), постнекротические кисты ПЖ у 24 (13,9%), флегмона забрюшинной клетчатки у 15 (8,7%), эндотоксический шок развился у 39 (22,5%), сепсис и ПОН развился у 25 (14,5%) пациентов. Развитие таких специфических осложнений, как ферментативный перитонит, абсцессы сальниковой сумки, гнойный перитонит, аррозивное кровотечение, требовали проведения оперативных вмешательств в экстренном порядке. Результаты лечения неинфицированного панкреонекроза в основной (59) и контрольной (60) группах больных приведены в табл. 13.
Таблица 13
Результаты лечения стерильного панкреонекроза (n=119)
| Способы лечения | Всего больных | Выздоровление | Летальный исход | |||
| Осн.гр. | Контр.гр. | Осн.гр. | Контр.гр. | Осн.гр. | Контр.гр. | |
| Консервативное | 12 | 3 | 12 | 3 | - | - |
| Дренирование жидкостных образований под контролем УЗИ | 4 | 1 | 4 | 1 | - | - |
| Холецистостомия под контролем УЗИ | 1 | - | 1 | - | - | - |
| ЭПСТ | 2 | 1 | 2 | 1 | - | - |
| Лапароскопия + дренирование брюшной полости | 37 | 46 | 34 | 39 | 3 | 7 |
| Лапаротомия+ холецистостомия+оменто- бурсостомия + дренирование брюшной полости | 3 | 10 | 3 | 6 | - | 4 |
| Всего | 59 | 60 | 56 | 49 | 3 (5,1%) | 11 (18,3%) |
Как следует из данных табл. 13, после комплексного консервативного лечения выздоровление наступило у 15 (8,7%) больных. Мини-инвазивные вмешательства (дренирование ограниченных жидкостных образований, холецистостомия под контролем УЗИ, ЭПСТ) в основной группе были выполнены у 7, в контрольной у 2 пациентов, в целом в 9 (5,2%) случаях. После указанных вмешательств на фоне комплексных консервативных мероприятий у пациентов мы отмечали улучшение общего состояния, и больные были выписаны. После лапароскопии и дренирования брюшной полости улучшение наступило у 73(87,9%) из числа 83 оперированных. Среди 14 (11,8%) умерших пациентов с неинфицированным панкреонекрозом, 10 погибли от эндотоксического шока и ПОН в сроки до 7 суток после госпитализации, несмотря на лапароскопическое дренирование и проводимую интенсивную терапию в условиях ОРИТ. При вскрытии у них обнаружено субтотально – тотальное поражение ПЖ.
Открытые операции были выполнены 13 пациентам (в основной группе у 3, контрольной у 10), в основном по поводу субтотально-тотального поражения ПЖ. При этом лапаротомию завершали холецистостомией, оментобурсостомией и дренированием брюшной полости. Умерли 4 из числа пациентов контрольной группы. В целом среди больных стерильным панкреонекрозом в основной группе умерло 3 (5,1%), в контрольной группе – 11(18,3%) пациентов.
Если учесть, что подавляющее большинство больных (74,9%) были в трудоспособном возрасте, то сокращение сроков стационарного лечения, снижение летальности при ОП представляет большое социально- экономическое значение. При инфицированном панкреонекрозе разработанный нами протокол НИЛИ-терапии в дополнение к комплексному консервативному, традиционному хирургическому лечению обеспечивала устойчивую тенденцию к восстановлению иммунного статуса пациентов. Результаты хирургического лечения инфицированного панкреонекроза и его гнойно-некротических осложнений у больных основной (25) и контрольной (28) групп представлены в табл.14
Таблица 14
Результаты хирургического лечения инфицированного панкреонекроза
(n=54)
| Способы хирургического лечения | Всего больных | Выздоровление | Летальный исход | |||
| Основн. группа. | Контр. группа | Основн. группа | Контр. группа | Основн. Группа | Контр. Группа | |
| Дренирование перипанкреатических абсцессов под контролем УЗИ | 6 | 6 | 6 | 5 | - | 1 |
| 1-этап Видеолапароскопия +дренирование брюшной полости. 2-этап Лапаротомия, некрсеквестрэктомия, оментобурсостомия, холецистостомия. Дренирование забрюшинной клетчатки и брюшной полости. | 3 | 7 | 2 | 3 | 1 | 4 |
| Лапаротомия, люмботомия, некрсеквестрэктомия, оменто-бурсостомия (по показаниям холецистэктомия, холедохо-холецистостомия), сквозное дренирование забрюшинной клетчатки и брюшной полости. | 17 | 15 | 12 | 8 | 5 | 7 |
| Всего | 26 | 28 | 20 | 16 | 6 (23,1%) | 12 (42,8%) |
Среди 12 больных с перипанкреатическими абсцессами после дренирования под УЗИ контролем улучшение наступило у 11 (91,7%), летальный исход у 1 (8,3%) от сепсиса и ПОН. В 10 (18,5%) наблюдениях после видеолапароскопии и дренирования брюшной полости, выполненной в экстренном порядке по поводу ферментативного перитонита, не было достигнуто положительной динамики, а было отмечено нарастание интоксикации на фоне прогрессирования перитонита или забрюшинной флегмоны. В этих случаях лапароскопическое дренирование мы рассматривали как первый этап выведения больного из септического состояния и подготовки его к открытой операции. В срочном порядке им в качестве второго этапа выполняли верхнесрединную лапаротомию, некрсеквестрэктомию, оментобурсостомию, сквозное дренирование забрюшинной клетчатки, а при необходимости выполняли люмботомию. При этом проводили ревизию и вскрытие гнойных затеков брюшной полости и забрюшинного пространства, вскрытие абсцессов поджелудочной железы, некрсеквестрэктомию с санацией брюшной полости сквозным дренированием сальниковой сумки, дренированием ретроперитонеального пространства. Среди этих 10 пациентов улучшение состояния было отмечено у 5, а 5 больных скончались от сепсиса, ПОН и гнойной интоксикации. У 32 пациентов с инфицированным панкреонекрозом (в основной группе – 17, в контрольной группе – 15 больных) в сроки от 2 до 4 недель после начала заболевания выполняли открытую хирургическую санацию гнойно-некротического очага, дополненную сквозным дренированием сальниковой сумки и забрюшинной клетчатки.
Закрытый непрерывный лаваж проводили в среднем в течение 15-30 дней антисептическими растворами до 5 л в сутки. Выполнение повторных операций потребовалось 12 больным. Показаниями к санационной релапаротомии были: нарастание симптоматики сепсиса и ПОН на фоне неадекватного функционирования дренажной системы (5 пациентов); клинико- инструментально и микробиологически доказанные случаи прогрессирования гнойного процесса в ПЖ, забрюшинном пространстве, брюшной полости (4 больных); аррозивное кровотечение из сосудов брюшной полости и забрюшинного пространства (3 пациента).
Оперированные по поводу инфицированного панкреонекроза пациенты основной группы находились в ОРИТ в среднем 29,1±2,9 койко/дней, (больные контрольной группы – 36,8±2,3 койко/ дней (разброс от 18 до 141 дн.), а сроки лечения пациентов со стерильным панкреонекрозом составили 21,6±1,4 в основной группе и 25,7±2,5 койко/дней в контрольной группе (разброс от 10 до 36 дн.).
Среди 79 пациентов с острым отечным панкреатитом летальных исходов не было. Общая летальность среди 173 больных с ОДП составила 18,5% (32 пациента). У больных стерильным панкреонекрозом летальность в контрольной группе составила 18,3%, в основной группе – 5,1%, у лиц с инфицированным панкреонекрозом летальность составила 42,8 % в контрольной группе и 23,1% в основной группе (табл. 15).
Таблица 15
Продолжительность лечения и летальность в зависимости от формы острого панкреатита
| Форма заболевания | Группа больных | Кол-во больных | Койко/день (M±m) | Летальность | |
| Абс | % | ||||
| Острый отечный панкреатит | Осн. Контр. | 39 40 | 9,5±0,9 (7-15) 13,6±0,8 (8-19) | - - | - - |
| Стерильный панкреонекроз | Осн. Контр. | 59 60 | 21,6±1,4 (10-33) 25,7 ±2,5 (12-36) | 3 11 | 5,1 18,3 |
| Инфицированный Панкреонекроз | Осн. Контр. | 26 28 | 29,1±2,9 (21-49) 36,8±2,3 (18-141) | 6 12 | 23,1 42,8 |
| Всего | 252 | 32 | 12,7 | ||
Данные табл. 15 свидетельствуют, что дополнение традиционной терапии ОП сеансами НИЛИ позволило уменьшить сроки стационарного лечения по сравнению с контрольной группой: при остром отечном панкреатите на 30,1%, стерильном панкреонекрозе – на 15,9%, инфицированном панкреонекрозе – на 20,9%. Если учесть, что подавляющее большинство больных (74,9%) были в трудоспособном возрасте, то сокращение сроков стационарного лечения и снижение летальности при ОП представляет большое социально-экономическое значение.
Проведение курса НИЛИ у больных стерильным панкреонекрозом и ферментативным перитонитом после видеолапароскопического дренирования брюшной полости способствовало восстановлению показателей Т- и В- лимфоцитов и их субпопуляций (СД3+ - 71,13±3.56 % и 1,24 ±0,07х10^9/л; СД4+ - 43,8±4,3% и 0,8±1,9х10^9/л; СД19+ - 10,8±1,26% и 0,16±0,03х10^9/л), снижению уровня лейкоцитов (7,1±1,2х10^9/л) и лейкоцитарно-Т-лимфоцитарного индекса с 13,7±5,2 до нормы (5,72±5,2) (р<0.05). Подобный иммуномодулирующий эффект НИЛИ предотвращал инфицирование очагов панкреонекроза и тем самым способствовал снижению летальности (рис.7)
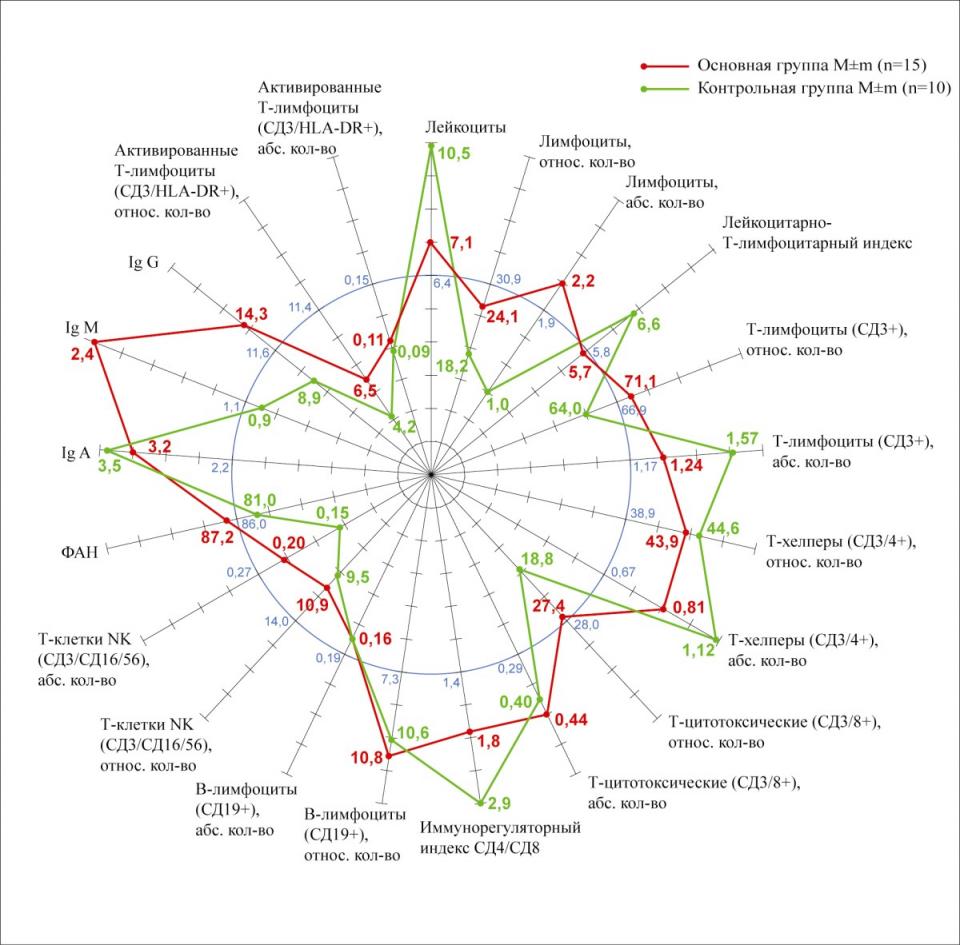
Рис.7. Иммунограмма больных со стерильным панкреонекрозом после применения НИЛИ
После проведения курса НИЛИ, мини-инвазивных и традиционных методов хирургического лечения больных инфицированным панкреонекрозом мы наблюдали восстановление показателей Т-клеточного звена иммунитета СД3+ и СД4+ как в относительном, так и в абсолютном показателе (71,13±7,2%, 1,19±0,15 и 43,2±5,7%, 0,99±0,12х10^9/л соответственно) которые оставались выше нормы, на фоне нормализации уровня Т-цитотоксических клеток СД8+, В-лимфоцитов и маркеров активации Т-лимфоцитов: СД8+ - 28,78±4,4% и 0,362±0,08x10^9/л; СД19+ - 9,44±2.6% и 0,15±0,02x10^9/л; СД3/HLA-DR+ - 12,3±1,1% и 0,146±0,07x10^9/л соответственно. В обеих группах больных уровень иммуноглобулинов А, М, G оставались выше нормы, а фагоцитарная активность и активация маркеров Т-лимфоцитов - ниже нормы (р<0,05) (рис.8).

Рис.8. Иммунограмма больных с инфицированным панкреонекрозом после хирургической санации гнойно-некротического очага и сеансов НИЛИ
Таким образом, у больных с инфицированным панкреонекрозом, после хирургической санации гнойно-некротического очага на фоне базисной терапии, потенцированной сеансами НИЛИ-ВЛОК местной, транскутанной лазеротерапии парапанкреатических зон мы наблюдали отчетливую тенденцию к восстановлению количества лейкоцитов, Т- и В-лимфоцитов и уровня маркеров активации Т-лимфоцитов, что в конечном итоге способствовало снижению частоты осложнений и летальности.
В целях оптимизации лечебной тактики нами предложена оригинальная схема диагностики и лечения ОП (рис.9). Как видно из представленного алгоритма, применением лабораторных тестов, динамического УЗИ, КТ, и видеолапароскопии можно достоверно установить форму, оценить тяжесть и объём поражения ПЖ, выявить осложнения панкреонекроза, позволяющие оптимизировать тактику лечения больных ОП на основе применения разработанной нами схемы НИЛИ.
В отдаленные сроки (от 6 мес. до 3-х лет) нами обследованы 103 больных (73,1%) из числа 141 выживших пациентов с ОДП.
Обследования, основанные на применении клинико–лабораторных методов и УЗИ у 49 (34,8%) пациентов позволили обнаружить клинические проявления хронического панкреатита, у 18 (12,8%), выявить наличие постнекротических кист ПЖ, у 16 (11,4%) – ЖКБ и ХКХ, у 9 (6,4%) сахарный диабет 2 типа, у 12 (8,5%) послеоперационные вентральные грыжи, а 13 пациентов (9,2%) были госпитализированы с рецидивом заболевания на фоне хронической алкогольной интоксикации.
Для функциональной реабилитации и улучшения качества жизни у 14 больных с постнекротическими ложными кистами поджелудочной железы была выполнена цистогастростомия по Юрашу с применением СО2- и полупроводникового лазера «Аткус–15» по разработанной в ФГУ «ГНЦ ЛМ ФМБА России» методике. Путем лазерной вапоризации внутренней оболочки кисты обеспечивали надежный гемостаз и предотвращали рецидив заболевания. У всех оперированных пациентов было отмечено гладкое послеоперационное течение, рецидива в отдаленные сроки не было.
Плановая лапароскопическая холецистэктомия была выполнена 4 пациентам, холецистэктомия с применением инструментов «мини-ассистент» – 5, лапаротомия и внутреннее дренирование псевдокист хвоста ПЖ у 3 пациентов, а у 6-ти больных было выполнено грыжесечение.
В отдаленные сроки у 32 (29,9 %) больных из числа 103 обследованных, успешно были выполнены различные оперативные вмешательства, направленные на улучшение качества жизни пациентов, что указывает на необходимость диспансерного наблюдения всех пациентов, перенесших ОДП.
Таким образом, включение в схему комплексного лечения ОДП сеансов НИЛИ-ВЛОК, местной, транскутанной комбинированной лазеротерапии, мини-инвазивных вмешательств и лапароскопического дренирования, благодаря восстановлению параметров иммунного статуса, позволило в 67,7% наблюдениях предотвратить инфицирование очагов деструкции и снизить летальность с 26,1 до 10,6%. Полученные нами результаты свидетельствуют об эффективности и целесообразности применения комбинированной НИЛИ при всех клинико-морфологических формах ОП.
СХЕМА ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОСТРОГО ПАНКРЕАТИТА
| Видеолапароскопия |
Рис.9 Диагностический алгоритм лечения ОП с применением НИЛИ
Выводы
- Диагностический алгоритм при остром панкреатите с применением лабораторных тестов, динамического УЗИ, КТ, РТМ и видеолапароскопии позволяет с высокой точностью верифицировать форму заболевания, фазы течения, оценить масштабы панкреонекроза, наличие местных и системных осложнений и тем самым оптимизировать тактику лечения.
- Скрининговым методом диагностики ОДП является УЗИ, чувствительность которого составляет 91,7%, специфичность – 97,2%, а диагностическая точность – 93,2%. КТ позволяет достоверно верифицировать объем панкреонекроза и прогнозировать течение заболевания. При индексе тяжести CTSI 7-10 летальность составляет 15,3%. Информативность РТМ составляет 20% и лишь при крупноочаговых и обширных панкреонекрозах.
- Переход острого отечного панкреатита в панкреонекроз сопровождается генерализованной активацией ПОЛ (МДА – 4,06±0,18 ммоль/л), угнетением системы антиоксидантной защиты (SH-гр.–0,27±0,05мµ), резким нарастанием эндотоксемии (СМ – 0,82±0,04 ед.), высоким лейкоцитарно-Т- лимфоцитарным индексом (13,7±5,7) на фоне снижения показателей Т-лимфоцитов и их субпопуляций (СД3+- 57,0±2,01%, 0,79±0,031х10^9/л), увеличением относительных показателей В-лимфоцитов (СД19+)– 19,16±1.2% и содержания естественных киллеров СД3/СД16/56 до 16,9±1,2% на фоне снижения абсолютного значения лимфоцитов (0,94±0,09x10^9/л) и ФАН (81,67±1,3%), что указывает на развитие иммунной агрессии на воспалительно-некротический очаг.
- Иммунный статус у пациентов с инфицированным панкреонекрозом характеризуется пан-Т-лимфоцитемией (СД3+-72,35±2,3%, СД4+ -40,5± 1,7%, СД8+-0,393±0,11х10^9/л), низким уровнем ФАН (80,2±1,2%), маркеров активации Т–лимфоцитов (8,09±1,2%, и 0,09±0,03х10^9/л) на фоне стойкого повышения содержания Ig G (14,2±1,3г/л) что является признаками инфицирования очагов деструкции и развития гнойно-воспалительных осложнений.
- Комплексное воздействие НИЛИ-терапии, независимо от клинико-морфологических форм ОП, способствует нормализации количества лейкоцитов, восстановлению уровней Т и В-лимфоцитов и их субпопуляций, а также уменьшению степени аутоагрессии. Подобный иммуномодулирующий эффект лазерной терапии ускоряет купирование патологического процесса в ПЖ.
- Включение в схему консервативного лечения острого отечного панкреатита низкоинтенсивной лазерной и антиоксидантной терапии способствует эффективному подавлению секреторной активности и степени аутоагрессии поджелудочной железы, уменьшению частоты развития осложнений и сокращению сроков выздоровления больных на 30,1%.
- Комплексная терапия стерильного панкреонекроза с применением ВЛОК в сочетании с местной (транскутанной) лазеротерапией, мини-инвазивных и эндоскопических вмешательств позволила в 67,7% случаев предотвратить инфицирование очагов деструкции, сократить сроки стационарного лечения и снизить летальность по сравнению с контрольной группой на 13,2%.
- У больных с инфицированным панкреонекрозом, после адекватной хирургической санации гнойно-некротического очага на фоне базисной терапии, ВЛОК и местной транскутанной лазеротерапии способствует снижению летальности с 42,8 до 23,1%.
- При постнекротических кистах ПЖ методом выбора является наложение цисто-гастроанастомоза по Юрашу, с комбинированным использованием СО2 и полупроводникового лазера, с лазерной вапоризацией внутренней оболочки кисты для надежности гемостаза и профилактики рецидива кисты.
- В отдаленные сроки у большинства пациентов, перенесших ОДП, наблюдаются осложнения в виде: хронического панкреатита (34,8%), псевдокисты поджелудочной железы (12,8%), ЖКБ, хронического калькулезного холецистита (11,4%), послеоперационных вентральных грыж (8,5%), сахарного диабета (6,4%) или рецидива заболевания на фоне хронической алкогольной интоксикации (9,2%), что требует диспансерного наблюдения и проведения, реабилитационных мер, направленных на улучшение качества жизни пациентов.
Практические рекомендации
- В диагностическую программу острого деструктивного панкреатита (панкреонекроза) следует включить лабораторные тесты по определению амилазы крови, ПОЛ, СМ, ЛИИ, динамическое УЗИ, КТ, ФГДС и видеолапароскопию, которые позволяют достоверно верифицировать объём деструкции ПЖ, окружающей клетчатки и прогнозировать течение заболевания. При этом прогностически неблагоприятными факторами являются объём зоны некроза более 50%, наличие субтотально- тотального смешанного и геморрагического панкреонекроза, забрюшинной флегмоны.
- При стерильном панкреонекрозе ограниченные жидкостные образования следует дренировать под контролем УЗИ, а при разлитом ферментативном перитоните необходимо видеолапароскопическое дренирование брюшной полости. При инфицированном панкреонекрозе необходимо дренировать перипанкреатические абсцессы под контролем УЗИ/КТ. Во время полостных операций, в целях обеспечения надежного гемостаза, рекомендуем выполнять лазерную некрэктомию с применением СО2- лазера.
- При постнекротических кистах ПЖ, формирование цисто-гастроанастомоза следует осуществлять с помощью СО2- и полупроводниковых лазеров, обязательно проводя лазерную вапоризацию внутренней оболочки кисты, обеспечивающую надежный гемостаз и предотвращающую развитие рецидивов заболевания.
- Сеансы внутривенного лазерного облучения крови следует начинать с первых суток госпитализации полупроводниковым лазерным аппаратом «Мулат», мощностью 5 мВт, экспозицией 40 мин., общим количеством сеансов 10 на фоне антиоксидантной терапии Мексидолом (5%-4,0 в/м в сутки). Транскутанное лазерное облучение следует проводить аппаратами «Милта-Ф» и « Мустанг» (длиной волны – 0,89 мВт) с излучающими импульсными головками ЛО-2, ЛО-3 в проекции парапанкреатических зон по разработанной нами методике.
- Все пациенты, перенесшие ОДП, в целях функциональной реабилитации и улучшения качества жизни, подлежат диспансерному наблюдению.
Список опубликованных работ
- Гульмурадов Т.Г., Гульмурадова Н.Т. Диагностика и лечебная тактика при остром деструктивном панкреатите // Проблемы гастроэнтерологии.- Душанбе. - 2007, №4, С.221-222.
- Geynits A.V., Gulmuradova N.T., Maksimenkov A.V. Complex application of low-level laser antioxidant therapy for treating acute pancreatities.// Photodiagnosis and Photodynamic therapy. Abstracts. - Helsinki, Finland.-2008. С.36
- Гейниц А.В, Гульмурадова Н.Т. Внутривенное лазерное облучение крови и антиоксидантная терапия в лечении острого панкреатита // «Лазеры в науке, технике и медицине» Сб. науч.тр. М.2008. МНТОРЭС им. А.С.Попова, т.19, с.69-71.
- Гульмурадова Н.Т., Гейниц А.В. Роль низкоинтенсивной лазерной терапии в лечении острого панкреатита. Всероссийская научно-практическая конференция с международным участием: «Современные алгоритмы диагностики и стандарты лечения в клинической медицине», Москва.- 2008, С.13-14.
- Гульмурадова Н.Т., Гейниц А.В., Парзян Г.Р. Низкоинтенсивная лазерная и антиоксидантная терапия при остром панкреатите //Доклады Академии наук Республики Таджикистан, Душанбе. – 2009, том 52.-№1.- С.70-74
- Geynits A.V., Gulmuradova N.T. Low-level laser therapy for treating acute pancreatities // Photodiagnosis and Photodynamic therapy. Abstracts. - Helsinki, Finland.- 2010. С 34.
- Гульмурадова Н.Т., Корнев А.В, Максимова И.И. Возможности лучевой диагностики острого деструктивного панкреатита // Доклады Академии наук Республики Таджикистан.- 2011, том 54, №5, С.402-407
- Гейниц А.В., Гульмурадова Н.Т., Успенская Т.З.. Острый деструктивный панкреатит – возможности оптимизации лечения комбинированным применением лазерного излучения // Хирургия журнал им. Н.И. Пирогова. - 2011, №7, с.56-62.
- Гульмурадова Н.Т. Лечение острого панкреатита с применением низкоинтенсивного лазерного излучения // Вестник Авиценны (Паеми Сино) ТГМУ, Душанбе. – 2011, №3, с.30-34.
- Гейниц А.В, Гульмурадова Н.Т., Люлько Л.С. Применение высокоэнергетического лазерного излучения при хирургическом лечении постнекротических кист поджелудочной железы // Московский хирургический журнал, 2011, №4 (20), с.42-44.
- Гейниц А.В, Гульмурадова Н.Т. Комбинированное применение лазерного излучения в лечении острого деструктивного панкреатита // Лазерная медицина.- 2011, том 15, вып.2, с. 29-30.
- Гульмурадова Н.Т., Гейниц А.В. Эффекты влияния комбинированной низкоинтенсивной лазерной и антиоксидантной терапии при остром панкреатите // Лазерная медицина, 2011, том 15. №4, с.14-17.
- Гульмурадова Н.Т., Гейниц А.В. Оптимизация лечения острого деструктивного панкреатита с применением малоинвазивных вмешательств и лазерного излучения // Проблемы гастроэнтерологии, 2011, №2, с. 67-70.
- Гульмурадова Н.Т. Комплексное лечение острого панкреатита с применением низкоинтенсивного лазерного излучения //Лазерная медицина. - 2011, том 15, №3, С.7-11
- Гульмурадова Н.Т., Гейниц А.В Комплексное лечение острого деструктивного панкреатита с применением малоинвазивных вмешательств и лазерного излучения // Московский хирургический журнал, 2011, №4 (20), с. 5-9.
- Винницкий Л.И., Бунятян К.А., Гульмурадова Н.Т. Влияние низкоинтенсивного лазерного излучения (НИЛИ) на состояние иммунной регуляции при различных формах острого панкреатита // Иммунология и аллергология.-2011, Т.12, №3, с.289.
- Гульмурадова Н.Т. Влияние низкоинтенсивного лазерного излучения на состояние клеточного и гуморального иммунитета при остром панкреатите //Известия Академии наук Республики Таджикистан. Отделение биологических и медицинских наук – 2011.№1(174), с. 115-120.
- Гульмурадова Н.Т. Хирургическая тактика при остром деструктивном панкреатите // Здравоохранение Таджикистана. 2011.№3, с.35-39.
- Гульмурадова Н.Т., Смольников П.В. Влияние лазерного излучения на иммунный статус у больных с острым панкреатитом //Вестник интенсивной терапии. - 2011.№3, С.33-35.
- Гейниц А.В., Гульмурадова Н.Т., Гульмурадов Т.Г. Низкоинтенсивная лазерная терапия в лечении острого панкреатита. Душанбе. ООО «Сармад-компания», 2011, 126с.
- Гульмурадова Н.Т., Гейниц А.В. Применение лазерных технологий в лечении острого деструктивного панкреатита //Альманах Института хирургии им. А.В. Вишневского - 2011, Т.6, №2, с.178
- Гульмурадова Н.Т., Лазерные технологии в комплексном лечении острого деструктивного панкреатита.// Материалы V съезда хирургов Таджикистана. Душанбе, 14 октября 2011., с.102-103.
СПИСОК ПРИНЯТЫХ СОКРАЩЕНИЙ.
| АлАт | – Аланинаминотрансфераза |
| АсАт | – Аспартатаминотрансфераза |
| БДС | – Большой дуоденальный сосочек |
| ВЛОК | – Внутривенное лазерное облучение крови |
| ДПК | – Двенадцатиперстная кишка |
| ЖКБ | – Желчнокаменная болезнь |
| ИПН | – Инфицированный панкреонекроз |
| КБ | – Карбонилы |
| КТ | – Компьютерная томография |
| ЛИИ | – Лейкоцитарный индекс интоксикации |
| МДА | – Малоновый диальдегид |
| НИЛИ | – Низкоинтенсивное лазерное излучение |
| ОДП | – Острый деструктивный панкреатит |
| ОП | – Острый панкреатит |
| ООП | – Острый отечный панкреатит |
| ОРИТ | – Отделение реанимации и интенсивной терапии |
| ПЖ | – Поджелудочная железа |
| ПОЛ | – Перекисное окисление липидов |
| ПОН | – Полиорганная недостаточность |
| РТМ | – Радиотермометрия |
| СМ | – Средние молекулы |
| СО2 - | – Углекислотный лазер |
| УЗИ | – Ультразвуковое исследование |
| ФАН | – Фагоцитарная активность нейтрофилов |
| ФГДС | – Фиброгастродуоденоскопия |
| ХКХ ЧСС | – хронический калькулезный холецистит – Частота сердечных сокращений |
| ЭПСТ | – Эндоскопическая папилосфинктеротомия |
| ЭРХПГ | – Эндоскопическая ретроградная холангио-панкреатография |

