Состояние сердечно-сосудистой системы при кардиальной автономной нейропатии у больных сахарным диабетом типа 2 в зависимости от наличия метаболического синдрома
На правах рукописи
ЛУНИНА Елена Юрьевна
СОСТОЯНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
ПРИ КАРДИАЛЬНОЙ АВТОНОМНОЙ НЕЙРОПАТИИ У БОЛЬНЫХ
САХАРНЫМ ДИАБЕТОМ ТИПА 2 В ЗАВИСИМОСТИ ОТ НАЛИЧИЯ
МЕТАБОЛИЧЕСКОГО СИНДРОМА
14.01.05 – Кардиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Тверь - 2011
Работа выполнена в Государственном образовательном учреждении высшего
профессионального образования «Тверская государственная медицинская академия»
Министерства здравоохранения и социального развития Российской Федерации
на кафедре общеврачебной практики и профилактической медицины с курсом основ
доказательной медицины
Научный руководитель:
доктор медицинских наук,
профессор Петрухин Игорь Сергеевич
Официальные оппоненты:
доктор медицинских наук,
профессор Мазур Евгений Станиславович
доктор медицинских наук,
профессор Поздняков Юрий Михайлович
Ведущая организация:
Федеральное государственное учреждение «Государственный научно-исследовательский центр профилактической медицины» Министерства здравоохранения и социального
развития Российской Федерации
Защита состоится «_____»______________2011 г. в ____ часов на заседании
Диссертационного совета Д 208.099.01 при ГОУ ВПО Тверская ГМА
Минздравсоцразвития России по адресу: 170100, г. Тверь, ул. Советская, д. 4
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Тверская ГМА
Минздравсоцразвития России и на сайте www.tvergma.ru
Автореферат разослан «_____»____________ 2011 г.
Ученый секретарь диссертационного совета,
кандидат медицинских наук,
доцент В.В. Мурга
Список сокращений и условных обозначений
АД артериальное давление
ВарАД вариабельность АД
ВИР время изоволюметрического
расслабления
ВОЗ Всемирная организация
здравоохранения
ВРС вариабельность ритма сердца
ДАД диастолическое АД
ДИ доверительный интервал
ИВ индекс времени
ИММЛЖ индекс массы миокарда ЛЖ
ИМТ индекс массы тела
КАН кардиальная автономная
нейропатия
ЛЖ левый желудочек
ММЛЖ масса миокарда ЛЖ
МС метаболический синдром
н.е. нормализованные единицы
ОБ окружность бедер
ОПЦ прогностическая ценность
отрицательного результата теста
ОТ окружность талии
ОТС относительная толщина стенок
ОШ отношение шансов
ППЦ прогностическая ценность
положительного результата теста
САД систолическое АД
СД сахарный диабет
СД 2 сахарный диабет типа 2
СНС АД степень ночного снижения АД
ТГ триглицериды
ТЗСЛЖ толщина задней стенки ЛЖ
ТМЖП толщина межжелудочковой
перегородки
ХС холестерин
ЛПВП липопротеиды высокой
плотности
ЛПНП липопротеиды низкой плотности
ЧСС частота сердечных сокращений
E/A отношение скоростей раннего и позднего диастолического наполнения ЛЖ
HF высокочастотный компонент
спектра ВРС
LF низкочастотный компонент
спектра ВРС
pNN50% процент последовательных интервалов NN, различие между которыми превышает 50 мс
RMSSD квадратный корень из среднего квадратов разностей величин последовательных пар интервалов NN
S площадь под характеристической кривой
SDNN стандартное отклонение величин интервалов NN за весь период
Se чувствительность теста
Sp специфичность теста
TP общая мощность спектра ВРС
VLF очень низкочастотный компонент ВРС
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
Сахарным диабетом (СД) во всем мире страдают 246 млн. человек. По оценкам Международной Федерации Диабета (2008), ожидается, что к 2025 году это число увеличится до 380 млн., что составит 7,1% всего взрослого населения планеты. В России 8 млн. (5%) человек страдают СД, из них 90% – СД типа 2 (СД 2). В 60% случаев больные СД погибают от кардиоваскулярных расстройств и в 10% – от цереброваскулярных осложнений, причем сердечно-сосудистая патология как причина смертности у пациентов СД 2 занимает лидирующее место практически во всех странах мира (Дедов И.И., 2003; Betteridge, D. J., 2001).
Кардиальная автономная нейропатия (КАН) – позднее осложнение СД 2, которое ухудшает качество жизни пациентов и повышает риск внезапной смерти (Верткин А.Л., 2005; Vinik A., 2003, 2007). Диагностика КАН при СД представляет определенные трудности. Бессимптомное течение указанного осложнения не позволяет диагностировать его на ранних стадиях (Boulton A.J., 2005; Vinik A.I., Ziegler D., 2007). Появление таких признаков, как ортостатическая гипотензия, безболевой инфаркт миокарда и тахикардия покоя, на которых базируется диагностика КАН, свидетельствует о далеко зашедшем процессе. Современными исследованиями доказано, что КАН до определенной степени обратима при условии своевременного лечения (Стаценко М.Е., 2009; Gaede P., 2003; Pop-Busui R., 2009).
СД 2 рассматривается в качестве одного из компонентов метаболического синдрома (МС), в основе формирования которого ведущую роль играет инсулинорезистентность (Alberti, K.G., 2005; Grundy S.M., 2005; Eckel R.H., 2005; Zimmet P.Z., 2005; Reaven G.M., 1993, 2007). Главная роль в развитии автономной дисфункции также отводится гиперинсулинемии/ инсулинорезистентности (Isomaa B., 2001; Manzella D., Paolisso G., 2005). Несмотря на существование общих патогенетических механизмов формирования МС и КАН, связь между развитием нарушений вегетативной регуляции сердечной деятельности и МС при СД 2 практически не изучена. Вместе с тем, выявление возможной ассоциации между КАН и МС, а также выяснение состояния сердечно-сосудистой системы у больных СД 2 с различными проявлениями МС помогло бы расширить представление о КАН и разработать критерии ранней диагностики данного осложнения.
Цель исследования
Изучить состояние сердечно-сосудистой системы при кардиальной автономной нейропатии у больных сахарным диабетом типа 2 в зависимости от наличия метаболического синдрома, а также выявить и охарактеризовать возможную связь между метаболическим синдромом и кардиальной автономной нейропатией для совершенствования диагностики данного осложнения.
Задачи исследования
- Определить распространенность кардиальной автономной нейропатии у больных
СД 2 в зависимости от наличия метаболического синдрома. - В группах больных СД 2 с различными сочетаниями кардиальной автономной нейропатии и метаболического синдрома провести сравнительный анализ выраженности отдельных составляющих метаболического синдрома: уровней систолического и диастолического артериального давления; выраженности абдоминального ожирения; показателей липидных фракций крови; показателей углеводного обмена.
- Изучить вегетативную регуляцию сердечной деятельности при кардиальной автономной нейропатии у больных СД 2, имеющих и не имеющих метаболический синдром.
- Выявить особенности суточного профиля артериального давления, характерные для кардиальной автономной нейропатии, у больных СД 2 в зависимости от наличия метаболического синдрома.
- Изучить характер ремоделирования левого желудочка сердца при кардиальной автономной нейропатии у больных СД 2 с метаболическим синдромом и без него.
- Оценить состояние диастолической функции левого желудочка сердца при кардиальной автономной нейропатии у больных СД 2 в зависимости от наличия метаболического синдрома.
- Оценить операционные характеристики тестов диагностики кардиальной автономной нейропатии у больных СД 2, имеющих и не имеющих метаболический синдром, и сформулировать подходы к ранней диагностике кардиальной автономной нейропатии у таких пациентов.
Научная новизна
- Впервые установлено, что у больных СД 2 кардиальная автономная нейропатия ассоциируется с метаболическим синдромом. Она чаще встречается у пациентов с метаболическим синдромом по сравнению с больными СД 2 без метаболического синдрома.
- Впервые комплексно изучено состояние сердечно-сосудистой системы при кардиальной автономной нейропатии у больных СД 2 в зависимости от наличия у них метаболического синдрома.
- Впервые обнаружено, что кардиальная автономная нейропатия ассоциируется с недостаточным ночным снижением артериального давления у больных СД 2 независимо от наличия метаболического синдрома. Показано, что для кардиальной автономной нейропатии типичным является повышение вариабельности артериального давления в дневное время у пациентов без метаболического синдрома, а у лиц с метаболическим синдромом – снижение вариабельности давления днем и ее увеличение в ночные часы.
- У больных СД 2 впервые установлено, что в отсутствие метаболического синдрома кардиальная автономная нейропатия не сопровождается гипертрофией левого желудочка, тогда как в присутствии метаболического синдрома она ассоциируется с концентрической гипертрофией левого желудочка независимо от пола и возраста пациентов, уровней артериального давления, а также степени тяжести диабета.
- Впервые продемонстрирован синергизм между кардиальной автономной нейропатией и метаболическим синдромом в их негативной связи с диастолической функцией левого желудочка у больных СД 2, что проявляется более высокой распространенностью диастолической дисфункции в случае сочетания кардиальной автономной нейропатии и метаболического синдрома, чем при каждом из указанных состояний в отдельности.
- Впервые определено, что показатели чувствительности, специфичности и прогностической ценности стандартных рефлекторных сердечно-сосудистых тестов и параметров вариабельности ритма сердца, рекомендованных для диагностики кардиальной автономной нейропатии, у больных СД 2 снижаются в присутствии метаболического синдрома по сравнению с его отсутствием.
Положения, выносимые на защиту
- Кардиальная автономная нейропатия у больных СД 2 ассоциируется с метаболическим синдромом.
- Характер и степень выраженности изменений состояния сердечно-сосудистой системы у больных СД 2, осложненным кардиальной автономной нейропатией, зависит от наличия у них метаболического синдрома.
- Показатели чувствительности, специфичности и прогностической ценности тестов диагностики кардиальной автономной нейропатии (стандартные тесты Эвинга и параметры TP и HF вариабельности ритма сердца) у больных СД 2 в присутствии метаболического синдрома ниже, чем в его отсутствие.
Практическая значимость работы
В настоящем исследовании продемонстрирована взаимосвязь между кардиальной автономной нейропатией и метаболическим синдромом, в связи с чем для своевременной диагностики кардиальной автономной нейропатии у больных сахарным диабетом типа 2, имеющих метаболический синдром, предлагается проводить рефлекторные сердечно-сосудистые пробы. Показано, что диагностическая ценность стандартных рефлекторных сердечно-сосудистых проб и показателей вариабельности ритма сердца, рекомендованных для диагностики кардиальной автономной нейропатии при сахарном диабете типа 2, различается в зависимости от наличия у пациентов метаболического синдрома. Предложено проведение разного набора рефлекторных тестов у пациентов, имеющих и не имеющих метаболический синдром. Также определены точки разделения больных сахарным диабетом типа 2 на имеющих и не имеющих кардиальную автономную нейропатию по частотным показателям вариабельности ритма сердца в зависимости от присутствия метаболического синдрома.
Обоснована необходимость проведения суточного мониторирования артериального давления для контроля гипотензивной терапии, особенно в ночные часы, а также эхокардиаграфии для оценки характера ремоделирования левого желудочка сердца и диагностики его диастолической дисфункции у больных сахарным диабетом типа 2, осложненным кардиальной автономной нейропатией.
Разработанные по результатам исследования дифференцированные подходы к ранней диагностике кардиальной автономной нейропатии у больных СД 2 в зависимости от наличия метаболического синдрома могут быть использованы в других лечебных учреждениях, что позволит совершенствовать диагностику данного осложнения сахарного диабета и, тем самым, будет способствовать оптимизации тактики ведения данной категории больных.
Внедрение результатов исследования
Результаты исследования внедрены в практику лечебно-диагностической деятельности эндокринологического отделения ГУЗ «Областная клиническая больница» и поликлиники №1 МУЗ «Городская клиническая больница № 7» г. Твери. Основные положения диссертационной работы включены в программу обучения студентов 5-го и 6-го курсов лечебного факультета и используются в преподавании на кафедре общеврачебной практики и профилактической медицины с курсом основ доказательной медицины ГОУ ВПО Тверская ГМА Минздравсоцразвития России.
Апробация работы
Основные результаты диссертационного исследования были изложены на Российском национальном конгрессе кардиологов (Томск, 2004); на съезде кардиологов и терапевтов Центрального Федерального округа России (Тверь, 2009); на четвертом Национальном конгрессе терапевтов (Москва, 2009); на российской конференции «Артериальная гипертония: спорные и нерешенные вопросы» (Ярославль, 2009); на 44-м ежегодном научном конгрессе Европейского общества клинических исследований (Бари, Италия, 2010); на российской научно-практической конференции «Современные подходы к диагностике и лечению сердечно-сосудистых заболеваний» (Санкт-Петербург, 2010); на международной конференции «Современная кардиология: эра инноваций» (Томск, 2010); на заседании Тверского отделения Всероссийского научного общества терапевтов и кардиологов (2010). Апробация состоялась на совместном заседании кафедры госпитальной терапии с курсом профессиональных болезней и кафедры общеврачебной практики и профилактической медицины с курсом основ доказательной медицины ГОУ ВПО Тверская ГМА Минздравсоцразвития России 16.12.2010 г.
Публикации результатов исследования
По теме диссертации опубликовано 11 работ, в том числе 2 статьи – в рецензируемых журналах, рекомендованных ВАК для публикации результатов диссертационных работ.
Структура и объем диссертации
Диссертация изложена на 170 страницах формата А4, состоит из введения, обзора литературы, описания материала и методов исследования, пяти глав собственных наблюдений, обсуждения полученных результатов, выводов, практических рекомендаций и списка использованной литературы. Список литературы включает 307 источников, в том числе 83 работы отечественных и 224 – зарубежных авторов. Работа иллюстрирована 35 таблицами и 15 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Для решения поставленных задач проведено комплексное клиническое и инструментальное обследование 157 пациентов (128 женщин и 29 мужчин), находившихся на стационарном лечении в эндокринологическом отделении ГУЗ «Областная клиническая больница» г. Твери. Дизайн исследования – одномоментное поперечное.
Критериями включения в исследование служили: диагноз СД 2, установленный в соответствии с диагностическими критериями ВОЗ, 1999 г; возраст от 35 до 70 лет. Критерии исключения: клинически выраженная ишемическая болезнь сердца, тяжелые нарушениями ритма и проводимости, пороки сердца, острое нарушение мозгового кровообращения в анамнезе, фракция выброса левого желудочка (ЛЖ) менее 50%, локальные нарушения сократимости миокарда, выявленные при эхокардиографии, почечная недостаточность.
Обследование включало измерение роста и массы тела с вычислением индекса массы тела (ИМТ), определение окружности талии (ОТ) и бедер (ОБ) с расчетом отношения ОТ/ОБ, двукратное измерение артериального давления (АД) на правой руке. Концентрации общего холестерина (ХС) сыворотки крови, ХС липопротеидов высокой плотности (ЛПВП) (после преципитации апо-В-содержащих липопротеидов фосфорновольфрамовой кислотой и хлоридом магния) и триглицеридов (ТГ) определяли энзиматическим колориметрическим методом с использованием наборов реагентов «Холестерин ФС «ДДС»» и «Триглицериды ФС «ДДС» (ЗАО «Диакон – ДС», РФ). Концентрацию ХС липопротеидов низкой плотности (ЛПНП) вычисляли по формуле Friedewald (1972 г.). В обследование также включалось измерение глюкозы цельной капиллярной крови натощак глюкозооксидазным методом и гликированного гемоглобина.
МС устанавливали по критериям ВОЗ (1999). КАН диагностировали по результатам набора стандартных рефлекторных сердечно-сосудистых тестов (тесты Эвинга) с регистрацией электрокардиограммы. Тесты выполнялись по стандартному протоколу (Ewing D.J., 1985) в следующем порядке: тест глубокого дыхания, маневр Вальсальвы, ортостатическая проба с оценкой ответа частоты сердечных сокращений (ЧСС) и АД на вставание. Каждый тест повторяли трижды с вычислением среднего значения результата и последующей оценкой результата по 2-балльной шкале: 0 – нормальный результат, 1 – пограничный результат, 2 – патологический результат. Критерием КАН считали патологические результаты двух и более тестов или балл автономной нейропатии 4. С учетом наличия МС и КАН все больные СД 2 были разделены на 4 группы: группа 1 (КАН–, МС–) – 14 человек; группа 2 (КАН–, МС+) – 16 человек; группа 3 (КАН+, МС–) – 19 человек; группа 4 (КАН+, МС+) – 108 человек.
Анализ вариабельности ритма сердца (ВРС) проводился статистическим, геометрическим методами и методом вариационной пульсометрии по Р.М. Баевскому (1984), а также спектральным методом после записи 5-минутных участков ритмограмм с использованием программно-аппаратного комплекса «РИТМ» в составе кардиокомплекса «КАД-03».
Неинвазивное 24-часовое мониторирование АД проводилось в дискретном режиме на фоне плановой гипотензивной терапии с использованием осциллометрического измерительного устройства (BPLab МнСДП-1 («Петр Телегин», Нижний Новгород), запрограммированного для измерения АД каждые 30 минут днем и каждые 60 минут – ночью. К рассмотрению не были приняты записи 5 пациентов, в которых количество ошибочных измерений превышало 30%. Вычисляли средние значения систолического и диастолического АД (САД, ДАД), вариабельность АД (ВарАД) и индекс времени в дневные и ночные часы, а также степень ночного снижения АД (СНС АД) с последующей оценкой по стандартной методике (Ольбинская Л.И., 1998). В зависимости от СНС АД выделяли следующие типы суточных кривых АД: 1) диппер – СНС АД 10-20%; 2) недиппер - СНС АД менее 10%; 3) найт-пикер – при повышении АД в ночные часы; 4) овердиппер – при СНС АД более 20%.
Эхокардиографическое исследование проводилось на аппарате Sonos 2000 (Hewlett Packard, США; датчик 2,5 МГц) в режиме одномерного, двухмерного и допплеровского сканирования. Критериями гипертрофии левого желудочка считали индекс массы миокарда ЛЖ (ИММЛЖ) 125 г/м2 для мужчин и 110 г/м2 – для женщин. Типы геометрии ЛЖ выделяли с учетом относительной толщины стенок ЛЖ и ИММЛЖ. Диастолическую дисфункцию ЛЖ диагностировали при Е/А < 1,0 и/или времени изоволюметрического расслабления (ВИР)> 100 мс у лиц в возрасте моложе 50 лет; Е/А < 0,5 и/или ВИР > 105 мc у лиц в возрасте 50 лет и старше.
Формирование базы данных и статистическая обработка проводились с использованием пакетов программ SPSS 10,0 для Windows (Chicago, Ill., USA) и WinPEPI 9.9 (J.H. Abramson, 2009). Различия между группами по категориальным переменным оценивались при помощи теста 2 Пирсона или точного критерия Фишера. При сравнении более двух групп использовали поправку Бонферрони на множественные сравнения. Для непрерывных переменных вычислялись средняя арифметическая и среднее квадратичное отклонение (M±) или медиана (25-я и 75-я процентили). При сравнении двух групп статистическая значимость различий арифметических средних оценивалась при помощи t-теста Стьюдента для независимых переменных, медиан – при помощи U-теста Манна-Уитни. При сравнении более двух групп использовали дисперсионный анализ (ANOVA) с post-hoc тестом Бонферрони для попарных сравнений или однофакторный дисперсионный анализ в аппроксимации Уэлча при неравных дисперсиях. Для оценки связи между отдельными переменными тестировали однофакторные, а затем многофакторные логистические регрессионные модели с одновременным включением в модель всех ковариат, показавших наличие статистически значимой ассоциации при тестировании однофакторных моделей. Диагностическую ценность тестов для выявления кардиальной автономной нейропатии оценивали путем расчета показателей чувствительности, специфичности, прогностической ценности положительного результата (ППЦ) и прогностической ценности отрицательного результата (ОПЦ) тестов, а также при помощи построения характеристических кривых. Значение двустороннего p менее 0,05 принимали за уровень статистической значимости.
Результаты исследования и их обсуждение
Возраст пациентов составил 58,0 (50; 64) лет (медиана (25-я; 75-я процентиль)). Длительность СД колебалась от впервые выявленного заболевания до 30 лет; медиана (25-я; 75-я процентиль) – 11,0 (4,0; 15,5) лет. У 54,8% больных заболевание характеризовалось тяжелым течением, а у 39,5% и 5,7% было средней степени тяжести или легким, соответственно. Наиболее частым осложнением СД была дистальная полинейропатия (85,4%), реже встречались ретинопатия (45,9%), макроангиопатия нижних конечностей (12,1%), нефропатия (11,5%) и энтеропатия (2,5%). Подавляющее большинство пациентов получали лечение инсулином или сочетанием инсулина и пероральных сахароснижающих средств (68,2%). Выделенные четыре группы пациентов не различались статистически значимо по среднему возрасту, длительности СД, половому составу и распространенности осложнений заболевания.
Распространенность МС среди обследованных пациентов составила 79%, что согласуется с данными G. Targher (2006), M. Monami (2007) и S.H. Song (2008). Из всех компонентов МС у больных СД 2 наиболее частым была артериальная гипертония (87,3%), реже встречались абдоминальное ожирение (70,7%) и дислипидемия (65,6%), представленная снижением концентрации ХС ЛПВП и повышением уровня ТГ в крови.
Распространенность КАН среди больных СД 2 по результатам стандартных рефлекторных тестов была высокой (80,9%) и оказалась сравнимой с данными, полученными на сходных выборках (Xueli Z., 1981), но превышала показатели, полученные в популяционных исследованиях (Ziegler D., 1992; Benrud-Larson L.M., 2004; Odusan O., 2008).
Проведенное исследование выявило связь между КАН и МС у больных СД 2. Так, распространенность КАН у пациентов, имеющих МС, составила 87,1% [95% ДИ 80,1%91,9%] и оказалась в 1,5 раза выше, чем у больных СД без МС (57,6% [95% ДИ 40,8%72,8%]). При этом КАН ассоциировалась с большим числом компонентов МС. В группе пациентов без автономной дисфункции около половины (46,7%) имели не более одного компонента МС, в то время как среди больных с КАН доля таких лиц составила только 15%, а три компонента имели уже более половины пациентов (p<0,001 для сравнения распределения по числу компонентов МС в группах КАН– и КАН+) (рис.1).


Рис. 1 Распределение больных СД 2 по количеству компонентов МС в зависимости
от наличия КАН
Примечание: 2 p<0,001 для сравнения распределения между КАН- и КАН+
Сравнительный анализ выраженности отдельных проявлений МС (уровней АД по результатам офисного измерения, показателей ИМТ, ОТ и ОБ, концентраций липидов и гликированного гемоглобина в крови) не выявил существенных различий между больными СД в зависимости от наличия КАН при условии сравнения между собой пациентов отдельно в группах с МС и без МС. Это согласуется с данными H.T. Chen (2008) и L.C. Rolim (2008), свидетельствующими об отсутствии связи между автономной нейропатией и уровнями липидов крови. В то же время, существующие в литературе указания на независимую ассоциацию КАН с ожирением (Valensi P., 2003; Rolim L.C., 2008) в настоящем исследовании не получили подтверждения. Обнаруженная в настоящем исследовании ассоциация между КАН и МС у больных СД 2 свидетельствует в пользу гипотезы об общности их патогенеза и, в частности, важной роли инсулинорезистентности в развитии обоих указанных состояний (Бондарь И.А., 2009; Manzella D., 2005).
Существенную роль в развитии и прогрессировании инсулинорезистентности и связанных с ней метаболических расстройств играет повышенная активность симпатической нервной системы (Бутрова С.А., 2001; Licht C.M., 2010). Вегетативный тонус у больных СД 2 характеризовался преобладанием влияния симпатического отдела вегетативной нервной системы при МС, а также в присутствии КАН вне зависимости от МС, что согласуется с данными Д.А. Аничкова (2005), A. Perciaccante (2006) и Z.R. Rasic-Milutinovic (2010). Так, среди пациентов первой группы (КАНМС) чаще встречалось состояние вегетативного равновесия (85,8%). Во второй группе (КАНМС+) вегетативный тонус характеризовалось вегетативным равновесием (43,8%) или симпатикотонией (43,8%) и значительно реже – ваготонией (12,4%). Вегетативный тонус более половины пациентов (57,9%) 3-ей группы (КАН+МС) характеризовался преобладанием симпатических влияний. Группа 4 (КАН+МС+) отличалась самой высокой долей лиц с симпатикотонией – 80,6% (p<0,01 для сравнения с группами 1, 2, 3 с поправкой на множественные сравнения).
У пациентов с МС и с КАН отмечено снижение общей ВРС в виде уменьшения стандартного отклонения величин нормальных интервалов RR (SDNN), триангулярного индекса и общей мощности спектра (TP), являющихся интегральными показателями ВРС (табл. 1).
Таблица 1
Показатели вариабельности ритма сердца у больных СД 2 в зависимости от наличия КАН и МС (М±)
| Показатель | МС– | МС+ | p3 | ||||
| КАН– группа 1 n=14 | КАН+ группа 3 n=19 | p1 | КАН– группа 2 n=16 | КАН+ группа 4 n=108 | p2 | ||
| SDNN, мс | 48,0±22,4 | 34,7±21,1 | 0,03 | 18,2±9,1 | 26,9±10,6 | нз | 0,001 |
| pNN50, % | 26,7±18,6 | 23,1±18,4 | нз | 3,5±2,4 | 4,4±4,1 | нз | <0,001 |
| RMSSD, мс | 67,5±44,9 | 59,5±29,7 | нз | 14,0±7,1 | 27,0±15,4 | нз | <0,001 |
| Триангулярный индекс ВРС | 6,0±0,8 | 5,9±1,7 | нз | 4,0±0,3 | 4,1±1,0 | нз | <0,001 |
| TP, мс2 | 2735,0 ±933,9 | 1791,5 ±1108,4 | 0,008 | 1163,0 ±341,8 | 982,6 ±353,5 | нз | <0,001 |
| VLF, мс2 | 208,2 ±15,1 | 122,8 ±45,3 | 0,003 | 166,0 ±4,7 | 168,7 ±79,2 | нз | нз |
| LF, мс2 | 893,2 ±284,6 | 547,2 ±273,6 | <0,001 | 432,6 ±148,8 | 455,0 ±167,4 | нз | <0,001 |
| HF, мс2 | 1524,0 ±593,8 | 815,7 ±412,8 | 0,001 | 563,6 ±195,4 | 338,9 ±121,9 | 0,007 | <0,001 |
| LF, н.е. | 35,4 ±11,6 | 39,5 ±15,8 | нз | 43,0 ±0,4 | 55,6 ±7,6 | <0,001 | <0,001 |
| HF, н.е. | 60,1 ±0,3 | 53,2 ±10,5 | 0,013 | 56,3 ±1,9 | 42,3 ±6,1 | <0,001 | <0,001 |
| LF/HF | 0,6 ±0,2 | 1,1 ±0,7 | 0,02 | 0,8 ±0,1 | 1,4 ±0,5 | 0,001 | <0,001 |
Примечания:
1 статистическая значимость различий между группами 1 и 3 (ANOVA с поправками на множественные сравнения)
2 статистическая значимость различий между группами 2 и 4 (ANOVA с поправками на множественные сравнения)
3 статистическая значимость различий между МС– и МС+
Наличие МС и автономной дисфункции ассоциировались с однонаправленными изменениями вегетативного обеспечения сердечной деятельности, проявляющимися ослаблением парасимпатических влияний (в виде снижения показателей pNN50%, RMSSD и HF) и усилением мобилизирующего влияния симпатического отдела вегетативной нервной системы (увеличение показателей LF, н.е и LF/HF). При этом преобладание симпатической активности не сопровождалось повышением абсолютного показателя LF, которое отражало бы состояние симпатикотонии. Это может свидетельствовать об относительном характере симпатикотонии у пациентов с КАН и/или МС. Следует отметить, что в условиях аномально низкой общей мощности спектра ритмограмм TP у больных СД 2 с МС, имеющих КАН, относительная активация симпатического звена вегетативной нервной системы не сочеталась с выраженными сдвигами показателя LF/HF, который у данных пациентов оставался в диапазоне нормальных значений (табл. 1).
При 24-часовом мониторировании АД обнаружены некоторые различия в изменении показателей суточного профиля АД при КАН у больных СД 2 в зависимости от наличия у них МС. У пациентов без МС вариабельность АД при наличии КАН в дневное время существенно увеличивалась (10,0±2,9 мм рт.ст у КАН– против 13,4±4,5 мм рт.ст. у КАН+, р=0,004). Полученные данные о повышенной вариабельности АД днем у больных СД 2 с КАН без МС, а также более высоких средних значениях АД и показателях нагрузки давлением ночью согласуются с результатами исследований П.Х. Джанашия (2006), C.R. Cardoso (2008) и A.K. Gupta (2008).
В противоположность данным П.Х. Джанашия (2006), в настоящем исследовании не было выявлено повышения вариабельности АД в дневные часы у пациентов с КАН и МС. У таких больных вариабельность АД днем была существенно снижена (21,7±1,4 мм рт.ст. у КАН– против 15,3±2,4 мм рт.ст. у КАН+, р<0,001), в то время как вариабельность ДАД ночью – повышена (6,9±0,8 мм рт.ст. у КАН– против 11,0±2,5 мм рт.ст у КАН+, р<0,001). КАН у больных с МС не ассоциировалась с изменениями средних уровней АД в дневные часы и была связана с меньшей нагрузкой давлением днем и увеличением нагрузки давлением ночью. Такие изменения АД могут быть проявлением феномена артериальной гипертонии в положении лежа, обусловленного постденервационной гиперчувствительностью адренорецепторов гладких мышц сосудов к медиаторам вегетативной нервной системы при далеко зашедшей КАН (Джанашия П.Х., 2006). Это может свидетельствовать о более выраженной автономной нейропатии с вовлечением не только парасимпатической, но и симпатической иннервации у пациентов с МС по сравнению с лицами без МС.
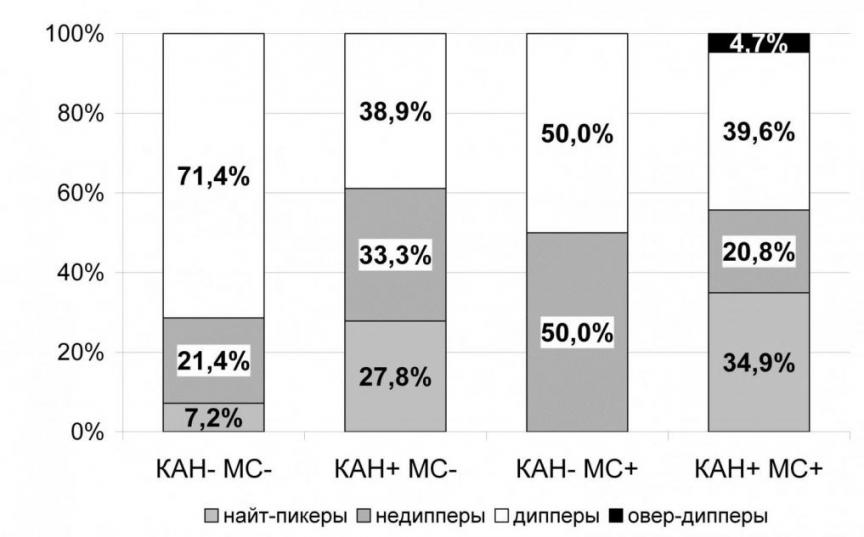
У больных СД наличие МС или КАН было связано с нарушением нормального ночного снижения систолического и диастолического АД (рис. 2). Так, в 1-ой группе доля дипперов по уровню САД была максимальной (71,4%) и постепенно уменьшалась от 1-ой к 4-ой группе. Среди пациентов 3-ей группы, также без МС, но имеющих КАН, доля дипперов существенно снижалась (33,3%), при одновременном увеличении доли недипперов (38,9%) и появлении найт-пикеров (27,8%). Сочетание МС и КАН в группе 4 ассоциировалось с наиболее неблагоприятным паттерном САД в ночные часы. Доля дипперов в этой группе составляла всего 14,2%, в то время как доли недипперов и найт-пикеров достигали 41,5% и 44,3%. Сходные данные были получены для ДАД.
В многофакторном логистическом регрессионном анализе у всех больных СД 2 вне зависимости от наличия МС присутствие КАН сочеталось с 5-6-кратным увеличением доли недипперов и найт-пикеров по уровню САД (ОШ=5,5, 95% ДИ 1,1-28,0 у МС; ОШ=5,9, 95% ДИ 1,8-19,1 у МС+) при условии контроля по наличию АГ.

Систолическое АД
2 p<0,001 для сравнения четырех групп
Диастолическое АД
2 p=0,036 для сравнения четырех групп
Рис. 2 Распределение больных СД 2 по степени ночного снижения АД
По данным эхокардиографии обнаружены различия в изменении параметров структуры ЛЖ сердца у больных СД 2 при КАН в зависимости от наличия МС. У пациентов без МС КАН не была связана с изменением показателей толщины стенок ЛЖ (ТЗСЛЖ, ТМЖП, ОТС) и массы миокарда ЛЖ (ММЛЖ). При наличии МС автономная нейропатия ассоциировалась со статистически значимым увеличением ТМЖП и ТЗСЛЖ (12,6±1,5 против 11,0±0,6 мм и 11,9±1,2 против 10,7±0,8 мм, соответственно, все p<0,001 для сравнения КАН+ с КАН–), ММЛЖ/Рост2,7 (78,1±15,8 г/м2,7 против 66,5±9,0 г/м2,7 для КАН+ и КАН–, соответственно, p=0,03) и повышенным показателем ОТС ЛЖ (0,48±0,06 против 0,42±0,03 для КАН+ и КАН–, соответственно, p<0,001), что свидетельствовало о более выраженном ремоделировании ЛЖ сердца у таких пациентов. Это нашло отражение в распределении пациентов по типу геометрии ЛЖ (рис. 3).

Рис. 3 Типы геометрии левого желудочка у больных СД 2
Примечание: 2 p<0,001 для сравнения распределения между четырьмя группами
Отмечено существенное снижение доли пациентов с нормальной геометрией ЛЖ от 57,1% в группе 1 (КАН,МС) до 10,2% - в группе 4 (КАН+,МС+). Распространенность концентрической гипертрофии при этом увеличивалась и оказалась максимальной при сочетании КАН с МС (63,9%). В логистическом регрессионном анализе шансы пациента с СД иметь концентрическую гипертрофию ЛЖ увеличивались вне зависимости от наличия МС в присутствии КАН в среднем в 6,6 раза (ОШ=6,6, 95% ДИ 2,5–17,3), а при наличии МС – в 3,5 раза (ОШ=3,5, 95% ДИ 1,5–8,0). Сочетание КАН с МС (при условии контроля по полу, возрасту, уровням САД и ДАД и степени тяжести СД) увеличивало шансы наличия концентрической гипертрофии ЛЖ в 8,7 раза (ОШ=8,7, 95% ДИ 1,8-41,3). При этом не обнаружено статистически значимого влияния КАН на формирование концентрической гипертрофии ЛЖ у лиц без МС.
Шансы больного СД 2 иметь нарушение диастолической функции ЛЖ при наличии МС увеличивались в среднем в 3,4 раза (ОШ=3,4, 95% ДИ 1,4–8,0), при наличии КАН– в 5 раз (ОШ=5,0, 95% ДИ 1,7–11,4), а в случае, если КАН сочеталась с МС – в 9 раз (ОШ=9,2, 95% ДИ 1,7–48,7), что свидетельствует о синергизме КАН и МС в отношении негативного влияния на диастолическую функцию ЛЖ сердца (табл. 2).
Таблица 2
Отношение шансов диастолической дисфункции левого желудочка у больных СД 2 в зависимости от наличия КАН и МС
| Ковариата | Однофакторный анализ | Многофакторный анализ1 | ||
| ОШ | 95% ДИ | ОШ | 95% ДИ | |
| Все пациенты (n=157) | ||||
| КАН | 6,07‡ | 2,50-14,76 | 5,00† | 1,69-11,38 |
| МС | 3,36† | 1,41-8,01 | - | - |
| Пациенты без МС (n=33) | ||||
| КАН | 2,80 | 0,65-12,09 | 3,02 | 0,21-42,75 |
| Пациенты с МС (n=124) | ||||
| КАН | 6,86‡ | 2,13-22,06 | 9,18† | 1,73-48,71 |
Примечания:
Зависимая переменная – диастолическая дисфункция ЛЖ (0: отсутствует; 1: присутствует)
1 - с контролем по степени тяжести СД (0: легкий или средней тяжести, 1: тяжелый) и наличию гипертрофии ЛЖ (0: отсутствует; 1: имеется)
† p<0,01, ‡ p<0,001
Учитывая выявленную ассоциацию между МС и КАН, справедливо предполагать, что операционные характеристики тестов диагностики КАН меняются у больных СД в зависимости от наличия у них МС. С целью оптимизации диагностики КАН у больных СД 2 с МС и без него проведена оценка операционных характеристик тестов, применяемых для диагностики КАН (табл. 3).
Таблица 3
Операционные характеристики стандартных рефлекторных сердечно-сосудистых тестов у больных СД 2 в зависимости от наличия МС (% и 95%ДИ)
| Тест | Чувствительность | Специфичность | ППЦ | ОПЦ | ||||
| МС– | МС+ | МС– | МС+ | МС– | МС+ | МС– | МС+ | |
| 1. Тест глубокого дыхания | 89,5 68,6-97,1 | 81,5 73,1-87,7 | 71,4 45,3-88,3 | 18,8 6,6-43,0 | 80,9 57,4-93,7 | 87,1 78,6-92,7 | 83,3 50,9-97,0 | 13,0 3,4-34,7 |
| 2. Проба Вальсальвы | 73,7 51,2-88,2 | 79,6 71,1-86,1 | 100 78,5-100 | 68,7 44,4-85,8 | 100 73,2-100 | 94,5 87,0-97,9 | 73,7 48,6-89,9 | 33,3 18,5-51,9 |
| 3. Ортостатическая проба ЧСС (проба 30:15) | 89,5 68,6-97,1 | 78,7 70,1-85,4 | 100 78,5-100 | 87,5 64,0-96,5 | 100 77,1-100 | 97,7 91,1-99,6 | 87,5 60,4-97,8 | 37,8 22,9-55,2 |
| 4. Ортостатическая проба АД | 21,0 8,5-43,3 | 22,2 15,4-30,9 | 100 78,5-100 | 93,7 71,7-98,9 | 100 39,6-100 | 96,0 77,7-99,8 | 48,3 29,9-67,1 | 15,1 9,0-24,1 |
В целом вне зависимости от наличия МС наиболее чувствительными из всех рефлекторных сердечно-сосудистых тестов для диагностики КАН оказались тест глубокого дыхания и проба Вальсальвы, а наименее чувствительной и наиболее специфичной – ортостатическая проба с оценкой АД, что согласуется с данными О. Н. Ткачевой (2009) и A. I. Vinik (2003). Обнаружено, что чувствительность, специфичность, прогностическая ценность положительного и отрицательного результатов тестов были ниже у больных с МС в сравнении с пациентами без МС (табл. 3).
Для выяснения возможности использования показателей спектральной мощности записи за весь период TP (мс2) и мощности высокочастотного компонента HF (мс2) с целью диагностики КАН у больных СД 2 был проведен анализ их характеристических кривых у пациентов в зависимости от наличия МС.

TP, мс2

HF, мс2
Рис. 4 Характеристические кривые показателей TP (мс2) и HF (мс2) для диагностики КАН у больных СД 2 в зависимости от наличия МС
На основании изучения характеристических кривых показателей TP и HF, представленных на рисунке 4, можно заключить, что оценка указанных показателей достаточно высоко эффективна для диагностики КАН у больных СД 2. Причем тесты несколько более информативны у больных СД, не имеющих МС, о чем можно судить по площади под кривыми (S). Так, Sмс+ для показателя HF составила 0,78 и была меньше в сравнении с Sмс-, составившей 0,84. Значения тех же показателей для характеристической кривой TP составили 0,89 и 0,90, соответственно. Предложены разные точки разделения больных на имеющих и не имеющих КАН по показателям TP и HF в зависимости от наличия у пациентов МС, что позволит оптимизировать диагностику автономной нейропатии при СД 2.
ВЫВОДЫ
- Распространенность кардиальной автономной нейропатии при СД 2 выше у пациентов с метаболическим синдромом по сравнению с лицами, не имеющими метаболического синдрома.
- У больных СД 2 уровни артериального давления при клиническом измерении, индекс массы тела, показатель ОТ/ОБ, значения липидов сыворотки крови и гликированного гемоглобина не связаны с присутствием кардиальной автономной нейропатии, но ассоциируются с наличием метаболического синдрома.
- При СД 2 кардиальная автономная нейропатия независимо от наличия метаболического синдрома связана с ослаблением парасимпатических влияний и относительным усилением мобилизирующего влияния симпатического отдела вегетативной нервной системы на фоне существенного снижения общей вариабельности ритма сердца.
- Кардиальная автономная нейропатия при СД 2 ассоциируется с недостаточным ночным снижением артериального давления независимо от наличия метаболического синдрома. В отсутствие метаболического синдрома для кардиальной автономной нейропатии типично повышение вариабельности артериального давления днем, а у лиц с метаболическим синдромом – снижение вариабельности давления днем и повышение ночью.
- У больных СД 2 без метаболического синдрома кардиальная автономная нейропатия не связана с гипертрофией левого желудочка, тогда как в присутствии метаболического синдрома она ассоциируется с концентрической гипертрофией левого желудочка независимо от пола и возраста пациентов, уровней артериального давления, а также степени тяжести диабета.
- При СД 2 в случае наличия кардиальной автономной нейропатии диастолическая дисфункция левого желудочка встречается у лиц без метаболического синдрома в среднем в 3 раза чаще, а с метаболическим синдромом в 9 раз чаще по сравнению с лицами без автономной нейропатии.
- Показатели чувствительности, специфичности и прогностической ценности тестов диагностики кардиальной автономной нейропатии (стандартные тесты Эвинга и параметры TP и HF вариабельности ритма сердца) у больных СД 2 с метаболическим синдромом ниже, чем у пациентов без метаболического синдрома.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Наличие у больного сахарным диабетом типа 2 метаболического синдрома с высокой долей вероятности свидетельствует о присутствии кардиальной автономной нейропатии и требует обязательного включения в план обследования такого пациента рефлекторных сердечно-сосудистых тестов.
- При диагностике кардиальной автономной нейропатии у больных сахарным диабетом типа 2 необходимо учитывать зависимость характеристик используемых тестов от наличия метаболического синдрома. У пациентов без метаболического синдрома целесообразно проведение полного набора батареи тестов Эвинга. При этом в последнюю очередь следует проводить ортостатическую пробу с оценкой реакции артериального давления, которая позволит уточнить наличие или отсутствие поражения симпатического звена вегетативной нервной системы. У больных сахарным диабетом, имеющих метаболический синдром, с высокой претестовой вероятностью наличия автономной нейропатии диагностика может быть упрощена и проведена с использованием только одного теста оценки сердечного ритма и одного теста оценки АД (ортостатическая проба с оценкой реакции ЧСС и АД).
- Рекомендованы следующие пороговые значения частотных показателей вариабельности ритма сердца для диагностики кардиальной автономной нейропатии у больных сахарным диабетом типа 2: TP 2317 мс2, HF 1075 мс2 в отсутствие у пациентов метаболического синдрома и TP 1086,5 мс2, HF 539 мс2 в случае наличия метаболического синдрома.
- Нормальные значения показателя LF/HF вариабельности ритма сердца не могут быть использованы в качестве критерия отсутствия кардиальной автономной нейропатии у больных сахарным диабетом типа 2, имеющих метаболический синдром. В условиях аномально низкой общей мощности спектра ритмограмм у таких пациентов показатель LF/HF остается в пределах нормальных значений.
- При разработке программы лечения больных сахарным диабетом типа 2 с кардиальной автономной нейропатией следует особое внимание уделить адекватной гипотензивной терапии в ночные часы. Учитывая недостаточную информативность клинического измерения артериального давления и преобладание патологических изменений у таких пациентов преимущественно в ночные часы, для контроля эффективности гипотензивной терапии целесообразно проведение суточного мониторирования артериального давления.
- У больных сахарным диабетом типа 2 при наличии кардиальной автономной нейропатии необходимо проведение эхокардиографии для оценки характера ремоделирования и диагностики диастолической дисфункции левого желудочка.
СПИСОК РАБОТ,
ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Лунина, Е.Ю. Метаболический синдром и его связь с автономной нейропатией сердца при сахарном диабете типа 2 [Текст] / Е.Ю. Лунина, И.С. Петрухин // Кардиоваскулярная терапия и профилактика. – 2004. – № 4, Приложение 2. – С. 293.
- Лунина, Е.Ю. Диабетическая кардиальная автономная нейропатия: проблемы диагностики (обзор литературы). [Текст] / Е.Ю. Лунина // Верхневолжский медицинский журнал. – 2004. – № 4. – С. 31–34.
- Лунина, Е.Ю. Сравнительный анализ способов диагностики кардиальной автономной нейропатии при сахарном диабете типа 2 [Текст] / Е.Ю. Лунина, И.С. Петрухин // Итоги и перспективы лечебно-профилактической, научно-исследовательской и педагогической деятельности : Ежегодный сборник научно-практических работ. – Тверь, 2004. – С. 136–138.
- Лунина, Е.Ю. Диагностическая ценность стандартных тестов оценки функции сердечно-сосудистой системы для выявления кардиальной автономной нейропатии у больных сахарным диабетом типа 2 в зависимости от выраженности метаболического синдрома [Текст] / Е.Ю. Лунина // Традиции, современность, будущее. Инновационные подходы в диагностике, лечении и профилактике сердечно-сосудистых заболеваний : Материалы съезда кардиологов и терапевтов ЦФО России. – Тверь, 2009. – С. 185–187.
- Лунина, Е.Ю. Параметры внутрисердечной гемодинамики, ассоциирующиеся с кардиальной автономной нейропатией, у больных сахарным диабетом типа 2 в сочетании с компонентами метаболического синдрома [Текст] / Е.Ю. Лунина, И.С. Петрухин // Материалы четвертого Национального конгресса терапевтов. – М. : ООО «Издательский дом «Бионика», 2009. – С. 155.
- Лунина, Е.Ю. Кардиальная автономная нейропатия и метаболический синдром у больных сахарным диабетом типа 2 [Текст] / Е.Ю. Лунина, И.С. Петрухин // Клиническая медицина. – 2010. – № 5. – С. 34–38.
- Лунина, Е.Ю. Артериальная гипертония ассоциируется с кардиальной автономной нейропатией при сахарном диабете типа 2 [Текст] / Е.Ю. Лунина, И.С. Петрухин // Клиническая медицина. – 2010. – Приложение № 1. – С. 52–53.
- Lunina, E.Y. Influence of cardiac autonomic neuropathy on left ventricular structure and function: does it depend on the number of metabolic syndrome components? [Text] / E.Y. Lunina, I.S. Petrukhin // European Journal of Clinical Investigation. – 2010. – Vol. 40, Supplement 1. – P. 10.
- Лунина, Е.Ю. Гипертрофия левого желудочка сердца у больных сахарным диабетом типа 2: влияние метаболического синдрома и кардиальной автономной нейропатии [Текст] / Е.Ю. Лунина, И.С. Петрухин // Вестник Военно-медицинской академии. – 2010. – Приложение 2 (30). – С. 242–243.
- Лунина, Е.Ю. Влияние метаболического синдрома и кардиальной автономной нейропатии на диaстолическую функцию левого желудочка сердца у больных сахарным диабетом типа 2 [Текст] / Е.Ю. Лунина, И.С. Петрухин // Сибирский медицинский журнал. – 2010. – №2, Вып.1. – С. 200–201.
- Лунина, Е.Ю. Изменения структуры и функции левого желудочка сердца у больных сахарным диабетом типа 2 в зависимости от наличия кардиальной автономной нейропатии и компонентов метаболического синдрома [Текст] / Е.Ю. Лунина, И.С. Петрухин // Кардиоваскулярная терапия и профилактика. – 2011. – Том 10. – принята в печать.

