Системный анализ факторов риска, биологических ритмов и ремоделирования сосудов в онтогенезе у мужчин с сердечно-сосудистыми заболеваниями
На правах рукописи
ГОЛОВАНОВА Елена Дмитриевна
СИСТЕМНЫЙ АНАЛИЗ ФАКТОРОВ РИСКА, БИОЛОГИЧЕСКИХ РИТМОВ
И РЕМОДЕЛИРОВАНИЯ СОСУДОВ В ОНТОГЕНЕЗЕ У МУЖЧИН
С СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ
14.00.05 – внутренние болезни
14.00.53 – геронтология и гериатрия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Смоленск – 2009
Работа выполнена в Государственном образовательном учреждении высшего
профессионального образования «Смоленская государственная медицинская
академия Федерального агентства по здравоохранению и социальному развитию».
Научные консультанты:
доктор медицинских наук, профессор Милягин Виктор Артемьевич
доктор медицинских наук, Донцов Виталий Иванович
Официальные оппоненты:
доктор медицинских наук, профессор Подпалов Владислав Павлович
доктор медицинских наук, профессор Никитин Геннадий Алексеевич
доктор медицинских наук, профессор Семенков Виктор Фаддеевич
Ведущая организация - Московская медицинская академия им. И.М.Сеченова
Защита состоится «_14_»____октября_________ 2009 г. в ________ часов
на заседании диссертационного совета Д 208.097.01 при ГОУ ВПО
«Смоленская государственная медицинская академия Росздрава»
(214019, г. Смоленск, ул. Крупской,28).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Смоленская государственная медицинская академия Росздрава»
Автореферат разослан «_____» __________________ 2009 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Л.В.Тихонова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность изучаемой темы определяется тем, что старение населения является глобальной проблемой, стоящей перед человечеством в начале ХХI века. Общей целью геронтологических исследований является получение достоверных знаний о механизмах старения у человека и использование их для улучшения качества и продолжительности жизни (Анисимов В.Н., 2003; Михальский А.И., Новосельцев В.Н., 2005). Индивидуальная скорость старения, определяющая продолжительность жизни человека, зависит от адаптационных возможностей и особенностей функционирования сердечно-сосудистой, вегетативной, кроветворной, нейро-эндокринной, иммунной и центральной нервной систем организма (Дильман В.М., 1987; Донцов В.И., 2000; Воробьев П.А., 2002; Воробьев А.И., 2003; Шабалин В.Н., 2005; Семенков В.Ф., 2005; Хавинсон В.Х., Коновалов С.С., 2008). Население России по объективным критериям ВОЗ относится к старому населению: доля лиц старше 60 лет по стране составляет 18% (Белоконь О.В., 2008; Харченко В.И. и др., 2008).
Начиная с 1992 года, в России отмечается постоянный рост смертности в возрастной группе 40-60 лет, особенно среди мужчин, связанный с резким ростом заболеваемости артериальной гипертензией (АГ). Известно, что АГ встречается в России у 40% мужчин трудоспособного возраста и является основным фактором риска ИБС и цереброваскулярных заболеваний, а также начальным звеном в развитии сердечной недостаточности (Оганов Р.Г., Масленникова Г.Я., 2004; Милягин В.А. и др., 2005). Если в странах Западной Европы с 70-х гг. смертность от сердечно-сосудистых заболеваний в среднем и пожилом возрасте постоянно снижается, то в странах Восточной Европы и в России она остается очень высокой, особенно у мужчин (Лазебник Л.Б., Конев Ю.В., 2008). Таким образом, у мужчин сердечно-сосудистая система является ведущей в реализации основных детерминант старения и смерти. Со скоростью ее старения тесно связаны понятия «биологический возраст» человека и «индивидуальный темп старения» организма. У пациентов с паспортным возрастом 40 лет возраст биологический определяется, прежде всего, состоянием его сосудистой стенки и может соответствовать календарному возрасту 70-летнего человека. Есть старение «успешное» – естественное физиологическое старение, и есть старение «ускоренное», при котором при воздействии факторов внешней среды существенно повышается риск развития сердечно-сосудистых заболеваний (Кобалава Ж.Д., 2006).
Необходимость активной профилактики сердечно-сосудистых заболеваний предусматривает многостороннее и тщательное изучение различных факторов риска, связанных с развитием атеросклероза и АГ. Известно, что три основных фактора – курение, АГ, дислипидемия или их сочетание ответственны в 75% случаев сердечно-сосудистых катастроф во всем мире (Marks D. et al 2006; Zhang X. et al 2006; Mancia G. et al 2007; Barth J. et al 2007; Rhee M.Y. et al 2007). Однако, существуют и другие факторы, значение которых продолжает уточняться (Scarabin P. et al 2003; Smeeth L. et al 2004; Оганов Р.Г. и др., 2007; Кисляк О.А.и др., 2008). Поэтому изучение влияния классических факторов риска на скорость биологического старения в различные периоды онтогенеза как у практически здоровых лиц, так и у пациентов с сердечно-сосудистой патологией, наряду с поиском и изучением новых факторов, является актуальной задачей геронтологических исследований.
Наука о биоритмах – хронобиология, подошла к важному рубежу, доказывающему, что биоритмы представляют собой широчайший спектр аутоколебаний, формирующих все функциональные процессы в организме на молекулярном, клеточном, органном и организменном уровне (Шапошникова В.И., 2008; Чернилевский В.Е., 2008). Циклические изменения в нейроэндокринной системе являются первоосновой циркадианного ритма такого важного для неспецифической резистентности организма звена, как корковое вещество надпочечников. Изменение ритма сердца – универсальная ответная оперативная реакция целостного организма на любое воздействие, в определенной степени характеризующая баланс между тонусом симпатического и парасимпатического отделов вегетативной нервной системы (ВНС). Все современные концепции признают важную роль ВНС как в регуляции жизнедеятельности организма, так и в развитии АГ (Бойцов С.А., 2002; Вейн А.М. и др., 2003; Гогин Е.Е., 2004; Цырлин В.А., 2006; Шляхто Е.В., Конради А.О., 2007). Дисфункция вегетативной нервной системы имеет особое значение в генезе АГ у пожилых пациентов (Чермных Н.А. и др. 2008). Эффективная диагностика и фармакотерапия нуждаются в информации об индивидуальных биологических ритмах организма пациентов: вариабельности сердечного ритма, циркадианных ритмах АД и секреции нейрогормонов.
Жесткость артерий является важнейшим интегральным показателем сердечно-сосудистого риска, зависящим от возраста и отражающим комплексное воздействие на организм разнообразных классических факторов риска (Ito N. et al., 2006; Wallace S.M. et al., 2007; Gedikli O. et al., 2008; Terai M. et al., 2008; Wang X. et al., 2008). Каротидно-феморальная скорость распространения пульсовой волны (СРПВ) является независимым предиктором общей сердечно-сосудистой смертности, особенно у больных с ИБС, АГ и у лиц пожилого и старческого возраста (Лопатин Ю.М. и др., 2007).
В Японии был разработан метод регистрации плече-лодыжечной СРПВ, отражающей распространение ее на более длинном участке магистральных сосудов - от сонных до тибиальных артерий (Munakata M., Ito N., Nunokawa T., 2003). Исследователями был предложен новый показатель – сердечно-лодыжечный сосудистый индекс CAVI, позволяющий определять жесткость сосудистой стенки вне зависимости от уровня АД (Tomoyuki Y., et al., 2004). В России исследования с различными вариантами индекса CAVI (в центральных и периферических сосудах) только начинают проводиться (Милягина И.В., 2008; Орлова Я.А. и др., 2009). Следует отметить, что сонные артерии и сосуды нижних конечностей более доступны для исследования, чем коронарные или мозговые. Ремоделирование брахиоцефальных артерий – важнейший патогенетический механизм формирования АГ в различные периоды онтогенеза, особенно в старческом возрасте (Белоусов Ю.Б. и др., 2004)
Фармакотерапия АГ разработана в различных возрастных периодах. Используются препараты разнообразных фармакологических групп (Моисеев В.С. и др., 2002; Комиссаренко И.А. и др., 2004; Гуревич М.А., 2004; Чазова И.Е., 2005; Котовская Ю.В., 2005; Марцевич С.Ю., 2007; Глезер М.Г., 2008; Маколкин В.И., 2008; Николаев Н.А., 2009). Однако комплексная оценка темпа биологического старения, параметров ВНС и показателей ремоделирования центральных и периферических сосудов как критериев для выбора определенной группы антигипертензивных препаратов, возможности моно- и целесообразности комбинированной терапии требует дальнейшего уточнения.
Таким образом, исследование феномена «ускоренного старения» у лиц зрелого возраста предполагает тщательный анализ влияния различных факторов риска на развитие этого процесса для разработки активных профилактических программ. С научной точки зрения, долгожители представляют интерес для исследователей как уникальная психосоматическая модель сохранения защитных свойств организма до глубокой старости и его адаптации к существованию в измененных условиях стареющего организма на фоне полиморбидности. Разработка обоснованных рекомендаций для практических врачей а также дополнительных показаний и противопоказаний в отношении лечения АГ у пациентов мужского пола в различных возрастных группах имеет особое медико-социальное значение.
Цель исследования – комплексная оценка действия факторов, влияющих на прогноз сердечно-сосудистых заболеваний, биологических ритмов, особенностей ремоделирования центральных и периферических сосудов на темп старения организма и оптимизация фармакотерапии у лиц мужского пола на основе изучения онтогенетических аспектов формирования артериальной гипертензии
Задачи исследования:
- Определить влияние факторов риска сердечно-сосудистых заболеваний на биологический возраст у пациентов мужского пола.
- Проанализировать роль некоторых биомаркеров, определяющих скорость старения у лиц мужского пола с сердечно-сосудистыми заболеваниями в зрелом возрасте.
- Выявить особенности функционирования вегетативно-регуляторных механизмов у мужчин в различных возрастных группах с учетом темпа биологического старения.
- Уточнить отдельные патогенетические звенья формирования «ускоренного» варианта старения на основе использования некоторых показателей вариабельности сердечного ритма и суточных ритмов секреции кортизола.
- Исследовать характер возрастзависимого ремоделирования сосудов эластического, мышечного и смешанного типов у мужчин.
- Выявить особенности функционирования компенсаторно-приспособительных механизмов у «долгожителей» в сравнении с вариантом «преждевременного» старения на основе применения показателей церебральной гемодинамики.
- Изучить онтогенетические аспекты клинико-патогенетических механизмов формирования артериальной гипертензии в различных возрастных группах с последующей разработкой критериев по оптимизации моно- и комбинированной фармакотерапии с использованием диуретиков, ингибиторов АПФ, антагонистов кальция и бета-адреноблокаторов.
Научная новизна исследования
В исследовании впервые:
– в условиях одномоментного поперечного исследования применен комплексный подход с определением биологического возраста, исследования биологических ритмов и ремоделирования сосудов для изучения онтогенетических особенностей формирования артериальной гипертензии у лиц мужского пола;
– установлено, что на скорость биологического старения у мужчин с нормальным АД в наибольшей степени влияют: уровень гликемии, индекс массы тела, пульсовое АД и скорость распространения пульсовой волны. У пациентов мужского пола с артериальной гипертензией, помимо этих факторов, темп старения определяют уровень систолического АД, частота сердечных сокращений, скорость клубочковой фильтрации;
– выявлена тесная взаимосвязь между циркадианными ритмами суточной секреции кортизола, суточными ритмами АД и скоростью биологического старения у мужчин;
– показана связь формирования определенных «патологических функциональных систем» с различными периодами онтогенеза;
– доказано, что гемодинамические и фиброзно-склеротические изменения в брахиоцефальных артериях мышечно-эластического типа соответствуют изменениям в индексах периферического сопротивления в сосудах этого же типа, но различного диаметра;
– показана возможность раннего выявления лиц с высоким риском сосудистых осложнений или предрасположенностью к замедленному варианту биологического старения на основании исследования взаимосвязи тонуса церебральных сосудов и показателей вариабельности сердечного ритма;
– разработан оригинальный алгоритм обследования лиц мужского пола с высоким кардиоваскулярным риском с использованием показателей жесткости артерий и параметров церебральной гемодинамики (удостоверение на рационализаторское предложение № 1545 от 12.06.2009г).
Практическая значимость работы
Использование результатов проведенных исследований дает возможность улучшить качество диагностики и повысить эффективность лечения артериальной гипертензии у мужчин в различных возрастных группах:
– использование онтогенетической «модели» развития артериальной гипертензии, основанной на определении биологического возраста, темпа старения и формы артериальной гипертензии, позволит проводить более полную оценку состояния сердечно-сосудистой системы у лиц мужского пола;
– принципы формирования «групп риска» в различные периоды онтогенеза с учетом показателей жесткости сосудов, вариабельности сердечного ритма и темпа биологического старения позволяют индивидуализировать профилактические мероприятия и фармакотерапию;
– использование алгоритма обследования пациентов с высоким кардиоваскулярным риском способствует повышению эффективности профилактики сердечно-сосудистых осложнений у лиц мужского пола;
– комплексное обследование состояния тонуса и кровотока в брахиоцефальных и церебральных сосудах с расчетом ряда гемодинамических показателей позволяет выявить предрасположенность к «замедленному» или «ускоренному» варианту биологического старения;
– использование разработанных критериев диагностики преобладающего механизма нарушения тонуса сосудов каротидной зоны, определяет способ выбора консервативного лечения каротидного стеноза с применением дигидропиридиновых антагонистов кальция III поколения и ингибиторов АПФ (заявка на изобретение, регистрационный № 2009119831 от 25.05. 2009);
– исследование исходного состояния вегетативной регуляции сердечного ритма и степени ремоделирования сосудов эластического, мышечного и смешанного типов определяет дополнительные показания и дает возможность расширить показания для моно- или комбинированной терапии дигидропиридиновыми антагонистами кальция II-III поколения, бета-адреноблокаторами, ингибиторами АПФ и диуретиками в различных возрастных группах у лиц мужского пола.
Основные положения диссертации, выносимые на защиту:
- Факторы, влияющие на прогноз сердечно-сосудистых заболеваний, в различные периоды онтогенеза оказывают неодинаковое воздействие на скорость биологического старения у лиц мужского пола.
- Параметры вегетативно-адаптационных звеньев гомеостаза (вариабельность сердечного ритма, циркадианные ритмы секреции кортизола) взаимосвязаны со скоростью онтогенеза и являются биомаркерами старения у лиц мужского пола с сердечно-сосудистыми заболеваниями.
- Ремоделирование центральных и периферических сосудов эластического и мышечного типов зависит от возраста, но имеет нелинейный характер в различные периоды онтогенеза
- Механизмы регуляции тонуса брахиоцефальных и церебральных сосудов находятся в тесной связи с функционированием вегетативной нервной системы, что может определять предрасположенность к «замедленному варианту» биологического старения.
- Эффективность антигипертензивной терапии препаратами различных групп во многом зависит от онтогенетической «модели» формирования артериальной гипертензии.
Внедрение результатов исследования в практику
Результаты исследования внедрены в работу ГУЗ «Смоленская областная клиническая больница», ОГУЗ «Смоленский клинический госпиталь для Ветеранов Войн», медицинский пункт ОАО «СИТАЛЛ». Основные положения и выводы работы внедрены в курс преподавания на кафедре терапии ФПК и ППС Смоленской государственной медицинской академии, и используются при проведении циклов усовершенствования врачей Смоленской, Брянской, Орловской областей. Издано в соавторстве практическое руководство для врачей «Диагностика и лечение ишемической болезни сердца» и монография «Биологический возраст и новые факторы риска сердечно-сосудистых заболеваний». По материалам диссертации сделано рационализаторское предложение и подана заявка на изобретение.
Апробация работы
Основные результаты исследований доложены на VII - ХIII Международных научно-практических конференциях «Пожилой больной. Качество жизни» (Москва, 2002 – 2008 гг.); II Съезде геронтологов и гериатров России (Москва, 2003); Российском национальном конгрессе кардиологов (Томск, 2004); ХI Российском национальном конгрессе «Человек и лекарство» (Москва, 2004); I- III Межобластной конференции «Пожилой больной» (Смоленск, 2004-2006 гг.); 4–ой национальной научно-практической конференции с международным участием «Активные формы кислорода, оксид азота, антиоксиданты и здоровье человека» (Смоленск, 2005); II Национальной научно-практической конференции с международным участием «Теория и практика оздоровления населения России» (Ижевск, 2005); Юбилейной научной конференции «Университетская наука: взгляд в будущее» (Курск, 2005); I Национальном конгрессе терапевтов (Москва, 2006), I конгрессе специалистов по сердечной недостаточности (Москва, 2006); VI Европейском конгрессе геронтологов и гериатров (Санкт-Петербург, 2007); заседании Смоленского областного научного общества терапевтов «Исследование КАРДИНАЛ – место антагонистов кальция в лечении АГ» (Смоленск, 2007).
Публикации
По теме диссертации опубликовано 40 работ; 24 – в центральной печати, из них
18– в журналах, рекомендованных ВАК.
Структура и объем диссертации
Диссертация изложена на 301 странице машинописного текста, содержит введение, обзор литературы, материалы и методы исследования, 6 глав результатов собственных исследований, обсуждение, выводы, практических рекомендации, список литературы и приложения.
Диссертационная работа иллюстрирована 69 рисунками и 48 таблицами. Список литературы содержит библиографические сведения о 446 литературных источниках, из них 224 – отечественных, 222 – зарубежных.
Диссертационная работа выполнена в соответствии с планом научных работ Смоленской государственной медицинской академии, № Гос. регистрации – 01200608914, код ВНТИЦ – 0203042140360.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В ходе работы обследовано 308 амбулаторных и стационарных пациентов мужского пола с АГ 1-3 степени и изолированной систолической АГ в возрасте от 35 до 98 лет. Контрольную группу составили 148 пациентов мужского пола в аналогичном возрастном диапазоне без клиники артериальной гипертензии и указаний на нее в анамнезе. По своей структуре исследование было одномоментным (поперечным). Сравнительная оценка влияния лекарственной гипотензивной терапии проводилось по плану параллельных групп.
На основании рекомендаций Европейского регионарного бюро ВОЗ пациенты были разделены на группы по возрасту: зрелый – 35-59 лет, пожилой - 60-74 года, старческий – 75-89 лет, долгожители 90 -98 лет. (табл. 1).
Таблица 1. Возрастная структура исследуемого контингента
| Исследуемый контингент | Зрелый возраст n (%) | Пожилой возраст n (%) | Старческий возраст n (%) | Долгожи-тели n (%) | Всего n (%) |
| Контрольная группа n=148 | 62 (41,9) | 34 (23) | 35 (23,7) | 17 (11,4) | 148 (32,4) |
| Больные с АГ n=308 | 92 (29,9) | 115 (37,3) | 88 (28,5) | 13 (4,3) | 308 (67,6) |
| ВСЕГО n=456 | 154 (33,5) | 149 (32,6) | 123 (26,9) | 30 (7) | 456 (100) |
Для диагностики АГ использовались рекомендации рабочей группы по лечению АГ Европейского общества гипертонии (ESH) и Европейского общества кардиологов (ESC) 2007 года с выделением АГ 1,2,3 степени и изолированной систолической АГ (ИСГ) по наибольшим значениям систолического АД при условии, что ДАД <90 мм.рт.ст.
Исследовались факторы, влияющие на прогноз и учитывающиеся при оценке общего (суммарного) сердечно-сосудистого риска: систолическое АД (САД), диастолическое АД (ДАД), пульсовое АД (ПАД), индекс массы тела (ИМТ), уровень гликемии (Gl) и креатинина плазмы, общий холестерин плазмы (ОХ), скорость клубочковой фильтрации (СКФ) с использованием формулы Кокрофта-Гаулта, скорость распространения пульсовой волны по сосудам эластического, мышечного и смешанного типов с расчетом индексов жесткости CAVI 1 и 2. Диагностику ассоциированных клинических состояний (ИБС, ХСН, заболевания периферических артерий) проводили с помощью клинических, ЭКГ - критериев, данных велоэргометрии и/или холтеровского мониторирования ЭКГ, ультразвуковой допплерографии сосудов нижних конечностей, шкалы оценки клинического состояния (Мареев В.Ю., 2000). За ЭКГ- критерии гипертрофии левого желудочка (ГЛЖ) принимали значения индекса Соколова-Лайона > 38 мм.
Для изучения степени развития процесса старения проводилось определение биологического возраста (БВ) с помощью уравнения множественной регрессии по методике Киевского НИИ Геронтологии с использованием стандартного набора маркеров (формула В.П.Войтенко с соавт. для мужчин – БВ = 26,985+0,215САД-0,149ЗВыд -0,151СБ+0,723СОЗ, где Звыд – задержка дыхания после выдоха в сек., СБ- статическая балансировка на левой ноге, СОЗ – субъективная оценка здоровья, анкета из 29 вопросов). Темп старения рассчитывался на основе сопоставления полученных показателей БВ с должным БВ (ДБВ). Темп старения считался замедленным если БВ был меньше ДБВ на 5 и более лет; нормальным (физиологическим) – если разница БВ и ДБВ находилась в диапазоне от –4,9 до +4,9 лет; ускоренным – если БВ был больше ДБВ на 5 и более лет.
В исследуемый контингент не включались больные, имеющие лекарственную аллергию на антагонисты кальция, - адреноблокаторы, ингибиторы АПФ, диуретики; пациенты с инфекционными заболеваниями в острой фазе; с нестабильной стенокардией и перенесенным инфарктом миокарда или инсультом в предшествующие 6 месяцев; с мерцательной аритмией, желудочковой экстрасистолией III-V класса (B. Lown, M. Wolf), тяжелой сердечной недостаточностью (IIБ-III ст., по классификации Василенко-Стражеско, IV ФК по NYHA); с сахарным диабетом, хроническим легочным сердцем, с тяжелыми острыми и хроническими заболеваниями желудочно-кишечного тракта, нервной системы, со стойкой протеинурией и повышенным содержанием креатинина в крови (более 115 мкмоль/л); выраженным ожирением (ИМТ более 40 кг/м), печеночной и почечной недостаточностью. Также исключались пациенты с вторичной симптоматической артериальной гипертензией. В период обследования пациентов все сопутствующие заболевания находились в стадии стойкой клинической ремиссии.
Специальные методы исследования
Суточное мониторирование АД (СМАД) проводили с помощью автоматической системы ВR-102 (SCHILLER, Швейцария). Были рассчитаны средние показатели АД за сутки, в дневные и ночные часы (мм. рт. ст.), вариабельность АД и суточный индекс. Офисное АД измеряли по методу Н.С.Короткова.
Стационарным больным проводилось исследование вариабельности сердечного ритма (ВСР) методом кардиоинтервалографии (КИГ) в покое и после активной ортоклиностатической пробы (АОП) с использованием автоматизированного диагностического комплекса «Анкар-131» («МЕДИКОМ-МТД», Россия). Проводился мониторинг количественных параметров ЭКГ (длительность интервалов RR) синхронно с электрокардиограммой и их последующей компьютерной обработкой во взаимосвязи с функциональной АОП. У амбулаторных пациентов ВСР исследовалась на электрокардиографе FX-7202 CARDIMAX («FUKUDA DENSHI», Япония) при записи 5-минутных участков ЭКГ утром в состоянии покоя при подключении программного картриджа PC-7403. Анализировались показатели Евроамериканского стандарта для временной и частотной области и показатели вариационной пульсометрии: СКО, SDNN (в м/с) - среднеквадратическое отклонение RR, M (MEAN) – среднее значение RR; СV – коэффициент вариации ЧСС, выражаемый в %; Мо (Мода); АМо – амплитуда моды, вероятность моды в %; МхDMn – вариационный размах (разница значений максимального (Xmax) и минимального (Xmin) кардиоинтервала); MxRMn – отношение (Xmax/Xmin); ИВР (индекс вегетативного равновесия) – отношение АМо / МхDMn.; Sl – стресс-индекс (вегетативный тонус); ВР (вегетативная реактивность) – в виде отношения Sl 2/ Sl 1, (Sl 1 – стресс- индекс до проведения пробы, Sl 2 – после проведения АОП). Определялась асимпатикотоническая, нормосимпатикотоническая и гиперсимпатикотоническая вегетативную реактивность. Значения Sl>500 усл.ед. расценивались как гиперсимпатикотония, 200-500 усл.ед. – умеренная симпатикотония, < 200 усл.ед. – нормосимпатикотония (эйтония).
Определение уровня кортизола в сыворотке крови производили с помощью набора реагентов «Стероид ИФА кортизол – 01» («Алкор Био», Россия), методом твердофазного иммуноферментного анализа. Специфичность метода для кортизола составляет 100%. Забор крови проводили между 830 – 930 часами утра после 10-часовой голодной паузы. Повторный забор – между 1930 – 2030 часами вечера того же дня. Образцы крови центрифугировали, полученную сыворотку замораживали при -20 С.
Изучение податливости, растяжимости и жесткости артерий различного калибра на участке аорта – магистральные артерии нижних конечностей проводилось с помощью метода обьемной сфигмографии на аппарате VaSera-1000 («FUKUDA DENSHI», Япония). С помощью основного режима определялись показатели скорости распространения пульсовой волны (СРПВ), характеризующие состояние сосудов преимущественно мышечного типа (B-PWV – плечевая артерия); смешанного типа (магистральные сосуды нижних конечностей) – СРПВ между правым плечом и правой (R-PWV) и левой (L-PWV) голенью с расчетом индексов жесткости CAVI 1 (R и L). Сосуды эластического типа исследовали с помощью аморфных датчиков. Определялась СРПВ по аорте (A-PWV) и по сонной артерии (C-PWV) с расчетом индекса жесткости аорты CAVI 2. Индекс жесткости вычислялся по формуле: CAVI=1/а[1/k2(lnPs/Pd)PWV'2+b], где Ps – систолическое АД, Pd – диастолическое АД, PWV’ – СРПВ, k, а, b – постоянные величины. «Биологический возраст» сосудистой стенки определялся с учетом значений R и L – PWV и календарного возраста пациента.
Морфо-функциональное состояния сердца исследовалось с помощью эхокардиографии (ЭхоКГ) («TOSHIBA NEMIO SSA 550А» Япония) по стандартной методике, с использованием рекомендаций Американского эхокардиографического общества и Европейской исследовательской группы по диастолической сердечной недостаточности. За ЭхоКГ критерии ГЛЖ для мужчин принимали значения индекса массы миокарда ЛЖ 125г/м.
Периферическое сосудистое сопротивление в брахиоцефальных и позвоночных артериях (ПА) исследовали с помощью ультразвуковой допплерографии общих (ОСА), наружных (НСА), внутренних сонных артерий (ВСА) в экстракраниальном отделе и терминальном отделе ВСА – надблоковых артериях (НБА) с обеих сторон в постоянном волновом режиме датчиком 4 МГц из переднешейного доступа после 5-минутной адаптации больного. Для этих целей использовался аппаратно – программный ультразвуковой диагностический комплекс «АНГИОДИН» (Россия). Качественная оценка допплерограмм осуществлялась визуально по характеру огибающей кривой и концентрации частот вблизи максимума. Количественный анализ спектра допплеровского сдвига частот проводился в спектральном режиме с помощью определения параметров линейной скорости кровотока: пиковой систолической (Vs), диастолической (Vd) и средневзвешенной (Vm), с расчетом индексов периферического сопротивления – пульсационного (PI) по формуле: Vs-Vd\Vm и резистивного (IR) по формуле: Vs-Vd\Vs. Извитость сонных артерий и наличие атеросклеротических бляшек оценивалась с помощью дуплексного сканирования. Ультразвуковым способом определяли толщину комплекса интима-медиа (ТИМ) общей сонной артерии (линейный датчик 7,5 МГц, «Sonos -2500», «Hewlett Packard» США). Признаками атеросклеротического поражения считали ТИМ >0,9 мм; наличие бляшки - ТИМ >1,3 мм.
Церебральная гемодинамика исследовалась методом реоэнцефалографии (РЭГ) на компьютерном реографе-полианализаторе РПГА-6/12 «РЕАН ПОЛИ» 4 модификации («Медиком», Россия) с использованием базовой версии. Данный метод позволял оценить пульсовое кровенаполнение – реографический индекс (РИ), время быстрого кровенаполнения крупных артериальных стволов (ВБКН), время медленного наполнения средних и мелких артериальных сосудов (ВМКН), периферическое сосудистое сопротивление (ППСС), а также эластические свойства магистральных артерий - время распространения пульсовой волны (ВРПВ); тонус артерий мелкого калибра и артериол – дикротический индекс (ДКИ); венозный отток (ИВО); тонус посткапиллярно-венулярных сосудов – диастолический индекс (ДСИ). Для этих показателей рассчитывались средние значения слева (S) и справа (D).
Обработка полученного материала проводилась методом вариационной описательной статистики. Данные представлены в виде средней арифметической (М) ± стандартное отклонение (SD). В зависимости от характера распределения использовались параметрические и непараметрические методы статистики. Для определения статистической значимости различий использовался критерий t Стьюдента, критерий Колмогорова–Смирнова, U-критерий Манн-Уитни. Для количественных признаков, не подчиняющихся закону нормального распределения, вычислялась медиана (Me) и 95% доверительный интервал (ДИ). Для сравнения двух групп по количественным признакам, использовались непараметрические критерии Вилкоксона (W-test), критерий знаков. При расчете и изучении корреляционных взаимосвязей для изучаемых параметров использовался ранговый корреляционный анализ по Спирмену. При проведении простого регрессионного анализа использовались модели линейной регрессии с анализом коэффициентов корреляции (r) и детерминации (r). Для выявления взаимосвязи нескольких признаков использовался многомерный анализ с пошаговым отбором переменных, анализом дисперсии и вычислением коэффициентов множественной детерминации (R). Различия и корреляционные связи считались статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение
Количественное распределение пациентов мужского пола с артериальной гипертензией и нормальным АД в зависимости от темпа биологического старения в исследуемых возрастных группах представлено в таблицах 2-3.
Таблица 2. Распределение пациентов с нормальным АД в зависимости от возраста и темпа биологического старения
| ТЕМП СТАРЕНИЯ | Зрелый n (%) | Пожилой n (%) | Старческий и долгожители n (%) | Всего n (%) |
| Замедленный | 7 (11,3) | 10 (29,4) | 41 (78,9) | 58 (38,9) |
| Нормальный | 30 (48,4) | 24 (70,6) | 11 (21,1) | 65 (45,3) |
| Ускоренный | 25 (40,3) | - | - | 25 (15,8) |
| ВСЕГО | 62 | 34 | 52 | 148 (100) |
Анализ представленных данных показывает явное преобладание замедленного темпа старения в старческом возрасте (78,9%), и отсутствии ускоренного темпа у лиц старше 60 лет при нормальных показателях АД.
Таблица 3. Распределение пациентов с АГ в зависимости от возраста и темпа биологического старения
| ТЕМП СТАРЕНИЯ | Зрелый n (%) | Пожилой n (%) | Старческий и долгожители n (%) | Всего n (%) |
| Замедленный | - | 3 (2,6) | 31 (30,6) | 34 (11) |
| Нормальный | 17 (18,4) | 37 (32,1) | 47 (46,7) | 101 (32,7) |
| Ускоренный | 75 (81,6) | 75 (65,3) | 23 (22,7) | 173 (56,3) |
| ВСЕГО | 92 | 115 | 101 | 308 (100) |
Приведенные данные демонстрируют превалирование ускоренного темпа старения в зрелом и пожилом возрасте (81,6 и 65,3% соответственно) у пациентов АГ в сравнении с их нормотензивными ровесниками. У пациентов старше 75 лет АГ не столь выраженно влияет на скорость старения – поэтому частота случаев встречаемости ускоренного темпа в старческом возрасте и у долгожителей не превышает 22,7% при явном преобладании замедленного (30,6%) и нормального (46,7%) темпов старения. Дальнейший анализ показал, высокую распространенность ИБС у гипертоников зрелого возраста (23,9%), в то время как у их нормотензивных ровесников частота зафиксированных случаев ИБС не превышала 1,6 % (р<0,01). В зрелом возрасте у пациентов с ускоренным темпом старения преобладала систоло-диастолическая АГ (СДАГ) II-III степени (74,7%). У пожилых больных с ускоренным темпом старения также лидировала СДАГ (72%). У 22,7% пациентов пожилого возраста выявлялась ИСГ 2 типа, трансформированная из систоло-диастолической АГ, имевшей место у этих пациентов до 60-летнего возраста. В группе пациентов с АГ старческого возраста и долгожителей при замедленном темпе старения преимущественно встречалась ИСГ 1 типа (71,8%), связанная с медленно развивающимися инволютивными изменениями в сердечно-сосудистой системе. В зрелом возрасте эти пациенты имели нормальное АД.
Влияние факторов риска сердечно-сосудистых заболеваний на биологический возраст у мужчин
В ходе исследования были проанализированы средние значения ряда основных факторов риска и факторов влияющих на прогноз сердечно-сосудистых заболеваний (САД, ДАД, ПАД, ЧСС, ИМТ, СКФ, ХС, креатинина, глюкозы, СРПВ по сосудам эластического, мышечного и смешанного типов и индекс жесткости CAVI) в различных возрастных группах и проведен корреляционный и регрессионный анализ взаимосвязи их с календарным (КВ) и биологическим (БВ) возрастом.
У пациентов контрольной группы при проведении линейного одностороннего анализа наиболее значимые коэффициенты корреляции (r) и детерминации (r) были получены между КВ и СРПВ по сосудам смешанного типа (r=0,78; r=61,1), КВ и СКФ (r=-0,41; r=17,1), КВ и пульсовым давлением (r=0,39; r=15,4). Зависимость умеренной степени отмечена между КВ и ЧСС, КВ и САД, КВ и ДАД, КВ и ИМТ, КВ и глюкозой. Таким образом, с увеличением хронологического возраста даже при сохранении нормального САД наблюдается медленное повышение ПАД, выраженное увеличение СРПВ, особенно по периферическим сосудам и снижение скорости клубочковой фильтрации.
При проведении многофакторного анализа зависимости БВ от факторов риска у пациентов с нормальным АД после процедуры пошагового отбора переменных остались 5 независимых факторов:
БВ=0,964 ИМТ + 4,01 Глюкоза – 0,226 Креат. + 0,343 ПАД + 2,011 СРПВкф.
Таким образом, пульсовое давление закономерно увеличивается как при росте КВ, так и при увеличении БВ у нормотоников. Однако у пациентов с нормальным АД СРПВ на каротидно-феморальном участке играет более значимую роль в увеличении биологического возраста, чем СРПВ по сосудам смешанного типа. Проведенное исследование обозначило новые значимые факторы, влияющие на БВ у нормотензивных пациентов: ИМТ и уровень гликемии, которые увеличивают биологический возраст и, следовательно, темп старения организма при нормальном систолическом АД.
При проведении одностороннего регрессионного анализа у пациентов с АГ наиболее значимые коэффициенты корреляции и детерминации были получены между КВ и СРПВ по сосудам смешанного (r=0,62; r=39,5) и мышечного (r=0,49; r=24,5) типов, КВ и СКФ (r=-0,64; r=42,1), КВ и ДАД (r=-0,38; r=15,3), КВ и пульсовым давлением (r=0,48; r=23,7). Умеренной степени зависимость отмечена между КВ и САД, КВ и ИМТ.
При проведении многофакторного анализа зависимости БВ от факторов риска у пациентов с АГ после пошагового отбора переменных остались 5 независимых факторов:
БВ=0,085 ПАД + 0,161 ЧСС + 0,315 ИМТ + 0,289 САД - 0,045 СКФ
Таким образом, у пациентов с АГ на биологическое старение в значительной степени будут влиять: ПАД, ЧСС, ИМТ, уровень систолического АД и СКФ, что важно учитывать при проведении антигипертензивной терапии.
У пациентов с АГ средние значения САД и ПАД были выше в старших возрастных группах по сравнению со зрелым возрастом (р < 0,01). Наибольший ИМТ был зафиксирован в зрелом возрасте и составил 30,20±5,54 кг/м. Показатель общего холестерина превышал 5,2 ммоль/л у пациентов с АГ во всех возрастных группах. СКФ, ДАД и уровень сывороточного креатинина имели четкую возрастную зависимость. ЧСС у лиц старческого возраста и долгожителей составила < 70 уд. в мин. Зависимость СРПВ по сосудам различных типов от возраста была аналогична зависимости в контрольной группе, однако у пациентов с АГ в зрелом возрасте ее значения статистически значимо отличались от значений выявленных у пациентов с нормальным АД (р < 0,01). Следовательно, АГ оказывает отчетливо выраженное влияние на сосудистое ремоделирование в зрелом возрасте. Однако эта зависимость находится в тесной связи с гиперхолестеринемией и избыточной массой тела.
У пожилых пациентов с АГ были выявлены прямые положительные корреляции между СРПВ и ЧСС (r=0,61, p=0,03); САД и ЧСС (r=0,58, p=0,04); ХС и ЧСС (r=0,65, p=0,02); ХС и САД (r=0,65, p=0,02); СРПВ и ХС (r=0,64, p=0,02); что отражает тесную взаимосвязь АГ с гиперхолестеринемией, сосудистым ремоделированием и гиперсимпатикотонией в этой возрастной группе. Обнаруженные взаимосвязи дают возможность выявить формирование у пожилых пациентов с АГ особой патологической «функциональной системы».
У лиц старческого возраста и долгожителей с АГ найдены отрицательные корреляции между КВ и ЧСС (r = – 0,71; p=0,01), КВ и СКФ (r = – 0,69, p=0,01). Анализ частоты распространения различных форм АГ в этой возрастной группе выявил явное преобладание ИСГ, возникшей после 60-летнего возраста и связанной с замедленным темпом биологического старения. Формирование АГ в позднем возрасте сопровождается адаптационно-компенсаторной перестройкой адрено- и холинергической иннервации, сопровождающей «брадикардию пожилых».
Как было продемонстрировано ранее, АГ оказывает наиболее сильное влияние на темп биологического старения в зрелом возрасте. Для изучения степени влияния факторов риска ССЗ на различия между темпами старения были рассчитаны средние значения основных факторов риска, выявленных у пациентов с нормальным АД и АГ и проведено их сравнение между темпами биологического старения (табл. 4).
Анализ полученных данных наглядно показывает, что у пациентов с АД<140/90 мм. рт. ст. в зрелом возрасте различия между темпами были обусловлены двумя важнейшими факторами – систолическим АД и жесткостью сосудов эластического типа. Лица с «ускоренным» темпом биологического старения имели «высокое» нормальное АД и «жесткую» аорту. У пациентов с АГ в аналогичной возрастной группе различия были обусловлены ЧСС, уровнем холестерина и показателем жесткости аорты CAVI2.
Таблица 4. Средние значения основных факторов риска у пациентов зрелого возраста в основной и контрольной группе (M± SD)
| Параметр | Нормальное АД | Артериальная гипертензия | ||
| Темп | нормальный | ускоренный | нормальный | ускоренный |
| Число больных | 37 | 25 | 27 | 45 |
| Ср.возраст,годы | 43,4±7,9 | 41,7±7,9 | 49,8±7,6 | 45,8±7,5 |
| ЧСС (уд.мин.) | 65,1±8,2 | 67,8±8,7 | 65,8±4,9 | 70,7±3,4• |
| САД (мм рт ст) | 122,9±8,1 | 130,5±7,1 | 149,2±8,2 | 156,2±3,5 |
| ДАД (мм рт ст) | 77,9±6,6 | 82,6±6,1 | 94,8±6,3 | 97,2±8,6 |
| ПАД (мм рт ст) | 45,7±7,3 | 48,7±7,4 | 56,0±9,1 | 58,0±11,1 |
| ИМТ (кг/м) | 26,1±2,7 | 25,4±3,7 | 30,2±2,4 | 28,7±4,4 |
| Gl (ммоль/л) | 4,3±1,3 | 4,6±0,6 | 5,1±0,3 | 4,8±0,2 |
| ОХ (ммоль/л) | 4,9±1,5 | 5,2±1,2 | 5,0±0,2 | 6,1±0,7• |
| В–PWV (м/с) | 6,4±0,7 | 6,5±0,7 | 7,6±1,1 | 7,3±1,1 |
| R–PWV (м/с) | 12,0±0,9 | 12,0±1,1 | 14,4±2,2 | 14,5±1,3 |
| CAVI -2 | 6,6±0,7 | 8,2±1,7 | 8,1±1,3 | 9,2±1,2• |
Примечание: р < 0,05 - различие между нормальным и ускоренным темпами в контроле. • < 0,05 - различие между нормальным и ускоренным темпами в основной группе.
Полученные данные подтверждают важность индивидуализации профилактической стратегии в различных возрастных группах у лиц мужского пола с АГ и нормальным АД.
Анализ вегетативно-адаптационных звеньев гомеостаза
Результаты исследования вариабельности сердечного ритма.
Сравнительная характеристика показателей вариабельности сердечного ритма (ВСР) у пациентов контрольной группы показала, что статистически значимое «напряжение» регуляторных систем, связанное с повышением симпатического тонуса (ИВР, АМО), наблюдается более выраженно в пожилом возрасте по сравнению со старческим. Анализ ВСР у пациентов с АГ выявил следующие особенности: показатели симпатической активности – ЧСС, Sl, АМо, также имели наибольшие значения в пожилом возрасте; у лиц старческого возраста обнаружено статистически значимое снижение MxDMn и SDNN по сравнению со зрелым и пожилым возрастом. Это свидетельствует об уменьшении лабильности регуляторных систем и является своеобразной компенсаторной реакцией, ограничивающей избыточные симпатические влияния. Sl был высоким во всех возрастных группах, что отражает независимое от возраста влияние АГ на степень напряжения регуляторных систем.
Анализ частоты сочетания различных вариантов вегетативного тонуса и типов реактивности, определяемой с помощью активной ортоклиностатической пробы (АОП) в зависимости от возраста и наличия АГ показал, что у нормотоников зрелого возраста варианты вегетативного тонуса были представлены умеренной симпатикотонией (43,7%) и эйтонией (31,3%). Гиперсимпатикотонический вариант вегетативного тонуса (со значениями Sl > 500 усл.ед.) встречался в 25% случаев в основном у лиц с черепно-мозговыми травмами (ЧМТ) в анамнезе. Реактивность была представлена асимпатикотоническим (50%) и нормосиматикотоническим типами (37,5%). У пациентов пожилого возраста с нормальным АД сохранялись аналогичные зафиксированным у пациентов в зрелом возрасте пропорции в частоте различных вариантов тонуса и типов реактивности. У лиц старческого возраста и долгожителей явно преобладали наиболее «сбалансированные варианты» тонуса и реактивности: частота умеренной симпатикотонии и эйтонии составила в сумме 86,2%, а нормосимпатикотонический тип реактивности встречался практически у половины обследованных пациентов (48%).
Таким образом, варианты «сбалансированного» вегетативного обеспечения явно начинают превалировать у пациентов с нормальным АД, «перешагнувших» 75-летний рубеж без сердечно-сосудистых катастроф и имеющих замедленный или нормальный темп биологического старения.
У пациентов с АГ в зрелом возрасте преобладала выраженная гиперсимпатикотония (43,5%), однако реактивность у 47,8% пациентов сохранялась нормосимпатикотонической. Таким образом, в зрелом возрасте «резервы адаптации» еще могут справляться с избыточными симпатическими влияниями, связанными как с центральными (подкорковыми), так и другими факторами (в частности – влиянием никотина, наличием ЧМТ).
У пожилых пациентов с АГ преобладающим вариантом вегетативного тонуса была гиперсимпатикотония (69,4%) при увеличении случаев асимпатикотонического типа реактивности (43,8%). При таком «декомпенсированном» варианте сочетания тонуса и реактивности резервы адаптации в значительной степени исчерпаны.
У пациентов с АГ старческого возраста и долгожителей наблюдалось иная частота встречаемости «сбалансированных» и «декомпенсированных» вариантов сочетания вегетативного тонуса и типа реактивности. Несмотря на высокую частоту умеренной и выраженной гиперсимпатикотонии (88,6%), преобладала нормосимпатикотоническая реактивность (ее доля составила 52,8%). Этот вариант реактивности «защищает» сердечно-сосудистую систему долгожителей, даже при наличии гиперсимпатикотонии.
В ходе исследования проведен многофакторный регрессионный анализ влияния на биологический возраст у нормотоников и пациентов с АГ показателей КИГ, выступающих в роли независимых переменных.
Были получены следующие модели регрессионной зависимости:
БВ=0,399ЧСС+0,028Мо+ 0,0003Амо
(у пациентов с нормальным АД)
БВ=0,419ЧСС+0,035Мо+0,0001Амо+1,365Reakt - 0,039MхDMn
(у пациентов с АГ)
Анализ полученной закономерности устанавливает наличие четкой зависимости между ростом активности симпатической нервной системы и биологическим возрастом, как при нормальном АД, так и при наличии артериальной гипертензии.
Однако у больных с АГ увеличение биологического возраста связано, помимо гиперсимпатикотонии с выраженным уменьшением лабильности регуляции ритма сердца, проявляющимся в сокращении вариационного размаха (MxDMn) и росте реактивности. Данные изменения ограничивают приспособительные возможности сердечно-сосудистой системы у пациентов с АГ.
На основании полученных данных была выдвинута гипотеза о тесной связи типа реактивности и биологическим возрастом. Рост активности симпатической нервной системы является закономерным процессом как физиологического, так и ускоренного вариантов старения. Но залогом «успешного» старения будет наличие нормосимпатикотонического типа реактивности.
Результаты исследования сывороточного кортизола у пациентов основной и контрольной групп
Следует отметить, что у лиц с нормальным АД обнаружено статистически значимое различие (p < 0,01) в содержании сывороточного кортизола в зависимости от возраста: его содержание было повышено на 48% у пациентов старше 60 лет, что указывает на увеличение содержания глюкокортикоидов в сыворотке крови с увеличение возраста. АГ несколько нивелирует эту возрастную зависимость: при сравнении средних значений достоверных различий в уровнях кортизола у пациентов с АГ в зависимости от возраста выявлено не было (табл.5).
Таблица 5. Содержание кортизола в плазме (нмоль/л) в зависимости от возраста и наличия АГ (M±SD)
| Возраст | Зрелый | Пожилой и старческий |
| Нормальное АД | 327,5±66,4 | 509,8±127,86 |
| Артериальная гипертония | 360,79±54,21 | 459,97±87,91 |
Примечание: p< 0,001 достоверность различий у нормотоников старших возрастных групп по сравнению со зрелым возрастом.
Однако, представленные в таблице 6 данные демонстрируют наличие взаимосвязи уровня сывороточного кортизола с возрастом пациентов и с АГ и с нормальным АД.
Таблица 6 Статистически значимые корреляционные взаимосвязи (r) между содержанием кортизола и календарным (КВ), биологическим (БВ) возрастом и статическим балансом (СБ) у нормотоников и пациентов с АГ
| КВ | БВ | СБ | |
| Контроль (n=32) | 0,78 | 0,70 | -0,68 |
| p | 0,0000 | 0,0001 | 0,0001 |
| Артериальная гипертония (n=58) | 0,67 | 0,44 | -0,65 |
| p | 0,0000 | 0,0008 | 0,0000 |
Это свидетельствует о зависимости секреции глюкокортикоидов от функции гипоталамических центров, тормозная активность которых значительно снижается с возрастом. Высоко значимые прямые положительные корреляции кортизола с БВ и отрицательные со статическим балансом, уменьшение которого связано с возрастной дисфункцией гипоталамуса, подтверждает роль высших вегетативных центров в повышении активности симпатической нервной системы.
При проведении одностороннего регрессионого анализа взаимосвязи между календарного, биологического возраста и уровня кортизола у пациентов основной и контрольной групп были получены следующие модели регрессионной зависимости:
Кортизол = 187,12 + 3,646 КВ
(r=0, 61; p=0, 0000)
БВ = 45,4348 + 0,039Кортизол
(r=0, 41; p=0, 0000)
Таким образом, увеличение календарного возраста на 1 год ассоциируется с увеличением секреции кортизола на 3,65 нмоль/л. Однофакторная регрессионная модель показывает что увеличение уровня сывороточного кортизола на 1 нмоль/л ассоциируется с увеличением биологического возраста на 0,04 года (или при нарастании уровня кортизола на 100 нмоль/л БВ увеличивается на 4 года).
Результаты изучения суточных («циркадианных») ритмов секреции кортизола у пациентов с ускоренным и замедленным темпами биологического старения представлены в таблице 7. Амплитудно-фазовые характеристики (амплитуда ритма) являются важными параметрами характеризующими гормональную активность системы гипоталамус-гипофиз-надпочечники. Функция надпочечников в отношении суточной секреции кортизола реализуется через изменение биоритмологических показателей.
Таблица 7. Средние значения изменения циркадианных ритмов секреции кортизола
в зависимости от времени суток (M±SD)
| Время суток Темп старения | Утренние часы (8-8.30) | Вечерние часы (20-20.30) |
| Замедленный и нормальный темп | 565±69,40 | 303,76±134,70 |
| Ускоренный темп | 493,41± 116,29 | 442,75± 108,02# |
Примечание: W – test ; р< 0,001 в сравнении утро-вечер; # р< 0,01 между замедленным и ускоренным темпом в вечернее время.
Таким образом, у пациентов с замедленным темпом биологического старения сохраняется статистически значимая разница между утренним пиком секреции кортизола и его вечерней секреций, которая составляет в среднем 261 нмоль/л (амплитуда колебаний > 100 нмоль/л, т.е в пределах нормальных значений). У пациентов с ускоренным темпом старения сохраняется монотонная секреция кортизола в течении суток: разница между утренними и вечерними значениями – всего 51 нмоль/л (амплитуда колебаний низкая – менее 100 нмоль/л, т.е. происходит сглаживание суточных кривых и уменьшение амплитуды колебаний среднесуточного уровня кортизола). Обращает на себя внимание статистически значимая разница в секреции кортизола в вечернее время у пациентов с ускоренным и замедленным темпом старения– 442,75± 108,02 и 303,76±134,70 нмоль/л, соответственно.
У лиц с замедлением скорости биологического старения сохранение нормальной амплитуды суточного ритма свидетельствует об адекватном функционировании механизма секреции кортизола корой надпочечников и, соответственно, нормальном функционировании более высоких отделов гипоталамо-гипофизарной области.
Результаты исследования суточных ритмов АД в зависимости от темпа
биологического старения
Анализ представленных в таблице 8 данных продемонстрировал, что показатели среднесуточных значений САД, ДАД, а также средних их значений в дневное и ночное время у пациентов с нормальным АД не имели статистически значимых различий в зависимости от темпа биологического старения.
Вариабельность среднесуточного САД и ДАД была достоверно выше у пациентов с ускоренным темпом старения, наиболее выраженная в дневное время, что можно объяснить снижением адаптационно-приспособительных возможностей сердечно-сосудистой системы, которая на небольшие нагрузки отвечает значительным, заметным повышением АД, что свидетельствует о снижении толерантности к физической нагрузке. В ночное время при отсутствии физических нагрузок показатели вариабельности были в пределах нормальных значений в обеих подгруппах вне зависимости от темпа биологического старения.
Таблица 8. Показатели суточного профиля АД у пациентов контрольной и основной групп с различными темпами биологического старения(M±SD)
| Показатели | Нормальное АД | Артериальная гипертензия | ||
| Замедленный (n=27) | Ускоренный (n=23) | Замедленный (n=24) | Ускоренный (n=26) | |
| Ср.сут. САД, мм рт.ст. | 114,78±5,55 | 121,67±3,77 | 143,69±7,89 | 152,94±11,83 |
| Ср.сут.ДАД, мм рт.ст. | 72,89±4,04 | 78,83±4,40 | 77,13±11,33 | 88,94±11,47 |
| Ср. днев.САД,мм рт.ст. | 117,67±7,57 | 125,00±3,16 | 143,13±12,13 | 152,63±12,06 |
| Ср. днев.ДАД, мм рт.ст. | 75,44±3,43 | 82,67±4,80 | 80,06±3,43 | 90,44±10,21 |
| Ср.ночн.САД, мм рт.ст. | 103,00±10,40 | 107,83±8,33 | 118,38±15,11 | 132,19±17,09 |
| Ср.ночн. ДАД, мм рт.ст. | 62,11±6,85 | 64,33±6,68 | 70,06±14,12 | 81,63±18,45 |
| Вар. сут. САД, мм рт.ст. | 14,07±2,69 | 21,83±1,77 | 20,14±3,35 | 18,59±5,25 |
| Вар. сут. ДАД, мм рт.ст. | 14,91±3,51 | 22,05±2,69 | 16,86±4,40 | 16,56±6,57 |
| Вар.дн. САД, мм рт.ст. | 15,16±3,39 | 21,70±2,37 | 17,44±3,66 | 19,63±5,33 |
| Вар. дн. ДАД, мм рт.ст. | 13,88±4,15 | 21,92±3,29 | 13,76±7,46 | 18,59±5,21 |
| Вар.ночн.САД, мм рт.ст. | 11,56±4,07 | 13,91±4,69 | 13,87±5,41 | 15,99±4,94 |
| Вар.ночн.ДАД, мм рт.ст. | 9,68±3,39 | 12,55±2,83 | 10,26±4,62 | 10,80±4,04 |
:Примечаниер<0,05, между замедленным и ускоренным темпом
При изучении выраженности двухфазного ритма (суточного индекса) было выявлено, что среди нормотоников с замедленным темпом преобладали Dipper (52%) и с одинаковой частотой встречались Non–dipper и Over–dipper (26 % и 24%, соответственно). В то время как у нормотоников с ускоренным темпом старения наоборот, частота избыточного или недостаточного снижения ночного АД была выше (78%), чем пациентов с нормальным суточным ритмом (22%).
Таким образом, у лиц с ускоренным темпом старения даже при нормальных цифрах «офисного АД» отмечается нарушение вариабельности АД в дневное время и изменение суточного индекса. По данным других авторов (Одинцова Н.Ф., 2005) у Non-dipper и Over-dipper выше риск «немого» повреждения головного мозга, особенно при наличии других факторов риска: гиперхолестеринемии, метаболических нарушений.
У пациентов с АГ в отличие от контроля показатели вариабельности суточного и дневного САД, ДАД были выше нормальных значений в обеих подгруппах вне зависимости от темпа биологического старения, что отражает влияние самой АГ на состояние адаптационных механизмов, вызывая их перенапряжение. Однако у пациентов с замедленным темпом даже при наличии АГ сохранялись нормальные показатели вариабельности САД и ДАД в ночное время и ДАД в дневное.
Повышенная вариабельность АД увеличивает риск поражения органов-мишеней. Она положительно коррелирует с массой миокарда, структурно-функциональным состоянием левого желудочка, уровнем креатинина, тяжестью ретинопатии и в целом увеличивает риск сердечно-сосудистых осложнений (Шуникова М.И. и др., 2008).
Следует отметить, что статистически значимые более высокие цифры среднесуточных САД и ДАД, средних дневных и ночных САД и ДАД наблюдались у пациентов с АГ и ускоренным темпом биологического старения. У больных с замедленным темпом снижение ночного САД было достаточным (<120 мм.рт.ст).
Изучение двухфазного ритма в подгруппах больных с АГ показало, что у пациентов с ускоренным темпом старения преобладали Non-dipper (80%) и достаточно часто встречались Night-peaker (10%). Наличие таких ритмов АД резко повышает риск развития мозгового инсульта, усугубляет эндотелиальную дисфункцию и вызывает прогрессирование патологии органов-мишеней. У пациентов с замедленным темпом старения Night-peaker не встречались, частота Non-dipper была значительно ниже (33%), а основную массу составили Dipper и Over-dipper (67%).
Таким образом, у пациентов с ускоренным темпом старения как с нормальным АД, так и с наличием АГ приспособительные механизмы работают на «максимуме» своих генетических и фенотипических возможностей. Это выражается в нарушении циркадианных ритмов степени снижения АД «день-ночь», не адекватных обычным физическим нагрузкам подъёмах АД, проявляющихся повышенной вариабельностью, что создает дополнительную нагрузку на сердечно-сосудистую систему.
При замедленном варианте биологического старения сохраняется «резерв» адаптации, даже при наличии АГ, сформировавшейся, как правило, после 60 лет. У этих пациентов показатели АД незначительно превышают норму, особенно систолического АД, что в свою очередь сказывается и на пульсовом АД, которое тесно связано с биологическим возрастом человека.
Результаты исследования структурно-функционального состояния сосудов эластического, мышечного и смешанного типов
У лиц контрольной группы в возрасте 35-59 лет СРПВ по всем типам сосудов была в пределах нормальных значений (R/L-PWV – 12,2±0,9 мс; B-PWV – 6,6±1,0 мс; A-PWV – 6,8±1,9 мс; CAVI 2 – 6,7±1,7). В возрастной группе 60-79 лет наблюдалось увеличение СРПВ по сосудам мышечного и смешанного типа в сравнении со зрелым возрастом (R/L -PWV – 14,87±2,9 мс, p < 0,01; B-PWV – 7,8±2,1 мс, p< 0,01). В возрасте 80-98 лет наблюдался дальнейший рост СРПВ по этим типам сосудов (R/L-PWV – 17,9±2,7 мс, р < 0,01; B-PWV – 8,8±1,9 мс, p < 0,01).
Анализ результатов изменения сосудов преимущественно эластического типа показал, что наибольшие значения СРПВ по аорте у нормотоников были достигнуты в возрастной группе 60-79 лет (10,7±2,4, р<0,01 по сравнению со зрелым возрастом). При сравнении этой группы с «долгожителями» статистически достоверной разницы в СРПВ по аорте не выявлено. Аналогичная зависимость получена и по «индексу жесткости» аорты CAVI 2. Полученные результаты согласуются с данными Meaume S. et al. (2001), показавшими, что у больных старше 70 лет дальнейшее увеличение возраста не оказывает существенного влияния на СРПВ, хотя, как и у молодых определена зависимость этого показателя от АД, ЧСС и ИМТ. Это указывает на отсутствие прямой линейной зависимости влияния возрастного фактора на скорость старения сосудов преимущественно эластического типа при отсутствии АГ в отличие от сосудов смешанного и мышечного типов.
У пациентов с АГ СРПВ по сосудам мышечного и смешанного типов была достоверно выше в возрастных группах 35-59 лет (R/L-PWV – 14,5±1,9 мс, p < 0,01; B-PWV – 7,6±1,2 мс, p < 0,01) и 60-79 лет (R/L-PWV – 18,6±3,4 мс, p < 0,05; B-PWV – 8,5±1,3 мс, p < 0,05), по сравнению с нормотониками идентичных возрастов.
Максимальные значения СРПВ для сосудов смешанного типа были зафиксированы у пациентов с АГ достигнуты в возрасте 80-98 лет (19,1±1,4 мс), однако статистически значимой разницы с показателями, полученными у нормотоников этой возрастной группы не выявлено (p > 0,05). СРПВ по аорте (8,2±2,5 мс) и индекс CAVI 2 (8,4±1,2) в зрелом возрасте были достоверно выше у гипертоников, чем у пациентов с нормальным АД (p < 0,01); в возрастной группе пациентов с АГ 60-79 лет достоверных различий с нормотониками по этим показателям не выявлено. Наибольшие значения СРПВ по аорте отмечены у пациентов в возрасте 60-79 лет, а по индексу CAVI – в возрасте 80-98 лет (10,3±2,0; p < 0,05 в сравнении с нормотониками).
Наиболее тесная положительная корреляция установлена между показателями СРПВ по сосудам смешанного типов (R\L-PWV) и биологическим возрастом сосудов в различных возрастных группах как у нормотоников, так и пациентов с АГ. Коэффициенты корреляции варьировали от 0,45 до 0,92. Наибольший коэффициент корреляции (0,92) определен у гипертоников зрелого возраста. Эта взаимосвязь может быть обусловлена влиянием повышенного АД на содержание и качественные изменения коллагена в сосудистой стенке. Индекс жесткости аорты (CAVI 2) наиболее тесно связан с биологическим возрастом сосудов у пациентов с АГ в возрастных группах 30-59 и 60-79 лет (r=0,49;0,53).
При изучении корреляционных взаимосвязей оказалось, что наибольшее количество достоверных связей у гипертоников отмечено в возрастной группе 35-59 лет. В возрастных группах 60-79 и 80-98 их количество уменьшается. У нормотоников наибольшее количество достоверных взаимосвязей наблюдается в возрасте 60-79 лет и существенно уменьшается в зрелом и старческом возрасте. Среди изученных показателей по количеству корреляций явно превалировали показатели, характеризующие сосуды смешанного типа (R/L -PWV) – 15 корреляций из 24 (62,5%).
Таким образом, изучение особенности ремоделирования сосудистой стенки с помощью плече-лодыжечного метода определения СРПВ выявило следующие закономерности: 1) скорость старения сосудов смешанного типа (магистральных артерий нижних конечностей) и преимущественно мышечного типа (плечевая артерия) имеет прямой возрастзависимый характер; 2) старение сосудов эластического типа (в частности, аорты), у пациентов с нормальным АД происходит с наибольшей скоростью до 75 лет, в дальнейшем «скорость» ремоделирования падает; 3) при наличии артериальной гипертензии ремоделирование сосудов смешанного, мышечного типов и аорты начинается уже в зрелом возрасте, увеличивая как биологический возраст сосудов, так и интегральный биологический возраст.
Состояние тонуса и ремоделирование брахиоцефальных артерий у пациентов с АГ и нормотоников в различных возрастных группах.
Результаты анализа УЗДГ каротидных и позвоночных артерий у пациентов с АД < 140/90 мм. рт. ст. не выявили статистически значимых различий в показателях пиковой систолической (Vs), диастолической (Vd) скорости кровотока и индексах периферического сопротивления в зависимости от возраста, за исключением терминального отдела брахиоцефальных артерий (НБА), где отмечалось статистически значимое снижение Vd (p < 0,05).
В ходе анализа динамики показателя, характеризующего тонико-эластические свойства артерий (пульсационный индекс PI, Gosling) в зависимости от уменьшения диаметра сосуда, обнаружено статистически значимое его повышение с обеих сторон у пациентов старшей возрастной группы в позвоночных и надблоковых артериях (рис. 1). Выявленные незначительные изменения в линейных показателях кровотока и параметрах периферического сопротивления, характеризующих тонико-эластические свойства брахиоцефальных и позвоночных артерий, свидетельствуют об адекватном функционировании системы ауторегуляции мозгового кровотока в экстракраниальных отделах каротидных артерий у пациентов без АГ в возрастном диапазоне 35-90 лет.
слева справа
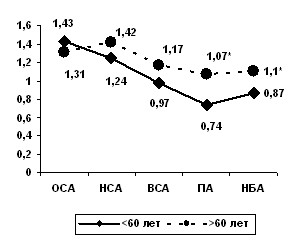
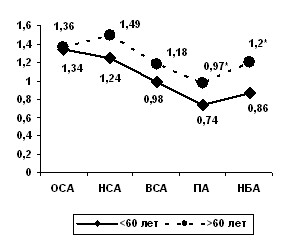
Рис. 1. Показатели пульсационного индекса (PI) в брахиоцефальных и позвоночных артериях у нормотоников в различных возрастных группах (* – p<0,05).
Несмотря на то, что у пациентов старше 60 лет значения PI были выше, чем у пациентов в зрелом возрасте, и, соответственно, отмечалось снижение Vd в общей, наружной и внутренней сонных артериях, эти изменения не достигали статистически значимых уровней. Более высокий миогенный тонус данных артерий у мужчин старше 60 лет может быть обусловлен, в частности, активацией симпатической нервной системы. Влияние возрастных изменений на эластические свойства сосудов мелкого калибра (позвоночных и надблоковых артерий) проявлялось в виде статистически значимого повышения PI.
У пациентов с АГ пожилого и старческого возраста обнаружено статистически значимое снижение Vd уже на уровне НСА (р < 0,01), а также снижение Vs в сосудах мелкого калибра (НБА), чего не наблюдалось у пациентов зрелого возраста. Наличие АГ на фоне возрастных изменений вызывало резкое повышение миогенного тонуса, проявляющееся уже при небольшом уменьшении калибра сосуда. ОСА – изменения субпороговые, статистически незначимые; НСА, ВСА, ПА, НБА – увеличение PI свидетельствует о наличии выраженного гемодинамически значимого «функционального» стеноза (рис. 2).
По мере уменьшения диаметра сосудов четко выявляется выраженное увеличение сосудистого тонуса за счет роста периферического сопротивления у пациентов с АГ старшей возрастной группы. Только на уровне ОСА – крупного сосуда с мощной мышечной стенкой не отмечается статистически значимой разницы в изменениях PI в зависимости от возраста.
слева справа
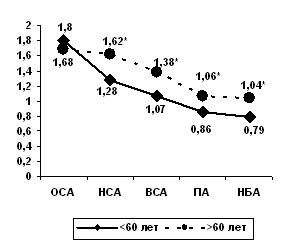
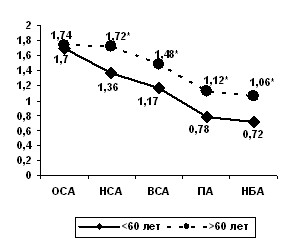
Рис. 2. Показатели пульсационного индекса PI в брахиоцефальных и позвоночных артериях у пациентов с АГ в различных возрастных группах (* – p<0,05).
Согласно результатам корреляционного анализа (по методу Спирмена) взаимосвязи между PI и показателями, характеризующими эластичность сосудистой стенки других сосудов большого круга кровообращения: скоростью пульсовой волны (СРПВ) по сосудам эластического, мышечного и смешанного типов (аорте, правой плечевой артерии, магистральным артериям нижних конечностей) и индексами САVI1 и 2, - PI в ОСА и НСА положительно коррелировал с B-PWV (r=0,37, р=0,01; r=0,47, р=0,01), с R/L -PWV (r=0,33, р=0,03; r=0,65, р=0,000), A-PWV (r=0,4, р=0,05) и индексом жесткости CAVI-1(r=0,44, р=0,02). Vs в ОСА отрицательно коррелировала с СРПВ по аорте (r=-0,53, p=0,01), по плечевой артерии (r=-0,42, p=0,008), с индексами жесткости аорты CAVI 2 (r=-0,46, p=0,02) и магистральных артерий мышечно-эластического типа CAVI 1 (r=-0,44, p=0,01). Vd в НСА отрицательно коррелировала с СРПВ по плечевой артерии (r=-0,53, p=0,006), CAVI 1 R/L (r=-0,62, p=0,001, r=-0,46, p=0,01).
Положительные взаимосвязи показателей каротидной УЗД,Г отражающих периферическое сопротивление, и показателей объемной сфигмографии, характеризующих ремоделирование аорты, плечевой артерии и магистральных артерий нижних конечностей указывают на тесную связь между состоянием кровотока в брахиоцефальных сосудах, определяющегося суммарным эффектом миогенного тонуса а также степенью фиброзно-склеротической трансформации и изменениями жесткости других сосудов большого круга кровообращения. Установленные отрицательные взаимосвязи подтверждают тот факт, что снижение линейных скоростных потоков в брахиоцефальных сосудах также тесно связано со снижением эластических свойств и увеличением ригидности сосудистой стенки не только в центральных, но и периферических магистральных сосудах.
Таким образом, индексы периферического сопротивления являются надежными маркерами, отражающими не только сопротивление, но и ремоделирование сосудистой стенки каротидных артерий. С целью изучения влияния скорости биологического старения на показатели УЗДГ в брахиоцефальных и позвоночных артериях был проведен анализ изменения линейных параметров и индексов периферического сопротивления в сосудах различного калибра по степени уменьшения их диаметра на участке «общие сонные артерии – надблоковые артерии». В ходе исследования не выявлено статистически значимых изменений в зависимости от темпа биологического старения Vs и Vd по ОСА, НСА, ВСА, ПА и НБА. Однако изменения касающиеся индексов периферического сопротивления (IR, PI), обнаружили следующие особенности: средние значения PI по надблоковым артериям имели статистически значимые различия у пациентов с замедленным и ускоренным темпом. У лиц с ускоренным темпом старения значения PI составили 1,26 ±0,38 усл. ед., в то время как в группе пациентов с замедленным темпом они были ниже - 0,93 ± 0,06 усл.ед. (p < 0,05). Аналогичные изменения касались и IR по НБА: средние значения у пациентов с ускоренным темпом старения были статистически значимо выше по сравнению со значениями, зафиксированными в группе пациентов с замедленным темпом старения – 0,65 ± 0,1 и 0,54± 0,1 усл.ед., соответственно (p < 0,05). При проведении сравнения значений исследуемых индексов на участке крупный сосуд (ОСА) – мелкий сосуд (НБА) была выявлена следующая закономерность: разница в средних значениях () PI на данном участке, т.е. степень «гемодинамического перепада» была высокой у лиц с замедленным темпом старения – 1,77±0,37 по ОСА и 0,93±0,06 усл.ед. по НБА (p < 0,05). Значения разницы () превышали 0,5 усл.ед. Статистически значимые различия были получены и по IR: 0,73±0,08 по ОСА и 0,52±0,1 усл.ед. в НБА (p < 0,05). Значения разницы () превышали 0,2 усл.ед. У пациентов с ускоренным темпом степень «гемодинамического перепада» была низкой: средние значения PI на участке ОСА – НБА составили 1,55±0,44 и 1,26±0,38 усл.ед. соответственно, различия статистически незначимы, а значения разницы () были меньше 0,5 усл.ед. Аналогичные изменения обнаруживались и по IR у лиц с ускоренным темпом старения: степень «гемодинамического перепада» была меньше 0,2 усл.ед, а разница средних значений статистически незначима.
Таким образом, уменьшение амплитуды колебаний параметров, определяющих периферическое сосудистое сопротивление и эластические свойства артерий на участке «крупный сосуд – мелкий сосуд» по мере уменьшения его диаметра, может констатировать преобладание фиброзно-склеротических изменений. Пациенты с ускоренным темпом старения имели более выраженные проявления атеросклеротических изменений в виде класса стенокардии, частоты встречаемости ПИКС, степени ХСН и степени дисциркуляторной энцефалопатии. По данным дуплексного сканирования у 77% пациентов с ускоренным темпом старения отмечалось наличие атеросклеротических бляшек, в то время как у лиц с замедленным темпом старения наличие атеросклеротических бляшек было выявлено лишь в 15% случаев.
Результаты изучения пульсового кровенаполнения сосудов головного мозга
Результаты анализа пульсового кровенаполнения сосудов головного мозга продемонстрировали статистически значимые изменения параметров РЭГ у нормотоников зрелого возраста между ускоренным и нормальным темпом старения (табл.9). Так, отмечено снижение РИ, увеличение ППСС, нарушение тонуса мелких резистивных сосудов, затруднение венозного оттока. Выявленные изменения параметров РЭГ у лиц с ускоренным темпом старения, на фоне нормального АД могут приводить к нарушению метаболических потребностей мозга и ухудшать функционирование подкорковых структур, ответственных за вегетативное обеспечение, создавая «порочный круг» с включением уже существующих изменений вегетативного звена гомеостаза.
Таблица 9. Показатели РЭГ у пациентов контрольной группы в зрелом возрасте в зависимости от темпов старения (Mе, 95%ДИ).
| Фронто-мастоидальное отведение | Окципито-мастоидальное отведение | |||
| Темп | Нормальный (1) n=31 | Ускоренный (2) n=30 | Нормальный (1) n=31 | Ускоренный (2) n=30 |
| РИ S (Ом) D | 0,09 (0,05-0,14) 0,1 (0,06-0,12) | 0,06 (0,04-0,08) 0,05 (0,03-0,07) | 0,09 (0,05-0,12) 0,09 (0,06-0,12) | 0,06 (0,04-0,08) 0,05 (0,04-0,07) |
| ВБКН S (мс) D | 62,6 (47,2-77,9) 61,2 (45,8-76,5) | 51,2 (44,3-58,1) 52 (42,1-61,8) | 58,1 (55,1-61,2) 61,8 (53,5-70,1) | 54,9 (49,7- 60,1) 55,6 (58,6-59,6) |
| ВМКНS (мс) D | 56,4 (44,8-67,9) 56,2 (44,8-67,9) | 66,7 (56,0-77,5) 63,0 (48,4-77,5) | 62,6 (44,8-80,5) 70,5 (53,5-87,8) | 56 (52,3 -59,7) 56,2 (49,3-63,2) |
| ППСС S ( % ) D | 68,8 (59,7-85,1) 72,4 (54,1-83,4) | 85,5 (79,6-91,4) 93 (81,4-104,8) | 70,6 (53,1-88,1) 70,1 (54,2-86,1) | 78,4 (64,8-92,1) 83,8 (65,6-102) |
| ВРПВ S (мс) D | 138,8 (112-148) 130,4 (122-144) | 111,5 (73-149) 103,5 (65-146) | 134(115- 138,6) 126,8(120,3-141,6) | 106,9(98,6- 115,1) 101,8 (93,1-110,5) |
| ДКИ S (%) D | 57,6 (43,8-78,9) 61,4 (40,1-75,1) | 75,7 (62,9-88,5) 68,7 (54,4-83) | 57,1 (40,4-78,9) 60,1 (40,9-73,4) | 66 (52,9-79) 70,3 (52,9-87,7) |
| ДСИ S (%) D | 49 (22,1-76,4) 48,8 (23,7-74,2) | 60,7 (14,8-106) 58,7 (24,1-93,4) | 58,1 (42,4-79,9) 63,1 (45,9-78,4) | 68 (53,9-79) 72,3 (62,9-97,7) |
| ИВО S (%) D | 15 (9,1-20,8) 17,6 (11,4-23,7) | 25,5 (14,2-36,7) 27,7(21,6-33,9) | 10,8 (4,8-20,8) 12,8 (3,7-17,9) | 22,2 (16,1-28,4) 21,2 (15,8-26,7) |
Примечание: р 1- 2 < 0,05
Анализ параметров РЭГ у пациентов, представляющих особую «группу риска» по сердечно-сосудистым катастрофам (т.е. у лиц пожилого возраста с АГ) выявил у пациентов с ускоренным темпом по сравнению с нормальным выраженное нарушение тонуса мелких сосудов, затруднение венозного оттока во фронто-мастоидальном отведении и увеличение ППСС в окципито-мастоидальном отведении (табл.10).
Таблица 10. Показатели РЭГ у пациентов основной группы в пожилом возрасте
в зависимости от темпов биологического старения (Mе, 95%ДИ)
| Фронто-мастоидальное отведение | Окципито-мастоидальное отведение | |||
| Темп | Нормальный (1) n=25 | Ускоренный (2) n=23 | Нормальный (1) n=25 | Ускоренный (2) n=23 |
| РИ S (Ом) D | 0,1 (0,08-0,12) 0,1 (0,08-0,13) | 0,1 (0,08-0,13) 0,09 (0,08-0,11) | 0,07 (0,06-0,1) 0,07 (0,06-0,09) | 0,08 (0,05-0,1) 0,08 (0,06-0,13) |
| ВБКН S (мс) D | 58,4(54,1-62,6) 60,2 (56,4-64,1) | 55,5 (52,9-58,1) 55,9(51,7-60,1) | 56,5(52,2-60,7) 52,7(49,6-55,8) | 56,1(50,6-61,6) 55,2(51,4-59,1) |
| ВМКНS (мс) D | 89,9(74,4-105,4) 94,7(72,3-117,1) | 86,8(73,1-100,4) 78,1 (71,8-84,4) | 76,8 (58,6-95,1) 76,9 (61,9-91,8) | 84,3(71,5-97,1) 75,2(64,3-86,1) |
| ППСС S (%) D | 91,1 (81,8-102,6) 92,2 (81,8-100,5) | 97,1 (85,9-108,3) 100,6(89,4-111,6) | 88,1 (73,1-103,1) 92 (71-112) | 96,4(106-121,4) 95,1 (89,4-100,6) |
| ВРПВ S (мс) D | 123,9(106,2-141,5) 122,2(104,3-140,3) | 120,7(114,1-127,4) 116,7(109,1-124,3) | 117,8(104,7-130,8) 118,6(104,4-132,9) | 113,1(89,6-136,5) 113,9(106-124,4) |
| ДКИ S (%) D | 61,9 (48,7-75,1) 58,1 (45,7-70,4) | 68,9(58,7-79,1) 77,3 (67,6-86,9) | 61,9 (41,8-66,9) 62,7 (43 -72,4) | 66,0 (54,6-77,5) 68,6 (66,2-77,3) |
| ДСИ S (%) D | 57,6(50,5-71,7) 61,1(49-66,2) | 70,8(62,9-78,6) 79(68,5-89,4) | 62,9 (46,8-76,9) 63,7 (45 -82,4) | 66,8(56,5-77,4) 68,6 (60,1-77,2) |
| ИВО S (%) D | 13,5(10,1-16,9) 13 (9,1-16,9) | 26,1(15,9-36,3) 25,2 (12,5-37,9) | 10,9 (7,5-14,3) 15,9 (9,8-20,9) | 16,4 (8,1-24,6) 14,7 (9,6-19,8) |
Примечание: р 1-2 < 0,05
Таким образом, становится очевидным, что при АГ, наличие которой само по себе значительно ухудшает кровоснабжение мозга за счет сосудистых изменений, сохраняется разница в значениях параметров РЭГ у пациентов с ускоренным и нормальным темпом биологического старения. Глубокие нарушения вегетативно-адаптационного обеспечения, повышенная жесткость сосудистой стенки, наличие метаболических нарушений, сопровождающие ускоренный темп старения, будут являться важными дополнительными факторами, ухудшающими кровоснабжение головного мозга на фоне изменений, обусловленных возрастом и АГ.
Анализ показателей РЭГ у нормотоников старческого возраста и долгожителей с замедленным и нормальным темпами биологического старения показал, что у пациентов, средний возраст которых составлял, 89,8 ±3,4 лет в условиях физиологического «нормального» или замедленного вариантов старения оставались стабильными такие параметры церебрального кровотока, как пульсовое кровенаполнение (РИ – 0,09-0,11 Ом), венозный отток (ИВО – 13,3-16,2 %) и, главное, тонус мелких резистивных сосудов (ДКИ – 60,1-70,8 %; ДСИ – 60,8- 68,6 %)
Увеличение с возрастом показателей, характеризующих изменение жесткости стенки крупных сосудов (ВРПВ, ППСС, ВБКН), сопровождалось значительным компенсаторным увеличением времени медленного кровенаполнения (ВМКН – 80,1- 98,3 мс), что приводит к увеличению времени перфузии ткани головного мозга. Следует отметить небольшое снижение пульсового кровенаполнения (РИ – 0,06 Ом) в вертебро-базиллярной области у долгожителей, которое, по-видимому, связано с наличием выраженных дегенеративных изменений в области позвоночного столба.
Анализ показателей РЭГ у пациентов с АГ старческого возраста (табл. 11) с учетом темпа биологического старения показал, что время медленного кровенаполнения средних и мелких сосудов превышало аналогичные показатели, зафиксированные у их нормотензивных ровесников и пациентов зрелого возраста (р < 0,05). Однако, наибольшие значения ВМКН (106,6 мс) были отмечены у больных с ИСГ и замедленным темпом старения. Увеличение времени перфузии средних и мелких сосудов является компенсаторным механизмом при этой форме АГ в старческом возрасте.
Таблица 11. Показатели РЭГ у пациентов основной группы в старческом возрасте в зависимости от темпов старения (Mе, 95%ДИ)
| Темп | Замедленный(1) n=21 | Нормальный(2) n=25 | Ускоренный (3) n=22 |
| Фронто-мастоидальное отведение | |||
| РИ S (Ом) D | 0,1 (0,08-0,11) 0,11 (0,09-0,13) | 0,12 (0,05-0,16) 0,13 (0,06-0,09) | 0,1 (0,05- 0,16) 0,12 (0,06-0,17) |
| ВБКН S (мс) D | 57,4 (51,3-63,5) 56,4 (51,7-60,2) | 61,0 (55,1-66,8) 55,7 (52,1-59,4) | 52,3 (47,6-57,1) 51,1 (44,8-57,4) |
| ВМКН S (мс) D | 94,4 (76,1-103,7) 106,6 (76,5-136) * | 88,3 (74,2-102,3) 86,8 (69,7-103,8) | 89,5 (54,4124,6) 83,3 (58,9-107,4) |
| ППСС S (% ) D | 96,5 (88,8-104,1) 92,1 (84,9-99,2) | 86,6 (75,4-97,7) 86,4 (73,2-99,6) | 114 (84,3-144,5) •# 113 (78,9-148,4) •# |
| ВРПВ S (мс) D | 106,1 (92,3-119,8) 105,2 (88,7-121,6) | 115,2 (96,5-133,8) 118,4 (99,1-137,7) | 118 (92,9-143,1) 109,3 (84,3-134,1) |
| ДКИ S (%) D | 61,8 (59,1-74,5) 57,3 (46,3-68,3) | 57,2 (46,7-67,7) 54,7 (40,1-69,4) | 82 (57,9-107,4) •# 83 (55,1-112,6) •# |
| ДСИ S (%) D | 54,9 (63,2-92,6) 56,7 (61,8-93,6) | 58,4 (53,2-95,6) 71,5 (62,1-88,9) | 81,8 (76,1-95,7) •# 81,5 (74,1-108,9) •# |
| ИВО S (%) D | 16,4 (10,1-22,7) 13,4 (7,9-18,8) | 10,0 (5,2-14,7) 8,7 (4,5-12,9) | 22,6 (17-28,3) •# 21,3 (13,6-29) •# |
| Окципито-мастоидальное отведение | |||
| РИ S (Ом) D | 0,06 (0,05-0,08) 0,06 (0,04-0,08) | 0,08 (0,06-0,11) 0,08 (0,07-0,10) | 0,09 (0,04- 0,14) 0,07 (0,04-0,11) |
| ВБКН S (мс) D | 61,7 (43,5-79,8) 59,1 (41,3-76,9) | 57,8 (53,9-61,6) 53,3 (49,1-57,6) | 50,3 (45,7-54,8) 58,1 (45,1-71,6) |
| ВМКН S (мс) D | 71,7 (50,7-92,6) 69,7 (56,2-73,1) | 77,8 (69,1-95,4) 69,3 (59,1-88,5) | 81,6 (58,4-103,8) 78,6 (63,8-93,4) |
| ППСС S (% ) D | 95,5 (88,8-101,2) 88,1 (98,8-117,4) | 81,6 (68,7-93,2) 81,7 (62,6-100,9) | 122 (84,4-158,2) •# 96 (71,7-120,3) |
| ВРПВ S (мс) D | 91,6 (70,1-112,1) 104,2 (86,1-121,8) | 107,2 (88,5-125,4) 108,5 (89,9-127,1) | 110 (94,4-123,8) 106,6 (88,5-124,7) |
| ДКИ S (%) D | 74,1 (59,1-88,9) 73,1 (51,6-94,4) | 52,4 (36,8-67,9) 50,2 (38,3-62,1) | 82 (67,9-108,7) •# 67 (40,7-93,2) # |
| ДСИ S (%) D | 64,9 (63,2-92,6) 66,7 (61,8-93,6) | 68,4 (53,2-95,6) 61,5 (62,1-88,9) | 81,8 (76,1-105,7) •# 81,5 (74,1-108,9) •# |
| ИВО S (%) D | 10,1 (3-37,2) 7,7 (11,5-23,8) | 9,0 (6,3-11,6) 9,4 (5,1-13,6) | 16,2 (11,8-20,4) •# 16,5 (9,6-23,3) •# |
Примечание: р 1- 2<0,05; • р 1- 3 < 0,05; # р 2-3< 0,05;
Дикротический индекс (ДКИ), характеризующий тонус мелких сосудов, и диастолический индекс (ДСИ), характеризующий тонус прекапиллярно-венулярного звена, оказались несколько сниженными в 1 и 2 группах, что свидетельствует об увеличении времени транскапиллярной перфузии у пациентов с нормальным и замедленным темпами старения при сохраненном венозном оттоке. Очевидно, у пациентов старческого возраста при медленном темпе инволютивных изменений имеются сформировавшиеся «конволюты» в микроциркуляторных модулях.
При ускоренном темпе старения тонус мелких резистивных сосудов повышен, а венозный отток оказывается затруднен, что влечет за собой застойные явлений в венулярном звене. Следует отметить значительное увеличение периферического сосудистого сопротивления во фронто-мастоидальном и окципито-мастоидальном отведениях, что свидетельствует о влиянии АГ, особенно в сочетании с ускоренным темпом старения на тонус сосудов вертебро-базиллярной области и бассейна внутренней сонной артерии.
При изучении (по методу Спирмена) корреляционных взаимосвязей показателей КИГ с показателями РЭГ, отражающими процессы регуляции тонуса и кровенаполнения мозговых сосудов, были обнаружены следующие средне - и высокозначимые связи у пациентов с нормальным АД. Реографический индекс (РИ) положительно коррелировал с MxDMn (r=0,57 p=0,01) и SDNN (r=0,72, p=0,001) и отрицательно с Sl (r=-0,61 p=0,009). Наличие подобных взаимосвязей отражает зависимость пульсового кровенаполнения сосудистой системы мозга от состояния вегетативных механизмов. Преобладание парасимпатических влияний улучшает кровенаполнение мозговых сосудов, тогда как гиперсимпатикотония способствует вазоконстрикции. Показатель, характеризующий венозный отток (ИВО) положительно коррелировал с Sl (r=0,56 p=0,01), что свидетельствует о нарушении венозной циркуляции при высоком симпатическом тонусе у пациентов с АГ.
При изучении корреляционных взаимосвязей у пациентов с АГ были обнаружены следующие средне- и высоко значимые парные корреляции: амплитуда моды (АМо) положительно коррелировала с ДКИ (r=0,38, р=0,028) и ДСИ (r=0,35, р=0,04) и отрицательно – с ВМКН (r=-0,53, р=0,002), что свидетельствует о сокращении времени кровенаполнения мелких сосудов и увеличении тонуса мелких артериол и посткапиллярно-венулярных сосудов при гиперсимпатикотонии. Стресс-индекс (Sl) аналогичным образом положительно коррелировал с ДКИ (r=0,48, р=0,01), ДСИ (r=0,41, р=0,01), ИВО (r=0,39, р=0,02) и отрицательно – с ВМКН (r=-0,47, р=0,006). Показатель соотношения симпатического и парасимпатического тонуса (ИВР) также обнаружил положительные корреляции с ДКИ (r=0,39, р=0,02), ДСИ (r=0,40, р=0,02), ИВО (r=0,38, р=0,02) и отрицательные – с ВМКН (r=-0,37, р=0,03).
Таким образом, изменение вегетативного обеспечения в сторону увеличения симпатических влияний приводит к изменениям тонических взаимоотношений в мелких артериях мозга при ухудшении венозного оттока в системе церебральной циркуляции, обеспечивающей кровоснабжение мозга через брахиоцефальные артерии.
У пациентов старших возрастных групп в условиях физиологического или замедленного вариантов старения остаются стабильными такие параметры церебрального кровотока как пульсовое кровенаполнение, венозный отток и тонус мелких резистивных сосудов. Увеличение с возрастом показателей, характеризующих изменение жесткости стенки крупных сосудов, сопровождается компенсаторным увеличением времени медленного кровенаполнения и небольшим снижением тонуса мелких артерий, капилляров и прекапилляров, что приводит к увеличению времени перфузии ткани головного мозга.
У пациентов с ИСГ I типа с замедленным темпом старения параметры церебральной гемодинамики незначительно изменены по сравнению с параметрами, наблюдаемыми у их нормотензивных ровесников. Увеличение ППСС в этой группе сопровождается выраженным компенсаторным снижением тонуса сосудов среднего и мелкого калибра. Другим важным фактором, является формирование «конволютов» в микроциркуляторных модулях при медленном развитии инволютивных изменений в мозговых сосудах (Верещагин Н.В. и др., 1997).
Наиболее выраженные нарушения перфузии головного мозга выявлены у пациентов с ускоренным темпом старения, у которых диагностирована ИСГ II типа и СДАГ. Данные нарушения проявляются в уменьшении пульсового кровенаполнения, патологической вазодилятации, выраженном увеличении жесткости сосудистой стенки и нарушении тонуса мелких резистивных сосудов. Это может приводить к быстрому формированию сосудистой деменции за счет хронической ишемии мозга, особенно на фоне «декомпенсированных» вариантов вегетативного обеспечения.
Обнаруженные корреляционные связи между показателями реоэнцефалограммы и параметрами вариабельности сердечного ритма, свидетельствуют о тесной взаимосвязи между вегетативной регуляцией и кровоснабжением головного мозга.
Сравнительное изучение эффективности влияния моно- и комбинированной терапии на структурно-функциональные изменения стенки сосудов и вариабельность сердечного ритма у пациентов с АГ в зрелом возрасте
Исследование влияния 6-месячной монотерапии АГ диуретиком (арифон – ретард, 1,5 мг/сут), селективным бета-адреноблокатором (метопролол-тартрат, Эгилок-Ретард, 50 мг/сут) и комбинированной терапии периндоприлом и индапамидом (Нолипрел-форте, 1 таб.сут) на скорость распространения пульсовой волны, АД в бассейнах верхних и нижних конечностей индексы жесткости CAVI и активность симпатоадреналовой системы, проведенное у 45 пациентов с АГ 1-2 степени зрелого возраста продемонстрировало, что монотерапия арифоном-ретард (n= 15) достоверно снижало САД на верхних и нижних конечностях (р < 0,05). Монотерапия метопрололом-ретард (n= 15) в дозе 50 мг также снижала АД на верхних конечностях, однако значения были статистически незначимы, достижения целевых уровней АД удалось достичь в дальнейшем только при увеличении дозы препарата до 100 мг, или при добавлении диуретика, ингибитора АПФ.
Терапия нолипрелом-форте (n= 15) привела к снижению АД практически во всех сосудистых бассейнах правых и левых конечностей, а при измерении офисного АД отмечено достижение его целевых уровней (130,5±10,5 и 88,0±2,1 мм. рт. ст.). Выраженное снижение АД на нижних конечностях (с 174±8,9 до 159,2±7,3 мм. рт. ст., р < 0,05) свидетельствует о благоприятном влиянии комбинированной терапии иАПФ + диуретик (нолипрел-форте) на структурно-функциональное состояние сосудистой стенки в этом бассейне, особенно у пациентов с «ранним» ремоделированием. Известно, что процессы облитерирующего атеросклероза затрагивают у мужчин в первую очередь сосудистые бассейны нижних конечностей, а у пациентов в исследуемой группе «биологический возраст периферических сосудов», по данным объемной сфигмографии, был выше в среднем на 10,5 лет, чем у пациентов, имеющих нормальное АД.
Арифон-ретард продемонстрировал высокую эффективность в плане уменьшения жесткости сосудов смешанного (CAVI 1) и эластического (CAVI 2) типов, с одновременным снижением биологического возраста сосудов в среднем на 5,2 года. Аналогичный эффект на жесткость сосудов эластического и смешанного типов оказал и нолипрел-форте, причем БВ сосудов снижался на 5 лет, как и после приема арифона-ретард. В исследовании Ж.Д. Кобалава и др. (2006) монотерапия арифоном-ретард у лиц с АГ старше 80 лет в течение 12 недель не привела к снижению показателей жесткости, что подчеркивает необратимость этого процесса у лиц очень пожилого возраста. Положительный результат монотерапии арифоном-ретард и нолипрелом-форте в течение 6 месяцев у пациентов с АГ в зрелом возрасте доказывает обратимость процессов ремоделирования сосудистой стенки, как минимум до 60-летнего возраста.
Монотерапия метопрололом-ретард в дозе 50 мг также приводила к снижению индексов жесткости, однако это снижение было не столь выражено, как после применения арифона и нолипрела-форте. Используемая в нашем исследовании низкая доза метопролола не привела к достижению целевых уровней АД, что может указывать на тесную связь между уменьшением ремоделирования сосудов и антигипертензивным эффектом препарата.
Результаты проведенного исследования продемонстрировали, что терапия нолипрелом-форте и арифоном-ретард в течение 6 мес. снижала СРПВ по сосудам всех типов, однако наибольший эффект отмечен по сосудам смешанного и эластического типов (р<0,05). «Раннее» ремоделирование сосудов эластического типа проявляется увеличением АД на ногах, причем этот процесс может предшествовать системному повышению АД (Милягина И.В., 2008). Поэтому снижение СРПВ по сосудам смешанного и эластического типов является важным фактором в сдерживании темпов преждевременного старения сосудистой стенки у пациентов с АГ в зрелом возрасте.
Монотерапия метопрололом-ретард в дозе 50 мг не повышала СРПВ по сосудам всех типов, что свидетельствует о безопасности его применения в низких дозах у пациентов зрелого возраста с начинающимся процессом ремоделирования сосудов нижних конечностей.
Действие арифона-ретард на активность симпатоадреналовой системы выражалось в изменении параметров ВНС – увеличении MxDMn и MxRMn (р<0,05) В группах больных, получавших метопролол-ретард и нолипрел-форте, получены статистически значимые различия в показателях: MxDM, MxRMn, SDNN и CV (р<0,01) до и после лечения. Благоприятное действие этих препаратов на ВСР в плане улучшения соотношения симпатического и парасимпатического тонуса в сторону увеличения последнего является важнейшим фактором в профилактике нарушений ритма. Метопролол в дозе 50 мг положительно влиял на показатели ВСР вне зависимости от выраженности антигипертензивного эффекта.
Таким образом, длительная терапия диуретиком или его комбинацией с иАПФ приводит к уменьшению сосудистого ремоделирования и положительно влияет на вегетативную нервную систему у пациентов с АГ зрелого возраста. Однако, эти процессы тесно связан с выраженностью антигипертензивного действия препаратов. Терапия метопрололом-ретард в низких дозах приводит к гармонизации вегетативного тонуса даже при отсутствии достижения целевых уровней АД.
Сравнительное изучение влияния амлодипина и нифедипина-ретард
на вегетативную регуляцию сердечного ритма у пожилых больных с АГ
В генезе повышения АД у пожилых, как показали проведенные исследования, большое значение имеют нейрогуморальные и гемодинамические факторы: усиление роли симпатической нервной системы и изменение механизмов ауторегуляции мозгового кровообращения с увеличением периферического сосудистого сопротивления.
Влияние 4-х недельной монотерапии АГ дигидропиридиновыми антагонистами кальция 2-3 поколения: амлодипином (кардилопин, 5 мг\сут.) и нифедипином-ретард (кордафлекс-ретард, 40 мг \сут), на показатели активности симпатоадреналовой системы (ВСР) изучено у 55 пациентов пожилого и старческого возраста (ср. возраст 75,25±7,18 лет) с ИСГ и СДАГ I-II степени. В конце исследования при недостаточном антигипертензивном эффекте был назначен диуретик либо иАПФ, то есть использовалась ступенчатая антигипертензивная терапия. Проведено открытое сравнительное нерандомизированное клиническое исследование. В I группу (n=29) вошли пациенты с физиологическим темпом старения, во II группу (n=26) – с ускоренным. В обеих группах в анамнезе не было ИМ.
После 4-х недельной терапии нифедипином-ретард целевой уровень АД был достигнут у 94,7% больных с физиологическим и у 81,3% с ускоренным темпом старения.
При анализе исходных значений параметров КИГ был установлен высокий уровень стресс-индекса (SI500 усл.ед) у пациентов с ускоренным темпом старения. У пациентов I группы исходные значения SI составили 374 усл.ед., что указывает на нормотонию или умеренную симпатикотонию.
После 4-х недельной терапии нифедипином-ретард у пациентов с физиологическим темпом старения произошло статистически значимое (p<0,05) повышение показателя MxDMn на 17,2%, что привело к снижению уровня централизации в управлении сердечным ритмом – SI уменьшился на 32,7%. У пациентов с ускоренным темпом после терапии нифедипином-ретард произошло статистически значимое увеличение ЧСС на 5,5% и снижение Мо на 5,3% (p < 0,05). Несмотря на достижение целевых уровней АД, во II группе сохранялись признаки гиперсимпатикотонии (SI – 760 усл.ед.). Таким образом, при исходно высоком тонусе ВНС и низком уровне парасимпатического контроля целесообразно прибегать к ранней комбинированной терапии -адреноблокаторами или иАПФ и дигидропиридиновыми антагонистами кальция.
После 4-х недельной терапии амлодипином целевой уровень АД был достигнут у всех пациентов с физиологическим и у 90% – с ускоренным темпом старения. У пациентов с физиологическим темпом старения произошло статистически значимое (p<0,05) увеличение MxDMn на 25,6% и СКО в 2,7 раза (р<0,05), а также снижение SI на 26,1% и ИВР на 33,9% (p<0,05). Это свидетельствует о выраженном уменьшении уровня централизации в управлении сердечным ритмом. Положительная статистически значимая динамика наблюдалась и у больных с ускоренным темпом старения: СКО увеличились на 58,3% и MxDMn на 87,8%, SI снизился на 60,2% (p<0,05) При достижении целевых уровней АД у пациентов с ускоренным темпом произошло изменение вегетативного тонуса от состояния гиперсимпатикотонии (SI – 1077 усл.ед) к умеренной симпатикотонии (SI – 428 усл.ед).
Анализ влияния терапии нифедипином-ретард и амлодипином на вегетативную реактивность (ВР) у пациентов I группы показал увеличение доли нормальной реактивности с 57,9% до 73,7% вследствие нормализации асимпатикотонической ВР. После лечения исследуемыми препаратами у пациентов II группы доля асимпатикотонической реактивности снизилась почти в 2 раза с 56,2% до 25,0%, вследствие чего нормальная ВР увеличилась с 37,5% до 68,7%.
Таким образом, проведенное исследование установило, что применение нифедипина-ретард и амлодипина в среднетерапевтических дозах у пациентов пожилого и старческого возраста с физиологическим темпом старения приводит к уменьшению уровня централизации в управлении сердечным ритмом при достижении целевых уровней АД. Доказательством этого послужило статистически значимое уменьшение SI после приема нифедипина и амлодипина. При ускоренном варианте старения у пациентов с АГ происходит изменение вегетативного тонуса с уменьшением уровня гиперсимпатикотонии только на фоне приема амлодипина при достижении целевых уровней АД.
Дисрегуляция СНС у пожилых рассматривается как важнейшее патогенетическое звено в развитии АГ в этой возрастной группе. Она приводит к развитию целого ряда осложнений, включая структурное ремоделирование сердечно-сосудистой системы. Поэтому задачей терапии наряду с достижением целевых уровней АД является воздействие на все факторы риска и лечение сопутствующей патологии.
Монотерапия амлодипином оказывает положительное влияние на вариабельность сердечного ритма при достижении целевых уровней АД у пожилых пациентов как с ускоренным, так и с физиологическим вариантами биологического старения. Достижение целевых уровней АД сопровождается уменьшением степени напряжения регуляторных систем и переходом от гиперсимпатикотонии к умеренной симпатикотонии или нормотонии. Значения стресс-индекса > 500 усл.ед, СКО < 25 усл.ед., MxDMn < 50 мсек., являются дополнительными показаниями для комбинированной терапии дигидропиридиновыми антагонистами кальция и селективными -адреноблокаторами или ингибиторами АПФ, т.е. препаратами способными в значительной степени снижать модуляцию симпатического тонуса у больных с высоким коронарным риском, особенно у пожилых больных с ускоренным вариантом биологического старения.
Сравнительное изучение влияния бисопролола и амлодипина на кровоток в брахиоцефальных артериях у пациентов с АГ пожилого и старческого возраста
Наиболее важными факторами, влияющими на мозговой кровоток у лиц пожилого и старческого возраста являются изменения механических свойств сосудов – потеря эластичности и увеличение жесткости, а также снижение чувствительности барорецепторов, что наряду с задержкой натрия и воды ведет к усилению вазоконстрикции и повышению общего периферического сопротивления (Сторожаков Г.И. и др., 2006). В соответствии с Российскими и Европейскими рекомендациями у больных с ИБС без инфаркта миокарда в анамнезе -адреноблокаторы и антагонисты кальция III поколения могут применяться в качестве стартовой терапии (Карпов Ю.А. и др., 2006; Марцевич С.Ю., 2007).
Проведено открытое сравнительное нерандомизированное клиническое исследование у 54 пациентов пожилого и старческого возраста мужского пола (ср. возраст 77,25±6,18лет) с ИСГ I-II степени, осложненной ХСН I-II ФК по NYHA, с сопутствующей ИБС I-III ФК., без ИМ в анамнезе. Сравнительная оценка эффективности влияния стартовой трехнедельной монотерапии дигидропиридиновым антагонистом кальция III поколения - амлодипином (кардилопином) в суточных дозах 2,5 и 5 мг и селективным -адреноблокатором - бисопрололом (конкором), в суточных дозах 2,5 и 5 мг на показатели УЗДГ (Vs, Vd, PI, IR), показала, что применение амлодипина в дозе 2,5 мг (n=14) оказывает статистически значимое (р<0,05) воздействие на периферическое сопротивление в общей сонной артерии, тогда как применение в той же дозировке бисопролола (n=12) не снижала, но и не повышал индексы периферического сопротивления в ОСА. В конце исследования при недостаточном антигипертензивном эффекте был назначен диуретик либо иАПФ.
Проведенный далее анализ воздействие исследуемых препаратов в дозе 2,5 мг на кровоток во внутренней сонной артерии, которая поражается при АГ и атеросклерозе в первую очередь, особенно в области бифуркации не выявил статистически значимой разницы в динамике показателей линейных скоростей кровотока (Vs, Vd) и индексах сопротивления (PI, IR) во ВСА как после назначения амлодипина, так и после назначения бисопролола.
Влияние амлодипина в дозе 5 мг (n=15) на скоростные параметры каротидной УЗДГ выражалось в увеличении Vd с 8,8 до 11,8 усл.ед (р<0,05) в ОСА, что свидетельствует об уменьшении степени «функционального стеноза» в брахиоцефальных артериях под влиянием проводимой терапии.
Анализ влияния амлодипина в дозе 5 мг на показатели периферического сопротивления в ОСА продемонстрировал статистически значимое (р<0,05) снижение индекса пульсации и сопротивления после 3-х недельной монотерапии. Лечение бисопрололом (n = 13) в дозе 5 мг не повышало индексы сопротивления в ОСА, что доказывает безопасность его действия на тонус крупных брахиоцефальных сосудов и в более высоких дозах.
Исследование продемонстрировало статистически значимое (р<0,05) повышение Vd и снижение PI во внутренних сонных артериях под влиянием амлодипина в дозе 5 мг. Действие бисопролола сопровождалось незначительным и статистически незначимым увеличением PI в ВСА.
Таким образом, амлодипин в дозах 2,5 и 5 мг оказывает отчетливое положительное действие на тонус ОСА и ВСА, уменьшая проявления «функционального» стеноза, что проявляется в статистически значимом повышении диастолической скорости кровотока и снижении индексов пульсации и периферического сопротивления. Это важно для пожилых больных с ИСГ как с гемодинамическими, так и выраженными дегенеративно-склеротическими изменениями каротидных артерий. Бисопролол в дозах 2,5 мг не увеличивает тонус крупных экстракраниальных сосудов, что доказывает его безопасность у пациентов пожилого и старческого возраста. При применении бисопролола в дозе 5 мг целесообразно предварительное проведения УЗДГ артерий каротидной зоны, особенно ВСА с оценкой индексов периферического сопротивления.
Выводы
- Для полноценной характеристики состояния сердечно-сосудистой системы у лиц мужского пола необходимо учитывать онтогенетические аспекты формирования артериальной гипертензии. Степень и формы АГ тесно связаны со скоростью биологического старения и неравномерным темпом инволютивных изменений сердечно-сосудистой системы.
- Многофакторный регрессионный анализ установил статистически значимую зависимость биологического возраста у лиц мужского пола с АД<140\90 мм.рт.ст. со следующими факторами, влияющими на прогноз сердечно-сосудистых заболеваний: скоростью распространения пульсовой волны, пульсовым давлением, индексом массы тела и уровнем гликемии. У мужчин с артериальной гипертензией, помимо вышеуказанных факторов, биологический возраст зависел от частоты сердечных сокращений, уровня систолического АД и скорости клубочковой фильтрации.
- У пациентов старческого возраста и долгожителей образуется особая «функциональная система», созданная интегративным аппаратом реактивности. У пациентов пожилого возраста с АГ формируется патологическая «функциональная система» связанная с гиперсимпатикотонией, гиперхолестеринемией и ремоделированием сосудов различных типов.
- У пациентов зрелого возраста с АД<140\90 мм.рт.ст. различия между замедленным и ускоренным темпами биологического старения обусловлены двумя важнейшими факторами: наличием «высокого нормального» систолического АД и повышенной жесткостью сосудов эластического типа. У пациентов с артериальной гипертензией ускоренное старение обусловлено, помимо жесткости сосудов, уровнем САД, ЧСС70 уд. в мин. и гиперхолестеринемией.
- Вариабельность сердечного ритма тесно связана с периодом онтогенеза и формой артериальной гипертонии. Наиболее выраженное нарушение регуляции и рост симпатических влияний наблюдается в пожилом возрасте вне зависимости от уровня АД. Варианты сбалансированного вегетативного обеспечения начинают преобладать у лиц старческого возраста и долгожителей с нормальным АД и изолированной систолической артериальной гипертензией, возникшей после 60 лет.
- Использование многофакторного регрессионного анализа установило статистически значимую зависимость между ростом активности симпатической нервной системы и увеличением биологического возраста у нормотоников и пациентов мужского пола с артериальной гипертензией. Параметры вариабельности сердечного ритма (реактивность, вариационный размах, мода) являются дополнительными факторами риска, определяющими ускоренный или замедленный вариант биологического старения, т.е. новыми биомаркерами.
- Изменение амплитудно-фазовых характеристик циркадианного ритма суточной секреции кортизола тесно связано с темпом биологического старения: сглаживание суточных кривых и уменьшение амплитуды среднесуточного уровня кортизола характерно для пациентов с ускоренным темпом старения. При замедленном варианте сохраняется нормальная амплитуда суточного ритма. Уровень кортизола является биомаркером, влияющим на темп биологического старения.
- Ускоренный темп биологического старения при нормальном АД ассоциируется с повышенной вариабельностью систолического АД и диастолического АД в дневное время, с изменением суточного индекса. У пациентов с артериальной гипертензией выявляются более глубокие нарушения циркадианных ритмов АД с изменением суточных индексов, связанных с формой артериальной гипертензии и темпом старения.
- Скорость старения сосудов смешанного типа (магистральных артерий нижних конечностей) и преимущественно мышечного типа (плечевая артерия) имеет прямой возрастзависимый характер. Скорость старения сосудов эластического типа (аорты) достигает максимума приблизительно к 75 годам, в дальнейшем темп ремоделирования снижается.
- Положительные взаимосвязи между показателями каротидной ультразвуковой допплерографии, показателями ремоделирования аорты, плечевой артерии и магистральных артерий нижних конечностей, по данным объемной сфигмографии, указывают на тесную связь между состоянием кровотока в брахиоцефальных сосудах, определяющегося суммарным эффектом миогенного тонуса, а также степенью фиброзно-склеротической трансформации и изменениями жесткости других сосудов большого круга кровообращения. Пульсационный индекс является маркером, отражающим не только сопротивление, но и ремоделирование сосудистой стенки каротидных артерий.
- У лиц старших возрастных групп с нормальным АД и, соответственно замедленным темпом старения остаются стабильными такие параметры мозгового кровотока, как пульсовое кровенаполнение, венозный отток и тонус мелких резистивных сосудов. Увеличение с возрастом времени распространения пульсовой волны, быстрого кровенаполнения и периферического сосудистого сопротивления сопровождается компенсаторным увеличением времени медленного кровенаполнения и снижением тонуса мелких артерий, капилляров и прекапилляров, что приводит к увеличению времени перфузии ткани головного мозга.
- У пациентов с изолированной систолической АГ, сформировавшейся после 60 лет, параметры церебральной гемодинамики незначительно изменены по сравнению с их нормотензивными ровесниками: увеличение периферического сосудистого сопротивления сопровождается снижением тонуса сосудов среднего и мелкого калибра, что является одним из механизмов компенсации.
- Наиболее выраженные нарушения перфузии головного мозга определяются у пациентов с ускоренным темпом старения вне зависимости от возраста, которые проявлялись в уменьшении пульсового кровенаполнения, патологической вазодилятации, выраженном увеличении жесткости сосудистой стенки и нарушении тонуса мелких резистивных сосудов, что приводит к хронической ишемии мозга, особенно на фоне «декомпенсированных» вариантов вегетативного обеспечения.
- Терапия нолипрелом-форте и арифоном-ретард в течение 6 мес. снижает скорость распространения пульсовой волны по сосудам всех типов. Однако наибольший эффект отмечен по сосудам смешанного и эластического типов (р<0,01). Влияние на раннее ремоделирование сосудов эластического типа является важным фактором в сдерживании темпов преждевременного старения сосудистой стенки у пациентов с артериальной гипертензией в зрелом возрасте.
- Монотерапия метопрололом-ретард в дозе 50 мг не повышает скорость распространения пульсовой волны по сосудам всех типов, что свидетельствует о безопасности его применения у пациентов зрелого возраста с начинающимся процессом ремоделирования сосудов нижних конечностей. Терапия метопрололом-ретард в низких дозах приводит к гармонизации вегетативного тонуса даже при отсутствии достижения целевых уровней АД.
- Монотерапия амлодипином оказывает положительное влияние на вариабельность сердечного ритма при достижении целевых уровней АД у пожилых пациентов с ускоренным и физиологическим темпами биологического старения, что сопровождается уменьшением степени напряжения регуляторных систем и переходом от гиперсимпатикотонии к умеренной симпатикотонии или нормотонии. Значения стресс-индекса>500 усл.ед, СКО<25 усл ед., MxDMn<50 мсек., являются показаниями для комбинированной терапии антагонистами кальция и селективными -адрено-блокаторами или ингибиторами АПФ, т.е. препаратами, способными в значительной степени снижать модуляцию симпатического тонуса.
- Амлодипин в дозах 2,5 и 5 мг оказывает положительное воздействие на тонус в общей и внутренней сонных артериях, уменьшая проявления «функционального» стеноза, что проявляется в статистически значимом повышении диастолической скорости кровотока и снижении индексов пульсации и периферического сопротивления. Бисопролол в дозах 2,5 мг и 5 мг не увеличивает тонус крупных экстракраниальных сосудов.
Практические рекомендации
- С целью выявления особых «групп риска» по сердечно-сосудистым заболеваниям среди лиц мужского пола с нормальным АД рекомендуется использовать метод ненозологической диагностики: определять биологический возраст, а также исследовать «жесткость» центральных и периферических сосудов с помощью обьемной сфигмографии, определять вариабельность сердечного ритма с применением активной ортостатической пробы. При оценке полученных результатов рекомендуется использовать возрастные нормативные значения ряда показателей, а при их отклонении следует направлять обследуемых пациентов для проведения ультразвуковых, биохимических исследований, рекомендовать модифицировать образ жизни и проводить в дальнейшем динамическое наблюдение с ранним назначением ингибиторов АПФ или диуретиков у пациентов с «высоким» нормальным АД и индексом жесткости аорты (CAVI) более 8 усл.ед.
- Для решения вопроса о выборе моно- или комбинированной терапии у пациентов старших возрастных групп следует выделять клинико-патогенетические варианты формирования изолированной артериальной гипертензии, (возникшей в поздний период онтогенеза или трансформированной из систолодиастолической АГ зрелого возраста), определять темп биологического старения, степень нарушения вегетативного обеспечения (сбалансированный или декомпенсированный вариант).
- При выявлении у лиц с артериальной гипертензией в старших возрастных группах изменений пульсационного индекса, характеризующего степень «гемодинамического перепада» на участке «крупный» сосуд (общая сонная артерия) - «мелкий» сосуд (надблоковые артерии), менее 0,5 усл.ед. целесообразно прибегать к раннему назначению препаратов, в наибольшей степени влияющих на сосудистое ремоделирование - иАПФ. Значение индекса более 0,5 усл. ед. свидетельствует о наличие «функционального» стеноза и необходимости обязательного назначения дигидропиридиновых антагонистов кальция III поколения.
- Для решения вопроса о назначении бисопролола в дозе 5мг и более лицам старческого возраста с изолированной систолической гипертензией или систоло-диастолической АГ рекомендуется предварительное проведение ультразвуковой допплерографии каротидной зоны с определением индекса пульсации во внутренней сонной артерии.
- При выявлении у больных артериальной гипертонией в зрелом возрасте прогностически неблагоприятных показателей «жесткости» сосудистой стенки (плече-лодыжечная СРПВ более 13 м/сек, CAVI более 8 усл.ед.) и гиперсимпатикотонии (стресс-индекс более 500 усл.ед.) патогенетически обосновано использовать препараты, в наибольшей степени влияющие одновременно на ремоделирование сосудов и вегетативное обеспечение – нолипрел или нолипрел-форте.
- У пациентов пожилого и старческого возраста с «ускоренным» и «нормальным» темпами биологического старения рекомендуется использовать амлодипин в дозах 2,5-5 мг при условии достижения целевых цифр АД.
Список работ, опубликованных по теме диссертации
- Статьи, опубликованные в журналах по перечню ВАК Минобрнауки РФ:
- Голованова Е.Д., Дубенская Л.И., Баженов С.М., Осипова Т.В., Цепов А.Л. Влияние темпа старения на вегетативный статус и энтропию лейкоцитарной формулы крови у пожилых больных с артериальной гипертонией // Клинич. геронтология. – 2005. –Т. 11, №2. – С. 12-16.
- Голованова Е.Д., Осипова Т.В., Салаш О.Б. Факторы риска сердечно-сосудистых заболеваний и темп старения в зрелом возрасте // Клинич. геронтология. – 2005. – Т. 11, № 11. – С. 26-30.
- Голованова Е.Д., Милягина И.В., Ковалев Д.Ю., Силаева Н.Н. Влияние амлодипина на эндотелиальную дисфункцию, вариабельность сердечного ритма и церебральную гемодинамику у больных артериальной гипертонией // Вестник Волгоградского государственного медицинского университета. - 2007. - № 2. – С. 31-34.
- Голованова Е.Д., Накорякова Е.В., Осипова Т.В., Кожеко С.Н., Маслова Н.Н. Особенности церебрального кровотока у пациентов с артериальной гипертонией с различной скоростью биологического старения // Бюллетень Сибирской медицины. - 2007. - № 2. – С.135-137.
- Golovanova E.D., Silaeva N.N., Kovalev D.Y. Effects of amlodipine on the endothelium, heart rate variability and cerebral blood flow in elderly patients with arterial hypertension // Успехи геронтологии. - 2007. - Т. 20, №3. – С.112-113.
- Голованова Е.Д., Милягин В.А., Милягина И.В., Грекова М.В., Коптева В.В., Осипова Т.В. Влияние артериальной гипертонии на возрастзависимое ремоделирование сосудов эластического, мышечного и смешанного типа // Клинич. геронтология. – 2007. – Т. 13, № 6. – С. 10-16.
- Голованова Е.Д. Ремоделирование сосудов и вариабельность сердечного ритма при фармакотерапии артериальной гипертонии различными средствами // Рациональная фармакотерапия в кардиологии. – 2008. - № 1. – С. 62-66.
- Голованова Е.Д., Силаева Н.Н., Ковалев Д.Ю. Влияние возраста и степени артериальной гипертонии на состояние кровотока в брахиоцефальных артериях у пациентов пожилого и старческого возраста // Клинич. геронтология. – 2008.- Т.14, №11.- С. 17-21.
- Гелетин П.Н., Аболмасов Н.Н., Голованова Е.Д. Особенности курации пациентов с хроническим генерализованным пародонтитом, осложненным дефектами зубных рядов на фоне артериальной гипертонии // Российский стоматологический журнал. – 2008. - № 6. – С.54-57.
- Голованова Е.Д., Осипова Т.В. Влияние амлодипина и нифедипина-ретард на вегетативную регуляцию сердца // Рациональная фармакотерапия в кардиологии. – 2008. - № 5. – С. 50-54.
- Материалы международных и всероссийских конференций
опубликованные в журналах, рекомендованных ВАК:
- Голованова Е.Д., Сухарукова О.В., Леонова Н.Я. Возрастные нарушения микроциркуляции у больных артериальной гипертензией // Клиническая геронтология. – 2002.– № 9. – С. 60.
- Голованова Е.Д., Осипова Т.В., Сухарукова О.В. Состояние вегетативного статуса и микроциркуляции у больных артериальной гипертонией в зависимости от темпов старения // Клинич. геронтология. – 2003. – Т. 9, № 3. – С. 7.
- Голованова Е.Д., Осипова Т.В., Белоусова Ю.А., Завадкин А.В. Распространенность и особенности течения остеоартроза у гериатрических больных с артериальной гипертензией // Научно-практич. ревматология. – 2004. – № 2. – С. 100.
- Голованова Е.Д., Осипова Т.В., Левитина З.К. Влияние темпа старения на эффективность гипотензивной терапии у больных пожилого и старческого возраста // Клинич. геронтология. – 2004. – № 9. – С. 95.
- Голованова Е.Д., Абраменкова Н.Ю., Осипова Т.В. Возрастные особенности взаимосвязи биологического возраста и степени ремоделирования каротидных артерий // Клинич. геронтология. – 2005. – Т. 11, № 9. – С. 71.
- Голованова Е.Д., Милягин В.А., Грекова М.В. и др. Особенности ремоделирование сосудов эластического, мышечного и смешанного типа // Клинич. геронтология. – 2006. – Т. 12, № 9. – С.5.
- Голованова Е.Д., Силаева Н.Н., Ковалев Д.Ю. Церебральная гемодинамика у пациентов пожилого и старческого возраста с артериальной гипертонией // Клинич. геронтология. – 2007. – Т. 13, № 9. – С. 33-34.
- Голованова Е.Д., Силаева Н.Н., Ковалев Д.Ю. Сравнительная оценка показателей церебрального кровотока у пациентов пожилого и старческого возраста с артериальной гипертонией и постинфарктным кардиосклерозом // Клинич. геронтология. – 2008. – Т. 14, № 9. – С. 73-74.
- Статьи и материалы, опубликованные в других научных изданиях:
- Голованова Е.Д., Сухарукова О.В. Возрастные нарушения микроциркуляции у больных артериальной гипертонией // Вестник Смоленской медицинской академии. – 2002.– № 2. – С. 30-32.
- Осипова Т.В., Голованова Е.Д., Иделевич Е.А. Особенности вегетативной регуляции у лиц пожилого и старческого возраста с артериальной гипертонией в зависимости от темпов старения // Реабилитация в геронтологии и гериатрии. Геронтология и гериатрия в семейной медицине: Тез. докл. Росс. научно-практической конф. – Курск, 2003. – С. 24-25.
- Осипова Т.В., Голованова Е.Д. Особенности течения артериальной гипертонии в зависимости от темпов старения организма // Влияние наркомании, табакомании, алкоголизма и антропогенной нагрузки на здоровье населения и методы борьбы с ними: Матер. Международной научно-практической конф. – Смоленск, 2003. – С. 133-134.
- Голованова Е.Д. Проблема деформирующего остеоартроза в пожилом возрасте // Перспективные направления развития системы стационарных учреждений России, проблемы и пути их решения: Материалы межрегионального семинара-совещания. – Смоленск, 2003. – С. 36-40.
- Голованова Е.Д., Абраменкова Н.Ю., Степанова Н.С., Филимоненкова В.Ф., Шпунтов М.Г. Распространенность факторов риска сердечно-сосудистых заболеваний среди рабочих и служащих АО «Ситалл» в сравнении с областными показателями // Влияние наркомании, табакомании, алкоголизма и антропогенной нагрузки на здоровье населения и методы борьбы с ними: Материалы Международной научно-практической конференции. – Смоленск, 2003. – С. 3-4.
- Голованова Е.Д., Леонова Н.Я. Особенности суточного профиля АД у больных хроническим пиелонефритом с артериальной гипертензией // Студенческая медицинская наука XXI века: Материалы III Международной научно-практической конференции. - Витебск, 2003. – С. 39-41.
- Голованова Е.Д., Осипова Т.В. Влияние терапии кордафлексом-ретард на вегетативный статус больных артериальной гипертонией пожилого и старческого возраста // Человек и лекарство: Тез. докл. II Росс. национ. конгр. – М., 2004. – С.123-124.
- Голованова Е.Д., Осипова Т.В., Белоусова Ю.А. Влияние особенностей вегетативной регуляции на эффективность терапии кордафлексом-ретард больных артериальной гипертонией с различными темпами старения // Вестник Смоленской медицинской академии. Терапевтический выпуск. – 2004. – № 1. – С. 16-18.
- Осипова Т.В., Голованова Е.Д., Левитина З.К. Влияние терапии метопрололом на вегетативный статус больных артериальной гипертонией пожилого и старческого возраста // Российская кардиология: от центра к регионам: Матер. Российского национального конгресса кардиологов. – Томск, 2004. – С. 366.
- Голованова Е.Д., Белоусова Ю.А., Леонова Н.Я., Завадкин А.В. Особенности суточного ритма артериального давления у больных с артериальной гипертонией пожилого и старческого возраста // Российская кардиология: от центра к регионам: Матер. Российского национального конгресса кардиологов. – Томск, 2004. – С. 116.
- Осипова Т.В., Голованова Е.Д. Зависимость форм артериальной гипертонии от темпа старения // Университетская наука: взгляд в будущее: Сб. трудов юбил. научн. конф. КГМУ и сессии Центрально-Черноземного научн. центра РАМН, посв. 70-летию КГМУ. – Курск, 2005. – С. 58-59.
- Голованова Е.Д., Осипова Т.В., Салаш О.Б., Завадкин А.В. Влияние социально-экономических факторов на биологический возраст и темп старения организма // Теория и практика оздоровления населения России: Матер. 2 национальной научно-практической конф. с международным участием. – М., 2005. – С. 67-68.
- Голованова Е.Д., Русаков В.В., Силаева Н.Н., Осипова Т.В., Ковалев Д.Ю. Влияние скорости биологического старения и формы артериальной гипертонии на состояние церебрального кровотока пациентов пожилого и старческого возраста // Актуальные проблемы клинической неврологии: Сб. трудов научно-практической конф. – Смоленск, 2005. – С. 16-20.
- Голованова Е.Д., Подопригорова В.Г., Осипова Т.В., Максакова Т.С. Влияние темпа биологического старения на свободнорадикальные процессы и антиоксидантный статус организма // Активные формы кислорода, оксид азота, антиоксиданты и здоровье человека: Матер. 4-й национальной научно-практической конф. с международным участием. – Смоленск, 2005. – С. 391-393.
- Подопригорова В.Г., Голованова Е.Д., Чайковская Н.Я. Особенности хемилюминисцентных биорадикальных параметров у больных хроническими гипоксическими состояниями // Активные формы кислорода, оксид азота, антиоксиданты и здоровье человека: Матер. 4-й национальной научно-практической конф. с международным участием. – Смоленск, 2005 г. – С. 148-150.
- Голованова Е.Д., Дубенская Л.И., Баженов С.М., Осипова Т.В., Салаш О.Б. Энтропия лейкоцитарной формулы и темп биологического старения как показатели адаптации в различных возрастных группах у больных с артериальной гипертонией // Актуальные вопросы кардиологии: Тез. докл. 12 научно-практической конф. с международным участием, посвященной 20-летию филиала ГУ НИИ кардиологии ТНЦ СО РАМН. – Тюмень, 2005. – С. 32-33.
- Силаева Н.Н., Голованова Е.Д., Ковалев Д.Ю. Влияние бисопролола на вариабельность сердечного ритма и АД у больных артериальной гипертонией // Материалы I Национального конгресса терапевтов. – М., 2006. – С. 196.
- Ковалев Д.Ю., Голованова Е.Д., Силаева Н.Н. Состояние эндотелиальной функции у больных артериальной гипертонией различных возрастных групп // Материалы I Национального конгресса терапевтов. – М., 2006. – С. 97-98.
- Голованова Е.Д., Силаева Н.Н., Ковалев Д.Ю., Коптева В.В., Шпунтов М.Г. Особенности ремоделирования сосудов у пациентов с артериальной гипертонией осложненной сердечной недостаточностью в пожилом и старческом возрасте // Материалы I конгресса Сердечная недостаточность. – М.,- 2006. – С. 48.
- Голованова Е.Д., Дубенская Е.Д., Баженов С.М. Энтропия лейкоцитарной формулы как маркер биологического старения // Электронный математический и медико-биологический журнал. – 2007. – Т. 6., Вып. 1, № 9. – С. 116.
- Милягин В.А., Горячева А.А., Абраменкова Н.Ю., Голованова Е.Д., Цепов А.Л. Практическое руководство по диагностике и лечению хронической ишемической болезни сердца: Методические рекомендации для участковых терапевтов, врачей общей практики. – Смоленск, 2007. – 128 с.
- Голованова Е.Д., Осипова Т.В., Козлов С.Н. Особенности антигипертензивной терапии бета-адреноблокаторами у пожилых // Фарматека. – 2008. – № 7. – С. 56-59.
Изобретения
- Голованова Е.Д., Силаева Н.Н., Ковалев Д.Ю. Способ выбора консервативного лечения каротидного стеноза. Приоритетная справка на изобретение № 2009119831 (027359) от 25.05.2009 г.
Рационализаторские предложения
- Голованова Е.Д., Ковалев Д.Ю. Алгоритм обследования пациентов в высоким кардиоваскулярным риском в условиях специализированного кардиологического отделения. Удостоверение № 1545 от 12.06.2009 г.
Приложение 1
Алгоритм обследования пациентов с высоким кардиоваскулярным риском
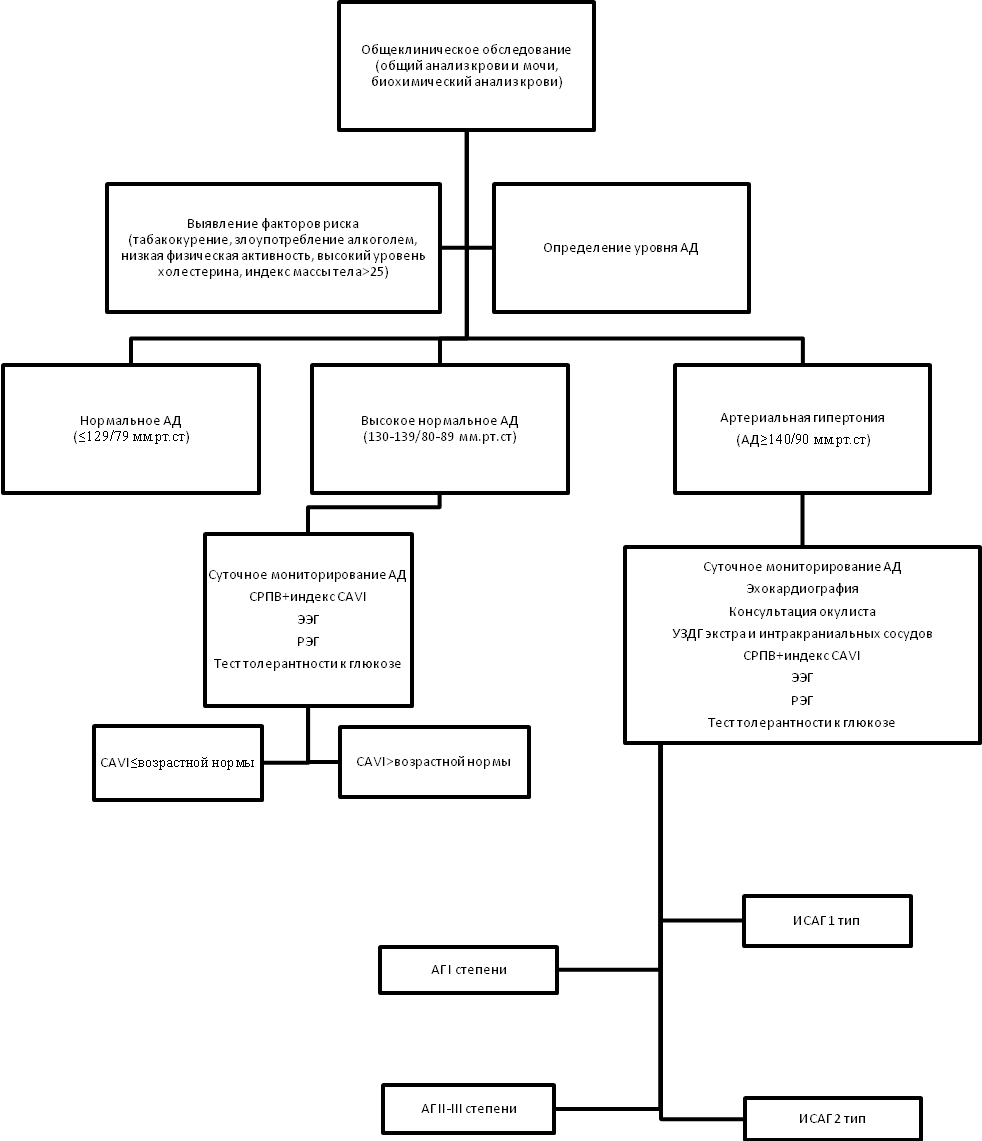
На основании обследования, наблюдения и курации пациентов с артериальной гипертонией (АГ) и нормальным АД с различной фоновой патологией нами был разработан алгоритм лечебно-диагностических действий в зависимости от величины «офисного» артериального давления, формы,и степени АГ с включением дополнительных показаний для проведения антигипертензивной терапии.
Основываясь на предложенном алгоритме врач-терапевт, врач кардиолог может заподозрить у пациента «доклиническую» стадию АГ и не допустить развития тяжелых осложнений со стороны сердечно-сосудистой системы. Для этого необходимо при поступлении пациента провести общеклиническое обследование, провести трехкратное измерение «офисного» АД, и выявить наличие основных («классических факторов риска») - табакокурение, низкая физическая активность, злоупотребление алкоголем, гиперхолестеринемия и высокий индекс массы тела, отягощенный анамнез по сердечно-сосудистым заболеваниям.
Если у пациента цифры «офисного» АД находятся в пределах 120-129/70-79 мм и выявляются факторы риска рекомендуется модифицировать образ жизни и проводить ежемесячный контроль АД при наличии отягощенного семейного анамнеза.
Если у пациента регистрируются цифры АД в пределах 130-139/80-89 мм рт.ст. то помимо выявления факторов риска ему рекомендуется проведение суточного мониторирования АД, консультация окулиста, определение гипертрофии левого желудочка (ГЛЖ) по ЭКГ (критерии Соколова-Лайона) определение скорости распространения пульсовой волны (СРПВ) и индексов жесткости (CAVI) центральных (аорта) и периферических сосудов (магистральные артерии нижних конечностей) методом обьемной сфигмографии, и проведение электро- и реоэнцефалографии для исследования пульсового кровенаполнения (ПК) и периферического сопротивления (ППС) мозговых сосудов. При значениях СРПВ и индексов CAVI в пределах возрастных норм и нормальном пульсовом кровенаполнении и ППС рекомендовано модифицировать образ жизни.
При наличии отклонения параметров, характеризующих ремоделирование сосудов от возрастных норм рекомендовано раннее назначение антигипертензивной терапии препаратами, в наибольшей степени влияющих на сосудистое ремоделирование – ингибиторов АПФ и тиазидных диуретиков. При изменениях в показателях церебральной гемодинамики целесообразно ранее назначения вазоактивных препаратов и средств, улучшающих метаболизм мозга (нейропротекция).
Если у пациента диагностирована АГ, то помимо вышеперечисленных методов обследования (ЭКГ, СМАД, окулист, СРПВ, CAVI, РЭГ, ЭЭГ) проводится эхокардиография и ультразвуковая допплерография экстра - и интракраниальных сосудов. У пациентов старше 60 лет, проводится анализ амбулаторных карт для уточнения стажа АГ, времени ее возникновения, а также трижды определяется САД, ДАД и пульсовое АД (ПАД).
АГ 1 степени – рекомендовано модификация образа жизни + монотерапия;
АГ 2-3 степени – модификация образа жизни + комбинированная антигипертензивная терапия
ИСГ 1 типа – рекомендовано модификация образа жизни + монотерапия (антагонисты Са, тиазидные диуретики в зависимости от преобладающего патогенетического механизма развития АГ)
ИСГ 2 типа – модификация образа жизни + комбинированная антигипертензивная терапия + нейропротекция.
Приложение 2.
Алгоритм лечения различных форм артериальной гипертензии с учетом периода онтогенеза и темпа старения
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
АГ – артериальная гипертензия
АД – артериальное давление
АМО – амплитуда моды
БВ – биологический возраст
ВБКН – время быстрого кровенаполнения
ВМКН – время медленного кровенаполнения
ВНС – вегетативная нервная система
ВОЗ – Всемирная организация здравоохранения
ВР – вегетативная реактивность
ВСА – внутренняя сонная артерия
ВСР – вариабельность сердечного ритма
ДАД – диастолическое артериальное давление
ДБВ – должный биологический возраст
ДИ – доверительный интервал
ДКИ – дикротический индекс
ДСИ – диастолический индекс
иАПФ – ингибиторы ангиотензинпревращающего фермента
ИБС – ишемическая болезнь сердца
ИВ – интегральный возраст
ИВО – индекс венозного оттока
ИВР – индекс вегетативного равновесия
ИМ – инфаркт миокарда
ИМТ – индекс массы тела
ИСГ – изолированная систолическая гипертензия
КВ – календарный возраст
КИГ – кардиоинтервалография
Мо – мода
НБА – надблоковые артерии
НСА – наружная сонная артерия
ОСА – общая сонная артерия
ПА – позвоночные артерии
ПАД – пульсовое артериальное давление
ПИКС – постинфарктный кардиосклероз
ППСС – периферическое сосудистое сопротивление
РИ – реографический индекс
РЭГ – реоэнцефалография
САД – систолическое артериальное давление
СДАГ – систолодиастолическая АГ
СКО – среднеквадратическое отклонение
СКФ – скорость клубочковой фильтрации
СМАД – суточное мониторирование АД
СНС – симпатическая нервная система
СРПВ – скорость распространения пульсовой волны
УЗДГ – ультразвуковая допплерография
УЗИ – ультразвуковое исследование
ФК – функциональный класс
ФР – факторы риска
ХС – холестерин
ХСН – хроническая сердечная недостаточность
ЧМТ – черепно-мозговая травма
ЧСС – частота сердечных сокращений
A-PWV – скорость распространения пульсовой волны по аорте
b-адреноблокаторы – блокаторы бета-адренергических рецепторов
B-PWV – скорость распространения пульсовой волны по плечевой артерии
CAVI – сердечно-лодыжечный сосудистый индекс (индекс жесткости)
C-PWV – скорость распространения пульсовой волны по сонной артерии
СV – коэффициент вариации ЧСС
Dipper – диппер
IR – индекс периферического сопротивления
L-PWV – скорость распространения пульсовой волны между плечем и левой голенью
Me – медиана
Mx DMn – вариационный размах
MxRMn – отношение максимального и минимального значений длительностей кардиоциклов (Xmax/Xmin).
Non – dipper – нон диппер
Night – peaker – найтпикер
r – коэффициент корреляции
R – коэффициент детерминации
R-PWV – скорость распространения пульсовой волны между плечом и правой голенью
Reakt – реактивность
PI – пульсационный индекс
р – коэффициент значимости
Over-dipper – Овер диппер
SI – стресс-индекс
Vd – диастолическая скорость кровотока
Vs – систолическая скорость кровотока
PI – разница в средних значениях («гемодинамический перепад» пульсационного индекса) на участке крупный сосуд (общая сонная артерия) – мелкий сосуд (надблоковая артерия

