Коррекция дисбиоза у больных после операций на органах желудочно-кишечного тракта
На правах рукописи
ВОРОНИНА
Ольга Вячеславовна
КОРРЕКЦИЯ ДИСБИОЗА У БОЛЬНЫХ ПОСЛЕ ОПЕРАЦИЙ
НА ОРГАНАХ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
14.00.27 – хирургия
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
кандидата медицинских наук
Санкт-Петербург
2009
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Санкт-Петербургская государственная медицинская академия имени И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель:
доктор медицинских наук,
профессор Лазарев Сергей Михайлович
Официальные оппоненты:
доктор медицинских наук,
профессор Гринёв Михаил Васильевич
доктор медицинских наук,
профессор Топузов Эскендер Гафурович
Ведущая организация:
ГОУДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агентства по здравоохранению и социальному развитию»
Защита состоится «10» сентября 2009 года в « ___ » часов на заседании диссертационного совета Д 208.086.01 при ГОУВПО “Санкт-Петербургская государственная медицинская академия имени И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию” по адресу: 195067, Санкт-Петербург, Пискарёвский проспект, дом 47.
С диссертацией можно ознакомиться в библиотеке ГОУВПО «Санкт-Петербургская государственная медицинская академия имени И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию»
Автореферат разослан « ___ » ____________ 2009 года.
Учёный секретарь диссертационного совета
доктор медицинских наук, профессор Успенский Юрий Павлович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. В структуре хирургических заболеваний 50-80% занимают локальные воспалительно-деструктивные процессы, развивающиеся в органах брюшной полости, которые представляют собой очаг инфекции, или патологический биоценоз, являющийся объектом противоинфекционной активности хирургов (Гринберг А.А., 2000; Ерюхин И.А., Гельфанд Б.Р., 2003; Борисов А.Е., Левин Л.А., 2004), что свидетельствует о существенной практической значимости проблемы.
Дисбиотические нарушения кишечного микробиоценоза следствие воздействия на организм таких факторов риска как инфекционно-воспалительные процессы органов желудочно-кишечного тракта, хирургические вмешательства, антибактериальная агрессия, сниженный иммунитет, стресс (Вялков А.И. и др., 2003; Хавкин А.И., 2004; Gibson G.R., 1995; Scevola D., Marone P., 2000).
Снижение колонизационной резистентности организма приводит к трансформации синергических межвидовых взаимоотношений. В условиях дисбиоза преобладает микробный антагонизм, проявляющийся в усилении ряда факторов патогенности грибково-бактериальных ассоциаций и росте активности аллохтонных микроорганизмов на фоне угнетения облигатной флоры (Гриценко В.А., 1996; Бухарин О.В., 1997; Бондаренко В.М., 2001).
В послеоперационном периоде возникает ряд взаимосвязанных проблемных звеньев (кишечный дисбиоз, синдром энтеральной недостаточности, иммунодефицит, нарушение целостности кишечного барьера, бактериальная транслокация, эндогенная интоксикация), обладающих потенцирующим влиянием друг на друга (Попова Т.С., 2005; Круглянский Ю.М., 2007; Berg R.D., 1992 et al., 1997; O'Boyle et al., 1998). В результате кишечный биотоп становится фактором агрессии в отношении организма (Петров В.П., Ерюхин И.А., 1989; Гриневич В.Б. и др., 2003).
Среди лечебных воздействий, направленных на стабилизацию кишечного микробиоценоза, в хирургической практике предпочтение отдаётся ранней нутритивной поддержке (Ермолов А.С. и др., 2005; Зингеренко В.Б., 2008; Newsholme E., 1997) и методу селективной деконтаминации желудочно-кишечного тракта, в основе которого применение антибактериальных препаратов (Гельфанд Б.Р. и др., 2002; Н. van Saene, Stoutenbeek С.P., 1983) и бактериофагов (Асланов Б.И., 2001; Бойцов А.Г. и др., 2006; Гостищев В.К., 2007; Hendrix R.W., 1999).
Использование препаратов пробиотического действия является новым подходом в хирургической практике, направленным на воссоздание и поддержание на оптимальном уровне микроэкологического статуса организма (Никитенко В.И., 2004; Шендеров Б.А., 2001; Привалова Т.Ю., 2006; Бондаренко В.М., 2007; Bengmark S. et al., 2003).
Отсутствие чёткой концепции целесообразности использования биопрепаратов и наличие фрагментарных данных о роли пробиотиков в комплексном лечении больных после операций на органах желудочно-кишечного тракта основание для выполнения данной исследовательской работы.
Цель исследования: Улучшение результатов лечения больных после экстренных операций на органах желудочно-кишечного тракта путём восстановления нарушений кишечного микробиоценоза.
Задачи исследования:
- Изучить характер изменений кишечной микрофлоры после экстренных
оперативных вмешательств на органах желудочно-кишечного тракта.
- Определить влияние препаратов с пробиотическим механизмом дейст-
вия на микробиологические характеристики кишечного биотопа, показатели иммунной системы и уровень интоксикации у больных, оперированных на органах желудочно-кишечного тракта в экстренном порядке.
- Показать целесообразность использования пробиотиков, обеспечиваю-
щих восстановление оптимальных параметров гомеостаза (микроэкологической и иммунной систем), в послеоперационном периоде.
Личный вклад автора: обследование и лечение больных, оперированных в экстренном порядке на органах желудочно-кишечного тракта в дооперационном и послеоперационном периодах; участие и самостоятельное проведение оперативных вмешательств данной категории больных; регистрация клинико-лабораторных показателей в динамике, их оценка, обобщение и анализ; компьютерная статистическая обработка полученных данных.
Научная новизна. Впервые получены данные о видовом и качественном составе кишечного микробиоценоза у больных после экстренных вмешательств на органах желудочно-кишечного тракта, уточняющие представления о роли кишечной микрофлоры в течение послеоперационного периода.
Выявлена зависимость степени угнетения иммунитета и показателей эндогенной интоксикации от глубины изменений кишечного микробиоценоза, что продиктовало необходимость активного вмешательства в восстановление нормобиоценоза.
В настоящем исследовании предложен патогенетически обоснованный способ коррекции кишечного дисбиоза у хирургических больных гастроэнтерологического профиля в восстановительном периоде.
На основании анализа состояния кишечного микробиоценоза, иммунной системы и эндогенной интоксикации показана эффективность пробиотической коррекции.
Практическая значимость исследования. Установлено значение бактериологического исследования кишечной микрофлоры на дисбиоз у хирургических больных гастроэнтерологического профиля. Обнаружение условно-патогенных и патогенных штаммов бактерий позволяет направленно регулировать биоценоз желудочно-кишечного тракта, добиться раннего восстановления его физиологических функции и предупредить развитие осложнений, поэтому имеет практическую ценность для качественного ведения восстановительного периода у оперированных больных.
На основании клинических исследований, доказывающих эффективность коррекции кишечного дисбиоза после экстренных операций на органах желудочно-кишечного тракта с помощью поликомпонентного пробиотического препарата «Экофлор», рекомендовано включение его в стандартные программы лечения с первых дней послеоперационного периода.
Апробация работы. Фрагменты научной работы доложены на региональной научно-практической конференции «Проблемы современной гастроэнтерологии» (Санкт-Петербург, 2007); отчётной научно-практической конференции «Исследования и разработки по приоритетным направлениям в медицине» (Санкт-Петербург, 2008; 2009); Всероссийской научной конференции с международным участием «Социальные аспекты хирургической помощи населению в современной России», посвящённой памяти проф. В.В. Успенского (Тверь, 2008); IX Всероссийской научно-практической конференции «Актуальные вопросы клиники, диагностики и лечения в многопрофильном лечебном учреждении» (Санкт-Петербург, 2009); 11-м Международном Славяно-Балтийском научном медицинском форуме «Санкт-Петербург-Гастро-2009».
Основные результаты исследования доложены и обсуждены на заседаниях: кафедры хирургических болезней с курсом малоинвазивной хирургии, эндоскопии и лазерных медицинских технологий СПбГМА им. И.И. Мечникова (13/04/2009); проблемной комиссии «Неотложная и пластическая хирургия» ГОУВПО СПбГМА им. И.И. Мечникова (12/05/2009).
Публикации. По материалам диссертационного исследования опубликовано 16 научных работ, 2 из них – в изданиях, рекомендованных ВАК; получен патент на полезную модель: Воронина О.В., Филенко Б.П., Лазарев С.М. «Зонд для назоинтестинальной интубации» № заявки 2006116602/22
(018067), приоритет от 15.05.2006, решение о выдаче патента на изобретение от 10.12.2006, патент № 58922.
Реализация результатов исследования. Предложенный способ коррекции кишечного дисбиоза, направленный на стабилизацию кишечного микробиоценоза и стимуляцию метаболических органных процессов в комплексном лечении больных после операций на органах желудочно-кишечного тракта, внедрен в лечебную практику хирургического отделения клинической больницы им. Петра Великого ГОУВПО СПбГМА им. И.И. Мечникова и отделения хирургии СПб ГУЗ «Городская больница № 31». Результаты научного исследования используются в учебно-педагогическом процессе кафедры хирургических болезней с курсом малоинвазивной хирургии, эндоскопии и лазерных медицинских технологий ГОУВПО СПбГМА им. И.И. Мечникова. Разработаны и утверждены на региональном уровне методические рекомендации «Способ коррекции дисбиоза кишечника в абдоминальной хирургии».
Структура и объём диссертации. Диссертация состоит из введения, четырёх глав, заключения, выводов, практических рекомендаций, списка литературы и приложений. Работа изложена на 138 страницах машинописного текста, содержит 28 таблиц, иллюстрирована 5 рисунками, документирована 5 выписками из историй болезни. Библиографический указатель включает 200 источников, из них 131 отечественных и 69 иностранных авторов.
Положения, выносимые на защиту
- Для раннего послеоперационного периода характерна тотальная деста-
билизация кишечного микробиоценоза.
- Дисбиотические изменения фекальной микрофлоры в послеоперацион
ном периоде характеризуются преобладанием представителей аллохтонной грамотрицательной аэробной микрофлоры и грибов рода Candida, что приводит к развитию дисбаланса защитно-приспособительных механизмов организма.
- Коррекция кишечного дисбиоза пробиотическими препаратами улучша-
ет клиническое течение послеоперационного периода у хирургических больных гастроэнтерологического профиля за счёт стабилизации кишечного микробиценоза, стимуляции иммунной системы и снижения эндогенной интоксикации.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Работа основана на анализе лечения 139 больных, оперированных в экстренном порядке на органах желудочно-кишечного тракта в хирургическом отделении клинической больницы имени Петра Великого кафедры хирургических болезней с курсом малоинвазивной хирургии, эндоскопии и лазерных медицинских технологий ФПК ГОУВПО «Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию» СПбГМА им. И.И. Мечникова и на базе отделения хирургии СПб ГУЗ «Городская больница № 31» в период с 2005 по 2008 годы. Для решения поставленных задач больные разделены на группы (таб. 1).
Таблица 1
Характеристика анализируемых групп
| Группа | Характеристика группы | Количество больных | |
| абс. | % | ||
| контрольная | пациенты, получавшие стандартное комплексное лечение | 73 | 52,5 |
| основная | пациенты, дополнительно получавшие пробиотический препарат | 66 | 47,5 |
| Всего: | 139 | 100 | |
Предложенный в исследовании способ лечения заключался в применении с первых дней послеоперационного периода одной из последних биотехнологических разработок – пробиотического препарата-консорциума «Экофлор». Благодаря комплексу микроколоний живых Bifidobacterium spp. и Lactobacillus spp., иммобилизованных на частицах углеродминерального сорбента СУМС-1 последний оказывает двойной санирующий эффект. Каждая частица является микроколонией, с титром 108 КОЕ, размещённой на определённом участке (эухтоне) и несущей репродукционную зону, активизирующую колонизационный процесс, что способствует быстрому восстановлению микроэкологии кишки и ускорению репаративных процессов слизистой.
При пероральном приёме «Экофлор» назначался в дозе 5 г на 1 приём 3 раза в день в течение 10-14 дней. Зондовая коррекция дисбиоза у больных поле операций по поводу острой кишечной непроходимости осуществлялась гравитационным методом с подключением инфузионных систем и дозирующей капельницы, или принудительным введением с помощью шприца Жане в течение 5-7 суток (до момента удаления зонда). Через назоинтестинальный зонд «Экофлор» вводился в дозе 5 г в 200 мл физиологического раствора хлористого натрия (3 раза в сутки) с экспозицией 45-60 минут, после чего зонд открывался для свободного оттока.
Достоверных различий распределения по возрасту и полу в группах сравнения не выявлено (p>0,05) (таблица 2).
Таблица 2
Распределение больных по возрасту и полу
| Показатели | контрольная (n=73) | основная (n=66) | Всего | |
| абс. | % | |||
| до 60 лет старше 60 | 42 31 | 39 27 | 81 58 | 58,3 41,7 |
| мужчины женщины | 28 45 | 31 35 | 59 80 | 42,4 57,6 |
Больные, введённые в исследование, имели различные острые хирургические заболевания органов ЖКТ, исключая онкологические (таблица 3).
Таблица 3
Распределение больных по характеру заболевания
| Нозологическая категория | контрольная группа | основная группа | ||
| абс. | % | абс. | % | |
| острый аппендицит | 21 | 28,8 | 19 | 28,9 |
| острый холецистит | 15 | 20,5 | 16 | 24,2 |
| осложнения язвенной болезни желудка и двенадцатиперстной кишки (перфорация, кровотечение, стеноз, пенетрация) | 13 | 17,8 | 9 | 13,6 |
| острый деструктивный панкреатит | 7 | 9,6 | 7 | 10,6 |
| острая кишечная непроходимость | 17 | 23,3 | 15 | 22,7 |
| Всего: | 73 | 100 | 66 | 100 |
Протокол клинического исследования одобрен локальным этическим комитетом 11.09.2008, соответствует Хельсинской декларации Всемирной медицинской ассоциации «Рекомендации для врачей, занимающихся биомедицинскими исследованиями с участием людей», требованиям, изложенным в основных нормативных документах РФ по клиническим исследованиям и правилам лабораторной практики (GCP). Сроки и объём хирургической помощи соответствовал протоколам организации экстренной лечебно-диагнос-тической помощи, утверждённым Минздравом РФ (2004).
В процессе распределения испытуемых по группам использовалась рандомизация по степени тяжести дисбиотических изменений кишечного микробиоценоза в соответствии с классификацией, основанной на данных микробиологического исследования (Отраслевой стандарт «Протокол ведения больных. Дисбактериоз кишечника» // ОСТ 91500.11.0004-2003, Приказ МЗ РФ №231 от 09.06.2003).
Для обоснования необходимости восстановления параметров кишечной микроэкологии у больных в послеоперационном периоде использовалась программа исследований, включающая клинико-лабораторные, микробиологические, иммунологические и статистические методы.
Микробиологические и иммунологические исследования по теме диссертации выполнены в лаборатории микробиологии и иммунологии (лицензия №0805/03 от 30.10.03) ФГУ «РНИИТО им. Р.Р. Вредена» Росздрава (зав. лабораторией, д.м.н., проф. Г.Е. Афиногенов).
Качественный и количественный состав кишечного микробиоценоза изучали с помощью бактериологического анализа просветной микрофлоры тонкой и толстой кишки.
Материал для исследования:
- содержимое тонкой кишки, отобранное путём аспирации через назоинтестинальный зонд, у больных после операций по поводу острой кишечной непроходимости (n=32);
- пробы фекалий, взятые из прямой кишки ректальным шпателем, а также пробы фекалий из колостомы.
Срок забора материала:
- первые сутки после операции;
- перед удалением назоинтестинального зонда (57-е сутки);
- после окончания курса лечения (1014-е сутки) у всех больных, включённых в исследование.
Материал для бактериологического исследования в количестве 1 г (или тонкокишечное содержимое – 1 мл) отбирали в стерильный герметически закрытый флакон без консерванта (или пробирку с 9 мл стерильной среды СКС-191) и в течение 24-х часов доставляли в лабораторию. Культивирование и обработку материала производили в течение 34-х суток на стандартных селективных питательных средах для оценки видового и количественного состава кишечной микрофлоры с помощью общепринятых микробиологических методов. Анаэробные микроорганизмы культивировали на стандартных селективных питательных средах с использованием анаэростата в условиях специальной газовой смеси (10% водорода, 10% углекислого газа, 80% азота) по методике Кочеровца В.И., 1990. Количественное содержание микроорганизмов в исследуемом материале выражали в lg КОЕ/г и lg КОЕ/мл.
Для подтверждения кишечного дисбиоза применяли индекс стабильности микрофлоры – отношение суммарного количества Bifidobacterium spp. и Lactobacillus spp. к количественному показателю Escherichia coli spp. При определении индекса ниже 2,0 – дисбиотические нарушения доказаны.
При исследовании иммунологического статуса оценивали состояние клеточного, гуморального и фагоцитарного звеньев иммунитета в сыворотке крови, а также состояние местного иммунитета ЖКТ.
Клеточный иммунитет изучали по количеству лимфоцитов методом розеткообразования с эритроцитами барана (E-POK), а также абсолютному и относительному количеству субпопуляций лимфоцитов (CD3+, CD4+, CD8+, CD22+) методами спонтанного и иммунофлюоресцентного анализа с применением наборов моноклональных антител с различными CD-антителами.
Гуморальный иммунитет определяли по общей концентрации сывороточных иммуноглобулинов А, М, G методом твёрдофазного гетерогенного иммуноферментного анализа – ELISA (enzyme linked immunosorbent assay), основанного на определении иммуноглобулинов А, М, G с помощью иммуносорбентов, связанных с ферментами.
Состояние местного иммунитета определяли путём количественной оценки в содержимом тонкой кишки секреторного иммуноглобулина A (SIgA) по принципу двухсайтового иммуноферментного анализа.
Уровень эндотоксикоза оценивали на основании интегрального анализа лабораторных тестов: общего количества лейкоцитов периферической крови и лейкоцитарного индекса интоксикации – ЛИИ (по Кальф-Калифу Я.Я. в модификации Толстого А.Д., 2003).
Статистическую обработку материала выполняли с использованием стандартных пакетов программ прикладного статистического анализа (STATISTICA Base for Windows v.8). Критический уровень достоверности нулевой статистической гипотезы (об отсутствии различий или факторных влияний) принимали равным 0,05.
Результаты исследования и их обсуждение
Состояние кишечной микрофлоры после оперативного вмешательства
Бактериологическое исследование химуса свидетельствовало о нарушении нормального градиента микроорганизмов от проксимальных отделов желудочно-кишечного тракта к дистальным, выразившееся в виде синдрома избыточного бактериального роста в тонкой кишке. Общая обсеменённость составляла 109-1012 КОЕ/мл. Бактериальная флора приобрела типично толстокишечный характер.
Микробиоценоз толстой кишки (рис. 1) характеризовался изменением соотношения представителей облигатной и факультативной микрофлоры.

Рис. 1. Состав кишечной микрофлоры в 1-е сутки послеоперационного периода
На фоне снижения популяционного уровня и концентрации Bifido-bacterium spp. и Lactobacillus spp. отмечался рост условно-патогенных бактерий и их ассоциаций (среднее число культур – 3,5±0,2), среди которых превалировали грамотрицательные аэробы и дрожжеподобые грибы рода Candida spp. Кроме того, наблюдалась контаминация просвета толстой кишки патогенными штаммами Escherichia coli с удельным содержанием более 104 КОЕ/г, что расценивалось как проявление ослабления колонизационной резистентности кишечной слизистой и снижение репаративных свойств организма в послеоперационном периоде.
Нестабильность бактериального равновесия кишечного биоценоза подтверждалась вариабельностью индекса стабильности микрофлоры от 0,32 до 0,56.
Анализ результатов микробиологического исследования микроэкологии толстой кишки (n=139) свидетельствовал о дисбалансе бактериального равновесия в первые сутки послеоперационного периода (рис. 2).
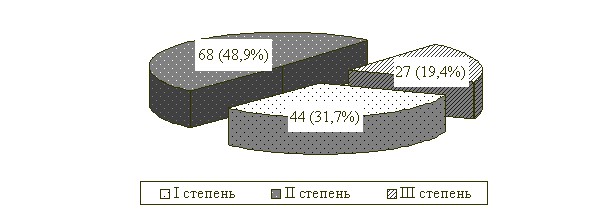
Рис. 2. Распределение больных по степени дисбиоза толстой кишки
в 1-е сутки послеоперационного периода
Как следует из полученных данных, у большей части больных после экстренного оперативного вмешательства на органах желудочно-кишечного тракта отмечался кишечный дисбиоз II степени.
Оценка эффективности способа коррекции дисбиоза
у больных после операций на органах желудочно-кишечного тракта
Выявленные изменения кишечной микрофлоры после экстренных операций на органах ЖКТ продиктовали необходимость активного вмешательства с целью восстановления нормобиоценоза.
Проведение зондовой коррекции биоценоза тонкой кишки к 57-м суткам послеоперационного периода позволило достичь восстановления физиологического уровня микробного фона интестинальной среды, снизив угрозу энтерогенного инфицирования организма.
Бактериологический мониторинг толстокишечного содержимого (диаграмма 3) на 10–14-е сутки послеоперационного периода указывал на отчётливую позитивную тенденцию изменения микробного профиля фекалий у основной группы больных.
Как представлено на рис. 3, концентрация облигатной микрофлоры (Bifidobacterium spp., Lactobacillus spp., типичные Escherichia coli) увеличилась на 3-4 порядка. Снизилось удельное содержание условно-патогенных микроорганизмов и их ассоциаций (среднее число культур – 1,3±0,3). Зарегистрирована полная элиминация Escherichia сoli с изменёнными биологическими свойствами. Восстановление кишечной микроэкологии у больных контрольной группы происходило медленнее.

Рис. 3. Сравнительная динамика трансформации микрофлоры толстой кишки
на 10–14-е сутки послеоперационного периода
Результаты анализа выраженности дисбиотичеких изменений в толстой кишке в соответствии с данными микробиологического исследования фекальной микрофлоры представлены на рис. 4.
Нормобиоценоз в основной группе зафиксирован у 45 больных (68,2%) в сравнении с контрольной группой – 19 (26,1%). Дисбиотические нарушения фекальной микрофлоры сохранялись у 21 больного (31,8%) основной группы, что нашло отражение в показателе индекса стабильности микрофлоры, который составил 1,8. Полученные данные указывали на длительное восстановление микрофлоры толстой кишки у больных, перенёсших оперативные вмешательства на поджелудочной железе, по поводу ОКН и течение послеоперационного периода которых сопровождалось осложнениями. У данной категории лиц патогенетический цикл превышал по продолжительности клинический, что требовало продолжения лечения. Негативное влияние медикаментозного вмешательства в бактериальное равновесие энтеральной среды отразилось на клинико-бактериологических показателях контрольной группы больных – на 1014-е сутки кишечный дисбиоз зарегистрирован в 54 случаях (73,9%), индекс стабильности микрофлоры – 1,2, что значимо отличалось от данных в основной группе больных (р<0,05).

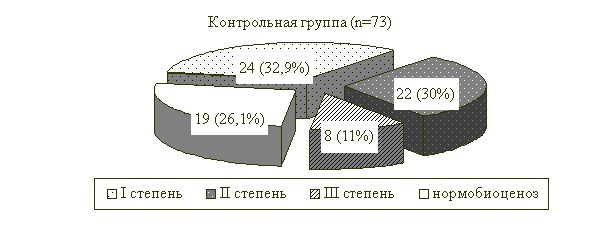
Рис. 4. Распределение больных по степени дисбиоза толстой кишки
на 1014-е сутки послеоперационного периода
При оценке состояния иммунологического статуса больных в раннем послеоперационном периоде выявлена зависимость степени угнетения иммунитета от глубины отклонений кишечного микробиоценоза (таблица 4).
Между глубиной нарушений в составе нормофлоры кишечного содержимого (Bifidobacterium spp. и Lactobacillus spp. – в разведениях 105-106 КОЕ/г при норме 109-1012 КОЕ/г и 107-108 КОЕ/г соответственно), характеризующей I степень дисбиоза, и умеренным ростом показателей иммунитета (лимфоциты – 2,4±0,07109/л против 0,8-2,0109/л в норме; IgA – 5,4±0,09 г/л, IgM – 2,8±0,03 г/л, IgG – 10,4±0,3 г/л против физиологической нормы IgA – 0,7-4,0 г/л, IgM – 0,4-2,6 г/л, IgG – 7-15 г/л соответственно) прослеживалась обратная корреляционная связь средней силы (r= –0,34, p<0,05), что свидетельствовало о мобилизации защитно-компенсаторных механизмов иммунологической реактивности организма больных.
Отмечена статистически достоверная прямая корреляционная взаимосвязь средней силы (r=0,58, p<0,05) между изменениями в составе кишечной микрофлоры, соответствующими II и III степени дисбиоза (Bifidobacterium spp. и Lactobacillus spp. – в разведениях 103-104 КОЕ/г при норме 109-1012 КОЕ/г и 107-108 КОЕ/г соответственно), и снижением иммунологических показателей (лимфоциты – 0,75±0,2109/л и 0,4±0,1109/л; IgA – 1,1±0,85 г/л и 0,65±0,1 г/л; IgM – 1,1±0,01 г/л и 0,27±0,01 г/л; IgG – 6,1±0,25г/л и 5,1±0,15 г/л против физиологической нормы IgA – 0,7-4,0 г/л, IgM – 0,4-2,6 г/л, IgG – 7-15 г/л соответственно), что указывало не только на тяжёлое состояние больных, но и тесную взаимосвязь организма с микробиотой.
Таблица 4
Показатели иммунологического статуса в зависимости от степени дисбиоза (M±m)
| Показатели | Норма | Степень дисбиоза (M±m) | ||
| I n=44 | II n=68 | III n=27 | ||
| CD3+ (Т-лимфоциты отн.) | 50-76% | 78,9±1,5* | 51,4±0,9* | 37,8±0,4* |
| CD3+ (Т-лимфоциты абс.) | 0,8-2,0109/л | 2,4±0,07 | 0,75±0,2 | 0,4±0,1 |
| CD4+ Т-хелперы | 32-44% | 45,7±1,2* | 29,7±0,9* | 27,3±1,75* |
| CD8+ Т-супрессоры | 18-30% | 23,4±0,3 | 18,7±0,7 | 17,9±0,5 |
| CD16+ (Т-киллеры) | 11-23% | 24,9±0,4* | 10,7±0,45* | 9,6±0,7* |
| CD22+ (В-лимфоциты отн.) | 11-20% | 11,9±0,1 | 9,7±0,2 | 5,8±0,08 |
| CD22+ (В-лимфоциты абс.) | 0,23-0,35109/л | 0,25±0,2 | 0,21±0,1 | 0,15±0,1 |
| ФИ | 66-74% | 71,7±1,75* | 61,3±1,8* | 54,6±1,75* |
| ФЧ | 8-12 | 8,9±0,2* | 7,8±0,25* | 5,9±0,2* |
| IG A | 0,7-4,0 г/л | 5,4±0,09* | 1,1±0,85* | 0,65±0,1* |
| IG М | 0,4-2,6 г/л | 2,8±0,03* | 1,1±0,01* | 0,27±0,01* |
| IG G | 7-15 г/л | 10,4±0,3* | 6,1±0,25* | 5,1±0,15* |
Достоверность различий: * – с вероятностью 95% (р<0,05)
При исходном послеоперационном иммунодефиците пробиотическая коррекция кишечного дисбиоза способствовала изменению напряжённости как местного, так и системного иммунитета, демонстрируя иммуномодулирующий эффект биоценозсберегающего лечения (таблица 5).
Клинически это проявлялось благоприятным течением послеоперационного периода, ранним исчезновением симптомов интоксикации и уменьшением числа инфекционно-воспалительных осложнений.
Таблица 5
Динамика показателей иммунного статуса (M±m)
| Показатели | Сроки наблюдения | ||
| до лечения (n=139) | после лечения | ||
| контрольная (n=73) | основная (n=66) | ||
| CD3+ (Т-лимфоциты отн.) | 49,2±1,3 | 61,1±1,5* | 77,6±1,8* |
| CD3+ (Т-лимфоциты абс.) | 0,4±0,01 | 0,7±0,1* | 2,2±0,2* |
| CD4+ Т-хелперы | 29,8±0,5 | 40,4±1,3* | 44,9±0,3* |
| CD8+ Т-супрессоры | 26,1±0,1 | 24,3±0,5 | 21,7±0,3 |
| CD16+ (Т-киллеры) | 24,3±0,3 | 18,4±0,5* | 12,1±0,7* |
| CD22+ (В-лимфоциты отн.) | 10,8±0,1 | 19,1±0,3 | 21,7±0,25 |
| C22+ (В-лимфоциты абс.) | 0,2±0,01 | 0,29±0,1 | 0,38±0,25 |
| ФИ | 63,4±0,8 | 69,4±2,1 | 73,0±0,6 |
| ФЧ | 7,2±0,2 | 10,4±0,01 | 11,8±0,1 |
| IG A | 0,65±0,1 | 2,3±0,1* | 3,4±0,2* |
| IG М | 0,6±0,01 | 2,1±0,03* | 2,5±0,2* |
| IG G | 6,9±0,1 | 12,4±0,4* | 15,7±0,1* |
| SIg A (в химусе) | 147±50 | 156±60* | 276±46* |
Достоверность различий: * – с вероятностью 95% (р<0,05)
Наличие обратной корреляционной связи средней силы (r= –0,43, p<0,05) между степенью несостоятельности кишечной микроэкологии и интегральными показателями эндогенной интоксикации (уровнем лейкоцитоза, ЛИИ) являлась доказательством наличия зависимости уровня интестиногенного компонента интоксикации организма от выраженности дисбаланса бактериального равновесия кишечного биотопа.
Для проведения интегрального анализа лабораторных тестов эндотоксикоза в группы сравнения, однородные по возрасту, полу, нозологическим категориям и степени дисбиоза (p>0,05), включены по 10 больных (таблица 6).
Как следует из таблицы 6, в основной группе интегральные показатели эндотоксикоза (количество лейкоцитов периферической крови, ЛИИ) на 10–14-е сутки послеоперационного периода находились в границах допустимых значений. В то время как у пациентов контрольной группы лейкоцитоз сохранялся, а ЛИИ в 1,3 – 1,6 раза превышал предельную величину, что свидетельствовало о сохранении интоксикации вследствие истощения восстановительного потенциала организма и присоединения осложнений.
Таблица 6
Динамика показателей выраженности эндогенной интоксикации
в зависимости от степени кишечного дисбиоза (M±m)
| Показатель | контрольная группа (n=10) | основная группа (n=10) | |||
| 1-е сутки | 1014-е сутки | 1-е сутки | 1014-е сутки | ||
| I степень | |||||
| лейкоциты, 109/л | 12,3±1,2 | 10,7±2,0* | 11,3±2,3 | 7,4±1,7* | |
| ЛИИ, усл. ед. | 2,4±0,6 | 1,9±0,3* | 2,5±0,7 | 0,65±0,1* | |
| II степень | |||||
| лейкоциты, 109/л | 13,4±1,5 | 9,5±1,9 | 12,7±2,1 | 8,1±1,3 | |
| ЛИИ, усл. ед. | 7,3±1,1 | 2,1±0,6* | 6,8±0,9 | 1,15±0,8* | |
| III степень | |||||
| лейкоциты, 109/л | 15,1±1,8 | 11,9±2,0* | 14,5±1,7 | 9,1±1,5* | |
| ЛИИ, усл. ед. | 9,4±1,3 | 2,4±1,1* | 10,7±1,8 | 1,3±0,4* | |
Достоверность различий: * – с вероятностью 95% (р<0,05)
Операционная травма приводит к увеличению циркуляции токсических субстанций, что делает ранний послеоперационный период наиболее опасным для развития декомпенсации детоксикационных систем организма, включая кишечную микрофлору, в силу выраженности фактора агрессии. Поэтому появление признаков несостоятельности кишечной микроэкологии является одним из симптомов нарушения её детоксикационного потенциала и требует коррекции проводимого лечения.
Биоценозсберегающий способ, включённый в комплексную программу лечения, по результатам анализа микробиологической и иммунологической составляющих гомеостаза, а также параметров интоксикации превзошёл стандартные методы ведения послеоперационного периода.
ВЫВОДЫ
- Кишечный микробиоценоз раннего восстановительного периода у боль-
ных, оперированных на органах желудочно-кишечного тракта в экстренном порядке, характеризуется тотальной дестабилизацией бактериального равновесия с преобладанием II (48,2%) и III (32,4%) степени дисбиоза.
- Параллельно снижению репаративных свойств организма в послеопера-
ционном периоде происходит снижение популяционной плотности аутохтонных штаммов кишечной микрофлоры и рост аллохтонных, с отчётливым доминированием грамотрицательных аэробов и грибов рода Candida.
- Пробиотическая корреция дисбиоза, начиная с первых суток послеопера-
ционного периода, основанная на применении поликомпонентного препарата «Экофлор», способствует стабилизации микробного фона кишечного биоценоза, стимуляции иммунной системы и устранению эндогенной интоксикации.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- При бактериологическом исследовании фекальной микрофлоры на дис-
биоз у хирургических больных гастроэнтерологического профиля основное внимание должно обращаться на выявление условно-патогенных и патогенных микроорганизмов, что позволит направленно регулировать биоценоз желудочно-кишечного тракта, добиться раннего восстановления его физиологических функции и предупредить развитие осложнений.
- С целью оптимизации микробного фона кишечного биотопа и профилак-
тики энтерогенного инфицирования после экстренных операций на органах желудочно-кишечного тракта рекомендуется включение поликомпонентного биопрепарата «Экофлор»в стандартные программы лечения с первых дней восстановительного периода в дозе 5 г на 1 приём 3 раза в день в течение 10-14 дней; при зондовой коррекции дисбиоза – в дозе 5 г в 200 мл физиологического раствора хлористого натрия (3 раза в сутки) с экспозицией 45-60 минут, после чего зонд открывался для свободного оттока в течение 5-7 суток (до момента удаления зонда).
- В комплекс лечебной программы пациентов, оперированных по поводу
острой кишечной непроходимости, рекомендуется введение зондовой интестинальной коррекции дисбиоза.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Воронина О.В. Применение эубиотиков в практике лечения перитонита / О.В. Воронина, Х.А. Гамзатов, Д.М. Кокорин // Проблема укрепления здоровья и профилактики заболевани: материалы научно-практической конференции. – СПб: СПбГМА им. И.И. Мечникова, 2004. – С. 57.
- Воронина О.В. Начальные результаты изучения микробиоценоза тонкой кишки у хирургических больных с синдромом избыточного кишечного роста на фоне применения препаратов функционального питания / О.В. Воронина // Состояние окружающей среды и здоровье населения Северо-Западного региона: сборник научно-практических работ / под ред. акад. РАМН, з.д.н. РФ А.В. Шаброва, з.д.н. РФ, проф. В.Г. Маймулова. – СПб.: СПбГМА им. И.И. Мечникова, 2006. – С.43.
- Воронина О.В. Возможности использования пробиотических препаратов у больных прооперированных на органах желудочно-кишечного тракта / О.В. Воронина // Актуальные вопросы хирургии (выпуск шестой): сборник научно-практических работ / под редакцией проф. В.Н. Бордуновского. – Челябинск: ЧГМА, 2006. – С.20-23.
- Воронина О.В. Обоснование необходимости применения пробиотиков в абдоминальной хирургии / О.В. Воронина // Юбилейный сборник научных трудов, посвящённый 100-летию СПбГМА им. И.И. Мечникова. – СПб.: СПбГМА им. И.И. Мечникова, 2007. – С. 58-63.
- Воронина О.В. Назоинтестинальная интубация при острой кишечной непроходимости (пособие для врачей) / С.М. Лазарев, Б.П. Филенко, А.С. Иванов, Т.В. Трунина, С.В. Ефремова, О.В. Воронина. – Санкт-Петербург, 2006. – 28с.
- Воронина О.В. Результаты оценки эффективности применения иммобилизованного пробиотика «Экофлор» с помощью бактериологического метода исследования / С.М. Лазарев, О.В Воронина // Проблемы хирургии в современной России: материалы IX научно-практической конференции. – СПб: СПбГУ, 2006. – С. 42-43.
- Воронина О.В. Применение «Экофлора» в абдоминальной хирургии // О.В. Воронина // Исследования и разработки по приоритетным направлениям в медицине: материалы научно-практической конференции / под редакцией акад. РАМН, з.д.н. РФ А.В. Шаброва, з.д.н. РФ, проф. В.Г. Маймулова. – СПб: СПбГМА им. Мечникова, 2008. – С. 54-56.
- Воронина О.В. Способ коррекции дисбиоза кишечника в абдоминальной хирургии (методические рекомендации) / С.М. Лазарев, Б.П. Филенко, О.В. Воронина. – Санкт-Петербург, 2008. – 16с.
- Воронина О.В. Способ коррекции дисбиоза кишечника после хирургического вмешательства на органах желудочно-кишечного тракта / О.В. Воронина // Terra medica nova. – 2008. – №2. – С.50-53.
- Воронина О.В., Филенко Б.П., Лазарев С.М. «Зонд для назоинтестинальной интубации» № заявки 2006116602/22(018067), приоритет от 15.05.2006, решение о выдаче патента на изобретение от 26.06.2006, патент № 589222.
- Воронина О.В. Корреляционные взаимосвязи иммуно-микробиологи-ческих показателей у больных после операций на органах желудочно-кишечного тракта / О.В. Воронина // Социальные аспекты хирургической помощи населению в современной России: материалы Всероссийской научной конференции с международным участием. – Тверь: ТГМА, 2008. – Выпуск 5. – С. 47.
- Воронина О.В. Коррекция проявлений дисбиоза у больных с острой кишечной непроходимостью / О.В. Воронина, С.М. Лазарев // Социальные аспекты хирургической помощи населению в современной России: материалы Всероссийской научной конференции с международным участием. – Тверь: ТГМА, 2008. – Выпуск 5. – С. 119-120.
- Воронина О.В. Микроэкология толстой кишки после аппендэктомии / С.М. Лазарев, О.В. Воронина // Проблемы хирургической гастроэнтерологии: материалы научно-практической конференции, посвящённой 80-летию со дня рождения проф. А.И. Горбашко. – СПб: СПбГУ, 2008. – С. 22-24
- Воронина О.В. Эффективность «Экофлора» у больных с осложнённой язвенной болезнью желудка и 12-перстной кишки в послеоперационном периоде / С.М. Лазарев, О.В. Воронина // Вестник Российской Военно-медицинской Академии. – 2009. – №1 (25). – Ч. II. – С. 945-946.
- Воронина О.В. Иммунологический статус больных оперированных на органах желудочно-кишечного тракта на фоне применения «Экофлора» / О.В. Воронина // Материалы 11-го Международного Славяно-Балтийского научного форума «Санкт-Петербург – Гастро-2009» // Гастроэнтерология Санкт-Петербурга. – 2009. – №2-3. – С. М17.
- Воронина О.В. Биоценозсберегающее лечение в хирургии желудочно-кишечного тракта / С.М. Лазарев, О.В. Воронина // Вестник хирургии им. И.И. Грекова. – 2009. – Т. 168, №1. – С. 84-88.

