Клинико-патофизиологическое обоснование ранней диагностики синдрома полиорганной недостаточности и висцеральных осложнений у пострадавших с политравмой
На правах рукописи
ГАЙДУК
Сергей Валентинович
КЛИНИКО-ПАТОФИЗИОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ
РАННЕЙ ДИАГНОСТИКИ СИНДРОМА ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ И ВИСЦЕРАЛЬНЫХ ОСЛОЖНЕНИЙ
У ПОСТРАДАВШИХ С ПОЛИТРАВМОЙ
14.00.16 – патологическая физиология
14.00.05 – внутренние болезни
Автореферат диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург
2009
Работа выполнена в ГОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ
Научный консультант:
доктор медицинских наук профессор СОСЮКИН Анатолий Евгеньевич
Официальные оппоненты:
доктор медицинских наук ВОЙЦИЦКИЙ Анатолий Николаевич
доктор медицинских наук профессор ВАСИЛЬЕВ Андрей Глебович
доктор медицинских наук профессор ПЕРШКО Анатолий Михайлович
Ведущая организация:
НИИЦ (МБЗ) ФГУ «ГосНИИИ ВМ Минобороны России»
Защита состоится 29 декабря 2009 года в 10 часов на заседании совета по защите докторских и кандидатских диссертаций Д 215.002.03 при ГОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ по адресу: 194044, Санкт-Петербург, ул. Академика Лебедева, 6
С диссертацией можно ознакомиться в фундаментальной библиотеке ГОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ.
Автореферат разослан "___" ноября 2009 года.
Ученый секретарь диссертационного совета
доктор медицинских наук профессор
А.В. ДЕРГУНОВ
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
Последние десятилетия характеризуются значительным ростом травматизма, имеющего многообразные причины, как в мирное, так и в военное время. Так, количество ежегодно погибающих от травм в дорожно-транспортных происшествиях в 90-е годы составило 8,4 миллиона человек в мире. В России ежегодно происходит 170 тысяч дорожно-транспортных происшествий, в которых получают травмы 225 тысяч и гибнут 34 тысячи человек [Агаджанян В.В.; 2003; Бондаренко А.В., 2004].
Характерной особенностью современного травматизма является высокий удельный вес множественных и сочетанных травм, отличающихся тяжелым течением, высокой летальностью и инвалидизацией [Лейдерман И.Н., 2007; Гуманенко Е.К., 2007]. Очевидно и то, что от травм погибают преимущественно молодые и трудоспособные люди. В возрасте от 1 года до 34 лет травма оказывается основной причиной смерти, а среди подростков и юношей этот показатель достигает 80% [Селезнев С.А., Багненко С.Ф. и соавт., 2004]. Поэтому тяжелая травма в мирных условиях может служить клинической моделью боевой травмы. Следовательно, изучение патофизиологических особенностей политравмы на основе современных методических возможностей чрезвычайно актуально для военной медицины в современных условиях [Гуманенко Е.К., 2005; Сосюкин А.Е. и соавт, 2008].
С другой стороны, является закономерным развитие различных висцеральных осложнений у пострадавших с политравмой, а частота их по данным различных авторов составляет от 20 до 98%, при этом высокий удельный вес составляет острая функциональная недостаточность двух или более органов или систем органов [Цыбуляк Г.Н., 1992; Гембицкий Е.В. и соавт., 1994; Ушаков Б.Н., 1998, Moore F.A., 2002; Faist E. et al., 2006].
Своевременное выявление синдрома полиорганной недостаточности, представляющего высокую угрозу для жизни, позволяет решить проблему ранней диагностики и вероятностного прогноза развития висцеральных осложнений у пострадавших. На сегодняшний день очевидно, что эти осложнения при поздней диагностике отличаются более длительными сроками лечения, значительными экономическими затратами и, часто, летальными исходами. Все это диктует настоятельную необходимость поиска объективных критериев, которые могли бы позволить осуществлять раннюю диагностику висцеральных осложнений, и, следовательно, их целенаправленную профилактику и лечение [Lee C.C. et al., 2001; Гельфанд Б.Р. и соавт., 2003].
В настоящее время разработаны и применяются на практике методы оценки тяжести нарушений со стороны отдельных органов и систем, например, расчет респираторного индекса, ренального индекса, шкалы ком Глазго и др., а также способы интегральной оценки тяжести состояния больных, например, индексы (шкалы) TISS, СНОР, АРАСНЕ, ВПХ-СП, ВПХ-СГ, SAPS, SOFA, MODS [Knaus W., 1985, 1991; Le Gall J., Loirat P., 1984, 1993; Vincent J.L., Moreno R., 1996; Marshall J., 1995; Гуманенко Е.К., Бояринцев В.В., 1996]. Однако эти методы даже в своей совокупности не позволяют осуществлять раннюю диагностику и прогнозирование синдрома полиорганной недостаточности и висцеральных осложнений у пострадавших с тяжелой травмой. При этом современные представления о клинико-патофизиологических закономерностях течения травматической болезни явно недостаточны.
В частности, до настоящего времени остаются недостаточно изученными особенности системного воспалительного ответа при политравме, которые могут обеспечивать в большей или меньшей степени функциональную дезинтеграцию нервной, иммунной и эндокринной систем, а также сосудистого эндотелия посредством специфических рецепторов для цитокинов и регуляторных полипептидов, т.е. первичных и вторичных месенджеров [Воne R.C., 1996; Aller M.A. et al, 2004; Вологжанин Д.А., 2005; Немченко Н.С., 2006].
Также нуждаются в дальнейшем изучении особенности иммунных нарушений, развивающихся на фоне политравмы и представляющих собой особо тяжелую составную часть полиорганной недостаточности с депрессией иммунной системы, что, в свою очередь, может быть одной из основных причин летальных исходов среди большинства пострадавших [Gando S. et all, 2002; Гуманенко Е.К., Козлов В.К., 2008].
Дальнейший интерес представляет изучение роли эндотелия кровеносных сосудов в процессе регуляции деятельности нервной системы, сердечно-сосудистой и эндокринной систем, легких, почек, но при этом до конца не ясно участие эндотелия в системном воспалительном ответе и в развитии полиорганной недостаточности у пострадавших [Gebhard F. et al., 1988; Inagami T. et al., 1995; Keel M. at al., 2005; Лупинская З.А., 2003].
Таким образом, разработка новых методических способов ранней диагностики полиорганной недостаточности и висцеральных осложнений у пострадавших с политравмой на основе изучения клинико-патофизиологических закономерностей течения травматической болезни является актуальной проблемой современной военной и экстренной медицины.
Цель исследования
Изучить клинико-патофизиологические закономерности травматической болезни и обосновать принципы и критерии ранней диагностики синдрома полиорганной недостаточности и висцеральных осложнений у пострадавших с политравмой.
Задачи исследования
1. Проанализировать причины и уточнить частоту, виды и сроки возникновения висцеральных осложнений и синдрома полиорганной недостаточности у пострадавших с политравмой.
2. Исследовать патофизиологические особенности системного воспалительного ответа с оценкой его роли в развитии полиорганной недостаточности у пострадавших с политравмой.
3. Изучить патофизиологические взаимоотношения между иммунным статусом, профилем про- и противовоспалительных цитокинов и функциональным состоянием эндотелия кровеносных сосудов у пострадавших в динамике травматической болезни.
4. Определить наиболее информативные показатели, позволяющие оценить степень компенсации основных физиологических систем организма у пострадавших с политравмой, тип течения и исход травматической болезни.
5. Разработать систему ранней диагностики синдрома полиорганной недостаточности и висцеральных осложнений у пострадавших в посттравматическом периоде.
6. Апробировать и обосновать возможность практического применения разработанной шкалы с оценкой ее эффективности при определении вероятности и тяжести висцеральных осложнений и летальности.
Научная новизна исследования
В комплексном исследовании впервые установлено, что к механизмам развития висцеральных осложнений при травматической болезни следует относить травматический шок с формированием системного воспалительного ответа, неинфекционные висцеральные осложнения с развитием раннего синдрома полиорганной недостаточности и высокую вероятность инфекционных висцеральных осложнений с развитием позднего синдрома полиорганной недостаточности. Частота и тяжесть висцеральных осложнений определяются локализацией, объемом и множественностью повреждений, выраженностью и длительностью функциональной недостаточности органов и систем.
Впервые на основании изучения клинико-патофизиологических особенностей травматической болезни доказано, что развивающийся после травмы неспецифический системный воспалительный ответ является адаптационным защитным механизмом и направлен на восстановление поврежденного гомеостаза. Об этом свидетельствуют посттравматические изменения в состоянии цитокиновой системы и эндотелия кровеносных сосудов, которые прямо коррелируют с тяжестью политравмы и ее осложнений, включающих висцеральные инфекционные осложнения.
Доказано, что в первые двое суток после тяжелой политравмы развитие системного воспалительного ответа совпадает с выраженной морфо-функциональной депрессией иммунной системы, что в совокупности следует считать одним из ведущих механизмов формирования раннего синдрома полиорганной недостаточности. Впервые показано, что с третьих суток после травмы системный воспалительный ответ и иммунодепрессия могут стать еще более выраженными, способствуя резкому снижению общей резистентности организма, генерализации инфекции и формированию позднего синдрома полиорганной недостаточности.
Впервые установлено, что дисфункция эндотелия кровеносных сосудов является одним из ведущих факторов, способствующих прогрессированию системного воспалительного ответа при политравме. Так, при тяжелой травме изменяются свойства эндотелия, такие как способность к вазодилатации и вазоконстрикции, к синтезу антикоагулянтов и факторов коагуляции. В частности, угнетается синтез противосвертывающих факторов и факторов фибринолиза, возникают выраженные нарушения микроциркуляции и микрососудистые тромбозы, способствующие развитию полиорганной недостаточности у пострадавших.
Практическая ценность работы
Показано, что клиническая картина синдрома полиорганной недостаточности проявляется двумя вариантами: ранним (не бактериальным), возникающим в конце первых – начале вторых суток после травмы (период относительной стабилизации жизненно важных функций) и поздним (бактериальным), возникающим с третьих суток после травмы (период максимальной вероятности развития осложнений).
С практической точки зрения для диагностического процесса и наблюдения за пострадавшими с политравмой важно то, что развитие висцеральных осложнений происходит на фоне выраженной иммунодепрессии, эндотелиальной дисфункции и соответствует наиболее часто третьим-пятым и восьмым-десятым суткам травматической болезни. Из этого вытекает необходимость мониторинга состояния иммунной системы и функции эндотелия кровеносных сосудов, который существенно дополняет результаты традиционных клинико-лабораторных и инструментальных тестов, позволяет с большей вероятностью определять риск развития синдрома полиорганной недостаточности, улучшать его раннюю диагностику и контроль эффективности лечения, а также прогнозировать исход.
Впервые на основе комплексного изучения клинико-патофизиологических закономерностей травматической болезни предложена система ранней диагностики синдрома полиорганной недостаточности и висцеральных осложнений у пострадавших с политравмой в виде шкалы “ВПХВПТ-РД”. С ее помощью, возможно проведение объективного динамического и высокочувствительного мониторинга состояния пострадавших с тяжелой травмой в динамике травматической болезни. Кроме того, она позволяет в скрининговом режиме оценивать каждую систему органов, своевременно диагностировать недостаточность их функции в различные периоды травматической болезни и на этой основе оптимизировать лечебную тактику. При этом целесообразно обязательное участие в данном лечебно-диагностическом процессе на всех его этапах врача-терапевта.
Основные положения, выносимые на защиту
- У пострадавших с политравмой в течении и исходе травматической болезни важную роль играют висцеральные осложнения, характер и частота развития которых определяется локализацией, тяжестью повреждений и тяжестью состояния, сроками оказания и эффективностью медицинской помощи. Висцеральные неинфекционные осложнения наиболее часто выявляются на третьи сутки после травмы. Висцеральные и генерализованные инфекционные осложнения при политравме развиваются с высокой частотой на третьи-пятые и восьмые-десятые сутки травматической болезни соответственно, что является объективной основой для обозначения этого временного промежутка «периодом максимальной вероятности развития осложнений», т.е. третьим периодом травматической болезни.
- Системный воспалительный ответ является неспецифическим защитным механизмом, формирующимся при травме независимо от ее тяжести и локализации. Об этом свидетельствуют посттравматические изменения в состоянии цитокиновой системы и эндотелия кровеносных сосудов, которые прямо коррелируют с тяжестью политравмы и ее осложнений. При наиболее тяжелой травме системный воспалительный ответ становится чрезмерным и протекает на фоне выраженной морфо-функциональной недостаточности и общей депрессии иммунной системы, что приводит к возникновению синдрома полиорганной недостаточности и сепсиса.
- Дисфункция эндотелия кровеносных сосудов является одним из ведущих факторов, способствующих прогрессированию системного воспалительного ответа при политравме. При тяжелой травме изменяются свойства эндотелия, такие как способность к вазодилатации и вазоконстрикции, к синтезу антикоагулянтов и факторов коагуляции. В частности, угнетается синтез противосвертывающих факторов и факторов фибринолиза, возникают выраженные нарушения микроциркуляции и микрососудистые тромбозы, способствующие развитию полиорганной недостаточности у пострадавших.
- Мониторинг состояния иммунной системы и функции эндотелия кровеносных сосудов существенно дополняет результаты традиционных клинико-лабораторных и инструментальных тестов, позволяет с большей вероятностью определять риск развития синдрома полиорганной недостаточности, улучшать его раннюю диагностику и контроль эффективности лечения, а также прогнозировать исход.
- Разработанная патофизиологически обоснованная система прогнозирования “ВПХ-ВПТ-РД”, основанная на оценке состояния функций отдельных систем организма, является объективной, специфичной и чувствительной в интересах ранней диагностики синдрома полиорганной недостаточности и висцеральных осложнений у пострадавших с политравмой в динамике травматической болезни по сравнению с традиционными методами.
Терапия, проводимая с учетом результатов шкалы “ВПХ-ВПТ-РД”, позволяет уменьшить сроки нахождения на искусственной вентиляции легких, продолжительность лечения в отделении интенсивной терапии и частоту развития висцеральных осложнений в сопоставимых по тяжести травмы группах пострадавших.
Апробация и практическая реализация
По теме диссертации опубликована 51 печатная работа, в том числе раздел в монографии, учебное пособие и 13 статей в рецензируемых научных журналах, рекомендованных ВАК.
Результаты исследования были обсуждены на Всероссийских научных конференциях «Актуальные проблемы современной тяжелой травмы» (СПб, 2001), «Кардиология – XXI век» (СПб, 2001), научно-практических конференциях «Актуальные вопросы диагностики и лечения в многопрофильном лечебном учреждении» (СПб, 2001), «Политравма: диагностика, лечение и профилактика осложнений» (г. Ленинск-Кузнецкий, 2007), «Новые технологии в медицине» (г. Ленинск-Кузнецкий, 2008), Всеармейских научно-практических конференциях «Медицинские последствия экстремальных воздействий на организм» (СПб, 2000), «Особенности оказания медицинской помощи и лечения раненых и больных с боевой хирургической и терапевтической травмой в локальных войнах и вооруженных конфликтах» (СПб, 2000), «Терапевтическая помощь в экстремальных ситуациях» (СПб, 2003), «Актуальные проблемы организации медицинского обеспечения войск и населения при чрезвычайных ситуациях мирного и военного времени» (СПб, 2006), международной конференции, посвященной 75-летию со дня рождения А.М. Уголева «Механизмы функционирования висцеральных систем» (СПб, 2001), международном российско-германском научно-практическом симпозиуме «Хирургия повреждений мирного и военного времени» (М, 2001), V научной конференции, посвященной 60-летию Победы в ВОВ 1941-1945 гг. (СПб, 2003), 36-ом Всемирном конгрессе по военной медицине (СПб, 2005), Российской научно-практической конференции с международным участием «Современные проблемы военной и экстремальной терапии» (СПб, 2005), международной конференции «Новые технологии в военно-полевой хирургии и хирургии повреждений мирного времени» (СПб, 2006); научно-практической конференции Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова (СПб, 2007); IV Всероссийской конференции «Клиническая гемостазиология и гемореология в сердечно-сосудистой хирургии» (М, 2009); съезде терапевтов юга России «Врач ХХI века: сегодня и завтра» (Ростов-на-Дону, 2009).
Исследование выполнялось в соответствии с плановой тематикой научно-исследовательских работ Военно-медицинской академии (тема № VMA 03.05.01. 0508/280).
Рекомендации, разработанные на основании полученных в ходе диссертационного исследования результатов, используются в научной работе, учебном процессе и лечебно-диагностической практике на кафедрах военно-полевой терапии, военно-полевой хирургии и патологической физиологии Военно-медицинской академии им. С.М. Кирова, 442 Окружном военном клиническом госпитале им. З.П. Соловьева.
Результаты диссертационного исследования использовались при подготовке учебного пособия «Висцеральная патология у раненых в локальном вооруженном конфликте», изданного в 2005 году, «Практикума по военно-полевой терапии», изданного в 2006 году.
Объем и структура диссертации
Диссертация изложена на 363 страницах машинописного текста и состоит из введения, обзора литературы, описания материалов и методов исследования, 6 глав результатов собственных исследований, выводов, практических рекомендаций, списка литературы и приложений. В диссертации приведены 77 таблиц и 41 рисунок. Список литературы содержит 431 библиографический источник, в том числе 205 отечественных и 226 иностранных публикации.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Осуществлено обследование 711 пострадавших, находившихся на лечении в клинике военно-полевой хирургии Военно-медицинской академии им. С.М.Кирова с 1998 по 2009 гг.
Все пострадавшие были разделены на три группы:
1. 444 пострадавших с тяжелой травмой (группа 1) – для анализа причин, уточнения частоты, видов и сроков возникновения висцеральных осложнений, определения наиболее информативных показателей, позволяющих оценить степень компенсации основных физиологических систем организма у пострадавших, тип течения и исход травматической болезни (ТБ), а также разработки метода ранней диагностики сидрома полиорганной недостаточности (СПОН) и висцеральных осложнений.
2. 87 пострадавших с тяжелой травмой (группа 2) – для оценки патофизиологических закономерностей формирования системного воспалительного ответа, изучения состояние иммунного статуса и функции эндотелия кровеносных сосудов.
3. 180 пострадавших (группа 3) – для апробации разработанной системы и проведения клинико-патофизиологического описания проявлений ТБ, основанных на интегральных показателях шкалы “ВПХ-ВПТ–РД”.
Обследование проводили в динамике ТБ в соответствии с классификацией Е.К. Гуманенко (1992): в период острых нарушений (1 сутки), в период относительной стабилизации (2 сутки), в период максимальной опасности инфекционных (5-7 сутки) и гнойно-септических (10 сутки) осложнений, в период полной стабилизации (11-25 сутки после травмы).
Характеристика пострадавших 1 группы. Среди пострадавших преобладали лица мужского пола – 347 (78,2%) человек, средний возраст – 38±7 лет. Основными причинами сочетанных травм были автопроисшествия (43,0%), рельсовая травма (14,6%) и падения с высоты (5,9%). В 82,2% случаев пациенты доставлялись в клинику в течение первых 1,5 часов после получения травмы, среднее время транспортировки – 1,1±0,1 часа. В 91,2% случаев имела место множественная и сочетанная травма, причем последняя – в 65,3%. При сочетанных травмах повреждение 2 областей имелось у 105 (36,2%) пострадавших, 3 областей – у 98 (33,8%), 4 областей – у 53 (18,3%), 5-6 областей – у 34 (11,7%). Тяжесть повреждения по шкале “ВПХ-П” – 10,9+0,9 баллов, тяжесть состояния на момент поступления (по шкале “ВПХ-СП”) – 28,7+1,4 баллов. Доминирующим повреждением были травмы головы (24,3%), груди (20,5%), живота (16,9%), а в 21,4% случаев тяжесть травмы была обусловлена сочетанием ведущих повреждений. Тяжелые травмы позвоночника имели место в 9,7%, таза – 5,2% и конечностей – 2,0%.
Характеристика пострадавших 2 группы. Большинство пострадавших были мужчины (86,2%) трудоспособного возраста (34±7 лет). Основными причинами сочетанных травм были автопроисшествия (70,1%), рельсовая травма (10,4%). Наиболее часто характер травмы был сочетанным (97,7%). Тяжесть повреждения по шкале “ВПХ-П” составила 10,6+0,9 баллов, тяжесть состояния на момент поступления (шкала “ВПХ-СП”) – 25,1+1,6 баллов. Доминирующими повреждениями были травмы головы (31,0%), груди (28,7,5%), живота (17,3%), в 10,4% случаев тяжесть травмы была обусловлена сочетанием ведущих повреждений. Тяжелые травмы позвоночника имели место в 5,7%, таза – 4,6% и конечностей – 2,3%.
Характеристика пострадавших 3 группы. В группу вошли мужчины трудоспособного возраста с тяжелыми и крайне тяжелыми травмами и ведущими по тяжести повреждениями травмами головы, груди. Основными причинами травм были автопроисшествия (60,0%), рельсовая травма (9,4%). Средняя тяжесть повреждения по шкале “ВПХ-П” составила 14,8±0,85 баллов, тяжесть состояния по шкале “ВПХ-СП” – 32,1±0,85 баллов. Летальность составила 42,7% (n = 77), что было обусловлено большей долей пострадавших с тяжелыми и крайне тяжелыми повреждениями. Травматический шок диагностирован у 117 (65,4%), причём в 11,4% случаев он сочетался с острой дыхательной недостаточностью. Травматическая кома определена у 43 (23,8%) пострадавших с тяжелой сочетанной травмой головы. Терминальное состояние и острая сердечно-сосудистая недостаточность развилась в 6,6% (n = 12) и 4,4 % (n = 8) случаев соответственно. Острая дыхательная недостаточность диагностирована у 33 (18,3%) пострадавших с тяжелыми повреждениями головы или груди в сочетании с травматическим шоком и травматической комой.
Степень тяжести травматического шока определяля по уровню АД и ЧСС, зафиксированных на месте травмы, а величину кровопотери ориентировочно по удельному весу крови сразу после доставки пациента в клинику. Систему крови оценивали по содержанию гемоглобина, эритроцитов, лейкоцитов, лейкоцитарной формуле.
Комплексное обследование включало лабораторные исследования (общеклинические, биохимические, газовый состав крови), электрофизиологические (мониторирование дыхания и гемодинамики, электрокардиографию, интегральную реографию тела, эхокардиографию, эхоэцефалографию, рентгенографию), а также оценку показателей клеточного и гуморального иммунитета, неспецифической резистентности и функции эндотелия кровеносных сосудов.
Лабораторные тесты. Газообмен оценивали по частоте дыхания, напряжению кислорода и углекислого газа в артериальной крови, индексу оксигенации, содержанию оксигемоглобина в артериальной крови, характеру дыхания. Насыщение артериальной крови кислородом оценивали спектрофотометрическим методом с помощью мониторов «Sirecust-732» («Siеmens», Германия). Содержание СО2 в конечной порции выдыхаемого воздуха определяли методом капнометрии газоанализатором «Elisa» («Gambro», Швеция). Газовый состав крови, респираторный индекс (РИ), индекс оксигенации крови (PaO2/FiO2), альвеолярно-артериальный градиент кислорода, внутрилегочный шунт, р50, КОС, уровень лактата крови определяли на газовом анализаторе «Synthesis 45» («Instrumentation Laboratory, США). Индекс экстракции кислорода, адекватность доставки кислорода рассчитывали по формулам M.J. Souter, P. Andrews (1996). Респираторный индекс (РИ) определялся по методу М.А. Goldfarb (1975). Индекс оксигенации крови (PaO2/FiO2) вычисляли как отношение парциального напряжения кислорода в артериальной крови к фракционной концентрации кислорода в дыхательной смеси. Молекулы средней массы (МСМ) и индекс интоксикации (ИИ) определяли методом С.В. Оболенского и М.Я. Малаховой (1993).
Содержание в крови глюкозы, холестерина, триглицеридов, общего белка, альбумина, глобулина, креатинина, мочевины, общего билирубина, АлТ, АсТ, гамма-ГТП и электролитов (калия, магния, кальция, хлора) оценивали на биохимическом анализаторе СМА 12/60 фирмы «Tehnicon» (США). Оценку системы гемостаза проводили при помощи тестовых наборов фирм «Diagnostica stago», «Roche», НПО «Ренам», «Технология стандарт».
Общую оксидантную и антиоксидантную активность крови определяли хемилюминисцентным методом. Определение индуцированной биохемилюминисценции в плазме крови проводили c помощью биохемилюминометра «БХЛ-06» (Россия).
Содержание в крови эндотелина, сосудистых молекул клеточной адгезии (sVCAM-1), монооксида азота (NO), фактора Виллебранда (vWF), фибринолитического комплекса тканевого активатора плазминогена и его ингибитора (tPA-PAI-1), цитокинов – ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10; ФНО, ИНФ, С-реактивного белка (СРБ) методом твердофазного ИФА (Elx 800, «Bio–tek instruments», США) с использованием наборов фирмы «Bender MedSystems» (Германия), тест-систем «ГосНИИ особо чистых биопрепаратов» (Санкт-Петербург) и «Протеиновый контур» (Санкт-Петербург),индуцированной и спонтанной активности ФНО – методом люминолзависимой хемилюминесценции. Определение цитокинов как в сыворотке, так и в супернатантах крови проводили после стимуляции (для оценки спонтанной и индуцированной продукции). Содержание в крови нитратов определяли спектрофотометрическим методом. Функциональную активность иммунной системы также оценивали по количеству лимфоцитов, экспрессировавших на своей поверхности HLA-DR+, CD3+, CD4+, CD8+, CD16+, CD19+, CD25+, CD95+, CD19+ HLAII+, моноцитов, экспрессирующих CD14+, CD14+ HLAII+, определявшихся на проточном цитометре Cytomics FC500 фирмы «Beckman Coulter» (США) с использованием различных комбинаций прямых моноклональных антител и изотипических контролей «Beckman Coulter». Эффекторные свойства нейтрофилов оценивались по спонтанной и индуцированной форболмиристатацетатом адгезивной способности [Кетлинский С.А., Калинина Н.М., 1998]. Способность нейтрофилов к завершенному фагоцитозу изучали в тесте с дрожжами, определяя число поглощающих дрожжи клеток и фагоцитарный индекс [Root R.K., 1975].
Электрофизиологические и инструментальные методы. Центральную нервную систему оценивали по шкале ком Глазго и результатам ЭЭГ с помощью программно-аппаратного комплекса «МИЦАР-ЭЭГ» (СПб). Алгоритм ЭКГ-обследования включал проведение ЭКГ в 12 стандартных отведениях, а также по Небу и по Слапаку. Состояние гемодинамики оценивали при помощи интегральной реографии тела (ИРГТ) по методике М.И. Тищенко и эхокардиографии (ЭхоКГ). Регистрацию показателей ИРГТ проводили на адаптированном для этой цели программно-аппаратном комплексе «МИЦАР-Рео» (СПб). ЭхоКГ проводили при помощи аппаратов “Sim 5000” и “Acuson 128XP” в М-режиме, В-режиме и D (допплеровском) режиме.
Статистические методы исследования. Полученные данные заносили в карты для статистической обработки. Анализ информации осуществлялся на персональном компьютере типа Pentium-V. В исследовании применен метод моделирования СПОН при тяжелых травмах, основанный на принципах системного подхода и предусматривающий совместное использование одномерных и многомерных статистических методик. В соответствии с решаемыми задачами использованы программы STATISTICA 6.0 for WINDOWS и пакет прикладных программ BMDP. Осуществляли оценку математического ожидания, дисперсии, медианы, моды, асимметрии, эксцесса, графическое представление распределений (модуль Basic Statistics and Tables, программа 2D), дисперсионный анализ (модуль ANOVA/MANOVA STATISTICA 6.0, программа 7D), корреляционный анализ (модуль Basic Statistics and Tables, программа 8D), анализ таблиц сопряженности (программа 4F), пошаговый регрессионный анализ (программа 2R, модуль Log-Linear Analysis of Frequency Tables– «Логлинейный анализ в таблицах частот»), надежность и позиционный анализ (модуль Reliability and Item Analysis), дискриминантный анализ (модуль Discriminant Analysis).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
ЧАСТОТА, СРОКИ РАЗВИТИЯ И ВИДЫ ВИСЦЕРАЛЬНОЙ ПАТОЛОГИИ У ПОСТРАДАВШИХ С ТРАВМАТИЧЕСКОЙ БОЛЕЗНЬЮ. Висцеральная патология при политравмах была выявлена у 92,8% пострадавших (n = 444) и зависела от тяжести повреждений, тяжести состояния при поступлении в клинику, тяжести травматического шока и величины кровопотери, а также от локализации доминирующего повреждения. Максимально часто висцеральные осложнения развивались при тяжелой сочетанной травме (ТСТ) груди и живота – 93,4% и 90,7% случаев соответственно, реже - при ТСТ головы (59,3%), таза (56,5%), позвоночника (51,2%) и конечностей (44,4%).
В первые сутки после травмы у пострадавших выявлялись первично-травматические повреждения внутренних органов (ушибы сердца, легких, почек) и анемия. В динамике ТБ, начиная со вторых по пятые сутки, у пострадавших развивались преимущественно висцеральные неинфекционные осложнения (миокардиодистрофия, нефропатия). Максимальная частота развития данных осложнений приходилась на третьи сутки лечения пострадавших с тяжелой травмой с постепенным снижением частоты их возникновения к девятым суткам. Висцеральные инфекционные осложнения (пневмония, миокардит, пиелонефрит) и сепсис диагностированы с максимальной вероятностью развития на третьи-пятые и восьмые-десятые сутки лечения (рис.1).
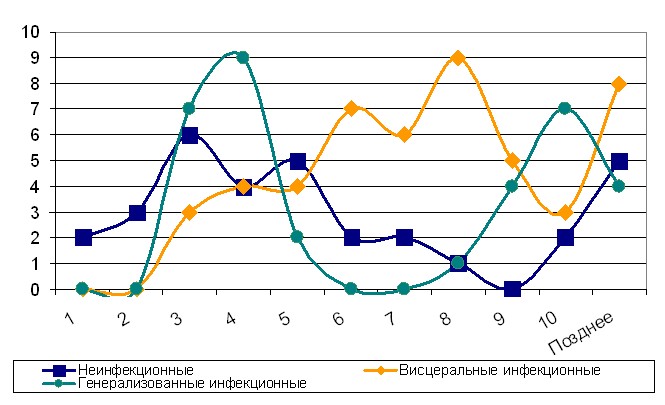
Рис. 1. Динамика развития осложнений по периодам травматической болезни
Структура висцеральной патологии по системам и органам в зависимости от локализации доминирующего повреждения представлена в таблице 1. Наиболее частой формой висцеральной патологии у пострадавших была постгеморрагическая анемия в 86,3% случаев, которую наблюдали чаще при ТСТ груди. На втором месте находилась патология органов дыхания (50,2%), на третьем – сердечно-сосудистой системы (48,4%), а затем –мочевыделительной и пищеварительной систем – у 39,4% и 28,6% соответственно.
Таблица 1
Частота висцеральной патологии по системам и органам в зависимости от локализации доминирующего повреждения (% к общему числу пострадавших данной локализации)
| Локализация доминирующего повреждения | Патология систем и органов | ||||
| Сердеч но-сосу дистая | Дыхательная | Пищеварительная | Мочевыделительная | Система крови | |
| Голова (n = 108) | 59,3 | 56,5 | 19,4 | 29,6 | 76,9 |
| Грудь (n = 91) | 68,1 | 89,0 | 25,3 | 29,7 | 90,1 |
| Живот (n = 75) | 52,0 | 64,0 | 56,7 | 62,0 | 89,3 |
| Таз (n = 23) | 39,1 | 34,8 | 43,5 | 39,1 | 87,0 |
| Позвоночник (n = 43) | 34,9 | 37,2 | 18,6 | 55,8 | 83,7 |
| Конечности (n = 9) | 33,3 | 11,1 | 11,1 | 22,2 | 88,8 |
| Сочетание (n = 93) | 51,6 | 59,1 | 24,7 | 37,6 | 88,2 |
| Всего (n = 444) | 48,4 | 50,2 | 28,6 | 39,4 | 86,3 |
Патология сердечно-сосудистой системы была выявлена у 215 из 444 пострадавших (48,4%). Наиболее часто была диагностирована посттравматическая миокардиодистрофия (ПТМКД) у 206 пострадавших (46,4%), особенно при ТСТ головы (58,3% случаев), груди (53,8%), живота (50,7%). Реже миокардиодистрофия развивалась при ТСТ таза (43,4%), позвоночника (39,5%), конечностей (33,3%).
Жалобы были малоинформативными вследствие нарушения сознания у большинства пострадавших. В части случаев имелись жалобы на чувство тяжести в области сердца (10,7%), одышки (30,6%) и сердцебиение (28,2%). При объективном исследовании наиболее часто наблюдали тахикардию (около 100 ударов в минуту) у 93,7% пострадавших. Нарушения сердечного ритма отмечены лишь в 9,2%. Границы сердца оставались в пределах нормы в 86,4% случаев. При аускультации в 50% случаев над верхушкой сердца первый тон был ослаблен и выслушивался короткий систолический шум. В 40,3% случаев ПТМКД систолическое АД было снижено (87,5±2,3 мм рт. ст.). Наиболее постоянно дистрофия миокарда сочеталась с постгеморрагической анемией (89,3% случаев).
Решающее значение в диагностике ПТМКД имела электрокардиография. При ЭКГ исследовании в абсолютном большинстве случаев (87,4%) были зарегистрированы нарушения процессов реполяризации миокарда диффузного характера с постепенной нормализацией в последующие 2-3 недели, синусовая тахикардия и экстрасистолия, начиная с третьих суток после травмы и до 10-14 дней. Дополнительными диагностическими критериями являлись повышение активности фракции МВ креатинкиназы более 5% от общей активности фермента с третьих суток после травмы, дилатация левого желудочка при ЭхоКГ через одну неделю после травмы. Начиная с третьих суток после травмы, при формировании у пострадавших с политравмами начальных проявлений недостаточности кровообращения ЭхоКГ позволила выявить снижение ударного и минутного объема сердца и фракции выброса (ФВ) на 10-20%.
Сроки развития ПТМКД колебались от одних до семнадцати суток от момента травмы (в среднем 3,3+0,5 дней), а длительность – от пятнадцати до шестидесяти суток (в среднем 27,7±1,5 дня). Важно, что миокардиодистрофия на секции была выявлена в 97 случаях (50,5%), но ни в одном случае она не была непосредственной причиной летального исхода.
Ушиб сердца был диагностирован у 78 из 444 пострадавших (17,6%), в том числе в 51 случае ТСТ груди (56,0%), в 6 случаях ТСТ верхних отделов живота (8,0%) и в 21 случае при сочетании ведущих повреждений (22,6%). У трех пострадавших с ТСТ груди и ушибом сердца (5,9%) было диагностировано повреждение межжелудочковой перегородки.
Характерной особенностью ушиба сердца являлось крайне тяжелое состояние пострадавшего, внешне не соответствующее степени поражения органов груди, живота, головы. Основными клиническими признаками ушиба сердца были постоянная тупая боль или чувство тяжести в прекардиальной области, сердцебиение и ощущение перебоев, одышка и нарастающая общая слабость в первые сутки после травмы.
При объективном исследовании регистрировалась тахикардия (123,0±2,5 ударов в минуту), расширение границ сердца, ослабление первого тона, систолический шум над верхушкой сердца в половине случаев ушиба сердца в первые сутки после травмы. Аритмия сердца клинически была отмечена у 19 пострадавших (24,4%). В 10% случаев аускультативно определяли шум трения перикарда, акцент II тона над легочной артерией, ритм галопа. Систолическое АД ниже 100 мм рт. ст. было зарегистрировано в 35 случаях (44,9%).
Решающую роль в диагностике ушиба сердца имело исследование ЭКГ. При этом на фоне синусовой тахикардии (с нарушениями ритма по типу частой желудочковой экстрасистолии и пароксизмальной мерцательной аритмии и проводимости по типу блокады ножек пучка Гиса, атриовентрикулярной блокады) регистрировали элевацию сегмента ST более 4 мм в первые сутки после травмы с последующим формированием отрицательного зубца Т до 2-3 недель. В большинстве случаев ушиба сердца имели место инфарктоподобные изменения на ЭКГ, но без патологического зубца Q. Отсутствовал также эффект от приема нитроглицерина и аналгетиков.
Дополнительным диагностическим критерием являлось повышение более 7% соотношения фракции МВ-креатинкиназы к общей активности фермента на второй день после травмы. О поражении сердечной мышцы при проведении ЭхоКГ свидетельствовало наличие локальных зон гипо- или акинезии миокарда, нарушение деятельности аортального и митрального клапана за счет повреждения хордальных нитей, дисфункции папиллярных мышц, митральная и (или) трикуспидальная регургитация, дилатация левого желудочка, снижение ФВ на 30-40%. При проведение ИРГТ и ЭхоКГ выявлено снижение ударного и минутного объема сердца (УО и МОС) на 25-40%. Длительность течения ушиба сердца была от 7 до 30 суток (в среднем 21,2±3,0 дня).
Миокардит был диагностирован у 41 из 444 пострадавших (9,2%), в том числе в 19 случаях ТСТ груди (20,9%), в 13 случаях ТСТ живота (17,3%) и в 9 случаях ТСТ головы (8,3%) с восьмых-десятых суток после травмы. Миокардит проявлялся тахикардией, ослаблением тонов сердца, систолическим шумом над верхушкой сердца, маятникообразным ритмом, замедлением атриовентрикулярной проводимости, снижением вольтажа зубцов комплекса QRS, нарушениями процессов реполяризации диффузного характера. Течение было длительным, а в 32 случаях имел место летальный исход. В двадцати четырех случаях диагностирована пневмония, в восьми – острая язва двенадцатиперстной кишки, осложненная кровотечением, что явилось причиной летального исхода.
Перикардит был диагностирован в 9 случаях тяжелой сочетанной травмы груди (9,9%), причем в 7 случаях - на восьмые сутки после тяжелой сочетанной травмы груди с повреждением легкого и переходом воспалительного процесса на перикард с появлением выпота в его полости. Тампонада сердца возникла в трех из девяти случаев посттравматического перикардита. При этом были отмечены тупые боли в области сердца, одышка, набухание шейных вен, субфебрильная температура, тахикардия, артериальная гипотензия, расширение границ сердечной тупости, глухость тонов, шум трения перикарда, постепенно исчезнувший при накоплении выпота в перикардиальном пространстве. При ЭКГ была выявлена элевация сегмента ST в стандартных и большинстве грудных отведениях, снижение вольтажа зубцов комплекса QRS. Рентгенологически определялось расширение тени сердца со сглаженными контурами, снижение амплитуды пульсации. Решающее значение для диагностики имело ультразвуковое исследование (УЗИ) сердца, при котором было отмечено утолщение перикарда, наличие “эхонегативного” пространства между поверхностью камер сердца и перикардом (наличие жидкости), снижение диастолического наполнения правого желудочка, снижение величины УО сердца, ФВ на 10-20%.
Патология органов дыхания при тяжелой травме была выявлена у 223 из 444 пострадавших (50,2%). Острый респираторный дистресс-синдром (ОРДС) был выявлен у 47 из 444 пострадавших (10,6%), в том числе у 10 - с ТСТ головы (9,3%), у 25 - ТСТ груди (27,6%), у 11 - ТСТ живота с повреждением полых и паренхиматозных органов (14,7%), у 1 - ТСТ конечностей с переломами длинных трубчатых костей и повреждением магистральных сосудов с большой кровопотерей и шоком. Диагноз ОРДС ставили при индексе оксигенации PaO2/FiO2 менее 200.
Было выявлено два клинических варианта течения ОРДС: ранний и поздний – у 26 и 21 из 47 пострадавших (55,3% и 44,7% соответственно). Ранний вариант имел место в 14 случаях ТСТ груди (15,4%), в 7 случаях ТСТ живота (9,3%), в 3 и 2 случаях (2,8% и 22,2%) ТСТ головы и конечностей. Клинические признаки раннего ОРДС развивались в первые-третьи сутки после травмы на фоне выраженного шока и гиповолемии. При этом наряду с тяжелыми нарушениями гемодинамики (артериальная гипотония и коллапс, тахикардия) нарастала острая дыхательная недостаточность (цианоз, тахипное), артериальная гипоксемия (SaО2 60±1,2%) при нормальном содержании углекислоты в артериальной крови (PaCО2 41,1±0,7%), но на фоне декомпенсированного метаболического ацидоза (BE – 5,6±0,1 ммоль/л, pH – 7,2±0,001). Рентгенологически при ранних вариантах ОРДС в 21 случае (80,8%) наблюдали резкое усиление сосудистого рисунка легких (интерстициальная фаза) и лишь в 5 случаях (19,2%) – начальные признаки альвеолярного отека.
Более тяжелый поздний вариант ОРДС имел место в 4 случаях на 8-10 день после ТСТ головы (3,7%) на фоне менингоэнцефалита и двухсторонней очаговой сливной пневмонии, а также в 7 случаях ТСТ живота (9,3%), осложненной гнойным перитонитом, с тяжелой интоксикацией, гектической лихорадкой и двусторонней пневмонией. В 10 случаях - на фоне ТСТ груди с повреждением легких (11,0%), осложненным двухсторонней сливной пневмонией с абсцедированием. На фоне прогрессирующей интоксикации и пневмонии развивалась дыхательная недостаточность, сопровождавшаяся развитием альвеолярного отека легких. Все эти случаи, несмотря на адекватную антибактериальную, дезинтоксикационную и симптоматическую терапию закончились летально. При секционном исследовании наряду с тяжелыми местными гнойно-септическими осложнениями травмы была обнаружена двусторонняя сливная пневмония, а в 5 случаях – множественные мелкоочаговые абсцессы и выраженный отек легких. Кроме этого была выявлена дистрофия внутренних органов (сердце и почки).
При оценке функции внешнего дыхания (ФВД) более чем у 90% пострадавших с ОРДС было выявлено снижение жизненной емкости легких (ЖЕЛ) до 30% от должных величин. При фибробронхоскопии были выявлены поверхностные и подслизистые геморрагии в долевых и сегментарных бронхах, подслизистый отек с сужением устьев бронхов 3-4 порядка, снижение их подвижности, сгустки крови в просвете мелких бронхов с частичной или полной обтурацией. При бронхоальвеолярном лаваже в смыве преобладали нейтрофилы (что было типично для последующей пневмонии), либо лимфоциты, что прогностически было более благоприятно.
Пневмония и гнойный трахеобронхит были выявлены у 171 и 32 из 444 пострадавших (38,5% и 7,2% соответственно). Наиболее часто пневмония развивалась при ТСТ груди (58,2%), а с пульмонитом – 83,5% случаев), при ТСТ живота и таза – в 53,3% и 47,8% случаев соответственно. Реже пневмония развивалась при ТСТ головы (25,9%), позвоночника (25,6%) и конечностей (22,2%). Пневмония была диагностирована в первые трое суток после травмы в 13% случаев, на 3-5 сутки – 31%, на 8-10 сутки – 47%, в более поздние сроки – 9% всех случаев пневмонии. Таким образом, пневмония у пострадавших в 78% случаях возникала с третьих по десятые сутки после травмы. В 93% случаев пневмония была диагностирована у пострадавших с травматическим шоком.
Физикальные данные при пневмонии: кашель выявлялся в 71% случаев, в 15% он был сухим, в 49% - с трудно отделяемой слизистой или слизисто-гнойной мокротой, и только в 7% - с обильной гнойной мокротой. Локальное укорочение перкуторного звука было отмечено в 53% случаев. При аускультации выявлялось ослабленное дыхание (51%), реже жесткое – 43% и только в 6% – бронхиальное. Сухие хрипы выслушивали в 29%, влажные разнокалиберные – в 71% случаев. В 95% случаев были отмечены тахипноэ и тахикардия и во всех случаях - лихорадка. Субфебрильную температуру наблюдали в 23% случаев, фебрильную – в 42% и выше 39оС – у 35%. Средняя продолжительность лихорадки у выздоровевших пострадавших составила 12,5±0,2дня.
При рентгенологическом исследовании легких патологический процесс справа был выявлен в 43%, слева – у 26% и с обеих сторон – в 31%. Мелкоочаговая инфильтрация была зарегистрирована в 51%, крупноочаговая – в 30% и сливная – в 19% случаев пневмонии.
В общем анализе крови у пострадавших с пневмонией был отмечен лейкоцитоз со сдвигом формулы влево, относительная лимфопения, высокая СОЭ. Данные красной крови свидетельствовали о наличии умеренной анемии. После клинического выздоровления сохранялось увеличение СОЭ. При бактериологическом исследовании мокроты наиболее часто были выявлены ассоциации микробов: гемолитический стрептококк со стафилококком, пневмококком, катаральным микрококком, грам-отрицательной флорой (кишечная, синегнойная палочка).
При исследовании ФВД у пострадавших с пневмонией выявлено снижение ЖЕЛ до 63,1+1,2% от должной (в 15% случаев до 20% от должных величин) и снижение скоростных параметров выдоха на всех участках бронхиального дерева до 34+1,1% от должных значений, т.е. наблюдался смешанный, обструктивно-рестриктивный характер функциональных нарушений. Следует отметить, что нормализация ЖЕЛ и рентгенологической картины отставала от клинического выздоровления. Эндобронхит при пневмонии был подтвержден эндоскопически в 55,6% случаев.
Средняя длительность пневмонии с ее разрешением составила 23,9±0,8 дней. В 42 случаях травм с летальным исходом на вскрытии была обнаружена пневмония, причем в 37 случаях она была диагностирована прижизненно. При этом в 11 случаях ТСТ головы с повреждением головного мозга и глубокой комой в течение 2-2,5 недель и в 4 случаях ТСТ груди с повреждением спинного мозга пневмония была основной причиной летальных исходов.
Пульмонит был выявлен в 23 из 444 случаев (5,2%) при ТСТ груди. Наиболее частым симптомом пульмонита наряду с болью в груди было тахипноэ. У 30,4% пострадавших отмечался кашель и кровохарканье, в большинстве случаев продолжавшееся в течение 3-4-х суток, в 7 случаях кровохарканье отмечалось в течение 5-7 дней. При перкуссии грудной клетки было отмечено укорочение перкуторного звука в 43,7% случаев пульмонита. При аускультации в большинстве случаев имели место ослабление везикулярного дыхания и мелкопузырчатых влажные хрипы над пораженным участком легкого.
В 52,1% случаев имела место субфебрильная лихорадка, продолжавшаяся в среднем 6,5 суток, а в 34,8% случаев температура тела достигала 38,1-39,0° С и сохранялась в течение 5-6 суток. И только в 13,1% случаях пульмонита лихорадка превышала 39,0° С в течение 6-7 суток с постепенной нормализацией к второй неделе. У большинства больных имела место тахикардия в течение 7-9 суток.
Рентгенологически в абсолютном большинстве случаев пульмонита (78,3%) было выявлено наличие гомогенного, интенсивного затенения легочной ткани, нередко овальной формы, с нечеткими контурами. Эти изменения возникали сразу после травмы и имели тенденцию к распространению в течение первых суток с медленной положительной динамикой в течение 2-3-х недель. Только в 3 случаях были отмечены участки просветления, соответствовавшие ходу травматического канала. При исследовании крови был отмечен нейтрофильный лейкоцитоз со сдвигом формулы влево, относительная лимфоцитопения и ускорение СОЭ. Нормализация анализа крови, особенно СОЭ, происходила медленно в течение 3-4-х недель. Длительность течения пульмонита составила в среднем 19,3+1,2 дня. В половине случаев пульмонит сопровождался реактивным плевритом.
Тромбоэмболия ветвей легочной артерии (ТЭЛА) была выявлена у 7 из 444 пострадавших (1,6%) и развивалась на 3-5 сутки после травмы у пострадавших с ТСТ конечностей (5 случаев) и таза (2 случая). В клинической картине преобладали жалобы на выраженную одышку, давящие загрудинные боли, кровохарканье. При физикальном исследовании - бледность с цианозом лица и верхней части туловища, набухание шейных вен, тахипноэ, тахикардия, аритмия, артериальная гипотензия и коллапс, расширение границ сердца вправо, акцент II тона над легочной артерией, незвучные влажные хрипы. При исследовании крови - внезапное нарастание артериальной гипоксемии в сочетании с подъемом уровня протромбина, фибриногена и Д-димера. На ЭКГ были выявлены признаки перегрузки правых отделов сердца, признаки ишемии миокарда в правых грудных отведениях. Решающее значение в диагностике ТЭЛА имела рентгенография, а по показаниям - компьютерная томография с сосудистым усилением. При рентгенологическом исследовании были выявлены обеднение сосудистого рисунка в зоне эмболии ветви легочной артерии, расширение и деформация легочного корня на пораженной стороне, уплотнение легочной ткани за счет скопления крови в альвеолах.
Эмпиема плевры была выявлена только у 3 пострадавших (0,7%), причем в 2 случаях она развилась на фоне ТСТ груди, осложненной развитием пульмонита и двухсторонней сливной абсцедирующей пневмонии и в 1 случае - ТСТ живота, осложненной развитием перитонита и поддиафрагмального абсцесса в брюшной полости.
Патология пищеварительной системы была выявлена у 127 из 444 пострадавших (28,6%), при этом наиболее часто при ТСТ живота (56,7%) и таза (43,5%), при других локализациях доминирующего повреждения реже – от 11 до 25%. Следует указать, что диспепсические расстройства до травмы отмечались в анамнезе только у 35 из 127 пострадавших с посттравматической патологией ЖКТ (27,6%).
Патология пищеварительной системы при ТСТ живота была наиболее выраженной и включала проявления функциональной диспепсии (25,3%), острые язвы желудка и двенадцатиперстной кишки (21,3%) и эрозивный гастрит (16,0%). Нередко наблюдали обострение хронического гастродуоденита и язвенной болезни (17,3%). При ТСТ головы наиболее часто были диагностированы эрозивный гастрит (16,7%), острые язвы желудка или двенадцатиперстной кишки (13,9%) и обострение хронического гастродуоденита (11,1%). При ТСТ позвоночника чаще были обнаружены острый гастродуоденит (16,3%) и обострение хронического гастродуоденита и язвенной болезни (14,0%). Функциональную диспепсию чаще наблюдали при травмах живота (25,3%), груди (16,5%), реже – при травмах конечностей (11,1%).
Клинические проявления характеризовались диспептическим синдромом (изжога, реже отрыжка и рвота) и болями в эпигастрии, чаще натощак (одной трети пострадавших с посттравматической патологией ЖКТ). В большинстве случаев эти синдромы возникли с восьмых-десятых суток после травмы, в связи с этим выполняли эзофагогастродуоденоскопию, в результате которой были диагностированы поверхностный гастрит у 14 из 127 пострадавших (11,0%), гастродуоденит (49 случаев, 38,6%) и эрозивный гастродуоденит (30 случаев, 23,6%).
Острые гастродуоденальные язвы были диагностированы в 35 из 127 случаев (27,6%) с поражением ЖКТ, в том числе в 14 случаях (11,0%) только на секции. Следует отметить, что данная патология чаще возникала при ТСТ живота (21,3%) на фоне развившегося перитонита и при ТСТ головы (13,9%), сопровождавшейся коматозным состоянием, на восьмые-десятые сутки после травмы, реже при травмах груди и конечностей. При двух последних локализациях травм острая язва была диагностирована на девятые сутки после травмы. При этом в связи с наличием голодных болей в эпигастрии и изжоги были предприняты эндоскопические исследования, что позволило диагностировать язвы. Консервативное лечение привело к заживлению язв на 20-25 сутки.
Более сложно протекали острые язвы при ТСТ живота и головы, когда клиническая симптоматика была замаскирована тяжелым состоянием пострадавших (перитонит, кома), а осложнение манифестировалось клиникой острого массивного желудочно-кишечного кровотечения в пяти случаях, в двух случаях - обострением признаков перитонита.
Посттравматическая патология ЖКТ сочеталась с сопутствующей патологией других органов. Так, самый большой процент сопутствующей патологии среди составляла нефропатия (45,6%), несколько меньше – постгеморрагическая анемия (34,7%), заболевания органов дыхания (17,3%), гепатит и другая патология печени (13,0%), заболевания сердечно-сосудистой системы (6,5%). Нарушение процессов пищеварения и всасывания при патологии желудочно-кишечного тракта совпадали с нарушением трофологического статуса. Так, расчет индекса Кетле у пострадавших подтвердил трофическую недостаточность у 87 из 127 больных (68,5%), в то время как снижение питания в общем массе клинических наблюдений было отмечено лишь у 8,7% пострадавших.
Патология мочевыделительной системы была выявлена у 175 из 444 пострадавших (39,4%): наиболее часто встречалась при ТСТ живота (62,0%), позвоночника (55,8%) и таза (39,1%), реже – груди (29,7%), головы (29,6%), при травмах конечностей (22,2%).
Основными нозологическими формами являлись нефропатия, пиелонефрит и ушиб почек. Наиболее распространенной формой патологии была нефропатия, которая была диагностирована у 120 из 175 пострадавших (68,6%), а наиболее часто - при ТСТ живота и таза (42,7% и 38,9% случаев соответственно), реже при ТСТ (34,8%), груди (30,8%) и позвоночника (20,9%). Основным проявлением посттравматической нефропатии был т.н. изолированный мочевой синдром в виде умеренной протеинурии (до 1 г/л) и единичных эритроцитов в осадке мочи (в среднем 5,4+0,6 в поле зрения). Кроме того, в 8,3 % случаев нефропатии в осадке мочи обнаруживались единичные гиалиновые цилиндры. Относительная плотность мочи была в пределах 1005-1020 (в среднем 1017+0,002). Мочевой синдром у пострадавших имел устойчивую связь с гнойно-резорбтивной лихорадкой. В то же время мочевой синдром в 13,5% случаев имел место уже при первом исследовании мочи (первые часы после травмы) и при развитии шока. Продлжительность нефропатии у пострадавших составила в среднем 17,7±0,3 дня.
Пиелонефрит был выявлен у 32 из 175 пострадавших (18,3%) с патологией почек, чаще при ТСТ таза (26,1%), живота (10,7%), позвоночника (9,3%), реже при ТСТ груди (7,7%) и головы (5,6%). Среди клинических проявлений пиелонефрита наиболее часто встречались лихорадка (субфебрильная – 41%, фебрильная – 43% и высокая – 16%), ознобы (34,4% случаев), дизурические явления (37,5% случаев), болезненность при поколачивании в области поясницы (59,4%). При исследовании мочи наряду с умереннойпротеинурией (до 1 г/л), выявлялась лейкоцитурия (до 100-200 лейкоцитов в поле зрения). Данные общего анализа мочи подтверждались пробой Нечипоренко. Пиелонефрит был диагностирован при травмах таза, живота, груди на 3-5 сутки после травмы, а при травмах головы, позвоночника, конечностей чаще на 8-10 сутки. Длительность течения пиелонефрита колебалась от 11 до 115 суток и составила в среднем 33,1±3,0 дня. В 12,5% случаев больные были выписаны с повышенным количеством лейкоцитов в анализах мочи.
Ушиб почек был диагностирован у 23 из 175 пострадавших (13,1%). Данный диагноз наиболее часто был установлен при ТСТ таза и живота (17,4% и 13,3% случаев соответственно). При других локализациях доминирующего повреждения ушиб почек наблюдали редко. Наиболее частым клиническим признаком ушиба почек была макрогематурия (56,5% случаев), продолжавшаяся 2-3 суток, в остальных случаях - выраженная микрогематурия (эритроциты покрывали все поле зрения). В 2/3 случаев выявлялась болезненность при поколачивании поясницы. В диагностике ушиба почек важное место занимало УЗИ, позволявшее уточнить объем и характер повреждений. Средняя продолжительность проявлений ушиба почек составила 16,1±2,3 дня. Необходимо отметить, что в одной трети случаев ушиб почек осложнился пиелонефритом, что потребовало более длительного лечения.
Патология системы крови. Тяжелая травма сопровождалась кровопотерей, что в большинстве случаев приводило к развитию постгеморрагической анемии у 383 из 444 пострадавших (86,3%). При этом наиболее часто анемия встречалась при ТСТ груди (90,1%), реже – при травме головы (76,9%). Средняя длительность анемии составила 29,3±0,8 дня, причем в каждом пятом случае при выписке показатели гемоглобина и эритроцитов не достигали нормальных величин, чаще при ТСТ с доминирующим повреждением живота, головы и нижних конечностей.
ПАТОФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА.
Состояние системы дыхания и гемостаза у пострадавших при травматической болезни. Установлено, что доставка кислорода к тканям (скорость транспорта О2) зависела от величины сердечного индекса (СИ) и содержания О2 в артериальной крови и была нарушена во все периоды ТБ, причем, в большей степени с 3-х до 10-х суток после травмы, что соответствовало третьему периоду ТБ. У пострадавших с благоприятным течением ТБ снижение доставки кислорода было менее выражено (на 40-50% на 3-4-е сутки и на 30% на 5-7-е сутки), чем у пациентов с генерализованными инфекционными осложнениями – сепсисом (на 50-60% к 3-7 суткам) независимо от исхода ТБ.
Уровень потребления О2 являлся заключительным этапом транспорта кислорода к тканям и представлял собой кислородное обеспечение тканевого метаболизма. Его определяли как производное СИ и артериовенозного различия в содержании О2. Этот показатель был взаимосвязан с клиническим течением и исходом ТБ. Так, потребление О2 у пострадавших без сепсиса было снижено почти в 2 раза в конце второго периода и в начале третьего периода (2-4 сутки), к 5-м суткам соответствовало нормальным значениям. Напротив, у пациентов с сепсисом с благоприятным исходом достоверно сниженный уровень потребления О2 на 1-е сутки ТБ в дальнейшем еще более уменьшался, достигнув на 6-7-е сутки (в сроки клинического проявления генерализованных инфекционных осложнений) критических значений: 52,3+2,9 мл/минм2 и 72,6+13,5 мл/минм2 соответственно (норма: 152,5+11,2 мл/минм2; p<0,05). Следует отметить, что потребление О2 тканями на 6-7 сутки после травмы было достоверно выше у пострадавших, умерших от сепсиса. Вероятно, это было вызвано централизацией кровообращения и максимальной реализацией компенсаторных резервов организма в период прогрессирования необратимых процессов при умирании.
У пострадавших с последующим развитием острой дыхательной недостаточности определялись наиболее низкие показатели индекса оксигенации артериальной крови и наиболее высокие – респираторного индекса (PaO2/FiO2). Снижение оксигенации артериальной крови в среднем на 27-34%, определялось на 1-2-е сутки, пролонгировано углублялось и на 7-е сутки после травмы и составляло всего 55% от нормальных значений (p<0,01). У пострадавших с последующим развитием сепсиса был отмечен наиболее низкий индекс оксигенации, особенно на 6-7 сутки после травмы – 2±0,18 и 2,34±0,2 соответственно (p<0,05). В группе пациентов, умерших от сепсиса, уже с 5-х суток ТБ индекс оксигенации не превышал 40% и свидетельствовал о синдроме острого повреждения легких (СОПЛ).
С 3-х суток после травмы наиболее высокие значения респираторного индекса (РИ) и альвеолярно-артериального различия по кислороду (А-аDO2) были выявлены у пострадавших с сепсисом. У пациентов, умерших от сепсиса, определяли самый высокий средний уровень РИ (в 19 раз выше нормы) на 4-е сутки после травмы, превышавший в 2 раза значение этого же показателя у пострадавших с благоприятным исходом сепсиса и у пациентов без генерализованных инфекционных осложнений. Резкое повышение РИ на 4-е сутки после травмы по отношению к 3-м суткам служило прогнозом дальнейшего развития сепсиса с неблагоприятным исходом ТБ, а снижение А-аDO2 в 2 раза по сравнению с данными 3-4-х суток – благоприятным признаком течения и исхода ТБ. Посттравматические нарушения в системе транспорта кислорода и его потребления, а также их следствие – тканевая гипоксия и микроциркуляторные расстройства, вызывали глубокие повреждения системы гемостаза, которые, в свою очередь, усиливали эти расстройства.
В различные периоды ТБ основным нарушением гемостаза было развитие диссеминированного внутрисосудистого свертывания (ДВС). При этом в первом периоде чаще развивалась геморрагическая стадия ДВС, а в последующем – тромботическая с потреблением главным образом тромбоцитов и фибриногена и угнетением фибринолиза. Число тромбоцитов было снижено на 30% в первом периоде ТБ, и в течение 2-4-х суток продолжало уменьшаться (p<0,05), затем количество тромбоцитов постепенно возвращалось к норме. У пациентов с сепсисом резко выраженная тромбоцитопения отмечалась в конце второго (111,7+9,6х109/л) и в начале третьего периода ТБ (106,9+9,5х109/л), у пациентов без сепсиса в эти периоды ТБ число тромбоцитов было значительно выше (144,6+8,7х109/л и 138,4+9,5х109/л соответственно; p<0,05). За 12 часов до летального исхода количество тромбоцитов не превышало 67,3+16,3х109/л.
В течение первых трех периодов ТБ определялась характерная для ДВС генерация тромбина – уровень растворимых фибрин-мономерных комплексов (РФМК) в 2-3 раза превышал нормальный. При этом основной противосвертывающий механизм был резко угнетен – активность антитромбина-III (АТ-III) в течение первой недели не достигла нижней границы нормы. Наибольшее потребление АТ-III отмечалось при летальном исходе ТБ.
Маркер генерации тромбина и активации плазминовой системы – Д-димер в течение первых трех периодов ТБ определялся в количестве в 3-5 раз превышавшим норму. Тем не менее, фибринолитическая активность в эти сроки была резко снижена вследствие системного повреждения эндотелия кровеносных сосудов и преобладания активности тканевых ингибиторов плазминогена. Такое состояние системы гемостаза углубляло нарушения микроциркуляции в паренхиматозных органах, приводило к органной дисфункции или недостаточности, которая была диагностирована у пострадавших в 92,8% случаев.
Состояние иммунной системы. При политравмах у пострадавших нарушались все этапы иммунного ответа. Начиная, с первого периода ТБ были выявлены иммунодефицит, иммунодепрессия, глубокие нарушения внешней и внутрисистемной регуляции, ставшие к 3-7-е суткам (третий период ТБ) наиболее выраженными. Из таблицы 2 очевидно уменьшение к 3-7-м суткам общего количества Т-лимфоцитов, Т-хелперов 1 типа (Th1-клеток) и Т-хелперов 2 типа (Th2-клеток) – CD3+, CD4+, CD8+ были снижены на 50% (p<0,05) и натуральных Т-киллеров (CD16+: 0,09±0,014109/л; p<0,05). Изменения в числе В-лимфоцитов (CD20+) были менее существенными. С 1-х суток после травмы было отмечено снижение на 40% иммунорегуляторного индекса – соотношения CD4+/CD8+ (1,04+0,12; норма 1,74+0,2), которое свидетельствовало о повреждении механизмов, регулирующих взаимоотношения активности двух типов Т-хелперов с противоположными влияниями на иммунный ответ, о преобладании количества Т-хелперов II типа, ответственных за супрессорную программу.
Несмотря на то, что изменения в числе В-лимфоцитов (CD20+) были не существенными, определялось снижение на их поверхности количества рецептора HLA-DR с 1-х суток после травмы (HLA-DR: 0,16±0,03109/л; p< 0,05), причем наиболее выраженное уменьшение зарегистрировано с 3-х суток (HLA-DR: 0,14±0,02109/л; p<0,05), что свидетельствовало о функциональной недостаточности этих клеток, нарушении презентации ими антигенов (таблица 3). Хотя спонтанная пролиферация лимфоцитов, начиная с 3-х суток после травмы, превышала норму в 2 раза, индуцированная ФГА, характеризовавшая готовность Т-лимфоцитов к иммунному ответу, была снижена в 3 раза. С 3-х суток после травмы, было также отмечено уменьшение на 26% индуцированной PWM пролиферации В-лимфоцитов, ответственных за реализацию гуморального иммунного ответа.
Таблица 2
Популяционный и субпопуляционный состав лимфоцитов в периферической крови у пострадавших с политравмой (M±m)
| Сроки обследования (сутки) | CD3 | CD4 | CD8 | CD4/ CD8 | CD20 | CD16 | |||||
| % | 109 /л | % | 109 /л | % | 109 /л | % | 109 /л | % | 109 /л | ||
| 2-е n=8 | 55,2± 5,5 | 0,75± 0,23 | 28,6± 3,2* | 0,39± 0,14 | 25,8± 1,7 | 0,34± 0,09 | 1,04± 0,12 | 13,4± 1,75 | 0,15± 0,04 | 10,8± 2,05 | 0,12± 0,03 |
| 3-7-е, n = 27 | 53,9± 2,77* | 0,51± 0,12* | 31,6± 2,1 | 0,4± 0,08* | 23,3± 1,46 | 0,31± 0,05 | 1,33± 0,14 | 12,9± 1,8 | 0,15± 0,05 | 8,9± 1,1* | 0,09± 0,014* |
| 8-14-е, n = 26 | 57,7± 3,3 * | 0,96± 0,16 | 36,0± 3,2 | 0,67± 0,17 | 19,7± 2,47 | 0,44± 0,09 | 2,2± 0,23 | 13,1± 1,8 | 0,26± 0,06 | 14,8± 1,0 | 0,16± 0,08 |
| 15-21-е, n = 17 | 59,5± 2,29* | 0,88± 0,1 | 39,3± 2,57 | 0,58± 0,07 | 19,9± 1,04 | 0,29± 0,037* | 2,13± 0,16* | 10,1± 0,83 | 0,15± 0,02 | 10,6± 0,85 | 0,15± 0,02* |
| 22-30-е, n = 22 | 63,7± 2,14 | 1,09± 0,11 | 46,04± 2,29 | 0,79± 0,07 | 20,8± 1,2 | 0,35± 0,04 | 2,4± 0,23* | 9,4± 0,8 | 0,17± 0,02 | 9,6± 1,09 | 0,19± 0,03 |
| Норма | 70,3± 1,7 | 1,18± 0,07 | 42,4± 2,3 | 0,70± 0,05 | 24,3± 1,5 | 0,41± 0,03 | 1,74± 0,2 | 9,3± 0,8 | 0,16± 0,02 | 12,7± 1,1 | 0,22± 0,02 |
* – достоверное отличие от нормы (p<0,05).
Таблица 3
Функциональная активность лимфоцитов в периферической крови у пострадавших с политравмой (M±m)
| Сроки обследования (сутки) | CD95 | HLA DR | Спонтанная пролифера ция лимфоцитов | Индукция ФГА (15 мкг/мл) | Индукция PWM (5 мкг/мл) | ||
| % | 109 /л | % | 109 /л | % | ед | ед | |
| 2-е, n = 8 | 9,8± 3,01 | 0,11± 0,037 | 15,0± 2,7 | 0,16± 0,03* | 1,14±0,17 | 55,6±2,3 | 6,7±2,9 |
| 3-7-е, n= 27 | 10,37± 1,57 | 0,12± 0,021 | 13,8± 1,5 | 0,14± 0,02* | 2,3±0,53* | 12,9±3,3* | 4,2±0,92 |
| 8-14-е, n = 26 | 13,4± 2,36* | 0,27± 0,06* | 12,8± 2,7 | 0,24± 0,06 | 2,8±0,3* | 11,6±2,8* | 3,26±0,72 |
| 15-21-е, n = 17 | 9,98± 1,65 | 0,15± 0,03 | 11,06±1,07 | 0,15 ± 0,02* | 1,5± 0,23 | 27,2± 3,7 * | 4,8± 0,8 |
| 22-30, n = 22 | 12,54± 1,8 | 0,066±0,016 | 11,7±1,15 | 0,19±0,028 | 2,6±0,6* | 15,9±2,9* | 3,5±0,53 |
| Норма | 6,9± 0,8 | 0,12± 0,02 | 12,4± 1,5 | 0,22± 0,03 | 1,1± 0,1 | 41,3± 3,2 | 5,3± 0,7 |
* – достоверное отличие от нормы (p<0,05).
Как видно из таблицы 4, в результате антигенной перегрузки, начиная с первых суток после травмы, была угнетена спонтанная и индуцированная фагоцитарная активность нейтрофилов – 26,1±5,3% и 26,3±3,9% соответственно (p< 0,05). В последующем наблюдалась постепенная нормализация этих показателей. Индекс завершенности фагоцитоза, начиная с 3-х суток после травмы, был менее 1.
Таблица 4
Функциональная активность нейтрофилов в периферической крови у пострадавших (M±m)
| Сроки обследова ния (сутки) | Адгезия спонтан ная | Адгезия индуцированная | Фагоци тоз | Индекс фагоцитоза | Завершен ность |
| % | % | % | ед | ед | |
| 2–е, n= 8 | 26,1±5,3* | 26,3±3,9* | 61,4±2,9 | 2,58±0,11 | 1 |
| 3-7-е, n= 27 | 32,1±2,3 | 34,9±2,5* | 66,5±1,9 | 2,5±0,08 | <1 |
| 8-14-е, n = 26 | 29,5±2,8* | 39,9±6,6* | 65,2±2,6 | 2,44±0,01 | <1 |
| 15-21-е, n = 17 | 30,8±2,15* | 38,3±5,1 * | 70,7±2,34 | 2,3±0,1 | <1 |
| 22-30-е, n = 22 | 36,7±3,2 | 44,6±3,8 | 62,4±1,9 | 2,4±0,09 | <1 |
| Норма | 39,3±3,1 | 54,0±2,3 | 68,3±1,5 | 2,7±0,3 | 1 |
* – достоверное отличие от нормы (p<0,05).
В результате проведенного исследования было также отмечено снижение в 2 раза количества Т-лимфоцитарных рецепторов CD25 к регуляторному цитокину ИЛ-2 и в этой связи – закономерное подавление индуцированной продукции ИЛ-2 (таблица 5). В то же время, наблюдалось увеличение спонтанной продукции ИЛ-2, что было также следствием недостаточного числа рецепторов к ним.
Таблица 5
«Иммунорегуляторные» цитокины и рецептор CD25 в периферической крови у пострадавших с политравмой (M±m)
| Сроки обследования (сутки) | CD25 | ИЛ-2 спонтан ная продук ция | ИЛ-2 индуцированная продук ция | ИФН спонтан ная продук ция | ИФН индуцированная продук ция | ИНФ содержа ние в сыворот ке крови | |
| % | 109 /л | ед/мл | ед/мл | ед/мл | ед/мл | ед/мл | |
| 2-е, n=8 | 4,9±1,46 | 0,05± 0,02* | 7,7±2,7 | 64,0±12,02 | 110,3±26,8 | 215,0±43,3 | 162,2± 29,2* |
| 3-7-е, n = 27 | 4,84±0,8 | 0,07± 0,02* | 8,7±1,49* | 44,7±5,9 | 118,0± 26,3* | 238,5±3,7* | 167,4± 28,0* |
| 8-14-е, n = 26 | 5,5±1,2 | 0,089± 0,02 | 10,9±1,28* | 47,1±14,9 | 145,2±29,2 * | 264,0± 29,0* | 272,4± 44,6* |
| 15-21-е, n = 17 | 2,38± 0,47* | 0,038± 0,008 * | 7,37± 1,83 | 73,7± 17,0 | 220,1±39,0* | 203,9±27,9* | 532,6± 75,45* |
| 22-30-е, n = 22 | 3,19±0,6 | 0,066± 0,016 | 7,65± 1,18 | 69,3±13,8 | 154,8±33,9 | 519,2± 141,2 | 234,8±62,1 |
| Норма | 7,4±1,2 | 0,14± 0,03 | 3,2±1,6 | 54,3±13,4 | 40,2±12,6 | 109,8±7,5 | 45,1±21,4 |
* – достоверное отличие от нормы (p<0,05).
Изменения в цитокиновом звене иммунного ответа были выявлены с 1-х суток после травмы, при этом они были наиболее выражены, начиная с 3-х суток, то есть в третьем периоде ТБ. Содержание гамма-интерферона (ИНФ) в сыворотке крови (162,2±29,2 ед/мл; p<0,05) и его спонтанная продукция (110,3±26,8 ед/мл; p<0,05) с 1-х суток после травмы были резко повышены. Индуцированная продукция ИНФ в отличие от первого и второго периодов, в которых отмечалась лишь тенденция к его повышению, достоверно увеличивалась на 50% (238,5±43,7 ед/мл; p<0,05) в третьем периоде ТБ. В эти же сроки отмечалось высокое (на 221% выше нормальных значений) содержание в сыворотке крови фактора некроза опухоли (ФНО) (122±32,2 пг/мл; p<0,05) (таблица 6). Спонтанная продукция ФНО в третьем периоде ТБ была ниже, чем в первом и втором периодах, и соответствовала норме. Напротив, индуцированная продукция ФНО в первых двух периодах ТБ была снижена в 2,3 раза, в третьем периоде ТБ находилась на критическом уровне (80,1±21,0 пг/л; p<0,05) и ее величина была меньше нормы в 8,5 раз.
Таблица 6
Про- и противовоспалительные цитокины периферической крови (M±m)
| Сроки обследования (сутки) | ИЛ-4 спонтан ная продукция | ИЛ-4 индуциро ванная продукция | ИЛ-4 содержание в сыворотке крови | ФНО спонтанная продукция | ФНО индуциро ванная продукция | ФНО содержание в сыворотке крови | |
| ед/мл | ед/мл | ед/мл | ед/мл | ед/мл | ед/мл | ||
| 2-е, n = 8 | 38,4±5,4 | 51,2±2,9* | 71,6±16,7 | 43,3±2,84 | 304,0±88,2 | 89,3± 52,3 | |
| 3-7-е, n = 27 | 40,7±2,6* | 52,8±3,4* | 135,4±16,8* | 41,8±1,7 | 80,1±21,0* | 122,9±32,2* | |
| 8-14-е, n = 26 | 46,2±5,0* | 45,1±3,3* | 127,3±26,2 * | 54,0±7,8 | 163,0±26,0* | 76,8±11,1* | |
| 15-21-е, n = 17 | 39,7±3,5 | 46,7±8,0* | 69,8±6,5* | 55,2± 7,0 | 247,3±93,5 | 99,5±15,7* | |
| 22-30-е, n = 22 | 48,6±3,1 | 50,4±2,8 | 77,1±10,5 | 60,1±6,02 | 351,2±76,8 | 71,7±19,7 | |
| Норма | 30,0±2,9 | 127,2±15,6 | 40,9±12,9 | 42,4±8,6 | 686,8±28,2 | 38,1±15,3 | |
* - достоверное отличие от нормы (p<0,05).
Концентрация противовоспалительного цитокина ИЛ-4 в сыворотке крови (135,4±16,8 пг/мл; р<0,05) и его спонтанная продукция (40,7±2,6 пг/мл; p<0,05) превышали норму (в 3,3 и 1,4 раза соответственно) с 3-х суток после травмы, а индуцированная продукция IL-4 (52,8±3,4 пг/мл, р<0,05) в эти же сроки, напротив, была в 2,4 раза ниже ее уровня (норма: 127,2±15,6 пг/мл). Таким образом, в начале третьего периода ТБ (на 3-7-е сутки) отмечалась высокая концентрация в плазме крови (в 3,3 раза больше нормы) ИНФ, ФНО, с одной стороны, и ИЛ-4 – с другой.
Чтобы получить более четкие представления о характере изменений уровня продукции и концентрации в сыворотке крови цитокинов при политравме, был предпринят анализ количественного соотношения про- и противовоспалительного цитокинов – ФНО/ИЛ-4. Полученные рассчетные коэффициенты у пострадавших (“К” спонтанной продукции – 1, индуцированной – 1,5, содержания в сыворотке – 0,9) сравнивали с аналогичными данными, полученными у здоровых людей в физиологических условиях, соответственно, 1,44; 5,4; 1,1. Проведенный анализ показал, что у пострадавших с политравмой на 3-7-е сутки ТБ резко преобладали спонтанная и индуцированная продукция, а также содержание в сыворотке крови противовоспалительного цитокина – ИЛ-4. Следовательно, использование коэффициента ФНО/ИЛ-4 позволило выявить нарушение баланса про- и противовоспалительных цитокинов в начале третьего периода ТБ (3-7-е сутки), выраженную активацию иммуносупрессорного звена иммунитета. Определенные изменения в продукции и активности двух типов цитокинов свидетельствовали об иммунодисфункции и иммунодепрессии, вследствие которых нарушалось участие цитокинов в иммунных, гемокоагуляционных, метаболических процессах, кроме того, было снижено их потребление, являвшееся причиной накопления обоих типов цитокинов в системном кровотоке. Поэтому дисбаланс про- и противовоспалительного звеньев иммунитета приводил к органной дисфункции и снижению резистентности организма к инфекции.
На 8-14-е сутки после травмы была отмечена четкая тенденция к улучшению показателей иммунитета по сравнению с 3-7-ми сутками ТБ. Число Т-лимфоцитов составляло 82% от нормальных значений (57,7±3,3; норма: 70,3±1,7%; p<0,05), число субпопуляций Т-лимфоцитов было приближено к нормальным величинам (85-96%), В-лимфоцитов – превышало норму на 63%. Однако сохранялись снижение иммунореактивности и дисбаланс иммунных процессов. Так, было отмечено резкое угнетение фагоцитарной активности нейтрофилов, определенное на уровне адгезии клеток и нарушения завершенности фагоцитоза (индекс менее 1). На данном этапе ТБ определялся резко выраженный апоптоз лимфоцитов – 13,4±2,36% и 0,27±0,06х109/л (норма: 6,9±0,8% и 0,12±0,02х109/л соответственно; p<0,05). В этой связи, несмотря на повышение по отношению к 3-7-м суткам числа лимфоцитов, их популяций и субпопуляций, активность их оставалась низкой, о чем свидетельствовала слабая (28% от нормальных значений) пролиферация лимфоцитов на индукцию ФГА, низкое количество поверхностных рецепторов на Т-лимфоцитах к ИЛ-2.
Характер изменений в цитокиновом звене иммунитета отражал намечавшееся снижение супрессорной функции по отношению к аналогичным данным 3-7-х суток. Особенно это было наглядно видно при анализе соотношения продукции и уровня в плазме крови ФНО и ИЛ-4: отношение величин спонтанной продукции составляло 1,16 (3-7-е сутки: 1), индуцированной – 3,6 (3-7-е сутки: 1,5), концентрации в плазме – 0,6 (3-7-е сутки: 0,9). Продукция и содержание в плазме крови регуляторно-интеграционного цитокина ИНФ в эти сроки ТБ оставалось на прежнем уровне, что указывало на наличие дезинтеграционных процессов в цитокиновом звене иммунитета. Этот факт и высокое содержание ИЛ-4 в сыворотке крови, преобладавшее над ФНО, свидетельствовало о том, что риск развития СПОН на 8-10 сутки ТБ все еще сохранялся. Эти данные соответствовали клиническим проявлениям ТБ – развитию у пострадавших с политравмой висцеральных осложнений в 92,8% случаев.
В последующие две недели (15-21-е сутки – четвертый период ТБ) в клеточном иммунитете отмечалась направленность к увеличению количества CD3+, CD4+, CD8+, CD16+, CD20+, HLA-DR по сравнению с 3-14-ми сутками, но они все еще были достоверно сниженными в сравнении с нормой. Активность пролиферации лимфоцитов, индуцированная ФГА, составляла всего 66% от нормальных значений (p<0,05). Так же, как и в предыдущие сроки, было отмечено нарушение иммунорегуляции на уровне влияний ИЛ-2 из-за резкого снижения числа рецепторов на поверхности лимфоцитов к интерлейкину-2 (CD25%: 2,38±0,47; CD25х109/л: 0,038±0,008; норма, 7,4±1,2 и 0,14±0,03 соответственно; p<0,05). На 15-21-е сутки соотношение двух типов хелперов нормализовалось – CD4/CD8 составляло 1,94±0,16. Фагоцитарная активность нейтрофилов все еще была снижена, и индекс завершенности фагоцитоза не достигал 1. Угнетение фагоцитоза проявлялось снижением адгезии нейтрофилов. Так, индуцированная адгезия составляла всего 71% от нормальных значений.
В эти сроки ТБ функция регуляторов иммунных процессов еще более усиливалась. Концентрация регуляторно-интеграционного цитокина ИНФ в сыворотке крови была в 11,8 раз выше нормы и в 3,2 раз выше показателей первой недели ТБ (532,6±75,5 пг/мл; 45,1±21,4 пг/мл; 167,4±28 пг/мл соответственно) при высокой индуцированной – 203,9±27 пг/мл (на 85% выше нормы) и спонтанной (в 5,5 раз выше нормы и в 1,8 раз выше данных 3-7-х суток) их продукции. На 15-21-е сутки количественное соотношение продукции ФНО и ИЛ-4 (спонтанной – 1,4; индуцированной – 5,3) уже соответствовало нормальному соотношению (1,4 и 5,4 соответственно). Нарушения иммунореактивности в динамике ТБ были наиболее выражены у пострадавших с развитием висцеральных инфекционных осложнений. Пролонгировано снижался уровень экспрессии молекул HLA-DR, презентирующих антигены и являющихся маркером гнойной инфекции (на 3-7-е, 8-14-е, 15-21-е сутки; содержание HLA-DR составлено: 0,13±0,02х109, p<0,05; 0,18±0,04х109; 0,15±0,02х109/л, p<0,05 соответственно; норма: 0,22±0,03х109/л).
Таким образом, на основании полученных результатов можно заключить, что при политравмах иммунная система включалась в формирование адаптационной реакции на этапе ишемии-реперфузии развитием СВО, генерализация которого реализовалась активированными иммунокомпетентными клетками. В первых двух периодах ТБ преобладало влияние неспецифических факторов защиты, относительное и абсолютное количество лимфоцитов было снижено. В условиях Т-лимфоцитарного иммунодефицита и СВО развивался ранний СПОН, иммунодепрессия, вызванные последствиями реакции организма на травму. Если в начале третьего периода ТБ иммунодефицит и иммунодепрессия сохранялись на прежнем уровне, возникала иммунодисфункция с выраженной иммуносупрессией, ведущая к снижению резистентности организма к инфекции и к ее генерализации. Развивался новый ответ организма бактериальной этиологии в форме бактериального СВО – теперь на генерализованную инфекцию, который приводил к сепсису и позднему СПОН.
Изменение функции эндотелия кровеносных сосудов в динамике травматической болезни. Изменения уровня эндотелина в крови при политравме представлены в таблице 7. В 1-е сутки после травмы уровень эндотелина в крови был резко повышен (в 3,5 раза). С 3-х суток он снижался на 46% по отношению к 1 суткам, в дальнейшем (до 25 суток) не имел динамики и превышал нормальные значения в 1,5-2 раза. Наиболее значительный (на 388%) его рост был отмечен в 1-е сутки у пострадавших с последующим развитием тяжелого сепсиса (у пациентов без сепсиса его повышение составляло 194%, p<0,05). В ходе течения тяжелого сепсиса уровень эндотелина был еще более высоким (15-е сутки – в 27 раз, 25-е сутки – в 9 раз выше нормы). Следовательно, в 1-е сутки после травмы возникала резко выраженная активации эндотелиальных клеток, которая приводила к пролонгированной дисфункции сосудистого эндотелия, опасным проявлением которой являлся СПОН, развившийся в результате вызываемой эндотелином мощной вазоконстрикции.
У пострадавших с политравмой уровень нитратов (NO) в 1,6-2 раза превышал норму и не имел достоверной динамики в различные периоды ТБ (таблица 8). Следует отметить, что наиболее высоким он был с 7-х суток после травмы, что соответствовало третьему периоду ТБ. У пострадавших с сепсисом максимальные увеличение NO определялось на 25 сутки (46,4±5,4 мкмоль/л против 34,5±1,2 мкмоль/л у пострадавших без сепсиса; р<0,05).
Из полученных результатов проведенного исследования следует что, несмотря на гиперпродукцию NO, достаточная защита сосудов не развивалась, так как в крови накапливался повышенный уровень эндотелина, что приводило к преобладанию сосудистого спазма, неадекватности системного кровоток в результате ишемии жизненно-важных органов. Корреляция между уровнем NO и общей прооксидантной (r=0,5) и антиоксидантной активностью (r=-0,37) позволяла предполагать, что при политравме разрушение NO наступало прежде, чем он достигал места своего действия.
Усиление прокоагулянтной активности эндотелия после травмы проявлялось повышением уровня фактора Виллебранда (таблица 9). У пострадавших без сепсиса уровень vWF неуклонно нарастал (в 1-е сутки – 87±5%, к 25-м суткам – 120±10%; p<0,05). В 1-е сутки после травмы у пациентов с сепсисом определялся самый высокий уровень vWF (124±3,8%; p<0,05). Однако в динамике отмечалось снижение уровня vWF, что вероятно было связано с развитием ДВС-синдрома, сопровождавшего генерализованные инфекционные осложнения.
Таблица 7
Уровень эндотелина в крови при политравме
| Группы обсле-дуемых | Сроки обследования (сутки) | |||||
| 1 | 3 | 7 | 10 | 15 | 25 | |
| Общая группа | 1,2±0,12 n = 16 | 0,65± 0,04, n = 24 | 0,64± 0,06, n = 20 | 0,51± 0,04, n = 10 | 0,53± 0,04, n = 11 | 0,72± 0,17, n = 6 |
| с сепси-сом | 1,66± 0,11, n = 4 | 0,87± 0,09,, n = 5 | 0,87± 0,06,, n = 4 | 0,42± 0,78 n = 3 | 9,06± 3,04,, n = 5 | 2,98± 0,17, n = 6 |
| без сеп-сиса | 1,0±0,12 n = 12 | 0.65± 0,04, n = 19 | 0,64± 0,06, n = 16 | 0,55± 0,017, n = 7 | 0,51± 0,035, n = 6 | _ |
| Здоро-вые | 0,34±0,04 фмоль/мл n = 10 | |||||
- различие с данными 1-х суток достоверно (p<0,05);
- различие между группами достоверно (p<0,05);
- различие с данными здоровых лиц достоверно (p<0,05).
Таблица 8
Уровень нитратов в крови при политравме
| Группы обсле-дуемых | Сроки обследования (сутки) | |||||
| 1 | 3 | 7 | 10 | 15 | 25 | |
| Общая группа | 35,0±3,2 n = 22 | 31,3±2,4 n = 31 | 38,4±2,9 n = 28 | 39,6±3,6 n = 27 | 39,0±3,8 n = 22 | 38,7±2,77 n = 17 |
| с сепси-сом | 38,2±10,0 n = 5 | 32,4±1,1 n = 8 | 36,0±4,3 n = 9 | 43,7±4,5 n = 12 | 37,8±3,8 n = 7 | 46,4±5,4, n = 6 |
| без сеп-сиса | 34,0±1,2 n = 17 | 40,8±3,6 n = 23 | 41,4±3,3 n = 19 | 36,3±2,9 n = 15 | 39,5±3,8 n = 15 | 34,5±1,2 n= 11 |
| Здоро-вые | 19,7±0,5 мкмоль/л n = 10 | |||||
– различие с данными здоровых лиц достоверно (p<0,05);
– различие между группами достоверно (p<0,05).
Ослабление фибринолитической активности эндотелия кровеносных сосудов после травмы проявлялось снижением уровня фибринолитического комплекса тканевого активатора плазминогена и его ингибитора (таблица 10). У пострадавших с сепсисом содержание комплекса tPA/PAI-1 на 1-3 сутки после травмы было снижено в 1,8-2 раза по сравнению с его содержанием у пострадавших без сепсиса и здоровых лиц. С 7-х суток при сепсисе содержание комплекса tPA/PAI-1 повышалось в 2-3,5 раза, что манифестировало развитие печеночной дисфункции или недостаточности с нарушением деградации tPA в пораженной печени. У пострадавших без сепсиса комплекс tPA/PAI-1 в первые трое суток сохранялся на нормальном уровне, с 7-х суток (третий период ТБ) было отмечено снижение его содержания с постепенной нормализацией к 25 суткам (четвертый период ТБ).
Таблица 9
Уровень фактора Виллебранда (vWF) в крови при политравме
| Группы обсле-дуемых | Сроки обследования (сутки) | |||||
| 1 | 3 | 7 | 10 | 15 | 25 | |
| Общая группа | 98±7,6 n = 17 | 91±6 n = 25 | 103±7 n = 7 | 108±8 n = 11 | 116±9 n = 9 | 120±10 n = 10 |
| с сепси-сом | 124± 3,8, n = 5 | 96±16 n = 6 | 99±16 n = 6 | 89±5, n = 4 | 94±7, n = 4 | _ |
| без сеп-сиса | 87±5 n = 12 | 89±2,8 n = 19 | 102±3, n = 14 | 119±5, n = 7 | 134±8, n = 5 | 120±10 n = 10 |
| Здоро-вые | 79,1±5 % n = 20 | |||||
– различие с данными 1-х суток достоверно (p<0,05).
– различие между группами достоверно (p<0,05);
– различие с данными здоровых лиц достоверно (p<0,05).
Таблица 10
Уровень фибринолитического комплекса (tPA-PAI-1) в крови при политравме
| Группы обсле-дуемых | Сроки обследования (сутки) | |||||
| 1 | 3 | 7 | 10 | 15 | 25 | |
| Общая группа | 12,35±1,9 n = 17 | 13,3±2,7 n = 25 | 13,6±3,0 n = 20 | 11±3,1 n = 11 | 8,7±2,8 n = 9 | 14,6±3,0 n = 6 |
| с сепси-сом | 7,2±1,6, n = 4 | 7,0 ±1,2, n = 5 | 24,3±8,6 n = 5 | 35,8± 12,2, n = 4 | 47,0±18,8 n = 4 | _ |
| без сеп- сиса | 13,2±1,0 n = 13 | 14,9±3,1 n = 20 | 9,8±0,14, n = 15 | 8,8±0,8, n = 7 | 9,2±2,0 n = 5 | 14,6±3,0 n = 6 |
| Здоро-вые | 13,5±1,3 нг/мл n = 20 | |||||
– различие с данными 1-х суток достоверно (p<0,05);
– различие между группами достоверно (p<0,05);
– различие с данными здоровых лиц достоверно (p<0,05).
Таким образом, нарушение гемостазрегулирующей функции эндотелиоцитов в ответ на травму и кровопотерю проявлялось усилением прокоагулянтной и ослаблением фибринолитической активности эндотелия кровеносных сосудов, что вызывало выраженные расстройства микроциркуляции и приводило к дисфункции и недостаточности органов и систем.
Регуляцию эндотелием адгезивных свойств сосудистой стенки оценивали по уровню растворимых сосудистых молекул клеточной адгезии в плазме крови (sVCAM-1). Содержание sVCAM-1 в 1-е сутки после травмы не отличалось от нормальных показателей здоровых лиц. Достоверно повышенный уровень sVCAM-1 был выявлен на 3-и и 7-е сутки (807,2±42,8 нг/мл и 794,3±47,2 соответственно; p<0,05), что соответствовало периоду максимальной вероятности развития висцеральных осложнений – третьему периоду ТБ. Достоверных различий в значениях данного показателя между группами пострадавших с сепсисом и пациентом без генерализованных инфекционных осложнений не выявлено. Из выше сказанного следует, что повышенное содержание sVCAM-1 приводит к нарушению адгезивных свойств сосудистой стенки, вызывая дисфункцию эндотелия кровеносных сосудов при политравме.
Регуляцию сосудистым эндотелием ангиогенеза оценивали по активности цитокинов – ИЛ-6, ИЛ-8, ИЛ-10. В ответ на политравму было выявлено резкое увеличение продукции провоспалительного цитокина – ИЛ-6 (таблица 11). Его уровень в 1-е сутки превышал норму в 8 раз (64,9±15,4 пг/мл; p<0,05). На 3-и сутки ИЛ-6 снижался (30,8±12,4 пг/мл), однако в последующем в динамике превышал норму в 2-5 раз. При сепсисе уровень ИЛ-6 в 4 раза выше нормы и в 2 раза выше, чем у пострадавших без сепсиса (58,1±4,4 пг/мл против 14,0±1,4 пг/мл и 20,2±3,2 пг/мл соответсвенно).
Уровень ИЛ-8 в динамике превышал норму, наиболее значительно на 15 и 25 сутки – в период развития сепсиса (46,9±22 и 89,4±17,1пг/мл, соответсвенно) (таблица 12).
Как видно из таблицы 13, содержание в крови ИЛ-10, ограничивавшего продукцию провоспалительных цитокинов (ИЛ-6, ИЛ-8), было наиболее повышено в 1-е сутки у пострадавших без сепсиса (26,2±9,2 пг/мл; при сепсисе: 6,7±0,9 пг/мл; p<0,05). В дальнейшем наблюдалось снижение данного показателя во всех группах до нормальных значений.
Между ИЛ-10 и ИЛ-6 (r = 0,79), ИЛ-8 (r = 0,56) в 1-е сутки после травмы определялась сильная прямая корреляционная связь. Однако, начиная с 3-х суток и в последующем, наблюдалась разбалансировка соотношения провоспалительных и противовоспалительных цитокинов с превышением провоспалительных цитокинов. При сепсисе такие нарушения отмечались с 1-х суток, детерминируя его развитие.
При тяжелой травме и сепсисе нарушается регуляция эндотелием ангиогенеза, повышение в крови в 1-е сутки после травмы уровня провоспалительных цитокинов (ИЛ-6, ИЛ-8) более выражено, чем противовоспалительных цитокинов (ИЛ-10).
Мониторинг состояния клеточного иммунитета, цитокинов и функции эндотелия кровеносных сосудов в прогнозе развития синдрома полиорганной недостаточности при политравме.
В результате проведенного исследования установлено, что наиболее резкие изменения наблюдались в моноцитарном звене иммунитета. Известно, что активность моноцитов проявляется экспрессией на их мембране гликопротеинового рецептора эндотоксина (липополисахарида, LPS) – CD14+ и презентацией антигена главного комплекса гистосовместимости класса II (CD14+ HLA-DR+). Как видно из таблицы 14, в первые трое суток после травмы относительное число CD14+ было снижено у всех пострадавших (в среднем на 18,5-26% при дальнейшем сепсисе и 10-15% у пациентов без сепсиса). С 5-7-х суток у пострадавших с диагностированным сепсисом или последующим сепсисом его снижение было критическим (CD14+: 30+4,6%, без сепсиса – 55,5+6,8%; p<0,05). Анализ амплитуды значений CD14+% в динамике (1-е, 3-и, 5-7-е сутки, сепсис/нет сепсиса: 44-75/58-85,5; 41-89,5/58-78; 17-43/40-77% соответственно) показал, что число CD14+% в первые трое суток ниже 58%, на 5-7 сутки – ниже 40% определялся только у пациентов с сепсисом. Этот тезис подтверждали расчеты с использованием статистического критерия 2: прослеживалась сильная отрицательная корреляционная связь между сепсисом и CD14+% (3-и сутки: n = 23;
= 1; 2 = 5,74; p<0,02; r = -0,5; 7-е сутки: n = 22; = 1; 2 = 6,08; p<0,02; r = -0,53). Таким образом, показатель CD14+ в моноцитарном гейте < 58% на 3-и сутки, возможно, использовать для прогноза, а CD14+ < 34% на 5-7-е – для ранней диагностики сепсиса, СПОН.
В динамике CD14+ HLAII+% определялись еще более выраженные изменения. Число моноцитов, имевших на своей поверхности CD14+ HLAII+, в первые трое суток в среднем составляло 37-39%, при небактериальной CПОН – было ниже 31% (норма > 85%). К 5-7-м суткам у пострадавших с сепсисом (31,1+3,68%) их количество еще больше снижалось, у пациентов без сепсиса (45,8+4,1%; p<0,05) – отчетливо повышалось. Пределы колебаний числа клеток с CD14+ HLAII+% свидетельствовало о том, что только при сепсисе оно ниже 31% (сепсис/нет сепсиса: 12-63/32-44; 7,5-67,5/31-47; 20,7-41,5/40-58,8 соответственно 1-е, 3-е, 7-е сутки). Между сепсисом и количеством моноцитов с CD14+ HLAII+ % определялась сильная отрицательная корреляционная связь (3-и сутки: n = 23; = 1; 2 = 6,6; p<0,01; r =-0,54; 5-7-е сутки: n = 22; = 1; 2 = 10,8; p<0,001; r = -0,73). Следовательно, число моноцитов, экспрессировавших CD14+ HLAII+%, менее 31% на 3-и сутки после травмы может служить прогнозом, менее 40% на 5-7-е сутки – ранним диагностическим признаком сепсиса, СПОН.
В результате проведенных исследований установлено, что повышение уровня ИЛ-10, ограничивавшего активность моноцита–макрофага и продукцию провоспалительных цитокинов, было отмечено только у пострадавших без септических осложнений (26,2±9,2 пг/мл; при сепсисе: 6,7±0,9 пг/мл; p<0,05; норма < 30 пг/мл). Это свидетельствовало о возможном существовании и других механизмов, подавлявших активность моноцита–макрофага.
Анализ функциональной активности лимфоцитов показал, что относительное число лимфоцитов, экспрессировавших молекулы HLA-DR+%, и В-лимфоцитов, экспрессировавших CD19+%, CD19+HLAII+% в течение первой недели после травмы было в пределах нормы или повышено, наиболее значительно при дальнейшем развитии сепсиса с достоверным различием показателей на 5-7 сутки (таблица 14). Напротив, абсолютное количество активированных лимфоцитов, особенно CD19+/мкл и CD19+HLAII+/мкл, в 1-е сутки было резко снижено. При этом самые низкие показатели определялись чаще у пациентов с травматическим шоком (75%) и ОДН (100%), у пострадавших с небактериальной СПОН (CD19+HLAII+: 20-55/мл; норма: 150-500/мл). На 3-7 сутки у 60-70% пострадавших независимо от клинической формы и течения ТБ абсолютное количество активированных лимфоцитов соответствовало нижней границе нормы, у остальных – по-прежнему оставалось низким.
Известно, что апоптоз является регулятором адаптивного иммунитета. Ряд исследователей апоптотическую реактивность лимфоцитов, определяемую по числу клеток, экспрессирующих мембранные Fas-рецепторы (CD95), рассматривает как маркер прогноза посттравматического сепсиса. По нашим данным, относительное число лимфоцитов, несших на своей мембране CD95, превышало верхнюю границу нормы у пострадавших с последующим сепсисом в среднем в 1,8 раза, без сепсиса – в 1,45 раза. При небактериальном СПОН CD95 (15-30%) был более чем в 2 раза выше нормы. Анализ (M±) показал, что количество CD95 более 15% в течение первых семи суток наблюдалось в основном при сепсисе. Между числом лимфоцитов с CD95 и сепсисом определялась сильная положительная корреляционная связь (1-е сутки: n = 20; = 1, 2 = 4, p<0,05; r = 0,89; 3-и сутки: n = 25; = 1, 2 = 3,9; p<0,05; r = 0,78). Таким образом, можно было считать, что CD95 может быть прогностическим признаком развития сепсиса и СПОН.
В ответ на травму наиболее резко увеличивалась продукция ИЛ-6, превышавшая норму в 1-е сутки в 8 раз независимо от клинического течения ТБ. На 3-и сутки после травмы при дальнейшем развитии сепсиса содержание ИЛ-6 в сыворотке крови оставалось на прежнем уровне (в 7 раз выше нормальных величин), а у пострадавших без сепсиса снижалось в 3 раза по отношению к исходным величинам.
Таблица 11
Уровни интерлейкина-6 в крови при травматической болезни
| Группы обследуемых | Сроки обследования (сутки) | ||||||
| 1 | 3 | 7 | 10 | 15 | 25 | ||
| общая группа | 64,9±15,4 n = 17 | 30,8±12,4 n = 25 | 20±5,5 n = 18 | 14±3,8 n = 11 | 25,5±9 n = 9 | 38,5±26,9 n = 4 | |
| с ЧМТ | 88,7±28 n = 5 | 18,2±5,5 n = 8 | 15,7±3,9 n = 6 | 20,4±4,6 n = 6 | _ | ||
| без ЧМТ | 55±8 n = 12 | 36,7±15,6 n = 17 | 32,2±6,3,n = 12 | 18,7±6,8 n = 14 | _ | ||
| с сепсисом | 65,7±13,8 n = 5 | 65,8±54,3 n = 7 | 20,2±2,3 n = 5 | 33,4±11,3 n = 11 | |||
| без сепсиса | 64,6±16 n = 12 | 18,9±3,2 n = 18 | 20,4±3 n = 14 | 14,2±8,8 n = 12 | |||
| умершие | 105,5± 37,45 n = 4 | 60,6±41,8 n = 8 | _ | _ | _ | ||
| выжив шие | 52,4±8,6 n = 13 | 32,3±2,2 n = 35 | _ | _ | _ | ||
| здоровые | 1,4 – 14 пг/мл | ||||||
– различие с данными 1-х суток достоверно (p<0,05);
– различие между группами достоверно (p<0,05).
Таблица 12
Уровни интерлейкина-8 в крови при травматической болезни
| Группы обследуемых | Сроки обследования (сутки) | |||||
| 1 | 3 | 7 | 10 | 15 | 25 | |
| общая группа | 28±6,5 n = 17 | 22,5±5,7 n = 25 | 27,2±9 n = 18 | 32±13,7 n = 11 | 46,9±22 n = 9 | 89,4±17,1 n = 6 |
| с ЧМТ | 30,8±6,6 n = 5 | 35,1±4,5n = 8 | 42,4±4,9 n = 6 | 40,5±8,8 n = 9 | ||
| без ЧМТ | 26,8±6,4 n = 12 | 16,6±6,25 n = 17 | 19,6±11 n = 12 | 24,4±21,9 n = 17 | ||
| с сепсисом | 8,38±0,5 n = 5 | 19,8±3 n = 7 | 23,7± 4,77 n = 9 | 76,9±20,4, n = 14 | ||
| без сепсиса | 28±9 n = 12 | 23,6±5,7 n = 18 | 28,5±10,6 n = 13 | 19,4±13,8 n = 12 | ||
| умершие | 38,6±10,6 n = 4 | 20,6±10,4 n = 4 | 21,6±12,4 n = 4 | - | ||
| выжившие | 20,1±5,2 n = 13 | 22,9±4,8 n = 21 | 28,8±8 n = 14 | - | ||
| здоровые | 30 пг/мл | |||||
– различие с данными 1-х суток достоверно (p<0,05);
– различие между группами достоверно (p<0,05).
Таблица 13
Уровни интерлейкина-10 в крови при травматической болезни
| Группы обследуемых | Сроки обследования (сутки) | |||||
| 1 | 3 | 7 | 10 | 15 | 25 | |
| общая группа | 24,4±7,36 n = 17 | 4,4±0,9 n = 25 | 3,6±0,95 n = 18 | 3,47±1 n = 11 | 4,35±1,4 n = 9 | 4,55±1,9 n = 6 |
| с ЧМТ | 18,7±7,1 n = 5 | 3,25±0,7 n = 8 | 3,5±0,48 n = 11 | _ | ||
| без ЧМТ | 26,8±7,2 n = 12 | 4,9±0,85 n = 17 | 3,5±1,26 n = 18 | _ | ||
| с сепсисом | 6,7±0,9 n = 5 | 6,25±3 n = 7 | 3,8±0,56 n = 9 | 3,85±1,16 n = 10 | ||
| без сепсиса | 26,2±9,2 n = 12 | 3,67±0,75 n = 18 | 3,4±1,1 n = 20 | 5,55±0,14 n = 5 | ||
| умершие | 30,55±17,4 n = 4 | 6,85±0,67 n = 4 | 5,7±0,96 n = 5 | _ | ||
| выжившие | 22,5±4,27 n = 13 | 3,9±0,94 n = 21 | 3,1±0,97 n = 24 | _ | ||
| здоровые | 0 пг/мл | |||||
– различие с данными 1-х суток достоверно (p<0,05);
– различие между группами достоверно (p<0,05).
Таблица 14
Функциональная активность клеточного иммунитета и ФНО (M±m)
при политравме
| Показатель | Норма | Сроки обследования (сутки) | ||
| 1 | 3 | 5-7 | ||
| CD14+ % | 80-90 | 59,5±6,2 71,6±4,0 | 65,3±9,9 68,0±6,0 | 30,0±4.6*,** 55,5±6,8 |
| CD14+ HLAII+ % | >85 | 37,4±12,8 38,1±1,67 | 37,5±11,3 39,3±2,2 | 31,1±3,6** 45,8±4,1 |
| HLADR+ (% лимфоцит.) | 6-22 | 24,9±3,8 19,5±2 | 25,3±1,46 20,6±2,38 | 24,8±3,1** 17,8±1,2 |
| CD 95 (% лимфоцит.) | 2-7 | 13,0±3,3 10,5±1,4 | 12,3±3,8 10,3±1,5 | 12,1±2,5 11,0±1,0 |
| CD 19+% | 6-18 | 20,0±4,1 14,6±2,3 | 19,9±2,6 16,5±2,3 | 24,8±4,1** 14,9±1,8 |
| CD19+ HLAII+ % | 6-18 | 20,0±4,0 14,3±2,3 | 19,5±2,6 16,5±2,9 | 24,9±4,2** 14,6±1,8 |
| ФНО спонт. пг/мл | 0-50 | 73,6±21,6 89,9±14,9 | 49,6±8,1 55,9±18,4 | 183,5±41,4** 44±8,4* |
| ФНО инд. пг/мл | 500-1500 | 201,0±97,5 238,0±28,0 | 207,9±45,6 211,2±50,2 | 360,0±54** 610.8±101,4* |
| ФНО сыв. пг/мл | 0-50 | 28,9±10,8 95,8±16,4 | 28,3±10,2 30,5±19,8* | 23,7±6,4 24,6±5,2* |
числитель – данные у пострадавших при сепсисе (n = 11);
знаменатель – данные у пострадавших без сепсиса (n = 16);
* – различие с данными 1-х суток достоверно (p<0,05);
** – различие между группами достоверно (p<0,05).
Средний уровень ИЛ-8 в сыворотке крови в первую неделю после травмы незначительно превышал нормальные значения (28+6,5 пг/мл; норма: 30 пг/мл), в период развития инфекционных висцеральных осложнений это превышение было наиболее выражено (76,9±20,4 пг/мл; норма: 30 пг/мл; p<0,05). Однако из-за большой амплитуды значения ИЛ-8, по нашему мнению, не могут иметь значимой прогностической ценности.
Между ИЛ-6 (r = 0,79), ИЛ-8 (r = 0,56) и ИЛ-10 в 1-е сутки после травмы определялась сильная прямая корреляционная связь. Однако уже с 3-х суток и в последующем наблюдался дисбаланс про- и противовоспалительных цитокинов с превышением провоспалительных цитокинов. При сепсисе резкое преобладание провоспалительных цитокинов отмечалось уже с 1-х суток, детерминирующее, вероятно, в последующем развитие генерализованных инфекционных осложнений.
Оценка ФНО показала его низкую информативность в прогностическом и диагностическом отношении. Возможно, это обусловлено широкими колебаниями его уровней даже у здоровых людей: спонтанная активность и содержание в сыворотке крови от 0 до 50 пг/мл, индуцированная активность – от 500 до 1500 пг/мл. Независимо от наличия тяжелого сепсиса величина спонтанной активности ФНО в сыворотке крови находилась в пределах 2-330 пг/мл, ex vivo LPS-индуцированная активность – пролонгированно резко снижалась. При летальном исходе от сепсиса отмечались наиболее низкие величины индуцированного ФНО.
Результаты исследования показали также что, чем тяжелее травма, тем более значимым были снижение числа моноцитов, экспрессировавших CD14+% и CD14+HLAII+% (r = -0,21), и повышение в крови маркеров активации эндотелия и цитокинов (“ВПХ-П”: эндотелины, ФНО, ИЛ-6, ИЛ-8, ИЛ-10; n = 20; r = 0,21-0,28). Изменения моноцитарной функции (n = 19; r = -0,58), относительного количества лимфоцитов с CD95 (n = 19; r = 0,28), содержания в сыворотке крови ИЛ-6 (n = 15; r = 0,62), ФНО (n = 19; r = -0,22) были связаны также с величиной кровопотери.
Уровень ИЛ-10 в сыворотке крови менее 10 пг/мл в 1-е сутки после травмы предполагал последующее развитие сепсиса, СПОН.
На 3-и сутки после травмы в качестве прогноcтического критерия развития сепсиса, СПОН служили следующие показатели: число моноцитов, экспрессирующих CD14+, менее 58%, CD14+ HLAII+ % – менее 31%; CD95 – более 15%, в сыворотке крови ИЛ 6 – более 45пг/мл и эндотелина – более 1,4 фмоль/мл.
Достоверные различия средних величин показателей иммуномониторинга в зависимости от клинического течения травматической болезни отмечались только с 5-7 суток после травмы и служили прогнозом последующего сепсиса, СПОН и ранним диагностическим признаком уже имевшегося сепсиса, СПОН (например, CD14+, CD14+ HLAII+ менее 40%).
РАННЯЯ ДИАГНОСТИКА СИНДРОМА ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ И ВИСЦЕРАЛЬНЫХ ОСЛОЖНЕНИЙ.
Разработка алгоритма ранней диагностики синдрома полиорганной недостаточности и висцеральных осложнений у пострадавших при травматической болезни.
Этот алгоритм включал ряд последовательных шагов:
- Формирование целевой группы пострадавших с тяжелой травмой.
- Выбор показателей (критериев) отклика.
- Отбор показателей функционального состояния организма, изменение которых влияет на отклики.
- Исследование отобранных показателей функционирования жизненно-важных систем организма в совокупности, то есть изучение корреляционной матрицы, выделение корреляционных плеяд, проведение факторного анализа. Исключение тех показателей, которые почти полностью определяются остальными.
- Построение линейной шкалы с помощью модели многомерной линейной регрессии. Определение коэффициентов регрессии.
- Ранжирование показателей и определение бальной градации каждого из них и шкалы в целом.
С целью упрощения практического использования шкалы, полученные коэффициенты были преобразованы в целые числа округлением до 0,5 и умножением на 33 и вычитанием 1, что позволило градировать значения признаков в интервале от 1 до 9.
Исходя из четырех типов течения травматической болезни, все пациенты были условно разделены на 4 группы по следующим показателям-откликам: 1 – выжил без осложнений (не осложненное течение ТБ), 2 – выжил с осложнениями (осложненное течение ТБ с выздоровлением), 3 – умер с осложнениями (осложненное течение ТБ с летальным исходом) и 4 – умер без осложнений (неблагоприятное течение ТБ с быстро развившимся летальным исходом). По t-критерию Стъюдента были определены однородность и различия показателей четырех выборок друг от друга на генеральном уровне. Построена линейная шкала с помощью модели многомерной линейной регрессии. В дальнейшем показатели были ранжированы и определена бальная градация каждого признака.
Были отобраны 41 показатель, позволявших оценить степень компенсации основных систем жизнеобеспечения пострадавшего с учетом мероприятий интенсивной терапии, которые хорошо описывали критерий – тип течения травматической болезни (показатель-отклик). Проведенный дисперсионный анализ показал, что отобранные показатели позволяли с высокой точностью (87,8%) предсказать значение показателя-отклика – тип течения травматической болезни. При этом было отмечено, что наибольшая точность предсказания, соответствует крайним типам течения ТБ – не осложненному и неблагоприятному с быстро развившимся летальным исходом (91,9% и 90,2% соответственно). В то же время общая величина ошибки прогноза течения ТБ (ложноположительные и ложноотрицательные значения) практически была одинаковая (5,9% и 6,3% соответственно).
Отобранные показатели были сгруппированы по принципу характеристики функционирования органа/системы и диагностики висцерального осложнения: центральная нервная система, сердечно-сосудистая система (гемодинимика), дыхательная система (транспорт газов), пищеварительная, выделительная, система крови и гемостаза, иммунный статус и функция эндотелия кровеносных сосудов, эндотоксикоз, синдром системного воспалительного ответа (ССВО) и сепсис (таблица 15).
Показатели были ранжированы по основным органам и системам организма. Разработанной шкале присвоена аббревиатура “ВПХ-ВПТ–РД” (ВПХ – кафедра военно-полевой хирургии, ВПТ – кафедра военно-полевой терапии, РД – ранняя диагностика СПОН и висцеральных осложнений у пострадавших в специализированном центре по лечению тяжелой травмы).
При отборе признаков и их градации учитывались современные подходы к диагностике основных синдромов, состояний и осложнений травматической болезни, как вариант функционального ответа организма пострадавшего на травму. Курсивом обозначены градации показателей, позволявшие диагностировать синдром острого повреждения легких и его крайнюю форму – ОРДС, жирным шрифтом выделены градации показателей, характеризовавшие ССВО и сепсиса. Таким образом, показатели шкалы позволяли диагностировать следующие синдромы: ССВО, СОПЛ, эндотоксикоза, СПОН.
Исходя из современной классификации недостаточности органов и систем, а также диагностики ССВО, сепсиса и синдрома эндотоксикоза, после градации и ранжирования признаков, вошедших в систему ранней диагностики СПОН и висцеральных осложнений у пострадавших при травматической болезни “ВПХ-ВПТ–РД”, были определены количественные границы в баллах состояния компенсации, субкомпенсации (дисфункции) и декомпенсации (недостаточности) для каждой функциональной системы организма (таблица 16).
Таблица 15
Шкала “ВПХ-ВПТ-РД”
| № п/п | Показатель и его градация | Балл |
| 1 | 2 | 3 |
| 1 | ЦНС Баллы шкалы ком Глазго | |
| 14-15 – ясное сознание | 1 | |
| 11-13 – оглушение | 3 | |
| 8-10 – сопор | 6 | |
| 5-7 – поверхностная кома | 8 | |
| 3-4 – глубокая кома | 9 | |
| СЕРДЕЧНО-СОСУДИСТАЯ СИСТЕМА, ГЕМОДИНАМИКА | ||
| 2 | Характер пульса | |
| нет аритмии | 1 | |
| есть аритмия | 6 | |
| 3 | Частота пульса (ударов в минуту) | |
| 60-90 | 1 | |
| 91-140 | 5 | |
| менее 60 или более 140 | 7 | |
| не определяется на периферических артериях | 8 | |
| не определяется на центральных артериях | 9 | |
| 4 | Систолическое АД (мм рт.ст.) | |
| более 100 | 1 | |
| 81-100 | 4 | |
| 61-80 | 8 | |
| 60 и менее | 9 | |
| 5 | Изменение зубца Т и сегмента ST на ЭКГ | |
| нет изменений | 1 | |
| сглаженность, двухфазность, отрицательность зубца Т диффузного характера | 4 | |
| элевация, депрессия сегмента ST | 8 | |
| 6 | Нарушения ритма и проводимости на ЭКГ | |
| нет нарушений | 1 | |
| полная блокада ножек пучка Гиса | 5 | |
| фибрилляция предсердий, парная и/или групповая желудочковая экстрасистолия | 8 | |
| 7 | Органические и функциональные изменения по данным ЭхоКГ | |
| нет изменений | 1 | |
| дилатация левого желудочка | 5 | |
| митральная и (или) трикуспидальная регургитация | 6 | |
| локальные зоны гипокинезии миокарда | 9 | |
| 8 | Фракция выброса по данным ЭхоКГ (%) | |
| более 60 | 1 | |
| 60-40 | 5 | |
| менее 40 | 9 | |
| 9 | Ударный индекс (мл/м2) по данным ИРГТ | |
| более 40 | 1 | |
| 28-40 | 3 | |
| менее 28 | 5 | |
| 10 | Инотропная поддержка (дофамин более 5 мкг*кг/мин) | |
| не проводится | 1 | |
| проводится | 8 |
Таблица 15
| 1 | 2 | 3 |
| ДЫХАТЕЛЬНАЯ СИСТЕМА, ТРАНСПОРТ ГАЗОВ | ||
| 11 | Характер внешнего дыхания | |
| Нормальное | 1 | |
| частое (более 20 в 1 мин.) | 6 | |
| патологический ритм | 9 | |
| ВВЛ | 6 | |
| ИВЛ | 9 | |
| 12 | Аускультация легких | |
| везикулярное | 1 | |
| жесткое | 3 | |
| ослабленное | 5 | |
| влажные хрипы | 9 | |
| Газовый состав крови | ||
| 13 | РаО2/FiО2 | |
| более 300 | 1 | |
| 150-300 | 4 | |
| менее 150 | 8 | |
| 14 | HbО2а (%) | |
| более 94 | 1 | |
| 93-90 | 5 | |
| менее 90 | 9 | |
| 15 | РаСО2 (мм рт.ст.) | |
| 32 –50 | 1 | |
| 50 – 60 | 2 | |
| более 60 или менее 32 | 4 | |
| ФУНКЦИЯ ПЕЧЕНИ, ЖКТ | ||
| 16 | Шумы кишечной перистальтики | |
| отчетливые | 1 | |
| ослаблены | 3 | |
| отсутствуют | 5 | |
| 17 | ГГТП (ммоль/л) | |
| 11-63 | 1 | |
| более 63 | 4 | |
| 18 | Общий билирубин (ммоль/л) | |
| 20,5 и менее | 1 | |
| более 20,5 | 4 | |
| 19 | Общий белок ( г/л ) | |
| более 60 | 1 | |
| 60 – 50 | 3 | |
| менее 50 | 5 | |
| ФУНКЦИЯ ПОЧЕК | ||
| 20 | Диурез почасовой (мл/час) | |
| более 60 | 1 | |
| менее 60 | 3 | |
| 21 | Креатинин (ммоль/л) | |
| 0,14 и менее | 1 | |
| более 0,14 | 3 | |
| 22 | Мочевина (ммоль/л) | |
| 8,3 и менее | 1 | |
| более 8,3 | 3 |
Продолжение таблицы 15
| 1 | 2 | 3 |
| СИСТЕМА КРОВИ И ГЕМОСТАЗА | ||
| 23 | Эритроциты крови (х 1012/л) | |
| более 3,0 | 1 | |
| 3,0-2,6 | 5 | |
| менее 2,6 | 9 | |
| 24 | Тромбоциты (х109/л) | |
| более 250 | 1 | |
| 150-200 | 3 | |
| менее 150 | 5 | |
| 25 | Фибриноген (г/л) | |
| 2,3-4,0 | 1 | |
| менее 2,3 или более 4,0 | 3 | |
| 26 | D-димер (мкг/мл) | |
| менее 0,5 | 1 | |
| более 1,5 | 5 | |
| 27 | Протромбиновый индекс (%) | |
| 80-105 | 1 | |
| менее 80 или более 105 | 3 | |
| 28 | Время свертывания по Ли-Уайту (мин.) | |
| 5-12 | 1 | |
| 12-16 | 3 | |
| менее 5 | 5 | |
| более 16 | 8 | |
| ИММУННЫЙ СТАТУС И ФУНКЦИЯ ЭНДОТЕЛИЯ КРОВЕНОСНЫХ СОСУДОВ | ||
| 29 | С-реактивный белок (мг/л) | |
| менее 6 | 1 | |
| 6-40 | 3 | |
| более 40 | 5 | |
| 30 | CD14+ (%) | |
| 80-90 | 1 | |
| менее 60 | 3 | |
| менее 40 | 5 | |
| 31 | CD14+ HLAII+ (%) | |
| более 85 | 1 | |
| менее 50 | 3 | |
| менее 35 | 5 | |
| 32 | CD 95 (%) | |
| 2-7 | 1 | |
| более 10 | 3 | |
| более 15 | 5 | |
| 33 | ИЛ-6 (пг/мл) | |
| менее 12 | 1 | |
| более 25 | 3 | |
| более 45 | 5 | |
| 34 | ИЛ-10 (пг/мл) | |
| менее 30 | 1 | |
| менее 10 | 3 | |
| 35 | Эндотелин (фмоль/мл) | |
| менее 0,46 | 1 | |
| более 0,6 | 3 | |
| более 0,8 | 5 |
Продолжение таблицы 15
| 1 | 2 | 3 |
| ЭНДОТОКСИКОЗ | ||
| 36 | Средние молекулы, 254 и (или) 280 нм, (кратность увеличения по сравнению с нормой) | |
| х 1 | 1 | |
| х 2 | 3 | |
| х 3 | 5 | |
| х 4 и более | 7 | |
| 37 | Индекс интоксикации мочи | |
| БОЛЬШЕ индекса интоксикации крови | 1 | |
| РАВЕН индексу интоксикации крови или МЕНЬШЕ его на 50 и менее % | 4 | |
| МЕНЬШЕ индекса интоксикации крови на 50 и более % | 9 | |
| СИНДРОМ СИСТЕМНОГО ВОСПАЛИТЕЛЬНОГО ОТВЕТА | ||
| 38 | Температура тела (0С) | |
| 35,9-37,0 | 1 | |
| 37,1-38,0 | 2 | |
| менее 35,9 или более 38,0 | 3 | |
| 39 | Лейкоциты крови (х109/л) | |
| 4,0 - 8,0 | 1 | |
| 8,1 - 12,0 | 3 | |
| более 12,0 или менее 4,0 | 4 | |
| 40 | Палочкоядерные лейкоциты (%) | |
| менее 10 | 1 | |
| 11 – 20 | 2 | |
| более 20 | 4 | |
| 41 | Бактериемия | |
| не определяется, и нет явно инфекционного очага | 1 | |
| определяется, и/или явно есть инфекционный очаг | 5 |
Таблица 16
Количественные границы компенсации, субкомпенсации и декомпенсации функциональных систем и органов
| Уровень функциони рования | Система / орган / осложнение | ||||||||
| ЦНС | ССС/ ГД | ДС/ СТГ | Ф ЖКТ | ФПо | СКр и Г | ИмС и Эн | ЭТ | ССВО, сепсис | |
| Компенсация | 1-3 | 9-21 | 4-16 | 4-9 | 3 | 6-14 | 6-10 | 2-4 | 9-11 (ССВО) > 14 (сепсис) |
| Субкомпенсация | 6 | 22-39 | 17-26 | 11-16 | 4-7 | 15-24 | 11-21 | 5-10 | |
| Декомпенсация | 8-9 | 40-54 | 27-40 | 18 | 9 | 25-32 | 22-28 | 11-16 | |
Для конвертации индекса тяжести состояния по шкале “ВПХ-ВПТ–РД” в традиционные градации тяжести состояния методом дисперсионного анализа были определены количественные его границы с учетом вероятности летального исхода и развития висцеральных осложнений. Принципиально тяжесть состояния может быть оценена количественным индексом, и не нуждается в дополнительной интерпретации. Приведение индексов тяжести к соответствию с общепринятыми градациями состояния обусловлено широким распространением этих понятий в повседневной врачебной деятельности, с одной стороны, и отсутствием четких критериев их определения, а, следовательно, и единства трактовки, с другой. В соответствии с этим, удовлетворительным считалось такое состояние пострадавших, при котором исключалась вероятность развития летального исхода и висцеральных осложнений в ближайшие сутки травматической болезни. К средней тяжести отнесены состояния, при которых вероятность развития летальных исходов не превышала 7,5%, а висцеральных осложнений травмы – 27,0%. При тяжелом и крайне тяжелом состоянии эти показатели составили 35,0% и 75,0% для летальности, 62,0% и 86,0% для вероятности развития висцеральных осложнений соответственно. Критическим считалось состояние, сопровождавшееся 100,0% летальностью. Результаты дисперсионного анализа приведены в таблице 17, в которой округлением максимальных и минимальных значений до целых определены количественные границы индекса тяжести состояния по шкале “ВПХ-ВПТ–РД”.
Таблица 17
Количественные границы индекса “ВПХ-ВПТ–РД”
для традиционной градации тяжести состояния
| Традиционные градации | Баллы “ВПХ-ВПТ–РД” | Летальность | Висцеральные осложнения |
| Удовлетворительное | 27-32 | 0% | 0% |
| Средней тяжести | 33-49 | < 7,5 % | < 27,5 % |
| Тяжелое | 50-69 | < 32 % | < 62,7 % |
| Крайне тяжелое | 70-98 | < 75 % | < 86,3 % |
| Критическое | > 99 | 100 % | > 98,2 % |
Для проверки надежности оценки тяжести состояния по системе “ВПХ-ВПТ–РД” все пациенты были разделены по тяжести состояния на пять групп: удовлетворительное, средней тяжести, тяжелое, крайне тяжелое, критическое. Надежность полученных интервалов индекса тяжести состояния по шкале “ВПХ-ВПТ–РД” для традиционной градации тяжести состояния была проверена путем анализа таблиц сопряженности реальных и предсказанных значений. Точность выделения группы пострадавших в удовлетворительном состоянии составила 89,4%, при этом лишь 10,6% попали ошибочно в группу с состоянием средней тяжести, что свидетельствовало о возможности гипердиагностики («утяжеления») состояния, у этой группы пациентов до уровня состояния «средней тяжести». В группе пострадавших «состояние средней тяжести» и «тяжелое» точность выделения соответствующих групп примерно одинаковая (94,6 и 94,2% соответственно). В то же время уровень гипо- и гипердиагностики в группе пациентов «состояние средней тяжести» находился на уровне 2,5 и 2,9%, а в группе «состояние тяжелое» 0,8 и 5,0% (3,7% ошибочно классифицированы в группу «крайне тяжелое» и 1,3% в группу «критическое»). Уровень гиподиагностики постепенно снижался с 2,5% (в группе «состояние средней тяжести») до 0,6% (в группе «состояние крайне тяжелое»). При оценке тяжести состояния с помощью шкалы “ВПХ-ВПТ–РД” был отмечен низкий уровень гиподиагностики, не превышавший 2,5% (для группы «состояние критическое», и не высокий уровень гипердиагностики, не превышавший 5,0% (для группы «состояние тяжелое»). Однако, чем выше уровень тяжести состояния (от удовлетворительного до критического) и, соответственно, больше индекс тяжести состояния “ВПХ-ВПТ–РД”, тем выше точность прогноза. Так, уровни тяжести состояний «крайне тяжелое» и «критическое» определены с точностью 96,8% и 97,5% соответственно.
Таким образом, отобранные показатели функционирования основных жизнеобеспечивающих систем организма с помощью логистической регрессии хорошо описывали критерий «тип течения ТБ» и с высокой точностью распределяли обучающую выборку по критерию «тяжесть состояния». Сформированная и ранжированная шкала “ВПХ-ВПТ–РД” может быть использована для оценки тяжести состояния на основе ранней диагностики СПОН и висцеральных осложнений у пострадавших с политравмой.
КЛИНИКО-ПАТОФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ТЕЧЕНИЯ ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ У ПОСТРАДАВШИХ С ПОЛИТРАВМОЙ НА ОСНОВЕ ШКАЛЫ “ВПХ-ВПТ–РД”. В настоящем исследовании использован новый подход к описанию динамики клинико-патофизиологических проявлений ТБ, основанный на интегральных показателях разработанной шкалы “ВПХ-ВПТ–РД”, которая предназначена для ранней диагностики СПОН и висцеральных осложнений у пострадавших с тяжелыми травмами в динамике ТБ. На основании описания динамики клинико-патофизиологических проявлений ТБ достоверно выделялись три временных интервала.
Первый интервал – с 1-х по 2-е сутки (конец первого – начало второго периода ТБ). В наибольшей степени вырос индекс эндотоксикоза, дыхательной системы (транспорта газов), системы крови и гемостаза. В остальных системах существенной динамики выявлено не было. Эти патофизиологические сдвиги соответствовали следующим клиническим проявлениям ТБ: у 68,3% пострадавших был диагностирован небактериальный ССВО, у 41,1% - СПОН, у 37,8% – неинфекционные висцеральные осложнения. Летальных исходов от ближайших последствий травм среди исследуемых пострадавших не было.
Второй интервал – с 3-х по 5-е сутки (третий период травматической болезни – максимальной вероятности развития висцеральных инфекционных осложнений). В наибольшей степени вырос индекс ССВО, далее по ухудшению динамики были индексы сердечно-сосудистой, дыхательной, выделительной и системы крови и гемостаза. ССВО был диагностирован у 69,7%, СПОН – у 45,1% пострадавших. Бронхолегочные висцеральные инфекционные осложнения развились в это время у максимального количества пациентов – у 28,9%, а 8,9% умерли в этот период от осложнений травм.
Третий интервал – с 8-х по 10–е сутки (третий период травматической болезни – максимальной вероятности развития генерализованных инфекционных осложнений). Как и во втором интервале, максимальный вклад, в ухудшение общего состояния пострадавших вносил индекс ССВО. Значимые изменения были отмечены в системах: дыхательной (транспорта газов), сердечно-сосудистой (гемодинамике) и крови (гемостаза). В этот интервал основным явлением в динамике ТБ было развитие генерализованных инфекционных осложнений. Они развились у 26,1% пострадавших: сепсис – 7,2%, тяжелый сепсис – 16,7% и септический шок – 2,2 %. Умерли от осложнений травм 12,8% пациентов.
Проведенное исследование, во-первых, продемонстрировало объективность выделения периодов ТБ, во-вторых, показало возможности мониторинга жизненно важных функций пострадавших с политравмой с помощью шкалы “ВПХ-ВПТ–РД”.
АПРОБАЦИЯ МЕТОДА РАННЕЙ ДИАГНОСТИКИ СИНДРОМА ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ И ВИСЦЕРАЛЬНЫХ ОСЛОЖНЕНИЙ У ПОСТРАДАВШИХ С ПОЛИТРАВМОЙ.
Для верификации разработанной шкалы “ВПХ-ВПТ–РД” было проведено ее сравнение с другими шкалами, которые позволяли определить тяжесть состояния посредством одних и тех же действий и операций, при этом хорошо зарекомендовавшими себя в практической работе. Для реализации этого была проведена верификация метода оценки тяжести состояния по шкале “ВПХ-ВПТ–РД” путем проверки ее валидности и надежности со шкалами “APACHE II” и “SAPS II”.
Определено, что шкала “ВПХ-ВПТ–РД” в наибольшей степени позволяла определить тяжесть состояния, поскольку ее оценка на 64,2% определялась фактором вклада этой шкалы (коэффициенты детерминации R2 (“ВПХ-ВПТ–РД”) = 0,642). При анализе надежности выявлено, что шкала “ВПХ-ВПТ–РД” имела сильную прямую достоверную корреляционную связь со шкалой “APACHE II”, и среднюю прямую достоверную корреляционную связь с методикой “SAPS II”.
С целью проверки эффективности шкалы “ВПХ-ВПТ–РД” в динамике ТБ у пострадавших с тяжелой травмой был выполнен двухфакторный дисперсионный анализ, в качестве факторов (показателей-откликов) рассмотрены исход травмы и вероятность развития висцеральных осложнений. Очевидно, что в динамике ТБ шкала-метод “ВПХ-ВПТ–РД” в наибольшей степени объясняла дисперсию показателей-откликов при достоверности различий меньше 0,01. При этом в первом периоде травматической болезни эффективность исследуемых шкал была приблизительно одинакова. Однако, во втором и третьем периодах эффективность шкалы “ВПХ-ВПТ–РД” в 1,5, а в четвертом периоде травматической болезни в 3 раза превышает эффективность систем “APACHE II” и “SAPS II”. Шкала “ВПХ-ВПТ–РД”ВПХ-прогноз была наиболее эффективна во втором, третьем и четвертом периодах ТБ. В этих периодах коэффициент детерминации был равен 0,085, 0,089 и 0,076 соответственно.
С целью дополнительной оценки качества, полученной модели оценки тяжести состояния по шкале “ВПХ-ВПТ–РД” методом дискриминантного анализа рассчитаны чувствительность, специфичность, безошибочность, ложноотрицательный и ложноположительный результаты для диагностики висцеральных осложнений (таблица 18) и вероятности летального исхода (таблица 19).
Таблица 18
Итоговая оценка качества прогноза развития висцеральных осложнений
по шкале “ВПХ-ВПТ–РД” (%, p<0,01)
| Сутки Характе- ристика модели | 1 | 3 | 5 | 7 | 10 | 15 | 25 | Итоговая оценка |
| Чувствительность | 93,4 | 96,9 | 92,9 | 87,3 | 90,6 | 95,5 | 93,7 | 92,9 |
| Специфичность | 39,8 | 78,6 | 70,6 | 82,4 | 73,3 | 79,5 | 81,4 | 72,2 |
| Безошибочность | 79,2 | 81,7 | 71,3 | 81,2 | 82,8 | 80,1 | 80,2 | 79,5 |
| Ошибка I рода | 6,6 | 3,1 | 7,1 | 12,7 | 9,4 | 4,5 | 6,3 | 7,1 |
| Ошибка II рода | 60,2 | 21,4 | 29,4 | 17,6 | 26,7 | 20,5 | 18,6 | 27,8 |
Специфичность (точность прогноза развития висцеральных осложнений) в первые сутки была не велика (39,8%), однако тот же показатель, оцененный на третьи сутки, возрастал в 2 раза (до 78,6%), и далее увеличивался до максимального значения на 7-е сутки лечения пострадавшего (82,4%). Несмотря на это, общая прогностическая ценность оценки вероятности развития висцеральных осложнений в динамике травматической болезни оставалась на высоком уровне (более 70%), итоговая оценка безошибочности составляла 79,5%. Чувствительность, как показатель, характеризовавший точность прогноза развития висцеральных осложнений, находился на высоком уровне, итоговая оценка составляла 92,9% при уровне достоверности p<0,001.
При анализе качества прогноза вероятности летального исхода (таблица 19) становится очевидным, что итоговая оценка общей прогностической ценности составляла 79,4%. Специфичность же увеличивалась в динамике наблюдения за состоянием пострадавших с 52,3 до 78,7% (итоговая оценка 70,3%). Чувствительность, как показатель, характеризовавший точность прогноза благоприятного исхода, находился на высоком уровне, итоговая оценка составляла 90,2% при уровне достоверности p<0,001.
Для оценки эффективности, применения метода “ВПХ-ВПТ–РД” был проведен дискриминантный анализ длительности ИВЛ, продолжительности лечения пациентов в ОИТ, летальности и частоты развития висцеральных осложнений в сопоставимых по тяжести травмы группах.
При анализе результатов применения метода “ВПХ-ВПТ–РД” достоверного уменьшения длительности проведения искусственной вентиляции легких в контролируемом режиме в группах пострадавших с средней степени тяжести травмой не отмечено (рис. 2). Однако в группах с тяжестью травмы тяжелая и крайне тяжелая имелось достоверное уменьшение сроков контролируемой вентиляции легких (на 77,6 ± 7,1 и на 56 ± 4,7 часов соответственно, р<0,05, рис. 2).
Таблица 19
Итоговая оценка качества прогноза летального исхода
по шкале “ВПХ-ВПТ–РД” (%, p<0,001)
| Сутки Характе- ристика модели | 1 | 3 | 5 | 7 | 10 | 15 | 25 | Итоговая оценка |
| Чувствительность | 93,2 | 89,7 | 92,9 | 87,3 | 90,6 | 95,1 | 95,5 | 90,2 |
| Специфичность | 52,3 | 56,5 | 77,9 | 81,2 | 78,7 | 78,8 | 78,9 | 70,3 |
| Безошибочность | 75,6 | 73,5 | 87,5 | 84,2 | 81,3 | 87,9 | 88,3 | 79,4 |
| Ошибка I рода | 6,7 | 10,2 | 7,0 | 12,7 | 9,3 | 4,9 | 4,4 | 9,7 |
| Ошибка II рода | 47,3 | 43,5 | 22,1 | 18,7 | 21,3 | 21,2 | 21,1 | 30,7 |
Рис. 2. Сроки проведения ИВЛ (часы) у пострадавших в зависимости от тяжести травмы
(здесь и далее № 1 – группа без “ВПХ-ВПТ–РД”, № 2 – группа с “ВПХ-ВПТ–РД”)
При анализе продолжительности лечения в отделении интенсивной терапии (рис. 3) в сравниваемых по тяжести травмы группах пострадавших имелась такая же закономерность – недостоверное уменьшение сроков лечения в группе с травмами средней тяжести и достоверное уменьшение при тяжелых и крайне тяжелых травмах (на 87±9,1 и 64±5,3 часов, p<0,05) в группе с “ВПХ-ВПТ–РД”.
Частота развития висцеральных осложнений в контрольной группе (с “ВПХ-ВПТ–РД”) уменьшилась (рис. 4). При этом в группах со средней и тяжелой травмами было отмечено достоверное снижение частоты развития висцеральных осложнений на 4,8% и 6,1% соответственно. Однако, у пострадавших с крайне тяжелыми травмами имелось достоверное увеличение частоты развития висцеральных осложнений в контрольной группе (с “ВПХ-ВПТ–РД”). Этот факт объяснялся тем, что применение метода “ВПХ-ВПТ–РД” позволяло не только объективно диагностировать такие осложнения, как ССВО, сепсис, СОПЛ, ДВС-синдром, но и количественно оценить значимость и удельный вклад каждого из осложнений в общую тяжесть состояния пострадавшего и в интегральную оценку тяжести травмы.
Рис. 3. Сроки лечения пострадавших в ОИТ (часы)
в зависимости от тяжести травмы
Рис. 4. Частота развития висцеральных осложнений (%)
у пострадавших в зависимости от тяжести травмы
Достоверное (p<0,05) увеличение частоты развития висцеральных осложнений в контрольной группе (с “ВПХ-ВПТ–РД”) на 2,3% – при крайне тяжелых травмах произошло преимущественно за счет генерализованных инфекционных осложнений и объяснялось тем, что летальность в данной группе достоверно снизилась и, соответственно, увеличился удельный вес пострадавших, которые в основной группе (без “ВПХ-ВПТ–РД”) погибали до развития у них этих осложнений или непосредственно от осложнений.
В результате применения дифференцированной лечебной тактики на основе шкалы “ВПХ-ВПТ–РД” летальность в контрольной группе (с “ВПХ-ВПТ–РД”) значимо снизилась (рис. 5).Для группы пострадавших со средней тяжестью травмы летальность снизилась на 1,1%, у пострадавших с тяжелой травмой – на 6,3%, в группе пострадавших с крайне тяжелой травмой этот показатель снизился на 9,0%.
Рис. 5. Летальность (%) в зависимости от тяжести травмы
В целом снижение летальности произошло в группах пострадавших с тяжестью травмы – «тяжелая» и «крайне тяжелая», и незначительно за счет группы с тяжестью травмы «средняя».
Таким образом, применение системы “ВПХ-ВПТ–РД” позволило уменьшить в сопоставимых по тяжести травмы группах пострадавших длительность искусственной вентиляции, продолжительность лечения в отделении интенсивной терапии, частоту развития висцеральных осложнений и летальность.
ВЫВОДЫ
1. Висцеральные осложнения выявляются у 92,8% пострадавших с политравмой, характер и частота их развития зависит от локализации, тяжести повреждений и тяжести состояния. Они диагностируются при травме груди и живота более чем в 90% случаев, а при других локализациях ведущего повреждения – у половины пострадавших.
2. Наиболее частыми нозологическими формами висцеральных осложнений при политравме являются постгеморрагическая анемия, миокардиодистрофия, пневмония. После тяжелой травмы в период острых нарушений жизненно важных функций (первые двенадцать часов) определяются первично-травматические повреждения внутренних органов (ушибы сердца, легких, почек). В период максимальной вероятности развития осложнений (чаще на третьи сутки) у пострадавших выявляются преимущественно висцеральные неинфекционные осложнения (миокардиодистрофия, нефропатия). Висцеральные инфекционные осложнения (пневмония, миокардит, пиелонефрит) и сепсис диагностируются с максимальной вероятностью развития на третьи-пятые и восьмые-десятые сутки лечения.
3. Синдром полиорганной недостаточности развивается у 84,5% пострадавших с политравмой. Его клиническая картина проявляется двумя вариантами: ранним (не бактериальным) в 44,0% случаев, возникающим в конце первых – начале вторых суток, и поздним (бактериальным) в 56,0% случаев, возникающему с третьих суток. В подавляющем большинстве случаев (71,6%) поздний синдром диагностируется на седьмые сутки после травмы.
4. Системный воспалительный ответ является неспецифическим защитным механизмом, развивающимся при травме независимо от ее тяжести и локализации. Для благоприятного течения травматической болезни (независимо от тяжести травмы) в периферической крови в первые 24 часа характерны умеренно повышенные уровни провоспалительных цитокинов (эндотелина, ИНФ, ФНО, ИЛ-6, ИЛ-8), а при неблагоприятном течении тяжелой травмы – наиболее высокие. Напротив, уровни противовоспалительных цитокинов (ИЛ-4, ИЛ-10) при менее тяжелой травме достоверно выше, чем при тяжелой травме и инфекционных осложнениях, что определяет прогноз и исходы травматической болезни. Уровни ИЛ-6, ИЛ-8, ИЛ-10, эндотелина имеют обратную корреляционную связь с величиной показателя срочной адаптации, количеством лимфоцитов, общего белка и прямую – с количеством нейтрофилов.
5. При наиболее тяжелой травме формирование системного воспалительного ответа в течение первых двух периодов травматической болезни сочетается с формированием выраженного вторичного иммунодефицита, что совпадает с развитием раннего синдрома полиорганной недостаточности. В тех случаях, когда с третьих суток после травмы (период максимальной вероятности развития осложнений) системный воспалительный ответ становится еще более выраженным, вторичный иммунодефицит также прогрессирует, что в совокупности углубляет нарушения резистентности организма, ведет к генерализации инфекции и развитию позднего синдрома полиорганной недостаточности.
6. Дисфункция эндотелия кровеносных сосудов является одним из основных факторов, способствующих прогрессированию системного воспалительного ответа при политравме. На фоне травматической болезни изменяются свойства эндотелия, что характеризуется повышением содержания эндотелина, оксида азота, растворимых сосудистых молекул клеточной адгезии и фактора Виллебранда, но снижением фибринолитического комплекса тканевого активатора плазминогена и его ингибитора, в результате чего возникают нарушения микроциркуляции и микрососудистый тромбоз. Эти нарушения также участвуют в патогенезе полиорганной недостаточности у пострадавших.
7. Мониторинг состояния иммунной системы и функции эндотелия кровеносных сосудов дополняет традиционные клинико-лабораторные и инструментальные исследования у пострадавших и позволяет с большей вероятностью оценивать риск развития синдрома полиорганной недостаточности, осуществлять его раннюю диагностику, контроль эффективности лечения, а также прогнозировать исход. Наиболее информативными показателями являются изменения популяций моноцитов CD14+ и CD14+ HLAII+%, лимфоцитов CD95, уровни С-реактивного белка, ИЛ-6, ИЛ-10 и эндотелина в сыворотке крови.
8. Разработанная шкала “ВПХ-ВПТ–РД” позволяет с высоким уровнем точности прогнозировать развитие висцеральных осложнений и летальных исходов при политравме в 79,5% и 79,4% случаях соответственно. С помощью этой шкалы имеется возможность интегральной оценки недостаточности функций основных систем организма у пострадавших с тяжелой травмой в динамике травматической болезни. Шкала позволяет осуществлять функциональный мониторинг с количественной оценкой нарушений центральной нервной, сердечно-сосудистой, дыхательной, пищеварительной, мочевыделительной, иммунной систем, системы крови и гемостаза, а также отдельных синдромов: эндотоксикоза, острого респираторного дистресс-синдрома, системного воспалительного ответа и сепсиса.
9. Терапия, основанная на ранней диагностике с применением шкалы “ВПХ-ВПТ–РД” в сопоставимых по тяжести группах пострадавших, позволяет уменьшить длительность искусственной вентиляции легких у пациентов с тяжелой (на 77,6±7,1 часов) и крайне тяжелой травмой (на 56±4,7 часов); а также продолжительность лечения в отделении интенсивной терапии (на 87±9,1 часов и на 64±5,3 часов соответственно). При этом частота развития висцеральных осложнений у пострадавших с травмой средней тяжести и с тяжелой травмой снижается на 4,8% и 6,1%, а летальность у пациентов с тяжелой и крайне тяжелой травмой – 6,3% и 9,0% соответственно.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Для своевременной диагностики и обеспечения полноценного лечения висцеральных осложнений у пострадавших с политравмой наряду с традиционными (стандартными) методами, необходимо проведение комплексного лабораторно-инструментального обследования в динамике травматической болезни с обязательным участием в лечебно-диагностическом процессе терапевта.
2. Поскольку у пострадавших с политравмой с третьих по десятые сутки развивается наибольшее количество (более 70%) висцеральных осложнений, которые часто являются причиной летального исхода (у 32,2%), в этом периоде оперативные вмешательства должны осуществляться по ограниченным (жизненно важным) показаниям.
3. Для повышения эффективности и оптимизации лечебной тактики у пострадавших с тяжелой травмой необходимо включить в систему объективной оценки тяжести травм шкалу “ВПХ-ВПТ–РД”. Ее целесообразно использовать ежедневно с первых суток лечения в отделении интенсивной терапии до полной стабилизации жизненно важных функций организма, то есть до четвертого периода травматической болезни.
4. Мониторинг состояния иммунной системы и функции эндотелия кровеносных сосудов позволяет с большей вероятностью определять риск развития синдрома полиорганной недостаточности у пострадавших с политравмой. Прогностическими критериями являются снижение уровня в сыворотке крови ИЛ-10 менее 10 пг/мл, количества моноцитов CD14+ и CD14+ HLAII+% менее 58% и 35% соответственно, повышение содержания в сыворотке крови ИЛ-6 и эндотелина более 45 пг/мл и 0,8 фмоль/мл соответственно, количества лимфоцитов CD95 более 15%. Их исследование целесообразно осуществлять на первые, третьи и седьмые сутки после травмы.
5. При селективной оценке степени нарушений функционирования отдельных органов и систем организма следует ориентироваться на следующие количественные границы фаз компенсации, субкомпенсации и декомпенсации. Оценка сердечно-сосудистой системы: 9-21 баллов, 22-39 баллов, 40-54 баллов соответственно. Дыхательная система: 4-16 баллов, 17-26 баллов, 27-40 баллов. Пищеварительная система: 4-9 баллов, 11-16 баллов, 18 баллов. Мочевыделительная система: 3 балла, 4-7 баллов, 9 баллов. Система крови и гемостаза: 6-14 баллов, 15-24 баллов, 25-32 баллов. Иммунная система и функция эндотелия кровеносных сосудов: 6-10 баллов, 11-21 баллов, 22-28 баллов. Выраженность синдрома эндотоксикоза: 2-4 баллов, 5-10 баллов, 11-16 баллов. Синдром системного воспалительного ответа диагностируется при значении 9-11 баллов, а сепсис – более 14 баллов.
6. Для определения степени тяжести общего состояния пострадавших с политравмой целесообразно после расчета индекса шкалы “ВПХ-ВПТ–РД” выделять следующие количественные градации: до 45 баллов – удовлетворительное состояние (компенсация), вероятность развития висцеральных осложнений и летальность 0%; от 46 до 69 баллов средней тяжести (субкомпенсация), вероятность развития висцеральных осложнений < 7,5% и летальность < 27,5%; от 70 до 99 баллов – состояние тяжелое (субкомпенсация), вероятность развития висцеральных осложнений < 32% и летальность < 62,7%; крайне тяжелое и критическое (декомпенсация) от 100 до 119 баллов и выше 119 баллов соответственно, вероятность развития висцеральных осложнений < 75% и 100%, летальность < 86,3% и 100% соответственно.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Гайдук С.В. К проблеме висцеральной патологии при травматической болезни / С.В. Гайдук // Всеармейская научно-практическая конференция «Медицинские последствия экстремальных воздействий на организм». – СПб., 2000. – С. 36-43.
2. Гайдук С.В. Травматическая миокардиодистрофия как проявление повреждения сердца при травматической болезни / С.В. Гайдук, Э.В. Пашковский // Всеармейская научно-практическая конференция «Медицинские последствия экстремальных воздействий на организм». – СПб., 2000. – С. 212.
3. Пашковский Э.В. Особенности изменения центральной гемодинамики у пострадавших с различным характером повреждений / Э.В. Пашковский, С.В. Гайдук // Всеармейская научно-практическая конференция «Медицинские последствия экстремальных воздействий на организм». – СПб., 2000. – С. 212-214.
4..Пашковский Э.В. К вопросу диагностики нарушений центральной гемодинамики при травматической болезни / Э.В. Пашковский, С.В. Гайдук // Всеармейская научно-практическая конференция «Медицинские последствия экстремальных воздействий на организм». – СПб., 2000. – С. 263-264.
5. Сосюкин А.Е. Патология внутренних органов у раненых в локальной войне / А.Е. Сосюкин, В.А. Гайдук, С.В. Гайдук // Всеармейская научно-практическая конференция «Медицинские последствия экстремальных воздействий на организм». – СПб., 2000. – С. 284-285.
6. Гайдук С.В. Состояние сердечно-сосудистой системы при травматической болезни / С.В. Гайдук // Всеармейская научно-практическая конференция «Особенности оказания медицинской помощи и лечения раненых и больных с боевой хирургической и терапевтической травмой в локальных войнах и вооруженных конфликтах». – СПб., 2000. – С. 31-38.
7. Гайдук В.А. К вопросу об анемии у раненых / В.А. Гайдук, В.П. Ретунских, С.В. Гайдук // Всеармейская научно-практическая конференция «Особенности оказания медицинской помощи и лечения раненых и больных с боевой хирургической и терапевтической травмой в локальных войнах и вооруженных конфликтах». – СПб., 2000. – С. 126-127.
8. Гайдук С.В. К вопросу диагностики ушиба сердца при минно-взрывной травме / С.В. Гайдук, Ю.Н. Фокин // Всеармейская научно-практическая конференция «Особенности оказания медицинской помощи и лечения раненых и больных с боевой хирургической и терапевтической травмой в локальных войнах и вооруженных конфликтах». – СПб., 2000. – С. 127-128.
9. Борисов М.Б. Особенности изменений показателей липидного обмена при тяжелой сочетанной травме / М.Б. Борисов, А.В. Гончаров, С.В. Гайдук // Международная конференция, посвященной 75-летию со дня рождения А.М. Уголева «Механизмы функционирования висцеральных систем». – СПб., 2001. – С. 42. (соавт. Борисов М.Б., Гончаров А.В.).
10. Гайдук С.В. Клиника и диагностика ушиба сердца при травматической болезни / С.В. Гайдук, Э.В. Пашковский, С.Н. Калинина, А.В. Гончаров, М.Б. Борисов, О.Ю. Саватеева // Международная конференция, посвященной 75-летию со дня рождения А.М. Уголева «Механизмы функционирования висцеральных систем». – СПб., 2001. – С. 73-74.
11. Гончаров А.В. Характеристика показателей центральной гемодинамики у пострадавших с тяжелой сочетанной травмой в остром периоде травматической болезни / А.В. Гончаров, Э.В. Пашковский, С.В. Гайдук, М.Б. Борисов, О.Ю. Саватеева // Международная конференция, посвященной 75-летию со дня рождения А.М. Уголева «Механизмы функционирования висцеральных систем». – СПб., 2001. – С. 85-86.
12. Пашковский Э.В. Состояние центральной гемодинамики у пострадавших с тяжелой сочетанной травмой / Э.В. Пашковский, А.В. Гончаров, С.В. Гайдук, В.Д. Куликов, Н.Г. Завалина // Международный российско-германский научно-практический симпозиум «Хирургия повреждений мирного и военного времени». – М.: ГИУВ МО РФ, 2001. – С. 75-76.
13. Гайдук С.В. К проблеме диагностики ушиба сердца при тяжелой сочетанной травме / С.В. Гайдук, С.Н. Калинина // V Всероссийская научно-практическая конференция «Актуальные вопросы диагностики и лечения в многопрофильном лечебном учреждении». – СПб., 2001. – С. 45.
14. Сосюкин А.Е. Патология сердца у раненых в Чечне / А.Е. Сосюкин, В.А. Гайдук, С.В. Гайдук // V Всероссийская научно-практическая конференция «Актуальные вопросы диагностики и лечения в многопрофильном лечебном учреждении». – СПб., 2001. – С. 45.
15. Пашковский Э.В. Состояние центральной гемодинамики при травматической болезни / Э.В. Пашковский, А.В. Гончаров, С.В. Гайдук // Вестник хирургии. – 2001.- Т. 160, № 5. – С. 109-113.
16. Пашковский Э.В. Характер и причины изменений центральной гемодинамики у пострадавших с тяжелой сочетанной травмой / Э.В. Пашковский, С.В. Гайдук, А.В. Гончаров // Всероссийская научная конференция “Актуальные проблемы современной тяжелой травмы”– СПб., 2001. – C. 91-92.
17. Сосюкин А.Е. Данные эхокардиографического обследования пострадавших с тяжелой сочетанной травмой / А.Е. Сосюкин, С.В. Гайдук, К.А. Одинак, О.И. Рябова // Всероссийская научная конференция “Актуальные проблемы современной тяжелой травмы”. – СПб., 2001. – C. 115-116.
18. Сосюкин А.Е. К проблеме диагностики посттравматической миокардиодистрофии / А.Е. Сосюкин, С.В. Гайдук, Э.В. Пашковский, С.Н. Калинина // Всероссийская научная конференция “Актуальные проблемы современной тяжелой травмы”. – СПб., 2001. – C. 116. 19. Сосюкин А.Е. Особенности механизмов нарушений и компенсации минутного объема сердца у пострадавших с различными степенями недостаточности кровообращения при травматической болезни / А.Е. Сосюкин, Э.В. Пашковский, С.В. Гайдук // Всероссийская научная конференция “Кардиология – XXI век”. – СПб., 2001. – C. 174-175.
20. Сосюкин А.Е. Диагностика повреждений миокарда при травматической болезни / А.Е. Сосюкин, С.В. Гайдук, Г.А. Кузовков // Всероссийская научная конференция “Кардиология – XXI век”. – СПб., 2001. – C. 333.
21. Гайдук С.В. Случай травматического дефекта межжелудочковой перегородки / С.В. Гайдук, Э.В. Пашковский, В.Б. Пырьев, С.Н. Калинина, О.Ю. Саватеева // Всеармейская научно-практическая конференция “Терапевтическая помощь в экстремальных ситуациях”. – СПб., 2003. – С. 130-132.
22. Сосюкин А.Е. Дифференциально-диагностические признаки ушиба сердца и посттравматической миокардиодистрофии / А.Е. Сосюкин, С.В. Гайдук // Всеармейская научно-практическая конференция “Терапевтическая помощь в экстремальных ситуациях”. – СПб., 2003. – С. 297-299.
23. Сосюкин А.Е. Патология системы кровообращения у раненых в Чечне / А.Е. Сосюкин, С.В. Гайдук, В.А. Гайдук // Научная конференция, посвященная 60-летию Победы в ВОВ 1941-1945 гг. – СПб.: ВММ МО РФ, 2005. – С. 97-99.
24. Сосюкин А.Е. Особенности заболеваний органов кровообращения в период Великой Отечественной войны 1941-1945 гг. / А.Е. Сосюкин, В.А. Гайдук, С.В. Гайдук // Научная конференция, посвященная 60-летию Победы в ВОВ 1941-1945 гг. – СПб.: ВММ МО РФ, 2005. – С. 97-99.
25. Gaiduk S.V. Diagnostics of Traumatic Lesion of the Miocard / S.V. Gaiduk // XXXVI World Congress on Military Medicine. – SPb., 2005. – P. 184.
26. Gaiduk S.V. The Results of Echocardiography Examination of Patients with Severe Multiple Trauma / S.V. Gaiduk // XXXVI World Congress on Military Medicine. – SPb., 2005. – P. 231.
27. Сосюкин А.Е. Кардио-респираторная патология у раненых в Чечне / А.Е. Сосюкин, В.А. Гайдук, А.М. Барановский, С.В. Гайдук // Вестник Российской Военно-медицинской академии. – 2005. – № 1(14). – С. 117-121.
28. Сосюкин А.Е. Диагностика первичных и вторичных повреждений миокарда при травматической болезни / А.Е. Сосюкин, С.В. Гайдук // Вестник Российской Военно-медицинской академии. – 2005. – № 1(14). – С. 121.
29. Сосюкин А.Е. Висцеральная патология у раненых в локальном вооруженном конфликте / А.Е. Сосюкин, В.А. Гайдук, А.В. Першин, С.В. Гайдук // Учебное пособие.- СПб: ВМедА им. С.М. Кирова, 2005. – 41 с.
30. Акимов А.Г. Практикум по военно-полевой терапии / А.Г. Акимов, А.Е. Сосюкин, С.В. Гайдук и др. // СПб, Фолиант, 2006. – 352 с.
31. Сосюкин А.Е. Клиника, диагностика, профилактика и лечение висцеральной патологии у пострадавших с сочетанными повреждениями / А.Е. Сосюкин, Д.В. Вологжанин, С.В. Гайдук // Научно-практический журнал “Медицинский вестник МВД”.- М., 2006. - № 3(22). – С. 35-40.
32. Суворов В.В. Оптимизация объективных критериев применения многоэтапной хирургической тактики при тяжелых повреждениях живота / В.В. Суворов, В.В. Бояринцев, А.В. Гончаров, В.Ю. Маркевич, Р.И. Шевчук, С.В. Гайдук // Международная конференция “Новые технологии в военно-полевой хирургии и хирургии повреждений мирного времени”. – СПб., 2006. – С. 131-132.
33. Сосюкин А.Е. К вопросу совершенствования медицинской помощи пострадавшим с тяжелой травмой / А.Е. Сосюкин, В.В. Бояринцев, С.В. Гаврилин, С.В. Гайдук, В.В. Суворов, С.В. Полюшкин // Всеармейская научно-практическая конференция “Актуальные проблемы организации медицинского обеспечения войск и населения при чрезвычайных ситуациях мирного и военного времени”. – СПб., 2006. – С. 294-295.
34. Сосюкин А.Е. Проблема диагностики и лечения ушиба сердца у пострадавших с тяжелой политравмой / А.Е. Сосюкин, В.В. Бояринцев, С.В. Гаврилин, С.В. Гайдук, Н.С. Немченко, В.В. Суворов // Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова – 2007. – № 1(2). – С. 167-168.
35. Гаврищук Я.В. Повреждение слизистой оболочки желудочно-кишечного тракта у пострадавших с множественными и сочетанными травмами / Я.В. Гаврищук, В.В. Бояринцев, С.В. Гаврилин, С.В. Гайдук // Вестник Российской Военно-медицинской академии. – 2007. – № 1(17). – С. 594.
36. Гаврилин С.В. Современная система мониторинга и прогнозирования полиорганной недостаточности у пострадавших с тяжелыми травмами / С.В. Гаврилин, В.В. Бояринцев, С.В. Гайдук, В.В. Суворов // Вестник Российской Военно-медицинской академии. – 2007. – № 1(17). – С. 644-645.
37. Бояринцев В.В. Проблема диагностики и лечения острого респираторного дистресс-синдрома у пострадавших с тяжелыми травмами / В.В. Бояринцев, С.В. Гаврилин, С.В. Гайдук, В.В. Суворов // Вестник Российской Военно-медицинской академии. – 2007. – № 1(17). – С.645.
38. Алгоритм подготовки и использования медицинских групп для медицинского обеспечения гуманитарных операций: отчет о НИР “Миротворец – О” 2.06.285.п1 / Ю.В. Лобзин, А.М. Шелепов, С.В. Гайдук и др.; под рук. Ю.В. Лобзина; М-во обороны РФ, Воен.-мед. акад. им. С.М. Кирова. – СПб.: Б.И., 2007. – 235 с.
39. Бояринцев В.В. Ранняя диагностика синдрома полиорганной дисфункции у пострадавших с политравмами / В.В. Бояринцев, С.В. Гаврилин, С.В. Гайдук, В.В. Суворов, С.В. Полюшкин // Всероссийская научно-практическая конференция “Политравма: диагностика, лечение и профилактика осложнений”. – г. Ленинск-Кузнецкий. – 2007. – С. 40-41.
40. Сосюкин А.Е. Современная система ранней диагностики синдрома полиорганной дисфункции у пострадавших с тяжелыми травмами / А.Е. Сосюкин, В.В. Бояринцев, С.В. Гайдук, В.В. Суворов // Воен.-мед. журн. – 2008. – Т. 329, № 3. – С. 86.
41. Гайдук С.В. Травматическая болезнь и синдром полиорганной дисфункции – актуальные проблемы медицины критических состояний / С.В. Гайдук, А.Е. Сосюкин, В.В. Бояринцев, С.В. Гаврилин, Н.С. Немченко, П.В. Агафонов // Вестник Российской Военно-медицинской академии. – 2008. – № 1(21). – С. 66-70.
42. Сосюкин А.Е. Иммунный статус пострадавших при различном характере течения травматической болезни: сравнительный анализ / А.Е. Сосюкин А.Е., Н.М. Калинина, Д.А. Вологжанин, С.В. Гайдук // Вестник Российской Военно-медицинской академии. – 2008. – № 1(21). – С. 71-75.
43. Гайдук С.В. Новые технологии в прогнозировании летальных исходов, развития осложнений и ранней диагностике синдрома полиорганной дисфункции при тяжелых травмах / С.В. Гайдук, А.Е. Сосюкин, В.В. Бояринцев, С.В. Гаврилин, Н.С. Немченко, Д.А. Вологжанин, В.В. Суворов // Вестник Российской Военно-медицинской академии. – 2008. – № 1(21). – С. 76-82.
44. Агафонов П.В. Динамика показателей условно-рефлекторной деятельности лабораторных животных в раннем периоде после контузионной травмы / П.В. Агафонов, А.Е. Сосюкин, С.В. Гайдук // Вестник Российской Военно-медицинской академии. – 2008. – № 1(21). – С. 82-84.
45. Борисов М.Б. Синдром жировой эмболии при тяжелых сочетанных травмах / М.Б. Борисов, С.В. Гайдук, В.Я. Апчел, С.В. Гаврилин // Вестник Российской Военно-медицинской академии. – 2008. – № 1(21). – С. 296-299.
46. Изменения в иммунной системе при развитии воспалительного процесса при тяжелых травмах: отчет о НИР “Иммунология” тема № VMA 03.05.01. 0508/280 / И.М. Самохвалов, В.В. Бояринцев, С.В. Гайдук и др.; под рук. И.М. Самохвалова; М-во обороны РФ, Воен.-мед. акад. им. С.М. Кирова. – СПб.: Б.И., 2008. – 146 с.
47. Бояринцев В.В. Клиника, диагностика, профилактика и лечение пневмонии у пострадавших с тяжелой сочетанной травмой / В.В. Бояринцев, С.В. Гаврилин, С.В. Гайдук, Н.С. Немченко, В.В. Суворов // Всероссийская научно-практическая конференция “Новые технологии в медицине”. – г. Ленинск-Кузнецкий. – 2008. – С. 34-35.
48. Сосюкин А.Е. Патология легких у раненых в вооруженных конфликтах на Северном Кавказе / А.Е. Сосюкин, В.В. Бояринцев, А.А. Будко, С.В. Гаврилин, С.В. Гайдук // Воен.-мед. журн. – 2008. – Т. 329, № 11. – С. 31-35.
49. Подготовка и применение групп медицинского усиления для медицинского обеспечения гуманитарных операций: отчет о НИР: шифр “Усиление” тема № VMA. 02.01.05. 0709/0188 / А.М. Шелепов, В.В. Романов, С.В. Гайдук и др.; под рук. А.М. Шелепова; М-во обороны РФ, Воен.-мед. акад. им. С.М. Кирова. – СПб.: Б.И., 2009. – 219 с.
50. Бояринцев В.В. Новые технологии в диагностике ушиба сердца и посттравматической миокардиодистрофии у пострадавших с политравмой /В.В. Бояринцев, С.В. Гаврилин, С.В. Гайдук, А.Я. Кузьмин // Воен.-мед. журн. – 2008. – Т. 329, № 12. – С. 45-46.
51. Самохвалов И.М. Гемокоагуляция и воспаление при политравме / И.М. Самохвалов, Н.С. Немченко, А.А. Завражнов, С.В. Гайдук. IV Всероссийская конференция “Клиническая гемостазиология и гемореология в сердечно-сосудистой хирургии” (с международным участием). – Москва. – 2009. – С. 430-431.
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
АД – артериальное давление;
АТ III – антитрмбин III;
ДВС – диссеминированное внутрисусодистое свертывание;
ЖЕЛ – жизненная емкость легких;
ИВЛ – искусственная вентиляция легких;
ИРГТ – интегральная реография тела;
ИИМ – индекс интоксикации мочи;
ИИК – индекс интоксикации крови;
МОС – минутный объем сердца;
ОДН – острая дыхательная недостаточность;
ОИТ – отделение интенсивной терапии;
ОРДС – острый респираторный дистресс-синдром;
ОЦК – объем циркулирующей крови;
ПТМКД – посттравматическая миокардиодистрофия;
РИ – респираторный индекс;
РФМК – растворимый фибрин-мономерный комплекс;
СИ – сердечный индекс;
СВО – системный воспалительный ответ;
СОПЛ – синдром острого повреждения легких;
ССВО – синдром системного воспалительного ответа;
СПОН – синдром полиорганной недостаточности;
ТБ – травматическая болезнь;
ТЕЛА – тромбоэмболия легочной артерии;
ТСТ – тяжелая сочетанная травма;
УИ – ударный индекс;
УО – ударный объем;
ФВ – фракция выброса;
ФВД – функция внешнего дыхания;
ЭКГ – электрокардиография;
ЭхоКГ – эхокардиография.

