Инфекции при гемобластозах и депрессиях кроветворения: клиника, диагностика и лечение
На правах рукописи
Клясова Галина Александровна
ИНФЕКЦИИ ПРИ ГЕМОБЛАСТОЗАХ И ДЕПРЕССИЯХ КРОВЕТВОРЕНИЯ: КЛИНИКА, ДИАГНОСТИКА И ЛЕЧЕНИЕ
14.00.29 – гематология и переливание крови
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва 2009
Работа выполнена в Учреждении Российской академии медицинских наук
Гематологический научный центр РАМН
Научный консультант:
доктор медицинских наук, профессор, академик РАН и РАМН А.И.Воробьев
Официальные оппоненты:
доктор медицинских наук, профессор, член-корреспондент РАМН Б.П.Богомолов
доктор медицинских наук, профессор, член-корреспондент РАМН И.В.Поддубная
доктор медицинских наук, профессор Л.Г.Ковалева
Ведущее научное учреждение:
Учреждение Российской академии медицинских наук
Российский онкологический научный центр им. Н.Н.Блохина РАМН
Защита состоится “____” _______________2009г. в ____ часов
На заседании диссертационного совета Д 001.042.01 при Учреждении Российской академии медицинских наук Гематологический научный центр РАМН
по адресу: 125167 Москва, Новозыковский проезд, дом 4
С диссертацией можно ознакомиться в библиотеке Учреждения Российской академии медицинских наук Гематологический научный центр РАМН
Автореферат разослан “____” ___________________ 2009 г.
Ученый секретарь диссертационного совета
кандидат медицинских наук Е.Е.Зыбунова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Инфекционные осложнения являются ведущими у больных гемобластозами и депрессиями кроветворения. Инфекции у них характеризуются рядом особенностей, которые включают скудность клинических проявлений, стремительность в развитии, полиэтиологичность. Они являются неотъемлемой частью такого полисиндромного заболевания как цитостатическая болезнь [Воробьев А.И., 1972]. Течение инфекций в период критической нейтропении может быть фатальным, если не начата своевременно терапия эффективными антибиотиками. Спектр микроорганизмов, ответственных за инфекционный процесс у больных, периодически претерпевает изменения. Так в 70-е годы преобладало выделение из крови грамотрицательных бактерий, в 90-е годы – грамположительных, а в настоящее время вновь появилась тенденция к увеличению роли грамотрицательных микроорганизмов в этиологии сепсиса [Schimpff S., 1971; Klastersky J. 1997; Velasco E., 2004; Norgaard M., 2005]. Что же касается инвазивных микозов, то в их структуре за истекшие годы существенно уменьшилась частота выделения грибов рода Candida и возросла доля Aspergillus. [Groll A., 2002; Barnes P., 2007].
В выборе противоинфекционных средств постоянно возникают ограничения не только из-за изменений в спектре патогенов, но и по причине формирования новых механизмов резистентности бактерий. Нередко лечение антибиотиками, эффективность которых была подтверждена исследованиями в 90-е годы, становится неуспешным в настоящее время. Резистентность микроорганизмов, выделяемых у больных с нейтропенией, как и их спектр, может различаться в отдельных странах и в отдельных клиниках. В этой связи крайне важным является изучение этиологической структуры возбудителей сепсиса и их чувствительности к антибиотикам в современных условиях. Полученные данные необходимы как для разработки тактики эмпирического назначения антибиотиков, так и направленной антимикробной терапии при программном лечении гемобластозов и депрессий кроветворения.
Наряду с регистрируемыми переменами в структуре возбудителей сепсиса и их чувствительности in vitro к антибиотикам, произошли изменения и в клинических проявлениях инфекционного процесса, в методах диагностики, в эффективности антимикробных препаратов. Проблемными стали другие инфекции, и такой инфекцией, наряду с грамотрицательным сепсисом, является инвазивный аспергиллез. Именно грамотрицательный сепсис и инвазивный аспергиллез легких являются ведущими и наиболее тяжелыми среди инфекционных осложнений у иммунокомпрометированных больных в настоящее время. Их значимость определяется тяжелым течением, удлинением периода госпитализации, высокой летальностью, немалыми финансовыми затратами на лечение. Сепсис – генерализованный инфекционный процесс и неотъемлемой частью его, наряду с инфекцией, является синдром диссеминированного внутрисосудистого свертывания, проявления которого были широко изучены в ранее выполненных научных работах [Воробьев А.И., 1985, 2006; Галстян Г.М., 2003], в то время как многие аспекты противомикробной терапии, диагностики в современных условиях этих наиболее тяжелых инфекций нуждаются в совершенствовании.
Также следует отметить, что в литературе, как правило, обсуждаются отдельные вопросы диагностики и антимикробной терапии инфекций у иммунокомпрометированных больных. В то же время, очевидно, что решению указанных задач может способствовать лишь углубленный совокупный анализ спектра возбудителей сепсиса, чувствительности их к антимикробным препаратам, современных подходов к диагностике, клинических особенностей тяжелых инфекций и прогностических факторов, влияющих на эффективность лечения. При этом, несомненно, важным является выяснение механизмов и источников инфицирования грамотрицательными бактериями и аспергиллами в стационаре в эпоху возрастающей резистентности к антибиотикам.
Актуальность настоящей работы определяется решением большого круга научных и практических вопросов, направленных на борьбу с наиболее тяжелыми инфекциями у больных гемобластозами и депрессиями кроветворения.
Цель исследования
Разработать современные подходы к диагностике и антимикробной терапии тяжелых инфекционных осложнений у больных гемобластозами и депрессиями кроветворения.
Задачи исследования
1. Исследовать этиологическую структуру возбудителей сепсиса, их чувствительность к антибиотикам у больных гемобластозами и депрессиями кроветворения, разработать тактику эмпирической и направленной терапии инфекций.
2. Определить пути инфицирования грамотрицательными бактериями в стационаре с помощью генотипирования госпитальных штаммов бактерий, выделенных из крови при сепсисе у иммунокомпрометированных больных.
3. Изучить особенности диагностики, клинического течения, прогностические факторы, оказывающие влияние на результаты терапии сепсиса, вызванного грамотрицательными бактериями, в современных условиях.
4. Установить особенности диагностики, клинического течения, прогностические факторы, оказывающие влияние на результаты лечения инвазивного аспергиллеза легких.
5. Определить источники инфицирования аспергиллами в стационаре.
6. Разработать алгоритм диагностики и антимикробной терапии инфекционных осложнений у больных опухолями системы крови и депрессиями кроветворения.
Научная новизна исследования
Проведено первое в России многоцентровое исследование по изучению этиологической структуры и чувствительности к антибиотикам возбудителей сепсиса у больных гемобластозами и депрессиями кроветворения. Детально изучена этиология возбудителей сепсиса, показано, что среди них преобладают грамотрицательные бактерии (49,1%), далее следуют грамположительные бактерии (43,4%), реже выявляют грибы (7,3%) и анаэробные бактерии (0,2%). Определено, что основными микроорганизмами являются Escherichia coli (18,6%) и стафилококк коагулазонегативный (18,0%). Отмечена высокая частота выделения энтеробактерий с продукцией бета - лактамаз расширенного спектра (БЛРС), а среди грибов выявлена низкая встречаемость Candida albicans (21%), преобладавших в прошлые годы.
Проведен сравнительный анализ чувствительности антибиотиков in vitro в отношении бактерий – возбудителей сепсиса. Зарегистрирована высокая резистентность микроорганизмов к антибиотикам, максимальная активность в отношении грамотрицательных бактерий определена у карбапенемов, из цефалоспоринов – у цефоперазона/сульбактама и цефепима; в отношении грамположительных бактерий – у линезолида. Впервые в России из крови выделены штаммы Enterococcus faecium, устойчивые к ванкомицину.
Молекулярное исследование возбудителей сепсиса доказало наличие двух путей инфицирования грамотрицательными бактериями в стационаре – экзогенного и эндогенного, с преобладание эндогенного варианта. Установлено, что для штаммов Escherichia coli наиболее характерным является эндогенный путь инфицирования, в то время как для других грамотрицательных бактерий, особенно для Pseudomonas aeruginosa, – смешанный вариант инфицирования. Генетическое изучение бактерий показало, что у штаммов с одинаковым генотипом могут быть разные параметры чувствительности, поэтому об экзогенном пути передачи инфекции нельзя судить только на основании результатов определения их чувствительности к антибиотикам.
Тяжелые инфекционные осложнения (грамотрицательный сепсис и инвазивный аспергиллез легких) развиваются преимущественно в период критической нейтропении (гранулоцитов < 0,5х109/л). Представлены особенности клинического течения сепсиса, обусловленного грамотрицательными бактериями в современных условиях. Выявлена высокая частота клинически доказанных инфекционных осложнений, из них основные – пневмония (53%), мукозит (40%), некротическая энтеропатия (30%). Наибольший риск развития пневмонии установлен при сепсисе, обусловленном неферментирующими бактериями, прежде всего P.aeruginosa (84%), в сравнении с энтеробактериями (41%).
Изучена антимикробная терапия при грамотрицательном сепсисе. Определена эффективность антибиотиков, назначаемых на 1-ом этапе лечения, которая составляет при сепсисе, вызванном энтеробактериями – 49%, неферментирующими бактериями – 29%; в половине случаев возникает необходимость в назначении карбапенемов. Более высокая частота излечения при добавлении карбапенемов отмечена при сепсисе, вызванном энтеробактериями в сравнении с неферментирующими бактериями. Выявлена полиэтиологичность инфекционных осложнений, более чем в половине случаев к цефалоспоринам или к карбапенемам дополнительно присоединены препараты других групп из-за развития сопутствующей инфекции иной этиологии. Определены прогностические факторы, оказывающие влияние на результаты терапии сепсиса, обусловленного грамотрицательными бактериями.
Зарегистрировано увеличение инвазивного аспергиллеза легких у иммунокомпрометированных больных. Выявлено преобладание этой инфекции при острых лейкозах, отмечена высокая частота в период индукции, продемонстрирована неспецифичность клинических признаков. Показано, что основу ранней диагностики инвазивного аспергиллеза легких составляют определение антигена Aspergillus (галактоманнан) и компьютерная томография легких. Доказано, что терапия вориконазолом инвазивного аспергиллеза приводит к достоверному увеличению частоты излечения в сравнении с амфотерицином В (77,3% против 44%). Определены факторы, отрицательно влияющие на успех терапии, - резистентность опухоли, сохранение нейтропении, выделение культуры Aspergillus, проведение лечения амфотерцином В.
Определена минимальная концентрация спор аспергилл в воздухе одноместных палатах с ламинарным потоком воздуха и оснащенных приточно-вытяжной системой вентиляции.
Научно-практическая ценность работы
Проведенное исследование позволило разработать оптимальную тактику антимикробной терапии у больных гемобластозами и депрессиями кроветворения. На основании результатов изучения активности антибиотиков in vitro в отношении возбудителей сепсиса и анализа лечения грамотрицательного сепсиса внесены изменения в протокол эмпирической антимикробной терапии при лихорадке в период нейтропении, которые заключаются в назначении на 1-ом этапе цефоперазона/сульбактама или цефепима и замены их на карбапенем (имипенем или меропенем) в случае неэффективности.
Получены убедительные данные о механизмах инфицирования в стационаре. Всех пациентов с сепсисом, вызванном P.aeruginosa, следует изолировать, поскольку для этих микроорганизмов определено значимое преобладание экзогенного механизма инфицирования. Размещать в отдельных палатах следует больных с прогрессией опухоли, так как у них наиболее часто выявляются полирезистентные микроорганизмы, которые могут быть источником инфицирования в стационаре.
Клинический анализ случаев сепсиса, обусловленного грамотрицательными бактериями, показал, что выделение из крови штаммов E.coli и K.pneumoniae без продукции бета - лактамаз расширенного спектра значимо чаще происходит у больных до лечения антибиотиками, а неферментирующих бактерий – при использовании антибиотиков. Установлено, что на фоне применения карбапенемов достоверно чаще возникает сепсис, обусловленный штаммами P.aeruginosа.
Детальное изучение клинических проявлений сепсиса показало, что его первые симптомы возникают в течение недели до выделения бактерий из крови в 35% случаев, причем, значимо чаще при сепсисе, обусловленном неферментирующими бактериями (56%) в сравнении с энтеробактериями (26%). Это свидетельствует о необходимости активного проведения комплекса диагностических исследований, повторения их, изменения тактики антимикробной терапии при отрицательных результатах у больных с персистирующей лихорадкой. Отмечена высокая частота инфекций другой этиологии при грамотрицательном сепсисе и инвазивном аспергиллезе, что диктует необходимость повторных исследований при персистирующей гипертермии и нейтропении. Установлено, что периодом наибольшего риска присоединения инфекции является нейтропения длительностью более 20 дней, на фоне которой развиваются достоверно чаще сопутствующие инфекции другой этиологии, а также пневмонии, парапроктиты.
Показано, что современная диагностика инвазивного аспергиллеза легких должна базироваться на данных исследования антигена Aspergillus (галактоманнан) и компьютерной томографии легких, а не на результатах рентгенографии легких, поскольку в 69% не удается выявить изменений на рентгенограммах или они оказываются малоинформативными. Проведенные исследования позволили создать современные программы диагностики и лечения этого тяжелого осложнения и существенно улучшить выживаемость больных гемобластозами.
Положения, выносимые на защиту
1. Результаты изучения этиологической структуры сепсиса у больных гемобластозами и депрессиями кроветворения свидетельствуют об увеличении частоты выделения из гемокультур грамотрицательных и снижении грамположительных бактерий.
2. Микроорганизмы, выделенные из гемокультур, характеризуются высоким уровнем резистентности к антимикробным препаратам; максимальную активность в отношении грамотрицательных бактерий проявляют карбапенемы, из цефалоспоринов – цефоперазон/сульбактам и цефепим, в отношении грамположительных бактерий– линезолид.
3. Генетическое исследование возбудителей сепсиса доказывает преобладание эндогенного пути инфицирования грамотрицательными бактериями в стационаре.
4. Для сепсиса, вызванного грамотрицательными бактериями, характерна высокая частота развития пневмонии, стоматита, некротической энтеропатии. На успех терапии сепсиса оказывают влияние вид возбудителя и его чувствительность к антибиотикам, фаза заболевания, характер и длительность инфекционных осложнений.
5. Инвазивный аспергиллез легких преобладает у больных острыми лейкозами в период курсов индукции, для ранней диагностики важно определение антигена аспергилл (галактоманнан) и проведение компьютерной томографии легких, препаратом выбора в лечении является вориконазол. Концентрация аспергилл в воздухе одноместных палат с ламинарным потоком воздуха и оснащенных приточно-вытяжной вентиляцией минимальна.
Внедрение в практику
Разработанные протоколы антимикробной терапии и лечения инвазивного аспергиллеза у иммунокомпрометированных больных используют в клинической практике отделений гематологии ГНЦ РАМН и ряда гематологических отделений России.
Публикации
По материалам диссертации опубликовано 114 печатных работ в отечественных и зарубежных изданиях. В общей сложности опубликовано 165 печатных работ.
Апробация
Основные положения диссертации обсуждались на ежегодных Международных школах гематологов “Лейкозы и лимфомы. Терапия и фундаментальные исследования” (1992-2008 гг.), использовались в лекциях для клинических ординаторов и практических врачей, проходящих стажировку в ГНЦ РАМН, а также для курсантов кафедры гематологии и интенсивной терапии Российской медицинской академии последипломного образования. Результаты работы доложены на ежегодных декадниках по гематологии, проходящих в ГНЦ РАМН (1995-2009 гг.), на I Всероссийском съезде гематологов и трансфузиологов (Москва, 2001 г.), на ежегодных конференциях “Современные проблемы антимикробной терапии” (Москва, 1999-2008 гг.), ежегодных конгрессах по медицинской микологии (2003-2007 гг.), конференции Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (2001 г), Московском онкологическом обществе (2009 г.).
Диссертация апробирована на заседании проблемной комиссии “Гемопоэз, молекулярная биология, биотехнология, иммуногематология; гемобластозы и депрессии кроветворения” 19 мая 2009 г.
Объем и структура диссертации
Диссертация изложена на 291 странице машинописного текста, состоит из введения, 8 глав, заключения, выводов, практических рекомендаций, списка литературы, приложения. Работа иллюстрирована 74 таблицами, 93 рисунками. Библиографический указатель включает 23 отечественных и 247 зарубежных литературных источников.
Диссертация выполнена в Учреждении Российской академии медицинских наук Гематологический научный центр РАМН (директор академик А.И.Воробьев) при научном сотрудничестве с лабораториями и отделениями ГНЦ РАМН, гематологическими отделениями Федерального научно-клинического центра гематологии, онкологии и иммунологии Росздрава (директор д.м.н., профессор, член-корр. РАМН Румянцев А.Г.), Гематологического научного центра г. Новосибирска (рук. центра д.м.н., проф. Поспелова Т.И.), областных клинических больниц г. Новосибирска (зав. лаб. бактериологии Крайнова Л.Е.), г. Иркутска (зав. лаб. бактериологии к.м.н. Верещагина С.А.), г. Самары (бактериолог Юрицина Н.Я.).
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы
Материалы исследования
В проспективном многоцентровом исследовании была изучена этиологическая структура 1290 возбудителей сепсиса, выделенных из крови у 946 больных, находившихся на стационарном лечении в гематологических отделениях 6 лечебных учреждений России (Москва – 2 центра, Новосибирск – 2 центра, Иркутск, Самара) с 2003 по 2007 гг., при этом 5 стационаров были для лечения взрослых пациентов, а один - для детей. Чувствительность к антимикробным препаратам была исследована у 1099 штаммов бактерий, выделенных из гемокультур.
Было проведено генотипирование 152 штаммов грамотрицательных бактерий, выделенных из крови больных, находившихся на лечении в ГНЦ РАМН.
Были изучены клинические проявления, диагностика и лечение у 155 больных 187 случаев сепсиса, обусловленного грамотрицательными бактериями, и у 75 больных инвазивного аспергиллеза легких. Исследование было у больных, находившихся на лечении в ГНЦ РАМН.
Методы исследования
Микробиологические исследования
Материалом проспективного многоцентрового исследования являлись микроорганизмы, выделенные из гемокультур от больных опухолями системы крови и симптомами сепсиса. Для исследования брали первый штамм, выделенный из крови, коагулазонегативные стафилококки и коринебактерии исследовали при повторном выделении из крови.
Все микроорганизмы были доставлены в лабораторию клинической бактериологии, микологии и антибиотической терапии ГНЦ РАМН, где проводили 100% реидентификацию. Чувствительность бактерий к антибиотикам оценивали методом серийных микроразведений в бульоне в соответствии с рекомендациями Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute – CLSI) и с “Методическими указаниями по определению чувствительности микроорганизмов к антибактериальным препаратам” [NCCLS, 2004; МУК 4.2.1890-04., 2004].
При характеристике результатов чувствительности бактерий использовали следующие показатели – чувствительные (Ч), умеренно-резистентные (УР), резистентные (Р), минимальная подавляющая концентрация (МПК) – наименьшая концентрация антибиотика, способная подавить видимый рост микроорганизма in vitro, МПК50 (МПК антибиотика для 50% исследованных штаммов), МПК90 (МПК антибиотика для 90% исследованных штаммов). Термин “нечувствительные” или “резистентные” штаммы объединял умеренно-резистентные и резистентные микроорганизмы.
Значения МПК определяли для меропенема, имипенема, цефтазидима, цефотаксима, цефтриаксона, цефепима, цефоперазона/сульбактама, триметоприма/сульфаметоксазола, левофлоксацина, ампициллина, гентамицина, амикацина, ванкомицина, линезолида, хлорамфеникола, тетрациклина, оксациллина, пенициллина, эритромицина. Скрининг для выявления высокого уровня устойчивости энтерококков проводили к гентамицину на агаре (гентамицина 500 мкг/мл) Мюллера – Хинтон, к стрептомицину в бульоне (стрептомицина 1000 мкг/мл) и на агаре (стрептомицина 2000 мкг/мл) Мюллера – Хинтон (Becton-Dickinson, США). Продукцию БЛРC у энтеробактерий (Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis) определяли методом “двойных дисков” и дополнительно сравнением МПК цефалоспоринов III поколения (цефотаксима и цефтазидима) и их комбинаций с клавулановой кислотой.
Исследование хромосомной ДНК бактерий
Исследование хромосомной ДНК грамотрицательных бактерий проводили методом гель - электрофореза в пульсирующем поле с использованием коммерческих наборов Genepath Reagent Kits (BioRad, США). Для расщепления ДНК применяли следующие рестриктазы: SpeI для штаммов P. aeruginosa и Enterobacter spp., XbaI - для K. pneumonia и NotI - для E. сoli. Электрофоретическое разделение полученных макрофрагментов ДНК проводили в аппарате GenePath (BioRad, США). В качестве маркеров использовали конкатемеры ДНК фага лямбда и контрольные штаммы бактерий (Control Plug E. coli 0157:H7, P. aeruginosa и E. coli). По количеству и расположению полос на электрофореграмме оценивали рестрикционные фрагменты ДНК бактерий. Сравнение и интерпретацию результатов исследования проводили с использованием программы компьютерного анализа (BioNumerics, Applied Maths) согласно критериям F.C. Tenover и соав. [Tenover F., 1995] Изоляты, различающиеся на электрофореграмме по трем и менее рестрикционным фрагментам ДНК, считали клонально-родственными (идентичными) и относили к подтипам одного клона. Изоляты с большим числом различий в рестрикционных фрагментах ДНК считали независимыми. Анализ дендрограмм проводился в программе GelCompar методом UPGMA с коэффицентом Dice.
Диагностика инвазивного аспергиллеза легких
Диагностику инвазивного аспергиллеза легких проводили в соответствии с Международными критериями 2002 г. [Ascioglu S., 2002].
Культуру Aspergillus spp. получали из мокроты, смывов из трахеи и бронхов, жидкости бронхоальвеолярного лаважа, биоптата легкого. Определение антигена Aspergillus (галактоманнан) в сыворотке крови проводили методом иммуноферментного анализа с использованием тест-систем PLATELIA® Aspergillus (BioRad Laboratories, США). Антиген считали положительным при значениях индекса, равных 0,5 и выше.
Компьютерную томографию легких проводили при положительном антигене Aspergillus или при стойкой персистирующей лихорадке. Обнаружение изменений в легких на рентгенограмме также являлось основанием для проведения компьютерной томографии.
Исследование образцов воздуха и смывов с поверхностей на мицелиальные грибы
Проспективное исследование микологического мониторинга воздуха осуществляли в двух лечебных корпусах центра. Образцы воздуха были отобраны с помощью пробоотборного устройства ПУ – 1Б в режиме 250 л/мин. Внутри помещений центра пробы воздуха отбирались ежемесячно в палатах, расположенных в начале, середине и конце отделения, в душевых комнатах, прилегающих к этим палатам, в коридоре и на постах медицинских сестер. Один раз в сезон исследовали образцы воздуха на улице (вблизи лечебных корпусов на территории центра) на высоте 1,5 м от земли. Количество колоний грибов выражали в колониеобразующих единицах (КОЕ) в 1 м3. Концентрацию мицелиальных грибов в исследуемых образцах определяли по формуле: С=1000 P/Q, где С – концентрация, P - наиболее вероятное число осажденных микроскопических грибов в зависимости от числа колоний (N), представленное в таблице, Q – объем отбираемой пробы воздуха.
Алгоритм обследования больных при нейтропении
При лихорадке до назначения антибиотиков забирали кровь из вены во флаконы с двухфазной средой с 2000 по 2003 гг., а с 2004 г. – только в коммерческие флаконы (Becton-Dickinson, США). Коммерческие флаконы для гемокультур находились в отделениях.
При наличии стоматита выполняли посев со слизистой оболочки ротоглотки, симптомов инфекции мочевыводящих путей – посев мочи, признаков некротической энтеропатии – определение токсина Clostridium difficile. При сохранении температуры выше 38°С комплекс микробиологических исследований повторяли, осуществляли мониторинг антигена Aspеrgillus (галактоманнан) в крови, компьютерную томографию легких. При пневмонии проводили бронхоскопию с исследованием бронхоальвеолярной жидкости на наличие бактерий, грибов (дрожжевых и мицелиальных), микобактерий (микроскопия), нокардий, пневмоцист, герпесвирусов.
Тактика антимикробной терапии при нейтропении.
При появлении лихорадки (температура более 380С) назначали внутривенно антибиотики 1-го этапа – сочетание амикацина с цефалоспорином III-IV поколения (цефепим, цефтазидим, цефоперазон/сульбактам, цефоперазон) или один цефалоспорин III-IV поколения.
Модификацию антибактериальной терапии проводили согласно результатам микробиологических исследований. Если проводимые исследования оказывались неинформативными при сохраняющейся лихорадке, то поэтапно эмпирически добавляли ванкомицин или амфотерицин В, последующим этапом была отмена антибиотиков 1-го этапа и назначение карбапенема (имипенема или меропенема). Антибиотики назначали в следующих дозах (в сутки) – амикацин 15 мг/кг, цефепим по 2г х 2 раза, цефтазидим по 2 г х 3 раза, цефоперазон/сульбактам по 4г х 2 раза, цефоперазон – по 2 г х 2 раза, имипенем по 0,5 х 4 раза, меропенем по 1г х 3 раза, ванкомицин по 0,5 х 4 раза.
Лечение инвазивного аспергиллеза легких проводили амфотерицином В (в/в, 0,6-1,25 мг/кг в сутки), каспофунгином (в/в, в 1-й день 70 мг в сутки, далее по 50 мг), вориконазолом (в/в, в 1й день по 6 мг/кг 2 раза в сутки, далее по 4 мг/кг 2 раза в сутки; через неделю - в таблетках по 200 мг 2 раза в день).
Антибактериальную терапию считали эффективной при совокупности следующих критериев: стойкое снижение температуры тела ниже 37,50С, регрессия клинических симптомов и очагов инфекции. Замену антибиотиков считали адекватной, если она была проведена согласно результатам чувствительности выделенных из крови микроорганизмов или при замене отмечалась положительная динамика в состоянии пациента. Лечение антибиотиками считали неэффективным, если сохранялись симптомы инфекции, несмотря на проводимую терапию, или был летальный исход.
Другие исследования
Морфологическое исследование крови проводилось сотрудниками клинико-диагностической лаборатории (зав. лаб. – Тихонова Л.Ю.). Радиологические исследования проводились сотрудниками отделения рентгенорадиологии (руководитель – д.м.н., профессор Готман Л.Н.). Гистологическое исследование осуществлялось сотрудниками патологоанатомической лаборатории (рук. лаборатории – д.м.н., проф., член-корр. РАМН Франк Г.А.), вирусологические исследования - в лаборатории клинико-вирусологической диагностики гепатитов и СПИД (рук. лаборатории – д.б.н. Филатов Ф.П.).
Статистическую обработку и анализ данных чувствительности микроорганизмов к антибиотикам проводили с помощью компьютерной программы “WHONET 5.”
Статистический анализ инфекционных осложнений был проведен совместно с заведующим лабораторией биомедицинской статистики к.ф.м.н. Куликовым С.М. и сотрудником лаборатории Гемджяном Э.Г. (рук. лаб. – к.ф.м.н. Куликов С.М.). Эта процедура осуществлялась в статистической программе SAS и STATVIEW с использованием базы данных по инфекциям.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Этиологическая структура сепсиса у больных гемобластозами и депрессиями кроветворения. Результаты проспективного многоцентрового исследования
Были изучены 1290 клинически значимых микроорганизмов, выделенных из крови при сепсисе у 946 больных. Сепсис чаще регистрировали у больных острыми лейкозами (47,5%), далее следовали больные лимфосаркомой/лимфомой (22%). В течение всех лет (2003-2007 гг.) наблюдалось некоторое преобладание грамотрицательных бактерий в общей структуре возбудителей сепсиса, и суммарно частота выделения их составила 49,1%, грамположительных бактерий – 43,4%. Грибы из крови были выявлены у 7,3% больных, у двух больных - анаэробные бактерии (0,2%). У 67 (7%) из 946 пациентов этиология сепсиса была полимикробной.
У 221 (23%) больного наблюдалось повторное выделение бактерий из крови в период полихимиотерапии (ПХТ), однако, только у 50 (23%) из них повторный эпизод сепсиса был обусловлен бактериями того же вида, что и первый эпизод. Следовательно, в случаях регистрации новых эпизодов лихорадки необходимо проводить поиск иных патогенов, поскольку вероятность того, что инфекция вызвана тем же возбудителем, невелика.
Спектр возбудителей сепсиса у иммунокомпрометированных больных представлен в табл. 1.
Таблица 1. Спектр микроорганизмов, выделенных при сепсисе из гемокультур у больных гемобластозами и депрессиями кроветворения
| Микроорганизмы | Абс. | % |
| Грамотрицательные бактерии Семейство Enterobacteriaceae В том числе: Escherichia coli Klebsiella pneumoniae Enterobacter spp. Иные Неферментирующие бактерии В том числе: Pseudomonas aeruginosa Acinetobacter spp. Stenotrophomonas maltophilia Иные | 634 431 240 94 51 46 203 90 49 29 35 | 49,1 33,4 18,6 7,3 4,0 3,5 15,7 7,0 3,8 2,2 2,7 |
| Грамположительные бактерии В том числе: Staphylococcus coagulase-negative Enterococcus spp. Streptococcus группы “viridans” Staphylococcus aureus Corynebacterium spp. Listeria monocytogenes Иные | 560 232 128 78 66 25 8 23 | 43,4 18,0 9,9 6,0 5,1 2,0 0,6 1,8 |
| Анаэробные бактерии В том числе: Clostridium histolyticum Clostridium perfringens | 2 1 1 | 0,2 0,1 0,1 |
| Грибы В том числе: мицелиальные дрожжевые | 94 3 91 | 7,3 0,2 7,1 |
В структуре микроорганизмов доминировали E.coli (18,6%) и стафилококк коагулазонегативный (18,0%), далее следовали Enterococcus spp. (9,9%), K. pneumoniae (7,3%), P. aeruginosa (7,0%), Streptococcus группы “viridans” (6,0%). Грибы среди всех возбудителей сепсиса заняли пятую позицию (7,3%). В число десяти наиболее часто выделяемых микроорганизмов также вошли S. aureus (5,1%), Enterobacter spp. (4,0%), Acinetobacter spp. (3,8%).
Этиологическая структура возбудителей сепсиса у взрослых и у детей, а также у больных, находившихся на лечении в нашем центре и в других клиниках, была сопоставимой по основным группам и видам бактерий. Значимое отличие было определено лишь по грибам: частота выделения их была достоверно выше в других стационарах в сравнении с нашим центром (10,6% против 5,7%, p=0,001). Выявленное сходство большинства позиций косвенно свидетельствует о наличии единых подходов антимикробной и цитостатической терапии в современной онкогематологии.
Среди грамотрицательных бактерий чаще выделяли микроорганизмы, относящиеся к семейству Enterobacteriaceae (33,4%). Отмечена высокая частота детекции у них БЛРС (43%), особенно у штаммов K.pneumoniae (63%), табл. 2. Распространенность БЛРС среди энтеробактерий отличается в разных странах, но для России характерен высокий уровень их детекции. Проведенное нами исследование подтвердило высокую встречаемость их еще у одной категории больных – у больных гемобластозами и депрессиями кроветворения.
В семействе Enterobacteriaceae третью позицию по частоте занимали штаммы Enterobacter spp. (n=51), которые были представлены в основном штаммами E.cloacae (n=47) и единичными штаммами E. gergoviae (n=3), E.asburiae (n=1). В состав иных микроорганизмов семейства Enterobacteriaceae (n=46) вошли Salmonella enteritidis (n=15), Serratia marcescens (n=9), Pantoea spp. (n=6), Proteus mirabilis (n=4), Citrobacter freundii (n=3), Klebsiella oxytoca (n=3), Serratia liquefaciens (n=3), Providencia spp. (n=1), Escherichia fergusonii (n=1), Morganella morganii (n=1). Встречаемость этих штаммов была сопоставимой по годам.
Таблица 2. Частота энтеробактерий, продуцирующих БЛРС
| Бактерии | Частота выделения штаммов с продукцией БЛРС по годам (%) | Всего (%) | ||||
| 2003 | 2004 | 2005 | 2006 | 2007 | ||
| E.coli | 11/35 (31) | 14/46 (30) | 18/37 (49) | 24/67 (36) | 19/55 (35) | 86/240 (36) |
| K.pneumoniae | 6/12 (50) | 17/26 (65) | 8/12(67) | 12/22 (55) | 16/22 (73) | 59/94 (63) |
| P. mirabilis | 0/1 | 1/1 | 0 | 0/1 | 1/1 | 2/4 |
| Всего | 17/48 (35) | 32/73 (44) | 26/49 (53) | 36/90 (40) | 36/78 (46) | 147/338 (43) |
Примечание. В столбцах - число штаммов, продуцирующих БЛРС к общему числу штаммов данного вида бактерий
Частота выделения грамотрицательных неферментирующих бактерий составила 15,7% (n=203). В этой группе микроорганизмов преобладали P.aeruginosa (n=90) и Acinetobacter spp. (n=49), основная доля которых была представлена A.baumannii (42 из 49 штаммов), реже выявляли A.lwoffii (n=3), A.haemolyticus (n=2), A.junii (n=2). В составе иных неферментирующих микроорганизмов (n=64) доминировали Stenotrophomonas maltophilia (n=29), Burkholderia cepacia (n=6), Pseudomonas putida (n=7), другие бактерии были представлены единичными штаммами разного вида (всего выявлено 22 вида). Отмечено достоверное увеличение встречаемости иных неферментирующих бактерий в составе грамотрицательных неферментирующих бактерий с 21% (13 из 61 штамма) до 36% (51 из 142 штаммов) при сравнении результатов 2003-2004 гг. и 2005-2007 гг. (p=0,04). Регистрируемое увеличение произошло как за счет большего выделения из гемокультур штаммов S. maltophilia (3-4 штамма в 2003-2004 гг. и 9-8 в 2005-2006 гг.), так и расширения спектра микроорганизмов этой группы.
Среди грамположительных бактерий доминировали стафилококк коагулазонегативный (18%), Enterococcus spp. (9,9%), Streptococcus группы “viridans” (6,0%), S. aureus (5,1%). Основная доля энтерококков была представлена штаммами E. faecium (74%), существенно реже выделяли E. faecalis (23%), по одному штамму были выделены E.durans (1%), E.hirae (1%), E.gallinarum (1%). Преобладание штаммов E. faecium зарегистрировано в течение всего анализируемого периода. Стрептококки, принадлежащие к другим группам, были представлены S.pneumoniae (n=6), S.pyogenes (n=1), S.agalactiae (n=1). Видовая идентификация Streptococcus группы “viridans” была проведена у 56 из 78 штаммов, отмечено преобладание S.mitis (63%). Всего было выделено 66 штаммов S. aureus, частота их составляла в разные годы от 2% (2006 г.) до 7% (2003 г.), в 2007 г. - 5%. Число штаммов Corynebacterium spp. было 25, включая С.propinquum (n=10), C.jeikeium (n=8), C.striatum (n=3), C.auris (n=2), C.urealyticum (n=1), C.bovis (n=1). Частота выделения их была постоянной и не превышала 2%. За анализируемый период из крови было выделено 8 штаммов L. monocytogenes, причем, у двух больных L. monocytogenes были выделены одновременно из крови и из спинномозговой жидкости. Среди редко выявляемых грамположительных бактерий были Micrococcus spp. (n=7), Aureobacterium spp. (n=2), Kocuria varians (n=1), Arcanobacterium haemolyticum (n=1), Leuconostoc spp. (n=2), Rothia spp. (n=1). Единичное выделение этих штаммов наблюдалось в течение всего анализируемого периода.
У двух больных причиной сепсиса были анаэробные бактерии Сlostridium spp. (0,2%), в одном случае – С. perfringens, в другом – С.histolyticum.
За анализируемый период было выделено 94 штамма грибов, из них 89 (95%) Candida spp., 3 (3%) штамма мицелиальных грибов, 1 (1%) Cryptococcus neoformans, 1 (1%) Geotrichum capitatum. Среди Candida spp. частота обнаружения С.albicans составила всего 21% (n=19), в то время как С.non-albicans – 79% (n=70). Спектр С.non-albicans был разнообразным и включал штаммы C.parapsilosis 31% (n=22), C.kefyr 6% (n=4), C.tropicalis 6% (n=4), C.krusei 10% (n=7), C.guilliermondii 28,5% (n=20), C.famata 4% (n=3), C.glabrata 3% (n=2), C.lusitaniae 4% (n=3), C.pelliculosa 6% (n=4), в 1 (1,5%) случае идентификации до вида не проводилось. Из крови мицелиальные грибы были выделены в составе Paecilomyces lilacinus (n=2) и Fusarium spp. (n=1). Выделение из крови грибов P. lilacinus было проявлением катетер-ассоциированной инфекции, а обнаружение Fusarium spp. свидетельствовало о диссеминации инвазивного микоза. Мицелиальные грибы были выделены только в 2006 году, низкая частота встречаемости C.albicans была в течение всех лет исследования.
Заключение. Многоцентровое исследование продемонстрировало разнообразие микроорганизмов, вызывающих сепсис у больных гемобластозами и депрессиями кроветворения. В структуре возбудителей зарегистрировано некоторое преобладание грамотрицательных бактерий, отмечена высокая частота детекции БЛРС у энтеробактерий, выявлено расширение в спектре за счет редких грамотрицательных неферментирующих бактерий. Частота грамположительных бактерий в этиологии сепсиса снизилась, но роль их остается значимой. Среди грамположительных бактерий ведущая позиция сохраняется за штаммами стафилококка коагулазонегативного, отмечена высокая частота и постоянство выделения штаммов Enterococcus spp., а также Streptococcus группы “viridans”. Выявлено разнообразие грибов при фунгемии, отмечена низкая встречаемость C.albicans.
Результаты чувствительности возбудителей сепсиса к антимикробным препаратам
Была изучена чувствительность к антимикробным препаратам 1099 бактерий, выделенных из крови больных гемобластозами и депрессиями кроветворения. Среди тестированных штаммов было 612 грамотрицательных и 487 грамположительных бактерий.
Чувствительность грамотрицательных бактерий
В табл. 3 представлена сравнительная чувствительность к антибиотикам ведущих возбудителей сепсиса - энтеробактерий (n=431). По результатам исследования наиболее высокая активность определялась у имипенема и меропенема. Это были единственные антибиотики, к которым были чувствительными все штаммы энтеробактерий. Активность имипенема и меропенема была сопоставимой, отличия между препаратами определены лишь в значениях МПК, которые были ниже у меропенема. Из цефалоспоринов наибольшей активностью обладал цефоперазон/сульбактам (87% чувствительных штаммов), далее - цефепим (73%). Следует отметить, что основная доля нечувствительных к цефепиму энтеробактерий была представлена резистентными штаммами, а не штаммами с промежуточной чувствительностью, поэтому совершенно необоснованно назначать этот антибиотик при выделении нечувствительных к нему бактерий. К цефтазидиму – антибиотику, который был препаратом выбора в лечении фебрильной нейтропении 90х годов, чувствительность сохранили лишь 66% бактерий семейства Enterobacteriaceae. Активность других цефалоспоринов III-го поколения (цефтриаксон, цефотаксим) была невысокой и составила 63%. Из аминогликозидов более высокий уровень чувствительности проявлял амикацин.
Низкие показатели чувствительности в отношении бактерий семейства Enterobacteriaceae были выявлены у ампициллина (17%) и триметоприма/сульфаметоксазола (31%), поэтому совершенно неоправданно назначать триметоприм/сульфаметоксазол для селективной деконтаминации кишечника, а ампициллин для лечения фебрильной нейтропении.
Распространение БЛРС у энтеробактерий представляет серьезную проблему. Особое значение БЛРС определяется, прежде всего, их способностью обуславливать устойчивость ко всем современным цефалоспоринам, которые широко используют для лечения госпитальных инфекций. Активность антибиотиков в отношении энтеробактерий с продукцией (n=147) и без продукции БЛРС (n=284) имеет большие отличия (рис.1). Стабильными к действию БЛРС являются карбапенемы, эти препараты проявили абсолютную чувствительность. Вторую позицию по активности занимал амикацин (резистентные 21% штаммов). Из цефалоспоринов активность в отношении продуцентов БЛРС была определена лишь у одного препарата - цефоперазона/сульбактама, резистентными были 27% штаммов. Причем, чувствительность цефоперазона/сульбактама в отношении штаммов E.coli была более высокой и составила 84%, чем в отношении штаммов K.pneumoniae (60%), табл. 4. Другие цефалоспорины были неактивны в отношении энтеробактерий – продуцентов БЛРС.
Уровень антибиотикорезистентности микроорганизмов, входящих в семейство Enterobacteriaceae, определяется долей детекции у них БЛРС. Поскольку детекция БЛРС преобладала у штаммов K.pneumoniae, то для этих микроорганизмов была выявлена более высокая резистентность к бета лактамам по сравнению с другими энтеробактериями, табл. 3. Штаммы Enterobacter spp. занимали по активности промежуточную позицию между штаммами E.coli и K.pneumoniae: чувствительными к карбапенемам были все штаммы, далее следовали амикацин (96%), левофлоксацин (92%), цефоперазон/сульбактам (74%), цефепим (73%).
Чувствительность бактерий семейства Enterobacteriaceae, входящих в состав “иные энтеробактерии”, характеризовалась более высокой активностью антибиотиков, табл. 3. Наиболее высокие показатели чувствительности были определены к карбапенемам (100%), цефоперазону/сульбактаму (96%), амикацину (92%), цефепиму (89%).
Таблица 3. Активность антибиотиков в отношении бактерий семейства Enterobacteriaceae
| Антибиотики | Ч n (%) | УР n (%) | Р n (%) | МПК50 мкг/мл | МПК90 мкг/мл | Диапазон МПК мкг/мл |
| Семейство Enterobacteriaceae, n=431 Ампицилин Цефотаксим Цефтриаксон Цефтазидим Цефоперазон/сульбактам Цефепим Имипенем Меропенем Гентамицин Амикацин Левофлоксацин Триметоприм/сульфаметоксазол | 75 (17) 273 (63) 270 (63) 286 (66) 376 (87) 315 (73) 431 (100) 431 (100) 271 (63) 389 (90) 317 (73) 133 (31) | 12 (3) 22 (5) 20 (4) 15 (4) 29 (7) 25 (6) 0 0 10 (2) 19 (5) 24 (6) 0 | 344 (80) 136 (32) 141 (33) 130 (30) 26 (6) 91 (21) 0 0 150 (35) 23 (5) 90 (21) 298 (69) | >128 0,5 0,5 1 1 0,125 0,032 0,016 1 2 0,125 >128 | >128 >128 >128 >128 32 >128 0,5 0,125 >128 16 16 >128 | 0,12->128 0,06->128 0,12->128 0,12->128 0,12->128 0,03->128 0,008-2 0,008-4 0,12->128 0,12->12 0,12-64 0,12->128 |
| E.coli, n=240 Ампициллин Цефотаксим Цефтриаксон Цефтазидим Цефоперазон/сульбактам Цефепим Имипенем Меропенем Гентамицин Амикацин Левофлоксацин Триметоприм/сульфаметоксазол | 46 (19) 173 (72) 173 (72) 182 (76) 225 (94) 190 (79) 240 (100) 240 (100) 158 (66) 219 (91) 158 (66) 58 (24) | 0 10 (4) 8 (3) 10 (4) 7 (3) 14 (6) 0 (0) 0 (0) 5 (2) 12 (5) 14 (6) 0 | 194 (81) 57 (24) 59 (25) 48 (20) 8 (3) 36 (15) 0 (0) 0 (0) 77 (32) 9 (4) 68 (28) 182 (76) | >128 0,125 0,125 1 0,5 0,125 0,032 0,008 1 2 0,125 >128 | >128 >128 >128 64 16 32 0,125 0,032 >128 16 16 >128 | 0,12->128 0,06->128 0,12->128 0,12->128 0,05-128 0,12->128 0,008-2 0,008-1 0,12->128 0,12->128 0,12-32 0,12->128 |
| K. pneumoniae, n=94 Ампициллин Цефотаксим Цефтриаксон Цефтазидим Цефоперазон/сульбактам Цефепим Имипенем Меропенем Гентамицин Амикацин Левофлоксацин Триметоприм/сульфаметоксазол | 6 (7) 39 (42) 37 (40) 42 (45) 69 (73) 47 (50) 94 (100) 94 (100) 42 (45) 79 (84) 71 (76) 24 (26) | 5 (5) 6 (6) 4 (4) 4 (4) 12(13) 9 (10) 0 (0) 0 (0) 2 (2) 4 (4) 8 (8) 0 (0) | 83 (88) 49 (52) 53 (56) 48 (51) 13 (14) 38 (40) 0 0 50 (53) 11 (12) 15 (16) 70 (74) | >128 64 128 32 8 8 0,064 0,032 32 2 0,25 >128 | >128 >128 >128 >128 128 >128 0,5 0,5 >128 64 16 >128 | 0,5->128 0,06->128 0,12->128 0,12->128 0,12->128 0,03->128 0,008-2 0,008-4 0,12->128 0,12->128 0,12-64 0,12->128 |
| Enterobacter spp., n=51 Ампициллин Цефотаксим Цефтриаксон Цефтазидим Цефоперазон/сульбактам Цефепим Имипенем Меропенем Гентамицин Амикацин Левофлоксацин Триметоприм/сульфаметоксазол | 1 (2) 22 (43) 22 (43) 21 (41) 38 (74) 37 (73) 51 (100) 51 (100) 34 (67) 49 (96) 47 (92) 17 (33) | 1 (2) 5 (10) 8 (16) 1 (2) 8 (16) 1 (2) 0 0 2 (4) 1 (2) 1 (2) 0 | 49 (96) 24 (47) 21 (41) 29 (57) 5 (10) 13 (25) 0 0 15 (29) 1 (2) 3 (6) 34 (67) | >128 16 16 64 4 0,5 0,125 0,016 1 1 0,125 >128 | >128 >128 >128 >128 32 >128 1 0,25 >128 8 1 >128 | 8->128 0,12->128 0,12->128 0,12->128 0,12->128 0,12->128 0,016-1 0,008-2 0,12->128 0,25->128 0,12-16 0,12->128 |
| Иные энтеробактерии*, n=46 Ампициллин Цефотаксим Цефтриаксон Цефтазидим Цефоперазон/сульбактам Цефепим Имипенем Меропенем Гентамицин Амикацин Левофлоксацин Триметоприм/сульфаметоксазол | 22 (48) 39 (85) 38 (83) 41 (89) 44 (96) 41 (89) 46 (100) 32 (100) 37 (81) 42 (92) 41 (89) 30 (65) | 6 (13) 1 (2) 0 0 2 (4) 1 (2) 0 0 1 (2) 2 (4) 1 (2) 0 | 18 (39) 6 (13) 8 (17) 5 (11) 0 4 (9) 0 0 8 (17) 2 (4) 4 (9) 16 (35) | 16 0,125 0,125 0,5 0,25 0,125 0,064 0,008 0,25 1 0,125 1 | >128 128 >128 128 16 16 1 0,064 32 16 4 >128 | 0,12->128 0,12->128 0,12->128 0,12->128 0,12-32 0,12->128 0,016-2 0,008-0,25 0,12->128 0,12->128 0,12-32 0,12->128 |
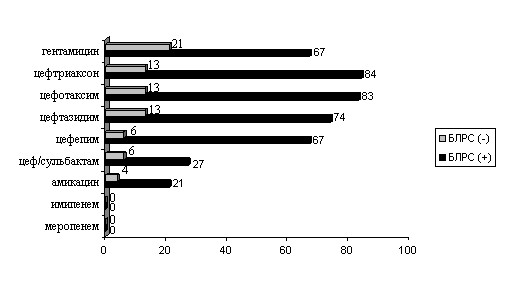
Примечание. Иные энтеробактерии - S. enteritidis (n=15), S. marcescens (n=9), S. liquefaciens (n=3), Pantoea spp. (n=6), P. mirabilis (n=4), С.freundii (n=3), K.oxytoca (n=3), Providencia spp. (n=1), E. fergusonii (n=1), M. morganii (n=1)
Рисунок 1. Резистентность бактерий семейства Enterobacteriaceae, продуцирующих и непродуцирующих БЛРС.
Примечание. В категорию резистентных штаммов отнесены устойчивые и умеренно-устойчивые штаммы; цеф/сульбактам – цефоперазон/сульбактам.
Таблица 4. Активность антибиотиков в отношении E.coli и K. pneumoniae, продуцирующих БЛРС
| Антибиотики | E.coli, БЛРС (n=86) | K. pneumoniae, БЛРС (n=59) | ||||||||
| Ч % | УР % | Р % | МПК50 мкг/мл | МПК90 мкг/мл | Ч % | УР % | Р % | МПК90 мкг/мл | МПК90 мкг/мл | |
| Цефотаксим | 23 | 12 | 65 | 128 | >128 | 9 | 10 | 81 | >128 | >128 |
| Цефтриаксон | 23 | 8 | 69 | 128 | >128 | 5 | 7 | 88 | >128 | >128 |
| Цефтазидим | 34 | 11 | 55 | 32 | >128 | 13 | 7 | 80 | >128 | >128 |
| Цефоперазон/ сульбактам | 84 | 7 | 9 | 8 | 64 | 60 | 20 | 20 | 16 | 128 |
| Цефепим | 42 | 16 | 42 | 16 | >128 | 22 | 15 | 63 | 64 | >128 |
| Имипенем | 100 | 0 | 0 | 0,032 | 0,25 | 100 | 0 | 0 | 0,064 | 0,5 |
| Меропенем | 100 | 0 | 0 | 0,016 | 0,064 | 100 | 0 | 0 | 0,032 | 1 |
| Гентамицин | 44 | 2 | 54 | 32 | >128 | 17 | 3 | 80 | 128 | >128 |
| Амикацин | 83 | 8 | 9 | 4 | 32 | 75 | 7 | 18 | 4 | >128 |
| Левофлоксацин | 38 | 11 | 51 | 8 | 32 | 66 | 12 | 22 | 2 | 32 |
| Тримет./сульф. | 18 | 0 | 82 | >128 | >128 | 13 | 0 | 87 | >128 | >128 |
Примечание. Тримет./сульф. – триметоприм/сульфаметоксазол
В последнее время становится нередким выделение из крови таких энтеробактерий, как Salmonella enteritidis. В нашем исследовании они были выделены из крови у 15 больных, причем, у большинства пациентов диарея отсутствовала. В отношении S.enteritidis многие антибиотики (карбапенемы, исследуемые цефалоспорины III и IV поколения, левофлоксацин, амикацин) проявили абсолютную активность, высокие показатели чувствительности были определены также у триметоприма/сульфаметоксазола (91%), ампициллина (93%), гентамицина (93%).
В последнее время отмечено нарастание устойчивости у штаммов P.aeruginosa к антимикробным препаратам, включая карбапенемы. Штаммы P.aeruginosa характеризовались высоким уровнем резистентности ко всем антибиотикам: в отношении этих бактерий не выявлено преимуществ карбапенемов над цефалоспоринами, полирезистентными были 21% штаммов, табл. 5. Наиболее высокие показатели чувствительности были определены для амикацина (76%), цефоперазона/сульбактама (66%), меропенема (66%), имипенема (62%), цефепима (64%). Диско-диффузионным методом была определена абсолютная активность только полимиксина в отношении P.aeruginosa.
Число антибиотиков, активных в отношении штаммов A.baumannii, было еще более ограниченным, табл. 5. Максимальная активность была определена у цефоперазона/сульбактама, чувствительными к нему были 86% штаммов. К имипенему были чувствительными 76% штаммов, а к меропенему – 57%. Столь выраженные отличия в чувствительности меропенема и имипенема могли быть обусловлены циркуляцией в стационаре клонально-родственных штаммов с идентичными параметрами устойчивости.
Активность антибиотиков в отношении других неферментирующих бактерий, частота которых увеличивается в последние годы, является неоднородной, активными могут быть один-два или, наоборот, несколько антимикробных препаратов. Так, в отношении штаммов S. maltophilia проявляют активность только 2 антибиотика: триметоприм/сульфаметоксазол и тикарциллин/клавуланат. Триметоприм/сульфаметоксазол сохранял чувствительность в отношении 90% штаммов S. maltophilia, активность тикарциллина/клавуланата нами не была изучена. В отношении Pseudomonas putida (n=7) были чувствительны амикацин, цефепим, цефтазидим, цефтриаксон, имипенем, меропенем, а в отношении Burkholderia cepacia (n=6) – только триметорим/сульфаметоксазол. Учитывая тот факт, что выделение неферментирующих бактерий становится нередким у иммунокомпрометированных больных, крайне важным является как их идентификация, так и исследование чувствительности, поскольку активными могут быть разные антибиотики.
Таблица 5. Активность антибиотиков в отношении P.aeruginosa и A.baumannii
| Антибиотики | Ч n (%) | УР n (%) | Р n (%) | МПК50 мкг/мл | МПК90 мкг/мл | Диапазон МПКмкг/мл |
| P.aeruginosa, n=90 Цефотаксим Цефтриаксон Цефтазидим Цефоперазон Цефоперазон/сульбактам Цефепим Имипенем Меропенем Гентамицин Амикацин | 10 (11) 5 (6) 42 (47) 49 (54) 59 (66) 58 (64) 56 (62) 59 (66) 53 (59) 68 (76) | 26 (29) 19 (21) 7 (8) 8 (9) 11 (12) 8 (9) 9 (10) 5 (6) 4 (4) 2 (2) | 54 (60) 66 (73) 41 (45) 33 (37) 20 (22) 24 (27) 25 (28) 26 (28) 33 (37) 20 (22) | 64 128 16 16 16 4 1 1 4 4 | >512 >512 256 512 128 64 64 128 >512 128 | 2->512 4->512 2->512 1->512 1->512 1-256 0,12-256 0,12-256 0,5->512 0,5->512 |
| A.baumannii, n=42 Цефотаксим Цефтриаксон Цефтазидим Цефоперазон Цефоперазон/сульбактам Цефепим Имипенем Меропенем Гентамицин Амикацин | 11 (26) 13 (31) 10 (24) 6 (14) 36 (86) 16 (38) 32 (76) 24 (57) 13 (31) 17 (40) | 5 (12) 3 (7) 5 (12) 4 (10) 5 (12) 13 (31) 5 (12) 6 (14) 0 (0) 5 (12) | 26 (62) 26 (62) 27 (64) 32 (76) 1 (2) 13 (31) 5 (12) 12 (29) 29 (69) 20 (48) | 128 256 128 512 8 16 0,5 2 64 32 | >512 >512 >512 >512 32 256 16 32 >512 256 | 4->512 4->512 0,5->512 4->512 0,5-512 1->512 0,12-16 0,12-64 0,5->512 0,5-512 |
Чувствительность грамположительных бактерий
Из 232 штаммов Staphylococcus coagulase-negative (Staphylococcus CN) устойчивыми к оксациллину были 190 (82%) штаммов, чувствительными к оксациллину – 42 (18%). Результаты чувствительности к оксациллину 66 штаммов S. aureus были диаметрально противоположными: устойчивыми были 18% (n=12) штаммов, чувствительными – 82% (n=54).
Результаты чувствительности оксациллиноустойчивых штаммов стафилококков представлены в табл. 6. Все оксациллиноустойчивые штаммы Staphylococcus CN и S. aureus были чувствительны к линезолиду и ванкомицину. Однако значения МПК90 ванкомицина в отношении штаммов S. aureus были высокие и составили 2 мкг/мл, что может быть причиной неудач в лечении этим препаратом. На втором месте по активности in vitro в отношении оксациллиноустойчивых Staphylococcus CN был тетрациклин (75% чувствительных штаммов), в отношении S. aureus - триметоприм/сульфаметоксазол (83% чувствительных штаммов). Активность остальных антибиотиков была невысокой.
Иными параметрами активности характеризовались оксациллиночувствительные штаммы Staphylococcus CN и S. aureus, табл. 7. Все штаммы были чувствительны не только к оксациллину, ванкомицину и линезолиду, но и к амикацину, карбапенемам, всем исследуемым цефалоспоринам, за исключением одного препарата - цефтазидима.
Таблица 6. Активность антибиотиков в отношении оксациллиноустойчивых штаммов Staphylococcus CN и S. aureus
| Антибиотики | Ч n (%) | УР n (%) | Р n (%) | МПК50 мкг/мл | МПК90 мкг/мл | Диапазон МПКмкг/мл |
| Staphylococcus CN, n=190 Амикацин Ванкомицин Гентамицин Линезолид Тетрациклин Тримет./сульф. Хлорамфеникол Эритромицин | 96 (51) 190 (100) 18 (9) 190 (100) 142 (75) 21 (11) 61 (32) 27 (14) | 21 (11) 0 (0) 15 (8) 0 (0) 0 (0) 0 (0) 3 (2) 5 (3) | 73 (38) 0 (0) 157 (83) 0 (0) 48 (25) 169 (89) 126 (66) 158 (83) | 16 1 64 1 1 16 32 >64 | >64 2 >64 2 64 16 >64 >64 | 0,06->64 0,125-4 0,06->64 0,125-2 0,06->64 0,06->64 1->64 0,06-256 |
| S. aureus, n=12 Амикацин Ванкомицин Гентамицин Линезолид Тетрациклин Тримет./cульф. Хлорамфеникол Эритромицин | 8 (67) 12 (100) 4 (33) 12 (100) 5 (42) 10 (83) 5 (42) 3 (25) | 1 (8) 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 1 (8) 0 (0) | 3 (25) 0(0) 8 (67) 0 (0) 7 (58) 2 (17) 6 (50) 9 (75) | 16 1 >64 1 16 0,064 16 >64 | >64 2 >64 2 32 8 >64 >64 | 4->64 0,25-2 4->64 0,5-2 0,25->64 0,06-64 4->64 0,06-2 |
Таблица 7. Активность антибиотиков в отношении оксациллиночувствительных штаммов Staphylococcus CN и S. aureus
| Антибиотики | Staphylococcus CN (n=42) | S. aureus (n=54) | ||||||
| Ч n (%) | УР n (%) | Р n (%) | МПК90 мкг/мл | Ч n (%) | УР n (%) | Р n (%) | МПК90 мкг/мл | |
| Амикацин | 42 (100) | 0 | 0 | 4 | 54 (100) | 0 | 0 | 8 |
| Ванкомицин | 42 (100) | 0 | 0 | 2 | 54 (100) | 0 | 0 | 2 |
| Гентамицин | 36 (86) | 1 (2) | 5 (12) | 16 | 53 (98) | 0 | 1 (2) | 2 |
| Имипенем | 42 (100) | 0 | 0 | 0,25 | 54 (100) | 0 | 0 | 0,064 |
| Линезолид | 42 (100) | 0 | 0 | 2 | 54 (100) | 0 | 0 | 2 |
| Меропенем | 42 (100) | 0 | 0 | 1 | 54 (100) | 0 | 0 | 0,125 |
| Оксациллин | 42 (100) | 0 | 0 | 0,25 | 54 (100) | 0 | 0 | 1 |
| Пенициллин | 26 (62) | 1 (2) | 15 (36) | 8 | 28 (52) | 1 (2) | 25 (46) | 16 |
| Тетрациклин | 26 (62) | 1 (2) | 15 (36) | 64 | 51 (94) | 0 | 3 (6) | 1 |
| Тримет./сульф. | 23 (54) | 0 | 19 (46) | 32 | 54 (100) | 0 | 0 | 0,125 |
| Цефепим | 42 (100) | 0 | 0 | 2 | 54 (100) | 0 | 0 | 2 |
| Цефоперазон | 42 (100) | 0 | 0 | 4 | 54 (100) | 0 | 0 | 4 |
| Цефопер./сульб. | 42 (100) | 0 | 0 | 4 | 54 (100) | 0 | 0 | 2 |
| Цефотаксим | 42 (100) | 0 | 0 | 4 | 54 (100) | 0 | 0 | 2 |
| Цефтазидим | 37 (88) | 2 (5) | 3 (7) | 16 | 44 (81) | 7(13) | 3 (6) | 16 |
| Цефтриаксон | 42 (100) | 0 | 0 | 8 | 54 (100) | 0 | 0 | 4 |
| Хлорамфеникол | 35 (83) | 0 | 7 (17) | 64 | 47 (87) | 0 | 7 (13) | 32 |
| Эритромицин | 21 (50) | 1 (2) | 20 (48) | >64 | 49 (91) | 0 | 5 (9) | 0,5 |
Примечание. Тримет./сульф. - триметоприм/сульфаметоксазол, цефопер./сульб. – цефоперазон/сульбактам
Триметоприм/сульфаметоксазол, эритромицин, тетрациклин были более активны в отношении оксациллиночувствительных штаммов S. aureus, чем в отношении оксациллиночувствительных штаммов Staphylococcus CN.
Таблица 8. Активность антибиотиков в отношении E.faecalis, E.faecium, Streptococcus группы “viridans”
| Антибиотики | Ч n (%) | УР n (%) | Р n (%) | МПК50 мкг/мл | МПК90 мкг/мл | Диапазон МПКмкг/мл |
| E.faecalis, n=30 Ампициллин Ванкомицин Гентамицин 500 мг Линезолид Пенициллин Стрептомицин 2000 мг Тетрациклин Хлорамфеникол Эритромицин | 30 (100) 30 (100) 17 (57) 30 (100) 30 (100) 18 (60) 7 (24) 15 (50) 9 (30) | 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 1 (3) 0 (0) 1 (3) | 0 (0) 0 (0) 13 (43) 0 (0) 0 (0) 12 (40) 22 (73) 15 (50) 20 (67) | 1 1 - 1 1 - 32 8 >128 | 2 2 - 2 4 - 64 64 >128 | 0,25-4 0,5-4 - 0,25-2 0,125-4 - 0,12-128 4-128 0,125->128 |
| E.faecium, n=95 Ампициллин Ванкомицин Гентамицин 500 мг Линезолид Пенициллин Стрептомицин 2000 мг Тетрациклин Хлорамфеникол Эритромицин | 0 (0) 89 (94) 5 (5) 95 (100) 0 (0) 21 (22) 71 (75) 68 (72) 1 (1) | 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 0 (0) 1 (1) 17 (18) 6 (6) | 95 (100) 6 (6) 90 (95) 0 (0) 95 (100) 74 (78) 23 (24) 10 (10) 88 (93) | 128 0,5 - 1 >128 - 0,125 8 >128 | >128 1 - 2 >128 - 64 32 >128 | 32->128 0,12-1024 - 0,25-2 128- >128 - 0,12-128 1-64 0,125->128 |
| Streptococcus группы “viridans”, n=78 Ампициллин Ванкомицин Линезолид Меропенем Пенициллин Тетрациклин Цефепим Цефотаксим Цефтриаксон Хлорамфеникол Эритромицин | 57 (73) 78 (100) 78 (100) 74 (95) 62 (80) 40 (51) 72 (93) 70 (90) 71 (91) 67 (86) 42 (54) | 10 (13) 0 (0) 0 (0) 0 (0) 8 (10) 3 (4) 1 (1) 1 (1) 1 (1) 9 (11) 9 (11) | 11 (14) 0 (0) 0 (0) 4 (5) 8 (10) 35 (45) 5 (6) 7 (9) 6 (8) 2 (3) 27 (35) | 0,064 0,25 0,5 0,016 0,016 2 0,016 0,016 0,016 2 0,25 | 4 1 1 0,5 1 >16 0,5 4 2 8 4 | 0,015->16 0,06-1 0,06-2 0,015->16 0,015-16 0,03->16 0,015->16 0,015-16 0,015->16 0,03-16 0,015->16 |
Среди энтерококков преобладали E.faecium, для которых характерным является более высокий уровень природной устойчивости в сравнении с E.faecalis, табл. 8. Так, все штаммы E.faecalis были чувствительны к ампициллину, пенициллину, ванкомицину, линезолиду. Активность в отношении всех штаммов E.faecium проявлял только один препарат - линезолид. Впервые в России в 2005 г. был выделен из крови ванкомициноустойчивый штамм E.faecium, и за 5 лет исследования число их достигло 6 штаммов. Все ванкомициноустойчивые штаммы E.faecium имели высокие значения МПК ванкомицина (у одного штамма – 128 мкг/мл, у пяти – более 128 мкг/мл). Активность аминогликозидов была невысокой.
Активность большинства исследуемых антибиотиков в отношении штаммов Streptococcus группы “viridans” была высокой, однако, к пенициллину были нечувствительны 20% штаммов, табл. 8. Все штаммы были чувствительны к линезолиду и ванкомицину. Чувствительность цефепима (93%), цефтриаксона (91%) и цефотаксима (90%) была сопоставимой. Значения МПК90 пенициллина, цефтриаксона, цефепима, цефотаксима, меропенема в отношении штаммов Streptococcus группы “viridans” были минимальны.
Стрептококки, принадлежащие к другим группам, были представлены единичными штаммами. Все исследованные штаммы S.pneumoniae (n=6) были чувствительны к цефепиму, цефотаксиму, линезолиду, меропенему, ванкомицину. К пенициллину чувствительность сохранили 5 из 6 штаммов.
Среди редких грамположительных бактерий были L. monocytogenes (n=8), все штаммы были чувствительны к ампициллину.
Заключение. Для возбудителей сепсиса была зарегистрирована высокая резистентность к антимикробным препаратам. Из цефалоспоринов наиболее активными были цефоперазон/сульбактам и цефепим, причем, цефоперазон/сульбактам в отличие от цефепима проявлял активность в отношении Acinetobacter spp. и энтеробактерий, продуцирующих БЛРС. Карбапенемы (имипенем и меропенем) демонстрировали наиболее высокую активность в отношении энтеробактерий, включая продуцентов БЛРС, и штаммов Acinetobacter spp. Из аминогликозидов выявлены преимущества у амикацина. Впервые в России из крови были выделены энтерококки, устойчивые к ванкомицину, и абсолютную активность в отношении грамположительных бактерий проявлял один антибиотик – линезолид.
Генотипирование госпитальных штаммов грамотрицательных бактерий, выделенных из гемокультур при сепсисе у больных опухолями системы крови
Следующей задачей стало изучение путей инфицирования грамотрицательными бактериями в стационаре, поскольку эти микроорганизмы преобладали в структуре возбудителей сепсиса, и для них была характерна высокая устойчивость к антибиотикам.
Была исследована хромосомная ДНК 152 штаммов грамотрицательных бактерий, выделенных из крови при сепсисе у больных гемобластозами и депрессиями кроветворения. Все пациенты находились на лечении в ГНЦ РАМН с января 2003 г по октябрь 2006 г. Исследуемыми микроорганизмами были E. coli (n=80), Enterobacter spp. (n=15), K. pneumoniae (n=31) и P. aeruginosa (n=26). Результаты, полученные при генотипировании, представлены в табл. 9. При генотипировании штаммов P. aeruginosa был выявлен 21 независимый рестрикционный профиль ДНК бактерий. Идентичные рестрикционные профили были у 9 штаммов P. aeruginosa, принадлежащих к 4 клонам. Один клон включал 3 клонально-родственных штамма, которые имели полную идентичность, а другие 6 штаммов, относящиеся к трем клонам, были попарно схожими между собой и отличались на три позиции рестрикционных фрагментов.
При изучении 15 штаммов Enterobacter spp. было выявлено 12 независимых рестрикционных профилей ДНК бактерий. Идентичные рестрикционные профили были определены у 5 штаммов Enterobacter spp., которые принадлежали к двум клонам, один из них включал 3 идентичных штамма (100% сходство), а другой клон – два штамма (идентичность 87%).
Таблица 9. Результаты генотипирования грамотрицательных бактерий, выделенных из гемокультур при сепсисе у больных опухолями системы крови
| Бактерии | Число рестрикционных профилей ДНК бактерий, n | Число различий в ре-стрикционных профи-лях ДНК бактерий, n | Число идентичных штаммов, n | ||||
| Вид | n | независимых | идентичных | 0 | 1-3 | >3 | |
| P.aeruginosa | 26 | 21 | 4 (19%) | 3 | 6 | 17 | 9 (35%)* |
| Enterobacter spp. | 15 | 12 | 2 (17%) | 3 | 2 | 10 | 5 (33%) |
| K.pneumoniae | 31 | 27 | 3 (11%) | 6 | 1 | 24 | 7 (23%) |
| E.coli | 80 | 79 | 1 (1%) | 2 | 0 | 78 | 2 (3%)* |
Примечание. * - отмечены отличия p<0.0001
Генотипирование 31 штамма K. pneumoniae выявило принадлежность их к 27 различным пульс-электрофорезным типам ДНК. Было обнаружено 3 идентичных клона, включающих 7 штаммов, все они имели продукцию БЛРС.
У 80 изученных штаммов E. coli было выделено 79 независимых рестрикционных профилей ДНК бактерий. Только 2 (3%) из 80 штаммов E. coli были идентичными (100%), происходили от одного клона и являлись продуцентами БЛРС. Время между выделением идентичных штаммов E. coli составило 24 дня.
Таким образом, наибольшее число клонов, имеющих 2 и больше генетически идентичных штамма, определялось у P. aeruginosa (19%), далее у Enterobacter spp. (17%) и K. pneumoniae (11%), минимальное – у E. coli (1%), p<0.0001.
Медиана пребывания больных в стационаре на момент выделения идентичных штаммов P.aeruginosa составила 47 дней (от 1 до 130 дней), энтеробактерий – 54 дня (от 4 до 141 дней).
Оценивая чувствительность бактерий к антибиотикам, следует отметить, что все идентичные штаммы энтеробактерий имели детерминанты устойчивости (БЛРС), а 4 из 9 штаммов P.aeruginosa были резистентны к карбапенемам. Интересные данные были получены при сопоставлении параметров антибиотикочувствительности. Оказалось, что идентичные по генотипу штаммы бактерий имели отличия в чувствительности к антибиотикам. Так, в процессе циркуляции генетически идентичные штаммы энтеробактерий приобретали детерминанты устойчивости (БЛРС), а у штаммов P.aeruginosa, наоборот, повышалась чувствительность к антибиотикам. Следовательно, делать заключение об идентичности микроорганизмов можно только на основании генетических, а не фенотипических (по данным чувствительности) методов исследования.
Клонально-родственные штаммы бактерий были выделены у 11 (48%) пациентов с резистентным гемобластозом, у 8 (35%) - впервые диагностированным гемобластозом (курсы индукции), у 4 (17%) – в период ремиссии. Следовательно, пациентов с резистентным течением гемобластоза следует помещать в отдельные палаты, поскольку они могут быть “резервуаром” наиболее устойчивых микроорганизмов и являться источником инфекции для других больных в стационаре.
Заключение. Генотипирование грамотрицательных бактерий продемонстрировало наличие двух путей инфицирования микроорганизмами в стационаре - эндогенного и экзогенного, с преобладанием эндогенного. Для штаммов E.coli наиболее характерным было эндогенное инфицирование, а экзогенный путь передачи инфекции чаще определялся у штаммов P. aeruginosa. Генетически идентичные штаммы бактерий имели отличия в чувствительности к антибиотикам.
Результаты терапии сепсиса, обусловленного грамотрицательными бактериями, у больных гемобластозами и депрессиями кроветворения
Общая характеристика больных
Были изучены клинические проявления и лечение сепсиса, обусловленного грамотрицательными бактериями, по причине преобладания этих микроорганизмов в этиологической структуре тяжелых инфекций. В задачи исследования также входило определение факторов, влияющих на результаты лечения. Было проведено изучение 187 случаев сепсиса, обусловленного грамотрицательными бактериями у 155 больных (женщин – 92, мужчин – 63). Все больные находились на лечении в ГНЦ РАМН с 2000г по 2006 гг. Медиана возраста больных составила 37 лет, колебания от 15 до 88 лет. Основную долю составили больные острым лейкозом (52%), далее следовали пациенты лимфосаркомой/лимфомой Беркитта (23%). Из 187 грамотрицательных возбудителей сепсиса к семейству Enterobacteriaceae принадлежало 132 (71%) штамма, к неферментирующим бактериям - 55 (29%). Для проведения анализа все бактерии были объединены в 5 групп: 1-я группа - штаммы E.coli и K. pneumoniae без продукции БЛРС (n=68), 2-я группа - E.coli и K. pneumoniae с продукцией БЛРС (n=49), 3-я группа - другие энтеробактерии (13 Enterobacter spp., 2 Pantoea spp.) в количестве 15 штаммов, 4-я группа - P. aeruginosa (n=45), 5-я группа – другие неферментирующие бактерии (8 Acinetobacter spp., 1 S. maltophilia 1 Alcaligenes xylosoidaus) – всего 10 штаммов.
В табл. 10 представлено распределение анализируемых групп бактерий в зависимости от исследуемых показателей. Сепсис, вызванный бактериями семейства Enterobacteriaceae и неферментирующими бактериями, развивался преимущественно в период нейтропении (89% и 87%); практически с одинаковой частотой возникал как при резистентном течении опухоли системы крови, так и в ремиссии (31% против 28%). Высокую частоту регистрации сепсиса у больных в ремиссии можно объяснить как выраженным иммунодефицитом, который сохраняется еще длительное время после достижения ремиссии, так и преобладанием эндогенного пути инфицирования бактериями.
При курсах индукции сепсис был зарегистрирован в 21% (в 40 из 187) случаев, в этот период отмечено значимое преобладание неферментирующих грамотрицательных бактерий над энтеробактериями (36% против 15%, p=0,002) из-за большей частоты выделения из крови P.aeruginosa (38%). При резистентном течении опухоли достоверно чаще выделяли из крови штаммы E.coli и K. pneumoniae с продукцией БЛРС (45%), в ремиссии значимо чаще преобладали менее резистентные штаммы-E.coli и K. pneumoniae без продукции БЛРС (40%).
Распределение микроорганизмов при сепсисе в зависимости от диагноза было сопоставимым за исключением больных острым лимфобластным лейкозом и апластической анемией. Так, при остром лимфобластном лейкозе было выявлено значимое превосходство энтеробактерий над неферментирующими бактериями (22% против 9%, p=0,005) по причине преобладания штаммов E.coli и K. pneumoniae без продукции БЛРС (28%), а при апластической анемии, наоборот, преобладали более резистентные бактерии - E.coli и K. pneumoniae с продукцией БЛРС (22%) и P.aeruginosa (14%).
При высокодозной полихимиотерапии (ПХТ) достоверно чаще выделяли энтеробактерии в сравнении с неферментирующими грамотрицательными бактериями (45% против 16%, p=0,0009) по причине значимого преобладания штаммов E.coli и K. pneumoniae с продукцией БЛРС (49%) и без продукции БЛРС (49%) над штаммами P.aeruginosa (13%, p=0,001). При проведении терапии вне протокола или паллиативной (другая ПХТ), наоборот, неферментирующие бактерии доминировали над энтеробактериями (30% против 15%, p=0,03) и статистически чаще определяли штаммы P.aeruginosa (29%) в этиологии сепсиса.
Таблица 10. Распределение групп бактерий в зависимости от исследуемых показателей
| Показатели | Грамотрицательные бактерии n (%) | ||||||
| Семейство Enterobacteriaceae | Неферментирующие бактерии | ||||||
| Всего n=132 | ЕК n=68 | ЕК, БЛРС n=49 | ДрЭн n=15 | Всего n=55 | PA n=45 | ДрНФ n=10 | |
| Гранулоцитов < 0,5х109/л | 117 (89) | 63 (93) | 42 (86) | 12 (80) | 48 (87) | 41 (91) | 7 (70) |
| Диагноз ОМЛ ОЛЛ ЛСА ЛГМ АА Другие | 43 (33) 29 (22)* 30 (23) 6 (4) 13 (10) 11 (8) | 24 (36) 19 (28)** 13 (19) 5 (7) 2 (3)* 5 (7) | 13 (27) 7 (14) 13 (27) 1 (2) 11 (22)* 4 (8) | 6 (40) 3 (20) 4 (27) 0 0 2 (13) | 21 (38) 5 (9)* 13 (24) 4 (7) 7 (13) 5 (9) | 19 (42) 5 (11)** 9 (20) 2 (4) 6 (14)* 4 (9) | 2 (20) 0 4 (40) 2 (20) 1 (10) 1 (10) |
| Фаза заболевания Впервые выявленное Резистентность Рецидив Ремиссия Част. ремиссия | 20 (15)* 41 (31) 15 (11) 39 (30) 17 (13) | 10 (15) 14 (20)* 10 (15) 27 (40)* 7 (10) | 8 (16) 22 (45)* 4 (8) 7 (15)* 8 (16) | 2 (13) 5 (33,5) 1 (7) 5 (33,5) 2 (13) | 20 (36)* 16 (29) 2 (4) 13 (24) 4 (7) | 17 (38) 15 (33) 1 (2) 10 (22) 2 (5) | 3 (30) 1 (10) 1 (10) 3 (30) 2 (20) |
| ПХТ Стандартная Высокодозная Другая | 113 45 (40) 51 (45)* 17 (15)* | 63 26 (41) 31 (49)** 6 (10) | 35 12 (34) 17 (49) 6 (17) | 15 7 (47) 3 (20) 5 (33) | 44 24 (54) 7 (16)* 13 (30)* | 38 22 (58) 5 (13)** 11 (29) | 6 2 (33,3) 2 (33,3) 2 (33,3) |
| Связь с ПХТ До ПХТ В период ПХТ После ПХТ | 1 (1) 27 (24) 85 (75) | 0 14 (22) 49 (78) | 1 (3) 7 (20) 27 (77) | 0 6 (40) 9 (60) | 1 (2) 11 (25) 32 (73) | 1 (3) 10 (26) 27 (71) | 0 1 (17) 5 (83) |
| Глюкокортикоиды | 73 (55) | 41 (60) | 25 (51) | 7 (47) | 29 (53) | 23 (51) | 6 (60) |
| Селективная деконтаминация | 106 (80) | 55 (81) | 41 (84) | 10 (67) | 39 (71) | 32 (71) | 7 (70) |
| Противогрибковая профилактика | 41 (31) | 26 (38) | 12 (24) | 3 (20) | 17 (31) | 13 (29) | 4 (40) |
| Перевод в ОРИТ | 30 (23)* | 12 (18)** | 15 (31) | 3 (20) | 29 (53)* | 21 (47)** | 8 (80) |
Примечание. * - отмечены отличия, p<0.05. ОМЛ – острый миелоидный лейкоз, ОЛЛ – острый лимфобластный лейкоз, ЛСА – лимфосаркома/лимфома Беркитта, ЛГМ – лимфогранулематоз, АА- апластическая анемия
Ни глюкокортикоиды в схемах цитостатической терапии, ни селективная деконтаминация кишечника, ни противогрибковая профилактика не оказали влияние на состав микрофлоры при сепсисе. Не было выявлено зависимости в спектре возбудителей от этапа ПХТ (до ПХТ, в период ПХТ, после ПХТ)
В 59 (32%) случаях сепсиса возникла необходимость перевода больных в отделение реанимации. Причинами перевода были в 20 (34%) случаях септический шок, в 25 (42%) - дыхательная недостаточность, в 8 (14%) - нарушение сознания, в 4 (7%) - нарушение сердечного ритма, в 2 (3%) - другие причины.
Перевод в отделение реанимации был достоверно чаще при сепсисе, обусловленном грамотрицательными неферментирующими бактериями, чем энтеробактериями (53% против 23%, p=0.0001), по причине значимого преобладания случаев перевода при выделении из гемокультур P.aeruginosa над E.coli и K.pneumoniae без продукции БЛРС (47% против 18%). Септический шок, как причина перевода больных в отделение интенсивной терапии, преобладал при сепсисе, обусловленном энтеробактериями (60%), а дыхательная недостаточность в сочетании с гипотензией - при сепсисе, обусловленном неферментирующими бактериями (60%).
Этиологическая структура сепсиса, обусловленного грамотрицательными бактериями, оказалась статистически значимой от такого показателя как антибиотики: было их применение или нет на момент выделения бактерий из крови, табл. 11. Так, бактерии из крови были выделены в 59 (32%) из 187 случаев на фоне проводимого уже лечения антибиотиками, а в 128 (68%) – до назначения антибиотиков, т.е. антибиотики были назначены сразу после взятия крови. Микроорганизмы высокого уровня резистентности, такие как P.aeruginosa, другие неферментирующие бактерии, в составе которых преобладали Acinetobacter spp, достоверно чаще выделяли из гемокультур уже на фоне проводимого лечения антибиотиками (52,5% против 19%), когда в процессе антимикробной терапии создавались условия для селекции полирезистентных бактерий (“индуцированный” сепсис). Штаммы низкого уровня резистентности, E.coli и K.pneumoniae без продукции БЛРС, значимо чаще выделяли из крови при впервые возникшей лихорадке, и лечение антибиотиками не предшествовало выделению бактерий из крови (“самостоятельный” сепсис).
Таблица 11. Спектр микроорганизмов, выделенных на фоне и без применения антибиотиков
| Грамотрицательные бактерии | Выделение бактерий из крови, n (%) | p | |
| на фоне применения антибиотиков n=59 | до назначения антибиотиков n=128 | ||
| ЕК | 4 (7) | 64 (50) | <0,0001 |
| ЕК, БЛРС | 18 (30,5) | 31 (24) | >0,05. |
| ДрЭн | 6 (10) | 9 (7) | >0,05 |
| РА | 23 (39) | 22 (17) | 0,001 |
| ДрНф | 8 (13,5) | 2 (2) | 0,001 |
Таблица 12. Антибиотики, на фоне применения которых выделены бактерии из крови
| Антибиотики | Грамотрицательные бактерии, n (%) | ||||||
| Семейство Enterobacteriaceae, n=28 | Неферментирующие бактерии, n=31 | ||||||
| Всего n=28 | ЕК n=4 | ЕК, БЛРС n=18 | ДрЭн n=6 | Всего n=31 | PA n=23 | ДрНф n=8 | |
| Цефалоспорины III поколения + амикацин | 9 (32) | 1 | 7 (39) | 1 | 9 (29) | 7 (30) | 2 |
| Цефалоспорины III поколения | 11 (39) | 2 | 6 (33) | 3 | 10 (32) | 5 (22) | 5 |
| Карбапенемы | 1 (4)* | 0 | 1 (6) | 0 | 10 (32)* | 9 (39) | 1 |
| Другие антибиотики | 7 (25) | 1 | 4 (22) | 2 | 2 (7) | 2 (9) | 0 |
Примечание. * - отмечены отличия р=0.02
На фоне применения цефалоспоринов были выделены из гемокультур как энтеробактерии (32%), в основном с продукцией БЛРС, так и неферментирующие бактерии (29%), а на фоне применения карбапенемов достоверно чаще выделяли неферментирующие бактерии (32% против 4%, p=0,008) за счет преобладания P.aeruginosа (32%), табл. 12.
Клинические проявления сепсиса
При сепсисе, обусловленном грамотрицательными бактериями, были изучены клинические симптомы и характер инфекционных осложнений в течение семи дней до выделения бактерий из крови, в день выделения бактерий из крови, на второй и последующие дни после выделения бактерий из крови (в процессе терапии сепсиса).
В течение семи дней до выделения бактерий из крови симптомы инфекции отсутствовали в 65% случаев, значимо чаще при сепсисе, обусловленном энтеробактериями в сравнении с неферментирующими бактериями (74% против 44%, p<0.0001). Регистрация симптомов инфекции в этот период была в 35% случаев, причем, температура в сочетании с другими признаками, такими как озноб, одышка, “отсевы” на коже, определялась достоверно чаще при сепсисе, обусловленном энтеробактериями с продукцией БЛРС (23%) и P.aeruginosa (18%), чем энтеробактериями без продукции БЛРС (1,5%, p=0.0002).
В день выделения бактерий из крови симптомы инфекции присутствовали во всех случаях.
На второй и последующие дни после выделения бактерий из крови симптомы инфекции сохранялись у большинства больных (76%). В этот период, как и в период до выделения бактерий из крови, симптомы инфекции были представлены значимо чаще только температурой при сепсисе, обусловленном энтеробактериями (40% против 18%, p<0.0001), а температурой в сочетании с иными признаками инфекции – неферментирующими бактериями (64% против 31%, p=0.0002).
Клинически диагностируемые инфекционные осложнения были определены в течение семи дней до выделения бактерий из крови в 64% (n=119) случаев, в день выделения бактерий из крови - во всех случаях, на второй и последующие дни после обнаружения бактерий из крови - в 85% (n=159) случаев. Основными инфекционными осложнениями были пневмония (53%), мукозит/стоматит (40%), некротическая энтеропатия (30%), парапроктит (12%), табл. 13.
Таблица 13. Основные инфекционные осложнения при сепсисе, обусловленном грамотрицательными бактериями
| Грамотрицательные бактерии | Пневмония n (%) | Мукозит/ стоматит n (%) | Некротическая энтеропатия n (%) | Парапроктит n (%) | |
| Род, вид бактерий | n | ||||
| Семейство Enterobacteriaceae ЕК ЕК, БЛРС ДрЭн | 132 68 49 15 | 54 (41)* 22 (32)** 27 (55) 5 (33) | 62 (47)*** 36 (53)# 19 (39) 7 (47) | 41 (31) 20 (29) 17 (35) 4 (27) | 16 (12) 10 (15) 6 (12) 0 |
| Неферментирующие бактерии PA ДрНф | 55 45 10 | 46 (84)* 38 (84)** 8 (80) | 13 (24)*** 13 (29)# 0 | 15 (27) 13 (29) 2 (20) | 7 (13) 6 (13) 1 (10) |
| Всего | 187 | 100 (53) | 75 (40) | 56 (30) | 23 (12) |
Примечание. (*), (#) - отмечены отличия *p<0.0001, **p=0,004, ***p=0.004, #p=0.01
Таблица 14. Сопутствующие инфекции при сепсисе, обусловленном грамотрицательными бактериями
| Грамотрицательные бактерии | Простой герпес, n (%) | ЦМВ n (%) | ИА n (%) | Кандиде мия, n (%) | Пневмоци сты, n (%) | Бактерии, кровь, n (%) | |
| Род, вид бактерий | n | ||||||
| Семейство Enterobacteriaceae ЕК ЕК, БЛРС ДрЭн | 132 68 49 15 | 28 (21) 16 (24) 9 (18) 3 (20) | 6 (5) 3 (4) 3 (6) 0 | 13 (10) 4 (6) 8 (16) 1 (7) | 5 (4) 3 (4) 2 (4) 0 | 7 (5) 4 (6) 3 (6) 0 | 25 (19) 12 (18) 11 (23) 2 (13) |
| Неферментирую-щие бактерии PA ДрНФ | 55 45 10 | 7 (13) 6 (13) 1 (10) | 3 (5) 1 (2) 2 (20) | 2 (4) 2 (4) 0 | 3 (5) 3 (7) 0 | 5 (9) 5 (11) 0 | 7 (13) 5 (11) 2 (20) |
Примечание. ЦМВ – цитомегаловирус, ИА- инвазивный аспергиллез
Таблица 15. Характеристика сепсиса, обусловленного грамотрицательными бактериями, в зависимости от длительности нейтропении
| Показатели | Изучаемый показатель в зависимости от длительности нейтропении, (%) | ||
| менее 10 дней | 11-20 дней | более 20 дней | |
| Сопутствующие инфекции | 14/54 (26)* | 21/48 (44) | 37/63 (59)* |
| Инфекционные осложнения Мукозит/стоматит Некротическая энтеропатия Парапроктит Пневмония | 23/54 (43) 16/54 (30) 4/54 (7)* 18/54 (33)* | 19/48 (40) 18/48 (38) 4/48 (8) 21/48 (44) | 29/63 (46) 20/63 (32) 15/63 (24)* 46/63 (73)* |
| Семейство Enterobacteriaceae ЕК ЕК, БЛРС ДрЭн | 37/116 (32) 24/62 (39) 10/42 (24) 3/12 (25) | 33/116 (28) 16/62 (26) 13/42 (31) 4/12 (33) | 46/116 (40) 22/62 (35) 19/42 (45) 5/12 (42) |
| Неферментирующие бактерии PA ДрНф | 17/49 (35) 14/42 (33) 3/7 (43) | 15/49 (30) 13/42 (31) 2/7 (28,5) | 17/49 (35) 15/42 (36) 2/7 (28,5) |
| Симптомы инфекции за неделю до выделения бактерий из крови | 16/54 (30) | 14/48 (29) | 21/63 (33) |
| Симптомы инфекции после выделения бактерий из крови | 30/54 (56)* | 40/48 (83) | 56/63 (89)* |
| Инфекционные осложнения за неделю до выделения бактерий из крови | 34/54 (63) | 31/48 (65) | 37/63 (59) |
| Инфекционные осложнения после выделения бактерий из крови | 40/54 (74)* | 43/48 (90) | 57/63 (90)* |
Примечание. В столбцах – изучаемый показатель к общему числу случаев (n/из);
* отмечены отличия p<0.05, нейтропения - гранулоцитов <0,5 х 109/л.
Пневмонии регистрировали достоверно чаще при сепсисе, обусловленном неферментирующими бактериями в сравнении с бактериями семейства Enterobacteriaceae (84% против 41%, p<0.0001) по причине значимого преобладания их при сепсисе, вызванном P.aeruginosa (84%). Развитие пневмонии предшествовало выделению из крови “проблемных” бактерий, таких как P.aeruginosa, иных неферментирующих бактерий, E.coli и K.pneumoniae с продукцией БЛРС. Мукозит (стоматит) возникал значимо чаще при сепсисе, обусловленном грамотрицательными бактериями семейства Enterobacteriaceae в сравнении с неферментирующими бактериями (47% против 24%, p=0,004) по причине достоверного преобладания этих осложнений при выделении из крови E.coli и K.pneumoniae без продукции БЛРС (53%) в сравнении со штаммами P.aeruginosa (29%, p=0.01). Развитие некротической энтеропатии, парапроктита было сопоставимым при разных бактериях.
В процессе терапии грамотрицательного сепсиса была отмечена высокая частота разнообразных сопутствующих инфекций другой этиологии, табл. 14. Вероятность развития инфекций другой этиологии находилась в корреляции с длительностью нейтропении, не было выявлено зависимости их частоты от видовой принадлежности бактерий, табл. 15. Так, диагностика инфекций другой этиологии была достоверно выше при длительности нейтропении более 20 дней, чем при нейтропении менее 10 дней (59% против 26%, p=0,0005). При нейтропении дительностью более 20 дней достоверно чаще диагностировали инфекционные осложнения, такие как пневмония (73% против 33%, p<0,0001), парапроктит (24% против 7%, p=0,01), табл. 15. У больных грамотрицательным сепсисом и пневмонией значимо чаще определяли другие микроорганизмы в этиологии инфекционного процесса, чем у больных без пневмонии (24% против 9%, p=0.007). Инвазию легких аспергиллами, пневмоцистами и цитомегаловирусом выявляли при грамотрицательном сепсисе только у больных с пневмонией. Длительность нейтропении не оказала влияние на видовую принадлежность грамотрицательных бактерий из гемокультур.
Антимикробная терапия
Антибиотики были применены в лечении 186 случаев сепсиса, обусловленного грамотрицательными бактериями. Назначение антибиотиков 1-го этапа было успешным в 43% случаев, значимо чаще при выделении из крови бактерий семейства Enterobacteriaceae в сравнении с неферментирующими бактериями (49% против 29%, p=0.01), табл. 16.
Таблица 16. Анализ антимикробной терапии сепсиса, обусловленного грамотрицательными бактериями
| Показатели | Грамотрицательные бактерии, n (%) | ||
| Всего n=187 | Семейство Enterobacteriaceae n=132 | Неферментирующие бактерии n=55 | |
| Антибиотики назначены | 186 (99) | 131 (99) | 55 (100) |
| Эффективность антибиотиков 1-го этапа | 80 (43) | 64 (49)* | 16 (29)* p=0.01 |
| Добавление к антибиотикам 1-го этапа других препаратов | 87 (47) | 57 (44) | 30 (55) |
| Добавление ванкомицина Эффективно | 82 (44) 21 (26) | 51 (39)* 16 (31) | 31(56)* p=0.03 5 (16) |
| Добавление амфотерицина В Эффективно | 86 (46) 26 (30) | 56 (43) 22 (39)* | 30 (55) 4 (13)* p=0.01 |
| Назначение карбапенема Имипенем Меропенем | 94 (51) 53 (56) 41 (44) | 59 (45)* 33 (56) 26 (44) | 35 (64*) p=0,02 20 (57) 15 (43) |
| Карбапенем эффективен | 46 (49) | 36 (61)* | 10 (29)* p=0,003 |
Минимальная эффективность антибиотиков 1-го эапа была определена для P.aeruginosa (31%) и штаммов E.coli и K.pneumoniae с продукцией БЛРС (33%), максимальная – для E.coli и K.pneumoniae без продукции БЛРС (59%). На первый взгляд эффективность антибиотиков 1-го этапа может показаться невысокой. Однако в многоцентровых исследованиях эффективность антибиотиков 1-го этапа составляет 40 - 45% при эмпирическом применении, а нами были получены те же результаты по эффективности при терапии наиболее тяжелой микробиологически доказанной инфекции - грамотрицательного сепсиса.
Добавление других антимикробных препаратов к антибиотикам 1-го этапа было в 47% случаях: ванкомицина в 44% случаях, амфотерицин В – в 46%. Несмотря на то, что дополнительные назначения чаще проводили при сепсисе, обусловленном грамотрицательными неферментирующими бактериями (в 56% - ванкомицин, в 55%- амфотерицин В), была отмечена низкая эффективность амфотерицина В и ванкомицина при этих возбудителях, которая составила 13% и 16%, соответственно. В большинстве случаев сохраняющаяся лихорадка была обусловлена неэффективностью назначенных антибиотиков по причине резистентности микроорганизмов, вызвавших сепсис, а не из-за присоединения дополнительной инфекции. В целом присоединение ванкомицина привело к положительному результату в 26% случаев, амфотерицина В – в 30%. Назначение карбапенема (имипенема или меропенема) было в 51% случаев. Значимо чаще карбапенем назначали при выделении из крови грамотрицательных неферментирующих бактерий в сравнении с бактериями семейства Enterobacteriaceae (64% против 45%, p=0,02), однако, эффект от назначения карбапенема был достоверно выше при сепсисе, обусловленном бактериями семейства Enterobacteriaceae (61% против 29%, p=0,003). Столь невысокий процент успешной терапии кабапенемом сепсиса, вызванного грамотрицательными неферментирующими бактериями, также был обусловлен высоким уровнем резистентности выделенных из гемокультур микроорганизмов.
На 1-ом этапе антимикробной терапии были назначены следующие антибиотики: сочетание цефалоспорина III-IV поколения с амикацином в 119 (64%) случаях, монотерапия цефалоспорином III-IV поколения в 23 (12%) случаях, карбапенем (имипенем или меропенем) в 28 (15%) случаях (в 22 – монотерапия, в 6 – в сочетании с амикацином), другие антибиотики – в 16 (9%) случаях. Из цефалоспоринов назначали преимущественно цефепим (60%), в остальных случаях цефоперазон, цефоперазон/сульбактам, цефтазидим и крайне редко цефтриаксон (2-3%). Общая эффективность стартовой терапии грамотрицательного сепсиса сочетанием цефалоспорина III-IV поколения с амикацином была значимо выше и составила 51% (61 из 119 случаев) в сравнении с монотерапией цефалоспорином III-IV поколения – 22% (5 из 23, p=0,01). Эффективность сочетания цефалоспорина III-го поколения с амикацином на 1-ом этапе лечения была значимо выше при сепсисе, обусловленном штаммами E.coli и K.pneumoniae без продукции БЛРС, чем штаммами P.aeruginosa (62% против 30%, p=0,01). Сочетание цефепима с амикацином было значимо ниже при выделении из крови штаммов E.coli и K.pneumoniae с продукцией БЛРС в сравнении со штаммами E.coli и K.pneumoniae без продукции БЛРС (25% против 60%, p=0,02).
В 69 (37%) случаях была проведена замена антибиотиков 1-го этапа на другие препараты, из них в 59 (86%) случаях были назначены карбапенемы. Проводя анализ препаратов, назначение которых привело к излечению при грамотрицательном сепсисе, следует отметить 1) эффективность цефалоспоринов была выше при сепсисе, обусловленном энтеробактериями в сравнении с неферментирующими бактериями (62% против 45%); 2) высокую частоту сопутствующих инфекций другой этиологии. Излечение было достигнуто при добавлении препаратов другого спектра активности к сочетанию цефалоспоринов III-IV поколения с аминогликозидом в 47,9% (в 35 из 73) случаев, к карбапенемам - в 58,6% (в 27 из 46) случаев, табл. 17.
Таблица 17. Перечень антимикробных препаратов, при назначении которых достигнуто излечение от грамотрицательного сепсиса
| Антибиотики | Грамотрицательные бактерии, n (%) | ||||||
| Семейство Enterobacteriaceae | Неферментирующие бактерии | ||||||
| Всего | ЕК | ЕК, БЛРС | ДрЭн | Всего | PA | ДрНФ | |
| Всего, n | 101 | 59 | 29 | 13 | 22 | 17 | 5 |
| Цефалоспорин III-IV поколения ± амикацин ± другие Цефалоспорин ± амикацин Цефалоспорин + амикацин + другие | 63 (62) 34 (33) 29 (29) | 40 (68) 19(32) 21 (36) | 13(45) 10(35) 3(10) | 10(77) 5 (38,5) 5(38,5) | 10(45) 4(18) 6(27) | 7(41) 2(12) 5(29) | 3 (60) 2 (40) 1 (20) |
| Карбапенем± другие Карбапенем Карбапенем + другие | 36 (36) 13(13) 23 (23) | 17 (29) 6 (10) 11 (19) | 16 (55) 6 (21) 10 (34) | 3 (23) 1 (8) 2 (15) | 10 (45) 6 (27) 4 (18) | 8 (47) 4 (23,5) 4 (23,5) | 2 (40) 2 (40) 0 |
| Другие антибиотики | 2 (2) | 2 (3) | 0 | 0 | 2 (10) | 2(12) | 0 |
Результаты терапии сепсиса. Факторы, оказывающие влияние на частоту излечений
Выживаемость в течение 60 дней от момента выделения бактерий из крови была значимо выше при сепсисе, обусловленном энтеробактериями в сравнении с грамотрицательными неферментирующими бактериями (87% против 71%, p=0,015), рис.2.

Рисунок 2. Выживаемость при сепсисе, обусловленном энтеробактериями и неферментирующими бактериями, в течение 60 дней от момента выделения бактерий из крови.
Рисунок 3. Выживаемость при сепсисе, обусловленном грамотрицательными бактериями в разные периоды исследования – 2000-2003 гг. и 2004–2006 гг.
Достоверное повышение выживаемости при сепсисе, вызванном грамотрицательными бактериями, отмечено в 2004 –2006 гг. в сравнении с 2000-2003 гг. – 87% против 76% (p=0,026), рис. 3. За анализируемые периоды (2000-2003 гг. и 2004-2006 гг.) выживаемость при сепсисе, вызванном энтеробактериями и неферментирующими бактериями, повысилась соответственно с 83% до 90% и с 66% до 78%, рис. 4 (А), (Б).
Рисунок 4. Выживаемость при сепсисе, обусловленном энтеробактериями (А) и неферментирующими бактериями (Б), в разные периоды исследования – 2000-2003 гг. и 2004-2006 гг.
Определены факторы, оказывающие влияние на результаты терапии грамотрицательного сепсиса, табл. 18. Излечение было статистически ниже при развитии септического шока и перевода больного в реанимацию (25%), при выделении из гемокультур синегнойной палочки (38%), при выделении бактерий из крови на фоне симптомов инфекции в течение недели (38%), при развитии пневмонии (42%), при сохранении симптомов инфекции после выделения бактерий из крови и назначения антимикробных препаратов (58%), при развитии сепсиса у больных апластической анемией (40%). Лечение грамотрицательного сепсиса было более успешным при высокодозной ПХТ (90%), у больных полной или частичной ремиссии гемобластоза (84%), при выделении из гемокультур энтеробактерий (77%), при выделении из крови бактерий с благоприятным профилем антибиотикочувствительности (74-76%).
Таблица 18. Излечение при сепсисе, обусловленном грамотрицательными бактериями, в зависимости от анализируемых факторов
| Анализируемые факторы | Излечение в зависимости от анализируемого фактора (%) | p | |
| Есть | Нет | ||
| Септический шок и перевод в реанимацию | 15/59 (25) | 108/128 (84) | <0.0001 |
| Симптомы инфекции в течение недели до выделения бактерий из крови | 25/65 (38) | 98/122 (80) | <0.0001 |
| Выделение из крови P.aeruginosa | 17/45 (38) | 106/142 (75) | <0.0001 |
| Пневмония | 42/100 (42) | 81/87 (93) | <0.0001 |
| Симптомы инфекции после выделения бактерий из крови | 83/143 (58) | 40/44 (91) | <0.0001 |
| Высокодозная ПХТ | 52/58 (90) | 58/99 (59) | 0,0001 |
| Полная/ частичная ремиссия гемобластоза | 61/73 (84) | 62/114 (54) | <0.0001 |
| Выделение из крови энтеробактерий | 101/132 (77) | 22/55 (40) | <0.0001 |
| Чувствительность бактерий к цефалоспоринам | 105/139 (76) | 15/43 (35) | <0.0001 |
| Чувствительность бактерий к аминогликозидам | 106/139 (76) | 14/43 (32) | <0.0001 |
| Чувствительность бактерий к карбапенемам | 115/155 (74) | 5/27 (19) | <0.0001 |
| Апластическая анемия | 8/20 (40) | 115/167 (69) | 0,01 |
| Сопутствующие инфекции | 52/84 (62) | 71/103 (69) | 0.3 |
| Мукозит/стоматит | 55/75 (73) | 68/112 (61) | 0,09 |
| Некротическая энтеропатия | 36/56 (64) | 87/131 (66) | 0,7 |
| Парапроктит | 12/23 (52) | 111/164 (68) | 0,1 |
Примечание. В столбцах – число случаев излечения к общему числу случаев (n/из).
Сопутствующие инфекции, парапроктит, некротическая энтеропатия, мукозит (стоматит) не оказали значимого влияния на результаты лечения грамотрицательного сепсиса.
Летальные исходы от сепсиса, обусловленного грамотрицательными бактериями, были у 53 (34%) из 155 больных, причем, у 43 (81%) - в период нейтропении (гранулоцитов < 0,5х109/л). Основная доля смертей была у больных резистентной опухолью системы крови (45%), но в то же время немало летальных исходов было зарегистрировано в период ремиссии (19%) и при впервые выявленном заболевании (36%). В ремиссии гемобластоза летальные исходы были достоверно чаще при выделении из крови неферментирующих бактерий, прежде всего полирезистентных штаммов P.aeruginosa, чем энтеробактерий (32% против 7%, p=0,02). Энтеробактерии были значимо чаще причиной летального исхода у больных при резистентности опухоли (64% против 24%, p=0,005). Септический шок или сочетание его с дыхательной недостаточностью являлись основной причиной летальных исходов.
Заключение. Сепсис, обусловленный грамотрицательными бактериями, возникал преимущественно в период нейтропении, с одинаковой частотой у больных в ремиссии и при резистентном течении гемобластоза. На фоне лечения антибиотиками значимо чаще развивался сепсис, вызванный неферментирующими бактериями, прежде всего синегнойной палочкой. Выделение синегнойной палочки из гемокультур достоверно чаще было на фоне применения карбапенема. Симптомы инфекции в течение недели до выделения бактерий из крови значимо чаще определяли при сепсисе, обусловленном неферментирующими бактериями, а после выделения бактерий они сохранялись у большинства больных. Была зарегистрирована высокая частота вовлечения органов и систем в инфекционный процесс, ведущими осложнениями были пневмония, особенно при синегнойном сепсисе, мукозит (стоматит), парапроктит, некротическая энтеропатия. Определена высокая частота инфекций другой этиологии. Длительная нейтропения являлась основным фактором, приводящим к достоверному увеличению частоты сопутствующих инфекций, а также пневмонии, парапроктита. Практически в половине случаев излечение при грамотрицательном сепсисе было достигнуто при добавлении антимикробных препаратов других групп к карбапенемам или к цефалоспоринам III-IV поколения по причине сопутствующих инфекций другой этиологии. На успех терапии сепсиса оказывали влияние вид возбудителя и их чувствительность к антибиотикам, фаза заболевания, характер и длительность инфекционных осложнений.
Результаты терапии инвазивного аспергиллеза легких
Другое крайне тяжелое инфекционное осложнение, частота которого возрастает в последнее время, - это инвазивный аспергиллез легких (ИАЛ). Было проведено изучение впервые возникшего ИАЛ у 75 больных (мужчин 43, женщин 32) с 2000 по 2006 гг., у 44 (59%) пациентов заболевание было диагностировано в течение трех последних анализируемых лет.
В табл. 19 представлена характеристика больных, медиана возраста - 39 лет, колебания от 15 до 78 лет. В структуре ИАЛ основную долю составили больные острыми лейкозами (54%), далее следовали больные лимфосаркомой (13%), апластической анемией (12%). Необходимо отметить высокую частоту ИАЛ у пациентов гемобластозами на этапе индукции, особенно у больных острым миелоидным лейкозом, которая составила 54% (у 12 из 22). В 60% случаев ИАЛ развился при нейтропении (гранулоцитов < 0,5х109/л), медиана длительности которой составила 32,5 дней (от 3 до 144 дней). У 35,5% (у 16 из 45) больных период нейтропении был продолжительным - более 40 дней. Развитие ИАЛ в период нейтропении достоверно увеличилось с 42% (у 13 из 31 больного) до 73% (у 32 из 44) в 2004 –2006 гг. по сравнению с 2000-2003 гг. (p=0.009).
Применение глюкокортикоидов, другой фактор возникновения ИАЛ, было у 55% больных. Профилактическое назначение антимикотиков (29%), эмпирическое назначение амфотерицина В (36%) не предупредили развитие ИАЛ.
Сопутствующие инфекции при ИАЛ были зафиксированы у 44% пациентов, причем, у 12% (у 9 из 75) больных они были обусловлены двумя возбудителями, табл. 20. Достоверно чаще сопутствующие инфекции регистрировали с 2004 г. по 2006 г. (57% против 26%, p=0,01). В этот период значимо чаще выявляли вирусные инфекции (36% против 10%, p=0,01), бактериемию (32% против 3%, p=0,003), грамотрицательные бактерии из крови (25% против 3%, p=0,01). Частота обнаружения пневмоцист была одинаковой в анализируемые периоды, а у двух больных наблюдалось выделение кандид из крови. Регистрируемое увеличение частоты сопутствующих инфекций было обусловлено как улучшением диагностики, так и интенсификацией программ иммуносупрессивной терапии.
Таблица 19. Характеристика больных ИАЛ
| Показатели | Число больных | |
| абс. | % | |
| Диагноз: ОМЛ ОЛЛ ЛСА АА Другие | 22 19 10 9 15 | 29 25 13 12 20 |
| Фаза заболевания: впервые выявленное резистентность к ПХТ рецидив ремиссия | 28 26 8 13 | 37 35 11 17 |
| Гранулоцитов < 0,5х109/л при включении в исследование | 45 | 60 |
| Длительность нейтропении (гранулоцитов< 0,5х109/л) 6-20 дней 21-30 дней 31-40 дней >40 дней | 13 9 7 16 | 29 20 15,5 35,5 |
| Терапия глюкокортикоидами | 41 | 55 |
| Профилактика антимикотиками флуконазол итраконазол нистатин кетоконазол | 22 13 5 3 1 | 29 17 7 4 1 |
| Эмпирическое назначение антимикотиков | 27 | 36 |
Примечание. В ОМЛ включены – острый миело/монобластный лейкоз (n=18), острый промиелоцитарный лейкоз (n=3), острый эритробластный лейкоз – (n=1); ЛСА – лимфосаркома, включены 2 больных с лимфомой Беркитта; АА - апластическая анемия; другие – хронический лимфолейкоз (n=5), хронический миелолейкоз - (n=2), реципиенты аллогенного костного мозга (n=2), лимфогранулематоз (n=2), по одному случаю сублейкемический миелоз, волосатоклеточный лейкоз, острая печеночная порфирия, множественная миелома
Таблица 20. Сопутствующие инфекции при ИАЛ
| Сопутствующие инфекции | Число больных ИАЛ, n (%) | p | ||
| Всего n=75 | 2000-2003гг n=31 | 2004-2006гг n=44 | ||
| Всего В том числе два возбудителя | 33 (44) 9 (12) | 8 (26)* 0 | 25 (57)* 9 (21) | 0,01 |
| Вирусы | 19 (25) | 3 (10) * | 16 (36)* | 0,01 |
| Бактериемия (всего) Грамотрицательные бактерии Грамположительные бактерии | 15 (20) 12 (16) 3 (4) | 1 (3)* 1 (3)* 0 | 14 (32)* 11 (25)* 3 (7) | 0,003 0,01 |
| Кандиды (кровь) | 2 (3) | 1 (3) | 1 (2) | > 0.05 |
| Пневмоцисты | 6 (8) | 3 (10) | 3 (7) | > 0.05 |
За анализируемые периоды произошли изменения в диагностике ИАЛ: в 2004-2006 гг. отмечено достоверное снижение частоты выделения культуры Aspergillus spp. (9% против 42%, p=0,001) и увеличение доли определения положительного антигена Aspergillus (59% против 26%, p=0,006), табл. 21. Культура Aspergillus spp. была выделена у 28 (37%) больных, из них у 24 был определен один вид Aspergillus spp., у 4 – ассоциация двух видов Aspergillus spp., табл. 22. Видовое разнообразие было представлено, прежде всего, A.fumigatus (68%), далее A.flavus (18%), A.niger (5%), A.versicolor (3,5%), в 1 (3,5%) случае идентификацию до вида не проводили. Видовая принадлежность грибов в анализируемые периоды была идентичной. У 8 больных Aspergillus spp. были выделены из мокроты, у 16 - из бронхоальвеолярной жидкости, у 3 – из содержимого бронхов (смыв), у 1 - из биоптата легкого.
Таблица 21. Диагностика ИАЛ
| Показатели | Число больных ИАЛ, n (%) | p | ||
| Всего n=75 | 2000-2003 гг. n=31 | 2004-2006гг. n=44 | ||
| Культура Aspergillus (только) | 17 (23) | 13 (42)* | 4 (9)* | 0,001 |
| Культура Aspergillus + антиген Aspergillus | 11 (15) | 4 (13) | 7 (16) | >0.05 |
| Антиген Aspergillus (только) | 34 (45) | 8 (26)* | 26 (59)* | 0,006 |
| КТ легких (только) | 13 (17) | 6 (19) | 7 (16) | >0.05 |
Положительный антиген Aspergillus (галактоманнан) был выявлен у 45 (60%) больных ИАЛ. Диагноз ИАЛ был поставлен только на основании изменений компьютерной томографии легких у 13 (17%) больных, но у троих из них Aspergillus spp. были выявлены позже, в процессе лечения, из исследуемых образцов нижних дыхательных путей. Таким образом, в соответствии с Международными критериями частота доказанного инвазивного аспергиллеза легких составила 1% (1 больной, биопсия легкого), вероятного – 82% (61 больной), возможного – 17% (13 больных).
Таблица 22. Спектр Aspergillus spp. при ИАЛ
| Спектр Aspergillus spp. | Число больных ИАЛ, n (%) | ||
| Всего n=28 | 2000-2003гг. n=17 | 2004-2006гг. n=11 | |
| A. fumigatus A. fumigatus (монокультура) A. fumigatus + A. niger A. fumigatus + A. flavus | 19 (68) 15 (54) 2 (7) 2 (7) | 12 (70) 10 (58) 1 (6) 1 (6) | 7 (64) 5 (46) 1 (9) 1 (9) |
| A. flavus | 5 (18) | 2 (12) | 3 (27) |
| A. niger | 2 (7) | 1 (6) | 1 (9) |
| A.versicolor | 1 (3,5) | 1 (6) | 0 |
| Идентификацию не проводили | 1 (3,5) | 1 (6) | 0 |
У всех больных отмечалось поражение легких, выявленное у 68 пациентов при рентгенологическом исследовании и компьютерной томографии, у 3 - только при рентгенографии, у 4 - только при компьютерной томографии. Диагностическая информативность рентгенологических исследований при ИАЛ была невысокой: cовпадение изменений в легких на рентгенограммах и компьютерных томограммах было лишь у 31% больных (у 21 из 68). Проявления при ИАЛ на рентгенограммах легких оказались малоинформативными у 29% пациентов (у 20 из 68), а у 40% больных (у 27 из 68) они вообще отсутствовали. В табл. 23 представлена характеристика поражений легких при ИАЛ. Необходимо отметить, что изменения в диагностике ИАЛ, которые заключались в определении антигена Aspergillus, привели к более раннему выявлению инвазии аспергиллами легких по данным компьютерной томографии, поскольку было отмечено снижение поздних томографических признаков ИАЛ (симптом “серпа”) с 26% до 9% (p=0,05), табл. 23.
Таблица 23. Характеристика поражений легких при ИАЛ
| Поражение легких | Число больных ИАЛ, n (%) | ||
| Всего n=75 | 2000-2003гг. n=31 | 2004-2006гг. n=44 | |
| Очаг (до 3 см) | 30 (40) | 9 (29) | 21 (48) |
| Фокус/инфильтрат (более 3 см) | 45 (60) | 22 (71) | 23 (52) |
| Симптом “серпа” | 12 (16) | 8 (26)* | 4 (9)* |
| Симптом “ореола” | 5 (7) | 0 | 5 (11) |
Примечание. * - отмечены отличия p=0,05. Симптомы “ореола” и “серпа” выявлены в очагах и фокусах поражения при ИАЛ.
Клинические проявления ИАЛ были неспецифичными у большинства больных. Температура более 38°С была зарегистрирована у 64 (85%) больных, менее 38°С – у 9 (12%), нормальная температура – у 2 (3%). Нормальная температура была у больного ХЛЛ и у реципиента аллогенного костного мозга. Другими проявлениями инфекции были кашель (49%), боль при дыхании (9%), одышка (9%). Кашель с выделением мокроты “ржавого” характера или с примесью крови относится к специфичным симптомам ИАЛ, однако, такой симптом был лишь у 9 пациентов (12%). У 17 (23%) больных выделялась мокрота без примеси крови, у 11 (15%) – был сухой частый надсадный кашель. Аускультативная симптоматика при ИАЛ также была неспецифичной, чаще дыхание было везикулярное и такое проявление наблюдалось у 47 (63%) больных.
С января 2000 г. по сентябрь 2004 г. для лечения ИАЛ использовали в основном амфотерицин В. С сентября 2004 г лечение ИАЛ стали проводить по новой программе, основные принципы этой программы были следующие: стартовая терапия ИАЛ вориконазолом (внутривенное введение), активное проведение компьютерной томографии легких на 7-9й день лечения вориконазолом и модификация лечения с учетом результатов исследования, назначение сочетания антимикотиков при рефрактерном ИАЛ. В случае положительной динамики, которая определялась сочетанием клинических (снижение или нормализация температуры) и радиологических (очаги в легких без динамики, нет дополнительных или уменьшение размеров старых очагов) признаков, назначали вориконазол в таблетках. Следующую компьютерную томографию легких проводили на 30й день от начала терапии вориконазолом.
Стартовое лечение ИАЛ было проведено амфотерицином В 50 больным, вориконазолом – 21, каспофунгином – 3, липосомальным амфотерицином В – 1. Излечение было достигнуто у 55% (у 41 из 75) больных. Процент излечений (монотерапия) при терапии вориконазолом был значимо выше, чем при лечении амфотерицином В: 77% (у 17 из 22, дополнительно в одном случае назначали при неэффективности амфотерицина В) против 34% (у 17 из 50, p=0,001). Выживаемость в течение 90 дней от момента диагностики ИАЛ составила 54,7% и была достоверно выше при лечении вориконазолом, чем амфотерицином В - 77,3% против 44% (p=0,012), рис. 5 (А), (Б).
Летальные исходы при ИАЛ были у 34 (45%) пациентов, у 21 (62%) из них при резистентной опухоли. Смерть в ремиссии зарегистрирована у 2 (6%) больных, у 11 (32%) пациентов - в период курсов индукции. Причиной смерти у 3 больных было легочное кровотечение, у 1 – кома (диссеминация аспергилл в головной мозг), у 6 - септический шок (присоединение бактериальной инфекции), у остальных – дыхательная недостаточность.
Рисунок 5. Выживаемость при ИАЛ в течение 90 дней (А), выживаемость при ИАЛ в зависимости от варианта лечения (Б)
Определены факторы, оказывающие влияние на результаты терапии ИАЛ, табл. 24. Процент излечений был значимо ниже при резистентности опухоли (15%), при сохранении нейтропении (11%), при выделении культуры Aspergillus (32%), при проведении стартовой терапии ИАЛ амфотерцином В (34%). Частота излечений была достоверно выше при остром лейкозе (66%) в сравнении с другими нозологическими формами, при нейтропении длительностью менее 40 дней (66%).
Таблица 24. Излечение при ИАЛ в зависимости от анализируемых факторов
| Анализируемые факторы | Излечение в зависимости от анализируемого фактора (%) | p | |
| Есть | Нет | ||
| Резистентность опухоли | 4/26 (15) | 37/49 (76) | <0.0001 |
| Сохранение нейтропении | 2/18 (11) | 39/57 (68) | 0,0001 |
| Выделение культуры Aspergillus | 9/28 (32) | 32/47 (68) | 0,0008 |
| Стартовая терапия ИАЛ амфотерицином В | 17/50 (34) | 18/25 (72) | 0,003 |
| Острый лейкоз | 27/41 (66) | 14/34 (41) | 0,03 |
| Длительность нейтропении менее 40 дней | 19/29 (66) | 5/16 (31) | 0,03 |
| Сопутствующая инфекция | 16/33 (48) | 25/42 (60) | >0,05 |
| Профилактика антимикотиком | 12/22 (55) | 29/53 (55) | >0,05 |
| Эмпирическая терапия | 17/27 (63) | 24/48 (50) | >0,05 |
| Глюкокортикоиды | 25/41 (61) | 16/34 (47) | >0,05 |
| Нейтропения | 24/45 (53) | 21/45 (47) | >0,05 |
Примечание. В столбцах – число случаев излечения к общему числу случаев (n/из).
Заключение. ИАЛ развивался преимущественно в период нейтропении, выявлена высокая частота у больных ОМЛ на этапе индукции. Основу ранней диагностики ИАЛ составляли определение антигена Aspergillus и проведение компьютерной томографии легких. У больных ИАЛ была выявлена высокая частота инфекций другой этиологии. Было доказано, что лечение вориконазолом увеличивает выживаемость при ИАЛ. Прогностическими неблагоприятными факторами были резистентность опухоли, сохранение нейтропении, диагностика ИАЛ на основании выделения культуры Aspergillus, назначение амфотерицина В на 1-ом этапе лечения ИАЛ.
Источники инфицирования аспергиллами в гематологическом стационаре
Следующей задачей исследования стало изучение источников инфицирования аспергиллами в гематологическом стационаре. Для решения этой задачи был проведен микологический мониторинг образцов воздуха во всех отделениях ГНЦ РАМН с сентября 2000 по декабрь 2004 года. Внутри помещений центра было отобрано и проанализировано 1345 проб воздуха, выделено 151248 КОЕ мицелиальных грибов. Частота выявления микромицетов составила 93% (1250 из 1345 образцов). Концентрация спор микроскопических грибов в 1 пробе воздуха варьировала от 0 до 1300 КОЕ в м3.
Грибное многообразие воздуха включало 43 вида микромицетов, относящихся к 27 родам. Аспергиллы входили в число доминирующих родов комплекса и занимали третье место. Частота выявления спор Aspergillus spp. в пробах воздуха составила 45% (605 из 1345), удельный вес численности - 5,6% (8455 из 151248 КОЕ). Видовой спектр Aspergillus spp. в воздухе отделений был представлен 17 видами, табл. 25. Наиболее распространенными среди них являлись A.versicolor (42%), A.niger (13%), A.sydowii (12%), A.fumigatus (10%). На протяжении всего периода исследования отмечено постоянство обильного выявления A.versicolor (40-47%), снижение численности A.niger с 17 до 9% и A.fumigatus с 20 до 10%, увеличение уровня A.sydowii с 13 до 20%. Количественное содержание A.flavus сохранялось на уровне 3-4%. Встречаемость доминирующих видов в образцах воздуха составляла 30-66%. Частота обнаружения и численность остальных видов Aspergillus spp. не превышала соответственно 5% и 2%.
Таблица 25. Видовой спектр Aspergillus spp. в воздухе гематологических отделений ГНЦ РАМН (число КОЕ = 8455)
| Название вида | Частота встречаемости в образцах воздуха (%), n=605 | Численность | ||
| КОЕ | % | КОЕ/м3 (диапазон) | ||
| Всего проидентифицировано 8068 | ||||
| A.versicolor | 400 (66) | 3360 | 42 | 2-96 |
| A.niger | 181 (30) | 1006 | 13 | 2-6 |
| A.sydowii | 115 (19) | 982 | 12 | 2-32 |
| A.fumigatus | 163 (27) | 818 | 10 | 2-18 |
| A.ochraceus | 132 (21) | 708 | 9 | 2-6 |
| A.alliaceus | 111 (18) | 406 | 5 | 2-6 |
| A.flavus | 66 (11) | 348 | 4 | 2-6 |
| A.flavipes | 30 (5) | 160 | 2 | 2-8 |
| A.ruber | 42 (7) | 92 | 1,0 | 2-6 |
| A.candidus | 18 (3) | 52 | 0,6 | 2-4 |
| A.restrictus | 20 (3) | 40 | 0,4 | 2 |
| A.terreus | 20 (3) | 20 | 0,2 | 2 |
| A.amsteloidamii | 10 (1,6) | 20 | 0,2 | 2 |
| A.nidulans | 8 (1) | 16 | 0,2 | 2 |
| A.clavatus | 6 (1) | 16 | 0,2 | 2-4 |
| A.glaucus | 4 (0,6) | 12 | 0,1 | 2-4 |
| A.sclerotiorum | 6 (1) | 12 | 0,1 | 2 |
Исследование 24 образцов воздуха на улице выявило более скудный видовой состав Aspergillus spp., ограниченный 10 видами. Частота выявления аспергилл составила 54% (13 из 24 образцов). В структуре грибного комплекса внешней среды преобладали следующие виды: A.alliaceus – 27%, A.fumigatus – 16%, A.niger – 14%.
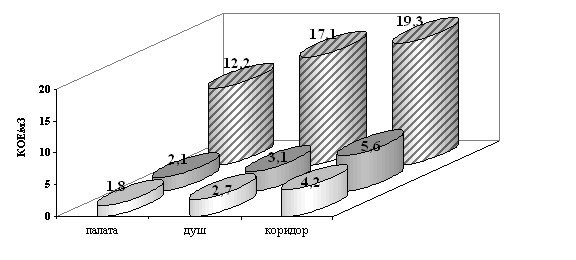
Рисунок 6. Концентрация спор Aspergillus spp. в воздухе различных отделений ГНЦ РАМН
Концентрация спор аспергилл в воздухе палат, душевых комнат и коридора представлена на рис.6. Минимальное содержание установлено в палатах, оснащенных системой вентиляции с ламинарным потоком воздуха (1,8 КОЕ/м3) и современных одноместных палатах, оборудованных приточно-вытяжной системой вентиляции (2,1 КОЕ/м3). Наиболее заспоренным был воздух в четырехместных палатах с общей обменной вентиляцией (12,2 КОЕ/м3). Максимальное содержание аспергилл в воздухе отмечено в коридоре. Выявлено существенное увеличение содержания спор Aspergillus spp.в воздухе отделений центра во время ремонтных работ. При замене напольного покрытия и дверной коробки в палате численность спор возросла с 3,0 КОЕ/м3 (до ремонта) до 19,5 КОЕ/м3 (в период ремонта). После окончания ремонтных работ содержание спор Aspergillus spp. снизилось до 1,5 КОЕ/м3. Включение вентиляции в новом отделении привело к снижению концентрации Aspergillus spp. в палатах с 4,8 КОЕ/м3 до 0,5 КОЕ/м3, в душевых комнатах – с 5,3 КОЕ/м3 до 0,8 КОЕ/м3, в коридоре – с 6,8 КОЕ/м3 до 2,4 КОЕ/м3.
Заключение. Было доказано, что аспергиллы являются типичными представителями комплекса микромицетов, сформированного в воздухе гематологического стационара. Минимальная концентрация спор аспергилл была выявлена в одноместных палатах с ламинарным потоком воздуха и оснащенных приточно-вытяжной системой вентиляции.
ВЫВОДЫ
1. Тяжелые инфекционные осложнения у больных гемобластозами и депрессиями кроветворения развиваются преимущественно в период критической нейтропении.
2. Этиологическая структура возбудителей сепсиса у больных гемобластозами и депрессиями кроветворения характеризуется широким разнообразием микроорганизмов; частота выделения из гемокультур грамотрицательных аэробных бактерий составляет 49,1%, грамположительных аэробных бактерий – 43,4%, анаэробных бактерий – 0,2%, грибов – 7,3%; у 7% больных этиология сепсиса полимикробная.
3. Ведущими возбудителями сепсиса являются Escherichia coli (18,6%), стафилококк коагулазонегативный (18,0%), Enterococcus spp. (9,9%), Klebsiella pneumoniae (7,3%), Pseudomonas aeruginosa (7,0%), Streptococcus группы “viridans” (6,0%); грибы в общей структуре микроорганизмов занимают пятую позицию, определена низкая встречаемость C.albicans (21%).
4. Микроорганизмы, выделенные из гемокультур, проявляют высокий уровень резистентности к антимикробным препаратам, отмечена высокая частота выделения энтеробактерий с продукцией бета - лактамаз расширенного спектра, максимальная активность в отношении грамотрицательных бактерий определена у карбапенемов, из цефалоспоринов – у цефоперазона/сульбактама и цефепима, из аминогликозидов – у амикацина, в отношении грамположительных бактерий - у линезолида; выделены энтерококки, устойчивые к ванкомицину.
5. Молекулярное исследование грамотрицательных бактерий, выделенных из крови, доказывает наличие в стационаре двух путей инфицирования бактериями – экзогенного и эндогенного, с преобладанием эндогенного варианта; установлено, что для Escherichia coli наиболее характерным является эндогенный, а для других грамотрицательных бактерий, особенно для Pseudomonas aeruginosa, – смешанный вариант инфицирования.
6. Симптомы инфекции в течение недели до выделения бактерий из крови достоверно чаще присутствуют при сепсисе, обусловленном неферментирующими бактериями в сравнении с энтеробактериями (74% против 44%); выделение из гемокультур Escherichia coli и Klebsiella pneumoniae без продукции бета - лактамаз расширенного спектра значимо чаще происходит у больных вне лечения антибиотиками (50% против 7%), а неферментирующих бактерий - на фоне терапии антибиотиками (52,5% против 19%); на фоне применения карбапенемов достоверно чаще возникает сепсис, обусловленный Pseudomonas aeruginosa.
7. Для грамотрицательного сепсиса характерна высокая частота осложнений, основные из них - пневмония (53%), мукозит/стоматит (40%), некротическая энтеропатия (30%); пневмонии преобладают при сепсисе, обусловленном неферментирующими бактериями, прежде всего Pseudomonas aeruginosa, в сравнении с энтеробактериями (84% против 41%).
8. При грамотрицательном сепсисе и инвазивном аспергиллезе отмечена высокая частота инфекций другой этиологии, определяющим в их развитии является длительность нейтропении более 20 дней по сравнению с 10 днями (59% против 26%).
9. Неблагоприятными факторами, оказывающими влияние на частоту излечений при грамотрицательном сепсисе, являются развитие септического шока и перевод больного в реанимацию (25%), выделение из гемокультур синегнойной палочки (38%), выделение бактерий из крови на фоне симптомов инфекции в течение недели (38%), развитие пневмонии (42%), сохранение симптомов инфекции после выделения бактерий из крови и назначения антимикробных препаратов (58%), развитие сепсиса у больных апластической анемией (40%).
10. Лечение вориконазолом инвазивного аспергиллеза легких приводит к достоверному увеличению частоты излечений; выживаемость в течение 90 дней при лечении вориконазолом составляет 77,3% против 44% при терапии амфотерицином В; факторами неблагоприятного прогноза являются резистентность опухоли (15%), сохранение нейтропении (11%), выделение культуры Aspergillus (32%), проведение лечения амфотерцином В (34%).
11. Аспергиллы являются типичными представителями комплекса микромицетов воздуха гематологического стационара, минимальная концентрация их определена в одноместных палатах с ламинарным потоком воздуха и оснащенных приточно-вытяжной системой вентиляции.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Инфекционные осложнения у больных гемобластозами и депрессиями кроветворения характеризуются 1) широким спектром возможных возбудителей; 2) высоким уровнем резистентности грамотрицательных бактерий к антимикробным препаратам, 3) высокой частотой сопутствующих инфекций другой этиологии (грибы, вирусы и др.).
2. Основными диагностическими исследованиями при лихорадке в период нейтропении являются 1) проведение посевов крови до назначения антибиотиков во флаконы для автоматического анализатора гемокультур, 2) мониторинг определения антигена Aspergillus у больных высокого риска развития инвазивного аспергиллеза (больные острым лейкозом и реципиенты аллогенного костного мозга), 3) проведение компьютерной томографии легких при персистирующей лихорадке и нейтропении, 4) микробиологическое исследование образцов, связанных с инфекцией.
3. Препаратами выбора (1й этап эмпирической терапии) при лихорадке в период нейтропении являются цефоперазон/сульбактам или цефепим, их назначают в режиме монотерапии или в сочетании с амикацином. При стойкой персистирующей фебрильной температуре и при отсутствии очага инфекции замену антибиотиков 1-го этапа проводят на карбапенем, имипенем или меропенем, (2й этап эмпирической терапии) ввиду высокой частоты выделения штаммов энтеробактерий с продукцией БЛРС; при наличии очага инфекции модификацию антимикробной терапии проводят согласно результатам микробиологического исследования.
4. При персистирующей лихорадке и сохраняющейся нейтропении повторяют комплекс диагностических исследований, включая компьютерную томографию легких, поскольку частота развития инфекций другой этиологии находится в корреляции с длительностью нейтропении и значимо чаще в этот период диагностируют пневмонию.
5. Препаратом выбора в лечении инвазивного аспергиллеза является вориконазол. При обнаружении дрожжевых грибов в гемокультуре начинают лечение антимикотиком широкого спектра активности: каспофунгином, или амфотерицином В, или вориконазолом; флуконазол назначают только после идентификации грибов и определения чувствительности. Подобная тактика лечения обусловлена низкой долей выделения Candida albicans при фунгемии.
6. Препаратами выбора в лечении инфекций, обусловленных грамположительными бактериями, являются линезолид и ванкомицин. Не обосновано эмпирическое назначение ванкомицина, когда единственным симптомом является лихорадка.
7. Крайне важным в контроле над госпитальными инфекциями является соблюдение эпидемиологических мероприятий – это изоляция больных с полирезистентной микрофлорой, проведение курсов ПХТ в палатах, оснащенных адекватной приточно-вытяжной вентиляцией.
Сокращения, используемые в тексте
ЕК - E.coli и K. pneumoniae
EК, БЛРС - E.coli и K. pneumoniae с продукцией бета - лактамаз расширенного спектра
ДрЭн - другие энтеробактерии
РА - P. aeruginosa
ДрНФ – другие неферментирующие бактерии
Список работ, опубликованных по теме диссертации
- Алехина Л.К., Клясова Г.А., Сперанская Л.Л. и др. Грамотрицательные бактериемии при нейтропении. Проблемы гематологии и переливания крови. 2002, N1, с.3
- Байдильдина Д.Д., Солопова Г.Г., Масчан М.А., Шнейдер М.М., Хачатрян Л.А., Новичкова Г.А., Клясова Г.А., Масчан А.А. Катетерассоциированная фунгемия с поражением легких, вызванная Paecilomyces lilacinus, у 2 больных острым лейкозом. Гематология и трансфузиология. 2007, N4, c.42-46
- Беденков А.В., Решедько Г.К., Кречикова О.И., Клясова Г.А. и др. Чувствительность нозокомиальных штаммов Pseudomonas aeruginosa, выделенных из крови. Клиническая микробиология и антимикробная химиотерапия. 2001, Том 3, приложение, с.9 Материалы IV Международной конференции МАКМАХ “Антимикробная терапия”
- Веселов А.В., Страчунский Л.С., Мултых И.Г., Клясова Г.А. и др. Эпидемиология возбудителей кандидозов и их чувствительность к азолам: результаты исследования ARTEMIS Disk в России. Клиническая микробиология и антимикробная химиотерапия. 2005, N1, c.25-33
- Веселов А.В., Климко Н.Н., Кречикова О.И., Клясова Г.А. и др. In vitro активность флуконазола и вориконазола в отношении более 10000 штаммов дрожжевых грибов: результаты 5-летнего проспективного исследования ARTEMIS Disk в России. Клиническая микробиология и антимикробная химиотерапия. 2008, N10(4) c. 345-354
- Виноградова М.А., Клясова Г.А., Михайлова Е.А., Устинова Е.Н., Савченко В.Г. Инвазивный аспергиллез легких у больных апластической анемией. Успехи медицинской микологии. 2006, том VIII, с.118-119
- Виноградова М.А., Клясова Г.А., Трушина Е.Е., Устинова Е.Н., Михайлова Е.А. Инфекционные осложнения в дебюте апластической анемии. Гематология и трансфузиология. 2007, N4, c.16-21
- Галстян Г.М., Городецкий В.М., Готман Л.Н., Гржималовский А.В., Клясова Г.А., Сперанская Л.Л., Тихонова Л.Ю., Каражас Н.В. Алгоритм диагностики поражений легких при депрессиях кроветворения. Пособие для врачей. М, 2001, МЗ РФ-ГНЦ РАМН, с.1-47
- Готман Л.Н., Яцык Г.А., Клясова Г.А. Ранние компьютерно-томографические признаки в диагностике некоторых микозов легких при миелотоксическом агранулоцитозе. Терапевтический архив. 2008, N7, с.30-33
- Егорова Е.К., Соркина О.М., Сперанская Л.Л., Кравченко С.К., Кременецкая А.М., Клясова Г.А. Нокардиоз легких у иммунокомпрометированных больных. Гематология и трансфузиология. 2007, N4, c.39-42
- Клясова Г., Савченко В., Паровичникова Е., Исаев В., Любимова Л., Менделеева Л. Эффективность итраконазола у больных гемобластозами. Материалы III Международного микологического симпозиума, Санкт-Петербург, 1995, с.63
- Клясова Г.А., Савченко В.Г., Паровичникова Е.Н. и др. Эмпирическая антибиотикотерапия в гематологической клинике. Материалы III Всероссийского съезда гематологов и трансфузиологов, Санкт-Петербург, 1996, с.21
- Клясова Г.А., Савченко В.Г. Микотические инфекции у онкогематологических больных. Проблемы гематологии и переливания крови. 1997, N1, с.20-26
- Клясова Г.А., Савченко В.Г. Тактика антибиотической терапии инфекционных осложнений у больных с критической нейтропенией. Проблемы гематологии и переливания крови. 1998, N4, с.54-64
- Клясова Г.А., Савченко В.Г., Паровичникова Е.Н., Толкачева Т.В., Шулутко Е.М., Хорошко Н.Д. Применение меропенема у больных с нейтропенией. Антибиотики и химиотерапия. 1998, N1, с.28-31
- Клясова Г.А., Савченко В.Г., Паровичникова Е.Н. и др. Эмпирическая антибиотическая терапия у больных острыми лейкозами: итоги многоцентрового исследования. Терапевтический архив. 1998, N7, с.15-21
- Клясова Г.А. Рациональная антибактериальняа терапия при критической нейтропении. Инфекции и антимикробная терапия. 2000, N1, c. 16-24
- Клясова Г.А., Савченко В.Г., Паровичникова Е.Н. и др. Сравнительная эффективность цефтриаксона в сочетании с коротким, в течение трех дней, и длительным применением амикацина у больных с нейтропенией. Результаты сравнительного многоцентрового исследования. Материалы научно-практической конференции, г.Санкт-Петербург, 2000, с.109-110
- Клясова Г.А. Микотические инфекции: клиника, диагностика, лечение. Инфекции и антимикробная терапия. 2000, N6, с.184-189
- Клясова Г.А., Савченко В.Г., Любимова Л.С. и др. Сравнительная эффективность монотерапии меропенемом и комбинации цефтазидима с амикацином в режиме эмпирической терапии при трансплантации костного мозга. Инфекции и антимикробная терапия. 2000, N6, с.172-178
- Клясова Г.А. Инфекционные осложнения у больных с нейтропенией: особенности эпидемиологии и лечения. Кремлевская медицина. 2001, N 1, с.12-20
- Клясова Г.А. Инвазивные микозы в онкогематологии: современное состояние проблемы. Современная онкология. 2001, N2, том 3, с.61-66
- Клясова Г.А., Толкачева Т.В., Петрова Н.А. Эволюция микроорганизмов при миелотоксическом агранулоцитозе. Гематология и трансфузиология. 2001, N3, с.38-42
- Клясова Г.А. Септицемия при нейтропении: алгоритмы диагностики и антибактериальной терапии. Consilium medicum, экстра-выпуск, 2001, с.14-18
- Клясова Г.А., Савченко В.Г., Любимова Л.С. и др. Профилактика дифлюканом грибковых инфекций при трансплантации костного мозга. Гематология и трансфузиология. 2001, N6, с.29-33
- Клясова Г.А., Петрова Н.А., Алехина Л.К. Особенности комплексов микроскопических грибов воздуха в отделениях ГНЦ РАМН. Современная микология в России. Материалы первого съезда микологов, 2002, с.59
- Клясова Г.А., Петрова Н.А., Толкачева Т.В. и др. Фунгемии при гемобластозах. Современная микология в России. Материалы первого съезда микологов, 2002, с.360
- Клясова Г.А., Петрова Н.А., Алехина Л.К. и др. Фунгемия при гемобластозах и ее исходы. Проблемы гематологии и переливания крови. 2002, N1, с.39
- Клясова Г.А., Сперанская Л.Л., Алехина Л.К. Антимикробная активность нового антибактериального препарата сульперазона. Проблемы гематологии и переливания крови. 2002, N1, с.39
- Клясова Г.А., Алехина Л.К., Сперанская Л.Л. и др. Применение сульперазона у иммунокомпрометированных больных. Гематология и трансфузиология. 2002, N6, c.13-17
- Клясова Г.А. Протокол антибиотической терапии у больных гемобластозами. В кн. Программное лечение лейкозов. М., Фолиант, 2002, с.224-238
- Клясова Г.А., Петрова Н.А., Сперанская Л.Л. и др. Фунгемия у иммуноскомпрометированных больных. Результаты восьмилетнего исследования. Успехи медицинской микологии. 2003, Том 2, с.241-242
- Клясова Г.А., Петрова Н.А., Шарикова О.А. и др. Инвазивный аспергиллез в гематологической практике. Успехи медицинской микологии. 2003, Том 2, с.242-243
- Клясова Г.А., Петрова Н.А., Галстян Г.М. и др. Инвазивный аспергиллез у иммуноскомпрометированных больных. Терапевтический архив. 2003, N7, c.63-68
- Клясова Г.А. Глава “Лечение и профилактика инфекционных осложнений при нейтропении.” Руководство по клинической гематологии. под ред. акад. А.И.Воробьев, М., “Ньюдиамед”; 2003, т.2, с.210-231
- Клясова Г.А. Глава “Инфекции в онкогематологии.” Руководство по антимикробной химиотерапии. под ред. В.П.Яковлева, С.В.Яковлева, М., “Литтерра”, 2003, с.483-495
- Клясова Г.А., Петрова Н.А., Савченко В.Г. и др. Инвазивный аспергиллез у иммунокомпрометированных больных. Проблемы медицинской микологии. 2003, том 5, N2, с.38-39
- Клясова Г.А., Петрова Н.А., Толкачева Т.В. и др. Эффективность итраконазола в суспензии при лечении орофарингеального кандидоза у иммунокомпрометированных больных. Проблемы медицинской микологии. 2003, том 5, N2, с.45-46
- Клясова Г.А. Эмпирическая монотерапия цефепимом при фебрильной нейтропении. Антибиотики и химиотерапия. 2003, N7, c.33-38
- Клясова Г.А., Петрова Н.А., Толкачева Т.В. и др. Лечение итраконазолом в суспензии орофарингеального кандидоза у иммунокомпрометированных больных. Гематология и трансфузиология. 2004, N1, с.19-24
- Клясова Г.А., Петрова Н.А., Устинова Е.Н. и др. Итраконазол в суспензии: эффективное применение при орофарингеальном кандидозе у больных гемобластозами. Успехи медицинской микологии. Том IV, 2004, с.221-223
- Клясова Г.А. Место Кансидаса в лечении инвазивных микозов. Русский медицинский журнал. 2004, N5, с.3-6
- Клясова Г.А., Петрова Н.А., Сперанская Л.Л. и др. Фунгемия у иммунокомпрометированных больных: проблема в лечении. Проблемы медицинской микологии. 2004, Том 6, N2, c.83-84
- Клясова Г.А. Кандидозные инфекции в хирургической практике. Русский медицинский журнал. 2004, N8, с.548-561
- Клясова Г.А., Петрова Н.А., Готман Л.Н. и др. Инвазивный аспергиллез легких в гематологической практике. Успехи медицинской микологии. 2005, том VI, с.96-97
- Клясова Г.А., Петрова Н.А., Паровичникова Е.Н. и др. Инвазивный аспергиллез легких. Терапевтический архив. 2005, N7, с.65-71
- Клясова Г.А., Фролова И.Н., Яцык Г.А. и др. Вориконазол – препарат выбора в лечении инвазивного аспергиллеза. Успехи медицинской микологии. 2006, том VIII, с.121-123
- Клясова Г.А., Сперанская Л.Л., Миронова А.В. и др. Возбудители сепсиса у иммунокомпрометированных больных: структура и проблемы антибиотикорезистентности (результаты многоцентрового исследования). Гематология и трансфузиология. 2007, N1, c.11-19
- Клясова Г.А., Паровичникова Е.Н., Галстян Г.М. и др. Алгоритмы лечения и профилактики кандидоза и аспергиллеза у взрослых больных лейкозами, лимфомами и депрессиями кроветворения. Гематология и трансфузиология. 2007, N4, c.3-8
- Клясова Г.А., Бриллиантова А.Н., Миронова А.В. Генотипирование грамотрицательных бактерий, выделенных из крови при сепсисе у больных с гематологическими заболеваниями. Терапевтический архив. 2007, N7, с.74-80
- Клясова Г.А. Глава “Микозы при гемобластозах”. Клиническая онкогематология. под ред. проф. Волковой М.А., М, Медицина, 2007, с.1044-1066
- Клясова Г.А., Трушина Е.Е., Миронова А.В. и др. Сравнительная активность аминогликозидов in vitro в отношении микроорганизмов, выделенных из крови у иммунокомпрометированных больных (результаты многоцентрового исследования). Гематология и трансфузиология. 2008, N6, c.12-17
- Клясова Г.А. Глава “Антимикробная терапия.” Программное лечение лейкозов. под ред. член-корр. Савченко В.Г., М, ООО “Русская книга”, 2008, с.400-425
- Клясова Г.А. Глава “Противогрибковая терапия.” Программное лечение лейкозов. под ред. член-корр. Савченко В.Г., М, ООО “Русская книга”, 2008, с.425-436
- Клясова Г.А. Глава “Современные системные антимикотики. Вориконазол.” Грибковые инфекции под ред. Сергеева А.Ю., Сергеева Ю.В.. М, БИНОМ, 2008, с.132-138
- Клясова Г.А. Глава “Пневмоцистоз”. Грибковые инфекции под ред. Сергеева А.Ю., Сергеева Ю.В., М, БИНОМ, 2008, с.420-429
- Лапин В.А., Ротанова М.Н., Птицин С.А., Паровичникова Е.Н., Клясова Г.А. Диссеминированный фузариоз у больной острым миелобластным лейкозом. Гематология и трансфузиология. 2007, N4, c.37-39
- Менделеева Л.П., Митиш Н.Е., Клясова Г.А. и др. Инфекционные осложнения после трансплантации аутологичных гемопоэтических клеток крови при гемобластозах. Терапевтический архив. 2005, N7, с.33-39
- Митиш Н.Е., Менделеева Л.П., Клясова Г.А. и др. Стоматиты у реципиентов стволовых гемопоэтических клеток. Проблемы гематологии и переливания крови. 2004, N2, c.48-49
- Митиш Н.Е., Менделеева Л.П., Клясова Г.А. и др. Инфекционные осложнения у больных гемобластозами в раннем посттрансплантационном периоде. Проблемы гематологии и переливания крови. 2004, N2, c.49
- Митюшкина Т.А., Масчан А.А., Новичкова Г.А., Катермазова М.К., Толкачева Т.В, Клясова Г.А. Определение эффективности флуконазола у детей с острым лимфобластным лейкозом, колонизированных грибами. Клиническая микробиология и антимикробная химиотерапия. 2001, Том 3, приложение с.28
- Михайлова Е.А., Клясова Г.А., Устинова Е.Н., Савченко В.Г. Программная терапия апластической анемии. Клинические рекомендации, издательство ООО “Компания Боргес”, Москва, 2008, с.1- 26
- Петрова Н.А., Толкачева Т.В., Голосова Т.В., Клясова Г.А. Чувствительность дрожжевых грибов рода кандида к противогрибковым препаратам. Материалы II Российской конференции по внутрибольничным инфекциям, 1999, с.183-184
- Петрова Н.А., Клясова Г.А., Толкачева Т.В. Этиологическая структура кандидоза у иммуноскомпрометированных больных. Современная микология в России. Материалы первого съезда микологов, 2002, с.371
- Петрова Н.А., Толкачева Т.В., Клясова Г.А. Изменение микрофлоры толстого кишечника у больных гемобластозами в зависимости от курсов полихимиотерапии. Проблемы гематологии и переливания крови. 2002, N1, с.69
- Петрова Н.А., Клясова Г.А., Фуныгина Л.П. Особенности распространения мицелиальных грибов в воздухе гематологических отделений ГНЦ РАМН. Успехи медицинской микологии. 2003, Том 1, с.26-28
- Петрова Н.А., Клясова Г.А., Шарикова О.А. Колонизация слизистой зева дрожжевыми грибами у больных гемобластозами. Успехи медицинской микологии. 2003, Том 1, с.28-29
- Петрова Н.А., Клясова Г.А., Толкачева Т.В., Сперанская Л.Л., Шарикова О.А. Чувствительность дрожжевых грибов, выделенных от больных гемобластозами, к современным противогрибковым препаратам. Успехи медицинской микологии. 2003, Том 1, с.29-30
- Петрова Н.А., Клясова Г.А., Фуныгина Л.П. Распространение мицелиальных грибов в гематологическом стационаре. Терапевтический архив. 2003, N7, c.58-63
- Петрова Н.А., Клясова Г.А. Особенности микромицетов в воздухе отделений гематологического научного центра. Проблемы медицинской микологии. 2003, N2, с.77
- Петрова Н.А., Клясова Г.А. Чувствительность нозокомиальных штаммов дрожжевых грибов к противогрибковым препаратам. Иммунопатология Аллергология Инфектология. 2004, N1, с.66-72
- Петрова Н.А., Клясова Г.А., Шарикова О.А., Толкачева Т.В. Результаты микологического мониторинга у больных гемобластозами. Успехи медицинской микологии. 2004, том IV, с.66-67
- Петрова Н.А., Клясова Г.А., Шарикова О.А., Сперанская Л.Л. Результаты in vitro чувствительности внутрибольничных штаммов дрожжевых грибов в гематологической клинике. Успехи медицинской микологии. Том III, 2004, с.68-70
- Петрова Н.А., Клясова Г.А. Возможные источники инфицирования грибами рода Aspergillus в гематологическом стационаре. Проблемы медицинской микологии. 2004, N2, c.105-106
- Петрова Н.А., Клясова Г.А. Особенности формирования комплекса мицелиальных грибов в воздухе отделений Гематологического научного центра. Сопроводительная терапия в онкологии. 2004, N1, 17-18
- Петрова Н.А., Клясова Г.А. Возможные источники инфицирования аспергиллами в гематологическом стационаре. Терапевтический архив. 2005, N7, с.71-77
- Покровская О.С., Менделеева Л.П., Грибанова Е.О., Устинова Е.Н., Клясова Г.А., Шарикова О.А., Галстян Г.М., Яцков К.В., Варламова Е.Ю., Капланская И.Б., Федорова С.Ю., Дроздова А.Г., Савченко В.Г. Менингит, вызванный Listeria monocytogenes, у больного с множественной миеломой. Терапевтический архив. 2003, N7, c.76-78
- Птицин С.А., Клясова Г.А., Масчан А.А. Определение in vitro чувствительности к флуконазолу и вориконазолу госпитальных штаммов Candida spp. в двух гематологических стационарах Москвы. Успехи медицинской микологии. 2006, том VII, с.170-171
- Птицин С.А., Клясова Г.А. Сопоставление двух методов исследования чувствительности Candida spp. к флуконазолу: диско-диффузионного и тест-систем “FUNGITEST”. Успехи медицинской микологии. 2006, том VII, с.172
- Птицин С.А., Клясова Г.А. Активность вориконазола в отношении госпитальных штаммов Candida spp. резистентных к флуконазолу. Данные диско-диффузионного метода. Успехи медицинской микологии. 2007, том Х, с.26-27
- Птицин С.А., Клясова Г.А., Масчан А.А. Активность флуконазола в отношении госпитальных штаммов Candida spp.. Успехи медицинской микологии. 2007, том Х, с.27-28
- Савченко В.Г., Клясова Г.А., Паровичникова Е.Н., Исаев В.Г. и др. //Эмпирическая антибиотическая терапия при лихорадке у больных лейкозами в период агранулоцитоза. Материалы III Российского национального конгресса "Человек и лекарство". Москва, 1996, с.198
- Толкачева Т.В., Петрова Н.А., Клясова Г.А. Частота выделения и видовой спектр дрожжевых грибов в кишечнике у больных гемобластозами. Успехи медицинской микологии. 2003, Том 1, с.30-32
- Трушина Е.Е., Клясова Г.А., Сперанская Л.Л., Птицин С.А. Значение грибов в этиологии эзофагитов у больных опухолями системы крови. Успехи медицинской микологии. 2007, том Х, с.72-73
- Файнберг М.Р., Кравченко С.В., Клясова Г.А. и др. Пневмоцистные пневмонии у больных гемобластозами. Проблемы гематологии и переливания крови. 2002, N1, с.89
- Харазова Л.В., Клясова Г.А., Бронин Г.О. и др. Изучение колонизации слизистых оболочек у больных с гемобластозами. Успехи медицинской микологии. 2004, с.59-61
- Харазова Л.В., Бронин Г.О., Клясова Г.А. и др. Колонизация слизистых оболочек грибковой флорой у детей, больных острым лейкозом. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2006, N1, c.15-20
- Яцык Г.А., Клясова Г.А., Готман Л.Н. Радиологические проявления при инвазивном аспергиллезе легких у иммунокомпрометированных больных. Успехи медицинской микологии. 2006, том VIII, с.135-136
- Яцык Г.А., Клясова Г.А., Готман Л.Н. Особенности радиологических проявлений в легких на момент диагностики инвазивного аспергиллеза у больных с опухолями системы крови в зависимости от уровня лейкоцитов. Успехи медицинской микологии. 2007, том Х, с.225-226
- Brilliantova A., Kliasova G., Mironova A., Sidorenko S. Clonal dissemination of Gram-negative bacteria causing bloodstream infections in patients with haematological malignancies. Clinical Microbiology and Infection, 2007, Vol.13, Supp.1, p.S176
- Brilliantova A., Kliasova G., Mironova A., Novichkova, Bobrynina V. Spread of epidemic vancomycin-resistant Enterococcus faecium clonal complex 17 in haematological patients in Russia. Clinical Microbiology and Infection, 2009, Vol. 15, Supp. 4, abst. R2141
- Brilliantova A., Kliasova G., Sidorenko S., Mironova A. Evaluation of virulence and resistance genes structure in vancomycin-resistant E.faecium. Clinical Microbiology and Infection, 2008, Vol. 14, Supp.7, p.S624
- Brilliantova A., Kliasova G., Mironova A., Sidorenko S., Tishkov V. Molecular characteristic and virulence evaluation of vancomycin-resistant enterococci in hematological patients. 48th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICCAC), Washington, DC, 2008, p.189, C2-1999
- Kliasova G., Savchenko V., Parovichnikova E., Isaev V. et al. Empirical antimicrobial therapy in febrile neutropenic patients. Proceedings of the 2nd International symposium on Febrile Neutropenia, Brussels, 1995, abstr.60
- Kliasova G., Savchenko V., Tolkacheva T., Shulutko E., Khoroshko N. Meropenem in the treatment of serious infections in granulocytopenic patients. 5thn scientific meeting of European Society of Chemotherapy Infectious Diseases, 1997, abstr.B014
- Kliasova G., Savchenko V., Parovitchnikova E., Isaev V. Ampicillin/Sulbactam and Fluconazole for the treatment of febrile neutropenia. Clinical Microbiology and Infection. 1997, V.3, Supp.2, abstr.1345
- Kliasova G., Savchenko V., Parovichnikova E., Isaev V., Tolkacheva T., Turina N., Mendeleeva L., Lubimova L. Meropenem monotherapy of severe infections in neutropenic patients. Supportive Care in Cancer. 1998, V.6, No3, p.316
- Kliasova G., Savchenko V., Parovichnikova E. et al. Ceftriaxone with a short or long course of amikacin for the empiric treatment of fever in neutropenic patients. Clinical Microbiology and Infection. 2000, Vol.6, Supp. 1, abstr. WeP320
- Kliasova G, Savchenko V., Lubimova L. et al. Monotherapy with meropenem vs. combination therapy with ceftazidime plus amikacin as empiric therapy for febrile neutropenic bone marrow transplant patients. Clinical Microbiology and Infection. 2001, Vol.7, p.224
- Kliasova G., Sidorenko S., Speranskaja L. et al. Detection of vanB2 in Enterococcus gallinarum in Moscow, Russia. International Journal of Antimicrobial Agents. 2004, Vol.24/S2, abstr 366/79P
- Kliasova G., Ptitcin S., Maschan A. In vitro activity of fluconazole against Candida species isolated from patients in two hematological centers of Russia. Mycosis. 2005, Vol.48, Suppl.2, abstr P015
- Kliasova G., Mironova A., Speranskaya L. et al. The antimicrobial susceptibility of bacteraemia isolates of Gram-negative pathogens in seven haematological centers in Russia. Clinical microbiology and infection. 2006, Vol.12, Supp.4, abst. P1299
- Kliasova G., Speranskaya L., Trushina E. et al. Bacteraemia and fungaemia in haematologic patients. Clinical Microbiology and Infection. 2007, Vol.13, Supp.1, p.S169
- Mironova A., Cherkashin E., Kliasova G. et al. First detection of vancomycin-resistant enterococci in Russia: genetic background. Clinical microbiology and infection. 2006, Vol.12, Supp.4, abst. P1819
- Mironova A., Kliasova G., Brilliantova A. Comparison of antibiotics susceptibility of different vancomycin-resistant Enterococcus faecium clones. Clinical Microbiology and Infection. 2007, Vol.13, Supp.1, p.S169, abst. P700
- Mironova A., Kliasova G., Brilliantova A., Sidorenko S. Clonal dissemination of vancomycin-resistant Enterococcus faecium isolates in two Russian centers over a 3-year period. Clinical Microbiology and Infection. 2007, Vol.13, Supp.1, abst. R2149
- Petrova N.A., Tolkachova T.V., Kliasova G.A. In vitro susceptibility of antifungal agents against Candida species by the fungitest. Clinical Microbiology and Infection. Vol.6, Supp. 1, 2000, abstr.TuP31
- Petrova N., Kliasova G., Tolkachova T. Microflora of throat and faeces in bone marrow transplant patients. Clinical Microbiology and Infection. 2001, Vol.7, p.221
- Veselov A., Sukhorukova M., Kliasova G. et al. The susceptibility of clinically significant Candida isolates to fluconazole in the European part of Russia. Clinical Microbiology and Infection. 2004, Vol.10, p.631, abst R2196
- Veselov A., Stratchounski L., Multih I., Kliasova G. et al. Susceptibility of Candida to Fluconazole (FLU) and Voriconazole (VOR) in Russia. 44th ICAAC 2004, Washington, USA, p.435/M-1795
- Veselov A., Stratchounski L., Kliasova G. et al. Susceptibility of Candida glabrata and Candida krusei isolates to fluconazole and voriconazole (VOR) in Russia. International Journal of Antimicrobial Agents. 2004, Vol.24/S2, abstr 539/90P
- Veselov A., Kliasova G., Agapova E. et al. Susceptibility of Candida Blood Isolates to Fluconazole (FLU) and Voriconazole (VOR) in Russia. 46th ICAAC, 2006, San Francisco, USA, M-1593
- Veselov A., Kliasova G., Kretchikova O. et al. Comparative activity of Fluconazole and Voriconazole against Candida isolates in Russia in 2004 and 2006. 47th ICAAC, 2007, Chicago, USA, M-1640
- Veselov A., Klimko N., Kretchikova O., Kliasova G. et al. A Susceptibility of Candida isolates to fluconazole and voriconazole in Russia: the results of a 5-year prospective study. 48th ICAAC, Washington, DC, 2008, p.641, M-1532

