Генетический полиморфизм гена-онкосупрессора р53 и функционально связанных с ним генов ccr5 и xrcc1 при раке легкого
На правах рукописи
ГЕРВАС ПОЛИНА АНАТОЛЬЕВНА
ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ГЕНА-ОНКОСУПРЕССОРА р53 И ФУНКЦИОНАЛЬНО СВЯЗАННЫХ С НИМ ГЕНОВ CCR5 И XRCC1
ПРИ РАКЕ ЛЕГКОГО
14.00.14 – онкология
14.00.16 – патологическая физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Томск - 2007
Работа выполнена в ГУ НИИ онкологии ТНЦ СО РАМН и ФГУН ГНЦ Вирусологии и Биотехнологии «Вектор» Роспотребнадзора
Научные руководители:
доктор биологических наук,
профессор Чердынцева Надежда Викторовна
доктор биологических наук Белявская Валентина Александровна
Официальные оппоненты:
доктор биологических наук,
профессор Агафонов Владимир Иванович
ГУ НИИ фармакологии ТНЦ СО РАМН
доктор медицинских наук Афанасьев Сергей Геннадьевич
ГУ НИИ онкологии ТНЦ СО РАМН
Ведущая организация:
ГУ НИИ молекулярной биологии и биофизики СО РАМН, г. Новосибирск
Защита состоится «____» _______________ 2007г. в ________часов на заседании диссертационного совета Д 001.032.01 при ГУ НИИ онкологии ТНЦ СО РАМН
(634009, г. Томск, пер. Кооперативный, 5)
С диссертацией можно ознакомиться в библиотеке ГУ НИИ онкологии ТНЦ СО РАМН
Автореферат разослан «____» _______________ 2007 г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук  Фролова И.Г.
Фролова И.Г.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Рак легкого (РЛ) занимает лидирующие позиции в структуре онкологической заболеваемости мужчин, которые болеют почти в 7 раз чаще, чем женщины. Статистические данные констатируют ежегодное увеличение числа диагностируемых случаев рака легкого, в России ежегодно от этого заболевания погибает свыше 60000 человек (Мерабишвили В.М., Дятченко О.Т., 2000, Имянитов Е.Н., 2006). Ведущими факторами риска формирования РЛ являются избыточная экспозиция к повреждающим факторам внешней среды и нарушения в системе поддержания стабильности клеточного генома. Общим атрибутом и пусковым моментом канцерогенеза является дисбаланс процессов пролиферации, дифференцировки клеток, апоптоза и репарации, детерминированный не только генетическими (наличие мутаций в генетическом материале) и эпигенетическими нарушениями, изменяющими функции онкогенов и генов-супрессоров, но и вариабельностью функционирования патогенетически значимых генов, обусловленной генетическим полиморфизмом (Malik, Brown, 2000; Singletary, 2003; Yokota, Kohno, 2004; Hunter, Crawford, 2006).
Особое место в картине нарушений при злокачественных новообразованиях (ЗНО) различных локализаций, в том числе и при РЛ, занимают повреждения гена онкосупрессора p53, локализованного на 17 хромосоме. р53 регулирует экспрессию генов клеточного цикла и апоптоза, инициирует репарацию поврежденной ДНК, тем самым контролируя геномную стабильность клетки (Копнин Б.П., 2000; Fan et al., 2000; Rom et al., 2000). Для гена р53 установлено 19 полиморфизмов, при этом полиморфизмы 3, 6 интронов и 4 экзона считаются вовлеченными в канцерогенез (Wu et al., 2002; Avigad et al., 1997; van Heemst, 2005). Наиболее широко изучен полиморфизм в кодирующем участке гена р53 (4 экзон, Arg72Pro полиморфизм), есть сведения о его ассоциации со злокачественными новообразованиями различных локализаций (Sjalander et al., 1996; Biros et al., 2001; Wu et al., 1995; Jain et al., 2005). Исследования роли полиморфизма интронов гена р53 в риске РЛ немногочисленны. Интронные полиморфизмы, благодаря своему участию в регуляции сплайсинга мРНК, экспрессии генов и ДНК-белковых взаимодействий, при определенных условиях также могут оказывать влияние на функциональную активность белков. Полиморфизм 6 интрона гена р53, представленный заменой гуанина на аденин в сайте рестрикции MspI эндонуклеазы, влияет на уровень экспрессии белка р53 (Barel et al., 1994). Дупликация 16 п.н. в 3 интроне может приводить к ингибиции перехода р53 из стрессовой конформации в латентную, в которой р53 стимулирует репарацию ДНК (Liang, 2005).
Высокая частота индивидуальных полиморфизмов в низкопенетрантных генах может обеспечивать достаточно солидный вклад этих генов в комбинации с экспозицией к патогенетически значимым внешним факторам в популяционный атрибутивный риск (Jong et al., 2002; Пальцев М.А. и др., 2004; Newman et al., 2005). При этом анализ генетических эффектов комбинаций функционально связанных полиморфизмов может существенно повысить эффективность исследований, поскольку затрагивает сразу несколько сигнальных путей, вовлекаемых в патогенез рака (Onay et al., 2006; Имянитов Е.Н., Хансон К.П., 2003). В работе Wu et al. (2002) выявлена ассоциация комбинаций, содержащих минорные аллели генотипов гена р53 по 3 локусам (3 и 6 интрон, 4 экзон) с РЛ для лиц европеоидной расы, которую авторы связывают со снижением апоптотической и репарационной активности в клетках с такими генотипами. Аналогичные данные получены для РМЖ и других локализаций ЗНО (Sjlander et al., 1996; Mitra et al., 2006; Schabath et al., 2006; Onay et al., 2006). Изменения в генах, модулирующих активность р53, также могут быть сопряжены с нарушением его функции. Так, в наследственных высоко агрессивных формах РМЖ при нарушении в генах репарации BRCA1 и BRCА2 часто встречаются мутации р53. Функциональная неполноценность р53 отмечена в случае изменений в генах ATM, PTEN и CHEK2, которые вовлекаются в регуляцию активации р53 (Lacroix, Leclercg, 2005).
Manes et al. в 2003 году было показано, что для осуществления эффективного апоптоза модифицированных клеток необходимо согласованное взаимодействие онкосупрессора р53 с белком-рецептором хемокинов CCR5. Авторы выявили, что носительство вариантного аллеля ССR5del32 ассоциировано с неблагоприятным прогнозом при раке молочной железы у пациенток при отсутствии соматических мутаций в гене p53 в клетках опухоли, что объясняется нарушением передачи апоптоз-индуцирующего сигнала трансформированным клеткам. CCR5 является одним из важных поливалентных хемокиновых рецепторов, определяющих инфильтрацию иммуноцитов в очаги воспаления и опухоль, и тесно связан с развитием Тh1 клеточно-опосредованного иммунного ответа, а также вовлечен в регуляцию подвижности и пролиферации опухолевых клеток (Azenstein et al., 1999; Mira et al., 2001; Luboshits et al., 2002). Мы не встретили в доступной нам литературе сведений об исследовании связи сочетаний полиморфизмов генов р53 и ССR5 с РЛ.
Белок р53 инициирует сборку комплекса эксцизионной репарации ДНК посредством активации транскрипции гена XRCC1 (X-ray repair cross-complementing group 1) (Marintchev et al., 2003). XRCC1 является связующим белком, который формирует комплекс эксцизионной репарации оснований (base excision repair, BER) путем индивидуального взаимодействия с каждым компонентом, соединяя ДНК-полимеразу, ДНК-лигазу III и ПАРП на поврежденном сайте ДНК (Caldecott et al., 1994). Arg399Gln полиморфизм 10 экзона гена XRCC1 затрагивает его центральный домен, необходимый для активации BER. Есть указания, что данный полиморфизм связан с повышенным риском возникновения рака молочной железы (Duell et al., 2001), рака поджелудочной железы (Duell et al., 2006), рака легкого (Park et al., 2002; Casse et al., 2003; Залесский В.Н. и соавт., 2005). Можно полагать, что полиморфизм обоих генов вносит сочетанный вклад в нарушение процессов репарации ДНК, однако таких данных в литературе не найдено.
Комплексное изучение полиморфизмов р53 и взаимосвязанных с ним генов может выявить биологические взаимодействия их полиморфных вариантов, вносящие существенный вклад в раннее возникновение злокачественных опухолей в условиях экспозиции к экзогенным и эндогенным генотоксическим факторам.
В настоящее время полемизируется вопрос об антагонистическом плейотропизме эффектов генов, которые осуществляют защиту от злокачественной трансформации. Накоплены доказательства, что гены опухолевых супрессоров, защищая организм от рака в раннем периоде онтогенеза, могут промотировать фенотип старения, включая поздний рак (Campisi et al., 2005). Сведения о взаимосвязи полиморфизма данных генов с формированием РЛ в зависимости от возраста немногочисленны и неоднозначны (Szymanowska et al., 2006; Taioli, Bonassi, 2004). Отсутствуют данные о вкладе комбинаций вариантных генотипов гена р53 по интронным и экзонным полиморфизмам в сочетании с генотипами других функционально связанных с ним генов, в частности, CCR5 и XRCC1, в риск РЛ. Все сказанное определяет актуальность изучения сочетанного вклада полиморфизма генов р53, CCR5 и XRCC1 в риск возникновения и прогрессию РЛ в европеоидной популяции Сибири с учетом основных патогенетически значимых факторов риска.
Цель исследования: Изучить ассоциации аллельных вариантов гена-онкосупрессора p53, гена хемокинового рецептора CCR5, гена репарации ДНК XRCC1 с раком легкого и с клинико-морфологическими особенностями течения заболевания.
Задачи исследования:
- Изучить ассоциации полиморфных вариантов генов р53, CCR5, XRCC1 с различными гистологическими формами РЛ.
- Оценить взаимосвязь интронного (3 и 6 интрон) и экзонного (4 экзон) полиморфизмов гена р53 и различных их комбинаций с РЛ в зависимости от возраста и курения.
- Оценить распределение сочетаний генотипов гена хемокинового рецептора CCR5 с комбинацией генотипов гена р53 (3 интрон-4 экзон-6 интрон) у больных РЛ.
- Оценить частоту встречаемости аллельных вариантов гена репарации ДНК XRCC1 в сочетании с комбинацией генотипов (3 интрон-4 экзон-6 интрон) гена р53 у больных РЛ
- Провести анализ ассоциаций исследуемых полиморфизмов генов р53, CCR5, XRCC1 с клинико-морфологическими особенностями злокачественного процесса.
Научная новизна. Впервые в России изучена ассоциация комбинаций вариабельных генотипов взаимосвязанных генов р53, CCR5, XRCC1 с раком легкого.
Получены новые данные о взаимосвязи комбинаций генотипов гена р53 (3 интрон-4 экзон-6 интрон) с НМРЛ в зависимости от возраста. Показано, что риск НМРЛ повышается при носительстве w/dup16-Arg/Pro-w/m комбинации гена р53 для лиц зрелого возраста, w/w-Arg/Arg-w/w комбинации гена р53 - для лиц пожилого возраста, при этом модифицирующее влияние фактора курения установлено только для индивидуумов зрелого возраста.
Не выявлено ассоциации минорных аллелей генов гена хемокинового рецептора CCR5 и гена репарации XRCC1 с риском формирования НМРЛ.
Показано, что вариантные генотипы гена рецептора хемокинов CCR5 не модифицируют выявленную взаимосвязь комбинации гетерозиготных генотипов гена 53 w/dup16-Arg/Pro-w/m с НМРЛ для лиц зрелого возраста. Показан сочетанный вклад гетерозиготных генотипов генов р53 и XRCC1 w/dup16-Arg/Pro-w/m(Arg/Gln) в риск формирования НМРЛ для лиц зрелого возраста. Мажорный генотип Arg/Arg гена XRCC1 нивелирует рисковую значимость комбинации гетерозиготных генотипов гена р53 для лиц зрелого возраста.
Комбинация гетерозиготных генотипов w/dup16-Arg/Pro-w/m гена р53 ассоциирована с более высокими показателями общей выживаемости больных НМРЛ, чем комбинация гомозиготных генотипов по мажорных аллелям гена р53.
Установлена ассоциация w/del32 генотипа гена CCR5 на уровне тенденции и комбинации гетерозигот w/dup16-Arg/Pro-w/m гена р53 с мелкоклеточной формой РЛ.
Теоретическая и практическая значимость. Выявленные ассоциации комбинаций мажорных генотипов и гетерозиготных генотипов гена р53 с НМРЛ для лиц пожилого возраста (60-74 лет) и зрелого возраста (40-59 лет), соответственно, указывают на различие механизмов вовлечения р53 в формирование НМРЛ в разные периоды онтогенеза человека.
Установленная ассоциация w/dup16-Arg/Pro-w/m комбинации гена р53 и ее сочетания с гетерозиготным генотипом гена репарации XRCC1 с НМРЛ для курящих лиц зрелого возраста свидетельствует о возможности использования изученных показателей в качестве дополнительных критериев формирования групп повышенного риска НМРЛ.
Данные о связи комбинации гетерозиготных генотипов гена р53 w/dup16-Arg/Pro-w/m с более высокими показателями общей выживаемости больных НМРЛ указывают на возможность использования этих параметров в качестве дополнительных критериев прогноза. Полученные результаты свидетельствуют о необходимости изучения полиморфизма гена р53 по указанным локусам на более представительной выборке, для обоснования возможности генотипирования р53 в качестве дополнительного прогностического критерия НМРЛ.
Основные положения, выносимые на защиту:
- В условиях патогенетически значимых экзогенных влияний (курение) сочетанное носительство функционально измененных генотипов, содержащих минорные аллели по интронным и экзонному полиморфизмам гена р53 и G399A полиморфизму гена репарации XRCC1, способствует формированию немелкоклеточной формы РЛ у лиц зрелого возраста.
- Носительство комбинации функционально полноценных генотипов w/w-Arg/Arg-w/w (мажорные аллели) по интронным и экзонному полиморфизмам гена р53 повышает риск возникновения НМРЛ в пожилом возрасте.
- Комбинация гетерозиготных генотипов гена р53 по 3, 6 интрону и 4 экзону w/dup16-Arg/Pro-w/m ассоциирована с более высокими показателями общей выживаемости больных НМРЛ, чем комбинация гомозиготных генотипов w/w-Arg/Arg-w/w.
Реализация и апробация работы. Основные положения диссертации докладывались и обсуждались на итоговой научно-практической конференции «Актуальные вопросы здравоохранения регионов Сибири, г.Красноярск (2005); научно-практической конференции НИИ онкологии ТНЦ СО РАМН «Иммунология на рубеже веков: к 75-летию со дня рождения академика РАМН Н.В. Васильева», г. Томск (2005); четвертой Всероссийской конференции молодых ученых в рамках 13 международного конгресса по приполярной медицине г. Новосибирск (2006); 16 ежегодном конгрессе Европейского респираторного общества, г. Мюнхен (2006); региональной конференции молодых ученых имени академика РАМН Н.В. Васильева, г. Томск (2007); 12 ежегодном конгрессе Международного сообщества по изучению рака легкого, г. Сеул (2007).
Публикации. Результаты исследования опубликованы в 23 печатных работах, отражающих основные положения диссертации.
Объем и структура работы. Диссертационная работа изложена на 147 страницах машинописного текста, состоит из введения, трех глав, включающих обзор литературы, материалы и методы исследования, главы с изложением собственных результатов, заключения, выводов, списка цитируемой литературы. Библиографический указатель включает 201 источник, из них 60 отечественных, 141 зарубежных. Работа иллюстрирована 47 таблицами и 6 рисунками.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика групп больных
В исследование были включены 170 пациентов с патологией легких, из них 136 больных НМРЛ, 34 больных МРЛ (таблица 1). Больные РЛ T1-4N0-3M0-1 находились на стационарном лечении в торако-абдоминальном отделении ГУ НИИ онкологии ТНЦ СО РАМН (зав. отделением – д.м.н. профессор С.А. Тузиков). Из всех обследованных 93% (158) составили мужчины, 7% (12) - женщины, возрастной интервал составил от 42 до 80 лет (60,2±8,6 лет).
Таблица 1. Характеристика групп обследованных
| Группы | РЛ | НМРЛ | МРЛ | Контроль |
| n | 170 | 136 | 34 | 198 |
| Пол, м/ж | 158/12 | 125/11 | 33/1 | 198/0 |
| Возраст, M±m | 60,2±8,6 | 60,2±8,6 | 58,7±7,7 | 58,0±4,4 |
Примечание: РЛ - рак легкого, НМРЛ - немелкоклеточный рак легкого, МРЛ - мелкоклеточный рак легкого.
Гистологическое исследование проводилось в отделении патологической морфологии ГУ НИИ онкологии ТНЦ СО РАМН (руководитель отделения – д.м.н. профессор В.М. Перельмутер). Стадия онкологического процесса определялась в соответствии с четвертым пересмотром Международной классификации опухолей по системе TNM (Женева, 1987), а также вторым пересмотром (UICC, 1992) и дополнением к классификации TNM (UICC, 1993), одобренным Американским комитетом по раку (AJCC). Формирование групп осуществлялось после постановки диагноза на основании клинического, морфологического, эндоскопического и рентгенологического обследования.
В качестве популяционного контроля использовали выборку здоровых лиц европеоидного происхождения, проживающих в г. Новосибирске (188 практически здоровых мужчин, средний возраст – 58,6±6,8 лет), данные любезно предоставлены М. И. Воеводой (г.Новосибирск). Во все обследованные группы больных и в контрольную группу здоровых были включены индивидуумы только европеоидного происхождения, поскольку существуют значительные межрасовые различия в распределении исследуемых генотипов и аллелей (Martinson et al., 1997; Yudin et al., 1998; Коршунова Т.Ю. и соавт., 2004).
Работа проводилась с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (указ Президента РФ от 24.12.1993 № 2288). Получено разрешение этического комитета НИИ онкологии ТНЦ СО РАМН.
Методы исследования
Геномная ДНК была выделена из цельной венозной крови с использованием протеиназы К с последующей фенольно-хлороформной экстракцией (Дейвис К., 1990). Оценка полиморфизмов генов проводилась с помощью ПЦР и ПЦР-ПДРФ-анализа. Характеристика исследованных локусов и условий их анализа представлены в таблице 2 и 3.
Визуализация продуктов ПЦР-ПДРФ реакции проводилась методом гель-электрофореза. Продукты амплификации или рестрикции анализировали в агарозном или полиакриламидном геле. Использовали 2% агарозный гель при получении продуктов реакции свыше 300 п.н.о., 7% полиакриламидный гель - при получении продуктов ПЦР реакции от 300 п.н.о. и 10% - менее 300 п.н.о.
Таблица 2. Характеристика полиморфизмов изучаемых генов
| Ген | Локус | Локализация в гене | Тип полиморфизма | Белок |
| CCR5 | 3p21 | экзон | делеция 32 н.о. | Хемокиновый рецептор |
| XRCC1 | 19q13.2 | экзон 10 | SNP, транзиция G399A | Белок эксцизионной репарации |
| p53 | 17p13.1 | интрон 3 | Дупликация 16 н.о. | Белок-онкосупрессор |
| экзон 4 | SNP, трансверсия G199C | |||
| интрон 6 | SNP, транзиция G13494A |
Таблица 3. Условия анализа полиморфизма локусов изучаемых генов
| Ген | Последовательность праймеров | Метод, фермент рестрикции | Температура отжига, С | |
| CCR5 | GAAGGTCTTCATTACACCTG AGAATTCCTGGAAGGTGTTС | ПЦР | 50 | |
| XRCC1 | GCCCCGTCCCAGGTAAG AGCCCCAAGACCCTTTCACT | ПЦР-ПДРФ MspI | 55 | |
| p53 | ||||
| интрон 3 | TGGGACTGACTTTCTGCTCTT TCAAATCATCCATTGCTTGG | ПЦР | 57 | |
| экзон 4 | CTGGTAAGGACAAGGGTTGG ACTGACCGTGCAAGTCACAG | ПЦР-ПДРФ BstU1 | 63 | |
| интрон 6 | TGGCCATCTACAAGCAGTCA TTGCACATCTCATGGGGTTA | ПЦР-ПДРФ MspI | 57 | |
Статистическая обработка данных проводилась с использованием пакета прикладных программ «Statistica for Windows 6.0». При сравнении частот генотипов использовался стандартный критерий 2 Пирсона, при условии, когда объем выборки не превышал 5 случаев, использовали критерий 2 с поправкой Йетса и критерий Фишера. Подсчитывали отношение шансов (OR - odds ratio) для оценки ассоциации между определенными генотипами и риском развития заболевания по стандартной формуле OR=a/b x d/c, где a и b – количество больных, имеющих и не имеющих мутантный генотип, соответственно, и d и с – количество человек в контрольной группе, имеющих и не имеющих мутантный генотип. OR указан с 95%-ным доверительным интервалом (Confidence interval CI) (Лакин Г.Ф., 1989; Флейс Д., 1989).
Для всех изученных полиморфных вариантов генов в выборках популяционного контроля и пациентов распределение генотипов соответствовало ожидаемому при равновесии Харди-Вайнберга.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Мультифункциональный белок р53 является ключевым участником процессов поддержания генетической стабильности и сбалансированного действия систем регуляции деления клеток. В настоящее время активно изучают взаимосвязь с ЗНО полиморфизма гена р53 в кодирующем районе, затрагивающем ДНК-связывающий домен (4 экзон), однако данные различных авторов неоднозначны. В популяции Западной Сибири полиморфизм 4 экзона изучался В.В. Ляховичем с соавторами (1997), была показана ассоциация Arg аллеля с РЛ и РЖ (рак желудка). Сведений по интронному полиморфизму в российской популяции нет. На первом этапе мы изучили распределение генотипов гена р53 (3 интрон, 4 экзон, 6 интрон) в группах больных раком легкого и здоровых лиц для выяснения их взаимосвязи с раком легкого в зависимости от возраста и курения. Пациенты были разделены на группы зрелого (40-59 лет) и пожилого возраста (60-74 лет), согласно рекомендациям ВОЗ (1963 г.) (Ревнивых И.Ю., 2003), а также в соответствии с морфологической формой РЛ (НМРЛ и МРЛ).
Распределение частот генотипов 4 экзона гена р53 у больных раком легкого представлено в таблице 4.
Таблица 4. Частота генотипов 4 экзона гена р53 у больных РЛ
| Группы обследованных | Частота генотипов, % | ||
| Arg/Arg | Arg/Pro | Pro/Pro | |
| здоровые | 46 (88/192) | 43 (80/192) | 11 (24/192) |
| РЛ | 54 (95/177) | 39 (69/177) | 7 (13/177) |
| МРЛ | 50 (17/34) | 41 (14/34) | 9 (3/34) |
| НМРЛ | 55 (75/136) | 38 (52/136) | 6 (9/136) |
| Больные НМРЛ зрелого возраста | |||
| курящие | 40 (19/48) | 54* (26/48) p<0,000 | 6 (3/48) |
| некурящие | 80 (4/5) | 0 | 20 (1/5) |
| Больные НМРЛ пожилого возраста | |||
| курящие | 73* (27/37) p<0,004 | 27 (10/37) | 0 |
| некурящие | 54 (7/13) | 38 (5/13) | 8 (1/13) |
Примечание: здесь и далее: *- различия статистически значимы по сравнению с аналогичными показателями группы контроля. В скобках - количество лиц, несущих определенный генотип, к общему числу лиц в данной группе.
Распределение генотипов 4 экзона гена р53 существенно не отличалось в группах больных в зависимости от гистологической формы опухоли. Однако при изучении сочетанного влияния возрастного фактора и курения, имеющих доказанную причинно-следственную связь с РЛ, нами были установлены значимые различия в распределении генотипов 4 экзона для больных НМРЛ. Частота Arg/Arg генотипа в группе курящих больных НМРЛ пожилого возраста составила 73% (X=8,09, p<0,004; OR=3,19, CI95%=1,38-7,50), статистически значимо превышая показатель в контроле. При этом установлена ассоциация Arg/Pro генотипа 4 экзона с риском НМРЛ для курящих зрелого возраста, частота данного генотипа составила 54% против 43% группы здоровых лиц (X=11,29, p<0,000; OR=2,84, CI95%=1,45-5,55). Наши результаты находятся в согласии с данными В.В. Ляховича и соавторами (1997) для Западно-Сибирской популяции о повышении частоты Arg аллеля в группах больных РЛ, а также данными ряда зарубежных авторов (Papadakis et al., 2002; Wang et al., 1999; Neeraj et al., 2005; Siddique et al., 2005).
Полиморфизм 3 интрона, обусловленый дупликацией 16 пар нуклеотидов, представлен тремя генотипами (w/w, w/dup16, dup16/dup16), их распределение у больных раком легкого представлено в таблице 5.
Таблица 5. Распределение генотипов 3 и 6 интрона гена р53 у больных РЛ
| Группы | Частота генотипов, % | |||||
| 3 интрон | 6 интрон | |||||
| w/w | w/dup16 | dup16/dup16 | w/w | w/m | m/m | |
| здоровые | 78 (153/196) | 21 (41/196) | 1 (2/196) | 84 (168/198) | 15 (29/198) | 1 (1/198) |
| РЛ | 78 (138/176) | 22 (38/176) | 0 | 79 (139/175) | 21 (36/175) | 0 |
| МРЛ | 79 (26/33) | 21 (7/33) | 0 | 73 (24/33) | 27 (9/33) | 0 |
| НМРЛ | 78 (106/136) | 22 (30/136) | 0 | 81 (109/135) | 19 (26/135) | 0 |
| Больные НМРЛ зрелого возраста | ||||||
| курящие | 66 32/48 | 33* 16/48 p=0,06 | 0 | 70 (33/47) | 29* (14/47) p<0,001 | 0 |
| некурящие | 100 5/5 | 0 | 0 | 100 (5/5) | 0 | 0 |
| Больные НМРЛ пожилого возраста | ||||||
| курящие | 86 32/37 | 14 5/37 | 0 | 83 (31/37) | 16 (6/37) | 0 |
| некурящие | 92 12/13 | 8 1/13 | 0 | 100 (13/13) | 0 | 0 |
Нами не установлено взаимосвязи гетерозиготного генотипа 3 интрона с риском РЛ в зависимости от гистологического типа опухоли. Однако для курящих лиц зрелого возраста гетерозиготный генотип 3 интрона (w/dup16) связан с риском НМРЛ на уровне тенденции (p=0,06). Установлено, что в 3 интроне находится и один из промоторов онкогена MDM2, т.е. полиморфизм данного интрона может быть причастен к нарушению убиквитинизации белка р53, необходимой для перехода р53 из стрессовой конформации в латентную, в которой р53 стимулирует репарацию ДНК (Liang H., 2005).
MspI полиморфизм 6 интрона изучен при раке яичников (Wang-Gohrke, 1999), хронической лимфоцитарной лейкемии (Kochethu, 2006), раке желудка (Peller, Kopilova, 1995), раке легкого (Biros et al., 2001), раке молочной железы (Суспицын Е.Н., 2002). Однако в литературе встречаются лишь немногочисленные исследования взаимосвязи данного полиморфизма с риском развития НМРЛ и МРЛ. Распределение генотипов 6 интрона гена р53 у больных раком легкого представлено в таблице 5.
Частота встречаемости генотипов по 6 интрону среди больных РЛ не имела различий с контролем. Однако установлена взаимосвязь гетерозиготного генотипа 6 интрона (p<0,001) с риском НМРЛ для курящих лиц зрелого возраста, данные согласуются с результатами Biros et al. (2001).
Таким образом, мы установили ассоциацию вариантных генотипов гена р53 по 4 экзону и 3 и 6 интрону с риском НМРЛ в условиях курения у лиц зрелого возраста, подтвердив значимость исследования интронного полиморфизма гена р53. Далее с целью повышения информативности нашего исследования мы изучили, как влияет носительство генотипических комбинаций трех изучаемых полиморфизмов гена р53 на риск НМРЛ в зависимости от таких патогенетически значимых факторов как курение и возраст. Согласно нашим данным, у больных раком легкого и здоровых лиц наиболее распространенными комбинациями генотипов трех локусов являются: w/w-Arg/Arg-w/w (наличие мажорных генотипов), w/w-Arg/Pro-w/w (гетерозиготность по 4 экзону Arg/Pro) и w/dup16-Arg/Pro-w/m (гетерозиготность по всем исследуемым полиморфизмам). Полученные данные по изучению генотипических комбинаций свидетельствуют об ассоциации как комбинации мажорных генотипов гена р53 w/w-Arg/Arg-w/w так и комбинации гетерозиготных генотипов с НМРЛ (p<0,015 и p<0,007, соответственно) и МРЛ (p<0,02) (данные не представлены).
При сравнении частот встречаемости указанных сочетаний в группах больных с учетом возраста и фактора курения мы выявили ассоциацию комбинации гетерозигот w/dup16-Arg/Pro-w/m с НМРЛ для курящих индивидуумов зрелого возраста (40-59 лет), а комбинации гомозиготных генотипов – с НМРЛ у пожилых индивидуумов независимо от фактора курения (табл.6). Очевидно, что в рисковую значимость комбинации гетерозиготных генотипов вносят свой вклад отдельные полиморфизмы, для которых выше была показана связь наличия минорных аллелей с НМРЛ в зрелом возрасте при воздействии фактора курения.
Таблица 6. Распределение комбинаций генотипов (3 интрон-4 экзон-6 интрон) гена р53 у больных НМРЛ в зависимости от возраста и курения
| Группы обследованных | Частота генотипов, % | |
| w/w-Arg/Arg-w/w | w/dup16- Arg/Pro-w/m | |
| здоровые | 38 (74/196) | 4 (8/196) |
| Больные НМРЛ зрелого возраста | ||
| курящие | 34 (16/47) | 21* (10/47) p<0,000 |
| некурящие | 80 (4/5) | 0 |
| Больные НМРЛ пожилого возраста | ||
| курящие | 68* (25/37) p<0,000 | 11 (4/37) |
| некурящие | 53 (7/13) | 0 |
Одновременное их сочетание может приводить к нарушению функции гена р53, подтверждением чему служат результаты Wu et al. (2003) о снижении апоптотического индекса и эффективности репарации ДНК в лимфобластоидных клеточных линиях с таким генотипом. Таким образом, субоптимальное функционирование системы программируемой клеточной гибели ведет к неполноценной элиминации мутированных клеток, что может иметь решающее значение при наличии влияния генотоксических факторов риска, каким в нашем случае является интенсивное курение. Установлено, что бенз(а)пирен, акролеин и др. компоненты табака являются генотоксикантами, метаболиты которых индуцируют мутации в различных генах, включая р53 (Alexandrov et al., 2002; Feng et al., 2006).
Установленная нами ассоциация с НМРЛ для лиц пожилого возраста (60-74 лет) комбинации мажорных (функционально полноценных) генотипов гена р53 w/w-Arg/Arg-w/w, может быть объяснена с позиции возрастных изменений, характерных для данной группы больных. Повышенный риск развития рака легкого у лиц пожилого возраста может быть обусловлен длительной экспозицией к повреждающим экзогенным и эндогенным (возникающим в условиях хронических воспалительных процессов) факторам, снижением активности иммунной системы, при этом решающим моментом может служить замедление с возрастом скорости репарации ДНК с одновременным накоплением мутаций и хромосомных аберраций в генах, функционально связанных с геном р53 (Свердлов, Vijg, 2000; Vijg, Dolle, 2002; Анисимов В.Н., 1996). Есть данные, что р53, несущий Arg аллель, характеризуется не только повышенной чувствительностью к мутациям (Bonafe, 2003), но и способностью блокировать р73 – супрессорный гомолог белка р53, который становится неспособным дублировать поврежденную апоптотическую функцию в случае мутации р53 (Bergamaschi et al., 2003; Копнин Б.П., 2000).
Вовлечение хемокинового рецептора ССR5 в осуществление р53 зависимого апоптоза модифицированных клеток, наряду с его важной ролью в становлении Тh1 иммунного ответа и существенным вкладом в реализацию инвазивного потенциала опухолевых клеток делает обоснованным исследование ассоциации его функционального полиморфизма, обусловленного делецией 32 пар нуклеотидов, с раком легкого.
Таблица 7. Частота генотипов гена хемокинового рецептора CCR5
у больных РЛ
| Группы обследованных | Частота генотипов, % | ||
| w/w | w/del32 | del32/del32 | |
| здоровые | 80 (139/172) | 19 (32/172) | 1 (1/172) |
| МРЛ | 70 (37/53) | 30* (16/53) p=0,07 | 0 |
| НМРЛ | 85 (116/136) | 14 (19/136) | 1 (1/136) |
Частотный анализ распределения генотипов гена CCR5 у пациентов в группе НМРЛ не выявил значимых различий со среднестатистической популяцией Западно-Сибирского региона. В группу пациентов с МРЛ мы также включили пациентов, прогенотипированных по данному полиморфизму Н.В.Севостьяновой (2004), и она суммарно составила 53 человека. Мы выявили на уровне тенденции увеличение частоты встречаемости гетерозиготного w/del32 генотипа гена ССR5 в сравнении с группой здоровых доноров (табл. 7). Стратификация групп по возрастному признаку и фактору курения не изменила соотношений частот генотипов гена ССR5 у больных НМРЛ и МРЛ.
Есть основания считать, что функциональная активность гена репарации XRCC1 может напрямую зависеть от полиморфизма гена р53, так как он координирует активацию транскрипции генов, необходимых для запуска репарации того или иного повреждения ДНК, стимулируя тем самым эксзиционную репарацию ДНК (Zhou et al., 2001; Offer et al., 2002; Gueven et al., 2000). Литературные сведения о связи Arg399Gln полиморфизма XRCC1 с РЛ достаточно противоречивы, хотя есть указания на рисковую значимость минорных аллелей. В наших исследованиях не выявлен вклад минорного аллеля гена репарации XRCC1 (генотипы Arg/Gln или Gln/Gln, данные не представлены) в риск возникновения НМРЛ, что согласуется с данными других авторов (Ratnasinghe et al., 2001; Stern et al., 2001).
Таким образом, при изучении отдельного вклада полиморфизма генов CCR5 и XRCC1 мы не установили их ассоциации с НМРЛ независимо от факторов риска, а также не выявили связи с патогенетически значимыми клинико-морфологическими признаками (данные не представлены). Наши данные согласуются с мнением Имянитова Е.Н. (2006) о том, что каждый полиморфизм в отдельности обладает лишь весьма умеренным эффектом, поэтому роль нормальных вариаций генома в патологии с трудом поддается изучению. Эффективность исследований может быть повышена при оценке сочетаний функционально связанных между собой патогенетически значимых генов. Поэтому мы оценили ассоциацию вариантных генотипов генов CCR5 и XRCC1 в сочетании с комбинациями полиморфизмов гена р53 с НМРЛ, учитывая возрастную компоненту.
Мы показали, что рисковая значимость w/dup16- Arg/Pro-w/m комбинации гена р53 для НМРЛ у лиц зрелого возраста сохраняется как при сочетании с w/w генотипом гена CCR5 (р0,006), так и в сочетании с w/del32 генотипом (р0,05). Следовательно, носительство гетерозиготных генотипов гена р53 определяет риск НМРЛ для лиц зрелого возраста, независимо от статуса гена CCR5, регулирующего его транскрипционную активность(табл.8).
Установлена ассоциация w/dup16-Arg/Pro-w/m комбинации генотипов гена р53 при сочетании с Arg/Gln генотипом гена репарации с НМРЛ для лиц зрелого возраста. В то же время при сочетании с мажорным генотипом Arg/Arg гена XRCC1 комбинация гетерозиготных генотипов р53 не ассоциирована с РЛ (табл.9).
Таблица 8. Сочетание генотипов гена CCR5 с комбинацией генотипов
(3 интрон-4 экзон-6 интрон) гена р53 у больных НМРЛ в зависимости от возраста
| Комбинации генотипов генов | здоровые | Больные НМРЛ | ||
| зрелого возраста | пожилого возраста | |||
| CCR5 | р53 | |||
| w/w | w/w-Arg/Arg-w/w | 41 (62/150) | 36 (14/39) | 67*,# (22/33) р0,01 |
| w/w-Arg/Pro-w/w | 28 (42/150) | 28 (11/39) | 18 (6/33) | |
| w/dup16- Arg/Pro-w/m | 4 (6/150) | 18* (7/39) р0,006 | 9 (3/33) | |
| w/del32 | w/w-Arg/Arg-w/w | 31 (11/35) | 33 (3/9) | 60 (6/10) |
| w/w-Arg/Pro-w/w | 31 (11/35) | 11 (1/9) | 10 (1/10) | |
| w/dup16- Arg/Pro-w/m | 6 (2/35) | 33* (3/9) р0,05 | 20 (2/10) | |
Примечание: #- различия статистически значимы по сравнению с аналогичными показателями группы больных зрелого возраста.
Таблица 9. Сочетание комбинаций генотипов (3 интрон-4 экзон-6 интрон) гена р53 c генотипами гена XRCC1 у больных НМРЛ в зависимости от возраста
| Комбинации генотипов генов XRCC1 и р53 | здоровые | Больные НМРЛ | ||
| зрелого возраста | пожилого возраста | |||
| Arg/Arg | w/w-Arg/Arg-w/w | 37 (25/68) | 36 (7/19) | 67* (18/27) p0,01 |
| w/w-Arg/Pro-w/w | 31 (21/68) | 26 (5/19) | 15 (4/27) | |
| w/dup16- Arg/Pro-w/m | 4 (3/68) | 12 (3/25) | 4 (1/27) | |
| Arg/Gln | w/w-Arg/Arg-w/w | 38 (35/91) | 42 (12/28) | 56* (18/32) |
| w/w-Arg/Pro-w/w | 27 (25/91) | 14 (4/28) | 28 (9/32) | |
| w/dup16- Arg/Pro-w/m | 3 (3/91) | 21* (6/28) p0,005 | 9 (3/32) | |
| Gln/Gln | w/w-Arg/Arg-w/w | 37 (11/30) | 25 (3/12) | 69 (9/13) |
| w/w-Arg/Pro-w/w | 33 (10/30) | 42 (5/12) | 7 (1/13) | |
| w/dup16- Arg/Pro-w/m | 6 (2/30) | 17 (2/12) | 15 (2/13) | |
По-видимому, нормально функционирующий белок XRCC1 может нивелировать рисковую значимость этой комбинации для индивидуумов зрелого возраста, показанную нами выше. Можно полагать, что сочетание генотипов (Arg/Gln)w/dup16-Arg/Pro-w/m является неблагоприятным с точки зрения риска формирования НМРЛ для лиц зрелого возраста ввиду совместного вклада минорных аллелей генов р53 и XRCC1 в снижение эффективности процессов репарации.
Мы показали, что ассоциация w/w-Arg/Arg-w/w комбинации генотипов гена р53 с НМРЛ в пожилом возрасте оставалась значимой при сочетании с w/w генотипом гена CCR5 и Arg/Arg генотипом гена репарации, характеризующимися неизмененной активностью своих белковых продуктов (табл.8 и 9). На наш взгляд, рисковая значимость этих сочетаний генотипов может быть определена наличием гомозиготного состояния р53 по аргинину, о возможных механизмах патологического вклада которого мы упоминали выше. Важно то, что с возрастом увеличивается вероятность мутации р53, обусловленная не только длительной экспозицией к факторам внешней среды, но и ошибками систем репарации.
Нам не удалось оценить ассоциацию генотипов гена CCR5 с комбинацией генотипов (3 интрон-4 экзон-6 интрон) гена р53 у больных МРЛ по причине малочисленности группы (n=34).
Таким образом, проведенные исследования показали, что в условиях патогенетически значимых экзогенных влияний (курение) сочетанное носительство функционально измененных генотипов, несущих минорные аллели генов р53 и XRCC1 способствует более раннему возникновению НМРЛ. В то же время носительство комбинации функционально полноценных генотипов (мажорные аллели) генов р53, CCR5, XRCC1 ассоциировано с НМРЛ в пожилом возрасте. Эти исследования подтверждают, что полиморфизм ДНК, даже вне кодирующей области, может быть связан с ослаблением или усилением функции гена и свидетельствуют о том, что существуют определенные механизмы реализации онкогенного потенциала каждой из изучаемых комбинаций гена р53 при НМРЛ в зависимости от возраста. В целом полученные нами данные в определенной степени подтверждают высказанную недавно гипотезу об антагонистической плейотропии генов онкосупрессоров, в первую очередь, гена р53, согласно которой нормально функционирующий белок р53 защищает от рака в раннем периоде жизни, промотируя одновременно фенотип старения и связанный с ним поздний рак. Защита от неоплазий у молодых организмов связана с активным апоптозом либо индукцией фенотипа клеточного старения: оба эти процесса предотвращают пролиферацию и снижают риск злокачественной трансформации. Оборотной стороной такой активности является ускоренное накопление стареющих клеток в тканях, что наряду с дисфункцией теломеразы характеризуется резистентностью к апоптотическим сигналам, а также проканцерогенными изменениями стромальных клеток. В частности, возрастная зависимость рака ряда локализаций, с одной стороны, обусловлена накоплением мутаций в эпителиальных клетках, а с другой, - связанным со старением изменением стромального микроокружения, которое становится способным формировать и поддерживать опухолевый фенотип. Такое микроокружение характеризуется повышением экспрессии факторов роста эпителия, провоспалительных цитокинов, ремодулирующих экстраклеточный матрикс молекул (Faragner, 2000; Krtolica, Campisi, 2002; Campisi, 2005).
Показанное нами вовлечение комбинации гетерозиготных генотипов гена р53 по интронным и экзонному полиморфизму в формирование НМРЛ и МРЛ свидетельствуют о важной роли этого гена в патогенезе обеих форм рака легкого. Предварительные данные о связи делеционного аллеля хемокинового рецептора CCR5 с МРЛ, но не с НМРЛ, по-видимому, могут объясняться тем фактом, что МРЛ развивается из нейроэндокринных клеток APUD-системы, в регуляции которой участвует иммунная система, и нарушение функции рецептора ССR5 в результате делеции 32 пар нуклеотидов может выступать патогенетически значимым фактором в развитии МРЛ.
Исход заболевания, одним из объективных оценочных критериев которого является продолжительность жизни больного, зависит от целого ряда факторов: распространенности процесса, гистологической структуры опухоли, применяемого лечения, чувствительности опухоли к цитостатической терапии. Для того, чтобы оценить возможную связь изучаемых комбинаций полиморфизмов гена р53 с исходом, мы провели однофакторный анализ общей выживаемости больных НМРЛ в зависимости от носительства разных комбинаций его генотипов по методу Каплана-Майера (рис.1). Исследуемые группы были сопоставимы по полу, возрасту, распространенности, локализации и гистотипу опухоли, а также по эффективности проводимой терапии.
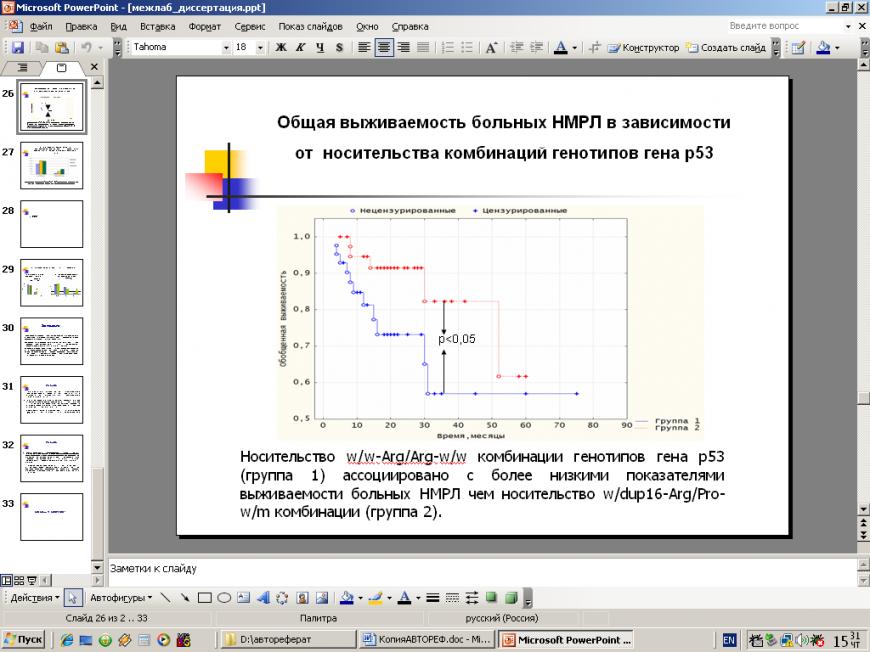
Рис 1. Общая выживаемость больных НМРЛ в зависимости от носительства комбинаций генотипов гена р53. Примечание: нецензурированные данные - завершенные наблюдения, в которых наступил случай смерти; цензурированные данные - незавершенные наблюдения, в которых исследуемый исход не наступил, или объект выбыл и больше не наблюдался. Группа 1- носительство w/w-Arg/Arg-w/w комбинации и группа 2 – носительство w/dup16- Arg/Pro-w/m комбинации. По оси абсцисс – время в месяцах с момента постановки диагноза НМРЛ, по оси ординат – кумулятивная выживаемость, рассчитанная по методу Каплан-Майера.
Была выявлена ассоциация комбинации гетерозиготных генотипов w/dup16-Arg/Pro-w/m гена р53 с более высокими показателями общей выживаемости больных НМРЛ по сравнению с комбинацией гомозиготных генотипов по мажорным аллелям w/w-Arg/Arg-w/w (р<0,04). Мы не обнаружили значимой связи данной комбинации генотипов гена р53 с такими клиническими проявлениями прогрессии заболевания, как лимфогенное и гематогенное метастазирование. Наши данные согласуются с результатами Bergamashi et al. (2003), Bonafe et al. (2003) о том, что больные ЗНО головы и шеи, несущие Arg аллель в 4 экзоне гена р53, резистентны к химиотерапии, и данными Tomminska et al. (2005), о том что Arg аллель 72 кодона гена р53 ассоциирован с низкими показателями общей выживаемости больных РМЖ.
В последние годы достаточно четко показано, что гены, вовлекаемые в формирование злокачественной опухоли, как правило, связаны с ее прогрессией и ответом на лечение, таким образом, внося вклад в исход заболевания (Zpits et al., 2006). Согласно нашим результатам, комбинация гетерозиготных генотипов является неблагоприятной в плане повышения риска НМРЛ у курящих лиц зрелого возраста, однако при этом связана с более благоприятным исходом.
На первый взгляд явная противоречивость данных исчезает при более подробном рассмотрении механизмов участия гена р53 в формировании, прогрессии и реакции опухоли на химиотерапию. Как уже упоминалось выше, наличие минорных аллелей способствует снижению апоптотической способности клеток (Wu et al., 2003), что может повышать риск РЛ в условиях высокой канцерогенной нагрузки, каковой является длительное интенсивное курение, приводящей к накоплению клеток с мутантным р53. Вероятен вклад этого генотипа в чувствительность к цитостатическим препаратам, противоопухолевый эффект которых связан с индукцией р53-зависимого апоптоза опухолевых клеток. Поскольку около 70% опухолей легкого содержат мутантный р53, не способный нормально запускать апоптоз, важным становится функционирование его гомологов, р73, в частности, активация которого может происходить в случае наличия Pro аллеля, однако ингибируется Arg аллелем (Yuan et al., 2006). Последнее может объяснить возможную более низкую эффективность химиотерапии у носителей Arg/Arg генотипа, по сравнению с носителями Pro аллеля.
ВЫВОДЫ
- Выявленное повышение частоты гетерозиготных генотипов гена р53 по 4 экзону (54%, Arg72Pro полиморфизм) и по 6 интрону (29%, MspI полиморфизм) по сравнению с контрольной группой (42%, p<0,000 и 15%, p<0,001, соответственно) свидетельствует о их вкладе в риск НМРЛ для курящих индивидуумов зрелого возраста (40-59 лет). Наличие гомозиготного генотипа по мажорным аллелям 4 экзона гена р53 ассоциировано с НМРЛ для курящих лиц пожилого возраста (60-74 лет).
- Генотипирование гена XRCC1 по полиморфизму Arg399Gln и гена CCR5 (ССR5del32 полиморфизм), не выявило различий в частоте встречаемости различных генотипов между группой больных НМРЛ и популяционным контролем, что свидетельствует об отсутствии ассоциации этих полиморфизмов с НМРЛ.
- Риск возникновения НМРЛ в зрелом возрасте повышается для курящих носителей комбинации гетерозиготных генотипов w/dup16-Arg/Pro-w/m гена р53 (p<0,002). Риск НМРЛ в пожилом возрасте повышается для носителей комбинации гомозиготных генотипов по мажорным аллелям гена р53 w/w-Arg/Arg-w/w (p<0,001) независимо от фактора курения.
- Показан сочетанный вклад гетерозиготных генотипов генов р53 и XRCC1 w/dup16-Arg/Pro-w/m(Arg/Gln) в риск формирования НМРЛ для лиц зрелого возраста. Сочетание комбинации гетерозиготных генотипов р53 с мажорным генотипом Arg/Arg гена XRCC1 не ассоциировано с НМРЛ в зрелом возрасте
- Установлена ассоциация w/del32 генотипа гена CCR5 (р=0,07) и комбинации гетерозигот w/dup16-Arg/Pro-w/m гена р53 (p<0,02) с мелкоклеточным раком легкого.
- Комбинация гетерозиготных генотипов w/dup16-Arg/Pro-w/m гена р53 ассоциирована с более высокими показателями общей выживаемости больных НМРЛ по сравнению с комбинацией гомозиготных генотипов по мажорным аллелям w/w-Arg/Arg-w/w (р<0,04).
Список работ, опубликованных по теме диссертации
- Чердынцева Н.В., Гервас П.А., Белявская В.А., Севостьянова Н.В., Флеминг М.В. Оценка связи функционального полиморфизма гена р53 и гена хемокинового рецептора CCR5 c риском возникновения и прогнозом клинического течения у больных раком легкого // Молекулярная медицина и безопасность: Сборник тезисов: 1 Международная конференция. - М. - 2004. - C.198-199.
- Чердынцева Н.В., Гервас П.А., Белявская В.А. и др. Онкоассоциированный полиморфизм кодона 72 гена р53 в опухолях различной локализации у пациентов Западно - Сибирского региона // Материалы Российской научно - практической конференции, посвященной 25 - летию НИИ онкологии ТНЦ СО РАМН. - Томск. – 2004. - C. 288-289.
- Флеминг М.В., Гервас П.А., Гердт Л.В., Севостьянова Н. В. Оценка частоты генетического полиморфизма хемокинового рецептора CCR5 при хроническом бронхите и раке легкого // Пятый конгресс молодых ученых и специалистов. - Томск, 2004. - C. 95-97.
- Чердынцева Н.В., Гервас П.А., Белявская В.А., Севостьянова Н.В., Флеминг М.В., Уразова Л.Н., Воевода М.И. Оценка связи функционального полиморфизма гена р53 и гена хемокинового рецептора CCR5 с риском возникновения и прогнозом клинического течения у больных раком легкого // Клиническая лабораторная диагностика. - 2004. -N 9. - C. 12.
- Гервас П.А., Дмитриева А.И., Добродеев А.Ю. Полиморфизм онкосупрессорного гена р53 и генов-модификаторов у больных раком легкого // Материалы Всероссийской научно - практической конференции по профилактике и борьбе со СПИД и другими инфекционными заболеваниями. - Красноярск, 2005. - С.77 -78.
- Флеминг М.В., Гервас П.А., Чердынцева Н.В. Функциональный полиморфизм генов онкосупрессорного белка p53 и хемокинового рецептора CCR5 у больных раком легкого и бронхиальной астмой // Материалы 9 Всероссийского научного форума с международным участием имени академика В. И. Иоффе Дни иммунологии в Санкт-Петербурге. - СПб. - 2005. - Том 7, N 2-3. - C.23.
- Fleming M.V., Gervas P.A., Cherdyntseva N.V., Klimov V.V., Sevostyanova N.V., Belyavskaya V.A. Functional polymorphism of p53 and CCR5 genes in lung carcinoma and bronchial asthma // Abstracts 15th ERS Annual Congress: European Respiratory Journal. – 2005. - Vol. 26., Supp.49. - P. 591.
- Чердынцева Н. В., Белявская В. А., Севостьянова Н. В., Гервас П.А. CCR5 как потенциальный медиатр активности р53: комбинации аллельных полиморфизмов CCR5 и P53 у больных со злокачественными новообразованиями // Биотехнология и онкология: I Российско - американская конференция.- СПб., 2005. - С.142 – 143.
- Чердынцева Н. В., Севостьянова Н.В., Белявская В.А., Гервас П.А. Генетические и эпигенетические факторы риска возникновения и прогресии рака легкого // Вопросы онкологии: Научно-практический журнал. -СПб. -, 2005. - Т.51, N1. - C. 27-28.
- Чердынцева Н. В., Севостьянова Н.В., Белявская В.А., Гервас П.А. Цитокины в патогенезе злокачественных новообразований // Цитокины и воспаление. - СПб. - 2005. - Том 4, N 2. - C. 103.
- Fleming M.V., Chugunova N.V., Grigorieva E.S., Gervas P.A. Steroid therapy resistance in bronchial asthma is associated with p53 gene polymorphism // Abstracts on respiratory health from the third annual national research forum for young investigators: Canadian Respiratory Journal. – 2006. - V.13., №3. - P.159.
- Чердынцева Н. В., Литвяков Н. В., Стахеева М. Н., Гервас П.А. Роль цитокинов в опухолевой прогрессии // Вопросы онкологии: научно - практический журнал. -Эскулап, 2006. - Том 52, N1. - С.42 -43.
- Чердынцева Н.В., Севостьянова Н.В., Флеминг М.В., Дмитриева А.И., Коломиец С.А., Малкова Е.М., Гервас П.А., Тузиков С.А., Чойнзонов Е.Л., Фрейдин М.Б., Белявская В.А., Воевода М.И. Полиморфизм генов ферментов глутатион-S-трансфераз у больных раком легкого: связь с опухолевой прогрессией // Молекулярная медицина – 2006. - №4. – С 46-52.
- Cherdyntseva N., Belyavskaya V., Gervas P. Polymorphism in GSTM1, GSTT1, p53 and CCR5 genes and lung cancer progression: relation to p53 and Ki-67 protein expression in tumors of non-small cell lung cancer patients // European respiratory journal. -Munich, 2006. - Том28, Sup.50. - C. 810.
- Чердынцева Н.В., Гервас П.А., Литвяков Н.В., Севостьянова Н.В., Флеминг М.В. Хемокины и прогрессия злокачественных новообразований: Дни иммунологии в Санкт-Петербурге // Медицинская иммунология. - СПб. - 2006. - Том 8, N 2-3. - С.355 – 356.
- Орлова Ю.Ю., Алифирова В.М., Чердынцева Н.В., Гервас П.А. Полиморфизм гена хемокинового рецептора CCR5 у больных рассеянным склерозом в Сибирском регионе // Бюллетень Сибирской Медицины. – 2006. - №3. – С. 98-103.
- Белявская В.А., Вардосанидзе В.К., Смирнова О.Ю., Гервас П.А. Генетический статус р53 при раке желудка: соматические мутации и полиморфизм кодона 72 // Бюллетень экспериментальной биологии и медицины. -М., - 2006. - Том141, N2. - C. 205 – 209.
- Гервас П.А., Сметанникова Н. А., Дмитриева А. И. Полиморфизм генов биотрансформации ксенобиотиков и репарации ДНК у больных раком легкого: связь с риском и опухолевой прогрессией // Материалы четвертой Всероссийской конференции молодых ученых в рамках 13 международного конгресса по приполярной медицине. - Новосибирск, 2006. - C. 21-22.
- Гервас П.А., Флеминг М.В., Сметанникова Н.Н. Оценка взаимосвязи полиморфизма гена хемокинового рецептора CCR5 с клиническим течением рака легкого // Материалы 10 Российского онкологического конгресса. - М., 2006. - С. 202.
- Гервас П.А., Сметанникова Н.А., Добродеев А.Ю. Гаплотипы гена-онкосупрессора р53: ассоциация с риском рака легкого // Материалы региональной конференции молодых ученых Томский НИИ онкологии ТНЦ СО РАМН. – Томск. - 2006. - C. 14-15.
- Gervas P., Smetannikova N., Dorodeev A. Influence of common p53 and XRCC1 variant alleles on risk of lung cancer // European respiratory journal. – Munich. - 2006. – Т.28, Sup.50. - C. 810.
- Гервас П.А., Сметанникова Н.А., Добродеев А.Ю., Рудык Ю.В., Миллер С.В., Васильева М.В., Белявская В.А., Тузиков С.А., Чердынцева Н.В. Полиморфизм гена-онкосупрессора р53: возрастные особенности в риске развития рака легкого // СОЖ.- 2007.-№2(22). - С.49-54.
- Gervas P., Smetannikova N., Vasilieva M., Cherdyntseva N., Belyavskaya V., Dobrodeev A., Tusikov S., Sevostianova N., Dmitrieva A. Influence of common glutathione-S-transferase and DNA repair variant alleles on p53 function: relation to lung cancer risk and progression // Journal of Thoracic Oncology. - 2007. – Vol.2, N8. – Supp.4. – P.484.
Благодарности
Автор выражает глубокую признательность и благодарность д.б.н., профессору Н.В. Чердынцевой, д.б.н. Белявской В.А., д.м.н. С.А. Тузикову, к.м.н. Добродееву А.Ю., Денисову Е.В., Сметанниковой Н.Н., к.м.н. Васильевой М.В., к.м.н. Миллеру С.В., к.м.н. Рудыку Ю.В. за помощь, оказанную при проведении исследований и обсуждении результатов.
Список сокращений:
МРЛ - мелкоклеточный рак легкого
НМРЛ - немелкоклеточный рак легкого
ПАРП – поли (АДФ-рибозо) полимераза
ПЦР – полимеразная цепная реакция
РЛ – рак легкого
Mdm2 (Murine double minute 2) - ингибитор апоптоза
Тираж 100. Заказ № 1309
Томский государственный университет
систем управления и радиоэлектроники
634050, г. Томск, пр. Ленина, 40

