Комплексное магнитно-резонансное исследование в диагностике, мониторинге и прогнозе ишемического инсульта
На правах рукописи
ФОКИН
Владимир Александрович
КОМПЛЕКСНОЕ МАГНИТНО-РЕЗОНАНСНОЕ ИССЛЕДОВАНИЕ
В ДИАГНОСТИКЕ, МОНИТОРИНГЕ И ПРОГНОЗЕ
ИШЕМИЧЕСКОГО ИНСУЛЬТА
14.00.19 - лучевая диагностика, лучевая терапия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
САНКТ-ПЕТЕРБУРГ
2008
Работа выполнена в Военно-медицинской академии им. С.М. Кирова
НАУЧНЫЙ КОНСУЛЬТАНТ:
доктор медицинских наук профессор Труфанов Геннадий Евгеньевич
ОФИЦИАЛЬНЫЕ ОППОНЕНТЫ:
доктор медицинских наук профессор Трофимова Татьяна Николаевна
доктор медицинских наук профессор Карлова Наталия Александровна
доктор медицинских наук профессор Савелло Виктор Евгеньевич
ВЕДУЩЕЕ УЧРЕЖДЕНИЕ:
ФГУ Российский научный Центр радиологии и хирургических технологий Федерального агентства по высокотехнологичной медицинской помощи
Защита состоится «___» ____________ 2008 г. в ___ часов на заседании диссертационного совета Д 215.002.11 в Военно-медицинской академии
им. С.М. Кирова (194044, Санкт-Петербург, ул. Академика Лебедева, 6)
С диссертацией можно ознакомиться в фундаментальной библиотеке
Военно-медицинской академии им. С.М. Кирова
Автореферат разослан «___» _________ 2008 г.
Ученый секретарь диссертационного совета
доктор медицинских наук профессор
Ищенко Борис Ионович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Острые нарушения мозгового кровообращения имеют большое значение для общества по ряду причин: распространенности, тяжести и быстроты течения заболевания, высокого уровня инвалидизации и смертности (Одинак М.М., 1998, 2005; Скворцова В.И., 2006; Скоромец А.А., 1998, 2007).
По данным ВОЗ, в 2006 году в мире уровень смертности от сердечно-сосудистых заболеваний составил 688 на 100 тыс. чел. и значительно превысил показатели смертности вследствие травм (217 на 100 тыс. чел.) и новообразований (152 на 100 тыс. чел.) (http://www.who.int/).
Частота возникновения инсультов в мире составляет около 200 случаев (в России 350-530) на 100 тыс. населения ежегодно. Для США инсульт является третьей по частоте причиной смерти, стран Европы – второй, для мегаполисов России – первой. Среди больных старше 25 лет заболеваемость и смертность увеличиваются примерно в 2-3 раза с каждым последующим десятилетием. Спустя год после возникновения инсульта в отдельных странах умирают до 50% больных; при этом среди выживших до 80% пациентов остаются до конца жизни инвалидами, нуждающимися в посторонней помощи и финансовой поддержке государства (Гусев Е.И. с соавт., 1997, 2001, 2003; Скоромец А.А. с соавт., 1998; Одинак М.М. с соавт., 2002, 2005; Hankey G.J., 2002).
В связи с этим заболевания, связанные с недостаточностью мозгового кровообращения, были выделены в самостоятельный раздел невропатологии – ангионеврологию, и эта проблема имеет в настоящее время чрезвычайно большое медицинское и социальное значение (Гусев Е.И., Скворцова В.И., 2001; Виленский Б.С. с соавт., 2002; Верещагин Н.В., 2002; Акимов Г.А., 2004).
В настоящее время достигнут определенный прогресс в изучении этиологии, патогенеза и диагностики ишемического инсульта. Это обусловлено в первую очередь широким внедрением в клиническую практику новейших методов и методик нейровизуализации (рентгеновской компьютерной и магнитно-резонансной томографии, магнитно-резонансной спектроскопии, позитронно-эмиссионной томографии, однофотонной эмиссионной компьютерной томографии), которые позволили раскрыть и понять механизмы церебральной гемодинамики, изучить структуру, особенности кровотока и метаболизма мозга (Трофимова Т.Н., 1998; Вордлоу Д., 2000; Верещагин Н.В., 2002; Банникова Е.A., 2004; Ананьева Н.И., 2005; Grotta J.C., 1999).
Наибольший интерес среди исследователей в раннем распознавании ишемического инсульта вызывает магнитно-резонансная томография (Дубенко О.Е., 2000; Петросян С.Л., 2000; Холин А.В., 2000; Grandin C.B., 2001; Schaefer P.W., 2003). Появление новых методик на основе магнитного резонанса (МР-диффузия, МР-перфузия, МР-спектроскопия) подтолкнуло отечественных и зарубежных исследователей к активному изучению их возможностей в выявлении ишемического инсульта (Тютин Л.А., 1999; Ананьева Н.И., 2001; Поздняков А.В., 2001; Пьянов И.В., 2005; Ueda T., 1999; Igarashi H., 2003; Hand P.J. et al., 2006).
Однако опыт применения МР-диффузии, МР-перфузии и МР-спектроскопии в диагностике ишемического инсульта на большой группе пациентов в отечественной литературе практически отсутствует. Тем не менее авторы сходятся во мнении, что перфузионная и диффузионная МРТ способны выявить изменения в головном мозге в первые часы от начала клинических проявлений ишемического инсульта (Пьянов И.В., 2005; Суслина В.А., 2005). Кроме этого следует отметить, что среди зарубежных ученых нет единого мнения о возможностях различных перфузионных показателей (времени до пика – TTP, среднего времени транзита – MTT, объема мозгового кровотока – CBV, мозгового кровотока – CBF) в диагностике и прогнозе развития ишемического инсульта (Flacke S., 2002; Schaefer P.W., 2002; Igarashi H., 2003).
В настоящее время дискутабельным остается вопрос о роли МР-диффузии и МР-перфузии в оценке прогноза выживаемости мозговой ткани (Grandin, C.B., 2001; Gonzalez R.G., 2006). По данным ПВИ и ДВИ в острейшей стадии можно прогнозировать исход и объем ишемического повреждения вещества головного мозга, а также прогноз выживаемости ткани мозга, но какие показатели являются наиболее информативными – до конца не ясно. В настоящее время не полностью разработан и алгоритм МРТ-обследования больных с клинико-неврологической симптоматикой ишемического инсульта, особенно в острейшую стадию. Не ясно, какие методики следует применять в первую очередь, а от каких импульсных последовательностей стоит отказаться вовсе.
В литературе практически отсутствуют сведения по изучению изменений содержания и соотношений метаболитов при остром ишемическом инсульте, которые можно определить при водородной МР-спектроскопии.
Целью настоящего исследования явилось решение проблемы диагностической, динамической и прогностической оценки особенностей развития перфузионных и метаболических изменений при ишемическом инсульте в остром периоде по данным комплексного магнитно-резонансного исследования.
В соответствии с целью исследования определены следующие задачи:
- Оценить возможности и эффективность различных методик и импульсных последовательностей высокопольной МРТ в диагностике изменений в веществе головного мозга в острейший период ишемического инсульта.
- Провести сравнительный анализ данных, полученных при использовании различных методик (МР-диффузии, МР-перфузии, МР-ангиографии, МР-спектроскопии) и импульсных последовательностей МРТ у больных в дебюте ОНМК по ишемическому типу.
- Усовершенствовать и оптимизировать методику водородной МР-спектроскопии у больных с ОНМК по ишемическому типу и описать характерные изменения содержания и соотношений метаболитов.
- Оценить возможности динамического магнитно-резонансного исследования у больных в конце острейшего и острого периодов ишемического инсульта с анализом полученных данных.
- Определить зависимость между подтипами ишемических инсультов и вариантами динамики перфузионных расстройств в остром периоде заболевания.
- Установить взаимосвязь ангиоархитектоники и величины обратимой и необратимой ишемии.
- Определить диагностическую эффективность МР-диффузии, МР-перфузии и МР-спектроскопии в оценке степени (необратимости) нарушений церебральной гемодинамики.
- Оценить прогностическую значимость измеряемого коэффициента диффузии (ИКД), показателей мозгового кровотока (CBV, CBF, MTT, TTP) и данных МР-спектроскопии в прогнозе окончательного объема инфаркта, риска развития геморрагической трансформации, клинико-неврологического исхода.
- Разработать оптимальный, сокращенный и минимальный алгоритмы МР-исследования больных в острейшем периоде ишемического инсульта.
Научная новизна
Впервые в неотложной лучевой диагностике на большом клиническом материале проведено обследование больных с ишемическим инсультом в острейшем периоде и в динамике с применением МР-диффузии, МР-перфузии, МР-ангиографии и МР-спектроскопии, а также различных импульсных последовательностей в мониторинге зон обратимой и необратимой ишемии с оценкой неврологического дефицита в динамике.
Определены приоритетность и целесообразность применения тех или иных импульсных последовательностей в диагностике, мониторинге и прогнозе острого ишемического инсульта. Установлено ведущее значение ДВИ и ПВИ в диагностике изменений головного мозга при ишемическом инсульте в острейшей стадии.
Установлено, что наиболее ранние изменения структур головного мозга могут быть выявлены на ПВИ. Они характеризуются снижением мозгового кровотока (CBF) и объема мозгового кровотока (CBV), удлинением временных параметров мозгового кровотока: времени до пика (TTP) и среднего времени транзита (MTT).
Доказана роль и значение ПВИ и ДВИ в отборе пациентов с ишемическим поражением головного мозга для проведения тромболитической терапии.
Разработаны и оптимизированы схема применения МР-перфузии, МР-спектроскопии и другие параметры различных методик МР-исследования.
На основании данных комплексного МР-исследования выделены пять этиопатогенетических вариантов (подтипов) ишемического инсульта в зависимости от характера перфузионных расстройств в области формирующегося инфаркта мозга: нормоперфузионный вариант, постишемическая (реактивная) гиперемия, персистирующая (хроническая) гипоперфузия, острая патологическая гиперперфузия, феномен невосстановленной перфузии и изучена их семиотика.
На основании динамической оценки перфузионных расстройств определены варианты клинического исхода острейшего и острого периодов заболевания у больных ишемическим инсультом, а также выявлена их зависимость от характера эволюции зоны обратимой ишемии. При этом выделены два прогностически благоприятных варианта: нормоперфузионный вариант и постишемическая (реактивная) гиперемия, относительно благоприятный – персистирующая (хроническая) гипоперфузия и два неблагоприятных варианта: острая патологическая гиперперфузия и феномен невосстановленной перфузии.
Проведена сравнительная оценка диагностической значимости различных показателей МР-перфузии при ишемическом инсульте, что позволило выявить закономерности изменения параметров кровоснабжения головного мозга с использованием референтных методов лучевой диагностики.
Впервые оценена диагностическая эффективность МР-диффузии (ИКД), МР-перфузии (CBV, CBF, MTT, TTP) и МР-спектроскопии в оценке окончательного объема инфаркта, а также в прогнозе развития геморрагической трансформации, роста ядра инфаркта, жизнеспособности ткани мозга и клинико-неврологического исхода. При этом наибольшее значение в неблагоприятном прогнозе принадлежит МР-перфузии (rCBF менее 0,18), затем МР-диффузии (ИКД менее 3010-5мм2/с), наименьшее значение – МР-спектроскопии.
Разработаны алгоритмы оптимального, сокращенного и минимального МР-исследования больных в острейшем периоде ишемического инсульта, которые изложены в практических рекомендациях.
Практическая значимость
Выделены пять этиопатогенетических вариантов (подтипов) ишемического инсульта в зависимости от характера перфузионных расстройств в области формирующегося инфаркта мозга и изучены особенности их картины по данным комплексного МРТ-исследования. При этом для различных подтипов ишемического инсульта установлены универсальные закономерности эволюции зоны обратимой ишемии. Результаты проведенного исследования имеют важное значение для понимания индивидуальных особенностей течения различных подтипов ишемического инсульта в зависимости от характера перфузионных расстройств в зоне обратимой ишемии.
Полученные данные углубляют представления о гетерогенности патологических процессов при ишемическом инсульте, что позволяет обосновать необходимость проведения комплексного инструментального мониторинга как в дебюте заболевания, так и в динамике.
Представлены оптимальные диагностические алгоритмы ишемического инсульта в острейшем периоде (оптимальный, сокращенный и минимальный), что позволяет в ряде случаев сократить объем исследования, уменьшив время поступления пациента с диагностического этапа на этап интенсивной терапии.
Определены критерии прогноза геморрагической трансформации по данным МР-диффузии (ИКД менее 3010-5мм2/с), МР-перфузии (rCBF менее 0,18).
Определены критерии прогноза жизнеспособности ткани мозга и роста ядра инфаркта по данным МР-перфузии (rCBV менее 50%, rCBF менее 0,35, увеличение TTP на 6 секунд по сравнению с противоположным полушарием).
Основные положения, выносимые на защиту
- Высокоэффективным методом лучевой диагностики ишемического инсульта в острейшей и острой стадии является комплексное МР-исследование, выполнение которого позволяет не только выявить ранние признаки острой ишемии головного мозга, но и определить объем ядра инфаркта и ишемической полутени, зоны перфузионных расстройств, а также установить предполагаемый подтип инсульта и тип гемодинамических нарушений. Наиболее чувствительными методиками в раннем выявлении признаков перфузионных расстройств головного мозга являются ПВИ (несколько минут от окклюзии) и ДВИ (минимально 2-3 часа от возникновения неврологической симптоматики).
- Комплексное МР-исследование с проведением МР-диффузии и МР-перфузии позволяет оценить в динамике перфузионные расстройства в перифокальной зоне с выделением прогностически благоприятных и неблагоприятных вариантов восстановления мозгового кровотока.
- МР-диффузия, МР-перфузия и МР-ангиография являются методиками, с помощью которых можно установить взаимосвязь ангиоархитектоники и величины обратимой и необратимой ишемии головного мозга в зависимости от подтипа ишемического инсульта.
- Высокопольная МРТ с определением ИКД по данным МР-диффузии и показателей мозгового кровотока (TTP, MTT, CBF и CBV) по данным МР-перфузии, количества и соотношений метаболитов при МР-спектроскопии позволяет прогнозировать возможное развитие геморрагической трансформации, роста зоны инфаркта и клинико-неврологического исхода.
- Оптимальным алгоритмом комплексного МРТ-исследования больных в острейшем периоде ишемического инсульта является последовательное применение следующих методик: МР-диффузия, МР-перфузия, МР-ангиография, импульсные последовательности градиентного эха, инверсия-восстановление, Т2- и Т1-ВИ.
Реализация результатов работы
Результаты исследования внедрены в практическую работу диагностических отделений кафедры рентгенологии и радиологии, клиник нервных болезней, нейрохирургии Военно-медицинской академии им. С.М. Кирова, Национального центра патологии мозгового кровообращения ФГУ «НМХЦ им. Н.И. Пирогова Росздрава».
Основные научно-практические положения диссертации используются в учебном процессе на кафедрах рентгенологии и радиологии, нервных болезней, нейрохирургии для курсантов и слушателей факультетов усовершенствования врачей ВМедА и курса лучевой диагностики Санкт-Петербургского государственного университета.
Апробация работы
Основные положения диссертации доложены на заседаниях Санкт-Петербургского радиологического общества (2006, 2007), отечественных и международных конференциях и симпозиумах: III Всероссийском съезде нейрохирургов (Санкт-Петербург, 2002); научной конференции, посвященной 85-летию со дня основания ЦНИРРИ МЗ РФ, «Современные технологии в клинической медицине» (Санкт-Петербург, 2004); VII международном симпозиуме «Новые технологии в нейрохирургии» (Санкт-Петербург, 2004); юбилейной конференции «Современная лучевая диагностика в многопрофильном лечебном учреждении», посвященной 75-летию кафедры рентгенологии и радиологии Военно-медицинской академии (Санкт-Петербург, 2004); Невском радиологическом форуме «Наука – клинике» (Санкт-Петербург, 2005); Всероссийском научном форуме «Радиология-2005» (Москва, 2005); научно-практической конференции ГВКГ им. Н.Н. Бурденко «Актуальные проблемы клинической онкологии» (Москва, 2005); Юбилейной Всероссийской научно-практической конференции «Поленовские чтения» (Санкт-Петербург, 2006); IX Всероссийском съезде неврологов (Ярославль, 2006); Европейском конгрессе радиологов «European Congress of Radiology – ECR-2006» (Vienna, Austria, 2006); Международном радиологическом форуме (Астана, Казахстан, 2006); IV съезде нейрохирургов России (Москва, 2006); Международной радиологической конференции (Алматы, Казахстан, 2006); научно-практической конференции «Россия – страна контрастов» (Санкт-Петербург, 2007); Невском радиологическом форуме «Новые горизонты» (Санкт-Петербург, 2007); VIII Всероссийской научно-практической конференции «Актуальные вопросы клиники, диагностики и лечения больных в многопрофильном лечебном учреждении» (Санкт-Петербург, 2007); Всероссийском конгрессе лучевых диагностов «Радиология-2007» (Москва, 2007); Алматинском радиологическом форуме «Теоретические и практические аспекты лучевой диагностики хирургических заболеваний» (Алматы, Казахстан, 2007); II Российском международном конгрессе Всероссийского общества неврологов «Цереброваскулярная патология и инсульт» (Санкт-Петербург, 2007).
Всего сделано 23 доклада. По теме диссертационного исследования опубликовано 82 печатных работы, из них одно учебное пособие, две монографии, 6 глав в учебниках, учебных пособиях и монографиях, 15 публикаций в журналах, рекомендованных ВАК. Диссертационное исследование выполнялось параллельно с научно-исследовательскими работами «Полутень» и «Резонанс». Положения диссертации легли в основу монографии «Рентгеновская компьютерная и магнитно-резонансная томография в диагностике ишемического инсульта» (2005) и учебного пособия «Магнитно-резонансная томография в диагностике ишемического инсульта» (2008). Внедрено шесть рационализаторских предложений.
Личный вклад автора в выполнение данной работы
Автором лично проведено комплексное МР-исследование 302 пациентов с нарушением мозгового кровообращения по ишемическому типу в острейшем, конце острейшего и конце острого периодов.
Детальному анализу автором были подвергнуты результаты традиционной МРТ, МР-диффузии, МР-перфузии, МР-ангиографии, МР-спектроскопии у больных с ОМНК в острейшем периоде и в динамике.
Проанализированы и сопоставлены с результатами комплексного МР-исследования результаты неврологического исследования и допплерографического исследования у больных с ОМНК в остром периоде и в динамике.
Результаты комплексного обследования составили содержание работы и легли в основу положений, выносимых на защиту.
Тема диссертационного исследования тесно согласуется с научно-исследовательской работой ряда кафедр: рентгенологии и радиологии; нервных болезней, сердечно-сосудистой хирургии и нейрохирургии. Автор является соисполнителем по темам НИР (Военно-медицинская академия, шифр «Полутень» № VMA.03.12.08.0609/0180 и «Резонанс» № VMA.03.12.20.0508/0277), основные направления которых перекликаются с материалами диссертационного исследования.
Тема и план диссертации, ее основные идеи и содержание разработаны совместно с научным консультантом на основании многолетних (20002008 гг.) целенаправленных исследований. Во всех совместных исследованиях по теме диссертации автору принадлежит формулирование общей цели и задач конкретной работы, а также анализ полученных данных.
Все результаты комплексного МР-исследования, использованные в диссертационной работе, получены и обработаны лично автором.
Объем и структура диссертации
Диссертация состоит из введения, пяти глав, заключения, выводов, практических рекомендаций, списка литературы, приложений. Работа изложена на 294 страницах, содержит 17 таблиц, 38 рисунков, 7 диаграмм. Список литературы включает 273 источника, из них 103 отечественных и 170 зарубежных.
СОДЕРЖАНИЕ РАБОТЫ
Методика комплексного МР-исследования головного мозга и общая характеристика обследованных больных.
В основу работы положены данные комплексного магнитно-резонансного исследования 302 пациентов в острейшем периоде ишемического инсульта, у которых при первичной МРТ были выявлены признаки острой ишемии головного мозга. Все 302 больных находились на стационарном обследовании и лечении в клинике нервных болезней Военно-медицинской академии. Анализируемый период – 2003-2007 гг.
Преобладали больные в возрастных группах от 41 до 80 лет (средний возраст – 60±6,18 года). Пациенты трудоспособного возраста (до 60 лет) составили больше половины больных, что подтверждает тенденцию к «омоложению» заболеваемости инсультом.
Всем 302 пациентам было выполнено комплексное МР-исследование в том или ином объеме, который зависел от многих факторов: состояния пациента, наличия спонтанной двигательной активности, планируемого лечения, объема выявленного инфаркта, сроков от появления неврологической симптоматики и т.д.
Комплексное МР-исследование включало: традиционную МРТ (Т1- и Т2-ВИ) с использованием импульсных последовательностей (ИП) спинового эха, а также применение ИП инверсия-восстановление (TIRM), градиентного эха (GRE), МР-диффузию, МР-перфузию, бесконтрастную время-пролетную (3D TOF) МР-ангиографию, водородную МР-спектроскопию в дебюте заболевания и в динамике.
В группе из 101 пациента, которые поступили в начале острейшего периода (до 24 часов), было выполнено комплексное МР-исследование в дебюте заболевания и в динамике (в трех точках):
- в точке А – в начале острейшего периода инсульта (до 24 часов от момента появления неврологической симптоматики) – при поступлении пациента в стационар;
- в точке Б – в конце острейшего периода инсульта (на 2-10-е сутки заболевания) – при стабилизации соматического состояния и завершении флюктуации неврологической симптоматики;
- в точке В – в конце острого периода заболевания (на 21-30-е сутки).
Перфузионную МРТ и водородную МР-спектроскопию выполняли только в точках А и Б, так как в точке В выполнение перфузии отражало лишь сохранившиеся нарушения кровообращения на фоне проведенного лечения инфаркта головного мозга. Выполнение МР-спектроскопии из-за наличия зоны ликворокистозных изменений не позволяло добиться подавления МР-сигнала от воды и затрудняло анализ спектров. Задачами при выполнении комплексного МР-исследования были:
- оценка наличия или отсутствия гематомы;
- оценка наличия или отсутствия ишемии;
- выявление ранних признаков ишемии;
- оценка объема диффузионных нарушений;
- оценка объема перфузионных расстройств;
- оценка степени снижения ИКД;
- оценка степени изменения показателей мозгового кровотока (CBF, CBV, MTT, TTP);
- визуализация «стоп-потока» (отсутствие МР-сигнала от тока крови на МР-ангиограммах и отсутствие эффекта «пустоты потока» от сосуда на импульсных последовательностях спинового эха),
- выявление особенностей ангиоархитектоники (разомкнутый/замкнутый виллизиев круг и т.д.);
- оценка содержания метаболитов по данным МР-спектроскопии (N-ацетиласпартата, холина, креатина, лактата, инозитола).
Кроме этого была проведена неврологическая оценка состояния больных по шкале неврологического дефицита NIH.
В первые 24 часа от дебюта заболевания были обследованы всего 33,5% пациентов. Такой процент обследования был связан с множеством факторов (организационными, социальными и прочими), которые приводили к более позднему поступлению пациентов в стационар. В эти сроки возможно проведение терапии, способной снизить возникновение необратимых изменений в веществе головного мозга. Проведение тромболитической терапии в рамках так называемого «терапевтического окна» возможно до 3 или до 6 часов (в зависимости от применяемого препарата и локализации очага ишемии) от момента появления неврологической симптоматики и может в большинстве случаев уменьшить объем ишемического повреждения вещества головного мозга.
Наиболее востребованной методикой у всех пациентов была МР-диффузия, что обусловлено двумя основными факторами: 1) высокой чувствительностью в острейшем периоде; 2) небольшим временем сканирования, что позволило технически ее выполнить и использовать для дальнейшего анализа у всех больных.
В третьей точке не выполняли МР-спектроскопию и МР-перфузию (за исключением начального этапа работ), так как в точке В выполнение перфузии отражало лишь сохранившиеся нарушения кровообращения на фоне проведенного лечения по поводу инфаркта. Но МР-перфузия в точках А и Б была выполнена в 100% случаев, при ее проведении были выявлены соответствующие изменения, не видимые при выполнении других методик, что подтверждает ее высокую чувствительность в диагностике острой ишемии головного мозга.
Применение спектроскопии было ограничено многими факторами: состоянием пациента (двигательная активность, острота заболевания, наличие достаточного времени для проведения исследования и т.д.), локализацией очага ишемии, наличием зоны ликворокистозных изменений, наличием внутричерепного кровоизлияния и т.д.
При выполнении МР-спектроскопии наличие зоны ликворокистозных изменений не позволяло добиться подавления МР-сигнала от воды и затрудняло анализ спектров.
Распределение пациентов по этиопатогенетическим вариантам (под-типам) ишемического инсульта, согласно классификации TOAST Stroke Subtype>
Клиническая оценка состояния больных и степени нарушения неврологических функций в динамике выполнялась невропатологом с использованием шкалы инсульта NIH (Brott T., Adams H.P., Olinger C.P. et al., 1989) всем поступающим больных и кроме этого в динамике в точках Б и В.
Традиционную МРТ с получением стандартных Т1- и Т2-ВИ, а также ИП градиентного эха в точке А проводили с целью первичной диагностики ишемического поражения головного мозга и исключения внутричерепной гематомы, объемного образования и другого несосудистого поражения головного мозга; в точке Б и В – с целью уточнения характера изменений сформировавшегося инфаркта мозга и подтверждения топического диагноза.
Диффузионную МРТ в точке А выполняли для подтверждения остроты патологического процесса и расчета объема предполагаемой необратимой ишемии; в точках Б и В – для уточнения характера изменений сформировавшегося инфаркта мозга.
При помощи перфузионной МРТ в точках А, Б и В определяли параметры мозгового кровотока в области формирующегося инфаркта мозга, а также объем перфузионных расстройств.
МР-ангиографию выполняли для визуализации сосудов головного мозга, выявления и дифференциации острой окклюзии мозговой артерии (тромбоз/эмболия) или сформировавшихся ранее стенозов/окклюзий.
В острейшем периоде в целях экономии времени предпочтительным являлся выбор только одной (аксиальной) плоскости сканирования.
В основном применяли оптимальный алгоритм МРТ-исследования.
- Локалайзер в трех плоскостях 19 с
- МР-диффузия 1 мин 12 с
- GRE 2 мин 12 с
- МРА 3D TOF (36 срезов 1,15 мм) 1 мин 57 с
- T1 преконтрастный 1 мин 28 с
- МР-перфузия 1 мин 17 с
- TIRM (FLAIR) 2 мин 38 с
- Pd+Т2-ВИ 2 мин 24 с
- Т1 постконтрастный 1 мин 28 с
- Итого: 14 мин 55 с
При ухудшении состояния пациента в процессе исследования переходили к сокращению алгоритма МРТ-исследования.
Зону ядра инфаркта определяли как зону снижения ИКД ниже 5510-5мм2/с на ИКД-картах. Более контрастными для определения зоны ядра были ДВИ с фактором взвешивания b=1000 с/мм2. При этом зона ядра с гиперинтенсивным МР-сигналом четко выделялась на фоне изоинтенсивного МР-сигнала от неизмененного вещества головного мозга.
Формула расчета объема инфаркта, зоны перфузионных расстройств (гематомы): V= (S1+S2+…Sn)0,65, где V – объем инфаркта (гематомы) в см3; S – площадь изменения интенсивности МР-сигнала на каждом информативном срезе; n – количество срезов.
Наиболее оптимальной последовательностью МР-спектроскопии при исследовании головного мозга, по нашему мнению, является CSI-последовательность со значением время-эхо (TE) 30 мс. Объем вокселя составлял 1,5 см3, что, с одной стороны, улучшало соотношение сигнал-шум и способствовало разрешению спектров, с другой стороны, при небольших объемах повреждения вызывало контаминацию спектра окружающими структурами.
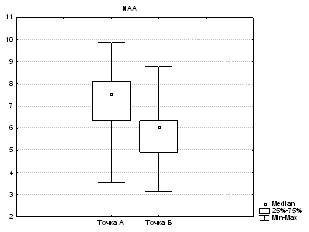
МР-спектроскопия по водороду в динамике была выполнена у 63 больных. При поступлении в сроки от 24 до 72 часов МРС была выполнена у 15 больных. При этом на всех спектрах были определены следующие метаболиты: холин (Cho), креатин (Cr), N-ацетиласпартат (NAA), лактат (Lac), инозитол (Ins) и проанализированы изменения содержания метаболитов и их соотношения в области ядра и зоне ишемической полутени, в том числе в динамике в точках А и Б.
Результаты клинико-инструментального и комплексного МР-исследования в диагностике нарушения мозгового кровообращения по ишемическому типу в острейшей стадии
В процессе научного анализа нами была проанализирована чувствительность различных импульсных последовательностей в диагностике ОНМК. Безусловно, такие попытки делались неоднократно различными авторами. В рамках данного исследования это было не основной задачей, но тем не менее необходимой, для того чтобы, опираясь на собственные данные и результаты исследований других авторов, доказать целесообразность применения предложенного нами алгоритма в диагностике нарушения мозгового кровообращения по ишемическому типу в острейшей стадии.
Наиболее чувствительной ИП в выявлении ОНМК в белом веществе является ИП инверсия-восстановление (TIRM), затем из последовательностей спин-эхо – изображения, взвешенные по протонной плотности, затем Т2-ВИ и наименее чувствительными в диагностике ОНМК в острейшей стадии являются Т1-ВИ.
Традиционные импульсные последовательности позволяют диагностировать ОНМК по ишемическому типу с выявлением прямых признаков в сроки более 12 часов от появления неврологической симптоматики. По косвенным признакам (особенно отсутствию эффекта «пустоты потока») ОНМК может быть выявлено и до 12 часов. Но даже отсутствие тока крови по сосуду по данным ИП спин-эхо и/или МРА при медленно развивавшейся хронической ишемии и наличии достаточных коллатералей не вызывает ишемического повреждения вещества головного мозга. Поэтому косвенные признаки не могут быть 100%-ным доказательством ОНМК, а отсутствие тока крови в ВСА требует дополнительного исследования сосудов шеи. Применения только стандартных импульсных последовательностей недостаточно, а иногда из-за недостатка времени и нецелесообразно для принятия решения о проведении тромболитической терапии в рамках «терапевтического окна» (3 или 6 часов).
На основании этих данных нами предложено изменить алгоритм обследования пациентов с ОНМК по ишемическому типу в острейшей стадии. Первыми выполнялись ДВИ, затем ПВИ, МР-ангиография. Из традиционных ИП первыми выполняли TIRM, затем GRE для исключения внутричерепного кровоизлияния, последними выполняли Т2-ВИ, Т1-ВИ.
Диффузионно-взвешенные изображения являются чувствительными в диагностике ОМНК по ишемическому типу в острейшей стадии и позволяют определить локализацию инфаркта и планировать дальнейшее лечение. ИКД в зоне ядра инфаркта достоверно отличался от ИКД неповрежденного вещества головного мозга с противоположной стороны. В зоне ядра инфаркта и в зоне ишемической полутени ИКД также различался. Со временем при благоприятном течении к концу острейшего периода ИКД постепенно увеличивался.
Перфузионно-взвешенные изображения являются наиболее чувствительными в диагностике ОНМК по ишемическому типу в острейшей стадии и позволяют выявить изменения до 3 часов от появления неврологической симптоматики, когда изменения не могут быть выявлены на ДВИ. Перфузионные расстройства характеризуются неоднородностью в зоне ядра и зоне ишемической полутени. В случае возобновления кровотока перфузионные расстройства проявляются постишемической гиперемией с увеличением показателей мозгового кровотока.
Максимальный объем перфузионных расстройств определяли по картам MTT и TTP, характеризующим увеличенное время циркуляции крови в ишемизированной ткани и более позднюю доставку крови, а соответственно, кислорода в эту область. Минимальный объем перфузионных расстройств рассчитывали по картам CBF, характеризующим скорость кровотока на капиллярном уровне. Как правило, данный показатель незначительно превышал объем необратимой ишемии.
Применение дополнительной методики – МРА и выявляемые на МР-ангиограммах изменения наряду с клинической картиной и данными ДВИ и ПВИ позволяли предположить причину (характер) церебральной ишемии, а также выявить особенности ангиоархитектоники у больных с острейшим инсультом.
По данным водородной МР-спектроскопии наиболее значимыми изменениями у пациентов с ОНМК в острейшем периоде по сравнению с неизмененным веществом головного мозга контралатеральной стороны оказались: увеличение Lac, увеличение Lac/Cr, снижение NAA, Cho, Ins и Cr.
Для оценки влияния на дисперсию метаболитов такого фактора, как зона (ядро, зона ишемической полутени и неизмененное вещество головного мозга противоположного полушария), был выполнен однофакторный дисперсионный анализ. Изучалось разложение дисперсии метаболитов на составляющие:
– дисперсию вследствие влияния контролируемого фактора (зона исследования);
– дисперсию, вызываемую действием неконтролируемых, случайных факторов и ошибками измерения.
Анализ результатов дисперсионного анализа показал, что наиболее тесная связь зоны исследования выявлена с содержанием Lac (F=24,08; p<0,001), Cr (F=6,94; p=0,002), а также с Cho (F=5,74; p=0,004) и NAA (F=4,47; p=0,013). Близка к достоверной связь с содержанием Cr2 (F=2,34; p=0,099). Содержание же метаболита Ins не зависит от зоны исследования (p=0,599).
Для оценки характера влияния зоны исследования на дисперсию метаболитов рассчитаны их числовые характеристики в каждой зоне (табл. 1), а также было проведено сравнение попарно различных зон с оценкой значимости различий полученных показателей при помощи непараметрического U–критерия Манна-Уитни (Mann-Whitney), позволяющего обнаружить различия между двумя независимыми выборками.
Таблица 1
Данные водородной МР-спектроскопии по содержанию метаболитов,
полученные от вокселей, в области ядра инфаркта (ядро), зоне ишемической полутени (полутень) и неизмененного вещества головного мозга противоположного полушария (норма), (Me [Q25; Q75])
| Метаболит | Ядро | Полутень | Норма |
| NAA | 6,97 [5,79; 7,93] | 6,98 [5,51; 8,16] | 7,45 [6,91; 8,30] |
| Cho | 3,05 [2,55; 3,61] | 3,18 [2,45; 3,88] | 3,77 [3,13; 4,17] |
| Cr | 3,4 [2,73; 4,05] | 3,23 [2,78; 4,06] | 3,95 [3,23; 4,53] |
| Cr2 | 2,65 [2,1; 3,13] | 2,4 [1,58; 2,96] | 2,36 [1,79; 2,91] |
| Lac | 1,49 [0,37; 2,84] | 0,80 [0,17; 1,77] | 0,11 [0,00; 0,45] |
| Ins | 1,14 [0,67; 1,48] | 0,99 [0,70; 1,29] | 1,13 [0,90; 1,33] |
Примечание: сравнение попарно различных зон по U–критерию Манна-Уитни обозначено: – ядро и норма (p<0,05); – норма и полутень (p<0,05); – полутень и ядро (p<0,05). Описание случайных величин произведено с указанием медианы и межквартильного размаха ввиду достоверного отличия эмпирического закона распределения от теоретического закона нормального распределения для большинства из них.
Для ядра инфаркта и вещества головного мозга противоположного полушария достоверные различия (p<0,05) выявлены для NAA, Cho, Cr, Cr2 и Lac.
Для зоны ишемической полутени и вещества головного мозга противоположного полушария метаболитов, имеющих достоверные различия (p<0,05), выявлено меньше – NAA, Cho, Cr и Lac.
Для ядра инфаркта и зоны ишемической полутени достоверные различия (p<0,05) выявлены только для Cr2 и Lac.
Наиболее достоверно значимые изменения (p<0,001) выявлены между ядром, зоной ишемической полутени и противоположным полушарием в содержании Lac и соотношении Lac/Cr. Различалось также достоверно (p<0,05) содержание NAA и содержание Cho.
Подводя итоги анализа результатов МР-спектроскопии, можно сделать вывод, что наибольшее количество достоверных изменений по содержанию метаболитов было выявлено между неизмененным веществом головного мозга и ядром инфаркта. Различия выявлены и между зоной ишемической полутени и зоной ядра инфаркта. Полученные нами данные соответствуют общим представлениям о гетерогенности изменений вещества головного мозга при ОНМК по ишемическому типу.
Между снижением ИКД и снижением содержания метаболитов выявлены сильные положительные корреляции у следующих метаболитов – NAA, Cho, Cr, Ins, отрицательная – у Lac.
Наиболее часто выявляемыми признаками нарушения мозгового кровотока в дебюте ишемического инсульта были снижение цереброваскулярной реактивности в бассейне поражения (ниже 80%), увеличение периферического сопротивления и тонуса артерий, асимметрия кровотока в пораженном и контралатеральном бассейнах.
Результаты клинико-лучевого обследования больных с острым нарушением мозгового кровообращения в динамике
Нами был произведен научный анализ данных комплексного МР-исследования в динамике. К окончанию острейшего периода инсульта, характеризовавшегося стабилизацией показателей гемодинамики, отсутствием признаков органной недостаточности и завершением флюктуации неврологической симптоматики, по динамике состояния пациенты (n=101) были разделены на две группы.
Первую группу (n=84, 83,2%) составили пациенты с отчетливой положительной динамикой, заключающейся в регрессе общемозговой и очаговой неврологической симптоматики (уменьшение неврологического дефицита по шкале инсульта NIH на 1-16 баллов, что в среднем для каждого пациента составило 38,8±19,6%).
Вторую группу (n=17, 16,7%) составили пациенты либо без отчетливой положительной динамики (регресс неврологического дефицита не более 10%), либо с отчетливым ухудшением состояния – нарастанием общемозговой и/или утяжелением степени выраженности очаговой неврологической симптоматики и увеличением неврологического дефицита по шкале инсульта NIH.
Для пациентов с лакунарным инсультом (n=12) были характерны быстрая (на 2-3-й день) стабилизация соматического состояния и существенный регресс неврологических расстройств.
При МР-исследовании в точке Б с получением Т1- и Т2-ВИ изменение интенсивности МР-сигнала, свидетельствовавшее о сформировавшемся инфаркте мозга, на Т2-ВИ было выявлено у всех больных (n=101).
У 14 пациентов (13,9%) на Т1- и Т2-ВИ были выявлены геморрагические осложнения – геморрагическое пропитывание в области ишемического очага (у 11 больных) и внутримозговая гематома (у 3 больных).
У всех больных с внутримозговыми гематомами отмечалось клиническое ухудшение преимущественно в виде нарастания общемозговой симптоматики, а также и очаговой неврологической симптоматики (вошли во вторую группу). У пациентов с геморрагическим пропитыванием ишемического очага клинического ухудшения не наблюдалось.
При выполнении ДВИ в конце острейшего периода инсульта у всех обследованных пациентов (n=101) выявляли изменения, характеризующиеся сохраняющимся повышением интенсивности МР-сигнала на ДВИ с факторами взвешивания b=500 и b=1000, снижением ИКД до 42,40±9,610-5мм2/c в области сформировавшегося инфаркта мозга. Минимальные значения ИКД были: для точки А – 2010-5мм2/c и для точки Б – 26,810-5мм2/c.
К концу острейшего периода (точка Б) происходило достоверное увеличение ИКД (p<0,01) в области ядра с 42,40±9,6 до 48,74±14,410-5мм2/c. Кроме этого уменьшалась и разница между ИКД в противоположном полушарии и ИКД в области ядра. Большой разброс показателей объясняется разнородностью вариантов гемодинамических изменений, сроками развития реперфузии и скоростью развития цитотоксического отека.
Увеличение ИКД происходило до 100,61±37,9410-5мм2/c, что достоверно (p<0,05) превышало ИКД в непораженном полушарии 74,34±8,110-5мм2/c. Кроме этого уменьшалась и даже становилась отрицательной разница между ИКД в полушарии, противоположном области инфаркта, и ИКД в области ядра инфаркта (-24,39±34,210-5мм2/c).
Объем сформировавшегося инфаркта мозга (по данным Т2-ВИ) у большинства пациентов (n=72, 71,3%) превышал объем, выявленный в дебюте заболевания (точка А) по данным ДВИ необратимой ишемии (средний прирост объема инфаркта 13,8%), однако никогда не достигал объема перфузионных расстройств острейшего периода. У 9 больных (8,9%) объем изменений на ДВИ в точке А был больше, чем объем изменений на Т2-ВИ в точке В.
Объем изменений на ДВИ, выявленных в точке Б, в 44,6% случаев был меньше, чем объем окончательно сформировавшегося инфаркта на Т2-ВИ в точке В (в среднем уменьшение объема на 20,2%).
Таким образом, ДВИ в начале острого (точка А) и конце острейшего периода (точка Б) могли незначительно переоценивать объем окончательно сформировавшегося инфаркта на Т2-ВИ (точка В). Данные изменения, наиболее вероятно связаны с пиком цитотоксического отека, когда происходили измерения объема на ДВИ в острейшем периоде.
При оценке динамики зоны ишемической полутени, определяемой как разница объема по данным ПВИ минус объем по данным ДВИ, отмечено уменьшение объема перфузионных расстройств с 130,7±127,9 см3 в точке А до 88,1±143 см3 в точке Б среди всей анализируемой группы больных. В группе пациентов с лакунарными инсультами разница между ПВИ и ДВИ в точках А и Б была равна нулю, что полностью соответствовало патогенезу таких инсультов.
Наиболее динамично изменялись в зоне ишемической полутени показатели, рассчитываемые при построении перфузионных карт. Разнообразие обнаруженных изменений в этой перифокальной области позволило нам выделить пять верифицированных вариантов динамических изменений перфузионных расстройств острейшего периода:
- Нормоперфузионный вариант.
- Постишемическая (реактивная) гиперемия.
- Персистирующая (хроническая) гипоперфузия.
- Острая патологическая гиперперфузия.
- Феномен невосстановленной перфузии.
1-й вариант – перфузионные расстройства в перифокальной зоне отсутствовуют (n=22, 21,8%), что свидетельствует о полном восстановлении кровотока и отсутствии микроциркуляторных расстройств. У пациентов с таким вариантом динамики перфузионных расстройств в дебюте заболевания отсутствовали признаки грубого повреждения гематоэнцефалического барьера по данным МРТ; при этом у шести из них был выявлен «стоп-поток» по данным МРА, в перифокальной зоне определены признаки гипоперфузии или постишемической гиперемии, а сроки поступления и, соответственно, выполнения первичного обследования и начала интенсивной терапии были различными.
Клинически к концу острейшего периода у всех пациентов с таким вариантом динамики перфузионных расстройств отмечались положительные изменения в виде значительного улучшения общего состояния и достоверного регресса неврологической симптоматики. Такой вариант динамики перфузионных расстройств был обозначен нами как «нормоперфузионный».
Для нормоперфузионного варианта было характерно резкое снижение объема перфузионных расстройств на фоне неизмененного объема ядра инфаркта (по данным ДВИ) и появления зоны сформировавшегося инфаркта на Т2-ВИ в точке Б.
2-й вариант – в перифокальной зоне определяются признаки постишемической гиперемии с увеличением показателей rCBV, TTP и MTT (n=35, 34,6%). При этом перфузионные изменения по интенсивности и объему по сравнению с острейшим периодом менее выражены (среднее уменьшение объема перфузионных расстройств 69,73±25,6%).
При сравнении значений MTT, TTP в дебюте инсульта и в конце острейшего периода заболевания достоверно значимых различий между этими показателями выявлено не было, что характеризовало сохраняющееся увеличение времени циркуляции крови в ишемизированной ткани, а также более позднюю доставку крови. В дебюте инсульта признаков грубого повреждения гематоэнцефалического барьера по данным МРТ у данных пациентов выявлено не было.
Клинически у пациентов с постишемической гиперемией отмечалась положительная динамика в виде быстрой стабилизации соматического состояния, достоверного регресса неврологической симптоматики к концу острейшего периода инсульта. При проведении УЗДГ у пациентов с таким вариантом исхода перфузионных расстройств была выявлена тенденция к увеличению линейной скорости кровотока с высокими значениями периферического сопротивления и тонуса артерий в бассейне поражения. Такой вариант динамики перфузионных изменений мы обозначили как «постишемическая (реактивная) гиперемия».
Для варианта «постишемическая (реактивная) гиперемия» было характерно снижение, но сохранение объема перфузионных расстройств на фоне незначительно увеличивающегося объема ядра инфаркта (по данным ДВИ) и появления зоны сформировавшегося инфаркта на Т2-ВИ в точке Б.
3-й вариант – сохранение перфузионных нарушений (n=12, 11,9%). В перифокальной зоне выявляли увеличение TTP и MTT, а в 3 случаях и rCBV, по сравнению с неизмененным кровотоком противоположного полушария без достоверного изменения скоростных параметров (rCBF), причем перфузионные расстройства по объему соответствовали размерам обратимой ишемии в дебюте инсульта. По данным МРА у пациентов этой группы сохранялся «стоп-поток» в ВСА пораженного бассейна. Отсутствие положительной динамики в отношении проходимости сосуда по данным МРА, сохраняющиеся перфузионные расстройства по данным ПВИ, а также выявленные структурные изменения сосудов по данным дуплексного сканирования брахиоцефальных артерий подтверждали первоначальные представления о механизмах развития инсульта у данной группы пациентов, а также свидетельствовали о сохраняющейся хронической полушарной ишемии, ошибочно обозначенной нами в острейшем периоде на начальном этапе работы как перифокальная зона, или ишемическая полутень.
Допплерографическая картина также не изменялась и характеризовалась признаками остаточного кровотока в пораженной артерии и сформировавшихся коллатеральных перетоков. Большинство пациентов этой группы в анамнезе имели транзиторные ишемические атаки или перенесенные ранее инсульты.
Такой вариант перфузионных нарушений мы обозначили как «персистирующая (хроническая) гипоперфузия».
Для варианта «персистирующая гипоперфузия» было характерно сохранение объема перфузионных расстройств на фоне незначительно увеличивающегося объема ядра инфаркта (по данным ДВИ) и появления зоны сформировавшегося инфаркта на Т2-ВИ в точке Б.
4-й вариант – восстановление кровообращения в перифокальной зоне с формированием гиперперфузионного феномена (n=18, 17,8%). При этом в перифокальной зоне отмечали увеличение скоростных и объемных параметров кровотока – rCBF и rCBV, а также удлинение временных параметров MTT и TTP. Основной особенностью данного варианта расстройств перфузии явилось достоверно значимое нарастание скоростного параметра кровотока CBF.
Среди пациентов с таким вариантом динамических изменений перфузионных расстройств большую часть (n=13, 12,9%) составляли больные с геморрагическими осложнениями, имевшие в дебюте заболевания признаки грубого поражения гематоэнцефалического барьера по данным МРТ, а по данным МРА у 8 больных наблюдался «стоп-поток». Все пациенты с внутримозговыми гематомами, как отмечалось ранее, имели признаки клинического ухудшения, преимущественно связанного с нарастанием общемозговой симптоматики.
Данный вариант динамики перфузионных расстройств с увеличением скорости кровотока (CBF) мы считали самым неблагоприятным и обозначили его как «острая патологическая гиперперфузия».
Для варианта «острая патологическая гиперперфузия» было характерно сохранение или незначительное снижение объема перфузионных расстройств на фоне увеличивающегося объема ядра инфаркта (по данным ДВИ) и увеличения зоны сформировавшегося инфаркта на Т2-ВИ.
5-й вариант – сохранение обедненного кровотока в зоне обратимых ишемических изменений (n=14, 13,9%). В перифокальной зоне сохранялось снижение скоростных и объемных параметров кровотока – CBF и CBV, а также удлинение временных параметров MTT и TTP.
Основной особенностью данного варианта явилось отсутствие положительной динамики в отношении восстановления скоростных и объемных параметров кровотока и, что особенно характерно, стремительное нарастание объема необратимой ишемии по данным ДВИ и Т2-ВИ и приближение ее к объемам перфузионных расстройств. У таких больных отмечалось развитие перифокального отека и признаков дислокационного синдрома (клинических и по данным МРТ). По данным МРА «стоп-поток» в дебюте заболевания был выявлен у 4 пациентов, а к концу острейшего периода восстановление МР-сигнала от тока крови по пораженной артерии было определено у всех обследованных.
Пациенты с таким вариантом изменений церебральной гемодинамики тяжелее переносили острейший период заболевания. Особенностью клинической картины у этих пациентов являлось быстрое формирование грубого неврологического дефицита уже с первых часов инсульта, отсутствие флюктуации неврологических симптомов.
Данный вариант перфузионных расстройств мы обозначили как «феномен невосстановленной перфузии».
Для варианта «невосстановленная гиперперфузия» было характерно незначительное снижение объема перфузионных расстройств на фоне увеличивающегося объема ядра инфаркта (по данным ДВИ) и увеличения зоны сформировавшегося инфаркта на Т2-ВИ в точке Б.
Таким образом, наиболее характерными для нормоперфузионного варианта были резкое уменьшение, практически до нуля, зоны перфузионных расстройств и симметричный кровоток по данным УЗДГ в конце острейшего периода. Для варианта постишемической гиперемии уменьшение объема перфузионных расстройств с увеличением показателей rCBV, TTP и MTT. Для персистирующей гипоперфузии были характерны «стоп-поток» и наличие коллатерального кровотока по данным МРА и УЗДГ при сохраненной зоне перфузионных расстройств. Для острой патологической гиперперфузии были характерны сохранение тяжелого состояния пациента по данным NIHSS, наличие повреждения ГЭБ в точках А и Б, формирование гематомы в конце острейшего периода. Для невосстановленной перфузии были характерны сохранение тяжелого состояния пациента по данным NIHSS, сохранения сниженного rCBF и rCBV в конце острейшего периода.
При проведении МР-спектроскопии в зависимости от варианта динамики перфузионных расстройств с благоприятным (нормоперфузионный вариант, постишемическая гиперемия, персистирующая гипоперфузия) и неблагоприятным прогнозом (острая патологическая гиперперфузия, невосстановленная перфузия) различалась и динамика изменения содержания метаболитов и их соотношений.
При варианте с благоприятным исходом (нормоперфузионный вариант, постишемическая гиперемия) происходило постепенное возвращение содержания метаболитов в области зоны ишемической полутени к нормальным показателям.
При варианте «персистирующая гипоперфузия» сохранение гипоперфузии, вероятно, способствовало наличию анаэробного гликолиза, что проявлялось повышением доли Lac и соотношения Lac/Cr. Кроме этого при статистическом анализе результатов МР-спектроскопии в этой группе отмечали лишь незначительное снижение Cho, что, по-видимому, отражало замедление обменных и ферментативных процессов в зоне гипометаболизма на фоне гипоперфузии.
Наибольшим изменениям было подвержено ядро инфаркта при вариантах с неблагоприятными исходами (табл. 2). Нами была проанализирована динамика изменения содержания метаболитов в точках А и Б у одних и тех же пациентов с использованием непараметрического теста Вилкоксона (Wilcoxon Matched Pairs Test).
Таблица 2
Изменения в зоне ядра инфаркта по данным водородной МР-спектроскопии в начале (точка А) и конце (точка Б) острейшего периода (Me [Q25; Q75]) по сравнению с неизмененным веществом головного мозга противоположного полушария (норма)
| Метаболит | Точка А | Точка Б | Норма |
| NAA* | 7,55 [6,33; 8,13] | 7,44 [5,87; 8,24] | 7,64 [7,11; 7,98] |
| Cho* | 3,15 [2,87; 4,13] | 3,17 [2,45; 3,74] | 3,87 [3,30; 4,17] |
| Cr* | 3,58 [2,95; 4,20] | 3,24 [2,92; 4,06] | 3,92 [3,29; 4,50] |
| Cr2 | 2,67 [2,19; 3,23] | 2,25 [1,56; 2,80] | 2,51 [1,88; 2,91] |
| Lac | 1,57 [0,56; 3,54] | 0,80 [0,52; 1,80] | 0,00 [0,15; 0,58] |
| Ins* | 1,32 [1,07; 1,51] | 1,06 [0,71; 1,36] | 1,16 [0,92; 1,37] |
* (p<0,05).
Как видно из данных в таблице 2, в динамике в ядре инфаркта происходит достоверное снижение NAA, Cho, Cr, кроме этого происходит постепенное снижение доли лактата.
При оценке значимости различий в динамике в точках А и Б в области ядра инфаркта найдено достоверное различие между следующими метаболитами: NAA (p=0,009; рис. 1а), Cho (p=0,003; рис. 1б), Cr (p=0,04), Ins (p=0,001). Для Cr2 изменения не достоверны (p>0,05), для Lac отмечена всего лишь тенденция (p=0,06).
При оценке значимости различий в точках А и Б в зоне ишемической полутени найдены достоверные различия только между Lac (p=0,013), соотношением Lac/Cr (p=0,02) и долей Lac (p=0,002), что, по нашему мнению, соответствовало наличию (сохранению) гипоперфузии, гипоксии и, соответственно, наличию анаэробного гликолиза.
 а а | 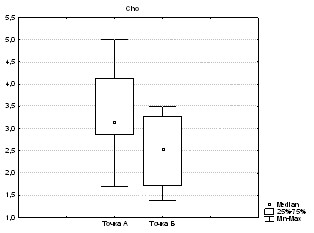 б б |
Рис. 1. Изменение содержания а) N-ацетиласпартата и б) холина в ядре в динамике (в точках А и Б) при гемодинамических вариантах с неблагоприятным прогнозом (p<0,01).
При оценке значимости различий в точках А и Б в неизмененном веществе головного мозга в противоположном инфаркту полушарии достоверных различий между всеми исследуемыми метаболитами выявлено не было.
Таким образом, в ядре инфаркта при неблагоприятном течении в динамике в точке Б по сравнению с точкой А происходило достоверное снижение метаболитов N-ацетиласпартата, холина, инозитола, креатина. Снижение N-ацетиласпартата свидетельствует, по мнению большинства исследователей, о снижении нейрональной активности. Снижение инозитола нуждается в дальнейшем изучении, но снижение холина может отражать снижение активности ферментов, в первую очередь фосфохолинэстеразы. Снижение уровня наиболее стабильного метаболита креатина свидетельствует о выраженности гибели (апоптоза) нейронов.
Кроме этого в веществе головного мозга пораженного полушария, там, где раньше (в точке А) имелась зона перфузионных расстройств (по картам MTT и TTP), в точке Б зона перфузионных расстройств отсутствовала, и никаких достоверных изменений в содержании метаболитов также не было выявлено, что, по нашему мнению, соответствовало полному восстановлению кровотока и, как следствие, метаболизма.
Таким образом, при проведении водородной МР-спектроскопии были выявлены признаки, соответствующие трем основным вариантам исхода: 1) гибели клеток, 2) наличию (сохранению) гипоперфузии и 3) полному восстановлению кровотока.
Для первого варианта было характерно одновременное снижение NAA, Cr, Cho, Ins, что отражало гибель нейронов. При сохранении гипоперфузии отмечено достоверное изменения Lac и соотношение Lac/Cr, что отражало сохранение в зоне гипоперфузии анаэробного гликолиза. В третьем случае происходило полное восстановление содержания метаболитов и их соотношений.
Возможности комплексного МР-исследования в прогнозе ОНМК по ишемическому типу
Для клинического применения наиболее важным является оценка прогнозирования исхода ОНМК и его осложнений. Комплексное магнитно-резонансное исследование способно более точно по сравнению с КТ, клиническим, неврологическим и инструментальным обследованием прогнозировать течение, исход и развитие возможных осложнений.
На основании проведенного нами научного анализа результаты комплексного МР-исследования позволяют осуществлять:
- Прогноз риска геморрагической трансформации.
- Прогноз жизнеспособности мозговой ткани.
- Прогноз роста зоны ядра инфаркта.
- Прогноз изменения объема сформировавшегося инфаркта.
- Прогноз клинико-неврологического исхода.
На основе ретроспективного анализа клинико-неврологических исходов сформулированы рекомендации по отбору пациентов для тромболитической терапии по данным ПВИ и ДВИ.
Снижение ИКД менее 3010-5мм2/с имеет чувствительность и специфичность в прогнозе возникновения геморрагической трансформации 91,7% и 96,1%, соответственно. Оценка сопряженности фактора (ИКД<3010-5мм2/с) с вероятностью развития геморрагической трансформации показала высокую степень связи по критерию Пирсона (2=60,3; p<0,001).
Снижение rCBF менее 0,18 (на момент исследования) при длительности более 6 часов от момента появления клинико-неврологической симптоматики являются, по нашим данным, предрасполагающими условиями, на фоне которых в нашем исследовании у 10 из 11 больных развилась геморрагическая трансформация.
Кроме этого нами был выявлен ряд дополнительных признаков, позволяющих предположить формирование геморрагической трансформации.
При локализации ОНМК в бассейне СМА возможное формирование геморрагической трансформации можно предположить при размерах зоны снижения ИКД или наличия гиперинтенсивного МР-сигнала на ДВИ с фактором взвешивания b=1000, занимающего более трети бассейна СМА.
Раннее накопление парамагнитных контрастных веществ на постконтрастных Т1-ВИ, которое отражало нарушение гематоэнцефалического барьера, также позволило предположить возможное формирование в дальнейшем геморрагической трансформации.
Первично выявленные на Т2* микрокровоизлияния (2 пациента) также были признаком выявившейся позже геморрагической трансформации.
На основе ретроспективного анализа нами были установлены показатели, которые позволяют в той или иной степени прогнозировать дальнейшее течение инсульта, определить жизнеспособность мозговой ткани и оценить, таким образом, возможности МР-диффузии и МР-перфузии, а также МР-спектроскопии в прогнозе увеличения размеров ядра инфаркта.
В анализ были включены пациенты с инсультами с перфузионно-диффузионным несоответствием (n=81), когда зона перфузионных нарушений в точке А была больше, чем зона повреждения ткани на МР-диффузии.
Проксимальные окклюзии чаще (n=43; 53,1%) приводили к перфузионно-диффузионной разнице, чем дистальные. Зона диффузионных нарушений (ИКД менее 5510-5мм2/с, соотношение ИКД по сравнению с противоположной стороной менее 0,8) и сниженной перфузии (rCBF менее 0,35) представляла собой нежизнеспособную ткань, или ядро инфаркта (p<0,05), которая затем четко визуализировалась в точках Б и В в виде гиперинтенсивного МР-сигнала на Т2-ВИ и при использовании ИП инверсия-восстановление как зона сформировавшегося инфаркта.
Изменения на ДВИ, как правило, необратимы и имеют высокую прогностическую значимость в оценке объема окончательно сформировавшегося инфаркта по данным Т2-ВИ с увеличением в среднем на 12,4% для всей группы больных.
При артериальной окклюзии участки головного мозга со сниженным ИКД и сниженной перфузией представляли собой нежизнеспособную ткань, или ядро инфаркта. В большинстве случаев (n=65; 80,2%) увеличение объема изменений на ДВИ в сочетании с пиком объемных изменений мозгового кровотока достигалось на 2-3-й день с момента появления неврологической симптоматики. Первоначальный объем изменений на ДВИ хорошо коррелировал с зоной окончательно сформировавшегося инфаркта, коэффициент корреляции Пирсона (r) варьировал от 0,69 (для всей группы больных) до 0,81 (для проксимальных окклюзий).
У 9 больных (8,9%) объем изменений на ДВИ в точке А был больше, чем объем изменений на Т2-ВИ в точке В. Среди этой группы сроки появления неврологической симптоматики составили в среднем 7,2 часа. У больных, у которых отмечали прирост зоны на Т2-ВИ в точке В по сравнению ДВИ в точке А, сроки появления неврологической симптоматики составили в среднем 10 часов.
Объем изменений на ДВИ, выявленных в точке Б, в 44,6% случаев был меньше, чем объем окончательно сформировавшегося инфаркта на Т2-ВИ в точке В (в среднем уменьшение объема на 20,2%).
Таким образом, МР-диффузия в начале острого (точка А) и конце острейшего периода (точка Б) могли незначительно переоценивать объем окончательно сформировавшегося инфаркта на Т2-ВИ (точка В). Данные изменения наиболее вероятно связаны с пиком цитотоксического отека, когда происходили измерения объема на ДВИ в острейшем периоде.
Первоначальный объем нарушений на картах rCBV в большинстве случаев (n=73; 90,1%) соответствовал объему изменений на ДВИ и также хорошо коррелировал с зоной окончательно сформировавшегося инфаркта с коэффициентом корреляции r=0,79.
Примерно у половины больных (n=51, 57,3%) отмечалось увеличение объема зоны сформировавшегося инфаркта в точках Б и В в среднем на 22% по сравнению с первоначальными данными (точка А) на картах rCBV. Когда имелось несоответствие данных rCBV и ДВИ (n=4; 4,9%), объем изменений на ДВИ соответствовал объему сформировавшегося инфаркта, но предполагаемый прирост зоны повреждения максимально увеличивался примерно до 60%.
Низкий rCBV (менее 50% от нормального) имел высокую прогностическую значимость для инфаркта головного мозга. Однако повышенный rCBV не показателен в отношении прогноза тканевой выживаемости, и значения rCBV, при которых произошел или не произошел инфаркт, могут различаться незначимо. Отношения rCBV, вызывающие ишемическое повреждение, находились в диапазоне 0,24-0,9 для ядра инсульта, от 0,68 до 1,27 для ишемической полутени.
Наиболее эффективным показателем, для того чтобы различить гипоперфузированную ткань, которая перейдет в зону инфаркта, и гипоперфузированную ткань, которая останется жизнеспособной, по нашим данным, был показатель rCBF, вычисляемый как часть, или фракция, от нормального значения. Для ядра инфаркта rCBF был равен 0,10-0,42 (p<0,05), для зоны ишемической полутени с тенденцией к инфаркту – 0,35-0,58 (p>0,01) и для жизнеспособной зоны ишемической полутени – 0,54-0,78 (p>0,01).
Такой разброс rCBF объясняется наличием большого количества факторов, влияющих на ишемическое повреждение вещества головного мозга. Наиболее важным из них является фактор – время наступления тканевой реперфузии (которая могла наступить до или после МР-исследования). Кроме этого полученные данные по результатам МР-перфузии представляют лишь одну временную точку в сложном динамическом процессе развития ОНМК.
Изменения на картах МТТ, как правило, переоценивали объем окончательно сформировавшегося инфаркта по данным Т2-ВИ.
При инфарктах в бассейнах мелких сосудов (перфорантные и дистальные ветви) первоначальные объемы повреждения на перфузионных (CBV, CBF, MTT) и диффузионных картах обычно соответствовали друг другу и зоне инфаркта. Прирост зоны инфаркта либо не отмечался, либо был очень незначительным.
Кроме этого в ряде случаев при лакунарных инфарктах (3 пациента) и при инфарктах в бассейне лентикулостриарных артерий (2 пациента) в точке А показатели CBV и CBF были равны нулю (контрастное вещество не достигало зоны интереса), что означало 100%-ную гибель нейронов.
При анализе времени до пика контрастного вещества (TTP) было выявлено, что пациенты с TTP больше или равным 6 секундам имеют риск значительного увеличения зоны ишемического повреждения, и то, что ткань головного мозга с TTP более 6 секунд имела сильную корреляцию с окончательным объемом инфаркта.
Нами были также проанализированы возможности МР-спектроскопии в прогнозе динамики ОНМК по ишемическому типу.
С учетом особенностей выполнения МР-спектроскопии в анализ были включены только пациенты с инфарктами в глубинных отделах белого вещества головного мозга (n=63, 62,4%).
Для области ядра было характерно снижение содержания NAA до 6,83±1,50, для зоны ишемической полутени – до 6,78±1,73, при нормальных показателях NAA 7,50±1,13 (CSI, TE=30 мс, объем вокселя 1,5 см3).
Максимальное увеличение лактата (1,75±1,57) происходило в области ядра инфаркта, менее выраженное – в зоне ишемической полутени (1,10±1,06), при этом в противоположном полушарии лактат не определялся или выявлялся в незначительных количествах. Такие изменения содержания лактата соответствуют выраженности анаэробного окисления в тканях, находящихся в разной степени гипоксии.
Прогноз клинико-неврологического исхода на основании снижения ИКД и показателей мозгового кровотока по данным МР-перфузии достаточно затруднен. Это связано с различной «неврологической значимостью» тех или иных структур головного мозга. Например, небольшой очаг ишемии в стволе головного мозга вызывает намного больший неврологический дефицит, чем такой же по объему участок корковой локализации.
Зависимости между степенью снижения ИКД и клинико-неврологическим исходом во всей группе больных выявлено не было.
Клинико-неврологический исход был в первую очередь связан с локализацией и «неврологической значимостью» тех или иных структур головного мозга.
Из выявленных нами вариантов динамических изменений перфузионных расстройств с прогнозом неблагоприятного исхода связаны варианты «острая патологическая гиперперфузия» и «невосстановленная перфузия»
При инсультах в бассейне ВСА и СМА наличие на ДВИ объема изменений более 90 см3 было высоко прогностическим фактором, указывающим на ухудшение неврологической симптоматики (r=0,78).
Также были проанализированы соотношения объема изменений на ПВИ и ДВИ в точке А и варианты клинического исхода. На основании научного анализа этих данных нами сформулированы рекомендации для отбора пациентов для тромболитической терапии. Наиболее «оптимальным» пациентом для тромболитической терапии, с точки зрения МР-диффузии и МР-перфузии, является пациент с положительной перфузионно-диффузионной разницей. Кроме этого необходимо учитывать наличие противопоказаний и риск возникновения геморрагической трансформации и общие критерии включения и исключения.
ВЫВОДЫ
- Комплексное МР-исследование позволяет установить: ранние признаки инсульта, его локализацию, исключить кровоизлияние, выявить окклюзию сосуда и ее уровень, оценить коллатеральный кровоток, особенности ангиоархитектоники, определить количественно степень снижения ИКД, объем ядра инфаркта, зоны перфузионных расстройств и ишемической полутени, установить предполагаемый подтип инсульта и тип гемодинамических нарушений.
- Наиболее чувствительной методикой в диагностике ОНМК по ишемическом типу является МР-перфузия, которая позволяет выявить зону перфузионных расстройств через несколько минут после окклюзии. МР-диффузия способна выявить ядро инфаркта примерно через 3 часа.
Возможности остальных импульсных последовательностей намного меньше и зависят от длительности отсутствия кровотока (сроков наступления реперфузии) и чувствительности ткани мозга к ишемии.
- Характерными изменениями метаболитов при проведении усовершенствованной методики водородной МР-спектроскопии для ядра инфаркта являются: одновременное снижение NAA, Cr, Cho, Ins, значительное увеличение Lac (p<0,05). Для ишемической полутени характерно незначительное снижение NAA, Cr, Cho и умеренное увеличение Lac (p<0,05).
- Комплексное МР-исследование в динамике позволило выделить пять вариантов восстановления мозгового кровотока: нормоперфузионный, постишемическая (реактивная) гиперемия, персистирующая хроническая ишемия, острая патологическая гиперперфузия, невосстановленная перфузия и их характерные признаки.
- Для проксимальных окклюзий крупных интракраниальных артерий характерна обширная зона перфузионных расстройств. При лакунарных инсультах – отсутствие перфузионных расстройств как в очаге ишемии, так и в перифокальной зоне.
- Объем окончательно сформировавшегося инфаркта позволяют наиболее точно прогнозировать: МР-диффузия в виде снижения ИКД менее 5510-5мм2/с, затем CBF (мозговой кровоток), CBV (объем мозгового кровотока); другие показатели – MTT (среднее время транзита) и TTP (время до пика) – значительно переоценивают окончательный объем инфаркта.
- Высокий риск развития у пациентов геморрагической трансформации предполагают: выявление ИКД менее 3010-5мм2/с по данным МР-диффузии, снижение rCBF менее 0,18 по данным МР-перфузии и длительность более 6 часов от момента появления клинико-неврологической симптоматики.
- Клинико-неврологический исход в первую очередь связан с локализацией и «неврологической значимостью» тех или иных структур головного мозга. С прогнозом неблагоприятного исхода связаны варианты: «острая патологическая гиперперфузия» и «невосстановленная перфузия». При инсультах в бассейне ВСА и СМА наличие на ДВИ объема изменений более 90 см3 является важным прогностическим фактором, указывающим на ухудшение неврологической симптоматики.
- Водородная МР-спектроскопия в динамике позволяет выявить три варианта изменения содержания метаболитов. Для первого варианта (гибели клеток) характерно одновременное снижение NAA, Cr, Cho, Ins. При втором варианте (сохранение гипоперфузии) кроме повышения Lac выявлено незначительное снижение содержания Cho. Для третьего варианта (восстановление кровотока) характерно полное восстановление содержания метаболитов и их соотношений.
- Разработанный оптимальный алгоритм МР-исследования больных в острейшем периоде ишемического инсульта включает проведение следующих методик: ДВИ, ПВИ, ИП градиентного эха, ИП инверсия-восстановление, трехмерная время-пролетная МР-ангиография, pd-, Т2- и Т1-ВИ в аксиальной плоскости и занимает не более 15 минут.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Обязательным для всех пациентов является выполнение МР-диффузии и МР-перфузии (за исключением пациентов с лакунарными инсультами). Для исключения внутричерепного кровоизлияния необходимо выполнять импульсную последовательность градиентного эха (GRE) или КТ перед планированием тромболитической терапии.
- Ядру инфаркта в острейшем периоде соответствует зона гиперинтенсивного МР-сигналом на ДВИ с фактором взвешивания b=1000 и снижением ИКД менее 5510-5мм2/с.
Зоной ишемической полутени в острейшем периоде следует считать максимальную по объему зону изменения показателей мозгового кровотока (CBV, CBF, MTT, TTP). Наличие в динамике только увеличенного TTP при сохраненном CBV и CBF может свидетельствовать о наличии хронической недостаточности мозгового кровообращения (гемодинамически значимом стенозе или окклюзии) на фоне развитых коллатералей. Объем окончательно сформированного инфаркта в конце острого периода лучше определять на изображениях, взвешенных по протонной плотности, или с использованием импульсной последовательности инверсия-восстановление (TIRM или FLAIR).
- При выполнении МР-перфузии необходимо добиться получения плотного болюса, для чего желательно использовать автоматический инъектор, парамагнитные контрастные вещества с высокой концентрацией, скорость введения не менее 5 мл/с.
- Перед выполнением МР-перфузии помимо общих противопоказаний к выполнению МРТ необходимо уточнить параметры артериального давления у пациента, отсутствие нарушений ритма и снижения фракции выброса. Наличие, например, у пациента мерцательной аритмии со сниженной фракцией выброса растягивает болюс, и оценить параметры мозгового кровотока по таким перфузионным данным не представляется возможным.
- Постпроцессорная обработка МР-перфузии оптимальна при наличии падения интенсивности МР-сигнала более 25% на кривой болюса (GBP – Global Bolus Plot) и ширине болюса не более 15 секунд.
- Время-пролетную МР-ангиографию (3D TOF) следует выполнять после МР-перфузии (для улучшения соотношения сигнал-шум и визуализации мелких сосудов за счет введенного парамагнитного контрастного вещества).
- Для минимизации времени сканирования во всех импульсных последовательностях необходимо сократить время повторения (TR) и число повторений до минимально допустимого.
- Для точного сопоставления данных сканирования пациентов при анализе необходимо использовать стандартное поле обзора (FOV, например 230 мм), количество и толщину срезов, межсрезовое расстояние и угол наклона срезов.
- Рекомендованные нами алгоритмы использования импульсных последовательностей (оптимальный, сокращенный, минимальный) со стандартизированными параметрами необходимо сохранить отдельно на рабочей станции для использования в диагностике острого ишемического инсульта.
- МР-спектроскопию целесообразно выполнять только в глубинных отделах белого вещества головного мозга, желательно использовать многовоксельную методику (CSI), размер вокселя 1,5 см3 и ТЕ=30 мс.
- При анализе спектров рекомендуется использовать только спектры с разрешенными пиками NAA, Cho, Cr, Cr2, Lac, Ins. Необходимо сравнивать не только абсолютные значения содержания метаболитов, определяемых как площадь по кривой пика, но и соотношения метаболитов между собой и их доли.
СПИСОК НАУЧНЫХ РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Труфанов, Г.Е. Высокопольная магнитно-резонансная ангиография в диагностике заболеваний сосудов головного мозга / Г.Е. Труфанов, В.М. Черемисин, В.А. Фокин и др. // Актуальные вопросы повреждений и заболеваний нервной системы. Материалы конференции нейрохирургов Нижегородского межобластного центра. – Иваново. – 2001. – С. 95.
- Труфанов, Г.Е. Первый опыт применения высокопольной магнитно-резонансной ангиографии в диагностике заболеваний сосудов головного мозга / Г.Е. Труфанов, В.М. Черемисин, В.А. Фокин и др. // Актуальные вопросы диагностики и лечения в многопрофильном лечебном учреждении. Тезисы докладов V Всероссийской научно-практической конференции. – СПб. – 2001. – С. 247.
- Черемисин, В.М. Магнитно-резонансная ангиография: клиническое применение / В.М.Черемисин, Г.Е.Труфанов, В.А. Фокин и др. // «Спиральная компьютерная томография –XXI век». – СПб. – 2001. – С. 147-149.
- Свистов, Д.В. Современное состояние церебральной ангиографии и ее место в комплексе методов диагностики сосудисто-мозговых заболеваний / Д.В. Свистов, Д.В. Кандыба, В.А. Фокин и др. // Современные технологии в нейрохирургии / Материалы III Всероссийского съезда нейрохирургов. – СПб. – 2002. – С. 674-675.
- Труфанов, Г.Е. Возможности магнитно-резонансной томографии и магнитно-резонансной ангиографии в диагностике артериовенозных мальформаций головного мозга / Г.Е.Труфанов, В.А.Ратников, В.А. Фокин и др. // Современные технологии в нейрохирургии / Материалы III Всероссийского съезда нейрохирургов. – СПб. – 2002. – С. 656-657.
- Труфанов, Г.Е. Магнитно-резонансная томография в диагностике ишемического инсульта / Г.Е. Труфанов, В.А. Ратников, В.А. Фокин и др. // Современные технологии в нейрохирургии / Материалы III Всероссийского съезда нейрохирургов. – СПб. – 2002. – С. 668.
- Черемисин, В.М. Магнитно-резонансная ангиография: современное состояние и перспективы развития / В.М. Черемисин, Г.Е. Труфанов, В.А. Фокин и др. // Современные технологии в нейрохирургии / Материалы III Всероссийского съезда нейрохирургов. – СПб. – 2002. – С. 655-656.
- Черемисин, В.М. Магнитно-резонансная томография и магнитно-резонансная ангиография в диагностике артериальных аневризм и артериовенозных мальформаций головного мозга / В.М. Черемисин, Г.Е. Труфанов, В.А. Фокин и др. // Современные технологии в нейрохирургии / Труды научно-практической конференции Северо-Западного нейрохирургического центра России. – Ярославль. – 2002.– С. 63-71.
- Cheremisin, V.M. MRI and MRA for postoperative assessment of intracranial aneurysms and arteriovenous malformations / V.M. Cheremisin, D.V. Svistov, V.A. Fokin, V.A. Ratnikov // Abstracts 19th Annual Meeting European Society for Magnetic Resonance in Medicine and Biology, Cannes, France, August 22-25, 2002. – MAGMA. – 2002. – Vol.15, Suppl. 1. – P. 13.
- Парфенов, В.Е. Нейронавигация в нейрохирургии / В.Е. Парфенов, В.М. Черемисин, В.А. Фокин и др. // Материалы Невского радиологического форума «Из будущего в настоящее». – СПб. – 2003. – С. 56-57.
- Труфанов, Г.Е. Возможности магнитно-резонансной томографии и магнитно-резонансной ангиографии в диагностике артериовенозных мальформаций головного мозга / Г.Е. Труфанов, Д.В. Свистов, В.А. Фокин и др. // Материалы Невского радиологического форума «Из будущего в настоящее». – СПб. – 2003. – С. 73-74.
- Труфанов, Г.Е. Применение магнитно-резонансной томографии и ангиографии при интракраниальных аневризмах и артериовенозных мальформациях после оперативных вмешательств / Г.Е. Труфанов, В.Е. Парфенов, В.А. Фокин и др. // Материалы Невского радиологического форума «Из будущего в настоящее». – СПб. – 2003. – С. 74-75.
- Труфанов, Г.Е. Первый опыт применения диффузно-взвешенных МРТ-изображений в ранней диагностике острых нарушений мозгового кровообращения по ишемическому типу / Г.Е. Труфанов, В.А. Ратников, В.А. Фокин и др. // Материалы научной конференции, посвященной 85-летию со дня основания ЦНИРРИ МЗ РФ «Современные технологии в клинической медицине» – СПб. – 2003. – С. 119.
- Труфанов, Г.Е. Возможности диффузионно- и перфузионно-взвешенной магнитно-резонансной томографии в диагностике нарушения мозгового кровообращения по ишемическому типу в острой стадии / Г.Е. Труфанов, В.А. Фокин, И.В. Пьянов // Сборник научных трудов Юбилейной конференции «Современная лучевая диагностика в многопрофильном лечебном учреждении», посвященной 75-летию кафедры рентгенологии и радиологии Военно-медицинской академии. – СПб: «Элби-СПб». – 2004. – С. 222-224.
- Труфанов, Г.Е. Диффузионно- и перфузионно-взвешенная магнитно-резонансная томография при нарушении мозгового кровообращения по ишемическому типу в острой стадии / Г.Е. Труфанов, В.А. Фокин, И.В. Пьянов // Регионарное кровообращение и микроциркуляция. – 2004. – № 2. – С. 26-30.
- Труфанов, Г.Е. Применение диффузно-взвешенной и перфузионно-взвешенной МР-томографии при нарушении мозгового кровообращения в острейшей стадии / Г.Е. Труфанов, В.А. Фокин, И.В. Пьянов // Материалы VII международного симпозиума «Новые технологии в нейрохирургии». – СПб. 2004. – С. 19.
- Декан, В.С. Использование однофотонной эмиссионной компьютерной томографии в клинико-лучевой диагностике сосудистой деменции / В.С. Декан, В.А. Фокин, Н.Я. Рожникова и др. // Роль лучевой диагностики в многопрофильной клинике и лечебных учреждениях стоматологического профиля. Сборник научных работ юбилейной конференции, посвященной 60-летию кафедры рентгенологии и радиологии СПбГМУ им. акад. И.П. Павлова – СПб.: «Издательство СПбГМУ», 2005. – С. 63.
- Одинак, М.М. Мониторинг перфузионных нарушений в острейшую стадию ишемического инсульта / М.М.Одинак, В.А. Фокин, С.Ю. Голохвастов, И.А. Вознюк // Вестник Российской Военно-медицинской академии. – 2005. – №2 (14). – С. 25-29.
- Труфанов, Г.Е. Возможности 1Н магнитно-резонансной спектроскопии в определении степени злокачественности опухолей головного мозга. / Г.Е. Труфанов, В.А. Фокин, А.В. Окользин // Роль лучевой диагностики в многопрофильной клинике и лечебных учреждениях стоматологического профиля. Сборник научных работ юбилейной конференции, посвященной 60-летию кафедры рентгенологии и радиологии СПбГМУ им. акад. И.П. Павлова – СПб.: «Издательство СПбГМУ». – 2005. – С. 126.
- Труфанов, Г.Е. Возможности МР-спектроскопии по водороду в лучевой диагностике опухолей головного мозга / Г.Е. Труфанов, В.А. Фокин // Материалы Всероссийского научного форума «Радиология-2005» – М., 2005. – С. 489-490.
- Труфанов, Г.Е. Возможности протонной магнитно-резонансной томографии в лучевой диагностике опухолей головного мозга / Г.Е. Труфанов, В.А. Фокин, А.В. Окользин, Б.В. Мартынов // Актуальные проблемы клинической онкологии: Тезисы докладов научно-практической конференции. – М.: ГВКГ им. Н.Н.Бурденко. – 2005. – С. 348.
- Труфанов, Г.Е. Магнитно-резонансная томография с использованием динамического контрастного усиления / Г.Е.Труфанов, В.А. Фокин, К.Л. Неруш, С.В.Серебрякова // Материалы Невского радиологического форума «Наука – клинике». – СПб. – 2005. – С.50.
- Фокин, В.А. 1H магнитно-резонансная спектроскопия опухолей головного мозга. Г.Е, Труфанов, В.А. Фокин // Вестник Российской Военно-медицинской академии – 2005. – №1(13) – С.384.
- Фокин, В.А. Диффузно-взвешенная и перфузионно-взвешенная МР-томография в диагностике ишемического инсульта в острейшей стадии // В.А. Фокин, И.В. Пьянов, Г.Е. Труфанов, С.Ю. Голохвастов // Материалы Невского радиологического форума «Наука – клинике». – СПб. – 2005. – С.181-182.
- Фокин, В.А. Магнитно-резонансная спектроскопия в определении степени злокачественности опухолей головного мозга / В.А. Фокин, Г.Е. Труфанов, И.В. Пьянов // Материалы III международной научно-практической конференции «Актуальные вопросы клинической и военно-морской медицины. Достижения и перспективы». – Севастополь. – 2005. – С.110.
- Фокин, В.А. Магнитно-резонансная спектроскопия по водороду: возможности определения степени злокачественности опухолей головного мозга / В.А. Фокин, Г.Е. Труфанов, Б.В. Мартынов // Актуальные проблемы клинической онкологии: Тезисы докладов научно-практической конференции. – М.: ГВКГ им. Н.Н.Бурденко, 2005. – С. 75.
- Фокин, В.А. Применение диффузионной и перфузионной МР-томографии в острейшей стадии ишемического инсульта / И.В. Пьянов, Г.Е. Труфанов, С.Ю. Голохвастов // Материалы Всероссийского научного форума «Радиология 2005» – М. – 2005. – С. 365-367.
- Фокин, В.А. Сравнение Т1 и Т2 ВИ в острейшем периоде ишемического инсульта с диффузионной и перфузионнной магнитно-резонансной томографией / В.А. Фокин, И.В. Пьянов, С.Ю. Голохвастов, Г.Е. Труфанов // Актуальные проблемы клинической онкологии: Тезисы докладов научно-практической конференции. – М.: ГВКГ им. Н.Н.Бурденко. – 2005. – С. 349.
- Одинак, М.М. Диффузионная и перфузионная МР-томография в сравнении с Т1 и Т2 взвешенными изображениями в диагностике ишемического инсульта в острейшем периоде / М.М. Одинак, В.А. Фокин, С.Ю. Голохвастов и др. // Материалы IX Всероссийского съезда неврологов. – Ярославль. – 2006. – С. 120.
- Одинак, М.М. Функциональная нейровизуализация в диагностике деменций / М.М. Одинак, В.А. Фокин, А.Ю. Емелин, А.В. Поздняков и др. // Вестник Российской Военно-медицинской академии. – 2006. – №1 (15). – С. 101-110.
- Труфанов, Г.Е. Возможности протонной магнитно-резонансной спектроскопии в неврологии / Г.Е. Труфанов, В.А. Фокин, А.В. Окользин // Всероссийское общество неврологов. IX Всероссийский съезд неврологов. – Ярославль. – 2006. – С. 123.
- Труфанов, Г.Е. Водородная магнитно-резонансная спектроскопия опухолей головного мозга / Г.Е. Труфанов, В.А. Фокин, Б.В. Мартынов // Материалы IV съезда нейрохирургов России. – М. – 2006. – С. 510.
- Труфанов, Г.Е. Картирование областей головного мозга человека, обеспечивающих высшие зрительные и гностические функции / Г.Е. Труфанов, В.А. Фокин, А.В. Севостьянов, Ю.Е. Шелепин и др. // Юбилейная всероссийская научно-практическая конференция «Поленовские чтения». – СПб. – 2006. – С. 293.
- Труфанов, Г.Е. Распознавание зрительных образов и клинические вопросы локализации функций / Г.Е. Труфанов, В.А. Фокин, Ю.Е. Шелепин и др. // Юбилейная всероссийская научно-практическая конференция «Поленовские чтения». – СПб. – 2006. – С. 299.
- Труфанов, Г.Е. Функциональная магнитно-резонансная томография в оценке высшего зрительного анализатора / Г.Е.Труфанов, В.А. Фокин, Ю.Е. Шелепин и др. // Материалы VII Всероссийского научного форума «Радиология-2006». – М., 2006. – С. 246.
- Фокин, В.А. Возможности протонной магнитно-резонансной спектроскопии (1H-MRS) в определении степени злокачественности глиальных опухолей головного мозга / В.А. Фокин, Г.Е. Труфанов, А.В. Окользин, Б.В. Мартынов // Юбилейная всероссийская научно-практическая конференция «Поленовские чтения». – СПб. – 2006. – С. 229.
- Фокин, В.А. Выявление метаболических нарушений в эпилептическом очаге в зависимости течения эпилепсии по данным протонной магнитно-резонансной спектроскопии / В.А. Фокин, А.В. Окользин, С.Н. Базилевич, Д.Е. Дыскин // Юбилейная всероссийская научно-практическая конференция «Поленовские чтения». – СПб. – 2006. – С. 294.
- Фокин, В.А. Диффузионная и перфузионная МР-томография в острейшей стадии ишемического инсульта / В.А. Фокин, И.В. Пьянов, Г.Е. Труфанов, С.Ю. Голохвастов // Юбилейная всероссийская научно-практическая конференция «Поленовские чтения». – СПб. – 2006. – С.151.
- Фокин, В.А. Длительность обратимых перфузионных нарушений при ишемическом инсульте / В.А. Фокин, И.А. Вознюк, С.Ю. Голохвастов, Н.А. Лупина // Материалы IX Всероссийского съезда неврологов. – Ярославль. – 2006. – С. 113.
- Фокин, В.А. Метаболические нарушения в эпилептическом очаге в зависимости от течения эпилепсии по данным магнитно-резонансной спектроскопии / В.А. Фокин, А.В. Окользин, С.Н. Базилевич // Материалы IX Всероссийского съезда неврологов. – Ярославль, 2006. – С. 537.
- Фокин, В.А. Оценка перфузионных нарушений в острейшем периоде ишемического инсульта / В.А. Фокин, С.Ю. Голохвастов, И.А. Вознюк и др. // Материалы IX Всероссийского съезда неврологов. – Ярославль. – 2006. – С. 113.
- Fokin, V. Occipital-parietal interaction in incomplete pattern discrimination / V. Fokin, G. Trufanov, Y. Shelepin et al. // 29th European Conference on Visual Perception, St Petersburg. ECVP 2006. Perception. – 2006. – Vol.35, Suppl. – P.18-19.
- Fokin, V. The principle of least action and visual perception / V. Fokin, Y. Shelepin, N. Krasilnikov et al. // 29th European Conference on Visual Perception, St Petersburg. ECVP 2006. – Perception. – 2006. – Vol.35, Suppl. – P.125.
- Fokin, V. The properties of internal noise in visual system of patients with multiple sclerosis / V. Fokin, S. Muravyova, A. Deshkovich, Y. Shelepin // 29th European Conference on Visual Perception, St Petersburg. ECVP 2006. Perception. – 2006. – Vol.35, Suppl. – P.130.
- Trufanov, G. FMRI localization of the mechanism underlying the incomplete patterns discrimination / G. Trufanov, V. Fokin, A. Sevostyanov et al. // 29th European Conference on Visual Perception, St Petersburg. ECVP 2006. – Perception. – 2006. – Vol.35, Suppl. – P.72.
- Trufanov, G. The role of functional MRI in localization of the work of the “central executive mechanism” in recognition of the visual stimuli of different complexities / G. Trufanov, V. Fokin, Y. Shelepin, A. Sevostyanov // Eur. Radiol. – 2006. – Vol.16, N2, Suppl.1. – P.465.
- Yanishevsky, S. Duration of reversible ischemia in the acute period of stroke / S. Yanishevsky, V. Fokin, S. Golokhvastov, I. Voznyuk // European Journal of Neurology. – 2006. – V.13, Supl.2. – P. 2034.
- Голохвастов, С.Ю. Острейший ишемический инсульт: применение диффузионно-взвешенной и перфузионно-взвешенной МР-томографии / С.Ю. Голохвастов, В.А. Фокин, И.В. Пьянов, А.Г. Труфанов // Материалы Невского радиологического форума «Новые горизонты». – СПб. – 2007. – С. 44-45.
- Одинак М.М. Системная тромболитическая терапия при ишемическом инсульте: особенности и опыт клинического применения / М.М. Одинак, И.А. Вознюк, В.А. Фокин и др. // Вестник Российской Военно-медицинской академии. – 2007. – № 6. – С. 28-33.
- Одинак, М.М. Диагностическая ценность нейровизуализации при острых нарушениях мозгового кровообращения / М.М. Одинак, В.А. Фокин, И.А. Вознюк и др. // Вестник Российской Военно-медицинской академии. – СПб. – 2007. – № 1 (17). – С. 388.
- Одинак, М.М. Особенности нейровизуализации ишемических инсультов / М.М. Одинак, В.А. Фокин, И.А. Вознюк и др. // Цереброваскулярная патология в практике военного невролога: тезисы научно-практической конференции. – М.: ГВКГ им. Н.Н. Бурденко. – 2007. – С. 88-90.
- Одинак, М.М. Оценка перфузионных нарушений в области обратимой ишемии при инсульте / М.М. Одинак, В.А. Фокин, И.А. Вознюк и др. // Вестник Российской Военно-медицинской академии. – СПб. – 2007. – № 1 (17). – С. 384-385.
- Одинак, М.М. Ранняя нейровизуализационная диагностика как фактор оптимизации оказания специализированной медицинской помощи при острых нарушениях мозгового кровообращения / М.М. Одинак, В.А. Фокин, С.Ю. Голохвастов и др. // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. – 2007. – Т. 2, №1. – С. 76.
- Одинак, М.М. Эффективность организации ранней нейровизуализационной диагностики у больных с острыми нарушениями мозгового кровообращения / М.М. Одинак, В.А. Фокин, И.А. Вознюк и др. // Вестник Российской Военно-медицинской академии. – СПб. – 2007. – № 1 (17). – С. 387–388.
- Парфенов, В.Е. Нейронавигация и интраоперационная визуализация у пациентов с объемными образованиями головного мозга / В.Е.Парфенов, В.А. Фокин, А.В. Савелло и др. // Материалы Невского радиологического форума «Новые горизонты». – СПб. – 2007. – С. 523-524.
- Свистов, Д.В. Предоперационная эмболизация гемангиобластомы краниовертебрального стыка / Д.В. Свистов, В.А. Фокин, Д.В. Кандыба и др. // Нейрохирургия. – 2007. – №1. – С.33-39.
- Труфанов Г.Е. КТ-, МРТ- и ОФЭКТ-перфузия в комплексной лучевой диагностике острого и хронического нарушения мозгового кровообращения / Г.Е. Труфанов, В.А. Фокин, И.В. Пьянов и др.// Вестник Российской Военно-медицинской академии. – СПб. – 2007. – № 1 (17). –С. 676.
- Труфанов, Г.Е. Возможности магнитно-резонансной спектроскопии по водороду в лучевой диагностике неопухолевых заболеваний головного мозга / Г.Е. Труфанов, В.А, Фокин, А.В. Окользин // Материалы Невского радиологического форума «Новые горизонты». – СПб. – 2007. – С. 36.
- Фокин, В.А. Гетерогенность перфузионных нарушений в области обратимой ишемии при инсульте / В.А. Фокин, С.Ю. Голохвастов, И.А. Вознюк и др. // Материалы Невского радиологического форума «Новые горизонты». – СПб. – 2007. – С. 56-58.
- Фокин, В.А. Гетерогенность перфузионных расстройств в области обратимой ишемии при инсульте /А.В. Фокин, С.Ю.Голохвастов, М.М. Одинак и др. // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. – 2007. – Т. 2, №1. – С. 72–75.
- Фокин, В.А. Локализация областей коры головного мозга человека, активируемых при восприятии упорядоченных и хаотичных изображений / В.А. Фокин, Ю.Е. Шелепин, А.К. Хараузов и др. // Российский физиологический журнал им. И.М.Сеченова. – 2007. – Т. 93, №10. – С. 1089-1100.
- Фокин, В.А. Нарушение церебрального кровотока и перфузионные расстройства в остром периоде ишемического инсульта / В.А. Фокин, И.А. Вознюк, С.Ю. Голохвастов и др. // Журнал неврологии и психиатрии им. С.С.Корсакова / Инсульт, спецвыпуск. – 2007. – С. 242-243.
- Фокин, В.А. Особенности ранней нейровизуализационной диагностики при острых нарушениях мозгового кровообращения / В.А. Фокин, С.Ю. Голохвастов, М.М. Одинак и др. // Регионарное кровообращение и микроциркуляция. – 2007. – №1 (21). – С. 113-114.
- Фокин, В.А. Применение метода ультразвуковой допплерографии в ранней диагностике ишемического инсульта / В.А. Фокин, С.Ю. Голохвастов, И.А. Вознюк и др. // Материалы Невского радиологического форума «Новые горизонты». – СПб. – 2007. – С. 16-17.
- Фокин, В.А. Применение функциональной магнитно-резонансной томографии в картировании областей головного мозга человека, обеспечивающих высшие зрительные и гностические функции / В.А. Фокин, А.В. Севостьянов, Ю.Е. Шелепин и др. // Вестник Российской Военно-медицинской академии. – СПб. – 2007. – № 1 (17). – С. 675-676.
- Фокин, В.А. Роль магнитно-резонансной спектроскопии по водороду (1HMRS) в лучевой диагностике опухолей головного мозга / В.А. Фокин, А.В. Окользин, Г.Е. Труфанов, Б.В. Мартынов // Материалы Невского радиологического форума «Новые горизонты». – СПб. – 2007. – С. 37.
- Фокин, В.А. Сравнительный анализ традиционной МРТ с диффузионной и перфузионной МРТ в диагностике ишемического инсульта / В.А. Фокин, И.А. Вознюк, С.Ю. Голохвастов и др. // Вестник Российской Военно-медицинской академии. – СПб. – 2007. – № 1 (17). – С. 385.
- Фокин, В.А. Функциональная магнитно-резонансная томография в изучении зрительного анализатора / В.А. Фокин, А.В. Севостьянов, Ю.Е. Шелепин и др. // Материалы Невского радиологического форума «Новые горизонты». – 2007. – С. 58-59.
- Fokin V. Localization of the decision-making mechanism for spatial vision / Y. Shelepin, V. Fokin, A. Harauzov // Perception. – 2007. – Vol.36, Suppl. – P.143.
- Fokin V. Two decision center for visual pattern recognition in the human brain / V. Fokin, A. Sevostyanov, Y. Shelepin et al. // Perception. – 2007. – Vol.36, Suppl. – P.103.
- Trufanov G. Localization of the decision center for pattern discrimination in the human brain / G. Trufanov, V. Fokin, Y. Shelepin et al. // Perception. – 2007. – Vol.36, Suppl. – P.136.
- Фокин, В.А. Лучевая диагностика сосудистых мальформаций головного мозга / В.А. Фокин, Д.В. Свистов // Сборник учебных пособий по нейрорентгенологии (Учебные пособия) / Под ред. профессора Г. Е. Труфанова, профессора Т. Е. Рамешвили / СПб. : ЭЛБИ-СПб, 2004. – Гл.7. – С.207-239.
- Фокин, В.А. Основы и клиническое применение магнитно-резонансной томографии / В.А. Фокин, А.В. Мищенко, Г.Е. Труфанов // Сборник учебных пособий по актуальным вопросам лучевой диагностики и лучевой терапии / Под ред. профессора Г.Е. Труфанова. – СПб. : ЭЛБИ-СПб, 2004. – Гл.1. – С.5-44.
- Труфанов, Г.Е. Лучевая диагностика и лучевая терапия (Учебное пособие) / Г.Е. Труфанов, В.А. Фокин и др. ; под общ. ред. профессора Г. Е. Труфанова. - СПб. : ВМедА, 2005. – 344 с.
- Труфанов, Г.Е. Лучевая диагностика сосудистых мальформаций и артериальных аневризм головного мозга / Г.Е. Труфанов, Т.Е. Рамешвили, В.А. Фокин, Д.В. Свистов – СПб. : ЭЛБИ-СПб, 2005. – 224 с.
- Труфанов, Г.Е. Рентгеновская компьютерная и магнитно-резонансная томография в диагностике ишемического инсульта (Монография) / Г.Е. Труфанов, В.А. Фокин, И.В. Пьянов, Е.А. Банникова. – СПб. : ЭЛБИ-СПб, 2005. – 192 с.
- Гайдар, Б.В. Основные методы визуализации опухолей головного мозга / Б.В. Гайдар, Т.Е. Рамешвили, В.А. Фокин и др. // Лучевая диагностика опухолей головного и спинного мозга / Б.В. Гайдар, Т.Е. Рамешвили, Г.Е. Труфанов, В.Е. Парфенов. – СПб. : ООО «Издательство ФОЛИАНТ», 2006. – Гл.1. – С. 11-27.
- Одинак, М.М. Острый церебральный тромбоз – реканализация за пределами «окна» тромболитической терапии / М.М. Одинак, И.А. Вознюк, В.А. Фокин и др. // Дисфункция эндотелия. Патогенетическое значение и методы коррекции / Под ред. Н.Н. Петрищева. – СПб. : ИИЦ ВМА, 2007. – Гл.3. – С. 121-138.
- Труфанов, Г.Е. Лучевая диагностика внутричерепных кровоизлияний / Г.Е. Труфанов, Т.Е. Рамешвили, В.А. Фокин. – СПб. : ЭЛБИ-СПб, 2007. – 302 с.
- Труфанов, Г.Е. Магнитно-резонансная томография (Руководство для врачей) / Под. ред. проф. Г.Е. Труфанов и к.м.н. В.А. Фокин. – СПб. : ООО «Издательство ФОЛИАНТ», 2007. – 688 с.
- Труфанов, Г.Е. Лучевая диагностика: Учебник / Г.Е. Труфанов, В.А. Фокин и др.; под общ. ред. проф. Г.Е. Труфанова. / М. : ГЭОТАР-Медиа, 2007. – 416 с.
- Фокин, В.А. Магнитно-резонансная томография в диагностике ишемического инсульта: Учебное пособие. / В.А. Фокин – СПб. : ВМедА, 2008. – 69 с.
СПИСОК СОКРАЩЕНИЙ
ВСА – внутренняя сонная артерия
ГЭБ – гематоэнцефалический барьер
ДВИ – диффузионно-взвешенные изображения
ИП – импульсная последовательность
ИКД – измеряемый коэффициент диффузии
КТ – компьютерная томография
МР – магнитно-резонансный (магнитный резонанс)
МРА – магнитно-резонансная ангиография
МРТ – магнитно-резонансная томография
ОНМК – острое нарушение мозгового кровообращения
ПВИ – перфузионно-взвешенные изображения
СМА – средняя мозговая артерия
Т1-ВИ – Т1-взвешенные изображения
Т2-ВИ – Т2-взвешенные изображения
УЗДГ – ультразвуковая допплерография
3D TOF – 3 Dimensional Time Of Flight – трехмерная время пролетная (методика бесконтрастной ангиографии)
CBF – Cerebral Blood Flow – мозговой кровоток
CBV – Cerebral Blood Volume – объем мозгового кровотока
FLAIR – Fluid Attenuated Inversion-Recovery – (импульсная последовательность) инверсия-восстановление с подавлением сигнала от жидкости
FOV – Field Of View – поле обзора
GRE – Gradient Echo – градиентное эхо (импульсная последовательность)
MTT – Mean Transit Time – среднее время прохождения (болюса)
NIHSS – National Institute of Health (NIH) Stoke Scale – шкала (оценки тяжести) инсульта Национального института здоровья (США)
CSI – Chemical Shift Imaging – визуализация химического сдвига
TE – Time Echo – время эхо
TIRM – Tuned Inversion Recovery Method метод настраиваемой инверсии-восстановления (импульсная последовательность)
TR – Time of Repetition – время повторения
TTP – Time To Peak – время до пика (болюса контрастного вещества)

