Когнитивные нарушения при цереброваскулярной болезни (патогенез, клиника, дифференциальная диагностика)
На правах рукописи
ЕМЕЛИН
Андрей Юрьевич
КОГНИТИВНЫЕ НАРУШЕНИЯ ПРИ
ЦЕРЕБРОВАСКУЛЯРНОЙ БОЛЕЗНИ
(ПАТОГЕНЕЗ, КЛИНИКА, ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА)
14.01.11 – нервные болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Санкт–Петербург
2010
Работа выполнена в ФГОУ ВПО «Военно–медицинская академия имени
С.М. Кирова» Минобороны Российской Федерации
НАУЧНЫЙ КОНСУЛЬТАНТ:
член корреспондент РАМН
доктор медицинских наук, профессор ОДИНАК Мирослав Михайлович
ОФИЦИАЛЬНЫЕ ОППОНЕНТЫ:
доктор медицинских наук, профессор Лобзин Сергей Владимирович
доктор медицинских наук, профессор Клочева Елена Георгиевна
доктор медицинских наук, профессор Помников Виктор Григорьевич
ВЕДУЩЕЕ УЧРЕЖДЕНИЕ: ГОУ ВПО «Санкт-Петербургский Государственный Медицинский Университет имени акад. И.П. Павлова»
Защита состоится «___» ___________ 2010 года в ___ часов на заседании диссертационного совета Д 215.002.04 в ФГОУ ВПО «Военно–медицинская академия имени С.М. Кирова» Минобороны Российской Федерации (194044, Санкт-Петербург, ул. Академика Лебедева, 6).
С диссертацией можно ознакомиться в фундаментальной библиотеке
ФГОУ ВПО «Военно–медицинская академия имени С.М. Кирова» Минобороны Российской Федерации
Автореферат разослан «___» ___________ 2010 года.
Ученый секретарь диссертационного совета
Доктор медицинских наук, профессор ШАМРЕЙ Владислав Казимирович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. В настоящее время во всем мире наблюдается значительный рост частоты острых и хронических форм цереброваскулярной патологии, что позволяет рассматривать сосудистые заболевания головного мозга как актуальную социально–медицинскую проблему, и даже как «эпидемию XXI века» (Гусев Е.И., Скворцова В.И., 2001; Одинак М.М. и др., 2005; Румянцева С.А., Беневольская Н.Г., 2006; Суслина З.А., 2006). В Российской Федерации регистрируется более 450000 случаев инсульта в год, неуклонно растет число пациентов с явлениями хронической ишемии головного мозга, составляя более 700 человек на 100000 населения (Инсульт …, 2002; Гусев Е.И. и др., 2003; Белоусов Ю.Б., Стулин И.Д., 2004; Суслина З.А. и др., 2005). Несвоевременная диагностика, неадекватные профилактика и лечение дисциркуляторной энцефалопатии закономерно сопровождаются прогрессированием заболевания и развитием выраженных нарушений функций головного мозга, что приводит к трудовой и социальной дезадаптации пациентов (Одинак М.М. и др., 1997; Иванова Г.Е. и др., 2007).
Среди разнообразных неврологических симптомов, развивающихся вследствие органических поражений головного мозга, особое место занимают нарушения когнитивных функций, наличие которых оказывает выраженное негативное влияние на качество жизни пациентов (Михайленко А.А. и др., 1996; Дамулин И.В. и др., 2005; Макаров А.Ю., 2006; Парфенов В.А., 2006; Яхно Н.Н., 2006; Левин О.С. и др., 2007; Помников В.Г. и др., 2009).
Вопросы нозологической дифференциации различных вариантов когнитивных нарушений, в том числе и при цереброваскулярной патологии, разрабатываются на протяжении многих лет, однако, остается до конца неуточненным само определение сосудистых когнитивных расстройств, отсутствуют общепринятые классификация и критерии диагностики (Chabriat H., Bousser M., 2006; Erkinjuntti T., Gauthier S., 2009). Противоречивыми являются данные о значении цереброваскулярной патологии в развитии дегенеративных и смешанных типов когнитивных расстройств (Литвиненко И.В. и др., 2010; de la Torre J., 2002; Jellinger K., Attems J., 2005).
Согласно эпидемиологическим данным в большинстве стран мира сосудистая деменция по распространенности занимает второе место после болезни Альцгеймера, составляя около 20–25% всех случаев (Kuller L. et al., 1998). Заболеваемость сосудистой деменцией варьирует от 1,5 до 3,3 случаев на 1000 человек пожилого возраста (Ruitenberger A. et al., 2001; Di Carlo A. et al., 2002).
В повседневной клинической практике наличие когнитивных нарушений часто автоматически связывается с нейровизуализационными признаками цереброваскулярного повреждения, при этом не учитываются локализация и выраженность структурных изменений, не устанавливаются причинно–следственные связи (Одинак М.М. и др., 2006). Особенно часто встречается такой подход в случаях выявления когнитивных нарушений у лиц, перенесших инсульт. Сегодня очевидно, что ведущей причиной формирования сосудистых когнитивных нарушений является хроническая ишемия мозга, приводящая к структурным изменениям белого и серого вещества головного мозга (Дамулин И.В., 1999; Яхно Н.Н., Захаров В.В., 2002; van Swieten J. et al., 1996; Esiri M. et al., 1997; Roman G. et al., 2002; Wen H. et al., 2004).
Длительное время когнитивные нарушения сосудистой этиологии ассоциировались преимущественно с сосудистой деменцией, тем самым как бы отрицалась возможность существования и выявления «додементных стадий». Сегодня, с развитием концепции сосудистых когнитивных расстройств и изменением представлений о формировании когнитивного дефицита, не вызывает сомнений положение, что умеренные когнитивные нарушения могут быть прообразом не только деменции альцгеймеровского типа, но и других типов деменции, в том числе сосудистой (Яхно Н.Н. и др., 2006; Meyer J. et al., 2002). Между тем, до настоящего времени не разработаны общепринятые критерии умеренных сосудистых когнитивных нарушений, стандарты диагностики и лечения данных состояний (Захаров В.В., 2006).
Большую роль в диагностике этиологии когнитивных нарушений сыграло внедрение в клиническую практику компьютерной и магнитно–резонансной томографии, которые сегодня используются как рутинные методики. В то же время, чувствительность и специфичность нейровизуализационных критериев сосудистой деменции не полностью удовлетворяют потребностям практической медицины, нет единого мнения о значении различных повреждений вещества мозга для развития сосудистых когнитивных нарушений (Дамулин И.В., 1999; Hsu Y. et al., 2001; van Straaten E. et al., 2004). С появлением методов функциональной нейровизуализации, таких как ОФЭКТ и ПЭТ, появилась возможность не только раннего выявления нарушений функции головного мозга, но и изучения закономерностей формирования различных вариантов когнитивных нарушений (Silverman D., 2004; Petrella J. et al., 2003; Johnson K. et al., 1998). В то же время, окончательно не определены роль и место этих современных методик в повседневной клинической практике. В России до настоящего времени не проводилось значимых исследований по возможностям использования методов функциональной нейровизуализации в дифференциальной диагностике сосудистых когнитивных нарушений.
Патоморфологические исследования при сосудистой деменции, в основном, ограничиваются описанием структурных повреждений головного мозга и церебральных сосудов. Однако до настоящего времени нет четких рекомендаций, какие изменения вещества головного мозга должны рассматриваться как сосудистые и каков их вклад в развитие когнитивных нарушений (Knopman D. et al., 2003; Pantoni L. et al., 2006). Нет детального сравнительного изучения патоморфологических изменений при сочетанном сосудисто–дегенеративном процессе с помощью методов не только световой, но и электронной микроскопии.
В последние годы в области профилактики и лечения когнитивных нарушений достигнуты определенные успехи, что обусловлено появлением современных медикаментозных средств, способных влиять на патогенез формирования когнитивного дефицита (Гаврилова С.И., 2007; Erkinjuntti T. et al., 2004; Kavirajan H., Schneider L., 2007). Вместе с тем, сегодня нет общепринятых схем терапии сосудистых когнитивных нарушений, поэтому разработка рекомендаций по дифференцированному назначению препаратов при различных клинико–патогенетических вариантах является чрезвычайно актуальной.
Таким образом, детальное изучение этиопатогенетических и клинических закономерностей развития различных вариантов когнитивных нарушений при цереброваскулярной патологии является важной и актуальной научной проблемой современной неврологии.
Цель исследования – установить этиопатогенетические закономерности формирования различных вариантов сосудистых когнитивных нарушений и усовершенствовать их диагностику с использованием комплекса клинико–нейровизуализационных критериев.
Задачи исследования:
- Изучить этиологические и патогенетические факторы, клинико–нейропсихологические особенности различных вариантов когнитивных нарушений при цереброваскулярной болезни.
- Определить диагностические возможности методов структурной (компьютерной и магнитно–резонансной томографии) и функциональной (однофотонной эмиссионной компьютерной томографии, позитронной эмиссионной томографии) нейровизуализации в дифференциальной диагностике сосудистых когнитивных расстройств.
- Выявить особенности региональных нарушений перфузии и метаболизма головного мозга на разных стадиях сосудистых когнитивных нарушений.
- Изучить значение сопутствующего нейродегенеративного процесса в развитии и прогрессировании когнитивных нарушений у пациентов с цереброваскулярной болезнью.
- Провести сопоставление и анализ данных нейропсихологического тестирования, структурной и функциональной нейровизуализации у больных с сосудистыми когнитивными нарушениями.
- Сравнить морфологические изменения сосудов головного мозга, нейронов, синапсов, белого вещества в различных церебральных структурах на аутопсийном материале умерших больных с цереброваскулярной и нейродегенеративной патологией.
Научная новизна исследования. Впервые на основе комплексного сравнительного клинико–нейропсихологического и нейровизуализационного обследования больных с сосудистыми когнитивными нарушениями систематизированы основные варианты когнитивных расстройств при цереброваскулярной патологии.
Выявлены закономерности формирования различных вариантов сосудистых когнитивных нарушений в зависимости от этиологических и патогенетических факторов. Определены наиболее значимые клинические и нейропсихологические проявления различных вариантов сосудистых когнитивных нарушений.
Установлена диагностическая значимость компьютерной томографии, магнитно–резонансной томографии, однофотонной эмиссионной компьютерной томографии с (99mTc)–гексаметилпропиленаминоксимом, позитронной эмиссионной томографии с фтор18–дезоксиглюкозой в дифференциальной диагностике когнитивных нарушений сосудистого, альцгеймеровского и смешанного типов.
Изучено состояние основных сфер когнитивной деятельности на различных стадиях когнитивного дефицита в сопоставлении с результатами однофотонной эмиссионной компьютерной томографии с (99mTc)–гексаметилпропиленаминоксимом, позитронной эмиссионной томографии с фтор18–дезоксиглюкозой.
Проведен детальный анализ информативности традиционных диагностических исследований и методов функциональной лучевой нейровизуализации при смешанном варианте когнитивных нарушений.
Показана возможность применения методов однофотонной эмиссионной компьютерной томографии с (99mTc)–гексаметилпропиленаминоксимом, позитронной эмиссионной томографии с фтор18–дезоксиглюкозой для изучения феномена «подкорково–коркового разобщения» при различных вариантах сосудистых когнитивных нарушений.
Подробно представлены варианты структурных и ультраструктурных изменений нейронов, глиальной ткани, синапсов, сосудов по результатам патоморфологического исследования материала, полученного из различных отделов головного мозга пациентов, страдавших при жизни деменцией.
Методологически исследование выполнено на основе системного структурно–функционального подхода и направлено на выявление взаимосвязанных показателей, отражающих закономерности формирования различных вариантов сосудистых когнитивных расстройств.
Диссертационное исследование выполнялось на базе клиники нервных болезней Военно–медицинской академии в соответствии с планом научно–исследовательских работ.
Практическая значимость. Показано значение выявления и изучения когнитивных нарушений у пациентов с цереброваскулярной болезнью. Дана оценка значимости неврологических симптомов при различных вариантах сосудистых когнитивных нарушений. Установлены роль и место нейропсихологических методик в обследовании пациентов с когнитивными нарушениями различной этиологии. Определены возможности компьютерной томографии, магнитно–резонансной томографии, однофотонной эмиссионной компьютерной томографии с (99mTc)–гексаметилпропиленаминоксимом, позитронной эмиссионной томографии с фтор18–дезоксиглюкозой в дифференциальной диагностике когнитивных нарушений. Определены структурные изменения, имеющие наибольшее значение для развития сосудистых и нейродегенеративных когнитивных нарушений. Установлено влияние сопутствующего нейродегенеративного процесса на характер и выраженность когнитивных нарушений при цереброваскулярной патологии. Изучены характер и локализация нарушений перфузии и метаболизма головного мозга при различных вариантах сосудистых когнитивных нарушений, альцгеймеровской патологии и смешанных сосудисто–нейродегенеративных нарушениях. Показано, что использование методов функциональной лучевой нейровизуализации позволяет повысить точность диагностики и дополнить представление о патогенезе когнитивных нарушений при цереброваскулярной патологии. Разработаны дополнительные ОФЭКТ и ПЭТ–маркеры ранней диагностики когнитивных нарушений различной этиологии и маркеры прогрессирования заболевания. Сформулированы практические рекомендации по обследованию пациентов с цереброваскулярной болезнью.
Основные положения, выносимые на защиту:
- Когнитивные нарушения различной степени выраженности являются одним из ведущих клинических синдромов цереброваскулярной болезни, для выявления и дифференцировки которых необходимо проведение комплексного клинико-нейропсихологического и нейровизуализационного обследования.
- Включение в диагностический алгоритм однофотонной эмиссионной компьютерной томографии и позитронной эмиссионной томографии дает возможность существенно повысить точность нозологической диагностики когнитивных нарушений.
- Нейродегенеративный процесс усугубляет выраженность и способствует прогрессированию когнитивных нарушений при цереброваскулярной болезни.
Реализация результатов исследования. Научные положения, практические рекомендации внедрены в лечебный и учебный процесс на кафедре нервных болезней Военно–медицинской академии, в практику неврологических отделений Главного военного клинического госпиталя им. Н.Н. Бурденко (г. Москва), 442 Окружного клинического военного госпиталя (г. Санкт–Петербург). Материалы исследования нашли отражение в трудах Военно–медицинской академии, учебниках, руководствах, монографии, научных статьях, методических рекомендациях.
Апробация работы. Материалы диссертации доложены и обсуждены на IX Всероссийском съезде неврологов (г. Ярославль, 2006), научно–практической конференции «Новые технологии в ядерной медицине» (г. Санкт–Петербург, 2006), Всероссийской Юбилейной научно–практической конференции с международным участием «Актуальные проблемы психиатрии и неврологии» (г. Санкт–Петербург, 2007), Невском радиологическом форуме «Новые горизонты» (Санкт–Петербург, 2007), научно–практической конференции «Цереброваскулярная патология в практике военного невролога» (г. Москва, 2007), II Российском Международном конгрессе «Цереброваскулярная патология и инсульт» (г. Санкт–Петербург, 2007), научной конференции «От лучей рентгена – к инновациям XXI века: 90 лет со дня основания первого в мире рентгенорадиологического института» (г. Санкт–Петербург, 2008), Всероссийской научно–практической конференции с международным участием «Психоневрология пожилого возраста» (г. Санкт–Петербург, 2008), IV Российской научно–практической конференции «Болезнь Альцгеймера и когнитивные нарушения в пожилом возрасте: достижения в нейробиологии и терапии» (г. Москва, 2008), научно–практической конференции «Церебро–кардио–ренальный континуум – междисциплинарный подход в гериатрии» (г. Санкт–Петербург, 2009), XI Всероссийской научно–практической конференции «Актуальные вопросы клиники, диагностики и лечения больных в многопрофильном лечебном учреждении (г. Санкт–Петербург, 2009), Всероссийской юбилейной научно–практической конференции «Актуальные проблемы клинической неврологии» (г. Санкт–Петербург, 2009), Конгрессе неврологов и нейрохирургов г. Санкт–Петербурга и Северо–Западного Федерального Округа РФ «Актуальные проблемы клинической неврологии и нейрохирургии» (г. Санкт–Петербург, 2009), 8–й Межрегиональной с международным участием научно–практической конференции с исследованием смежных вопросов неврологии и стоматологии, посвящённой 65–летию Победы в Великой Отечественной Войне и 75–летию Новосибирского государственного медицинского университета (г. Новосибирск, 2010), на заседаниях общества неврологов Санкт–Петербурга (2004, 2006, 2008, 2009).
Апробация диссертационной работы проведена на межкафедральном совещании кафедр: нервных болезней, рентгенологии и радиологии, психиатрии ФГОУ ВПО Военно-медицинская академия имени С.М. Кирова 16.09.2010.
По материалам диссертации опубликовано 70 работ, в том числе 14 работ в журналах, рекомендованных ВАК Минобрнауки РФ.
Личный вклад. Автором было проведено комплексное клинико-нейропсихологическое обследование всех пациентов, включенных в исследование. Обработка и кодирование данных структурной и функциональной нейровизуализации осуществлялись совместно с врачом-рентгенологом при непосредственном участии автора. Во всех совместных исследованиях по теме диссертации, наряду с личным участием в их проведении, автору принадлежит формулирование общей цели и задач конкретной работы, анализ и статистическая обработка полученных данных, обсуждение результатов. Оформление диссертации и автореферата выполнены автором самостоятельно.
Объем и структура диссертации. Диссертация состоит из введения, 8 глав, включающих обзор литературы, материал и методы исследования, результаты собственных исследований и их обсуждение, заключения, выводов и практических рекомендаций. Работа изложена на 410 страницах, включающих 310 страниц аналитического текста, 99 рисунков, 51 таблицу, приложения. Список литературы содержит 124 источника на русском и 314 на иностранных языках.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования. Нами обследовано 404 человека, из них 317 человек составили основную группу, включавшую 175 больных с сосудистыми когнитивными нарушениями, 57 больных с когнитивными нарушениями смешанной этиологии, 85 пациентов с болезнью Альцгеймера. 55 человек составили контрольную группу. У 32 пациентов выявлены другие причины когнитивных нарушений.
Диагностика синдрома деменции проводилась на основании критериев МКБ–10. При диагностике нозологической формы деменции руководствовались критериями NINDS–ADRDA и NINDS–AIREN, шкалой Хачинского (Hachinski V.C., 1978). Диагностика УКН осуществлялась на основании критериев, предложенных R.Petersen (Petersen R.,1999; Touchon J.,2004). Степень выраженности когнитивных нарушений определялась на основании клинической рейтинговой шкалы деменции (CDR) и шкалы общих нарушений (GDS) (Hughes C. et al., 1982; Reisberg B. et al., 1982).
Для детального анализа были использованы результаты обследования 317 пациентов с различными вариантами когнитивных нарушений (табл. 1).
Таблица 1
Распределение обследованных больных по основным вариантам
когнитивных нарушений, полу и возрасту
| Варианты когнитивных нарушений | Количество больных (М/Ж) | Средний возраст, лет (m±). |
| Постинсультный | 65 (52/13) | 65,6+10,1 |
| Стратегический | 8(7/1) | 66,6+10,4 |
| Субкортикальный | 92(69/23) | 66,9+10,1 |
| Постгеморрагический | 10(7/3) | 62,8+8,9 |
| Смешанный | 57(26/31) | 70,9+7,6 |
| Альцгеймеровский | 85(35/50) | 69,4+8,1 |
| Всего | 317 | 67,9+9,4 |
Для сравнительной оценки результатов нейропсихологического исследования были обследованы 47 практически здоровых человек (28 мужчин и 19 женщин, в возрасте 68,7+5,3 года). Для получения контрольных нормативных данных КТ, МРТ, ОФЭКТ и ПЭТ были выполнены 8 практически здоровым лицам (5 мужчин и 3 женщины) в возрасте 64,2+5,4 года.
Клинико–неврологическое и нейропсихологическое обследование
Клинико–неврологическое обследование проводилось согласно стандартному неврологическому осмотру (Триумфов А.В.,1959; Михайленко А.А., 2001; Скоромец А.А. и др., 2007).
Общее состояние когнитивной сферы и различные когнитивные функции в отдельности оценивались по следующим методикам: 1) Краткая шкала оценки психического статуса (Folstein M. et al., 1975); 2) Комплексная шкала оценки деменции Маттиса (Mattis S., 1976); 3) Когнитивный раздел шкалы оценки степени выраженности болезни Альцгеймера (англ. Alzheimer`s Disease Assessment Scale – ADAS–Cog) (Rosen W. et al., 1984); 4) повторение цифр в прямом и обратном порядке (Wechsler, D., 1945); 5) тест «слежения» (Reitan R., 1955); 6) тест «5 слов» (Grober E. et al., 1988); 7) тест «10 слов» (Лурия А.Р., 1969); 8) тест «узнавание рисунков» (Лурия А.Р., 1969); 9) «Батарея исследования лобной дисфункции» (Dubois B., et al., 2000); 10) тест рисования часов (Sunderland T. et al., 1989); 11) методика «вербальных ассоциаций» (Borkowski J. et al., 1976); 12) бостонский тест называния (Kaplan E. et al., 1983).
Степень выраженности эмоциональных и поведенческих расстройств оценивали с помощью шкалы Гамильтона (Hamilton M., 1967), гериатрической шкалы депрессии (Yesavage J., Sheikh J., 1986), комплексной шкалы оценки нейропсихиатрических симптомов (Cummings J. et al., 1994).
Лабораторные исследования
Всем больным проводился анализ крови на содержание глюкозы, уровня холестерина, триглицеридов, липопротеидов. У 56 больных определялось содержание витамина В12, фолиевой кислоты и гомоцистеина. У 37 пациентов проведен анализ полиморфизма фрагментов гена АПОЕ.
Компьютерная и магнитно–резонансная томография головного мозга
КТ и МРТ головного мозга выполнялись соответственно на компьютерном томографе «Somatom Emotion Duo» и на установках серии Magnetom фирмы «Siemens» с напряженностью магнитного поля 1,5Т и 0,2Т.
Выраженность атрофических КТ и МРТ изменений оценивали полуколичественным методом, используя визуально–рейтинговую шкалу: 0 баллов – отсутствуют изменения; 1 балл – незначительные изменения; 2 балла – умеренные изменения и 3 балла – выраженные изменения. Выраженность лейкоареоза по данным МРТ оценивали по шкале P.Scheltens с соавт. (1993), в собственной модификации. Изменения в перивентрикулярной области оценивали на аксиальных срезах на уровне максимальной ширины тел боковых желудочков головного мозга по 3–х балльной системе: 0 баллов – нет изменений; 1 балл – размеры зон измененного сигнала до 5 мм; 2 балла – размеры зон измененного сигнала 6–10 мм. Учитывались изменения вблизи передних, задних рогов и вдоль тел боковых желудочков с обеих сторон. Наличие гиперинтенсивных сигналов в субкортикальных отделах лобных, теменных, височных и затылочных долей оценивалось следующим образом: 0 баллов – нет изменений; 1 балл – наличие единичных (до 5) очагов размерами до 3 мм; 2 балла – наличие единичных очагов размерами 4–10 мм; 3 балла – наличие более 6 очагов размерами 4–10 мм; 4 балла – наличие хотя бы одного очага размерами свыше 11 мм; 5 – наличие сливных очагов. Количество лакун подсчитывалось в субкортикальных отделах лобных, теменных, височных, затылочных долей, базальных ганглиях, зрительных буграх. Количественная оценка кодировалась баллами: 0 – нет очагов; 1 балл – единичные очаги; 2 балла – наличие от 3 до 5 очагов; 3 балла – более 5 очагов.
Методика перфузионной однофотонной эмиссионной компьютерной томографии головного мозга с [99mТс]–ГМПАО
Перфузионную ОФЭКТ головного мозга выполняли на гамма–камере Е–САМ Variable Angle с использованием радиофармпрепарата 99mТс–ГМПАО с активностью 350–500 МБк. На первом этапе проводили динамическую энцефало–ангиосцинтиграфию, на втором – томографию головного мозга с расчетом показателей регионарной перфузии. После реконструкции изображений определялись среднее значение общего мозгового кровотока (мл/100г/мин), коэффициент мозговой перфузии (мл/100г/мин), сосудистый коэффициент, затем оценивалась перфузия в различных областях головного мозга. За зоны интереса принимались: мозжечок, корковые и подкорковые отделы лобных долей, медио–базальные отделы височных долей, базальные ганглии, хвостатое ядро, таламус, теменные доли, затылочные доли. Полученные результаты в различных зонах мозга сопоставлялись с соответствующими значениями в мозжечке и с контрольными результатами, и кодировались в баллах следующим образом: снижение перфузии до 10% – 1 балл, на 11–20% – 2 балла, на 21–30% – 3 балла, на 31–40% – 4 балла, на 41–50% – 5 баллов, на 51–60% – 6 баллов, на 61–70% – 7 баллов, на 71–80% – 8 баллов, на 81–90% – 9 баллов, на 91–100% – 10 баллов.
Методика позитронной эмиссионной томографии головного мозга с 18F–ФДГ
ПЭТ выполняли на совмещенном позитронно–эмиссионном компьютерном томографе «Биограф» фирмы «Siemens» (Германия). Часть пациентов была обследована на томографах Ecat Exact 47 и Ecat Exact HR+ фирмы «Siemens».
Для ПЭТ исследований использовался РФП – 18F–ФДГ (период полураспада 110 минут; объемная активность 300–700 МБк на 1мл). Данные представляли в виде количественного показателя метаболической активности ткани – стандартизированного уровня захвата РФП «Standard Uptake Value (SUV)». В дальнейшем КТ и ПЭТ данные отправлялись на диагностическую станцию с возможностью реконструкции (MPR, MIP, SSD, VRT), а также одновременной визуализации (Fusion). Обработка данных включала вычисление отношений радиоактивности, накопленной в области интереса по отношению к контралатеральной зоне и к среднему значению данного показателя во всей коре головного мозга (в процентах). Для статистической обработки использовали специально разработанную рейтинговую шкалу: снижение метаболизма 18F–ФДГ на 11–20% оценивали в 1 балл; на 21–30% – в 2 балла; на 31–40% – в 3 балла; при превышении более чем на 40% –в 4 балла.
Материал и методики патоморфологического исследования
Для исследования были взяты макропрепараты головного мозга 4–х умерших с деменцией альцгеймеровского типа и семерых умерших с дисциркуляторной энцефалопатией, среди которых в трех случаях заболевание сопровождалось деменцией. В качестве группы сравнения был использован материал, полученный у 4–х погибших от несовместимой с жизнью травмы.
Проводилось поэтапное посмертное МРТ–патоморфологическое исследование. Фиксация препарата головного мозга осуществлялась в растворе нейтрального формалина в течение 1 месяца. Посмертное МРТ–исследование проводили на магнитно–резонансном томографе «Signa Infinity» General Electric (1,5 Тесла). Проводилось изготовление горизонтальных срезов с последующим сопоставлением макроскопических и МРТ–срезов и прицельным забором материала для гистологического исследования. Все микропрепараты окрашивались гематоксилином и эозином, также использовались окраски по методу ван–Гизон, импрегнация серебром по Футу, окраска Конго–рот, по методам Маллори, Шпильмейера и Ниссля. Производилась морфометрия с подсчетом числа нейронов в коре, а также клеток глии в белом веществе. Всего проведено исследование 958 образцов материала, из которых получено и оценено около 2350 препаратов. В ряде наблюдений проведено иммуногистохимическое исследование с геном онкосупрессором (Р–53), определение Fas–рецепторов, белка Bcl, маркера митотической активности (Ki–67).
Материал для электронной микроскопии приготавливали по методике, разработанной Н.Д. Клочковым с соавт. (2003). Всего было проанализировано около 1500 электронограмм.
Общее количество выполненных исследований представлено в таблице 2.
Таблица 2
Общее количество обследованных лиц и использованных методов
| Категория обследованных | Клинико–невроло–гический осмотр | Нейро–психоло–гическое обследо–вание | КТ | МРТ | ОФЭКТ | ПЭТ | Пато–морфоло–гическое исследова–ние |
| Больные, n=360 | 349 | 349 | 166 | 295 | 62 | 49 | 11 |
| Контроль, n=59 | 55 | 47 | 8 | 8 | 8 | 8 | 4 |
| Всего, n=419 | 404 | 396 | 174 | 313 | 70 | 57 | 15 |
Методы статистической обработки результатов исследования
Статистическую обработку результатов исследования выполняли с использованием методов параметрической и непараметрической статистики с помощью пакета прикладных программ Statistica for Windows 8.0 (StatSoft®, Inc., USA). Проверка гипотезы о происхождении групп, сформированных по качественному признаку, из одной и той же популяции, проводилась на основе построения таблиц сопряжённости наблюдаемых и ожидаемых частот; применялся критерий Pearson Chi–square (при его неустойчивости использовался двусторонний Fisher exact test). Сравнение независимых групп по количественному признаку осуществлялось при помощи T–критерия Стьюдента (для двух групп), в случае ограничения его применимости – непараметрического критерия Манна–Уитни (Mann–Whitney U–test); при числе групп более двух использовался параметрический и непараметрический дисперсионный анализ. Оценка связи между показателями выполнена с использованием корреляционного анализа с расчетом коэффициента корреляции Пирсона и регрессионного анализа, для переменных, измеренных в интервальной и ранговой шкалах, с помощью непараметрического коэффициента корреляции Спирмена. Для построения математических диагностических моделей использовался дискриминантный анализ. Нулевую гипотезу отвергали при вероятности p<0,05.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Среди пациентов с сосудистыми вариантами когнитивных нарушений преобладали мужчины (80% при постинсультном варианте и 75% при субкортикальном варианте), при альцгеймеровском и смешанном вариантах – женщины (соответственно 58,8 и 54,4%), (p<0,001). ГБ II и III стадии чаще встречалась при сосудистых вариантах (при постинсультном варианте в 89,1%, при субкортикальном в 79,3%), в то время как при альцгеймеровском варианте в 49,3% и при смешанном варианте в 68,4% случаев (p<0,001). Сахарный диабет и курение чаще имели место у пациентов с сосудистыми вариантами (p<0,05). Установлена корреляционная связь когнитивных нарушений с наличием эпсилон–4 изоформы гена АПОЕ (=0,41; p<0,001), возрастом (=0,27; p<0,001) и уровнем образования (= –0,14; p<0,05).
Результаты клинико–неврологического обследования пациентов с сосудистыми вариантами когнитивных нарушений
У пациентов с постинсультным вариантом средний балл по шкале Хачинского составил 7,8+2,4. Среди известных факторов риска чаще встречались ИБС (93,8%), артериальная гипертензия (92,3%), сахарный диабет (38,4%), гиперхолестеринемия (36,9%) и курение (33,8%). Установлена корреляционная связь между выраженностью когнитивных нарушений и степенью артериальной гипертензии (=0,25; p<0,05).
Неврологическая симптоматика и нарушения высших корковых функций в основном определялись локализацией очага поражения. Афазия выявлялась в 50,8% случаев, апраксия в 36,9%, агнозия в 16,9%, алексия в 6,2%, аграфия в 30,8%. Двигательные нарушения имели место у 89,2% пациентов, нарушения координации – у 72,3%, нарушения чувствительности – у 32,3%, гемианопсия – у 21,5%. В 86,1% случаев отмечались признаки псевдобульбарного пареза, в 10,8% – диспраксия ходьбы, в 20% – лобная симптоматика, в 7,7% – экстрапирамидные нарушения, в 6,2% – нейрогенный мочевой пузырь. Данные симптомы чаще встречались у пациентов с повторными инсультами и в большинстве случаев были ассоциированы с сопутствующей патологией белого вещества и подкорковых структур. Аффективные и поведенческие нарушения выявлялись соответственно в 20 и 33,8% случаев.
У пациентов с субкортикальным вариантом средний балл по шкале Хачинского составил 4,9+2,8. Основными факторами риска были ИБС (91,3%), артериальная гипертензия (91,3%), сахарный диабет (26,1%), гиперхолестеринемия (41,3%), курение (26,1%). Артериальная гипертензия коррелировала с выраженностью когнитивных нарушений (=0,23; p<0,05). У 16,7 и у 5,5% обследованных пациентов выявлены соответственно одна или две аллели эпсилон–4 гена АПОЕ, что коррелировало с выраженностью когнитивных нарушений по шкале GDS (=0,53; p<0,05).
Нарушения речи выявлялись в 22,8% случаев, апраксия в 32,6%, агнозия в 17,4%, алексия в 5,4%, аграфия в 22,8%. Нарушения речи характеризовались снижением плавности и беглости. Более часто наблюдались идеаторная и пространственная апраксия. Нарушения в двигательной сфере определялись у 69,6% пациентов, нарушения координации – у 68,5%, чувствительности – у 17,4%, гемианопсия – у 4,3%. В 85,9% случаев выявлялись признаки псевдобульбарного пареза, в 33,7% – диспраксия ходьбы, в 21,7% – лобная симптоматика, в 17,4% – экстрапирамидные нарушения, в 14,1% – нейрогенный мочевой пузырь. Частота встречаемости вышеперечисленных симптомов увеличивалась по мере нарастания тяжести когнитивных нарушений (табл.3).
Таблица 3
Сопоставление частоты встречаемости неврологических синдромов и выраженности когнитивных нарушений, в процентах
| Синдром | CDR=0,5 | CDR=1 | CDR=2 |
| Псевдобульбарный | 74,4 | 92,9 | 100 |
| Лобный | 7,7 | 33,3 | 27,3 |
| Диспраксия ходьбы | 10,3 | 50 | 63,6 |
| Экстрапирамидный | 7,7 | 23,8 | 27,3 |
| Нейрогенные тазовые нарушения | 2,6 | 19 | 45,5 |
Суммарный балл «батареи лобных тестов» имел отрицательную корреляционную связь с наличием лобной симптоматики (= –0,28; p<0,01), псевдобульбарным синдромом (= –0,29; p<0,01), диспраксией ходьбы (= –0,49; p<0,0001), экстрапирамидным синдромом (= –0,27; p<0,01), нейрогенным мочевым пузырем (= –0,37; p<0,001).
Аффективные нарушения выявлялись в 48,9% случаев, при этом на более легких стадиях когнитивных нарушений частота эмоциональных расстройств была несколько выше. Поведенческие нарушения встречались в 45,6% случаев, частота их возрастала по мере прогрессирования когнитивных расстройств.
У пациентов со стратегическим вариантом средний балл по шкале Хачинского составил 7,8+2,6. У всех пациентов встречались ИБС и ГБ, у половины – сахарный диабет и гиперхолестеринемия. У 4–х пациентов с левосторонними таламическими инфарктами наблюдались нарушения речи по типу динамической афазии. У всех пациентов наблюдались признаки псевдобульбарного пареза, двигательные нарушения были выявлены у 6 пациентов, координаторные у 7, чувствительные у 3–х. Среди пациентов с локализацией поражения в базальных ганглиях во всех случаях отмечалась экстрапирамидная симптоматика. У 2–х пациентов имели место аффективные расстройства, у 4–х – поведенческие нарушения.
При постгеморрагическом варианте ГБ и ИБС встречались у всех пациентов. Средние цифры артериального давления были максимальными среди всех вариантов, превышая показатели при альцгеймеровском (p<0,001), субкортикальном (p<0,05) и смешанном (p<0,001) вариантах. Сахарный диабет отмечался у 3–х пациентов, гиперхолестеринемия у 2–х, курение и злоупотребление алкоголем у 3–х. Нарушения высших корковых функций отражали локализацию очага поражения; афазия и аграфия наблюдались у 4–х пациентов, апраксия, агнозия и алексия – у 2–х. У всех пациентов наблюдались признаки псевдобульбарного пареза, у 9 человек имелись двигательные нарушения, у 8 – координаторные нарушения, у 4–х – нарушения чувствительности, гемианопсия – у одного. Нарушения поведения отмечались у половины пациентов, эмоциональная неустойчивость у двух человек.
Результаты клинико–неврологического обследования пациентов с альцгеймеровским и смешанным вариантами когнитивных нарушений
Среди основных факторов риска при альцгеймеровском варианте ИБС регистрировалась в 91,8% случаев, ГБ в 72,9%, сахарный диабет в 17,6%, гиперхолестеринемия в 28,3%, курение в 14,1%. У 29,8% пациентов выявлена одна патологическая аллель эпсилон–4 гена АПОЕ, у 21,6% – две аллели, что коррелировало с выраженностью когнитивных нарушений. У лиц пожилого возраста и лиц с низким уровнем образования чаще встречались более выраженные когнитивные нарушения.
В клинической картине преобладали нарушения высших корковых функций при незначительно выраженной очаговой неврологической симптоматике. Нарушения речи выявлялись в 67,1% случаев, апраксия в 81,2%, агнозия в 77,6%, алексия в 54,1%, аграфия в 68,2%. Аффективные нарушения имели место в 28,2% случаев, поведенческие расстройства – в 27,1%. Частота поведенческих нарушений резко увеличивалась с увеличением выраженности когнитивных нарушений: от 12,5% среди пациентов с УКН до 50% среди пациентов с тяжелой деменцией.
У пациентов со смешанным вариантом среди факторов риска чаще встречались ИБС (94,7%), ГБ (82,5%), сахарный диабет (24,6%), гиперхолестеринемия (24,6%), курение (19,3%). У 36,8% пациентов выявлена одна аллель эпсилон–4 гена АПОЕ, у 10,5% – две аллели, что также соответствовало более выраженным когнитивным расстройствам. Нарушения высших корковых функций сочетались с очаговой симптоматикой, причем корковая дисфункция, как правило, преобладала. Нарушения речи выявлялись в 45,8% случаев, апраксия в 54,4%, агнозия в 56,1%, алексия в 28,1%, аграфия в 38,6%. Двигательные нарушения имели место у 61,4% пациентов, расстройства координации – у 45,6%, чувствительности – у 12,3%. В 84,2% случаев выявлялись признаки псевдобульбарного пареза, в 8,9% – лобные симптомы, в 21,1% – диспраксия ходьбы, в 3,5% – экстрапирамидные нарушения, в 7,0% – нейрогенный мочевой пузырь. Аффективные нарушения наблюдались в 43,9% случаев. Поведенческие нарушения встречались у 24,6% пациентов, сочетались с более тяжелым когнитивным дефицитом.
Особенности нейропсихологических проявлений у пациентов с сосудистыми вариантами когнитивных нарушений
При постинсультном варианте на стадии УКН наиболее значимое снижение показателей выявлялось по тестам, отражающим состояние регуляторных функций и внимания. Монофункциональный амнестический тип наблюдался в 7,7% случаев, полифункциональный амнестический тип в 57,7% случаев, монофункциональный тип без мнестических нарушений в 34,6% случаев. Наиболее значимые различия между пациентами с УКН и легкой деменцией отмечались по следующим тестам: КШОПС, повторение цифр вперед и назад, шкала деменции Матисса, батарея лобных тестов, тесты «5» и «10» слов, тест рисования часов (уровень достоверности не менее p<0,01), таблица 4.
Таблица 4
Показатели основных нейропсихологических тестов у пациентов с постинсультным вариантом, баллы (![]() )
)
| Методики | CDR=0,5 (n=25) | CDR=1 (n=33) | CDR=2 (n=6) | CDR=3 (n=1) | Все пациенты (n=65) |
| ШДМ | 122,3+1,7 | 113,1+3,1* | 74+9,0### | 74 | 110,2+3,2 |
| КШОПС: | 25,8+0,3 | 21,1+0,6*** | 13,5+1,4### | 9 | 22,0+0,6 |
| БЛТ | 13,3+0,6 | 11,0+0,6* | 6,8+1,6### | 3 | 11,4+0,5 |
| Тест 5 слов | 9,8+0,1 | 8,5+0,3** | 7+1,1# | 1 | 8,8+0,2 |
| ТРЧ | 7,8+0,3 | 6,2+0,4** | 4,3+0,8# | 5 | 6,6+0,3 |
Примечания: различия между УКН и легкой деменцией: * – p<0,05, ** – p<0,01, *** – p<0,001; различия между легкой и умеренной деменцией: # – p<0,05, ## – p<0,01, ### – p<0,001.
Значительное нарушение регуляторных функций было характерным для пациентов с постинсультной деменцией. По субшкале «инициация» ШДМ средний балл у пациентов с легкой деменцией составил 28,3+1,2, с умеренной деменцией – 16,7+2,6 (p<0,001); по субшкале «концептуализация» – 30,8+1,2 и 18,3+4,5 (p<0,001); по «батарее исследования лобной дисфункции – 11,0+0,6 и 6,8+1,6 (p<0,001). Субтест «внимание» наиболее значимо был снижен у пациентов с умеренной деменцией – до 27,2+2,5 баллов (p<0,01). Прогрессирование когнитивного дефицита было обусловлено как ухудшением регуляторных функций и внимания, так и снижением памяти и способности к ориентировке.
У пациентов с многоочаговым поражением когнитивные нарушения были выражены в большей степени, при этом наибольшее значение имели интегративные показатели психической деятельности. Нам представляется, что именно наличие комплексной когнитивной дисфункции в большей степени, чем очаговые нарушения высших корковых функций, должно приниматься во внимание при диагностике постинсультного варианта когнитивных нарушений.
При субкортикальном варианте монофункциональный амнестический тип УКН наблюдался в 12,8% случаев, полифункциональный амнестический тип – в 69,3%, монофункциональный тип без мнестических нарушений – в 17,9% случаев. Нарушения внимания и регуляторных функций также преобладали среди нейропсихологических симптомов у пациентов с УКН, но при этом были менее выраженными, в сравнении с постинсультным вариантом. Нарушения памяти проявлялись преимущественно снижением кратковременной памяти, хорошо корректировались подсказкой. Различия между пациентами с УКН и легкой деменцией были особенно значимыми по следующим показателям: ШДМ и ее подшкалы «инициация», «праксис», «концептуализация», тест «повторения цифр вперед и назад», «тест слежения», КШОПС, батарея лобных тестов, вербальные ассоциации (уровень различий не менее чем, p<0,01). В меньшей степени на этом этапе прогрессировали мнестические расстройства, таблица 5.
Таблица 5
Показатели основных нейропсихологических тестов у пациентов с субкортикальным вариантом, баллы (![]() )
)
| Методики | CDR=0,5 (n=39) | CDR=1 (n=42) | CDR=2 (n=11) | Все пациенты (n=92) |
| ШДМ | 128,3+1,2 | 115,0+2,4*** | 115,0+3,0 | 121,2+1,6 |
| КШОПС: | 26,2+0,2 | 21,7+0,5*** | 15,8+1,2### | 22,9+0,5 |
| БЛТ | 14,6+0,3 | 10,8+0,5*** | 8,6+1,1# | 12,2+0,4 |
| Тест 5 слов | 9,6+0,1 | 8,8+0,2* | 5,5+1,0### | 8,8+0,2 |
| ТРЧ | 7,8+0,3 | 6,8+0,3* | 4,0+0,5### | 6,9+0,2 |
Примечания: те же, что и в таблице 4.
Таким образом, нейропсихологические проявления характеризовались преимущественно нарушением внимания и регуляторных функций. Нарушения памяти проявлялись изменениями кратковременной памяти, при умеренной деменции наблюдался более распространенный характер мнестических расстройств – наряду с ведущим вторичным характером нарушений памяти страдало и собственно запоминание. Отмечалось более равномерное снижение основных показателей с большим нарушением праксиса, ориентировки, памяти, при менее выраженных речевых нарушениях в сравнении с постинсультным вариантом.
При стратегическом варианте нейропсихологический профиль можно было условно разделить на три субварианта в зависимости от локализации очага поражения: «таламический», «базальный» и «височный». «Височный» субвариант проявлялся выраженными расстройствами памяти по типу Корсаковского синдрома в сочетании с нарушениями речи, ориентировки во времени и пространстве, гнозиса. При «базальном» субварианте ведущими были дизрегуляторные расстройства, также отмечались динамическая апраксия, нарушения речи, зрительно–пространственной ориентировки и счета. «Таламический» субвариант характеризовался выраженными мнестическими, нейродинамическими и речевыми нарушениями.
Нейропсихологический профиль пациентов с постгеморрагическими когнитивными нарушениями в целом был сопоставим с изменениями при постинсультных ишемических расстройствах. Основу нейропсихологических проявлений составляли нарушения внимания, регуляторных функций, речи.
Особенности нейропсихологических проявлений у пациентов с альцгеймеровским и смешанным вариантами когнитивных нарушений
Наибольшие изменения у пациентов с УКН альцгеймеровского типа были отмечены в отношении памяти. Пациенты с легкой деменцией имели значительно более выраженные изменения, что отражало быстрый срыв компенсаторных возможностей и лавинообразное нарастание когнитивного дефицита (табл. 6).
Таблица 6
Показатели основных нейропсихологических тестов у пациентов с альцгеймеровским вариантом, баллы (![]() )
)
| Методики | CDR=0,5 (n=16) | CDR=1 (n=31) | CDR=2 (n=24) | CDR=3 (n=14) | Все пациенты (n=85) |
| ШДМ: | 129+1,8 | 101,5+4,8*** | 66,6+7,3### | 64,8+6,1 | 97+5,1 |
| КШОПС: | 26,6+0,5 | 19,4+0,5*** | 14,1+0,7### | 8,9+1,3&&& | 17,5+0,7 |
| БЛТ | 15,2+0,4 | 10,3+0,5*** | 7,2+0,4### | 4,8+0,8&& | 9,4+0,5 |
| Тест 5 слов | 9+0,4 | 6,0+0,3*** | 3,4+0,4### | 1,5+0,4&& | 5,1+0,3 |
| ТРЧ | 7 +0,5 | 5,0+0,3*** | 3,4+0,4** | 2,1+0,3& | 4,4+0,3 |
Примечания: различия между УКН и легкой деменцией: *** – p<0,001; различия между легкой и умеренной деменцией: ## – p<0,01, ### – p<0,001; различия между умеренной и тяжелой деменцией: & – p<0,05, && – p<0,01, &&& – p<0,001.
Нарушения памяти носили первичный характер. Наиболее значимые различия отмечались по следующим показателям: субшкала «память» и суммарный балл ШДМ, КШОПС, называние цифр, батарея лобных тестов, тесты 5 и 10 слов, тест рисования часов, тест вербальных ассоциаций, (p<0,001), что позволяет рассматривать их изменение в динамике как прогностически неблагоприятный признак трансформации УКН в деменцию.
Изменения показателей всех комплексных шкал (КШОПС, ШДМ, ADAS–Cog) при легкой деменции альцгеймеровского типа были максимальными по сравнению с другими вариантами. Средний балл по ШДМ составил 101,5+4,8, в то время как для постинсультного и субкортикального вариантов – 113,1+3,1 и 115,0+2,4 баллов (p<0,05 и p<0,01). По результатам теста «5 слов» средний балл составил соответственно 6,0+0,3, 8,5+0,3 и 8,8+0,2 (p<0,001). Грубо также страдала и семантическая память – 7,4+0,7 баллов. Кроме нарушений памяти, были выражены расстройства речи, гнозиса, ориентировки во времени и пространстве, зрительно–пространственной функции, мышления.
У пациентов с умеренной деменцией наиболее значимо ухудшались следующие показатели: суммарный балл ШДМ и подшкалы «инициация», КШОПС, батарея лобных тестов, тесты 5 и 10 слов (p<0,001). Прогрессировали в основном нарушения памяти, также отмечено появление новых маркеров – нарушений речи и активности. У пациентов с тяжелой деменцией наблюдался грубый распад когнитивной деятельности, мнестические нарушения оставались доминирующими.
Нейропсихологический профиль пациентов со смешанным вариантом в целом сочетал в себе признаки как сосудистых, так и альцгеймеровского вариантов, занимая как бы промежуточное положение. В структуре УКН значительно чаще встречался амнестический полифункциональный вариант (73,4%); амнестический монофункциональный и монофункциональный без мнестических нарушений варианты имели место в 13,3% случаев каждый.
У пациентов с легкой деменцией наблюдалось достаточно равномерное снижение основных показателей, но прослеживалась тенденция к большему повреждению памяти, ориентировки во времени и пространстве, зрительно–пространственной функции. На стадии умеренной и тяжелой деменции увеличивалась выраженность нарушений регуляторных функций и речи, при этом значимыми оставались нарушения памяти, ориентировки (табл. 7).
Таблица 7
Показатели основных нейропсихологических тестов у пациентов со смешанным вариантом, баллы (![]() )
)
| Методики | CDR=0,5 (n=15) | CDR=1 (n=33) | CDR=2 (n=7) | CDR=3 (n=2) | Все пациенты (n=57) |
| ШДМ: | 131,3+1,0 | 113,0+5,7*** | 83,3+9,8### | 56,5+2,5&& | 115,8+4,9 |
| КШОПС: | 25,7+0,3 | 20,7+0,4*** | 13,4+0,9### | 10+1,0 | 20,7+0,6 |
| БЛТ | 14,6+0,9 | 11,1+0,6** | 6,4+1,5## | 5,5+1,5 | 11,2+0,6 |
| Тест 5 слов | 9,5+0,2 | 7,1+0,3*** | 5,4+0,8# | 0,5+0,5 | 7,3+0,3 |
| ТРЧ | 6,3 +0,7 | 5,6+0,4 | 4,9+0,6 | 4,0 | 5,6+0,3 |
Примечания: различия между УКН и легкой деменцией: ** – p<0,01, *** – p<0,001; различия между легкой и умеренной деменцией: # – p<0,05, ## p<0,01, ### – p<0,001; различия между умеренной и тяжелой деменцией: && – p<0,01.
Таким образом, сосудистый фактор оказывал наибольшее влияние на состояние зрительно–пространственной и регуляторных функций, однако ведущими оставались первичные нарушения памяти, что свидетельствовало о более значимом вкладе нейродегенеративной патологии в развитие и динамику когнитивных нарушений при смешанных вариантах.
Дисперсионный анализ показал, что наиболее информативными признаками являлись: тест 5 слов, тест категориальных ассоциаций, тест 10 слов, суммарный балл ориентировки во времени и пространстве, тест рисования часов. Самыми информативными для дифференциальной диагностики инциденталами в полученной дискриминантной модели оказались тест 5 слов и тест слежения, затем тест повторения цифр вперед и тест категориальных ассоциаций (критерий F=14,0; p<0,001). Диагностическая эффективность полученной модели составила 62,8%, при этом лучше всего распознавались субкортикальный (75%) и альцгеймеровский (66,7%) варианты.
Результаты КТ и МРТ головного мозга у пациентов с сосудистыми вариантами когнитивных нарушений
У пациентов с постинсультными вариантами преобладали очаговые изменения в виде кистозно–глиозных изменений, лакунарных инфарктов. Повреждение теменных и височных долей наблюдалось соответственно в 37,4 и 20,2% случаев. Среди больных со «стратегическим» вариантом у 5 пациентов очаг локализовался в таламусе, у 2 в базальных ганглиях, у 1 в медиобазальных отделах височной доли. Средний объем поврежденного мозгового вещества при постинсультных вариантах составил 46,5+9,4 см3. Корреляционной связи между объемом повреждения и выраженностью когнитивных нарушений выявлено не было (=0,11, p>0,05); в то же время, среди пациентов, перенесших инсульт однократно, УКН наблюдались в 49% случаев, деменция в 51% случаев, а при мультиинфарктных поражениях соответственно в 12,5 и 87,5% (p<0,05).
Диффузные изменения были представлены атрофическими изменениями ткани головного мозга и патологией белого вещества по типу перивентрикулярного лейкоареоза. Субкортикальный лейкоареоз рассматривался как диффузно–очаговое повреждение.
При постинсультном варианте наиболее выраженные атрофические изменения наблюдались в лобных и теменных долях, при субкортикальном варианте преимущественно страдали теменные и височные доли (рис. 1).
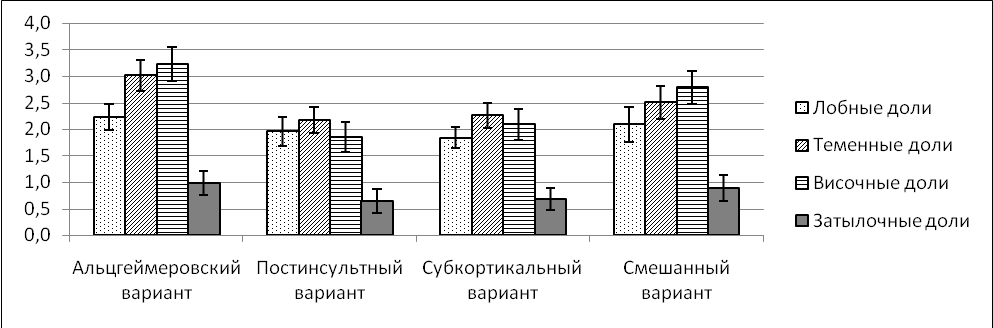
Рис. 1. Средние значения выраженности атрофических нарушений (в баллах) в долях головного мозга при различных вариантах когнитивных нарушений
Атрофические изменения имели корреляционную связь преимущественно с нейропсихологическими показателями, отражающими состояние внимания, памяти, общего когнитивного состояния. У пациентов с постинсультным вариантом показатель субшкалы «внимание» ШДМ коррелировал с общим показателем конвекситальной атрофии (= –0,31; p<0,05); субшкалы «память» – с выраженностью общей атрофии (= – 0,47; p<0,01). Такие же связи общей атрофии установлены с суммарным баллом КШОПС (= –0,5; p<0,0001) и ШДМ (= –0,3; p<0,05). При субкортикальном варианте показатели комплексных шкал имели тесную корреляционную связь с выраженностью атрофических изменений в височных долях головного мозга (ШДМ – = –0,37; p<0,01; КШОПС – = –0,46; p<0,0001). Результаты тестов «5 слов» и «10 слов» коррелировали в первую очередь с атрофией височных долей (соответственно, = –0,39; p<0,001 и = –0,33; p<0,01) и гиппокампов (= –0,47; p<0,001 и = –0,44; p<0,001). Данные связи могут отражать вклад сопутствующего нейродегенеративного процесса. Выраженность и локализация атрофических изменений в большей степени имели значение для прогрессирования когнитивных нарушений от стадии умеренных расстройств до деменции (p<0,001). На поздних стадиях более значимое влияние оказывали патологические изменения белого вещества и лакуны.
Общий показатель субкортикального лейкоареоза при субкортикальном варианте был значительно выше, чем при постинсультном варианте и составил при легкой деменции 10,3+1,4 балла, при умеренной деменции – 17,8+6,0 баллов (при постинсультном варианте соответственно 9,2+1,6 баллов и 9,3+2,3 баллов). Изменения белого вещества встречались преимущественно в теменных и лобных долях, коррелировали с нейродинамическими и регуляторными нарушениями (рис. 2).
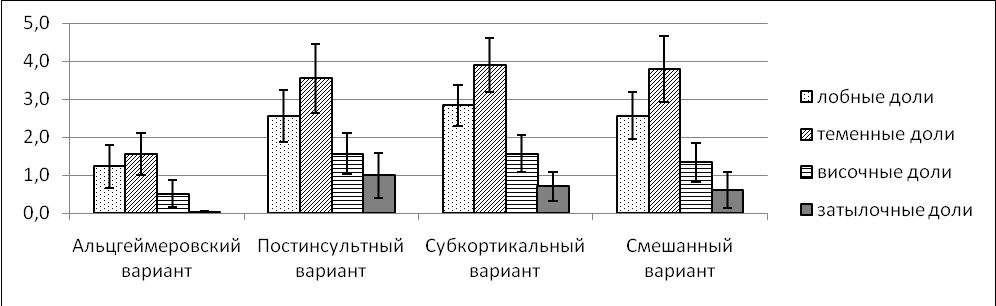
Рис. 2. Средние значения выраженности субкортикального лейкоареоза (в баллах) в долях головного мозга при различных вариантах когнитивных нарушений
Так, у пациентов с постинсультным вариантом показатель «батареи лобных тестов» имел наиболее тесную корреляционную связь с выраженностью субкортикального лейкоареоза (= –0,36; p<0,01) и суммарным показателем лейкоареоза (= –0,38; p<0,01); у пациентов с субкортикальным вариантом – с перивентрикулярным лейкоареозом (= –0,48; p<0,0001). Установлена также связь между показателем лакунарного повреждения белого вещества с КШОПС (= –0,3; p<0,05), батареей лобных тестов (= –0,37; p<0,01), тестом «5 слов» (= –0,28; p<0,05), тестом рисования часов (= –0,35; p<0,01), тестом вербальных и категориальных ассоциаций (=0,33; p<0,05). Корреляционный анализ также позволил выявить связь сосудистых и атрофических изменений, что может отражать взаимодействие сосудистого и нейродегенеративного факторов. При постинсультном и субкортикальном вариантах степень конвекситальной атрофии устойчиво коррелировала с выраженностью перивентрикулярного и субкортикального лейкоареоза (p<0,05).
Для всех сосудистых вариантов, особенно для субкортикального, выявлена прямая связь между степенью поражения белого вещества и лакунами с выраженностью когнитивных нарушений. Различия между пациентами с УКН и легкой деменций в первую очередь были связаны с выраженностью перивентрикулярного лейкоареоза. По мере дальнейшего прогрессирования когнитивного дефицита наибольшее значение имело увеличение выраженности субкортикального лейкоареоза.
Результаты КТ и МРТ головного мозга у пациентов с альцгеймеровским и смешанным вариантами когнитивных нарушений
При альцгеймеровском варианте выраженность и локализация атрофических изменений значительно отличались от сосудистых вариантов. Атрофические изменения были достоверно более выражены в теменных и височных долях (p<0,001). Наиболее тесная корреляционная связь суммарного балла шкал ШДМ и КШОПС установлена с выраженностью атрофических изменений в височных долях и с общей конвекситальной атрофией (соответственно = –0,7; p<0,0001 и = –0,53; p<0,0001; = –0,75; p<0,0001 и = –0,63; p<0,0001). Такие же закономерности установлены для нейропсихологических показателей, отражающих состояние памяти, внимания.
У пациентов с УКН наиболее выраженные атрофические изменения отмечались в теменной коре, но, при этом, достоверно не отличались от сосудистых вариантов, что не позволяет рассматривать наличие конвекситальной атрофии в качестве маркера ранних стадий БА. В то же время, полуколичественная оценка выраженности атрофических изменений гиппокампа, показала наличие характерных изменений уже на ранних стадиях заболевания.
У пациентов с деменцией отмечалось значительное увеличение выраженности атрофических изменений практически по всем областям головного мозга, при этом наибольшие различия между пациентами с УКН и легкой деменцией отмечены для теменных и височных долей, а также по суммарным показателям конвекситальной и общей атрофии (p<0,001).
Изменения белого вещества при БА характеризовались единичными очагами субкортикального лейкоареоза, перивентрикулярным лейкоареозом. Перивентрикулярный лейкоареоз имел корреляционную связь с суммарным баллом шкал ШДМ (= –0,51; p<0,01), и КШОПС (= –0,38; p<0,01), и рядом других показателей, характеризующих внимание и память. Таким образом, при патологии альцгеймеровского типа изменения белого вещества и единичные лакуны могут оказывать влияние преимущественно на нейродинамические процессы.
У пациентов со смешанным вариантом характерным было сочетание атрофических изменений с лейкоареозом и лакунами в субкортикальном белом и сером веществе. В сравнении с пациентами с сосудистыми вариантами, наряду с сопоставимыми атрофическими изменениями в лобных отделах, более значительно была представлена атрофия в теменно–височных областях, (p<0,05). У пациентов с умеренной деменцией отмечено равномерное распределение атрофических изменений в лобных, теменных и височных долях. В то же время у пациентов с тяжелой деменцией наиболее выраженные изменения отмечались в височных долях.
Патологические изменения белого вещества были представлены сочетанием перивентрикулярного и субкортикального лейкоареоза, преимущественно в лобных и теменных долях. По мере прогрессирования заболевания акцент выраженности субкортикального лейкоареоза смещался в сторону теменных и височных долей. Общий показатель лейкоареоза у пациентов с легкой деменцией смешанного типа составил 14,4+1,6 баллов, у пациентов с деменцией альцгеймеровского типа 7,8+1,3 баллов (p<0,05), у пациентов с субкортикальной деменцией 17,2+1,8 баллов, у пациентов с постинсультной деменцией 16,5+2,2 баллов. Подобная картина наблюдалась и при анализе количества лакун, показатель которых составил 3,1+0,7, 0,2+0,1 (p<0,05), 4,6+2,5 и 3,8+0,8 баллов соответственно.
Большинство нейропсихологических показателей коррелировали в первую очередь с выраженностью атрофии, а не с сосудистыми изменениями. Суммарный балл шкал ШДМ и КШОПС имел наиболее устойчивую корреляционную связь с расширением желудочков (= –0,61; p<0,001 и = –0,57; p<0,0001) и общим показателем атрофии (= –0,66; p<0,001 и = –0,52; p<0,0001). Такие же закономерности установлены для тестов «5 и 10 слов», повторения цифр, теста «слежения». Перивентрикулярный и субкортикальный лейкоареоз, наличие лакун коррелировали с показателями, отражающими состояние регуляторных функций, внимания, речи.
Дисперсионный анализ показал, что наиболее информативными признаками являлись: атрофия височных долей, гиппокампов и теменных долей, субкортикальный лейкоареоз теменной локализации, общий показатель субкортикального лейкоареоза, сочетание перивентрикулярного и субкортикального лейкоареоза. Самыми информативными для дифференциальной диагностики показателями оказались выраженность атрофии гиппокампов и теменных долей, общий показатель лакунарного повреждения и сочетание перивентрикулярного и субкортикального лейкоареоза (критерий F=8,15; p<0,001). Диагностическая эффективность полученной модели позволяла хорошо дифференцировать альцгеймеровский вариант когнитивных нарушений (с точностью до 77,1%). Вместе с тем, для сосудистых и, особенно смешанного, вариантов чувствительность была ограничена.
Результаты ОФЭКТ с [99mТс]–ГМПАО у пациентов с сосудистыми вариантами когнитивных нарушений
Выделены несколько вариантов нарушений церебральной перфузии при сосудистой этиологии когнитивных расстройств. При постинсультном варианте выявлялись крупные зоны снижения перфузии в корковых и подкорковых отделах, вплоть до полного её отсутствия, в том числе сочетающиеся с перифокальным и гомолатеральным снижением перфузии всего полушария. При стратегическом варианте имели место небольшие зоны аперфузии в проекции базальных ганглиев, в том числе с гомолатеральной гипоперфузией коры головного мозга. Субкортикальный вариант проявлялся множественными мелкоочаговыми асимметричными зонами гипоперфузии в корковых и подкорковых отделах, сочетанием гипоперфузии в проекции базальных ганглиев со снижением перфузии в лобной коре, лобной и теменной коре, диффузным снижением перфузии в корковых отделах полушарий мозга.
У пациентов с постинсультным вариантом наиболее выраженные изменения перфузии отмечались в затылочных, теменных и лобных долях; при субкортикальном варианте – в лобных долях, в сравнении с теменными (p<0,01), височными (p<0,01) и затылочными долями (p<0,05), причем данное распределение перфузионных нарушений не соответствовало структурным изменениям, вероятно, предшествуя им во времени (рис.3).

Рис. 3. Средние значения выраженности перфузионных нарушений (в баллах) в долях головного мозга при различных вариантах когнитивных нарушений
При субкортикальном варианте также отчетливо была снижена перфузия в базальных ганглиях, хвостатых ядрах и таламусах, в сравнении с постинсультным вариантом, соответственно 2,5+0,6 и 1,2+0,6 баллов 3,0+0,6 и 1,8+0,4 баллов, 3,7+0,5 и 2,4+0,4 баллов.
Выявлены корреляционные связи между снижением перфузии и выраженностью атрофии в соответствующих структурах мозга. У пациентов с субкортикальным вариантом также установлены связи между снижением перфузии в проекции таламусов c общей атрофией (=0,48; p<0,05). Перивентрикулярный лейкоареоз был связан с гипоперфузией базальных отделов лобной коры (=0,56; p<0,05) и с гипоперфузией в проекции гиппокампов (=0,52; p<0,05). Более тесные связи были установлены для субкортикального лейкоареоза, который коррелировал с гипоперфузией в базальных и глубоких отделах лобной коры (=0,55; p<0,05 и =0,61; p<0,01), гипоперфузией в проекции хвостатых ядер (=0,51; p<0,05) и таламусов (=0,49; p<0,05). С выраженностью лакунарного повреждения коррелировало снижение перфузии в базальных отделах лобной доли (=0,6; p<0,01), проекции гиппокампов (=0,58; p<0,05), глубоких отделах лобной коры (=0,73; p<0,001), проекции базальных ганглиев (=0,56; p<0,05), хвостатых ядер (=0,65; p<0,01) и таламусов (=0,72; p<0,001). Таким образом, перфузионные нарушения были преимущественно связаны с сосудистыми структурными изменениями в виде лейкоареоза и лакун, что может рассматриваться как подтверждение гипотезы деафферентации корковых структур в результате повреждения подкорково–корковых связей.
Выраженность нарушений мозговой перфузии была выше у пациентов с более тяжелыми когнитивными расстройствами, что было особенно характерно для субкортикального варианта. Прогрессирование когнитивного дефицита при субкортикальном варианте сопровождалось нарастанием перфузионных нарушений в подкорковых структурах и в глубоких отделах лобной коры. У пациентов с УКН снижение перфузии в глубоких отделах лобной коры составило в среднем 2,0+0,6 баллов, у пациентов с легкой деменцией – 4,5+0,7 (p<0,05), у пациентов с умеренной деменцией – 9,3+0,7 баллов (p<0,001); в области хвостатых ядер – соответственно 1,5+0,5, 3,2+0,8 и 6,7+0,7 баллов (p<0,05), в области таламусов – 2,3+0,6, 4,0+0,5 (p<0,05) и 6,7+0,7 баллов (p<0,05). На этапе перехода УКН в стадию легкой деменции наиболее значимые различия наблюдались при оценке перфузии в лобной коре и медиобазальных отделах височной коры (p<0,01и p<0,001). При переходе легкой деменции в стадию умеренной наиболее выраженная динамика перфузионных нарушений имела место в лобной коре и базальных ганглиях (p<0,001и p<0,01), а также в проекционных зонах хвостатых ядер и таламусов (p<0,05).
Таким образом, изменения перфузии в соответствующих структурах головного мозга могут рассматриваться как возможные маркеры прогрессирования когнитивных нарушений. Так как для постинсультного варианта не выявлено достоверных различий в выраженности перфузионных нарушений в зависимости от тяжести когнитивного дефицита, можно предположить, что прогрессирование цереброваскулярной патологии в меньшей степени оказывает влияние на состояние когнитивной сферы, чем наличие атрофических изменений. Что касается субкортикального варианта, то по мере прогрессирования цереброваскулярного заболевания присоединяется нарушение перфузии в глубоких и корковых отделах головного мозга, определяющее в конечном итоге тяжесть когнитивного дефицита. Нарушения перфузии в подкорковых структурах можно рассматривать как ранний и достаточно специфичный маркер возможного развития когнитивных расстройств при субкортикальной ишемической энцефалопатии.
Результаты ОФЭКТ с [99mТс]–ГМПАО у пациентов с альцгеймеровским и смешанным вариантами когнитивных нарушений
Нарушения перфузии при когнитивных нарушениях альцгеймеровского и смешанного вариантов носили более однородный характер. При альцгеймеровском варианте типичными паттернами перфузионных нарушений являлись: билатеральное снижение перфузии теменной и височной коры; диффузное снижение перфузии корковых отделов полушарий мозга. Смешанный вариант характеризовался билатеральным снижением перфузии теменной и височной коры в сочетании с множественными мелкоочаговыми асимметричными зонами гипоперфузии в корковых и подкорковых отделах, особенно в проекции базальных ганглиев.
При альцгеймеровском варианте показатели снижения перфузии в теменных и медиобазальных отделах височных долей в среднем составили соответственно 5,2+0,7 и 5,7+0,7 баллов, что являлось максимальным значением среди всех вариантов (p<0,001). У пациентов со смешанным вариантом снижение перфузии в теменных и медиобазальных отделах височных долей составило соответственно 4,8+0,5 и 4,8+0,4 баллов, что было меньше, чем при альцгеймеровском варианте, но значительно превышало показатели при субкортикальном и постинсультном вариантах (p<0,01 и p<0,001). Кроме того, у пациентов со смешанным вариантом отчетливо была снижена перфузия в коре и глубоких отделах лобных долей, соответственно 2,1+0,3 и 4,3+0,6 баллов. Эти показатели значительно превышали не только аналогичные показатели у пациентов с патологией альцгеймеровского типа (p<0,05), но и показатели у пациентов с сосудистыми вариантами.
Выраженность перфузионных нарушений была выше у пациентов с более тяжелым когнитивным дефицитом. У пациентов с легкой деменцией альцгеймеровского типа гипоперфузия в теменной и височной коре составила соответственно 4,5+1,0 и 4,0+1,6 балла, у пациентов с умеренной деменцией – 5,0+1,7 и 6,3+1,0 балла, с тяжелой деменцией – 5,8+1,1 и 6,6+0,9 баллов. У пациентов с альцгеймеровским вариантом была выявлена обратная корреляционная связь между нарушением перфузии и выраженностью структурных изменений лишь в отношении нескольких атрофических параметров, что позволяет говорить о вторичном характере перфузионных нарушений при нейродегенеративной патологии.
У пациентов со смешанным вариантом уже на стадии легкой деменции определялись выраженные нарушения перфузии в различных отделах коры и в подкорковых структурах. Особенно значимые изменения перфузии имели место в теменной, височной коре и в глубоких отделах лобных долей. По мере прогрессирования когнитивного дефицита, наиболее существенно нарушения перфузии нарастали в лобной коре (p<0,05), теменной коре, в области хвостатых ядер и таламусов. Нарушения перфузии в коре головного мозга в большей степени коррелировали с выраженностью атрофии в соответствующих областях, в то время как нарушения перфузии в глубоких отделах лобных долей и в области подкорковых структур – с субкортикальным лейкоареозом теменной локализации и лакунами в белом веществе.
Дисперсионный анализ показал, что наиболее информативными ОФЭКТ–признаками являлись: выраженность нарушений перфузии в медиобазальных отделах височных долей, в теменных долях, в проекции таламусов, базальных ганглиев. В дискриминантной модели самими информативными для дифференциальной диагностики оказались гипоперфузия в медиобазальных отделах височных долей и базальных ганглиев (критерий F=8,87; p<0,001). Диагностическая эффективность полученной модели составила 64,4%.
Результаты ПЭТ с 18F–ФДГ у пациентов с сосудистыми вариантами когнитивных нарушений
У пациентов с постинсультным вариантом во всех случаях определялся один или несколько обширных участков резкого снижения метаболизма, соответствующих зонам структурных изменений. Как правило, по периметру зоны дополнительно определялась область гипометаболизма. При таламическом инфаркте дополнительно наблюдались билатеральный гипометаболизм передних отделов поясной извилины, дорзолатеральной префронтальной коры, а также несколько участков гипометаболизма в теменной коре гомолатерально; при медиобазальной локализации очага – гипометаболизм смежных подкорковых областей, а также диффузный гипометаболизм коры полушарий.
Пациенты с субкортикальным вариантом имели паттерны метаболических нарушений, включающие сочетание множественных асимметричных участков гипометаболизма в подкорковых, корковых областях, поясной извилине, которые можно было охарактеризовать как «пятнистые» или «мозаичные».
Наиболее выраженные нарушения метаболизма определялись в орбитофронтальной коре, в то время как у пациентов с постинсультным вариантом преимущественно в теменной и височной коре (рис.4).
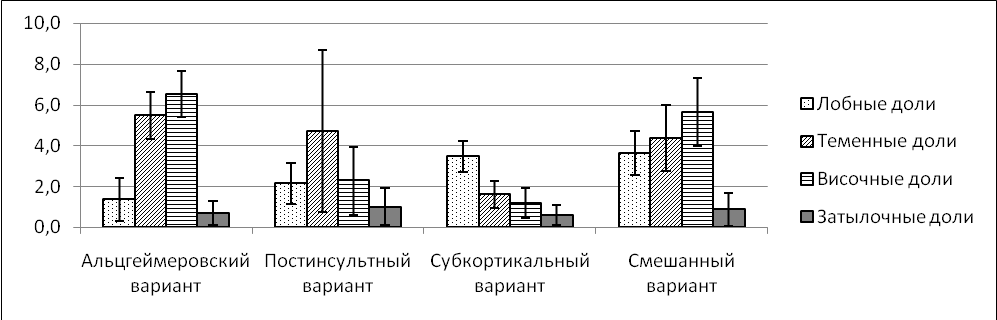
Рис. 4. Средние значения выраженности метаболических нарушений (в баллах) в долях головного мозга при различных вариантах когнитивных нарушений
Нарушения метаболизма в орбитофронтальной коре при субкортикальном варианте, на наш взгляд, носили вторичный характер, вследствие повреждения подкорково–корковых связей, что подтверждалось выраженным нарушением метаболизма в подкорковых структурах – в проекции базальных ганглиев снижение метаболизма составило 3,3+0,5 балла, в проекции таламусов 2,7+0,4 балла. При постинсультном варианте эти же показатели составили соответственно 1,4+0,4 и 1,3+0,5 баллов (p<0,01). Также в пользу феномена разобщения может свидетельствовать снижение метаболизма в передних отделах поясной извилины (1,9+0,3 баллов при субкортикальном варианте и 0,9+0,3 баллов – при постинсультном варианте (p<0,05).
У пациентов с постинсультным вариантом установлены прямые корреляционные связи между выраженностью метаболических нарушений в подкорковых структурах и структурными изменениями ткани головного мозга. Кроме того, нарушения метаболизма в задних отделах поясной извилины коррелировали с выраженностью атрофии в височных долях (=0,88; p<0,01) и с общим показателем конвекситальной атрофии (=0,88; p<0,01). При субкортикальном варианте нарушения метаболизма преимущественно коррелировали с патологическими изменениями белого вещества и выраженностью лакунарного повреждения. Гипометаболизм в височных долях головного мозга имел прямую корреляционную связь с выраженностью перивентрикулярного (=0,52; p<0,05) и субкортикального лейкоареоза (=0,52; p<0,05). Нарушения метаболизма в орбитофронтальной коре были связаны с выраженностью лакунарного повреждения (=0,53; p<0,05).
При субкортикальном варианте снижение метаболизма имело связь с выраженностью когнитивного дефицита, в то время как при постинсультном варианте эта связь прослеживалась в меньшей степени. При субкортикальном варианте отмечалось отчетливое прогрессирование метаболических нарушений в орбитофронтальной и префронтальной коре, базальных ганглиях, таламусах, передних и задних отделах поясной извилины. У пациентов с УКН снижение метаболизма в орбитофронтальной коре составило 2,3+0,7 балла, у пациентов с легкой деменцией 3,9+0,4 балла, у пациентов с умеренной деменцией 4,0+0,7 балла; в проекции базальных ганглиев соответственно 1,3+0,3, 3,9+0,5 (p<0,05) и 4,5+1,0 балла; в проекции таламусов 0,8+0,5, 3,0+0,2 (p<0,001) и 4,0+0,4 балла. При постинсультном варианте ухудшение метаболизма в основном отмечалось в теменной и височной коре, а также в проекции гиппокампов, что могло отражать не столько прогрессирование цереброваскулярного процесса, сколько влияние сопутствующей нейродегенеративной патологии.
Результаты ПЭТ с 18F–ФДГ у пациентов с альцгеймеровским и смешанным вариантами когнитивных нарушений
ПЭТ в диагностике пациентов с когнитивными нарушениями альцгеймеровского типа в целом обладала большей информативностью в сравнении с ОФЭКТ. Паттерн метаболических нарушений при альцгеймеровском варианте был, главным образом, представлен билатеральным снижением метаболизма в теменной и височной коре, в том числе в гиппокампе, или диффузным снижением коркового метаболизма. При смешанном варианте наблюдались: билатеральное снижение метаболизма теменной и височной коры в сочетании с гипометаболизмом лобной коры и множественными мелкоочаговыми асимметричными зонами гипометаболизма в подкорковых отделах, диффузное снижение метаболизма в коре больших полушарий в сочетании с гипометаболизмом в подкорковых образованиях.
Таким образом, общим для всех пациентов с альцгеймеровским и смешанным вариантами было наличие симметричного билатерального гипометаболизма в теменной и височной коре различной степени выраженности, а также выраженное снижение метаболизма в области гиппокампов, что отличало их от пациентов с сосудистыми когнитивными нарушениями. При смешанном варианте имелось снижение метаболизма также в лобной коре, особенно в орбитофронтальных отделах, и в подкорковых образованиях. Гипометаболизм в орбитофронтальной коре составил в среднем 3,6+0,5 балла (при альцгеймеровском варианте – 1,4+0,5 баллов, p<0,01), что даже несколько превышало аналогичный показатель у пациентов с субкортикальным вариантом (3,5+0,4 баллов). Наиболее интересным оказалось снижение метаболизма во всех отделах поясной извилины при смешанном варианте, чего не наблюдалось при других вариантах. Снижение метаболизма в задних отделах составило 3,0+0,3 баллов, в передних отделах – 2,8+0,3 баллов, в средних отделах – 1,9+0,2 баллов (p<0,01 при сравнении с постинсультным и субкортикальным вариантами). Таким образом, комбинированное снижение метаболизма во всех отделах поясной извилины можно использовать в качестве маркера смешанного варианта.
У пациентов с альцгеймеровским вариантом были выявлены связи метаболических нарушений со структурными изменениями, и что особенно важно, с выраженностью лейкоареоза. Гипометаболизм в проекции гиппокампов коррелировал с выраженностью перивентрикулярного (=0,57; p<0,05) и субкортикального лейкоареоза (=0,58; p<0,05); гипометаболизм в задних отделах поясной извилины – с суммарным показателем перивентрикулярного и субкортикального лейкоареоза (=0,69; p<0,01). Метаболические нарушения в коре головного мозга в большей степени коррелировали с выраженностью атрофических изменений. Таким образом, результаты, полученные с помощью ПЭТ, позволили подтвердить влияние сосудистого фактора на течение нейродегенеративного процесса.
Выраженность нарушений метаболизма была выше у пациентов с более тяжелыми когнитивными расстройствами, хотя достоверных различий выявить не удалось. Возможно, это обусловлено тем, что отчетливые нарушения метаболизма появляются уже на ранних этапах формирования когнитивного дефицита. Учитывая данное обстоятельство, можно рассматривать ПЭТ как метод ранней диагностики когнитивных нарушений альцгеймеровского типа. На начальных этапах БА отмечалось снижение метаболизма теменной, височной коры, задних отделов поясной извилины и особенно медиобазальных отделов височных долей. Прогрессирование метаболических нарушений, в основном, наблюдалось в лобной, теменной и височной коре, при менее выраженной отрицательной динамике в других структурах.
При смешанном варианте наблюдалось более равномерное снижение метаболизма на этапе легкой деменции в лобной, теменной и височной коре, медиобазальных отделах височной коры, передних и задних отделах поясной извилины. В дальнейшем прогрессирование гипометаболизма наблюдалось в лобной коре, особенно в префронтальных отделах, височной коре и подкорковых структурах.
Дисперсионный анализ показал, что наиболее информативными ПЭТ–признаками являлись: нарушения метаболизма в области гиппокампов, в височных долях, в проекции таламусов, в теменных долях, в области базальных ганглиев. Самыми информативными для дифференциальной диагностики инциденталами в полученной модели оказались гипометаболизм в области гиппокампов и в области таламусов (критерий F=9,31; p<0,001). Диагностическая эффективность полученной модели составила 78,7%. Одновременное включение в дискриминантный анализ результатов структурной и функциональной нейровизуализации позволило повысить чувствительность модели до 82,6%.
Результаты патоморфологического обследования
У умерших с СД макроскопические изменения артерий были представлены утолщением стенки и значительным расширением их просвета при отсутствии атеросклеротических бляшек. В группе с БА сосуды были тонкими, спадающимися, в их стенках обнаруживались единичные очаги фиброзного уплотнения. При микроскопическом исследовании выделено три варианта церебральной дегенеративно–дилатационной артериопатии. При первом варианте просвет сосуда был значительно расширен, мышечная оболочка была истончена и в некоторых участках фактически отсутствовала. При втором варианте толщина диффузной гиперплазии интимы и мышечной оболочки были примерно равны, просвет сосуда был расширен. В мышечной оболочке имели место дистрофические изменения гладкомышечных клеток. Третий вариант был представлен очаговой гиперплазией соединительной ткани интимы, без дистрофических изменений в участках с атрофией мышечной оболочки. Первый вариант имел место в 4,7% наблюдений при ДЭ и в 38% при БА, второй – соответственно в 20,1 и в 52%, третий – в 75,2 и 10%.
Состояние микроциркуляторного русла различалось в зависимости от нозологии деменции. Более отчетливые изменения наблюдались при цереброваскулярной патологии. Так, при ДЭ в цитоплазме эндотелиоцитов встречались крупные липидные включения, иногда окруженные инвагинациями ядра, имевшего при этом «лопастной» вид. Ядра эндотелиоцитов и перицитов имели типичную структуру кариоплазмы, и только в некоторых из них хроматин был представлен либо узкой плотной полоской вдоль кариолеммы, либо грубыми диффузными гетерохроматиновыми скоплениями в кариоплазме. При СД, кроме того в перицитах выявлялись признаки апоптоза.
Толщина коры по данным посмертной МРТ в контроле составила 4,0±0.06 мм, в группе с деменцией альцгеймеровского типа 2.2±0.05–3.2±0.08 мм, в группе с ДЭ 2.5±0.06– 3.4±0.07 мм. Плотность нейронов в коре в контрольной группе составила 23–25 клеток в поле зрения. При ДЭ число нейронов варьировало в широких пределах от 11,8±0,9 до 39±2,7, при БА – от 13,7+1,1 до 17,9+2,3. При БА основной процент клеток составили нейроны, имевшие характерную структуру ядра и цитоплазмы. Это были клетки с очень крупным светлым, практически прозрачным ядром, занимавшим более половины цитоплазмы, в котором хроматин был четко выражен и образовывал глыбки или полоски (гетерохроматин). Вещество Ниссля в цитоплазме практически не определялось, но обнаруживалось большое количество липофусцина. При электронно–микроскопическом исследовании ядра нейронов имели не совсем типичный рисунок хроматина в кариоплазме, который образовывал крупные гетерохроматиновые скопления, диффузно распределенные по всей кариоплазме. Так как эти нейроны были характерны для умерших с БА, мы их условно обозначили «нейронами деменции альцгеймеровского типа». Морфометрия коры показала, что у умерших с БА нейроны без липофусцина составили 70–82%, а с липофусцином – 11–23%. У умерших с СД эти же нейроны составляли от 17,7 до 47,5% всех клеток. Иммуногистохимическое исследование показало, что эти нейроны дают положительную реакцию с геном онкосупрессором (Р–53), контролирующим состояние ДНК в клетке и запускающим программу клеточной гибели (апоптоза). Кроме того, во многих нейронах на мембране клеток определялись Fas–рецепторы, отвечающие за запуск апоптоза. Также резко положительной была реакция с белком Bcl, который блокирует ген–онкосупрессор Р–53 и тем самым ингибирует процессы апоптоза.
При БА также обнаружены патоморфологические маркеры в виде сенильных бляшек, представленных волокнами –амилоида. Отложения амилоида обнаруживались как в межклеточном пространстве, так и внутри нейронов и были представлены не только сформировавшимися сенильными бляшками, но и диффузными скоплениями амилоидных нитей. Использование окраски на амилоид (Конго–красный) позволило выявить более мелкие бляшки и, кроме того, – отложения амилоида в стенках сосудов и в нейропиле. В некоторых олигодендроцитах коры головного мозга при электронно-микроскопическом исследовании также наблюдались фрагменты будущих как волокнистых, так и диффузных бляшек. У всех умерших с БА обнаружены патологические изменения структуры синапсов.
При микроскопическом исследовании белого вещества были выделены три типа изменений, формирующих МРТ–картину лейкоареоза: 1) очаговые скопления криблюр, расположенные в белом веществе без признаков демиелинизации; 2) диффузная демиелинизация и разрежение нейропиля без микрополостных образований; 3) очаговые скопления криблюр на фоне умеренно выраженной демиелинизации аксонов и разрежения нейропиля.
При электронной микроскопии изменения миелина в областях лейкоареоза также были неоднородными. Наблюдались волокна с «пушистым» (очень рыхлым) миелином, гомогенизация слоев миелина, слипание ламелл, уплотнение липидного слоя. В других миелиновых волокнах были видны крупные липидные капли, являющиеся, скорее всего, конечным продуктом распада миелина. Как правило, имело место сочетание миелинопатии и аксонопатии.
При МР–томографии также можно было выделить более мелкие очаговые изменения белого вещества, в которых при световой микроскопии наблюдалось значительное разрежение нейропиля. Подсчет клеток глии показал, что их количество уменьшалось в два–три раза, также уменьшалось и количество миелиновых волокон. В неизмененном по данным посмертной МРТ белом веществе определялось повышение значений интенсивности МР–сигнала в сравнении с контролем. При микроскопическом изучении было выявлено разрежение нейропиля различной степени выраженности, что в большинстве случаев совпадало с повышением интенсивности МР–сигнала.
При электронно–микроскопическом исследовании у пациентов с СД миелиновые волокна в основной своей массе имели выраженные признаки миелино– и аксонопатии. Миелиновые оболочки были истончены, либо разволокнены и слабо осмиофильны. Аксонопатия проявлялась полной прозрачностью, либо разрежением содержимого осевого цилиндра. Трофические олигодендроциты были, как правило, дистрофически изменены по светлому типу, в некоторых из них ядро было изменено по типу апоптоза, но гораздо чаще картины апоптоза были видны в миелинобразующих олигодендроцитах. При БА миелиновые волокна имели менее выраженные признаки миелино– и аксонопатии по сравнению с цереброваскулярной патологией.
Таким образом, результаты проведенного комплексного исследования свидетельствуют о том, что нозологическая диагностика когнитивных нарушений представляет собой сложный многоэтапный процесс, включающий наряду с оценкой клинических и нейропсихологических особенностей когнитивного дефицита, применение современных методов структурной и функциональной нейровизуализации. Включение в диагностический алгоритм ОФЭКТ и ПЭТ позволяет с более высокой чувствительностью и специфичностью проводить дифференциальный диагноз различных вариантов когнитивных нарушений, в том числе при сочетании сосудистой и нейродегенеративной патологии.
ВЫВОДЫ
- Сосудистые когнитивные нарушения представляют собой гетерогенные расстройства когнитивных функций, отличающиеся по этиологии, патогенезу, клиническим, нейропсихологическим и нейровизуализационным проявлениям. Наличие синдрома когнитивных нарушений различной степени выраженности является облигатным признаком цереброваскулярного заболевания.
- Наиболее значимыми факторами, определяющими выраженность когнитивных нарушений, являются пожилой возраст, низкий уровень образования и наличие патологической изоформы гена АПОЕ. При субкортикальной артериолосклеротической энцефалопатии наличие патологической изоформы гена АПОЕ имеет прямую, статистически значимую корреляционную связь с выраженностью когнитивного дефицита.
- Комплексный подход, включающий наряду с оценкой клинических и нейропсихологических симптомов цереброваскулярного заболевания, изучение структурных и функциональных изменений головного мозга, является наиболее достоверным способом диагностики нозологической принадлежности когнитивных нарушений.
- При использовании клинических и нейропсихологических критериев установления сосудистой этиологии когнитивных нарушений наибольшее значение имеет выявление очаговых симптомов, этиопатогенетически связанных с когнитивным дефицитом, и анализ профиля нейропсихологических нарушений. Выраженность дизрегуляторных и нейродинамических нарушений коррелирует с наличием псевдобульбарного синдрома, диспраксией ходьбы, нейрогенными расстройствами функции тазовых органов.
- Ядро нейропсихологической картины у пациентов с сосудистыми когнитивными расстройствами составляют нейродинамические, дизрегуляторные и зрительно–пространственные нарушения. Ведущим механизмом формирования когнитивных нарушений при основных вариантах цереброваскулярной патологии является механизм «подкорково–коркового разобщения» вследствие структурного и функционального повреждения проекционных связей.
- Наибольшей диагностической значимостью для верификации сосудистого генеза когнитивных нарушений при использовании магнитно–резонансной томографии обладает сочетание перивентрикулярного и субкортикального лейкоареоза, локализованного в лобных и теменных долях, с лакунами в глубинных отделах серого и белого вещества головного мозга и конвекситальной атрофией. Выраженность атрофических изменений связана с нарушением памяти, внимания, глобальным нарушением когнитивных функций. Перивентрикулярный лейкоареоз обуславливает нарушение регуляторных функций, а субкортикальный лейкоареоз и лакуны – нарушение регуляторных функций и памяти. Выраженность перивентрикулярного лейкоареоза имеет значение на начальных стадиях развития когнитивного дефицита, субкортикальный лейкоареоз способствует дальнейшему прогрессированию заболевания.
- Нарушение перфузии в области подкорковых структур при субкортикальной дисциркуляторной энцефалопатии является ранним маркером развития сосудистых когнитивных расстройств, в то время как их прогрессирование обусловлено появлением кортикальных перфузионных нарушений в областях, функционально значимых для обеспечения регуляторной деятельности и общего когнитивного состояния. Маркером когнитивных нарушений альцгеймеровского типа является билатеральное снижение метаболизма в гиппокампах и теменных долях.
- При постинсультных вариантах когнитивных расстройств нарушение перфузии не ограничивается зонами структурного повреждения головного мозга и выявляется как «по соседству» в гомолатеральном полушарии, так и в зонах, удаленных от очагов. При субкортикальном варианте перфузионные нарушения преобладают в области базальных ганглиев, особенно в хвостатых ядрах и таламусах, глубоких отделах лобных долей. Болезнь Альцгеймера характеризуется двухсторонним нарушением перфузии в теменной и височной коре на фоне диффузного снижения кортикальной перфузии. При смешанном варианте когнитивных нарушений, наряду с выраженным снижением перфузии в коре полушарий, преимущественно лобных, теменных и височных долей, выявляются множественные асимметричные зоны гипоперфузии в подкорковых структурах.
- Постинсультные когнитивные нарушения, независимо от локализации очага повреждения, проявляются снижением метаболизма в теменных и височных долях, что отражает наличие сопутствующего нейродегенеративного процесса. Субкортикальная ишемическая энцефалопатия характеризуется мозаичным характером метаболических нарушений с преимущественной локализацией в базальных ганглиях, орбитофронтальной коре, передних отделах поясной извилины. Таламическая деменция проявляется сочетанием локального гипометаболизма, соответствующего локализации структурного повреждения, с нарушением метаболизма в коре лобных и теменных долей. У пациентов с болезнью Альцгеймера определяется билатеральное снижение метаболизма в височных и теменных долях головного мозга, гиппокампах, задних отделах поясной извилины. Смешанный вариант характеризуется равномерным снижением метаболизма в лобной, теменной и височной коре, подкорковых структурах, поясной извилине. Равномерное снижение метаболизма во всех отделах поясной извилины наблюдалось только при смешанном варианте.
- Лейкоареоз, выявляемый по результатам МРТ, при микроскопическом исследовании представлен неоднородными изменениями: скоплением криблюр, диффузной демиелинизацией и разрежением нейропиля, сочетанием первых двух патологий. Наибольшее значение для повышения интенсивности МР–сигнала имеет уменьшение плотности нейропиля, в меньшей степени – количество клеток глии и миелинизация аксонов.
- У умерших с сосудистой деменцией патологические изменения белого вещества были выражены максимально и преобладали над изменениями коры, в то время как при деменции альцгеймеровского типа доминировали признаки нейродегенеративных изменений. При болезни Альцгеймера почти 90% всего клеточного пула составляли нейроны с признаками апоптоза, с крупным, практически прозрачным ядром, занимавшим более половины цитоплазмы. У умерших с сосудистой деменцией такие нейроны составляли от 17,7 до 47,5% всех клеток. Отложения амилоида обнаруживались как в межклеточном пространстве, так и внутри нейронов и были представлены не только сформировавшимися сенильными бляшками, но и диффузными скоплениями амилоидных нитей. В большинстве случаев обнаружена комбинация нейродегенеративных и сосудистых изменений.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Алгоритм обследования пациентов с цереброваскулярной болезнью должен включать определение генотипа АПОЕ. Пациенты с наличием патологической изоформы АПОЕ должны находиться под динамическим наблюдением с проведением нейропсихологического тестирования не реже 2 раз в год.
- При установлении субкортикального варианта сосудистых когнитивных нарушений следует обращать внимание на наличие следующих неврологических синдромов: псевдобульбарного, диспраксии ходьбы, нейрогенных расстройств функции тазовых органов.
- Нейропсихологическое тестирование необходимо проводить всем пациентам с цереброваскулярной болезнью. Минимальный набор нейропсихологических тестов должен включать КШОПС, тест «5 слов», тест вербальных ассоциаций, тест рисования часов, тест повторения цифр в прямом и обратном порядке и тест «слежения».
- При отсутствии структурных изменений по данным КТ или МРТ, способных объяснить генез когнитивных нарушений, необходимо выполнение однофотонной эмиссионной компьютерной томографии и/или позитронной эмиссионной томографии.
- Выполнение ОФЭКТ показано пациентам с признаками цереброваскулярного заболевания и дизрегуляторным типом когнитивных нарушений. При отсутствии цереброваскулярной патологии и наличии преимущественно первичных нарушений памяти следует выполнять ПЭТ с фтор18–дезоксиглюкозой.
- Коррекция когнитивных нарушений сосудистого генеза должна проводиться с учетом особенностей выявленных структурно-функциональных изменений и включать нейротрофические, холинергические и глутаматергические препараты.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Всего опубликовано 70 работ, из них наиболее значимые:
1. Лобзин В.Ю. Сосудистая деменция / В.Ю. Лобзин, М.М. Одинак, А.Ю. Емелин // Вестн. Рос. Воен. – мед. акад. – 2004. – № 1 (11). – С. 120–124.
2. Одинак М.М. Открытое сравнительное исследование эффективности мемантина в терапии посттравматических когнитивных расстройств / М.М. Одинак, И.В. Литвиненко, А.Ю. Емелин // Неврол. журн. – 2005. – Т. 10, № 6. – С. 32–38.
3. Емелин А.Ю. Оценка мозговой перфузии с помощью однофотонной эмиссионной компьютерной томографии (ОФЭКТ) у пациентов с сосудистой деменцией / А.Ю. Емелин, В.В. Дремов, В.С. Декан, В.Ю. Лобзин // IX Всерос. съезд неврологов. – Ярославль, 2006. – С.63.
4. Одинак М.М. Нарушение когнитивных функций при цереброваскулярной патологии / М.М. Одинак, А.Ю. Емелин, В.Ю. Лобзин. – СПб. : ВМедА, 2006. – 158 с.
5. Одинак М.М. Опыт применения Танакана в терапии умеренных когнитивных расстройств / М.М. Одинак, А.Ю. Емелин // Рус. мед. журн. – 2006. – Т.14, № 23. – С. 1681–1686.
6. Одинак М.М. Функциональная нейровизуализация в диагностике деменций / М.М. Одинак, А.Ю. Емелин, А.В. Поздняков, Л.А. Тютин, Г.Е. Труфанов, В.А. Фокин, В.В. Декан, В.Ю. Лобзин // Вестн. Рос. Воен. – мед. акад. – 2006. – № 1(15). – С. 101–110.
7. Яхно Н.Н. Танакан (EGb 761) в терапии умеренных когнитивных нарушений (мультицентровое исследование) / Н.Н. Яхно, В.В. Захаров, А.Б. Локшина, С.И. Гаврилова, Я.Б. Федорова, А.В. Густов, Ю.А. Коршунова, Л.А. Дзяк, Е.В. Мизякина, М.М. Одинак, А.Ю. Емелин, П.И. Пилипенко, Е.В. Вострикова // Журн. неврологии и психиатрии. – 2006. – Т. 106, № 12. – С. 41–46.
8. [Декан В.С.] Dekan V. Dynamic encephaloscintigraphy and rCBF brain SPECT in determination of blood flow abnormalities in patients with multiple infarct dementia (MID) / [В.С. Декан, А.Ю. Емелин, В.Ю. Лобзин, В.А. Фокин, Г.Е. Труфанов] V. Dekan, A. Emelin, V. Lobzin, V. Fokin, G. Trufanov // Eur. J. Nucl. Med. Mol. Imaging. – 2006. – Vol. 33, supl. 2. – P. S296, P. 348.
9. Емелин А.Ю. Аффективные расстройства у пациентов с сосудистыми когнитивными нарушениями // Всерос. Юбил. науч. – практ. конф. «Актуальные проблемы психиатрии и неврологии»: Материалы. – СПб., 2007. – С. 189.
10. Емелин А.Ю. Клинические проявления и диагностика когнитивных нарушений при дисциркуляторной энцефалопатии / А.Ю. Емелин, В.В. Флуд, Е.М. Бухмиллер // Вестн. психотерапии. – 2007. – № 24 (29). – С. 73–81.
11. Емелин А.Ю. Структура синдрома умеренных когнитивных нарушений / А.Ю. Емелин, В.Ю. Лобзин, В.В. Дремов // Вестн. Рос. Воен.– мед. акад. Прил. –2007. – № 1(17), ч. 1. – С. 377.
12. Литвиненко И.В. Эффективность и безопасность применения галантамина (реминила) в случаях деменции при болезни Паркинсона (открытое контролируемое исследование) / И.В. Литвиненко, М.М. Одинак, В.И. Могильная, А.Ю. Емелин // Журн. неврологии и психиатрии. – 2007. – Т. 107, № 12. – С. 25–33.
13. Емелин А.Ю. [Опыт применения акатинола в лечении болезни Бинсвангера] // Социал. и клинич. психиатрия. – 2007. – Т. 17, вып. 4. – С. 64-65.
14. Гайкова О.Н. Сравнительная характеристика состояния сосудов артериального круга большого мозга у умерших с клиническими диагнозами сосудистая деменция и дисциркуляторная энцефалопатия / О.Н. Гайкова, А.Ю. Емелин, Д.М. Морозов, Н.Н. Ананьева // Пароксизмальный мозг. Мультидисциплинарный подход к проблеме: избр. тр.: материалы конгр. с междунар. участием. – СПб., 2008. – Разд. 2. – С. 98–99.
15. Гаврилова С.И. Терапевтический потенциал церебролизина в превентивной терапии болезни Альцгеймера / С.И. Гаврилова, Я.Б. Федорова, И.В. Колыхалов, М.М. Одинак, А.Ю. Емелин, А.В. Кашин, Н.Д. Селезнева, Я.Б. Калын, И.Ф. Рощина // Журн. неврологии и психиатрии. – 2008. – Т. 108, № 8. – С. 24–28.
16. Одинак М.М. Танакан в лечении сосудистых умеренных когнитивных нарушений / М.М. Одинак, А.Ю. Емелин // Рус. мед. журн. – 2008. – Т. 16, № 6. – С. 372–374.
17. Одинак М.М. Ультразвуковая диагностика нарушений церебральной гемодинамики у больных сосудистой деменцией / М.М. Одинак, В.Ю. Лобзин, А.Ю. Емелин, Н.А. Лупина // Мед. акад. журн. – 2008. – Т. 8, № 4. – С. 115–122.
18. [Литвиненко И.В.] Litvinenko I. Efficacy and safety of galantamine (reminyl) for dementia in patients with Parkinson's disease (an open controlled trial) / [И.В. Литвиненко, М.М. Одинак, В.И. Могильная, А.Ю. Емелин] I. Litvinenko, M. Odinak, V. Mogil'naya, A. Emelin // Neurosci. Behav. Physiol. – 2008. –Vol. 38, № 9. – P. 937–945.
19. Емелин А.Ю. Особенности клинической диагностики посттравматических когнитивных нарушений / А.Ю. Емелин, С.В. Воробьев, А.П. Коваленко // Мед. –биол. и соц.–психол. пробл. безопасности в чрезв. ситуациях. – 2009. – № 5. – С.1 5–17.
20. Емелин А.Ю. Влияние генотипа аполипопротеина Е на состояние когнитивных функций у пациентов с болезнью Альцгеймера / А.Ю. Емелин, А.В. Кашин, О.С. Глотов, В.Ю. Лобзин // Вестн. Рос. Воен. – мед. акад. Прил. – 2009. – № 1(25), ч. 2. – С. 439–440.
21. Емелин А.Ю. Функциональная нейровизуализация при таламической деменции / А.Ю. Емелин, В.Ю. Лобзин, С.В. Воробьев, А.В. Кашин // Вестн. Рос. Воен. – мед. акад. Прил. – 2009. – № 1(25), ч. 2. – С. 440.
22. Нарушения когнитивных функций // Андреева Г.О. Частная неврология / Г.О. Андреева, С.Н. Базилевич, Г.Н. Бисага … А.Ю. Емелин и др. – М., 2009. – Гл. 23. – С. 547–557.
23. Одинак М.М. Когнитивные расстройства при цереброваскулярных заболеваниях / М.М. Одинак, А.Ю. Емелин, В.Ю. Лобзин // Доктор. Ру. – 2009. – № 4(47). – С. 7–12.
24. Одинак М.М. Нарушение когнитивных функций при сосудистых поражениях головного мозга в практике военного невролога / М.М. Одинак, А.Ю. Емелин, П.А. Коваленко, В.Ю. Лобзин // Воен.–мед. журн. – 2009. – Т. 330, № 4. – С. 32–40.
25. Одинак М.М. Современные возможности нейровизуализации в диагностике деменций / М.М. Одинак, А.Ю. Емелин, В.С. Декан, В.Ю. Лобзин // Психиатрия. – 2009. – № 1(37). – С. 57–61.
26. Одинак М.М. Терапия сосудистых когнитивных расстройств / М.М. Одинак, А.Ю. Емелин, В.Ю. Лобзин, Ю.А. Колчева // Рус. мед. журн. – 2009. – Т.17, № 20. – С. 1295–1297.
27. Одинак М.М. Позитронная эмиссионная томография / М.М. Одинак, А.Ю. Емелин, А.Г. Труфанов // Неврология: нац. рук. / гл. ред. Е.И.Гусев и др. – М.: ГЭОТАР–Медиа, 2009. – Гл. 5. – С. 167–171.
28. Гаврилова С.И. Возможности превентивной терапии болезни Альцгеймера: результаты 3–летнего проспективного открытого сравнительного исследования эффективности и безопасности курсовой терапии церебролизином и кавинтоном у пожилых пациентов с синдромом мягкого когнитивного снижения / С.И. Гаврилова, Н.Д. Селезнева, А.В. Густов, М.М. Одинак, А.Ю. Емелин, И.Ф. Рощина, Я.Б. Калын, И.В. Колыхалов, Т.А. Давыдова, А.В. Кашин, Ю.А. Коршунова, Е.А. Антипенко, Г. Месслер, Я.Б. Федорова // Журн. неврологии и психиатрии. – 2010. – Т. 110, № 1. – С. 62–69.
29. Емелин А.Ю. Сосудистая деменция: диагностика, профилактика, лечение // Материалы 8–й Межрегион. с междунар. участием науч.–практ. конф. «Актуальные вопросы неврологии». – Новосибирск, 2010. – С.60–61.
30. Емелин А.Ю. Структурная нейровизуализация в дифференциальной диагностике сосудистых когнитивных нарушений // Вестн. Рос. Воен. – мед. акад. – 2010. – № 3 (31). – С. 97–102.
СПИСОК СОКРАЩЕНИЙ
АПОЕ – аполипопротеин Е
БА – болезнь Альцгеймера
БЛТ – батарея лобных тестов
ГБ – гипертоническая болезнь
ГМПАО – гексаметилпропиленаминоксим
ДЭ – дисциркуляторная энцефалопатия
ИБС – ишемическая болезнь сердца
КТ – компьютерная томография
КШОПС – краткая шкала оценки психического статуса
МРТ – магнитно–резонансная томография
ОФЭКТ – однофотонная эмиссионная компьютерная томография
ПЭТ – позитронная эмиссионная томография
РФП – радиофармпрепарат
СД – сосудистая деменция
ТРЧ – тест рисования часов
УКН – умеренные когнитивные нарушения
ШДМ – шкала деменции Матисса
CDR – Clinical Dementia Rating (клиническая рейтинговая шкала деменции
F18–ФДГ – фтор–восемнадцать флюородезоксиглюкоза
GDS – Global Deterioration Scale (шкала общих нарушений когнитивных функций)

