Патогенетические механизмы формирования наружного генитального эндометриоза и его стадий у пациенток репродуктивного возраста
На правах рукописи
ЕРМОЛОВА НАТАЛЬЯ ВИКТОРОВНА
ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ НАРУЖНОГО ГЕНИТАЛЬНОГО ЭНДОМЕТРИОЗА И ЕГО СТАДИЙ У ПАЦИЕНТОК РЕПРОДУКТИВНОГО ВОЗРАСТА
14.00.01- акушерство и гинекология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Ростов-на-Дону
2009
Работа выполнена в Федеральном государственном учреждении «Ростовский научно-исследовательский институт акушерства и педиатрии Федерального агентства по высокотехнологичной медицинской помощи».
Научный консультант:
доктор медицинских наук, профессор,
Заслуженный деятель науки РФ
Орлов Владимир Иванович
Официальные оппоненты:
доктор медицинских наук, профессор
Михельсон Александр Феликсович
доктор медицинских наук, профессор
Жаркин Николай Александрович
доктор медицинских наук, профессор
Аксененко Виктор Алексеевич
Ведущая организация:
ГОУ ВПО Кубанский государственный медицинский университет
Защита состоится « » 2009 г. в часов на заседании диссертационного совета Д 208.082.05 при ГОУ ВПО Ростовском государственном медицинском университете (344022, г.Ростов-на-Дону, пер. Нахичеванский 29).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Ростовского государственного медицинского университета.
Автореферат разослан « » 2009 г.
| Ученый секретарь диссертационного совета, доцент | В.А.Шовкун |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Эндометриоз – одно из самых многоликих и загадочных заболеваний, которое встречается у 7-50% всех женщин и нередко сопровождается выраженным болевым синдромом, является одной из частых причин бесплодия (Б.И.Железнов и соавт., 1985; В.П.Баскаков и соавт., 1990; Л.В.Адамян и соавт., 2006; G.B.Melis et al., 1995; B.Lassey, 2000; I.Brosens et al., 2002; R.Teirney et al., 2002). Это гормонозависимое заболевание, развивающееся на фоне нарушения иммунного гомеостаза, сущность которого заключается в доброкачественном разрастании за пределами полости матки ткани, по морфологическим и функциональным свойствам подобной эндометрию (В.П.Баскаков, 1990; А.Н.Стрижаков, А.И.Давыдов, 1996; Л.В.Адамян и соавт., 1998; А.Л.Тихомиров и соавт., 2006; М.А.Данилова и соавт., 2008; L.Giuduce, 2004). Эндометриоз является прогрессирующим, рецидивирующим заболеванием, что во многом обусловлено ежемесячной ретроградной менструацией. Несмотря на многочисленные исследования, этиология и патогенез заболевания продолжают оставаться предметом споров и научных дискуссий (В.А.Бурлев и соавт., 2008; Л.В.Адамян и соавт., 2009; М.Bruhat et al., 1987).
В соответствии с современной концепцией о природе генитального эндометриоза, в патогенезе заболевания рассматривается участие разнообразных факторов: наследственность, феномен ретроградной менструации, целомическая метаплазия, дефекты клеточного и гуморального иммунитета, роль избыточной экспрессии энзима ароматазы и развитие в связи с этим феномена локальной гипергормонемии, ауто – и паракринные влияния (факторы роста), оксидативный стресс, ятрогенные влияния, воздействие токсикантов внешней среды.
В настоящее время предпринимаются попытки рассматривать эндометриоз с новых позиций. Уточняется характер нарушений функции системы гипоталамус – гипофиз – яичники, изучается возможная роль иммунных нарушений, генетических факторов и онкоантигенов в развитии этого заболевания (И.И.Куценко, 1995; В.И.Кулаков, 2003).
В связи с широким внедрением лапароскопии в гинекологическую практику представилась возможность визуального изучения наружного генитального эндометриоза (НГЭ) (И.Б.Манухин, М.А.Геворкян и соавт., 2002). НГЭ диагностируется у 44,3% пациенток. Среди всех локализаций, характеризующих проявления эндометриоза, поражение яичников занимает второе место и первое при НГЭ (32%- 65,4%) (В.П.Баскаков и соавт., 2002; Р.Г.Гатаулина, 2003).
Установлено, что 30-40% больных эндометриозом женщин страдают бесплодием, а у 6-25% женщин с бесплодием выявляется эндометриоз (Л.В.Адамян, 1997; В.П.Баскаков и соавт., 2006). Несмотря на многочисленные исследования все ещё не уточнены причинно-следственные взаимоотношения эндометриоза и бесплодия.
Y.Taketani (1989), P.R.Koninckx (1998), D.S.Oosterlynck et al. (1996; 1999) обнаружено, что у пациенток с эндометриозом, страдающих бесплодием, в обе фазы менструального цикла объем перитонеальной жидкости больше, чем у женщин, страдающих бесплодием без эндометриоза. При этом ПЖ является средой, где происходит окончательное созревание ооцита, она играет роль своеобразного динамического депо половых гормонов, и имеет важное значение в обеспечении функционирования эндометриоидных гетеротопий (E.Confino, L.Harlow, 1990; E.Orol et al., 1996; P.K.Koninckx, 1996; W.Kupker et al., 1998; C.Bruse, A.Bergqvist, 1998). Остается недостаточно ясным значение гормональных параметров ПЖ в имплантации желез эндометрия. Иммунологические показатели ПЖ противоречивы и нередко отражают следствие, а не причину заболевания.
В ряде исследований показано, что на развитие заболевания значительное влияние могут оказывать генетические факторы (H.Baranova et al., 1997; Л.В.Адамян и соавт., 1998; В.С.Баранов и соавт., 2000). В последние десятилетия выдвигаются гипотезы о влиянии неблагоприятной экологической обстановки на распространение эндометриоза (Э.К.Айламазян и соавт., 2007; А.И.Ищенко и соавт., 2007; W.G.Foster et al., 2002; S.Rier et al., 2003). Одним из факторов, увеличивающим риск заболевания генитальным эндометриозом, является наследственность (Э.К.Айламазян и соавт., 2007). НГЭ характеризуется преимущественно аутосомно-доминантным типом наследования (В.С.Баранов и соавт., 2004).
Сегодня уже можно считать доказанной гипотезу о том, что эндометрий (особенно функциональный слой) у женщин с эндометриозом имеет повышенную способность к пролиферации, имплантации и росту в брюшной полости, что, очевидно, связано с возрастающим ангиогенезом в эутопическом эндометрии (Г.А.Савицкий и соавт., 1997; 1999; I.M.Mattaliotakis et al., 2003). Очаги НГЭ являются производными функционального слоя эндометрия, сосуды которого изменяются под воздействием стероидных гормонов и крайне чувствительны к изменению концентраций факторов роста (Г.Е.Чернуха, 2000; S.K.Smith, 1998).
А.И.Ищенко, Е.А.Кудрина (2002) полагают, что одним из факторов развития НГЭ является нарушение баланса между процессами пролиферации и апоптоза, инициирующие автономный рост патологического субстрата. Представляется актуальным поиск новых антиапоптотических и апоптотических маркеров НГЭ.
Одним из регуляторов апоптоза, действующим на уровне целостного организма, являются гормоны. Реализация функции гормонов на клеточном уровне осуществляется через вовлечение множества полипептидных ростовых факторов, среди которых особая роль отводится лимфогемопоэтическим цитокинам, продуцируемым иммунокомпетентными клетками (V.Machelon et al., 1997; L.Al-Harhi et al., 2000; S.R.Bornstein et al., 2004).
Абсолютная или относительная гиперэстрогения по мнению В.И.Краснопольского и соавт., (1994), Е.И.Абашовой (1999), G.M.B.Louis, J.M.Weiner et al., (2004) является одним из основных факторов, способствующих развитию эндометриоза, особенно на фоне измененной рецепторной функции эндометрия. Эстрогены (эстрадиол) являются медиаторами факторов роста и оказывают стимулирующее действие на их синтез (К.В. Войташевский и соавт., 2004; Н.И.Кондриков и соавт., 2004).
Ряд авторов S.E.Bulun, K.Zeitoun et al. (1999), J.Kitowaki (2002) обнаружили чрезмерную выработку ароматазы в эндометриоидных гетеротопиях, в то время как другие такого факта не наблюдали (A.D.Ebert, G.Bartley, 2003). Имеются сведения о роли факторов роста, в частности, ТФР в индукции гена ароматазы и об ауто-паракринной регуляции образования эстрогенов эндометриоидными клетками (A.Tada, H.Sasaki et al., 1993; L.Noble, E.R.Simpson, 1996). В то же время установлено, что лептин является антагонистом стимулирующего эффекта ТФР на ФСГ-зависимую продукцию эстрогенов через Р450 ароматазу (R.J.Zachow et al., 1999). Однако, при отсутствии секреции лептина ставится под угрозу реализация репродуктивной функции за счет резкого ослабления процессов фолликулогенеза, ранней атрезии фолликулов и активации апоптотических процессов (M.L.Hamm et al., 2004; I.S.Farooqi et al., 2007). Изучение эффектов действия лептина на функцию яичников показало, что возможны как стимуляция, так и подавление им стероидогенеза (M.Matarese, S.Moschos, 2005).
В научной литературе подчеркивается особое значение СЭФР, являющегося важнейшим регулятором нормального ангиогенеза и патологической неоваскуляризации (J.L.Shifren et al., 1996; L.P.Reynolds et al., 2002), а также ЭФР как возможных активаторов пролиферативных процессов фибробластов и эпителиальных клеток и влияние последнего на развитие спаек (Н.Ю.Сотникова и соавт., 2001; А.И.Ищенко и соавт., 2002).
В последние годы большое внимание уделяется роли цитокинов в патогенезе перитонеального эндометриоза. Имеются данные о повышении уровней ФНО-, ИЛ-1, ИЛ-6 и ИЛ-8 в ПЖ больных эндометриозом (С.А.Сельков, М.И.Ярмолинская и соавт., K.N.Khau et al., 2005). В ПЖ при эндометриозе экспрессия молекул адгезии значительно превышала показатели контрольной группы, тогда как между степенью эндометриоза и уровнем молекул адгезии корреляции не было найдено (М.М.Сонова и соавт., 2008). Взаимодействие FAS (CD95)-FASL является главным источником сигналов к апоптозу активированных периферических Т-лимфоцитов (P.H.Krammer, 1999). Q.Chen, T.Yano et al. (2005) выявили подавление оксидом азота FASL – зависимого апоптоза с последующей атрезией фолликулов.
О важности участия свободных радикалов, в том числе NO-, в патогенезе различных нарушений репродуктивной функции, а также при генитальном эндометриозе, сообщают ряд исследователей (Dong M. et al., 2001; Polak G. et al., 2001; Osborn B.H. et al., 2002; Szczepanska M. et al., 2003; Wu Y. et al., 2003; Kim K.H. et al., 2004; Kao S.H. et al., 2005).
Окислительный стресс, сопровождаясь выбросом провоспалительных факторов, приводит к ограниченной воспалительной реакции, в результате чего повышается концентрация цитокинов, факторов роста и других биологически активных субстанций ( Адамян Л.В. и соавт., 2008; Liu Y. et al., 2001; Polak G et al., 2001; Jackson L.W. et al., 2005). С другой стороны, свободные радикалы активируют арилкарбоновые рецепторы эндометрия, которые вызывают активацию фермента ароматазы в цитохроме Р450, что индуцирует локальную гиперэстрогенемию (Адамян Л.В. и соавт., 2008; 2009).
Одной из наиболее дискутируемых проблем в современной гинекологии является персистенция эндометриоза после гормонального лечения. Наблюдается толерантность к действию гормональных препаратов, обусловленная снижением и изменением чувствительности рецепторов гормонов в эндометриоидных очагах. Отсутствие признанных однозначно научным сообществом механизмов развития эндометриоза не позволяет добиться эффективности его лечения.
Имеются лишь фрагментарные сведения о молекулярно-биологических особенностях процессов неоангиогенеза и экспрессии факторов роста, отражающих ремоделирование стромы гетеротопий, а также – о взаимосвязи изменений на системном уровне (состояние гипоталамо-гипофизарной системы) и местном (гормональной функции яичников).
Данные литературы, касающиеся механизма формирования НГЭ, немногочисленны и порой противоречивы, что диктует необходимость дальнейшего изучения этой проблемы. Многочисленные исследования в области генетики, эндокринологии, иммунологии, морфологии эндометриоза пока не позволяют обосновать кардинально новые подходы к диагностике, лечению и мониторингу заболевания.
Цель исследования
Выявление особенностей ангиогенеза с позиций аутопаракринной клеточной регуляции и уточнение механизмов формирования наружного генитального эндометриоза и его стадий у пациенток репродуктивного возраста.
Основные задачи исследования
1. Изучить частоту и структуру, клинические аспекты наружного генитального эндометриоза у пациенток репродуктивного возраста.
2. Изучить морфофункциональные характеристики эндометриоидных гетеротопий.
3. Исследовать характер влияния уровня факторов роста: ЭФР, СЭФР-А и их рецепторов, ТФР-1, оФРФ, ИФР-1 в сыворотке крови и ПЖ на механизмы развития наружного генитального эндометриоза и его стадий.
4. Определить в сыворотке крови и ПЖ содержание гормонов: ЛГ, ФСГ, ПРЛ, ТТГ, Т3, Т4, лептина, активина, прогестерона, тестостерона, эстрадиола и индукцию гена фермента их взаимодействия (тестостерона и эстрадиола) – ароматазы и генов детоксикации.
5. Проанализировать содержание цитокинов: ИЛ-1, ИЛ-6, ИЛ - 8, ИЛ-10, ФНО- и компонентов межклеточного матрикса (ММП-9, sVCAM1, sFASL) в сыворотке крови и ПЖ для уточнения их роли в формировании НГЭ.
6. Установить значение вазоактивных соединений: эндотелина-1, оксида азота, NO-синтазы в патогенезе НГЭ на системном и локальном уровнях.
7. Изучить характер влияния апоптотических и антиапоптотических соединений: ФНО-, sFasL, оксида азота, СЭФР-А-R на формирование эндометриоидных гетеротопий.
8. Определить антитела к кардиолипину, антиовариальные антитела, опухолевоассоциированный антиген СА-125 с целью исключения аутоиммунного и неопластического процесса.
9. Выработать объективные критерии диагностики НГЭ и его стадий.
Научная новизна работы
Впервые на базе репрезентативного комплекса лабораторных исследований, проведённых в аспекте изучения факторов роста, вазоактивных соединений, интерлейкинов, компонентов межклеточного матрикса, участвующих в регуляции клеточных процессов в организме здоровой женщины и при наружном генитальном эндометриозе, установлены принципиально новые закономерности в нарушении биохимических механизмов клеточной регуляции пролиферативных процессов, обусловливающих формирование наружного генитального эндометриоза. При этом, впервые выявлены специфические изменения продукции факторов роста и интерлейкинов на системном и местном уровнях при различных стадиях развития данного заболевания и общие закономерности, свойственные каждому периоду течения НГЭ. Доказано, что тяжесть клинического течения заболевания зависит от ранее перенесённых оперативных вмешательств, ИППП, ВЗОМТ и экстрагениатльной патологии, а III-IV стадии патологического процесса коррелируют с распространенностью эндометриоза в малом тазу. Принципиально новым явилось – установление особенностей, характерных для ранней стадии НГЭ в виде формирования на системном уровне ангиогенного потенциала из оФРФ, ИФР-1 и факторов ангиогенной защиты: ИЛ-10, СЭФР-А-R. Обнаружен ранее неизвестный механизм формирования эндометриоидных гетеротопий, заключающийся в сочетанном действии ангиогенного, антиапоптотического фактора - ИЛ-8 и молекул адгезии cVCAM1, обеспечивающих клеткам эндометрия, находящимся в перитонеальной жидкости, адгезию на органах малого таза. Впервые выявлены и проанализированы в сравнительном аспекте особенности изменений содержания факторов роста, интерлейкинов, вазоактивных соединений (эндотелина-1 и оксида азота) и соотношений белковых и стероидных гормонов на системном и местном уровнях в зависимости от стадий наружного генитального эндомтериоза. При этом также впервые установлен принципиально новый механизм формирования наружного генитального эндометриоза с участием лептина и выявлена его роль в бесплодии. Доказано участие гипоксии в активации неоангиогенеза в очагах НГЭ и выявлен механизм её развития.
Теоретическое и практическое значение работы
Проведенное исследование углубляет наши представления о молекулярно-биохимических механизмах формирования наружного генитального эндометриоза - одного из наиболее распространённых заболеваний женщин репродуктивного возраста. Установлены определённые закономерности, лежащие в основе повреждения процессов внутри- и межклеточной регуляции ангиогенеза и как следствие активация роста кровеносных сосудов, усиливающая рост эндометриоидных гетеротопий. Полученные в работе данные обосновывают механизмы возникновения бесплодия и предпосылки для её коррекции. Выявленные особенности метаболических дефектов на системном уровне при различных стадиях наружного генитального эндометриоза позволили научно обосновать и разработать принципиально новые способы неинвазивной диагностики этих состояний.
По результатам исследования внедрены информативные критерии для диагностики наличия НГЭ (коэффициент ЭФР/оФРФ); I-II стадии - повышение в сывортке крови оФРФ в 2 раза; III-IV стадий – повышение в сыворотке крови уровня ЭФР в 2 раза, рецидивирования НГЭ - повышение уровня СЭФР-А в 5 раз.
Положения, выносимые на защиту
1. При наружном генитальном эндометриозе на системном уровне происходят значительные изменения продукции компонентов внутри - и межклеточной регуляции: характерной чертой их спектра является высокий уровень ЭФР, оФРФ, ИФР-1, обладающих выраженной митогенной, пролиферативной и ангиогенной активностью, и низкий - лептина, контролирующего альтернативные пути синтеза эстрогенов и изменяющего их соотношение при нормальной экспрессии CYP19. На местном уровне наблюдается увеличение соотношений апоптотических и антиапоптотических, ангиогенных и антиангиогенных факторов, обеспечивающих адгезию эндометриоидных клеток на органах брюшной полости и рост гетеротопий.
2. Ранние стадии наружного генитального эндометриоза на системном уровне сопровождаются усилением продукции не только ангиогенных факторов оФРФ, ИФР-1, но и антиангиогенных – ИЛ-10 и растворимого СЭФР-А-R, со сдвигом в сторону увеличения антиангиогенных факторов, обеспечивающих антиангиогенную метаболическую защиту. Особенно значимые биохимические изменения, происходящие на местном уровне, формирование эндометриоидных гетеротопий, достигается полифункциональным ИЛ-8 и молекулами адгезии сVCAM1.
3. Cпецифические особенности, выявленных изменений аутопаракринной клеточной регуляции ангиогенеза, при III-IV стадиях наружного генитального эндометриоза, обусловливаются участием большего количества ангиогенных факторов относительно I-II стадий наружного генитального эндометриоза. В перитонеальной жидкости имеет место смена ангиогенных факторов – относительно I-II стадий, рост которых обусловливает локальную гипоксию, способствующую инициации развития новых гетеротопий.
4. Высокая продукция факторов роста на системном уровне при рецидивировании наружного генитального эндометриоза характеризуется дополнительным механизмом паракринного воздействия СЭФР-А, усиливающего своеобразный ангиогенный потенциал, возобновляющий имплантацию эутопического эндометрия при ретроградном попадании его в брюшную полость. На местном уровне особенно значимое увеличение генерации оксида азота, усиливает кислородный дефицит, инициирующий развитие новых гетеротопий.
Апробация работы
Основные положения работы представлены на ученом совете и проблемной комиссии ФГУ Ростовский НИИ акушерства и педиатрии Росмедтехнологий, - Съезде акушеров – гинекологов Южного федерального округа (г. Ростов - на – Дону 2005г.); - VII, VIII, IX Всероссийском форуме «Мать и дитя» (Москва) в 2005,2006,2007 гг.; - Международном конгрессе «Практическая гинекология: от новых возможностей к новой стратегии» (Москва 2006 г.); - Научной конференции с международным участием «Новейшие технологические решения и оборудование» «Гомеостаз и инфекционный процесс» (г. Москва 2006 г.); - V и VI Международных конференциях «Обмен веществ при адаптации и повреждении» (г. Ростов-на-Дону 2006, 2007 гг.); - XVI международной конференции Российской ассоциации Репродукции Человека «Вспомогательные репродуктивные технологии сегодня и завтра» (г. Ростов - на - Дону 2006г.); - V Всероссийском конгрессе эндокринологов «Высокие медицинские технологии в эндокринологии» (г. Москва 2006г.); - III Всероссийской научно-практической конференции «Актуальные вопросы диагностики и лечения метаболического синдрома» (г. Москва 2006г.); - Первого регионального научного форума «Мать и дитя» (г. Казань 2007г.); - Конференции с международным участием «Современные технологии в диагностике и лечении гинекологических заболеваний» (г. Москва 2007г.); - XVII международной конференции Российской ассоциации Репродукции Человека «Репродуктивные технологии сегодня и завтра» (г. Казань 2007г.); - Республиканской научно-практической конференции «Инновационные технологии в охране репродуктивного здоровья женщины» (г. Екатеринбург 2007г.); - Второго международного конгресса по репродуктивной медицине «Репродуктивное здоровье семьи» (г. Москва 2008 г.); - IV съезде акушеров – гинекологов России (г. Москва 2008 г.); - Международной научно-практической конференции «Репродуктивное здоровье населения Урала и Сибири» (г. Екатеринбург 2008 г.); - XVIII ежегодной международной конференции Российской ассоциации Репродукции Человека «Репродуктивные технологии сегодня и завтра» (г. Самара 2008 г.); - III международного конгресса по репродуктивной медицине 2009 г. (г. Москва 2009 г.).
Внедрение результатов работы в практику
Полученные результаты внедрены в практику работы гинекологического отделения МЛПУЗ 8 городской больницы г. Ростова – на - Дону, гинекологического отделения ФГУ «РНИИАП Росмедтехнологий», отделения гинекологии НУЗ «Дорожная клиническая больница» на станции Ростов – главный ОАО РЖД.
Материалы диссертации используются при проведении ежегодных семинаров по актуальным вопросам акушерства и гинекологии ЮФО, семинаров для аспирантов и ординаторов кафедр медуниверситета, а также лекций для практических врачей.
Публикации
По материалам диссертации опубликовано 32 научных работ, 8 из них в ведущих рецензируемых изданиях, рекомендованных ВАК, получена приоритетная справка на патент.
Структура и объем работы
Диссертация изложена в традиционной форме. Состоит из введения, обзора литературы, глав, посвященных собственным исследованиям и обсуждения полученных результатов, заключения, выводов, практических рекомендаций и списка литературы. Работа представлена на 250 страницах машинописного текста, иллюстрирована 12 рисунками и 77 таблицами, 6 приложениями. Библиографический указатель включает 134 работы на русском языке и 334 - на иностранных языках.
Личный вклАД автора
С участием автора выполнены основные и подготовительные этапы работы. По данным современной литературы автором рассмотрено состояние вопроса и проведен анализ полученных результатов. Автором лично осуществлялось ведение и оперативное лечение пациенток с наружным генитальным эндометриозом, исследования, направленные на выявление новых патогенетических механизмов формирования НГЭ. Проведена регистрация, статистическая обработка, анализ полученных данных и обобщение результатов клинико-лабораторных исследований.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Материалы и методы исследования
Общая клиническая характеристика обследованных больных
Для изучения патогенетических механизмов развития и совершенствования методов диагностики, лечения и реабилитации больных с НГЭ был проведен ретроспективный анализ историй болезни 245 пациенток, которым было проведено обследование и лечение в Центре Репродукции Человека и ЭКО в период с 2000 по 2006 гг.
Проспективный анализ клинических проявлений заболевания и лабораторных исследований проведен у 107 пациенток, из них 87 пациенток с НГЭ и 20 женщин без эндомпетриоза (контрольная группа), проходивших обследование и лечение в отделении гинекологии ФГУ РНИИАП с 2005 по 2008 гг. По основным клиническим параметрам - возрасту, жалобам, особенностям репродуктивной системы, распространенности процесса – больные в проспективной и ретроспективной группах не различались.
Общий объем выборки составил 352 пациентки. В ходе проводимого нами исследования все больные были разделены на три клинические группы: I группу составили 148 (119 ретроспективной и 29 проспективной групп) пациенток с I-П стадией наружного генитального эндометриоза по классификации r-AFS (1985), П группу – 184 (114 ретроспективной и 46 проспективной групп) больных с III - IY стадией заболевания (160 пациенток с III-IY стадией и 24 с рецидивом). III контрольную группу составили 20 пациенток без эндометриоза, проводивших обследование по поводу бесплодия. У 24 (12 больных ретроспективной и 12 проспективной групп) пациенток с рецидивом НГЭ была обнаружена III-IY стадия НГЭ. Все пациентки имели нормальный индекс массы тела, который составлял 18,5-25 кг/м(М.А.Репина и соавт., 2001).
В Международной Классификации Болезней 10-го пересмотра представлена рубрика N 80 – эндометриоз, имеющий подрубрики – N 80.1 – эндометриоз яичников, N 80.2 – эндометриоз маточных труб, N 80.3 – эндометриоз тазовой брюшины, что относится в наружному генитальному эндометриозу. Из исследования были исключены пациентки с миомой матки и аденомиозом.
Распространенность эндометриоза определяли при проведении лапароскопии, используя рекомендации пересмотренной классификации, разработанной Американским обществом фертильности (r-AFS)(1985).
Все клинические исследования проводились с информированного согласия больных и протоколировались по стандартам Этического комитета Российской Федерации. В качестве объектов исследования были использованы кровь и перитонеальная жидкость, биоптаты брюшины и яичников.
Все пациентки, включенные в исследование были репродуктивного возраста. При этом средний возраст женщин I группы составил 29,8±0,1года, а пациенток II группы - 27,5±0,3 года, III группы – 28,6±0,2 года.
Нами обнаружено, что в группах пациенток с НГЭ наступление менархе приходилось, в основном, на период до 11лет и с 11 до 14 лет (у 327 из 332 пациенток). Вместе с тем, раннее наступление менархе (до 11 лет) чаще встречалось среди больных НГЭ II группы (60,9%) и I группы (52,7%), т.е. у пациенток с НГЭ обнаружено раннее менархе в отличие от пациенток контрольной группы. Средний возраст начала менструации у женщин I группы составил 10,2±0,11 лет, II группы - 11,8±0,19 лет, в III группе - 13,4±0,1лет, что также подтверждает наличие раннего менархе у больных с НГЭ.
Регулярность менструального цикла отмечалась у подавляющего числа пациенток и в среднем составила 28-30 дней. В то же время, наличие пролонгированного цикла (31-38 дней и более), чаще отмечалось среди женщин II группы (III-IV стадия НГЭ) - 61 пациентка (33%). Альгоменорея имела место у 50% (166) больных с НГЭ с менархе, причем у 126(85,1%) пациенток с I-II стадией НГЭ и только у 40(21,7%) больных с III-IV стадией НГЭ.
Первичное бесплодие имело место у 52% (173) больных, причем у пациенток с I-II стадией НГЭ в 55,4% (82) случаев, тогда как в группе с III-IV стадией заболевания в 49,5% (91). Вторичное бесплодие было обнаружено у 25% (83) пациенток с НГЭ, при этом в I группе больных – у 25,7% (38), во II - ой группе - у 24,5% (45). Таким образом, у больных с НГЭ преобладает первичное бесплодие.
У пациенток с I-II стадией НГЭ (I группа) ИППП имели место у 79,7%(118), ВЗОМТ - у 57,4%(85) больных, тогда как во II группе пациенток с НГЭ III-IV стадии ИППП были обнаружены у 78,3% (144), а ВЗОМТ – у 60,9%(112) женщин. При этом гипофункция яичников развилась у 46,6%(69) пациенток I группы и у 29,3%(54) II группы. У пациенток III группы (контрольной) ИППП имели место у 60%(12) пациенток, ВЗОМТ – у 45%(9) больных. При этом гипофункция яичников развилась у 40%(8) женщин. Фоновые заболевания шейки матки были выявлены у 60,1%(89) больных с I-II стадией НГЭ, у 76,6%(141) пациенток с III-IV стадией НГЭ, тогда как дисплазия шейки матки обнаружена у 16,9%(25) больных I группы и у 21,7%(40) II группы. В контрольной группе пациенток фоновая патология шейки матки обнаружена у 30%(6), а дисплазии шейки матки - 10%(2) женщин. Гиперпластический процесс эндометрия выявлен у 27%(40) пациенток I группы и у 35,3%(65) больных II группы, тогда как в контрольной группе эта патология была обнаружена у 5%(1) женщин. Таким образом, у больных с НГЭ имел место неблагоприятный фон в виде перенесенных ИППП (78,9%)(262) и ВЗОМТ (59,3%)(197) в анамнезе.
В структуре перенесенных ИППП обращает на себя внимание высокий удельный вес уреамикоплазмоза – 27,7%(41) у пациенток I группы и 29,3%(54) II группы, хламидиоза – 23,6%(35) и 22,8%(42), а трихомониаза – 25%(37) и 20,7%(38) соответственно. Высокий уровень выявленных заболеваний, по-видимому, может быть одним из факторов в патогенезе НГЭ. На значение воспалительного процесса в патогенезе эндометриоза ранее указывали В.П.Баскаков и соавт.(2002), Л.В.Адамян и соавт.(2006).
У 16,8%(31) больных с III-IV стадией НГЭ в анамнезе имела место лапаротомия, в 21,7%(40) случаев – лапароскопия, при этом в 21,2%(39) была проведена резекция яичников, а в 5,4%(10) – аднексэктомия. У 3,8%(7) пациенток II группы в анамнезе осуществлена пункционная биопсия кист яичников. Перенесенные ранее операции на придатках и яичниках у пациенток с III-IV стадией НГЭ являются тем неблагоприятным фоном, на котором происходит формирование эндометриоидных кист.
Таким образом, вышеизложенное указывает на превалирование факторов, отягощающих гинекологический анамнез в группе пациенток с НГЭ по сравнению с женщинами контрольной группы.
Пациентки с НГЭ имели следующую экстагенитальную патологию, которая оказывала значительное влияние на развитие и течение основного заболевания: хронический тонзиллит отмечен у 91% (302) больных, практически все пациентки (98%) (325) перенесли детские инфекции (эпидемический паротит, краснуха, ветряная оспа), заболевания мочевыделительной системы (8,4%) (28), хронические заболевания желудочно-кишечного тракта (12%) (40), эндокринопатии (28,9%) (96), причем чаще в I группе больных НГЭ. Заболевания щитовидной железы имели 8 (5,4%) пациенток I группы и 12(6,5%) больных II группы. ВДКН была обнаружена у 13(8,8%) больных с I-II стадией НГЭ и у 11(6%) пациенток с III-IY стадией НГЭ. Галакторея была выявлена у 8,1%(12) пациенток I группы и у 9,8%(18) больных II группы. Синдром гиперандрогении в стадии компенсации имел место у 6,1%(9) больных с I-II стадией НГЭ и у 6,5%(12) пациенток с III-IV стадией НГЭ.
ТЕЧЕНИЕ НАСТОЯЩЕГО ЗАБОЛЕВАНИЯ. Анализ длительности заболевания от начала клинических проявлений до 1-ой госпитализации позволил установить, что этот период составил от 3 месяцев до 6 лет.
Характерными симптомами эндометриоза являлись – бесплодие (77%)(256), появление прогрессивно нарастающих болей в животе (37,3%)(124) до или во время менструации (54%)(179), диспареуния (22%)(73), мажущиеся кровянистые выделения до и после менструации (28%)(93), психоэмоциональные нарушения (38%)(126) и т.д. При прогрессировании заболевания имеет место тенденция увеличения частоты симптомов. Выраженность и интенсивность жалоб преобладали в группе больных с III – IV стадией НГЭ.
Из анамнеза обнаружено, что 4,7%(7) пациенток первой клинической группы и 7,6%(14) больных второй группы ранее использовали гормональные контрацептивы. Без положительного результата ранее ЭКО и искуcственная инсеминация были проведены у 8,8%(13) больных при I-II стадии НГЭ и у 10,9%(20) пациенток с III-IV стадией НГЭ. У 35,8%(53) пациенток I группы проведенная стимуляция овуляции оказалась безуспешной, у пациенток II группы – в 22,8%(42) случаев.
У половых партнеров пациенток с НГЭ воспалительный процесс имел место в 16%(53) случаев, патология семенной плазмы выявлена в 18,7%(62) случаев.
Объем перитонеальной жидкости у пациенток с НГЭ составил 52,3±0,5 мл, у пациенток контрольной группы - 18 ±0,6 мл.
Рецидивы. В группе пациенток с рецидивом заболевания первичное бесплодие в течение 3,4 ±0,3 года имело место у 58,3% (14) пациенток, вторичное - в течение 2,5±0,1 года - у 16,7% (4) больных.
Альгодисменорея у пациенток с рецидивом НГЭ имела место в 8,3% (2) больных. Нарушения менструального цикла по типу мено-метроррагий диагностированы у 33,3% (8) пациенток с рецидивом НГЭ, при этом у 8,3% (2) больных имел место гиперпластический процесс эндометрия.
У больных с рецидивом НГЭ 50% (12) пациенток перенесли ранее лапаротомию, 75% (18) - лапароскопию по поводу эндометриоза. У 33,3% (8) больных имело место сочетание этих оперативных вмешательств. Таким образом, у больных с рецидивом НГЭ имеет место высокий удельный вес перенесенных оперативных вмешательств на придатках.
В послеоперационном периоде 41,6% (10) пациенток назначалась гормональная терапия - золадекс (от 3 до 6 инъекций) и 8,3% (2) - бусерелин, 16,7% (4) пациенток получали норколут, ригевидон – 8,3% (2) больных. Время развития рецидива НГЭ – от 0,5 года до 6 лет, в среднем составило 3,4±0,3 года.
По данным обследования при рецидиве НГЭ заболевания, вызванные ИППП не были обнаружены у 33,3%(8) пациенток; тогда как хламидии были выявлены у 41,7% (10) больных, трихомонады в 16,6% (4) случаев, уреамикоплазмы в 16,6% (4), гонококки и гарднереллы по 8,3% (2). Воспалительные заболевания органов малого таза у пациенток с рецидивом НГЭ были обнаружены в 20% (5) случаев.
У пациенток с рецидивом заболевания у всех больных обнаружен эндометриоз III-IV стадии. Спаечный процесс 1-ой степени обнаружен в 8,3% (2) случаев, 2-ой - у 41,6% (10) больных, 3-ей степени выявлен у 8,3% (2) женщин, 4 –ой – у 41,6% (10).
При гистологическом исследовании удаленных макропрепаратов у 50% (12) пациенток при гистологическом исследовании были обнаружены «старые» эндометриоидные кисты, лишенные эпителиальной выстилки с отложениями гемосидерина.
Методы исследования
Всем пациенткам проведено рутинное обследование: RW, ВИЧ, гепатит В, гепатит С, флюорограмма, ЭКГ. Всем пациенткам в рамках предоперационного обследования для выявления нарушений функций печени и почек, изменений в системе гемостаза проводились клинические и биохимические анализы крови и мочи.
Ультразвуковое исследование (УЗИ) органов малого таза женщинам осуществляли в положении лёжа при опорожненном мочевом пузыре с помощью ультразвукового диагностического прибора «Aloka SSP-1400», 1998, сканирующего в реальном масштабе времени, снабженного 2-мя датчиками: эндовагинальным электронным датчиком с диапазоном, частоты UST-984-5 МНЧ и линейным датчиком -3,5 МНЧ.
Эндоскопические методы. Лапароскопия. Видимые проявления эндометриоза – наличие гетеротопий, описывались нами с точки зрения особенностей нарушения нормальной анатомии органов малого таза и по цветовым признакам. Лапароскопия проводилась по общепринятой методике с использованием оборудования фирмы Karl Storz (Германия). После визуальной ревизии брюшной полости и исключения другой патологии осуществляли забор перитонеальной жидкости (ПЖ) из позади-маточного пространства с соблюдением правил, предотвращающих контаминацию кровью. Оценивались локализация и цвет эндометриоидных гетеротопий и степень распространения НГЭ на брюшине, крестцово-маточных связках, широких связках, в прямокишечно-маточном углублении, на пузырно-маточной складке, яичниках и подъяичниковых ямках, маточных трубах, матке. Все случаи сочетания НГЭ с аденомиозом и миомой матки исключены из исследования. В нашем исследовании выборка больных была ограничена черными и желто-коричневыми «типичными» эндометриоидными гетеротопиями. Эндометриоидные очаги иссекались в пределах здоровых тканей, коагулировались, полученные биоптаты направлялись на гистологическое исследование.
Оценка степени распространения НГЭ осуществлялась согласно классификации r-AFS (1985).
Наиболее высокой (54%) в нашем исследовании оказалась частота эндометриоидных кист, что свидетельствует о несвоевременной диагностике эндометриоза яичников. Поверхностные очаги эндометриоза на яичниках были обнаружены в 42,8% случаев. При гистологическом исследовании у 16,3% (30) пациенток с эндометриозом III - IV стадией, как «находка», обнаружены желтые тела.
Обращает на себя внимание факт наличия при лапароскопии большого количества подкапсулярных желтых тел у 54% (180) пациенток с I-II стадией, обнаруженных нами при лапароскопии.
На брюшине малого таза эндометриоз был обнаружен в 64% случаев на крестцово-маточных связках, в 62% в прямокишечно-маточном углублении, тогда как пузырно-маточное пространство имело очаги только в 20,5% случаев. Широкая связка матки была поражена очагами эндометриоза в 48,5% случаев.
У пациенток первой группы с I-II стадией НГЭ спаечный процесс I степени обнаружен у 12,8% (19) больных, II - у 10,8% (16), III – 2,7%(4), IV степени у 2%(3). У женщин второй группы с III – IV стадией НГЭ спаечный процесс был обнаружен в 12%(22), 16,3%(30), 17,4%(32), 16,3%(30) соответственно. Таким образом, при III-IV стадии НГЭ имеет место более выраженный спаечный процесс.
При I- II стадии – поражения яичников были обнаружены в 31% (46), эндометриоидные кисты в 4% (6) случаев. Поражение только брюшины - 66,2% (98), сочетанные формы – (брюшина и яичники) – 48,7% (72).
При III – IV стадии – поражения яичников в виде эндометриоидных кист были обнаружены в 94,6% (174) случаев. Поражение брюшины - 40,2% (74). Сочетанные формы – (брюшина и яичники) - 78 % (144).
Хирургическое лечение во всех случаях выполнено лапароскопическим доступом в органосберегающем объеме (таблица 1). Основными задачами лапароскопического лечения считали: максимальное удаление всех эндометриоидных очагов; устранение спаечного процесса; восстановление нормальной анатомии внутренних половых органов. При рецидивирующих эндометриомах, ввиду уменьшения фолликулярного резерва оперированного ранее яичника, избегали повторной резекции, а выполняли широкую внутреннюю марсупиализацию, обрабатывали внутреннюю выстилку кисты монополярной коагуляции.
Таблица 1.
Виды и удельный вес хирургических пособий при эндоскопических вмешательствах (абс., %).
| Вид хирургического пособия | I–II стадия НГЭ n=148 | III-IV стадия НГЭ n=184 | Всего n =332 | |||
| Абс. | % | Абс. | % | Абс. | % | |
| Коагуляция очагов эндометриоза | 144 | 97,3 | 181 | 98,4 | 325 | 97,9 |
| Энуклеация кист яичников | 6 | 4,1 | 174 | 94,6 | 180 | 54,2 |
| Биопсия яичников | 46 | 31,1 | 67 | 36,4 | 113 | 34 |
| Биопсия брюшины | 98 | 66,2 | 74 | 40,2 | 172 | 51,8 |
С целью верификации диагноза НГЭ выполнено 113(34%) биопсий яичников, 172 (51,8%) – брюшины малого таза.
Гистероскопия выполнялась по общепринятой методике с использованием оборудования фирмы Karl Storz (Германия).
Кольпоскопия выполнялась по общепринятой методике с использованием оборудования LEISEGANG Mod 3DLF Nr 53000 (Германия).
Гистологическое исследование. Фрагменты биоптатов тканей брюшины, яичников и эндометриоидных кист яичников, удаленных оперативным путем, доставлялись в отдельной посуде и после маркировки фиксировались обычным способом, проводилась спиртово-формалиновая проводка и изготовление парафиновых блоков. Гистологические срезы делались серийно, окрашивались гематоксилином-эозином и пикрофуксином по Ван Гизону.
Биохимические методы исследования
Определение содержания факторов роста, молекул межклеточного взаимодействия, гормонов, антиовариальных антител, антител к кардиолипину, опухолевоассоциированного антигена СА-125 в сыворотке крови и перитонеальной жидкости.
Вышеперечисленные соединения определяли в сыворотке крови и перитонеальной жидкости с помощью иммуноферментного анализа. Взятие крови производили следующим образом: у пациенток из локтевой вены натощак брали 5,0 мл крови. Кровь центрифугировали в течение 15 минут при 1500 оборотов в минуту. Отбирали сыворотку крови в пластиковые пробирки объемом 1,5 мл и хранили при температуре - 20°С. Перитонеальную жидкость получали из позади-маточного пространства при выполнении лапароскопии.
Для ЭФР, СЭФР-А, оФРФ, ФНО- использовали иммуноферментные наборы (Cytimmune systems, USA). Аналитическая чувствительность методов 8,3 пг/мл, 18,6 пг/мл, 0,48пг/мл и 8,8 пг/мл соответственно. О высокой воспроизводимости методов свидетельствовали следующие коэффициенты вариации: для ЭФР интра- и интер- коэффициенты вариации измеренных уровней составили соответственно – 7,0% и 10,6%, для СЭФР-А вариации внутри серии – 8,9%, между сериями – 11,1%, для оФРФ – 8,2% и 10,1% и для ФНО- – 7,7% и 6,54% соответственно.
Содержание ИФР-1 и ТФР- определяли иммуноферментными наборами «R&Dsystems», USA. Чувствительность методов – 10,1 пг/мл и 4,8 пг/мл соответственно. Вариации внутри серии – 3,3%, между сериями – 8,6% - для ИФП-1 и для ТФР – 8,3% и 10,8% соответственно.
Принцип этих методов заключается в ферментативно-усиленном двухстадийном анализе «сэндвичевого» типа. Стандарты, контроли и предварительно разведенные образцы сыворотки и ПЖ инкубировали в лунках планшета, сорбированных антителами к вышеуказанным факторам роста. После инкубации и промывки ячейки инкубируются с другими антителами к факторам роста, меченым соответствующими ферментами. В наборах «Cytimmune systems» используют сорбированные мышиные моноклональные антитела, другие специфические кроличьи античеловеческие поликлональные антитела связываются с конъюгатом стрептавидина и щелочной фосфатазы. Субстратом является НАДФН, который щелочная фосфатаза дефосфорилирует до НАДН, служащего кофактором, активизирующим циклическую реакцию окисления - восстановления, управляемую алкогольдегидрогеназой и диафоразой. В реакции образуется окрашенный продукт красного цвета (формазин), определяемый при 490 нм. Стандартная кривая показывает прямую цитокины, входящие в состав тест-наборов.
ММП-9, сVCAM1, sFASL определяли методом иммуноферментного анализа наборами фирмы Bender MedSystems (Austria).
Определение антител к кардиолипину (анти-кардиолипиновый скрининг - IgG/IgM – cуммарных) проведено методом иммуноферментного анализа набором ORGENTEC (Германия), антиовариальных антител – BIOSERV Diagnostics (Германия), опухолевоассоциированного антигена СА-125 – DRG (Германия). Все анализы проведены на многофункциональном счетчике для иммуноферментных исследований с программным обеспечением Victor (Finland).
С целью оценки состояния эндокринного статуса репродуктивной системы обследуемых пациенток проводилось определение концентрации уровня гормонов в плазме крови и перитонеальной жидкости - стероидных гормонов: эстрадиола, прогестерона, тестостерона; тиреоидных – Т3, Т4; белковых: гликопротеинов - ЛГ, ФСГ, ТТГ, лептина, активина, а так же полипептида – пролактина. Концентрацию гормонов определяли в первую фазу менструального цикла иммуноферментным методом с использованием иммуноферментных тест – систем EIA-DRG (Germany) по прилагаемым протоколам.
Определение NO, NOS в сыворотке крови и перитонеальной жидкости. Эндогенный уровень оксида азота в форме нитрит-аниона (NO-) определяли с помощью реактива Грисса (Н.П.Дмитренко и соавт., 1998). Активность нитрооксидсинтазы (NOS) измеряли по увеличению продукции оксида азота из L- аргинина в присутствии NADPH (D.J.L.Julio et al., 1995).
Генетические исследования
Проведено обследование 115 человек. В группу больных вошли женщины, проходящие лечение по поводу эндометриоза в стационаре ФГУ «РНИИАП Росмедтехнологий» (41 пациент) в 2007-2008 гг. В контрольную группу (74 пациента) были включены недавно родившие женщины, у которых не было эндометриоза в анамнезе. Большинство пациенток были русскими (29 пациенток с НГЭ и 70 без него).
Выделение ДНК из лимфоцитов периферической крови проводили в набором DIAtom™ DNA Prep100 по рекомендации фирмы производителя («Центр Молекулярной генетики» Россия). Генотипирование локусов GSTT и GSTM проводили с помощью коммерческой тест-системы фирмы «Центр Молекулярной генетики» (Россия). Определение аллельных вариантов генов GPIII и Cyp19 проводили методом ПЦР с последующим рестрикционным анализом тест-системами для молекулярно-генетического анализа разработанными ГосНИИгенетика (Москва).
Полимеразную цепную реакцию (ПЦР) проводили при помощи программируемых термоциклеров «ДНК-Технология» (Москва) и «PTC-220» (MJ Research, США) по программе, рекомендованной производителем набора.
Статистическая обработка данных при генетическом исследовании. Определение достоверности различий между сравниваемыми группами или подгруппами по частотам генотипов и аллелей исследуемых генов производили с помощью критерия Фишера (для количества наблюдений меньше 20 и значения частот меньше 5) или хи-квадрат по стандартной формуле с учетом поправки Йетса для парных сравнений (Бочкарев П.Н. и соавт. 2004; 2005). Значение р<0,05 было принято как статистически значимое. Величину относительного риска OR (odds ratio), выражающего силу ассоциаций рассчитывали по стандартной методике (Бабич П.Н. и соавт, 2005). Если значение OR=1, это свидетельствует об отсутствии различий между сравниваемыми группами. Статистический анализ полученных результатов проводился с использованием программ Microsoft Excel 2002 SP-2 (Microsoft Corporation, США) и Fisher_Exact (www.biostat.kiev.ua.).
Математические методы анализа данных.
Статистическая обработка данных проводилась с помощью пакета программ Office 2003, Statistica 6.0. При статистической обработке цифрового материала нормальность распределения определялась по критерию согласия Пирсона. В случае подтверждения нормальности распределения и однородности дисперсий анализ по выявлению различий между средними значениями параметров в различных группах выполнялся с помощью t- критерия Стьюдента. Результаты оценивали статистически значимыми при р<0,05.
Для исследования переменных, имеющих неоднородную дисперсию или распределение, отличное от нормального, применяли U-критерий Манна-Уитни (Г.Ф.Лакин, 1990; И.В.Гайдышев, 2001; О.Ю.Реброва, 2003). Проводилась оценка показателей общей статистики, медианы (квартиль 50%), квартили 75% и 25%. Различие между средними значениями параметров считалось достоверным, если значение р-уровня для данных переменных оказывалось меньше 0,05.
При проведении корреляционного анализа данных применялся критерий Пирсона в случае нормального распределения переменных и критерий Спирмена в противном случае, при этом уровень значимости выбирался равным 0,05.
Построение графиков и диаграмм осуществлялось с помощью пакета Statistica 5.1 и программы Microsoft Office Excel 2003.
Результаты исследований и их обсуждение
Известная на данный момент полиэтиологичность НГЭ, представленная различными концепциями, не в состоянии объяснить ключевой момент развития заболевания – имплантацию и превращение клетки эндометрия в эндометриоидный очаг (Л.В.Адамян и соавт., 2005; В.М.Пашков, В.А.Лебедев, 2007; В.А.Бурлев и соавт., 2008).
В проведенном исследовании нами предпринята попытка на системном и местном уровнях изучить некоторые аспекты клеточной аутопаракринной регуляции ангиогенеза, а также эндокринные, иммунологические и метаболические факторы при НГЭ и выяснить их роль в патогенезе данного заболевания.
Верификацию эндометриоза проводили по степени распространения процесса и морфофункциональным характеристикам гетеротопических очагов (И.И.Куценко,1994). Морфологический диагноз основывался на микроскопическом выявлении эктопического эндометриоидного эпителия в сочетании с элементами эндометриоидной стромы. В гетеротопических очагах выявлено наличие двух направлений их существования - прогрессия и регрессия. Для очагов прогрессирующего НГЭ наиболее частыми и типичными были пролиферация эпителия желез различной степени выраженности, секреторные изменения, децидуализация цитогенной стромы (таблица 2). Очаги регрессирующего НГЭ без признаков функциональной активности характеризовались наличием кистозной трансформации желез, атрофией эпителия, фибропластической перестройкой и ангиоматозом цитогенной стромы в общей группе – у 19,6% пациенток, при I-II стадиях НГЭ – у 13,5% больных, при III-IY стадиях – у 24,5% женщин (рисунок 1).
Таблица 2.
Функциональное состояние желез эндометрия в эндометриоидных гетеротопиях в операционном материале пациенток с НГЭ
| Фаза | Абс. | % |
| Пролиферация | 118 | 49,6 |
| Секреция | 120 | 50,4 |
| Средняя секреция | 22 | 18,3 |
| Поздняя секреция | 98 | 81,7 |
При рецидивах, после проведения гормональной терапии или во время её, эпителий во многих участках характеризовался дистрофическими изменениями, склерозированием крупных артерий. При этом имели место старые кровоизлияния, а также участки, в которых эпителий отсутствовал, наблюдалось замещение цитогенной стромы волокнистой соединительной тканью. Анатомически киста сохранялась как полостное образование. В некоторых участках регрессии эндометриоидная ткань замещена фиброзной, нередко с формированием гиалина.
При проведении генетического исследования нами не выявлены достоверные различия по частотам аллельных вариантов генов GSTT, Cyp 19 и GPIII между больными русской и чеченской национальности. У носительниц нулевого генотипа гена GSTM риск развития эндомтериоза выше. Нулевой аллель гена GSTT1 и аллель PLA2 гена GPIII не предрасполагают к развитию эндометриоза, но обусловливают более тяжелое течение заболевания.
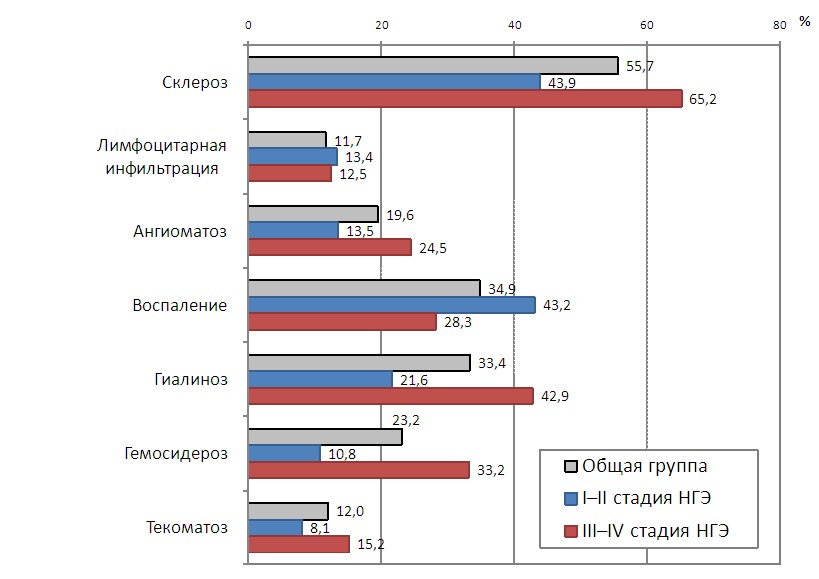 |
| Рисунок 1. Гистологическая характеристика эндометриоидных гетеротопий при проспективном и ретроспективном анализе у пациенток в зависимости от стадии наружного генитального эндометриоза (р<0,05). |
Основу данной работы составили итоги наблюдения и лечения 332 женщин с НГЭ, причём особого внимания заслуживает их соматический анамнез, который был отягощён хроническим тонзиллитом в 91,3% случаев, перенесенными детскими инфекциями в 98%, заболеваниями сердечно-сосудистой системы в 4,5%, желудочно-кишечного тракта – в 12%, мочевыделительной системы – 8,4%, заболеваниями эндокринной системы – в 30% случаев. Особенностями гинекологического анамнеза явилось обнаружение у 59,3% больных воспалительных заболеваний половых органов, а ИППП – у 80% пациенток. Репродуктивная функция характеризовалась высоким уровнем бесплодия - основного симптома эндометриоза, достигающего при сроке заболевания свыше 5 лет почти 55%. При этом первичное бесплодие имело место у 52% больных, причём у пациенток с I-II стадией НГЭ в 55,4%, тогда как в группе с III-IV стадией в 49,5%. Вторичное бесплодие было обнаружено у 25% пациенток с НГЭ, при этом в первой группе – у 25,7%, во второй группе – 24,5%.
Представленные основные клинические особенности, степень выраженности которых при НГЭ не может быть не учтена в процессе формирования принципов регуляции не только на клеточном уровне, но и на системном.
Обобщенные результаты проведенного нами исследования, касающиеся изменений регуляторов внутри- и межклеточного метаболизма при НГЭ позволяют выразить собственную позицию на патогенез данного заболевания. Уместно заметить, что выработка ангиогенных факторов роста, (достоверные нарушения продукции которых выявлено нами при НГЭ), контролируется, по мнению ряда авторов, преимущественно гормонами. Однако, многие исследователи не смогли доказать участие стероидных гормонов в неоангиогенезе (В.А.Бурлев, 2008; C.Cargett, P.A.W.Rogers, 2001). При этом также установлено, что ни один из факторов роста в отдельности не способен изолированно контролировать патологическую пролиферацию при эндометриозе (В.А.Бурлев, 2006; D.Dikon, H.He., 2000). Это позволило R.Varma et al. (2004) рассматривать эндометриоз как доброкачественный неопластический процесс, обусловленный нарушением аутопаракринной регуляции клеточного метаболизма на системном уровне.
В нашем исследовании (таблица 3) на системном уровне выявлено нарушение ауто-пара – и интракринной клеточной регуляции ангиогенеза, происходящее в результате высокой продукции ЭФР, оФРФ, ИФР-1, СЭФР-R и низкой – лептина (рисунок 2). Характер изменения последнего снижает его ингибирующее влияние на действие ИФР-1. Высокий уровень данного фактора роста подавляет активируемый ФСГ синтез эстрадиола, нарушение продукции которого усиливается также в результате снижения исходного субстрата – тестостерона, хотя экспрессия гена ароматазы сохранена. Однако, необходимая активация данного фермента с участием лептина (низкое содержание), по-видимому, модифицирована. Следовательно, классический путь синтеза эстрадиола нарушен и наблюдается также снижение другого (альтернативного), менее эффективного пути с участием ауто-паракринного регулятора ИФР-1 (рисунок 11).
Установлено, что лептин оказывает влияние на секрецию гонадотропин-рилизинг-гормона (ГнРГ) (B.Meczekalski, A.Warenik – Szymankiewicz, 2005). При снижении его уровня, наряду с нарушением выделения ГнРГ, наблюдается резкое ослабление фолликулогенеза, ранняя атрезия фолликулов, вследствие активации в нем апоптотических процессов (Н.Б.Чагай и соавт., 2008; M.L.Hamm et al., 2004).
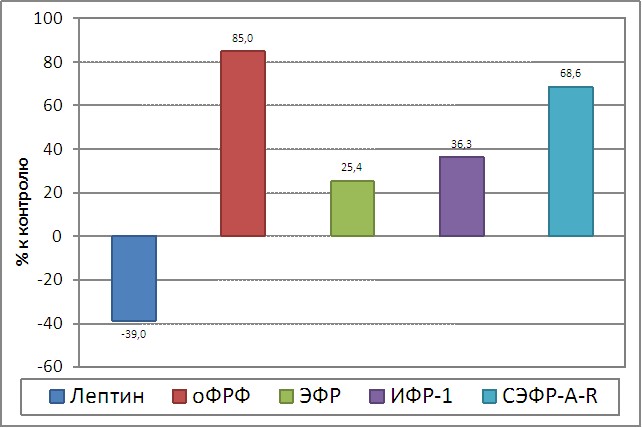 |
| Рисунок 2. Изменение содержания лептина, оФРФ, ЭФР, ИФР-1, СЭФР-A-R в сыворотке крови у больных с НГЭ (р<0,05) |
Природа сигнала, осуществляющего взаимосвязь между состоянием метаболизма и репродуктивной функцией организма, является одной из научных загадок гинекологической эндокринологии. В настоящее время считают, что, возможно на основании контроля лептином секреции ГнРГ базируется механизм его действия как связующего звена между состоянием метаболизма и репродуктивной системой (B.Meczekalski, A.Warenik – Szymankiewicz, 2005).
При проведении корреляционного анализа обнаружена тесная корреляционная связь между содержанием ИФР-1 и ЭФР (r=0,77), оФРФ и ЭФР-R (r=0,67), оФРФ и ЭФР (r=0,71), ИФР-1 и ИЛ-8 (r=0,32). Так же было отмечено изменение регуляторной связи между лептином и ИФР-1 (r=-0,69).
Становится очевидным, что роль лептина в метаболических нарушениях при НГЭ особенно значима. При этом, падение его уровня снижает известную взаимосвязь с СТГ, который в свою очередь оказывает регулирующее действие на синтез ИФР-1. В условиях НГЭ ангиогенное действие данного фактора роста усиливается высоким уровнем ЭФР, в отсутствие которого ИФР-1 не может активировать пролиферацию (V.M.Jasonni et al., 1996).
Таблица 3.
Показатели регуляторов клеточного метаболизма у пациенток с НГЭ (сыворотка крови)
| Показатель | Стадии НГЭ | Контроль | Р |
| НГЭ | |||
| ЭФР (пг/мл) | 372,80 [263,80-432,70] | 297,10 [148,80 – 381,10] | 0,018857 |
| оФРФ (пг/мл) | 35,35 [29,70 – 40,80] | 19,10 [16,90- 22,80] | 0,000112 |
| ИФР-1 (нг/мл) | 184,75 [150,80-210,50] | 135,60 [30,50 – 186,80] | 0,027277 |
| СЭФР-А-R (нг/мл) | 6,24 [4,48 – 10,00] | 3,70 [1,96 – 5,80] | 0,003413 |
| Лептин (нг/мл) | 11,45 [9,80 – 13,20] | 18,80 [9,80 – 43,80] | 0,045549 |
| I-II стадия НГЭ | |||
| оФРФ (пг/мл) | 36,38 [16,8-44,3] | 19,10 [16,90- 22,80] | 0,000078 |
| ИФР-1 (нг/мл) | 186,85 [132,6-246,3] | 135,60 [30,50 – 186,80] | 0,027913 |
| СЭФР-А-R (нг/мл) | 7,24 [4,22 – 12,8] | 3,70 [1,96 – 5,80] | 0,000461 |
| ИЛ-10 (пг/мл) | 7,5 [ 3,9 – 12,72] | 5,20 [ 2,80 – 7,20] | 0,011687 |
| III-IV стадия НГЭ | |||
| ЭФР (пг/мл) | 404,80 [258,20 – 521,40] | 297,10 [148,80 – 381,10] | 0,017828 |
| оФРФ (пг/мл) | 29,85 [19,40 – 40,00] | 19,10 [16,90- 22,80] | 0,001084 |
| ИФР-1 (нг/мл) | 188,95 [148,30-210,60] | 135,60 [30,50 – 186,80] | 0,056822 |
| СЭФР-А-R (нг/мл) | 5,24 [4,00 - 6,62] | 3,70 [1,96 – 5,80] | 0,030757 |
| Лептин (нг/мл) | 10,15 [8,40 – 11,20] | 18,80 [9,80 – 43,80] | 0,037198 |
| ФНО- (пг/мл) | 15,58 [ 7,44 – 29,60] | 8,38 [ 6,42 – 17,20] | 0,055816 |
| Т4(нммоль/л) | 12,6 [ 12,2 – 16,4] | 11,07 [5,05 – 13,75] | 0,043383 |
| Рецидив НГЭ | |||
| ЭФР (пг/мл) | 480,00 [386,20 – 538,60] | 297,10 [148,80 – 381,10] | 0,01852 |
| оФРФ (пг/мл) | 32,80 [22,90 – 36,80] | 19,10 [16,90- 22,80] | 0,001005 |
| ИФР-1 (нг/мл) | 204,65 [186,70 – 245,80] | 135,60 [30,50 – 186,80] | 0,020909 |
| СЭФР-А (пг/мл) | 853,40 [209,80-1109,80] | 176,60 [150,80 – 262,00] | 0,007789 |
| ЭФР-R (fмоль/мл) | 0,251 [0,148 – 0,99] | 0,55 [0,523 – 0,59] | 0,020889 |
| ИЛ-6 (пг/мл) | 5,68 [ 3,70 – 6,00] | 7,26 [ 5,56 – 74,60] | 0,046999 |
Примечание: результаты представлены как медиана и межквартильный интервал.
р<0,05 – достоверность различий по сравнению с контрольной группой.
Несомненный интерес представляют высокие показатели растворимого СЭФР-А-R при НГЭ, изменение содержания которого на системном уровне при данной патологии, наряду с модификацией продукции ангиогенных факторов, увеличивает возможность изменения различных звеньев в общей цепи ангио- и митогенных эффектов СЭФР. В тоже время увеличение на системном уровне растворимого СЭФР-А-R, способного связывать и нейтрализовывать СЭФР (T.Veikkola, K.Alitalo,1999), что по-видимому, и наблюдается при НГЭ, обусловливает в определенной мере подавление неоангиогенеза, и как следствие - гетеротопий (R.Kerbel, J.Folkman, 2002). Растворимый рецептор СЭФР-А относят к антиангиогенным соединениям белковой природы (S.Ballara et al., 2001; E.M.Paleolog, 2002; В.А.Бурлев, 2006), в связи с чем высокое содержание данного рецептора при НГЭ на системном уровне можно, в какой – то степени, отнести и к компенсаторным реакциям, развивающимся в организме женщины.
Анализ результатов нашего исследования позволяет объяснить ключевой момент развития заболевания (НГЭ) – имплантацию и превращение клеток эндометрия в эндометриоидный очаг (таблица 4). Высокий уровень ИЛ-8 в перитонеальной жидкости усиливает адгезию эндометриоидных клеток и имплантацию их на крестцово-маточных связках, брюшине прямокишечно-маточного углубления и задних листках широких связок матки. Указанные процессы происходят на фоне активного неоангиогенеза, который интенсифицируется также ИЛ-8, являющимся главным эндогенным аутокринным фактором роста эндометриоидных гетеротопий. Для данного цитокина характерна ещё и антиапоптотическая функция, как и для молекулы NO (высокий уровень в ПЖ) (рисунок 3). Наряду с ингибиторным действием ИЛ-8 и NO в отношении апоптоза в эндометриоидных гетеротопиях, при НГЭ существенная роль как ингибитора апоптоза принадлежит повышенной продукции ФСГ. Снижение при НГЭ в ПЖ (рисунок 10) уровня тестостерона, предшественника эстрадиола, свидетельствует об отсутствии прямого влияния эстрогенов на клеточные элементы эндометриоидных гетеротопий, а опосредовано оно активацией цитокинами, в частности, ИЛ-8. Данное утверждение логично, так как в этих гетеротопиях значительно снижено содержание эстроген-, прогестерон – и андрогенсвязывающих рецепторов (Л.В.Адамян и соавт., 2005; И.С.Сидорова и соавт., 2007).
Необходимая для развития эндометриоза пролиферация сосудов внутри и вокруг очагов достигается наличием гипоксии, (механизм возникновения, которой обусловлен высоким уровнем NO, приводящим к образованию ONOO-, снижающего кислородный баланс) являющийся важным регуляторным фактором неоангиогенеза, стимулирующим экспрессию ангиогенных цитокинов в данном случае ИЛ-8, ускоряя рост сосудов - с одной стороны. С другой – высокое содержание NO, являющегося также мощным антиапоптотическим соединением эндотелиальных клеток (H.Ota et al., 1998; V.Bourlev et al., 2006), поддерживает формирование сосудов. При корреляционном анализе обнаружена тесная взаимосвязь между NO и NOS (r=0,92).
Таким образом, при НГЭ на местном уровне наблюдается резкое снижение апоптоза, обусловленное ИЛ-8, NO, ФСГ и одновременным усилением интерлейкином – 8 активности ангиогенеза в эндометриоидных гетеротопиях, а также вазодилатация капилляров с участием NO (рисунок 12). Корреляционный анализ выявил следующие взаимовлияния между ИЛ-8 и ЭФР (r=0,3), тестостероном и 17-эстрадиолом (r=0,59), 17-эстрадиолом и СЭФР-R (r=0,26), ФСГ и СЭФР-А (r=0,29).
 |
| Рисунок 3. Изменение содержания ФСГ, тестостерона, СЭФР-A-R, ИЛ-8, sFASL, NO в перитонеальной жидкости у больных с НГЭ. (р<0,05) |
Гистологическое изучение очагов НГЭ показало, что они построены из желез с эпителием пролиферативного типа, цитогенной стромы с новообразованными сосудами капиллярного типа. Усиление процесса неоангиогенеза наблюдалось особенно в эндометриоидных кистах яичников. И главное, установленное нами при НГЭ резкое снижение апоптоза в гетеротопиях, обусловленное высокой продукцией антиапоптотических молекул: ИЛ-8, NO и ФСГ, и усиление ангиогенеза, согласуется с гистологическими результатами. Развитие морфологических изменений при НГЭ происходит за счет сниженного апоптоза и возрастания массы соединительнотканного компонента (фибробластов и внеклеточного матрикса), а также сохранение функциональной активности эпителиальных и стромальных компонентов даже в регрессирующих очагах, трансформированных в кисты.
Таблица 4.
Показатели регуляторов клеточного метаболизма у пациенток с НГЭ (перитонеальная жидкость)
| Показатель | Стадии НГЭ | Контроль | Р |
| НГЭ | |||
| ФСГ (мМЕ/мл) | 4,4 [3,1 – 5,6 ] | 3,0 [1,8 – 4,4] | 0,019615 |
| Тестостерон (нмоль/л) | 2,65 [1,69 – 3,95] | 4,80 [2,5 – 7,22] | 0,030166 |
| ИЛ-8 (пг/мл) | 16,8 [11,8 – 55,7] | 8,3 [4,5 – 18,8] | 0,04064 |
| СЭФР-А-R (нг/мл) | 9,22 [0,508 – 12,8] | 1,15 [0,42 – 4,54] | 0,000406 |
| sFASL (нг/мл) | 0,196 [0,128 – 0,32] | 0,162 [0,087 – 0,214] | 0,041136 |
| NOx (мкмоль/л) | 38,8 [ 28,6 – 49,6] | 24,0 [18 - 27,5] | 0,059264 |
| I-II стадия НГЭ | |||
| ЭФР-R (fмоль/мл) | 0,106 [0,102 – 0,115] | 0,02 [0,017- 0,102 | 0,002616 |
| ИЛ-8 (пг/мл) | 58,6 [19,80 – 67,80] | 8,3 [4,5 – 18,8] | 0,000368 |
| sFASL (нг/мл) | 0,198 [0,172 – 0,780] | 0,162 [0,087 – 0,214] | 0,004596 |
| cVCAM-1 (нг/мл) | 1320,50 [558,6 – 1562,5] | 547,5 [461,21 – 567] | 0,009470 |
| III-IV стадия НГЭ | |||
| NOx (мкмоль/л) | 31,75 [23,00 – 51,50] | 24,0 [18 - 27,5] | 0,027301 |
| NOS (мкмоль/л) | 40,60 [31,40 – 50,8] | 28,6 [26,4 - 36,7] | 0,026270 |
| СЭФР-А-R (нг/мл) | 11,930 [9,010 – 13,38] | 1,15 [0,42 – 4,54] | 0,000001 |
| Рецидив НГЭ | |||
| NOx (мкмоль/л) | 42,40 [28,50 – 44,50] | 24 [18 - 27,5] | 0,011992 |
| NOS (мкмоль/л) | 49,60 [33,00 – 60,40] | 28,6 [26,4 - 36,7] | 0,030850 |
| СЭФР-А-R (нг/мл) | 9,34 [1,327 – 11,4] | 1,15 [0,42 – 4,54] | 0,017065 |
| Активин (пг/мл) | 1,585 [1,120 – 2,73] | 0,89 [0,55 – 1,69] | 0,017031 |
| ЛГ (мМЕ/мл) | 1,45 [ 0,14 – 1,9] | 1,78 [1,48 – 3] | 0,034916 |
Примечание: результаты представлены как медиана и межквартильный интервал.
р<0,05 – достоверность различий по сравнению с контрольной группой.
Следует отметить, что в сыворотке крови пациенток с НГЭ столь выраженная степень изменений ангиогенных факторов роста, среди которых отмечен рост показателей комплекса оФРФ, ЭФР и ИФР-1 является, очевидно, следствием патологических процессов в организме женщины, активизирующих и запускающих синтез этих полипептидов (В.А.Бурлев, 2006). Анамнестические данные, приведенные ранее, позволяют считать, что высокий уровень продукции ЭФР, оФРФ и ИФР-1 на системном уровне может быть следствием выявленных заболеваний. Однако, наиболее высокие концентрации в сыворотке крови пациенток были характерны для ЭФР, что позволяет предложить его в качестве неинвазивного маркёра в диагностике НГЭ. Последнее будет способствовать, не только использованию специфических показателей в верификации НГЭ, но и разработке новых препаратов в лечении НГЭ, в частности, применение антиангиогенных средств.
Обобщая результаты соотношений гонадотропных и стероидных гормонов в сыворотке крови женщин с позиций их роли в репродуктивной функции, следует отметить следующее. Особенно значимые изменения молярных соотношений ФСГ, ЛГ, 17- эстрадиола и прогестерона при НГЭ (рис. 10) подтверждают наличие дисфункции гипоталамо-гипофизарно-яичникового комплекса, что несомненно нарушает функцию яичников, характеризующуюся синдромом неовулирующего фолликула (Л.В.Адамян, В.И.Кулаков, 1998; Л.Н.Кузьмичев и соавт., 2001).
В нарушении гипоталамо-гипофизарной системы существенное значение имеет низкий уровень лептина, в результате чего резко снижается выделение ГнРГ, обусловливающее ослабление фолликулогенеза и раннюю атрези0ю фолликула (Н.Б.Чагай и соавт., 2008). Вышеизложенное позволяет считать, что при НГЭ наблюдается модификация контроля со стороны центральной регуляции продукции половых гормонов, которая лежит в основе нарушения репродуктивной функции у данного контингента больных.
Выявлено сочетанное воздействие модификации факторов роста при НГЭ, заключающееся в нарушении ауто-, интра- и паракринной клеточной регуляции ангиогенеза, степень и характер которой зависит также от стадии заболевания, что подтверждается результатами нашего исследования.
Анализ результатов изученных соединений, достоверное изменение которых установлено у больных при НГЭ I-II стадии по сравнению с данными контрольной группы, показал следующее (рисунок 4). На ранних стадиях развития НГЭ (таблица 3) на системном уровне в противовес высокой продукции ангиогенных факторов оФРФ и ИФР-1, активирующих пролиферативные процессы при ангиогенезе, создающих эндометриоидный потенциал, формируется антиангиогенный «экран» с участием ИЛ-10 и растворимого СЭФР-А-R.
 |
| Рисунок 4. Изменение содержания оФРФ, ИФР-1, СЭФР-A-R, ИЛ-10 в сыворотке крови у больных с НГЭ I – II стадии. (р<0,05). |
Можно полагать, что на начальных стадиях НГЭ существует серьезная метаболическая защита (развитие компенсаторных реакций). Прежде всего, ИЛ-10 участвует в снижении миграции делящихся эндотелиальных клеток в сторону гетеротопий (В.А.Бурлев, 2006), а растворимый СЭФР-А-R, связывающий СЭФР-А, предотвращает также чрезмерный рост кровеносных сосудов.
Наиболее значимое изменение при I-II стадии НГЭ оказалось для такого ангиогенного фактора роста как оФРФ (почти двухкратное увеличение содержания в сыворотке крови). Исходя из вышеизложенного, логично предположить возможность использования данного показателя для диагностики I-II стадии заболевания без хирургического вмешательства и контроля проводимого лечения.
На фоне выявленных на системном уровне нарушений и компенсаторных реакций внутри- и межклеточной регуляции метаболических процессов ангиогенеза при I-II стадиях НГЭ, на местном уровне (таблица 4) в развитии данного заболевания существенную роль играют ангиогенный и антиапоптотический фактор - ИЛ-8 и ЭФР-R. Значение молекул адгезии сVCAM1 и sFASL(r=0,4) в перитонеальной жидкости неоднозначно, поскольку они усиливают апоптоз не только клеток эндометриоидных гетеротопий, но и иммунокомпетентных клеток, в результате чего могут наблюдаться изменения в иммунной системе, вследствие этого возможно снижение контроля за эндометриоидными клетками, попадающими в перитонеальную полость (рисунок 5).
 |
| Рисунок 5. Изменение содержания ЭФР-R, ИЛ-8, sFASL, cVCAM-1 в перитонеальной жидкости у больных с НГЭ I –П стадии. (р<0,05). |
При I-II стадии НГЭ (рисунок 10) в перитонеальной жидкости наблюдается снижение молярных соотношений прогестерона и тестостерона к эстрадиолу за счет резкого снижения продукции тестостерона и прогестерона. Корреляционный анализ обнаружил тесную корреляционную связь между 17-эстрадиолом и тестостероном (r=0,77). В то время как в сыворотке крови (системный уровень) имеет место рост этих коэффицициентов, что свидетельствует о преобладании продукции прогестерона и тестостерона над 17-эстрадиолом и, по-видимому, носит компенсаторный характер.
Обобщённые результаты, полученные при III-IV стадиях развития НГЭ, позволяют выделить специфические особенности в характере изменений клеточной и межклеточной регуляции при данной стадии заболевания (таблица 3). Прежде всего, в этом периоде наблюдается интенсивная экспрессия ЭФР и падение лептина, роль которых в процессах пролиферации противоположна. Патологическое действие высокого уровня ЭФР при III-IV стадиях НГЭ заключается в усилении ангиогенеза и создании, очевидно, ангиогенного потенциала на системном уровне (рисунок 6). Особенно значимая генерация оксида азота в перитонеальной жидкости несомненно реализуется в повышение синтеза пероксинитрита (ОNOO-), обусловливающего оксидантный стресс, сочетающийся с гипоксией.
 |
| Рисунок 6. Изменение содержания лептина, оФРФ, ЭФР, ИФР-1, СЭФР-A-R, ФНО- в сыворотке крови у больных с НГЭ III –IV стадии. (р<0,05). |
При III-IV стадиях НГЭ на системном уровне выявленные изменения характеризовались более значимыми показателями, чем при I-II стадиях. На фоне обнаруженного увеличения продукции ангиогенных факторов оФРФ, ИФР-1 и растворимого СЭФР-А-R, а также ИЛ-10 при I-II стадиях НГЭ, при III-IV стадиях отмечено ещё повышение ФНО- и снижение уровня лептина (рисунок 6). При этом в перитонеальной жидкости сохраняется особенно высокий уровень только СЭФР-А-R, как и при I-II стадиях заболевания, в то же время отмечен рост других ангиогенных факторов – NO и NOS (r=0,93) (рисунок 7). Можно констатировать, что обнаруженные нарушения продукции изученных соединений касаются в основном факторов, обеспечивающих клеточную регуляцию ангиогенеза. Становится очевидным усугубление при III-IV стадии НГЭ дисбаланса ангиогенных и антиангиогенных соединений, обусловливающих вовлечение в механизм развития данного заболевания большего количества ангиогенных факторов.
Что касается содержания прогестерона, тестостерона и эстрадиола в сыворотке крови у больных с III-IV стадиями НГЭ (рисунок 10), то коэффициенты Pr/E2 и Ts/E2 позволяют констатировать снижение молярной концентрации прогестерона в 40 раз, а тестостерона – в 2 раза относительно эстрадиола, в то время как у здоровых пациенток преобладание продукции прогестерона над эстрадиолом достигало стократной величины, а тестостерона – трёхкратной.
 |
| Рисунок 7. Изменение содержания СЭФР-A-R, NO, NOS в перитонеальной жидкости у больных с НГЭ III –IV стадии. (р<0,05). |
В ПЖ по сравнению с эстрадиолом отмечается снижение молярного уровня прогестерона почти в 25 раз, а концентрации тестостерона в 6 раз. При этом у женщин контрольной группы преобладание молярного уровня прогестерона над эстрадиолом достигало 50-кратной величины, а тестостерона – 10-кратной (рисунок 10).
К биохимическим особенностям рецидивирования НГЭ следует отнести не наблюдаемое ни в одной из описанных стадий заболевания, увеличение на системном уровне продукции СЭФР-А (корреляционный анализ показал взаимосвязь СЭФР-А и рецептора СЭФР-А-R – r=0,3). Последнее свидетельствует об усилении дисбаланса ангиогенных и антиангиогенных факторов с преобладанием ангиогенных, приводящих к возобновлению заболевания.
Результаты полученных данных позволяют сделать заключение относительно молекулярных изменений на системном уровне, приводящих к рецидивированию НГЭ (таблица 3). Прежде всего, у всех пациенток, находящихся под наблюдением, выявлен одновременный рост продукции трех ангиогенных факторов у данных больных: ЭФР, СЭФР-А, оФРФ в то время как для ЭФР-R было характерно снижение его содержания. Поскольку ЭФР является стимулятором экспрессии гена СЭФР-А, его высокий уровень, несомненно, усиливает интенсивность продукции СЭФР-А (E.M.Paleolog, 2002) (рисунок 8). Особенность биохимических реакций с участием СЭФР-А при патологии обусловливается его высоким содержанием, которое усиливает пролиферацию эндотелиальных клеток, приводя к чрезмерному росту сосудов (N.Ferrara, 1999; H.M.Blau et al., 2001). Нами обнаружена тесная корреляционная связь между СЭФР-А и рецептором СЭФР-А (r=0,82).
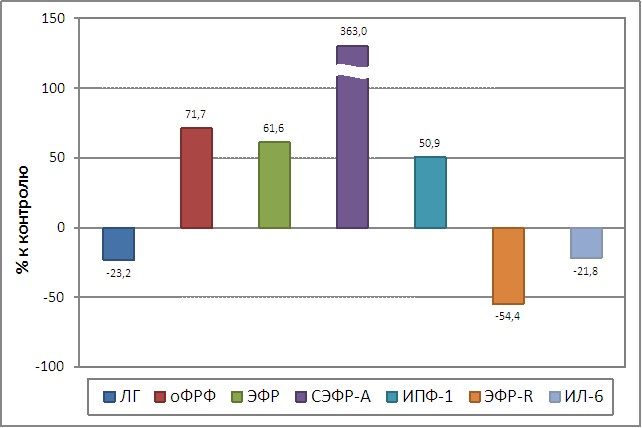 |
| Рисунок 8. Изменение содержания ЛГ, оФРФ, ЭФР, ИФР-1, СЭФР-A, ЭФР-R, ИЛ-6 в сыворотке крови у больных с рецидивом НГЭ. (р<0,05). |
Сопоставительный анализ полученных результатов, касающихся стероидов при рецидивировании НГЭ (рисунок 10), позволил обнаружить следующий характер молярных соотношений прогестерона, тестостерона и эстрадиола, которые свидетельствуют, что содержание прогестерона в сыворотке крови снижено в 3 раза, а тестостерона не изменено относительно эстрадиола в сравнении с контрольными данными. При рецидиве НГЭ в сыворотке крови обнаружен по сравнению с нормой выраженный дисбаланс прогестерона и эстрадиола, обусловленный почти трехкратным снижением содержания прогестерона. В ПЖ, напротив, имело место нарушение молярного соотношения тестостерона и эстрадиола.
Оценивая значение модификации факторов роста следует отметить известную роль ЭФР в процессе пролиферации тканей, которая заключается в том, что данный полипептид контролирует клеточный цикл. ЭФР необходим для выхода клетки из состояния покоя (GO), в результате чрезмерной его генерации у женщин при рецидиве НГЭ эта стадия клеточного цикла будет ускоренной, а, следовательно, и пролиферация. Метаболические особенности свидетельствуют о значительных изменениях ведущих ангиогенных факторов и их роли в рецидивировании НГЭ. На фоне высокой экспрессии ангиогенных факторов выявлено снижение ИЛ-6, одного из белков межклеточного взаимодействия. Он оказывает разнообразное и существенное влияние на многие органы и системы организма (S.C.Zin et al., 1997). Корреляционный анализ обнаружил, что между ИЛ-6 и оФРФ обнаружена определенная связь (r=0,5). Поскольку при рецидиве НГЭ имеет место достоверное снижение ИЛ-6, можно полагать, что в этих условиях на системном уровне первостепенное значение приобретает снижение индукции гипоталамо-гипофизарной системы, в которой данный цитокин участвует.
На местном уровне (ПЖ) выявленные изменения характеризовались высоким содержанием растворимого СЭФР-А-R (в 8 раз выше контроля), значительной продукцией NO и активностью NO-синтазы (рисунок 9). Увеличение в ПЖ растворимого СЭФР-А-R, который способен связывать и нейтрализовывать СЭФР-А (T.Veikkola, K.Alitalo, 1999), подавляя рост новых сосудов, и как следствие, - гетеротопий (R.Kerbel, I.Folkman, 2002), можно отнести к благоприятным факторам. Растворимый рецептор СЭФР-А относят к антиангиогенным маркерам (В.А.Бурлев, 2006; S.Ballara et al., 2001; E.M.Paleolog, 2002;), в связи с чем высокое содержание данного рецептора в ПЖ при рецидивировании НГЭ можно отнести к компенсаторным реакциям, развивающимся в паракринной регуляции ангиогенеза в эндометриоидных гетеротопиях. Это подтверждается менее значимыми образованиями последних, выявляемыми при данной стадии НГЭ во время лапароскопических операций.
Последствия выявленной модификации эндотелиальных факторов обусловливают неконтролируемый рост кровеносных сосудов и образование гетеротопий. Изменения в системе NO-NO-синтаза также обнаружены в данном исследовании в ПЖ при рецидиве НГЭ (таблица 4). При этом увеличенной оказалась генерация такого ангиогенного фактора как оксид азота и активность NO-синтазы (NOS). Высокая активность последней, обусловленная изменением соотношений при НГЭ половых стероидов с преобладанием 17-эстрадиола, контролирующего NO-синтазу (D.A.Pelligrino et al., 2001), приводит к значительному синтезу оксида азота. Избыток NO сопровождается оксидантным стрессом (Е.М.Васильева, Н.И.Баканов,2005) и известный как антиапоптозный фактор в данных условиях способствует росту гетеротопий (А.Х.Коган и соавт.,2006; Адамян Л.В. и соавт., 2008; М.Dong et al., 2001). Исследованиями В.А.Бурлева и соавт. (2008) и D.Sharkey и соавт. (2000) доказана роль гипоксической стимуляции ангиогенеза при эндометриозе. По нашему мнению, в развитии гипоксии существенную роль может играть обнаруженная нами особенно высокая генерация NO в перитонеальной жидкости. В последнее время доказано, что в случае чрезмерного уровня NO наблюдается его взаимодействие с супероксиданионом (О2-) с образованием пероксинитрита (ОNОО-) (В.В.Зинчук и соавт., 2006), мощного окислителя, приводящего к снижению кислородсвязывающих свойств крови, а, следовательно, к гипоксии, обусловливающей реализацию нарушений клеточного метаболизма при формировании очагов эндометриоза (P.Taylor et al., 2000).
 |
| Рисунок 9. Изменение содержания ЛГ, активина, СЭФР-A-R, NO, NOS в перитонеальной жидкости у больных с рецидивом НГЭ. (р<0,05). |
Развитие конкретной стадии НГЭ, в частности рецидивирующей, по-видимому, определяется специфическими клеточно-молекулярными изменениями на системном уровне: высокой продукцией основных ангиогенных факторов роста ЭФР, СЭФР-А, ИФР-1, оФРФ, и снижением его рецептора, а также уменьшением ИЛ-6, обусловливающим модификацию регуляторного влияния на гипоталамо-гипофизарно-яичниковую систему.
Сочетанное воздействие высокого содержания модуляторов роста сосудов на системном уровне создают условия для возникновения своеобразного ангиогенного потенциала и имплантации эутопического эндометрия при ретроградном попадании его в брюшную полость во время менструации. В рецидивировании НГЭ существенное значение приобретает, по нашему мнению, локальная гипоксия, способная стимулировать инициацию развития новых эктопических очагов.
Сравнительная характеристика данных, полученных на системном уровне, у пациенток с рецидивом НГЭ и без такового показало, что достоверные изменения изученных показателей обнаружены в уровне СЭФР-А, который оказался повышенным почти в 5 раз у женщин с рецидивом заболевания при снижении ЭФР-R и ИЛ-6. Отклонения в уровне ЭФР-R и ИЛ-6 выявлены от величин, которые достоверно отличаются от данных здоровых женщин, в то время как нарушений в продукции СЭФР у пациенток без рецидива НГЭ не наблюдалось. Можно полагать, что на системном уровне в данной ситуации выраженная степень роста СЭФР при рецидивировании НГЭ усиливает нарушение аутопаракринной клеточной регуляции ангиогенеза и способствует усилению ангиогенного потенциала, создающего условия для индукции имплантации эутопического эндометрия в брюшной полости (В.А.Бурлев, 2008). При этом, наряду с модифицирующими регуляцию клеточного метаболизма ЭФР, оФРФ как у больных без рецидива заболевания, так и при его наличии, в последнем случае выявляется существенная роль и СЭФР-А. Обобщенные результаты изучения динамики факторов роста, в том числе и СЭФР, при различных вариантах НГЭ показали, что изменение уровня данного полипептида наблюдалось только в случае рецидивирования НГЭ, причём, повышение его продукции имело место не только по сравнению с контрольными данными, но и относительно показателей у пациенток без рецидива заболевания. Последнее свидетельствует о роли СЭФР-А в механизме формирования рецидивирующей стадии НГЭ, когда необходимое для роста гетеротопий формирование кровеносных сосудов обеспечивается этим фактором роста, метаболическая функция которого заключается в индукции пролиферации эндотелиальных клеток.
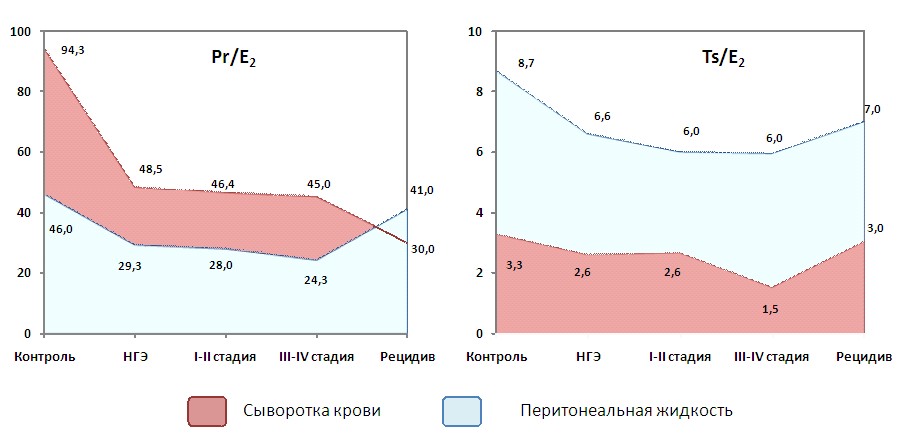 |
| Рисунок 10. Соотношение молярных уровней прогестерона и тестостерона к эстрадиолу у пациенток исследуемых групп |
В механизмах, патогенетически связанных с рецидивированием НГЭ, наряду с сохранением высокого уровня СЭФР-А и низкой экспрессии ЭФР-R, важную роль играет значительное снижение содержания ИЛ-6, приводящее к дисфункции гипоталамо-гипофизарной системы, и как следствие – снижению ГнРГ.
Данные о характере изменений регуляторных факторов на местном уровне при рецидивировании НГЭ (таблица 4) свидетельствуют о сохранении высокого содержания ИЛ-8, как и наблюдаемые нами на начальных стадиях (I-II стадия) развития данного заболевания. Кроме того, имеет место снижение СЭФР. В случае рецидивирования НГЭ особую информативность для суждения о механизме возврата формирования гетеротопий даёт высокая степень роста ИЛ-8, который усиливает адгезию эндометриоидных клеток и обеспечивает их имплантацию на органах брюшной полости. Наряду с участием этого фактора роста в регуляции пролиферации, одним из его метаболических эффектов, влияющих на процессы гемодинамики (кровоснабжение), является изменение обмена l- аргинина в результате модификации активности NO-синтазы и аргиназы (J.D.Shearer et al., 1997). Другим наиболее значимым фактом, обнаруженным нами в ПЖ является повышение уровня активина, одной из функций которого при высоких концентрациях является индукция гибели клеток по механизму апоптоза.
 |
| Рисунок 11. Схема регуляторных и функциональных нарушений метаболизма при наружном генитальном эндометриозе. |
Следует согласиться с мнением В.А.Бурлева (2008), который считает, что на различных стадиях развития эндометриоза, происходит переключение возникающих нарушений в аутопаракринных регуляторных процессах с одних факторов роста на другие. По нашему мнению, выявленная динамика продукции цитокинов, в том числе и ростовых факторов, при рецидивировании НГЭ, образующих сложную систему регуляторов клеточного роста и дифференцировки, позволяет заключить, что разнообразие морфологических и клинических проявлений указывает участие широкого спектра факторов роста в рецидивировании данного заболевания. Характер модификации продукции биоактивных компонентов в данном случае служит специфическим механизмом формирования рецидива НГЭ. Развитие этой формы эндометриоза является следствием отсутствия нормализации в клеточном метаболизме даже после проводимого стандартного лечения и служит теоретическим обоснованием для проведения дополнительных лечебных мероприятий, направленных на нормализацию метаболических процессов как на системном, так и локальном уровнях.
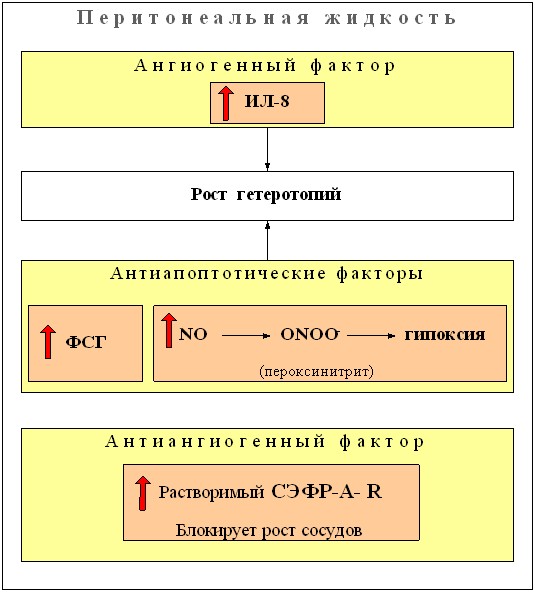 |
| Рисунок 12. Особенности клеточной регуляции при наружном генитальном эндометриозе. |
Анализ результатов исследования с учётом стадии НГЭ и роли ангиогенных факторов в их развитии позволил выявить на системном уровне ряд особенностей, заключающихся в изменении спектра факторов роста, обусловливающих нарушение регуляции клеточного метаболизма. Очевидно, можно считать, что при различных стадиях НГЭ наблюдаются изменения в нарушении регуляторных процессов в результате переключения отрицательного действия одних факторов роста на другие. Так, при I-II стадии НГЭ нарушение регуляции клеточного метаболизма в период ангиогенеза из изученных соединений связано с увеличением уровня оФРФ и ИФР-1. НГЭ III-IV стадии характеризуется изменениями в регуляторных процессах с участием ещё одного мощного ангиогенного цитокина - ЭФР. В период рецидивирования НГЭ на системном уровне, наряду с модифицирующими регуляцию клеточного метаболизма ЭФР, оФРФ, ИФР-1 как при I-II, III-IV стадиях, выявляется существенная роль и СЭФР-А.
Наблюдаемые особенности являются, очевидно, результатом изменения при НГЭ регуляторной взаимосвязи между ЭФР и системой тироксин – тиреотропин и СЭФР-А – ИФР-1. Известно, что Т4 участвует в клеточной пролиферации и дифференциации путем индукции ЭФР (E.Odeblad, 1993; M.D.Kilby et al., 1998). Значительная продукция последнего при III-IV стадиях НГЭ на системном уровне является, несомненно, следствием усиленной активации высокой генерацией тироксина синтеза ЭФР. Для рецидивирующей стадии НГЭ измененной оказалась другая регуляторная связь, заключающаяся в контроле продукции СЭФР-А – ИФР-1 (Ю.А.Панков, 1999, 2007), а также действием ЭФР, обеспечивающего активацию гена СЭФР-А (G.E.Hofman et al., 1992; D.M.Copper et al., 1994). Наличие высокого содержания ИФР-1 и ЭФР относительно как I-II, так и III-IV стадий НГЭ в процессе рецидивирования НГЭ обусловливает усиление количества СЭФР-А, приводящего к изменениям в сосудистой системе организма.
Возникающая при НГЭ модификация продукции изученных ангиогенных факторов роста и гормона из системы тироксин-тиреотропин обусловливает нарушение конкретных регуляторных взаимоотношений Т4-ЭФР, ИФР-1 – СЭФР-А и изменение активации гипоталамо-гипофизарной системы.
Резюмируя полученные нами результаты можно заключить, что отклонения в физиологических соотношениях изученных биоактивных компонентов, а также гипофизарных и половых стероидов при НГЭ подтверждают факт нарушений в продукции регуляторов клеточного роста и дифференцировки как на системном, так и локальном уровнях. При различных стадиях НГЭ установлены особенности модификации продукции факторов роста, относящиеся к специфическим реакциям, позволяющим использовать выявленные значимые изменения биоактивных соединений в диагностике соответствующей стадии НГЭ неинвазивным методом (рисунок 11).
Существенным является то, что наши данные дают возможность оценить значение высокого уровня в ПЖ ИЛ-8, который усиливает адгезию эндометриоидных клеток и обеспечивает их имплантацию на органах брюшной полости. Этот процесс происходит на фоне активного неоангиогенеза, важным активирующим фактором которого является гипоксия (рисунок 12).
Другим наиболее значимым фактом полученных результатов является возможность выразить нашу позицию в отношении установления среди изученных компонентов роли тех из них, изменение продукции которых приводит к дисфункции гипоталамо-гипофизарной системы. Сочетанное действие низких уровней ИЛ-6 и лептина на системном уровне нарушает активацию гипоталамо-гипофизарной системы и снижает секрецию гонадотропин-рилизинг гормона. Последствием модификации данных регуляторных процессов является резкое ослабление фолликулогенеза и ранняя атрезия фолликулов, что несомненно является одним из механизмов развития бесплодия при НГЭ.
На основании результатов исследования факторов роста и эндотелиальных компонентов можно заключить, что при различных стадиях формирования НГЭ происходит переключение нарушения регуляторного контроля клеточного метаболизма с одних факторов роста на другие.
Выявленные особенности в продукции ангиогенных факторов роста на системном уровне позволяют использовать их количественные характеристики в качестве неинвазивного метода диагностики наличия НГЭ и его стадий, при:
- соотношении ЭФР/оФРФ в сыворотке крови равном 10 или более, осуществляют биохимическую верификацию НГЭ;
- увеличении в сыворотке крови содержания оФРФ в 2,5 раза относительно нормы диагностируют I-II стадию НГЭ;
- увеличении в сыворотке крови содержания ЭФР в 2 раза диагностируют III-IY стадию НГЭ.
- пятикратное повышение содержания СЭФР-А в сыворотке крови пациентки позволяет диагностировать редивирующую стадию НГЭ.
ВЫВОДЫ:
1. Клинические особенности у пациенток с НГЭ, свидетельствуют, что тяжесть клинического течения НГЭ зависит от раннего наступления менархе, ранее перенесенных оперативных вмешательств, в большей степени проведенных на придатках матки, ранее перенесенных ЗППП и ВЗОМТ, экстрагенитальной патологии и не зависит от возраста пациенток, длительности менструаций, продолжительности менструального цикла. Альгодисменорея имеет место у 50% пациенток с НГЭ, причем чаще (85,1%) с I-II стадией НГЭ. У больных с НГЭ преобладает первичное бесплодие (53%).
2. Тяжесть клинического течения НГЭ при III-IV стадии патологического процесса коррелирует с распространенностью эндометриоза в малом тазу: наблюдается сочетание 2-3 симптомов, причем формирование эндометриоидных кист яичников усугубляет тяжесть клинических проявлений; рецидивирование, а также III-IV стадия развития НГЭ сочетаются с количеством и объемом ранее перенесенных оперативных вмешательств.
3. На системном уровне при наличии НГЭ характерной чертой факторов роста является высокий уровень ЭФР, оФРФ, ИФР-1, обладающих выраженной митогенной, пролиферативной и ангиогенной активностью, и низкий – лептина. Повышение продукции ИФР-1 и, напротив, падение лептина, контролирующих альтернативные пути синтеза эстрогенов, изменяют соотношение тестостерона и 17-эстрадиола, прогестерона и 17-эстрадиола при нормальной экспрессии CYP19. Нулевой аллель гена GSTT1 и аллель PLA2 гена GPШ не предрасполагают к развитию эндометриоза, но могут обусловливать более тяжелое течение заболевания.
4. На местном уровне изменения регуляторных соединений пролиферации относительно здоровых пациенток характеризуется увеличением содержания в перитонеальной жидкости ангиогенного и антиапоптотического фактора – ИЛ-8, повышением уровня антиапоптотических веществ – NO, ФСГ, апоптотического sFASL и антиангиогенного растворимого СЭФР-R. Соотношение апоптотических и антиапоптотических, ангиогенных и антиангиогенных факторов увеличивается, обеспечивая адгезию эндометриоидных клеток на органах брюшной полости и рост гетеротопий.
5. Начальные стадии (I-II) НГЭ сопровождаются усилением на системном уровне продукции оФРФ и ИФР-1, активирующих пролиферативные процессы при ангиогенезе, и антиангиогенных – ИЛ-10 и растворимого СЭФР-R. Наиболее выраженное увеличение содержания имело место для оФРФ и растворимого СЭФР-R. НГЭ I-II стадии характеризуется наличием значительной антиангиогенной метаболической защитой, предотвращающей чрезмерный рост кровеносных сосудов. На местном уровне на раннем этапе НГЭ в процессе формирования гетеротопий существенная роль принадлежит высокому уровню ангиогенного и антиапоптотического фактора – ИЛ-8, молекулам адгезии sVCAM1, и как следствие сочетанное действие снижения контроля за эндометриоидными клетками, попадающими в перитонеальную жидкость, и, обеспечивающих адгезию на органах малого таза.
6. Специфические особенности в характере изменений клеточной регуляции пролиферации при III-IV стадиях НГЭ на системном уровне заключаются в интенсивной экспрессии ЭФР, ФНО- и падении содержания лептина на фоне увеличенной продукции, как и при I-II стадии, оФРФ, ИФР-1, растворимого СЭФР-R. Показатели ангиогенных и вазоактивных соединений в перитонеальной жидкости отличаются ростом других ангиогенных факторов NO и NOS, и сдвигом соотношений ангиогенных и антиангиогенных в сторону снижения содержания последних. Выявленные изменения аутопаракринной клеточной регуляции ангиогенеза при III-IV стадиях НГЭ обусловливаются участием в механизме развития данного заболевания большего количества ангиогенных факторов.
7. Развитие рецидивирующей стадии НГЭ определяется на системном уровне не только высокой продукцией наблюдаемой при I-II, III-IV стадиях ангиогенных факторов ЭФР, оФРФ, ИФР-1, снижением ЭФР-R и ИЛ-6, но и особенно значительным ростом СЭФР-А, не отмеченным ни при одной из изученных стадий НГЭ. Высокий уровень продукции СЭФР-А, низкой экспрессии ЭФР-R и ИЛ-6 сохраняются также относительно НГЭ без рецидива. В перитонеальной жидкости (местный уровень) относительно данных здоровых женщин увеличение генерации оксида азота с участием NO-синтазы, обусловливающее локальную гипоксию, способствует инициации развития новых гетеротопий. По сравнению с результатами при НГЭ без рецидива заболевания в данной стадии НГЭ принимает участие широкий спектр биоактивных компонентов и служит специфическим механизмом для формирования рецидива НГЭ.
8. Фактором, усиливающим неоангиогенез внутри и вокруг очагов эндометриоза является гипоксия, развивающаяся вследствие высокого уровня в перитонеальной жидкости NO, обусловливающего рост пероксинитрита, нарушающего кислородный баланс.
9. В процессе развития НГЭ наблюдается изменение контроля функции гипоталамо-гипофизарной системы, обусловленное низким уровнем лептина и ИЛ-6, с последующим падением секреции ГнРГ, приводящего к ослаблению фолликулогенеза и ранней атрезии фолликулов, обусловливая бесплодие при НГЭ.
10. При I-II стадии НГЭ на местном уровне наблюдается снижение молярных соотношений прогестерона и тестостерона к 17-эстрадиолу за счет снижения продукции тестостерона и прогестерона. Системный уровень характеризуется ростом коэффициентов Pr/E2 и Ts/E2, свидетельствующим о преобладании продукции прогестерона и тестостерона над 17- эстрадиолом и обеспечивающим компенсаторные реакции. При III-IV стадиях НГЭ на системном уровне снижена молярная концентрация прогестерона и тестостерона относительно 17- эстрадиола, в то время как у здоровых пациенток преобладание прогестерона и тестостерона над 17- эстрадиолом более значительно выражено. Аналогичная тенденция наблюдается и на местном уровне.
11. Высокая интенсивность продукции наиболее мощного антиангиогенного фактора - растворимого СЭФР-R, влияющего на ограничение роста сосудов и отражающего степень компенсаторных возможностей организма при НГЭ отмечена на начальных этапах (I-II стадия заболевания) на системном уровне и не обнаружена на местном, свидетельствует об отсутствии в перитонеальной жидкости метаболического механизма, снижающего активность ангиогенеза. В случае прогрессирования заболевания (III-IV стадия) наблюдается сохранение содержания на системном уровне растворимого СЭФР-R, соответствующего показателям при I-II стадии, но в этот период имеет место особенно значимый рост растворимого СЭФР-R в перитонеальной жидкости, указывающий на формирование механизма антиангиогенной защиты. Рецидивирующая стадия НГЭ на системном уровне характеризуется снижением роста растворимого СЭФР-R относительно I-II, III-IV стадий НГЭ, а также на местном уровне, отражающего истощение компенсаторных резервов организма.
12. Содержание факторов роста, интерлейкинов и вазоактивных соединений – сложной системы регуляторов клеточного роста и дифференцировки, в сыворотке крови отражают характер регуляторных нарушений при наличии НГЭ, а также при различных стадиях его развития и может быть использовано в качестве неинвазивных тестов их диагностики.
Практические рекомендации
1. При первичном обследовании пациенток репродуктивного возраста с целью выявления риска развития НГЭ и последующей разработки комплексных мероприятий по его предупреждению целесообразно проводить тестирование пациенток на наличие неблагоприятных вариантов генов детоксикации и их сочетаний.
2. Для реализации репродуктивной функции рекомендуется проведение безотлагательных мероприятий, направленных на лечение бесплодия у пациенток с НГЭ и восстановление у них функции гипоталамо-гипофизарно-яичниковой системы.
3. С учётом последствий оперативных вмешательств на придатках матки (особенно резекции яичников), рекомендуется проведение максимально органосберегающих объемов с целью сохранения овариального резерва.
4. С целью профилактики формирования и прогрессирования НГЭ рекомендуется использование шкалы модифицируемых и немодифицируемых факторов риска. Особое внимание следует уделять своевременному лечению ИППП и ВЗОМТ, профилактике инвазивных вмешательств, своевременной коррекции хронической ановуляции и лечению гиперпластических процессов эндометрия.
5. С целью применения неинвазивных методов диагностики наличия НГЭ и его стадий представляется возможность использования количественных показателей изученных факторов роста, отражающих характер регуляторных нарушений клеточного роста:
- для биохимической верификации НГЭ в сыворотке крови определяют уровень ЭФР и оФРФ, после чего рассчитывают их соотношение; при величине коэффициента ЭФР/оФРФ равной или более 10 диагностируют НГЭ.
- увеличение в сыворотке крови содержания оФРФ в 2,5 раза относительно нормы свидетельствует о наличии НГЭ I-II стадии, при повышении в сыворотке крови уровня ЭФР в 2 раза диагностируют НГЭ III-IY стадии, а пятикратный рост концентрации СЭФР указывает на рецидивирование НГЭ. Количественные показатели данных факторов роста представляют исключительную ценность, так как позволяют осуществлять не только диагностику НГЭ и конкретных его стадий, но и проводить под их контролем патогенетическую терапию, что будет также способствовать восстановлению фертильности и здоровья пациенток.
Список работ, опубликованных по теме диссертации
1. Ермолова Н.В. Клиническая характеристика больных с перитонеальным эндометриозом и бесплодием // Сборник научно-практических материалов съезда акушеров-гинекологов Южного федерального округа «Современные проблемы диагностики и лечения нарушения репродуктивного здоровья женщин. - Ростов-на-Дону, 2005. - С. 128-131.
2. Ермолова Н.В. Клинические аспекты характеристики больных с перитонеальным эндометриозом и бесплодием // Материалы YII Российского форума «Мать и дитя». - Москва, 2005. - С. 379 – 380.
3. Ермолова Н.В. Клинические особенности течения наружного генитального эндометриоза у пациенток с бесплодием // Известия ВУЗов Северо-Кавказский регион. Актуальные проблемы акушерства и педиатрии. Естественные науки. Спецвыпуск. – 2005. - С. 51 – 54.
4. Ермолова Н.В., Орлов В.И. Ангиогенные факторы роста у пациенток с наружным генитальным эндометриозом // Тезисы Международного конгресса «Практическая гинекология: от новых возможностей к новой стратегии». - Москва, 2006. - С.61.
5. Ермолова Н.В., Орлов В.И. Содержание цитокинов в перитонеальной жидкости и сыворотке крови больных с наружным генитальным эндометриозом // Тезисы Международного конгресса «Практическая гинекология: от новых возможностей к новой стратегии». - Москва, 2006. - С.61 - 62.
6. Ермолова Н.В., Орлов В.И., Зинкин В.И., Скачков Н.Н., Берлим А.А., Зинкина Е.В., Ширинг А.В. Факторы ангиогенеза при перитонеальном эндометриозе у пациенток с бесплодием // Научно-практический журнал «успехи современного естествознания». - Москва, 2006. - № 6. - С. 29.
7. Ермолова Н.В., Орлов В.И. Роль цитокинов перитонеальной жидкости и сыворотки крови в патогенезе наружного генитального эндометриоза // Труды V Международной конференции «Обмен веществ при адаптации и повреждении». - Ростов н/Д, 2006. - С.66 -69.
8. Ермолова Н.В. Содержание цитокинов в перитонеальной жидкости и сыворотке крови больных наружным генитальным эндометриозом и бесплодием // Акушерство и гинекология, Москва, 2007, депонирована в ЦНМБ ММА им.И.М.Сеченова № Д – 27808. - 11с.
9. Ермолова Н.В., Орлов В.И. Значение факторов роста в патогенезе бесплодия у пациенток с наружным генитальным эндометриозом // Материалы V Всероссийского конгресса эндокринологов. Высокие медицинские технологии в эндокринологии. - Москва, 2006. - С.584.
10. Ермолова Н.В. Эндотелиальные факторы перитонеальной жидкости при наружном генитальном эндометриозе у больных с бесплодием // Материалы VIII Всероссийского форума «Мать и дитя». - Москва, 2006. - С. 387 – 388.
11. Ермолова Н.В. Значение ангиогенных факторов роста в и их рецепторов в патогенезе наружного генитального эндометриоза и бесплодия // Материалы VIII Всероссийского форума «Мать и дитя». - Москва, 2006. - С. 386 – 387.
12. Ермолова Н.В., Орлов В.И. Оценка роли рецепторов ангиогенных факторов роста у пациенток с бесплодием, ассоциированным с наружным генитальным эндометриозом // Тезисы XVI Международной каонференции РАРЧ «Вспомогательные репродуктивные технологии сегодня и завтра». - Ростов н/Д, 2006. - С. 32 – 33.
13. Ермолова Н.В. Особенности гомеостаза ростовых факторов в перитонеальной жидкости и сыворотке крови у пациенток с наружным генитальным эндометриозом и бесплодием // Известия ВУЗов Северо-Кавказский регион. Актуальные проблемы акушерства и педиатрии. Естественные науки. Спецвыпуск. – 2006. - С. 54 – 57.
14. Ермолова Н.В. Цитокиновый статус пациенток с наружным генитальным эндометриозом и бесплодием // Материалы конференции «Актуальные вопросы диагностики и лечения метаболического синдрома». - Москва, 2006. - С. 41.
15. Ермолова Н.В. Дисфункция эндотелия - звено патогенеза наружного генитального эндометриоза у пациенток с бесплодием // Материалы III Всероссийской научно – практической конференции «Актуальные вопросы диагностики и лечения метаболического синдрома». Москва, 2006. – С.40.
16. Ермолова Н.В., Орлов В.И., Зинкин В.И., Берлим А.А., Зинкина Е.В., Скачков Н.Н., Ширинг А.В. Оксид азота и эндотелиальная дисфункция в патогенезе наружного генитального эндометриоза // Труды VI межвузовской конференции с международным участием «Обмен веществ при адаптации и повреждении». - Ростов н/Д, 2007. - С. 62 – 67.
17. Ермолова Н.В., Орлов В.И., Зинкин В.И., Берлим А.А., Зинкина Е.В., Скачков Н.Н., Ширинг А.В. Значение гомеостаза ангиогенных факторов роста в патогенезе наружного генитального эндометриоза // Материалы первого регионального научного форума «Мать и дитя». - Казань, 2007. - С.239 – 240.
18. Ермолова Н.В., Орлов В.И. Оксид азота и дисфункция эндотелия в патогенезе бесплодия при наружном генитальном эндометриозе // Современные технологии в диагностике и лечении гинекологических заболеваний. - Москва, 2007. - С.238 – 240.
19. Ермолова Н.В. Состояние эндотелиальтной системы перитонеальной жидкости при наружном генитальном эндометриозе // Тезисы XVII международной конференции РАРЧ «Репродуктивные технологии сегодня и завтра». - Казань, 2007. - С. 47 – 48.
20. Ермолова Н.В. Роль провоспалительных цитокинов перитонеальной жидкости и сыворотки крови в патогенезе наружного генитального эндометриоза // Материалы 9-го Всероссийского научного форума «Мать и дитя». - Москва, 2008. - С. 398 – 399.
21. Ермолова Н.В. Оксид азота и эндотелиальная дисфункция в патогенезе наружного генитального эндометриоза // Материалы 9-го Всероссийского научного форума «Мать и дитя». - Москва, 2008. - С. 399 - 400.
22. Ермолова Н.В. Значение эндотелиальной дисфункции в патогенезе бесплодия при наружном генитальном эндометриозе // Материалы Республиканской научно-практической конференции «Инновационные технологии в охране репродуктивного здоровья женщины». - Екатеринбург, 2007. - С.214 – 216.
23. Ермолова Н.В., Коган О.М. Способ диагностики наружного генитального эндометриоза // Решение о выдаче патента на изобретение. Заявка № 2008102329/15 (002541). – 2008. - 11 с.
24. Ермолова Н.В., Орлов В.И. Роль эндотелиальных факторов и половых гормонов в патогенезе наружного генитального эндометриоза // Второй международный конгресс по репродуктивной медицине «Репродуктивное здоровье семьи». - Москва, 2008. - С. 197 – 198.
25. Ермолова Н.В., Орлов В.И. Провоспалительные цитокины в патогенезе наружного генитального эндометриоза // Второй международный конгресс по репродуктивной медицине «Репродуктивное здоровье семьи». - Москва, 2008. - С. 198 – 199.
26. Ермолова Н.В. Патогенетическая роль эндотелиальных факторов и половых гормонов в формировании наружного генитального эндометриоза // «Российский Вестник акушера- гинеколога». МедиаСфера. – 2008. – Т. 8, № 3. - С. 29 – 33.
27. Ермолова Н.В. Значение нарушений процессов клеточной регуляции в развитии наружного генитального эндометриоза // «Российский Вестник акушера- гинеколога». МедиаСфера. – 2008. –Т. 8, № 3. – С. 29 – 33.
28. Ермолова Н.В., Орлов В.И., Зинкин В.И., Зинкина Е.В., Скачков Н.Н., Ширинг А.В. Эндотелиальные факторы и половые гормоны в патогенезе наружного генитального эндометриоза // Вестник Уральской медицинской академической науки Международная научно-практическая конференция «Репродуктивное здоровье населения Урала и Сибири». - Екатеринбург, 2008. - С. 9- 10.
29. Ермолова Н.В., Орлов В.И. Патогенетическая роль нарушений клеточной регуляции в развитии наружного генитального эндометриоза // Тезисы материалов XVIII международной конференции РАРЧ «Репродуктивные технологии сегодня и завтра». - Самара, 2008. - С. 63 – 64.
30. Ермолова Н.В., Орлов В.И., Зинкин В.И., Зинкина Е.В., Скачков Н.Н., Ширинг А.В. Роль нарушений процессов клеточной регуляции в патогенезе наружного генитального эндометриоза // Материалы IV съезда акушеров-гинекологов России. - Москва, 2008. - С. 354 – 355.
31. Ермолова Н.В., Орлов В.И. Новые аспекты патогенеза рецидива наружного генитального эндометриоза // Проблемы Репродукции. Спецвыпуск. III международный конгресс по репродуктивной медицине. – 2009. - С.180- 181.
32. Ермолова Н.В. Изменение экспрессии ангиогенных факторов роста и их рецепторов в развитии бесплодия при наружном генитальном эндометриозе // Вестник Волгоградского медицинского университета. - Волгоград, 2009. - №2. - С. 18 - 23.
Список сокращений:
ВЗОМТ – воспалительные заболевания органов малого таза
ГнРГ - гонадотропинрелизинг гормон
ИКК - иммуннокомпетентные клетки
ИКСИ – оплодотворение одной яйцеклетки одним сперматозоидом
ИЛ – интерлейкин
ИППП – инфекции, передаваемые половым путем
ИФР-1 – инсулиноподобный фактор роста
КОК – комбинированные оральные контрацептивы
ЛГ – лютеинизирующий гормон
МКБ – международная классификация болезней
ММП -9 – матриксная металлопротеиназа -9
НГЭ - наружный генитальный эндометриоз
оФРФ – основной фактор роста фибробластов
ПГЕ2 – простагландин Е2
ПЖ - перитонеальная жидкость
ПРЛ - пролактин
Pr – прогестерон
СА – раковый антиген
СЭФР – сосудистый эндотелиальный фактор роста
СЭФР –R – рецептор СЭФР
cVCAM1 – молекула межклеточной адгезии
sFASL - лиганд гена системы sFAS гена- регулятора апоптоза
Ts - тестостерон
ТТГ – тиреотропный гормон
Т3 – трийодтиронин
Т4 - тироксин
ТФР - трансформирующий фактор роста
УЗИ - ультразвуковое исследование
ФНО- – фактор некроза опухолей
ФР – факторы роста
ФСГ – фолликулостимулирующий гормон
ЦИК – циркулирующие иммунные комплексы
ЭФР - эпидермальный фактор роста
ЭФР-R – рецептор ЭФР
ЭКО – экстракорпоральное оплодотворение
Э2 - эстрадиол

