Комплексное магнитно-резонансное исследование в диагностике образований молочных желез и контроле эффективности их лечения
На правах рукописи
СЕРЕБРЯКОВА
Светлана Владимировна
КОМПЛЕКСНОЕ МАГНИТНО-РЕЗОНАНСНОЕ ИССЛЕДОВАНИЕ
В ДИАГНОСТИКЕ ОБРАЗОВАНИЙ МОЛОЧНЫХ ЖЕЛЕЗ
И КОНТРОЛЕ ЭФФЕКТИВНОСТИ ИХ ЛЕЧЕНИЯ
14.01.13 – лучевая диагностика, лучевая терапия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург
2010
Работа выполнена в ФГОУ ВПО «Военно-медицинская академия
им. С. М. Кирова» Министерства обороны Российской Федерации
НАУЧНЫЙ КОНСУЛЬТАНТ:
доктор медицинских наук профессор Труфанов Геннадий Евгеньевич
ОФИЦИАЛЬНЫЕ ОППОНЕНТЫ:
доктор медицинских наук профессор Амосов Виктор Иванович
доктор медицинских наук профессор Поздняков Александр Владимирович
доктор медицинских наук профессор Холин Александр Васильевич
ВЕДУЩЕЕ УЧРЕЖДЕНИЕ:
ФГУ «Научно-исследовательский институт онкологии имени проф. Н. Н. Петрова Федерального агентства по высокотехнологичной медицинской помощи»
Защита состоится «__» ____________ 2010 г. в ___ часов на заседании диссертационного совета Д 215.002.11 в ФГОУ ВПО «Военно-медицинская академия им. С. М. Кирова» Министерства обороны Российской Федерации
(194044, Санкт-Петербург, ул. Академика Лебедева, 6)
С диссертацией можно ознакомиться в фундаментальной библиотеке ФГОУ ВПО «Военно-медицинская академия им. С. М. Кирова» Министерства обороны Российской Федерации
Автореферат разослан «___» _________ 2010 г.
Ученый секретарь диссертационного совета
доктор медицинских наук профессор
ГОЛОВКО Александр Иванович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Одной из ведущих проблем онкологии является дифференциальная диагностика доброкачественных и злокачественных процессов, а также оценка распространенности опухолевого поражения молочных желез (Семиглазов В.Ф., 2001; Рожкова Н.И., 2005; Silverstein M.J., 2002; Berg W.A. et al., 2004). В Российской Федерации рак молочной железы занимает первое место по показателю заболеваемости (46,3 тыс.) и смертности (22,7 тыс.) на 100 тыс. человек среди злокачественных новообразований у женщин (Аксель Е.М., Давыдов М.И. и соавт., 2006). По данным ВОЗ, число новых случаев рака молочной железы, ежегодно выявляемых в разных странах мира, превышает 1 млн, при этом прогнозируется рост числа заболеваний до 1,35 млн (World Health Statistics, http://www.who.int/; Рожкова Н.И. и соавт., 2008; Parkin D. et al., 1999; Kataya V., 2008).
Результаты лечения зависят от эффективного и своевременного выявления и дифференциальной диагностики образований молочных желез, оценки степени вовлечения в опухолевый процесс регионарных лимфоузлов (Трофимова Е.Ю., 2000; Metreweli C., 2000; Летягин В.П., 2004). Основным методом лучевой диагностики рака молочной железы является рентгеновская маммография (Семиглазов В.Ф., 2004; Харченко В. П., 2005; Комарова Л. Е., 2006). Однако, по мнению большинства авторов, она не позволяет однозначно трактовать природу выявленного узлового образования, обладает низкой информативностью в выявлении образований у женщин молодого возраста, а также на фоне отечно-инфильтративных и рубцовых изменений. Имеются сложности и в оценке поражения регионарных лимфатических узлов (Маряшева Ю.А. и соавт., 2003; Корженкова Г.П., 2004; Куплевцкая Д.И., 2004; Чистяков С.С., 2006; Morris E.A., 2003; Chakraborti K.L., 2005). В настоящее время широкое распространение в маммологии получила ультразвуковая диагностика, применение допплеровских методик и появившаяся в последнее время методика эластографии добавляют ей новые диагностические возможности (Заболотская Н.В. и соавт., 2005; Chao T.C. et al., 1999; Iton A., Ueno E. et al, 2006; Tardivon A. et al., 2007). Вместе с тем УЗИ имеет определенные ограничения и трудности в выявлении образований на фоне жировой инволюции молочных желез, оценке протоковой распространенности опухоли; часто нераспознанными остаются опухоли, расположенные ретромаммарно в железах большого объема, а также узловые образования менее 1,5 см в диаметре; существенным недостатком метода является его операторозависимость (Заболотская Н.В., 2005; Камповой-Полевой Е.Б., 2006; Birdwell B. et al., 2003; Zhi H. et al., 2007, Rizzatto G., 2007).
В последние годы наибольший интерес среди исследователей в диагностике опухолей молочных желез вызывает магнитно-резонансная маммография (Назаренко Г.И. и соавт., 2003; Jacobs M.A., Knopp M.V. et al., 2003). Преимуществом МРТ является высокая контрастность, получение тонких срезов и в любых плоскостях, высокая разрешающая способность данного метода (Лукьянченко А.Б., 2001; Назаренко Г.И., 2003; Jacobs M.A., 2003). Но возможности этого метода изучены недостаточно, наряду с оптимистическими взглядами на перспективы МР-диагностики молочных желез существуют и достаточно сдержанные, а данные о преимуществах и недостатках противоречивы. Это связано с тем, что одни исследователи изучают возможности бесконтрастной МРТ в диагностике образований молочных желез, другие представляют результаты, полученные на низко- и среднепольных аппаратах, без применения современных технологических возможностей метода (Корженкова Г.П. и соавт., 2006; Абдурахимов А.Б., 2009). Главным препятствием к широкому внедрению МРТ в диагностический алгоритм обследования молочных желез, по мнению Р.А. Керимова (2006), является его дороговизна, некоторые авторы отмечают еще и ограниченную доступность к современным высокопольным МР-томографам, адаптированных для исследования молочных желез (Лукьянченко А.Б., Гурова Н.Ю., 2005). Другие исследователи считают, что МРТ не имеет преимуществ перед традиционными методами диагностики (Хайленко В.А., Комова Д.В. и соавт., 2005; Корженкова Г.П., 2006). Но при этом отмечают, что на фоне рубцовой послеоперационной и постлучевой деформации выявить рецидив рака молочной железы достаточно сложно, а порой и невозможно (Абдурахимов А.Б., 2009). Следует отметить, что в отечественной литературе не существует стандартизированного алгоритма комплексного лучевого обследования больных с подозрением на образование молочных желез, не отработаны показания к проведению МРТ, нет четких данных о МР-семиотике узловых образований, диффузных и возрастных изменений структуры желез. Требуют уточнения различные мнения по использованию МРТ не только в выявлении новообразований, но и в определении признаков распространения опухоли и в мониторинге лечения, выявлении послеоперационных осложнений. Также не освещена проблема диагностики осложнений и рецидива рака после оперативного и/или комбинированного лечения. Наиболее актуальна данная проблема у больных после органосохраняющего лечения рака молочной железы и различных видов пластических операций.
ЦЕЛЬЮ исследования явилось определить новые подходы к выявлению и дифференциальной диагностике образований, оценке местной и регионарной распространенности рака молочной железы, мониторингу эффективности оперативного и комбинированного лечения на основе проведения комплексного магнитно-резонансного исследования.
В соответствии с целью исследования определены следующие ЗАДАЧИ:
1. Разработать методику комплексного МР-исследования молочных желез с использованием поверхностной матричной катушки и различных импульсных последовательностей с целью оптимизации алгоритма исследования и повышения его диагностической эффективности.
2. Определить критерии нормальной МР-анатомии, возрастных особенностей МР-строения, а также особенностей контрастирования ткани молочных желез при ДКУ.
3. Систематизировать МР-семиотику доброкачественных и злокачественных образований молочных желез и разработать их дифференциально-диагностические критерии. Определить изменение сосудистой сети и степень васкуляризации образований, провести корреляцию между параметрами ДКУ и гистологическими типами опухолей.
4. Определить эффективность МРТ с ДКУ в оценке местной и регионарной распространенности рака молочной железы.
5. Определить диагностическую информативность различных методик комплексного МР-исследования и критерии оценки эффективности лечения больных с образованиями молочных желез.
6. Разработать МР-семиотику послеоперационных осложнений, алгоритм комплексного МР-исследования в зависимости от вида лечения и периода лечебно-диагностического процесса, а также оценить возможности МРТ с ДКУ в диагностике продолженного роста и рецидива опухоли.
7. Определить показания, роль и место МРТ с ДКУ в алгоритме обследования женщин с патологией молочных желез.
Научная новизна
Работа является обобщающим научным трудом, посвященным целенаправленному изучению возможностей МРТ с ДКУ в выявлении и дифференциальной диагностике опухолей молочных желез. В работе впервые на большом клиническом материале (766 пациенток) проведен анализ результатов применения основных методик МРТ в диагностике заболеваний молочной железы. Разработана рациональная комп-лексная методика МРТ с последующей постпроцессорной обработкой полученных данных, отвечающая всем современным требованиям, предъявляемым к исследованиям больных с применением новых технологий в лучевой диагностике. Установлено, что наиболее полная характеристика патологических изменений молочной железы базируется на последовательном использовании нативного сканирования, особенно с подавлением сигнала от жировой ткани, МРТ с динамическим контрастным усилением и постпроцессорной обработки полученных данных с построением графических кривых, MIP-реконструкций и перфузионных карт.
Впервые детально изучены нормальная МР-анатомия и варианты возрастных особенностей строения; особенности васкуляризации и перфузии ткани молочных желез. На основе которых разработана комплексная магнитно-резонансная семиотика наиболее часто встречающихся диффузных изменений и узловых образований молочных желез.
Обоснована и уточнена роль МРТ в оценке распространенности и стадировании рака. При этом доказано, что МРТ позволяет уточнить локализацию опухоли, оценить степень опухолевой инфильтрации и определить характер роста. Изучена роль МРТ в оценке поражения регионарных лимфатических узлов, послеоперационной диагностике ранних и поздних осложнений, а также в мониторинге химиотерапии, выявлении рецидива и продолженного роста рака молочной железы.
Сформулированы основные принципы комплексной МРТ молочных желез:
- Принцип комплексности методик МР-исследования – применение оптимального комплекса МР-методик, исходя из определенной клинической ситуации.
- Принцип комплексности интерпретации МР-симптомов при изучении результатов МР-исследования.
- Принцип комплексности клинико-лучевой интерпретации данных МР-исследования с учетом анамнеза, данных клинико-лабораторных, инструментальных методов исследования, а также результатов гистологического исследования материалов, полученных при биопсии и оперативных вмешательствах.
- Принцип этапности МР-исследования – обязательные контрольные МР-исследования в процессе лечения.
На основании предложенных принципов, а также с учетом анализа результатов выполненных исследований разработаны оптимальные диагностические алгоритмы использования различных методик при первичной диагностике, стадировании рака молочной железы, динамическом контроле консервативной терапии и после оперативного лечения. Показано, что использование ДКУ и постпроцессорной обработки с использованием МР-перфузии позволяет существенно повысить эффективность МРТ в выявлении и дифференциальной диагностики образований молочных желез, позволяет с высокой точностью визуализировать гиперваскулязированную ткань при рецидиве. Новым является построение математической модели дифференциальной диагностики узловых образований молочных желез на основе применения комплексной МРТ с ДКУ, и при использовании методов лучевой диагностики в комплексе, позволяющих в полуавтоматическом режиме с большой вероятностью (96,5%) высказаться о характере имеющейся патологии и планировать дальнейшую тактику лечения больных.
Практическая значимость
Разработана и внедрена в клиническую практику методика МРТ молочных желез у женщин с применением специальной поверхностной катушки, проведена оптимизация методик МР-исследования, которая позволила сократить общее время исследования без потери качества получаемых изображений на высокопольном МР-томографе с индукцией поля 1,5 Тл.
Обобщена нормальная МР-анатомия молочных желез с анализом вариантов их строения. Разработанный комплексный подход в интерпретации МР-симптомов значительно облегчает проведение дифференциальной диагностики заболеваний молочной железы. Внедрение в клиническую практику МРТ с ДКУ наглядно представляет особенности васкуляризации доброкачественных и злокачественных образований молочных желез. Разработанная МР-семиотика и комплексная МР-методика помогают определению стадии опухолевого процесса и способствуют обоснованному отбору пациентов для хирургического лечения, особенно органосохраняющего.
Проведено сопоставление данных динамической МРТ с результатами гистологического анализа и сравнение информативности различных методов лучевой визуализации в дифференциальной диагностике узловых образований, были выбраны наиболее информативные диагностические критерии, выявлены их статистически достоверные различия в различных группах. Разработаны алгоритмы динамического контроля и наблюдения в диагностике ранних и поздних послеоперационных осложнений, оценки результатов пластических операций, выявлению на этом фоне рецидива и продолженного роста.
На основании полученных данных построена математическая модель дифференциальной диагностики узловых образований молочных желез, определены чувствительность, специфичность и диагностическая точность методики и место МРТ в общем алгоритме лучевой диагностики.
Разработаны оптимальные, важные для практического использования параметры МР-исследования при различной патологии молочных желез, сформулированы показания и практические рекомендации к комплексному применению МРТ с ДКУ в диагностике заболеваний молочных желез и оценке эффективности их лечения.
Основные положения, выносимые на защиту
- Комплексное МР-исследование является высокоинформативным методом, с помощью которого возможно получение полной и объективной характеристики деталей нормального строения и патологических изменений внутренней структуры молочных желез независимо от возраста женщины, размеров и внутренней структуры молочных желез.
- Применение разработанной методики МРТ с ДКУ позволяют с высокой надежностью оценить морфологию и васкуляризацию узловых образований молочных желез, прогнозировать вероятность злокачественного характера образования, выявлять метастазы в лимфатических узлах при раке молочной железы.
- МРТ является наиболее эффективным методом выявления опухолей молочной железы небольших размеров, независимо от их расположения, типа строения внутренней структуры железы, наличия отечно-инфильтративных изменений и рубцовой деформации. МРТ является наиболее информативным методом диагностики оценки местной и регионарной распространенности рака молочной железы.
- Комплексная МРТ является высокоинформативным методом в оценке состояния эндопротезов, выявлении послеоперационных осложнений, продолженного роста и рецидива опухоли, а также позволяет оценить непосредственный эффект химио- и лучевой терапии.
Реализация результатов работы
Результаты диссертационного исследования используются в практической работе отделений ультразвуковой, магнитно-резонансной и компьютерной томографии кафедры рентгенологии и радиологии с курсом ультразвуковой диагностики, в клиниках общей и госпитальной хирургии, акушерства и гинекологии Военно-медицинской академии, а также в онкологических стационарах Санкт-Петербурга и Ленинградской области. Основные научно-практические положения диссертации используются в учебном процессе на кафедрах рентгенологии и радиологии для курсантов и слушателей факультетов усовершенствования врачей ВМедА и курса лучевой диагностики Санкт-Петербургского государственного университета.
Апробация работы
Основные положения диссертации доложены на следующих отечественных и международных конференциях: юбилейной конференции «Современная лучевая диагностика в многопрофильном лечебном учреждении», посвященной 75-летию кафедры рентгенологии и радиологии Военно-медицинской академии (СПб, 2004); Невском радиологическом форуме (СПб, 2005, 2007, 2009); научно-практических конференциях на кафедре рентгенологии и радиологии ВМедА (2005–2009), Всероссийском научном форуме «Радиология» (М., 2006-2009); юбилейной конференции «Роль лучевой диагностики в многопрофильной клинике и лечебных учреждениях стоматологического профиля», посвященной 60-летию кафедры рентгенологии и радиологии СПбГМУ (СПб, 2006); научно-практической конференции ГВКГ им. Н.Н. Бурденко «Актуальные проблемы клинической онкологии» (М, 2006); IV, V международных ежегодных конференциях «Белые ночи Санкт-Петербурга», посвященных проблемам диагностики и лечения рака молочной железы (СПб, 2007, 2008); научно-практической конференции «Россия – страна контрастов» (СПб, 2007); 20th European Congress of Radiology – ECR'2008 (Vienna, Austria, 2008); международном радиологическом форуме (Астана, Казахстан, 2008); международной научной конференции «От лучей Рентгена – к инновациям XXI века: 90 лет со дня основания первого в мире рентгенорадиологического института» (СПб, 2008); заседаниях Санкт-Петербургского радиологического общества (2006–2009); юбилейной научно-практической конференции «Современные возможности лучевой диагностики заболеваний и повреждений в многопрофильном лечебном учреждении», посвященной 80-летию основания кафедры рентгенологии и радиологии ВМедА (СПб, 2009).
Всего сделано 26 докладов. По материалам диссертации опубликовано 74 печатных работ в центральных научных журналах, материалах конференций, симпозиумов и сборниках научных трудов, из них 18 работ в журналах, рекомендованных ВАК РФ. Внедрено 2 рационализаторских предложения.
Личный вклад автора в выполнение работы
Автором лично проведено комплексное МР-исследование молочных желез 766 пациенткам. Детальному анализу были подвергнуты результаты нативного МР-сканирования, МРТ с ДКУ и МР-перфузии. Результаты комплексного обследования составили содержание работы и легли в основу положений, выносимых на защиту.
Тема диссертационного исследования тесно согласуется с научно-исследовательскими работами. Автор является соисполнителем по темам НИР (Военно-медицинская академия, шифр «Контур» «Магнитно-резонансная томография в диагностике опухолевых и неопухолевых заболеваний молочных желез» №VMA.03.12.20.0508/0276 и «Горизонт» «Комплексная лучевая диагностика в стадировании рака молочной железы» №VMA.03.12.20.0508/0277), основные направления которых перекликаются с материалами диссертационного исследования.
Тема и план диссертации, ее основные идеи и содержание разработаны совместно с научным консультантом на основании многолетних (2004–2009 гг.) целенаправленных исследований. Во всех совместных исследованиях по теме диссертации автору принадлежит формулирование общей цели и задач конкретной работы, а также анализ полученных данных. Все результаты комплексного МР-исследования, использованные в диссертационной работе, получены и обработаны лично автором.
Структура и объем диссертации
Диссертация состоит из введения, семи глав, заключения, выводов, практичес-ких рекомендаций и списка литературы. Работа содержит 114 рисунков, 54 таблицы. Список литературы включает 223 источников (108 отечественных и 115 зарубежных). Текст диссертации изложен на 315 страницах.
СОДЕРЖАНИЕ РАБОТЫ
Общая характеристика обследованных больных и методика
комплексного МР-исследования молочных желез
В основу работы положены данные комплексного магнитно-резонансного исследования 766 женщин в возрасте от 16 до 87 лет (средний возраст 49,9±11,6 года), проходивших обследование на кафедре рентгенологии и радиологии Военно-медицинской академии в 2004–2009 годах. С учетом клинически установленных диагнозов и конкретных задач исследования и по результатам лучевого обследования все женщины были разделены на следующие группы: I группа – 162 женщины с образованиями молочных желез доброкачественной природы (21,1%), из них 47 женщин с крупными кистами и 115 – с солидными узловыми образованиями; II группа – 250 пациенток с образованиями злокачественной природы (32,6%); III группа – 264 больных, которым проводили комплексное клинико-лучевое обследование мониторинга лечения, из них результаты проведенных оперативных вмешательств были проанализированы у 206 женщин (после секторальных резекций по поводу доброкачественных изменений 56 человек (27,2%), после по поводу злокачественных – 47 (22,8%), после мастэктомии – 80 больным (38,8%) и после различных видов пластических оперативных вмешательств – 44 пациенткам (21,3%). Эффективность консервативного и/или комбинированного лечения была проанализирована у 58 женщин, из них неоадъювантной химиотерапии 25 больных. Повторное МР-исследование выполнено из числа обследуемых I и II групп – 112 женщинам.
Средний возраст женщин I группы составил – 41,8±9,8 года, II группы – 53±10,2 года. Различие среднего возраста пациенток в группах статистически достоверно (p1-2<0,001). У женщин в возрасте от 41 до 50 лет (т. е. у социально активной, трудоспособной части населения) отмечается сравнимое количество образований, как доброкачественной, так и злокачественной природы (25,3% и 28,0%, соответственно), что говорит об особой актуальности проблемы дифференциальной диагностики образований молочных желез для этой возрастной категории.
По гистологической структуре пациентки I и II групп были распределены следующим образом (табл. 1).
Таблица 1
Распределение больных по гистологической структуре образований
| Гистологическая структура | Количество больных | ||
| абс. | % | ||
| Кисты, из них: | 47 | 11,4 | |
| Простые | 34 | 72,3 | |
| Сложные | 13 | 27,7 | |
| Доброкачественные опухоли, из них: | 115 | 27,9 | |
| Фиброаденома | Периканаликулярная | 55 | 47,8 |
| Интраканаликулярная | 18 | 15,7 | |
| Смешанная | 3 | 2,6 | |
| Локализованный фиброаденоматоз, липома, цистоаденопапиллома, листовидная опухоль, гамартома | 39 | 33,9 | |
| Злокачественные опухоли, из них: | 250 | 60,7 | |
| Рак молочной железы | Инфильтративный протоковый | 168 | 67,2 |
| Неинфильтративный протоковый | 14 | 5,6 | |
| Инфильтративный дольковый | 44 | 17,6 | |
| Др. формы (слизистые, медуллярные и др.) | 21 | 8,4 | |
| Саркома | 3 | 1,2 | |
| Всего | 412 | 100 | |
Из таблицы 1 следует, что среди доброкачественных образований молочных желез наиболее часто диагностирована периканаликулярная фиброаденома (47,8%). Значительно реже были выявлены интраканаликулярная фиброаденома, цистоаденопапиллома и листовидная опухоль (15,7%, 7,8%, 10,4%, соответственно). Злокачественные опухоли молочных желез в подавляющем большинстве случаев были представлены различными формами рака, в 67,2% наблюдениях – инфильтративно-протоковым. У пациенток III группы были проанализированы МР-признаки вариантов осложнений в зависимости от вида оперативного вмешательства и от сроков выполнения МР-исследования. Различные осложнения после оперативных вмешательств были выявлены у 92 (44,7%) женщин. Наиболее часто встречаемыми осложнениями после оперативных вмешательств были различные виды сером и воспалительные изменения (16,3%), рецидив образования в оперированной железе был выявлен у 34 женщин (36,9%). Злокачественные образования в противоположной железе были выявлены у 23 пациенток, доброкачественные у 15 женщин.
Всем пациенткам проведено комплексное клинико-лучевое и морфологическое обследования, которые включали в себя клиническое обследование (100%), рентгеновскую маммографию (83,4%), УЗИ (96,3%), МРТ с ДКУ (100%), гистологическое исследование у женщин с узловыми образованиями (95,9%).
Для определения распространенности процесса женщинам со злокачественными образованиями были выполнены УЗИ брюшной полости и малого таза (100%), КТ груди (47,2%), ОФЭКТ молочных желез с 99mTc-МИБИ (38,4%), сцинтиграфия скелета с 99mTc-пирфотех (100%), ПЭТ-КТ тела с 18F-дезоксиглюкозой (18,4%), МРТ или КТ головного мозга (10%).
Таким образом, основу клинического материала составили больные с узловыми образованиями молочных желез (44,6%), из них у 1/3 женщин были выявлены доброкачественные и у 2/3 злокачественные образования. Мониторинг лечения был проведен 264 больным (28,6%). Женщины с проявлениями диффузного фиброаденоматоза составили 19,0% от общего числа обследуемых пациенток. Эта группа была выделена для анализа изменений клинико-лучевой картины, обусловленных диффузными изменениями ткани молочной железы и дифференцировки на этом фоне образований разной природы. Для сравнительной оценки выявляемых изменений и оценке «возрастных» особенностей была выделена контрольная группа, составившая 7,8% обследуемых.
Разработанная комплексная методика МРТ с ДКУ
МРТ молочных желез выполняли на аппарате Magnetom Symphony с напряженностью магнитного поля 1,5 Тесла, используя специальную поверхностную катушку Breast Coil. Для первичной оценки структуры молочных желез выполняли Т2 ВИ без и с использованием подавления сигнала от жировой ткани (FS); затем выполняли одну преконтрастную серию Т1ВИ 3D FLASH FS в аксиальной плоскости с толщиной среза 1,2 мм. Далее с помощью автоматического инъектора внутривенно болюсно вводили контрастное вещество из расчета 0,1 ммоль/кг и после 10–20 секундной задержки выполняли 5 постконтрастных серий с теми же техническими параметрами. Затем проводили Т1ВИ 3D FS последовательность в сагиттальной плоскости с толщиной среза 0,5–0,8 мм, обладающей высокой разрешающей способностью. Для контрастного усиления использовали парамагнитные контрастные средства 0,5 и 1 ммоль/мл. Общее время МРТ с ДКУ молочных желез в среднем составляло 20–26 минут.
В завершение исследования проводили постпроцессорную обработку: цифровую субтракцию (вычитание из постконтрастных изображений преконтрастных); оценивали степень накопления контрастного вещества патологическим образованием; производили построение MIP-реконструкций для визуализации сосудистой сети опухоли. Затем проводили анализ динамики захвата и выведения контрастного вещества тканью молочной железы и построение кривых, отображающих этот процесс. Для этого из нескольких серий, полученных в результате динамического сканирования, выбирали срез (уровень), на котором более четко определялся патологический участок. Затем с использованием специализированных программ Mean Curve, анализировали изменение МР-сигнала в выбранных областях во всех сериях динамического сканирования. Данные анализа представляли либо в табличном виде, либо в виде кривых «интенсивность сигнала – время», в которых за точку отсчета принимали интенсивность сигнала от зоны интереса до контрастного усиления. Для стандартизации показателей динамики накопления контрастного вещества использовали классификацию Kuhl C.K et al. (2003), в которой все виды кривых были разделены на три типа по характеру хода в раннюю, среднюю и позднюю фазы ДКУ: I тип – кривая постоянного роста, II тип – кривая с быстрым увеличением с формированием плато, III тип – кривая с выраженным максимумом и быстрым снижением амплитуды МР-сигнала в первые минуты. Таким образом, основными параметрами, оцениваемыми при ДКУ, были: время максимального пика, уровень повышения интенсивности сигнала, выраженный в процентах, и тип графической зависимости. По характеру накопления и выведения контрастного вещества представлялось возможным судить о предположительной природе образования.
В дальнейшем результаты динамического исследования обсчитывали в специальном пакете программ Breast Perfusion. Методика перфузионной МРТ представляет собой математический обсчет изображений, полученных при первом прохождении болюса контрастного вещества с последующим цветовым картированием полученных данных. Анализ динамических кривых по картам распределения контрастного вещества позволяет получать оценку скорости и количества притока (Wash in) и его вымывания (Wash out) контрастного вещества, а также расчет времени до пика контрастного усиления ткани молочных желез – TTP (Time To Peak), построение реконструкции максимальной интенсивности изображений за все время динамического сканирования – MIP time и перфузии опухоли – PEI (Positive Enhancement Integral), рассчитываемый как интеграл положительного накопления, или площадь под графической кривой прохождения контрастного болюса. Мы использовали цветовое картирование по красно-желто-сине-черной шкале, в которых минимальные изменения окрашивались синим цветом, а максимальные – красным, или их оттенками; для построения изображений оттока и времени пика контрастного вещества использовались инвертированные данные. Перфузионно-взвешенные изображения (PEI) являются наиболее чувствительными в оценке васкуляризации образований.
Таким образом, применение разработанной методики на высокопольном МР-томографе с проведением постпроцессорной обработки и построением перфузионных карт позволяет оценивать структуру желез, выявлять и проводить дифференциальную диагностику на этом фоне образований молочных желез.
Статистическую обработку результатов исследования проводили с использованием процедур и методов статистического анализа (определение числовых характеристик переменных; оценка соответствия эмпирического закона распределения количественных переменных теоретическому закону нормального распределения по критерию Колмогорова-Смирнова; оценка значимости различий средних значений количественных показателей в независимых выборках по t-тесту Стьюдента). Проверку гипотезы о происхождении групп, сформированных по качественному признаку из одной и той же популяции, проводили на основе построения таблиц сопряженности наблюдаемых и ожидаемых частот с применением критерия Хи-квадрата Пирсона (Pearson Chi-square), при его неустойчивости использовали двусторонний точный тест Фишера (Fisher exact test); логистический регрессионный анализ.
Результаты МР-исследования возрастных вариантов развития и
особенностей строения молочных желез
Контрольную группу составили 72 женщины, средний возраст – 48,0±11,2 года. Все женщины были распределены на 4 возрастные подгруппы – до 30 лет, от 31 до 40, от 41 до 50 и старше 50 лет. Нами был проведен эксперимент по выбору наиболее оптимального способа расчета объемов молочной железы и железистой ткани для определения типа строения железы в зависимости от размеров железы и ее соотношения с чашей катушки для исследования. Для определения типа внутреннего строения молочных желез использовали классификацию, предложенную в 1989 г. Wolfe G. et al., которая основана на соотношении железистой и жировой тканей: I тип – это тотальное замещение ткани железы жировой тканью; II тип – до 25–50% объема железы представлено железистой тканью; III тип – до 50–75% объема железы представлено железистой тканью; IV тип – жировая ткань практически отсутствует, железистая ткань хорошо выражена, занимает более 75% объема железы.
Было доказано, что при правильной форме для расчета объема молочной железы можно использовать формулу цилиндра или усеченного конуса (в зависимости от размера желез и её соотношений с чашей катушки). При патологических состояниях, приводящих к изменению и деформации формы железы, необходимо проводить измерения дважды – у основания и посередине с суммированием полученных данных. Для оценки симметричности внутреннего строения мы определяли модуль разницы в процентах между объемами железистой ткани и всей железы. Для расчета объема железистой ткани также использовали формулу усеченного конуса с вычитанием толщины пре- и ретромаммарной клетчатки. У женщин контрольной группы асимметрия размеров молочных желез более 15% была выявлена у 17 женщин (23,6%) и отмечалась во всех подгруппах, что является индивидуальной особенностью и не зависит от возраста женщин (р=0,655). Асимметрия внутреннего строения у женщин контрольной группы, рассчитанная по модулю разницы объемов правой и левой молочных желез, была выявлена у 26 женщин (37,1%), средние его значения составили 13,0±11,6%. Распределение женщин контрольной группы по типам внутреннего строения молочных желез в различных возрастных подгруппах показало, что наиболее вариабельное строение молочных желез имело место у женщин в возрасте от 30 до 50 лет, в этих возрастных подгруппах встречались все типы строения. Эта закономерность более отчетливо прослеживалась при сравнении женщин до 30 и старше 50 лет, это объясняется физиологическими процессами жировой инволюции и было статистически достоверно (p<0,001). Различия значений размеров железы у женщин в других возрастных подгруппах не были значимыми (p>0,05).
При анализе данных динамического контрастирования у женщин контрольной группы было отмечено, что ткань молочной железы незначительно и равномерно накапливает контрастное вещество в течение всего времени исследования. У большинства женщин контрольной группы (86,1%) средние значения накопления контрастного вещества железистой тканью не превышали 100% и имели первый тип графической зависимости. Второй тип накопления встречался значительно реже – у 13,9% женщин. Третий тип графической зависимости накопления контрастного вещества при ДКУ у женщин контрольной группы выявлен не был. Измеряемое повышение интенсивности сигнала на Т1 ВИ от ткани железы составило от 5 до 141%, а среднее повышение интенсивности сигнала – 59,54±29,99%. При анализе параметров ДКУ у женщин контрольной группы было выявлено следующее: с возрастом происходит уменьшение уровня накопления контрастного вещества в среднем с 77,6±22,2% у женщин младше 30 лет до 47,6±26,0% в старшей возрастной подгруппе. В возрастных подгруппах достоверных статистических различий в степени накопления контрастного вещества выявлено не было. При оценке достоверности различий средних значений значимым было только различие у женщин младшей и старшей возрастных подгрупп (F=25,69, df=3, p<0,0001), что объясняется снижением степени пролиферации ткани железы именно в этих возрастных пределах за счет ее уплотнения и фиброза, что связано с физиологическим уменьшением уровня гормонального фона.
Неравномерное очаговое накопление контрастного вещества железистой тканью нами определено у молодых женщин (до 30 лет), особенно при проведении исследования во вторую фазу менструального цикла. Эти изменения необходимо учитывать при проведении исследования, так как они могут приводить к диагностическим ошибкам как в сторону гипердиагностики вследствие неспецифического повышения сигнала при контрастировании, так и гиподиагностики, поскольку могут сочетаться и «маскировать» злокачественную опухоль небольших размеров. На основании этого МРТ с ДКУ молодым женщинам репродуктивного возраста необходимо проводить в период минимального гормонального воздействия – в первую фазу менструального цикла и строго по показаниям.
Таким образом, комплексное МР-исследование является информативным методом определения типов строении железы, оценки размеров и внутренней архитектоники, а также диагностики вариантов и аномалий развития молочных желез. Знание возрастных особенностей строения, критериев накопления контрастного вещества железистой тканью при ДКУ и особенностей МР-перфузии молочных желез позволяет более эффективно проводить дифференциальную диагностику узловых образований на этом фоне.
Результаты комплексного МР-исследования женщин с диффузными изменениями структуры молочных желез
Всего обследованы 175 женщин с диффузными изменениями внутренней структуры молочных желез, средний возраст составил 44,5±9,5 года, большинство женщин были в возрасте от 41 до 60 лет (61,1%). Это объясняется тем, что именно в этом возрасте происходят более выраженные изменения, связанные с перестройкой гормонального фона женщин. Доля женщин других возрастных групп значительно меньше (р<0,001). У женщин данной группы, в отличие от контрольной, имелись различные жалобы – болевые ощущения различной степени отмечали 59,4%, локальные уплотнения в молочных железах, выявляемые при самостоятельной пальпации – 57,7% женщин. При объективном обследовании у 76,6% женщин при пальпации структура железы не соответствовала фазе менструального цикла или возрасту, то есть отмечались клинические признаки дисгормональных изменений структуры желез. Патологические изменения в органах малого таза и в щитовидной железе были выявлены у 49,1% женщин с диффузными изменениями по сравнению с 12,5% у женщин контрольной группы, что статистически является достоверным, р<0,001.
Все пациентки с диффузными изменениями внутренней структуры в зависимости от преобладающего компонента были разделены на 4 вида ФАМ: железистый (39), фиброзный (44), кистозный (41) и смешанный (51). Большая часть женщин имели среднюю степень выраженности проявлений диффузных изменений – 47,43% и характеризовалась II-III типом внутреннего строения. У 90% женщин с диффузными изменениями размеры молочных желез были симметричными, и 85,3% симметричным было и внутреннее строении, что отличало эту группу от женщин других групп и является статистически достоверным, р<0,001.
При проведении МРТ с ДКУ у 125 женщин (71,4%) было выявлено диффузное накопление тканью железы, у остальных накопления было минимальным или отсутствовало. При построении MIP-реконструкций сосудистая сеть при всех видах диффузных изменений внутренней структуры молочных желез была не изменена. У 48,6% женщин с диффузными изменениями внутренней структуры определена средняя интенсивность сигнала, не превышающая 100%, у большинства пациентов выявляли I тип графической зависимости накопления контрастного вещества (84,6%). Накопление контрастного вещества железистой тканью более 100% от первоначального уровня выявлено лишь у женщин со смешанным вариантом ФАМ (13,7%) и у женщин с преобладанием железистого компонента (23,1%), что необходимо принимать во внимание в процессе дифференциальной диагностики.
Главной особенностью диффузных изменений внутренней структуры ткани молочной железы явилось наличие пролиферативных изменений в норме у женщин различных возрастных подгрупп, на фоне которых необходимо выявлять и проводить дифференциальную диагностику узловых образований. Нами были построены усредненные графические кривые для различных видов фиброаденоматоза по средним значениям изменения интенсивности сигнала и по характеру накопления контрастного вещества при ДКУ от ткани молочных желез (рис.1). При построении перфузионных карт у женщин с диффузными изменениями особенностей васкуляризации железистой ткани выявлено не было.

Рис. 1. Диаграмма графической зависимости изменений интенсивности сигнала при проведении ДКУ для различных вариантах ФАМ
Таким образом, кинетика контрастирования при различных видах ФАМ различна и зависит от выраженности пролиферативных изменений в железистой ткани. Максимальных значений она достигает при железистом варианте, минимальных – при фиброзном. При смешанном и кистозном вариантах – диапазон изменения интенсивности сигнала средний, но для значительного большинства различных видов диффузных изменений внутренней структуры молочных железе характерен I тип накопления контрастного вещества.
Результаты комплексного МР-исследования женщин с узловыми образованиями молочных желез доброкачественной природы
Обследованы 162 женщины с доброкачественными узловыми образованиями, природа которых была подтверждена при морфологическом обследовании. Чаще (45,7%) образования встречались у женщин в возрасте до 40 лет. Доля женщин других возрастных групп была значительно меньше (р<0,001). Патологические изменения в органах малого таза и в щитовидной железе были выявлены у 40,1% женщин с доброкачественными образованиями по сравнению с 12,5% у женщин контрольной группы, что статистически является достоверным, р<0,001.
При анализе размеров – симметричными молочные железы были у 132 пациенток (81,5%); а при анализе симметричности внутреннего строения у 130 женщин (80,2%). У превалирующего количества женщин данной исследуемой группы имелись признаки различных вариантов ФАМ (72,3%), на фоне которых выявлялись образования. Чаще были выявлены признаки железистого варианта фиброаденоматоза (40,9%), реже – смешанного варианта (35,8%), еще более редко и приблизительно одинакового количества – кистозного (12,1%) и фиброзного вариантов (11,2%).
По нашим данным, у женщин с доброкачественными образованиями и диффузными изменениями объем железистой ткани достоверно больше, чем в контрольной группе у женщин соответствующих возрастных групп (p<0,05), что соответствовало II и III типам внутреннего строения. Признаки узловых образований молочных желез при рентгеновской маммографии выявлены у 118 человек (72,8%) и при УЗИ – у 132 (81,5%).
Результаты комплексного МР-исследования в диагностике кист
Всего обследованы 47 женщин с наличием в молочных железах крупных кист (более 1 см). Размеры кист варьировали в широких пределах и достигали у четырех женщин 5–6 см, средний размер кист составил 3,2±1,1 см. У 70,2% женщин кисты располагались в верхне-наружном квадранте, у 17,0% больных были множественными и у 36,2% – двусторонними. Кисты сочетались с другими узловыми доброкачественными образованиями молочной железы и проявлениями диффузного фиброаденоматоза у 55,3% и 76,6% женщин, соответственно.
В зависимости от сигнальных характеристик внутреннего содержимого кисты были разделены на простые – 34 женщины (72,3%) и сложные – 13 человек (27,7%).
Для простых кист характерна следующая МР-семиотика: овальная или округлая форма; четкие, ровные контуры; равномерная толщина стенки, не более 1–2 мм. Типичными признаками простых кист являлась однородная внутренняя структура с жидкостными сигнальными характеристиками. Наиболее информативными для выявления кист являлись Т2 ВИ, особенно с использованием жироподавления, и TIRM за счет высокой контрастности жидкостного содержимого на фоне пониженного сигнала от жировой ткани. При проведении МРТ с ДКУ простые кисты на Т1 ВИ до и после введения контрастного препарата не изменяли свою структуру и не накапливали контрастное вещество. При построении перфузионных карт простые кисты не визуализировались на цветовых картах притока и времени транспорта контрастного вещества (TTP) по сравнению с окружающей тканью железы. На перфузионных картах оттока, MIPt и PEI четко визуализируются границы кист на фоне незначительно повышающей интенсивность сигнала от ткани молочной железы.
Сложные кисты выявлены у 27,7% женщин. МР-признаком сложных кист является неоднородное внутреннее содержимое (92,3%) с неравномерно повышенным сигналом на Т1-преконтрастных изображениях (69,2%). Усиление стенок без очагового их утолщения являлось признаком воспаления или пролиферативных изменений окружающей ткани железы. При проведении ДКУ сложные кисты у 76,9% женщин накапливали контрастное вещество стенкой или вокруг нее, что более отчетливо визуализировалось при построении перфузионных карт MIPt и PEI.
После пункции кисты у 6 обследуемых был выявлен уровень неоднородного содержимого за счет разделения сред между жидкостным и геморрагическим содержимым, у двух женщин кисты с воспалением характеризовались наличием разделения сред между жидкостным и белковым (гнойным) содержимым. У трех женщин были выявлены образования молочных желез воспалительной природы, которые характеризовались наличием полостного образования с нечетким контуром, неоднородным содержимым и неравномерно утолщенной капсулой с зоной отека ткани железы. При ДКУ утолщенная капсула кольцевидно накапливала контрастное вещество, что требовало проведение дифференциальной диагностики.
Таким образом, для кист типична следующая МР-семиотика: для простых – однородная внутренняя структура с жидкостными характеристиками сигнала, отсутствие накопления контрастного вещества при ДКУ; для сложных – неоднородное внутреннее содержимое с неравномерно повышенным сигналом на Т1 ВИ, накопление контрастного вещества стенками кисты и окружающей ее паренхимой железы.
Результаты комплексного МР-исследования женщин
с узловыми доброкачественными образованиями
Всего обследовано 115 женщин с узловыми образованиями доброкачественной природы, подтвержденными морфологически. Доброкачественные узловые образования молочной железы чаще были единичными, у 27,8% женщин выявлено несколько образований. Важным критерием для дифференциальной диагностики была ориентация образования. У 70,4% женщин с доброкачественными образованиями поперечный размер образования превышал передне-задний (р<0,001), у 23,5% женщин образования имели округлую форму, реже определить ориентацию образования не представлялось возможным из-за его неправильной формы. Контуры образований в большинстве случаев были ровные и четкие (76,5%), реже они были нечеткие – 11,7% (при локализованной форме фиброаденоматоза), p>0,05. Внутренняя структура образований у 73,0% больных была однородной. Неоднородность структуры образований (27,0%) обусловлена наличием участков пониженного МР-сигнала за счет фиброза и обызвествлений (более отчетливо определяемых на маммограмах). По интенсивности МР-сигнала структура образований до контрастного усиления на Т1ВИ была изоинтенсивной (71,3%), реже гипоинтенсивной – (24,3%); у отдельных пациенток – гиперинтенсивной в 4,3% случаев (липомы, кистозные формы фиброаденом). У пациенток с гамартомой и листовидной фиброаденомой образования имели гетерогенную структуру и состояли, как из участков изоинтенсивного, так и гиперинтенсивного МР-сигнала, что являлось характерным для них МР-признаком.
При ДКУ у большинства женщин (61,7%) данной исследуемой группы накопление контрастного вещества патологическими образованиями отсутствовало или было минимальным. Отсутствие накопления было отмечено у 18 женщин с фиброзными аденомами, не накапливали контрастное вещество и липомы. У трети женщин было выявлено гетерогенное накопление образованием контрастного вещества, у остальных – гомогенное. Асимметричное усиление сосудистой сети вокруг образования было выявлено у 10 больных (8,7%) и, вероятно, связано с наличием сопутствующих воспалительных изменений.
Таким образом, для доброкачественных образований молочных желез при проведении МРТ до использования постпроцессорной обработки было характерно: неизмененные кожные покровы; отсутствие нарушения структуры окружающих тканей; преимущественно единичный характер поражения; преобладание поперечного размера образования; округлая или овальная форма; четкие, ровные контуры; однородная МР-структура; отсутствие или минимальное гомогенное накопление контрастного вещества.
Окончательное суждение о предполагаемом характере узловых образований выносили с учетом постпроцессорной обработки. Нами установлено, что для большинства пациенток с доброкачественными узловыми образованиями характерны следующие динамические критерии: у 74,1% женщин максимальная интенсивность сигнала приходилась на 5–6 минуты и у 73,0% была меньше 100% по сравнению с преконтрастными изображениями. Значительных отличий параметров ДКУ в центральных и периферических отделах у доброкачественных образований не определялось (р<0,05), но отмечалось первоначальное накопление в центральных отделах с распространением к периферии (центробежный), р<0,001. Данные изменения более отчетливо визуализировались при построении перфузионных карт (притока, TTP, MIPt). Васкуляризация образований определялась при построении PEI. Наиболее специфичными для диагностики доброкачественных образований являлись карты оттока, где было характерно задержка вымывания контрастного вещества в опухоли, по сравнению с неизмененной тканью железы в результате аккумуляции контрастного вещества в межклеточной строме доброкачественных образований. При построении кривых «интенсивность сигнала – время» доброкачественные узловые образования по периферии характеризовались преимущественно I типом – кривая постоянного роста МР-сигнала (80,0%), реже II типом накопления (13,9%), а III тип встречался – в 6,1%, что проиллюстрировано на рис. 2.
Быстрое накопление контрастного вещества (более 100% от преконтрастного) было выявлено у восьми женщин с листовидными фиброаденомами (7,1%) и у 24 пациенток (21,4%) с интраканаликулярными фиброаденомами. У семи из них отмечали быстрое накопление и быстрое вымывание контрастного вещества образованиями, что затрудняло их дифференциальную диагностику. III тип накопления был выявлен именно у этой группы пациенток.

Рис. 2. Графическая зависимость изменения интенсивности сигнала от доброкачественных узловых образований молочных желез при ДКУ.
Изменение сосудистой сети молочной железы на стороне локальных изменений выявлено у 10 женщин. Работы Маряшевой Ю.А. и соавт., (2003); Тернового С.К. и соавт., (2007) указывают на отсутствие лимфоаденопатии аксиллярных лимфатических узлов при доброкачественных узловых образованиях и отмечают их гиперплазию только при воспалении. В нашей работе из всех обследованных пациенток аксиллярные лимфоузлы были выявлены у 39,1% женщин группы, куда вошли все женщины с образованиями воспалительной природы (5,2%); что несколько больше, чем в контрольной группе (23,6%). Остальные обследованные в анамнезе указывали на перенесенные воспалительные заболевания.
Таким образом, для узловых образований доброкачественной природы при МРТ с ДКУ характерно: отсроченное накопление контрастного вещества; низкая и средняя степень интенсивности МР-сигнала; центробежный (первично в центре) характер контрастирования; I тип кривой «интенсивность сигнала – время»; неизмененная сосудистая сеть; отсутствие питающего сосуда.
Результаты комплексного МР-исследования женщин
со злокачественными образованиями
Всего обследованы 250 женщин со злокачественными образованиями молочных желез, у которых данные клинико-лучевых методов подтверждены при гистологическом исследовании, из них 148 женщин репродуктивного возраста и 102 женщины, находящиеся в менопаузе. Из анамнеза значительно чаще, чем в контрольной группе, встречалась сопутствующая гинекологическая патология (60% и 6,9% соответственно), патология щитовидной железы (19,6% и 8,3%). Количество пациенток, имеющих сочетанную патологию органов малого таза и щитовидной железы, превышало количество таких женщин в контрольной группе в 5,5 раз, р<0,001. Следует отметить, что диффузные изменения ткани молочных желез были выявлены у 52,8% женщин со злокачественными образованиями, но достоверных отличий по сравнению с женщинами с доброкачественными узловыми образованиями выявлено не было (р<0,01), что вероятно связано с наличием значительного количества женщин с проявлениями диффузного фиброаденоматоза в качестве фона, на котором выявляются и доброкачественные, и злокачественные образования. При анализе размеров молочные железы были асимметричными у 40,8% женщин, преимущественно за счёт наличия отёка, а асимметрия внутренней структуры в среднем составила 25,67±40,03%, при аналогичных показателях в группе доброкачественных образований 13,19±10,35% и ФАМ 10,06±9,48% (р=0,0021).
При анализе данных комплексной МР-маммографии утолщение кожных покровов было выявлено у 47,6% женщин (p>0,05), деформация контура кожи над образованием была определена у 26,8% больных, у 30,4% обследованных определяли деформацию контура большой грудной мышцы на стороне поражения. Признаки лимфангита были выявлены у 84,0% женщин данной исследуемой группы (р<0,001). У каждой третьей пациентки наблюдали расширение и наличие жидкостного содержимого в протоках молочных желез (больные с инфильтрирующим протоковым раком и цистоаденокарциномой). У 76,0% женщин образования характеризовались инфильтрирующим характером роста (р<0,001). Наиболее часто такой тип роста был типичен для протокового рака. Образования с экспансивным типом роста были выявлены у больных с железистым и медуллярным раком. Важным критерием для дифференциальной диагностики считали ориентацию образования. У 74,0% женщин со злокачественными образованиями передне-задний размер образования превышал поперечный (р<0,001). У 6,4% женщин, преимущественно при инфильтрирующем внутрипротоковом распространении опухоли, определить ориентацию образования было достаточно сложно. У 66,4% женщин были выявлены образования неправильной формы, реже форма образований соответствовала округлой (26,4%). Контуры образований у большинства женщин были неровные и нечеткие (72,8%); реже – неровные, но достаточно четкие (17,6%). Полностью видимые границы новообразований выявлены лишь у 4,4% больных, у которых они были четкие и ровные, что характерно для медуллярного типа опухоли.
Внутренняя МР-структура образований у 86,0% больных была неоднородной и обусловлена наличием участков пониженного МР-сигнала, за счет кальцинатов или некроза (р<0,001). Наличие гипоинтенсивных участков в структуре образований у 30,8% женщин соответствовало выявленным при рентгеновской маммографии кальцинатам. У каждой седьмой женщины МР-структура образований была достаточно однородной (некоторые – слизеобразующие, медуллярные и протоковые типы опухолей). В этих случаях мы проводили анализ постконтрастных изображений и постпроцессорную обработку, оценивая васкуляризацию образований, что позволяло правильно определить природу образования.
По интенсивности МР-сигнала на преконтрастных Т1 ВИ образования характеризовались преимущественно изоинтенсивной (66,4%) и гипоинтенсивной (32,8%) структурой. Основная проблема заключалась в том, что при неоднородной структуре образования было трудно выделить приоритетный компонент интенсивности, создающий фоновую структуру образования. У 95,6% больных злокачественные образования после ДКУ интенсивно, преимущественно по периферии, и накапливали контрастное вещество. В каждом третьем случае мы отмечали гетерогенный характер контрастирования. У 13 пациенток (5,3%) интенсивность МР-сигнала от новообразований возрастала незначительно. При гистоморфологическом исследовании данная картина была характерна для некоторых небольших инфильтративно-протоковых и слизеобразующих карцином.
Среди больных данной исследуемой группы мы обследовали трех женщин с саркомой молочных желез, которые имели несколько отличную картину. В первую очередь их отличало наличие капсулы и достаточно крупные размеры опухоли, причем все женщины отмечали наличие образования уже более 3 лет. Кожные покровы пораженной железы были утолщены, образование было единичным, вытянутым в поперечном направлении, овальной формы, с четкими ровными контурами, неоднородной МР-структуры, преимущественно изоинтенсивные на преконтрастных Т1 ВИ, интенсивно и гетерогенно накапливали контрастное вещество.
Обобщив МР-признаки до проведения постпроцессорной обработки нами было доказано, что для злокачественных образований характерно: нарушение внутренней архитектоники железы; инфильтрирующий тип роста; единичный характер поражения; неправильная форма с преобладанием передне-заднего размера; неровные, нечеткие контуры; неоднородная внутренняя МР-структура; преимущественно изогипоинтенсивный МР-сигнал на преконтрастных Т1 и Т2 ВИ; интенсивное гетерогенное накопление контрастного вещества; кольцевидный характер контрастирования.
Однако, ни одно из них не является единственно возможным для злокачественных образований. Поэтому для оптимизации дифференциальной диагностики необходима дополнительная информация, которую мы получали при постпроцессорной обработки динамического контрастирования.
При построении MIP-реконструкций асимметрия сосудистой сети молочных желез определена у 70,8% женщин, и почти половина злокачественных опухолей (45,2%) имела собственный питающий сосуд. Нами доказано, что для всех злокачественных образований МР-сигнал быстро увеличивался, достигая максимума к 1–2-й минуте после введения контрастного вещества, преимущественно по периферии. В дальнейшем сигнал по периферии либо выходил на «плато» (у 35,2% женщин), либо быстро начинал снижаться (феномен вымывания) со 2-й по 6-ю минуту после контрастного усиления (61,2%), при этом у большинства образования наблюдался центростремительный характер накопления. У 2,8% больных мы отмечали незначительное увеличение МР-сигнала (менее 50%) после введения контрастного вещества в центральных и периферических отделах опухоли. Наоборот, высокие значения интенсивности (более 300%) были зарегистрированы у 7 пациенток с инфильтративно-протоковым раком и у 3 женщин с инфильтративно-дольковым.
При построении перфузионных карт злокачественные образования характеризовались интенсивным окрашиванием, более выраженным по периферии, наиболее информативными являлись карты MIPt и PEI, которые оценивали васкуляризацию образований, а также карты притока и TTP. А специфичными являлись карты оттока, по которым образования характеризовались более выраженными вымыванием контрастного вещества, по сравнению с окружающей тканью железы.
При построении графической зависимости изменения интенсивности сигнала за время динамического сканирования от центральных отделов образования у 42,2% женщин был выявлен II тип кривой, а более чем у половины (52,4%) – III тип. По периферии злокачественных узловых образований графическая зависимость характеризовались в большинстве наблюдений III типом кривой (63,1%), реже II и I типами накопления (34,5% и 2,4% соответственно) – рис. 3.
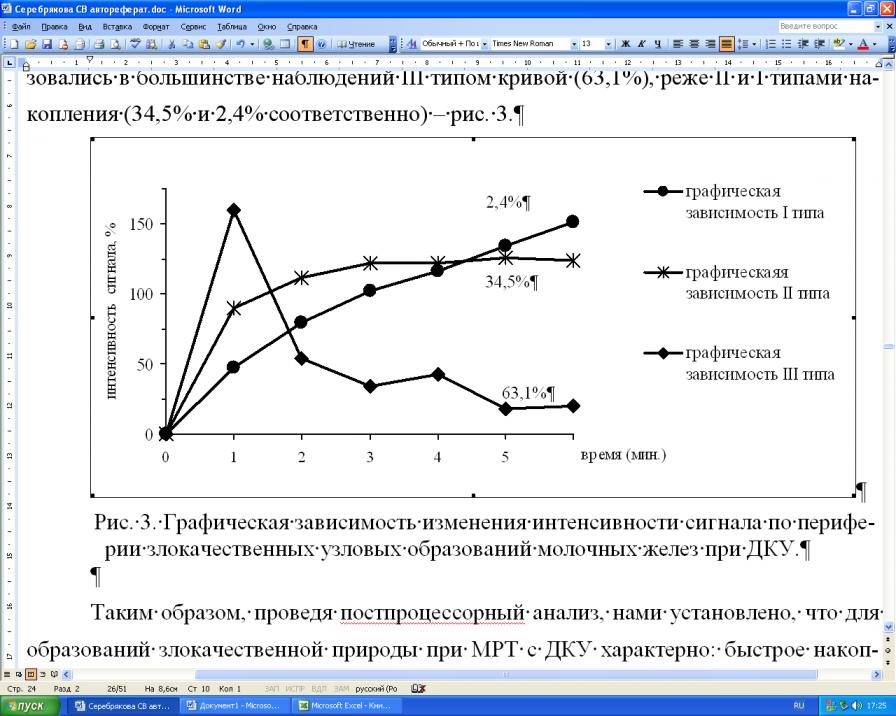
Рис. 3. Графическая зависимость изменения интенсивности сигнала по периферии злокачественных узловых образований молочных желез при ДКУ.
Таким образом, проведя постпроцессорный анализ, нами установлено, что для образований злокачественной природы при МРТ с ДКУ характерно: быстрое накопление контрастного вещества; высокая степень интенсивности МР-сигнала; центро-стремительный (первично на периферии) характер контрастирования; III тип графической зависимости «интенсивность сигнала – время»; асимметрия сосудистой сети; наличие питающего сосуда. Различие интенсивности МР-сигнала и типа кривой от периферических и центральных отделов опухоли является статистически достоверным дифференциально-диагностическим критерием, р<0,001.
Результаты комплексного МР-исследования в диагностике местной
распространенности рака молочной железы
Злокачественные образования практически с одинаковой частотой встречались в левой (48,8%) и правой (43,2%) молочной железах, билатеральное поражение выявлено у 20 женщин (8,0%). Диффузно-отечная форма рака молочной железы с наличием множественных сливающихся между собой образований была выявлена у 12,4% больных, у 5 больных была выявлена оккультная форма (без наличия четкого узла).
89 женщинам (35,6%) преимущественно с отечно-инфильтративной формой заболевания, крупными размерами опухоли (Т3-Т4), а также при наличии отдаленных метастазов, после выполнения биопсии и получения гистологического заключения была назначена консервативная и/или комбинированная терапия.
После проведения комплексного МР-исследования 161 больной были выполнены различные оперативные вмешательства с гистологическим анализом макро- и микропрепаратов, с определением размеров опухоли, внутрипротоковой распространенности и характера роста. При статистическом анализе данных достоверных закономерностей между характером роста и гистологическим типом опухоли выявлено не было (р>0,05). Мультифокальный (в разных квадрантах) и мультицентричный (в одном квадранте) характер роста опухоли был выявлен у 49 женщин, монофокальное поражение – у 96 больных. При анализе монофокальных образований наибольшее количество пациенток в наших наблюдениях имели размеры опухоли менее 21 мм (65,6%), что соответствовало I стадии по системе TNM.
Нами была проведена оценка различий в определении размеров опухоли при клиническом обследовании и методами лучевой диагностики с использованием t-теста Стьюдента для связанных выборок. У 42,7% женщин размеры опухоли, измеренные при рентгеновской маммографии и УЗИ, превосходили максимальные размеры, определяемые морфогистологически, а у 13 больных при МРТ они были недооценены. При анализе причин ошибок основная из них была связана с наличием лимфангита и отека ткани железы вокруг опухолевого узла.
Наибольшая ошибка оценки максимального размера опухоли отмечается при маммографии и несколько меньше при УЗИ, что статистически достоверно больше, чем ошибка при МРТ (p<0,001). Таким образом, МРТ с ДКУ является наиболее точным методом в определении максимального размера опухоли и, соответственно, Т-стадии.
Нами была проведена оценка эффективности лучевых методов диагностики в выявлении образований в зависимости от типа строения молочной железы (степени выраженности железистой ткани и ее соотношений с жировой тканью) и на фоне диффузно-отечных изменений (табл. 2).
Таблица 2
Чувствительность различных методов лучевой диагностики в выявлении образований в зависимости от внутреннего строения молочных желез (%)
| Методы диагностики | Тип строения | Отечно-инфильтративная форма | |||
| I | II | III | IV | ||
| Клиническое исследование | 68,8 | 66,7 | 51,0 | 43,5 | 36,4 |
| Рентгеновская маммография | 75,9 | 53,7 | 41,5 | 28,1 | 25,0 |
| УЗИ | 65,7 | 71,8 | 78,5 | 80,3 | 44,4 |
| Комплекс традиционных методов (РМ, УЗИ) | 78,0 | 77,7 | 78.7 | 80,1 | 53,2 |
| МРТ (без контрастного усиления) | 75,4 | 71,0 | 52,5 | 46,3 | 30,0 |
| МРТ с ДКУ | 92,6 | 95,7 | 94,1 | 93,3 | 89,5 |
Как видно из таблицы 2, только МРТ с ДКУ обладает практически одинаковой чувствительностью при различных типах строения и при наличии отечно-инфильтративных изменений ткани железы, т. е. выявление образований не зависит от внутренней структуры (р>0,05). Чувствительность остальных методов и МРТ без контрастного усиления зависят от степени выраженности железистой ткани и наличия отечно-инфильтративных изменений, эти данные являются статистически достоверными (р<0,001).
Нами проведен сравнительный анализ информативности методов лучевой диагностики в выявлении мультицентричного и мультифокального характера роста у 49 женщин, который был подтвержден при гистологическом исследовании (табл. 3).
Таблица 3
Информативность лучевых методов в определении характера роста (%)
| Показатели информативности | Методы лучевой диагностики | |||
| РМ | УЗИ | Комплекс традиционных методов | МРТ с ДКУ | |
| Чувствительность | 44,9 | 49,0 | 55,1 | 83,7 |
| Ложноположительные результаты | 55,1 | 51,0 | 44,9 | 16,3 |
| Специфичность | 55,6 | 66,7 | 81,8 | 89,4 |
| Ложноотрицательные результаты | 44,4 | 33,3 | 28,2 | 10,6 |
| Точность | 49,7 | 57,6 | 67,8 | 86,2 |
Как видно из таблицы 3, рентгеновская маммография и УЗИ обладают довольно низкой чувствительностью в выявлении мультифокальных и мультицентричных злокачественных образований. МРТ с ДКУ позволила правильно определить распространение опухолей по сравнению с традиционными методами диагностики на 28,6% (у 14 женщин), а точность комплексного исследования традиционными методами диагностики уступает в эффективности МРТ с ДКУ в выявление характера роста (67,8% против 86,2%). Различия всех показателей диагностической эффективности для маммографии, УЗИ и МРТ статистически достоверны (p<0,001).
Для более точной оценки распространенности процесса нами была разработана и усовершенствована методика определения Т-стадии, предложенная М. И. Давыдовым (2007), в которой мы использовали не абсолютные значения размеров опухоли, а относительные. Для оценки распространенности опухолевого процесса рассчитывали индекс соотношения объема опухоли к объему молочной железы и получали индекс «К». При наличии множественного, мультифокального и мультицентричного, поражения, мы суммировали объемы образований. При анализе полученных данных, учитывая полученный индекс, к I стадии были отнесены образования, занимающие не более 10% от объема железы, ко второй – от 11 до 20%, к III – от 21 до 30%. Если же опухоль занимала более 30% объема железы, то эти образования были отнесены к IV стадии. При сравнении определения стадии процесса по максимальным размерам опухоли и при вычислении индекса «К» изменения были отмечены у женщин с небольшими молочными железами в сторону увеличения на 19,2%, и, наоборот, у женщин с большим объемом желез в сторону уменьшения на 17,2%. Так как при увеличении размеров опухоли возрастает вероятность поражения регионарных лимфоузлов, мы провели сравнение определения Т-стадии по классической (т. е. по максимальному размеру) и усовершенствованной нами методикам. Полученные данные сравнили с гистологическими данными поражения лимфоузлов. Совпадение с данными гистологии в первом случае составило 76,0%, а по усовершенствованной методике расчета соотношения объема опухоли к объему железы – 96,0%. Усовершенствованная нами методика определения Т-стадии более точно позволяет предполагать регионарное и отдаленное метастазирование, так как опухоль, занимающая значительную часть железы, приближается к регионарным лимфатическим коллекторам, и быстрее попадает в более интенсивную зону их дренирующего влияния.
Таким образом, МРТ с ДКУ является более информативным и безошибочным методом в выявлении злокачественных образований, определении их размеров и оценке характера роста (Т-стадии), чувствительность метода не зависит от типа строения и развитости железистой ткани молочной железы, а также от локализации образования и наличия отека. МРТ с ДКУ позволяет получить дополнительные данные, когда традиционные методы лучевой диагностики недооценивают или переоценивают размеры образований.
Результаты комплексного МР-исследования в диагностике поражения
регионарных лимфатических узлов у больных со злокачественными
образованиями молочных желез (N-стадия)
При гистологическом исследовании у 134 женщин (53,6%) со злокачественными образованиями было выявлено поражение регионарных лимфоузлов, из них: подмышечных у 53,7%, подключичных у 9,7%, внутригрудных (парастернальных) – у 7,5% больных, у 29,1% женщин было выявлено поражение интра- и парамаммарных лимфатических узлов (узлы Бартельса и Зоргиуса). Поражение нескольких групп лимфатических узлов (подмышечных, подключичных или внутригрудных) – у 8,2% женщин. Двустороннее поражение лимфатических подмышечных узлов – у 16,4% больных.
Нами были определены МР-критерии поражения лимфатических узлов по данным МРТ с ДКУ у женщин со злокачественными образованиями. Достоверными признаками поражения лимфатических узлов являются увеличение размеров и изменение внутренней структуры (р<0,001). Множественность метастатического поражения лимфатических узлов выявлена у 48,5% больных. Контуры лимфатических узлов у больных со злокачественными опухолями могли быть достаточно четкими, но неровными у 59,7% обследуемых (р<0,05). У 78,4% больных определялось неравномерное утолщение кортикального слоя с потерей внутренней дифференцировки (р<0,001). При нативном исследовании пораженные лимфоузлы у большинства женщин имели изо-гипоинтенсивный сигнал на Т1 ВИ и изо-гиперинтенсивный на Т2 ВИ. Диаметр пораженных лимфатических узлов в наших наблюдениях составил от 8 мм до 6 см, средние размеры – 15,22±9,97 мм.
Таким образом, МР-критериями пораженного метастатически лимфатического узла являются: увеличение размеров, нарушение внутренней структуры с неравномерным утолщением кортикального слоя, округлая форма, наличие четких, но неровных контуров, неравномерного отёка клетчатки вокруг, неравномерного накопления контрастного вещества, преимущественно по периферии узла более 100%, III тип графической зависимости изменения интенсивности сигнала.
Сравнение информативности методов лучевой диагностики в выявлении поражения регионарных лимфатических узлов у больных раком молочной железы представлено в таблице 4.
Таблица 4
Сравнение информативности методов в выявлении поражения регионарных лимфатических узлов у больных раком молочной железы (%)
| Информативность | Методы лучевой диагностики | ||||
| РМ | УЗИ | Комплекс традиционных методов | МРТ с ДКУ | ОФЭКТ | |
| Чувствительность | 39,8 | 82,1 | 81,9 | 76,6 | 84,6 |
| Ложноположительные результаты | 60,2 | 17,9 | 18,1 | 23,4 | 15,4 |
| Специфичность | 58,2 | 76,7 | 79,3 | 64,0 | 78,6 |
| Ложноотрицательные результаты | 41,8 | 23,3 | 20,7 | 26,0 | 21,4 |
| Точность метода | 47,8 | 74,6 | 77,7 | 71,4 | 84,6 |
Как видно из таблицы 4, наиболее информативной методикой определения пораженных лимфоузлов является ОФЭКТ с 99mTc-МИБИ, которая позволяет более правильно определить распространение опухолей по сравнению с МРТ (84,6% против 71,4%). Различия показателей диагностической эффективности для УЗИ, ОФЭКТ и МРТ между собой слабо достоверны (p<0,05). По данным МРТ более отдаленные группы (надключичные, шейные, внутригрудные) вследствие ограничения поля обзора при использовании поверхностной катушки для исследования молочных желез отчетливо не визуализировались. Наибольшую сложность для традиционных методов диагностики представляет выявление поражения внутригрудных лимфоузлов. Обычно их поражение по данным традиционных методов диагностики предполагается лишь при расположении опухоли во внутренних квадрантах. Поэтому для их выявления используют дополнительные методы, такие как КТ и радионуклидные.
Таким образом, на основании данных комплексного исследования по определению Т- и N-стадированию определяется дальнейшая программа обследования пациенток с акцентом на выявление возможных отдаленных метастазов путем выполнения УЗИ, компьютерной томографии, радионуклидных методик, которые были проведены всем женщинам со злокачественными образованиями молочных желез.
Результаты магнитно-резонансной томографии в оценке эффективности химиотерапии у больных раком молочной железы
Мониторинг консервативного лечения проведен 58 пациенткам со злокачественными образованиями молочных желез в возрасте от 35 до 66 лет, средний возраст составил 51±7,8 года. По результатам проведенного исследования ответ опухоли на лечение после первых циклов химиотерапии был выявлен у 42 женщин (72,4%) – контуры узла становились четче, структура более однородная, интенсивность сигнала от опухоли несколько понижалась на Т1 и Т2 ВИ за счет фиброза, размеры опухоли, зона отека и воспаления вокруг уменьшались, а на постконтрастных изображениях определялось уменьшение кровоснабжения образований, которое проявлялось снижением пика накопления контрастного вещества до 54–75%, а графическая зависимость у 49% женщин сменялась с III на II тип, а у 15% обследованных – на I тип, что отражало снижение васкуляризации опухоли, восстановление проницаемости поврежденных капилляров и снижение уровня активности жизнедеятельности клеток опухоли. Непосредственным эффективным ответом на лечение нами считалось снижение захвата контрастного вещества более чем в 2 раза по сравнению с исходными данными, что более наглядно отражалось при построении графических кривых и перфузионных цветовых карт. Аналогичными критериями оценивали и изменения в пораженных лимфоузлах, в которых значимый уровень захвата контрастного вещества и данные перфузии были значительно выше, чем у опухоли ответивших на терапию пациенток (р<0,001). У 27,6% пациенток не было выявлено заметных изменений показателей динамического контрастирования, что связано с неэффективностью воздействия химиопрепаратов на жизнедеятельность опухоли. Уменьшение размеров образования при повторном исследовании было отмечено у 43,1% больных, уплотнение внутренней структуры (фиброз) у 60,3% пациенток. При оценке параметров ДКУ у 19,0% женщин васкуляризация образований не изменилась, однако более чем у 70% пациенток уменьшилась, что характеризовалось уменьшением пика накопления контрастного вещества до 63,8–66,0% и изменением типа графической зависимости. И именно эти показатели являются наиболее достоверными критериями оценки проводимой химиотерапии и положительного ответа опухоли на лечение и, соответственно, могут служить критериями эффективности проводимого лечения (р<0,001).
В процессе лечения обязательно проводилось динамическое наблюдение за лимфатическими узлами. При положительном эффекте они уменьшались в размерах (20,7%), внутренняя структура их уплотнялась и становилась более гипоинтенсивной на Т1 и Т2 ВИ. У 8,6% больных контуры лимфатических узлов оставались нечеткими и размытыми и даже несколько увеличивались в размерах. Отчетливо уменьшилась васкуляризация пораженных лимфоузлов у 13 пациенток, что коррелировало с изменениями аналогичных параметров в опухоли. Однако признаки поражения лимфатических узлов сохранялись у 70,7% женщин, даже при уменьшении их размеров сохранялось повышенное накопление ими контрастного вещества (более 100%). У 69,7% женщин после окончания курса адъювантной химиотерапии сохранялись признаки поражения лимфатических узлов, даже при значительном уменьшении их размеров, которые определялись у 57,5% обследуемых, сохранялся отек клетчатки вокруг лимфатических узлов у 87,9% больных. При анализе результатов МР-исследования второй подгруппы, проведенных после окончания курса химиотерапии, изменение размеров опухоли и ее структуры определялось лишь у половины обследованных. Поэтому характер контуров, границы опухоли, изменение размеров, структуры не могут быть достоверными критериями оценки эффективности проведенного лечения (р<0,05). Достоверными критериями эффективности лечения (р<0,001) явилось уменьшения отека железы у 87,9% пациенток, уменьшение степени накопления контрастного вещества у 72,7% и изменение типа графической зависимости у 63,6% больных (р<0,001).
Нами проанализированы анамнестические данные клинико-лучевого исследования 44 женщин через год после завершения консервативного и комбинированного лечения. У 43,2% (19 женщин) признаков распространения, прогрессирования процесса выявлен пяти человек (11,4%), множественные метастазы в кости скелета – у семи (15,9%), метастазы в печень – у шести женщин (13,6%), метастазы в легкие – у двух пациенток (4,5%), множественное метастатическое поражение было выявлено у пяти пациенток (11,4%).
Таким образом, непосредственный эффект консервативного лечения оценивается по изменению степени накопления контрастного вещества при МРТ с ДКУ. Наиболее информативным параметром, определяющим качественные изменения метаболизма в опухоли и позволяющим оценить непосредственный эффект лечения (с вероятностью Хи-квадрат=4,86 df=3, р=0,007), является накопления контрастного вещества, которые более отчетливо визуализируются при построении MIP-реконструкции и PEI.
Результаты комплексного МР-исследования в диагностике послеоперационных осложнений и выявлении рецидивов рака молочной железы
Обследованы 206 пациенток после различных оперативных вмешательств на молочной железе, у которых были получены неоднозначные данные клинико-рентгенологического и ультразвукового исследований, не позволяющие на фоне послеоперационной деформации провести дифференциальную диагностику осложнений и исключить на этом фоне наличие образований. Большую часть составили женщины, прооперированные по поводу злокачественных образований – 127 пациенток (61,6%), по поводу доброкачественных процессов – 27,2% обследуемых. После оперативного вмешательства на молочной железе формируются рубцы, которые характеризовались различной степенью выраженности фиброзно-атрофических изменений и в зависимости от степени выраженности затрудняли диагностику традиционными методами визуализации.
Рубцы характеризовались следующими МР-признаками: деформацией формы и контуров молочной железы, нарушением внутренней архитектоники строения ткани железы, а также различной степенью выраженности фиброзных «наслоений». Данные изменения зависели от вида и характера оперативного вмешательства, а также объема удаленных тканей и наличия послеоперационных осложнений. Незначительно выраженные изменения формы и внутренней архитектоники молочной железы были выявлены у 35,9% женщин, прооперированных по поводу доброкачественных изменений, а выраженные рубцовые изменения были выявлены у 23,3% женщин, прооперированных по поводу злокачественных образований. При наличии небольшого отека и утолщения кожи с минимальным локальным фиброзом вокруг шовного материала, а также небольшие участки жирового некроза не затрудняли диагностику, как традиционными методами визуализации, так и при проведении МРТ с ДКУ, при которых накопления контрастного вещества при этих изменениях в наших наблюдениях выявлено не было. Слабые и умеренно выраженные рубцово-фиброзные изменения с наличием небольшого отека и участков жирового некроза были выявлены у 114 женщин (55,3% обследуемых). Эти изменения мы отнесли к неосложненными вариантам последствий хирургических вмешательств, хотя в зависимости от степени их выраженности они затрудняли проведение дифференциальной диагностики традиционными методами визуализации и нередко являлись причиной ложноотрицательных результатов.
Нами проанализированы данные комплексного МР-исследования после эндопротезирования 33 женщин, из которых 14 пациенткам была выполнена аугментационная маммопластика и 19 женщинам – пластика после мастэктомии. Все женщины были направлены на МРТ с подозрением на наличие различных осложнений. Разрыв имплантов был выявлен у 15 женщин – из них внутрикапсульные у восьми человек, экстракапсулярные у трёх женщин, у четырёх – сочетание интра-экстракапсулярных повреждений. В дальнейшем они были прооперированы – восьми пациенткам была выполнена открытая капсулотомия с одномоментной заменой имплантата, семи женщинам – удаление силикогранулем. МР-исследование без внутривенного контрастирования позволило выявить скопление жидкости (сером) по периферии и в складках капсулы протеза у 42,4% женщин, деформация протеза с нарушением его эластичности с формирование грыж имплантата – у 15,2% женщин.
Интракапсулярный разрыв на МР-изображениях имеет достаточно четкие критерии в виде наличия низкоинтенсивных извитых тонких линий внутри протеза (симптом «языков»), а скопление силиконового геля в тканях молочной железы за пределами оболочки протеза более отчетливо визуализируется при использовании жироподавления и подавления сигнала от силикона, что позволяет их дифференцировать от сером. Наличие таких участков за пределами капсулы протеза является МР-признаком экстракапсулярного разрыва. При фиброзировании капсулы отмечалось изменение формы протеза с полусферической на округлую – у 15,2% женщин. При развитии фиброзно-капсулярной контрактуры при МР-исследовании определялись низкоинтенсивные изогнутые линии в однородном содержимом эндопротезов. При МРТ с ДКУ рубцовые изменения и воспалительные гранулемы в области фиброзной капсулы давали незначительное усиление, что затрудняло их дифференциальную диагностику. При отсутствии этих изменений патологического накопления контрастного вещества после эндопротезирования не выявлялось.
Таким образом, при МРТ имеются четкие критерии диагностики осложнений эндопротезирования, и, соответственно, данный метод позволяет своевременно выявить и детально охарактеризовать изменения ткани молочных желез и самих эндопротезов в неосложненных случаях и при развитии различных видов осложнений. Чувствительность и специфичность комплексного МР-исследования в диагностике осложнений после эндопротезирования составляет 91% и 98%, соответственно.
После оперативных вмешательств на молочной железе возникают различные послеоперационные осложнения, которые зависят от вида хирургического вмешательства и различаются по срокам их возникновения. Все осложнения, развившиеся после оперативных вмешательств, мы разделили на ранние (развившиеся в течение первых трех месяцев после операции), промежуточные (от трёх месяцев до двух лет), поздние (более двух лет). Такое разделение связано с этапами формирования рубца и реакцией организма на проведение хирургического вмешательства, а также со сроками проведения консервативного и комбинированного лечения. Распределение обследованных женщин в зависимости от сроков выполнения МРТ после проведенного хирургического вмешательства и выявленные осложнения представлены в таблице 5.
Таблица 5
Распределение больных по срокам проведения МРТ после операции и
выявленные осложнения
| Периоды проведения МРТ после оперативных вмешательств | Всего | Осложнения | ||
| абс | % | абс | % | |
| Ранний | 14 | 6,3 | 14 | 100 |
| Промежуточный | 93 | 45,1 | 46 | 49,5 |
| Поздний | 99 | 36,9 | 32 | 34,2 |
| Всего | 206 | 100 | 92 | 44,7 |
Нозологические формы послеоперационных осложнений в зависимости от сроков их выявления после поведенного вмешательства представлены в таблице 6.
Таблица 6
Распределение пациенток в зависимости от вида и частоты осложнений в разные сроки после оперативных вмешательств
| Нозологическая форма | Число наблюдений | ||
| n | % | ||
| Ранние послеоперационные осложнения n=14 | Серома, лимфоцелле | 7* | 50,0 |
| Гематома | 3* | 21,4 | |
| Воспалительные изменения | 4* | 28,6 | |
| промежуточные послеоперацион-ные осложнения n=46 | Серома, лимфоцелле | 8* | 17,4 |
| Хроническая гематома с фиброзом вокруг | 6 | 13,0 | |
| Воспалительные изменения | 9* | 19,6 | |
| Жировой некроз с дистрофическими обызвествлениями | 8* | 17,4 | |
| Рецидив образования | 15 | 32,6 | |
| поздние послеоперационные осложнения n=32 | Инфекционные осложнения, гранулемы инородных тел | 2* | 6,2 |
| Выраженный фиброз | 3* | 9,4 | |
| Жировой некроз с дистрофическими обызвествлениями | 8* | 25,0 | |
| Рецидив образования | 19 | 59,4 | |
* - сочетание нескольких видов осложнений
Как видно из таблицы 6, наиболее частым осложнением является рецидив образования в оперированной железе (32,6 и 59,4%), приблизительно одинаково встречаются проявления жирового некроза с дистрофическими обызвествлениями (17,4%; 25,0%). Гематомы и выпот четко выявляются при УЗИ, однако в ранний период данное исследование было затруднено из-за выраженного послеоперационного отека, наличия раны и болезненности при надавливании датчиком. Рентгенография также из-за необходимости компрессии у данных пациенток не выполнялась, а если выполнялась, то была малоинформативна. При наличии гематомы в зоне рубца формировался звездчатый рубец, который сочетался с наличием обызвествлений в 16 наблюдениях. При МРТ звездчатый рубец и осумкованные гематомы имели достаточно четкие МР-критерии и характеризовались неоднородной структурой на Т1 и Т2 ВИ с наличием в центральных отделах жидкостных участков, окруженных зоной рубцово-фиброзных изменений. Важным критерием дифференциальной диагностики рецидива в рубце и послеоперационных фиброзно-рубцовых изменений является отсутствие накопления контрастного вещества при ДКУ, что более наглядно визуализируется при построении перфузионных карт.
Другим осложнением, которое было выявлено в 15 наблюдениях в различные периоды обследования, являлось наличие воспаления, у четырех пациенток нами были выявлены гранулемы вокруг инородного тела, в дальнейшем подтвержденные при повторных оперативных вмешательствах.
Осложнения секторальных резекций по поводу доброкачественных образований в виде рецидива в области рубца встречались значительно реже, чем при злокачественных – 3,6% обследуемых против 32,0% (р<0,001). Рецидив доброкачественных образований был выявлен у двух пациенток, при этом по гистологическому типу в одном наблюдении была выявлена – цистоаденопапиллома, в другом – листовидная фиброаденома. Рецидивы злокачественных образований связаны с субтотальным удалением или недооценкой местной распространенности. Выявление рецидива образования в рубце в промежуточный период затруднялось терапевтическим лечебным воздействием химиотерапии, снижающей ангинеогенез опухоли и тем самым вызывающей определенные трудности в диагностике. После проведения органосохраняющих операций по поводу рака у 32 больных были выявлены образования в оперированной железе, при этом рецидив был выявлен у семи пациенток через 6–9 месяцев после окончания комплексного лечения и характеризовался наличием узла в области рубца с неравномерным накоплением контрастного вещества до 90–130%. У трех женщин были выявлены множественные образования в ткани оперированной молочной железы, располагавшиеся как в рубце, так и вне его, что являлось недооценкой мультифокального распространения образования перед операцией. У пяти женщин были выявлены рецидивы образований в области рубца после мастэктомии. В одном наблюдении рак молочной железы был выявлен у женщины 48 лет после двустороннего эндопротезирования более 10 лет назад.
Таким образом, МРТ с ДКУ является эффективным методом оценки состояния молочных желез после органосохраняющих операций, на фоне формирования рубца и рубцовой деформации, а также в диагностике различных послеоперационных осложнений, данные изменения крайне редко накапливают контрастное вещество, в 96% они являются аваскулярными (p<0,001). С применением данной методики возможно с высокой степенью вероятности диагностировать продолженный рост или рецидив рака молочной железы по сравнению с другими методами лучевой диагностики. Критерием МР-диагностики является любое накопление контрастного вещества независимо от параметров ДКУ и типа графической зависимости.
Построение математической модели дифференциально-диагностических критериев диагностики
Одной из задач исследования явилось выявление закономерностей результатов исследования методами лучевой диагностики, их сопоставление с морфологическими характеристиками опухолевых образований молочных желез. Для решения данной задачи использовали многомерную математическую модель, учитывающую сразу несколько наиболее информативных показателей для оценки вероятности наличия злокачественного образования молочной железы по данным МРТ с ДКУ. В целях отбора группы наиболее информативных признаков, включаемых в конечную модель, оценена информативность каждого в однофакторном анализе, произведена их экспертная оценка, опробован ряд моделей с различным набором признаков. Признаки, включенные в нее, их градации и коэффициенты приведены в таблице 7.
Таблица 7
Признаки, включенные в логистическую регрессионную модель МРТ с ДКУ
| Наименования и градации признака | Коды | Коэффициенты модели | Уровень значимости, р |
| Нарушение внутренней архитектоники железы за счет образования: 0 – нет; 1 – да | Х1 | 2,929 | 0,0145 |
| Тип кривой «интенсивность сигнала – время»: 1 – тип I; 2 – тип II; 3 – тип III | Х2 | 2,359 | 0,0202 |
| Интенсивное центростремительное накопление парамагнитного контрастного вещества: 0 – нет; 1 – да | Х3 | 4,755 | 0,0007 |
| Константа | -7,586 | 0,0002 |
Получена статистически достоверная логистическая регрессионная модель (Хи-квадрат=203,9; df=3; p<0,00001). Окончательная модель вероятности злокачественного характера опухоли молочной железы имеет вид:
![]() =exp (-7,586+Х12,929+Х22,359+Х34,755)/
=exp (-7,586+Х12,929+Х22,359+Х34,755)/
(1+exp (-7,586+Х12,929+Х22,359+Х34,755)
Подставляя в уравнение значения признаков, выявленных у конкретной обследуемой, рассчитывается «![]() » – вероятность злокачественного характера опухоли молочной железы по данным МР-маммографии с динамическим контрастным усилением. Если рассчитанное значение вероятности «
» – вероятность злокачественного характера опухоли молочной железы по данным МР-маммографии с динамическим контрастным усилением. Если рассчитанное значение вероятности «![]() » равно или больше 0,5, то данную опухоль необходимо отнести к злокачественным. Если же рассчитанное значение «
» равно или больше 0,5, то данную опухоль необходимо отнести к злокачественным. Если же рассчитанное значение «![]() » меньше 0,5, опухоль целесообразно отнести к доброкачественным. Показатели диагностической точности модели говорят о ее высокой информативности (табл. 8).
» меньше 0,5, опухоль целесообразно отнести к доброкачественным. Показатели диагностической точности модели говорят о ее высокой информативности (табл. 8).
Таблица 8
Показатели качества полученной модели МРТ с ДКУ, %
| Показатель | Значение показателя на обучающей выборке, n=412 |
| Чувствительность | 95,1 |
| Специфичность | 93,2 |
| Диагностическая эффективность (безошибочность) | 93,9 |
| Уровень ложноотрицательных результатов | 4,9 |
| Уровень ложноположительных результатов | 6,8 |
Диагностическая эффективность полученной модели составила 93,9%, что подтверждает возможность качественной дифференциальной диагностики доброкачественных и злокачественных образований по результатам МРТ с ДКУ. Высокая чувствительность (95,1%) в сочетании с приемлемой специфичностью (93,2%) модели свидетельствуют об эффективно проведенной МР-семиотике доброкачественных и злокачественных узловых образований молочных желез, а также о высокой информативности выделенных МР-симптомов.
Модель на основе комплексного применения методов лучевой диагностики
Для построения диагностической модели методом дискриминантного анализа использовали только переменные, измеренные в количественной и порядковой шкале. Для верификации модели использовалась имеющаяся матрица наблюдений в качестве обучающей информации: группирующим служил признак принадлежности опухоли к одному из трех типов инцинденталом: 1-й – злокачественное образование (рак); 2-й – доброкачественное образование (фиброаденома); 3-й – киста. Дисперсионный анализ показал, что информативными признаками являются: пальпируемость образования (выявляемое клинически и зависящее от многих факторов – размеров образования, расположения и фона (типа) внутреннего строения молочной железы); структура опухоли (кистозное или солидное образование, его однородная или неоднородная структура, регистрируемые при УЗИ); наличие микрокальцинатов на маммограммах; возраст пациентки; перфузия (васкуляризация) опухоли по данным МРТ с ДКУ.
Окончательная дискриминантная модель дифференциальной диагностики на основе традиционных методов визуализации содержит пять переменных, указанных в табл. 9. Полученная модель статистически достоверна (критерий F=68,02; p<0,001).
Таблица 9
Информативность признаков, вошедших в модель
| Название признака | Значение F-критерия | Уровень значимости, p |
| Возраст пациента | 6,90 | <0,01 |
| Пальпируемость | 8,96 | <0,001 |
| Наличие микрокальцинатов при РМ | 80,17 | <0,001 |
| Перфузия (васкуляризация) опухоли по данным ДКУ МРТ | 110,67 | <0,001 |
| Структуры опухоли по данным УЗИ | 5,39 | <0,01 |
Самым информативным для дифференциальной диагностики образований в полученной дискриминантной модели, оказался признак васкуляризация образований по данным МРТ с ДКУ (F=110,67; р<0,001), на втором месте – наличие микрокальцинатов при рентгенографии (F=80,17; р<0,001). Чувствительность полученной дискрименантной модели представлена в таблице 10.
Таблица 10
Оценка чувствительности полученной дискриминантной модели
| Истинная принадлежность пациентов | Корректно распознано моделью, % | Прогноз по дискриминантной модели | ||
| Группа 1 | Группа 2 | Группа 3 | ||
| Группа 1, n=115 | 91,3 | 105 | 9 | 1 |
| Группа 2, n=250 | 98,0 | 2 | 97 | 0 |
| Группа 3, n=47 | 61,9 | 2 | 6 | 13 |
| Всего | 91,5 | 109 | 112 | 14 |
Эффективность полученной модели составила 91,5%, что статистически достоверно выше (Хи-квадрат=29,1; df=1; p<0,001) по сравнению с аналогичной моделью, полученной по результатам традиционных методов исследования (72,3%). Сравнительный анализ качества дифференциальной диагностики групп, созданными моделями показал достоверно более высокую чувствительность модели с применением МРТ с ДКУ при диагностике злокачественных образований 91,3% против 73,9% (Хи-квадрат=12,1; df=1; p<0,01), и доброкачественных образований, соответственно, 98,0% против 77,8% (Хи-квадрат=19,0; df=1; p<0,001). Для диагностики кист достоверного различия между показателями нет (Хи-квадрат=2,4; df=1; p=0,123). Для практического применения полученной дискриминантной модели используется расчет значений данных классификационных функций по результатам обследования пациента. Функция, значение которой оказывается больше, указывает на группу, вероятность принадлежности к которой выше, чем к двум другим.
Таким образом, полученная дискриминантная модель позволяет на основании результатов обследования женщин с узловыми образованиями эффективно оценить их природу с чувствительностью 91,5%.
ЗАКЛЮЧЕНИЕ
По диагностической информативности МРТ с ДКУ в диагностике узловых образований желез является достаточно высокоинформативным методом исследования. Проведенный сравнительный анализ результатов МРТ с ДКУ у женщин с диффузными и узловыми образованиями молочной железы разной природы дал возможность выделить ряд магнитно-резонансных критериев, изменение комбинации которых позволяет с высокой долей вероятности верифицировать доброкачественную или злокачественную природу выявляемых образований. При разработке методики МРТ с ДКУ у женщин с подозрением на наличие образований молочной железы были учтены технические возможности высокопольного томографа. Основным преимуществом метода является практически высокая чувствительность для выявления васкуляризированных образований. Сравнение данных МРТ и других методов лучевой диагностики, применяемых в настоящее время в маммологии, предоставило возможность определить показания и преимущества метода в более точном установлении Т-стадии опухолевого процесса, тем самым обеспечивая обоснованный отбор пациентов для органосохраняющего хирургического лечения. Особенно важно, что МРТ с ДКУ позволяет выявлять образования на фоне хорошо развитой железистой ткани молочной железы, отёчно-инфильтративных и рубцово-атрофических изменений, а также на фоне различных послеоперационных осложнений. Высокие показатели диагностической эффективности МРТ с ДКУ по разработанной методике позволяют рассматривать данный метод в качестве одного из ведущих в диагностике рака молочной железы, особенно у молодых женщин, а также при выраженных отёчно-инфильтративных изменениях и на фоне рубцовых изменений. Созданная многомерная математическая модель, учитывающая сразу несколько наиболее информативных показателей на основе данных комплексного магнитно-резонансного исследования, позволяет с высокой долей вероятности (до 98%) определить наличие злокачественного образования молочной железы.
ВЫВОДЫ
- Комплексное магнитно-резонансное исследование с динамическим конт-растным усилением является высокоинформативной методикой лучевого обследования женщин, позволяющей оценить внутреннее строение молочных желез, выявлять и эффективно проводить дифференциальную диагностику узловых образований молочных железу женщин независимо от их строения.
- Комплексное МР-исследование позволяет оценить размеры, внутреннюю структуру, оценить симметричность молочных желез, а также диагностировать патологию при наличии аномалий и вариантов развития. Динамика накопления контрастного вещества зависит от возраста, гормонального статуса, что косвенным образом отражает пролиферативные процессы в молочных железах.
- Дифференциально-диагностическими критериями образований молочных желез доброкачественной природы является следующая МР-семиотика: отсутствие нарушения структуры окружающих тканей, преобладание поперечного размера образования, округлая или овальная форма, четкие, ровные контуры и однородная МР-структура. Для образований злокачественной природы характерно: инфильтрирующий тип роста, неправильная форма с преобладанием передне-заднего размера, неровные, нечеткие контуры и неоднородная внутренняя МР-структура.
- МР-маммография с динамическим контрастным усилением является информативной методикой оценки сосудистой сети и васкуляризации образований молочных желез. Доброкачественные узловые образования минимально, центробежно и гомогенно накапливают контрастное вещество в течение всего времени исследования (I тип кривой «интенсивность сигнала – время»), у них отсутствует деформация сосудистой сети молочной железы на стороне поражения. Злокачественные опухоли интенсивно, центростремительно и кольцевидно накапливают контрастное вещество (III тип кривой «интенсивность сигнала – время»), имеют асимметрию сосудистой сети молочных желез и питающий опухоль сосуд.
- Комплексная МР-маммография с динамическим контрастным усилением является информативной методикой в оценке местной распространенности опухолевого процесса, определении характера роста, исключения мультифокальности, мультицентричности и билатеральности поражения. Анализ изменения сосудистой сети вокруг опухоли, наличие питающей опухоль артерии позволяют определить направление лимфооттока и оценить состояния регионарных лимфатических узлов. Чувствительность МРТ с ДКУ в выявлении метастатически пораженных лимфоузлов составляет 74,5%.
- Магнитно-резонансная томография с динамическим контрастным усилением позволяет визуально и количественно оценить эффективность химиотерапии у больных раком молочной железы. При этом положительным ответом на лечение являются снижение пика накопления контрастного вещества более чем в 2 раза, по сравнению с исходными данными, а также изменения типа графической зависимости с III на II или I, что отражает снижение ангинеогенеза опухоли.
- Магнитно-резонансная томография с динамическим контрастным усилением является информативной методикой диагностики послеоперационных осложнений не зависимо от их сроков возникновения и их в распространенности, а также различных осложнений после пластических операций. Критерием рецидива на фоне послеоперационных изменений является любое очаговое накопление контрастного вещества в области оперативного вмешательства. Данные изменения наиболее наглядны при построении MIP-реконструкций и перфузионных карт.
- Показаниями к проведению МР-маммографии с динамическим контрастным усилением являются: подозрение на наличие опухоли у молодых женщин с хорошо развитой железистой тканью молочных желез, определение мультицентричнос-ти, мультифокальности и билатеральности процесса, наличие признаков злокачественной природы образований, предполагаемая органосохраняющая тактика хирургического лечения, трудности дифференциальной диагностики по данным традиционных методов лучевой диагностики.
- Разработанная на основе методов многомерного математического моделирования диагностическая модель позволяет с высокой надежностью прогнозировать вероятность злокачественного характера выявляемого образования при МР-маммографии с динамическим контрастным усилением. Общая чувствительность полученной модели составляет 95,1%, специфичность – 93,2%, безошибочность 93,5%.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Для проведения МР-исследования целесообразно использовать специальную поверхностную катушку (Breast Coil), позволяющую выполнять дозированную билатеральную компрессию молочных желез, что исключает двигательные артефакты от дыхания. Поле обзора должно составлять не менее 30–35 см и включать ткань молочных желез, ретромаммарную клетчатку и зоны регионарного лимфооттока.
2. Для первичной оценки структуры молочных желез должны быть использованы Т1 и Т2 ВИ в корональной и аксиальной плоскостях, при толщине срезов не более 3–4 мм и с максимально возможным разрешением (размерность матрицы – 512 пикселей), без и с подавлением МР-сигнала от жировой ткани. Использование импульсной последовательности TIRM (Tuned Inversion Recovery Magnetization) или FLAIR (Fluid Attenuated Inversion Recovery) с коротким временем ТI позволяет более отчетливо отграничить и оценить кисты, жидкостное содержимое в протоках, дифференцировать кистозные и солидные образования от зоны отека окружающей ткани железы.
4. Для динамического сканирования необходимо выполнять пре- и постконтрастные Т1 ВИ FLASH 3D FS серии в аксиальной плоскости с толщиной среза не более 1,5 мм строго соблюдая одинаковые параметры, что позволяет сравнить постконтрастные изображения с аналогичными до введения контрастного вещества, выполнить методику субтракции и оценивать степень накопления и динамику прохождения болюса контрастного вещества.
5. Контрастное усиление необходимо проводить из расчета 0,1 ммоль/кг массы тела со скоростью 2 мл/с, желательно одномолярными контрастными средствами. Катетеризация локтевой или кистевой вены должна быть произведена до начала исследования. Использование автоматического инъектора позволяет выполнить введение контрастного препарата непосредственно во время динамического сканирования и избежать смещения молочной железы во время исследования.
- Постпроцессорный анализ МР-изображений обязательно должен включать: выполнение субтракции для оценки МР-семиотики образования; использование программы Mean Curve с построением динамических кривых «интенсивность сигнала – время» для анализа изменения интенсивности МР-сигнала в выбранных областях интереса на всех сериях динамического сканирования, оценивая степень накопления в процентах и динамику прохождения контрастного вещества; построение MIP-реконструкций для оценки сосудистой сети молочных желез и вокруг образования; построение цветовых перфузионных карт при использовании программы Breast Perfusion, представляющей собой математический обсчет прохождения болюса контрастного вещества с последующим картированием полученных данных, анализ перфузионных карт позволяет оценить васкуляризацию образований и оценить параметры ангионеогенеза по пяти критериям: накопление и вымывание контрастного вещества, время пика контрастного вещества, проекция максимальной интенсивности изображений, интеграл положительного накопления.
7. МРТ молочных желез с контрастным усилением следует проводить в первую фазу менструального цикла. Проведение исследования во вторую (пролиферативную) фазу цикла может привести к диагностическим ошибкам, особенно у молодых женщин и у женщин с диффузными дисгормональными изменениями ткани молочных желез, в результате неспецифического диффузного или очагового усиления сигнала от железистой ткани молочной железы. Также нецелесообразно применять ДКУ на фоне проведения химиотерапии, после проведения лучевой терапии (до 3–6 месяцев) и в раннем послеоперационном периоде. Для анализа изменений эндопротезов и диагностики их разрывов достаточно нативного исследования без применения ДКУ, но обязательным является применение подавления сигнала от силикона, изменения параметры TI.
8. Проведение комплексного магнитно-резонансного исследования молочных желез показано для дифференциальной диагностики узловых образований при неоднозначных данных традиционных методов визуализации, при образованиях молочной железы больших размеров; при отечно-инфильтративной форме рака молочной железы и дифференциальной диагностике с воспалительными изменениями (мастит); при предполагаемой органосохраняющей тактике хирургического лечения (для исключения мультицентричного, мультифокального характера роста или билатерального поражения); для выявления и диагностике образований на фоне предшествующих оперативных вмешательствах, в том числе после реконструктивных пластических операций для исключения наличия патологических изменений, как самих имплантатов, так и оставшейся ткани железы на фоне имплантатов), после лучевой терапии.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Неруш, К.Л. Методические аспекты проведения МРТ исследований молочных желез / К.Л. Неруш, С.В. Серебрякова, Г.Е. Труфанов, А.В. Мищенко, В.А. Фокин // Материалы научно-практической юбилейной конференции «Современная лучевая диагностика в многопрофильном лечебном учреждении», посвященной 75-летию кафедры рентгенологии и радиологии ВМедА. – СПб, 2004. – С. 289-290.
- Неруш, К.Л. К вопросу о применении магнитно-резонансной томографии в диагностике заболеваний молочных желез / К.Л. Неруш, В.А. Фокин, Г.Е. Труфанов, С.В. Серебрякова // Невский радиологический форум «Наука – клинике»: Материалы конгресса. – СПб, 2005 – С. 49.
- Труфанов, Г.Е. Магнитно-резонансная томография с использованием динамического контрастного усиления / Г.Е. Труфанов, К.Л. Неруш, В.А. Фокин, С.В. Серебрякова // Невский радиологический форум «Наука – клинике»: Материалы конгресса. – СПб, 2005. – С. 50.
- Неруш, К.Л. МРТ с динамическим контрастным усилением: методические аспекты / К.Л. Неруш, Г.Е. Труфанов, С.В. Серебрякова // Материалы Всероссийского научного форума «Радиология-2005». – М., 2005. – С. 302.
- Неруш, К.Л. Опыт использования МР с динамическим контрастным усилением в диагностике заболеваний молочных желез / К.Л. Неруш, Г.Е. Труфанов, В.А. Фокин, С.В. Серебрякова // Вестник Российской Военно-медицинской академии. – 2005. – № 1 (13). – С. 383-384.
- Неруш, К.Л. Возможности магнитно-резонансной томографии в диагностике заболеваний молочных желез / К.Л. Неруш, Г.Е. Труфанов, В.А. Фокин, С.В. Серебрякова // Сб. научных работ юбилейной конференции, посвященной 60-летию кафедры рентгенологии и радиологии СПБГМУ им. акад. И.П. Павлова «Роль лучевой диагностики в многопрофильной клинике и лечебных учреждениях стоматологического профиля». – СПб, 2005. – С. 124.
- Неруш, К.Л. К вопросу о применении МРТ в диагностике образований молочных желез / К.Л. Неруш, С.В. Серебрякова, В.А. Фокин // «Состояние, перспективы развития маммологической службы Российской Федерации и роль общественных организаций». Материалы III Всероссийской научно-практической конференции с международным участием– М. – 2005. – С.76-77.
- Труфанов, Г.Е. МР-маммография с использованием динамического контрастного усиления / Г.Е. Труфанов, В.А. Фокин, К.Л. Неруш, С.В. Серебрякова // «Состояние, перспективы развития маммологической службы Российской Федерации и роль общественных организаций». Материалы III Всероссийской научно-практической конференции с международным участием. – М., 2005. – С. 83-84.
- Фокин, В.А. Возможности МР-маммографии в диагностике заболеваний молочных желез / В.А. Фокин, Г.Е. Труфанов, В.О. Панов, К.Л. Неруш, С.В. Серебрякова, Л.И. Иванова, В.С. Декан, О.А. Гончарова // «Мать и дитя». Материалы VII Российского форума. – М., 2005. – С. 221.
- Неруш, К.Л. Магнитно-резонансная маммография в дифференциальной диагностике узловых образований молочных желез / К.Л. Неруш, Г.Е. Труфанов, В.А. Фокин, Л.И. Иванова, С.В. Серебрякова // «Мать и дитя». Материалы VII Российского форума. – М., 2005. – С. 342.
- Иванова, Л.И. Комплексная лучевая диагностика новообразований молочных желез / Л.И. Иванова, Г.Е. Труфанов, Л.Л. Кириллова, В.В. Рязанов, В.А. Фокин, С.В. Серебрякова // «Актуальные вопросы клинической и военно-морской медицины. Достижения и перспективы». Материалы III международной научно-практической конференции. – С., 2005. –101-102.
- Труфанов, Г.Е. Возможности магнитно-резонансной томографии в диагностике послеоперационных изменений молочных желез / Г.Е. Труфанов, В.А. Фокин, С.В. Серебрякова Л.И. Иванова // Интервенционная радиология. Материалы III научной конференции с международным участием. – Петрозаводск, 2006. – С. 93-94.
- Фокин, В.А. Методика МР-маммографии / В.А. Фокин, С.В. Серебрякова // «Проблемы диагностики и лечения рака молочной железы». Материалы III международной конференции Белые ночи. – СПб, 2006. – С. 87.
- Иванова, Л.И. Возможности ультразвукового исследования лимфатических узлов при раке молочной железы / Л.И. Иванова, Г.Е. Труфанов, В.В. Рязанов, Е.Л. Перегудова, С.В. Серебрякова // «Проблемы диагностики и лечения рака молочной железы». Материалы III международной конференции Белые ночи. – СПб, 2006. – С. 67.
- Иванова, Л.И. Сочетанная патология щитовидной железы и органов малого таза у пациенток с раком молочной железы, выявляемая при ультразвуковом исследовании / Л.И. Иванова, Г.Е.Труфанов, В.В. Рязанов, Е.Л. Перегудова, С.В. Серебрякова // «Проблемы диагностики и лечения рака молочной железы». Материалы III международной конференции Белые ночи. – СПб, 2006. – С. 67-68.
- Серебрякова, С.В. Возможности магнитно-резонансной томографии в диагностике послеоперационных изменений молочных железы / С.В. Серебрякова, Г.Е. Труфанов, В.А. Фокин, Л.И. Иванова, В.С. Декан, // Материалы III международной конференции – Белые ночи «Проблемы диагностики и лечения рака молочной железы» – СПб., 2006.– С. 87.
- Серебрякова, С.В. Методика МР-маммографии / С.В. Серебрякова, В.А. Фокин // «Проблемы диагностики и лечения рака молочной железы». Материалы III международной конференции Белые ночи – СПб, 2006.– С. 87-88.
- Неруш, К.Л. Возможности магнитно-резонансной маммографии в дифференциальной диагностике узловых образований молочных железы / К.Л. Неруш, Г.Е. Труфанов, В.А. Фокин, Л.И. Иванова, С.В. Серебрякова // Научно-практическая конференция «Высокотехнологичная специализированная медицинская помощь». – М., ГВКГ им. Н.Н. Бурденко, 2006. – С. 342.
- Серебрякова, С.В. Методика магнитно-резонансной маммографии. / С.В. Серебрякова, В.А. Фокин // Маммология. – 2006. – № 4. – С. 64-65.
- Серебрякова, С.В. Лучевая диагностика заболеваний молочных желез. Руководство для врачей / под редакцией Г.Е. Труфанова. – СПб., «Элби»» 2006. – 232 с.
- Труфанов, Г.Е. Возможности магнитно-резонансной томографии в диагностике послеоперационных изменений молочных желез / Г.Е. Труфанов, В.А. Фокин, С.В. Серебрякова, Л.И. Иванова, Е.А. Юхно // Невский радиологический форум «Новые горизонты»: Сборник научных трудов. – СПб, 2007. – С. 386-387.
- Фокин, В.А. Возможности магнитно-резонансной томографии в дифференциальной диагностике узловых образований молочных желез / В.А. Фокин, Г.Е. Труфанов, С.В. Серебрякова, Е.А. Юхно // Невский радиологический форум «Новые горизонты»: Сборник научных трудов. – СПб, 2007. – С. 402-403.
- Декан, В.С. Полуколичественный метод в диагностике злокачественных образований молочных желез при проведении ОФЭКТ с 99m Тс-метоксиизобутилизонитрилом / В.С. Декан, Г.Г. Романов, Д.Ю. Анохин, С.В. Серебрякова // Невский радиологический форум «Новые горизонты»: Сборник научных трудов. – СПб, 2007. – С. 539.
- Юхно, Е.А. Роль и значение магнитно-резонансной маммографии с динамическим контрастным усилением в дифференциальной диагностике узловых образований молочных желез / Е.А. Юхно, Г.Е. Труфанов, В.А. Фокин, С.В. Серебрякова // Амбулаторная хирургия. Стационарзамещающие технологии. – СПб. – № 3 (27). –С. 19-24.
- Серебрякова, С.В. Возможности магнитно-резонансной маммографии и маммосцинтиграфии в оценке распространенности и стадировании рака молочной железы. / С.В. Серебрякова, Г.Е. Труфанов, В.А. Фокин, В.С. Декан //«Проблемы диагностики и лечения рака молочной железы». IV Международная ежегодная конференция. – СПб, 2007. – С. 91.
- Юхно, Е.А. Роль и значение магнитно-резонансной маммографии с динамическим контрастным усилением в оценке васкуляризации узловых образований молочной железы. / Е.А. Юхно, Г.Е. Труфанов, В.А. Фокин, С.В. Серебрякова // «Проблемы диагностики и лечения рака молочной железы». IV международная ежегодная конференция. – СПб, 2007. – С. 101.
- Труфанов, Г.Е. Возможности магнитно-резонансной томографии в оценке васкуляризации узловых образований молочной железы, как один из критериев дифференциальной диагностики желез / Г.Е. Труфанов, В.А. Фокин, С.В. Серебрякова, Е.А. Юхно // Радиология-2007. Научные материалы конференции. – М., 2007. – С. 425-426.
- Серебрякова, С.В. МР-диагностика заболеваний молочных желез. Магнитно-резонансная томография (Руководство для врачей) / Под ред. проф. Г.Е. Труфанова и к.м.н. В.А. Фокина – СПб.: ООО «Издательство ФОЛИАНТ», 2007. – С. 586-630.
- Юхно, Е.А., Возможности МР-маммографии с динамическим контрастным усилением в диагностике локализованной формы фиброаденоматоза / Г.Е. Труфанов, Е.А. Юхно, С.В. Серебрякова // Байкальские встречи. Материалы первой межрегиональной научно-практической конференции с международным участием. – Иркутск, 2008. – С. 414.
- Yukhno, E.A. Advantages of contrast enhanced MRI in the estimation of breast cancer extent before breast-preserving surgery / E.A. Yukhno, G.E. Trufanov, V.A. Fokin, S.V. Serebryakova // European Congress of Radiology. – Vienna, Austria, 2008. – Vol.18, Supp.1. – P. 358.
- Dekan, V.S. Breast MRI and breast SPECT: Are they alternative or mutually complementary to each other /V.S. Dekan, G.E. Trufanov, T. Demshina, S.V. Serebryakova // ECR. – Vienna, Austria, 2008. – Vol.18, Supp.1. – P. 35.
- Е.А. Юхно МР-маммография, как наиболее точный метод диагностики в определении распространенности опухолевого процесса перед выполнением органосохраняющих операций / Г.Е. Труфанов, Е.А. Юхно, С.В. Серебрякова // Вестник Российской Военно-медицинской академии. – 2008. – № 2 (22). – С. 112-116.
- Труфанов, Г.Е. Решающее значение данных МРТ у больных с раком молочной железы при органосохраняющем лечении / Г.Е. Труфанов, С.В. Серебрякова, Е.А. Юхно // «Проблемы диагностики и лечения рака молочной железы». V международная ежегодная конференция. – СПб, 2008. – С. 53-54.
- Серебрякова, С.В. МРТ в диагностике рецидива рака молочной железы после органосохраняющего лечения / С.В. Серебрякова, Г.Е. Труфанов, Е.А. Юхно // «Проблемы диагностики и лечения рака молочной железы». V международная ежегодная конференция. – СПб, 2008. – С. 58.
- Труфанов, Г.Е. Влияние заместительной гормональной терапии на результаты МР-маммографии / Г.Е. Труфанов, С.В. Серебрякова, Е.А. Юхно // Медицинская визуализация. Материалы II Всероссийского национального конгресса по лучевой диагностике и терапии – М., 2008. – С. 323.
- Серебрякова, С.В. Возможности МР-маммографии при синдроме отечной молочной железы / С.В. Серебрякова, Г.Е. Труфанов, Е.А. Юхно // Медицинская визуализация. Материалы II Всероссийского национального конгресса по лучевой диагностике и терапии. – М., 2008. – С. 323-324.
- Серебрякова, С.В. Усовершенствованная методика магнитно-резонансной маммографии с динамическим контрастным усилением. / С.В. Серебрякова, Г.Е. Труфанов, Фокин В.А., Е.А. Юхно // Усовершенствование способов и аппаратуры, применяемых в учебном процессе, медико-биологических исследованиях и клинической практике. – Под общей ред. проф. В.Н. Цыгана СПб.: ВМедА., 2008. – С. 142-143.
- Труфанов, Г.Е. Корреляция данных динамической МРТ с типом распределения микроциркуляторного русла и гистологическим типом опухоли молочной железы / Г.Е. Труфанов, Е.А. Юхно, С.В. Серебрякова // «От лучей Рентгена – к инновациям ХХI века: 90 лет со дня основания первого в мире рентгенорадиологического института (Российского научного центра радиологии и хирургических технологий)». Материалы научной конференции. – СПб, 2008. – С. 134-135.
- Trufanov, G.E. The decisive importance of MRI at breast preserving surgery of breast cancer / G.E. Trufanov, E.A. Yuchno, S.V. Serebryakova // ESMRMB. – Valencia, 2008. – P. 293.
- Serebryakova, S.V. The MR-mammography and breast scintigraphy in detection of breast cancer regional metastases / S.V. Serebryakova, G.E. Trufanov, V.A. Fokin, E.A. Yuchno, V.S. Dekan // ESMRMB. – Valencia, 2008. – P. 293-294.
- Trufanov, G.E. The MRI of breast cancer recurrence following breast-conserving surgery / G.E. Trufanov, E.A. Yuchno, S.V. Serebryakova // ESMRMB. – Valencia, 2008. – P. 295.
- Труфанов, Г.Е. МР-маммография и маммосцинтиграфия в определении регионарного метастазирования рака молочной железы / Г.Е. Труфанов, В.А. Фокин, В.С. Декан, Е.А. Юхно, С.В. Серебрякова // Современные алгоритмы диагностики и стандарты лечения в клинической медицине. Тезисы докл. науч.-практ. конф. – М.: ГВКГ им. Н.Н. Бурденко, 2008. – С. 364-365.
- Труфанов, Г.Е. Корреляция данных динамической МРТ с гистологическим типом опухоли молочной железы / Г.Е. Труфанов, Е.А. Юхно, С.В. Серебрякова // Современные алгоритмы диагностики и стандарты лечения в клинической медицине: Тезисы докл. науч.-практ. конф. – М.: ГВКГ им. Н.Н. Бурденко, 2008. – С 372-373.
- Труфанов, Г.Е. Патофизиологические основы контрастного усиления при магнитно-резонансной томографии молочных желез / Г.Е. Труфанов, С.В. Серебрякова, Е.А. Юхно, О.А. Гончарова // Вестник Российской Военно-медицинской академии. – 2008. – № 4 (24). – С. 80-85.
- Серебрякова, С.В. Динамическая магнитно-резонансная томография с контрастным усилением в диагностике узловых образований молочных желез / С.В. Серебрякова, Г.Е., Труфанов, Е.А. Юхно, М.В. Резванцев // Вестник Российской Военно-медицинской академии. – 2008. – № 4 (24). – С. 85-90.
- Серебрякова, С.В. Магнитно-резонансная томография в диагностике опухолевых и неопухолевых заболеваний молочных желез / С.В. Серебрякова, Г.Е. Труфанов, Е.А. Юхно // Отчет по НИР VMA.03.12.20.0508/0276. Шифр «Контур», 2008 г. – 52 с.
- Демшина, Т.Е. Возможности ОФЭКТ с 99Tс-МИБИ в диагностике новообразований молочной железы / Т.Е. Демшина, В.В. Рязанов, С.В. Серебрякова // Невский радиологический форум. – СПб, 2009. – С. 162.
- Труфанов, Г.Е. МРТ и ОФЭКТ диагностика рецидива рака молочной железы после органосохраняющих операций / Г.Е. Труфанов, С.В. Серебрякова, В.А. Фокин, В.С. Декан, Е.А. Юхно // Невский радиологический форум. – СПб., 2009. – С. 483-484.
- Демшина, Т.Е. ОФЭКТ в оценке состояния регионарных зон лимфооттока при раке молочной железы / Т.Е. Демшина, С.В. Серебрякова // Невский радиологический форум. – СПб, 2009. – С. 484.
- Труфанов, Г.Е. Оценка васкуляризации опухолей молочной железы по результатам динамической МРТ / Г.Е. Труфанов, В.А. Фокин, С.В. Серебрякова, Е.А.Юхно и др. // Невский радиологический форум. – СПб, 2009. – С. 624-625.
- Труфанов, Г.Е. Возможности однофотонной эмиссионной компьютерной томографии с 99mTc-метоксиизобутилизонитрилом в диагностике новообразований молочной железы / Г.Е. Труфанов, В.В. Рязанов, С.В. Серебрякова, И.В. Бойков, Т.Е. Демшина / Вестник Российской Военно-медицинской академии. – 2009. – № 1 (25). – С. 118-122.
- Труфанов, Г.Е. Информативность МР-маммографии при определении распространения опухолевого процесса на фоне железистой ткани / Г.Е. Труфанов, Е.А. Юхно, С.В. Серебрякова // Вестник Российской Военно-медицинской академии. – 2009. – № 1 (25). – С. 718-719.
- Серебрякова, С.В. Магнитно-резонансная маммография в диагностике фиброаденом / С.В. Серебрякова // Вестник Российской Военно-медицинской академии. – 2009. – № 1 (25). – С. 809-810.
- Серебрякова, С.В. Методика магнитно-резонансной томографии при отечно-инфильтративных маститоподобных и послеоперационных изменениях молочных желез / С.В. Серебрякова, В.А. Фокин, Е.А. Юхно // Усовершенствование способов и аппаратуры, применяемых в учебном процессе, медико-биологических исследованиях и клинической практике. – СПб, ВМедА, 2009. – С. 483-484.
- Серебрякова, С.В. Прогностические факторы образований молочных желез по данным динамической маммографии / С.В. Серебрякова // Медицинская визуализация. Материалы III Всероссийского национального конгресса по лучевой диагностике и терапии. – М., 2009. – С. 366-367.
- Труфанов, Г.Е. Совмещенная ПЭТ-КТ в диагностике и стадировании рака молочной железы / Г.Е.Труфанов, В.В. Рязанов, С.В. Серебрякова, И.В. Бойков, Н.И. Дергунова, В.С. Декан, Т.Е. Демшина // Медицинская визуализация. Материалы III Всероссийского национального конгресса по лучевой диагностике и терапии. – М., 2009. – С. 416-417.
- Труфанов, Г.Е. Магнитно-резонансные критерии диагностики листовидных опухолей молочных желез / Г.Е. Труфанов, Е.А. Юхно, Л.И. Иванова, Л.Л. Кириллова, С.В. Серебрякова // Медицинская визуализация. Материалы III Всероссийского национального конгресса по лучевой диагностике и терапии. – М., 2009. – С. 417-418.
- Юхно, Е.А. Типы распределения микроциркуляторного русла в опухолях молочной железы по результатам динамической МРТ / Е.А. Юхно, Г.Е. Труфанов, С.В. Серебрякова // «Проблемы диагностики и лечения рака молочной железы». VI международная ежегодная конференция. – СПб, 2009. – С. 110.
- Труфанов, Г.Е. МР-критерии рецидива рака молочной железы после органосохраняющих операций / Г.Е. Труфанов, В.А. Фокин, Е.А. Юхно, Л.Л. Кириллова, С.В. Серебрякова // «Проблемы диагностики и лечения рака молочной железы». VI международная ежегодная конференция. – СПб, 2009. – С. 111.
- Труфанов, Г.Е. Оценка эффективности неоадъювантной химиотерапии рака молочной железы по результатам динамической МРТ / Г.Е. Труфанов, Е.А. Юхно, Л.И. Иванова, С.В. Серебрякова // «Проблемы диагностики и лечения рака молочной железы». VI международная ежегодная конференция. – СПб, 2009. – С. 110-111.
- Юхно, Е.А. Магнитно-резонансная маммография в диагностике листовидных опухолей / Е.А. Юхно, Г.Е. Труфанов, Л.И. Иванова, С.В. Серебрякова // «Проблемы диагностики и лечения рака молочной железы». VI международная ежегодная конференция. – СПб, 2009. – С. 116.
- Yuchno, E.A. The MR mammography of phylloid tumors of different histological grades / E.A. Yuchno, G.E. Trufanov, S.V. Serebryakova // ESMRMB. – Antalya/TR. 2009 – P. 406.
- Труфанов, Г.Е. Магнитно-резонансная маммография, обоснование необходимости динамического контрастирования / Г.Е. Труфанов, Е.А. Юхно, С.В. Серебрякова // Вестник Санкт-Петербургского университета. – 2009. – Сер. 11., вып. 1. – С. 151-156.
- Серебрякова, С.В. Место магнитно-резонансной томографии в комплексной дифференциальной лучевой диагностике образований молочных желез / С.В. Серебрякова // Вестник Санкт-Петербургского университета. – 2009. – Сер. 11., вып. 2. – С. 120-130.
- Серебрякова, С.В. Возможности совмещенной позитронно-эмиссионной и компьютерной томографии в диагностике рака молочной железы / С.В. Серебрякова, Г.Е. Труфанов, В.В. Рязанов, И.В., Бойков, Н.И. Дергунова, Т.Е. Демшина // Вестник Российской Военно-медицинской академии. – СПб., 2009. – № 2 (26). – С. 34-38.
- Серебрякова, С.В. Магнитно-резонансная томография в диагностике разрывов силиконовых имплантов молочных желез / С.В. Серебрякова, Г.Е. Труфанов, В.Е. Савелло, Т.А. Шумакова // Вестник Российской Военно-медицинской академии. – 2009. – № 3 (27). – С. 80-87.
- Демшина, Т.Е. Совмещенная ПЭТ-КТ в оценке регионарного и отдаленного метастазирования рака молочной железы / Т.Е. Демшина, Г.Е. Труфанов, В.В. Рязанов, И.В. Бойков, С.В. Серебрякова // Вестник Российской Военно-медицинской академии. – 2009. – № 4 (28). – С. 38-39.
- Труфанов, Г.Е. Возможности МРТ с ДКУ у больных раком молочной железы в оценке эффективности проводимой неоадъювантной химиотерапии / Г.Е. Труфанов, Е.А. Юхно, С.В. Серебрякова // Вестник Российской Военно-медицинской академии. – 2009. – № 4 (28). – С. 112-113.
- Серебрякова, С.В. Возможности магнитно-резонансной маммографии в диагностике осложнений аугментационной маммопластики / С.В. Серебрякова, Т.А. Шумакова, Г.Е. Труфанов, В.Е. Савелло // Вестник Российской Военно-медицинской академии. – 2009. – № 4 (28). – С. 113-114.
- Труфанов, Г.Е. Возможности магнитно-резонансной маммографии в оценке распространения опухолевого процесса на фоне железистой ткани / Г.Е. Труфанов, Е.А. Юхно, В.А.Фокин, Л.И. Иванова, Л.Л. Кириллова, С.В. Серебрякова // Актуальные проблемы оказания специализированной медицинской помощи в условиях стационара и применения стационарзамещающих технологий. – М.: ГВКГ им. Н.Н. Бурденко, 2009. – С. 282-283.
- Серебрякова, С.В. Магнитно-резонансная семиотика рака молочной железы / С.В. Серебрякова, Г.Е. Труфанов, Е.А. Юхно // Опухоли женской репродуктивной системы. Маммология / онкогинекология. – 2009. – № 3-4. – С. 20-25.
- Серебрякова, С.В. Руководство по лучевой диагностике заболеваний молочных желез / Под ред. проф. Г.Е. Труфанова. – СПб, «Элби», 2009. – 351 с.
- Серебрякова, С.В. МРТ в маммологии. Руководство для врачей / С.В. Серебрякова, Г.Е. Труфанов, Е.А. Юхно. – СПб, «Элби», 2009. – 201 с.
- Серебрякова, С.В. МР-семиотика образований молочных желез / С.В. Серебрякова, Г.Е. Труфанов, В.А. Фокин, Е.А. Юхно, Е.К. Яковлева, К.Е. Тихова // Вопросы онкологии. – 2010. – № 1. – С. 45-48.
СПИСОК СОКРАЩЕНИЙ
MIP – Maximum Intensity Projection – проекция максимальной интенсивности
(алгоритм реконструкции изображения)
MIPt – проекция максимальной интенсивности за всё время динамического исследования
PEI – (Positive Enhancement Integral)интеграл положительного накопления
ТТР – Time To Peak – время до максимального пика контрастного вещества
ВИ – взвешенные изображения
ДКУ – динамическое контрастное усиление
КТ – компьютерная томография
МР – магнитно-резонансный (-ое, -ая, -ые)
МРТ – магнитно-резонансная томография
МРМ – магнитно-резонансная маммография
ОФЭКТ – однофотонная эмиссионная компьютерная томография
ПЭТ-КТ – совмещенная позитронно-эмиссионная и компьютерная томография
РМ – рентгеновская маммография
УЗИ – ультразвуковое исследование
ФАМ – фиброаденоматоз

