Роль лекарственной терапии в лечеии рака мочевого пузыря, рака предстательной железы и рака почки
На правах рукописи
БОЛОТИНА Лариса Владимировна
РОЛЬ ЛЕКАРСТВЕННОЙ ТЕРАПИИ В ЛЕЧЕИИ РАКА МОЧЕВОГО ПУЗЫРЯ, РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ И РАКА ПОЧКИ
14.00.14 – онкология
АВТОРЕФЕРАТ
Диссертации на соискание ученой степени
доктора медицинских наук
Москва – 2008
Работа выполнена в ФГУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий»
(директор – академик РАМН, профессор В.И. Чиссов)
Научный консультант:
доктор медицинских наук, профессор И.Г. Русаков
Официальные оппоненты:
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Среди онкоурологических заболеваний рак мочевого пузыря (РМП), рак предстательной железы (РПЖ) и рак почки (РП) составляют разные доли, темпы прироста, но общим является то, что проблема их лечения далека от разрешения. В разных странах, а иногда и в различных клиниках одной страны существуют отличные лечебные подходы с применением тех или иных методов лечения.
По данным ВОЗ отмечается ежегодная тенденция к росту заболеваемости РМП, РПЖ и РП, а по темпам прироста заболеваемости за последние 10 лет РП опережает все остальные нозологии. Другой особенностью последних лет является снижение возраста заболевших, в том числе и РПЖ. Все чаще онкоурологические заболевания встречаются у людей трудоспособного возраста, что делает актуальной проблему разработки новых подходов к лечению с обеспечением не только качества жизни, но и с возможностью выполнения органо-сберегающих операций. Выполнение экономных операций, стремление воздействовать на оккультные метастазы, внедрение в клиническую практику активных цитостатиков для лечения каждой из нозологий приводит к закономерному включению в комплекс лечебных мероприятий дополнительного и возможно более раннего системного воздействия.
Идеальным подходом к лечению неоспоримо является подбор лекарственной терапии на основании индивидуальных факторов прогноза течения заболевания и эффективности лечения. Несмотря на серьезные успехи молекулярной биологии и разработки новых видов лекарственных средств, сегодня преждевременно говорить о возможности формирования индивидуальной программы лечения каждого пациента. Возможно, на современном этапе развития онкологии наиболее важно определить последовательность и объем лечебных мероприятий, рациональность сочетания локальных и системных методов лечения. Неоправданное увеличение объема лечения также может принести вред больному, как и его недолечивание. В связи с этим актуален поиск маркеров, позволяющих вовремя определить возобновление опухолевого процесса на доклинической стадии, что позволит более эффективно провести необходимую терапию. Иногда речь может идти не только о своевременном начале лекарственной терапии, но иногда и хирургическом вмешательстве по удалению изолированных метастатических очагов, что может в ряде случаев заменить системное воздействие при малочувствительных вариантах опухолей, в частности РП, или увеличить эффективность проводимой терапии за счет удаления основного опухолевого массива.
Стремление к более раннему началу системного воздействия определяется дополнительно тем, что благодаря хорошему общему состоянию больных, имеющих ограниченный опухолевый процесс и еще не получавших никакого противоопухолевого лечения, неоадъювантная терапия является менее токсичной. Кроме того, при современном уровне развития медицины существует возможность создания всех условий для более комфортного проведения лекарственной терапии. Это означает применение антиэметиков, колониестимулирующих препаратов, позволяющих справится с явлениями угнетения кроветворения, назначение бисфосфонатов при поражении костей, а также использование цитостатиков одной группы, но с разными профилями токсичности, что позволяет проводить лечение у больных со снижением функции органов без снижения эффективности лекарственного воздействия, а также таблетированных средств, дающих возможность проведения лечения в амбулаторных условиях.
По данным ВОЗ рак мочевого пузыря (РМП) в структуре онкологических заболеваний составляет около 4%, занимая лидирующее место (70%) среди опухолей мочевого тракта и второе место среди опухолей мочеполовой системы. Ежегодно регистрируется более 73 000 новых случаев заболевания в Европе и более 60 000 в США, а умирает в мире от РМП около 132 000 человек в год. (Jemal A., 2005). В 2005 году в Российской Федерации число больных с впервые установленным диагнозом составило 11939 человек, а прирост заболеваемости за 10 лет в абсолютном выражении превысил 2500 человек. На конец 2005 года в онкологических учреждениях Российской Федерации под наблюдением находились 65339 больных РМП, и лишь 29502 (45,2%) из них в течение 5 лет. (Чиссов В.И., 2006).
Инвазивный РМП, на долю которого на момент первичного установления диагноза приходится около 30% опухолей этой локализации, характеризуется исходно агрессивным течением и неблагоприятным прогнозом с высоким риском раннего возникновения экстраорганных очагов заболевания. Если больным инвазивным РМП не проводить противоопухолевого лечения, то более 85% из них умрут в течение ближайших 2 лет от прогрессирования процесса (Borden L.S., 2003). Кроме того, несмотря на потенциальную курабельность инвазивного РМП, при использовании только оперативного лечения, у половины оперированных больных развиваются отдаленные метастазы, и они погибают от прогрессирования заболевания.
Syed M. было показано, что даже при выполнении больным радикальной цистэктомии, 5-летняя выживаемость при поражении регионарных лимфатических узлов составляет 15-20% и не превышает 35-40% при микроскопическом поражении 1 лимфатического узла со стороны поражения (Syed M., 2002).
Как правило, инвазивный уротелиальный рак является высоко злокачественной опухолью с быстрым темпом распространения на более глубокие слои органа, паравезикальную клетчатку, прилежащие структуры малого таза. При увеличении инвазии прогрессивно возрастает частота вовлечения в процесс регионарных лимфатических узлов (Stein J.P., 2001; Poulsen A.L., 1998; Viewig, 1999; Leissner, 2004).
На сегодняшний день в США и большинстве европейских стран радикальная цистэктомия с билатеральной лимфаденэктомией является стандартом лечения инвазивного РМП. Однако, несмотря на такой обширный объем оперативного вмешательства, у половины оперированных больных в течение ближайших 2 лет развиваются отдаленные метастазы (Syed M., 2002).
В России нет единого мнения об объеме хирургического вмешательства при инвазивном РМП. Усовершенствование хирургической техники привело к расширению возможности выполнения больным ортотопического замещения мочевого пузыря с сохранением произвольного мочеиспускания, что, несомненно, улучшило качество жизни больных, подлежащих цистэктомии. В ряде клиник наряду с радикальной цистэктомией достаточно широко выполняется чрезбрюшинная резекция мочевого пузыря при степени распространенности опухоли T2N0M0. В послеоперационном периоде этим больным назначается химиотерапия. Но химиотерапия может быть использована как после операции (адъювантная химиотерапия), так и до хирургического вмешательства (неоадъювантная химиотерапия). Ответ опухоли на проведенную неоадъювантную химиотерапию с последующим оперативным вмешательством является значимым прогностическим фактором в отношении выживаемости (Splinter T.A., 1992).
Рак предстательной железы (РПЖ) занимает 2 место в структуре онкологической заболеваемости и смертности у мужчин в США и странах Западной Европы. Увеличение продолжительности жизни в большинстве экономически развитых стран создают тенденцию к общемировому старению населения и опосредованно к росту заболеваемости. В США в 2006 году выявлено 234460 новых случаев РПЖ, а 27350 больных умерли от этого заболевания (ACS, 2006). Необходимо отметить, что наблюдается исключительно быстрый прирост ежегодной заболеваемости РПЖ, составляющий 3% в год. Такая динамика позволяет прогнозировать удвоение количества регистрируемых случаев к 2030 году. Наиболее высокие показатели заболеваемости зарегистрированы у лиц старше 65 лет (81% случаев).
В России по величине темпа прироста РПЖ выходит на 2 место (прирост 63,9%), уступая только раку почки (прирост 66,1%). Смертность от РПЖ составляет 2,9% и занимает 2 место после рака легкого среди прочих онкологических заболеваний (Чиссов В.И., 2006). Около 90% больных генерализованным РПЖ имеют костные метастазы. На протяжении многих лет стандартом лечения данной категории больных оставалась комбинация митоксантрона и преднизолона, которая позволяла добиться у 30% больных, имеющих болевой синдром в костях, уменьшения уровня болей, при этом не оказывая никакого влияния на продолжительность жизни по сравнению с симптоматической терапией (Tannock I.F., 1996; Kantoff P.W., 1999). В 2004 году были опубликованы результаты 2 рандомизированных международных исследований, продемонстрировавших преимущества лечебных комбинаций с включением доцетаксела, впервые позволивших не только добиться непосредственного лечебного эффекта, но и увеличить продолжительность жизни больных (Eisenberg M.A., 2004; Petrylak D.P., 2004). Ряд авторов изучали эффективность комбинаций на основе другого препарата из группы таксанов – паклитаксела (Berry W., 2001; Hudes G.R., 2001).
ПСА является надежным опухолевым маркером как для диагностики РПЖ, оценки эффективности проводимого лечения, так и для раннего выявления прогрессирования заболевания. Повышение уровня ПСА на фоне проводимого лечения не всегда означает его неэффективность. Одной из причин может являться повышение дифференцировки опухолевых клеток в процессе лекарственной терапии. При обратной ситуации, когда отмечается нарастание анаплазии опухолевых клеток, уровень ПСА может снижаться, что связано с потерей способности таких клеток синтезировать ПСА.
Доля рака почки (РП) в структуре онкологических заболеваний невелика, около 3%, однако четко прослеживается ежегодная тенденция к росту заболеваемости. Так, в США в 2006 году было зарегистрировано 38890 новых случаев заболевания, а число умерших от этой патологии составило 12840 человек (Jemal A., 2006). За прошедшие 50 лет заболеваемость и смертность от РП в США увеличились на 126% и 37%, соответственно. В России в 2005 году впервые РП диагностирован у 8778 человек, а прирост заболеваемости за 10 лет составил 66,1% (Чиссов В.И., 2006). РП регистрируется у мужчин в 2 раза чаще, чем у женщин. Наибольшее число случаев заболевания РП наблюдается с 4 по 6 декаду жизни, хотя РП может встречаться в любом возрасте. К моменту постановки диагноза около 20%-30% больных имеют отдаленные метастазы. У 25% диагностируется местно-распространенный процесс. Однако у одной трети из числа этих пациентов в послеоперационном периоде наблюдается прогрессирование заболевания с появлением отдаленных метастазов. Пятилетняя выживаемость больных, перенесших нефрэктомию при локализации опухоли в пределах почечной паренхимы (Т1-Т2), превышает 80%. Вовлечение в опухолевый процесс почечной вены при отсутствии поражения лимфатических узлов не оказывает влияния на показатель выживаемости. Поражение лимфатических узлов или распространение опухоли за пределы капсулы органа сопровождается снижением показателя 5-летней выживаемости до 10%-25%. Средняя продолжительность жизни больных с метастатическим процессом составляет 1 год, а показатель 5-летней выживаемости колеблется от 0% до 10%. Это является отражением недостатка эффективных лекарственных средств системного воздействия. РП обладает устойчивостью к цитостатическим и гормональным препаратам. Эффективность применения химиотерапевтических средств не превышает 10% (Motzer R.J., 1997). Наиболее часто из цитостатиков используются препараты фторпиримидинового ряда. Иммунотерапия с применением для этой категории больных препаратов интерлейкина-2 (ИЛ-2) и интерферона альфа (ИФА) позволяет достичь объективного ответа у 10%-20% больных (Motzer R.J., 1997).
Механизм противоопухолевого действия интерферонов не до конца известен, но считается, что он состоит в стимуляции фагоцитоза, который осуществляют макрофаги, активации Т-лимфоцитов и непосредственном цитотоксическом действии на опухолевую клетку. Применение рекомбинантного ИФН в режиме монотерапии при метастатическом РП оценивалось в исследованиях разных авторов (Savane P.D., 1995; Steineck G, 1990; Ritchie, 1998). Одной из попыток очередной оценки вклада цитостатиков в лечение генерализованного РП явилось, опубликованное в 2003 году исследование Wenzel C. с соавторами, в котором оценивалась эффективность капецитабина в монотерапии и в комбинации с иммунотерапией. К сожалению, режим комбинированной терапии не был единообразным для всех пациентов, что не позволяет провести адекватный анализ эффективности этого вида лечения.
Необходимость анализа факторов, определяющих течение процесса, и оценка эффективности используемых лечебных подходов в лечении резектабельных форм РМП, гормонально-рефрактерного РПЖ, а также метастатического РП обуславливают актуальность избранной темы исследования.
Цель исследования:
Разработка новых подходов к лечению резектабельных форм инвазивного РПМ с целью сохранения органа на основе факторов индивидуального прогноза, а также улучшение результатов лечения генерализованного гормоно-рефрактерного рака предстательной железы и рака почки путем разработки вариантов комплексной лекарственной терапии с использованием современных лекарственных средств.
Задачи исследования:
- Изучить непосредственную эффективность комбинации химиопрепаратов гемцитабин и цисплатин, гемцитабин и оксалиплатин у больных местно-распространенным РМП в качестве неоадъювантного воздействия.
- Оценить сроки возникновения рецидива заболевания у групп больных, получавших различные варианты комбинированного лечения, а также токсические реакции при проведении комбинированной химиотерапии препаратами гемцитабин и цисплатин/оксалиплатин. На основании полученных данных разработать показания к назначению неоадъювантной и адъювантной ПХТ.
- Разработать схемы лекарственной терапии на основе таксановых производных для лечения ГРРПЖ
- Оценить уровень объективного ответа и продолжительность жизни больных гормонально-рефрактерным раком предстательной железы, а также изучить токсические реакции при проведении различных вариантов химиотерапии.
- На собственном материале оценить эффективность комбинированной терапии с включением современного таблетированного туморактивируемого цитостатика капецитабина и иммунотерапии препаратами группы интерферонов у больных метастатическим раком почки, назначаемой в качестве 1 линии лечения.
- Изучить длительность периода до прогрессирования заболевания и продолжительность жизни больных, ответивших на лечение, а также оценить токсические реакции изучаемой лечебной схемы.
- Оценить прогностическую значимость опухолевых маркеров при онкоурологических заболеваниях в качестве раннего метода диагностики рецидива болезни в процессе динамического наблюдения, а также в процессе лекарственной терапии с целью своевременного прекращения лечения при его неэффективности.
Научная новизна
Новизна проведенного исследования состоит в том, что разработаны новые подходы к определению лечебной тактики больных инвазивным РМП путем комбинации хирургического и лекарственного методов лечения.
Впервые в отечественной онкологии комбинация гемцитабина и производных платины изучена у больных местно-распространенным РМП, подлежащих радикальному хирургическому лечению. Установлено, что при глубине инвазии опухоли Т2 и выше проведение комбинированного лечения в последовательности 2 курса ПХТ + операция + 3 курса ПХТ имеет преимущество перед последовательностью операция + 5 курсов ПХТ по показателям общей и безрецидивной выживаемости, а также времени до возникновения рецидива. Показано, что у больных с почечной патологией замена цисплатина на оксалиплатин в схеме лекарственной терапии при РМП не приводит к снижению клинического и морфологического эффекта.
Предложены варианты лекарственной терапии больных гормонально рефрактерным РПЖ на основе таксановых производных, применяемых в качестве 1 линии лечения. При сравнении непосредственной эффективности лечебных схем, токсических реакций, а также оценки продолжительности жизни больных установлено, что наиболее эффективными являются различные режимы доцетаксела. Показано, что благоприятный профиль токсичности регистрируется при еженедельном режиме введения доцетаксела. Зафиксировано, что при гормонально рефрактерном РПЖ увеличение уровня опухолевого маркера ПСА после 2 курса лечения по сравнению с исходным уровнем не является критерием прогрессирования заболевания. Однако при дальнейшем росте ПСА опухоль должна быть расценена как химиорезистентная.
Показано, что проведение химиоиммунотерапии интерфероном и капецитабином при генерализованном раке почки наиболее часто позволяет добиться частичной регрессии процесса, в особенности при изолированном поражении легких. При длительном сохранении достигнутого эффекта и ограниченном числе метастатических очагов целесообразно через год после завершения лекарственного лечения рассматривать вопрос о хирургическом удалении метастазов.
Практическая значимость
Проведенное исследование явилось объективным доказательством целесообразности осуществления комплексного подхода в лечении операбельного инвазивного РМП с использованием хирургического и лекарственного компонентов лечения как подхода, повышающего эффективность лечения местно-распространенного РМП, позволяющего увеличить длительность безрецидивного периода и продолжительность жизни больных. Разработка показаний для назначения неоадъювантной и адъювантной ПХТ в зависимости от факторов прогноза, позволяет оптимизировать объем адекватной для каждого пациента терапии и увеличить безрецидивную и общую выживаемость.
Разработка схем лекарственной терапии на основе таксановых производных на собственном материале позволила продемонстрировать улучшение результатов лечения гормонально-рефрактерного рака предстательной железы в сравнении с существующим современным стандартом с точки зрения объективного ответа и продолжительности жизни.
Оценка эффективности современной комбинации капецитабина и интерферона при генерализованном раке почки позволила на собственном материале оптимизировать 1 линию лечения данной категории больных, в связи с отсутствием в настоящее время общепринятых стандартов.
Положения, выносимые на защиту
- При РМП T2-3N0M0 комбинированное лечение в последовательности 2 курса ПХТ + операция + 3 курса ПХТ имеет преимущество перед последовательностью операция + 5 курсов ПХТ при общем равном количестве курсов лекарственной терапии.
- При ГРРПЖ в качестве 1 линии терапии различные режимы монотерапии доцетаксела эффективнее двухкомпонентных комбинаций и имеют более благоприятный профиль токсичности.
- При ГРРПЖ увеличение уровня ПСА после 2 курсов лечения по сравнению с исходным не является критерием прогрессирования заболевания.
- Достижение стойкой регрессии метастатических очагов на фоне химиоиммунотерапии при генерализованном РП определяет возможность применения комбинированного подхода с проведением хирургического этапа лечения.
Апробация работы
Результаты исследования доложены на VI Всероссийском съезде онкологов (Ростов-на-Дону, 2005), IX Российском онкологическом конгрессе (Москва, 2005), IV съезде онкологов и радиологов СНГ (Баку, 2006). Апробация диссертации состоялась 26.06.2008 на межотделенческой клинической конференции в МНИОИ им. П.А. Герцена.
Внедрение результатов исследования в практику
Полученные результаты исследования внедрены в клиническую работу МНИОИ им. П.А. Герцена. Научные положения и практические рекомендации, разработанные в диссертации, используются при проведении сертификационных циклов и курсов повышения квалификации на кафедре онкологии ФППО ММА им. И.М. Сеченова.
Публикации
По теме диссертации опубликовано 19 печатных работ, из них 9 статей в центральной медицинской печати, утверждено пособие для врачей и усовершенствованная медицинская технология.
Объем и структура диссертации
Материалы диссертации изложены на 262 страницах машинописного текста, иллюстрированы 52 таблицами и 4 рисунками. Диссертация состоит из введения, 3 глав, каждая из которых посвящена отдельной нозологии и содержит обзор литературы, собственные материалы и заключение. Кроме того, диссертация включает выводы, практические рекомендации, указатель литературы, содержащий 190 источников.
СОДЕРЖАНИЕ РАБОТЫ
Дизайн исследования
В диссертационной работе проанализированы 450 клинических наблюдений. Распределение больных по нозологиям представлено на рис. 1.
Рис.1.
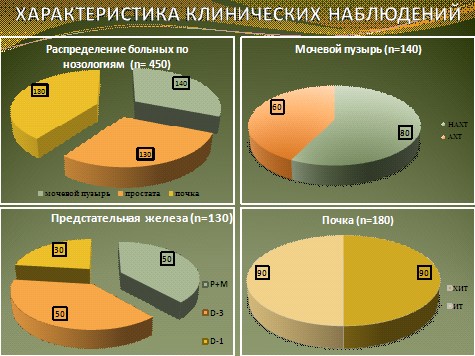
НАХТ – неоадъювантная химиотерапия; АХТ – адъювантная химиотерапия
Р+М – паклитаксел + митоксантрон; D-3- доцетаксел 1 раз в 3 недели; D-1- доцетаксел еженедельно
ХИТ – химиоиммунотерапия; ИТ - иммунотерапия
Больные РМП составили 140 человек, распределенных на группы в зависимости от варианта комбинированного лечения. Больные, страдающие ГРРПЖ, составили 130 человек, распределенных на 3 группы в зависимости от варианта химиотерапии. Больных генерализованным РП было 180 человек, распределенных на 2 группы в зависимости от варианта лекарственной терапии.
Результаты лечения РМП
Неоадъювантная химиотерапии (НАХТ)
В исследование эффективности неоадъювантной химиотерапии (НАХТ) инвазивного РМП с применением гемцитабина и производных платины с последующим выполнением чрезбрюшинной резекции мочевого пузыря с подвздошно-обтураторной лимфаденэктомией было включено 80 человек (табл.1). Возраст больных находился в интервале от 25 до 64 лет. У всех больных была II стадия процесса, но практически у 2/3 опухоль инфильтрировала глубокий мышечный слой (Т3а). Гистологическая структура опухоли во всех случаях была представлена переходно-клеточным раком.
Таблица №1. Характеристика больных, получавших НАХТ.
| Стадия (TNM) | Пол | Возраст | Предыдущее лечение | |||
| T2N0M0 | T3aN0M0 | Муж. | Жен. | 25-64 лет | ТУР | Не было |
| 28 (35%) | 52 (65%) | 78 (97,5%) | 2 (2,5%) | 27 (33,8%) | 53 (66,2%) | |
Семидесяти больным химиотерапия проведена в следующем режиме: гемцитабин 1250 мг/м2 1 и 8 дни, цисплатин 100 мг/2 в 1 день. Десяти больным химиотерапия назначалась по схеме: гемцитабин 1250 мг/м2 1 и 8 дни, оксалиплатин 130 мг/м2 в 1 день. Интервал между курсами составлял 3 недели. Всего проводилось 2 курса предоперационного лечения.
Необходимо отметить, что клинический и морфологический эффект не зависел от варианта платиновых производных, что позволило суммировать полученные результаты. После завершения 2 курсов НАХТ полная регрессия (ПР) опухоли наблюдалась у 11 больных, что составило 13,8%. Дополнительно у 28 (35%) больных отмечено уменьшение размеров опухоли более чем на 30%, что соответствовало частичной регрессии (ЧР). Таким образом, общий ответ на лечение зарегистрирован у 39 больных, что составило 48,8%. У 35 больных размеры опухоли уменьшились, но менее чем на 20%, что соответствовало стабилизации опухолевого процесса (рис. 2).
Рис.2.Эффективность неоадъювантной химиотерапии РМП.
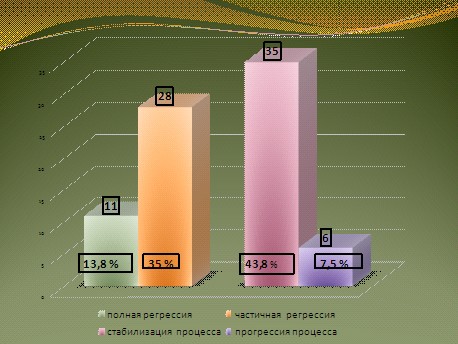
Анализируя степень достигнутого лекарственного патоморфоза, необходимо отметить несколько важных моментов. Во-первых, несмотря на то, что после завершения 2 курсов НАХТ у всех 11 больных с ПР по результатам объективного обследования, включая цистоскопию, наблюдалось полное исчезновение опухолевого очага, у 2 пациентов при морфологическом исследовании были обнаружены опухолевые клетки с III степенью повреждений. Этот факт является подтверждением положения о необходимости выполнения оперативного этапа лечения, при котором произойдет не только удаление оставшихся опухолевых клеток, но и удастся объективизировать результат проведенной ХТ. Во-вторых, у всех больных, у которых была зафиксирована стабилизация опухолевого процесса, что формально не относится к лечебному эффекту, отмечены морфологические повреждения опухолевых клеток. Это может свидетельствовать о том, что для этой категории больных проведения 2 курсов НАХТ оказалось недостаточно.
Адъювантная химиотерапия (АПХТ)
В исследовании эффективности АПХТ инвазивного РМП было включено 60 больных, перенесших в 1 этапе оперативное вмешательство в объеме чрезбрюшинной радикальной резекции с подвздошно-обтураторной лимфаденэктомией или радикальную цистэктомию с формированием мочевого резервуара. По данным предоперационного обследования у всех больных была диагностирована 2 стадия заболевания. Однако после морфологического исследования распределение больных по стадиям изменилось. Наибольшее число составили больные с поражением регионарных лимфатических узлов (рис. 3).
Рис. 3. Адъювантная химиотерапия РМП: характеристика больных
Гистологическая структура опухоли во всех случаях была представлена переходно-клеточным раком.
Всем больным химиотерапия проводилась в следующем режиме: гемцитабин 1250 мг/м2 1 и 8 дни, цисплатин 100 мг/м2 в 1 день. Интервал между курсами составлял 3 недели. Всего проводилось 5 курсов АПХТ.
Лечебный эффект оценивался по частоте и срокам возникновения рецидива или появления отдаленных метастазов. Из 60 пролеченных больных у 17 (28,3%) наблюдался рецидив заболевания, который возник в сроки от 9 месяцев до 3 лет (рис.4).
Рис.4. Результаты адъювантной химиотерапии РМП (n=60).
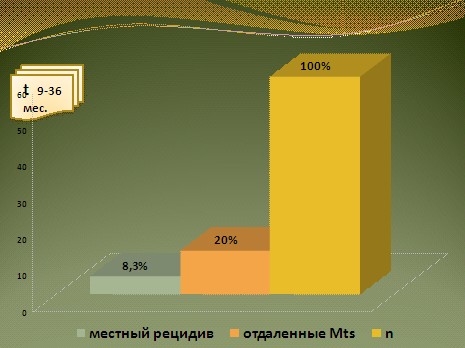
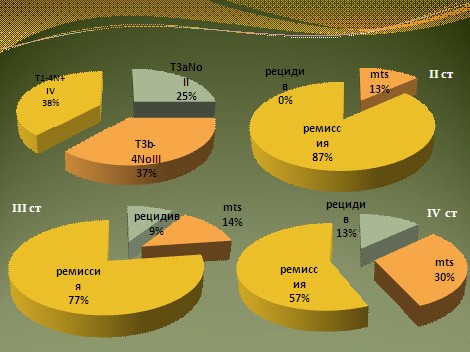
Наиболее часто рецидив регистрировался у больных с поражением лимфатических узлов (10 человек). Из 17 человек у 5 рецидивная опухоль локализовалась в полости малого таза, у 8 зарегистрировано метастатическое поражение парааортальных лимфатических узлов, у 4 человек наблюдалось появление гематогенных метастазов (в печени, легких, костях и мягких тканях передней брюшной стенки), рис. 5.
Рис. 5.Адъювантная химиотерапия РМП: результаты лечения
В последующие 2 года наблюдения дополнительно у 6 (10%) больных с поражением лимфатических узлов малого таза зарегистрировано появление отдаленных метастазов.
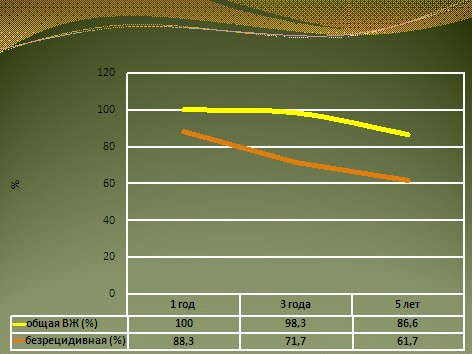
Для оценки отдаленных результатов лечения проведена оценка годичной, 3-летней и 5-летней безрецидивной и общей выживаемости. Все больные пережили 1 год. Таким образом, годичная общая выживаемость составила 100%. Рецидив заболевания за это время развился у 7 человек, то есть безрецидивная выживаемость за этот промежуток времени составила 88,3%. В течение 3 лет от прогрессирования процесса умер 1 больной. Таким образом, общая 3-летняя выживаемость составила 98,3%. Рецидив заболевания зарегистрирован у 17 больных, то есть 3-летняя безрецидивная выживаемость составила 71,7%. К 5 годам наблюдения живы 52 человека, что составило 86,6%, из них без признаков заболевания 37 человек (61,7%), рис. 6.
Рис. 6.Общая и безоецидивная выживаемость у больных РМП, получивших адъювантную химиотерапию.
Неоадъювантная химиотерапия и адъювантная химиотерапия
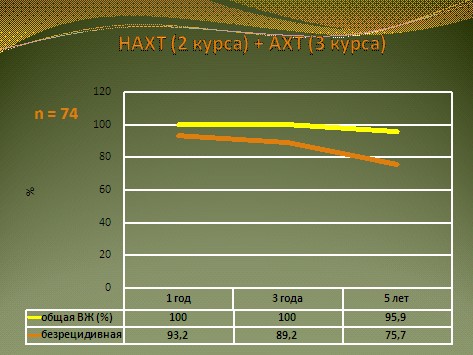
Отдельную группу составили 74 больных, у которых после проведения 2 курсов НАХТ была зарегистрирована ПР, ЧР или стабилизация процесса. Этим больным в послеоперационном периоде дополнительно проводилось 3 курса АПХТ по аналогичной схеме. При оценке отдаленных результатов лечения этой группы больных было отмечено, что все больные пережили 3 года. Из них без признаков возобновления заболевания в течение первого года – 93,2%, в течение 3 лет – 89,2%. Общая 5-летняя выживаемость составила 95,9%, а безрецидивная – 75,7% (рис. 7).
Рис. 7. Общая и безрецидивная выживаемость больных РМП, получивших неоадъювантную и адъювантную химиотерапию.
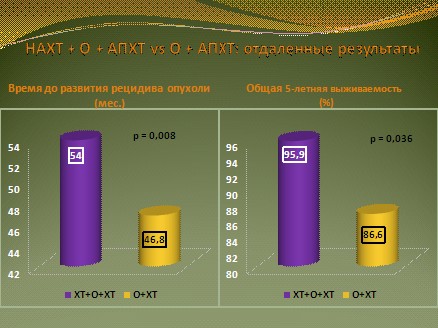
Для сравнения результатов лечения больных, получавших лекарственную терапию до и после хирургического вмешательства с больными, получавшими лишь послеоперационную химиотерапию, было произведено сравнение показателей времени до возникновения рецидива заболевания и 5-летней выживаемости. Различия в пользу комбинированного лечения с назначением предоперационного и послеоперационного системного воздействия по сравнению с одним послеоперационным оказались достоверны: время до возникновения рецидива в группе НАХТ + О + АПХТ составило 54 месяца, что было достверно выше 46,8 месяцев в группе О + АПХТ (р=0,008). Общая 5-летняя выживаемость также оказалась достоверно выше в группе с предоперационным воздействием 95,9% vs 86,6% (р=0,036), рис. 8.
Рис. 8.Сравнительные результаты.
Результаты лечения гормоно-рефрактерного рака предстательной железы (ГРРПЖ)
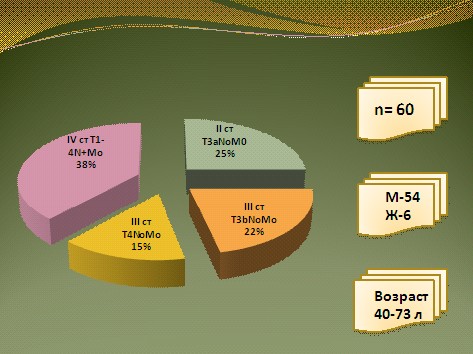
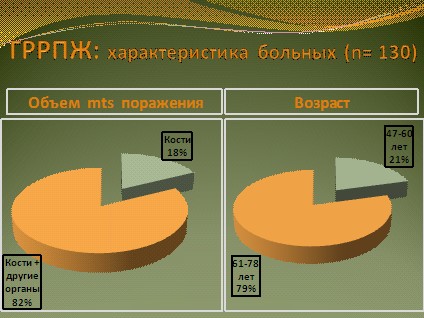
В исследование эффективности и токсичности химиотерапии на основе таксановых производных было включено 130 больных ГРРПЖ. У всех больных зарегистрирована метастатическая форма заболевания с тотальным поражением костей скелета, а также наличием метастазов в висцеральных органах, лимфатических узлах или рецидивной опухоли в ложе ранее удаленной предстательной железы. Лишь у 23 больных наблюдались изолированные костные метастазы. Возраст больных колебался от 47 до 78 лет, но подавляющее число составляли больные старше 60 лет (рис. 9).
Рис. 9.ГРРПЖ: характеристика больных.
Больные были разделены на 3 группы.
Первой группе больных (50 человек) химиотерапия (ХТ) проводилась 2-компонентной комбинацией: паклитаксел 135 мг/м2 в 1 день и митоксантрон 12 мг/м2 в 1 день. Проводилось 6 курсов лечения с интервалом 3 недели.
Вторая группа больных (50 человек) получала монотерапию доцетакселом в дозе 75 мг/м2. Всего проводилось 6 введений с интервалом 3 недели.
Отдельную группу составили больные (30 человек) старшей возрастной группы (старше 70 лет, ECOG>1), которым лечение проводилось доцетакселом в дозе 30 мг/м2 в еженедельном режиме в течение 5 недель с последующим 2-недельным перерывом. Лечебные курсы повторялись трижды.
Общая продолжительность лечения во всех группах составила 18 недель.
У больных с изолированным поражением костей снижение уровня ПСА>50% расценивалось как частичная регрессия (ЧР), что соответствует принятым международным стандартам.
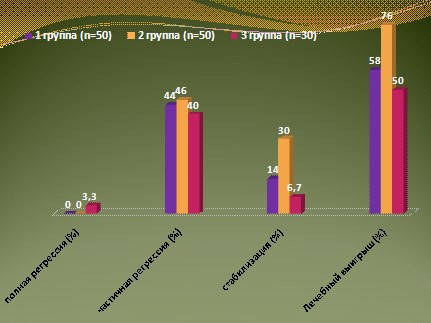
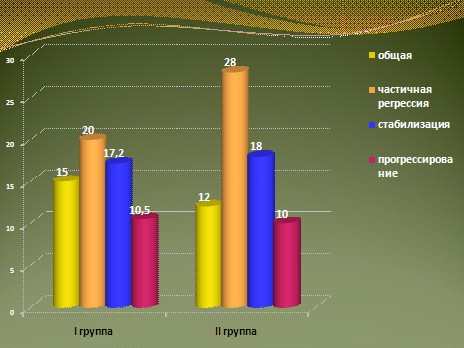
Объективный клинический ответ зарегистрирован в 1 группе у 7 из 32 больных, имевших кроме костных метастазов висцеральные очаги поражения. Дополнительно у 15 человек с изолированными метастазами в костях уровень ПСА снизился более чем на 50%. Таким образом, уровень объективного ответа составил 44%. Во 2 группе объективный ответ наблюдался у 13 из 50 больных (46%). У 13 из 30 больных 3 группы зарегистрирована положительная динамика процесса, в том числе 1 ПР (43,3%).
Анализируя полученные результаты, необходимо отметить, что наилучшими можно считать результаты лечения 2 группы больных. Лечебный выигрыш, включающий кроме ПР и ЧР стабилизацию опухолевого процесса, в этой группе составил 76%. В 1 группе, несмотря на незначительные отличия в показателях ЧР в сравнении со 2 группой, уровень лечебного выигрыша был значительно ниже – 58%. В 3 группе у больных старшей возрастной группы отягощенных серьезными сопутствующими заболеваниями объективный ответ (ПР + ЧР) составил 43,3%, а лечебный выигрыш 50% (рис. 10).
Рис. 9.ГРРПЖ: непосредственные результаты лечения.
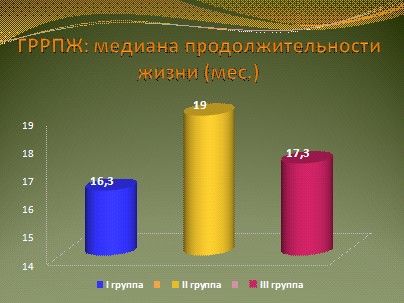
Наибольшая медиана продолжительности жизни была зарегистрирована у больных, получавших лечение доцетакселом в 3-недельном режиме (19 месяцев). Наименьшая медиана продолжительности жизни наблюдалась в группе комбинированной ХТ паклитакселом и митоксантроном (16,3 месяца), рис. 11. У больных этой группы наиболее часто отмечались обострения сердечно-сосудистых заболеваний, что, возможно, связано с применением митоксантрона, который обладает кардиотоксическим действием.
Рис. 11
Динамика опухолевого маркера ПСА
До начала и в процессе лечения всем больным проводилось измерение уровня ПСА в крови. Динамика маркера имела свои особенности, которые не зависели от варианта ХТ, что послужило поводом для изучения закономерностей изменения ПСА в зависимости от клинического эффекта проводимого лечения. Работа проведена совместно с лабораторией прогноза эффективности противоопухолевого лечения (руководитель проф. Н.С. Сергеева). Все больные в соответствии с лечебным эффектом были разделены на 2 группы: группа А, у которых был зарегистрирован эффект, и у которых ПСА по окончании лечения уменьшился в сравнении с исходным. Группа В, которая лечилась без эффекта, и в которой ПСА по окончании лечения возрос в сравнении с исходным уровнем. У всех больных группы А после 2 курса ХТ наблюдалось повышение ПСА. После 4 курса лечения у всех больных этой группы ПСА снижался. Дальнейшее снижение регистрировалось и после 6 курса лечения. Иная картина зафиксирована у больных группы В: у всех пациентов наблюдалось монотонное повышение уровня ПСА после 2, 4 и 6 курсов лечения (рис. 12).
Рис. 12. Динамика опухолевого маркера ПСА в зависимости от эффекта проводимой химиотерапии.
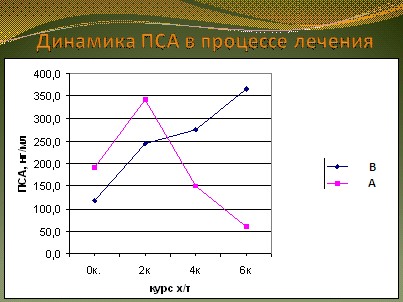
В соответствии с полученными данными оценку эффективности ХТ у больных ГРРПЖ можно с высокой достоверностью осуществлять по ПСА, сравнивая его уровни после 4 курса лечения с его уровнями после 2 курса ХТ. При этом рост ПСА косвенно свидетельствует о химиорезистентности, а его снижение – о химиочувствительности опухоли. Таким образом, установленные закономерности позволяют прогнозировать эффективность ХТ уже после 4 курса лечения.
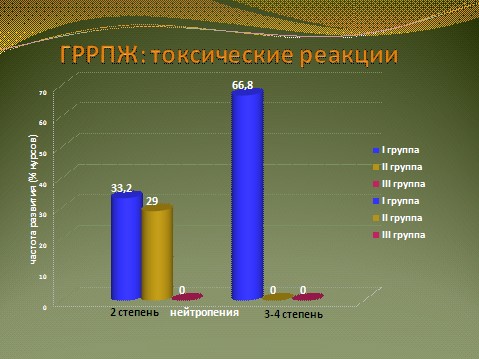
Выраженность гематологической токсичности существенно зависела от варианта проводимого лечения. Так, у больных 1 группы она в подавляющем большинстве случаев достигала 3-4 степеней. Нейтропения 3-4 степени развилась на 66,8% курсов, что требовало применения КСФ. Во 2 группе нейтропения не превышала 2 степени и регистрировалась на 29% курсов лечения. У больных 3 лечебной группы гематологическая токсичность была клинически незначимой и не превышала 1 степени (рис. 13.).
Рис. 13.Профиль токсичности различных режимов химиотерапии ГРРПЖ.
Результаты лечения больных генерализованным раком почки (РП).
В исследование эффективности комбинированной химиоиммунотерапии (ХИТ) на основе интерферона (ИФН) в сочетании с таблетированным цитостатиком капецитабином было включено 90 больных метастатическим РП. У большинства наблюдалось метастатическое поражение легких, но изолированное поражение легких регистрировалось лишь у 19 (21,1%) больных. Группой сравнения являлись 90 больных генерализованным РП, которым в качестве лекарственной терапии 1 линии проводилась иммунотерапия (ИТ) ИФН.
Больным исследуемой группы ХИТ назначалась в режиме:
ИФН 6 млн МЕ/м2 подкожно 3 раза в неделю в течение 3 недель и капецитабин 2,5 г/м2 в 8-12 и 15-19 дни. Интервал между курсами составлял 1 неделю. Лечение проводилось до прогрессирования заболевания.
Больным группы сравнения назначалась ИТ ИФН 9 млн МЕ/м2 подкожно 3 раза в неделю до прогрессирования заболевания.
Наиболее часто эффект ХИТ был представлен ЧР (16,7%). Подавляющее число больных, ответивших на лечение, имели поражение легких (рис. 14).
Рис. 14.Непосредственные результаты лечения больных генерализованным РП.
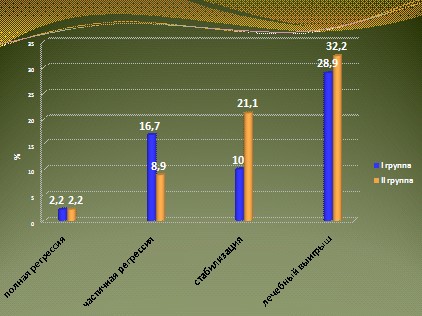
Если сравнивать эффективность двух изученных режимов, то в целом можно констатировать близкие результаты. Однако, несмотря на то, что лечебный эффект в обеих группах оказался очень похожим, даже с некоторым преимуществом лечебного выигрыша в группе ИТ (28,9% vs 32,2%), обращает на себя внимание разница в структуре полученного эффекта. Так, в исследуемой группе ХИТ практически в 2 раза чаще регистрировалась ЧР 16,7% vs 8,9%. Тогда как в группе ИТ в 2 раза чаще регистрировалась стабилизация процесса (21,1% vs 10%).
Медиана общей продолжительности жизни больных исследуемой группы составила 15 месяцев. Но этот показатель существенно варьировал в зависимости от достигнутого эффекта лечения. Так, у больных с частичной регрессией опухоли медиана продолжительности жизни превысила полтора года и составила 20 месяцев. В группе больных со стабилизацией процесса более полугода этот показатель был равен 17,2 месяцев, а у больных, не ответивших на лечение - 10,5 месяцев. Еще более показательна разница в показателях общей выживаемости была зарегистрирована в группе больных, получавших иммунотерапию. При достижении ЧР длительность составила 28 месяцев, при стабилизации опухолевого процесса более полугода - 18 месяцев, а у больных, лечившихся без эффекта, была равна 10 месяцам (рис. 15).
Рис. 15 РП: медиана продолжительности жизни больных в зависимости от эффекта проведенного лечения (мес.).
Таким образом, очевидно, что достигнутая стабилизация опухолевого процесса, в особенности при таких устойчивых к лекарственной терапии опухолях, как РП, должна рассматриваться как лечебный эффект.
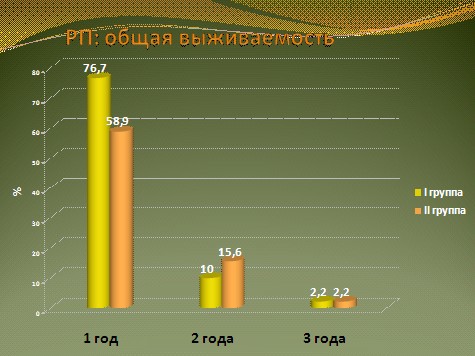
Показатели 1-летней, 2-летней и 3-летней выживаемости среди всех 90 больных группы комбинированной химиоиммунотерапии составили 76,7%, 10% и 2,2%, соответственно. В группе сравнения эти показатели были равны 58,9%, 15,6% и 2,2%, соответственно (рис. 16).
Рис. 16. Показатели выживаемости больных генерализованным РП в зависимости от вида лекарственной терапии.
Выводы
- Неоадъювантная химиотерапия резектабельных форм РМП с включением гемцитабина и производных платины позволяет добиться объективного ответа у 48,8% больных, дополнительно у 43,8% больных удается стабилизировать опухолевый рост. Это позволяет рекомендовать проведение НАХТ при планировании органо-сберегающих оперативных вмешательств.
- Даже при клинически полной резорбции опухоли в мочевом пузыре у 2,7% больных зарегистрирована лишь 3 степень лечебного патоморфоза, что подтверждает необходимость выполнения оперативного вмешательства как основного этапа лечения.
- При проведении адъювантной химиотерапии наибольшая частота рецидива заболевания зафиксирована в течение первых 3 лет (28,3%), тогда как в последующие 2 года этот показатель составил лишь 10%.
- При глубине инвазии опухоли Т2 и выше проведение комбинированного лечения в последовательности 2 курса ПХТ + операция + 3 курса ПХТ имеет достоверное преимущество перед последовательностью операция + 5 курсов ПХТ по показателям общей и безрецидивной выживаемости, а также времени до возникновения рецидива при общем равном количестве курсов лечения.
- У больных с почечной патологией замена цисплатина на оксалиплатин в схеме лекарственной терапии при РМП не приводит к снижению клинического и морфологического эффекта.
- При лечении генерализованного рака предстательной железы комбинированная химиотерапия паклитакселом и митоксантроном не улучшает результатов лечения по сравнению с монотерапией доцетакселом.
- Еженедельный режим введения доцетаксела является эффективным в сравнении с 3-недельным режимом по частоте общего ответа (40% и 46,7%) и медиане продолжительности жизни (17,3 мес. и 19 мес.). Наряду с этим еженедельные введения доцетаксела имеют наиболее благоприятный профиль токсичности. При общей равной курсовой дозе препарата (ОД 450 мг/м2) гематологическая токсичность еженедельного режима не превышает 1 степени.
- Выбор лечебного режима больных генерализованным РПЖ должен основываться на общем состоянии больного. При ECOG 0-1 целесообразно проводить лечение доцетакселом в 3-недельном режиме. При ослабленном состоянии больного (ECOG >1) старшей возрастной группы предпочтение необходимо отдать еженедельному введению доцетаксела.
- Увеличение уровня ПСА после 2 курса лечения по сравнению с исходным уровнем не является критерием прогрессирования заболевания. Если после 4 курса лечения регистрируется дальнейший рост ПСА по сравнению с показателями после 2 курса терапии, то опухоль должна быть расценена как химиорезистентная.
- Наиболее часто при химиоиммунотерапии генерализованного рака почки лечебный эффект представлен частичной регрессией (16,7%). При комбинации ИФА с капецитабином наибольший эффект регистрировался у больных с метастатическим поражением легких. Стабилизация опухолевого процесса получена у 10% больных, что должно рассматриваться как эффект лечения, в связи с низкой чувствительностью опухоли к лекарственной терапии.
- При проведении химиоиммунотерапии у больных генерализованным РП медиана продолжительности ЧР превысила 1 год (14 месяцев). При длительном сохранении достигнутого эффекта и ограниченном числе метастатических очагов целесообразно через год после завершения лекарственного лечения рассматривать вопрос о хирургическом удалении метастазов.
- При генерализованном РП медиана продолжительности жизни больных, ответивших на лечение, превысила 1,5 года (20 месяцев), что при умеренной токсичности комбинации ИФН и капецитабина, не превышавшей 1-2 степени, позволяет рекомендовать ее в качестве 1 линии лечения.
Практические рекомендации
- При инвазивном РМП выполнение оперативного вмешательства должно рассматриваться как обязательный этап комбинированного лечения.
- При достижении стабилизации опухолевого процесса после проведения 2 курсов НАХТ назначение дополнительных 2 курсов химиотерапии может привести к регистрации клинического эффекта лишь у каждого 5 больного. Учитывая это обстоятельство, этой категории больных проведение оперативного вмешательства показано после 2 курсов НАХТ.
- У больных инвазивным РМП динамическое наблюдение в течение 3 лет после завершения лечения должно проводиться каждые полгода.
- При глубине инвазии опухоли Т2 и выше рекомендуется проведение комбинированного лечения в последовательности 2 курса ПХТ + операция + 3 курса ПХТ.
- При проведении неоадъювантной ПХТ цисплатином + гемцитабином у больных РМП с почечной патологией возможна замена цисплатина на оксалиплатин без снижения эффективности лечения.
- Для достижения адекватного лечебного эффекта у больных генерализованным ГРРПЖ достаточно проведения 6, а не 10 лечебных курсов химиотерапии. В качестве 1 линии химиотерапии ГРРПЖ рекомендуется использование монотерапии доцетакселом в трех- или еженедельном режиме.
- Еженедельный режим введения доцетаксела рекомендован больным старшей возрастной группы при ослабленном общем состоянии (ECOG > 1), в связи с наиболее благоприятным профилем токсичности.
- При увеличении уровня ПСА после 4 курса лечения по сравнению с показателями после 2 курса терапии, рекомендуется пересмотр дальнейшей лечебной тактики.
- Низкий уровень гемоглобина в начале лечения больных ГРРПЖ может быть связан с метастатическим поражением костного мозга. Для более успешного проведения лечения целесообразно назначение эритропоэтинов одновременно с началом химиотерапии. Это позволяет сохранять адекватный уровень гемоглобина на протяжении всего времени лечения и избежать редукции доз химиопрепаратов.
- При достижении ЧР у больных генерализованным РП необходимо оценивать ее длительность. При продолжительности достигнутого эффекта в течение года и ограниченном числе метастатических очагов целесообразно рассматривать вопрос о хирургическом удалении метастазов.
Список работ, опубликованных по теме диссертации
- Лекарственное лечение рака мочевого пузыря. (соавт. И.Г. Русаков) // Российский онкологический журнал. – 2001, №4, стр. 56-59.
- Современные возможности лечения рака мочевого пузыря. // Вопросы онкологии. – 2002, №2, стр. 21-24.
- Гемцитабин в лечении распространенного рака мочевого пузыря. (соавт. В.И. Борисов) // Российский онкологический журнал. – 2002, №2, стр. 14-16.
- Роферон А в комбинации с кселодой у больных диссеминированным раком почки. (соавт. И.Г. Русаков, И.М. Шевчук) // Современная онкология. – 2005, №4, том 7, стр. 181-182.
- Химиотерапия гормоно-рефрактерных форм генерализованного рака предстательной железы. (соавт. Л.А. Королева, А.А. Пайчадзе) // Российский онкологический журнал. – 2006, №5, стр. 36-39.
- Неоадъювантная и адъювантная химиотерапия в комбинированном лечении инвазивного рака мочевого пузыря. (соавт. И.Г. Русаков) // Российский онкологический журнал. – 2007, №2, стр. 47-51.
- Комбинированный подход к лечению инвазивного рака мочевого пузыря. Собственный опыт – адъювантная химиотерапия. (соавт. И.Г. Русаков) // Российский онкологический журнал. – 2007, №
- Инвазивный рак мочевого пузыря – современные подходы к лечению. (Обзор литературы). (Соавт. И.Г. Русаков) // Российский онкологический журнал. – 2007,
- Возможности опухолевого маркера ПСА в оценке эффективности химиотерапии гормоно-рефрактерного рака предстательной железы. (соавт. Н.С. Сергеева, Н.В. Маршутина, Н.К. Парилова) // Российский онкологический журнал. – 2008, №
- Гемцитабин при местно-распространенном и/или метастатическом раке мочевого пузыря. (соавт. T. Scacel) // Современная онкология. – 2002, №2, стр. 43-49.
- Гемзар в лечении рака мочевого пузыря. (соавт. И.Г. Русаков) // Глава в монографии «Гемцитабин в клинической практике». Под редакцией М.Б. Бычкова. - Москва, 2002.
- Лечение больных инвазивным раком мочевого пузыря. (соавт. И.Г. Русаков, А.А. Теплов) // Пособие для врачей. – Москва, 2003.
- Зомета в комбинированном лечении метастатического поражения костей. (соавт. Л.А. Королева, В.В. Тепляков, В.Ю. Карпенко) // Современная онкология. – 2003, №3.
- Вариант комбинированного лечения инвазивного рака мочевого пузыря с использованием неоадъювантной химиотерапии. // Усовершенствованная медицинская технология. – Регистрационное удостоверение №ФС-2006/070, Москва, 2006.
- Результаты лечения инвазивного рака мочевого пузыря препаратом гемцитабин. //Материалы конференции молодых ученых госпиталя им. Бурденко.- Москва, 2000 г.
- Предварительные результаты химиоиммунотерапии интерфероном альфа и кселодой при генерализованном раке почки. (соавт. Л.А. Королева, А.А. Трофимова) // Материалы научно-практической конференции «Современные возможности и новые направления в диагностике и лечении рака почек, мочевого пузыря и предстательной железы». – Уфа, 2001, стр. 113.
- Химиотерапия рака мочевого пузыря. // Материалы III ежегодной встречи молодых исследователей, 2001, США, Индианаполис
- Иммунотерапия генерализованного рака почки. (соавт. И.Г. Русаков, И.М. Ахмедова) // Материалы I Всероссийской научно-практической конференции «Биотерапия рака». – Москва, 2002, стр. 91-93.
- Непосредственные результаты неоадъювантной химиотерапии инвазивного рака мочевого пузыря гемцитабином и цисплатином. (соавт. Л.А. Королева) // Материалы медико-фармацевтического форума «Аптека-2002». – Москва, 2002, стр. 144-145.
- Оценка токсичности препарата Паклитаксел-ЛЭНС у больных распространенными формами злокачественных новообразований. (соавт. Л.В. Крамская, Л.А. Королева, А.А. Пайчадзе) // Материалы медико-фармацевтического форума «Аптека-2003». – Москва, 2003, стр. 98-99.
- Иммунохимиотерапия больных генерализованным раком почки. (соавт. И.М. Ахмедова, И.Г. Русаков) // Материалы медико-фармацевтического форума «Аптека-2003». – Москва, 2003, стр. 102-103.
- Опыт применения нового бисфосфоната в паллиативном лечении костных метастазов рака предстательной железы и рака молочной железы. (соавт. А.А. Пайчадзе, И.Г. Русаков) // Материалы медико-фармацевтического форума «Аптека-2003». – Москва, 2003, стр. 114-115.
- Непосредственные результаты первой линии химиотерапии гормоно-рефрактерного рака предстательной железы. (соавт. Л.А. Королева, А.А. Пайчадзе) // Материалы научно-практической конференции «Онкологическая урология – от научных исследований к клинической практике (Современные возможности диагностики и лечения опухолей предстательной железы, почки, мочевого пузыря). – Москва, 2004.

