Особенности метаболизма и рецепции эстрогенов при гиперпластических процессах и раке эндометрия
На правах рукописи
БОЧКАРЕВА НАТАЛЬЯ ВАЛЕРЬЕВНА
ОСОБЕННОСТИ МЕТАБОЛИЗМА И РЕЦЕПЦИИ ЭСТРОГЕНОВ ПРИ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССАХ И РАКЕ ЭНДОМЕТРИЯ
14.00.14 – онкология
14.00.16 – патологическая физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Томск – 2007
Работа выполнена в ГУ НИИ онкологии Томского научного центра СО РАМН
Научные консультанты:
доктор медицинских наук,
профессор Коломиец Лариса Александровна
доктор медицинских наук Кондакова Ирина Викторовна
Официальные оппоненты:
доктор медицинских наук Тузиков Сергей Александрович
доктор медицинских наук,
профессор Серебров Владимир Юрьевич
доктор биологических наук,
профессор Гуляева Людмила Федоровна
Ведущая организация: ФГУ Российский Онкологический Научный Центр им. Н.Н. Блохина, г. Москва.
Защита состоится ______________ 2007 г. в ____ часов на заседании диссертационного совета Д.001.032.01 при НИИ онкологии Томского научного центра СО РАМН (634009, Россия, г.Томск, пер. Кооперативный, 5).
С диссертацией можно ознакомиться в библиотеке ГУ НИИ онкологии Томского научного центра СО РАМН.
Автореферат разослан ______________________ 2007г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, Фролова И.Г.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Изучение различных аспектов патогенеза предрака и рака эндометрия (РЭ) является одной из актуальных задач онкогинекологии и обусловлено, прежде всего, неуклонным ростом заболеваемости этой патологии. В России за последние 20 лет заболеваемость РЭ увеличилась в 2 раза и составляет 12,6 случая на 100 тыс. населения [Чиссов В.И., 2002]. За последнее десятилетие в России заболеваемость гиперпластическими процессами эндометрия в репродуктивном и постменопаузальном возрасте не имеет тенденции к снижению, а в перименопаузе – значительно увеличилась [Савельева Г.М. с соавт., 1998, Чернуха Г.Е., 1999, Каппушева Л.М. с соавт., 2005,].
Проблема патогенеза гиперпластических процессов и РЭ в течение многих лет ассоциируется с развитием «эстрогенной теории» [Берштейн Л.М., 2000, Gulyaeva L.F. еt al., 2006]. Однако постоянно появляются новые данные, касающиеся вопросов синтеза эстрогенов, их транспорта, метаболизма и рецепции, заставляют считать, что данная проблема еще далека от своего разрешения. Особую актуальность представляют комплексные исследования по изучению роли рецепции и метаболизма эстрогенов в патогенезе гиперпластических процессов и РЭ, а также определению клинического и прогностического значения показателей, связанных с рецепцией и метаболизмом эстрогенов.
Многочисленные исследования показали, что эстрогены в большинстве случаев необходимы для возникновения гиперпластических процессов эндометрия, а также для инициации и поддержания роста злокачественных опухолей эндометрия [Гилязутдинова З.Ш., 1998, Берштейн Л.М., 2000, Вихляева Е.М., 2000, Савицкий Г.А. с соавт., 2000,Бохман Я.В., 2002, Bamberger A.M. et al., 1999]. По отношению к гиперпластическим процессам и РЭ в литературе обсуждается в основном пролиферативный эффект эстрогенов [Вихляева Е.М., 2000, Артымук Н.В. c соавт., 2004, Emos G. et al., 2000]. Вместе с тем доказан прямой генотоксический эффект метаболитов эстрогенов [Jan S.T. et al., 1998, Chakravarti D. et al., 2001, Cavalieri E.L. et al., 2002].
Особенности овариального и экстрагонадного метаболизма и рецепции женских половых гормонов в тканях-мишенях (эндометрий, миометрий) при участии ферментов метаболизма эстрогенов (ароматазы, стероидсульфатазы, эстрогенгидроксилаз, катехол-О-метилтрансферазы (КОМТ) и глутатион-S-трансферазы (ГТ)), как предполагается, определяют возможность реализации в эндометрии как промоторного, так и генотоксического вариантов гормонального канцерогенеза. Поэтому, является актуальным изучение эстрогенного профиля сыворотки крови и уровня локальной продукции половых стероидов у больных с гиперпластическим процессами и РЭ, а также их анализ во взаимосвязи с активностью ферментов метаболизма эстрогенов.
В настоящее время канцерогенез рассматривается как многоступечатый процесс накопления различных генетических повреждений, приводящих к нарушениям регуляции клеточного цикла, апоптоза, утрате способности к полной дифференцировке, инвазивному росту и метастазированию, тесно связанных с неоангиогенезом [Лихтенштейн А.В., 1998, Фильченков А.А., 1998, Белушкина Н.Н. с соавт., 2001, Лушников Е.Ф., 2001, Копнин Б.П., 2002, Lundenberg A.S. et al., 1999]. Поэтому особую актуальность представляют исследования, посвященные изучению активности ферментов метаболизма эстрогенов во взаимосвязи с экспрессией белков - регуляторов клеточного цикла, апоптоза и неоангиогененеза в малигнизированном эндометрии для понимания их роли в патогенезе РЭ.
Значительный интерес вызывают исследования, в которых оценивается влияние ингибиторов ароматазы на опухолевый рост. В исследованиях in vitro выявлен антипролиферативный эффект ингибиторов ароматазы в отношении злокачественных опухолей эндометрия и яичников [Yamamoto T., 1990, Sasano H. et al., 1999]. Клинические исследования по использованию ингибиторов ароматазы в комплексном лечении больных РЭ единичны, что не позволяет сделать корректные выводы об их эффективности [Rose P.G. et al., 2000, Mo B.Y. et al., 2004, Berstein L. M. et al., 2005]. Однако являются перспективными дальнейшие клинические исследования по изучению эффективности современных ингибиторов ароматазы в лечении РЭ с учетом данных по активности этого фермента в тканях опухолей.
Вторичная профилактика РЭ является актуальным направлением в снижении заболеваемости и смертности от РЭ. Перспективным направлением в решении этой проблемы является объективное формирование групп повышенного онкологического риска, прежде всего, среди больных с различными гиперпластическими процессами эндометрия [Чернуха Г.Е., 1999, Бохман Я.В., 2002, Чернышова А.Л., 2002, Артымук Н.В. с соавт., 2004, Ашрафян Л.А. с соавт., 2004, Берштейн Л.М., 2004, Маликова Л.В., 2005,]. Гиперпластические процессы и РЭ в репродуктивном возрасте традиционно ассоциируются с нарушением овуляции, хронической гиперэстрогенемией, бесплодием, миомой матки, генитальным эндометриозом, часто с гиперандрогенемией в сочетании с ожирением и гиперинсулинемией. [Берштейн Л.М., 2000, 2004, Бахидзе Е.В. с соавт., 2002, Бохман Я.В. 2002, Чулкова О.В., 2003]. Вопросы патогенеза гиперпластических процессов и РЭ в перименопаузе менее изучены. В постменопаузе развитие патологии эндометрия часто связано с усилением экстрагонадного синтеза эстрогенов в периферических тканях и тканях-мишенях [Берштейн Л.М., 2004]. Предполагаемая роль ферментов метаболизма эстрогенов в развитии гиперпластических процессов и РЭ в репродуктивном и перименопаузальном периоде до настоящего времени не определена, хотя в ряде исследований подчеркивается значимость состояния менструальной функции для интерпретации данных по активности этих ферментов, а также данных по образованию основных гидроксилированных эстрогенных метаболитов [Xu X. et al., 1999, Tworoger S. et al., 2004].
Недостаточно изученной остается роль половых гормонов, их рецепторов и ферментов метаболизма эстрогенов в прогнозе РЭ. Традиционно в качестве прогностических факторов при РЭ используют клинические и морфологические критерии [Бокина Л.И., 1998, Баринов В.В., 1999, Захарцева Л.М. c соавт., 2001, Козаченко В.П., 2005, Brit J.M. et al., 2005]. Однако многообразие форм и патогенетических вариантов РЭ заставляет искать новые биохимические и молекулярно-генетические факторы прогноза. Высока прогностическая значимость наличия в опухолях PR [Самсонова Е.А. с соавт., 2004, Fukuda K., 1998]. Среди молекулярно-генетических маркеров обсуждается прогностическая значимость Bax, Bcl-2, p53, Ki67 и маркеров неоангиогенеза [Chieng D.C. et al., 1996, Giatromanolaki A. et al., 2001, Piero G. et al., 2001, Veral A. et al., 2002, Osmanagaoglu M.A. et al., 2005]. Данные о прогностической значимости ферментов метаболизма эстрогенов немногочисленны. Есть сведения о том, что экспрессия ароматазы в стромальных, но не эпителиальных клетках аденокарцином эндометрия позитивно коррелировала с запущенностью и плохим прогнозом [Segawa T.et al., 2005].
Высокая встречаемость гиперпластических процессов и РЭ в сочетании с миомой матки диктует необходимость изучения патогенетических особенностей этой сочетанной патологии [Вихляева Е.М., 2000, Гаврилов А.С. c соавт., 2002, Мамедбекова Р.Б., 2003, Studzinski Z. et al., 2000, Koshiyama M. et al., 2001]. В настоящее время не изучены уровень половых гормонов, рецепторов к ним, а также активность ферментов метаболизма эстрогенов в гиперплазированном и малигнизированном эндометрии и миоматозных узлах у больных с гиперплазией и РЭ в сочетании с миомой матки, а онкологические аспекты проблемы не акцентированы. Сведения об уровне половых гормонах у данной категории больных немногочисленны и требуют детализации с учетом менопаузального статуса и морфологического состояния эндометрия [Савицкий Г.А. с соавт. 2000].
Все вышесказанное определяет актуальность исследования, которое позволило выявить участие рецепторов эстрогенов и прогестерона и ферментов метаболизма эстрогенов в патогенезе пролиферативных процессов эндометрия, оценке онкологического риска у больных с гиперпластическими процессами и и прогнозе течения РЭ.
Цель и задачи исследования.
Целью настоящей работы явилось комплексное изучение роли рецепции и метаболизма эстрогенов в патогенезе гиперпластических процессов и РЭ, а также определение клинического и прогностического значения изучаемых показателей.
Для достижения цели были поставлены следующие задачи:
- Оценить особенности гормонального фона, рецепции эстрогенов и прогестерона, а также уровень локальной продукции половых стероидов у больных с гиперпластическими процессами и РЭ.
- Изучить активность ферментов метаболизма эстрогенов во взаимосвязи с клинико-морфологическими, гормональными параметрами и уровнем рецепторов стероидных гормонов у больных исследованных групп.
- Оценить активность ферментов метаболизма эстрогенов во взаимосвязи с экспрессией про- и антиапоптотических белков и неоангиогенезом в опухолях эндометрия.
- Изучить прогностическую значимость гормональных параметров, рецепторов стероидных гормонов и ферментов метаболизма эстрогенов у больных РЭ.
- Разработать патогенетическое обоснование использования ингибиторов ароматазы в комплексном лечении резектабельных форм РЭ.
- Изучить особенности гормонального статуса и метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ в различные возрастные периоды.
- Создать математическую модель для оценки риска развития РЭ у больных с гиперпластическими процессами эндометрия с учетом возрастного периода и факторов, ассоциированных с рецепцией и метаболизмом эстрогенов.
- Изучить особенности рецепции и метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ в сочетании с миомой и без миомы матки.
- Разработать новую схему метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ в сочетании с миомой матки.
Научная новизна
Впервые проведено комплексное исследование рецепции и метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ. Исследован уровень рецепторов стероидных гормонов и активность ферментов метаболизма эстрогенов в эндометрии во взаимосвязи с уровнем половых гормонов в системном и локальном маточном кровотоке. Выявлено что, активность ароматазы в гиперплазированном эндометрии коррелировала с уровнем РR, уровнем эстрадиола и глобулина, связывающего половые стероиды (SHBG) в сыворотке крови, а активность ГТ - с SHBG. Активность стероидсульфатазы в опухолях эндометрия коррелировала с уровнем ER и эстрона в локальном маточном кровотоке, с уровнем эстрона и эстрадиола в сыворотке крови, активность КОМТ – с уровнем прогестерона в локальном маточном кровотоке, активность ГТ с уровнем прогестерона и SHBG в сыворотке крови.
Впервые с помощью наиболее прогностически значимых клинических показателей, гормональных параметров, данных по рецепторному статусу и активности ферментов метаболизма эстрогенов разработана математическая модель в виде формулы для прогноза онкологического риска у больных с гиперпластическими процессами эндометрия в различные возрастные периоды.
Получены новые данные о наличии взаимосвязи между экспрессий антиапоптотического белка Bcl-2, неоангиогенезом и активностью стероид сульфатазы в опухолях эндометрия. Вне зависимости от наличия или отсутствия мутантного р53 в Bcl-2-позитивных опухолях в 72,2% выявлялась высокоразвитая сеть кровеносных сосудов, а в Bcl-2-негативных опухолях в 75% - низкая плотность сосудов. В Bcl-2-позитивных опухолях активность стероидсульфатазы была значимо выше по сравнению с Bcl-2-негативными опухолями. В опухолях со слабым кровоснабжением активность стероидсульфатазы была статистически ниже по сравнению с опухолями с умеренным и высоким кровоснабжением.
Впервые выявлено, что активность ароматазы и КОМТ в ткани рака эндометрия являются прогностически значимыми факторами для больных РЭ. Высокая активность ферментов связана с низкой безрецидивной выживаемостью.
Впервые показано, что больные с гиперпластическими процессами и РЭ в сочетании с миомой матки имеют особенности в метаболизме эстрогенов. У больных с гиперпластическими процессами и РЭ с миомой матки доминирует ароматаза-зависимый путь синтеза эстрогенов в сочетании с высокой активностью ГТ в эндометрии, а у больных без миомы матки – стероидсульфатаза-зависимый путь в сочетании с низкой активностью ГТ. Впервые представлена схема, характеризующая пути образования и основные эффекты эстрогенов и их гидроксилированных метаболитов у больных с гиперпластическими процессами и РЭ в сочетании с миомой матки.
Теоретическая и практическая значимость.
Полученные результаты исследования позволяют расширить теоретические представления о роли рецепции и метаболизма эстрогенов при гиперпластических процессах и РЭ.
Выявлены особенности метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ в различные возрастные периоды. Одним из значимых аспектов в патогенезе РЭ в репродуктивном возрасте и перименопаузе является повышение активности КОМТ и суммарной эстрогенгидроксилазной активности в малигнизированном эндометрии по сравнению с нормальной тканью. Выраженная гипопрогестеронемия и сниженный уровень SHBG являются значимыми в развитии РЭ у больных в перименопаузе. У больных в постменопаузе в патогенезе РЭ играет значение повышение интенсивности как ароматаза-зависимого, так и стероидсульфатаза-зависимого пути локального синтеза эстрогенов.
Полученные результаты формируют новые представления о механизмах синтеза и метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ в сочетании с миомой матки с выявлением 4 основных источников синтеза эстрогенов (жировая ткань, миометрий, миоматозные узлы, эндометрий).
Разработанная математическая модель позволяет формировать группы повышенного онкологического риска среди больных с гиперпластическими процессами эндометрия в различные возрастные периоды. Чувствительность разработанной модели в различные возрастные периоды составляет от 80 до 92%, специфичность – от 83 до 90%.
С учетом выявленных новых объективных гормонально-биохимических прогностических факторов возможно разработка индивидуального прогноза для больных РЭ и выбора индивидуальной тактики лечения.
Патогенетически обоснован и апробирован новый комплексный метод лечения резектабельных форм РЭ с включением в схему адьювантной гормонотерапии ингибитора ароматазы анастразола. Сформулированы показания к применению разработанного метода лечения. Оценка его эффективности показала достоверное повышение двухлетней безрецидивной выживаемости по сравнению с контрольной группой при сохранении высокого уровня качества жизни.
Положения, выносимые на защиту
- При гиперпластических процессах эндометрия активация синтеза эстрогенов в эндометрии не сопровождается повышением их биотрансформации и не связана с уровнем половых стероидов в локальном маточном кровотоке. В злокачественных опухолях эндометрия усиленный синтез эстрогенов за счет повышения активности ароматазы сопровождается повышением активности ферментов II фазы биотрансформации – КОМТ и ГТ, и зависит от уровня половых стероидов в локальном маточном кровотоке
- Активность ферментов метаболизма эстрогенов в опухолях эндометрия зависит от стадии опухолевого процесса и гистологического типа. Уровень эстрадиола, активность внутриопухолевой ароматазы и КОМТ являются прогностически значимыми факторами в отношении двухлетней безрецидивной выживаемости при РЭ.
- Использование прогностически наиболее значимых клинико-анамнестических показателей, гормональных параметров, данных по рецепторному статусу и активности ферментов метаболизма эстрогенов дает возможность определить риск развития РЭ у больных с гиперпластическими процессами эндометрия в различные возрастные периоды.
- У больных с гиперпластическими процессами и РЭ в сочетании с миомой матки наблюдается активация ароматаза-зависимого пути синтеза эстрогенов в эндометрии, миометрии и миоматозных узлах, которая сопровождается повышением активности ГТ. У больных без миомы матки усиление синтеза эстрогенов просходит, главным образом, за счет активации стероидсульфатаза-зависимого пути синтеза эстрогенов и сопровождается снижением активности ГТ в эндометрии.
Апробация работы
Основные результаты работы доложены на всероссийской научно-практической конференции «Рак репродуктивных органов: профилактика, диагностика, лечение», Томск, 2002; на всероссийской научно-практической конференции с международным участием «Актуальные вопросы онкоурологии и онкогинекологии», Барнаул, 2002; на всероссийской конференции «Новые диагностические и лечебные технологии в онкологии», Томск 2003; на всероссийской конференции «Актуальные проблемы лабораторной медицины», Томск 2003; на X национальном Конгрессе «Человек и лекарство», Москва, 2003; на V Международном конгрессе молодых ученых «Науки о человеке», Томск 2004; на III Съезде онкологов СНГ, Минск, 2004; на всероссийской научно-практической конференции «Современное состояние и перспективы развития экспериментальной и клинической онкологии», Томск, 2004; на региональной научно-практической конференции «Актуальные вопросы онкогинекологии», Кемерово, 2004; на научно-практической конференции «Экстрагенитальная патология и репродуктивное здоровье женщин», Томск, 2004; 14th international meeeting of the ESGO, Istanbul, 2005; на международном симпозиуме “Молекулярные механизмы регуляции функции клетки”, Тюмень, 2005; на 9-ой Российской научно-практической конференции «Актуальные вопросы акушерства и гинекологии», Ленинск-Кузнецкий, 2005; International meeting “Endocrine treatmeant, prevention of breast and gynaecological cancers”, Brussels, 2006, на 10-ой Российской научно-практической конференции «Актуальные вопросы акушерства и гинекологии», Ленинск-Кузнецкий, 2006.
Публикации
Основные результаты диссертации опубликованы в 37 печатных работах, в том числе 13 статей в отечественных реферируемых журналах, 10 из которых - в рекомендованных ВАК изданиях. Материалы исследования использованы при написании монографии «Клинико-морфо-биохимические аспекты гиперпластических процессов и рака эндометрия» (Коломиец Л.А., Чернышова А.Л., Крицкая Н.Г., Бочкарева Н.В, 2003).
Внедрение результатов исследования
Результаты исследования используются в учебном процессе для студентов и клинических ординаторов при изучении вопросов, посвященных патогенетическим аспектам и терапии гиперпластических процессов и РЭ, на кафедре акушерства и гинекологии ФУС СГМУ, а также внедрены в работу онкогинекологического отделения НИИ онкологии ТНЦ СО РАМН и ГУ НИИ акушерства, гинекологии и перинаталогии ТНЦ СО РАМН для объективизации формирования групп повышенного онкологического риска по РЭ и уточнения прогноза у больных РЭ. Получено положительное решение о выдаче патента РФ на изобретение «Способ комплексного лечения резектабельных форм рака эндометрия» N2005130582 от 03.10. 2005.
Структура и объем диссертации
Диссертация состоит из введения, 3 глав, заключения, выводов, практических рекомендаций и списка цитируемой литературы. Работа изложена на 251 странице и иллюстрирована 18 рисунками и 26 таблицами. Библиография включает 293 литературных источника, из которых 122 отечественных и 171 иностранный.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Было проведено комплексное обследование 301 женщины, обратившейся на консультативный прием и находившихся на стационарном лечении в гинекологическом отделении ГУ НИИ онкологии ТНЦ СО РАМН и гинекологической клинике ГУ Родильного дома N4 г.Томска. В соответствии с Международной классификацией гинекологов-патологов морфологического состояния эндометрия, основанного на структурных и цитологических изменениях (ВОЗ, 1994) и Международной классификацией РЭ FIGO (ВОЗ, 1992) и TNM (ВОЗ, 1998) было сформировано 3 клинические группы.
I группа – больные РЭ с I-III стадией заболевания (138 человек), средний возраст 55,9±1,08 лет. В данной группе были выделены 2 подгруппы.
Первую подгруппу составили 74 больных РЭ, у которых изучались особенности метаболизма и рецепции эстрогенов (55 больных этой подгруппы в зависимости от стадии заболевания получили хирургическое или комбинированное лечение, включающее хирургический этап и послеоперационную дистанционную гамма терапию на область малого таза и зону регионарного лимфооттока (СОД 44-46 Гр), а 19 больных РЭ с IB-III стадией заболевания получили комплексное лечение с адьювантной гормонотерапией ингибитором ароматазы анастразолом в дозе 1 мг в день в течение 6 месяцев после проведения хирургического и лучевого этапов лечения). Вторую подгруппу составили 64 больных РЭ с IB-III стадией заболевания, получивших стандартное комбинированное лечение. Данная подгруппа была сформирована для изучения эффективности разработанного метода комплексного лечения РЭ с адьювантной гормонотерапией ингибитором ароматазы.
II группа – 110 больных с гиперпластическими процессами эндометрия, средний возраст 47,9±0,66 лет.
III группа – контрольная, куда вошли 59 пациенток, в том числе 18 больных с атрофией эндометрия без атипии и 41 пациентка без патологии эндометрия, средний возраст 50,0±1,20 лет.
В соответствии с определением ВОЗ (1990г.), дополненным Международным обществом по изучению менопаузы (1999г.), в каждой из групп были выделены подгруппы больных репродуктивного, перименопаузального и постменопаузального периодов [Utian W.H. et al., 1999]. Для количественной оценки степени ожирения рассчитывали индекс массы тела (ИМТ) исходя из росто-весовых показателей [Вейн А.М., 2000]. Данные о дате оперативного вмешательства, сроках появлении рецидивов, метастазов или смерти от злокачественного новообразования получены из историй болезни, амбулаторных карт и данных канцеррегистра Томской области.
Кровь для оценки концентрации половых стероидов в локальном маточном кровотоке забирали во время оперативного вмешательства из маточной вены в области восходящей ветви маточной артерии после мобилизации связочного аппарата матки и сосудистых пучков [Савицкий Г.А. с соавт., 2000]. В сыворотке крови, взятой из локтевой вены и в сыворотке крови из локального маточного кровотока определяли уровень половых стероидных гормонов (эстрона, эстрадиола, прогестерона) и SHBG с использованием наборов для радиоиммунного и радиометрического анализа фирм “Immunotech” (Чехия), “DSL” (США) и “Orion” (Финляндия). Рассчитывали индекс свободных эстрогенов (ИСЭ) [Сметник В.П. с соавт., 1998].
Иммуногистохимическое исследование проводили пероксидазно-антипероксидазным методом по традиционной методике. Использовали антитела фирм “Dako” (рецепторы эстрогенов (ER) и прогестерона (PR), “Новокастра” (Bcl-2, CD31, p53) и “BD Biosciences-Pharmingen” (Bax). Рецептор-положительными считали опухоли, в которых выявлялось более 5-10% четко окрашенных ядер. При постановке иммуногистохимической реакции с антителами к Bcl-2 и Bax цитоплазматическое и мембранное окрашивание 20% и более опухолевых клеток принимали за положительную реакцию [Лукашина М.И. с соавт., 2002]. Опухоли считали положительными по экспрессии мутантного р53 при окрашивании более 25% ядер опухолевых клеток [Veral A. et al., 2002]. Оценка неоангиогенеза в опухолях проводилась путем подсчета количества микрососудов, окрашенных антителами CD31. Количество сосудов в опухоли менее 10 принимали за низкую плотность микрососудов, 10 и более - относили к умеренной и высокой плотности сосудов в опухоли.
Активность ферментов метаболизма эстрогенов определяли в образцах нормального или патологически измененного эндометрия, миометрия и фрагментах миомы матки, которые забирали во время операций и хранили в жидком азоте до исследования. Активность ароматазы оценивалась по образованию тяжелой воды из меченного тритием в 1-положении андростендиона в описанной ранее модификации [Ларионов А.А., 1997]. Cчет радиоактивности производили на тритиевом канале жидкостного сцинтилляционного счетчика MICROBETA (Perkin Elmer, США). Активность стероидсульфатазы оценивали радиометрическим методом [Barth A. et al., 2000], активность КОМТ - радиометрическим методом по Zurcher G. et all.(1982) [Zurcher G. et al., 1982], cуммарную активность эстроген 2/4- гидроксилаз - радиоферментативным методом [Theron C.N., 1986]. Активность ГТ определяли по образованию хромогенных коньюгатов глутатиона с 1-хлоро-2,4-динитробензолом (ХДНБ), региструемых спектрофотометрически [Ланкин В.З. с соавт., 1981].
Для определения уровня ER и PR образцы эндометрия и фрагменты миомы матки гомогенизировали в жидком азоте до порошкообразного состояния. Порошок экстрагировали 6-8-кратным объемом 10 mM Tris-HCl буфера с 1,5 mM ЭДТА и 0,5 mM дитиотрейтола, содержащего 10% глицерина (рН=7,4). Гомогенат центрифугировали 30 минут при 105000g и 40С. Цитозоль использовали для определения ER и PR радиолигандным методом [Бассалык Л.С. с соавт., 1987]. Белок в пробах определяли по методу Lowry.
Статистическая обработка результатов выполнена с использованием пакета прикладных программ STATISTICA 6.0. Все результаты представлены в виде M±m, где M – среднее выборочное, m – ошибка среднего. После проверки характера распределения исследуемых выборок значимость различий между группами определяли с помощью критериев Стюдента, Манна-Уитни и Фишера. Различия считались значимыми при p<0,05. Рассчитывался коэффициент ранговой корреляции Спирмена (r). При построении математической модели для оценки риска развития РЭ у больных с гиперпластическими процессами эндометрия в различные возрастные периоды был применен метод мультиноминальной логистической регрессии (SPSS 11.5). На основании выбранной оптимальной совокупности признаков с уровнем значимости p<0,05 была определена регрессионная функция для оценки риска развития РЭ у больных с гиперпластическими процессами. Оценка эффективности комплексного лечения больных РЭ с адьювантной гормонотерапией ингибиторами ароматазы, включая двухлетнюю общую и безрецидивную выживаемость, проводилась с использованием метода Каплана-Майера. Достоверность различий оценена по лонк-ранговому критерию. Прогностическая значимость признаков в отношении общей и безрецидивной выживаемости у больных РЭ оценена с использованием программы Survival Analysis, STATISTICA 6.0. Кривые кумулятивной выживаемости строились по методу Каплана-Майера. Значимость различий в выживаемости между группами оценена по критерию Гехана-Вилкоксона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Особенности гормонального статуса и уровень половых стероидов в локальном кровотоке у больных с гиперпластическими процессами и РЭ: взаимосвязь с рецепцией половых стероидов в эндометрии.
При изучении гормонального статуса выявлено, что у больных с гиперпластическими процессами эндометрия уровень общего эстрадиола в локальном кровотоке был в 3 раза ниже по сравнению с его уровнем в системном кровотоке, 0,14±0,07 и 0,53±0,06 нмоль/л, соответственно, (p<0,05). Кроме того, аналогичная менее выраженная зависимость выявлена и для эстрона. Выявленный факт может свидетельствовать о повышенном локальном потреблении эстрогенов из кровотока гиперплазированным эндометрием. У больных РЭ уровень эстрона в локальном кровотоке был несколько выше, чем в системном, а в контрольной группе уровень этого гормона в системном и локальном кровотоке был одинаков. Такие особенности в эстрогенном гомеостазе при РЭ могут быть связаны с внутритканевым синтезом эстрогенов в тканях РЭ при участии ароматазы и стероидсульфатазы.
У больных РЭ уровень эстрона в локальном кровотоке был статистически значимо выше по сравнению с больными с гиперпластическими процессами эндометрия. Кроме того, ИСЭ у больных РЭ в локальном маточном кровотоке был более чем в 2 раза выше по сравнению с больными с гиперпластическими процессами эндометрия и в контрольной группе, 2,05±0,65, 0,84±0,20 и 0,72±0,15, соответственно, (p<0,05). Минимальный уровень SHBG выявлен в локальном маточном кровотоке у больных РЭ. В тоже время в системном кровотоке у больных с гиперпластическими процессами и РЭ не выявлено каких-либо различий в уровне половых гормонов и SHBG по сравнению с пациентками контрольной группы.
Полученные результаты по гормональному статусу у больных РЭ в значительной степени согласуются с основными положениями эстрогенной теории гормонального канцерогенеза [Берштейн Л.М., 2000, Бохман Я.В., 2002, Emos G. et all., 2002]. Так, у больных РЭ выявлена гиперэстрогенемия в локальном маточном кровотоке. Полученные результаты не подтверждают значение системной гиперэстрогенемии в развитии гиперпластических процессов эндометрия. Литературные данные также свидетельствуют о том, что в патогенезе гиперпластических процессов эндометрия в значительной степени играет не столько избыточная пролиферация ткани-мишени под действием эстрогенов, сколько определенный дисбаланс в соотношении проапоптотических и антиапоптотических факторов, мозаичность распределения рецепторов стероидных гормонов в железах и строме гиперплазированного эндометрия, наличие эндокринной и паракринной регуляции пролиферативных процессов в эндометрии [Сметник В.П. с соавт., 1999, Сухих Г.Т. с соавт., 2002, 2005, Лысенко О.Н. с соавт., 2004].
При анализе взаимосвязей уровня половых гормонов с их рецепцией в эндометрии было выявлено, что у больных с гиперпластическими процессами эндометрия уровень ER ассоциировлся с количество беременностей и абортов в анамнезе, а также с концентрацией SHBG в сыворотке. Количество PR у этих больных коррелировало с концентрацией общего эстрадиола в сыворотке крови и с его свободной фракцией (ИСЭ). В опухолях эндометрия, как и при гиперпластических процессах эндометрия, выявлена корреляция между уровнем сывороточного эстрадиола и уровнем PR, а уровень ER был связан с концентрацией прогестерона и SHBG в сыворотке крови. Полученные данные свидетельствуют о сходной регуляции количества PR в гиперплазированном и малигнизированном эндометрии.
Взаимосвязь активности ферментов метаболизма эстрогенов с клинико-морфологическими параметрами, гормональным статусом и рецепторами стероидных гормонов у больных с гиперпластическими процессами и РЭ.
При анализе активности ферментов метаболизма эстрогенов во взаимосвязи с клиническими и морфологическими параметрами выявлено, что активность ароматазы в эндометрии у больных с гиперпластическими процессами и РЭ была достоверно выше по сравнению с пациентками контрольной группы (табл. 1). Полученные результаты свидетельствуют об определенных особенностях метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ. У больных c гиперпластическими процессами эндометрия интенсификация синтеза эстрогенов не влекла за собой повышение активности ферментов биотрансформации эстрогенов, а у больных
РЭ усиленный синтез эстрогенов в эндометрии сопровождался повышением активности ферментов II фазы биотрансформации.
Таблица 1.
Активность ферментов метаболизма эстрогенов в тканях гиперплазированного эндометрия и РЭ (M±m).
| Ферменты | Группы | ||
| ГПЭ | РЭ | Контроль | |
| Ароматаза, фмоль андростендиона/мг белка в час Стероидсульфатаза, фмоль эстрон сульфата/мг белка в час 2/4-эстрогенгидроксилазная активность, пмоль метоксиэстрогенов/мг белка в час КОМТ, нмоль гваякола/мг белка в час ГТ, мкмоль ХДНБ-SH/мг белка в час | 21,8±2,60* 50,7±17,0 42,9±13,7 131±22,0 168±22,8*** | 19,5±2,23* 64,4±12,5 55,2±10,0 379±82,0** 289±44,4 | 8,21±1,90 36,9±8,70 22,9±8,20 127±31,1 185±48,0 |
Примечание: ГПЭ – гиперпластические процессы эндометрия, * - достоверность различий по сравнению с контролем, p<0,05; **- достоверность различий по сравнению c контролем и гиперплазированным эндометрием, p<0,05, *** - достоверность различий по сравнению с тканями РЭ (p<0,05).
Изучена активность ферментов метаболизма эстрогенов в эндометрии во взаимосвязи с ожирением, сахарным диабетом или нарушением толерантности к глюкозе, наличием доброкачественных опухолей и кистозных образований яичников, наличием артериальной гипертонии, патологии щитовидной железы, хронической венозной недостаточности вен нижних конечностей или малого иаза, показателями менструальной и репродуктивной функции. У больных с гиперпластическими процессами эндометрия корреляционные взаимосвязи изучаемых параметров не выявлены. У больных РЭ проведенный однофакторный дисперсионный анализ показал, что наличие избыточной массы тела достоверно влиял на активность ГТ в опухоли (F=6,75, p=0,048), наличие доброкачественных опухолей и кистозных образований яичников - на суммарную активность эстроген 2/4-гидроксилаз (F=5,31, p=0,028) и активность ГТ (F=6,75, p=0,012), а сопутствующая артериальная гипертония - на активность ГТ (F=4,150, p=0,048). Полученные результаты, с одной стороны, подтверждают данные литературы об отсутствии зависимости между активностью ароматазы и показателями, отражающими состояние репродуктивной функции, ИМТ и экстрагенитальной патологии у больных РЭ [Берштейн Л.М. с соавт., 2003], с другой стороны - являются принципиально новыми, поскольку активность эстроген гидроксилаз и ГТ во взаимосвязи с данными клиническими параметрами у больных РЭ ранее не исследовалась.
При анализе активности ферментов метаболизма эстрогенов в злокачественных опухолях во взаимосвязи со стадией заболевания выявлено, что для большинства ферментов характерна нелинейная зависимость данных показателей. Исключение составила только ГТ, активность которой непрерывно нарастала при увеличении стадии заболевания (табл.2).
Таблица 2.
Взаимосвязь стадии опухолевого процесса с активностью ферментов метаболизма эстрогенов в опухоли (M±m).
| Ферменты | Стадия | |||
| Ca in situ | I | II | III | |
| Ароматаза, фмоль андростендиона/мг белка в час Стероидсульфатаза, фмоль эстрон сульфата/мг белка в час 2/4-эстрогенгидроксилазная активность, пмоль метоксиэстрогенов/мг белка в час КОМТ, нмоль гваякола/мг белка в час ГТ, мкмоль ХДНБ-SH/мг белка в час | 22,0±4,40 24,1±7,87 18,9±7,12 181±56,5 233±92,0 | 14,9±2,35 78,1±27,0 67,6±15,6 495±157 200±33,5 | 26,5±6,20* 83,1±18,3** 58,1±20,3 295±62,3 344±92,7 | 17,7±5,01 28,2±12,3 22,6±9,96 273±37,0 632±270*** |
Примечание: * - значимость различий по сравнению с I стадией, ** - значимость различий по сравнению с ‘Ca in situ’, p<0,05, *** - значимость различий по сравнению с ‘Ca in situ’ и I стадией, p<0,05.
При Ca in situ активность всех ферментов, за исключением ароматазы, была невысока. Максимальная активность ферментов, за исключением ГТ, выявлялась в опухолях эндометрия при I-II стадии опухолевого процесса. При III стадии заболевания активность практически всех ферментов снижалась, за исключением ГТ, активность которой достигала максимума и коррелировала с глубиной инвазии опухоли в миометрий (r=-0,305, p<0,05). Вероятно, метаболизм эстрогенов играет важную роль на ранних стадиях, когда формируется новообразование с присущими ему биологическими характеристиками. Исключение составляет ГТ, активность которой имеет важное значение на всех стадиях опухолевого роста, в том числе и в формировании инвазивного фенотипа.
Выявлена зависимость между активностью эстрогенгидроксилаз, КОМТ и гистологическим типом опухолей. В неэндометриоидных опухолях суммарная активность эстроген 2/4-гидроксилаз и КОМТ оказалась значительно выше, чем в эндометриоидных карциномах. В неэндометриоидных опухолях интенсивность гидроксилирования эстрогенов увеличена практически в 3 раза. Более чем в 2 раза повышена активность КОМТ. Хотя морфологические, некоторые молекулярно-генетические аспекты и клинические варианты течения неэндометриоидных опухолей эндометрия достаточно изучены, их биохимические особенности практически не исследованы [Горделадзе А.С. с соавт., 2002, Ульрих Е.А., 2004, Veral A. et al., 2002, Zehavi S. et al., 2003, Creasman W.T. et al., 2004]. В представленной работе показано, что эти опухоли характеризуются значительной интенсификацией процессов образования катехолэстрогенов и их метилирования.
Проведен анализ активности ферментов метаболизма эстрогенов в неизмененном, гиперплазированном и малигнизированном эндометрии во взаимосвязи с уровнем половых стероидов, SHBG и ИСЭ в системном и локальном маточном кровотоке. В нормальном и атрофичном эндометрии активность стероид сульфатазы коррелировала с уровнем общего эстрадиола и его свободной фракцией в сыворотке крови, а активность ГТ - с уровнем SHBG. При гиперпластических процессах эндометрия выявлены корреляционные взаимосвязи между активностью ароматазы и уровнем эстрадиола и SHBG в сыворотке крови. У больных РЭ активность стероидсульфатазы и КОМТ коррелировала с уровнем половых стероидов в локальном маточном кровотоке. Так, активность стероидсульфатазы коррелировала с уровнем эстрона (r=-0,595, p<0,05), а активность КОМТ – с уровнем прогестерона (r=-0,786, p<0,05). Кроме того, активность внутриопухолевой стероидсульфатазы коррелировала с уровнем эстрона и эстрадиола в сыворотке крови, а активность ГТ зависела от уровня прогестерона и SHBG в сыворотке крови. У больных РЭ выявлена корреляционная зависимость между активностью стероидсульфатазы и ER в опухолевой ткани (r=0,369, p=0,048), а у больных с гиперпластическими процессами эндометрия активность ароматазы коррелировала с уровнем PR (r=-0,433, p<0,05). Полученные результаты по гормональной регуляции активности ферментов метаболизма эстрогенов в нормальном и патологически измененном эндометрии в основном созвучны данным литературы [Киселев В.И. с соавт., 2005, Kennedy J. et al., 1991, Kojiama T. et al., 1994, Zhu B.T. et al., 1998, Bao H. et al., 2002, Reed M.J. et al., 2005]. Данные о наличии взаимосвязей между активностью внутриопухолевой стероид сульфатазы и уровнем общего эстрадиола в сыворотке крови, уровнем эстрона в системном и локальном маточном кровотоке, а также уровнем ER являются новыми.
При анализе корреляций между активностью ферментов метаболизма эстрогенов и клинико-морфологическими параметрами выявлено, что активность ГТ в эндометрии в контрольной группе коррелировала с наличием артериальной гипертонии, а у больных РЭ - с целым рядом параметров: c наличием ожирения, доброкачественных опухолей и кистозных образований яичников, артериальной гипертонии. Выявлена зависимость между активностью ГТ и стадией заболевания, а также глубиной инвазии опухоли в миометрий. При анализе гормональных параметров выявлено, что активность ГТ во всех клинических группах коррелировала с уровнем SHBG в сыворотке крови, а у больных РЭ и с уровнем прогестерона. Полученные данные свидетельствуют о весьма многообразной и сложной регуляции активности ГТ в эндометрии в норме и пролиферативных процессах эндометрия. Вероятно, этот фермент регулирует разнообразные физиологические функции, в том числе, метаболизм эстрогенов [Paraga A. et al., 1998, Zhu B.T. et al., 1998, Davanesan P. et al., 2001].
Взаимосвязь между активностью ферментов метаболизма эстрогенов, апоптозом и неоангиогенезом в опухолях эндометрия.
Для изучения взаимосвязи активности ферментов метаболизма эстрогенов с апоптозом и неоангиогенезом в опухолях эндометрия была исследована экспрессия белков, регулирующих индукцию апоптоза в клетках (Bax, Bcl-2, р53), ER и PR, а также плотность микрососудов. При изучении иммуногистохимических характеристик опухолей эндометрия выявлена четкая тенденция к различной встречаемости маркера эндотелиальных клеток CD31 в Bcl-2-позитивных и Bcl-2-негативных опухолях эндометрия. В Bcl-2-позитивных опухолях в 72,2% выявлялась высокоразвитая сеть кровеносных сосудов, в то время как в Bcl-2-негативных опухолях эндометрия в 75% - низкая плотность сосудов. При изучении активности ферментов метаболизма эстрогенов в опухолях эндометрия было выявлено, что в Bcl-2-позитивных опухолях активность стероидсульфатазы была значимо выше по сравнению с Bcl-2-негативными опухолями (табл. 3). При анализе экспрессии изучаемых маркеров в опухолях эндометрия с различной интенсивностью ангиогенеза выявлено, что в опухолях с низким уровнем ангиогенеза Bcl-2 экспрессировался несколько реже, чем в опухолях с умеренным и высоким уровнем ангиогенеза. В опухолях эндометрия со слабым кровоснабжением активность стероидсульфатазы была статистически значимо ниже по сравнению с опухолями с умеренным и высоким уровнем ангиогенеза (56,3±13,3 и 107±19,0 фмоль эстрон сульфата/мг белка в час, соответственно, p=0,048). В опухолях эндометрия активность стероидсульфатазы коррелировала с экспрессией ER (r=0,464, p=0,049).
В литературе практически отсутствуют данные об активности ферментов метаболизма эстрогенов в опухолях эндометрия с различной интенсивностью ангиогенеза.
Таблица 3.
Активность ферментов метаболизма эстрогенов в Bcl-2-позитивных и Bcl-2-негативных опухолях эндометрия (M±m).
| Ферменты | Bcl-2-позитивные опухоли (n=19) | Bcl-2-негативные опухоли (n=12) | P |
| Ароматаза, фмоль андростендиона/мг белка в час Стероидсульфатаза, фмоль эстрон сульфата/мг белка в час 2/4-эстрогенгидроксилазная активность, пмоль метоксиэстрогенов/мг белка в час КОМТ, нмоль гваякола/мг белка в час ГТ, мкмоль ХДНБ--SH/мг белка в минуту | 22,0±4,0 103±29,5 59,0±17,1 664±192 371±130 | 20,1±8,4 47,0±10,1 60,1±18,1 370±68,5 311±90,0 | 0,645 0,047 0,765 0,248 0,566 |
Примечание: P - уровень значимости различий по критерию Манна -Уитни.
Хотя известно, что эстроген-индуцированная экспрессия фактора роста эндотелия сосудов (VEGF) и эндометриальной тимидинфосфорилазы выявляется с высокой частотой в высокодифференцированных опухолях эндометрия, а эстрогены в эндометрии индуцируют синтез специфического рецептора VEGF [Киселев В.И. с соавт., 2005, Saad R.S. et al., 2003, Fujimoto J. et al., 2005]. По данным наших исследований в злокачественных новообразованиях эндометрия существует четкая взаимосвязь между экспрессией антиапоптотического белка Bcl-2, неоангиогенезом, экспрессией ER и PR и активностью стероидсульфатазы.
На основании полученных результатов можно предположить несколько вариантов регуляции эстрогенами апоптоза и неоангиогенеза в опухолях эндометрия (рис.1).

Рис. 1. Предполагаемая схема регуляции апоптоза и неоангиогенеза эстрогенами в опухолях эндометрия.
Высокая активность стероидсульфатазы способствует накоплению эстрона в опухоли. Эстрон, аналогично эстрадиолу, по-видимому, через ER повышает уровень экспрессии Bcl-2 и рецептора к VEGF [Lai D., 1999]. При наличии неповрежденного р53 и ER в опухолях эндометрия возможно взаимодействие AF-домена активированного ER с С-терминальным регуляторным доменом белка р53. Формирование комплекса приводит к утрате транскрипции р53-зависимых генов, к числу котоых относят: гены, участвующие в р53- зависимом апоптозе, гены, кодирующие ингибиторы ангиогенеза, р53-зависимые гены, активация которых способствует подавлению клеточного цикла (р21) [Копнин Б.П., 2000, Liu W. et al., 2006]. При отсутствии ER в опухолях возможно прямое влияние эстрогенов на ряд факторов, ассоциированных с апоптозом и пролиферацией в опухолях (степень фосфорилирования белкового продукта гена PTEN, активация PI3K-PK/Akt сигнального пути) [Guzeloglu Kayisli O. et al., 2003].
Прогностическая значимость показателей гормонального статуса, рецепторов стероидных гормонов и ферментов метаболизма эстрогенов у больных РЭ.
Изучена прогностическая значимость показателей гормонального статуса, рецепторов стероидных гормонов и ферментов метаболизма эстрогенов в отношении двухлетней общей и безрецидивной выживаемости у больных РЭ. Больные наблюдались в сроки от 4 до 56 месяцев после оперативного этапа комбинированного лечения, средний срок наблюдения составил 31,5±1,93 месяца. Срок возникновения локальных рецидивов РЭ составил от 5 до 24 месяцев.
Анализ полученных данных выявил, что параметры, ассоциированные с половыми гормонами, их рецепторами и ферментами метаболизма эстрогенов, не являлись факторами прогноза в отношении двухлетней общей выживаемости. В то время как значимыми факторами двухлетней безрецидивной выживаемости явились стадия заболевания, глубина инвазии опухоли в миометрий, ИМТ, уровень эстрадиола в сыворотке крови, активность ароматазы и КОМТ в опухолях. Высокий дооперационный уровень эстрадиола в сыворотке крови у больных РЭ является положительным прогностическим признаком, обуславливающим высокую двухлетнюю безрецидивную выживаемость. Возможно, что лучшие показатели выживаемости у пациенток с более высоким уровнем эстрадиола отражают принадлежность этой группы больных к I патогенетическому варианту РЭ, имеющему лучшие показатели выживаемости по сравнению с II патогенетическим вариантом РЭ [Бохман Я.В., 2000, Koshiyama M., 1998].
Высокие активности ароматазы и КОМТ в опухолях РЭ ассоциировались с низкой двухлетней безрецидивной выживаемостью. Двухлетняя безрецидивная выживаемость в группе больных с активностью ароматазы 20 фмоль составила 71,0%, а группе с активностью ароматазы менее 20 фмоль – 97,1% (p<0,05). Двухлетняя безрецидивная выживаемость в группе больных с активностью КОМТ 300 нмоль составила 67,2%, а группе с активностью КОМТ менее 300 нмоль - 95,3% (p<0,05) (рис. 2). Обобщая полученные результаты, можно сказать, что факторами высокого риска рецидива РЭ в первые 2 года после комплексного лечения наряду с традиционными клиническими параметрами (стадия заболевания, глубина инвазии опухоли в миометрий, локализация опухоли в полости матки, степень дифференцировки опухоли) являются: уровень эстрадиола в сыворотке крови
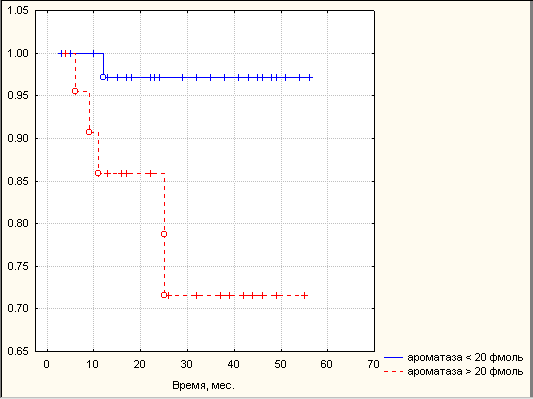
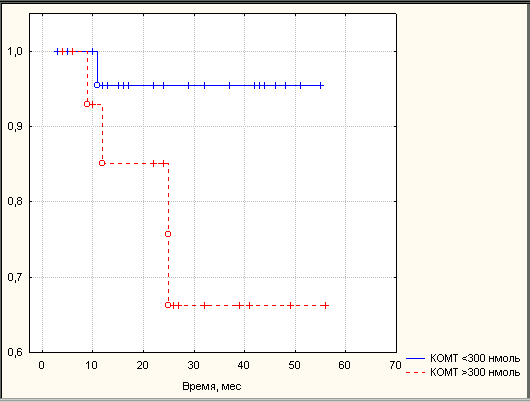
Рис. 2. Безрецидивная выживаемость больных РЭ в зависимости от активности ферментов метаболизма эстрогенов в опухоли. Примечание: А – в зависимости от активности ароматазы, сплошная линия – ароматаза менее 20 фмоль, пунктирная линия – ароматаза 20 фмоль; Б – в зависимости от активности КОМТ, сплошная линия – КОМТ менее 300 нмоль, пунктирная линия – КОМТ 300 нмоль. По оси абсцисс – время после оперативного этапа комбинированного лечения (мес.), по оси ординат – кумулятивная выживаемость, рассчитанная по методу Каплан-Мейера.
менее 0,46 нмоль/л, активность ароматазы в опухоли более 20 фмоль андростендиона/мг белка в час и КОМТ - выше 300 нмоль гваякола/мг белка в час.
Патогенетическое обоснование и результаты комплексной терапии РЭ с использованием ингибиторов ароматазы.
Известно, что эстрогены стимулируют рост и метастазирование опухолей эндометрия. Ароматаза выявляется в 64-100% опухолей эндометрия [Берштейн Л.М. с соавт., 2003, Bulun et al., 1994], что, по-видимому, обуславливает высокий локальный синтез эстрогенов. Ингибиторы ароматазы оказывают значительный антипролиферативный эффект в отношении некоторых клеточных линий РЭ, что обусловлено не только подавлением активности ароматазы, но и индукцией апоптоза [Sasano H. et al., 2001]. На основании этих наблюдений можно сделать предположение о целесообразности назначения ингибиторов ароматазы больным РЭ.
Анализ данных мета-анализа многоцентровых рандомизированных исследований показал неэффективность адьювантной гормонотерапии прогестинами в комплексном лечении больных в плане повышения безрецидивной и общей выживаемости [Урманчеева А.Ф., 2004, Martin-Hirsch E. et al., 2001]. У больных РЭ частота рецидивов после традиционных методов лечения достигает 30-34% при I-II стадиях заболевания и 41% при III стадии [Крикунова Л.И., 2004, Козаченко В.П., 2005, Ayahan A. et al., 2002, J-C. Horiot et al., 2004]. В связи с этим, актуальным является разработка новых подходов к лечению этой патологии. На основании полученных данных о наличии группы больных РЭ с высокой активностью ароматазы в опухоли был обоснован и апробирован новый способ лечения резектабельных форм РЭ.
Метод включал хирургический этап в стандартном объеме оперативного лечения при РЭ, анализ активности ароматазы в удаленном опухолевом материале радиометрическим методом, дистанционную гамма терапию на область малого таза и зону регионарного лимфооттока в стандартном режиме фракционирования и адъювантную гормонотерапию ингибитором ароматазы анастрозолом в дозе 1 мг в день в непрерывном режиме в течение 6 месяцев после окончания хирургического и лучевого этапов лечения. Адъювантная гормонотерапия анастрозолом назначалась больным, у которых активность ароматазы в опухоли была 7 фмоль андростедиона /мг белка в час и более, независимо от рецепторного статуса. Рецепторный фенотип рака ER+/PR+ выявлен у 42% больных, ER-/PR- у 15,7%, ER+/PR- у 31,5%, рецепторный фенотип не определялся у 4 больных (21%). Включение в исследование больных РЭ с рецепторотрицательными опухолями обусловлено тем, что противоопухолевый эффект ингибиторов ароматазы может опосредоваться через активацию апоптоза, возможно, без изменения уровней рецепторов эстрогенов и их связывающей способности [Sasano H., 1999].
Клиническая апробация предлагаемого способа лечения проведена у 19 больных РЭ с IB-III стадией заболевания, средний возраст составил 57,0±2,2 года. Переносимость 6-ти месячного курса адъювантной терапии анатрозолом была удовлетворительной. Не отмечено неблагоприятного влияния препарата на показатели общего анализа крови и свертывающей системы крови. Основными побочными эффектами при терапии анастразолом были приливы легкой степени тяжести, которые наблюдались в 32% и не требовали дополнительной коррегирующей терапии. Оценка 2-летней безрецидивной выживаемости по методу Каплана-Майера у больных, пролеченных предлагаемым способом, составила 89,8±3,7%, в контрольной группе (64 больных РЭ IB-III стадии, получивших стандартное комбинированное лечение) - 69,8±1,68% (p<0,05). Оценка общей 2-летней общей выживаемости у больных, пролеченных предлагаемым способом, составила 100,0±3,7%, в контрольной группе – 86,1±1,76% (p>0,05). Таким образом, при данном способе лечения больных РЭ значительно снижается уровень местных рецидивов заболевания в первые 2 года жизни после проведенного лечения при сохранении высокого уровня качества жизни, вследствие минимального количества осложнений гормонотерапии.
Особенности гормонального статуса и метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ в различные возрастные периоды.
При изучении особенностей гормонального статуса, рецепции и метаболизма эстрогенов в различные возрастные периоды выявлено, что в репродуктивном периоде уровень сывороточного эстрона был значительно снижен у больных РЭ по сравнению с пациентками аналогичного возраста с гиперпластическими процессами эндометрия и в контроле. Выявлено достоверное снижение уровня SHBG у больных РЭ в перименопаузе по сравнению с пациентками аналогичного возраста с гиперплазией эндометрия, 45,3±7,7 нмоль/л и 74,4±10,6 нмоль/л, соответственно (p<0,05). Подобные ассоциации ранее были выявлены только для больных РЭ в постменопаузе [Brody S. et al., 1993, Potischman N. et al., 1996, Sherman M.E. et al., 1997]. Следует отметить низкий уровень прогестерона в сыворотке крови у больных РЭ в перименопаузе, который был достоверно ниже по сравнению с больными РЭ в репродуктивном периоде и постменопаузе, 2,97±0,70 нмоль/л, 9,14±3,07 нмоль/л и 8,55±3,03 нмоль/л, соответственно, (p<0,05), а также по сравнению с пациентками с гиперпластическими процессами и в контроле в перименопаузе (p<0,05). Выявленные изменения в гормональном профиле у больных РЭ со всей очевидностью демонстрируют роль гипопрогестеронемии и относительной гиперэстрогенемии в развитии РЭ в перименопаузе [Horn L. et al., 2000, Hale G., 2002].
При анализе активности ферментов метаболизма эстрогенов в эндометрии у пациенток контрольной группы в зависимости от возрастного периода выявлено повышение активности ГТ с возрастом (табл.4). При анализе активности ферментов у больных гиперпластическими процессами эндометрия выявлена тенденция к повышению активности ароматазы у пациенток в постменопаузе по сравнению с пациентками в репродуктивном возрасте. Активность стероидсульфатазы у пациенток этой клинической группы в постменопаузе была значительно ниже, чем у пациенток в перименопаузе и репродуктивном периоде. Активность ГТ у больных гиперпластическими процессами эндометрия не повышалась с возрастом. Можно предположить, что одним из патогенетических механизмов развития гиперпластических процессов эндометрия во все возрастные периоды является повышение активности ароматазы. Отсутствие повышения активности ГТ в эндометрии с возрастом, по-видимому, также может способствовать развитию гиперпластических процессов в постменопаузе вследствие неконтролируемого образования катехолэстроген орто-хинонов в эндометрии.
Таблица 4.
Активность ферментов метаболизма эстрогенов в эндометрии у больных РЭ в различные возрастные периоды (M±m).
| Ферменты | Возрастные периоды | ||
| Репродуктивный | Перименопауза | Постменопауза | |
| Ароматаза, фмоль андростендиона/мг белка в час Стероидсульфатаза, фмоль эстрон сульфата/мг белка в час 2/4-эстрогенгидроксилазная активность, пмоль метоксиэстрогенов/мг белка в час КОМТ, нмоль гваякола/мг белка в час ГТ, мкмоль ХДНБ-SH/мг белка в минуту | 17,4±6,90 36,0±12,0 67,0±33,0 210±90,0 127±50,0 | 23,5±3,69 34,0±11,3 27,7±8,20 475±130** 282±91,1 | 18,1±2,97 86,6±18,5* 58,3±12,7 356±74,0 320±59,0** |
Примечание: * - достоверность различий по сравнению с больными репродуктивного периода и в перименопаузе, ** - достоверность различий по сравнению с больными репродуктивного периода, p<0,05.
При изучении активности ферментов метаболизма эстрогенов в опухолях у больных РЭ в зависимости от возрастного периода выявлено, что активность стероидсульфатазы была достоверно повышена в постменопаузе по сравнению с больными в репродуктивном периоде и перименопаузе. Глутатион-S-трансферазная активность в малигнизированном эндометрии также была повышена у больных в постменопаузе, по сравнению с пациентками репродуктивного периода.
Анализируя особенности гормонального статуса и активности ферментов метаболизма эстрогенов у больных гиперпластическими процессами эндометрия необходимо отметить, что одним из значимых аспектов в патогенезе данной патологии во все возрастные периоды является повышение активности ароматазы в гиперплазированном эндометрии по сравнению с нормальным. Развитие гиперпластических процессов в постменопаузе, по-видимому, обусловлено и отсутствием возрастного повышения активности ГТ в эндометрии, а также общей гиперэстрогенемии, вследствие тенденции к снижению уровня SHBG в сыворотке крови.
Обсуждая возможные варианты гормонального канцерогенеза в эндометрии у женщин в различные возрастные периоды, следует подчеркнуть, что в репродуктивном периоде и перименопаузе, по-видимому, наиболее вероятно развития промоторного варианта канцерогенеза. По данным Сидоренко М.Ю.с соавт. (1996), у женщин молодого возраста злокачественный процесс в матке развивается на фоне снижения секреции половых стероидов всех классов – эстрогенов, прогестинов, андрогенов [Сидоренко М.Ю. с соавт., 1996]. Полученные результаты о выраженном снижении уровня эстрона в сыворотке крови у больных РЭ репродуктивного периода соответствуют этим данным. Кроме того, у больных с гиперпластическими процессами эндометрия и РЭ в репродуктивном периоде выявлены наиболее высокие показатели суммарной 2/4-эстрогенгидроксилазной активности по сравнению с пациентками других возрастных периодов и с контрольной группой. Следует отметить, что активность ферментов II фазы биотрансформации эстрогенов – КОМТ и ГТ - у больных с гиперпластическими процессами эндометрия и РЭ в репродуктивном периоде невысока и достоверно не отличалась от активности ферментов в контроле. Суммируя эти данные и принимая во внимание наличие рецепторов стероидных гормонов в большинстве этих опухолей, можно предположить развитие промоторного варианта гормонального канцерогенеза у больных РЭ в репродуктивном периоде. Причем, вероятно это вариант без системной гиперэстрогенемии, но с локальной тканевой гиперэстрогенемией, поскольку катехолэстрогены – конечные продукты эстрогенгидроксилазных реакций, обладают высоким сродством к ER [Киселев В.И. с соавт., 2005, Zhu B.T., 1998].
В перименопаузе развитие злокачественного процесса в эндометрии происходит на фоне повышения активности КОМТ при отсутствии повышения активности других ферментов по сравнению с пациентками контрольной группы в перименопаузе. У перименопаузальных больных РЭ, по-видимому, определенный вклад в малигнизацию эндометрия вносит выявленная гипопрогестеронемия и сниженный уровень SHBG в сыворотке крови. Таким образом, у больных РЭ в перименопаузе антипролиферативный и проапоптотический эффекты прогестерона на эндометрий оказываются нивелированы, а эстрогенные эффекты усилены за счет повышенного синтеза эстрогенов при участии ароматазы.
Можно предположить развитие РЭ в постменопаузе как по промоторному, так и по генотоксическому варианту, что обусловлено полученными результатами об отсутствии изменений в гормональном статусе, высокой доли рецепторнегативных опухолей, сочетанного повышения активности ароматазы и стероидсульфатазы в эндометрии по сравнению с соответствующими больными в контрольной группе, а также достоверного повышения ГТ по сравнению с больными РЭ других возрастных периодов. Значительное повышение активности стероидсульфатазы выявлено только у больных РЭ в постменопаузе, что созвучно данным Гуляевой Л.Ф. с соавт. (2006) о значительном повышении содержания мРНК и активности стероидсульфатазы в опухолевой ткани у больных РЭ по сравнению с нетрансформированной тканью [Герасимов А.С., 2006, Gulyaeva L.F. et al., 2006].
Оценка риска развития РЭ у больных с гиперпластическими процессами эндометрия в различные возрастные периоды.
Хотя общеизвестна значимость выявления онкологического заболевания на ранних стадиях, поскольку именно оно определяет продолжительность жизни больного, успех или неуспех проводимого лечения [Чиссов В.И., 2006], многие вопросы ранней диагностики, выделения групп повышенного онкологического риска по РЭ среди женщин различных возрастных групп в настоящее время не решены.
Разработка математической модели для оценки риска развития РЭ среди больных с гиперпластическими процессами эндометрия в различные возрастные периоды проводилась на основании комплексной оценки анамнестических, клинических, морфологических данных, результатов определения показателей гормонального статуса, рецепторов стероидных гормонов и активности ферментов метаболизма эстрогенов. При построении математической модели был применен метод мультиноминальной логистической регрессии. На основании выбранной оптимальной совокупности признаков c уровнем значимости p<0,05 была определена регрессионная функция (F) для расчета риска развития РЭ у больных с гиперпластическими процессами эндометрия в различные возрастные периоды.
У больных репродуктивного периода в регрессионную функцию вошли следующие информативные показатели: уровень эстрона и прогестерона в сыворотке крови, индекс свободных эстрогенов, суммарная активность эстрогенгидроксилаз в эндометрии и наличие миомы матки. Значение регрессионной функции имело вид:
F(x1, x2, x3, x4, x5 ) = -1,970+ax1+bx2+cx3 +dx4+ ex5,
где коэффициенты регрессионной функции:
a =-0,149, b=4,285, c=-0,153, d=0,095, e=-4,275,
x1 - уровень эстрона в сыворотке крови,
x2 - индекс свободных эстрогенов,
x3 - уровень прогестерона в сыворотке крови,
x4 - cуммарная эстроген 2/4-гидроксилазная активность в эндометрии,
x5 - наличие миомы матки (1 – миома есть, 0 – миомы нет).
У больных в перименопаузальном периоде в регрессионную функцию вошли следующие информативные показатели с уровнем значимости p<0,05: уровень прогестерона и эстрона в сыворотке крови, активность КОМТ в эндометрии. Значение регрессионной функции (F) имело следующую формулу:
F(x1, x2, x3) = -4,338+ax1+bx2+cx3,
где коэффициенты регрессионной функции:
a = 0,014, b=0,089, c=-0,174,
x1 - активность КОМТ в эндометрии,
x2 - уровень эстрона в сыворотке крови,
x3 - уровень прогестерона в сыворотке крови.
Для больных в постменопаузальном периоде регрессионная функция включала следующие информативные показатели: ER, уровень прогестерона и эстрадиола в сыворотке крови, возраст менархе, наличие гипертонической болезни. Значение регрессионной функции (F) определялось по формуле:
F(x1, x2, x3, x4, x5 ) = -29,723+ax1+bx2+cx3 +dx4+ex5,
где коэффициенты регрессионной функции:
a =6,761, b=0,794, c=1,970, d=-11,217, e = 4,877,
x1 - ER,
x2 – уровень прогестерона в сыворотке крови,
x3 - возраст менархе,
x4 – уровень эстрадиола в сыворотке крови,
x5 – наличие гипертонической болезни (1 – гипертоническая болезнь есть, 0 - гипертонической болезни нет).
Используя значение регрессионной функции и основание натурального логарифма (е), была разработана математическая модель в виде формулы для оценки риска развития РЭ у больных с гиперпластическими процессами эндометрия в различные возрастные периоды. Общий вид математической модели:
eF
P= -------
1+eF
где P – вероятность развития РЭ у больных с гиперпластическими процессами эндометрия, e (основание натурального логарифма) =2,718, F – регрессионная функция для каждого возрастного периода.
Чувствительность модели для прогноза общего риска развития РЭ у больных с гиперпластическими процессами эндометрия репродуктивного возраста составила 87,5%, специфичность - 90%, в перименопаузе, соответственно, 80% и 85,7%, в постменопаузе - 92% и 83%, соответственно.
Проведенное исследование позволило объективизировать оценку риска развития РЭ у больных с гиперпластическими процессами эндометрия в различные возрастные периоды. Анализ факторов, вошедших в уравнение регрессионной функции, показал, что гормональные факторы одинаково значимы для всех возрастных групп. Такие клинические факторы, как возраст менархе, наличие гипертонической болезни и миомы матки, наиболее значимы для оценки онкологического риска у больных в репродуктивном и постменопаузальном возрастных периодах. Определение суммарной активности эстроген-2/4-гидроксилаз у больных с гиперпластическими процессами эндометрия в репродуктивном периоде и активности КОМТ в перименопаузе позволяет уточнить онкологический риск у этих пациенток и индивидуализировать тактику лечения.
Клинико-морфологические аспекты, метаболизм и рецепция эстрогенов у больных с гиперпластическими процессами и РЭ в сочетании с миомой матки.
Изучение клинико-морфологических факторов, связанных с метаболизмом эстрогенов у больных с гиперпластическими процессами в сочетании с миомой и без миомы матки выявило, что у пациенток с миомой матки в анамнезе было достоверно большее число беременностей и абортов по сравнению с больными без миомы матки (p<0,05). У больных РЭ анализ клинических параметров показал, что ИМТ у больных с миомой матки был достоверно выше по сравнению с больными РЭ без миомы матки, 33,0±1,18 и 29,4±1,12, соответственно (p<0,05).
При изучении особенностей метаболизма и рецепции эстрогенов выявлено, что у пациенток контрольной группы с миомой матки уровень эстрона в сыворотке крови был в 4 раза выше по сравнению с пациентками без миомы матки, 76,3±16,8 нг/мл и 19,2±3,0 нг/мл, соответственно, (p<0,05). Аналогичные, менее выраженные тенденции выявлены у больных с гиперпластическими процессами и РЭ.
У больных РЭ рецепторный фенотип ER+PR- встречался достоверно чаще в группе без миомы матки (49%), в группе с миомой матки – в 21% случаев (p<0,05). Полученные результаты согласуются с данными литературы, что фенотип с отсутствием прогестероновых рецепторов и наличием рецепторов эстрогенов наиболее характерен для больных РЭ со II патогенетическим вариантом и чаще всего без сопутствующей миомы матки [Хаджимба А.В., 2003, Berstein L.M. et al., 2003]. В тоже время у больных с гиперпластическими процессами и в контрольной группе таких особенностей выявлено не было.
Анализ активности ферментов метаболизма эстрогенов показал, что во всех клинических группах имелась общая тенденция к повышению активности ароматазы в эндометрии при наличии сопутствующей патологии миометрия. В группе больных РЭ эти различия были статистически достоверны (табл. 5). Во всех изученных группах выявлена общая тенденция к повышению активности стероидсульфатазы в эндометрии у пациенток без миомы по сравнению с соответствующими пациентками с миомой матки. В группе с гиперпластическими процессами эндометрия эта разница была статистически достоверна. При анализе активности эндометриальной ГТ было выявлено, что у больных с гиперпластическими процессами эндометрия и РЭ в сочетании с миомой матки активность этого фермента была статистически значимо выше по сравнению с пациентками без миомы матки.
Таблица 5.
Активность ферментов метаболизма эстрогенов в эндометрии у больных с гиперпластическими процессами и РЭ в сочетании с миомой матки (M±m).
| Группы | Ферменты | ||||
| Ароматаза, фмоль андростендиона/мг белка в час | Стероидсульфата-за, фмоль эстрон сульфата/мг белка в час | 2/4-эстрогенгидроксилаз-ная активность, пмоль метоксиэстрогенов/мг белка в час | КОМТ, нмоль гваякола/мг белка в час | ГТ, мкмоль ХДНБ-SH/мг белка в час | |
| ГПЭ: с миомой без миомы РЭ: c миомой без миомы Контроль: с миомой без миомы | 22,2±2,80 19,8±7,33 22,0±3,00 16,2±2,65* 8,25±2,19 8,11±3,25 | 31,2±10,0 139±55,0** 58,8±13,7 76,8±24,5 31,5±9,07 55,1±8,25 | 46,0±15,0 27,4±5,11 50,7±13,0 61,2±12,6 24,5±8,09 7,00±2,25*** | 135±22,0 82,5±20,0 431±132 302±56,2 141±30,0 100±24,2 | 187±24,0 49,5±13,8** 379±79,0 196±31,0* 193±54,7 128±45,0 |
Примечание: ГПЭ – гиперпластические процессы эндометрия, * - достоверность различий по сравнению с больными РЭ с миомой матки (p<0,05), ** - достоверность различий по сравнению с больными ГПЭ с миомой матки (p<0,05), *** - достоверность различий по сравнению с пациентками контрольной группы с миомой матки (p<0,05).
Таким образом, у больных с различным морфологическим состоянием эндометрия в сочетании с миомой матки выявлены особенности в активности ферментов синтеза эстрогенов. У пациенток с гиперпластическими процессами и РЭ в сочетании с миомой матки доминирует ароматаза-зависимый путь синтеза эстрогенов, а у пациенток без миомы матки – стероидсульфатаза-зависимый путь.
Для более детального изучения роли рецепции и метаболизма эстрогенов в развитии гиперпластических процеыссов и РЭ, сочетающихся с миомой матки, была исследована активность ароматазы в миометрии и миоматозных узлах, а также уровень рецепторов стероидных гормонов в миоматозных узлах. Анализ полученных результатов показал, что вне зависимости от активности ароматазы в эндометрии, активность этого фермента в миометрии и миоматозных узлах у пациенток всех клинических групп была высокой и достоверно не различалась. Однако уровень ER и PR в миоматозных узлах у больных с гиперпластическими процессами был достоверно выше по сравнению с больными РЭ (табл.6).
Таблица 6.
Активность ароматазы и уровень рецепторов стероидных гормонов в миометрии и миоматозных узлах у больных гиперпластическими процессами и РЭ в сочетании с миомой матки (M±m).
| Группы | Ароматаза в миометрии, фмоль андростендиона/ мг белка в час | Ароматаза в миоматозных узлах, фмоль андростендиона/мг белка в час | ER в миоматозных узлах, фмоль/мг белка | PR в миоматозных узлах, фмоль/мг белка |
| ГПЭ РЭ Контроль | 17,8±4,0 24,1±5,0 20,8±4,9 | 21,7±3,2 19,5±3,1 21,2±3,3 | 19,9±2,5 8,1±2,0* 10,8±4,0 | 38,8±7,0 18,0±3,5* 22,3±4,7 |
Примечание: ГПЭ – гиперпластические процессы эндометрия, * - достоверность различий по сравнению с группой ГПЭ (p<0,05).
Полученные результаты свидетельствуют о высоком потенциале миометрия и миоматозных узлов к синтезу эстрогенов из андрогенов у всех больных, имеющих миому матки, вне зависимости от морфологического состояния эндометрия. Также можно предположить отсутствие зависимости между процессами синтеза и рецепции эстрогенов в миоматозных узлах у больных РЭ. Выявленные особенности синтеза и рецепции эстрогенов в миоме матки у больных РЭ могут способствать реализации в миоме генотоксического варианта гормонального канцерогенеза. Правомерность этого предположения подтверждается данными литературы о встречаемости синхронного РЭ и саркомы тела матки [Hrycelak H., 1994, Sheyn L. et al., 2000].
На основании анализа клинических, гормональных параметров, уровня рецепторов стероидных гормонов и активности ферментов метаболизма эстрогенов разработана схема метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ в сочетании с миомой матки (рис.3). Как представлено на схеме, у этих больных имеется 4 источника синтеза эстрогенов. Первым источником является жировая ткань, в которой синтезируется, главным образом, эстрон из надпочечниковых андрогенов при участии ароматазы. Основанием для включения жировой ткани в схему метаболизма эстрогенов были полученные данные о большей выраженности обменных нарушений у больных с сочетанной патологией эндо- и миометрия. Наличие ожирения приводило к более высокому уровню эстрона в сыворотке крови у больных с миомой по сравнению с пациентками без миомы матки. Во-вторых, активный синтез эстрогенов происходит в миометрии. В-третьих – в миоматозных узлах, где выявлена высокая активность ароматазы. В-четвертых, эстрогены активно синтезируются и в самом эндометрии, где также выявлялась высокая активность ароматазы. Учитывая присутствие эстрогенгидроксилаз в эндометрии можно предположить, что эстрон, поступивший в матку из периферического кровотока, а также синтезированные в эндометрии, миометрии и миоматозных узлах эстрогены и их гидроксилированные метаболиты стимулируют гипертрофию миометрия, рост миоматозных узлов, возможно, их злокачественную трансформацию, а также избыточную пролиферацию эндометрия и рост опухолей эндометрия.
Таким образом, в результате проведенного исследования были выявлены особенности рецепции и метаболизма эстрогенов у больных с гиперпластическими процессами эндометрия и РЭ, изучены особенности гормональной регуляции ферментов метаболизма эстрогенов, определена роль ферментов метаболизма эстрогенов в опухолевом росте и инвазии, выяснены некоторые механизмы регуляции эстрогенами апоптоза и неоангиогенеза в опухолях эндометрия, разработана схема метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ в сочетании с миомой матки. Разработана математическая модель оценки вероятности развития РЭ у больных с гиперпластическими процессами эндометрия в различные возрастные периоды. Показано, что уровень эстрадиола в сыворотке крови, активность ароматазы и КОМТ в опухоли являются статистически значимыми факторами прогноза двухлетней безрецидивной выживаемости у больных РЭ. Патогенетически обосновано использование нового вида гормонотерапии - нестероидных ингибиторов ароматазы - у больных с резектабельными формами РЭ с активностью ароматазы в опухоли 7 фмоль андростендиона/мг белка в час и выше, после хирургического и лучевого этапов лечения. Разработанный способ комплексного лечения позволил достоверно повысить двухлетнюю безрецидивную выживаемость.
Рис. 3. Схема метаболизма эстрогенов у больных с гиперпластическими процессами и РЭ в сочетании с миомой матки. Примечание: КОМТ – катехол-О-метилтрансфераза, ГТ – глутатион–S-трансфераза, ER – рецепторы эстрогенов.
ВЫВОДЫ:
- У больных с гиперпластическими процессами эндометрия выявлен низкий уровень эстрадиола в локальном маточном кровотоке 0,14±0,07 нмоль/л, в контрольной группе - 0,45±0,19 нмоль/л, (p<0,05), а у больных РЭ - высокий уровень эстрона и индекс свободных эстрогенов, сочетающийся со сниженным уровнем SHBG.
- Уровень PR в гиперплазированном и малигнизированном эндометрии коррелировал с концентрацией общего эстрадиола в сыворотке крови (r=0,385) и его свободной фракцией (r=0,334, p<0,05). Уровень ER в опухолях ассоциировался с содержанием прогестерона (r=0,300) и SHBG (r=0,384, p<0,05), а у больных с гиперпластическими процессами эндометрия - с количеством беременностей (r=0,343), абортов (r=0,387) и концентрацией SHBG (r=-0,397, p<0,05).
- У больных с гиперпластическими процессами и РЭ выявлены корреляционные взаимосвязи между активностью ферментов метаболизма эстрогенов и уровнем половых гормонов в сыворотке крови, а у больных РЭ - и в локальном маточном кровотоке - между активностью стероидсульфатазы и уровнем эстрона (r=-0,595, p<0,05), активностью катехол-О-метилтрансферазы и уровнем прогестерона (r=-0,786, p<0,05).
- У больных РЭ наличие доброкачественных опухолей и кистозных образований яичников влияло на суммарную активность эстроген-2/4-гидроксилаз (F=5,31, p=0,028) и глутатион-S-трансферазы (F=6,75, p=0,012) в ткани РЭ, наличие ожирения (F=6,75, p=0,048) и артериальной гипертонии (F=4,15, p=0,048) - на активность глутатион-S-трансферазы.
- В опухолях эндометрия повышение активности ароматазы сопровождалось активацией ферментов II фазы биотрансформации - катехол-О-метилтрансферазы и глутатион-S-трансферазы. При неинвазивном РЭ по сравнению с инвазивным была выявлена низкая активность всех ферментов за исключением ароматазы. Максимальная активность ароматазы, стероидсульфатазы, эстрогенгидроксилаз и катехол-О-метилтрансферазы выявлялась в опухолях эндометрия при I-II стадии опухолевого процесса и снижалась при III стадии. Активность глутатион-S-трансферазы коррелировала с глубиной инвазии опухоли в миометрий (r=-0,305, p<0,05). В неэндометриоидных опухолях суммарная активность эстрогенгидроксилаз и катехол-О-метилтрансферазы была значительно выше, чем в эндометриоидных карциномах.
- Факторами высокого риска рецидива РЭ в течение двух лет после комплексного лечения являются дооперационный уровень эстрадиола в сыворотке крови менее 0,46 нмоль/л, активность ароматазы в опухоли выше 20 фмоль андростендиона/мг белка в час и катехол-О-метилтрансферазы – выше 300 нмоль гваякола/мг белка в час.
- В Bcl-2-позитивных опухолях в 72,2 % выявлялась высокоразвитая сеть кровеносных сосудов, а в Bcl-2-негативных опухолях в 75% - низкая плотность сосудов. В Bcl-2-позитивных опухолях активность стероид- сульфатазы была значимо выше по сравнению с Bcl-2-негативными опухолями (103±29,5 и 47,0±10,1 фмоль, соответственно, p<0,05). В опухолях эндометрия со слабым кровоснабжением активность стероид- сульфатазы была ниже по сравнению с опухолями с умеренным и высоким уровнем кровоснабжением (56,3±13,3 и 107±19,0 фмоль, соответственно, p<0,05).
- Повышение активности ароматазы в эндометрии отмечено у больных с гиперпластическими процессами и РЭ во все возрастные периоды по сравнения с больными в контрольной группе. У больных РЭ в репродуктивном периоде отмечена тенденция к повышению суммарной 2/4-эстрогенгидроксилазной активности, в перименопаузе - повышение активности катехол-О-метилтрансфферазы, которое сочеталось с выраженной гипопрогестеронемией и снижением SHBG. У больных РЭ в постменопаузе активированы оба ароматаза-зависимый и стероидсульфатаза-зависимый пути локального синтеза эстрогенов.
- У больных с гиперпластическими процессами и РЭ в сочетании с миомой матки выявлено достоверное повышение активности ароматазы и ГТ в эндометрии, а также уровня эстрона в сыворотке крови. У больных с гиперпластическими процессами и РЭ без миомы матки отмечена активация стероидсульфатаза-зависимого пути синтеза эстрогенов. Рецепторный фенотип ER+PR- у больных РЭ без миомы матки наблюдался в 49%, с миомой матки - в 21%, (p<0,05).
- У больных с гиперпластическими процессами и РЭ в сочетании с миомой матки выявлена высокая активность ароматазы в миометрии и миоматозных узлах. Уровень ER в миоматозных узлах у больных с гиперпластическими процессами эндометрия составил - 19,9±2,5 фмоль/мг белка, PR - 38,8±7,0 фмоль/мг белка, у больных РЭ - 8,1±2,0 фмоль/мг белка и - 19,0±3,5 фмоль/мг белка, соответственно, (p<0,05).
- Патогенетически обоснован и апробирован метод комплексного лечения больных РЭ I-III стадиями с адьювантной гормонотерапией ингибитором ароматазы анастразолом в дозе 1 мг в день в течение 6 месяцев после проведения хирургического и лучевого этапов лечения при активности внутриопухолевой ароматазы 7 фмоль андростендиона/ мг белка в час и выше. Двухлетняя безрецидивная выживаемость у больных, пролеченных данным методом, составила 89,8±3,7%, у больных, получивших стандартное комбинированное лечение - 68,8±1,68% (p<0,05).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ:
1. При формировании групп риска по развитию РЭ в репродуктивном периоде необходимо учитывать уровень эстрона и прогестерона в сыворотке крови, ИСЭ, суммарную активность 2/4-эстрогенгидроксилаз в эндометрии и наличие или отсутствие миомы матки; в перименопаузе - уровень эстрона и прогестерона в сыворотке крови и активность КОМТ в эндометрии; в постменопаузе – уровень эстрадиола и прогестерона в сыворотке крови, уровень ER в эндометрии, возраст менархе и наличие или отсутствие гипертонической болезни с определением вероятности развития РЭ по формуле: eF
P= -------
1+eF
где P – вероятность развития РЭ у больных с гиперпластическими процессами эндометрия, e (основание натурального логарифма) =2,718, F – регрессионная функция для каждого возрастного периода.
2. У больных РЭ, наряду с традиционными клинико-морфологическими факторами определение уровня эстрадиола в сыворотке крови, активности ароматазы и КОМТ в опухоли должны использоваться для прогнозирования двухлетней безрецидивной выживаемости. При разработке индивидуального плана лечения больных РЭ необходимо учитывать, что факторами высокого риска рецидива РЭ в течение двух лет после комплексного лечения являются дооперационный уровень эстрадиола в сыворотке крови менее 0,46 нмоль/л, активность ароматазы в опухоли выше 20 фмоль андростендиона/мг белка в час и КОМТ – выше 300 нмоль гваякола/мг белка в час.
3. У больных РЭ с IB-III стадией заболевания с активностью ароматазы в опухоли 7 фмоль андростендиона/ мг белка в час и выше, комплексный метод лечения должен включать хирургический, лучевой этап и адьювантную гормонотерапию ингибитором ароматазы анастразолом в дозе 1 мг в день в течение 6 месяцев.
Список работ, опубликованных по теме диссертации
- Ароматазная активность в эндометрии и перспективы использования ингибиторов ароматазы в лечении больных раком эндометрия //Современные направления исследований в акушерстве, гинекологии и перинатологии.-Томск,2001.-C.70-72 (в соавт. с Л.А. Коломиец, И.Г. Заевой).
- Перспективы использования ингибиторов ароматазы в лечении больных раком эндометрия //Вопросы онкологии.-2001.-т.47(5).-С.557-561 (в соавт. с Л.А.Коломиец).
- Перспективы использования ингибиторов ароматазы в комплексном лечении больных раком эндометрия //Актуальные вопросы онкоурологии и онкогинекологии: Материалы региональной научно-практической конференции. /Под ред. А.Ф. Лазарева -Барнаул,2002.-C.135-136 (в соавт. с Л.А. Коломиец, С.В.Ивановой, И. Г. Заевой).
- Ароматазная активность у больных гиперпластическими процессами и раком эндометрия //Актуальные вопросы онкоурологии и онкогинекологии: Материалы региональной научно-практической конференции. /Под ред. А.Ф.Лазарева -Барнаул,2002.-C.133-134 (в соавт. с Л.А. Коломиец, С.В. Ивановой, И.В. Кондаковой, И.Г. Заевой, С.Л.Стукановым).
- Опыт использования ингибитора ароматазы «Аримидекса»в комплексном лечении больных раком эндометрия //Рак репродуктивных органов: профилактика, диагностика, лечение: Материалы региональной научно-практической конференции.- Томск: Изд-во НТЛ, 2002.-C.58-59 (в соавт. с Л.А. Коломиец, С. В. Ивановой, И.Г. Заевой).
- Ароматазная активность в эндометрии как объективный критерий формирования группы повышенного риска развития рака тела матки //Рак репродуктивных органов: профилактика, диагностика, лечение: Материалы региональной научно-практической конференции.- Томск: Изд-во НТЛ, 2002.-С.26-27 (в соавт. с Л.А. Коломиец, С.В. Ивановой, И.В. Кондаковой, И.Г. Заевой).
- Перспективы использования ингибитора ароматазы «Аримидекса» в комплексном лечении больных раком эндометрия // Юбилейная конференция «Гормонозависимые опухоли».- Санкт-Петербург,2002.-C.227-229 (в соавт. с Л.А. Коломиец, С.В.Ивановой, И.Г. Заевой).
- Ароматазная активность у больных гиперпластическими и атрофическими процессами эндометрия как объективный критерий формирования группы повышенного онкологического риска // Юбилейная конференция «Гормонозависимые опухоли».-Санкт-Петербург,2002.-C.206-209 (в соавт. с Л.А. Коломиец, С.В.Ивановой, И.Г. Заевой, И.В. Кондаковой, С.Л. Стукановым).
- Aromatase activity as an objective parameter for determining group at risk for endometrial cancer //XXVIII Nordic Congress in Clinical Chemistry and XXXV Nordic Conference on Coagulation.- Reykjavik, 2002.-P.139-140 (with L. Kolomijets, I. Kondakova, S. Ivanova, S. Stukanov, I. Zajeva).
- Ароматазная активность в гиперплазированном и малигнизированном эндометрии на фоне фибромиомы //Сибирский медицинский журнал.-2002.-т.17, N4.-С.26-29 (в соавт. с Л.А. Коломиец, И.В.Кондаковой, И.Г. Заевой, С.Л.Стукановым, С.В. Ивановой).
- Ароматазная активность при гиперпластических процессах и раке эндометрия //Бюллетень СО РАМН. -2003.-N1.-С.24-27 (в соавт. с С.В. Ивановой).
- Патогенетическое обоснование использования ингибиторов ароматазы в лечении рака эндометрия //Вопросы гинекологии, акушерства и перинаталогии.- 2003.-т.2,N1.-С.57-60 (в соавт. с Коломиец Л.А., И.В. Кондаковой).
- Клинико-морфо-биохимические аспекты гиперпластических процессов и рака эндометрия -Томск: НТЛ, 2003.-113с. (в соавт. с Коломиец Л.А., Чернышовой А.Л., Крицкой Н.Г.).
- Новые подходы к гормонотерапии рака эндометрия //Материалы российской научно-практическая конференция «Новые диагностические и лечебные технологии в онкологии».- Томск,2003.- С.119-120 (в соавт. с Л.А. Коломиец, А.Б. Старовой).
- Ароматазная активность в гиперплазированном и малигнизированном эндометрии на фоне миомы: перспективы использования ингибиторов ароматазы //Материалы российской научно-практическая конференция «Новые диагностические и лечебные технологии в онкологии».- Томск,2003.-С.44-45 (в соавт. с И.В. Кондаковой, Л.А. Коломиец, С.Л. Стукановым, С.В. Ивановой, И.Г. Заевой).
- Опыт использования ингибитора ароматазы Аримидекса при раке тела матки //X Российский Национальный Конгресс «Человек и лекарство», тезисы докладов.-Москва,2003-С.491 (в соавт. с С.В. Ивановой, Л.А. Коломиец).
- Синтез высокомеченных тритием стероидных гормонов и их использование для оценки активности ароматазы //Радиохимия.- 2004.-т.45,N5.-С.458-463 (в соавт. с Л.А. Коломиец, И.В. Кондаковой, В.П. Шевченко, И.Ю. Нагаевым, Н.Ф. Мясоедовым).
- Ферменты метаболизма эстрогенов у больных с типичной и атипичной гиперплазией эндометрия в сочетании с миомой матки //Сибирский медицинский журнал.-2004.-N5.-С.22-25 (в соавт. с Л.А. Коломиец, А.Б. Старовой, И.В. Кондаковой, И.Г. Заевой)
- Ферменты метаболизма эстрогенов у больных раком эндометрия в сочетании с миомой матки //Медицина в Кузбассе.-2004.-N11.-С.10-14 (в соавт. с Л.А. Коломиец, И.В.Кондаковой, А.Б. Старовой, С.Л. Стукановым).
- Перспективы использования ингибиторов ароматазы в терапии рака эндометрия //III съезд онкологов и радиологов СНГ: материалы съезда.-Минск, 2004.-С.408 (в соавт. с Л.А. Коломиец, И.В. Кондаковой, А.Б. Старовой).
- Половые гормоны при сочетанной патологии эндометрия и миометрия //Материалы российской научно-практической конференции «Современное состояние и перспективы развития экспериментальной и клинической онкологии» - Томск: НТЛ, 2004 - С.75-76 (в соавт. с Л.А. Коломиец, А.Б. Старовой, И.В. Кондаковой, С.Л. Стукановым, И.Г. Заевой И.Г.).
- Активность ферментов метаболизма эстрогенов у больных раком эндометрия в сочетании с миомой матки ///Материалы российской научно-практической конференции «Современное состояние и перспективы развития экспериментальной и клинической онкологии» - Томск: НТЛ, 2004 - С.74-75 (в соавт. с Л.А. Коломиец, А.Б. Старовой, И.В. Кондаковой).
- Современная схема метаболизма эстрогенов у больных с гиперплазией эндометрия в сочетании с миомой матки //Мать и дитя в Кузбассе. -2005.-N1.-С. 61-64 (в соавт. с Л.А.Коломиец, И.В.Кондаковой, А.Б. Старовой, С.Л. Стукановым, Л.П. Смирновой).
- Ферменты метаболизма эстрогенов при гиперплазии и раке эндометрия в сочетании с миомой матки //Сибирский онкологический журнал. -2005.-N3(15).-С.32-38 (в соавт. с Л.А.Коломиец, И.В.Кондаковой, А.Б. Старовой, Л.А. Агарковой).
- Сочетание гиперплазии и рака эндометрия с миомой матки: роль половых гормонов, их рецепторов и ферментов метаболизма эстрогенов //Вопросы онкологии -2005.-т.51, N4.-С.427-433 (в соавт. с Л.А.Коломиец и И.В.Кондаковой).
- Использование радиометрических и спектрофотометрических методов для оценки активности ферментов метаболизма эстрогенов у больных раком эндометрия //Материалы российской научно-практической конференции «Новые технологии в онкологической практике» - Барнаул, 2005 - С.204 (в соавт. с Л.А. Коломиец, А.Б. Старовой, И.В. Кондаковой).
- The activity of enzymes of estrogen metabolic pathway: relation with Stage, Grade and histological subtype //ESGO 14th Meeting.-Istanbul, 2005.-P. 107-108 (with L. Kolomiets, I. Kondakova, A. Muntyan).
- Potential use of aromatase inhibitors in the treatment of endometrial cancer //ESGO 14th Meeting.-Istanbul, 2005.-P. 127 (with L. Kolomiets, A.Muntyan).
- Ферменты метаболизма эстрогенов в малигнизированном эндометрии //Материалы международного симпозиума «Молекулярные механизмы регуляции функции клетки» - Тюмень: Вектор Бук, 2005 - С.114-116 (в соавт. с Л.А. Коломиец, А.Б. Старовой, И.В. Кондаковой, С.Л. Стукановым, Л.П. Смирновой).
- Ферменты метаболизма эстрогенов в гормонозависимых опухолях //Материалы IX Российского Онкологического Конгресса - М., 2005 - С.215 (в соавт. с И.В. Кондаковой, Л.А. Коломиец Л.А., Е.Е. Шашовой, Е.М. Слонимской).
- Ферменты метаболизма эстрогенов при раке эндометрия // Бюллетень экспериментальной биологии и медицины.- 2006.-Т.141(2).-С.202-204 (в соавт. с И.В. Кондаковой, Л.А. Коломиец, С.Л. Стукановым, А.Б. Старовой, Л.А. Агарковой).
- Endometrial cancer and enzymes of estrogen metabolic pathway: correlation with clinical and histopathological parameters //5th Biennial International meeting of the FGOG “Endocrine treatment & prevention of breast and gynaecological cancers” – Brussels, 2006.-P.169 (with I.V.Kondakova, L.A. Kolomiets, A.B. Muntyan, S.L. Stukanov).
- Aromatase and steroid sulfatase in endometrial tumors: potential use of non-steroidal aromatase and steroid sulfatase inhibitos //5th Biennial International meeting of the FGOG “Endocrine treatment & prevention of breast and gynaecological cancers” – Brussels, 2006.-P.170 (with I.V.Kondakova, L.A. Kolomiets, A.B. Muntyan, S.L. Stukanov).
- Anastrazole in endometrial cancer treatment: first results. //5th Biennial International meeting of the FGOG “Endocrine treatment & prevention of breast and gynaecological cancers” – Brussels, 2006.-P.171 (with L. A. Kolomiets, A.B. Muntyan).
- Половые гормоны в системном и локальном маточном кровотоке при гиперпластических процессах и раке эндометрия: новые аспекты патогенеза // Медицина в Кузбассе.-2006.- Спецвыпуск N2.-C.106-108 (в соавт. с Л.А. Коломиец, И. В. Кондаковой, А.Б. Мунтян, С.Л. Стукановым, С.В. Фоминой)
- Апоптоз и ангиогенез в опухолях эндометрия: взаимосвязь с активностью ферментов синтеза и метаболизма эстрогенов. // Актуальные вопросы морфологической, иммуногистохимической и цитологической диагностики злокачественных новообразований. Материалы Российской научно-практической конференции.-Томск,2006.-С.86-87 (в соавт. с Н.Г. Крицкой, О.В. Савенковой, Л.А. Коломиец, А.Л. Чернышовой, И.В. Кондаковой, А.Б. Мунтян).
- Синтез высокомеченных тритием стероидов для оценки активности ароматазы и стероидсульфатазы в опухолях эндометрия // Бюллетень экспериментальной биологии и медицины.- 2006.- т.142,N10.-С.462-464 (в соавт. с И.В. Кондаковой, Л.А. Коломиец, А.Б. Мунтян, В.П. Шевченко, И.Ю. Нагаевым, К.В. Шевченко, Н.Ф. Мясоедовым, Н.Н. Дорофеевой).
Изобретение
- Способ комплексного лечения резектабельных форм рака эндометрия: положительное решение о выдаче патента РФ на изобретение N2005130582 от 03.10.2005. (в соавт. с Л.А. Коломиец, И.В. Кондаковой, А.Б. Мунтян).
Автор выражает глубокую благодарность руководителю отделения лучевой диагностики НИИ онкологии ТНЦ СО РАМН профессору, заслуженному деятелю науки РФ, доктору медицинских наук Величко Светлане Андреевне, научному сотруднику радиоизотопной лаборатории, кандидату биологических наук Стуканову Сергею Леонидовичу, руководителю лаборатории патанатомии, профессору, доктору медицинских наук Перельмутеру Владимиру Михайловичу и старшему научному сотруднику лаборатории, кандидату биологических наук Крицкой Надежде Георгиевне, младшему научному сотруднику отдела научно-медицинской информации Фоминой Светлане Викторовне за большую практическую помощь в выполнении диссертационной работы и высказанные ценные рекомендации.
Список сокращений:
ВОЗ – Всемирная Организация Здравоохранения;
ГПЭ – гиперпластические процессы эндометрия;
ГТ – глутатион-S-трансфераза;
ИМТ – индекс массы тела;
ИСЭ – индекс свободных эстрогенов;
КОМТ – катехол-О-метилтрансфераза;
РЭ – рак эндометрия;
СОД – суммарная очаговая доза излучения;
ХДНБ – 1-хлоро-2,4-динитробензол;
CYP1A1, CYP1A2, CYP1B1, CYP3A – гены, белковые продукты которых являются цитохром P450-содержащими ферментами с эстрогенгидроксилазной активностью;
ER- эстрогенные рецепторы;
ESGO – European Society of Gyneacological Oncology;
GSH – восстановленный глутатион;
PR – рецепторы прогестерона;
SHBG – глобулин, связывающий половые стероиды;
VEGF – фактор роста эндотелия сосудов.

