Иммунопатогенетические особенности распространенных дерматозов и перспективы их лечения
На правах рукописи
БЫКОВ Сергей Анатольевич
Иммунопатогенетические особенности
распространенных дерматозов
и перспективы их лечения
14.00.36 — Аллергология и иммунология
14.00.11 — Кожные и венерические болезни
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2008
Работа выполнена в ГОУ ВПО ММА им. И.М.Сеченова Росздрава и
в МЗ МО ГУ МОНИКИ им. М.Ф.Владимирского
Научные руководители: Член-корреспондент РАМН,
доктор медицинских наук, профессор
Караулов Александр Викторович
Доктор медицинских наук, профессор
Молочков Антон Владимирович
Официальные оппоненты:
Доктор медицинских наук, профессор
Афанасьев Станислав Степанович
Доктор медицинских наук, профессор
Кочергин Николай Георгиевич
Ведущая организация: Государственный научный центр – Институт иммунологии Федерального медико-биологического агентства
Защита состоится «___» ______ 2008 г. в ___ часов на заседании диссертационного совета Д208.040.08 в ГОУ ВПО Московской медицинской академии им. И.М. Сеченова Росздрава по адресу: 119992, Москва, Трубецкая ул., д.8, строение 2.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Московской медицинской академии им. И.М. Сеченова Росздрава
(117998, Москва, Нахимовский проспект, д. 49).
Автореферат разослан «___» __________ 2008 года
Ученый секретарь диссертационного совета Д208.040.08
доктор медицинских наук, профессор Миронов Андрей Юрьевич
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Длительное время в мире продолжается неуклонный рост числа аллергических заболеваний кожи — аллергодерматозов (атопический дерматит, контактный дерматит, экзема, крапивница), поражающих до 25% населения. Этиология и патогенез аллергодерматозов до настоящего времени во многом остаются невыясненными. Так, клинический фенотип, характеризующий атопический дерматит — результат сложных взаимодействий между генами восприимчивости организма, окружающей средой, а также дефектов баръерной функции кожи, системного и местного иммунитета (Хаитов Р.М. и соавт., 2002; Караулов А.В., 2002; Ильина Н.И., Феденко Е.С., 2004; Геварзиева В.Б. и соавт., 2006; Boguniewicz M., Leung D., 2006).
Сложная ситуация существует и в отношении дерматозов с иными иммунопатологическими проявлениями типа псориаза. Особый интерес вызывает сравнительное изучение двух патологических процессов с преобладанием аллергического (атопический дерматит) и иного иммунопатологического компонента (псориаз). Выявление и уточнение особенностей патогенеза иммунопатологических нарушений различных механизмов развития может служить основой для разработки методов эффективной профилактики и лечения больных. Остаются неясными варианты и механизмы взаимоотношений защитных факторов организма с представителями микрофлоры кожи человека in situ. Такие взаимоотношения могут изменять биологические свойства микрофлоры человека, влияя на развитие и лечение заболеваний с иммунопатологическими нарушениями. Требуют уточнения вопросы применения иммуномодуляторов при аллергии. Считают, что при аллергических заболеваниях типа «атопического марша» иммуномодуляторы целесообразно применять для борьбы с проявлениями вторичной иммунной недостаточности например, при атопическом дерматите с инфекционными осложнениями, при бронхиальной астме с явлениями хронического гнойно-обструктивного бронхита, при рецидивирующей герпетической или цитомегаловирусной инфекции и т. д. (Хаитов Р.М., Пинегин Б.В., 2003). Отмечается также нецелесообразность применения иммуномодуляторов при острых бактериальных и вирусных инфекциях из-за опасности утяжеления инфекционного процесса.
Изучение в данной работе показателей иммунного статуса в сравнении с иммунопатологическими нарушениями на патологически измененной коже с учетом микропейзажа кожи может дать новые сведения об иммунопатогенезе и адекватном лечении ряда дерматозов.
Цель исследования: изучение взаимоотношения микрофлоры и защитных факторов организма в динамике заболевания и лечения больных хроническими дерматозами на примере атопического дерматита с учетом влияния виферона.
Задачи исследования:
- Исследовать иммунный статус у больных атопическим дерматитом до и после лечения Вифероном;
- Установить особенности взаимоотношений бактерий с защитными факторами организма у больных атопическим дерматитом и псориазом с использованием метода электронной микроскопии ультратонких срезов;
- Изучить возможность применения реакции иммунного прилипания у больных для оценки эффективности лечения больных;
- Исследовать уровень 2-макроглобулина в сыворотке крови больных;
- Выявить особенности клинического течения и клинико-иммунологические взаимосвязи при атопическом дерматите;
- Разработать критерии оценки прогноза течения патологического процесса;
- На основе полученных результатов предложить коррекцию иммунопатологических нарушений при атопическом дерматите.
Научная новизна. Впервые проведено комплексное бактериологическое и иммунологическое изучение больных с атопическим дерматитом с анализом иммунобиологических и структурных особенностей репрезентативных представителей микрофлоры кожи — стафилококков. Обнаружены иммунобиологические особенности поверхности стафилококков, связанные с адсорбцией гуморальных факторов защиты с участием 2-макроглобулина.
Впервые показано, что поскольку реакция иммуноприлипания имеет комплементзависимый, интегральный характер с участием различных гуморальных факторов организма, ее можно использовать для оценки состояния патологического процесса и эффективности лечения больных с атопическим дерматитом.
Выявлен положительный эффект применения Виферона при лечении атопического дерматита у взрослых. Предложена схема лечения атопического дерматита с включением в базовое лечение Виферона.
Практическая значимость работы. Применение Виферона при лечении атопического дерматита позволяет повысить эффективность лечения атопического дерматита. Для оценки эффективности лечения хронических дерматозов можно использовать реакцию иммунного прилипания и учет видового состава стафилококков кожи.
Основные положения, выносимые на защиту
- Иммуноглобулины, альфа2-макроглобулин, альбумин, комплемент и другие белки сыворотки крови адсорбируются в виде иммуноглобулинового покрова на поверхности стафилококков — основных представителях микрофлоры кожи. Это обстоятельство может служить причиной повышения иммуногенности различных веществ, включенных в состав иммуноглобулинового покрова.
- Течение атопического дерматита и псориаза характеризуется отличиями по состоянию репрезентативных представителей микрофлоры кожи — стафилококков и изменениями иммунного статуса, состояние которого может отражаться в показателях реакции иммуноприлипания.
- Препарат Виферон в ректальных суппозиториях, включенный в схему лечения атопического дерматита, оказывает благоприятное воздействие на эффективность терапевтических мероприятий.
Апробация работы. Материалы диссертации апробированы в ММА им. И.М. Сеченова на совместной конференции кафедры аллергологии и иммунологии и кафедры кожных и венерических болезней ФППО (Москва, сентябрь 2007г.). Данные диссертации доложены на III Конференции молодых ученых России с международным участием (Москва, январь 2004г.), на I международной конференции «Молекулярная медицина и биобезопасность» (Москва, октябрь, 2004г.) и на V Конференции молодых ученых России с международным участием (Москва, май, 2008г.).
Внедрение результатов исследования. Результаты исследования внедрены: в учебный процесс на кафедре дерматовенерологии и дерматоонкологии ФУВ МОНИКИ им. М.Ф. Владимирского; на кафедре клинической иммунологии и аллергологии ФППОВ ММА им. И.М. Сеченовa, кафедрах микробиологии, вирусологии и иммунологии ММА им. И.М. Сеченова и МГМСУ, а также используются при преподавании в других медицинских ВУЗах, для которых рекомендованы (Учебно-методическим обьединением по медицинскому и фармацевтическому образованию вузов России) 3 цветных атласа по микробиологии, иммунологии и аллергологии (изданы с участием Быкова С.А.). По теме диссертации опубликовано 19 работ.
Структура диссертации. Диссертация изложена на 122 страницах и состоит из введения, обзора литературы, главы «Материалы и методы исследования», трех глав собственных исследований, заключения, выводов и практических рекомендаций. Она иллюстрирована 24 рисунками и 11 таблицами. Указатель литературы включает 77 отечественных и 117 зарубежных источников.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Под наблюдением было 50 пациентов с атопическим дерматитом и 21 с псориазом, находившихся на стационарном лечении в клиниках. У 46 пациентов был установлен диагноз атопический дерматит, распространенная форма, среднетяжелое течение (поражалось более 5% площади кожи в области шеи, предплечий, лучезапястнных суставов, кистей, локтевых и подколенных сгибов, а также груди, спины); выраженный зуд. У 4 пациентов отмечалась локализованная форма, легкое течение атопического дерматита. Больные (возраст — от 16 до 55 лет) находились на лечении в отделении дерматовенерологии и дерматоонкологии ФУВ МОНИКИ им. М.Ф. Владимирского и в отделении аллергологии и иммунологии клинической больницы №83 г. Москвы. Больным проводили базисную терапию. Оценку кожных проявлений и эффективности терапии проводили с помощью бальной оценки атопического дерматита SCORAD (Scoring of Atopic Dermatitis). Больные атопическим дерматитом (21 женщина и 29 мужчин) составляли две группы — соответственно 30 и 20 пациентов. Основная группа из 30 человек получала лечение препаратом «Виферон» в виде ректальных суппозиторий и 20 человек — лечение традиционными методами, составляя группу контроля. Больные двух групп получали традиционную медикаментозную терапию: антигистаминные, седативные, гипо-сенсибилизирующие, энтеросорбентные препараты, наружные средства в виде кремов и мазей. Больные псориазом (20 человек) имели возраст 20-40 лет. Также обследовано 20 человек контрольной группы без патологии кожи.
Виферон (регистрационный номер 000017/01-2000) — комплексный препарат, выпускаемый в ректальных суппозиториях. Содержит человеческий рекомбинантный альфа2b-интерферон в дозе 1 млн. МЕ (Виферон-3), альфа-токоферола ацетат, аскорбиновую кислоту и основу с твердым жиром.
Оценка иммунного статуса больных проводилась на базе лаборатории иммунодиагностики и иммунокоррекции НИИ трансплантологии и искусственных органов МЗ РФ (зав., д.м.н., проф. В.С. Сускова). Клеточный состав субпопуляций лимфоцитов в периферической крови и рецепторы клеточной кооперации определялись на проточном цитофлюориметре фирмы FACScan Becton Dickinsn США с использованием моноклональных антител к дифференцировочным и активационным маркерам (НПЦ – «МедБиоСпектор» и «Сорбент»), меченные FITC и фикоэритрином (PE).
Определение иммуноглобулинов классов G, A и M проводилось по методу радиальной иммунодиффузии по Манчини с использованием моноклональных антител. IgE определяли методом твердофазного ИФА с помощью набора фирмы ООО «Хема-Медика» (Москва), которая рекомендует использовать возрастную норму IgE (15 лет и старше) как менее 130 МЕ/мл.
Цитокины определяли на базе лаборатории онтогенеза и коррекции системы интерферонов НИИЭМ им. Н.Ф. Гамалеи (зав. проф. В.В. Малиновская).
Определение интерферонового статуса. Определялся ИФН-, индуцируемый вирусом болезни Ньюкастла и ИФН-, индуцируемый фитогемагглютинином. Титрование ИФН проводилось на плоскодонных планшетах с монослоем диплоидной культуры клеток фибробластов человека с помощью вносимого в нее тест-вируса (вируса энцефаломиокардита мышей).
Определение фактора некроза опухолей (ФНО-) и интерлейкина-4 (ИЛ-4) проводили с помощью набора реагентов ProCon ФНО- и ProCon IL-4 ООО «Протеиновый контур» (С-Петербург) для твердофазного ИФА.
Определение альфа2–макроглобулина проводилось в плазме крови методом иммунотурбидиметрии (с помощью наборов реагентов производства фирмы «Aptec diagnostics nv», Бельгия) в лаборатории клинической и экспериментальной биохимии ФГУ «НИИ Трансплантологии и искусственных органов Росздрава» (зав. проф. О.П. Шевченко). Оптическая плотность измерялась при температуре 37С с помощью фотометра для микропланшетов (BIO-TEK FL600 FA, производства США, программа KC 4 for Windows), при длине волны 340 нм.
Фагоцитарная активность нейтрофилов изучалась с убитым штаммом (Wood 46) стафилококка: определялись фагоцитарное число и фагоцитарный индекс.
Реакцию иммуноприлипания (РИП) стафилококков применяют для оценки врожденного иммунитета у больных различного профиля заболеваний (Смирнова А.М., 1975; Пустовалова Н.А., 1975). Реакция основана на активации системы комплемента корпускулярными антигенами (бактериями, вирусами), обработанными сывороткой крови. В результате активированный компонент комплемента (СЗb) присоединяется к корпускулярному антигену в составе иммунного комплекса. РИП ставили в новой модификации с разведениями сыворотки крови больных (титрационный вариант), которая давала сходные результаты при использовании как стафилококков, так и эшерихий, что свидетельствовало о неспецифичности реакции. Постановка РИП заключалась в 10 мин. инкубации (при 37°С) золотистого стафилококка (Wood 46) с разведениями сыворотки крови больного и последующим добавлением отмытых эритроцитов этого же больного. Для изучения взаимоотношений гуморальных факторов организма с бактериальными клетками применяли РИФ. Окрашенные препараты фотографировали на фотомикроскопе-III фирмы Цейсс-Оптон.
Исследование микрофлоры кожи. Микрофлору кожи изучали с помощью метода агаровых отпечатков с использованием «Бактотестов» — стерильных пластиковых одноразовых микрочашек площадью 10 см2. «Бактотесты» были любезно предоставлены профессорами Ивановым А.А. и Мальцевым В.Н. (Институт Биофизики РФ). Для оценки общей количественной обсемененности кожи учитывались колонии бактерий, выросшие на отпечатках с питательными средами — 10% кровяным агаром, среду Columbia фирмы BioMerieux, желточно-солевым агаром (метод «Бактотестов»). Наиболее стабильным показателем микробной обсемененности кожи здоровой группы и группы больных, оказалась кокковая микрофлора биотопа «предплечье/локтевая область». Время аппликации — 10 секунд. Состояние микробиоценоза кожи оценивали по наиболее ее представительному сочлену — стафилококку. Дифференциацию стафилококков проводили по общепризнанным методикам с включением тестов на выявление плазмокоагулирующей, лецитовителлазной и гемолитической активности.
Электронномикроскопическое исследование. В работе использовали чистые культуры бактерий, выделенные из гнойного отделяемого поражений кожи больных, а также лабораторные штаммы Staphylococcus aureus Wood-46, Staphylococcus aureus Cowan и Escherichia coli штамм B, полученные из ГИСК им. Л.А. Тарасевича. Кроме этого проводили электронномикроскопическое изучение гнойно-воспалительного эксудата гнойных осложнений на коже больных. Для получения ультратонких срезов применяли глютаральдегид-осьмиевую фиксацию с использованием фосфатного или Na-кокадилатного буфера с учетом соответствуюших рекомендаций (Быков А.С. и соавт., 1981), что позволило выявить как структуры бактерий, так и структуры тканей. Фиксированные и обезвоженные объекты заключали в эпоксидные смолы, или другие полимеры, с последующей полимеризацией. Полученные на ультрамикротоме LKB ультратонкие срезы объекта контрастировали и снимали на сверконтрастные носители в электронном микроскопе JEM-100B.
Статистическая обработка результатов исследования проводилась с применением свободно распространяемого програмного комплекса EpiInfo 5,0, рекомендованного для использования ВОЗ. Дистрибутив программы был получен с сайта www.cdc.gov (центр слежения за заболеваемостью и смертностью, США, Атланта). Достоверность различий средний по группам проверяли при помощи дисперсионного анализа. Сравнение дублировали при помощи аналогичных методов непараметрической статистики.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследование было начато с оценки показателей врожденного иммунитета у больных с атопическим дерматитом. Врожденный иммунитет оценивали по показателям реакции иммунного прилипания, микробной обсемененности кожи, фагоцитарному показателю и содержанию 2-макроглобулина. Комплексных методов оценки врожденного иммунитета, с учетом взаимодействия большинства составляющих компонентов, практически не существует. Поэтому нами был выбран ранее предложенный вариант реакции иммунного прилипания титрационным способом (Быков А.С., 1985). Реакция носит неспецифический характер, так как показатели с применением стафилококка и E. coli были сходными, а при прогревании сыворотки крови до 56°С (инактивация комплемента) реакция была отрицательной в обоих случаях.
Задачей настоящего исследования являлось выяснение механизма иммуноприлипания бактерий к эритроцитам при помощи электронной микроскопии ультратонких срезов продукта реакции. Электронномикроскопическое изучение продукта реакции с различными видами лабораторных и клинических штаммов стафилококков позволило выявить формирование капсулоподобной структуры, соединяющей эритроциты и стафилококки, соответствующей ранее описанному образованию, названному иммуноглобулиновым покровом (Воробьев А.А. и др., 2003).
Показатель РИП у больных атопическим дерматитом в начале лечения с вифероном (n=25) и без виферона (n=20) были соответственно 1:125,4±33,0 и 1:148,4±39,7 а после лечения среднее значение титров сыворотки крови достоверно поднялось соответственно до 1:453,1±67,9 и 1:253,2±35,2, что свидетельствует о частичном восстановлении врожденного иммунитета (рис. 1).
Рис. 1. Средние показатели РИП (двоичный логарифм разведения) у больных атопическим дерматитом до лечения с препаратом («Виферон») и со стандартом терапии (среднее геометрическое титров сыворотки крови) практически идентичны. После лечения среднее значение титров сыворотки крови достоверно поднялось. С «Вифероном» повышение РИП достоверно с p<0,001, а при стандартном методе лечения – достоверно с p0,003.
Наиболее низкие показатели (положительная гемагглютинация при титре сыворотки крови 1:8–1:16) наблюдались у больных атопическим дерматитом с тяжелым состоянием. При повторном обследовании (с 12 дневным интервалом) тех же больных с благоприятным течением болезни показатели реакции возрастали до значения 1:128–1:256. Выявлены индивидуальные показатели реакции у различных больных. У 3 больных с прогрессированием патологического процесса, не удавалось достигнуть удовлетворительной компенсации гомеостаза; показатели реакции у них на 12 сутки оставались на исходных цифрах или ухудшались. Интересно, что динамика показателей РИП имела тенденцию сходства с изменениями фагоцитарного числа у больных, леченых с применением Виферона. Так, фагоцитарное число у больных (n=25) атопическим дерматитом до и после лечения с вифероном соответственно составляло 3,8±0,2 и 4,5±0,3.
Таким образом, изменение показателей реакции иммуноприлипания титрационным способом может отражать уровень и взаимодействие компонентов врожденного иммунитета и служить прогностическим тестом течения заболевания. Реакция отличается простотой и легко выполнима в практических лабораториях. Повышенная восприимчивость пациентов с атопическим дерматитом к инфекционным поражениям кожи связана с TH2-типом иммунного ответа с интерлейкинами (IL-4 и IL-13), дефицитом антимикробных пептидов (Ong P.Y. et al., 2002; Nomura I. et al., 2003), а также с дефектами функций TH1 и цитотоксических T-лимфоцитов. Поэтому представляет интерес сопоставление особенностей течения атопического дерматита (как аллергического заболевания с преобладанием цитокинов TH2-типа, переходящего, при хронизации, в TH1-тип продукции цитокинов с образованием -интерферона) и псориаза (как иммунопатологического заболевания с преобладанием TH1-профиля, что обуславливает более редкие инфекции кожи, чем при атопическом дерматите).
С этих позиций определенный интерес предствляет состояние микрофлоры данных больных. Наиболее стабильным показателем микробной обсемененности кожи здоровой группы и группы больных, оказалась кокковая микрофлора (представители рода Staphylococcus) биотопа «предплечье/локтевая область». Мы исследовали микрофлору данного биотопа до и после лечения с помощью «Бактотестов» (рис. 2). До лечения из очагов поражения при атопическом дерматите часто выделялись штаммы S. aureus (свыше 70% обследованных), численность которых почти на 50% превышала носительство этих бактерий на участках непораженной кожи.
Коагулазоотрицательные виды стафилококков высевались от значительного числа больных (60 – 100% обследованных), причем в очагах поражения проявлялась тенденция вытеснения их более патогенным видом – S. аureus (табл. 1, 2). Анализ обсемененности стафилококками очагов поражения кожи больных атопическим дерматитом и больных псориазом выявил различия: частота выявления этих бактерий у больных псориазом была ниже, что может быть объяснено повышенной активностью антимикробных пептидов при псориазе.
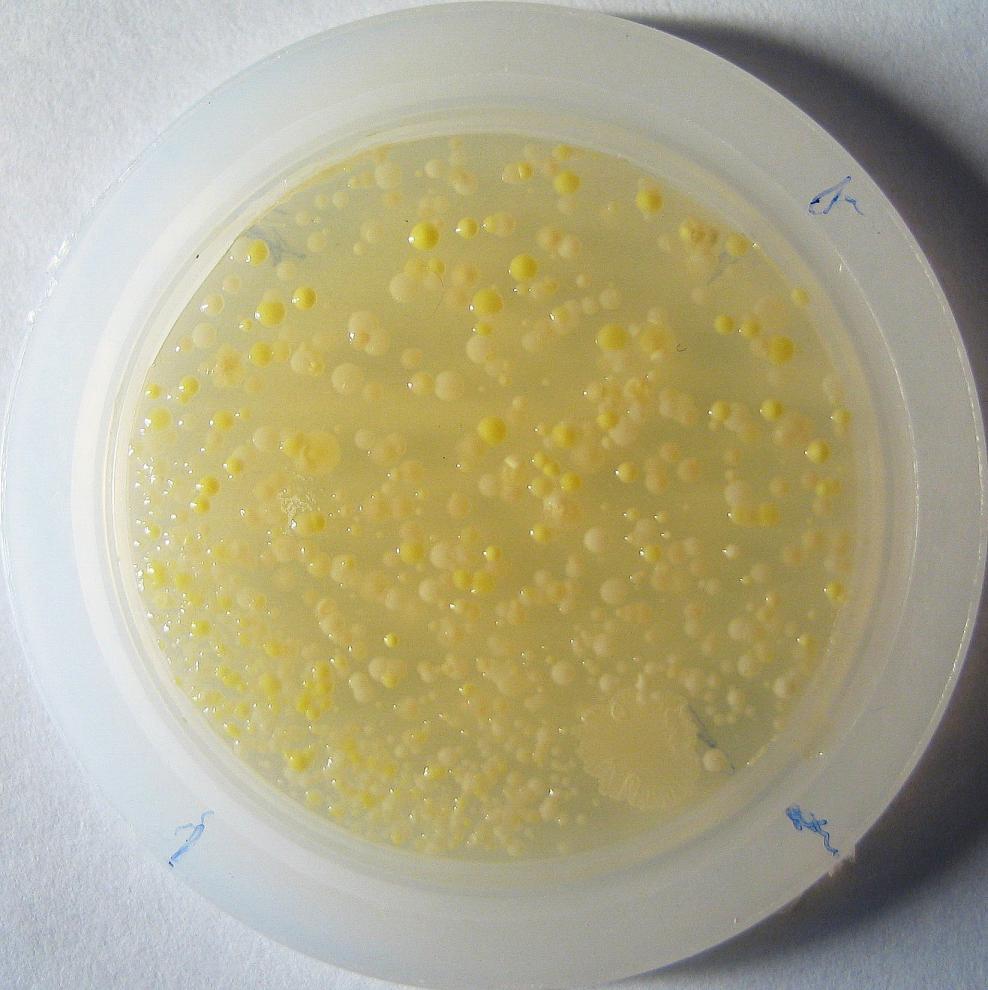
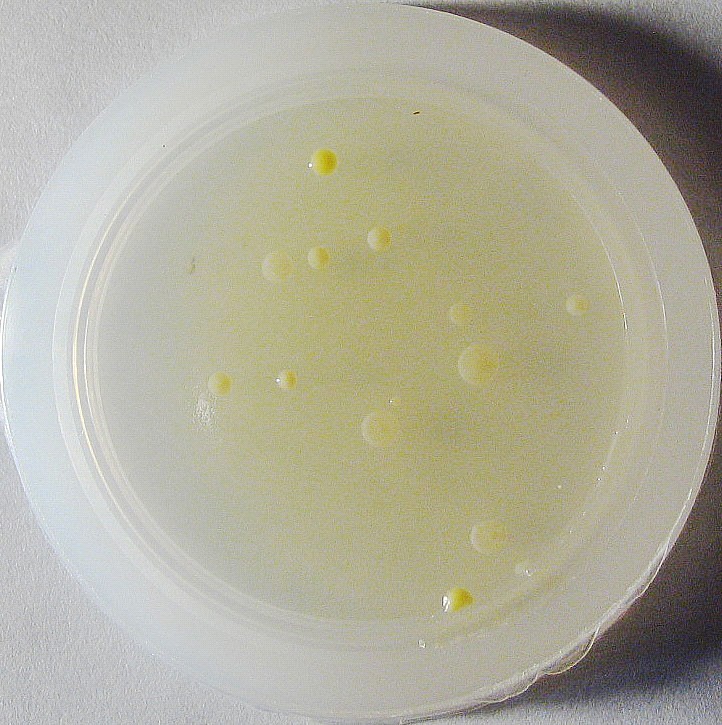
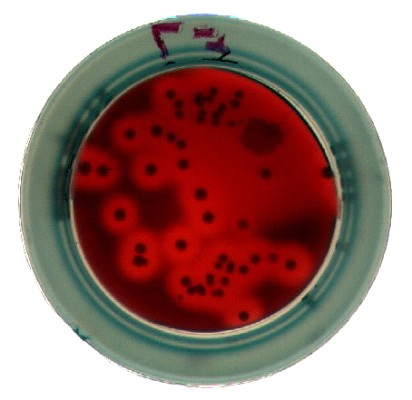
Рис. 2. Рост колоний микрофлоры кожи на «Бактотестах» с различными средами
Таблица 1.
Частота выделения стафилококков из пораженных* и не пораженных участков кожи: в группе больных атопическим дерматитом (n=30) до и после лечения с включением Виферона (приведены данные исследования пораженных/здоровых участков кожи); в контрольной группе (n=20); в группе больных псориазом (n=21).
| Стафилококки | Больные атопическим дерматитом | Контрольная группа (абс/%) | Р (до лечения/ контроль-ная группа | Больные (псориаз) до лечения (абс/%) | |
| До лечения (абс/%) | После лечения (абс/%) | ||||
| S. aureus | 22/73,3* 8/26,6 | 9/30* 5/16,6 | 3/15 | <0,001 | 8/38* |
| Коагулазоотри-цательные стафилококки | 20/66,6* 18/60 | 27/90* 30/100 | 18/90 | 19/90,4 | |
*----данные исследования: пораженных участков кожи*/не пораженных участков кожи.
Действительно, в нормальной коже такие антимикробные пептиды, как кателицидины (LL-37), дефенсины и другие незначительны. Они обычно продуцируются кератиноцитами и накапливаются в коже в ответ на воспалительные стимулы типа псориаза (Lande R. et al., 2007). Уровень микробной обсемененности кожи у больных псориазом при поступлении превышал данный показатель у лиц без патологии кожи, но был ниже чем у больных атопическим дерматитом. Среднее количество колоний, выросших на питательных средах колебалось от единиц до несосчитываемого количества (сплошной рост).
Таблица 2.
Частота выделения стафилококков из пораженных* и не пораженных участков кожи:
- в группе больных атопическим дерматитом (n=20) до и после лечения без включения виферона (приведены данные исследования пораженных/здоровых участков кожи);
- в контрольной группе (n=20);
- в группе больных псориазом (n=21)
| Стафилококки | Больные атопическим дерматитом | Контрольная группа (абс/%) | Р (до лечения/ контроль-ная группа) | Больные (псориаз) до лечения (абс/%) | |
| До лечения (абс/%) | После лечения (абс/%) | ||||
| S. aureus | 15/75* 5/25 | 9/45* 5/25 | 3/15 | <0,001 | 8/38* |
| Коагулазоотри-цательные стафилококки | 17/85* 14/70 | 18/90* 19/95 | 18/90 | 19/90,4 | |
*----данные исследования: пораженных участков кожи*/не пораженных участков кожи.
На пораженных участках кожи больных атопическим дерматитом среднее количество колоний до лечения было повышенным, а после лечения с вифероном снижалось почти в два раза (табл. 1). В группе больных, леченых без виферона тенденция снижения микробной обсемененности была менее выраженной. На участках здоровой кожи отчетливых различий не установлено. Таким образом, включение Виферона в схему лечения больных атопическим дерматитом способствует нормализации состояния стафилококковой микрофлоры – одного из основных показателей состояния микробиоценоза кожи.
Методом электронной микроскопии ультратонких срезов бактерий в сочетании с методами иммунологического анализа мы установили различные эффекты опсонизации микробов. Грамположительные бактерии (стафилококки и стрептококки) неспецифически адсорбировали гуморальные факторы защиты организма и более интенсивно фагоцитировались по сравнению с грамотрицательными бактериями. Так, стафилококки, обработанные сывороткой крови, неспецифически адсорбировали белки сыворотки крови (иммуноглобулины, 2-макроглобулин, комплемент, альбумин и др.) в виде капсулоподобного покрова, условно названного ранее иммуноглобулиновым покровом (Воробьев А.А. и соавт., 2006).
Как лабораторные штаммы стафилококков, так и стафилококки и стрептококки, выделенные с кожи больных атопическим дерматитом, псориазом и здоровых людей неспецифически адсорбировали антитела люминесцирующих сывороток против иммуноглобулинов человека. Была также выявлена адсорбция альбумина, меченного родамином. Стафилококки, обработанные в течение 5 минут сывороткой крови как здоровых лиц, так и больных атопическим дерматитом или псориазом, были способны к иммунному прилипанию к добавленным аутологичным эритроцитам (рис. 3,4).
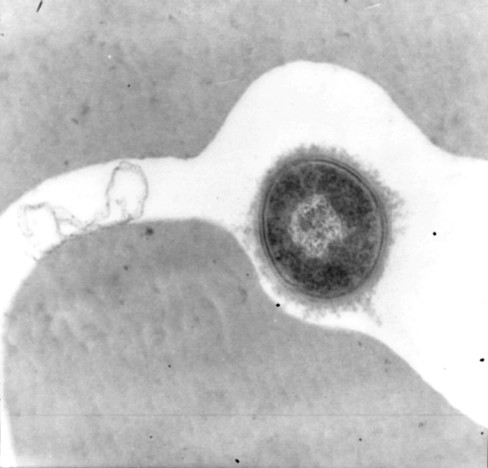
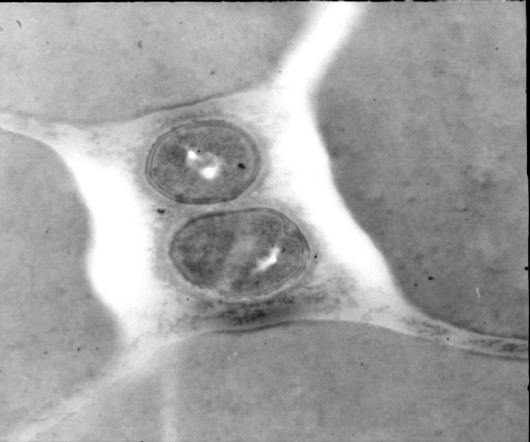
Рис. 3, 4. Взаимодействие стафилококков, иммуноглобулинового покрова (ИП) и эритроцитов (РИП). Электронная микроскопия ультратонкого среза стафилококков, инкубированных с сывороткой и форменными элементами крови.
Данный феномен не наблюдался при прогревании сывороток крови при 56 °С вследствии инактивации комплемента. Электронная микроскопия ультратонких срезов позволила выявить появление на бактериях иммуноглобулинового покрова, способствующего иммунному прилипанию их к фагоцитам и эритроцитам. Иммуноглобулиновый покров откладывался на бактериальных клетках неравномерно: в области формирования перегородок деления и некоторых других участках поверхности бактерий толщина этого покрова доходила до 200 нм, что можно объяснить взаимодействием белков крови с продуктами метаболизма локальной выбрасываемых бактериальной клеткой.
В сыворотке крови больных происходило увеличение 2-макроглобулина, по сравнению с контрольной группой, что свидетельствует о вовлечении в патогенез атопического дерматита данного важного фактора врожденного иммунитета. Альфа2-макроглобулин является одним из основных наиболее универсальных ингибиторов протеиназ плазмы. Он обладает широким спектром активности: ингибирует бактериальные и эукариотические эндопептидазы, участвует в удалении активированных протеиназ из кровотока, в иммунном ответе и метаболизме соединительной ткани (Armstrong P.B., Quigley J.P., 1999). Поглощение комплекса антигена и 2-макроглобулина усиливает иммунный ответ в результате презентации процессированного антигена молекулами MHC II.
Наши исследования свидетельствуют о том, что в формировании биологической пленки на слизистых оболочках и коже, кроме нормальной микрофлоры и микробного гликокаликса, принимают участие и гуморальные факторы организма, адсорбированные на микробных клетках. Таким образом, электронномикроскопическое изучение ультратонких срезов стафилококков, выделенных от больных, а также изучение реакции иммунофлюоресценции и световой микроскопии, позволило нам выявить отложение гуморальных факторов защиты и секретов кожи на поверхности бактерий в виде капсулоподобного покрова толщиной до 50 – 150 нм. Факт связывания in situ представителями микрофлоры гуморальных факторов защиты организма (иммуноглобулинов, комплемента, коллектинов, альбумина, 2-макроглобулина и цитокинов) следует учитывать при лечении аллергодерматозов.
Мы исследовали адсорбционную способность клеток S. aureus (штамм Wood-46 и клинический штамм, выделенный от больного С.) по отношению к компонентам сыворотки крови больных атопическим дерматитом и псориазом. Исследовано по 10 сывороток крови каждой группы больных. Оказалось, что сыворотки крови, как больных атопическим дерматитом, так и псориазом, обработанные суспензией разных штаммов стафилококков, «истощались» по отношению к 2-макроглобулину на 20 – 30%, а по отношению к IgG – на 36 – 40%. Проведенное нами исследование сывороток крови больных атопическим дерматитом показало достоверное снижение 2-макроглобулина (p<0,001) в процессе лечения Вифероном (табл. 3). Выявленная динамика изменения уровня альфа2-макроглобулина в сыворотках крови больных с атопическим дерматитом демонстрирует вовлеченность в патогенез атопического дерматита этого важного фактора врожденного иммунитета.
Таблица 3.
Показатели содержания альфа2-макроглобулина в сыворотке крови больных атопическим дерматитом до и после лечения с вифероном
| Фактор врожденного иммунитета | До лечения (г/л) | После лечения (г/л) | Норма (г/л) |
| Альфа2-макроглобулин (муж., n=10) | 2,2±0,4 | 1,5±0,2 | 1,19-2,54 |
| Альфа2-макроглобулин (жен., n=10) | 2,5±0,4 | 1,6±0,3 | 1,32–3,01 |
Иммуноглобулиновый покров, откладывающийся in situ на бактериях, очевидно, участвует в иммунном прилипании (за счет активации комплемента),
«впитывает и складирует» in situ антимикробные пептиды, альфа2-макроглобулин и цитокины, продуцируемые клетками воспалительного инфильтрата. Не исключено, что недавнее обнаружение инициации аллергенами окружающей среды иммунного ответа на эндогенные антигены (аутоаллергены) человека, связано с активацией антигенпрезентирующих клеток иммунными комплексами, расположенных на бактериях в виде иммуноглобулинового покрова. То есть, возможно развитие аутоиммунного процесса. Иммуноглобулиновый покров бактерий, по-видимому, включает разнообразные опсонины, которые, связываясь с поверхностью микробов, облегчают их фагоцитоз. К ним относятся C1q комплемента, ЛПС-связывающий белок, маннозосвязывающий лектин, фиколины и другие. Поэтому, при рассмотрении патогенеза и тактики терапии аллергодерматозов следует учитывать новые данные в отношении многочисленных антимикробных и опсонизирующих факторов, изменяющих in situ биологические свойства микробов.
Другим аспектом проблемы является особенность взаимоотношений микрофлоры кожи друг с другом и с защитными факторами организма. Ранее с помощью электронной микроскопии ультратонких срезов было показано, что стафилококки адсорбируют вирионы вируса гриппа посредством иммуноглобулинового покрова. В исследованиях, проводимых совместно с В.К. Солнцевой нами была показана способность клещей рода Demodex, обитающих на коже, адсорбировать факторы иммуноглобулинового покрова и стафилококки (Воробьев А.А. и др., 2006). Известна передача вируса гепатита B не только с кровью, но и через пот (Bereket-Ycel S, 2007). В поте кожи обнаружены антимикробные пептиды (Хаитов Р.М., 2002), иммуноглобулины классов А и G, трансферин, лизоцим, органические кислоты и другие противомикробные вещества (Нормейн Р.Х., Асгар С.С., 1983). Таким образом, с учетом полученных результатов, стафилококки, обитающие на коже, могут рассматриваться как определенный эпидемиологический фактор, участвующий в распространении коинтегрированных вирусов и антигенов среди людей.
Для анализа эффективности лечения больных атопическим дерматитом мы использовали РИП и оценку микробного фактора, сопоставляя данные клинических (индекс SCORAD) и иммунологических (иммунный статус) показателей, полученных до и после лечения альфа-интерферон-содержащим препаратом (Вифероном). Нас заинтересовало появление отдельных сведений о положительном влиянии альфа-интерферона на течение атопического дерматита, особенно при развитии осложнений. Тем более, что альфа-интерферон индуцирует экспрессию антигенов MHC I, усиливает продукцию гамма-интерферона NK-клетками и TH1, а также противоопухолевое и антимикробное действие дендритных клеток, макрофагов, NK-клеток и клеток воспаления (Decker T. et al., 2005). Одним из новых подходов в лечении аллергии является применение IFN-, который считается важным цитокином, стимулирующим развитие клеточного иммунитета за счет активации TH1 (Симбирцев А.С., 2007). Он участвует в регуляции поляризации T-хелперов (CD4+), усиливая роль TH1 и клеточного. Образуемый в течение бактериальных инфекций интерферонпродуцирующими клетками (iPCs) IFN- может активировать NK и TH1 как продуцентов ИФН-. Последний усиливает противобактериальный иммунитет, например через активацию макрофагов (Decker T., et al., 2005).
При терапии 30 больных атопическим дерматитом наряду со стандартной терапией мы назначали Виферон (ежедневно по 1 суппозиторию в дозе 1000000 МЕ в течение 10 дней). Группа сравнения состояла из 20 больных атопическим дерматитом, получавших стандартную терапию (антигистаминные, седативные и энтеросорбентные средства, наружную терапию). Переносимость «Виферона» у всех больных была хорошей, побочных эффектов не наблюдалось. Введение Виферона вызывало положительную динамику исследуемых показателей, что сопровождалось возрастанием титров сыворотки крови в РИП, а также снижением уровня микробной обсемененности кожи и частоты развития вторичной инфекции. После проведения курса терапии атопического дерматита (с включением Виферона) выявилась тенденция к восстановлению уровня нормофлоры кожи, что проявилось в снижении микробной колонизации кожи. Так, количественный уровень микробной обсемененности снизился в 1,5 – 2 раза по изученным биотопам кожи. При этом новые отдаленные бактериальные и вирусные осложнения не возникали, в отличие от осложений, встречающихся при проведении стандартной терапии без Виферона. Полученные результаты (табл. 2) косвенно подтверждают данные литературы о нормализующем действии альфа-интерферона при атопическом дерматите.
Сравнительный анализ иммунного статуса у больных атопическим дерматитом, леченных Вифероном, выявил положительные изменения по показателям интерферона, IgE, РИП, 2-макроглобулину и SCORAD. Достоверных изменений содержания Т- и В-лимфоцитов выявить не удалось (табл. 4). В сыворотке крови больных атопическим дерматитом при лечении с Вифероном увеличились титры сывороток крови в РИП до разведений близких к титрам сывороток крови здоровых лиц; достоверно снижался показатель SCORAD. Происходило достоверное снижение 2-макроглобулина (p<0,001), обычно мало изменяемого белка острой фазы. Уменьшение содержания 2-макроглобулина в пределах нормы может свидетельствовать о нормализации воспалительного процесса под влиянием терапии атопического дерматита.
Таблица 4.
Показатели обследования больных атопическим дерматитом двух групп больных со стандартным лечением и лечением с вифероном (приведены показатели до и после лечения).
| Показатели (до и после лечения) | Лечение с вифероном n=30 | Стандартное лечение n=12 | Норма | ||
| Медиана | Нижняя – верхняя гр. | Медиана | Нижняя–верхняя гр. | ||
| IFN- до лечения и после лечения | 128 256* | 27 – 256 64 – 512 | 256 64* | 64 – 512 32 – 128 | 128 –512 Ед/мл |
| IFN- до лечения и после лечения | 32 32 | 16 – 64 16 – 64 | 64 32 | 16 – 128 8 – 64 | 32 – 128 Ед/мл |
| ИЛ-4 до лечения ИЛ-4 после лечения | 22 10 | 10 – 50 10 – 29 | 10 10 | 10 – 137 10 – 10 | 0 – 20 пкг/мл |
| IgE до лечения IgE после лечения | 350 230 | 210 – 414 134 – 409 | 300 310 | 180 – 680 74 – 483 | до 130 МЕ/мл |
| IgG до лечения IgG после лечения | 10,5 12 | 8,8 – 12,5 10 – 13,5 | 11,3 11 | 9,6 – 12 9,2 – 13,3 | 12 – 14 г/л |
| IgM до лечения IgM после лечения | 1,2 1,4 | 0,98 – 1,5 1,0 – 2,0 | 0,9 1,0 | 0,66 – 1,62 0,76 – 2,2 | 1,3 – 1,7 г/л |
| IgА до лечения IgА после лечения | 1,8 1,5 | 1,4 – 2,0 1,1 – 1,75 | 1,7 1,6 | 1,1 – 1,9 1,1 – 2,4 | 2,1 – 2,9 г/л |
| SCORAD до и после лечения | 50 32 | 47 – 52 28 – 36 | 48 33 | 42 – 57 29 – 38 | |
*Достоверно отличается от исходного значения – p<0,05.
Влияние цитокиновой цепи на течение атопического дерматита мало изучено. Следует учитывать их иммуномодулирующее действие. Так, IFN- и TNF, образуемые вначале иммунного ответ, являются мощными активаторами NK-клеток — главных источников IFN- задолго до начала его синтеза T-лимфоцитами (Хаитов Р.М., Пинегин Б.В., 2003). Поэтому иммуномодулирующее и противовирусное действие интерферонов могут оказывать благоприятный фон для эффективной терапии атопического дерматита и профилактики инфекционных осложнений. IFN- предположительно относится к активаторам генерации регуляторных T-лимфоцитов, которые характеризуются толерогенной активностью при некоторых аутоиммунных и аллергических заболеваниях. Предполагается, что приемы, активирующие регуляторные T-лимфоциты, могут подавлять и контролировать аллергию (Симбирцев А.С., 2007).
Таким образом, при остром течении атопического дерматита целесообразно применение Виферона, который обладает строго направленным иммунозаместительным действием, иммуномодулирующим и протективным эффектом. Он не имеет побочных действий, характерных для рекомбинантных ИФН, к нему не вырабатываются инактивирующие антитела. Форма введения препарата в виде ректальных суппозиториев обеспечивает его эффективность при приеме с интервалом в 24 часа и является удобной в применении по сравнению с парентеральным введением. Общепризнанной целью терапии атопического дерматита является: восстановление структуры и функции кожи; предотвращение развития тяжелых форм заболевания; лечение сопутствующих заболеваний. На наш взгляд показанием для применения Виферона в комплексном лечении атопического дерматита является обострение процесса, непрерывно рецидивирующее течение аллергодерматоза с вторичным инфицированием и персистенцией возбудителей.
ВЫВОДЫ
- Получено патогенетическое обоснование включения Виферона в виде ректальных суппозиторий в комплексную терапию атопического дерматита у взрослых.
- Частота выявления S. aureus у больных атопическим дерматитом была выше чем у больных псориазом, что свидетельствует о более выраженном снижении местной антимикробной защиты чем при псориазе и является обоснованием проведения терапии, усиливающей иммунитет при атопическом дерматите.
- На фоне терапии больных атопическим дерматитом Вифероном в форме ректальных суппозиторий отмечается деконтаминация S. aureus, уменьшение проявлений кожного синдрома и нормализация лабораторных показателей, касающихся оценки состояния врожденного иммунитета (восстановление показателей реакции иммунного прилипания и нормальной микрофлоры кожи).
- Впервые выявлено, что стафилококки способны участвовать в адсорбции важного фактора врожденного иммунитета альфа2-макроглобулина в составе с другими белками крови в виде капсулоподобной структуры, образующейся в условиях постановки реакции иммунного прилипания.
- Установлена интенсивная адсорбция стафилококками кожи различных белков крови in situ и ex vivo-системе, которая может приводить к изменению их биологических свойств (способность участвовать в феномене иммунного прилипания и др.) и возможно является триггером формирования аутоантител при атопическом дерматите в результате сложных взаимодействий в системе «иммуноглобулинового покрова» (гуморальные факторы и продукты секреции бактериальной клетки).
- Показано, что реакция иммуноприлипания в титрационном варианте может применяться для оценки состояния гуморальных факторов врожденного иммунитета и прогноза лечения больных атопическим дерматитом.
Практические рекомендации
- С целью повышения эффективности лечения атопического дерматита и профилактики осложнений рекомендуется включать в терапию препарат «Виферон» в виде ректальных суппозиторий.
- Для повышения эффективности применения препарата «Виферон» у больных атопическим дерматитом целесообразно проводить оценку иммунологического статуса до начала терапии и назначать препарат в соответствии с исходным уровнем иммунологических показателей крови.
- В схему обследования и контроля лечения атопического дерматита рекомендуется включать постановку реакции иммуноприлипания, как прогностический тест течения патологического процесса и эффективности лечения пациента.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Быков А.С., Солнцева В.К., Воробьев А.А., Быков С.А. Свойства поверхностных структур бактерий // Материалы XVIII Российской конф. по электронной микроскопии. – Черноголовка, июнь, 2000, С. 215.
- Солнцева В.К., Быков А.С., Воробьев А.А., Иванов О.Л., Солнцев В.В.,
Быков С.А. Микробиоценоз кожи больных хроническими дерматозами // Ж. Микробиологии., эпидемиологии. и иммунобиологии – 2000 – №6 – С. 51-55.
- Солнцева В.К., Быков С.А. Особенности микрофлоры кожи при хронических дерматозах // Материалы международной конф. студентов и аспирантов по фундамент. наукам. «Ломоносов». Изд. Моск. Университета 2000. – Вып. 4. – С. 503.
- Атлас-руководство для врачей и студентов: Медицинская микробиология, иммунология и аллергология / Быков А.С., Пашков Е. П., Воробьев А.А., Караулов А.В., Быков С.А., Корн М.Я // Электрон. опт. диск (CD-ROM). Рег. № 2001610396 РОСПАТЕНТА. Изд. ДиаМорф. М., 2002.
- Атлас по медицинской микробиологии, вирусологии и иммунологии: учебн. пособие / Быков А.С., Пашков Е. П., Воробьев А.А., Корн М.Я, Быков С. А. (Медицинская микробиология); Воробьев А.А., Быков А.С., Караулов А.В.,
Быков С.А. (Иммунология и аллергология) // М.: МИА, 2003, – 236 с.
- Быков С.А., Солнцева В.К. Иммунобиологические особенности микрофлоры кожи и клещей рода Demodex // Материалы III Конф. молодых ученых России с международным участием Москва, января, 2004, – С. 104-106.
- Быков А.С., Караулов А.В., Воробьев А.А., Быков С.А. Лиганд-рецепторные взаимодействия микробов и защитных факторов организма // Тезисы: 1 международная конф. «Молекулярная медицина и биобезопасность. Москва, октябрь, 2004, – С. 39-40.
- Быков С.А., Молочков А.В., Караулов А.В. Возможности иммунотерапии атопического дерматита с учетом его иммунопатогенеза. Российская научно-практическая конференция дерматовенерологов // Санкт-Петербургские дерматологические чтения. СПб, сентябрь, 2005, – С. 9-10.
- Быков С.А. Иммунобиологические особенности взаимоотношений микрофлоры кожи и защитных факторов организма при атопическом дерматите. // Санкт-Петербургские дерматологические чтения. СПб, сентябрь, 2005, – С. 10.
- Быков С.А., Молочков А.В., Караулов А.В. Подходы к иммунотерапии атопического дерматита // Материалы 5-ой научно-практической конференции «Терапия социально значимых заболеваний в дерматовенерологии». Сборник тезисов. Новые лекарственные препараты и средства в дерматологии и косметологии. Москва, сентябрь, 2005. – С. 13-14.
- Быков А.С., Караулов А.В., Воробьев А.А. Быков С.А. Взаимоотношения микроорганизмов и защитных факторов макроорганизма. // Материалы II–ой международной конф. «Молекулярная медицина и биобезопасность». Москва, октябрь, 2005. – С. 96-97.
- Bykov S.A. Microbes and protective factors of macroorganism Abstract of the Congress «Immune-mediated diseases: from Theory to Therapy // Moscow, October, 2005, – С. 55.
- Воробьев А.А., Быков А.С., Караулов А.В., Быков С.А., Корн М.Я. Иммунология и аллергология // М. Практическая медицина, 2006. – 290 с.
- Быков С.А. Караулов А.В., Бактерии и факторы врожденного иммунитета // Тезисы: Российский медицинский форум. «Фундаментальная наука и практика». Москва, октябрь, 2006. – С. 18-19.
- Быков С.А. Молочков А.В., Малиновская В.В., Шевченко О.П. Иммунобиологические особенности атопического дерматита и возможности терапии // Альманах клинической медицины. Том XV Москва 2007, – С. 144-150
- Быков С.А. О взаимодействии опсонизирующих факторов и микроорганизмов // Российский аллергологический журнал, – 2007, №3, приложение 1. Труды VIII Конгресса. Современные проблемы аллергологии, иммунологии и иммунофармакологии. Москва, июнь, 2007. – С. 16-17.
- Быков С.А., Караулов А.В. Иммунопатогенез атопического дерматита и возможности терапии. // Российский аллергологический журнал, 2007, №3, приложение 1. Труды VIII Конгресса. Современные проблемы аллергологии, иммунологии и иммунофармакологии. Москва, июнь, 2007, – С. 132-133
- Атлас по медицинской микробиологии, вирусологии и иммунологии; учебн. пособие / Быков А.С., Пашков Е. П., Воробьев А.А., Зверев В.В., Быков С. А., Корн М.Я. (Медицинская микробиология); Быков А.С., Караулов А.В., Воробьев А.А., Быков С.А. (Иммунология и аллергология) // М. МИА, 2008, – 247с.
- Быков С.А. Лечение больных атопическим дерматитом с применением виферона. // Вестник российской академии медицинских наук, – 2008, №6, приложение. Фундаментальные науки и прогресс клинической медицины. V Конференция молодых ученых России с международным участием. Москва, май, 2008г.). – С. 78-79.
Список сокращений, принятых в диссертации
АПК – антигенпрезентирующая клетка
РИП – реакция иммуноприлипания
РИФ – реакция иммунофлюоресценции
ИФН (IFN) – интерферон
ЛПС – липополисахарид

