Патогенетические особенности воспаления и методы его коррекции при ремиссии и обострении хронической герпетической инфекции
На правах рукописи
ОБУХОВА
Ольга Олеговна
ПАТОГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ ВОСПАЛЕНИЯ И
МЕТОДЫ ЕГО КОРРЕКЦИИ ПРИ РЕМИССИИ И ОБОСТРЕНИИ ХРОНИЧЕСКОЙ ГЕРПЕТИЧЕСКОЙ ИНФЕКЦИИ
14.00.16 – патологическая физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Новосибирск – 2009
Работа выполнена в Научном центре клинической и экспериментальной медицины Сибирского отделения Российской академии медицинских наук (Новосибирск)
Научный консультант:
доктор медицинских наук,
профессор Трунов Александр Николаевич
Официальные оппоненты:
доктор медицинских наук,
профессор Сафронов Игорь Дмитриевич
член-корреспондент РАМН,
доктор медицинских наук,
профессор Любарский Михаил Семенович
доктор медицинских наук,
профессор Поляков Лев Михайлович
Ведущее учреждение: Государственное образовательное учреждение высшего профессионального образования «Новосибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» (Новосибирск).
Защита состоится « 02 » июня 2009г. в 1000 часов на заседании диссертационного совета Д 001.048.01 в Научном центре клинической и экспериментальной медицины СО РАМН по адресу: ул. Академика Тимакова, 2, Новосибирск, 630117.
Тел/факс 8 (383) 333-64-56
С диссертацией можно ознакомиться в библиотеке Научного центра клинической и экспериментальной медицины СО РАМН.
Автореферат разослан «____» ____________ 2009 г.
Ученый секретарь
диссертационного совета
доктор биологических наук  Пальчикова Наталья Александровна
Пальчикова Наталья Александровна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Не вызывает сомнения, что в современном индустриальном обществе хронические инфекционно-воспалительные патологические процессы, в том числе и вирусной этиологии, занимают значительное место в общей структуре заболеваемости. Многими исследователями широкое распространение процессов хронизации связывается с несвоевременным и неадекватным лечением острых инфекционно-воспалительных процессов, развивающихся на фоне несовершенного иммунного ответа на этиологический фактор, который обладает низкоиммуногенными свойствами и эволюционно сформировавшейся способностью «ускользать» из-под контроля иммунной системы. Кроме того, постоянное воздействие комплекса негативных антропогенных факторов приводит к истощению и срыву адаптационных возможностей организма, а иммунная система человека является наиболее чувствительной к воздействию ксенобиотических факторов, что проявляется в нарушении иммунорегуляторных механизмов, участвующих в дифференцировке иммунокомпетентных клеток и межклеточной кооперации (Авцын А.П., 1977; (Хаитов Р.М., Пинегин Б.В., 2000;. Кеворков Н.Н., Черешнев В.А., 2001; Винокуров М.Г., 2002; Трунова Л.А. и др., 2003; Михайленко А.А., 2004).
По данным глобального обзора герпесвирусных исследований, инфицированность и заболеваемость ими человечества из года в год нарастают, опережая скорость прироста населения Земли, в связи с чем, проблема герпесвирусной инфекции приобретает медико-социальный характер, а многообразие клинических проявлений, особенности возбудителей, возможность их распространения практически всеми известными путями передачи позволили Европейскому региональному бюро ВОЗ отнести герпесвирусные инфекции в группу болезней, которые определяют будущее инфекционной патологии в текущем столетии (Шульженко А.Е., 2004; Железникова Г.Ф., 2005; Arduino P.G., et. al., 2004; Vgyrkonyi V., 2006; Porter S.R., 2006).
Значимым для науки и практического здравоохранения является изучение патогенеза инфекционных заболеваний, вызываемых вирусами простого герпеса на современном научно-методическом уровне. Развитие данной группы заболеваний происходит на фоне нарушений в иммунном реагирования, что приводит к возникновению хронического рецидивирующего патологического процесса с постоянными обострениями, в основе которых лежит длительная персистенция слабоиммуногенных вирусных антигенов (Латышева Т.В., Хутиева Л.М., 2001; Шульженко А.Е., 2004; C.M., Давтян Т.К. и др., 2005; Новиков Д.К., 2005; Boswell C.M. et.al., 1999; Corey L., Handsfield H.H., 2000 Carrillo-Infante C., 2007). В тоже время, необходимо отметить, что имеет место не только возрастание количества пациентов с хронической герпетической инфекцией, но также значительно более тяжелое ее течение (Латышева Т.В., Хутиева Л.М., 2001; Редькин Ю.В. и др., 2006; Самгин М.А., Халдин А.А., 2002; Ball S.C., 2001; Corey L., 2000, 2002; Hjalmarsson A, 2007).
Известно, что, попав в организм, вирус простого герпеса (ВПГ, HSV) может находиться в нем в течение всей жизни в неактивном (латентном) состоянии, что связано с механизмами персистенции, реактивации и репликации вируса при наличии нормальных вирусоспецифических реакций организма (Халдин А.А., 2000, 2002; Шульженко А.Е., 2004; Ball S.C., 2001; Divito S. et.al., 2006; Arena A. et.al, 2007; Sheridan B.S. et.al., 2007; van den Driessche P. et.al., 2007).
Остается неясным механизм неполной элиминации вируса как при первичном заражении при сохраненной реактивности организма, так и при рецидивах ВПГ-инфекции в условиях полного набора анти-ВПГ-иммунных реакций. Вероятно, это может быть связано со способностью вируса ускользать из-под иммунного надзора из-за низкой иммуногенности вируса и, как следствие этого, имеют место нарушения в макрофагальной фазе иммунного ответа, дефекты формирования специфической фазы и развитие синтеза низкоаффинных и слабоспецифичных антител, не обладающих нейтрализующими свойствами (Сухих Г.Т. и др. 2000; Баринский И.Ф., 2004; Шульженко А.Е., 2005; Zinkernagel R.M., 2001, 2005; Broketa M.M. et.al., 2000, Lavrov V.F. et.al., 2006; Lindsay M.K., 2006; Chapman M.D., Thompson E.J. et.al., 2007).
При достаточно большом количестве научных исследований, до настоящего времени, остаются недостаточно изученными механизмы протективного иммунитета как основы эффективного излечения больного, а также роли нарушений в цитокиновой сети в патогенетических механизмах развития хронической герпетической инфекции (Серебряная Н.Б., 2005; Ito M. et.al., 1998; LeBlanc R.A., Pesnicak L., et. al., 1999; Inagaki-Ohara K., Daikoku T. et.al., 2000; Harandi A.M., Svennerholm B. et.al., 2001; Deshpande S.P. et.al., 2002; Iwasaki A., 2003; Corey L., 2007; Uchakin P.N. et.al., 2007).
Многие аспекты патогенеза хронической герпетической инфекции остаются до конца не раскрытыми, а исследований патогенетических особенностей механизмов клинической ремиссии патологического процесса, во многом, определяющего дальнейшее развитие заболевания, практически не проводилось.
Все большее значение придается использованию в лечении не только противовирусных химиопрепаратов, но и патогенетически обоснованных методов лечения, способных регулировать баланс медиаторов межклеточных взаимоотношений – цитокинов, участвовать в нормализации функционального состояния иммунной системы (Gladko O.V. et.al., 2002; Hengge U.R., Ruzicka T., 2004; Miller R.L. et.al., 2002; Patel R. et.al., 2007; Tempesta M. et.al., 2007). Для этих целей достаточно широко используют стимуляторы макрофагальной фазы иммунного реагирования (Percival S.S. 2000; Kislova L.K., 2003; Naser B. et.al., 2005; Raduner S. et.al., 2006; McCann D.A. et.al., 2007). Однако авторы приводят разноречивые данные относительно механизмов влияния препаратов этой группы на активность деструктивно-воспалительного процесса при герпетической инфекции (Vonau B. et.al., 2001; Schwarz E. et.al., 2005; Matthias A. et.al., 2007), а данные по их применению у пациентов с клинической ремиссией патологического процесса практически отсутствуют.
Вышеизложенное определило актуальность дальнейшего углубленного изучения механизмов развития иммуновоспалительного процесса в патогенезе обострения и клинической ремиссии хронической герпетической инфекции и разработки новых патогенетически обоснованных подходов к лечению и реабилитации, и позволило сформулировать цель и задачи настоящего исследования.
Цель работы. Изучить особенности воспалительного процесса и иммунного реагирования в патогенезе ремиссии и обострения хронической герпетической инфекции и разработать новые патогенетически обоснованные подходы их коррекции.
Задачи исследования:
- Изучить активность воспалительного процесса у пациентов c ремиссией и обострением хронической герпетической инфекцией путем определения в сыворотке крови концентраций и баланса провоспалительных и противовоспалительных цитокинов, уровней содержания аутоантител к антигенам нативной и денатурированной ДНК.
- Оценить функциональное состояние иммунной системы путем определения концентраций регуляторных цитокинов; уровней специфических противогерпетических антител и степени их авидности, содержания циркулирующих иммунных комплексов в сыворотке крови пациентов с ремиссией и обострением хронической герпетической инфекции.
- Провести сравнительный анализ клинико-иммунологических показателей активности воспалительного процесса и иммунного реагирования у пациентов в период ремиссии и при обострении хронической герпетической инфекции.
- Разработать патогенетически обоснованную схему коррекции выявленных нарушений с использованием индуктора макрофагальной фазы иммунного ответа и изучить его влияние на клинико-иммунологические проявления воспаления при хронической герпетической инфекции в различные периоды заболевания после проведенной коррекции.
- Разработать диагностический комплекс обследования пациентов с хронической герпетической инфекции для оценки исходного статуса и эффективности проводимой коррекции.
Научная новизна. Впервые у пациентов с ремиссией хронической герпетической инфекции было установлено повышение в сыворотке крови, относительно величин показателей в норме, концентраций провоспалительных цитокинов ИЛ-1, ИЛ-6, содержания маркеров клеточной деструкции, аутоантител к антигенам нативной и денатурированной ДНК, концентраций индукторов гуморального и клеточного звеньев иммунной системы ИЛ-2, ИЛ-4, ИФН-, содержания циркулирующих иммунных комплексов и специфических противогерпетических антител. Полученные данные, свидетельствуют о том, что, несмотря, на отсутствие клинических проявлений хронической герпетической инфекции, в организме у обследованных пациентов сохраняется активность деструктивно-воспалительных процессов, стимуляция иммунного реагирования и противогерпетической защиты, которая является низкоэффективной, так как не приводит к полной элиминации этиологического фактора. Вышеизложенное является подтверждением постулата о непрерывности развития патологического процесса даже в периоде клинического благополучия.
Показано, что основным отличием стадии обострения хронической герпетической инфекции, от клинической ремиссии патологического процесса, является 2-3 кратное повышение концентраций основного провоспалительного цитокина ИЛ-1 в сыворотке крови, что определяет выраженность воспалительного процесса на этой стадии заболевания.
Впервые показано, что использование у пациентов с клинической ремиссией и обострением хронической герпетической инфекции индуктора макрофагальной фазы иммунного ответа по предлагаемой схеме (1 капсула 2 раза в сутки – 1 день и по 1 капсуле 1 раз в сутки – 4 дня) приводит к снижению активности воспалительного процесса и стимуляции специфической противовирусной резистентности организма, вне зависимости от клинической стадии патологического процесса. Указанное подтверждается снижением на 7, 14 и 21 дни после окончания курса коррекции содержания основного провоспалительного цитокина ИЛ-1, маркеров клеточной деструкции, аутоантител к антигенам нативной и денатурированной ДНК, нарастанием концентраций ИФН-, повышением уровней специфических противогерпетических IgG-антител и степени их функциональной зрелости (авидности) в сыворотке крови, относительно данных полученных до использования предлагаемой схемы коррекции
Впервые установлено, что используемый в исследовании индуктор макрофагальной фазы иммунного реагирования обладает модулирующими эффектом на течение иммуновоспалительного процесса при ремиссии и обострении хронической герпетической инфекции и позволяет сформировать оптимальный баланс про- и противовоспалительных цитокинов, способствующий снижению активности воспалительно-деструктивного процесса, что подтверждается данными дисперсионного анализ, свидетельствующими о том, что характер и направленность изменений концентраций ИЛ-1, ИФН-, ИЛ-6 и ЦИК в сыворотке крови обследованных пациентов на 7, 14 и 21 день после проведенной коррекции зависит от их исходной концентрации до её начала
Установлено, что более интенсивное нарастание концентраций ИФН- происходит у пациентов с хронической герпетической инфекцией с исходно низкими значениями его величин в сыворотке крови до проведения коррекции индуктором макрофагальной фазы иммунного реагирования по сравнению с пациентами исходно высокими его величинами, однако к 21 дню после проведенного курса происходит выравнивание его концентраций в сыворотке крови обследованных лиц
Впервые установлено, что изменение содержания специфических противогерпетических IgG-антител, а также степени их авидности значимым являлся фактор фазы продукции иммуноглобулинов и образования ЦИК, в которую применяли индуктор макрофагальной фазы. Показано, что наиболее эффективным является начало коррекции в 1 и 3 фазу продукции иммуноглобулинов и образования ЦИК, в этом случае отмечали нарастание содержания специфических противогерпетических антител и степени их авидности на протяжении всего периода наблюдения (7, 14 и 21 день), в то время как у лиц, коррекционный курс которым проводили во 2 фазу к 21 дню после его окончания, имело место снижение уровней содержания специфических противогерпетических IgG-антител, а также степени их авидности.
Научно-практическая значимость. Показана патогенетическая обоснованность и клиническая эффективность предлагаемой схемы коррекции, основанной на использовании стимулятора макрофагальной фазы иммунного реагирования (1 капсула 2 раза в сутки – 1 день и по 1 капсуле 1 раз в сутки – 4 дня), использование которой позволяет снизить активность воспалительного процесса и стимулировать специфическую противовирусную резистентность организма у пациентов с обострением и клинической ремиссией хронической герпетической инфекции, что клинически подтверждается снижением продолжительности обострения в среднем в 2,2 раза, снижением частоты их возникновения в среднем в 2,25 раза, а также возрастанием длительности ремиссии в среднем в 2,2 раза независимо от периода начала лечения, то есть улучшением качества жизни пациентов.
Полученные результаты позволили выработать критерии определения эффективности лечения хронической герпетической инфекции, основанные на определении до и через 7, 14, 21 дней после окончания лечения, проведенного в стадию ремиссии, содержания в сыворотке крови специфических IgG-антител к вирусу простого герпеса I и II типа, степени авидности специфических IgG-антител, содержания циркулирующих иммунных комплексов (Трунов А.Н., Обухова О.О., Шваюк А.П., Горбенко О.М., Трунова Л.А. Способ оценки эффективности лечения хронической герпетической инфекции // Патент РФ на изобретение № №2331886, дата регистрации (публикации) 2008.08.20, дата приоритета 2007.03.20, заявка на изобретение №2007110276/15).
Теоретические и практические положения, разработанные в диссертационном исследовании, внедрены в научно-педагогическую деятельность кафедры патофизиологии с курсом клинической патофизиологии Новосибирского государственного медицинского университета Росздрава (раздел патогенез воспаления) и практическую деятельность Городского иммунологического центра МУЗ ГП№1.
Положения, выносимые на защиту:
- Отсутствие клинических проявлений у пациентов с хронической герпетической инфекцией в период ремиссии не сопряжено с отсутствием активности деструктивно-воспалительного процесса.
- Для клинической ремиссии и обострения хронической герпетической инфекции характерна активация процессов иммунного реагирования и специфической противогерпетической защиты, которая является низкоэффективной, так как не приводит к полной элиминации этиологического фактора
- Предложенная схема коррекции с использованием индуктора макрофагальной стадии иммунного реагирования, является патогенетически обоснованной и клинически эффективной, так как приводит к снижению активности деструктивно-воспалительного процесса, стимуляции противовирусной резистентности организма, снижает длительность и частоту возникновений обострений патологического процесса, удлиняет длительность ремиссии
- У пациентов с ремиссией и обострением хронической герпетической инфекции эффективность индуктора макрофагальной фазы иммунного реагирования на синтез специфических противогерпетических антител и степень их авидности зависит от фазы синтеза иммуноглобулинов и образования циркулирующих иммунных комплексов, в которую была начато его использование, а его влияние на содержание провоспалительных цитокинов и ИНФ- зависит от их исходного уровня до начала коррекции.
Апробация работы. Основные результаты диссертационной работы были представлены и обсуждены на: Всероссийской научной конференции с международным участием. «Влияние окружающей среды на здоровье человека» (Новосибирск, 2002); Всероссийской конференции «Компенсаторно-приспособительные процессы: фундаментальные и клинические аспекты (Новосибирск, 2002); V Съезде иммунологов и аллергологов СНГ (СПб., 2003); Всероссийской конференции физиология и патология иммунной системы (Краснодар-Сочи, 2003); Второй Всероссийской научно-практической конференции «Компенсаторно-приспособительные процессы: фундаментальные, экологические и клинические аспекты» (Новосибирск, 2004);. 6 Съезде аллергологов и иммунологов СНГ (Москва, 2006); V Всемирном конгрессе по иммунопатологии (Москва, 2007); Третьей Всероссийской научно-практической конференции «Фундаментальные аспекты компенсаторно-приспособительных процессов (Новосибирск, 2007); Международной конференции «Физиология и патология иммунной системы» (Москва, 2008).
Публикации. По теме диссертации опубликовано 33 печатных работы, из них 17 – в изданиях, рекомендованных ВАК РФ для публикаций материалов диссертационных исследований; получен патент РФ на изобретение.
Объем и структура диссертации. Диссертация изложена на 355 страницах печатного текста, иллюстрирована 32 таблицами и 42 рисунками. Работа состоит из введения, обзора литературы, описания материала и методов исследования, глав с описанием результатов собственных исследований, обсуждения результатов, выводов, практических рекомендаций и списка цитированной литературы (685 источников из них 244 отечественных и 441 зарубежных авторов). Весь материал, представленный в диссертации, получен, обработан и проанализирован автором лично.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клиническая характеристика обследованных групп. Основным материалом исследования служили данные сравнительного клинико-иммунологического обследования больных с хронической вирусной инфекцией, вызванной вирусами герпеса типа I и II с различной локализацией процесса. Отбор больных для исследования проводился на базе дерматологического отделения больницы Химзавода г. Бердска (Новосибирская обл.), а также на амбулаторном приеме в кожно-венерологических диспансерах. Больные в стадии обострения отбирались на основе наличия характерных клинических признаков герпесвирусной инфекции (HSV-инфекции). Больные в стадии клинической ремиссии выявлялись путем активного опроса на предмет наличия проявлений HSV-инфекции в анамнезе больных, пришедших на прием в кожно-венерологический диспансер для профилактического осмотра и не страдающих другими инфекционными процессами. При отборе групп на этом этапе отклоняли больных, получавших кортикостероиды или иммуноактивные препараты, больных с сопутствующей патологией, что могло исказить оценку проводимой иммунореабилитации. В качестве лабораторного подтверждения диагноза определяли наличие специфических антиHSV-IgG-антител против вируса герпеса I и II типов в сыворотке крови, как показателя наличия хронического процесса, обусловленного вирусами простого герпеса I и II типов.
В результате, для определения эффективности применения активатора макрофагальной фазы иммунного ответа у больных с герпесвирусной инфекцией была сформирована группа из 126 пациентов с хронической герпесвирусной инфекцией в стадии обострения и клинической ремиссии в которой выделены следующие подгруппы пациентов:
I – 54 человека – больные с обострением HSV-инфекции;
II – 52 человека – больные с клинической ремиссией HSV-инфекции;
III – контрольная - 16 человек – больные с обострением HSV-инфекции, не получавшие иммуноактивное лечение;
IV – контрольная - 14 человек - больные с клинической ремиссией HSV-инфекции, не получавшие иммуноактивное лечение.
Как основные, так и контрольные группы были рандомизированы по возрасту, длительности и клиническому течению заболевания. В группы входили пациенты от 17 до 52 лет, страдающие хронической рецидивирующей герпетической инфекцией легкой и средней степени тяжести, с частотой рецидивирования от 4 до 8 раз в год (в среднем 6 раз в год). Длительность заболевания, то есть время от момента первого клинического проявления, в группах колебалась от 4 до 10 лет (в среднем 5 лет). Клинически у пациентов диагностировали хроническую герпетическую инфекцию как генитальной, так и орофациальной локализации. Однако в связи с тем, что при лабораторном подтверждении диагноза использовали определение специфических антител одновременно к вирусу герпеса 1 и 2 типов, выделение подгрупп, в зависимости от локализации процесса, не проводили.
В качестве активатора макрофагального звена применялся препарат эхинацеи - «Эхинацея плюс» (“Echinacea plus”) в микросферированной форме производства «Груп Мишель Идерн» («Groupe Michel Iderne»), Франция, упак. ЗАО «Витамакс» и ООО «САНФ», Россия. Регистрационное удостоверение МЗ РФ № 77.99.25.3.У.4152.10.04 от 11.10.2004 г. Препарат содержит экстракты Echinacea purpurea (60%) et Echinacea pallida (40%) (Свидетельство о гос. регистрации № 0004473 от 11.10.2004).
Препарат Эхинацеи применялся по схеме, разработанной в лаборатории иммунологии репродукции НЦКЭМ СО РАМН под руководством члена-корреспондента РАМН, доктора медицинских наук, профессора Труновой Л.А. Препарат эхинацеи вводили per os до еды. Доза препарата для взрослых составляла: 1 капсула х 2 раза в сутки – 1 день, затем 1 капсула х 1 раз в сутки – 4 дня. Общий курс составлял 5 дней.
В группах контроля в качестве лечения применялись: витаминные, антигистаминные препараты, антиоксиданты, а также местное лечение мазевыми препаратами, обладающими противозудным и противовоспалительным действием.
Клинико-иммунологическое обследование проводили четырежды:
1 – до начала лечения; 2 – через 7 дней после окончания лечения; 3 – через 14 дней после окончания лечения; 4 – через 21 день после окончания лечения.
Клиническое обследование включало оценку клинического состояния пациента: выраженность воспалительных изменений при обострении, а также частоту рецидивирования при обострении и ремиссии.
Кроме того, для формирования нормативных величин исследуемых показателей была обследована группа из 205 практически здоровых доноров крови, обследованных на базе БСМП №2 г. Новосибирска. Помимо обследований, общепринятых для доноров крови, исследовались уровни ЦИК, как интегрального показателя наличия процессов воспаления. В результате, только у 27,32% из общей группы доноров не только отсутствовали маркеры инфекционных заболеваний, но и уровни ЦИК не превышали нормативных, то есть отсутствовали как клинические, так и лабораторные признаки воспалительных реакций. Значения величин показателей этой подгруппы пациентов были использованы для определения нормативных величин изучаемых показателей.
На проведение исследование было получено разрешение этического комитета ГУ Научный центр клинической и экспериментальной медицины СО РАМН. У всех обследованных лиц было получено информированное согласие на забор биологического материала (сыворотки крови) и его использование для научно-исследовательских работ и представления в научных публикациях.
Лабораторные методы исследования
Определение концентрации интерлейкинов ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИФН- в сыворотке крови. Исследования выполнялись на коммерческих тест-системах ProCon IL1-beta, ProCon IL4, IL2, IL6, IFN-gamma производства ООО "Протеиновый контур" (С-Петербург) по инструкции производителя.
Определение уровня содержания циркулирующих иммунных комплексов в сыворотке крови. Определение циркулирующих иммунных комплексов (ЦИК) проводили методом жидкостной преципитации в 7,5% полиэтиленгликоля-6000 на 0,01М боратном буфере рH 8,4.
Определение аутоантител к антигенам нативной и денатурированной ДНК в сыворотке крови. Аутоантитела к антигенам нативной и денатурированной ДНК определяли с помощью тест-системы «ВектоДНК- IgG-стрип» производства ЗАО «Вектор-Бест» (п. Кольцово, Новосибирская обл.) по инструкции производителя.
Определение уровней специфических IgG-антител к вирусу простого герпеса (HSV) I и II типов. Уровень специфические IgG-антитела к вирусу простого герпеса (HSV) I и II типов в сыворотке крови определяли с помощью коммерческих диагностических тест-систем производства ЗАО “Вектор-Бест” (п.Кольцово, новосибирская обл.) методом ИФА по инструкции производителя.
Определение индекса авидности антител к вирусу простого герпеса I и II типов.
Степень авидности специфических IgG-антител к вирусу простого герпеса определяли с помощью тест-систем «ДС-ИФА-АНТИ-ВПГ1,2-G-Авидность» НПО «Диагностические системы» (г. Нижний Новгород) метода ИФА по инструкции производителя. Для оценки полученных результатов в инструкции предусмотрено, что если индекс авидности менее 50 усл.ед. то исследуемая сыворотка содержит низкоавидные антитела, если индекс авидности выше 50 усл.ед., но ниже 70 усл.ед. то исследуемая сыворотка содержит антитела среднего уровня авидности, если индекс авидности выше 70 усл.ед., то сыворотка содержит высокоавидные антитела.
Для исследования изменения значений изучаемых показателей в динамике после курса коррекции была предпринята попытка оценить значимость такого фактора как фаза продукции иммуноглобулинов и образования ЦИК. Такой подход был сформирован в свете допущения наличия аналогии между специфической антителопродукцией и динамикой трех классов общих сывороточных иммуноглобулинов и ЦИК в течение воспалительного процесса (Трунов А.Н., 1997). В основу деления на фазы была взята динамика продукции IgM:
- первая фаза, характеризовалась увеличением продукции IgM и отсутствием явно выраженного образования ЦИК. Она совпадала с ранними признаками начала заболевания и развития воспалительного процесса. Подключение в 1 фазе продукции IgG и/или IgA расценивалось как развитие вторичного иммунного ответа на повторный контакт с тем же антигеном;
- вторая фаза характеризуется пиком продукции IgM и выраженной продукцией IgG и/или IgA, началом интенсивного образования ЦИК, что соответствует разгару воспалительного процесса; диагностическое и, особенно, прогностическое значение имеет высота уровней IgG и/или IgA, что, видимо, зависит от генетически обусловленной силы иммунного ответа, природы возбудителя, состояния иммунной системы на момент заболевания;
- третья фаза характеризуется падением ниже нормы уровня IgM, повышенной или несколько снижающейся продукцией IgG и/или IgA и высоким уровнем ЦИК;
- четвертая фаза с нормативным значением IgM и различными уровнями продукции IgG и/или IgA, соответствующими, как правило, 3 фазе, т.е. уровню ниже нормы. Клинически проявляется признаками завершения воспалительного процесса. Затем наблюдается нормализация уровней IgG и/или IgA и ЦИК.
Весь процесс длится, в зависимости от состояния иммунной системы и природы возбудителя, примерно 4 - 5 недель.
Статистическая обработка полученных данных. Полученные цифровые данные подвергнуты математическому анализу и представлены в виде таблиц и графиков. В работе использовались методы параметрической и непараметрической статистики. В таблицах данные представлены в виде М±m, где М - среднее арифметическое значение, m - ошибка среднего арифметического значения. Значимость различий вариационных рядов в связанных попарно выборках оценивалась с помощью W - критерия Вилкоксона. При сравнении двух несвязанных между собой выборок (основная и контрольная группы; обострение и ремиссия) применяли U-критерий Манна-Уитни. Анализ данных проводился с помощью пакета прикладных программ Statgrafics и Statistica 6.0.
Кроме того, с целью исследования однородности групп, сформированных, исходя из разных признаков (исходное значение исследованных параметров, фаза продукции иммуноглобулинов и образования ЦИК), а также для определения значимости этих признаков для динамики значений исследованных иммунологических параметров в процессе наблюдения проводился дисперсионный анализ. На рисунках, характеризующих результаты дисперсионного анализа, приведены данные в виде выборочных средних, не предполагающих расчет ошибки среднего арифметического значения (Гланц С.,1998). Достоверным считали различие между сравниваемыми рядами с уровнем достоверной вероятности 95% (р<0,05).
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Исследование исходных величин показателей, отражающих напряженность иммуновоспалительных реакций. При первом обследовании, то есть до начала лечения, в период обострения средний уровень ИЛ-1 значительно превышал нормативные значения с высоким уровнем достоверности и составил 239,24±49,29 pg/ml (Р<0,001). В периоде клинической ремиссии уровень ИЛ-1 также достоверно превышал нормативные значения и составил 77,09±10,15 pg/ml (Р<0,01), что, однако, достоверно ниже, чем в группе с обострением заболевания (Р<0,01) (рисунок 1).

Рисунок 1. Уровни ИЛ-1 в сыворотке крови обследованных пациентов в разные периоды ХГИ при первом обследовании в сравнении с нормой (М±m)
В отношении ИФН- обнаружены следующие особенности. До начала лечения у пациентов с обострением хронической ГИ средний уровень ИФН- составил 51,67±4,07 pg/ml, что достоверно превышало его уровень у здоровых доноров – 35,58±4,54 pg/ml (Р<0.05). В период клинической ремиссии среднее содержание ИФН- в сыворотке крови обследованных лиц составило 57,98±5,41 pg/ml, что также достоверно превышало нормативные значения (Р<0,05) и недостоверно превышало «среднюю» показателя периода обострения (Р>0,05) (рисунок 2).

Рисунок 2. Уровни ИФН- в сыворотке крови обследованных пациентов в разные периоды ХГИ при первом обследовании в сравнении с нормой (М±m)
При определении уровней специфических антител отмечено, что у всех обследованных лиц уровень показателя (в дальнейшем именуемого «уровень антител к HSV») многократно превышал критическую величину. Так, у пациентов с обострением ГИ средний уровень антител составил 1,28±0,09 усл.ед. То есть, имело место практически десятикратное превышение критических значений. В период клинической ремиссии ГИ средний уровень IgG-антител к HSV составил 1,36±0,08 усл.ед, что также на порядок превышает критическую величину (рисунок 3). То есть при сравнении средних значений показателей исследуемых групп статистически значимых различий не обнаружено (Р>0,05).
В то же время наличие высоких значений уровней специфических противогерпетических антител у больных в периоде клинической ремиссии является подтверждением активной антителопродукции при отсутствии клинических проявлений заболевания. Эти результаты свидетельствует о непрерывной репликации вируса, вероятно, в клетках эпителия согласно динамической теории развития вирусного процесса при HSV-инфекции.
Изначально было высказано предположение, что неэффективность имеющейся противовирусной защиты обусловлена, в частности, неполноценностью иммунного ответа, что приводит к продукции низкоавидных специфических антител, слабо взаимодействующих с вирусными антигенами. Результатом этого является неэффективная элиминация возбудителя, а также, видимо, недостаточная активация реакций антителозависимой клеточной цитотоксичности. В связи с этим, помимо уровней специфических анти-HSV-антител определялся такой показатель как их авидность.
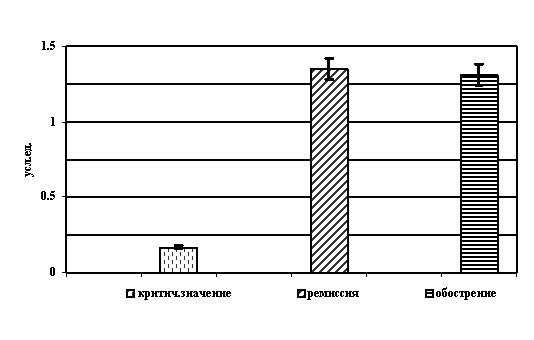
Рисунок 3. Уровни специфических IgG-антител в разные периоды ХГИ при первом обследовании (М±m)
В обеих обследованных группах среднее значение индекса авидности несколько превышало критическую величину (50 усл.ед.), однако это превышение было незначительным (рисунок 4). Так, при обострении среднее значение индекса авидности составило 66,9±2.14 усл.ед., а при ремиссии – 65,84±1.59 усл.ед., то есть показатели в группах достоверно не различались между собой (Р>0,05).
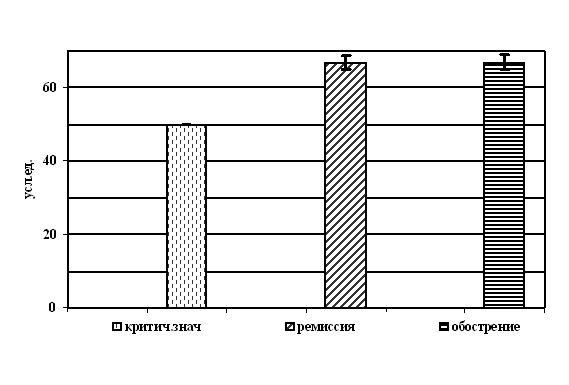
Рисунок 4. Средние значения уровней авидности специфических IgG-антител в разные периоды ХГИ при первом обследовании (М±m).
Средний уровень авидности, определяемый как при обострении заболевании, так и в периоде клинической ремиссии, видимо, может служить подтверждением высказанного предположения о недостаточной функциональной зрелости продуцирующихся противогерпетических антител, результатом которой является их слабое взаимодействие с вирусом и недостаточная протективная активность независимо от клинического периода заболевания.
Кроме того, значения ИЛ-2, ИЛ-4, ЦИК, а также ААТ к н- и дДНК до лечения также достаточно выражено превышали нормативные значения, но при этом практически не различались в группах с обострением и ремиссией ХГИ.
Изменение значений иммунопатогенетических показателей в процессе наблюдения после активации макрофагальной фазы иммунного ответа
При оценке клинической эффективности проведенного курса коррекции, отмечено, что на фоне применения эхинацеи длительность рецидива сократилась при начале лечения в период обострения с 7,6 дней до 3,3 дней (в 2,3 раза). В процессе коррекции высыпания новых элементов не отмечено ни у одного больного. Практически все больные отметили значительное уменьшение тяжести рецидива заболевания, что подтверждается данными объективного наблюдения. В некоторых случаях везикулы подсыхали, не образовывая эрозивных элементов. При оценке данных катамнеза отмечено, что после проведенного курса с использованием активатора макрофагальной фазы длительность рецидива сократилась при начале лечения в период ремиссии – с 7,8 дней до 3,5 дней (в 2,2 раза), то есть, в среднем, независимо от того, в какой клинический период начата коррекция, длительность рецидива сократилась в 2,25 раза.
Таблица 1.
Частота рецидивов и длительность ремиссии
до и после курса иммунокоррекции (М±m)
| Начало курса коррекции | Частота обострений до коррекции | Частота обострений после коррекции | Длительность ремиссии до коррекции (дни) | Длительность ремиссии после коррекции (дни) |
| Обострение (n =54) | 5,6±1,18 | 2,3±1,1 | 28,6±21,4 | 64,4±34,2 |
| Ремиссия (n=52) | 6,4±1,23 | 3,5±1,02 | 36,9±22,7 | 75,8±45,4 |
| Уменьшение/ увеличение в среднем | >в 2,25 раза | <в 2,2 раза | ||
При начале лечения в период обострения частота рецидивов у пациентов сократилась с 5,6 раз в год до приема препарата до 2,3 раз в год после курса терапии (в 2,4 раза). У пациентов при начале лечения в период ремиссии частота обострений уменьшилась с 6,4 до 3,5 раза соответственно (в 1,8 раза), то есть в среднем, частота обострений снизилась в 2,1 раза. Длительность ремиссии возросла у лиц с началом лечения в период обострения ХГИ с 28,6 дней до лечения до 64,4 дней после лечения (в 2,25 раза).
В группе с началом лечения в период ремиссии герпетической инфекции отмечено увеличение длительности ремиссии с 36,9 дней до 75,8 дней соответственно (в 2,1 раза), то есть независимо от периода начала лечения – в среднем в 2,2 раза (таблица 1).
По данным субъективного и объективного наблюдения, а также при использовании традиционных методов лабораторного анализа, каких-либо осложнений или побочных реакций при приеме препарата эхинацеи не отмечено.
При анализе динамики показателей, характеризующих деструктивно-воспалительные реакции, в периоде обострения по сравнению с аналогичными показателями периода ремиссии отмечено, что только по уровню «средних» содержания ИЛ-1 имели место значимые различия до начала лечения, а также при втором обследовании. В этих случаях среднее содержание ИЛ-1 в периоде обострения достоверно превышало таковое в периоде ремиссии (р<0,01 и р<0,05 соответственно). При третьем обследовании средний уровень цитокина при обострении, хотя и был выше такового периода ремиссии, но превышение не было статистически значимым (р>0,05). При четвертом обследовании значения средних концентраций ИЛ-1 практически были равны друг другу (р>0,05) в разные периоды заболевания (рисунок 5). Полученные результаты свидетельствуют о наличии воспалительного процесса и при отсутствии его клинических проявлений, хотя и менее выраженных в период ремиссии.

Обострение Ремиссия
Рисунок 5. Динамика содержания IL-1 у больных ХГИ при обострении и ремиссии после коррекции (М±m)
При анализе «средних» содержания других показателей, характеризующих напряженность иммуновоспалительных и иммунодеструктивных реакций в периодах обострения и ремиссии ХГИ, обращает на себя внимание, что имело место не только отсутствие значимых различий «средних» значений исследованных параметров, но сходная динамика изменения «средних» после проведенного курса терапии с использованием активатора макрофагального звена – препарата эхинацеи.
Такая схожесть динамики иммунологических показателей до начала и в процессе лечения в разные периоды ХГИ, видимо, является подтверждением общих иммунопатогенетических закономерностей разных клинических периодов герпетической инфекции, что проявляется выраженными иммуновоспалительными и иммунодеструктивными реакциями не только в периоде обострения процесса, но и в отсутствие клинических проявлений заболевания
Среднее содержание ИФН- до лечения практически не различалась в разные периоды заболевания. Динамика изменения средних концентраций также носила сходный характер – имело место нарастание среднего содержания ИФН- в процессе лечения от первого к четвертому обследованию (рисунок 6).

Обострение Ремиссия
Рисунок 6. Динамика содержания ИФН- у больных ХГИ при обострении и ремиссии после коррекции (М±m)
При первом обследовании (0 день) средний уровень антител значительно превышал критическую величину независимо от периода заболевания, что свидетельствует о продукции антител в межрецидивный период инфекционного процесса также, как при обострении. При этом в динамике лечения отмечается нарастание средних уровней антител в оба периода хронической герпетической инфекции, что является отражением повышения активности антителопродукции после использования стимулятора макрофагальной фазы независимо от еприода заболевания (рисунок 7).
Характеристикой функциональной активности продуцирующихся специфических антител является степень их авидности, которая в оба периода ХГИ до лечения определялась как средняя.

Обострение Ремиссия
Рисунок 7. Динамика средних концентрации специфических IgG-антител у больных ХГИ при обострении и ремиссии после коррекции (М±m)

Обострение Ремиссия
Рисунок 8. Динамика средних значений степени авидности специфических IgG-антител у больных ХГИ при обострении и ремиссии после коррекции (М±m)
В процессе проведенного лечения, направленного на активацию макрофагальной фазы, отмечалось повышение степени авидности от первого к третьему обследованию, что отражает нарастающую специфичность продуцирующихся IgG-антител, а, следовательно, и активность взаимодействия их с антигенами вируса. Однако при четвертом обследовании (к 21 дню) по сравнению с третьим уровень авидности практически не изменился в оба периода заболевания (рисунок 8).

Обострение Ремиссия
Рисунок 9. Динамика среднего содержания аутоантител к нДНК у больных ХГИ при обострении и ремиссии после коррекции (М±m)

Обострение Ремиссия
Рисунок 10. Динамика среднего содержания аутоантител к дДНК у больных ХГИ при обострении и ремиссии после коррекции (М±m)
Активность воспалительно-деструктивных реакций определяется, в частности, активностью продукции аутоантител к нативной и денатурированной ДНК, «средние» уровней которых при первом обследовании значительно превышали норму независимо от периода заболевания. В динамике лечения имело место прогрессивное снижение «средних» содержания аутоантител к нативной и денатурированной ДНК от первого обследования к четвертому независимо от периода заболевания (рисунки 9,10).
В группах контроля подобной выраженной динамики средних уровней исследованных показателей не выявлено, отмеченные изменения были значительно менее выражены и зачастую укладывались в пределы ошибки метода.
В то же время, при оценке индивидуальных значений иммунологических показателей при первичном обследовании (до начала коррекции), выявлена значительная их гетерогенность в обеих группах. То есть, как в период обострения, так и в период клинической ремиссии герпетической инфекции у пациентов отмечались как очень высокие, так и нормативные и низкие значения цитокинов.
Такая гетерогенность особенно ярко проявилась для индивидуальных значений ИЛ-1, ИФН- и, в меньшей степени для ИЛ-6.
При анализе индивидуальных значений ИФН-отмечено, что в периоде обострения хронической герпетической инфекции его уровень колебался в пределах от 12,0 до 134,0 pg/ml, а в периоде клинической ремиссии – от 18,0 до 169,0 pg/ml. В соответствии с исходным значением показателя сформированы группы и в результате выявлено, что в период обострения у почти у половины обследованных - 44,44% - имел место нормативный или сниженный уровень ИФН-, а у 55,56% его уровень превышал норму.

Рисунок 11. Динамика выборочных средних содержания IFN- при обострении и ремиссии в зависимости от его исходного значения
В периоде клинической ремиссии имело место сходное частотное распределение. Высокий уровень ИФН- отмечен у 51,92% пациентов, нормативный и низкий – у 48,08% обследованных лиц. При сравнении «средних» значений в сформированных группах и проведении дисперсионного анализа, выявлено, что динамика выборочных средних содержания ИФН- зависит от его исходного уровня и, следовательно, этот фактор является значимым для динамики изменения содержания цитокина в процессе активации (рисунок 11). В динамике отмечено нарастание выборочных средних ИФН-, но при исходных более низких его значениях нарастание было более интенсивным. В то же время, к 4-му обследованию выборочные средние в разных группах были близки по значению.
При исследовании индивидуальных значений ИЛ-1 обращает на себя внимание значительная гетерогенность показателя в группах пациентов как при обострении хронической HSV-инфекции, так и в периоде клинической ремиссии. То есть, и в период обострения и в период клинической ремиссии заболевания у пациентов имели место как очень высокие, так и нормативные и низкие значения цитокина. При обострении HSV-инфекции диапазон колебания уровня ИЛ-1 составил от 3 до 2000 pg/ml, а в период клинической ремиссии ГИ – от 5 до 235 pg/ml. При формировании групп в соответствии с исходным значением ИЛ-1 отмечено, что в период обострения герпетической инфекции у 72,22% пациентов значения ИЛ-1 превышали среднее значение нормы, но при наличии клинических признаков воспаления почти третья часть пациентов - 27,77% - имели низкое или нормативное значение ИЛ-1. В периоде клинической ремиссии также более половины пациентов – 57,69% - имели уровень ИЛ-1, превышающий нормативные значения, а у 42,31% пациентов отмечен низкий и нормативный уровень ИЛ-1.

Рисунок 12. Динамика выборочных средних содержания IL-1 при обострении и ремиссии в зависимости от его исходного значения
При оценке «средних» в динамике после применения активатора макрофагальной фазы отмечено, что исходно высокие значения показателя снижались, а исходно низкие – повышались (рисунок 12), но это повышение, видимо, не было «бесконтрольным», поскольку к 21-му дню выявлено выравнивание средних значений на уровне, который, вероятно, обеспечивает поддержку определенной напряженности иммуновоспалительных реакций без развития гиперактивности. При проведении дисперсионного анализа также показано, что фактор исходного уровня ИЛ-1 является значимыми для его дальнейшей динамики в процессе коррекции.
При оценке исходных уровней ИЛ-6 отмечено, что при обострении минимальное значение в группе составило 24,0 pg/ml, максимальное – 260,0 pg/ml; при ремиссии – минимальное – 23,0 pg/ml, максимальное – 127,0 pg/ml, при нормативном уровне 24,69±6,39 pg/ml. Разделив пациентов, исходя из того, каким было исходное содержание ИЛ-6, выявлено, что в периоде обострения у 75,93% отмечен высокий уровень ИЛ-6 до лечения, нормативное значение выявлено у 24,07% пациентов. В периоде клинической ремиссии у 64,71% больных уровень ИЛ-6 был выше нормативного, а у 35,29% - не превышал норму, то есть распределение в разные клинические периоды ГИ имело сходный характер. В процессе иммунокоррекции отмечено, что динамика выборочных средних ИЛ-6 зависит от его исходного содержания, но период заболевания не является значимым фактором для изменения «средних» концентрации ИЛ-6 после активации макрофагальной фазы (рисунок 13). Кроме того, также как для ИФН- и ИЛ-1, для ИЛ-6 отмечалось выравнивание выборочных средних к 21-му дню после лечения.
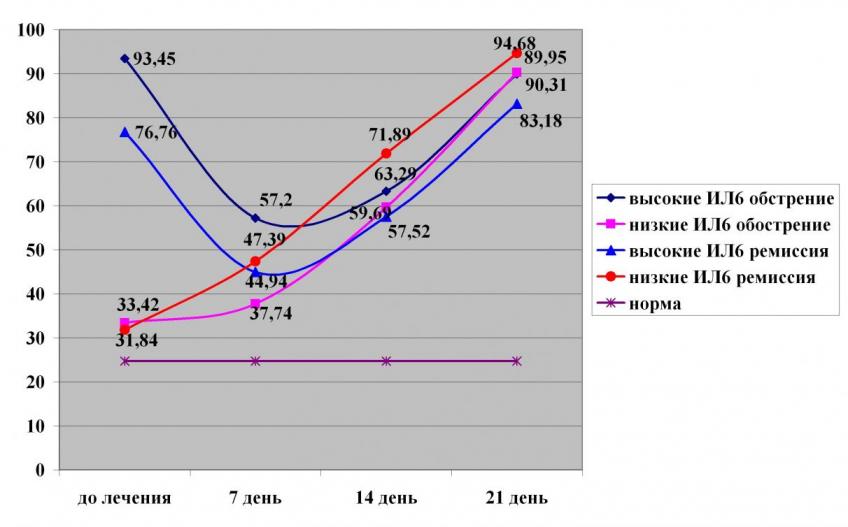
Рисунок 13. Динамика выборочных средних содержания IL-6 при обострении и ремиссии в зависимости от его исходного значения
Таким образом, можно говорить, что иммуноактивный препарат эхинацеи, воздействуя на индуцибельную фазу иммунного ответа, оказывает иммуномодулирующий эффект, видимо, позволяя к 14-21 дню после терапии достичь некоторого оптимального уровня ИФН-, который обеспечивает полноценный запуск и дальнейшую активацию протективного иммунного ответа. Это, в свою очередь индуцирует продукцию ИЛ-1 в таких концентрациях, которые бы поддерживали иммуновоспалительные реакции без развития гиперергии, что также подтверждается модуляцией продукции ИЛ-6 на таком уровне, который, видимо, является оптимальным для поддержания достаточной напряженности иммуновоспалительного ответа при имеющейся хронического латентного инфекционного процесса.
В отношении ИЛ-2 и ИЛ-4 закономерности, выявленные при оценке подгрупп, сформированных исходя из исходного уровня показателя, и которые бы отличались от закономерностей, обнаруженных для средних значений всей выборки относительно периода заболевания, не выявлены.
Циркулирующие иммунные комплексы, которые, как известно, можно расценивать как интегральный показатель воспалительного процесса, при оценке их в группах, соответственно периоду заболевания, в динамике иммунокоррекции, как уже отмечалось выше, изменяются незначительно. В то же время, индивидуальные значения ЦИК демонстрируют достаточно выраженную динамику, что потребовало иного подхода к оценке этих изменений. Поскольку ни в одном случае, как при обострении, так и при ремиссии ХГИ, у пациентов не отмечено низких или нормативных уровней ЦИК, то выделение подгрупп сравнения проводилось по другому принципу. В качестве пограничного был принят уровень, соответствующий трехкратному нормативному значению – 150 усл.ед. При проведении дисперсионного анализа отмечено, что полученные результаты можно расценивать как значимость такого фактора как исходный уровень ЦИК для изменения их содержания в процессе иммунокоррекции (рисунок 14). Однако, хотя динамика изменения выборочных средних была разной в сформированных группах, но к 21-му дню отмечено выравнивание «средних» значения показателя.

Рисунок 14. Динамика выборочных средних содержания ЦИК при обострении и ремиссии в зависимости от их исходного значения
В отношении других показателей, характеризующих напряженность гуморального иммунного ответа, подобный подход оказался неприменим, поскольку динамика изменения их содержания при оценке в различных группах сохранялась, независимо от периода заболевания и принципа формирования групп. То есть, для следующих показателей - ИЛ-2, ИЛ-4, специфические IgG-антитела, авидность антител, аутоантитела к нативной и денатурированной ДНК фактор их исходного содержания не является значимым для изменения их концентрации в процессе наблюдения после коррекции с использованием активатора макрофагальной фазы независимо от клинического периода хронической герпетической инфекции.
Динамика изменения величин исследованных показателей в зависимости от фаз продукции иммуноглобулинов и образования ЦИК. Для оценки состояния гуморального звена иммунной системы определялось содержание общих иммуноглобулинов IgM, IgG, IgA и циркулирующих иммунных комплексов (ЦИК) в сыворотке крови. Полученные результаты позволяют говорить об активации гуморального звена иммунной системы как при обострении, так и при ремиссии хронической герпетической инфекции. Известно, что любой хронический воспалительный процесс, протекает волнообразно, в соответствии с фазами продукции иммуноглобулинов и образования ЦИК. Такой подход оправдал себя при использовании в качестве маркера выделения различных этапов иммунного ответа при острых и хронических бактериальных процессах (Трунова Л.А., Трунов А.Н., 1994-1999), но, видимо, подобный подход может быть использован и при вирусной инфекции, также являющейся хроническим рецидивирующим процессом. Таким образом, помимо исследования изменения уровней изучаемых показателей в зависимости от периода заболевания, а также от их исходного значения, впервые была предпринята попытка провести подобный анализ динамики изменения содержания всех исследованных параметров в зависимости от фаз продукции иммуноглобулинов и образования ЦИК.
В соответствии с разработанными критериями оценки фаз продукции иммуноглобулинов и образования ЦИК внутри групп, соответствующих клиническим периодам заболевания, сформированы подгруппы, соответствующие фазам продукции иммуноглобулинов и образования ЦИК (далее - фазы). Распределение по фазам внутри групп, видимо, обусловлено, не столько периодом заболевания, сколько индивидуальными особенностями реагирования иммунной системы на хроническую вирусную инфекцию (таблица 4).
Таблица 4.
Количественное распределение пациентов в периодах обострения
и ремиссии в зависимости от фаз продукции иммуноглобулинов
и образования ЦИК
| Фаза продукции иммуноглобулинов и образования ЦИК | Количество пациентов | % от числа больных в периоде герпетической инфекции |
| Обострение (n=54) | ||
| Фаза 1 | 11 | 20,37% |
| Фаза 2 | 20 | 37,04% |
| Фаза 3 | 18 | 33,33% |
| Фаза 4 | 5 | 9,26% |
| Ремиссия (n=52) | ||
| Фаза 1 | 16 | 30,77% |
| Фаза 2 | 14 | 26,92% |
| Фаза 3 | 13 | 25,0% |
| Фаза 4 | 9 | 17,31% |
При проведении дисперсионного анализа выявлено, что для изменения уровней исследованных цитокинов– ИЛ-1, ИФН-, ИЛ-2, ИЛ-4, ИЛ-6 - в динамике после коррекции фактор фазы продукции иммуноглобулинов и образования ЦИК, в которую начата коррекция, не является значимым. Также не является значимым фактор фазы иммунного ответа для динамики изменения содержания ААТ к н- и дДНК. В этом случае средние содержания ААТ прогрессивно снижаются независимо от того, в какую фазу иммунного ответа начат коррекционный курс, причем эта закономерность не зависит от периода заболевания.
Однако, фактор фазы продукции иммуноглобулинов и образования ЦИК является значимым для изменения уровня ЦИК, специфических противогерпетических антител и степени их авидности в динамике после коррекции. При анализе изменения концентраций IgG-антител отмечено, что при начале иммунокоррекции в 1, 3 и 4 фазы иммунного ответа выявлено прогрессивное нарастание содержания IgG-антител на протяжении всего периода наблюдения как при обострении, так и при ремиссии ГИ.

Примечание: * - р<0,05 по сравнению с предыдущим обследованием
Рисунок 16. Динамика выборочных средних уровня IgG-антител в обострении герпетической инфекции в зависимости от фаз продукции иммуноглобулинов и образования ЦИК
При начале коррекции в 2 фазу иммунного ответа к 21-му дню выявлено снижение величин показателя и нарастание внутригрупповых разбросов индивидуальных значений, причем выявленная динамика отмечена независимо от клинического периода заболевания (рисунок 16, 17).

Примечание: * - р<0,05 по сравнению с предыдущим обследованием
Рисунок 17. Динамика выборочных средних уровня IgG-антител в ремиссии герпетической инфекции в зависимости от фаз продукции иммуноглобулинов и образования ЦИК
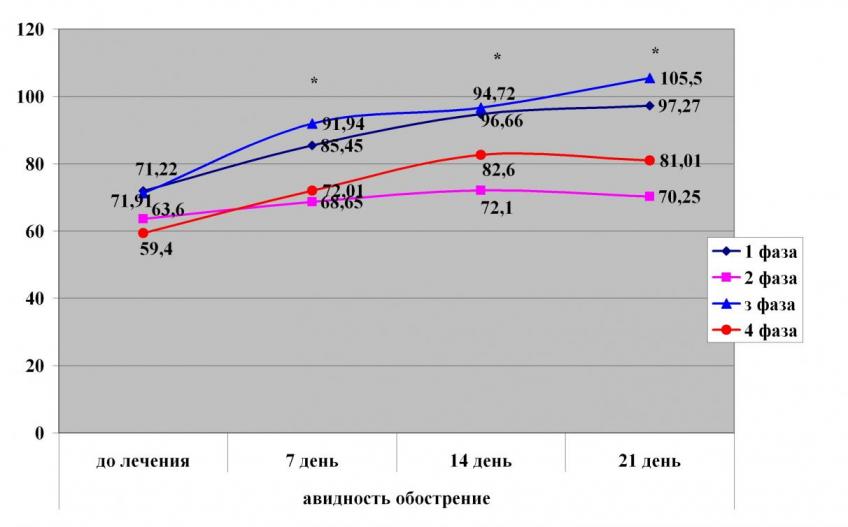
Примечание: * - р<0,05 по сравнению с предыдущим обследованием
Рисунок 18. Динамика выборочных средних уровня авидности антител в обострении герпетической инфекции в зависимости от фаз продукции иммуноглобулинов и образования ЦИК
В отношении степени авидности специфических антител также выявлена определенная закономерность. При начале лечения в 1, 3 и 4 фазы иммунного ответа выборочные средние уровня авидности прогрессивно нарастают или (в 4 фазе) практически не изменяются от 14-го к 21-му дню. При начале коррекции в 2 фазу к 21-му дню выявлено снижение выборочных средних показателя по сравнению с предыдущим обследованием, а также отмечено нарастание внутригрупповых разбросов. Следует отметить, что динамика изменения выборочных средних носила сходный характер независимо от периода заболевания (рисунок 18, 19).

Примечание: * - р<0,05 по сравнению с предыдущим обследованием
Рисунок 19. Динамика выборочных средних уровня авидности антител в ремиссию герпетической инфекции в зависимости от фаз продукции иммуноглобулинов и образования ЦИК
Таким образом, из исследованных показателей, фактор фазы продукции иммуноглобулинов и образования ЦИК, в которую начата коррекция, является значимым для таких показателей, как специфические IgG-антитела, авидность специфических антител, причем клинический период заболевания значимым фактором не является, что подтверждает значимость индивидуальных особенностей реакций организма в развитии специфического противовирусного реагирования в процессе коррекции. Для изменения содержания ИЛ-1, ИФН-, Ил-2, ИЛ-4, ИЛ-6, ААТ к н- и дДНК в динамике после проведенной коррекции, фактор фазы продукции иммуноглобулинов и образования ЦИК не является значимым.
Таким образом, обобщая полученные результаты, можно предположить, что клинические периоды хронической герпетической инфекции имеют сходные патогенетические механизмы развития процесса. Это подтверждается не только близкими значениями цитокинов (за исключением ИЛ-1), уровней IgG-антител, их авидности, ЦИК, а также уровней ААТ к н- и дДНК, являющихся маркерами деструктивно-воспалительных реакций, определяемыми до лечения, но также сходной динамикой изменения уровней исследованных показателей в процессе коррекции выявленных нарушений, направленного на стимуляцию макрофагального звена иммунного ответа. Однако, отмечено, что значимым фактором для динамики изменения уровней ИЛ-1, ИФН-, ИЛ-6 и ЦИК является их исходный уровень независимо от периода заболевания. В то же время, для таких показателей как ЦИК, специфические IgG-антитела и их авидность значимым фактором для изменения их уровней в динамике является фаза иммунного ответа, в которую начата коррекция также независимо от периода заболевания. При этом для динамики ААТ к н- и дДНК оба эти фактора не проявляли свою значимость, эти маркеры деструктивно-воспалительных реакций прогрессивно снижались независимо от периода заболевания и других факторов, что свидетельствует о снижении напряженности воспалительных реакций, сопровождающихся деструкцией.
ВЫВОДЫ
- У пациентов в стадиях клинической ремиссии и обострения хронической герпетической инфекции имеют место деструктивно-воспалительные процессы, что подтверждается наличием высоких концентраций провоспалительных цитокинов ИЛ-1, ИЛ-6 в сыворотке крови и содержанием маркеров клеточной деструкции - аутоантител к антигенам нативной и денатурированной ДНК.
- Для пациентов в стадиях клинической ремиссии и обострения хронической герпетической инфекции характерна активация процессов иммунного реагирования и специфической антителопродукции, что проявляется повышением в сыворотке крови концентраций индукторов гуморального и клеточного звеньев иммунной системы ИФН-, ИЛ-2, ИЛ-4, содержания циркулирующих иммунных комплексов и специфических IgG антител к вирусу простого герпеса.
- Отличием стадии обострения от клинической ремиссии хронической герпетической инфекции является 2-3-х кратное повышение концентрации основного провоспалительного цитокина ИЛ-1, что определяет более высокую активность воспалительного процесса при обострении заболевания.
- Установлено, что использование, у пациентов с хронической герпетической инфекцией, индуктора макрофагальной фазы иммунного ответа по предложенной схеме приводит к снижению активности воспалительного процесса и стимулирует противовирусную резистентность организма. Указанное подтверждается снижением концентраций провоспалительного цитокина ИЛ-1 и уровней аутоантител к антигенам нативной и денатурированной ДНК, на фоне нарастания концентраций ИФН-, уровней специфических противогерпетических IgG-антител и степени их авидности от 7 к 14 и 21 дням после курса коррекции.
- Показана клиническая эффективность предлагаемого схемы коррекции с использованием индуктора макрофагальной фазы иммунного ответа у пациентов с хронической герпетической инфекцией, что проявляется снижением длительности обострения патологического процесса в 2,2 раза, снижением частоты возникновения обострения в 2,25 раза, возрастанием длительности ремиссии в среднем в 2,2 раза.
- Показано, что об эффективности проводимой коррекции свидетельствует повышение к 21 дню после проведения коррекции содержания специфических IgG-антител не менее чем на 60% и их авидности не менее чем на 40% по отношению к исходному уровню, а также повышение содержания ЦИК в сыворотке крови к 14 суткам после проведения коррекции не менее, чем на 36% при исходном содержании ЦИК 150 условных единиц или снижение их уровней через 14 дней – не более, чем на 43%при исходным содержанием > 150 условных единиц.
- Выявлено, что используемый индуктор макрофагальной фазы иммунного ответа обладает модулирующими свойствами на развитие воспалительного процесса при хронической герпетической инфекции, о чем свидетельствуют данные дисперсионного анализа, позволившие установить, что значимым фактором определяющим характер изменения величин ИЛ-1, ИФН-, ИЛ-6 и ЦИК в сыворотке крови обследованных пациентов на 7 14 и 21 день после проведенной коррекции является их исходная концентрация.
- При проведении курса коррекции с использованием индуктора макрофагальной фазы иммунного ответа, выявлена зависимость изменений уровней специфических противогерпетических IgG-антител и степени их авидности от фазы продукции иммуноглобулинов и образования ЦИК и показано, что наиболее эффективным является начало коррекции в 1 и 3 фазу, так как приводит к нарастанию уровней специфических противогерпетических IgG-антител и их авидности к 21 дню наблюдения.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Рекомендуется использование при хронической герпетической инфекции индуктора макрофагальной фазы иммунного ответа по предлагаемой схеме, так как это позволяет снизить активность деструктивно-воспалительного процесса, повысить противовирусную резистентность организма, что приводит к снижению частоты возникновения обострений патологического процесса у этой группы пациентов
- Для оценки эффективности проводимых лечебно-профилактических мероприятий при хронической герпетической инфекции предлагается использование разработанного и запатентованного автором способа, основанного на определении до лечения и через 7, 14, 21 дней после его окончания содержания в сыворотке крови пациентов специфических IgG-антител к вирусу простого герпеса I и II типов, степени авидности специфических IgG-антител, содержания циркулирующих иммунных комплексов. Повышение к 21 дню после проведения коррекции содержания специфических IgG-антител не менее чем на 60% и их авидности не менее чем на 40% по отношению к исходному уровню, а также повышение содержания ЦИК в сыворотке крови к 14 суткам после проведения коррекции не менее чем на 36% при исходном содержании ЦИК 150 условных единиц или снижение уровня ЦИК в сыворотке крови, через 14 дней – не более чем на 43%, при их исходным содержании > 150 условных единиц, свидетельствует об эффективности проводимых мероприятий.
СПИСОК РАБОТ ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ:
- Уровни аутоантител к ядерным ДНК в группе “практически здоровых” лиц./А.Н. Трунов, А.П. Шваюк, О.О. Обухова, О.М. Горбенко, И.В. Кудрявцева // International J. of Immunorehabilitation - 2000. - Т. 2, № 2.- С. 185
- Формирование нормативных показателей иммунной системы в условиях промышленного центра / О.О. Обухова, О.М. Горбенко, А.П. Шваюк, А.Н. Трунов // Влияние окружающей среды на здоровье человека: тез. докл. 1 всерос. научн. конф. с межд. участием. - Новосибирск, 2002. – С. 116-117
- Состояние здоровья работников промышленных предприятий./ А.Н. Трунов, О.О. Обухова, О.М. Горбенко, А.П. Шваюк // Влияние окружающей среды на здоровье человека: тез. докл. 1 всерос. научн. конф. с межд. участием. - Новосибирск, 2002. – С. 146-147
- Трунова Л.А. Отсутствие унифицированного подхода к формированию нормативных значений как фактор, сдерживающий развитие клинической иммунологии / Л. А. Трунова, О.О. Обухова, А.Н. Трунов, // Компенсаторно-приспособительные процессы: фундаментальные и клинические аспекты: тез. докл. всерос. конф. – Новосибирск, 2002. – С. 352-353
- Состояние иммунной системы здоровых доноров / О.О. Обухова, О.М. Горбенко, А.П. Шваюк, А.Н. Трунов, С.М. Чорняя // Материалы II Всерос. конф. «Молекулярные основы иммунорегуляции, иммунодиагностики и иммунотерапии». – Санкт-Петербург, 2003 - Мед. Иммунол. – 2003. – Т.5, № 3-4. – С. 378-379
- К вопросу формирования нормативных показателей / Л.А. Трунова, О.М. Горбенко, А.П. Шваюк, О.О. Обухова //International J. оf immunorehabiltation.- 2003 – Т.5, №2. – С. 292
- Обухова О.О. Клиническая эффективность препарата эхинацеи при рецидивирующей герпетической инфекции / О.О. Обухова, Г.В. Башур, Л.А. Трунова // Журнал клинической и экспериментальной медицины – 2003. - № 4. – С. 89-92
- Обухова О.О. Определение нормативных значений при оценке иммунного статуса / О.О. Обухова, А.В. Обухов, С.В. Чорняя // Актуальные вопросы современной медицины: тез. докл. ХIII науч.-практ. конф. врачей. - Новосибирск, 2003. – С. 352
- Трунова Л.А. Содержание цитокинов в сыворотке крови мужчин с генитальным герпесом в стадии клинической ремиссии / Л.А. Трунова, О.В. Авдеева, О.О. Обухова // Всемирный конгресс по иммунологии и аллергологии: тез. докл. – Москва, 2004. - Аллергология иммунология – 2004 – Т.5 - № 1. – С. 124
- Динамика антителопродукции в процессе иммунокорригирующего лечения хронической герпетической инфекции / О.О. Обухова, О.Е. Авдеева, А.В. Обухов, Л.А. Трунова // IX Международный конгресс по клинической патологии: тез. докл. – Бангкок, Таиланд, 2004. - International J. оf immunorehabiltation - 2004. - Т.6, № 1. – С. 142
- Принципы формирования нормативных значений иммунологических показателей в условиях ксеногенного воздействия / О.О. Обухова, О.М. Горбенко, А.П. Шваюк, О.Е. Авдеева, А.Н. Трунов // Компенсаторно-приспособительные процессы: фундаментальные, экологические и клинические аспекты: тез. докл. второй всерос. науч.-практ. конф. - Новосибирск, 2004. – С. 65-66
- Баланс цитокинов и специфических антител к вирусу герпеса у пациентов в стадии клинической ремиссии на фоне проводимой реабилитации / О.О. Обухова, О.Е. Авдеева, О.М. Горбенко, А.П. Шваюк, Л.А. Трунова // Компенсаторно-приспособительные процессы: фундаментальные, экологические и клинические аспекты: тез. докл. всерос. конф. - Новосибирск, 2004. – С. 59
- Изучение состояния иммунопатофизиологических показателей у больных с инаппарантной формой генитального герпеса / Л.А. Трунова, Г.В. Башур, О.О. Обухова, О.Е. Авдеева // Проблемы клинической медицины – 2005. - № 2. – С. 79-83
- Провоспалительные цитокины при герпетической инфекции / О.О. Обухова, Г.В. Башур, Л.А. Трунова, О.М. Горбенко, А.П. Шваюк // Проблемы клинической медицины – 2005. - № 3. – С. 96-99
- Динамика специфической антителопродукции у больных с герпетической инфекцией на фоне иммуноактивной терапии в период клинической ремиссии / О.О. Обухова, О.М. Горбенко, А.П. Шваюк, Л.А. Трунова, А.Н. Трунов // Тезисы Х международного конгресса по реабилитации в медицине и иммунореабилитации и III Европейского конгресса по астме. – Афины, Греция, 2005. - Аллергология и иммунология. - 2005. – Т.6, №3. - 382.
- Динамика уровней циркулирующих иммунных комплексов в процессе иммунокорригирующей терапии хронической герпетической инфекции / О.О.Обухова, Г.В. Башур, А.П. Шваюк, О.М. Горбенко // Тезисы Х международного конгресса по реабилитации в медицине и иммунореабилитации и III Европейского конгресса по астме. – Афины, Греция, 2005. - Аллергология и иммунология. - 2005. - Т.6, №3. - С.383
- Иммунореабилитация при хронической герпетической инфекции / О.О. Обухова, О.М. Горбенко, А.П. Шваюк, А.В. Обухов, Г.В. Башур, Л.А. Трунова, А.Н. Трунов // Тезисы Х международного конгресса по реабилитации в медицине и иммунореабилитации и III Европейского конгресса по астме. – Афины, Греция, 2005. - Аллергология и иммунология.- 2005. – Т.6, №3.- С.383-384.
- Особенности иммунопатогенеза герпетической инфекции в стадии клинической ремиссии / О.О.Обухова, Л.А.Трунова, А.П. Шваюк, О.М. Горбенко, А.Н. Трунов // Тезисы ХI международного конгресса по реабилитации в медицине и иммунореабилитации и IV Европейского конгресса по астме. – Тенерифе, Канарские острова, Испания, 2006. – Аллергология и иммунология.- 2006.- Т.7, №1.-С.104-105.
- Влияние иммуностимулирующей терапии на динамику концентраций IFN- и продукцию специфических антител у больных хронической герпетической инфекцией / О.О. Обухова, О.М. Горбенко, А.П. Шваюк, А.Н. Трунов, Л.А. Трунова // Тезисы ХI международного конгресса по реабилитации в медицине и иммунореабилитации и IV Европейского конгресса по астме: тез. докл. – Тенерифе, Канарские острова, Испания, 2006. - Аллергология и иммунология. - 2006. - Т.7, №1. -С. 105.
- Особенности иммунопатогенеза хронической герпетической инфекции в стадии клинической ремиссии / О.О. Обухова, Л.А. Трунова, А.П. Шваюк, О.М. Горбенко, А.Н. Трунов // Сибирский консилиум. – 2006. - №3. – С.73 - 78.
- Некоторые аспекты функционирования иммунной системы здоровых доноров в условиях ксеногенного воздействия / О.О. Обухова, А.Н. Трунов, А.П. Шваюк, О.М. Горбенко, А.В. Обухов, С.М. Чорняя // Мед. иммунология. - 2006. - Т.8, №1. - С. 91 - 97.
- Трунова Л.А. Специфическая антителопродукция у больных в период ремиссии герпетической инфекции при иммунокоррекции эхинацеей / Л.А.Трунова, О.О. Обухова, А.Н. Трунов // VI Съезд аллергологов и иммунологов СНГ. Российский национальный конгресс аллергологов и иммунологов. III Российская конференция по иммунотерапии: тез. докл. – Москва, Россия, 2006. - Аллергология и иммунология. - 2006. - Т. 7. - №3. – С. 394-395
- Принципы формирования нормативных значений иммунологических показателей / О.О. Обухова, А.Н. Трунов, А.П. Шваюк, О.М. Горбенко, А.В. Обухов, В.В. Черных, Л.А. Трунова // Проблемы клинической медицины – 2007. - № 4(12). – С. 98-101
- Особенности баланса цитокинов в сыворотке крови пациентов с генитальным герпесом в стадии клинической ремиссии. / Л.А.Трунова, О.О.Обухова, А.П. Шваюк, О.М. Горбенко, Н.И. Анисимова, А.Н. Трунов // V Всемирный конгресс по иммунопатологии и аллергии. V Европейский конгресс по астме: тез. докл. – Москва, Россия, 2007. - Аллергология и иммунология.- 2007. - Т. 8. - №1. – С. 94-95
- Баланс цитокинов у пациентов с обострением хронической герпетической инфекции в динамике иммунокорригирующей терапии / О.О. Обухова, А.Н. Трунов, Л.А. Трунова, А.П. Шваюк, О.М. Горбенко // Иммунология. – 2007. - №6. – С. 335-338
- Фазы развития инфекционно-воспалительного процесса при обострении и ремиссии хронической герпетической инфекции / О.О. Обухова, А.Н. Трунов, А.П. Шваюк, О.М. Горбенко, Л.А. Трунова // «Фундаментальные аспекты компенсаторно-приспособительных процессов»: тез. докл. 3 всерос. науч.-практ. конф. – Новосибирск, 2007. - Сибирский консилиум. – 2007. - № 7(62). – С. 64
- Продукция вируснейтрализующих антител при герпесе в различные фазы инфекционного процесса / О.О. Обухова, А.Н. Трунов, А.П. Шваюк, О.М. Горбенко, Л.А. Трунова //«Фундаментальные аспекты компенсаторно-приспособительных процессов»: тез. докл. 3 всерос. науч.-практ. конф. – Новосибирск, 2007. - Сибирский консилиум. – 2007. - № 7(62). – С. 65
- Динамика продукции интерферона у больных герпетической инфекцией на фоне иммунокоррекции / О.О. Обухова, А.Н. Трунов, О.М. Горбенко, А.П. Шваюк, Л.А. Трунова, А.П. Ковалевский // Вестник новых мед. технологий. – 2008. – № 2. – С. 141-143
- Баланс цитокинов у пациентов с хронической герпетической инфекцией в период ремиссии в динамике иммунокоррекции / О.О. Обухова, А.Н. Трунов, А.П. Шваюк, О.М. Горбенко, Л.А. Трунова // Бюллетень экспериментальной биологии и медицины – 2008., Приложение 1. – С. 63-66
- Взаимосвязь продукции цитокинов в динамике иммунокоррекции эхинацеей при обострении герпетической инфекции / О.О. Обухова, А.Н. Трунов, А.П. Шваюк, О.М. Горбенко, Л.А. Трунова // Мед. Иммунология. – 2008. – Т.10, №2-3. – С. 283-290
- Иммунопатогенетические особенности клинических периодов хронической герпетической инфекции / О.О. Обухова, А.Н. Трунов, Л.А. Трунова, А.П. Шваюк, О.М. Горбенко // Аллергология и иммунология. – 2008. – Т.9, №2. – С. 223-227
- Некоторые эффекты иммуномодулирующей терапии при остром и обострении хронического генитального герпеса / Л.А. Трунова, О.О. Обухова, О.М. Горбенко, А.П. Шваюк, А.Н. Трунов // Международная конференция «Физиология и патология иммунной системы». IV международная конференция по иммунотерапии: тез. докл. – Москва, Россия, 2008. - Аллергология и иммунология. – 2008. – Т.9, № 3. – С. 297
- Способ оценки эффективности лечения хронической герпетической инфекции / А.Н. Трунов, О.О. Обухова, А.П. Шваюк, О.М. Горбенко, Л.А. Трунова / Патент РФ на изобретение № №2331886, дата регистрации (публикации) 2008.08.20, дата приоритета 2007.03.20, заявка на изобретение №2007110276/15. // Официальный бюллетень федеральной службы по интеллектуальной собственности, патентам и товарным знакам «Изобретения. Полезные модели». – 2008. - № 23. – С. 1-7
Список использованных сокращений
| AГ | - антиген |
| AT | - антитело |
| ААТ | - аутоантитело |
| ВПГ | - вирус простого герпеса |
| ГИ | - герпетическая инфекция |
| дДНК | - денатурированная ДНК |
| ИЛ | - интерлейкин |
| ИЛ-1 | - интерлейкин -1 |
| ИЛ-2 | - интерлейкин - 2 |
| ИЛ-4 | - интерлейкин - 4 |
| ИЛ-6 | - интерлейкин - 6 |
| ИФА | - иммуноферментный анализ |
| ИФН- | - интерферон- |
| нДНК | - нативная ДНК |
| ХГИ | - хроническая герпетическая инфекция |
| ЦИК | - циркулирующие иммунные комплексы |
| IgА | - иммуноглобулин А |
| IgG | - иммуноглобулин G |
| IgМ | - иммуноглобулин М |
| HSV | -герпесвирус |
| HSV- инфекция | - герпесвирусная инфекция |
Соискатель

