Ивановна геморрагическая трансформация инфаркта головного мозга: клинико-томографическая структура, факторы риска, влияние на ранний клинический исход
На правах рукописи.
Батищева Елена Ивановна
ГЕМОРРАГИЧЕСКАЯ ТРАНСФОРМАЦИЯ ИНФАРКТА ГОЛОВНОГО
МОЗГА: КЛИНИКО-ТОМОГРАФИЧЕСКАЯ СТРУКТУРА,
ФАКТОРЫ РИСКА,
ВЛИЯНИЕ НА РАННИЙ КЛИНИЧЕСКИЙ ИСХОД
14.00.13. – « Нервные болезни»
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
МОСКВА – 2009
Работа выполнена в ФГУ «Национальный медико-хирургический центр
им. Н.И.Пирогова Росздрава».
Научный консультант:
Доктор медицинских наук, профессор Кузнецов Алексей Николаевич
Официальные оппоненты:
Доктор медицинских наук, профессор Виленский Борис Сергеевич
Доктор медицинских наук, профессор Широков Евгений Алексеевич
Доктор медицинских наук, профессор Пышкина Людмила Ильинична
Ведущая организация:
ГОУ ВПО «Московская медицинская академия им. И.М. Сеченова Росздрава».
Защита состоится _________________ 2009 года в ____ часов на заседании диссертационного совета ДМ 208.041.04 при ГОУ ВПО «Московский государственный медико-стоматологический университет Росздрава» (Москва, ул. Долгоруковская, д.7, строение 4 – кафедра истории медицины).
Почтовый адрес – 127473, Москва, Делегатская ул., д.20/1.
С диссертацией можно ознакомиться в библиотеке Московского государственного медико-стоматологического университета (127206, Москва, ул. Вучетича, д. 10а).
Автореферат разослан «____» 2009 года.
Ученый секретарь диссертационного совета Т.Ю.Хохлова
кандидат медицинских наук, доцент
Актуальность исследования
Острые нарушения мозгового кровообращения являются важнейшей медико-социальной проблемой, что обусловлено их значительной долей в структуре заболеваемости и смертности населения, высоким уровнем временных трудовых потерь и первичной инвалидности [Скворцова В.И., 2007].
По данным ВОЗ частота возникновения инсультов в мире составляет около 200 случаев на 100 тыс. населения ежегодно. В России, как показывает национальный регистр, ежегодно наблюдаются 450 000 больных инсультом, а смертность от цереброваскулярных заболеваний достигла 175 на 100 тыс. населения, занимая второе место в структуре общей смертности населения России и в структуре смертности от болезней системы кровообращения. Причем ранняя 30-дневная летальность после инсульта составляет 32-42%, а в течение года умирают около 50% больных, то есть каждый второй заболевший. В связи с вышесказанным изучение цереброваскулярных заболеваний является одним из приоритетных направлений отечественной неврологии [Скворцова В.И., 2007].
В структуре церебральных инсультов преобладают ишемические поражения головного мозга, доля которых достигает 80-85% [Скворцова В.И., 2001; Яхно Н.Н., 2001; Верещагин Н.В., 2003]. Согласно современным представлениям, ишемический инсульт – это сложный многокомпонентный клинический синдром, развивающийся во времени и пространстве [Суслина З.А., Пирадов М.А., Танашян М.М., 2005]. Обширность ишемического процесса и степень повреждения структур мозга определяют различную выраженность неврологического дефицита и могут инициировать последующее развитие геморрагической трансформации (ГТ) инфаркта головного мозга [Lodder J. et al, 1986; Alexandrov A.V. et al., 1997; Larrue V. et al., 2001; Khatri P. et al., 2007]. В доступной отечественной литературе мы обнаружили только единичные упоминания, посвященные изучению ГТ инфаркта головного мозга [Виленский Б.С., 1995; Шевченко Ю.Л., Одинак М.М., Михайленко А.А., Кузнецов А.Н., 1997; Суслина З.А., Пирадов М.А., 2005].
По мнению некоторых авторов, инсульт, сопровождающийся вторичным интраишемическим кровоизлиянием, является особенно трудным для диагностики и лечения видом инсульта [Horning C.R. et al., 1986; Ворлоу Ч.П. с соавт., 1998]. Подлинную частоту спонтанных ГТ вне специальных исследований практически невозможно определить, так как в большинстве случаев они протекают без клинического утяжеления состояния больного, то есть асимптомно и, как правило, не диагностируются [Kent D.M. et al., 2004; Trouillas P., von Kummer R., 2006; Khatri P. et al., 2007]. Это ставит под сомнение утверждение ряда исследователей, которые рассматривают любое кровоизлияние в ишемизированную мозговую ткань как осложнение в течении инсульта. Кроме того, получаемый нейровизуальный спектр ГТ довольно широк – от небольших петехий до обширных гематом. Поэтому абсолютное отождествление геморрагического инфаркта (ГИ) и геморрагической трансформации инфаркта головного мозга, приводимое в некоторых отечественных и зарубежных публикациях, нецелесообразно. Очевидно, что на сегодняшний день имеется много не имеющих ответа вопросов относительно причин возникновения геморрагической трансформации инфаркта мозга. Факторы риска развития ГТ в настоящее время в литературе рассматриваются в основном применительно к реперфузионной терапии [Montaner J. et al, 2003; Derex L. et al, 2005; Khatri P. et al, 2007] и почти не упоминаются при естественном течении процесса.
Немногочисленные результаты изучения вариантов развития ГТ, их клинического и прогностического значения представлены в основном зарубежными исследователями в протоколах по использованию различных видов тромболитической терапии [The NINDS rt-PA Stroke Study Group, 1997; Hacke W. et al, 1998; Tong D.C. et al, 2001; Molina C.A. et al, 2002; Rha J., Saver J.L., 2007], в доступной отечественной литературе отсутствуют вовсе.
Цель исследования
Изучить особенности клинической картины, томографические варианты развития геморрагической трансформации инфаркта головного мозга, факторы риска ее возникновения, влияние на ранний клинический исход заболевания.
Задачи исследования
- Уточнить варианты клинического течения и томографического проявления геморрагической трансформации инфаркта головного мозга вне тромболитического лечения, выполнить клинико-томографическое сопоставление.
- Установить количественные критерии ухудшения неврологического статуса пациента при симптомной ГТ.
- Сопоставить клиническую картину заболевания у больных с ишемическим инфарктом головного мозга без геморрагической трансформации и у больных с геморрагической трансформацией инфаркта головного мозга, выявить особенности клинической картины дебюта инсульта с последующим развитием интраишемического кровоизлияния.
- Провести сравнительный анализ факторов риска развития ишемического инсульта у больных с геморрагической трансформацией инфаркта головного мозга и у больных без трансформации. Выявить факторы риска развития интраишемического кровоизлияния.
- Методом логистической регрессии установить факторы, в наибольшей степени определяющие вероятность развития геморрагической трансформации ишемического инфаркта головного мозга.
- Определить факторы риска развития интраишемических паренхимальных гематом у больных с инфарктом головного мозга.
- Сопоставить ранний клинический исход у больных с различными видами геморрагических трансформаций инфаркта головного мозга и у пациентов без геморрагической трансформации.
- Методом логистической регрессии установить факторы, оказывающие наибольшее влияние на вероятность развития неудовлетворительного исхода заболевания у больных с геморрагической трансформацией инфаркта головного мозга.
Научная новизна работы
Впервые на большом клиническом материале вне тромболитического лечения произведено изучение геморрагической трансформации инфаркта головного мозга, оценена клинико-томографическая структура интраишемических кровоизлияний.
Показаны особенности клинической картины дебюта ишемического инсульта, предрасполагающие к последующему развитию геморрагической трансформации, в том числе и большего объема.
Впервые вне тромболитического лечения установлены факторы риска развития ГТ, определена доминирующая роль кардиоэмболического механизма ишемического инсульта и тяжести неврологического дефицита в дебюте заболевания в последующем возникновении интраишемического кровоизлияния. С применением метода logit-регрессии создана математическая модель, позволяющая прогнозировать вероятность возникновения геморрагической трансформации инфаркта головного мозга. Доказано влияние мерцательной аритмии, гипергликемии, повышенного уровня диастолического артериального давления на формирование вторичного кровоизлияния большего объема – паренхимальной гематомы, установлены факторы, не влияющие на размеры кровоизлияния.
Впервые определено прогностическое значение возникшего интраишемического кровоизлияния и отдельных его видов. Доказана главенствующая роль первоначальной тяжести инсульта и обширности области ишемического повреждения, а не развившейся геморрагической трансформации в формировании раннего неудовлетворительного исхода заболевания. Установлено, что в качестве осложнения течения ишемического инсульта следует рассматривать только развитие ГТ симптомного типа либо развитие ГТ в виде паренхимальной гематомы 1-го или 2-го типа.
Практическая значимость
Доказана необходимость клинической и томографической дифференциации геморрагических трансформаций инфаркта головного мозга. Объективизирован подход к выявлению среди пациентов с ишемическим инсультом клинически значимых и прогностически более неблагоприятных форм геморрагической трансформации.
Предложен и внедрен новый способ определения вероятности возникновения геморрагической трансформации инфаркта головного мозга уже в дебюте ишемического инсульта.
Разработан и внедрен способ прогнозирования неудовлетворительного раннего клинического исхода заболевания уже на ранних сроках развившегося инфаркта мозга независимо от наличия или отсутствия ГТ.
На основании установленных факторов риска предложены новые подходы к профилактике клинически значимых и более обширных интраишемических кровоизлияний.
Предложена тактика ведения больных с геморрагической трансформацией на этапе острого периода инсульта в зависимости от обширности и локализации вторичного кровоизлияния. Оптимизирована антитромботическая и гипотензивная терапия у больных с развившейся геморрагической трансформацией в зависимости от вида геморрагической трансформации инфаркта головного мозга, механизма развития инсульта, а также наличия у пациента сопутствующей патологии.
Обоснована возможность использования терминологии «симптомная геморрагическая трансформация инфаркта головного мозга» или «паренхимальная гематома 1-го или 2-го типа» при формулировании клинического диагноза у пациента с ишемическим инсультом в рубрике «осложнения». И, напротив, определена роль ГТ асимптомного типа и ГИ-1, ГИ-2 в качестве маркеров положительного исхода.
Основные положения, выносимые на защиту
- Геморрагическая трансформация инфаркта головного мозга характерна для инсультов умеренной или выраженной степени тяжести с большими или обширными размерами зоны ишемического повреждения.
- Кардиоэмболический инсульт имеет особое, но не эксклюзивное предрасположение к геморрагической трансформации инфаркта, которое наиболее проявляется в случае развития инсультов незначительной и умеренной тяжести.
- Мерцательная аритмия является не только наиболее частым потенциальным источником кардиогенной церебральной эмболии, но и предиктором интраишемического кровоизлияния, особенно – паренхимальной гематомы.
- Повышенный уровень артериального давления в первые несколько суток инсульта является фактором риска геморрагической трансформации инфаркта головного мозга, а диастолическая гипертензия – ее симптомного клинического течения.
- Неблагоприятный клинический исход ишемического инсульта в большей степени определяется обширностью повреждения и выраженностью неврологического дефицита в дебюте заболевания, чем развитием геморрагической трансформации инфаркта.
- При равной исходной тяжести ишемических инсультов развитие геморрагической трансформации в случае ее асимптомного характера улучшает ранний клинический исход заболевания, в случае симптомного течения – ухудшает исход.
- В качестве осложнения ишемического инсульта следует рассматривать только развитие симптомных геморрагических трансформаций или паренхимальной гематомы.
Внедрение результатов исследования в практику
Результаты исследования внедрены в практическую деятельность Национального центра патологии мозгового кровообращения «Национального медико-хирургического центра им. Н.И.Пирогова Росздрава» (г. Москва).
Основные научно-практические положения диссертации используются в учебном процессе на кафедре нервных болезней и нейрохирургии института усовершенствования врачей ФГУ «Национальный медико-хирургический центр им. Н.И.Пирогова Росздрава».
Личный вклад автора в выполнение данной работы
Тема и план диссертации, ее основные идеи и содержание разработаны совместно с научным консультантом на основании многолетних (20042007 гг.) целенаправленных исследований. Во всех совместных исследованиях по теме диссертации автору принадлежит формулирование общей цели и задач конкретной работы, а также анализ полученных данных.
Автором лично было проведено клиническое обследование рассматриваемого контингента больных, сопоставление полученных результатов с данными параклинических методов диагностики, применяемых у пациентов в остром периоде ишемического инсульта.
Диссертационное исследование выполнено по проблеме «Геморрагическая трансформация ишемического инсульта: этиопатогенез, клиническая картина, методы диагностики, лечение и профилактика» и входит в план НИР ФГУ «Национальный медико-хирургический центр им. Н.И.Пирогова Росздрава».
Результаты комплексного обследования составили содержание работы и легли в основу положений, выносимых на защиту.
Апробация работы
Основные положения диссертации доложены на II Российском Международном конгрессе «Цереброваскулярная патология и инсульт» (Санкт-Петербург 2007 г.); 1-ом Всемирном конгрессе «Controversies in neurology» (Берлин 2007 г.); Конгрессе по цереброваскулярной патологии (Нидерланды 2008 г.); II Всероссийской научно-практической конференции с международным участием «Современные методы диагностики и лечения кардиальной и церебральной патологии» (Светлогорск 2008 г.); X Международной конференции «Актуальные вопросы неврологии» (Судак 2008г.); VII Европейской конференции по инсульту (Ницца 2008 г.); I Национальном конгрессе «Кардионеврология» (Москва 2008 г.), XI Международной конференции «Новые стратегии в неврологии» (Судак 2009 г.).
Диссертация апробирована на совместном заседании кафедр нервных болезней с курсом нейрохирургии, лучевой диагностики, сердечнососудистой хирургии с курсом эндоваскулярной хирургии, внутренних болезней ИУВ ФГУ «НМХЦ им. Н.И. Пирогова Росздрава» 28 января 2009 года.
По теме диссертационного исследования опубликована 21 печатная работа, из них 11 публикаций в журналах, рекомендованных ВАК. Положения диссертации легли в основу монографии «Геморрагическая трансформация инфаркта головного мозга» (2009 г. в соавторстве с Кузнецовым А.Н).
Объем и структура диссертации
Диссертация состоит из следующих разделов: введение, обзор литературы, материал и методы исследования, результаты собственных исследований, обсуждение результатов, выводы и практические рекомендации. Работа изложена на ….. страницах печатного текста, иллюстрирована… таблицами и …рисунками. Библиографический указатель содержит… источников: …отечественных и ….зарубежных.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В соответствии с задачами исследования проведено комплексное обследование 239 человек с ишемическим инсультом головного мозга в остром периоде, находившихся на лечении в Национальном центре патологии мозгового кровообращения ФГУ НМХЦ им. Н.И.Пирогова (г. Москва) и неврологическом отделении ОКБ Святителя Иоасафа (г. Белгород) с 2004 по 2007 годы. Критерием исключения из исследования явилось наличие первичного внутричерепного кровоизлияния (ВЧК), инфаркт мозга вследствие травмы, инфекции или опухоли, а также развитие ОНМК в виде транзиторной ишемической атаки. Никто из обследованного контингента не получал тромболитические препараты.
Для анализа полученных данных все исследуемые больные (n=239) были разделены на две группы: пациенты, имеющие ишемический инсульт головного мозга – Группа А (n=164) и пациенты, перенесшие геморрагическую трансформацию ишемического очага – Группа Б (n=75). Характеристика каждой из групп представлена в таблице 1.
Таблица 1. Характеристика обследованного контингента.
| Признак | Группа А Больные, перенесшие ишемический инсульт (n=164) | Группа Б Больные, перенесшие ишемический инсульт с ГТ (n=75) |
| Женщины | 75 (45,7%) | 29 (38,7%) |
| Мужчины | 89 (54,3%) | 46 (61,3%) |
| Средний возраст | 65,8±11,7 (от 40 до 89 лет) | 59,9±15,4 (от 18 до 84 лет) |
*p<0,05;
Группы достоверно не различались между собой по половой принадлежности и возрасту. Средний возраст пациентов в группе с ишемическим инсультом составил 65,8±11,7 года (от 40 до 89 лет). В группе больных с геморрагической трансформацией - 59,9±15,4 года, здесь возрастной диапазон составил от 18 до 84 лет.
Всему обследованному контингенту на 1-е и 21-е сутки заболевания, а при ухудшении состояния внепланово проводили оценку тяжести клинического и функционального состояния, для чего использовали стандартизированные шкалы. Выраженность неврологического дефицита устанавливали по шкале Национального института неврологических заболеваний и инсульта США– NIHSS (National Institutes of Health Stroke Scale) (Brott T., Adams H.P., Olinger C.P. et al., 1989), глубину угнетения сознания определяли с использованием шкалы ком Глазго. Выраженность функциональных нарушений устанавливали согласно модифицированной шкале Ранкин.
Нейровизуализацию (СКТ и/или МРТ) выполняли на 1-ый, 2-ой и 21-ый дни заболевания, а при ухудшении состояния – внепланово. В том случае, если пациент поступал не в первые сутки заболевания, томографическое обследование проводили в день поступления. СКТ проводили на аппаратуре Somatom Sensation (Siemens), Hi Speed NX/ I (General Electric). Использовали стандартное сканирование в аксиальной плоскости. Для МР-исследования пользовались оборудованием Giroscan INTERA NOVA (Toshiba), Signa Infinity (General Electric) напряжением магнитного поля 1,5 и 1 Тесла. Оно включало: традиционную МРТ (Т1- и Т2-ВИ), T2 Flair – с использованием импульсных последовательностей быстрая инверсия-восстановление с ослаблением сигнала от жидкости, в некоторых случаях - МР-диффузию.
При оценке результатов СКТ и МРТ обращали внимание на:
- возможное наличие объемного образования и другого несосудистого поражения головного мозга
- наличие или отсутствие первичного ВЧК;
- наличие или отсутствие ишемии;
- размер зоны ишемии;
- принадлежность зоны ишемии к тому или иному сосудистому бассейну кровоснабжения;
-наличие или отсутствие геморрагической трансформации ишемического очага;
- объем и насыщенность геморрагии в зоне ишемии;
- расположение геморрагической трансформации в ишемическом очаге;
- наличие или отсутствие геморрагии за пределами зоны ишемии – экстраишемических очагов: а) интрапаренхимальных кровоизлияний не в зоне инфаркта; б) экстрапаренхимальных (интравентрикулярных, субарахноидальных) очагов;
- наличие перифокального отека и масс-эффекта;
В определении размеров ишемического инсульта (ИИ) мы пользовались классификацией ГУ Научного центра неврологии РАМН, в соответствии с которой выделяли: обширные инфаркты; большие; средние; малые – небольшие очаги размером 5-15 мм в диаметре.
С целью территориального уточнения расположения ишемии различали инсульты, возникшие:
- в бассейне средней мозговой артерии (СМА) (левого и правого полушария головного мозга);
- в бассейне передней мозговой артерии (ПМА);
- в бассейне задней мозговой артерии (ЗМА);
- в бассейне позвоночных (ПА)/основной артерий (ОА);
- вследствие закупорки внутренней сонной артерии (ВСА);
Отдельно выделяли инсульты, развившиеся в М-1 сегменте СМА и в более дистальных отделах СМА.
Томографический характер развившейся вторичной геморрагии устанавливали согласно ECASS-I и ECASS-II классификации (European Cooperative Acute Stroke Study Group) с подразделением ГТ ишемического очага на 4 типа:
1) геморрагический инфаркт 1 типа (ГИ-1) - маленькие петехии вдоль границы инфаркта;
2) геморрагический инфаркт 2 типа (ГИ-2) - более расплывчатые сливные петехии в ишемической зоне без масс-эффекта;
3) паренхимальная гематома 1 типа (ПГ-1) - гематома, занимающая менее 30% зоны инфаркта с небольшим масс-эффектом;
4) паренхимальная гематома 2 типа (ПГ-2) - плотная гематома, занимающая более 30% зоны инфаркта с существенным масс-эффектом, либо любое интракраниальное геморрагическое проявление вне зоны инфаркта.
Клинико-неврологическое, нейровизуальное обследование пациентов дополняли расширенной программой инструментального и лабораторного обследования.
Сосудистую визуализацию осуществляли посредством ультразвукового триплексного сканирования экстра- и интракраниальных артерий, для чего пользовались аппаратурой VIVID-7 (General Electric) с линейными датчиками для локации на частотах 5 и 7,5 МГц. Допплерографическое обследование проводилось на аппарате EME Nicolet Companion, с набором датчиков для экстракраниальной и транскраниальной локации артерий (2 МГц, 4 МГц, 8 МГц). Оценивали степень стено-окклюзирующего поражения брахиоцефальных и церебральных артерий, состояние устьев общих сонных, подключичных и позвоночных артерий, кровоток внутри сосудов, степень его турбулентности, наличие атеросклеротических бляшек, их структуру, протяженность, эмбологенность, наличие пристеночного тромбообразования. Измеряли диаметр артерии, степень стеноза. При необходимости сопровождали выше описанное исследование эмболодетекцией. В некоторых случаях применяли КТ-ангиографию и/или бесконтрастную (3D TOF) МР-ангиографию, инвазивную субтракционую церебральную ангиографию. Данные исследования выполняли для визуализации сосудов головного мозга, установления и дифференциации острой окклюзии мозговой артерии (тромбоз/эмболия) или сформировавшихся ранее стенозов/окклюзий.
Для выявления кардиальной патологии наряду с традиционной ЭКГ выполняли трансторакальную и/или трансэзофагеальную эхокардиографию, позволявшую детектировать наличие потенциальных источников эмболии клапанного и неклапанного происхождения. Для этого пользовались ультразвуковым аппаратом VIVID-7 (General Electric).
Особое внимание уделяли мониторированию систолического и диастолического АД в течение первых двух суток от момента возникновения инсульта, для чего пациентам измеряли артериальное давление не менее 5 раз в день. Артериальное давление измерялось постоянно на одной и той же руке, а в случае разности давления на руках, использовалось большее значение. Максимальное систолическое и максимальное диастолическое АД, зафиксированное в 1-е и 2-е сутки заболевания, было включено в анализ.
Среди лабораторных исследований обращали внимание на состояние системы свертывания крови, липидный спектр, отдельные показатели биохимического анализа крови (глюкоза, мочевина, креатинин). Уровень сахара крови определяли ежедневно на протяжении первой недели инсульта, среднее значение было включено в анализ.
Геморрагические трансформации в зависимости от наличия или отсутствия клинически зафиксированного утяжеления в состоянии пациента подразделяли на симптомные или асимптомные. Симптомный характер кровоизлияния устанавливали по определению NINDS: «Это любое кровоизлияние, зафиксированное на снимках КТ, которое было связано по времени с ухудшением клинического состояния пациента при отсутствии кровоизлияния на предварительном КТ сканировании» [The NINDS rt-PA Stroke Study Group, 1997]. В случае симптомного характера течения ГТ изменения в состоянии больного оценивали динамически в день предполагаемой вторичной геморрагии с использованием оценочных шкал NIHSS и Глазго. Дополнительной оценке в это же время подвергали уровень максимального систолического и максимального диастолического АД, уровень глюкозы плазмы. В случае появления менингеального синдрома или нарастания головной боли исследовали возможное наличие экстрапаренхимальных очагов кровотечения по результатам нейровизуализации, в ряде случаев – по данным диагностической люмбальной пункции.
Были проанализированы возможные факторы риска развития цереброваскулярной патологии у обследованных больных, для чего пользовались анамнестическими данными, имевшейся медицинской документацией, результатами дополнительных методов исследования, проведенных в стационаре. Отдельно уточнялось наличие перенесенных ранее цереброваскулярных событий, их характер и количество (инсульты, ТИА) с уточнением пораженного артериального бассейна.
На основании полученных анамнестических сведений, результатов клинического и параклинического обследования устанавливали подтип настоящего ишемического инсульта. Для этого использовали TOAST Stroke Subtype>
СТАТИСТИЧЕСКАЯ ОБРАБОТКА
Для сравнения несвязанных групп по количественным и порядковым признакам применялся непараметрический дисперсионный анализ по Крускалу-Уоллесу, критерий Манна-Уитни. Сравнение несвязанных групп по качественным признакам проводилось с использованием теста 2 и точного критерия Фишера. Для оценки влияния количественных признаков на качественный результат пользовались методом logit- регрессии. Статистически значимые различия устанавливались на уровне не менее 0,95. Расчеты проводились с использованием программного продукта Statsoft Statistica 6.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Большинство из геморрагических трансформаций протекало без клинического утяжеления состояния пациента. Количество больных с асимптомной ГТ составило 56 (74,7% случаев).
У остальных 19 пациентов (25,3%) выявлен симптомный характер ГТ. В этой группе развитие ГТ сопровождалось некоторым нарастанием степени угнетения сознания, утяжелением неврологического дефицита в виде увеличения выраженности пареза, афатических нарушений, появлением менингеального синдрома, в ряде случаев - усилением дислокационных проявлений. Полученный нами клинический спектр трансформаций с превалированием асимптомных ГТ над симптомными почти втрое указывает на значительную частоту такого клинического явления, как асимптомная геморрагическая трансформация ишемического инфаркта головного мозга, а клинически «немое» протекание не позволяет с достоверной точностью установить период их появления. Результаты проведенного исследования указывают, что в первые 48 часов ишемического инфаркта произошло 23 геморрагические трансформации (30,7%), 14 из 19 (73,7%) симптомных ГТ были выявлены в 1-ю неделю инфаркта.
При анализе данных динамического наблюдения за больными с симптомными ГТ выявлено, что клиническое утяжеление состояния пациента, воспринимаемое как нарастание симптомов инсульта, имело очерченное балльное выражение с достоверным (p=0,01) увеличением значения Шкалы NIHSS в среднем на 4 балла, и уменьшением значения Шкалы Глазго в среднем на 1 балл (p=0,05) (рис. 1).
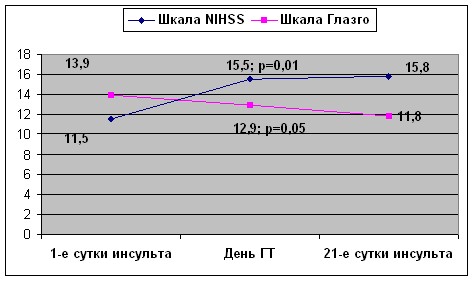
Рисунок 1. Динамика неврологического статуса у пациентов с симптомными ГТ в течение острого периода инсульта.
Полученная нами информация может быть использована для создания стандартизированного критерия симптомности для спонтанных геморрагических трансформаций инфаркта головного мозга по примеру PROACT-критериев для тромболизиса. Рисунок 1, отражающий динамику клинического состояния «симптомных» пациентов, убедительно демонстрирует, что нарастание степени выраженности неврологического дефицита, степени угнетения сознания, произошедшее в день ГТ, сохранялось длительное время и не возвращалось на уровень показателей, зафиксированных в дебюте заболевания. Это говорит о весомом вкладе вторичной симптомной геморрагии в клиническую картину заболевания и последующий прогноз и позволяет расценивать вторичную спонтанную геморрагию симптомного типа как осложнение в течении инсульта.
У обследованных нами 75 пациентов Группы Б распределение имеющихся геморрагических трансформаций инфаркта головного мозга по томографическим вариантам выглядело следующим образом: ГИ-1 был диагностирован у 32 больных (42,7%), ГИ-2 – у 19 (25,3%), ПГ-1 была выявлена у 15 пациентов (20%), ПГ-2 – у 9 (12%) (рис. 2).
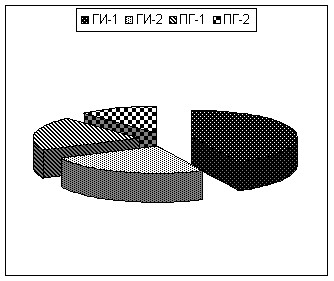
Рисунок 2. Распределение томографических вариантов геморрагической трансформации инфаркта головного мозга.
В то же время симптомный характер течения ГТ - это исключительно клиническое понятие. Невозможно, чтобы утяжеление в состоянии больного совпадало с любым вторичным кровоизлиянием, выявленным при КТ. Произведенное в работе клинико-томографическое сопоставление выглядело следующим образом и представлено в таб. 2 и на рис. 3.
Таблица 2. Структура клинических и томографических вариантов ГТ.
| Томографический вариант ГТ | Симптомные ГТ (n=19) | Асимптомные ГТ (n=56) |
| Геморрагический инфаркт 1 типа | 5,3% | 55,4%**** |
| Геморрагический инфаркт 2 типа | 21,1% | 26,8% |
| Паренхимальная гематома 1 типа | 36,8%*** | 14,3% |
| Паренхимальная гематома 2 типа | 36,8%*** | 3,5% |
| Экстрапаренхимальное кровоизлияние | 26,3%* | 1,8% |
*p<0,05;***p<0,001;****p<0,0001;
Таким образом, асимптомные геморрагические трансформации в 82,2% случаев были представлены ГИ 1-го и 2-го типа, причем наиболее часто встречался ГИ-1 (55,4% против 5,3%; p<0,0001). Среди симптомных интраишемических геморрагий превалировали ПГ-1 и ПГ-2 типа в равных долях, в совокупности составляя 73,6% (p<0,001). Экстрапаренхимальные кровоизлияния (субарахноидальные или интравентрикулярные), являющиеся одним из вариантов или составных частей ПГ-2, в 5 случаев из 6 протекали симптомно и составили 26,3% симптомных геморрагий.
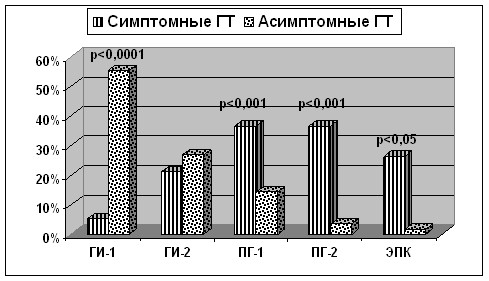
ЭПК – экстрапаренхимальное кровоизлияние
Рисунок 3. Распределение клинических и томографических вариантов ГТ.
Среди всего обследованного контингента было произведено изучение значимости локализации закупорки церебральной артериальной системы для последующего развития ГТ инфаркта головного мозга. Частота поражения того или иного церебрального бассейна кровоснабжения в каждой из исследованных нами групп пациентов имела некоторые особенности и представлена в таблице 3.
Таблица 3. Частота встречаемости ИИ и ИИ с геморрагической трансформацией очага в различных сосудистых бассейнах.
| Бассейн пораженной артерии | Пациенты, перенесшие ишемический инсульт (n=164) | Пациенты, перенесшие инсульт с ГТ (n=75) |
| Левая СМА | 59 (35,9%) | 30 (40%) |
| Правая СМА | 43 (26,2%) | 21 (28%) |
| ПМА | 2 (1,2%) | 0% |
| ЗМА | 18 (11%) | 7 (9,3%) |
| ПА/ОА | 39 (23,8%)** | 3 (4%) |
| ВСА | 3 (4,7%) | 14 (18,7%)*** |
| М-1 сегмент СМА | 8 (4,95%) | 11 (14,7%)** |
| Дистальные ветви СМА | 94 (57,3%) | 40 (53,3%) |
**p<0,01;***p<0,001;
Наличие закупорки М-1 сегмента СМА среди больных с ГТ было зафиксировано у 11 пациентов (14,7%), а у больных группы А – у 8 (4,95%; P<0,01). Инфаркт в более дистальных ветвях СМА диагностировался в группе с ГТ у 40 больных (53,3%), в группе без интраишемической геморрагии у 94 (57,3%). Анализируя вышеуказанные данные, можно сделать вывод, что ишемические инсульты и инсульты, сопровождающиеся геморрагической трансформацией, с одинаковой частотой наблюдаются в артериях каротидного бассейна кровоснабжения обеих сторон (ЛСМА, ПСМА, ПМА), а также ЗМА. Развитие ишемии в бассейне ПА/ОА значительно реже сопровождалось геморрагической трансформацией (P<0,01). Напротив, поражение крупных артерий, таких как ВСА и М-1 сегмент СМА вызывало последующую геморрагическую конверсию в 14 случаях из 75 (18,7%) и 11 из 75 (14,7%) и наблюдалось только у 3-х и 8 пациентов, соответственно, из группы с ишемическим инсультом без ГТ P<0,001 и P<0,01. Объяснение этому очевидно, поскольку окклюзия артерии большого диаметра вызывает обширный территориальный инфаркт с высокой вероятностью возникновения патологически повышенной проницаемости стенок сосудов, в том числе с некрозом сосудистой стенки и увеличивает вероятность последующей геморрагической трансформации ишемической области.
Обширность ишемической зоны – это другой из потенциальных предикторов развития ГТ, изученный нами и показавший свою значимость (рис. 4).
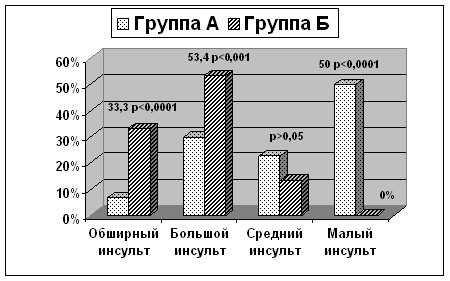 Рисунок 4. Частота встречаемости инфарктов головного мозга различного размера среди обследованных группы А и группы Б.
Рисунок 4. Частота встречаемости инфарктов головного мозга различного размера среди обследованных группы А и группы Б.
Полученные данные указывают, что обширные и большие инсульты достоверно чаще сопровождались геморрагической трансформацией и были зарегистрированы, соответственно, у 33,3% и 53,4% пациентов с геморрагической трансформацией ИИ и только у 6,7% и 20,7% пациентов группы сравнения (без геморрагии) (p<0,0001 и p<0,001). В свою очередь, инсульты среднего размера несколько преобладали в группе А. Малый размер инсульта наблюдался у половины больных группы А, в группе Б не встречался вовсе (50% против 0%; p<0,0001).
Обширные и большие размеры очагов ишемии подразумевают развитие инсультов, сопровождающихся выраженным неврологическим дефицитом уже в дебюте заболевания, что и было установлено по результатам проведенного исследования среди пациентов с развившейся геморрагической трансформацией. Данные сопоставления функционального и неврологического статуса в дебюте инсульта у пациентов с наличием и отсутствием ГТ приведены в таблице 4.
Таблица 4. Неврологический и функциональный статус обследованного контингента в 1-е сутки заболевания.
| Оценка клинического состояния и функционального статуса пациента в 1-е сутки заболевания согласно шкалам: | Группа А Больные, перенесшие ишемический инсульт (n=164) (M±m) | Группа Б Больные, перенесшие ишемический инсульт с ГТ (n=75) (M±m) |
| NIHSS Глазго Ранкин | 7,9±4,1 14,4±1,6 3,1±0,8 | 11,5±6,0**** 13,7±2,2**** 3,8±1,1**** |
*****p<0,00001;
Пациенты с развившейся впоследствии геморрагической трансформацией инфаркта головного мозга имели в дебюте заболевания более выраженный неврологический дефицит по шкале NIHSS (11,5±6,0 против 7,9±4,1; p<0,0001), более глубокий уровень угнетения сознания (13,7±2,2 против 14,4±1,6; p<0,0001) и худший функциональный статус (3,8±1,1 против 3,1±0,8; p<0,0001).
Достаточно наглядный результат дает сопоставление частоты встречаемости в 1-е сутки инсульта легко выраженных, умеренных и выраженных изменений неврологического статуса в изучаемых группах пациентов (рис. 5).
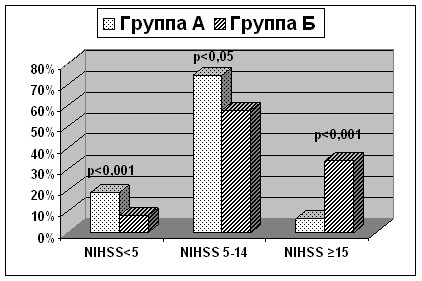
Рисунок 5. Частота встречаемости изменений неврологического статуса по шкале NIHSS различной степени выраженности в 1-е сутки инсульта у пациентов групп А и Б.
В 1-е сутки у пациентов группы А легко выраженные изменения неврологического статуса диагностировались почти у каждого пятого больного (18,9%), в то время как у больных с развившейся в последующем ГТ только у 8% (p<0,001). Неврологические изменения средней степени выраженности (от 5 до 14 баллов по шкале NIHSS) в обеих группах были преобладающими, но достоверно чаще (p<0,05) обнаруживались у больных группы А. В то же время, почти у трети пациентов с развившимся позднее интраишемическим кровоизлиянием с первых суток заболевания наблюдался выраженный неврологический дефицит (NIHSS 15), в группе А – у 6,7% обследованных (p<0,001). Таким образом, геморрагические трансформации наиболее характерны для инсультов с тяжестью неврологического дефицита в дебюте заболевания более 15 баллов.
Полученные нами результаты указывают на бесспорную значимость таких параметров, как исходно высокая тяжесть инсульта и развитие крупного территориального инфаркта в каротидном бассейне в последующем возникновении спонтанных вторичных геморрагий.
В группе больных с геморрагической трансформацией установлено преобладание выраженных неврологических нарушений в виде высокой частоты гемиплегии: у 23 больных (31,1%) (против 6,7% в группе А; P<0,0001); грубых чувствительных нарушений – у 32 больных (43,2%) (против 9,1% в группе А; P<0,0001). Также со значительной частотой, как видно из рисунка 6, в группе пациентов с ГТ, диагностировались гемипарез (29 пациентов), гемианопсия (13 пациентов), афатические нарушения (28 пациентов), интеллектуально-мнестические расстройства (12 пациентов), характерные для обширных полушарных инсультов. В то же время для больных группы А более характерными оказались проявления поражения стволовых структур головного мозга, мозжечка и его связей. Вестибулоатактический синдром наблюдался у 64 пациентов (39%) из группы с ИИ без геморрагии против 12,2% в группе с ГТ; P<0,01. (рис.6).
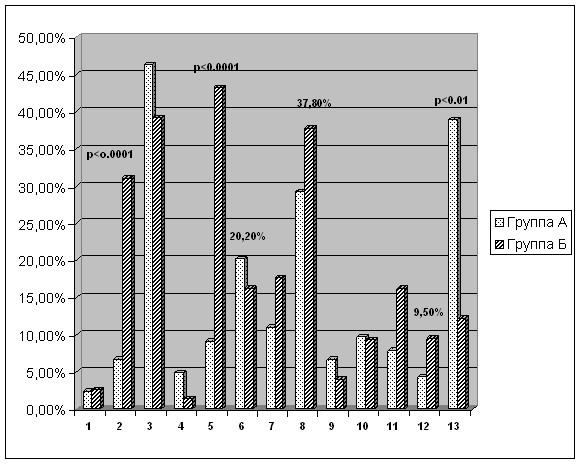
Рисунок 6. Частота развития различных неврологических синдромов у больных с ишемическим инсультом головного мозга (Группа А) и больных с ГТ ишемического очага (Группа Б).
Условные обозначения: 1-тетрапазез; 2-гемиплегия; 3-гемипарез; 4- монопарез; 5-гемигипестезия; 6-пирамидная недостаточность; 7-гемианопсия; 8-афатические нарушения; 9-бульбарные расстройства; 10-псевдобульбарные расстройства; 11-интеллектуально-мнестические расстройства; 12-глазодвигательные расстройства; 13-вестибулоатактический синдром.
Полученные данные обусловлены более частым развитием геморрагической трансформации на фоне значительных по размеру корково-подкорковых ишемических инсультов в каротидном бассейне, затрагивающих двигательные, чувствительные центры, центры высших корковых функций.
Потеря сознания и судорожный синдром в дебюте заболевания достоверно чаще диагностировались среди пациентов с развившимся в последующем интраишемическим кровоизлиянием (22,7% и 12%), а в группе без геморрагии в 9,7% и 3% случаев, соответственно, (P<0,05). Кроме того, потеря сознания в дебюте заболевания была зафиксирована у 15,7% больных с последующим развитием ГИ и 37,5% - с ПГ (P<0,05), в том числе судорожный синдром в дебюте устанавливался у каждого четвертого пациента с последующим развитием паренхимальной гематомы и только 5,9% с развитием геморрагического инфаркта (P<0,05). Потеря сознания в дебюте заболевания и судорожный синдром являются одним из характерных проявлений кардиоэмболического клинического подтипа ишемического инсульта, также, вероятно, могут указывать на массивность эмболии и первоначальную тяжесть ишемии с закупоркой артерии большого диаметра и формированием территориального инфаркта.
За время нахождения в стационаре обе группы достоверно не различались между собой по частоте развития осложнений в течение острого периода инсульта (тромбоэмболии легочной артерии и инфаркта миокарда). Тромбоэмболия легочной артерии в группе А была зафиксирована у 2 (1,2%) пациентов, а в группе с ГТ – в 2,6% случаев. Острый инфаркт миокарда в группе А был установлен у 5 пациентов (3%), в группе Б – у 3 (4%).
При исследовании роли того или иного подтипа ишемического инсульта в последующем формировании ГТ инфаркта головного мозга среди обследованного нами контингента больных было установлено, что кардиоэмболический подтип ишемического инсульта не был превалирующим среди обследованных группы А и был зафиксирован у 47 пациентов (28,7%), атеротромботический подтип встречался у 30 больных (18,3%), несколько чаще, чем остальные подтипы диагностировался лакунарный инсульт – у 52 пациентов (31,7%). Доля инсультов неуточненной этиологии и инсульта другой уточненной причины составила, соответственно, 19,5% и 1,8% (рис. 7, рис. 8).
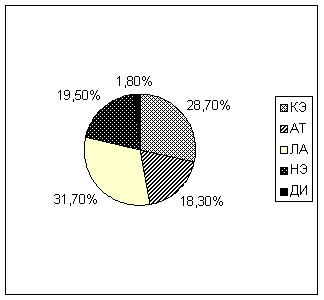 |  |
| Рисунок 7. Распределение подтипов ишемического инсульта среди пациентов группы А (ишемический инсульт). | Рисунок 8. Распределение подтипов ишемического инсульта среди пациентов группы Б (ишемический инсульт с ГТ). |
В группе Б большинство пациентов (49, 65,3%) имели кардиоэмболический подтип ишемического инсульта. Больные с атеротромботическим инфарктом головного мозга наблюдались практически с такой же частотой, что и в группе А, и составили 18,7%. Особого внимания заслуживает тот факт, что среди пациентов группы Б не было зафиксировано ни одного «свежего» лакунарного инсульта. ИИ головного мозга другой уточненной причины диагностировался у небольшого числа обследованных из группы Б – 4 (5,3%), у оставшихся 8 пациентов (10,6%) был установлен инсульт неуточненной этиологии. При исследовании предрасположенности того или иного подтипа ИИ к последующей геморрагической конверсии произведено сравнение частоты встречаемости каждого из подтипов в группах А и Б (рис. 9).
 Рисунок 9. Сопоставление частоты различных подтипов ИИ среди пациентов без вторичной геморрагии (Группа А) и пациентов с геморрагической трансформацией ИИ (Группа Б).
Рисунок 9. Сопоставление частоты различных подтипов ИИ среди пациентов без вторичной геморрагии (Группа А) и пациентов с геморрагической трансформацией ИИ (Группа Б).
При анализе полученных данных установлено, что наиболее подверженным геморрагической трансформации является кардиоэмболический инфаркт, частота встречаемости которого с высокой достоверностью (p<0,0001) превалировала среди больных с геморрагической трансформацией. Наоборот, лакунарный подтип инсульта наблюдался исключительно в группе А (p<0,00001), где составил почти 1/3, из чего можно сделать вывод, что для лакунарных инсультов вследствие микроваскулярной окклюзии геморрагические трансформации не характерны. Атеротромботический инсульт одинаково часто встречался среди пациентов обеих групп и составил 18,3% и 18,7%, что свидетельствует о незначительной предрасположенности инсультов такого типа к последующей геморрагической конверсии. Инсульт другой уточненной этиологии был зафиксирован в единичных случаях в обеих группах (1,8% и 5,5%), но все же с недостоверной частотой из-за малого числа обследованных превалировал у больных с геморрагической трансформацией.
Учитывая большую представленность кардиоэмболии, как причинного фактора данного ишемического события, была проведена оценка частоты встречаемости тех или иных имеющихся потенциальных источников эмболии среди больных групп А и Б и возможное их участие в развитии последующей геморрагической конверсии области инфаркта (Таб. 5).
Таблица 5. Частота встречаемости различных потенциальных источников церебральной эмболии среди обследованного контингента.
| Потенциальный источник кардиогенной церебральной эмболии | Группа А Больные, перенесшие ишемический инсульт (n=164) | Группа Б Больные, перенесшие ишемический инсульт с ГТ (n=75) |
| Мерцательная аритмия (пароксизмальная форма) | 20 (12,2%) | 11 (14,7%) |
| Мерцательная аритмия (постоянная форма) | 22 (13,4%) | 23 (30,7%)** |
| Инфаркт миокарда в анамнезе | 19 (11,6%) | 13 (17,3%) |
| Уточненная патология клапанов сердца | 7 (4,3%) | 4 (5,3%) |
| Другие уточненные источники кардиоцеребральной эмболии | 6 (3,7%) | 1 (1,3%) |
| Отсутствие потенциальных кардиогенных источников | 100 (60,9%) | 23 (30,7%) |
**p<0,01;
Вышеприведенные данные демонстрируют, что только постоянная форма мерцательной аритмии обнаружила достоверно большую представленность среди больных с геморрагической трансформацией ишемического инфаркта головного мозга. Она была установлена почти у каждого третьего пациента из группы с ГТ ишемического очага – 23 (30,7%) и намного реже наблюдалась среди больных из группы А – 22 (13,4%), p<0,01. Обращает на себя внимание состав потенциальных источников кардиогенной церебральной эмболии среди больных, имеющих интраишемическое кровоизлияние. Отмечается заметное преобладание источников с потенциальным образованием красных тромбов в полостях сердца – это постоянная и пароксизмальная формы мерцательной аритмии, инфаркт миокарда, в совокупности составившие более 60%. В группе А такие источники в сумме наблюдались вдвое реже. Интересной оказалась взаимозависимость мерцательной аритмии и последующего формирования более обширной геморрагии. Так, у больных с постоянной и пароксизмальной формами мерцательной аритмии частота возникновения обеих видов паренхимальных гематом почти в два раза превышала частоту возникновения геморрагических инфарктов (Таб. 6).
Таблица 6. Соотношение возникновения ГИ и ПГ среди пациентов с мерцательной аритмией.
| Признак | Геморрагический инфаркт (n=51) | Паренхимальная гематома (n=24) |
| Мерцательная аритмия (постоянная форма) | 11 (21,6%) | 12 (50%)* |
| Мерцательная аритмия (пароксизмальная форма) | 6 (11,8%) | 5 (20,8%) |
*p<0,05
Таким образом, мерцательная аритмия является значимым фактором не только для развития кардиоэмболического ишемического инфаркта головного мозга, но также и для последующего формирования интраишемической геморрагии большего размера. В исследованных нами группах больных была рассмотрена возможная взаимосвязь между установленными факторами риска развития цереброваскулярной патологии и развитием ГТ области инфаркта (Таб. 7).
Таблица 7. Частота встречаемости некоторых факторов риска развития цереброваскулярной патологии среди обследованного контингента.
| Факторы риска развития цереброваскулярной патологии | Группа А Больные, перенесшие ишемический инсульт (n=164) | Группа Б Больные, перенесшие ишемический инсульт с ГТ (n=75) |
| Гипертоническая болезнь в анамнезе | 137 (83,5%) | 63 (84%) |
| Болезни крови в анамнезе | 4 (2,4%) | 2 (2,6%) |
| Сахарный диабет в анамнезе | 39 (23,8%) | 12 (16%) |
| Гиперхолестеринемия | 95 (57,9%)** | 28 (37,3%) |
| АД систолическое максимальное в 1-е и 2-е сутки. | 144,6±29,1 | 180,9±37,6**** |
| АД диастолическое максимальное в 1-е и 2-е сутки | 96,6±12,8 | 100,9±20,1* |
*p<0,05; **p<0,01; ****p<0,0001;
Приведенные в таблице 7 результаты указывают на отсутствие достоверных различий среди пациентов с ишемическим инсультом и пациентами с ГТ в частоте диагностирования гипертонической болезни, болезней крови в анамнезе. Сахарный диабет незначительно превалировал среди больных группы А, однако различия между группами были недостоверны (p>0,05). Обнаружена обратная корреляционная связь между гиперхолестеринемией и развитием геморрагической трансформации области инфаркта (гиперхолестеринемия диагностирована у 57,9% больных группы А против 37,3% в группе Б; p<0,01). Особое предиктивное значение в развитии ГТ по полученным нами данным имеет повышенное систолическое и диастолическое АД в первые несколько суток инсульта (см. таб. 7). Кроме того, у больных с диагностированной в последствии ГТ по типу паренхимальной гематомы в первые и вторые сутки инсульта был зафиксирован более высокий уровень среднего диастолического АД - 107,1 мм рт.ст (при среднем диастолическом уровне АД у больных с будущим ГИ – 98,3 мм рт.ст). Это позволило предположить, что не хроническое повышение АД, а именно уровень систолической и/или диастолической артериальной гипертензии, сохраняющийся в первые 24-48 часов от начала инсульта, то есть в период наиболее высокого риска спонтанных и медикаментозных ГТ, имеет значение в последующем развитии и объеме интраишемической геморрагии. Все это указывает на важность тщательного мониторинга артериального давления в течение первых, вторых суток инсульта, независимо от проводимой терапии. Однако остается неясным, является ли острое повышение давления тем фактором, который, взаимодействуя с интенсивной реперфузионной циркуляцией крови, приводит к возникновению кровоизлияния. И это весьма важно, поскольку выраженное снижение АД в остром периоде инсульта может быть вредным.
Исследована динамика уровней систолического и диастолического АД у пациентов с симптомными ГТ в 1-е сутки, в день случившейся геморрагической трансформации и на 21 сутки инсульта (таб. 8; рис. 10).
Таблица 8. Динамика систолического и диастолического АД у обследованных пациентов с симптомным характером геморрагии.
| Признак | 1-е сутки инфаркта (M±m) | День геморрагической трансформации (M±m) | 21-е сутки инфаркта (M±m) |
| АД систолическое максимальное | 191,8±38,6 | 182,9±37,8 | 135,4±16,9 |
| АД диастолическое максимальное | 107,4±15,4 | 122,9±30,6* | 84,3±11,1 |
*p<0,05;
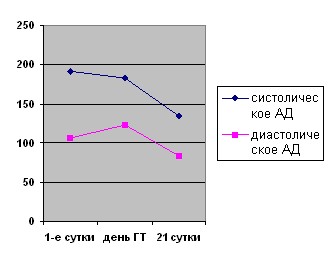
Рисунок 10. Динамика систолического и диастолического АД у симптомных пациентов.
Приведенные выше диаграмма и таблица указывают, что в день состоявшейся геморрагической трансформации происходило достоверное нарастание уровня диастолической гипертензии в среднем на 15 мм рт.ст., уровень же систолического АД плавно снижался от момента поступления к окончанию острого периода. Полученные результаты, вероятно, отражают реакцию сосудистого русла и, возможно, развитие церебрального вазоспазма в ответ на формирование клинически значимой и, как правило, более обширной вторичной геморрагии и могут играть определенную роль в клиническом утяжелении состояния больного, усиливая общемозговые проявления, цефалгический синдром, выраженность неврологического дефицита и усугубляя течение имеющейся ишемии.
Рассматривая ранее перенесенные церебральные сосудистые события (ТИА, инсульт) как возможный фактор риска развития ГТ, оказалось, что 37,3% пациентов с ГТ и только 19,5% пациентов с ишемическим инсультом сообщили о перенесенной в анамнезе подобной патологии. Более высокая частота анамнестических инсультов среди пациентов с ГТ указывает на значимость давности и тяжести цереброваскулярной патологии для появления вторичной геморрагии. По мнению Del Zoppo и Von Kummer (1998 г.) уже существующее хроническое поражение церебральной микроциркуляции, функционально включающее в себя эндотелиальную дисфункцию, увеличивает риск разрыва сосудов с последующим большим кровоизлиянием. Наличие повторных ИИ, особенно в различных церебральных бассейнах кровоснабжения, также характерно для кардиоэмболического подтипа инсульта, явно преобладающего в группе с ГТ. Эти выводы подчеркивают важность диспансерного наблюдения и эффективной вторичной профилактики инсультов, а, соответственно, и возможной вторичной геморрагии у больных с перенесенными ТИА и инсультами в анамнезе.
С целью выделения наиболее значимых предикторов геморрагической трансформации инфаркта головного мозга после предварительного отбора из 30 исследовавшихся факторов риска ГТ были выделены 5 из них, которые были использованы в модели logit - регрессии. В качестве зависимой переменной мы рассматривали вероятность возникновения ГТ, а в качестве независимых переменных следующие факторы риска:
- Подтип ИИ (бинарная) (х1). За подтип ИИ «1» принимали кардиоэмболический инфаркт; за подтип ИИ «0» - принимали атеротромботический, лакунарный, инсульт другой уточненной причины либо недифференцированный инсульт.
- Наличие ИИ, ТИА в анамнезе (бинарная) (х2). За «1» принимали наличие ИИ, ТИА в анамнезе, за «0» - их отсутствие.
- Размер зоны ИИ (бинарная) (х3). За «1» принимали обширный размер инфарктной зоны у пациента, за «0» - меньшие размеры инфарктов.
- NIHSS (х4) – цифровое выражение тяжести неврологического дефицита, измеренное по шкале NIHSS.
- Наличие сахарного диабета в анамнезе (бинарная) (х5). За «1» принимали наличие сахарного диабета в анамнезе, за «0» - его отсутствие.
В результате оценки параметров модели было получено следующее уравнение:
Наличие только двух факторов риска из обозначенных пяти в приведенном уравнении обусловлено тем, что оценки параметров модели при переменных (х2 - наличие ИИ, ТИА в анамнезе), (х3 - размер зоны ИИ) и (х5 - сахарный диабет в анамнезе) являются статистически незначимыми (рис.11).
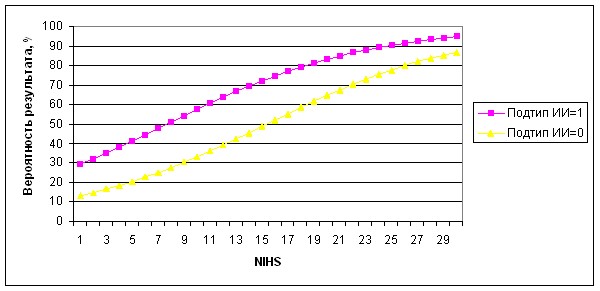 Рисунок 11. Графическое выражение вероятности развития ГТ.
Рисунок 11. Графическое выражение вероятности развития ГТ.
Полученная в результате статистического анализа модель позволила в 92,1% случаев верно спрогнозировать развитие ишемического инсульта головного мозга без последующей ГТ, и в 32,8% случаев верно предсказать развитие интраишемического кровоизлияния. Кардиоэмболический подтип ИИ по сравнению с остальными факторами обнаружил максимальное влияние на вероятность развития ГТ. Причем наиболее заметное увеличение вероятности наблюдается при низких и средних значениях шкалы NIHSS, в то время как при более высоком значении шкалы NIHSS подтип ИИ оказывает уже меньшее влияние на риск возникновения ГТ.
Таким образом, развитие инсульта по кардиоэмболическому механизму действительно дает особое предрасположение к последующей геморрагической трансформации области ишемии, еще более усиливающееся в случае развития инсульта незначительной и умеренной тяжести. При тяжелых инсультах с выраженным неврологическим дефицитом вероятность последующей геморрагической конверсии при других подтипах инсульта почти сравнивается с кардиоэмболическим. Это многими годами ранее на основании патологоанатомических исследований предполагали Lodder et al (1986 г.).
Среди обследованного нами контингента дополнительно к факторам, оказывающим влияние на развитие всех типов геморрагических трансформаций инфаркта головного мозга, было произведено выделение тех из них, которые могли бы участвовать в формировании более обширных и тяжелых кровоизлияний – паренхимальных гематом (некоторые из них уже упоминались ранее)(Таб. 9).
Таблица 9. Характеристика первоначальной тяжести инсульта, размера, локализации инфарктной зоны, факторов риска цереброваскулярной патологии у пациентов с ГИ и ПГ.
| Признак | Геморрагический инфаркт (n=51) | Паренхимальная гематома (n=24) |
| Оценка клинического состояния и функционального статуса пациента в 1-е сутки инсульта: NIHSS Глазго Ранкин | 11,9±5,6 14±2 3,8±1,1 | 10,9±6,4 13,6±2,6 3,7±1,2 |
| Бассейн пораженной артерии: ЛСМА ПСМА ПМА ЗМА ВББ ВСА | 20 (39,2%) 13 (25,5%) 0% 6 (11,8%) 3 (5,9%) 9 (17,6%) | 11 (45,%) 7 (29,2%) 0% 1 (4,2%) 0% 5 (20,8%) |
| Размер инфарктной зоны: Обширный инсульт Большие Средние Лакунарные | 17 (33,3%) 26 (51%) 8 (15,7%) 0% | 8 (33,3%) 14 (58,4%) 2 (8,3%) 0% |
| Перенесенные церебральные сосудистые события (инсульты, ТИА) в анамнезе: в том числе соответствующие настоящему артериальному бассейну | 19 (37,2%) 9 (17,6%) | 9 (37,5%) 4 (16,7%) |
| Гипертоническая болезнь в анамнезе | 41 (80,3%) | 22 (91,7%) |
| Сахарный диабет | 6 (11,8%) | 6 (25%) |
| Мерцательная аритмия (постоянная форма) | 11 (21,6%) | 12 (50%)* |
| Мерцательная аритмия (пароксизмальная форма) | 6 (11,8%) | 5 (20,8%) |
| Гиперхолестеринемия | 22 (43,1%) | 6 (25%) |
| Уровень сахара крови | 6,0±1,9 | 8,2±2,4* |
| Лейкоареоз | 16 (31,4%) | 11 (45,8%) |
| Уровень тромбоцитов крови | 225 000±80 | 221 000±79 |
| Уровень МНО | 1,12±0,28 | 1,12±0,2 |
| АД систолическое максимальное в 1-е и 2-е сутки заболевания | 177,9±36,5 | 186,8±39,9 |
| АД диастолическое максимальное в 1-е и 2-е сутки заболевания | 98,3±21,5 | 107,1±16,2* |
*p<0,05;
Значимыми факторами риска развития паренхимальной гематомы у больных с ишемическим инсультом головного мозга в нашем исследовании оказались постоянная форма мерцательной аритмии, повышенный уровень сахара крови, повышенный уровень диастолического АД в 1-е и 2-е сутки инфаркта мозга. Показатели системы свертывания крови не обнаружили предиктивного значения. Также обнаружена предположительная зависимость развития геморрагической трансформации большего объема в случае наличия у пациента лейкоареоза на предварительных томограммах, пароксизмальной формы мерцательной аритмии и сахарного диабета в анамнезе. Однако достоверность различий не достигла степени значимости.
Некоторые особенности имела частота развития ГИ и ПГ на фоне ишемических инсультов головного мозга различных клинических подтипов. Кардиоэмболический инсульт доминировал среди пациентов с развившейся паренхимальной гематомой. Также довольно часто в этой группе диагностировался инсульт на фоне других уточненных причин. Однако степень различий между группами с ГИ и ПГ не достигла уровня значимости.
Таким образом, объем интраишемического кровоизлияния с формированием вторичной гематомы не зависит от обширности ишемической зоны и тяжести инсульта, а достоверно связан с наличием постоянной формы мерцательной аритмии, гипергликемией и повышенным уровнем диастолической артериальной гипертензии в 1-е и 2-е сутки заболевания. Весомую роль в увеличении объема геморрагии, вероятно, могут играть наличие лейкоареоза, сахарного диабета, повышенный уровень систолического АД в 1-е и 2-е сутки инфаркта, кардиоэмболический подтип инсульта либо развитие инсульта на фоне других уточненных причин, а также особенности терапевтической тактики на догоспитальном и госпитальном этапах. Та или иная комбинация вышеуказанных факторов может оказать решающую роль в развитии именно паренхимальной гематомы.
Влияние произошедшей ГТ на ранний клинический исход заболевания очень важно, так как позволяет прогнозировать течение заболевания и окончательный клинический результат. Кроме того, высокая частота спонтанных геморрагических конверсий, особенно на фоне кардиоэмболического клинического подтипа инсульта, приводимая в публикациях, заставляет рассматривать данное явление как весьма частое. Среди множества факторов, оказывающих влияние на формирование раннего неудовлетворительного исхода заболевания к 21 суткам инсульта, нами выделено 6 теоретически наиболее значимых для последующего проведения статистического анализа в виде logit - регрессии. В качестве зависимой переменной мы рассматривали вероятность развития неудовлетворительного исхода (летальный исход или значение шкалы Ранкин 4), а в качестве независимых переменных следующие факторы:
- Возраст (х1). Цифровое выражение возраста пациента.
- NIHSS (х2) – цифровое выражение тяжести неврологического дефицита, измеренное по шкале NIHSS.
- Наличие симптомного характера геморрагической трансформации инфаркта головного мозга (бинарная) (х3). За «1» принимали симптомный характер ГТ, за «0» - асимптомный характер ГТ.
- Развитие ГТ в виде ПГ-2 (бинарная) (х4). За «1» принимали имеющийся радиологический характер геморрагии в виде ПГ-2, за «0» - остальные виды ГТ (ГИ-1,ГИ-2,ПГ-1).
- Наличие экстрапаренхимального кровоизлияния (ЭПК) (бинарная) (х5). За «1» принимали течение ГТ в сопровождении экстрапаренхимального кровотечения, за «0» - без такового.
- Размер зоны ИИ (бинарная) (х6). За «1» принимали обширный размер инфарктной зоны у пациента, за «0» - меньшие размеры инфарктов.
В дальнейшем переменная «Наличие ЭПК» была исключена из модели в силу коррелированности с переменной ПГ-2. Проведенные расчеты показали, что оценки параметров модели при переменных (х1) возраст, симптомность (х3) и ПГ-2 (х4) являются статистически незначимыми.
В результате оценки параметров модели было получено следующее уравнение:

Полученная модель позволяет в 90% случаев верно спрогнозировать удовлетворительный ранний клинический исход заболевания, и в 97,1% случаев правильно предсказать формирование неудовлетворительного раннего клинического исхода заболевания (рис.12).
 Рисунок 12. Графическое выражение вероятности развития неудовлетворительного исхода.
Рисунок 12. Графическое выражение вероятности развития неудовлетворительного исхода.
Таким образом, наиболее значимыми факторами неблагоприятного исхода инсульта независимо от наличия или отсутствия ГТ являются тяжесть инсульта в дебюте и размеры области ишемического повреждения. Причем размер инфаркта оказывает существенное влияние на вероятность возникновения неудовлетворительного исхода при значениях шкалы NIHSS, находящихся в интервале от 5 до 18 единиц. Если значение шкалы NIHSS меньше 5, то независимо от размера инфаркта наблюдается вероятность результата «0» (то есть положительный исход в любом случае), а если значение шкалы NIHSS больше 19, то вероятность развития неудовлетворительного исхода близка к 100% при всех размерах инфарктной зоны.
Для выделения непосредственной роли геморрагической трансформации инфаркта головного мозга в раннем клиническом исходе заболевания произведено сопоставление пациентов, равновеликих по тяжести инсульта в дебюте заболевания и величине инфарктной зоны, имеющих и не имеющих интраишемическое кровоизлияние: группы Б с ГТ (n=75) с выборочной группой сравнения В (n=64) c ишемическим инсультом головного мозга без геморрагии (таб. 10).
Таблица 10. Характеристика обширности инфарктной зоны и тяжести инсульта на 1-е и 21-е сутки заболевания среди обследованных больных групп Б и В.
| Признак | Группа Б ишемический инсульт с ГТ (n=75) | Группа сравнения В ишемический инсульт (n=64) |
| Величина инфарктной зоны: Обширный инсульт Большие Средние Лакунарные | 25 (33,3%) 40 (53,4%) 10 (13,3%) 0% | 16 (25%) 36 (56,2%) 12 (18,7%) 0% |
| Оценка клинического состояния и функционального статуса пациента в 1-е сутки поступления: NIHSS Глазго Ранкин | 11,5±6,0 13,7±2,2 3,8±1,1 | 11,3±4,8 13,9±2,3 3,4±1,1 |
| Оценка клинического состояния и функционального статуса пациента на 21-е сутки заболевания: NIHSS Глазго Ранкин | 10,4±6,2 13,3±3,9 3,5±1,3 | 12,3±4,6** 13,3±3,1* 3,5±1,2 |
*p<0,05; **p<0,01;
Данные, приведенные в таблице 10, убедительно демонстрируют, что у больных с геморрагической трансформацией инфаркта головного мозга к 21 суткам заболевания наблюдался достоверно лучший клинический исход по шкалам NIHSS и Глазго, различий в функциональном статусе между группами не отмечалось.
Отдельно проанализирован ранний клинический исход в подгруппах с симптомными (n=19), асимптомными (n=56) геморрагическими трансформациями и сопоставление их с выборочной группой сравнения В (n=64). Полученные результаты с высокой достоверностью дистанцировали одну группу от другой. Наилучший результат шкал NIHSS (9,8±6,0), Глазго (14,0±3,1) и Ранкин (3,4±1,3) по отношению к остальным группам был достигнут в группе с асимптомными ГТ (p<0,005), наихудший – в группе с симптомными геморрагиями (p<0,005) (таб. 11.).
Таблица 11. Сопоставление раннего клинического исхода у пациентов с симптомными, асимптомными ГТ и группой сравнения.
| Признак | Симптомные ГТ (n=19) | Асимптомные ГТ (n=56) | Группа сравнения (n=64) |
Оценка раннего клинического исхода на 21 сутки: 1. Шкала NIHSS
| 15,9±8,7^ 11,8±5,2^ 4,4±1,4^^^ | 9,8±6,0*** 14,0±3,1*** 3,4±1,3*** | 12,3±4,6 13,3±3,1 3,5±1,2 |
*p<0,05;**p<0,01;***p<0,005;****p<0,0001; (при сравнении группы пациентов с симптомными ГТ и группы пациентов с асимптомными ГТ).
^ p<0,05;^^ p<0,01;^^^ p<0,005;^^^^ p<0,0001; (при сравнении группы пациентов с симптомно протекающими ГТ и группы больных без ГТ);
p<0,05; p<0,01; p<0,005; p<0,0001(при сравнении группы пациентов с асимптомно протекающими ГТ и группы больных без ГТ).
Доля пациентов с незначительным неврологическим дефицитом (NIHSS<5) в группе с асимптомными ГТ также была достоверно выше (14,8% против 0%), чем в группе сравнения (p<0,01). Только пятая часть асимптомных больных имела к 21 суткам выраженный неврологический дефицит (NIHSS15), в то время как среди больных с симптомными ГТ такие пациенты составили более половины (p<0,05). В группе больных, имеющих асимптомные интраишемические кровоизлияния, по сравнению с остальными группами обследованных к 21 суткам заболевания чаще диагностировалось ясное сознание (81,5%). Пациенты с симптомными ГТ чаще к 21 суткам находились в состоянии сопора (21,1%). Наихудший функциональный статус на 21 сутки был зафиксирован среди пациентов с симптомными ГТ, где более половины составили больные с выраженными признаками инвалидности (значение шкалы Ранкин 4), в то время как группа с асимптомными ГТ и группа сравнения между собой достоверно не различались.
Отдельно стоит упомянуть летальность среди обследованного контингента. Она была достоверно выше среди больных, имевших симптомный характер геморрагии (26,3%), чем у больных с асимптомными ГТ (5,6%) и пациентами выборочной группы сравнения В (4,7%).
Таким образом, геморрагическая трансформация инфаркта головного мозга в целом не является событием, определяющим будущий отрицательный клинический исход заболевания, который больше зависит от первоначальной обширности области ишемического повреждения и выраженности неврологического дефицита в дебюте заболевания. При равной исходной тяжести ишемических инсультов головного мозга развитие геморрагической трансформации в случае ее асимптомного характера улучшает ранний клинический исход заболевания, в случае симптомного характера – ухудшает ранний клинический исход заболевания.
ВЫВОДЫ
- ГТ ишемического инфаркта головного мозга в большинстве случаев протекает асимптомно (в 74,7%). Асимптомные геморрагические трансформации инфаркта головного мозга в основном представлены геморрагическими инфарктами 1-го и 2-го типа (82,2%). При симптомных ГТ доминируют паренхимальные гематомы 1 и 2 типа (73,6%).
- Клиническое ухудшение неврологического статуса пациента при развитии спонтанной геморрагической трансформации инфаркта головного мозга соответствует увеличению значения Шкалы инсульта Национального института здоровья США на 4 балла и снижению значения Шкалы комы Глазго на 1 балл.
- Потеря сознания и/или судорожный приступ в дебюте инсульта указывают на высокую вероятность развития последующего интраишемического кровоизлияния, в том числе и паренхимальной гематомы.
- Факторами риска развития геморрагической трансформации у больных с ишемическим инсультом являются:
-кардиоэмболический клинический подтип ишемического инсульта;
-ишемический инфаркт вследствие закупорки проксимального сегмента СМА и/или ВСА;
-обширные или большие размеры инфарктной зоны;
-умеренная или выраженная тяжесть неврологического дефицита в дебюте инсульта;
-повышенное систолическое и диастолическое АД в 1-е и 2-е сутки заболевания;
- наличие постоянной формы мерцательной аритмии;
-наличие церебральных сосудистых событий (инсульты, ТИА) в анамнезе;
- Методом логистической регрессии установлено, что некардиоэмболический клинический подтип ишемического инсульта в совокупности с низким значением шкалы NIHSS в дебюте заболевания в 92,1% случаев определяют течение инфаркта головного мозга без геморрагической трансформации. В то же время кардиоэмболический клинический подтип инсульта в сочетании с высоким значением шкалы NIHSS позволяют прогнозировать последующее развитие интраишемической геморрагии в 32,8% случаев.
- Объем спонтанного интраишемического кровоизлияния не зависит от обширности области ишемического повреждения и выраженности неврологического дефицита в дебюте заболевания. Факторами риска интраишемической паренхимальной гематомы являются постоянная форма мерцательной аритмии, гипергликемия, высокий уровень диастолической артериальной гипертензии в 1-е и 2-е сутки заболевания.
- Методом логистической регрессии установлено, что факторами, определяющими неблагоприятный ранний исход заболевания независимо от наличия или отсутствия ГТ, являются выраженная тяжесть неврологического дефицита в дебюте заболевания по шкале NIHSS в совокупности со значительными размерами зоны ишемии. Возраст и клинико-томографический вариант развития геморрагической трансформации не являются независимыми предикторами раннего отрицательного исхода заболевания.
- При равной исходной тяжести ишемических инсультов головного мозга развитие геморрагической трансформации в случае ее асимптомного характера улучшает ранний клинический исход заболевания, в случае симптомного характера – ухудшает его.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- В случае развития геморрагической трансформации инфаркта головного мозга обязательно должна быть определена ее принадлежность к той или иной клинической и томографической форме.
- Спонтанную геморрагическую трансформацию инфаркта головного мозга необходимо рассматривать как симптомную в случае утяжеления неврологического статуса пациента по шкале NIHSS на 4 балла и дополнительном снижении по шкале комы Глазго на 1 балл.
- Повторная нейровизуализация с возможным использованием Т2 GrE (градиентное эхо) необходима у пациента с ишемическим инсультом при клиническом ухудшении по шкале NIHSS на 4 балла и шкале комы Глазго на 1 балл особенно в течение первой недели заболевания, так как это может указывать на развитие интраишемической паренхимальной гематомы.
- Пациенты, имеющие потерю сознания и судорожный синдром в дебюте ишемического инсульта, должны находиться под более пристальным наблюдением, так как подобные клинические проявления являются прогностически неблагоприятными для развития спонтанной геморрагической трансформации ишемического инфаркта головного мозга большего объема – паренхимальной гематомы.
- Решение о назначении, продолжении и виде антикоагулянтной терапии в случае развития ГТ должно решаться индивидуально с учетом клинико-томографической характеристики имеющейся ГТ, обширности области ишемического повреждения, тяжести инсульта в дебюте заболевания, механизма развития инсульта и наличия у больного сопутствующей патологии. А) при развитии ГТ в виде ПГ-1, особенно ПГ-2, а также экстраишемического кровоизлияния лечебная тактика должна быть такой же, как и при первичном внутримозговом кровоизлиянии. Целесообразно прекращение приема антикоагулянтов в течение 1-2 недель острого периода инсульта. В случае особенно массивного кровоизлияния одновременно желательно назначить препараты витамина К, свежезамороженную плазму. Возможно также хирургическое удаление интраишемической гематомы с установлением показаний к операции, основанных на объеме и локализации гематомы;
Б) развитие ГТ в виде ГИ-1 или ГИ-2 не требует хирургического вмешательства и гемостатической коррекции;
В) при необходимости в назначении или продолжении антикоагулянтной терапии у больных с кардиоэмболическим механизмом развития инсульта и геморрагической трансформацией в виде ГИ-1, ГИ-2, более предпочтительным и безопасным будет использование внутривенного гепарина, чем пероральных антикоагулянтов. Возобновление приема пероральных антикоагулянтов возможно через 3-4 недели с соблюдением строгого мониторинга и поддержанием уровня МНО на нижней границе терапевтической нормы;
Г) развитие ГТ в виде ГИ-1, ГИ-2 на фоне обширного атеротромботического инсульта с прогредиентным характером течения на фоне приема антикоагулянтной терапии требует отмены антикоагулянтов;
- Необходимо тщательно мониторировать АД среди пациентов с ишемическим инсультом независимо от проводимой терапии, так как сохраняющийся повышенный уровень АД в 1-е и 2-е сутки заболевания является фактором риска развития интраишемического внутричерепного кровоизлияния, в том числе и большего объема.
А) гипотензивная терапия абсолютно показана при уровне АД превышающем 220/120;
Б) при уровне АД 180-200/100-110 гипотензивная терапия показана: если планируется тромболизис, если у пациента диагностированы острый инфаркт миокарда, острая левожелудочковая недостаточность, расслоение грудного отдела аорты, развитие ГТ в виде ПГ-1, ПГ-2;
В) в то же время снижение систолического АД должно быть не более чем на 20%, а диастолического АД не более чем на 15% от исходного, так как в противном случае возникает угроза церебральной гипоперфузии.
- Весьма важно диспансерное наблюдение и эффективная вторичная профилактика у больных с перенесенными ишемическими инсультами головного мозга или ТИА с подбором адекватной патогенетической терапии, так как наличие церебральных сосудистых событий в анамнезе является фактором риска развития ГТ.
- При формулировании диагноза у больного, имеющего геморрагическую трансформацию инфаркта, в качестве осложнения инсульта следует рассматривать только вторичные кровоизлияния с симптомным характером течения либо развитие паренхимальной гематомы 1-го или 2-го типа.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ
- Батищева Е.И., Жаботинская М.Г., Виноградов О.И., Кузнецов А.Н. Факторы риска развития геморрагической трансформации ишемического инсульта // Журнал неврологии и психиатрии им. С.С.Корсакова. – 2007. – С. 261.
- Батищева Е.И. Спонтанная интраинфарктная гематома. Предрасполагающие факторы возникновения // Вестник Национального медико-хирургического центра им. Н.И.Пирогова. – 2008. – Т. 3. - №1. – С. 43-44.
- Batishcheva E., Kuznetsov A., Vinogradov O., Gabotinskaya M. Does hemorrhagic transformation of cerebral infarction always predict unfavourable outcome? / Materials of the 1st World Congress on controversies in neurology. Berlin. – 2007. – P.41. (Батищева Е.И., Кузнецов А.Н., Виноградов А.Н., Жаботинская М.Г. Всегда ли геморрагическая трансформация инфаркта головного мозга является предиктором неблагоприятного прогноза? / Материалы 1-го всемирного конгресса «Неврологические дискусии». Берлин. – 2007. – С.41.)
- Batishcheva E., Kuznetsov A., Vinogradov O., Gabotinskaya M. Outcome after hemorrhagic transformation of cerebral infarction // European Journal Anesthesiology. – 2008. – Vol. 25, Suppl. 43. – P. 11. (Батищева Е.И., Кузнецов А.Н., Виноградов О.И., Жаботинская М.Г. Исход после геморрагической трансформации инфаркта головного мозга // Европейский журнал анестезиологии. – 2008. – Т. 25, Прилож. 43. – С. 11.)
- Батищева Е.И., Кузнецов А.Н. Геморрагическая трансформация инфаркта головного мозга: клинико-радиологические варианты, факторы риска, прогностическое значение // Неврологический журнал. – 2008. – Т.13. - №5. – С. 29-34.
- Batishcheva E. Hemorrhagic transformation in acute ischemic stroke: structure and influence on the early clinical outcome // Cerebrovasc. Dis. – 2008. – Vol. 25. – P.162. (Батищева Е.И. Геморрагическая трансформация острого ишемического инсульта: структура и влияние на ранний клинический исход // Цереброваскулярные заболевания. – 2008. – Т. 25. – С. 162.)
- Батищева Е.И. Прогностическое влияние симптомного характера геморрагической трансформации на ранний клинический исход // Вестник Национального медико-хирургического центра им. Н.И.Пирогова. – 2008. – Т. 3. - №1. – С. 44-45.
- Батищева Е.И., Кузнецов А.Н. Факторы риска возникновения спонтанных интраинфарктных гематом головного мозга / Матерiали X Мiжнародноi конференцii «Актуальнi питання неврологii». – м. Судак. – 2008. – С.5.
- Batishcheva E., Gabotinskaya M., Kuznetsov A. Spontaneous hemorrhagic transformation of cerebral infarction: the structure, risk factors and influence on the early stroke outcome // Internation. J. of Stroke. – 2008. – Vol. 3 (suppl. 1). – P. 142. (Батищева Е.И., Жаботинская М.Г., Кузнецов А.Н. Спонтанная геморрагическая трансформация церебрального инфаркта: структура, факторы риска возникновения, влияние на ранний клинический исход // Междунар. журнал инсульта. – 2008. – Т. 3 (прилож. 1). – С. 142.)
- Батищева Е.И., Кузнецов А.Н. Мерцательная аритмия – фактор риска геморрагической трансформации ишемического инфаркта головного мозга / Материалы I Национального конгресса «Кардионеврология». – Москва. – 2008. – С. 309-310.
- Батищева Е.И., Кузнецов А.Н. Геморрагический инфаркт головного мозга // Вестник национального медико-хирургического центра им. Н.И. Пирогова. – 2008. – Т.3. - №.2. – С. 83-89.
- Батищева Е.И. Кардиоэмболический инсульт - фактор риска геморрагической трансформации ишемического инфаркта головного мозга/ Е. И. Батищева, А.Н. Кузнецов // Вестник Российской Военно - медицинской академии. - 2009. - Т.25, Ч. I, 1. - С. 309.
- Батищева Е.И., Кузнецов А.Н. Каково влияние геморрагической трансформации инфаркта головного мозга и отдельных ее видов на ранний клинический исход инсульта? // Мат. XI Мiжнар. конф. "Новi стратегii в неврологii".- Судак, 2009.- С. 16-19.
- Батищева Е.И. Исследование влияния факторов риска цереброваскулярной патологии на развитие геморрагической трансформации ишемического инфаркта головного мозга / Е. И. Батищева, А.Н. Кузнецов // Вестник Российской Военно - медицинской академии. - 2009. - Т.25, Ч. II, 1. - С. 805-806.
- Батищева Е.И. Клинико - томографические варианты геморрагической трансформации инфаркта головного мозга/ Е. И. Батищева, А.Н. Кузнецов // Вестник Российской Военно - медицинской академии. - 2009. - Т.25, Ч. II, 1. - С. 806.
- Батищева Е.И., Кузнецов А.Н. Факторы риска цереброваскулярной патологии, оказывающие влияние на развитие геморрагической трансформации инфаркта головного мозга / Материалы международной конференции по нейрореабилитации. - Белокуриха. – 2009. – С.72
- Батищева Е.И., Кузнецов А.Н. Всегда ли геморрагическая трансформация инфаркта головного мозга предопределяет неблагоприятный клинический результат? / Материалы международной конференции по нейрореабилитации. - Белокуриха. – 2009. – С. 34
- Батищева Е.И., Кузнецов А.Н. Геморрагическая трансформация инфаркта головного мозга: Монография – М.: Издательство РАЕН. – 2009. – 109 с.
- Батищева Е.И., Кузнецов А.Н. Повышенное систолическое и диастолическое АД в 1-е и 2-е сутки заболевания – фактор риска развития геморрагической трансформации у больных с ишемическим инсультом / Материалы научно-практической конференции «Нарушения мозгового кровообращения. Патофизиология, клиника, диагностика, лечение». – Барнаул. – 2009. – С.118
- Батищева Е.И., Кузнецов А.Н. Клинико-томографическая структура геморрагической трансформации инфаркта головного мозга / Материалы научно-практической конференции «Нарушения мозгового кровообращения. Патофизиология, клиника, диагностика, лечение». – Барнаул. – 2009. – С. 44
- Батищева Е.И., Кузнецов А.Н. Факторы риска развития геморрагической трансформации инфаркта головного мозга // Вестник национального медико-хирургического центра им. Н.И. Пирогова. – 2009. – Т.4. - №.1. – С. 73-78.

