Молекулярно-генетические маркеры и клинико – эпидемиологические аспекты эссенциальной артериальной гипертензии у детей и подростков разных популяций, проживающих в республике бурятия
На правах рукописи
Баирова Татьяна Ананьевна
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МАРКЕРЫ И
КЛИНИКО – ЭПИДЕМИОЛОГИЧЕСКИЕ АСПЕКТЫ
ЭССЕНЦИАЛЬНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ
У ДЕТЕЙ И ПОДРОСТКОВ РАЗНЫХ ПОПУЛЯЦИЙ,
ПРОЖИВАЮЩИХ В РЕСПУБЛИКЕ БУРЯТИЯ
14.00.16 – патологическая физиология
14.00.09 - педиатрия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Иркутск
2009
Работа выполнена в «Учреждение Российской академии медицинских наук Научный центр проблем здоровья семьи и репродукции человека Сибирского отделения РАМН» (г. Иркутск)
| Научные консультанты: | доктор медицинских наук, профессор, член-кор. РАМН Колесникова Любовь Ильинична |
| доктор медицинских наук, профессор Долгих Владимир Валентинович | |
| Официальные оппоненты: | доктор медицинских наук, профессор, член-кор. РАМН Антоненко Федор Федорович |
| доктор медицинских наук, профессор Корытов Леонид Иннокентьевич | |
| доктор медицинских наук, профессор Мордовин Виктор Федорович | |
| Ведущая организация | ГОУ ВПО Московская медицинская академия им. И.М.Сеченова Росздрава (г. Москва) |
Защита состоится «___»_____________ 2009 г. в ____ часов на заседании диссертационного совета Д. 001.038.02 при «Учреждение Российской академии медицинских наук Научный центр проблем здоровья семьи и репродукции человека Сибирского отделения РАМН» по адресу: г. Иркутск, ул. Тимирязева, 16.
С диссертацией можно ознакомиться в библиотеке «Учреждение Российской академии медицинских наук Научный центр проблем здоровья семьи и репродукции человека Сибирского отделения РАМН».
Автореферат разослан «____»__________2009 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук Шолохов Л.Ф.
ОБЩАЯ ХАРАКТЕРИСТИКА ДИССЕРТАЦИИ
Актуальность проблемы.
Проблема профилактики и прогнозирования течения эссенциальной артериальной гипертензии (ЭАГ) у детей и подростков занимает приоритетное положение в педиатрии и детской кардиологии. Это связано, прежде всего, с высокой распространенностью данного заболевания, а также с большим риском его трансформации в ишемическую и гипертоническую болезни, являющиеся основной причиной инвалидизации и смертности взрослого населения [Оганов Р.Г, 2001].
Артериальная гипертензия регистрируется у 40% взрослого населения Российской Федерации и Сибирского федерального округа [Карпов Р.С., Беленков Ю.Н., 2002]. Неблагоприятная эпидемиологическая ситуация отмечается также в Республике Бурятия. По данным официальной статистики Министерства здравоохранения Республики Бурятия, уровень заболеваемости сердечно-сосудистой патологией с 2000г. по 2007г. возрос на 53,7% (с 11461,9 до 17613,2 на 100 тыс. населения), вместе с тем показатель заболеваемости ЭАГ за аналогичный период вырос в 2 раза (с 4172,6 до 8372,9 на 100 тыс. населения). Среди подросткового населения показатель заболеваемости ЭАГ за 7 лет также вырос в 2,8 раза (121,8 в 2000 г. до 339,7 на 100 тыс. в 2007г) [Занданов А.О., 2008].
Большинство исследователей признают наличие так называемого трекинга АД, т.е. сохранения его повышенного уровня в последующие годы жизни индивида [Леонтьева И.В., 2000; Розанов В.Б., 2008; Dawber T.R., 1980; Vasan R.S., 2001; Julius S., et al., 2006].
Механизмы, вовлекаемые в процесс становления ЭАГ и участвующие в процессе ее первичной компенсации ЭАГ, многообразны. Наряду с господствующей с 50-х гг. нейрогенной теорией Г.Ф.Ланга широкое признание получили мембранная, нейрогуморальная, ренальная и ряд других концепций патогенетических механизмов формирования ЭАГ. Несмотря на утверждение о мультипатогенности и полиэтиологичности ЭАГ, многие ученые признают ведущую роль наследственности [Бубнов Ю.И. и др., 1997; Шулутко Б.И., 2001; Шляхто Е.В., Конради А.О., 2002; Яковлева О.И. и др., 2005; B.Baudin, 2004; Day Ian N.M. 2004; Robinson R.F., 2005; Imumorin I.G., 2005; Sandrim V.C., 2006; Deng A.Y., 2007].
По образному выражению Г.Н.Крыжановского [2002] генетический аппарат является «верховным контролем» и регулятором внутриклеточных процессов, а через них – и процессов, протекающих в целостном организме. При этом поиск взаимосвязи патогенетически значимых механизмов формирования ЭАГ и генетических маркеров проводится исходя из принятой схемы взаимоотношений между генотипом, биохимическим и клиническим фенотипом заболевания: генотип биохимический фенотип клинический признак [Гайцхоки В.С., 2006].
Многочисленными исследованиями определен круг кандидатных генов, вовлеченных в формирование и стабилизацию ЭАГ, тем не менее эти данные крайне противоречивы, как и литературные данные о распространенности и вкладе кандидатных генов в формирование и становление сердечно-сосудистой патологии. Указанная противоречивость обусловлена генетической гетерогенностью популяций, в которых проводились исследования, а также физиологическими различиями в генезисе заболеваний у представителей разных этнических групп [Мустафина О.Е. и др., 2001; Рязанов А.С., 2003; Naber C.K., 2004; Marroni A.S., 2005; Cinteza E., 2006; Tanus-Santos J.E., 2007].
Вышеизложенное послужило поводом для проведения комплексного эпидемиологического, клинико-биохимического и функционально-психологического исследования, а также предпосылкой для поиска молекулярно-генетических детерминант сердечно-сосудистых заболеваний у детей и подростков разных этнических групп, проживающих в Республике Бурятия, и изучения роли этих молекулярно-генетических маркеров в формировании структурно-функциональных изменений в сердечно-сосудистой системе при ЭАГ.
В соответствии с актуальностью работы была определена цель работы - исследовать состояния ренинангиотензинового, нитритергического и липидтранспортного звеньев патогенеза эссенциальной артериальной гипертензии и их взаимосвязь с молекулярно-генетическими маркерами у подростков разных этнических групп, проживающих в Республике Бурятия.
На основании поставленной цели нами последовательно решались следующие задачи:
- Выявить распространенность высокого нормального давления и артериальной гипертензии среди школьников Республики Бурятия с учетом географических, социальных, половозрастных и этнических факторов.
- Определить частоту и характер распределения факторов риска развития ЭАГ у школьников русской и бурятской популяций, проживающих в Республике Бурятия.
- Провести оценку прогностической значимости модифицируемых и немодифицируемых факторов риска в реализации ЭАГ у школьников.
- Исследовать состояние липидного обмена у подростков русской и коренной бурятской этногрупп, оценить взаимосвязь липидного профиля с характером питания и молекулярно-генетическими маркерами.
- Охарактеризовать генетическое разнообразие русской и коренной бурятской популяции Республики Бурятия по комплексу молекулярно-генетических маркеров, принимающих участие в патогенезе ЭАГ.
- Исследовать ассоциации полиморфизмов изучаемых молекулярно-генетических маркеров с патогенетически значимыми механизмами становления и развития ЭАГ, состоянием системной гемодинамики, особенностями циркадного профиля АД подростков русской и бурятской популяций, проживающих в Республике Бурятия.
- Изучить наличие ген-генного взаимодействия полиморфных вариантов молекулярно-генетических маркеров, контролирующих разные звенья патогенеза ЭАГ у детей и подростков разных этнических групп.
- Разработать прогностические критерии риска раннего становления ЭАГ и развития гипертрофии миокарда левого желудочка у детей и подростков русской и бурятской популяций, проживающих в Республике Бурятия для разработки персонифицированных программ первичной профилактики ЭАГ.
Научная новизна
Впервые получены данные о распространенности ЭАГ среди детского населения республики в зависимости от этнического, половозрастного и климатогеографического факторов.
Проведена оценка распространенности модифицируемых и немодифицируемых факторов риска формирования ЭАГ и их прогностической ценности в реализации ЭАГ у школьников Республики Бурятия.
При изучении особенностей липидного обмена показана антиатерогенная направленность дислипидемии у подростков популяционной выборки коренной этногруппы, характеризующаяся повышением содержания холестерина липопротеидов высокой плотности.
Получены приоритетные данные по частоте встречаемости генотипов и аллелей полиморфных маркеров ЭАГ, контролирующих разные звенья патогенеза ЭАГ: ренинангиотензинового (ген ангиотензинпревращающего фермента, ген ангиотензиногена), нитритергического (ген эндотелиальной синтазы окиси азота) и липидтранспортного (ген аполипопротеина А1) в подростковой популяции Республики Бурятия с учетом этнической составляющей. Дана оценка риска формирования ЭАГ по изучаемому молекулярно-генетическому комплексу.
Впервые установлена связь структурно-генетических полиморфизмов с показателями, характеризирующими состояние системной гемодинамики, метаболическими процессами, показателями циркадного ритма АД у подростков разных этнических групп.
Выявлена зависимость индекса времени систолического АД и диастолического АД в ночные часы, вариабельности систолического АД и общего периферического сосудистого сопротивления (ОПСС) от носительства инсерционно-делеционного полиморфизма гена ангиотензинпревращающего фермента; среднесуточного индекса времени САД от носительства VNTR полиморфизма гена эндотелиальной синтазы окиси азота.
Приоритетными являются данные об ассоциации VNTR полиморфизма гена эндотелиальной синтазы окиси азота с уровнем сывороточного железа, определяющие механизм включенности данного полиморфизма в вазогенный эффект оксида азота. Изучен синергизм ген-генных взаимоотношений генетических маркеров у подростков разных этнических групп, проживающих в Республике Бурятия, и их роль в реализации гемодинамических и негемодинамических фенотипических признаков.
Впервые при проведении молекулярно-генетического тестирования показано наличие универсальных генетически детерминированных ренинангиотензиновой и нитритергической систем регуляции АД и этнически дифференцированной липидтранспортной системы.
Впервые показан вклад делетированного аллеля гена AроА1 в развитие дислипидемий проатерогенного характера у подростков русской этногруппы.
Практическая значимость работы.
Полученные данные позволили определить молекулярно-генетическую панель прогипертензивной направленности у подростков разных этнических групп, проживающих в Республике Бурятия, определив тем самым группы повышенного риска по раннему становлению ЭАГ, формированию гемодинамических и негемодинамических нарушений и раннему поражению органов-мишеней, в том числе развитие гипертрофии миокарда левого желудочка.
Предложены математические модели прогнозирования риска раннего развития ЭАГ, формирования гемодинамических и дислипидемических нарушений у подростков с учетом структурно-генетических полиморфизмов генов-кандидатов.
Создан регистр детей и подростков, страдающих ЭАГ, что позволит проводить проспективное наблюдение за состоянием их здоровья, своевременно планировать и внедрять групповые, а также индивидуальные профилактические и лечебные мероприятия.
Основные положения, выносимые на защиту:
- Для подростков коренной бурятской популяции по сравнению с подростками некоренной популяции характерна антиатерогеннаая направленность липидного профиля, характеризующаяся повышением фракции холестерина липопротеидов высокой плотности. Развитие ЭАГ у подростков обеих изучаемых популяций сопровождается формированием атерогенной дислипидемии.
- Ренинангиотензиновое и нитритергическое звенья патогенеза, являясь универсальными, детерминированы носительством делетированного аллеля гена ангиотензинпревращающего фермента, мутантного аллеля Т полиморфизма Т174М гена ангиотензиногена и носительством аллеля 4а VNTR полиморфизма гена еNOS у подростков русской и бурятской популяции Республики Бурятия.
- Включенность инсерционно-делеционного полиморфизма гена АроА1 у подростков русской этногруппы определяет формирование проатерогенных нарушений при ЭАГ. Для подростков коренной этногруппы представленный полиморфизм не ассоциирован с липидным обменом.
- Взаимодействия основных регуляторных систем организма, их вклад в стабилизацию прессорных механизмов и развитие гипертрофии миокарда левого желудочка у подростков, страдающих ЭАГ, имеют этнические особенности и детерминированы синергизмом гена ангиотензинпревращающего фермента и гена аполипопротеина А1 у подростков русской этногруппы и синергизмом гена ангиотензинпревращающего фермента и гена эндотелиальной синтазы окиси азота у подростков коренной этногруппы
Внедрение результатов работы в практику. Результаты работы внедрены в практику ГУЗ «Детская республиканская клиническая больница» МЗ РБ, МУЗ Городская поликлиника №2 (г.Улан-Удэ), МУЗ «Городская поликлиника №3» (г.Улан-Удэ), МУЗ «Детская городская клиническая больница» (г.Улан-Удэ), клиники У РАМН НЦ ПЗСиРЧ (г.Иркутск).
Методические рекомендации:
1. Долгих В.В. Эссенциальная артериальная гипертензия у детей и подростков: диагностика, профилактика и восстановительное лечение: Методические рекомендации / В.В.Долгих, Т.А.Баирова, Н.В.Дуйбанова. – Улан-Удэ, 2004. – 36с.
2. Бимбаев А.Б-Ж. Артериальная гипертензия при заболеваниях почек: диагностика, терапия, диспансеризация: Методические рекомендации / А.Б-Ж.Бимбаев, Т.А.Баирова, В.В.Альбот, Н.А.Шадрина. – Улан-Удэ, 2006. – 40с.
3. Долгих В.В. Распространенность артериальной гипертензии, факторов риска и меры профилактики артериальной гипертензии у детей и подростков Республики Бурятия: Информационное письмо / В.В.Долгих, Т.А.Баирова, А.Б-Ж.Бимбаев, И.О.Вологдина. – Улан-Удэ, 2007. – 45с.
Апробация и публикации. Апробация материалов диссертации проведена на расширенном заседании ученого совета ГУ НЦ МЭ ВСНЦ СО РАМН. Основные материалы диссертации доложены и обсуждены на I Всероссийской конференции «Здоровый ребенок» (г. Улан-Удэ, 2003г.), II Всероссийской конференции «Здоровый ребенок» (г. Чита, 2004г.), Всероссийской конференции «Человек и здоровье» (г. Иркутск, 2004г.), Всероссийском национальном конгрессе кардиологов (г. Томск, 2004г.), на Сибирской региональной конференции по реализации Федеральной программе «Профилактика и лечение артериальной гипертонии в РФ» (г. Томск, 2004 г.), Конгрессе педиатров (г. Москва, 2005г.), Сибирской научно-практической конференции «Артериальная гипертония: медико-социальные и организационно-методические проблемы профилактики и лечения» (г. Иркутск, 2005г.), Всероссийской конференции «Здоровый ребенок» (г. Томск, 2006г.), Всероссийском конгрессе детских кардиологов (г. Москва, 2006г.), на Республиканских научно-практических конференциях (г. Улан-Удэ, 2003-2007г.г.), Президиуме Восточно-Сибирского научного центра Сибирского отделения РАМН (г. Иркутск, 2007), Коллегии МЗ РБ (г. Улан-Удэ, 2007г.), Российской научно-практической конференции «Профилактика сердечно-сосудистых заболеваний в первичном звене здравоохранения» (Новосибирск, 2008г.).
Исследования по теме диссертации выполнялись в рамках Госбюджетной темы У РАМН МЭ ПЗСиРЧ СО РАМН «Закономерности формирования артериальной гипертензии у детей и подростков разных этнических групп в зависимости от средовых воздействий» (2006-2008 г.г.) и Республиканской целевой программы «Профилактика и лечение артериальной гипертонии в Республике Бурятия» (2001-2007 г.г). По теме диссертации опубликована 51 работа, в том числе 12 в центральных и рецензируемых журналах. Результаты исследований изложены в монографии «Эссенциальная артериальная гипертензия и гены ренинангиотензиновой системы».
Структура и объем диссертации. Диссертация изложена на 287 страницах печатного текста, состоит из введения, обзора литературы, характеристики материалов и методов исследования, результатов собственных исследований и их обсуждения, заключения, выводов, практических рекомендаций и приложения. Работа иллюстрирована 64 рисунками, 57 таблицами. Библиографический указатель включает 470 источников, из которых 265 - публикации иностранных авторов.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Материалы и методы исследования
Работа выполнена в Бурятском филиале Учреждения РАМН Научного центр проблем здоровья семьи и репродукции человека (г. Улан-Удэ). Набор материала осуществлялся с 1999 по 2008 г.г.
Республика Бурятии – многонациональный регион с численностью населения 981238 человек. Основной состав представлен двумя этническими градациями: русское (67,8%) и коренное бурятское (27,8%) [Итоги Всероссийской переписи населения, 2002].
Характеристика обследуемых детей и дизайн исследования
Объект исследования - 4615 школьников русской (некоренной) и бурятской (коренной) национальности (52,5% и 47,8% соответственно), обучающихся по программе общеобразовательных школ. Данные об этнической принадлежности подростков выясняли путем опроса, включая указания на национальную принадлежность предков до III поколения. Мальчиков обследовано – 2160 (46,8%), девочек – 2455 (53,2%). Все дети разделены на 3 возрастные группы: младший школьный возраст 7-11 лет (2067 чел., или 44,8%); средний школьный возраст 12-15 лет (1971 чел., или 42,7%) и старший школьный возраст 16-18 лет (577 чел., или 12,5%). Возраст детей определяли по числу полных лет на момент обследования.
Исследование проведено в трех сельских районах Республики Бурятия (Северо-Байкальский, Окинский, Хоринский) и столице Республики Бурятия - г. Улан-Удэ. Критерием выбора данных районов послужили климатогеографические особенности указанных районов (высота расположения над уровнем моря) и особенности этнического состава представленных районов. Северобайкальский – самый северный район республики с преимущественным проживанием пришлого (русского) населения, основной прирост которого произошел в годы строительства Байкало-Амурской магистрали (1977 – 1983 г.г.).
Окинский район занимает высокое плоскогорье Восточных Саян, расположен на высоте от 700 до 1600 м. над уровнем моря. По климатическим условиям приравнен к районам Крайнего Севера. В районе проживает коренное бурятское население (98,02%), сохранившее приоритет культурно-религиозных традиций быта и питания.
Хоринский район – скотоводческо-земледельческий район, расположенный в холмисто-степной местности на высоте 700 м. над уровнем моря. Этнический состав представлен коренным (34,43%) и некоренным русским (62,19%) населением.
Город Улан-Удэ – административный центр Республики Бурятия с развитой социальной и промышленной инфраструктурой, высоким уровнем антропогенного загрязнения окружающей среды и преимущественным проживанием русского населения (66,05% против 29,99% коренного населения).
В соответствии с поставленной целью работа выполнялась поэтапно. На первом этапе работы проведено анкетирование и оценка показателей АД согласно таблицам перцентильного распределения АД с учетом возраста, пола и роста. В качестве нормальных принимались показатели САД и ДАД 10-90 перцентиля, уровень САД и ДАД в пределах 90-94 перцентиля оценивался как «высокое нормальное АД», высоким считались значения свыше 95 перцентиля.
На первом этапе выявлено 673 (14,6%) школьника с показателями уровня АД, превышающими 90 перцентиль. Все эти дети отбирались на II этап, предусматривающий динамическое наблюдение в течение 1 месяца с повторным двухкратным измерением АД. При двух последующих повторных измерениях у 447 (9,7%) было выявлено высокое АД. Этим детям был установлен диагноз АГ с последующим комплексным обследованием с целью уточнения генеза АГ и формированием группы детей с ЭАГ.
Липидный профиль изучен у 412 подростков, в том числе у 256 подростков некоренной этногруппы (125– группа контроля (48,83%), 131 подросток с ЭАГ (51,17%), 156 подростков коренной этногруппы (87– группа контроля (55,77%), 69 подростков с ЭАГ (44,23%).
Комплексное клинико-биохимическое, функциональное, психологическое и молекулярно-генетическое обследование проведено 226 подросткам в Бурятском филиале НЦ ПЗСиРЧ СО РАМН.
Первую группу наблюдения составили 144 подростка некоренной этногруппы, в том числе мальчиков – 125 (86,81%); девочек – 19 (13,19%). Средний возраст - 16,22±1,14 лет. Во вторую группу включены пациенты коренной этногруппы. Всего – 82 подростка, средний возраст – 16,57±1,62 лет. В том числе: мальчиков - 70 (85,36%); девочек – 12 (14,64%).
Таким образом, представленный в нашей выборке этнический состав (руовские : буряты = 1,8:1) соотносим с популяционным по данным Всероссийской переписи населения (2002) - 2,4:1 соответственно. Распределение по гендерному признаку было представлено следующим образом: 195 мальчиков (86,28%), 31 девочка (13,72%), т.е. подавляющее большинство пациентов составляли подростки мужского пола.
Группу популяционного контроля составили 173 подростка (средний возраст 15,12±2,71лет), в том числе подростки коренной этногруппы - 79 (45,7%); некоренной этногруппы – 94 (54,3%). Подростки контрольной группы не имели каких-либо острых, а также обострений хронических заболеваний, относились к первой-второй группам здоровья. При обследовании они не предъявляли жалоб, их физическое и нервно-психическое развитие соответствовало возрасту.
Каждый пациент, его родственники и представители группы контроля проходили следующие этапы обследования:
1. Разъяснение всем обследуемыми и членами их семьи необходимости выявления факторов риска АГ, роли факторов риска в реализацию ЭАГ, значении наследственности в данном заболевании, о целях и методах исследования. Все участники исследования, их родители (опекуны) были осведомлены о научной стороне проблемы и дали свое согласие на участие в дальнейшей совместной работе в соответствии с п.5 ст.24 «Права несовершеннолетних» Основ законодательства Российской Федерации об охране здоровья граждан от 22 июля 1993 г. №5487-1 (с изменениями от 20 декабря 1999 г.).
2. Заполнение анкет, включающих информацию о состоянии здоровья, пищевых привычках и приоритетах.
3. Клинический осмотр с обязательным измерением артериального давления и оценкой антропометрических данных.
4. Забор крови для проведения молекулярно-генетических, биохимических исследований.
Всем пациентам проводилось комплексное обследование согласно алгоритмам диагностики и дифференциальной диагностики ЭАГ, изложенным в первом докладе Научного общества по изучению артериальной гипертонии Всероссийского общества кардиологов и Межведомственного Совета по сердечно-сосудистым заболеваниям «Профилактика, диагностика и лечение первичной артериальной гипертонии в Российской Федерации (ДАГ 1)», 2000 г.
Методы исследования
Измерение уровня АД проводилось по стандартной методике c последующей совокупной оценкой уровня артериального давления согласно перцентильного распределения с учетом пола, возраста и роста.
Наряду с этим проведено анкетное исследование пищевого рациона с количественной оценкой животных и растительных составляющих [Киселева Н.Г., 1998].
Лабораторные методы исследования
Исследование липидного спектра крови
Уровень общего холестерина (ХС), холестерина липопротеидов высокой плотности (ХС ЛПВП) и триглицеридов (ТГ) в сыворотке крови определяли ферментативным методом на автоанализаторе «Diana» («Cоrmay» (Польша) с использованием реактивов фирмы «Cormay» (Польша). В качестве контрольного материала использовали реактивы той же фирмы. Содержание холестерина липопротеидов низкой плотности (ХС ЛПНП) определяли по формуле: ХС(ХС ЛПВП+ХС ЛПОНП).
При этом вычислялся индекс атерогенности (ИА):
ИА = (ХСХС ЛПВП): ХС ЛПВП.
За референсный уровень приняты показатели 3,4 единиц.
Исследование ангиотензинпревращающего фермента
Активность ангиотензинпревращающего фермента определяли в сыворотке крови иммуноферментным методом на спектрофотометре «Multiskan Ascent» (Финляндия) с использованием реактивов «Buhlmann» (Германия). За референсный уровень приняты показатели 12-68 единиц АПФ.
Исследование кортизола
Количественное определение кортизола на иммуннофлюполяризационном анализаторе «MDX» фирмы «Abbot». За референсный уровень приняты показатели 138-635 нгмоль/л.
2.2.2. Кардиоинтервалография
Вегетативный статус оценивали при помощи кардиоинтервалографии и клиноортостатической пробы. Кардиоинтервалографию проводили при помощи портативного аппарата «Shiller» (Швейцария).
2.2.3. Психологическое тестирование
Психологический статус оценивали при помощи теста тревожности Ч.Д.Спилберга-Ю.Л.Ханина. Оценку уровня тревожности проводили в соответствии с общепринятыми критериями: <30 ед. - низкий уровень тревожности, 30-60 ед. – умеренная тревожность, >60 ед. – высокая тревожность.
2.2.4. Электрокардиография
ЭКГ проводилась на аппарате «Shiller AT-1» (Швейцария). У 32 (14,16 %) пациентов на ЭКГ отмечались умеренные метаболические изменения в миокарде, в виде снижения сегмента ST на 0,5 мм от изолинии и сглаженности зубца T.
2.2.5. Суточное мониторирование артериального давления
Для оценки суточного ритма АД у подростков в естественных условиях проводилось суточное мониторирование АД (СМАД) с использованием переносного монитора BR-102, «Shiller» (Швейцария) по стандартной методике. Анализировали следующие параметры: средние суточные, дневные и ночные значения систолического и дистолического артериального давления, их вариабельность, индекс времени гипертензии и суточный индекс САД и ДАД. Рассчитывали также величину утреннего повышения САД и ДАД и скорость утреннего повышения САД и ДАД.
2.2.6. Ультразвуковое исследование сердечно-сосудистой системы
Ультразвуковое исследование проводилось на аппарате «Aloka 5500» (Япония) в М – режиме импульсным датчиком 3,5 Гц в положении больного лежа на левом боку. Измерение проводилось согласно рекомендациям американского эхокардиографического общества [N.B.Shiller, 1989]. Измеряли толщину межжелудочковой перегородки (ТМЖП), толщину задней стенки левого желудочка в диастолу (ТЗСЛЖ), также определяли конечный диастолический размер левого желудочка (КДРЛЖ). Определяли ударный объем (УО), фракцию выброса (ФВ). Вычисляли массу левого желудочка (ММЛЖ) по формуле Devereux [Devereux R.B., 1986]:
MMЛЖ = 1,04·(ТМЖП+ТЗСЛЖ+ КДРЛЖ)3- КДРЛЖ3) – 13,6 (г),
где 1,04 – коэффициент плотности миокарда.
Индекс массы миокарда левого желудочка (ИМ) определяли как отношение ММЛЖ к площади поверхности тела (BSA).
Относительную толщину стенки левого желудочка (ОТС) рассчитывали по формуле ОТС= (ТЗСЛЖ+ТМЖП) : КДРЛЖ (Барсуков А.В., 2004):
Для оценки упруго-эластических свойств артерий использован неинвазивный метод расчета общей артериальной податливости (total arterial compliance), основанный на определении ударного объема сердца и пульсового артериального давления:
С (compliance)= ударный объем / пульсовое АД.
2.2.7. Молекулярно-генетические методы
Выделение ДНК. Материалом для исследования послужила тотальная геномная ДНК, выделенная из образцов цельной венозной крови. Венозную кровь, взятую из локтевой вены, смешивали с антикоагулянтом (6% раствор этилендиаминтетрауксусная кислота, ГОСТ 10652-73). До момента выделения ДНК образцы крови хранили в замороженном состоянии при температуре - 200С. Выделение тотальной ДНК проводили с помощью неэнзиматического метода [Johns M.B., Paulus J.E., 1989; Lahiri D.K et al., 1992]. Выделенные образцы ДНК хранили в морозильной камере при - 200С.
Амплификация ДНК. Амплификацию участков ДНК, содержащих полиморфные фрагменты и сайты рестрикции, проводили с помощью полимеразной цепной реакции в автоматическом термоциклере «Biometra» (Германия) с использованием праймеров, синтезированных ЗАО «Литех» (г. Москва). Нуклеотидная последовательность праймеров для амплификации ДНК следующая:
- полиморфизм Т174М гена AGT:
5’- GATGCGCACAAGGTCCT<G>-3’;
5’- GCCAGCAGAGAGGTTTGCC<T>-3 (Yu-Lin Ko et al., 1997);
2. инсерционно-делеционный полиморфизм гена АСЕ:
5’- CTGGAGACCACTCCCATCCTTTCT-3’;
5’- GATGTGGCCATCACATTCGTCAGAT-3’ (Odawara et al., 1997);
3.VNTR полиморфизм гена еNOS:
5:5-AGGCCCTATGGTAGTGCCTTT-3
3:5-TCTCTTAGTGCTGTGGTCAC-3 (Wang X et al., 1996);
4. инсерционно-делеционный полиморфизм гена Apo А1:
5:5- GGCCCTATGGTAGTGCCTTT-3
3:5- TCTCTTAGTGCTGTGGTCAC-3 (Batzer M.A. et al., 1994).
2.3. Методы статистического анализа
Статическая обработка результатов проведена по общепринятой методике вариационной статистики. Рассчитывалась средняя арифметическая (М), квадратичная ошибка средней арифметической (s), стандартные отклонения (). Статическая значимость различий средних величин при сравнении двух групп проверялась с помощью двувыборочного t-критерия Стьюдента, предполагающего проверку равенства дисперсий выборочных совокупностей и нормальность закона их распределения. В случае распределения количественных признаков, отличного от нормального, значимость между 2 группами проверялась с помощью непараметрического критерия Манна-Уитни, между 3 и более группами - метод Краскела – Уоллиса. Для проверки эмпирического распределения частот генотипов теоретически ожидаемому равновесию Харди-Вайнберга использован критерий 2. Для построения модели прогнозирования количественных данных использованы метод обобщенной линейной модели GLM (General Linear Model). Все различия считались статически значимыми при р<0,05. Статическую обработку полученных данных проводили, используя пакет прикладных программ «Statistics for Windows®», версия 5,5 (StatSoft, USA) и SPSS, версия 11.5
Для оценки ассоциаций полиморфных вариантов генов с патологическим фенотипом рассчитывали относительный риск (RR) по формуле: RR = ad/bc, где а – частота анализируемого аллеля у больных; b – частота анализируемого аллеля в контрольной выборке; c и d – суммарная частота остальных аллелей у больных и в контроле, соответственно. RR = 1 рассматривали как отсутствие ассоциации, RR>>1 как положительную ассоциацию («фактор риска») и RR<<1 – отрицательную ассоциацию аллеля с заболеванием.
Отношение шансов (ОШ) – это отношение вероятности того, что заболевание реализуется, к вероятности того, что оно не произойдет при воздействии изучаемого фактора.
ОШ= AD/BC, где А и В – подгруппы, подвергавшиеся воздействию изучаемого фактора, С и D - не подвергавшиеся; А и С – школьники с повышенным АД; B и D – школьники с нормальным АД [Реброва О.Ю., 2006].
Результаты собственных исследований и их обсуждение
Распространенность АГ среди обследованных детей школьного возраста в Республике Бурятия составила 96,86 на 1000 обследованных, высокого нормального уровня АД - 113,76 на 1000 обследованных. Распространенность ЭАГ среди школьников, проживающих в г. Улан-Удэ, составила 117,86 на 1000 обследованных. Совокупная оценка распространенности ЭАГ у школьников, проживающих в сельских районах, составила 84,84 на 1000 обследованных, что достоверно ниже показателей распространенности у городских школьников (р<0,001).
Среди сельских районов наиболее высокая распространенность ЭАГ выявлена в высокогорном Окинском районе с преимущественным проживанием коренного населения (1500 м. над уровнем моря) – 110,46 на 1000 обследованных. В Хоринском районе, с высотой расположения над уровнем моря 700 м., распространенность ЭАГ составила 90,6 на 1000 обследованных. В Северобайкальском районе, расположенном на высоте 500 м. над уровнем моря и характеризующимся преимущественным проживанием пришлого населения, распространенность ЭАГ составила 54,97 на 1000 обследованных школьников.
Для изучения вклада климатогеографического фактора проведен сравнительный анализ распространенности ЭАГ среди школьников коренной этногруппы, проживающих на высоте 700 м. (Хоринский район) и 1500 м. над уровнем моря (Окинский район), с соотносимым уровнем медицинского обслуживания и социально-бытовыми условиями. Показатели составили соответственно 78,19 и 110,46 на 1000 обследованных (р=0,035), что свидетельствует о вкладе такого климатогеографического фактора как высота расположения над уровнем моря в реализации ЭАГ у школьников коренной этногруппы.
Распространенность ЭАГ с возрастом увеличивается: среди детей 7-11 лет составила 88,05; в возрасте 12-15 лет – 103,00; 16-17 лет – 107,46 на 1000 обследованных. При этом если среди мальчиков и девочек некоренной этногруппы достоверных различий не выявлено: 79,10‰ и 88,24‰, соответственно, то среди мальчиков коренной этногруппы распространенность статистически ниже, чем среди девочек: 73,17‰ и 110,46‰, соответственно (р=0,0391). В возрастной группе 12-15 лет выявлено преобладание распространенности среди девочек как коренной (111,57 на 1000 обследованных), так и некоренной этногруппы (106,58 на 1000 обследованных), в отличие от мальчиков, распространенность ЭАГ среди которых составила 101,08 и 91,51 на 1000 обследованных соответственно. В старшем школьном возрасте (16-17 лет) зарегистрированы несколько иные тенденции. В частности, увеличилась распространенность ЭАГ среди мальчиков, составив 128,00 на 1000 обследованных среди подростков некоренной этногруппы и 108,53 на 1000 обследованных – среди мальчиков коренной этногруппы. При этом среди девочек показатели составили соответственно 90,91; 106,51 на 1000 обследованных. Таким образом, существует общая зависимость максимальной распространенности ЭАГ у девочек в возрасте 12-15 лет, среди мальчиков – на возраст 16-17 лет вне этнической принадлежности.
В целом распространенность ЭАГ среди школьников изучаемых этногрупп статистически значимо не отличалась, составив соответственно 100,68 и 96,86 на 1000 обследованных детей и подростков (2=0,67; df=1,0; p=0,4115).
Дифференцированная оценка прогностического вклада основных и дополнительных факторов риска в реализацию ЭАГ в изучаемых этнических группах выявило наиболее значимые факторы риска: отягощенная по сердечно-сосудистым заболеваниям наследственность, высокий уровень ХС-ЛПОНП, триглицеридов (таб.1). Анализ полученных результатов позволил выделить дополнительные риск-факторы для детей и подростков, в ряду которых значатся: курение родителей, фаза неустойчивого полового созревания у девочек.
Относительный риск формирования АГ многократно увеличивается при наличии комбинации риск-факторов у одного ребенка (таб.2). При этом, прогностически наиболее неблагоприятными являются комбинации таких модифицируемых факторов риска как избыточная масса тела, курение и низкая физическая активность.
Таблица 1
Показатели отношения шансов формирования ПАД
и доверительный интервал для отношения шансов
в группах школьников разных этногрупп
| Факторы риска | ОШ | ДИ | ОШ | ДИ |
| Пришлая этногруппа | Коренная этногруппа | |||
| Наследственность | 2,00 | 1,39 – 2,87 | 2,44 | 1,85 – 3,24 |
| ИМТ | 2,83 | 2,15 – 3,76 | 2,71 | 2,04 – 3,58 |
| НФА | 1,69 | 1,35 – 2,10 | 1,52 | 1,22 – 1,90 |
| Курение | 1,96 | 1,39 – 2,87 | 1,85 | 1,18 – 2,95 |
| Условия высокогорья | - | - | 1,26 | 0,97 – 1,63 |
| Проживание в городе | 1,21 | 0,99 – 1,48 | 1,25 | 0,93 – 1,68 |
| Досаливание готовой пищи | 1,43 | 1,15 – 1,79 | 1,26 | 0,97 – 1,63 |
| Фаза неустойчивого полового созревания (менархе менее 1 года) | 1,73 | 1,06 – 2,83 | 1,40 | 1,23 – 1,92 |
| Фаза завершенного полового созревания (менархе более 1 года) | 0,87 | 0,54 – 1,39 | 1,22 | 1,28 – 3,86 |
| Холестерин | 2,02 | 0,76 – 5,37 | 1,83 | 1,03 – 15,99 |
| Триглицериды | 3,09 | 1,01 – 9,50 | 2,86 | 0,15 – 15,99 |
| ЛПВП | 0,71 | 0,43 – 1,19 | 0,69 | 0,32 – 1,51 |
| ЛПНП | 1,08 | 0,91 – 3,53 | 1,15 | 0,34 – 3,94 |
| ЛПОНП | 3,26 | 1,39 – 13,09 | 4,14 | 1,49 – 34,54 |
Примечание. ОШ – отношение шансов, ДИ – 95 % доверительный интервал
Таблица 2
Отношение шансов сочетания основных факторов риска формирования
ЭАГ и доверительный интервал для отношения шансов
в группах школьников изучаемых этногрупп
| Сочетание факторов риска | ОШ | ДИ | ОШ | ДИ |
| некоренная этногруппа | коренная этногруппа | |||
| Наследственность и ИМТ | 4,45 | 0,24 - 81,68 | 3,30 | 0,32 - 33,19 |
| Наследственность и НФА | 7,73 | 0,14 - 434,3 | 6,65 | 0,17 - 385,2 |
| Наследственность и курения | 1,65 | 0,62 - 4,40 | 1,27 | 0,79 - 2,03 |
| ИМТ и НФА | 7,83 | 0,14 - 447,58 | 8,92 | 0,12 - 654,65 |
| Курение и ИМТ | 13,11 | 0,08 -2007,81 | 9,09 | 0,12 - 695,15 |
| Курение и НФА | 9,84 | 0,11 - 883,85 | 4,78 | 0,22 - 101,79 |
Примечание. ОШ – отношение шансов, ДИ – 95 % доверительный интервал
Основным признаком артериальной гипертензии является повышение артериального давления, но клиническая манифестация заболевания у разных индивидуумов дифференцированна. По результатам обследования наиболее регулярно регистрировались жалобы на головную боль средней интенсивности. Однако предъявляемая жалоба не носила специфических характеристик и описывалась пациентами как ноющая (36,84%), пульсирующая (28,95%), сдавливающая (18,42%), распирающая (7,89%) и т.д. Вне зависимости от этнической принадлежности подростки отмечали преимущественную локализацию головных болей в височной и затылочной областях (по 22,93%), а также сочетанной височно-затылочной цефалгии (12,74%), несколько реже головная боль подростками идентифицировалась как диффузная (10,19%). Вместе с тем, каждый третий подросток отрицал наличие головной боли (30,53%). Провоцирующими к повышению АД факторами подростки в равной степени указывали психоэмоциональные (43,87%) и физические стимулы (46,67%) (р=0,6729). Лишь 9,06 % подростков не могли указать причину повышения АД. На связь повышения АД с изменением метеорологических условий указывало 6,06% обследованных подростков.
Наряду с головным болями подростки предъявляли жалобы на головокружения (20,20% пациентов некоренной этногруппы; 24,14% - коренной этногруппы, р=0,5567), носовые кровотечения (12,12%; 22,41% соответственно, р=0,0984), боли в области сердца (17,17%; 18,97% соответственно, р=0,6382), слабость (7,07%; 5,17% соответственно, р=0,6183). Нами не выявлено различия в представленности указанных жалоб у подростков изучаемых этногоупп, вместе с тем, среди подростков коренной этногруппы носовые кровотечения встречались чаще, чем у подростков некоренной этногруппы.
Интегративная оценка вегетативной нервной системы (ВНС) включала исследование исходного вегетативного тонуса (ИВТ), вегетативной реактивности (ВР), вегетативного обеспечения (ВО). Известно, что вегетативный тонус и реактивность дают представление о гомеостатических возможностях организма, вегетативное обеспечение – об адаптивных возможностях. Сравнительный анализ исходного вегетативного тонуса указывает на преобладание ваготонии у пациентов с ЭАГ за счет уменьшения эйтонии. Так, если среди подростков группы контроля некоренной этногруппы ваготония выявлена в 43,3%, то среди подростков с ЭАГ 54,4% (р=0,3016); среди подростков коренной этногруппы показатели составили соответственно 36,4% и 57,1% (р=0,0589). Частота эйтонии у подростков некоренной популяции группы контроля составила 23,6% и 9,1% у пациентов с ЭАГ (р=0,0492); у подростков коренной популяции 28,4% и 14,3% соответственно (р=0,1028). Данные оценки вегетативной реактивности (ВР) указывают на преобладание нормальной ВР среди подростков некоренной (48,84%) и коренной этногрупп (46,2%), р=0,7129) и асимпатикотонической реактивности (34,88% и 40,29% соответственно, р=0,5265).
Таким образом, для подростков обеих этнических групп с ЭАГ характерно преобладание исходной ваготонии с нормальной или асимпатикотоничекой реактивностью. Результаты корреляционного анализа указывают на обратно пропорциональную связь ИВТ и ВР: чем выше ИВТ, тем менее выражена ВР (r= - 2,49; р=0,0127).
ИВТ имеет прямую корреляционную связь с отягощенной ССЗ наследственностью по линии матери, вариабельностью САД в дневные часы и скоростью подъема САД в утренние часы, а также обратную корреляционную связь с концентрацией кальция в сыворотке крови. ВР имеет прямую корреляционную связь с таким ведущим клиническим признаком, как головная боль и нагрузкой давлением (индекс времени гипертензии) САД в течение суток (рис.1).

Рис.1. Схема корреляционных связей показателей вегетативного гомеостаза с клинико-биохимическими и функциональными показателями у подростков
Результаты данных КОП указывают на однонаправленную динамику вегетативного обеспечения в виде преобладания гипердиастолического варианта ВО у подростков изучаемых этногрупп (45,31% среди подростков некоренной этногруппы, 47,78% среди подростков коренной этногруппы, р=0,8058). Данный вариант является наиболее дезадаптивным типом реакции сердечно-сосудистой системы на КОП в силу высокой адренергической активности -рецепторов с повышением периферического сосудистого тонуса. Результаты корреляционного анализа выявили зависимость вегетативного обеспечения с индексом времени ДАД в дневные (r= - 1,87, р=0,0169) и ночные часы (r=-1,74, р=0,0825), повышением уровня кортизола (r=+1,86, р=0,0627), а также с носительством полиморфизма 4а4в гена эндотелиальной синтазы окиси азота (r=+2,28, р=0,0228).
Сравнительный анализ основных показателей липидного профиля выявил статистически значимое повышение уровня ХС ЛПВП у подростков популяционной выборки коренной этногруппы в сравнении с группой подростков некоренной этногруппы (р=0,0179). Соотношение показателей липидного спектра у пациентов с ЭАГ и группой контроля в пределах каждой этногруппы выявило наличие статистически достоверного повышения содержания ХС-ЛПНП (р=0,0021) у подростков некоренной этногруппы и снижения содержания ХС-ЛПВП у подростков коренной этногруппы (р=0,0001) при наличия тенденции повышения уровня ХС-ЛПНП. Таким образом, у подростков коренной этногруппы уровень ХС-ЛПВП выше, чем у подростков некоренной этногруппы, при этом у пациентов обеих этногрупп зарегистрированы однонаправленные тенденции усиления проатерогенной направленности липидного спектра (таб.3).
Таблица 3
Липидограмма у пациентов с ЭАГ и группой контроля с учетом этнической принадлежности
| наименование | ГРУППА КОНТРОЛЯ | больные | ||
| Русские [n=125] Rz | Буряты [n=87] Bz | Русские [n=131] RB | Буряты [n=69] BB | |
| Холестерин | 3,82 ± 3,14 | 3,65 ± 1,07 | 3,84 ± 0,92 | 3,74 ± 1,20 |
| Триглицериды | 1,11 ± 0,29 | 1,06 ± 0,22 | 1,01 ± 0,68 | 0,97 ± 0,42 |
| ХС ЛПВП | 1,19 ± 0,42 Bz* | 1,33 ± 0,43 Rz* BB** | 1,18 ± 0,39 | 1,18 ± 0,32 Bz** |
| ХС ЛПОНП | 0,52 ± 0,22 | 0,48 ± 1,01 | 0,55 ± 0,29 | 0,44 ±0,32 |
| ХС ЛПНП | 1,86 ± 0,93 RB** | 1,87 ± 0,94 | 2,21 ± 0,87 Rz** | 2,09 ± 1,04 |
| ИА | 2,34±1,77 | 2,06±1,49 | 2,60±2,07 | 2,51±1,03 |
*р<0,05; **р<0,005
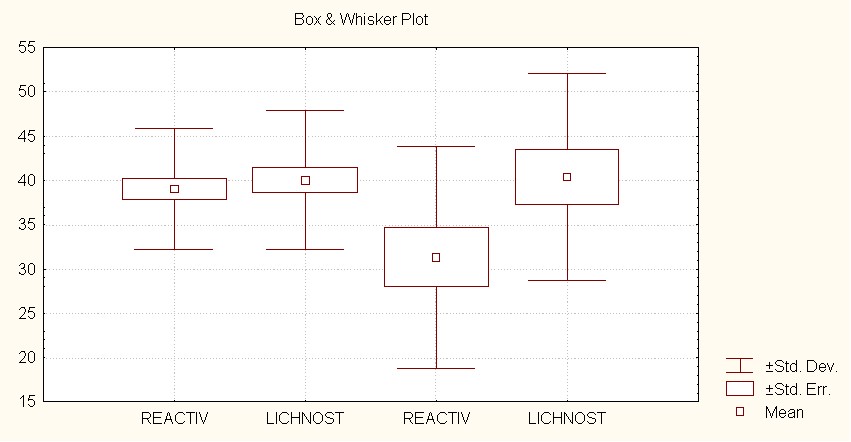
Принимая во внимание общепринятые критерии оценки уровня тревожности по тесту Спилберга Ч.Д. – Ханина Ю.Л., на основании полученных результатов можно констатировать наличие умеренного уровня тревожности, как реактивной, так и личностной у подростков, страдающих ЭАГ, вне зависимости от этнической принадлежности. Уровень реактивной тревожности среди подростков коренной этногруппы статически значимо ниже уровня личностной тревожности (33,34±5,34 против 42,83±8,59, р<0,0001) и уровня реактивной тревожности у подростков некоренной этногруппы (39,19±7,22, р=0,0001). Вместе с тем, у подростков коренной этногруппы в сравнении с подростками некоренной этногруппы выше уровень личностной тревожности (42,83±8,59 против 39,59±7,97, р=0,0622) (рис.2).
 некоренная этногруппа коренная этногруппа
некоренная этногруппа коренная этногруппа
Рис.2 Уровень тревожности у подростков разных этнических групп, страдающих ЭАГ
Анализ корреляционных связей указывает на статически значимую прямую зависимость уровня тревожности, как реактивной, так и личностной, с активностью АПФ. У подростков коренной этногруппы сила корреляционной связи активности АПФ с уровнем личностной тревожности составила r = 0,9512, с уровнем реактивной r =0,9889; у подростков некоренной этногруппы, соответственно, 0,8586; 0,8034. Продемонстрировано наличие статически значимых положительных корреляционных связей компонентов тревожности с параметрами СМАД (ИВ САД, ИВ ДАД, КВ САД суточное, КВ САД ночью, КВ ДАД ночью) и показателями центральной гемодинамики (УПСС, МОК) у подростков обеих этногрупп.
Таким образом, повышенный уровень тревожности у пациентов с ЭАГ, коррелирующий с активностью АПФ, параметрами СМАД, характеризующими нагрузку давлением (индекс времени САД, ДАД, коэффициент вариабельности САД, ДАД), показателями системной и внутрисердечной гемодинамики, подчеркивает взаимосвязь повышенного уровня тревожности и показателей АД через активацию РАС.
В поиске генетических маркеров ЭАГ мы, опираясь на гипотезу геном биохимический фенотип клинический признак, проводили анализ генетических ассоциаций в каждой изучаемой этнической выборке.
Инсерционно-делеционый полиморфизм гена АСЕ. При сравнительном сопоставлении частот аллелей гена АСЕ в популяционных выборках изучаемых этногрупп показано достоверное увеличение частоты встречаемости инсерции среди подростков коренной этногруппы (частота инсерции в русской популяции 0,5053, бурятской 0,6139, р=0,0412), что соотносится с данными о более высокой частоте встречаемости инсерции в монголоидной расе, к которой относится коренная этногруппа [Duru K., 1994; Кузнецова Т., 1998]. При попарном сравнении распространенности изучаемого структурного полим орфизма гена АСЕ среди здоровых и больных ЭАГ подростков продемонстрирована тенденция преобладания делетированного алелля в группе гипертензивных подростков некоренной этногруппы: 0,3861 против 0,4528 (р=0,2764) среди подростков коренной этногруппы; 0,4947 против 0,5704 (р=0,0945) среди подростков некоренной этногруппы.
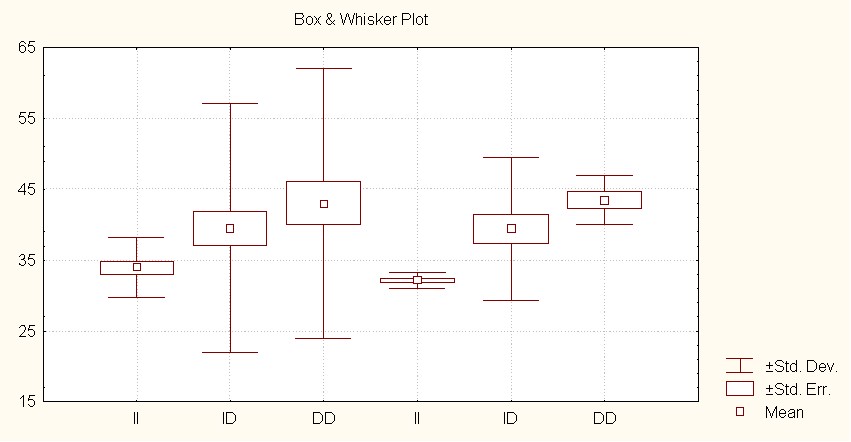
Биохимическим фенотипом изучаемого инсерционно-делеционного полиморфизма гена ангиотензинпревращающего фермента (АСЕ) является активность ангиотензинпревращающего фермента (АПФ). Показано достоверное увеличение активности АПФ у подростков-носителей dd-полиморфизма по сравнению с носителями гомозиготного ii-генотипа: у русских подростков — носителей гомозиготного ii-генотипа активность составила 33,99 ± 4,392 ед. АПФ, носителей гомозиготного dd — 41,37 ± 8,77 ед. АПФ (р=0,0068); для подростков коренной этногруппы эти показатели составили соответственно 32,25 ± 0,49 ед. АПФ и 43,45 ± 3,23 ед. АПФ (р=0,001) (рис.3).
некоренная этногруппа коренная этногруппа
Рис.3 Активность АПФ у пациентов изучаемых этногрупп, являющихся носителями разных генотипов инсерционно-делеционного полиморфизма гена АСЕ.
У подростков обеих этногрупп показана положительная корреляционная связь активности АПФ с ХС-ЛПОНП: r=+0,3195 (p=0,0324) – у подростков некоренной этногруппы и r=+0,6779 (р=0,0312) – у подростков коренной этногруппы. Наряду с этим в выборке подростков коренной этногруппы продемонстировано достоверное повышение уровня триглицеридов (p=0,0481) у носителей гомозиготного генотипа dd в сравнении с лицами – носителями гомозиготного генотипа ii. Близкие результаты получены сотрудниками Санкт-Петербургской военно-медицинской академии, исследовавшими метаболический статус у женщин репродуктивного возраста, страдающих ЭАГ, и выявившими достоверное повышение уровня общего холестерина за счет ХС-ЛПНП и триглицеридов в группах носителей id и dd полиморфизмов гена АСЕ (Бойцов С.А., 2002), а также сотрудниками НИИ терапии СО РАМН, показавшими, что у носителей d-аллеля отношение шансов иметь холестерин 200 мг/дл в 1,3 раза выше, чем у носителей i-аллеля [Максимов В.Н., 2007].
Изучение показателей циркадного ритма АД в группах больных ЭАГ с различными генотипами гена АСЕ выявило наибольшие показатели индекса времени САД и ДАД в ночное время суток у носителей dd – генотипа при наличии статически значимых различий по показателям ДАД у подростков коренной этногруппы: у подростков некоренной этногруппы – носителей ii- генотипа показатель составил 10,88±14,43%, id-генотипа 21,17±17,13%, dd-генотипа 25,24±19,49%; соответственно у подростков коренной этногруппы индекс времени составил 11,45±11,49%; 31,38±27,62%; 51,11±9,23%.
При сравнении основных параметров системной и внутрисердечной гемодинамики у больных подростков коренной этногруппы с разными генотипами полиморфного маркера id гена АСЕ выявлены статистически достоверные различия общего периферического сосудистого сопротивления (ОПСС): у носителей dd-полиморфизма в обеих этнических группах констатированы наибольшие параметры ОПСС, при этом ОПСС была наименьшей у носителей ii-полиморфизма, а у гетерозигот этот показатель носил промежуточное значение. Наряду с этим у пациентов коренной этногруппы показана статически достоверная зависимость активности АПФ с параметрами УПСС (р=0,0415).
Рис.4 Взаимосвязь аллелей гена АСЕ, активности ангиотензинпревращающего фермента и ряда клинико-биохимических и функциональных параметров
Таким образом, у носителей делетированного аллеля гена АСЕ наблюдается активация ренинангиотензиновой системы с повышением активности АПФ, который определяет конвертацию ангиотензина I в вазоактивный ангиотензин II. Последний, являясь ключевым звеном РАС, взаимодействует со специфическими клеточными рецепторами, стимулирует корковый и мозговой слой надпочечников с последующей выработкой катехоламинов и альдостерона, соответственно, повышает тонус гладкомышечной мускулатуры сосудов, определяя повышение УПСС у подростков обеих этногрупп, увеличение времени гипертензии САД и ДАД в ночное время суток. Наряду с этим, носительство делетированного аллеля и повышение активности АПФ в плазме крови способствуют формированию проатерогенных нарушений в виде повышения фракции холестерина ЛПОНП и повышению тревожности, демонстрируя тем самым плейотропный эффект гена АСЕ (рис. 4).
Полиморфизм Т174М гена ангиотензиногена (AGT). Частоты генотипов в выборках составили: некоренной tt-76,59%, tm-19,15%, mm-4,26%; коренной соответственно 83,35%; 13,92%; 2,53%. Все попарные различия недостоверны. Сравнительный анализ частот генотипов в группе популяционного контроля и у пациентов в обеих этногруппах не выявил статистически значимых отличий: в некоренной этногруппе частота генотипа tt составила 63,19%, tm – 34,03%, mm – 2,77%; коренной соответственно 71,95%, 25,61%, 2,44%. Аллель m встречается в некоренной этногруппе контроля с частотой 13,83%, среди пациентов с ЭАГ 19,72% (р=0,3099), в группе подростков коренной этногруппы соответственно 9,49% и 15,24% (р=0,5850).
Регрессионный анализ выявил вклад гена AGT в регуляцию активности АПФ у пациентов коренной этногруппы, при этом носители мутантного аллеля m имеют более высокие показатели активности данного фермента в сравнении с носителями аллеля t.
Активность АПФ в плазме у подростков коренной этногруппы =
47,650 + [-12,662 AGT[tt]] (F=11,534 p=0,009).
Общий вклад зависимой переменной на независимую = 59%.
Для подростков некоренной этногруппы не показано ассоциации полиморфизма t174m гена AGT и активности АПФ.
Следовательно, генетически детерминированная геном АGT экспрессия исходного белка ренинангиотензинового каскада ангиотензиногена, не обладающего самостоятельной вазоконстрикторной активностью, реализует свое эффекторное действие на уровень АД опосредованно, через запуск вышеобозначенного каскада и, в частности, через повышение активности АПФ.
VNTR полиморфизм гена эндотелиальной синтазы окиси азота. Частоты генотипов в популяциях составили: некоренной 4в4в -73,40%, 4а4в – 25,53%, 4а4а – 1,06%; коренной - соответственно 73,42%; 25,32%; 1,26%. Среди пациентов показатели составили: среди подростков некоренной этногруппы 70,64%, 27,52%, 1,83%; коренной соответственно 74,65%, 22,53%, 2,82%. Межгрупповые различия недостоверны, как и недостоверны различия частоты встречаемости аллелей: 13,83% в группе контроля против 15,60% у пациентов с ЭАГ в некоренной этногруппе (р=0,5747), соответственно 13,92% и 14,08% (р=0,8002) в группе подростков коренной этногруппы.
Для понимания механизмов «включения» изучаемого полиморфизма в развитии патологического процесса нами проведено изучение ассоциативной связи VNTR полиморфизма еNOS с рядом клинико-анамнестических и биохимических параметров у подростков обеих популяций. Среди подростков коренной этногруппы показана взаимосвязь данного полиморфизма с носовыми кровотечениями (r=+0,467, p=0,0437).
Следует отметить, что анализ предъявляемых подростками жалоб показал превышение частоты встречаемости носовых кровотечений у подростков коренной этногруппы (в некоренной этногруппе – 12,12%, коренной – 22,41%, р=0,0984), что в сочетании с выявленной высокой корреляционной зависимостью носовых кровотечений с изучаемым полиморфизмом гена еNOS позволяет нам сделать предположение о возможном участии изучаемого полиморфизма в сочетании с другими генетическими маркерами, регулирующими иные звенья коагуляционного гемостаза в реализации такого клинического признака ЭАГ как носовые кровотечения у пациентов коренной этногруппы. Так известно, что NO, наряду с регуляцией тонуса сосудов, сократительной функцией сердца, торможением клеточной пролиферацией, ингибирует агрегацию и адгезию тромбоцитов [Marin J., 1997; Wener R., 1998; Jeremy J.Y, 1999].
Метаболические нарушения у носителей разных генотипов гена еNOS характеризуются статистически достоверными различиями содержания сывороточного железа, при этом носители аллеля 4а (носители гомозиготного генотипа 4а4а и геторозиготного генотипа 4а4в объединены в одну подгруппу в виду малого количества пациентов-носителей 4а4а генотипа) имеют минимальные показатели сывороточного железа: у подростков некоренной этногруппы 12,36±1,97 ммоль/л против 14,81±4,81 ммоль/л. У носителей 4в4в генотипа (р=0,0479); 14,96±4,53 ммоль/л – у носителей 4в4в генотипа и 12,58±2,55 – у носителей 4а4а и 4а4в генотипов в выборке пациентов коренной этногруппы (р=0,0708) (рис.5).
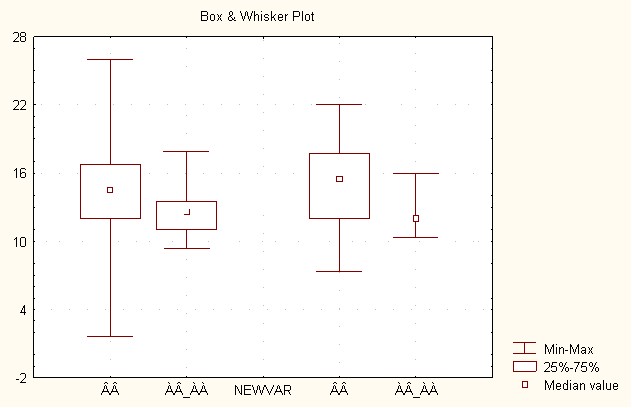
Рис.5 Уровень сывороточного железа у подростков изучаемых этногрупп – носителей разных генотипов гена еNOS
Существовавшие ранее противоречивые указания на обратную связь уровня сывороточного железа с ССЗ и смертностью находили объяснение с точки зрения прооксидантного эффекта Fe [Стукс И.Ю., 2003; Гончарова Е.В., 2008; Ascherio A., 1994; Liao Y., 1994]. Вместе с тем указанная противоречивость может быть объяснена с молекулярно-генетических позиций реализации депрессорного действия NO. Участие гена eNOS, определяющего экспрессию NO, в формировании вазогенного эффекта NO опосредуется через S-нитрозольные и динитрозольные комплексы железа, способные депонировать NO, с одной стороны, с другой - через активацию растворимой гуанилатциклазы. При этом Fe-дефицитная растворимая гуаниталциклаза не может активироваться оксидом азота [Северина И.С., 2007].
Таким образом, наличие железодефицитных состояний у пациентов – носителей мутантного аллеля 4а гена еNOS определяет склонность к вазоконстрикторным реакциям и формированию ЭАГ. Продемонстрирована взаимосвязь еNOS c результатами мониторирования АД: увеличение индекса времени САД в дневные часы у пациентов некоренной этногруппы (ИВ у носителей генотипа 4в4в составил 19,47±12,29, 4а4в – 16,67±12,22 (р=0,4924), 4а4а – 36,18±9,15 (р=0,0722; р=0,0499), уменьшение суточного индекса ДАД у подростков коренной этногруппы (носители гомозиготного генотипа 4а4а имели меньший суточный индекс САД (7,35±2,08) против суточного индекса у носителей генотипа 4в4в 16,52±10,06 (р=0,0061)), что указывает на формирование у данной когорты больных прогностически неблагоприятного циркадного ритма по типу «non dipper» или «night peaker» (рис. 6).
Рис.6 Схема ангиприпертензивного действия гена синтазы окиси азота
Инсерционно-делеционный полиморфизм гена аполипопротеина А1. Частоты генотипов полиморфного маркера i/d гена аполипопротеина А1 (АроА1) у здоровых подростков разных этнических групп были следующими: у подростков некоренной этногруппы – носителей ii полиморфизма – 84,04%, id – 15,96%, dd– 0,00%; у подростков коренной этногруппы соответственно, 83,54%, 16,46%, 0,00%. Попарное сравнение здоровых и больных ЭАГ подростков обеих этногрупп не выявило значимого различия по частоте генотипов и аллелей гена АроА1.
Анализ показателей липидного обмена у пациентов-носителей разных полиморфных вариантов гена АроА1 некоренной этногруппы, проживающей в Республике Бурятия, выявил статистически значимые различия содержания в сыворотке таких показателей липидного обмена, как холестерин липопротеидов очень низкой плотности и триглицериды:
Содержание триглицеридов = 1,552 + [-0,653АроА1[ii]] (F=7,174 p=0,009)
Общий вклад всех зависимых переменных на независимую = 9,4%
Содержание ХС – ЛПОНП = 0,613 + [- 0,189 АроА1 [ii]] (F=4,738 p=0,033)
Общий вклад всех зависимых переменных на независимую = 6,3%
Для подростков некоренной этногруппы детерминированный геном АпоА1 дисбаланс фракций липопротеидов в виде повышения фракции ХС ЛПОНП и ТГ определен носительством делетированного аллеля. При этом вклад изучаемого полиморфизма на уровень ХС-ЛПОНП и ТГ невысок, что может быть объяснено многофакторностью данных биохимических параметров. Для пациентов коренной этногруппы данный генетический маркер, определяющий экспрессию аполипопротеина А1 ЛПВП, является индифферентным.
По результатам анализа синергизма генов АСЕ и АроА1 в реализацию фенотипических проявлений для подростков некоренной этногруппы показана тенденция взаимопотенциирующего действия указанных генетических полиморфизмов с содержанием ТГ в сыворотке крови (F=2,8358, p=0,0663), ХС-ЛПОНП (F=2,5689, p=0,0846), уровнем глюкозы в сыворотке крови (F=2,6639, p=0,0791), показателем САД (F=2,4852, p=0,0924), индексом времени САД (F=2,4934, p=0,0955), коэффициентом вариабельности САД (F=2,6127, p=0,0941) и ДАД в дневные часы (F=0,7237, р=0,0851)..
Генетически детерминированные нарушения экспрессии АПФ (d-аллель) и аполипопротеина А1 (d-аллель), потенцируя друг друга, определяют повышение концентрации богатых триглицеридами высокоатерогенных ЛПОНП, способствуя усилению проатерогенных процессов, вазоконстрикторных реакций с повышением уровня САД, индекса времени САД, вариабельности САД и ДАД у подростков некоренной этногруппы. Гипергликемия и априори сопровождающая ее гиперинсулинемия являются важным связующим звеном между ЭАГ и метаболическими расстройствами.
Существуют указания на генетическую предопределенность инсулинорезистентности, метаболических нарушений при ЭАГ. При этом инсулинорезистентность рассматривают как независимый фактор риска возникновения и стабилизации АГ (P.Bjorntort, 2000). Известно, что скорость синтеза в печени ЛПОНП регулируется инсулином плазмы крови и наличием начального субстрата – свободных жирных кислот и глюкозы, при этом гипергликемия и сопутствующая ей гиперинсулинемия способны усиливать синтез ЛПОНП печенью. Наряду с этим элиминация ЛПОНП регулируется липопротеинлипазой, активность которой зависит от содержания инсулина в крови. При гиперинсулинемии липопротенлипаза оказывается резистентной к действию инсулина и выведение ЛПОНП из кровотока замедляется (Зимин Ю.В., 1998). Инсулин регулирует ряд механизмов трансмембанного транспорта ионов, с помощью которых поддерживаются нормальное внутриклеточное содержание электролитов и рН клетки, при этом увеличение концентрации инсулина при гипергликемии способствует стимуляции Na+-H+ противотранспорта и снижению активности Са2+-АТФ – азного насоса. Ион натрия, обладая гидрофильным свойством, вызывает набухание сосудистой стенки с последующим сужением просвета сосудов. Увеличение концентрации цитозольных Na+ и Са2+ сопровождается повышением чувствительности заложенных в них нервных рецепторов к прессорному действию циркулирующих в плазме крови катехоламинов, в частности, норадреналину и ангиотензину, даже при незначительном повышении их концентрации. Инсулин, стимулируя выработку гепатоцитами инсулиноподобного фактора роста – 1, определяет пролиферацию гладкомышечных клеток сосудов и становление АГ (рис. 7).

Рис.7 Синергизм гена АСЕ и АпоА1 у пациентов русской этногруппы
Существуют указания на генетическую предопределенность инсулинорезистентности, метаболических нарушений при ЭАГ. При этом инсулинорезистентность рассматривают как независимый фактор риска возникновения и стабилизации АГ (P.Bjorntort, 2000). Известно, что скорость синтеза в печени ЛПОНП регулируется инсулином плазмы крови и наличием начального субстрата – свободных жирных кислот и глюкозы, при этом гипергликемия и сопутствующая ей гиперинсулинемия способны усиливать синтез ЛПОНП печенью. Наряду с этим элиминация ЛПОНП регулируется липопротеинлипазой, активность которой зависит от содержания инсулина в крови. При гиперинсулинемии липопротенлипаза оказывается резистентной к действию инсулина и выведение ЛПОНП из кровотока замедляется (Зимин Ю.В., 1998). Инсулин регулирует ряд механизмов трансмембанного транспорта ионов, с помощью которых поддерживаются нормальное внутриклеточное содержание электролитов и рН клетки, при этом увеличение концентрации инсулина при гипергликемии способствует стимуляции Na+-H+ противотранспорта и снижению активности Са2+-АТФ – азного насоса. Ион натрия, обладая гидрофильным свойством, вызывает набухание сосудистой стенки с последующим сужением просвета сосудов. Увеличение концентрации цитозольных Na+ и Са2+ сопровождается повышением чувствительности заложенных в них нервных рецепторов к прессорному действию циркулирующих в плазме крови катехоламинов, в частности, норадреналину и ангиотензину, даже при незначительном повышении их концентрации. Инсулин, стимулируя выработку гепатоцитами инсулиноподобного фактора роста – 1, определяет пролиферацию гладкомышечных клеток сосудов и становление АГ.
Обращаясь к синегизму генов АроА1-еNOS и АроА1-eNOS-АGT, следует отметить, что вопрос участия генетических факторов в регуляции циркадного ритма АД не вызывает дискуссии. Тем не менее, до настоящего времени именно этот аспект патогенеза ЭАГ остается наименее изученным. Нами показана тенденция зависимости ряда показателей СМАД, а именно, индекса времени гипертензии от панели генов-кандидатов АроА1-АGT-eNOS. При этом лица, являющиеся носителями гомозиготного генотипа 4а4а гена eNOS наивысшие показатели «нагрузкой» ДАД, а носительство гомозиготного генотипа tt гена AGT и гомозиготного ii генотипа гена АроА1детерминирует снижение ИВ ДАД:
ИВ ДАД днем = 28,000 + [+20,850 NOS[aa]] + [-24,517 AGT [tt] ApoA1[ii]]
(F=2,314, p=0,087).
Общий вклад всех зависимых переменных на независимую = 27,8%.
ИВ ДАД суточный = 33,250 +[-25,500 ApoA1[ii]] + [+21,156 NOS [aa]] + [-28,010 AGT[tt] ApoA1[ii]] (F=2,228, p=0,079).
Общий вклад всех зависимых переменных на независимую = 37,8%.
Показатели вариабельности ДАД, а именно КВ ДАД в ночные часы, величина подъема ДАД в утренние часы зависимы от синергизма полиморфизма Т174М гена AGT и инсерционно-делеционного полиморфизма гена АроА1. При этом носительство гомозиготного генотипа tt гена AGT и диаллеля ii гена АроА1 способствует снижению вариабельности и величины подъема АД в утренние часы:
КВ ДАД ночью = -15,187 AGT[tt] ApoA1 [ii] (F=2,768, p=0,062).
Общий вклад всех зависимых переменных на независимую = 24,2%.
Величина подъема ДАД в утренние часы =94,5 +[-56,610AGT[tt]] + [-58,100 ApoA1 [ii] + [55,818 AGT [tt] ApoA1 [ii]] (F=5,471, p=0,005).
Общий вклад всех зависимых переменных на независимую = 39,6%.
Таким образом, совокупный анализ результатов многомерного анализа указывает на коморбидность липидтранспортной и ренинангиотензиновой систем у подростков некоренной этногруппы, определяя повышение времени увеличение вариабельности дистолической гипертензии. Иные закономерности выявлены при анализе ген-генных взаимоотношений у подростков коренной этногруппы: значим синегризм инсерционно-делеционного полиморфизма гена АСЕ с VNTR полиморфизмом гена еNOS и VNTR полиморфизма гена eNOS с геном AGT, т.е. коморбидность ренинангиотензиновой и нитритергической систем при интактности изучаемого полиморфизма гена липидтранспортной системы.
Так, по результатам многофакторного дисперсионного анализа показана статически значимая связь гена АСЕ и еNOS с показателем САД (F=10,99; p = 0,0002), ДАД (F=10,26; p = 0,0003), пульсовым АД (F=7,29; p = 0,0021), ЧСС (F=10,84; p = 0,0002), индексом времени САД (F=3,05; p = 0,0697) и ДАД (F=7,93; p = 0,0035), суточным индексом САД (F=3,59; p = 0,0465), ДАД (F=3,28; p = 0,0587), уровнем Fe сыворотки (F=3,25; p=0,0516), а также с такими показателями системной и внутрисердечной гемодинамики как УО (F=22,97; p = 0,000001), ОПСС (F=11,19; p = 0,0002) и ММЛЖ (F=14,13; p = 0,00007), индексом ММЛЖ (F=19,60; p = 0,00019) (рис.8).

Рис.8 Синергизм генов АСЕ и еNOS у пациентов коренной этногруппы
Носительство делетированного аллеля гена АСЕ и редкого аллеля 4а VNTR полиморфизма гена еNOS определяет повышение активности АПФ с последующей деградацией вазодилятатора брадикинина в условиях генетически детерминированного снижения экспрессии NO-синтазы и продукции эндотелиального фактора релаксации – NO, что закрепляет прессорные механизмы и предопределяет ранний риск развития гипертрофии миокарда левого желудочка.
Известно, что поражение органов-мишеней усугубляет течение и прогноз ЭАГ. В связи с этим поиск факторов, способствующих развитию поражений органов-мишеней, в том числе гипертрофии миокарда левого желудочка, является актуальным. Масса миокарда левого желудочка имеет высокодостоверные положительные корреляционные связи с массой тела (r=+0,3982, p=0,0001), индексом Кетле (r=+0,3119, p=0,0034), ударным объемом сердца (r=+0,5306, p=0,000001), величиной подъема САД в утренние часы (r=+0,3721, p=0,0468), удельным периферическим сопротивлением (r=+0,3296, p=0,0089) и личностной тревожностью (r=+0,5146, p=0,0169). Обратная зависимость выявлена между ММЛЖ и податливостью артериального русла (r= - 0,4076, p=0,0016), а также фракцией выброса (r= - 0,2089, p=0,0535).
Таким образом, выявлены универсальные клинико-функциональные маркеры риска раннего развития ГМЛЖ: избыточная масса тела, нарушение циркадного ритма АД (увеличение индекса времени ДАД, повышение величины и скорости подъема САД и ДАД в утренние часы), повышение УПСС, увеличение УО, снижение пульсового АД, снижение упруго-эластических свойств сосудистого русла.
Анализ результатов собственного исследования среди подростков, страдающих ЭАГ, позволил выделить генетические маркеры риска раннего развития гипертрофии миокарда левого желудочка, к которым у подростков коренной этногруппы следует отнести носительство делетированного аллеля i/d полиморфизма гена АСЕ и аллеля 4а VNTR полиморфизма гена еNOS. Для подростков некоренной этногруппы нами не выявлено ассоциации изучаемых полиморфных маркеров с ММЛЖ и ТЗСЛЖ, что свидетельствует об отсутствии значимого вклада изучаемых молекулярно-генетических маркеров в развитии гипертрофии миокарда левого желудочка.

Рис.9 Относительный риск развития ЭАГ у подростков русской популяции – носителей разных вариантов генотипов изучаемых полиморфизмов

Рис.10 Относительный риск развития ЭАГ у подростков бурятской популяции – носителей разных вариантов генотипов изучаемых полиморфизмов
Оценка релятивного риска развития ЭАГ у подростков изучаемых этногрупп позволяет отнести носителей гетерозиготного id генотипа гена АСЕ, носителей гетерозиготного tm AGT и гомозиготного 4а4а генотипа eNOS к группе риска по раннему развитию ЭАГ (рис. 9, 10). Подростков некоренной этногруппы, являющихся носителями мутантного аллеля d АpoA1, следует относить к группе риска по раннему развитию проатерогенных дислипидемий.
Таким образом, использование метода ассоциативных связей не выявило статистически значимых отличий частоты встречаемости изучаемых структурно-генетических полиморфизмов в группах популяционного контроля и среди пациентов с ЭАГ. Тем не менее, оценка релятивного риска развития изучаемой патологии и наличие ассоциативной связи представленных структурно-генетических полиморфизмов с клинико-биохимическими и гемодинамическими параметрами позволяет отнести указанные кандидатные гены к генам - «модификаторам» – генам, определяющим клинический полиморфизм заболевания. Полученный результат соответствует пониманию ЭАГ как мультифакториального заболевания, в формировании клинических признаков которого участвуют комплексы генетических маркеров.
В целом генетическую детерминированность формирования патологических процессов при артериальной гипертензии можно представить в виде схемы (рис.11). Изученные нами звенья патогенеза, в частности, ренинангиотензиновое, нитриергическое и липидтранспортное генетически детерминированы панелью генов-кандидатов. Ген АСЕ определяет конвертацию ангиотензина I в вазоактивный ангиотензин II, который кроме прямого вазоконстрикторного действия стимулирует выработку альдостерона и катехоламинов, подавляет активность калликреинкининовой системы. Нитриергическое патогенетическое звено детерминировано геном eNOS, редкий аллель 4а которого снижает экспрессию NO-синтазы, способствующей образованию эндотелиального фактора релаксации NO из L-аргинина. Дефицит NO в сочетании с недостаточным уровнем сывороточного железа определяет склонность к вазоконстрикторным реакциям и формированию ЭАГ вследствие снижения активности растворимой гуанилатциклазы и снижения концентрации NO в динитрозольных и S-нитрозольных комплексах железа сыворотки крови. Наряду с вышеобозначенными универсальными для изучаемых популяций патогенетическими механизмами развития ЭАГ существуют этнически дифференцированные особенности метаболических процессов. Делетированная аллель гена АроА1 детерминирует дислипидемию проатерогенной направленности у пациентов некоренной этногруппы.
Перспективность проведенного исследования заключается в открытии возможности идентификации генетической предрасположенности к артериальной гипертензии и создании в перспективе генетического паспорта населения Республики Бурятия. Наряду с этим, благодаря идентификации генов и пониманию механизмов, в регуляции которых они принимают участие, возможна реальная сверхранняя досимптомная дифференцированная диагностика, прогнозирование течения синдрома повышенного артериального давления у подростков с обозначением группы риска по раннему становлению АГ и поражению органов-мишеней, а также разработка индивидуальных лечебно-профилактические мероприятий.

Рис.11 Схема генетической детерминации патогенетических механизмов формирования ЭАГ
ВЫВОДЫ
- Распространенность ЭАГ среди школьников Республики Бурятия составляет 96,86 на 1000 обследованных школьников, высокого нормального АД – 113,76 на 1000 обследованных школьников. Распространенность ЭАГ зависит от климатогеографических условий (проживание на высоте 1500 м. над уровнем моря), социальной среды, окружающей ребенка (в городе распространенность ЭАГ выше, чем в сельских районах), и половозрастного фактора (высокая распространенность ЭАГ зарегистрирована у мальчиков старшего школьного возраста, у девочек среднего школьного возраста).
- Прогностически значимыми в формировании АГ, вне зависимости от этнической принадлежности, являются отягощенная по сердечно-сосудистой патологии наследственность (для школьников некоренной этногруппы отношение шансов (ОШ) = 2,0, для школьников коренной этногруппы ОШ = 2,44), дислипидемия проатерогенной направленности (содержание ХС-ЛПОНП ОШ = 3,26; 4,14 соответственно; уровень триглицеридов ОШ=3,09; ОШ=2,86, соответственно), избыточная масса тела (ОШ=2,83; ОШ=2,71, соответственно).
- У подростков коренной этногруппы, вне зависимости от характера питания, дислипидемия носит антиатерогенный характер за счет повышения холестерина липопротеидов высокой плотности (1,33±0,43 ммоль/л., 1,19±0,42 ммоль/л., р=0,0190).
- Вегетативный гомеостаз у подростков обеих популяций характеризуется исходной ваготонией с гипердиастолическим вариантом вегетативного обеспечения, коррелирующего с индексом времени ДАД в дневные (r= - 1,87, р=0,0169) и ночные часы (r=-1,74, р=0,0825), а также уровнем кортизола (r=+1,86, р=0,0627).
- Повышенный уровень личностной и реактивной тревожности у пациентов с ЭАГ, коррелирующий с нагрузкой давлением (индекс времени САД, ДАД, коэффициент вариабельности САД, ДАД), показателями системной (УПСС) и внутрисердечной гемодинамики (МОК), опосредует свой соматогенный эффект в том числе через активацию ренинангиотензиновой системы.
- По спектру изучаемых генетических маркеров в представленных популяциях выявлена этническая дифференциация частоты встречаемости инсерционно-делеционного полиморфизма гена ангиотензинпревращающего фермента за счет более высокой частоты встречаемости инсерции в группе подростков бурятской этногруппы по сравнению с русской (0,6139; 0,5053, р=0,0412). По другим генетическим маркерам этнических различий не выявлено.
- Важнейшими компонентами в структуре подверженности к развитию ЭАГ у подростков обеих этногрупп является генетически детерминированный дисбаланс прессорной ренинангиотензиновой и депрессорной нитриергической систем у пациентов – носителей гомозиготного генотипа 4а4а VNTR полиморфизма гена еNOS (RR у русских подростков составляет 1,75, бурят – 3,44), гетерозиготного i/d генотипа гена АСЕ (RR у русских подростков составляет – 1,27, бурят – 2,88), гетерозиготного генотипа tm полиморфизма Т174М гена ангиотензиногена (RR у русских подростков составляет 2,19, бурят – 2,10).
- Железодефицитные состояния у носителей редкого аллеля 4а VNTR полиморфизма гена еNOS, предопределяя снижение активности растворимой гуанилатциклазы и снижения резервного депо NO в динитрозольных и S-нитрозольных комплексах железа сыворотки крови, способствуют стабилизации ЭАГ в виде увеличения индекса времени СAД в дневные часы, формирования неблагоприятного суточного профиля по типу «non dipper» у пациентов обеих этнических групп.
- Анализ ген-генных взаимоотношнений и их вклад в реализацию клинико-биохимических и функциональных фенотипов установил наличие этнической дифференциации ценности выявленных синергизмов. Для подростков русской этногруппы значим синергизм делетированного аллеля гена АСЕ и делетированного аллеля гена АроА1, клинико-биохимическим фенотипом которого явилось формирование липидного профиля проатерогенной направленности с увеличением нагрузкой давлением и стабилизацией АГ. Для подростков коренной этногруппы синергизм нитритергической системы (ген еNOS) и ренинангиотензиновой системы (гена АСЕ), определяющий формирование циркадного ритма САД и ДАД (повышение индекса времени САД, ДАД, недостаточное снижение САД в ночное время суток), состояние системной гемодинамики (повышение ОПСС) и формирование гипертрофии миокарда. Наряду с этим, для подростков коренной этногруппы важен синергизм генов NOS и AGT, обеспечивающий регуляцию уровня холестерина (F=0,8103, р=0,0459).
- Наряду с универсальными клинико-функциональными критериями риска раннего развития гипертрофии миокарда (избыточная масса тела, снижение пульсового АД, увеличение УО, увеличение индекса времени ДАД, повышение величины и скорости подъема САД и ДАД а также повышение УПСС) существуют этнически дифференцированные молекулярно-генетические маркеры: для подростков коренной этногруппы синергизм делетированного аллеля гена АСЕ и аллеля 4а еNOS, для подростков некоренной этногруппы изучаемые молекулярно-генетических маркеры не вносят значимого вклада в формирование гипертрофии миокарда левого желудочка.
Практические рекомендации
- Для прогнозирования течения ЭАГ всем детям и подросткам с повышением уровня АД необходимо генотипирование по ряду генов-кандидатов. Носителей гетерозиготного генотипа АСЕ, гомозиготного генотипа 4а4а гена еNOS, гетерозиготного генотипа AGT необходимо отнести к группе риска по раннему становлению ЭАГ.
- Наличие железодефицитных состояний у детей и подростков с ЭАГ, являющихся - носителями аллеля 4а VNTR полиморфизма гена еNOS, требует своевременной коррекции и дальнейшего диспансерного наблюдения в силу синергичного усиления при железодефицитной анемии вазоконстрикторного эффекта дефицита оксида азота у пациентов – носителей редкого аллеля 4а.
- Пациентам некоренной этногруппы – носителям делетированного аллеля гена АроА1 необходим динамический контроль за показателями липидного профиля (ТГ, ХС-ЛПОНП) и активная коррекция питания с целью профилактики раннего развития проатерогенной дислипидемии.
- При разработке стратегии первичной профилактики ЭАГ среди школьников Республики приоритетными следует считать мероприятия по предупреждению и избавлению от курения, коррекции веса и оптимизации физической нагрузки.
- В комплекс мер по диагностике и лечению ЭАГ целесообразно включать меры психологической коррекции, направленные на снижение тревожности, изменение восприятия и переживаний актуальной психотравмирующей ситуации.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ
ПО ТЕМЕ ДИССЕРТАЦИИ
- Баирова Т.А. Личностно-типологические особенности подростков бурятской популяции, проживающих в различных социальных средах / Т.А. Баирова, В.В. Долгих // Вопросы сохранения и развития здоровья населения: материалы итог. науч. конф., 1-2 окт. 2003 г. – Красноярск, 2002. – С. 18-21.
- Еремина Е.Р. Изучение наследственного полиморфизма у детского населения Бурятии / Е.Р. Еремина, Т.А. Баирова, А.Б-Ж. Бимбаев // Генетика человека и патология: сб. науч. тр. – Томск, 2002. – С. 65-66.
- Баирова Т.А. Личностно-типологические предикторы эссенциальной артериальной гипертензии у подростков бурятской популяции / Т.А. Баирова, В.В. Долгих // Бюл. ВСНЦ СО РАМН. – 2003. - №6. – С. 25-29.
- Баирова Т.А. Уровень артериального давления у подростков Республики Бурятия / Т.А. Баирова, И.И. Киселева, А.Б-Ж. Бимбаев // Вопросы сохранения и развития здоровья населения: материалы итог. науч. конф., 1-2 окт. 2003 г. - Красноярск, 2003. – С. 20-21.
- Использование сенсорной терапии в реабилитации подростков с артериальной гипертензией / Т.А. Баирова [и др.] // Тихоокеан. мед. журн. – 2003. - №3 (13). – С. 90.
- Оценка уровня артериального давления у подростков республики Бурятия / Т.А. Баирова [и др.] // Итоги и перспективы экстренной и неотложной помощи медицины Бурятии: материалы II науч.-практ. конф., 3 июля 2003 г. – Улан-Удэ, 2003. – С. 146-147.
- Баирова Т.А. Ген ангиотензинпревращающего фермента: полиморфизм в сибирской популяции и его роль в формировании эссенциальной артериальной гипертензии: сб. тез. / Т.А. Баирова, А.Б-Ж. Бимбаев, И.В. Тугутова // Детская кардиология 2004. – М., 2004. – С. 7-8.
- Ген ангиотензинпревращающего фермента и его роль в формировании эссенциальной артериальной гипертензии / Т.А. Баирова [и др.] // Кардиоваскулярная терапия и профилактика. – 2004. - Т.3, №4. – Приложение. - С. 40.
- Долгих В.В. Молекулярно-генетические маркеры эссенциальной артериальной гипертензии / В.В. Долгих, Т.А. Баирова, А.Б-Ж. Бимбаев // Бюл. ВСНЦ СО РАМН. – 2004. - №3. – С. 100-106.
- Импульсное низкоинтенсивное электромагнитное поле в лечении эссенциальной артериальной гипертензии у подростков / Т.А.Баирова [и др.] // Кардиоваскулярная терапия и профилактика. – 2004. - Т.3, №4.- Приложение. - С.149-150.
- Использование импульсного низкоинтенсивого электромагнитного поля в реабилитации подростков с артериальной гипертензией / Т.А. Баирова [и др.] // Бюл. ВСНЦ СО РАМН. – 2004. - №3. – С. 42-46.
- Полиморфные маркеры ангиотензинпревращающего фермента и артериальная гипертензия у подростков разных популяций, проживающих на территории Республики Бурятия: сб. тез. / Т.А. Баирова [и др.] // Детская кардиология 2004. – М., 2004.- С. 40.
- Сравнительная оценка эффективности методов восстановительного лечения подростков с артериальной гипертензией / Т.А. Баирова [и др.] // Актуальные проблемы клинической медицины: материалы XII науч.-практ. конф., посвящ. 25-летию Иркутского ГИДУВа. – Иркутск, 2004. – С. 156-157.
- Баирова Т.А. Вариабельность артериального давления у подростков с эссенциальной артериальной гипертензией / Т.А. Баирова, И.И. Киселева // Артериальная гипертония: медико-социальные и организационно-методические проблемы профилактики и лечения: материалы сибир. науч.- практ. конф., 24-25 нояб. 2005 г. - Иркутск, 2005. – С. 15-16.
- Баирова Т.А. Генетический полиморфизм в популяциях, проживающих на территории Республики Бурятия / Т.А. Баирова, А.Б-Ж. Бимбаев // Современные проблемы стационарной помощи детям: материалы науч.- практ. конф., посвящ. 20-летию РДКБ, 25 нояб. 2005 г. – М., 2005. – С. 145.
- Баирова Т.А. Оценка релятивного риска развития артериальной гипертензии у подростков / Т.А. Баирова, А.Б-Ж. Бимбаев // Современные проблемы стационарной помощи детям: материалы науч.- практ. конф., посвящ. 20-летию РДКБ, 25 нояб. 2005 г. – М., 2005. – С. 28.
- Баирова Т.А. Оценка циркадного ритма артериального давления у подростков с эссенциальной артериальной гипертензией / Т.А. Баирова, И.И. Киселева // Артериальная гипертония: медико-социальные и организационно-методические проблемы профилактики и лечения: материалы сибир. науч.- практ. конф., 24-25 нояб. 2005 г. - Иркутск, 2005. – С. 31-33.
- Взаимосвязь гена метилентетрагидрофолатредуктазы и эссенциальной артериальной гипертензии у подростков разных этнических групп, проживающих на территории Бурятии / Т.А. Баирова [и др.] // Бюл. ВСНЦ СО РАМН. – 2005. - №4. – С. 104-107.
- Некоторые генетические маркеры эссенциальной артериальной гипертензии / Т.А. Баирова [и др.] // Вопросы сохранения и развития здоровья населения Севера и Сибири: материалы науч.-практ. конф., 15-17 июня 2005 г. – Красноярск, 2005. – С. 157-158.
- Особенности использования преформированных физических факторов у подростков с лабильной артериальной гипертензией / Т.А.Баирова [и др.] // Артериальная гипертония: медико-социальные и организационно-методические проблемы профилактики и лечения: материалы сибир. науч.- практ. конф.., 24-25 нояб. 2005 г. - Иркутск, 2005. – С. 23-25.
- Региональные особенности распространенности артериальной гипертензии у детей школьного возраста в республике Бурятия // Т.А. Баирова [и др.] // Бюл. ВСНЦ СО РАМН. – 2005. - №5. – С. 143-148.
- Роль импульсного низкоинтенсивного электромагнитного поля в лечении подростков с эссенциальной артериальной гипертензией / Т.А. Баирова [и др.] // Физиотерапия и курортология. – 2005. - №6. – С. 13-15.
- Роль полиморфизма Т174М гена ангиотензиногена в реализации симптоматической артериальной гипертензии / Т.А. Баирова [и др.] // Бюл. ВСНЦ СО РАМН. – 2005. - №5. – С. 124-128.
- Шадрина Н.А. Системная гипертензия при гломерулонефрите у детей разных этнических групп и ее взаимосвязь с полиморфизмом гена ангиотензинпревращающего фермента / Н.А. Шадрина, Т.А. Баирова, А.Б-Ж. Бимбаев // Бюл. ВСНЦ СО РАМН. – 2005. - №5. – С. 128-133.
- Ассоциация полиморфных маркеров генов ренин-ангиотензиновой системы с симптоматической артериальной гипертензией при хроническом гломерулонефрите у детей разных этнических групп / Т.А. Баирова [и др.] // Сибир. мед. журн. – 2006. - №5. - С. 91-97.
- Баирова Т.А. Молекулярно-генетическое тестирование как одно из перспективных направлений фармакотерапии артериальной гипертензии / Т.А. Баирова, И.В. Тугутова, О.Ч. Хойкова // 85 лет здравоохранению г. Улан-Удэ: сб.статей. – Улан-Удэ, 2006. – С. 218-219.
- Бимбаев А.Б-Ж. Симптоматическая артериальная гипертензия при хроническом гломерулонефрите и ее взаимосвязь с полиморфным маркером геном ангиотензиногена / А.Б-Ж. Бимбаев, Т.А. Баирова, Н.А. Шадрина // 85 лет здравоохранению г. Улан-Удэ: сб.ст. – Улан-Удэ, 2006. – С. 120-212.
- Взаимосвязь инсерционно-делеционного полиморфизма гена ангиотензинпревращающего фермента с суточным профилем артериального давления / Т.А.Баирова [и др.] // Современные технологии в педиатрии и детской хирургии: Материалы V Рос. конгр., 24-26 окт. 2006 г. – М., 2006. - С. 75-76.
- Вологдина И.О. Зависимость уровня артериального давления от фазы полового развития девочек / И.О. Вологдина, Т.А. Баирова, А.Б-Ж. Бимбаев // 85 лет здравоохранению г. Улан-Удэ: сб.ст. – Улан-Удэ, 2006. – С. 208.
- Клинические особенности формирования симптоматической артериальной гипертензии при хроническом гломерулонефрите у детей и подростков Республики Бурятия / Т.А. Баирова [и др.] // Современные технологии в педиатрии и детской хирургии: материалы V Рос. конгр., 24-26 окт., 2006. – М., 2006. - С. 159-160.
- О распространенности артериальной гипертензии среди сельских и городских детей школьного возраста в Республике Бурятия / Т.А. Баирова [и др.] // 85 лет здравоохранению г. Улан-Удэ: сб.ст. – Улан-Удэ, 2006. – С. 206-207.
- Распространенность артериальной гипертензии в зависимости от фазы полового развития у девочек 12-15 лет Республики Бурятия / Т.А.Баирова [и др.] // V Современные технологии в педиатрии и детской хирургии: Материалы V Рос. конгр., 24-26 окт. 2006 г. – М., 2006. - С. 79-80.
- Распространенность артериальной гипертензии у детей школьного возраста в Республике Бурятия / Т.А. Баирова [и др.] // Современные технологии в педиатрии и детской хирургии: материалы V Рос. конгр., 24-26 окт., 2006. – М., 2006. – С. 84.
- Генетический полиморфизм ангиотензинпревращающего фермента у подростков с эссенциальной артериальной гипертензией / Т.А.Баирова [и др.] // Рос. вестн. перинатологии и педиатрии. - 2007. – Т.52, №4. – С. 32-40.
- Баирова Т.А. Ген синтазы окиси азота и эссенциальная артериальная гипертензия / Т.А. Баирова, И.В. Тугутова, О.Ч. Хойкова // Актуальные проблемы педиатрии: материалы XI Конгр. педиатров России, 5-8 февр., 2007 г. – М., 2007. – С. 47.
- Баирова Т.А. Некоторые аспекты генетической детерминации циркадного ритма артериального давления / Т.А. Баирова, В.В. Долгих, И.И. Киселева // Актуальные проблемы педиатрии: материалы XI Конгр. педиатров России, 5-8 февр., 2007 г. – М., 2007. – С. 46.
- Баирова Т.А. Особенности липидного обмена у подростков Республики Бурятия / Т.А. Баирова, И.В. Тугутова, В.К. Булавко // Междунар. науч.-практ. конф. между АРВМ КНР и Республикой Бурятия: сб.ст. - Китай, Манчжурия, 2007. – С.222.
- Баирова Т.А. Роль гена ангиотензинпревращающего фермента в регуляции циркадного ритма артериального давления / Т.А. Баирова, В.В. Долгих, А.Б-Ж. Бимбаев // Междунар. науч.-практ. конф. между АРВМ КНР и Республикой Бурятия: сб.ст. – Китай, Манчжурия, 2007. – С. 223.
- Взаимосвязь VNTR полиморфизма гена эндотелиальной синтазы окиси азота и эссенциальной артериальной гипертензии в популяциях Восточной Сибири / Т.А. Баирова [и др.] // Бюл. ВСНЦ СО РАМН. – 2007. - №3. – С. 64-65.
- Долгих В.В. Значимость некоторых факторов риска в формировании артериальной гипертензии среди детей и подростков Республики Бурятия / В.В. Долгих, А.Б-Ж. Бимбаев, Т.А. Баирова // Актуальные проблемы педиатрии: материалы XI Конгр. педиатров России, 5-8 февр. 2007 г. – М., 2007. – С. 210-211.
- Метаболические нарушения у подростков, страдающих эссенциальной артериальной гипертензией / Т.А. Баирова [и др.] // Бюл. ВСНЦ СО РАМН. – 2007. - №5. – С. 90-91.
- Оценка риска эссенциальной и симптоматической артериальной гипертензии на фоне хронического гломерулонефрита у лиц – носителей инсерционно-делеционного полиморфизма ангиотензинпревращающего фермента / Т.А. Баирова [и др.] // Бюл. ВСНЦ СО РАМН. – 2007. - №3. – С. 65-66.
- Системная гипертензия при гломерулонефрите у детей разных этнических групп и ее взаимосвязь с полиморфными маркерами генов ренин-ангиотензин-альдостероновой системы / Т.А. Баирова [и др.] // Проблемы медико-демографического развития воспроизводства населения в России и регионах Сибири: материалы Всерос. науч.- практ. конф., 18-19 июня 2007 г. – Иркутск, 2007. – С. 104-110.
- Факторы риска артериальной гипертензии у школьников Республики Бурятия / Т.А. Баирова [и др.] // Проблемы медико-демографического развития воспроизводства населения в России и регионах Сибири: материалы Всерос. науч.-практ. конф., 18-19 июня 2007 г. – Иркутск, 2007. – С. 79-87.
- Эпидемиологические аспекты артериальной гипертензии среди детей и подростков в республике Бурятия / Т.А. Баирова [и др.] // Актуальные проблемы педиатрии: материалы XI Конгр. педиатров России, 5-8 февр. 2007 г. – М., 2007. – С. 211.
- Баирова Т.А. Риск реализации эссенциальной и симптоматической артериальной гипертензии на фоне хронического гломерулонефрита у лиц-носителей инсерционно-делеционного полиморфизма гена ангиотензинпревращающего фермента / Т.А. Баирова, Н.А. Шадрина, А.Б-Ж. Бимбаев // На страже здоровья детей: материалы науч. – практ. конф., 21 авг. 2008 г. – Улан-Удэ, 2008. – С. 6-7.
- Прогностический вклад факторов риска в формирование артериальной гипертензии у школьников республики Бурятия / Т.А. Баирова [и др.] // Профилактика сердечно-сосудистых заболеваний в первичном звене здравоохранения: материалы науч.- практ. конф. ВНОК. 25-26 марта 2008 г. – Новосибирск, 2008. – С. 36.
- Эссенциальная артериальная гипертензия и гены ренинангиотензиновой системы / Т.А. Баирова [и др.]. – Новосибирск: Наука, 2008. – 108 с.
- VNTR полиморфизм гена эндотелиальной синтазы окиси азота и его роль в реализации эссенциальной артериальной гипертензии в популяциях Восточной Сибири / Т.А. Баирова [и др.] // На страже здоровья детей: материалы науч. – практ. конф., 21 авг. 2008 г. – Улан-Удэ, 2008. – С. 9-10.
- Epidemiology of arteriai hypertension among teenage children in the Buryat Republic / T.A. Bairova [et al.] // The Bulletin of the Siberian branch of the Russian Academy of the Medical Sciences: Thesis of the 13th international congress on circumpolar health. – Novosibirsk, 2006. – P. 43-44.
- Polymorphism of angiotensin-converting enzyme gene and symptomatic arterial hypertension in the children of Republik Buryatia / T.A. Bairova [et al.] // The Bulletin of the Siberian branch of the Russian Academy of the Medical Sciences: Thesis of the 13th international congress on circumpolar health. – Novosibirsk, 2006. – P. 17-18.
Список сокращений
| 1 | АГ | артериальная гипертензия |
| 2 | АД | артериальное давление |
| 3 | АПФ | ангиотензинпревращающий фермент |
| 4 | ДАД | диастолическое артериальное давление |
| 5 | ДИ | доверительный интервал |
| 6 | ИА | индекс атерогенности |
| 7 | ИВ | индекс времени |
| 8 | ИМТ | избыточная масса тела |
| 9 | КВ | коэффициент вариабельности |
| 10 | КДР | конечный диастолической размер левого желудочка |
| 11 | ММЛЖ | масса миокарда левого желудочка |
| 12 | МОК | минутный объем кровообращения |
| 13 | НФА | низкая физическая активность |
| 14 | ОПСС | общее периферическое сосудистое сопротивление |
| 15 | ОТС | относительная толщина стенок левого желудочка |
| 16 | ОШ | отношение шансов |
| 17 | РАС | ренинангиотензиновая система |
| 18 | СМАД | суточное мониторирование артериального давления |
| 19 | ССЗ | сердечно-сосудистая заболеваемость |
| 20 | САД | систолическое артериальное давление |
| 21 | СИ | суточный индекс |
| 22 | ТГ | триглицериды |
| 23 | ТЗСЛЖ | толщина задней стенки левого желудочка |
| 24 | ТМЖП | толщина межжелудочковой перегородки |
| 25 | УО | ударный объем |
| 26 | УПСC | удельное периферическое cосудистое сопротивление |
| 27 | ФВ | фракция выброса |
| 28 | ХС | холестерин |
| 29 | ХС-ЛПВП | холестерин липопротеидов высокой плотности |
| 30 | ХС-ЛПНП | холестерин липопротеидов низкой плотности |
| 31 | ХС-ЛПОНП | холестерин липопротеидов очень низкой плотности |
| 32 | ЭАГ | эссенциальная артериальная гипертензия |
| 33 | АСЕ | ген ангиотензинпревращающего фермента |
| 34 | AGT | ген ангиотензиногена |
| 35 | i | инсерция |
| 36 | d | делеция |
| 37 | RR | релятивный риск |
| 38 | NO | оксид азота |
| 39 | eNOS | ген эндотелиальной синтазы окиси азота |
| 40 | VNTR | вариабельное число тандемных повторов |

