Методы малоинвазивного лечения заболеваний щитовидной и околощитовидных желез
На правах рукописи
Слепцов Илья Валерьевич
МЕТОДЫ МАЛОИНВАЗИВНОГО ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ
ЩИТОВИДНОЙ И ОКОЛОЩИТОВИДНЫХ ЖЕЛЕЗ
14.01.17 – хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург
2012
Работа выполнена на кафедре факультетской хирургии Медицинского факультета Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Санкт-Петербургский государственный университет» Правительства Российской Федерации
Научный консультант:
доктор медицинских наук профессор Бубнов Александр Николаевич
Официальные оппоненты:
Пищик Вадим Григорьевич — доктор медицинских наук, ФГБОУ ВПО «Санкт-Петербургский государственный университет» Правительства РФ, профессор кафедры госпитальной хирургии
Семенов Дмитрий Юрьевич — доктор медицинских наук профессор, ГБОУ ВПО «Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Министерства здравоохранения и социального развития РФ, заведующий кафедрой общей хирургии
Бельцевич Дмитрий Германович — доктор медицинских наук, ФГБУ «Эндокринологический научный центр» Министерства здравоохранения и социального развития РФ, главный научный сотрудник
Ведущая организация:
ГБОУ ВПО «Санкт-Петербургская педиатрическая медицинская академия» Министерства здравоохранения и социального развития РФ
Защита состоится « »____________ 20 г. в ______ часов на заседании диссертационного совета Д 212.232.60 на базе Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Санкт-Петербургский государственный университет» Правительства Российской Федерации по адресу: 199106, Санкт-Петербург, В.О., 21 линия, д. 8а, Медицинский факультет, актовый зал
С диссертацией можно ознакомиться в научной библиотеке им. М. Горького Санкт-Петербургского государственного университета (199034, Санкт-Петербург, Университетская набережная, д. 7/9)
Автореферат разослан «___»_________20 г.
Ученый секретарь диссертационного совета
кандидат медицинских наук доцент А.Н. Напалков
Общая характеристика работы
Актуальность проблемы
Малоинвазивные вмешательства (МИВ), предусматривающие использование высокотехнологичных методов лучевой и оптической визуализации патологических образований и применение эндоскопической техники, получают все более широкое распространение, как в нашей стране, так и за рубежом. Поскольку травматичность традиционного оперативного доступа при этих операциях нередко значительно превышает травматичность оперативного приема, преимущества использования миниинвазивного вмешательства для пациента бесспорны, и именно оно должно быть методом выбора [Cushieri A. et al., 1995]. Актуальность темы подчеркивается и высокой распространенностью заболеваний щитовидной и околощитовидных желез. Первичный гиперпаратиреоз является вторым по распространенности видом патологии эндокринных желез, требующим хирургического лечения. В результате планомерного определения уровня кальция в странах Западной Европы удалось выявить симптомы гиперпаратиреоза у 0,05-0,1% амбулаторных или стационарных больных [Heath H. et al., 1980; Niederle В. et al., 1992; Clark O.H., 1997]. До сих пор имеется ряд проблем, решение которых необходимо для повышения эффективности малоинвазивных вмешательств на щитовидной и околощитовидных железах. Для проведения видеоассистированных вмешательств предложено несколько операционных доступов, в то же время как детальные анатомо-хирургические обоснования для применения того или иного доступа проработаны недостаточно подробно. Кроме того, сохраняется реальная опасность повреждения неизмененных околощитовидных желез при проведении вмешательств, однако, методы, обеспечивающие надежную их визуализацию при проведении операции, отсутствуют. Для выполнения внутритканевых деструкций также используется несколько методик, но в литературе слабо представлены экспериментальные данные, касающиеся особенностей формирования очага поражения при использовании этих методов, и полностью отсутствуют работы по сравнительному изучению результатов их клинического применения и обоснованию у тех или иных пациентов.
Перечисленные проблемы послужили основанием для проведения данного исследования.
Цель исследования
Улучшение результатов лечения пациентов с объемными образованиями щитовидной и околощитовидных желез путем повышения его эффективности за счет разработки новых и усовершенствования существующих методов малоинвазивных вмешательств и определения показаний к использованию каждого из них.
Для выполнения указанной цели были поставлены следующие основные задачи:
1. Провести сравнительное изучение в эксперименте различных методов внутритканевой деструкции ткани щитовидной железы и определить особенности формирования очага поражения при использовании этаноловой склеротерапии, лазериндуцированной интерстициальной термотерапии и радиочастотной аблации.
2. Провести сравнительную оценку использования указанных методов у больных с различными типами узлов щитовидной железы и определить показания для применения каждого из них.
3. Разработать, исследовать в эксперименте и применить в клинической практике комбинированные методы внутритканевой деструкции, оценить их эффективность и безопасность, сформулировать показания к использованию.
4. На основании эксперимента дать анатомо-хирургическое обоснование и предложить оптимальную методику выполнения видеоассистированных малоинвазивных оперативных вмешательств на щитовидной железе.
5. Провести клиническое изучение видеоассистированных вмешательств в репрезентативных группах больных и сравнить их результаты с таковыми после применения традиционного оперативного вмешательства.
6. Усовершенствовать методику выполнения малоинвазивных операций у пациентов с первичным гиперпаратиреозом, оценить их эффективность и безопасность, разработать показания к применению хирургических операций различного объема у пациентов данной группы.
7. Разработать методику интраоперационного мониторинга паратгормона с помощью иммунноферментного анализа плазмы крови пациента.
8. Разработать методику интраоперационной фотодинамической визуализации околощитовидных желез.
Научная новизна
Впервые описаны морфологические характеристики очага поражения и представлены особенности зоны поражения при радиочастотной аблации ткани щитовидной железы.
Впервые получены данные об особенностях воздействия различных режимов переменного электромагнитного поля на ткань щитовидной железы и описаны особенности сонографической картины при проведении радиочастотной аблации узлов щитовидной железы.
Впервые показано отсутствие малигнизации коллоидных узлов щитовидной железы после проведения их этаноловой склеротерапии при длительных сроках наблюдения пациентов.
Показана эффективность комбинированных методик внутритканевой деструкции узлов щитовидной железы, сочетающих лазериндуцированную термотерапию и этаноловую склеротерапию, радиочастотную аблацию и этаноловую склеротерапию.
В ходе анатомического эксперимента анатомически обоснован выбор оптимального операционного доступа для проведения видеоассистированных операций на щитовидной железе при узловых образованиях различной локализации и размера.
Показана возможность интраоперационного мониторинга уровня паратгормона путем определения изменения оптической плотности или флюоресценции раствора, содержащего плазму крови пациента и реагенты для иммуноферментного анализа.
Разработана методика интраоперационной фотодинамической визуализации околощитовидных желез с использованием 5-аминолевулиновой кислоты и показаны ее эффективность и безопасность.
Практическая значимость
Разработаны методики этаноловой склеротерапии кистозно-трансформированных узлов щитовидной железы повторными инстилляциями этанола и солидных узлов щитовидной железы с многократным смещением пункционной иглы, в том числе с использованием иглы оригинальной конструкции.
Разработана и предложена для клинического применения методика проведения лазериндуцированной интерстициальной термотерапии доброкачественных узлов щитовидной железы, определены оптимальные режимы воздействия (тип используемого лазера, мощность, длительность воздействия, диаметр световода).
Разработана и предложена для клинического применения методика проведения радиочастотной аблации доброкачественных узлов щитовидной железы, определены оптимальные режимы воздействия переменного электромагнитного поля.
Установлены критерии контроля за ходом проведения радиочастотной аблации доброкачественных узлов щитовидной железы с помощью ультразвуковой сонографии.
Предложены для клинического использования комбинированные методики внутритканевой деструкции узлов щитовидной железы с использованием лазериндуцированной интерстициальной термотерапии, этаноловой склеротерапии и радиочастотной аблации
Положения, выносимые на защиту
1. Зоны деструкции ткани щитовидной железы при использовании различных методик отличаются следующими особенностями: введение 95% этанола в ткань железы вызывает образование очага некроза без четких границ, отличающегося наличием участков сохранившей жизнеспособность ткани среди некротизированных зон; воздействие лазерного излучения в контактном режиме приводит к возникновению очага поражения, четко отграниченного от здоровой ткани железы, имеющего зональное строение и полость в центральных отделах; воздействие переменного электромагнитного поля на ткань щитовидной железы приводит к возникновению гомогенного очага поражения, имеющего четкие морфологические границы.
2. Этаноловая склеротерапия позволяет в подавляющем большинстве случаев устранить симптомы сдавления, связанные с наличием у пациента кистозно-трансформированного или солидного узла коллоидного строения. Лазериндуцированная интерстициальная термотерапия позволяет подавлять функциональную активность автономно функционирующих узлов размером до 3 см, тогда как радиочастотная аблация является эффективным методом подавления активности автономно функционирующих узлов размером более 3 см.
3. Комбинация различных видов внутритканевой деструкции (лазериндуцированная интерстициальная термотерапия и этаноловая склеротерапия, радиочастотная аблация и этаноловая склеротерапия) позволяет повысить эффективность процедуры и улучшить результаты лечения больного.
4. Результаты анатомического эксперимента и клинических исследований свидетельствуют, что оптимальным для выполнения видеоассистированных малоинвазивных оперативных вмешательств является доступ по белой линии шеи, позволяющий оперировать на всех отделах щитовидной железы, обеспечивающий минимальную травматичность и адекватные параметры оперативного доступа.
5. Сравнительное изучение непосредственных и ближайших (до 3-х лет) результатов традиционных и малоинвазивных оперативных вмешательств свидетельствует, что малоинвазивные вмешательства имеют определенные преимущества, выражающиеся в снижении уровня послеоперационной боли, укорочении сроков госпитализации больных и лучшем косметическом результате. Выполнение малоинвазивных вмешательств не снижает радикализма оперативного вмешательства и не увеличивает количества осложнений.
6. Односторонняя ревизия шеи и селективная паратиреоидэктомия являются методами выбора при лечении пациентов с установленной до операции локализацией аденомы околощитовидной железы. Двусторонняя ревизия шеи показана у пациентов, имеющих дискордантные результаты ультразвукового исследования и сцинтиграфии околощитовидных желез, а также у пациентов с подозрением на полигландулярное поражение ОЩЖ.
7. Использование фотодинамической визуализации околощитовидных желез и модифицированного интраоперационного исследования динамики уровня паратгормона крови позволяет проводить эффективное и безопасное малоинвазивное удаление аденом этих желез при первичном гиперпаратиреозе.
Апробация работы
Результаты работы доложены на XI(XIII) Российском симпозиуме с международным участием по хирургической эндокринологии (Санкт-Петербург, 2003 г.); ассоциации эндокринологов Санкт-Петербурга (2003 г.); на научной конференции, посвященной 75-летию проф. Симбирцева С.А. (Санкт-Петербург, 2004 г.), на 3-ем Всероссийском тиреологическом конгрессе «Диагностика и лечение узлового зоба» (Москва, 2004 г.), на I Съезде амбулаторных хирургов России (Санкт-Петербург, 2004 г.), на 13-м Международном тиреологическом конгрессе (г. Буэнос-Айрес, Аргентина, 2005 г.), на конференции «Современные диагностические и лечебные технологии в многопрофильной клинике» (Санкт-Петербург, 2006 г.), на II съезде амбулаторных хирургов РФ (Санкт-Петербург, 2007 г.), на XVI Российском симпозиуме по хирургической эндокринологии «Современные аспекты хирургической эндокринологии» (Саранск, 2007 г.); на IV Всероссийском тиреоидологическом конгрессе (Москва, 2007 г.), на международном научном симпозиуме «Малоинвазивные технологии в эндокринной хирургии» (Санкт-Петербург, 2008 г.), на научно-практической конференции «Новые оперативные технологии. Анатомические, экспериментальные и клинические аспекты» (Томск, 2008 г.), на заседании Хирургического общества Н.И. Пирогова (Санкт-Петербург, 2008 г.), ассоциации эндокринологов Санкт-Петербурга (Санкт-Петербург, 2008 г.), на симпозиуме Европейской ассоциации эндокринных хирургов (г. Лунд, Швеция, 2009 г.), на научной конференции с международным участием «Человек и его здоровье» (Санкт-Петербург, 2009 г.), на Российской научно-практической конференции, посвященной 110-летию со дня рождения академика Н.С. Молчанова «Актуальные вопросы пульмонологии, кардиологии и эндокринологии» (Санкт-Петербург, 2009 г.), на международном научном форуме «Рак щитовидной железы: современные принципы диагностики и лечения» (Санкт-Петербург, 2009 г.), на конгрессе Европейской тиреологической ассоциации (Лиссабон, Португалия, 2009 г.), на международном научном форуме «Патология околощитовидных желез: современные принципы диагностики и лечения» (Санкт-Петербург, 2009 г.), на Всероссийском конгрессе «Современные технологии в эндокринологии (тиреоидология, нейроэндокринология, эндокринная хирургия)» (Москва, 2009 г.), на заседании Хирургического общества Н.И. Пирогова (Санкт-Петербург, 2010 г.), на 14-м Международном тиреологическом конгрессе (г. Париж, Франция, 2010 г.), на Всероссийском форуме "Пироговская хирургическая неделя" (Санкт-Петербург, 2010 г.), на XVIII ежегодном нефрологическом семинаре "Белые ночи" (Санкт-Петербург, 2011 г.).
Внедрение результатов работы
Результаты диссертационного исследования внедрены в лечебную практику Санкт-Петербургского клинического комплекса ФГБУ «Национальный медико-хирургический центр им. Н.И. Пирогова» и используются в учебном процессе на кафедре оперативной хирургии и топографической анатомии Государственного бюджетного образовательного учреждения высшего профессионального образования «Северо-Западный государственный медицинский университет им. И.И. Мечникова» и кафедре факультетской хирургии Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Санкт-Петербургский государственный университет им. акад. И.П. Павлова» Правительства Российской Федерации.
Публикации
По теме исследования опубликовано 79 научных работ, из них 10 – в журналах, рекомендованных перечнем ВАК, 12 патентов РФ, 1 монография.
Структура диссертации
Диссертация состоит из введения, обзора литературы, 6 глав собственных исследований, заключения, выводов, практических рекомендаций и списка литературы, содержащего 317 литературных источников, из них – 48 отечественных и 269 зарубежных источников, изложена на 300 стр., иллюстрирована 77 таблицами, 138 рисунками.
Личный вклад автора в проведенное исследование.
Автор участвовал в планировании исследования, проведении анатомического эксперимента, эксперимента на лабораторных животных, в лечении большинства пациентов, включенных в исследование, статистической обработке полученного материала и научном анализе данных.
ОБЪЕКТ, МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Диссертационное исследование состоит из двух разделов – экспери-ментального, состоящего из анатомического эксперимента на изолированной ткани ЩЖ с узлами, анатомического эксперимента на трупах, эксперимента на лабораторных животных и интраоперационного эксперимента, и клинической части.
Анатомический эксперимент проводился на 30 препаратах удаленных щитовидных желез и 30 трупах. В эксперименте на животных были использованы 120 кроликов и 20 крыс линии «Вистар». Интраоперационное воздействие различных способов внутритканевой деструкции на ткань коллоидных узлов щитовидной железы было проведено в группе из 15 пациентов во время оперативного вмешательства, непосредственно перед удалением коллоидного узла ЩЖ.
Клиническая часть исследования выполнена на основании изучения результатов лечения 1240 пациентов, проводившегося на базе Санкт-Петербургского клинического комплекса ФГБУ «Национальный медико-хирургический Центр им. Н.И. Пирогова» (до 2011 г. – ФГУ «Северо-Западный окружной медицинский центр Росздрава») в 2006-2011 гг. Распределение больных по использованным лечебным методам представлено в таблице 1.
Таблица 1
Распределение больных по использованному методу лечения
| Метод лечения | Количество больных |
| Этаноловая склеротерапия | 322 |
| Лазериндуцированная термотерапия | 37 |
| Радиочастотная аблация | 64 |
| Комбинированные виды деструкции | 25 |
| Видеоассистированная гемитиреоидэктомия | 178 |
| Традиционная гемитиреоидэктомия | 178 |
| Видеоассистированная тиреоидэктомия | 44 |
| Операции на околощитовидных железах | 297 |
| Операции с использованием фотодинамической визуализации околощитовидных желез | 95 |
При выполнении клинического этапа исследования применялись:
- физикальное обследование;
- лабораторное исследование;
- УЗИ шеи с цветным и энергетическим допплеровским картированием;
- ТАБ узлов ЩЖ;
- сцинтиграфия ЩЖ;
- субтракционная двухизотопная сцинтиграфия ОЩЖ;
- эндоскопическая ларингоскопия с видеозаписью процедуры;
- анкетирование пациентов для выявления уровня послеоперационной боли с использованием модифицированной визуально-аналоговой шкалы и болевого опросника Мак-Гилла;
- анкетирование пациентов для выявления степени удовлетворенности косметическим результатом операции с использованием модифицированной визуально-аналоговой шкалы.
Статистическую обработку всех результатов исследований проводили с помощью программ “Microsoft-Excel” для Windows, Statistica 2007, количественные показатели были представлены в виде «Box & Whisker Plot». Критерием статистической достоверности получаемых результатов считали величину p0,01, используя t-критерий (Стьюдента), U-критерий (Манна-Уитни), точный критерий Фишера, критерий Хи-квадрат, критерий Kruskal-Wallis и r-критерий (ранговая корреляция Спирмена). Также для установления зависимости между отдельными показателями был проведен простой корреляционный анализ.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Экспериментальное изучение характера поражения ткани ЩЖ при использовании различных методов внутритканевой деструкции
Изучение характера поражения во время анатомического эксперимента на изолированной ткани ЩЖ показало, что очаг поражения при воздействии этанола характеризуется сохранением участков жизнеспособной ткани ЩЖ в зоне распространения этанола; очаг поражения при ЛИТТ имеет зональное строение с формированием зоны полного тканевого дефекта и выраженной карбонизацией ее границ; основным отличием очага поражения при РЧА является гомогенное строение зоны поражения без формирования полостей, карбонизации, с полной гибелью всех клеток в зоне воздействия. Процесс заживления очага поражения при использовании всех методов сопровождается уменьшением объема тиреоидной ткани; этот процесс наименее выражен при заживлении очага поражения при ЛИТТ, более значителен при заживлении очага поражения после воздействия этанола, наиболее выражен при заживлении очага поражения после РЧА.
При проведении анатомического эксперимента были выяснено, что при лазерном воздействии на ткань щитовидной железы невозможно получение очага некроза диаметром более 15 мм, при этом в центре зоны поражения формировался тканевой дефект и карбонизация, поэтому требовалось использовать излучение низкой мощности с целью профилактики травматизации окружающих органов и тканей. Жизнеспособные тироциты в зоне воздействия не встречались.
Введение этанола приводило к формированию зоны некроза ткани узла ЩЖ, не имевшей четких контуров. В ряде случаев, при достижении склерозантом капсулы узла, граница зоны некроза становилась четко очерченной. На всем протяжении зоны некроза встречались фолликулы с жизнеспособными тироцитами.
При использовании радиочастотной аблации отмечали формирование очага гомогенного некроза ткани ЩЖ с сохраненной гистоархитектоникой, без формирования дефектов ткани и карбонизации. Очаг некроза имеет округлую форму. Размеры очага некроза на 5 мм превышают размеры зоны раскрытия проводников электрода, т.е. могут достигать 55 мм. Редукция объема ткани ЩЖ при заживлении дефекта выражена значительно, степень редукции превышает таковую при действии этанола и лазерного излучения.
Эффективность клинического применения
различных методов внутритканевой деструкции
Лечение пациентов с кистозно-трансформированными узлами ЩЖ
В ходе исследования сравнивали три различных методики ЭС кистозно-трансформированных узлов (в группах по 50 пациентов): 1). аспирация кистозного содержимого, введение в просвет кисты 95% этанола в объеме, равном 30% от объема жидкости, оставление этанола в просвете кисты; 2). аспирация кистозного содержимого, введение в просвет кисты 95% этанола в объеме, равном 30% от объема эвакуированной жидкости, экспозиция 1 минута, эвакуация остатков этанола; 3). оригинальная методика с повторным промыванием полости кисты этанолом. Оценка результатов лечения проводилась через 6 месяцев.
Таблица 2
Эффективность различных режимов проведения этаноловой склеротерапии
| Параметры оценки | Методы склеротерапии | Всего | ||
| 1 | 2 | 3 | ||
| Исчезновение жалоб | 34 (68%) | 37 (74%) | 48 (96%) | 119 (79,3%) |
| Уменьшение объема на 50% | 29 (58%) | 32 (64%) | 46 (92%) | 107 (71,3%) |
| Облитерация полости кисты | 26 (52%) | 32 (64%) | 44 (88%) | 102 (68%) |
Предлагаемый метод склеротерапии кистозно-трансформированных узлов с повторными промываниями кистозной полости этанолом оказался наиболее эффективным и позволяет повысить эффективность лечения пациентов с данным видом патологии ЩЖ. На данный метод склеротерапии подана заявка на изобретение («Способ этаноловой склеротерапии кистозно-трансформированных узлов щитовитной железы», заявка №2010121903, положительное решение от 27.10.2011).
Результаты использования методов деструкции солидных узлов ЩЖ
При лечении пациентов с данным типом узлов ЩЖ проводилось сравнение ЭС, а также ЛИТТ и РЧА. При анализе результатов четко прослеживается тенденция к сокращению числа жалоб пациентов после лечения (таблица 3).
Таблица 3
Характер жалоб пациентов до и после лечения внутритканевой деструкцией
| Жалоба | Частота | |||||
| ЭС 2 | ЛИТТ | РЧА | ||||
| До | После | До | После | До | После | |
| Ощущение инородного тела | 94 (71,2%) | 27 (20,5%) | 31 (83,8%) | 16 (43,2%) | 64 (100%) | 17 (26,6%) |
| Косметический дефект | 90 (68,2%) | 14 (10,6%) | 30 (81,1%) | 14 (37,8%) | 58 (90,6%) | 13 (20,3%) |
| Всего пациентов | 132 (100%) | 37 (100%) | 64 (100%) | |||
Динамика уменьшения объема узлов после проведения внутритканевой деструкции приведена в таблице 4.
Таблица 4
Динамика уменьшения объема узлов после применения деструкции
| Параметр | Методы деструкции | |||||
| ЭС 2 | ЛИТТ | РЧА | ||||
| До | После | До | После | До | После | |
| Средний объем узлов, мл | 12,1 | 5,3 | 6,5 | 4,8 | 14,7 | 6,3 |
Применение деструкции при автономно функционирующих узлов ЩЖ
При проведении деструкции АФУ наибольшее значение придавалось изучению динамики уровня тиреоидных гормонов и ТТГ, а также динамике сцинтиграфической картины.
Таблица 5
Тиреоидный статус пациентов с солидными узлами щитовидной железы,
перенесших внутритканевую деструкцию узлов
| Статус | До лечения | 2 мес | 6 мес | 24 мес | Всего | |
| ЭС | Эутиреоз | 127 (73,8%) | 161 (93,6%) | 154 (89,5%) | 151 (87,8%) | 172 (100%) |
| Гипотиреоз | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | ||
| Гипертиреоз | 45 (26,2%) | 11 (6,4%) | 18 (10,5%) | 21 (12,2%) | ||
| ЛИТТ | Эутиреоз | 21 (56,8%) | 30 (81,1%) | 30 (81,1%) | 29 (78,4%) | 37 (100%) |
| Гипотиреоз | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | ||
| Гипертиреоз | 16 (43,2%) | 7 (18,9%) | 7 (18,9%) | 8 (21,6%) | ||
| РЧА | Эутиреоз | 13 (20,3%) | 55 (85,9%) | 56 (87,5%) | 55 (85,9%) | 64 (100%) |
| Гипотиреоз | 0 (0%) | 0 (0%) | 0 (0%) | 1 (1,6%) | ||
| Гипертиреоз | 51 (79,7%) | 9 (14,0%) | 8 (12,5%) | 8 (12,5%) |
У части пациентов, достигших эутиреоидного состояния через 1 год после использования ЭС, при оценке отдаленных результатов был зафиксирован поздний рецидив тиреотоксикоза (таблица 6).
Таблица 6
Отдаленные результаты применения склеротерапии у пациентов с АФУ ЩЖ
| До лечения | 1 год | 2 года | 3 года | 5 лет | |
| Количество пациентов в состоянии тиреотоксикоза | 45 | 18 | 21 | 23 | 25 |
Наиболее вероятной причиной поздних рецидивов тиреотоксикоза является гиперплазия сохранивших жизнеспособность участков ткани АФУ.
В группу пациентов, получивших РЧА, вошли только пациенты, имевшие АФУ размером 3 см и больше. У подавляющего большинства этих пациентов имелись токсические аденомы ЩЖ, вызывавшие манифестный тиреотоксикоз. Результаты применения радиочастотной аблации приведены в таблице 7.
Таблица 7
Изменение тиреоидного статуса пациентов с АФУ после проведения РЧА
| До лечения | 2 месяца | 6 месяцев | 2 года | |
| Манифестный тиреотоксикоз | 40 (78%) | 4 (8%) | 5 (10%) | 6 (12%) |
| Субклинический тиреотоксикоз | 11 (22%) | 5 (10%) | 3 (6%) | 2 (4%) |
| Эутиреоз | 0 (0%) | 42 (82%) | 43 (84%) | 43 (84%) |
Динамика изменения размеров АФУ ЩЖ после проведения внутритканевой деструкции приведена в таблице 8.
Таблица 8
Динамика изменения объема АФУ после применения деструкции
| Параметр | Методы деструкции | |||||
| ЭС 2 | ЛИТТ | РЧА | ||||
| До | После | До | После | До | После | |
| Средний объем узлов, мл | 3,27±3,15 | 1,25±1,01 | 5,75±1,23 | 4,4±1,34 | 11,6±10,2 | 8,4±5,3 |
При выполнении этаноловой склеротерапии АФУ ЩЖ полное подавление функции узла отмечалось по данным сцинтиграфии в 57% случаев, в 34% случаев отмечалось снижение накопления радиофармпрепарата в узле, в 9% случаев эффекта от ЭС при сцинтиграфии отмечено не было. При выполнении ЛИТТ узлов полное подавление функции узла отмечалось у 24% пациентов, в 47% случаев отмечался частичный эффект, отсутствие эффекта было выявлено в 29% случаев. После выполнения РЧА полное подавление функции АФУ отмечалось в 64% случаев, в 24% случаев накопление изотопа в узле снижалось, в 12% случаев подавить функцию узла не удалось.
Комбинированные методы деструкции узлов щитовидной железы
Комбинированное использование этаноловой склеротерапии и ЛИТТ
Метод применен у 5 пациентов с узлами размером от 4 до 5 см. Первым этапом лечения использовалась этаноловая склеротерапия, проведенная с использованием методики с повторными промываниями кистозной полости этанолом. Пациентам проведено по 3 сеанса этаноловой склеротерапии. Симптомы компрессии органов шеи у 3 из 5 пациентов купировались, однако при исследовании крови у всех пациентов отмечалось сохранение субклинического тиреотоксикоза, в связи с чем им проводился курс ЛИТТ солидного компонента узла. Контрольное обследование, проведенное через 2 месяца после проведения ЛИТТ, показало нормализацию уровня ТТГ у 3 из 5 пациентов. У 2 пациентов уровень ТТГ повысился, но не нормализовался, в связи с чем пациентам проводилась этаноловая склеротерапия периферических участков солидного компонента узла, ориентируясь на данные, полученные при допплеровском исследовании. Исследование уровня тиреоидных гормонов и ТТГ показало их нормализацию через 2 месяца после проведения ЭС. Всем пациентам через 6 месяцев после начала лечения выполнялась повторная сцинтиграфия ЩЖ с технецием, при которой было выявлено полное подавление функции узла у 3 пациентов, значительное снижение функции узла с восстановлением функции нормальной ткани ЩЖ у 2 пациентов. Все пациенты хорошо перенесли лечение, осложнений внутритканевой деструкции не отмечено.
Комбинированное использование ЛИТТ и этаноловой склеротерапии
У 10 пациентов с солидными АФУ ЩЖ размером от 3 до 4 см была применена комбинированная деструкция с использованием ЛИТТ и ЭС. Комбинированную деструкцию узла осуществляли одномоментно. Первым этапом деструкции было разрушение центральных отделов узла с использованием ЛИТТ, при этом расположение очагов деструкции планировали таким образом, чтобы вдоль капсулы узла сохранялась жизнеспособная ткань шириной не менее 5 мм. Вторым этапом вводили 95% этанол в периферические отделы узла.
При проведении контрольной сцинтиграфии ЩЖ с технецием через 6 месяцев после лечения у большинства пациентов отмечали подавление функции узла и восстановление функции ткани ЩЖ (таблица 9).
Таблица 9
Функциональная активность узлов ЩЖ после комбинированной деструкции
| Функция узла | До лечения | 6 мес | Всего |
| Токсическая аденома | 10 | 0 | 10 |
| Пректоксич. аденома | 0 | 2 | |
| Отсутствие функции | 0 | 8 |
Комбинированное использование РЧА и этаноловой склеротерапии
У 10 пациентов с солидными АФУ ЩЖ размером от 4 до 6 см была применена деструкция с использованием РЧА и ЭС. Первым этапом деструкции было разрушение центральных отделов узла с использованием РЧА, при этом расположение зоны деструкции планировали таким образом, чтобы вдоль капсулы узла сохранялась жизнеспособная ткань шириной не менее 5 мм. В тех зонах, где узловое образование непосредственно примыкало к трахее и зоне прохождения возвратного гортанного нерва, сохраняли до 1 см жизнеспособной ткани. После завершения этапа РЧА извлекали электрод из узла и проводили этаноловую склеротерапию периферических отделов узла, вводя этанол в участки узла вблизи его капсулы. Осложнений при проведении комбинированной деструкции АФУ с использованием РЧА и ЭС не отмечали.
При контроле уровня ТТГ, Т4 св., Т3 св. через 2 месяца у 8 из 10 пациентов была отмечена нормализация уровня ТТГ и тиреоидных гормонов. В 2 случаях у пациентов сохранялся субклинический тиреотоксикоз, поэтому на сроке 4 месяца после лечения указанным пациентам была проведена повторная РЧА узла с введением этанола. При контроле тиреоидного статуса через 2 месяца у данных пациентов отмечена нормализация тиреоидного статуса.
При проведении контрольной сцинтиграфии ЩЖ с технецием через 6 месяцев после лечения у большинства пациентов отмечали подавление функции узла и восстановление функции ткани ЩЖ (таблица 10).
Таблица 10
Функциональная активность узлов ЩЖ по данным сцинтиграфии
после проведения комбинированной деструкции
| Функция узла | До лечения | 6 мес | Всего |
| Токсическая аденома | 10 | 0 | 10 |
| Пректоксич. аденома | 0 | 1 | |
| Отсутствие функции | 0 | 9 |
Анатомо-хирургическое обоснование методики выполнения
видеоассистированных малоинвазивных оперативных вмешательств
на щитовидной и околощитовидных железах
Исследование проведено на 40 трупах (20 мужских, 20 женских) пациентов, умерших от заболеваний, не связанных с патологией щитовидной железы. Проводили описание следующих операционных доступов к щитовидной железе: подмышечного по Takami H.E., Ikeda Y. (для полностью эндоскопического доступа, с инсуффляцией газа, с введением эндоскопа и двух инструментов через отдельные разрезы кожи); переднего грудного по Takami H.E., Ikeda Y. (для полностью эндоскопического доступа, с инсуффляцией газа, с введением эндоскопа и двух инструментов через отдельные разрезы кожи); бокового шейного доступа по Huscher C.S. et al. (для полностью эндоскопического доступа, с инсуффляцией газа, с введением эндоскопа и двух инструментов через отдельные разрезы кожи); срединного шейного по Miccoli P. (для видеоассистированного доступа, с ретракцией мышц без использования газа, c одним разрезом для проведения всех инструментов и эндоскопа).
Результаты исследования показали, что задачам, поставленным при проведении анатомического эксперимента, в максимальной степени отвечает срединный шейный доступ. При использовании данного доступа сохраняется возможность оперирования на обеих долях ЩЖ, обеспечивается минимальная травматизация (рассечение тканей проводится по белой линии шеи) и минимальный контакт с жизненно важными образованиями (доступ осуществляется вне зоны прохождения крупных сосудов и нервов), а также оптимальные условия для осмотра важных для проведения операции образований, достаточные для удобной работы глубина раны, эндохирургический угол операционного действия и зона доступности. После извлечения ЩЖ из кожной раны доступ обеспечивает оптимальный классический угол операционного действия. Площадь апертуры раны при этом достаточна для введения инструментов (эндоскопа, двух рабочих инструментов – распатора, ультразвукового гармонического скальпеля).
Результаты клинического применения видеоассистированных
оперативных вмешательств при заболеваниях ЩЖ
Использование видеоассистированной гемитиреоидэктомии при лечении пациентов с фолликулярными опухолями ЩЖ
При изучении результатов применения различных типов резекции ЩЖ (видеоассистированной, традиционной) 356 пациентов с фолликулярными опухолями ЩЖ были разделены на группы по 178 пациентов.
Сравнение длительности оперативного вмешательства при выполнении МИВАГ и традиционной гемитиреоидэктомии производилось по итогам работы в 2010 году, результаты представлены в таблице 11.
Таблица 11
Длительность операций в группах сравнения
| МИВАГ | Трад. операция | Стат. различия | |||
| Время операции, мин | год | время | год | время | p0,01, t =2,8 |
| 2010 | 52,2 ± 13,9 | 2010 | 45,6 ± 12,9 | ||
Результаты самооценки интенсивности боли в послеоперационном периоде, проведенной пациентами на основе визуально-аналоговой шкалы через 24 часа после операции, представлены в таблице 12. При сравнении интенсивности послеоперационных болевых ощущений между группами были получены следующие результаты: происходит снижение уровня боли как в группе МИВАГ (r=0,21, p=0,01), так и в группе традиционных операций (r=0,8, p=0,01); уровень боли статистически достоверно ниже при использовании МИВАГ — как через 24 часа (r1=0,59, p=0,01), так и через 48 часов (r2=0,49, p=0,01).
Таблица 12
Интенсивность послеоперационной боли через 24 часа после операции
| Болевые ощущения | МИВАГ | Традиционная операция |
| Отсутствие боли | 24 (13%) | 0 |
| Очень слабая боль | 117 (66%) | 15 (9%) |
| Слабая боль | 34 (19%) | 120 (68%) |
| Умеренная боль | 3 (2%) | 38 (21%) |
| Сильная боль | 0 | 5 (2%) |
| Невыносимая боль | 0 | 0 |
| Всего: | 178 (100 %) | 178 (100%) |
В обеих группах не требовалось введение наркотических анальгетиков. Из данных, приведенных в таблице 13, видно, что количество (в миллилитрах) вводимого в послеоперационном периоде кеторола достоверно меньше в группе пациентов, перенесших МИВАГ (p0,01).
Таблица 13
Объем использованного для обезболивания кеторола в группах сравнения
| МИВАГ | Традиционная операция | |
| Количество вводимого кеторола, мл | 2,3 ± 1,7 | 3,8 ± 1,9 |
Таблица 14
Характер и частота послеоперационенных осложнений в группах сравнения
| Параметры сравнения | МИВАГ | Традиционная операция |
| Парез возвратного нерва транзиторный | 2 (1,1 %) | 2 (1,1%) |
| Парез возвратного нерва постоянный | 0 | 0 |
| Послеоперационная гематома | 2 (1,1 %) | 3 (1,6 %) |
| Нагноение послеоперационной раны | 0 | 0 |
| Всего операций | 178 | 178 |
Результаты данного раздела исследования свидетельствуют, что МИВАГ не ведет к увеличению количества послеоперационных осложнений и не является более опасным, по сравнению с традиционным, вмешательством.
Объем интраоперационной кровопотери был изучен у 25 пациентов из каждой группы. Использовался гравиметрический метод оценки кровопотери. Средний объем кровопотери в группе исследования составляет 16 ± 8,6 мл, в группе контроля — 37,7 ± 11,4 мл (различия статистически достоверны).
Для сравнительной оценки радикальности проведения гемитиреоидэктомии всем пациентам в послеоперационном периоде было выполнено УЗИ шеи. Результаты данной части исследования представлены в таблице 15.
Таблица 15
Локализация остаточной ткани ЩЖ при контрольном УЗИ
| Локализация остаточной тиреоидной ткани | МИВАГ (n=178) | Традиционная операция (n=178) |
| Область верхнего полюса, n (%) | 3 (1,7%) | 6 (3,4%) |
| Трахеопищеводная борозда, n (%) | 2 (1,1%) | 1 (0,56%) |
| Область нижнего полюса, n (%) | 0 (0%) | 1 (0,56%) |
| Всего | 5 (2,8%) | 8 (4,5%) |
Таким образом, радикальность удаления ткани ЩЖ значимо не отличается при использовании МИВАГ и традиционной методики оперирования.
Данные о частоте применения дренажей представлены в таблице 16.
Таблица 16
Дренирование послеоперационной раны в группах сравнения
| МИВАГ | Традиционная операция | Стат. различия | |||
| Коли-чество дренажей | 2008 | 26 из 46 (56,6%) | 2008 | 28 из 28 (100%) | — |
| 2009 | 27 из 58 (46,5%) | 2009 | 47 из 58 (81%) | — | |
| 2010 | 6 из 74 (8,1%) | 2010 | 41 из 92 (44,5%) | — | |
| Всего: | 59 из 178 (33%) | 116 из 178 (65%) | p0,01, U*=0 | ||
*U — критерий Манна-Уитни
Через 1 год после операции всем пациентам было произведено измерение длины послеоперационного рубца. Различия в длине рубца между группами было статистически достоверным (t=8,1, р=0,01). Средний размер послеоперационного рубца в группе МИВАГ составил 20,2 ± 6,2 см, в группе традиционных операций — 40,7 ± 11,6 см.
Через 1 и 2 года после операции были проанализированы косметические характеристики послеоперационного рубца. При сравнении результатов по Манчестерской шкале (Manchester scar scale), полученных у пациентов через 1 год после оперативного вмешательства, статистически значимых различий обнаружено не было (t=0,6, p=0,01), однако при сравнении результатов на сроке в 2 года после операции, статистически значимое различие в качестве послеоперационного рубца в пользу МИВАГ было зарегистрировано (t=2,9, p=0,01).
В ходе исследования оценивалась также и субъективная удовлетворенность пациентов косметическим результатом операции с использованием визуально-аналоговой шкалы. Было произведено анкетирование 232 пациентов через 1 год после операции. Результаты представлены в таблице 17.
Таблица 17
Уровень удовлетворенности пациентов косметическим результатом операции
| МИВАГ | Традиционные операции | |
| «Отлично» | 74 (64%) | 58 (50%) |
| «Хорошо» | 30 (26%) | 44 (38%) |
| «Удовлетворительно» | 12 (10%) | 14 (12%) |
| Всего пациентов: | 116 (100%) | 116 (100%) |
Как отличный оценивают результат операции 74 (64%) пациента в группе МИВАГ и 58 (50%) пациентов в группе традиционной гемитиреоидэктомии.
В ходе анкетирования пациентов также просили оценить свое самочувствие и результат операции. Результаты опроса приведены в таблице 18. Как видно из полученных ответов, большинство опрошенных пациентов в группах наблюдения на момент опроса считало себя здоровыми и оценивало самочувствия как «отличное» и «хорошее».
Анализ результатов данного опроса позволил установить достоверно большее число оценок «отлично» и «хорошо» в группе МИВАГ как относительно самочувствия после операции, так и относительно оценки общего результата оперативного лечения.
Таблица 18
Субъективная оценка самочувствия и общего результата операции
| МИВАГ | Традиционные операции | |||
| Самочувствие | Результат | Самочувствие | Результат | |
| «Отлично» | 37 (32%) | 82 (71%) | 15 (13%) | 54 (47%) |
| «Хорошо» | 62 (53%) | 34 (29%) | 80 (69%) | 62 (53%) |
| «Удовлетворительно» | 17 (15%) | 0 (0%) | 18 (16%) | 0 (0%) |
| Всего пациентов: | 116 (100%) | 116 (100%) | 116 (100%) | 116 (100%) |
Таким образом, первый этап клинического исследования позволил подтвердить выполнимость видеоассистированных операций при фолликулярных опухолях ЩЖ в клинической практике и их безопасность. Результаты исследования указывают на снижение уровня послеоперационных болевых ощущений, объема операционной кровопотери, уровня болевых ощущений после выполнения видеоассистированного вмешательства по сравнению с традиционным.
Результаты применения видеоассистированной тиреоидэктомии
В исследование были включены 44 пациента с опухолями ЩЖ. Пациенты были рандомизированы в две группы по 22 пациента в каждой: для проведения видеоассистированного вмешательства (МИВАТ) и для проведения традиционного вмешательства, при этом оперативное вмешательство в обеих группах производилось в объеме тиреоидэктомии. Пациентам с установленным после операции диагнозом дифференцированного рака ЩЖ назначалась терапия I131 с использованием активности 100 мКи. За 2 дня до лечения проводили анализ крови на ТТГ, ТГ, АТ к ТГ. Через 3 дня после терапии проводилось сканирование всего тела. Через 6 месяцев – определение уровня тиреоидного статуса, ТГ, АТ к ТГ (сначала на фоне продолжающейся супрессивной терапии тироксином, затем – на фоне 3-х недельной отмены приема тироксина). В качестве параметров сравнения использовали частоту осложнений, степень накопления I131 в области шеи по данным сцинтиграфии всего тела, уровень тиреоглобулина и титр АТ к ТГ перед проведением радиойодтерапии, а также через 6 месяцев после радиойодтерапии. Пациентов с повышенным титром АТ к ТГ из исследования исключали. Результаты сравнения приведены в таблицах 19 и 20.
Таблица 19
Длительность и осложнения МИВАТ и традиционной операции
| Параметры сравнения | МИВАТ | Традиционная ТЭ |
| Средняя длительность операции, мин | 92±24 | 84±21 |
| Парез возвратного нерва транзиторный | 1 (4,5%) | 1 (4,5%) |
| Парез возвратного нерва постоянный | 0 (0%) | 0 (0%) |
| Гипопаратиреоз транзиторный | 4 (18,1%) | 5 (22,7%) |
| Гипопаратиреоз постоянный | 0 (0%) | 0 (0%) |
Таблица 20
Сравнительные результаты использования МИВАТ и традиционной операции
| Параметры сравнения | МИВАТ | Традиционная ТЭ |
| Накопление I131 в зоне шеи отсутствует | 1 (4,5%) | 1 (4,5%) |
| Накопление I131 в зоне шеи выраженное | 2 (9,0%) | 3 (13,5%) |
| Уровень ТГ перед РЙТ, нг/мл | 2,63±2,43 | 2,48±2,28 |
| Уровень ТГ (6 мес., отмена Т4), нг/мл | 1,17±0,97 | 1,32±1,12 |
Уровень послеоперационных осложнений в группах МИВАТ и традиционными вмешательств не отличался ни по одному из оцениваемых параметров. Не было выявлено также отличий и при анализе параметров, используемых для послеоперационного наблюдения пациентов.
Малоинвазивные операции в лечении первичного гиперпаратиреоза
Оценка результатов использования различных оперативных методов
В исследование было включено 297 пациентов с ПГПТ, среди них преобладали пациенты с поражением нижних ОЩЖ (правой – 35,0% случаев, левой – 23,6% случаев). Множественное поражение ОЩЖ выявлено в 5,7% случаев. При этом достоверных различий между группами с использованием различных типов операций по локализации аденом ОЩЖ выявлено не было.
В группе селективной паратиреоидэктомии оперативное вмешательство проводилось видеоассистированным или традиционным методом. Видеоассистированное вмешательство применяли у пациентов с небольшим (до 2 см) размером аденомы ОЩЖ, четко лоцирующейся при УЗИ. Во всех случаях после удаления аденомы ОЩЖ проводили интраоперационное определение уровня паратгормона крови с использованием иммунохемилюминесцентного анализатора. Длительность оперативных вмешательств приведена в таблице 21.
Таблица 21
Длительность оперативных вмешательств
| Тип операции | Средняя длительность, мин |
| ДРШ | 73,41 |
| ОРШ | 56,25 |
| СПТЭ | 37,98 |
| ВСПТЭ | 40,00 |
| ДРШ+ТЭ | 86,56 |
| ДРШ+ТЭ+ЦЛД | 98,33 |
| ОРШ+ГТЭ | 55,31 |
| Всего | 52,12 |
Наибольшую длительность среди операций на околощитовидных железах имела двусторонняя ревизия шеи (73,41 минут), наименьшую – селективная паратиреоидэктомия (37,98 минут). Видеоассистированное выполнение селективной паратиреоидэктомии приводило к незначительному росту ее средней длительности (40,00 минут). Операции на ЩЖ и ОЩЖ имели значительно большую длительность с максимальным значением 98,33 минут для двусторонней ревизии шеи, совмещенной с тиреоидэктомией и центральной шейной лимфодиссекцией. Достоверной зависимости длительности операции от расположения аденомы ОЩЖ выявлено не было – Kruskal-Wallis test, p=0.2994. При анализе длительности первичных и повторных оперативных вмешательств выявлена достоверно большая длительность повторных операций (таблица 22).
Таблица 22
Длительность первичных и повторных оперативных вмешательств
| Операция | Ср. длительность, мин | Количество | Количество, % |
| Первичная | 53,11 | 273 | 91,9% |
| Повторная | 63,33 | 24 | 8,1% |
| Всего | 53,98 | 297 | 100,0% |
Важно отметить, что при использовании СПТЭ отмечалось постепенное сокращение длительности оперативных вмешательств с течением времени, что объясняется постепенным накоплением опыта хирургов – корреляция Спирмена -0,42. В группе ДРШ подобной корреляции не отмечалось.
При использовании ДРШ отмечалось достоверно более частое использование дренирования послеоперационной раны (р=0,00682, критерий Хи-квадрат). Очевидно, что это было связано с более сложными условиями для проведения качественного гемостаза в ране при использовании ДРШ.
Таблица 22
Состояние голосовых складок после оперативного вмешательства
| ДРШ | ОРШ | СПТЭ | ВСПТЭ | ДРШ+ТЭ | ДРШ +ТЭ+ЦЛД | ОРШ +ГТЭ | |
| Складки подвижны | 38 (95,0%) | 18 (100%) | 124 (96,9%) | 8 (100%) | 13 (86,7%) | 6 (100%) | 24 (100%) |
| Односторонний паралич | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
| Двусторонний паралич | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) | 0 (0%) |
| Ограничение подвижности складки | 2 (5,0%) | 0 (0%) | 4 (3,1%) | 0 (0%) | 2 (13,3%) | 0 (0%) | 0 (0%) |
| Всего | 40 (100%) | 18 (100%) | 128 (100%) | 8 (100%) | 15 (100%) | 6 (100%) | 24 (100%) |
Сравнительный анализ показывает, что ни в одном случае после операции не отмечалось полного нарушения подвижности голосовых складок. Подвижность одной из складок была ограничена у 5,0% пациентов после двусторонней ревизии шеи и у 3,0% пациентов после проведения селективной паратиреоидэктомии (3,1% пациентов после СПТЭ традиционным доступом, 0% - после СПТЭ видеоассистированным доступом). После проведения односторонней ревизии шеи случаев ограничения подвижности голосовой складки не отмечалось. Случаев двустороннего нарушения подвижности складок также выявлено не было. При наблюдении пациентов в течение 2 месяцев было отмечено восстановление подвижности голосовых складок во всех случаях, кроме 1 в группе ДРШ, а также 1 в группе использования ДРШ с тиреоидэктомией.
В группе СПТЭ в 5 случаях (3,8%) отмечалось персистирование гиперпаратиреоза через 1 сутки после операции и в 1 случае (0,8%) – кровотечение в послеоперационном периоде, потребовавшее повторной ревизии шеи под наркозом. После использования ОРШ персистирование гиперпаратиреоза отмечалось в 1 случае (2,0%), после двусторонней ревизии шеи – в 3 случаях (3,8%). Таким образом, частота персистирования гиперпаратиреоза оказалась одинаковой при использовании СПТЭ и ДРШ и достоверно меньшей при использовании ОРШ.
При анализе частоты встречаемости гипопаратиреоза на сроке 1 месяц после операции были получены следующие данные (рис. 1).
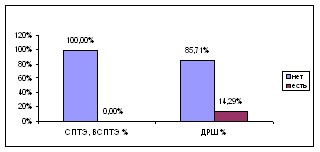
Рис. 1. Встречаемость гипопаратиреоза через 1 месяц после операции
При анализе полученных результатов установлено, что средняя длительность госпитализации при использовании СПТЭ была ниже (средний срок – 5,8 койко-дней), чем при использовании ДРШ (среднее – 7,9 койко-дней). При этом наименьшая средняя длительность госпитализации была зафиксирована в группе использования видеоассистированной СПТЭ (3,5 койко-дня).
При анализе расходования анальгетиков пациентам после операций было выяснено, что средний расход кеторола пациентам после проведения ДРШ составил 3,6 мл, после ОРШ – 1,75 мл, СПТЭ – 1,41 мл, ВСПТЭ – 0,75 мл. При анализе полученных данных с использованием критерия Kruskal-Wallis была подтверждена достоверность выявленных различий (р=0,000).
Анализ длины разреза кожи выявил различия между группами: средняя длина разреза кожи в группе с использованием ДРШ составила 55 мм, ОРШ – 45 мм, СПТЭ – 31 мм, ВСПТЭ – 16,3 мм (различия достоверны).
Таким образом, использование малоинвазивных методов не увеличивает частоты персистирования ПГПТ, позволяет снизить травматичность вмешательства, длительность госпитализации, улучшить косметический результат операции по сравнению с двусторонней ревизией шеи.
Интраоперационное определение уровня паратгормона крови
В 2005-2010 гг. интраоперационное определение уровня ПТГ было использовано у 234 пациентов с ПГПТ. При оценке результатов интраоперационного определения уровня ПТГ использовались критерии, изложенные в таблице 24.
Таблица 24
Критерии оценки результатов интраоперационного определения уровня ПТГ
| Результат | Значение |
| Истинноположитель- ный результат | Уровень ПТГ падает на 50% или больше после удаления единственной аденомы ОЩЖ; других аденом нет |
| Ложноположитель- ный результат | Уровень ПТГ падает на 50% или более, несмотря на то, что патологически измененная ОЩЖ остается in situ |
| Истинноотрицатель- ный результат | Уровень ПТГ не падает или падает менее чем на 50% и указывает на наличие дополнительных аденом ОЩЖ |
| Ложноотрицательный результат | Уровень ПТГ не падает или падает менее чем на 50% несмотря на то, что дополнительных аденом ОЩЖ нет |
Результаты применения мониторинга ПТГ приведены в таблице 25.
Таблица 25
Результаты интраоперационного мониторинга уровня ПТГ при операции
| Вид исследования | Результаты интраоперационного ПТГ | |||
| Ист. + | Ложно + | Ист. – | Ложно – | |
| Интраоперационное определение уровня ПТГ крови | 198 (88,8%) | 16 (7,2%) | 8 (3,6%) | 1 (0,4%) |
| Всего | 223 (100%) | |||
Интраоперационное определение ПТГ позволило корректно предсказать результат операции у большинства пациентов (206 из 223, или 92,4%).
Одной из задач работы явилось определение оптимального времени взятия крови для определения ПТГ. Всем пациентам выполнялось взятие венозной крови из периферической вены через 5 и 10 минут после удаления аденомы. Результаты оценки данных проб приведены в таблице 26.
Таблица 26
Падение уровня паратгормона после удаления аденомы ОЩЖ
| Падение уровня ПТГ | 5 мин | 5 мин, % | 10 мин | 10 мин, % |
| >50% | 197 | 83,12% | 216 | 91,14% |
| <50% | 40 | 16,88% | 21 | 8,86% |
| Всего | 237 | 100,00% | 237 | 100,00% |
Анализ данных таблицы позволяет сделать вывод о повышенном уровне ложноотрицательных результатов при анализе через 5 минут после удаления аденомы, по сравнению с анализом проб, полученных через 10 минут. При использовании лишь уровня ПТГ, полученного через 5 минут после удаления аденомы, в исследованной группе пациентов неоправданная двусторонняя ревизия шеи была бы проведена 19 пациентам (8%). Указанная особенность позволяет высказать мнение о том, что пробы крови должны забираться не ранее, чем через 10 минут после удаления аденомы.
Модифицированный метод интраоперационного анализа уровня ПТГ
С целью сокращения времени выполнения теста без повышения его стоимости была предложена модифицированная методика определения уровня ПТГ с использованием раннего прерывания реакции до наступления фазы стабилизации. При этом определение уровня ПТГ в абсолютных цифрах (выраженных в пг/мл или пмоль/л) становится невозможным, однако сохраняется возможность определения оптической плотности среды или ее люминесценции, выраженной в относительных световых единицах (RLU, relative light unit), которые пропорциональны концентрации ПТГ в исходной пробе крови. Данные параметры могут быть использованы вместо абсолютных значений уровня ПТГ, при этом общее время выполнения теста до получения диагностически значимого результата может быть сокращено как минимум в 2 раза по сравнению с традиционной методикой его выполнения (рис. 2).
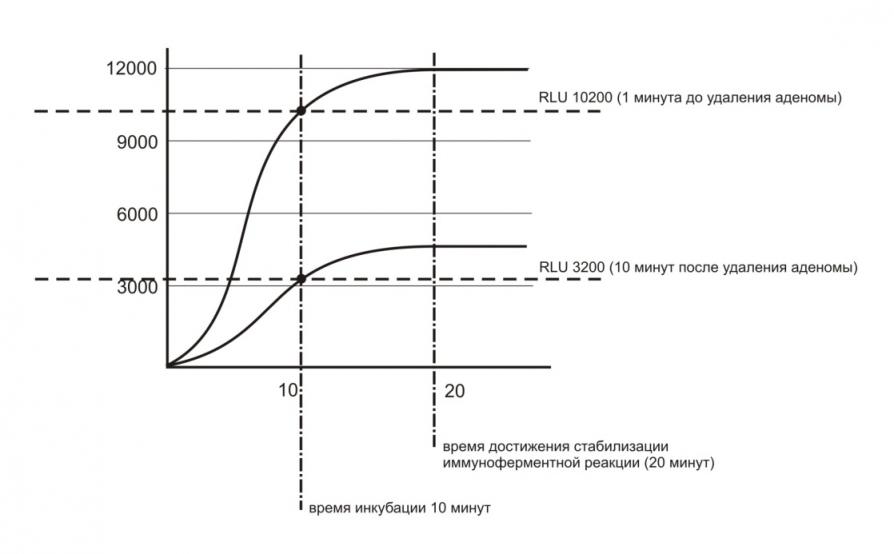
Рис. 2. Технология модифицированного интраоперационного теста на ПТГ
В рамках настоящего исследования модифицированный тест (патент РФ на изобретение №2438129 RU С1 от 20.06.2011) был применен в клинической практике при лечении 175 пациентов с ПГПТ.
Результаты исследования приведены в таблице 27.
Таблица 27
Результаты применения модифицированного интраоперационного метода
| Вид исследования | Результаты интраоперационного теста | |||
| Ист. + | Ложно + | Ист. – | Ложно – | |
| Модифицированный тест | 143 (85,6%) | 2 (1,2%) | 3 (1,8%) | 19 (11,4%) |
| Всего | 167 (100%) | |||
Данные, приведенные в таблице, свидетельствуют о более высоком уровне ложноотрицательных результатов при модифицированном анализе проб крови, по сравнению с проведением традиционного анализа. В группе из 151 пациента было произведено сравнение результативности применения традиционного и модифицированного способов интраоперационного определения тактики (таблица 28). Всем пациентам в данной группе выполнялось определение уровня ПТГ традиционным способом одновременно с расчетом RLU по модифицированной методике.
Таблица 28
Результаты применения традиционного и модифицированного способов
| Традиционный способ | Модифицированный способ | |||||||
| 5 минут | 10 минут | 5 минут | 10 минут | |||||
| >50% | 122 | 80,79% | 139 | 92,05% | 108 | 71,52% | 131 | 86,75% |
| <50% | 29 | 19,21% | 12 | 7,95% | 43 | 28,48% | 20 | 13,25% |
| Всего | 151 | 100,00% | 151 | 100,00% | 151 | 100,00% | 151 | 100,00% |
Сравнительный анализ результатов применения обоих методов свидетельствует о более частой встречаемости ложноотрицательных результатов при использовании модифицированного метода. При использовании только модифицированной методики у 8 (5,2%) пациентов была бы произведена ДРШ, не оправданная клинически и не приводящая к обнаружению второй аденомы ОЩЖ. Углубленный анализ 8 случаев расхождений показал, что подобные ошибки отмечались у пациентов с исходно незначительно повышенным уровнем ПТГ и «мягким» течением гиперпаратиреоза. Падение уровня RLU у данных пацентов происходило, но не достигало 50% от исходного, хотя всегда превышало 40%. В подобных ситуациях снижение число ложноотрицательных результатов может быть достигнуто использованием меньшего предела определения эффективности вмешательства (40% и более от исходного уровня), либо определением уровня RLU через 30 минут после операции, что во всех описанных случаях позволило выявить 50% снижение RLU от исходного и подтвердить излечение пациентов. У всех пациентов с выявленным диагностическим снижением уровня RLU при контрольном обследовании через 24 и 48 часов не получено данных о персистировании заболевания. Через 6 месяцев после операции у пациентов сохранялся нормальный уровень ПТГ и ионизированного кальция крови, что свидетельствовало об отсутствии рецидива ПГПТ.
Разработка методики интраоперационной фотодинамической
визуализации околощитовидных желез
Экспериментальное применение фотодинамической визуализации ОЩЖ
Был проведен эксперимент на 20 лабораторных крысах линии «Вистар», которым вводили внутрибрюшинно 5-АЛК в дозе 300 мг/кг. Через 1 час после введения препарата производили оперативное вмешательство в условиях затемненной операционной. Производили попытку визуализации ОЩЖ путем визуального осмотра и ревизии паратрахеальной клетчатки – ОЩЖ выявить не удалось, после чего производили освещение операционного поля поляризованным синим светом с использованием установки Karl Storz D-Light C. Путем регистрации розового свечения визуализировали ОЩЖ и производили взятие их ткани для гистологического исследования. При гистологическом исследовании в удаленных препаратах была выявлена ткань ОЩЖ нормального строения.
Клиническое применение фотодинамической визуализации ОЩЖ
На первом этапе клинического исследования задачей явилось изучение безопасности назначения пациентам 5-АЛК и влияния данного препарата на строение ткани ОЩЖ человека и уровень некоторых лабораторных показателей. Метод фотодинамической визуализации ОЩЖ был применен в клинике у 50 пациентов с фолликулярными опухолями ЩЖ. Использовали препарат 5-АЛК «Аласенс» производства ФГУП «ГНЦ «Ниопик». За 3 часа до операции пациенты получали перорально раствор 5-АЛК в дозе 20 мг/кг в виде водного раствора. Производилась МИВАГ с фотодинамической визуализацией ОЩЖ.
Визуализация неизмененных ОЩЖ оказалась возможной у 44 (88%) из 50 пациентов данной группы. В случае визуализации ОЩЖ отмечалось достаточно интенсивное розовое свечение ткани железы в лучах синего света. Статистически достоверного изменения уровня паратгормона, гемоглобина, трансаминаз в послеоперационном периоде отмечено не было.
При гистологическом исследовании у одного пациента из 50 после выполнения МИВАГ с использованием 5-АЛК в препарате была выявлена случайно удаленная правая нижняя околощитовидная железа, располагавшаяся под капсулой щитовидной железы. При исследовании ткани ОЩЖ данных за изменение в гистоархитектонике и клеточном строении не отмечено.
Задачей второго этапа клинического исследования явилось изучение интенсивности флюоресценции ОЩЖ при различных режимах назначения 5-АЛК. Препарат назначался 25 пациентам (по 5 в каждой группе) в дозе 20 мкг/кг за 1, 2, 3, 4, 5 часов до операции. Пациентам проводилась МИВАГ с фотодинамической визуализацией ОЩЖ. Регистрировалось общее количество выявленных ОЩЖ, демонстрирующих свечение.
Таблица 29
Интенсивность флюоресценции ОЩЖ при использовании
различных режимов назначения 5-АЛК
| Время назначения | Количество ОЩЖ со свечением |
| 1 час до операции | 1 |
| 2 часа до операции | 4 |
| 3 часа до операции | 9 |
| 4 часа до операции | 3 |
| 5 часов до операции | 1 |
В результате данного этапа исследования было установлено, что максимальная интенсивность флюоресценции достигается при назначении 5-АЛК за 3 часа до операции. При назначении препарата за 1 и 5 часа до операции интенсивность флюоресценции является низкой, в ряде случаев ОЩЖ выявить не удалось.
Третий этап клинического исследования был посвящен использованию фотодинамической визуализации при проведении видеоассистированной селективной паратиреоидэктомии у пациентов с ПГПТ. В исследовании принимали участие 20 пациентов с лабораторно подтвержденным ПГПТ и конкордантными результатами УЗИ и сцинтиграфии. В первой группе (10 больных) пациенты получали 5-АЛК перорально за 3 часа до операции, во второй группе препарат не использовался. Производилось видеоассистированное вмешательство через срединный шейный доступ, пораженная ОЩЖ визуализировалась с использованием фотодинамической методики. Результаты исследования приведены в таблице 30.
Таблица 30
Результаты применения фотодинамической визуализации при лечении ПГПТ
| Параметр | без визуализации | с визуализацией |
| Время до визуализации аденомы ОЩЖ | 14±9 мин | 8±3 мин |
| Длительность операции | 45±12 мин | 33±9 мин |
Результаты исследования свидетельствуют о достоверном снижении длительности видеоассистированной СПТЭ у пациентов с ПГПТ при использовании фотодинамической визуализации, что обусловлено более быстрой локализацией аденомы в операционной ране.
Проведенное исследование позволило подтверждить возможность и безопасность интраоперационной фотодинамической визуализации ОЩЖ с использованием 5-аминолевулиновой кислоты, отработать механизм назначения препарата. Методика позволяет облегчить проведение видеоассистированных оперативных вмешательств на щитовидной железе за счет ускорения процесса поиска околощитовидных желез.
ЗАКЛЮЧЕНИЕ
Совершенствование диагностических и лечебных методик приводит к появлению новых возможностей в лечении пациентов с объемными образованиями щитовидной и околощитовидных желез. Основной задачей при разработке новых методов является снижение травматичности лечебного процесса при обеспечении высокой его клиническо эффективности. Выполненное исследование позволило определить показания к использованию методов внутритканевой деструкции узлов ЩЖ и видеоассистированных операций на ЩЖ, что значительно расширяет диапазон лечебных мероприятий у пациентов с объемными образованиями этого органа. В лечении пациентов с ПГПТ показана возможность успешного применения как двусторонней ревизии шеи, так и менее травматичных вмешательств, обеспечивающих излечение заболевания.
ВЫВОДЫ
1. Зона поражения ткани ЩЖ при использовании химического метода деструкции – этаноловой склеротерапии – характеризуется образованием очага некроза без четких границ с участками жизнеспособной ткани среди полей некроза.
2. Физические методы внутритканевой деструкции – ЛИТТ и РЧА – позволяют создать в узле ЩЖ четко отграниченный очаг поражения, не содержащий жизнеспособных клеток, зональное строение которого зависит от использованного метода деструкции.
3. Оптимальным методом, позволяющим устранить симптомы компрессии органов шеи, связанные с наличием у пациента кистозно-трансформированного или солидного узла коллоидного строения, является этаноловая склеротерапия.
4. Физические методы деструкции являются наиболее эффективными при лечении пациентов с узловым токсическим зобом, при этом ЛИТТ является более безопасным методом деструкции узлов размером до 3 см, а РЧА позволяет эффективно подавлять функцию крупных узлов размером более 3 см.
5. Комбинированное использование физических и химических методов деструкции позволяет повысить эффективность лечения и улучшить результаты лечения больного.
6. Наиболее эффективным методом внутритканевой деструкции крупных автономно функционирующих узлов является комбинированная методика с использованием радиочастотной аблации и этаноловой склеротерапии.
7. Параметры доступов для проведения тотально эндоскопических вмешательств на ЩЖ (подмышечного, переднего грудного, бокового шейного) не позволяют признать их применение в эндокринной хирургии обоснованным.
8. Оптимальным для выполнения малоинвазивных оперативных вмешательств является горизонтальный доступ по белой линии шеи, позволяющий оперировать на всех отделах щитовидной железы и околощитовидных железах.
9. Видеоассистированные операции на щитовидной железе позволяют снизить уровень послеоперационных болевых ощущений и объем операционной кровопотери, а также улучшить косметический результат лечения.
10. Видеоассистированные операции на щитовидной железе не приводят к повышению риска осложнений и позволяют полноценно удалять ткань ЩЖ.
11. Односторонняя ревизия полости шеи и СПТЭ, как наименее травматичные методики, являются предпочтительными при лечении пациентов с ПГПТ и локализованной по данным предоперационного обследования аденомой.
12. Двусторонняя ревизия шеи является эффективным методом, обеспечивающим оптимальные результаты лечения пациентов с персистирующим и рецидивным ПГПТ, а также пациентов с неустановленной по данным предоперационного обследования локализацией аденомы околощитовидной железы.
13. Модифицированное интраоперационное определение динамики снижения уровня ПТГ крови позволяет снизить время до получения результата в 2 раза при сопоставимой с традиционной методикой точности исследования и полностью аналогичной стоимости.
14. Фотодинамическая визуализация ОЩЖ позволяет сократить время оперативного вмешательства при проведении видеоассистированной селективной паратиреоидэктомии у пациентов с первичным гиперпаратиреозом за счет более быстрой локализации пораженной железы в операционной ране.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Перед проведением малоинвазивных методик лечения узлов ЩЖ требуется оценка их размеров с помощью УЗИ, подтверждение доброкачественной природы узла с помощью ТАБ, определение тиреоидного статуса пациента и титра антитиреоидных антител.
- Все пункционные манипуляции на ЩЖ следует проводить только под сонографическим контролем, в части случаев – с использованием допплеровских режимов.
- При лечении пациентов с кистозно-трансформированными коллоидными узлами ЩЖ, вызывающими симптомы сдавления органов шеи, следует использовать этаноловую склеротерапию в качестве метода выбора.
- Этаноловую склеротерапию следует использовать при лечении пациентов с солидными узлами ЩЖ размером до 4 см, вызывающими симптомы компрессии органов шеи на фоне эутиреоидного состояния пациента. При выявлении узлов большего размера предпочтение следует отдать РЧА.
- При склеротерапии солидных узлов следует использовать методику с множественным смещением пункционной иглы, поскольку она позволяет ввести большие объемы склерозанта в узел и повысить эффективность воздействия.
- При лечении пациентов с АФУ ЩЖ, вызывающими симптомы тиреотоксикоза, следует отдавать предпочтение физическим методам внутритканевой деструкции. При этом деструкция узлов размером до 3 см более безопасно осуществляется с использованием ЛИТТ. Деструкция крупных узлов размером более 3 см более эффективна при использовании РЧА.
- При лечении пациентов с крупными кистозно-трансформированными узлами смешанного строения оптимальных результатов лечения можно достичь путем склерозирования кистозной полости с помощью этаноловой склеротерапии и последующей деструкции солидного компонента лазерным воздействием.
- Лечение пациентов с токсическим узловым зобом методами внутритканевой деструкции следует проводить только после достижения эутиреоидного состояния путем тиреостатической терапии.
- При использовании РЧА, следует учитывать, что зона аблации на 5 мм превышает зону раскрытия проводников электрода.
- Для обеспечения должной безопаности процедуры при использовании ЛИТТ следует располагать световод в ткани ЩЖ таким образом, чтобы на линии его оси не находилось опасных в плане повреждения объектов. Следует также учитывать, что на расстоянии 2 см от торца световода температура может достигать опасных значений, поэтому расстояние от конца световода до жизненно важных объектов не должно быть меньше 2 см.
- В сохраненную при проведении РЧА или ЛИТТ периферическую часть автономно функционирующего узла ЩЖ следует вводить этанол, поскольку это повышает общую эффективность деструкции.
- Пациентов, перенесших внутритканевую деструкцию узлов ЩЖ, следует наблюдать в течение не менее 1 года после лечения, поскольку у части пациентов положительный эффект лечения может быть зафиксирован на сроке до 6 месяцев после воздействия, а в части случаев возможны рецидивы заболевания после первичного клинического улучшения.
- Видеоассистированные вмешательства на ЩЖ следует проводить у пациентов с фолликулярными опухолями при размере узла до 35 мм, общем объеме железы до 25 мл, индексе массы тела пациента до 39,9.
- С целью профилактики травматизации кожи при проведении видеоассистированных операций следует использовать ограничительное металлическое кольцо, удерживающее ретракторы в правильном положении, либо рассекать ткани белой линии шеи на расстояние, меньшее чем длина кожного разреза.
- При проведении видеоассистированных вмешательств на ЩЖ следует визуализировать возвратный нерв и наружную ветвь верхнего гортанного нерва на эндоскопическом этапе операции, с использованием освещения и увеличения, обеспечиваемых эндоскопом.
- При проведении видеоассистированных вмешательств на щитовидной железе и расположении узлов в верхнем полюсе доли, а также при лечении пациентов мужского пола или пациентов с аутоиммунным поражением щитовидной железы следует проводить разрез кожи длиной 2,5-3 см.
- Пациентам с ПГПТ, при конкордантных результатах УЗИ и сцинтиграфии с технетрилом, в качестве метода выбора следует проводить селективную паратиреоидэктомию (в случае технической возможности – видеоассистированную).
- Пациентам с первичным гиперпаратиреозом, при дискордантных результатах УЗИ и сцинтиграфии с технетрилом, но наличии данных о стороне поражения, следует проводить одностороннюю ревизию шеи.
- Пациентам с ПГПТ, имеющим негативные результаты УЗИ и сцинтиграфии, либо при дискордатных результатах этих исследований и отсутствии данных о стороне поражения, следует проводить двустороннюю ревизию шеи.
- Пациентам с персистирующим или рецидивным ПГПТ следует проводить двусторонюю ревизию шеи.
- При оперативном лечении ПГПТ следует контролировать результаты вмешательства путем интраоперационного мониторинга динамики изменения уровня ПТГ крови.
- При использовании интраоперационного мониторинга уровня ПТГ крови следует проводить сравнение между собой пробы крови, полученной перед отсечением сосудов аденомы, и пробы крови, полученной через 10 минут после отсечения сосудов.
ОСНОВНЫЕ ПЕЧАТНЫЕ РАБОТЫ,
ОПУБЛИКОВАННЫЕ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Слепцов И.В. Диагностическая ценность тонкоигольной аспирационной биопсии узлов щитовидной железы / Н.И. Тимофеева, Р.А. Черников, И.В. Слепцов, И.К. Чинчук, А.С. Шестериков // Вестник Санкт-Петербургского университета – серия 11. – раздел медицина. – Вып. 2. – 2006. – С. 79-85.
2. Слепцов И.В. Радиочастотная абляция автономно функционирующих узлов щитовидной железы – первые результаты клинического применения / И.В. Слепцов, Р.А. Черников, И.К. Чинчук, А.А. Семенов, Н.И. Тимофеева, В.В. Дмитриченко, Ю.Н. Федотов, А.Н. Бубнов // Вестник Санкт-Петербургского университета – Серия 11. – Медицина. – Вып. 1. – 2007. – С. 72-80.
3. Слепцов И.В. Организация диагностики и лечебной помощи пациентам с заболеваниями щитовидной железы в регионе / Ю.Н. Федотов, А.Н. Бубнов, Р.А. Черников, В.Ф. Русаков, И.В. Слепцов, И.К. Чинчук, Е.В. Быченкова, А.А. Семенов, Н.И. Тимофеева, А.А. Успенская // Клиническая и экспериментальная тиреоидология. – 2009. – Т.5, №1. – С. 8-12.
4. Слепцов И.В. Фотодинамическая визуализация околощитовидных железы – результаты клинического применения / И.В. Слепцов, А.Н. Бубнов, Р.А. Черников, Ю.Н. Федотов, А.А. Семенов, И.К. Чинчук, В.А. Макарьин, А.А. Успенская, Ю.В. Карелина // Клиническая и экспериментальная тиреоидология. – 2009. – Т.5, №1. – С. 35-40.
5. Слепцов И.В. Диагностика злокачественных опухолей щитовидной железы / Ю.Н. Федотов, Н.И. Тимофеева, Р.А. Черников, И.В. Слепцов, А.А. Семенов, А.А. Успенская, А.А. Абдулхаликов, А.Н. Бубнов // Вестник Санкт-Петербургского университета. – Серия 11. – Медицина. – Вып. 3. – 2009. – С. 211-215.
6. Слепцов И.В. Тонкоигольная аспирационная биопсия в диагностике заболеваний щитовидной железы. Корреляция между заключением цитолога и гистолога, технические аспекты / Ю.Н. Федотов, С.Л. Воробьев, Р.А. Черников, Н.И. Тимофеева, А.А. Семенов, И.В. Слепцов, А.А. Успенская, А.А. Абдулхаликов, А.Н. Бубнов, И.К. Чинчук // Клиническая и экспериментальная тиреоидология. – 2009. – Т.5, №4. – С. 28-33.
7. Слепцов И.В. Организация тиреоидологической службы в Северо-Западном Федеральном округе / Ю.Н. Федотов, И.В. Слепцов, А.А. Семенов, А.А. Успенская, А.А. Абдулхаликов, А.Н. Бубнов, И.К. Чинчук, Р.А. Черников, Е.В. Быченкова, Ю.В. Карелина, А.А. Семенов // Вестник Санкт-Петербургского университета. – Серия 11. – Медицина. – Вып. 4. – 2009. – С. 293-296.
8. Слепцов И.В. Внутритканевая деструкция узлов щитовидной железы (сравнительная характеристика) / И.В. Слепцов, Ю.Н. Федотов, В.В. Дмитриченко, А.А. Успенская, А.А. Абдулхаликов, А.Н. Бубнов, А.А. Семенов, И.К. Чинчук, Р.А. Черников, Е.В. Быченкова // Вестник Санкт-Петербургского университета – Серия 11. – Медицина. – Вып. 4. – 2009. – С. 201-206.
9. Слепцов И.В. Опыт применения видеоассистированных вмешательств при лечении пациентов с узловым нетоксическим зобом / И.В. Слепцов, А.Н. Бубнов, Р.А. Черников, И.К. Чинчук, А.А. Семенов, А.А. Успенская, Ю.В. Карелина, В.А. Макарьин // Российская научно-практическая конференция, посвященная 110-летию со дня рождения академика Н.С. Молчанова «Актуальные вопросы пульмонологии, кардиологии и эндокринологии». Сборник материалов конференции. – Санкт-Петербург. – 2009. – С. 97.
10. Слепцов И.В. Видеоассистированные вмешательства в лечении пациентов с объемными образованиями щитовидной железы / И.В. Слепцов, А.Н. Бубнов, Р.А. Черников, Ю.Н. Федотов, И.К. Чинчук, А.А. Семенов, В.А. Макарьин, А.А. Успенская, Ю.В. Карелина, Е.В. Быченкова // Современные технологии в эндокринологии. Сборник тезисов. – Москва, 2009. – С.334-335.
11. Слепцов И.В. Интраоперационная фотодинамическая визуализация околощитовидных желез при видеоассистированных операциях / И.В. Слепцов, А.Н. Бубнов, Р.А. Черников, Ю.Н. Федотов, И.К. Чинчук, А.А. Семенов, В.А. Макарьин, А.А. Успенская, Ю.В. Карелина, Е.В. Быченкова // Современные технологии в эндокринологии. Сборник тезисов. – Москва, 2009. – С.335-337.
12. Слепцов И.В. Метод лечения гиперпаратиреоза с интраоперационным определением динамики изменения оптической плотности раствора, содержащего плазму крови пациента и реагенты для иммуноферментного анализа / И.В. Слепцов, Н.Б. Выборнова, Ю.В. Карелина, В.А. Макарьин, А.Н. Бубнов, Ю.Н. Федотов, Р.А. Черников, И.К. Чинчук, А.А. Семенов, А.А. Успенская, Е.В. Быченкова, Н.И. Тимофеева// Патология околощитовидных желез: современные принципы диагностики и лечения. Материалы международного научного форума. – СПб, 2010. – С. 125-130.
13. Слепцов И.В. Хирургическое лечение первичного гиперпаратиреоза: эволюция оперативных подходов / И.В. Слепцов, Р.А. Черников, А.Н. Бубнов, Ю.Н. Федотов, Ю.В. Карелина, Г.Н. Погосян, В.А. Макарьин, И.К. Чинчук, А.А. Семенов, А.А. Успенская, Е.В. Быченкова, Н.И. Тимофеева // Патология околощитовидных желез: современные принципы диагностики и лечения. Материалы международного научного форума. – СПб, 2010. – С. 130-132.
14. Слепцов И.В. Видеоассистированные операции в лечении патологии щитовидной железы / И.В. Слепцов, А.Н. Бубнов, Р.А. Черников, Федотов Ю.Н., И.К. Чинчук, В.А. Макарьин, А.А. Семенов, А.А. Успенская //Всероссийский форум «Пироговская хирургическая неделя». Материалы форума. – СПб, 2010. – С. 868.
15. Слепцов И.В. Патент на изобретение 2394505 RU C1. Способ резекции щитовидной железы с интраоперационной фотодинамической визуализацией околощитовидных желез / И.В. Слепцов, А.Н. Бубнов, Р.А. Черников, А.А. Семенов, И.К. Чинчук, В.А. Макарьин, А.А. Успенская, Ю.В. Карелина, Н.И. Тимофеева (Россия). – №2009107618. – Приоритет 04.03.2009; опубл. 20.07.2010.
16. Слепцов И.В. Патент на полезную модель 96769 RU U1. Аспиратор / И.В. Слепцов, В.А. Макарьин, А.Н. Бубнов, Р.А. Черников, Ю.Н. Федотов, А.А. Семенов, И.К. Чинчук (Россия). – №2010108376. – Приоритет 10.03.2010; опубл. 20.08.2010.
17. Слепцов И.В. Патент на полезную модель 105577 RU U1. Ранорасширитель / И.В. Слепцов, В.А. Макарьин, А.Н. Бубнов, Р.А. Черников, Н.И. Тимофеева, Ю.Н. Федотов, А.А Семенов, И.К. Чинчук, А.А. Успенская, И.С. Шумакович, К.Ю. Новошонов (Россия). – №2010154712. – Приоритет 27.12.2010; опубл. 20.06.2011.
18. Слепцов И.В. Патент на полезную модель 96753 RU U1. Пункционная игла для деструкции доброкачественных узлов щитовидной железы / И.В. Слепцов, В.А. Макарьин, А.Н. Бубнов, Р.А. Черников, Ю.Н. Федотов, А.А. Семенов, И.К. Чинчук (Россия). – №2010108375. – Приоритет 10.03.2010; опубл. 20.08.2010.
19. Слепцов И.В. Патент на изобретение 2402359 RU С1. Способ двухэтапной комбинированной деструкции доброкачественных солидных узлов щитовидной железы / И.В. Слепцов, А.Н. Бубнов, Р.А. Черников, Н.И. Тимофеева, Ю.Н. Федотов, А.А. Семенов, И.К. Чинчук, В.А. Макарьин, А.А. Успенская (Россия). – №2009130054. – Приоритет 06.08.2009; опубл. 27.10.2010.
20. Слепцов И.В. Патент на изобретение 2402359 RU С1. Способ комбинированной деструкции доброкачественных солидных узлов щитовидной железы / И.В. Слепцов, А.Н. Бубнов, Р.А. Черников, Н.И. Тимофеева, Ю.Н. Федотов, А.А. Семенов, И.К. Чинчук, В.А. Макарьин, А.А. Успенская (Россия). – №2009130054. – Приоритет 06.08.2009; опубл. 27.10.2010.
21. Слепцов И.В. Возможности метода внутритканевой деструкции при узловом токсическом зобе у пациентов старшей возрастной группы / И.В. Слепцов, Р.А. Черников, В.А. Макарьин, А.А. Успенская, Н.И. Тимофеева, И.К. Чинчук, В.А. Одинцов, Е.А. Федоров, К.Ю. Новокшонов, Ю.В. Карелина, А.А. Семенов // Естественные и технические науки. – Москва, 2011. № 6, - С. 181-185.
22. Слепцов И.В. Радиочастотная абляция как метод купирования послеоперационного рецидивного тиреотоксикоза при болезни Грейвса / И.В. Слепцов, Р.А. Черников, В.А. Макарьин, А.А. Успенская, Н.И. Тимофеева, И.К. Чинчук, В.А. Одинцов, Е.А. Федоров, К.Ю. Новокшонов, Ю.В. Карелина, А.А. Семенов // Естественные и технические науки. – Москва, 2011. № 6, - С. 185-190.
23. Слепцов И.В. Патент на полезную модель 100896 RU U1 Мобильный диагностический комплекс «Тиробус» / А.Н. Бубнов, Ю.Н. Федотов, И.В. Слепцов, Р.А. Черников, А.А. Семенов, И.К. Чинчук, Е.В. Быченкова – №2010121903. – Приоритет 20.05.2010; опубл. 10.01.2011.
24. Слепцов И.В. Патент на изобретение 2426565 RU С2. Способ комбинированной деструкции доброкачественных солидных узлов щитовидной железы / И.В. Слепцов, А.Н. Бубнов, Р.А. Черников, Н.И. Тимофеева, Ю.Н. Федотов, А.А. Семенов, И.К. Чинчук, В.А. Макарьин, А.А. Успенская (Россия). – №2009130055. – Приоритет 06.08.2009; опубл. 20.08.2011.
25. Слепцов И.В. Патент на полезную модель 109398 RU U1. Комплекс для тонкоигольной пункционной биопсии под ультразвуковым контролем / И.В. Слепцов, В.А. Одинцов, Р.А. Черников, А.А. Успенская, И.С. Шумакович, К.Ю. Новокшонов (Россия). – №2009130055. – Приоритет 02.03.2011; опубл. 20.10.2011.
26. Слепцов И.В. Патент на полезную модель 105574 RU U1. Устройство для тонкоигольной пункционной биопсии / И.В. Слепцов, В.А. Одинцов, Р.А. Черников, А.А. Успенская, И.С. Шумакович, К.Ю. Новокшонов (Россия). – №2010154708. – Приоритет 27.12.2010; опубл. 20.06.2011.
27. Слепцов И.В. Патент на изобретение 2438129 RU С1. Способ лечения гиперпаратиреоза / И.В. Слепцов, В.А. Одинцов, Р.А. Черников, А.А. Успенская, И.С. Шумакович, К.Ю. Новокшонов (Россия). – №2010154708. – Приоритет 27.12.2010; опубл. 20.06.2011.
28. Слепцов И.В. Патент на полезную модель 115666 RU U1. Манипулятор для инъекционного шприца / И.В. Слепцов, В.А. Одинцов, Р.А. Черников, А.А. Успенская, И.С. Шумакович, К.Ю. Новокшонов (Россия). – №2011107863. – Приоритет 02.03.2011; опубл. 10.05.2012.
29. Слепцов И.В. Минимально инвазивная хирургия щитовидной железы / Ю.В. Иванов, Д.Н. Панченков, А.В. Борсуков, И.В. Слепцов, Н.А. Соловьев – Смоленск: Маджента, 2012. – 128 с.
СПИСОК СОКРАЩЕНИЙ
5-АЛК – 5-аминолевулиновая кислота
АТ к ТГ – антитела к тиреоглобулину
АФУ – автономно функционирующий узел
ГТЭ – гемитиреоидэктомия
ДРШ – двусторонняя ревизия шеи
ЛИТТ – лазериндуцированная термотерапия
МИВАТ – минимально-инвазивная видеоассистированная тиреоидэктомия
МИВАГ – минимально-инвазивная видеоассистированная гемитиреоидэктомия
ОРШ – односторонняя ревизия шеи
ОЩЖ – околощитовидная железа
ПГПТ – первичный гиперпаратиреоз
ПТГ – паратгормон
РЙТ – радиойодтерапия
РЧА – радиочастотная аблация
СПТЭ – селективная паратиреоидэктомия
Т4 св. – свободная фракция тетрайодтиронина (тироксина)
Т3 св. – свободная фракция трийодтиронина
ТАБ – тонкоигольная аспирационная биопсия
ТГ – тиреоглобулин
ТТГ – тиреотропный гормон гипофиза
ТЭ – тиреоидэктомия
УЗИ – ультразвуковое исследование
ЦДК – цветное допплеровское картирование
ЩЖ – щитовидная железа
ЭС – этаноловая склеротерапия

