Хронических ран в оториноларингологии методом трансплантации культивированных аллофибробластов человека
Диссертационный совет Д 208.072.11 при ГОУ ВПО «Российский Государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» направляет сведения о предстоящей защите докторской диссертации и автореферат диссертации Поматилова Алексея Алексеевича
Отправитель: Ученый секретарь диссертационного совета профессор Гурам Давидович Лазишвили
Автореферат диссертации
На правах рукописи
Поматилов Алексей Алексеевич
УДК 616.285.001-085.366.018.21
Лечение острых и хронических ран в оториноларингологии методом трансплантации культивированных аллофибробластов человека
14.00.04-Болезни уха, горла и носа
Автореферат на соискание ученой степени
доктора медицинских наук
Москва-2008
Работа выполнена в государственном образовательном учреждении высшего профессионального образования «Российский Государственный Медицинский Университет»
Научные консультанты:
чл.-корр. РАМН,
засл. деятель науки РФ,
поч. зав. каф. оториноларингологии
л/ф Российского Государственного
Медицинского Университета
д. м.н. профессор Пальчун В.Т.
лауреат Государственной премии
д.м.н. профессор каф. пат. анатомии
п/ф Российского Государственного
Медицинского Университета Туманов В.П.
.
Официальные оппоненты:
1. Член-корр. РАМН д.м.н. проф.
зав. каф. оториноларингологии
п/ф Российского Государственного
Медицинского Университета Богомильский М.Р.
2. Д.м.н. проф. зав. каф. лор болезней
Российского Университета Дружбы Народов
им. П. Лумумбы Антонив В.Ф.
3. Д.м. н. проф. каф. болезней уха, горла и носа
Московской медицинской Академии
им. И. М. Сеченова Гамов В.П.
Ведущее учреждение: Московский медико-стоматологический университет
Защита состоится «______»___________________________2008 г. в _________часов
На заседании диссертационного совета Д2008.072. при Российском Государственном Университете (117997, г. Москва, ул. Островитянова д.1)
С диссертацией можно ознакомиться в библиотеке РГМУ по адресу: 117997, г. Москва, ул. Островитянова д.1
Автореферат разослан «_____»___________________2008 года
Ученый секретарь диссертационного совета
Доктор медицинских наук
Профессор Г.Д. Лазишвили
Общая характеристика работы
Актуальность темы.
Лечение и уход за ранами остается одной из важных проблем современной медицины. Больные, имеющие раны различного генеза, составляют значительную часть пациентов хирургических стационаров. Отоларингологам, как и врачам других специальностей, довольно часто приходится иметь дело с лечением не только классических ран, но и с особенными ранами, к которым относятся перфорация барабанной перепонки, послеоперационная трепанационная рана височной кости
Пока еще не все известно о тонких механизмах процесса заживления ран, что создает трудности при лечении, особенно в случае нарушения динамики заживления раны. Затяжное заживление послеоперационных ран среднего уха и часто встречающаяся необходимость удаления грануляций из послеоперационной полости является весьма актуальной проблемой современной отохирургии. Направлениями в решении этой проблемы являются: раннее хирургическое вмешательство при выявлении костной деструкции, тщательное (под микроскопом) и, по возможности, полное удаление кариозной кости, а также разработка принципиально нового, более эффективного, патофизиологически обоснованного послеоперационного метода лечения хирургической раны височной кости.
Обширные скальпированные раны лицевой области, когда не возможно наложить хирургический шов, чаще всего лечатся, как инфицированные раны. При ранах лицевой области одним из важных показателей эффективности лечения должен быть положительный пластический и эстетический результат (отсутствие рубцов, деформаций, пигментации). Клинический опыт, свидетельствует, что даже самые изначально эффективные лекарственные средства в процессе их применения нередко вызывают нежелательные побочные эффекты, а известные способы заживления скальпированных ран лица часто не приводят к необходимому результату.
В отоларингологии своеобразной и распространенной патологией являются перфорации. Если история лечения классических ран уходит своими корнями в далекое прошлое, то лечение таких ран как перфорация барабанной перепонки, берет свое начало с середины прошлого столетия. Одной из важных задач реконструктивной лор-хирургии является восстановление целостности анатомических образований. За последние 50 лет предложено множество способов восстановления целостности барабанной перепонки. Основные причины неудачных исходов тимпанопластики связаны с чрезвычайно плохими условиями питания трансплантата, свободно натянутого над перфорацией, возможностью его смещения или западения, что приводит к нарушению процессов приживления, вплоть до некроза и отторжения, или к образованию сращений и, наконец, опасностью нагноения трансплантата. Клиницистами оториноларингологами предложено множество различных способов мирингопластики. Достоинства и недостатки этих методов общеизвестны. По данным различных авторов их применение обеспечивает благополучное приживление в 43-98% случаев. Успех операции зависит не столько от тканевой принадлежности трансплантата, сколько от характера патологического процесса (размер и расположение перфорации, состояния тканей и т.д.).
Таким образом, современное состояние проблемы реконструктивно-восстановительной хирургии скальпированных ран лицевой области и анатомических образований лор органов, определяет настоятельную необходимость как дальнейшего поиска более адекватных в биологическом, физическом и функциональном отношении материалов, так и совершенствования способов лечения специфических ран лор органов для достижения более стойких морфологических и функциональных результатов.
В последнее десятилетие, благодаря научно-техническому прогрессу в мировой и отечественной трансплантологии произошли значительные изменения, что позволяет по-новому рассматривать проблему лечения раневой поверхности. Российскими учеными был предложен оригинальный и эффективный метод лечения больных с ожоговыми повреждениями тканей культурой аллофибробластов человека. Метод позволяет восстанавливать пораженные участки кожи различной площади. Учитывая, то, что фибробласты являются основными клетками- участниками репаративного процесса ответственными за синтез молекул внеклеточного вещества и в целом за заживление любых ран, в том числе и перфорации барабанной перепонки, костной раны височной кости, в ЛОР-клинике РГМУ им. Н.И. Пирогова, под руководством член-корр. РАМН, профессора Пальчуна В.Т., используя научный потенциал лаборатории культивирования тканей института хирургии им. А.В. Вишневского, впервые в оториноларингологии, в качестве материала для лечения ран была предложена культура аллофибробластов человека.
Сказанное обусловило выбор темы и план проведения исследования.
Цель работы составили клиническое обоснование, разработка и апробация нового способа лечения ран, встречающихся в отоларингологии с использованием культуры аллофибробластов человека.
Для достижения указанной цели предстояло решить следующие основные задачи:
- Обосновать выбор аллофибробластов, как пластического и репаративного материала при лечении ран в оториноларингологии
- Разработать методику и показания трансплантации культуры аллофибробластов человека при лечении ран в оториноларингологии
- Изучить особенности патоморфологического процесса у больных после трансплантации культуры аллофибробластов человека на исследуемые раны
- Провести сравнительный анализ результатов применения аллофибробластов с традиционными способами лечения ран
Научная новизна.
- впервые в оториноларингологии для лечения различных ран применены культивируемые аллофибробласты человека, стимулирующие процессы направленной регенерации поврежденных тканей
- Научно обоснован способ лечения ран, встречающихся в оториноларингологии с помощью новой технологии культивирования клеток.
- Определены морфологические особенности заживления ран при использовании культивированных аллофибробластов человека
Практическая значимость работы.
Разработанный способ восстановления ран, встречающихся в отоларингологии, основанный на трансплантации культуры аллофибробластов человека, может быть рекомендован в работе городских, районных, областных ЛОР-отделений.
Определены показания и противопоказания для применения культуры аллофибробластов человека при хирургическом лечении больных с перфорацией барабанной перепонки, со скальпированными ранами лица, и с хирургическими ранами височной кости.
Сравнительный анализ отдаленных результатов лечения больных с различными ранами, без использования культуры аллофибробластов человека и с их использованием показал более высокую эффективность последнего метода.
Апробация работы.
Материалы диссертационной работы доложены и обсуждены на Всероссийской конференции по клеточным технологиям в Самаре в 2004г., и Российской конференции отоларингологов Москве в 2005 и 2006, 2007 гг. Тема обсуждалась на совместной научно-практической конференции коллективов кафедры ЛОР-болезней РГМУ, ЛОР-отделения 1-ой Московской ГКБ им. Н.И. Пирогова и сотрудников кафедры патанатомии п/ф РГМУ 16.10.2007.
Реализация результатов работы.
Материалы диссертации внедрены в работу ЛОР-отделения 1-ой ГКБ им. Н.И. Пирогова, в учебный процесс кафедры ЛОР-болезней РГМУ, включены в программу преподавания на факультете усовершенствования врачей, получено решение о выдаче патента на изобретение, приоритет установлен с 2000 г. Патент РФ № 2165765. По теме диссертации опубликовано 22 работы, в том числе выпущено пособие для практикующих врачей.
Объем и структура диссертации.
Диссертация изложена на 245 страницах машинописного текста, состоит из введения, 9 глав, заключения, выводов, практических рекомендаций и списка литературы, включающего 160 источников (из них 83 отечественных и 117 иностранных авторов). Работа иллюстрирована 186 рисунками. Результаты клинического исследования отражены в 45 таблицах.
Основные положения, выносимые на защиту.
- Трансплантация культуры аллофибробластов человека ускоряет регенерацию ран, встречающихся в отоларингологии
- Применение культивированных аллофибробластов существенно повышает клинико-морфологический результат при заживлении перфорации барабанной перепонки, скальпированных ран лица, и хирургических ран височной кости.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
С 2001 по 2006 год в ЛОР-клинике РГМУ было проведено обследование и лечение 268 больных (106 женщин, 162 мужчины) в возрасте от 10 до 72 лет с нарушением целостности тканей лор-органов. Из них с повреждением барабанной перепонки 197 больных, состояние после трепанации височной - 33 больных, раны лицевой области – 38 больных (Таб. 1). Диагноз поставлен на основании полного клинического обследования. Возрастной состав больных представлен в таблице 1
Таблица 1
Распределение больных по локализации раневого процесса (n=268)
| Диагноз заболевания | Пол больных | Всего | ||||
| мужчины | женщины | абсолютное число | % | |||
| абсолютное число | % | абсолютное число | % | |||
| Перфорация барабанной перепонки | 105 | 53.3 | 92 | 46.7 | 197 | 100 |
| Состояние после операции на височной кости | 25 | 75.8 | 8 | 24.2 | 33 | 100 |
| Раны лицевой области | 32 | 84.2 | 6 | 15.8 | 38 | 100 |
| Итого | 162 | 60.4 | 106 | 39.6 | 268 | 100 |
В зависимости от методов лечения больные в каждой нозологической категории были разделены на группы.
Для заживления перфорации барабанной перепонки применялись следующие методы лечения: 1-я группа - 87 пациентов. Этим больным на перфорированную барабанную перепонку осуществлена трансплантация культивированных аллофибробластов человека, с фиксацией современной интерактивной повязкой Tampograss. 2-я группа - 51 пациент, которым на перфорированную барабанную перепонку осуществлена трансплантация куриного амниона. 3-я группа - 59 больных. Этим больным, для объективной оценки результатов исследования на перфорированную барабанную перепонку укладывалась только синтетическая подложка с коллагеном без аллофибробластов (рис.1).
 Рис. 1
Рис. 1
При исследовании заживления трепанационной раны височной кости 17 пациентам 1 клинической группы по мере развития грануляционной ткани после операции трансплантировали культуру аллофибробластов человека. 16 пациентам 2 клинической группы в послеоперационную полость, для объективной оценки результатов исследования вводилась только синтетическая подложка с коллагеном без аллофибробластов (рис.2).
 Рис. 2
Рис. 2
У больных с ранами лицевой области применялись следующие методы лечения: 1-я группа - 15 пациентов. Этим больным на рану лицевой области осуществлена трансплантация культивированных аллофибробластов человека, с фиксацией современной интерактивной повязки Grasolind в 1 и 2 фазу раневого процесса. 2-я группа - 12 пациентов, которым проводилось традиционное лечение – использование 3% перекиси водорода, марлевых повязок с мазью левомиколь. У этих пациентов мы наблюдали за возможностью самовосстановления эпидермального слоя без дополнительного хирургического лечения. 3-я группа - 11 больных. Этим больным, для объективной оценки результатов исследования на рану укладывалась только синтетическая подложка с коллагеном без аллофибробластов (рис.3).
 Рис. 3
Рис. 3
Во всех группах были представлены пациенты различного возраста, пола, с различной локализацией, глубиной и размером раны. возникшие в результате разных механизмов, отличающиеся по локализации и размеру.
Больные всех групп находились на динамическом наблюдении. Особое внимание уделялось морфологической и цитологической оценке ран в ходе лечения. Морфологическое исследование включало изучение клеток раневой поверхности методом мазков-отпечатков и исследование биоптатов ран.
Цитологическое исследование производили периодически в соответствии с этапами лечения и заживления ран: до трансплантации культивированных аллофибробластов человека, после снятия пленочных матриксов, на которых переносились клеточные культуры, в процессе заживления раны на 2-е 4-е 7-е сутки после трансплантации аллофибробластов в сравнении с участками, где не выполнялась трансплантация аллофибробластов.
Исследуемые раны пациентов подвергались фото- и видеосъемке. Больным проводись следующие общеклинические исследования: общий клинический анализ крови; RW и ВИЧ; группа крови, RH; рентгенография костей свода черепа. Больные консультированы по показаниям терапевтом, стоматологом, нейрохирургом, окулистом. В группе больных с поражением звукопроводящей системы осуществлялся аудиологический контроль как до, так и во время и после лечения на протяжении 20 месяцев. Специальное обследование включало в себя следующее: отоскопию; микроотоскопию с использованием воронки Зигле и операционного микроскопа фирмы "Karl Zeiss"; зондирование барабанной полости, аттика, aditus ad antrum, задней стенки наружного слухового прохода; исследование проходимости слуховой трубы; исследования вентиляционной функции слуховой трубы. Рентгенологическое исследование - в проекциях Шюллера, Майера, а при показаниях - в проекции Стенверса. Для выяснения функции слухового анализатора использовали следующие методы: определение расстояния восприятия шепотной и разговорной речи; камертональное исследования в форме опытов Ринне, Вебера, и Швабаха камертонами С128, С250; тональную пороговую аудиометрию. Исследование функции слухового анализатора проводились акуметрически и аудиометрически в звукоизолированной камере фонового шума менее 30 дБ. Пороговую аудиометрию проводили на приборе МА-31. Диапазон исследуемых частот при пороговой аудиометрии при воздушном звукопроведении включал частоты от 125 Гц до 10000 Гц, при костном звукопроведении включал частоты от 125 Гц до 8000 Гц. Тимпанометрию производили на импедансометре ZA-27 (Дания) при частоте зондирующего тона 220 Гц. Исследование проводилось через 1,5-3-6-12 месяцев после операции.
Расчет статистических значений, критерия Стьюдента, доверительных интервалов для зависимых и независимых выборок по различным группам обследованных проводили на ЭВМ методами вариационной статистики с помощью пакета прикладных биометрических программ. В табличных данных представлено, в основном, сравнение полученных значений зависимых и независимых выборок, частоты возникновения положительных морфологических результатов для Р < 0,05.
При поиске новых методов оптимального лечения вышеперечисленных ран встречающихся в оториноларингологии наше внимание остановилось на работе по культивированию аллофибробластов, которые с успехом применяются при лечении больных с ожоговыми ранами. Уникальные свойства и возможности культивируемых аллофибробластов по регенерации тканей, давали надежду на успешное внедрение их в оториноларингологическую практику, в том числе и в условиях нашего исследования.
Метод культивирования трансплантата из аллофибробластов человека.
Для получения первичной культуры фибробластов используются фрагменты расщепленного кожного лоскута, полученные от больных во время операции дермопластики, а также из дермы плодов человека. Следует отметить большую эффективность трансплантации при использовании фибробластов из дермы плодов человека, которые обладают высокой пролиферативной способностью. Перед началом культивирования обязательно проводится их бактериологическое и вирусологическое тестирование – ставится реакция Вассермана, определяется наличие антител к вирусам гепатита и СПИДа.
Забор материала осуществляется стерильно, после чего он помещается среду ИГЛа, содержащую 1000 ед./мл пенициллина, 0,1 г/мл стрептомицина и 25 мкг/мл фунгезона, и доставляется в лабораторию. Первичную культуру фибробластов получают методом органного культивирования. Культивирование фибробластов на всех этапах ведется в среде ИГЛа (Институт полиомиелита РАМН) с добавлением 10% эмбриональной телячьей сыворотки и 2% глютамина CO2-инкубаторе (Flow, Великобритания) на пластмассовой посуде фирмы «Costar” (США). Смена среды осуществляется каждые 3-5 дней. После получения островкового роста, культура клеток подвергается пассированию, для чего используется трипсин-EDITA (Flow, Великобритания). Плотность посева клеток при получении культуры и клеток фибробластов человека составляет 20х103 см2 поверхности и остается постоянной на всех этапах.
Основные этапы методики получения трансплантата из культивируемых аллофибробластов человека представлены на рис.4
Основные этапы получения трансплантата культивируемых аллофибробластов
ФРАГМЕНТ ДЕРМАЛЬНОГО ЛОСКУТА
ФРАГМЕНТАЦИЯ
ПЕРВИЧНАЯ КУЛЬТУРА ФИБРОБЛАСТОВ
микробиологический контроль морфологический контроль
ПАССИРОВАНИЕ
СУБКУЛЬТИВИРОВАНИЕ ФИБРОБЛАСТОВ
ТРАНСПЛАНТАЦИЯ КЛЕТОК НА РАНУ
Рис. 4
Морфологическая характеристика трансплантируемых фибробластов.
Динамическая морфофункциональная оценка культур фибробластов показывает, что через 2 часа после начала субкультивирования, культура фибробластов состоит в основном из округлых клеток, интенсивно окрашиваемых толуидиновым синим.
При электронной микроскопии основной тип клеток через 2 часа после начала культивирования представлен небольшими округлыми, реже овальной формы фибробластами. Ядро таких клеток характеризуется округлой формой и занимает почти весь объем клетки. К исходу первых суток культивирования изменяется соотношение типов клеток культуры, на этом этапе преобладают клетки веретеновидной формы с хорошо дифференцируемым ядром. К исходу первых суток развития культуры в фибробластах происходит накопление фибронектина, также отмечается преобладание клеток веретеновидной и звездчатой формы, в которых цитоплазма занимает больший объем клетки. На третьи сутки культивирования плотность посева уже составляет не менее 20000 клеток на 1 см2 поверхности, культура фибробластов характеризуется конфлюэнтным ростом. Практически все клетки культуры представлены веретеновидными или звездчатыми формами. К концу третьих суток большинство клеток характеризуется вытянутой формой, меньшим по сравнению с предыдущими сроками наблюдения, объемом цитоплазмы. Пластинчатый комплекс клеток выглядит значительно редуцированным. Экстрацеллюлярный матрикс становится еще более насыщенным хлопьевидным материалом и коллагеновыми микрофибриллами и волокнами. Таким образом, структурно-функциональный анализ культуры фибробластов человека на этапе четвертого субкультивирования показывает их динамику, и обуславливает то, что наиболее благоприятными сроками использования культуры аллофибробластов для изготовления трансплантатов являются третьи сутки культивирования.
Методика трансплантации культивированных аллофибробластов человека
поперечный разрез трансплантата
монослой аллофибробластов
монослой коллагена
полимерная пленка
толщиной 0,1 мм
Рис. 5
- Культура аллофибробластов нанесена на тонкую, прозрачную полимерную пленку. Это обстоятельство позволяет варьировать размерами трансплантата и доставлять клетки непосредственно к ране.
- Фибробласты фиксируются на пленку за счет монослоя коллагена, обладающего хорошим адгезивным эффектом. Это позволяет обеспечить стабильную позицию трансплантата на ране без использования клеевых композиций.
- Непосредственный контакт фибробластов с питающим ложем обеспечивается за счет гранулирующей поверхности раны или деэпителизированного участка барабанной перепонки.
Фибробласты нанесены с обеих сторон полимерной пленки, что позволяет укладывать пленку любой стороной к ране, барабанной перепонке.
Методика трансплантации культивированных аллофибробластов человека на перфорированную барабанную перепонку
Трансплантацию фибробластов выполняли следующим образом: анестезировали слуховой проход и барабанную перепонку 1% раствором ультрокаина в типичных точках. Затем иссекали рубцово-измененные края перфорации БП, деэпидермизировали ее наружную поверхность по окружности перфорации на расстоянии до 5 мм от краев последней или субтотально. Зона деэпителизации зависела от состояния перепонки, размера перфорации, наличия сосудов, механизма образования перфорации. Вырезали кусочек пленки с фибробластами по форме приближающийся к очертаниям перфорации, превышающий размеры дефекта БП. Трансплантат плотно фиксировали к БП так, чтобы он несколько вдавался в просвет перфорации. При этом большая часть трансплантата находилась на поверхности неповрежденной БП, а часть закрывала перфорацию. Благодаря пленке на перфорации слух улучшался во время операции, а за счет пленки с клетками, плотно прилегающей к деэпителизированному слою, происходила трансплантация фибробластов на края перфорации. Пленку с фибробластами фиксировали современной интерактивной повязкой Tampograss (Paul Hartman). Тампон удаляли на 3 сутки после трансплантации клеток. Полимерную пленку-носитель, на которую были нанесены аллофибробласты, не удаляли (рис. 6-8)
Трансплантация аллофибробластов на перфорированную барабанную перепонку

Рисунок 6. Перфорация барабанной перепонки
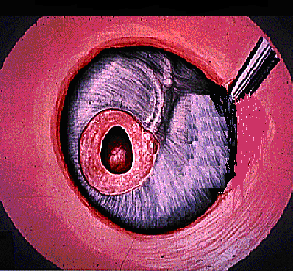
Рисунок 7. Деэпителизация наружного слоя барабанной перепонки

![]()
турунда tampogrss
Рисунок 8 Трансплантация аллофибробластов на синтетической подложке, с последующей тампонадой слух. прохода турундой Tampograss
Методика трансплантации культивированных аллофибробластов человека на рану лицевой области
Культуру аллофибробластов человека получали в институте хирургии им. А.В. Вишневского РАМН. Культура клеток выращивалась в лаборатории культивирования тканей по отработанной методике. Срок выращивания монослойной культуры составлял 3-е суток. Трансплантаты культивированных аллофибробластов доставляли в клинику в день операции. Перевозка клеток осуществлялась на мембране (матриксе), помещенной в пластиковые чашки Петри со средой ИГЛа.
Трансплантация на раневую поверхность культивированных аллофибробластов человека осуществлялась на этих же матриксах и выполнялась в условиях операционной. Матриксы с культивированными аллофибробластами извлекали из чашек Петри пинцетом и накладывали на раневую поверхность. При этом матриксы плотно располагали один к другому. Раневую поверхность после наложения синтетических матриксов с аллофибробластами закрывали интерактивной повязкой Grasolind (Paul Hartman) и лейкопластырем.
В зависимости от вида раны трансплантация культуры аллофибробластов человека осуществлялась одномоментно с некрэтомией или отсрочено, через несколько дней. После некрэктомии матриксы с монокультурой аллофибробластов трансплантировались на дермальную поверхность раны сразу после иссечения и выполнения гемостаза. Удаление матриксов независимо от вида очищения раны производилось в строго установленные сроки через 2-3 суток после трансплантации ( рисунки 9-11).
Трансплантация аллофибробластов на скальпированную рану носа

Рис.9. Скальпированная рана носа

Рис. 10. Трансплантация аллофибробластов на полимерном носителе

Рис. 11 Восстановление тканей после трансплантации аллофибробластов
Методика трансплантации культивированных аллофибробластов человека на послеоперационную рану височной кости
Трансплантацию фибробластов осуществляли через 7 суток после выполнения операции на височной кости. Это связано с тем, что к этому сроку происходит полное прекращение гемморрагических выделений из раны, и начинается пролиферативная фаза репаративного процесса (рис. 12-16). Перед началом трансплантации проводили тщательный туалет послеоперационной полости, затем вырезали кусочек пленки-матрикса с фибробластами произвольной формы соответствующий размерам трепанационной раны. Пинцетом укладывали матрикс с трансплантатом на дно хирургической полости. За счет пленки с клетками, плотно прилегающей к грануляционному слою послеоперационной полости, происходила трансплантация фибробластов. Пленку с фибробластами фиксировали турундой Tampograss (Paul Hartman), путем плотного тампонирования послеоперационной раны. Тампон удаляли на 3 сутки после трансплантации клеток. Полимерную пленку-носитель, на которую были нанесены аллофибробласты, удаляли на 7 сутки после трансплантации.
В послеоперационном периоде для улучшения регенерации клеток, с целью активизации обменных процессов в тканях, проводилось лечение инъекциями АТФ по 2,0 внутримышечно, кокарбоксилазы по 50 мг, витаминотерапия (мильгамма по 1 мл. через 1 сутки в/м). Проводилась адекватная антибиотикотерапия, соответствующая состоянию больного и объему проведенной операции. Местное лечение было направлено на удаление корок, полость обрабатывалась мазью солкосерил. Для уменьшения отека слухового прохода и послеоперационной полости проводилась тампонада турундами с мазью гиоксизон.
Трансплантация аллофибробластов на послеоперационную полость сосцевидного отростка


Рисунок 12 Рисунок 13.
Сосцевидный отросток Сосцевидный отросток
во время операции после хирургического вмешательства


Рисунок 14 Рисунок 15
Появление грануляций Трансплантация аллофибробластов на
в сосцевидном отростке полимерном носителе в область раны

Рисунок 16 Эпидермизация послеоперационной раны височной кости
Современные интерактивные повязки, используемые при трансплантации аллофибробластов человека
Современная повязка Grasolind neutral (Paul Hartman) состоит из крупноячеистой хлопчатобумажной ткани, пропитанной не содержащей фармпрепаратов, индифферентной для кожи мазевой массой. Поэтому эта повязка особенно рекомендуется для лечения ран у пациентов с чувствительной кожей и аллергией на медикаменты, а также при длительном лечении плохо заживающих ран. Grasolind neutral, во всех фазах заживления раны, делает поверхность и края раны эластичными, и предохраняет ее от высыхания. При этом повязка стимулирует процессы ангиогенеза и эпителизации. Мазевая повязка не приклеивается к ране. Смена повязки происходит безболезненно. Молодая грануляционная ткань и вновь образованный эпителий при этом не раздражаются. Благодаря крупноячеистой хлопчатобумажной ткани обеспечивается доступ кислорода и хорошая вентиляция. Экссудат беспрепятственно удаляется. Кроме того, хлопчатобумажную ткань можно легко разрезать на небольшие салфетки и использовать их, например, в качестве надежных матриксов для расщепленных кожных трансплантатов. Grasolind neutral при длительном лечении не вызывает сенсибилизацию и аллергической реакции. С другой стороны в случае необходимости в сочетании с повязкой можно применять лекарственные средства.
Grasolind neutral используют для особо щадящего ухода и сохранения эластичности у поверхности раны, например, при ссадинах и ушибленных ранах, при ожогах, прижигании химическими веществами, лучевых поражениях и т.д. Идеален для лечения ран у пациентов с повышенной реакцией на медикаменты, а также при длительном лечении ран с тенденцией к плохому заживлению, так как при этом часто существует опасность сенсибилизации В некоторых случаях, когда необходимо длительное наложение повязки на рану, например, при трансплантации кожи, мазевая масса рассасывается и тогда повязка приклеивается к ране. Это проблема легко решается наложением новой повязки сверху. Рисунок 17.

Рисунок 17. Современная повязка Grasolind neutral
Марлевая турунда Tampograss (Paul Hartman)-атравматичная мазевая повязка из гидрофобного полиэфирного материала, пропитанного самоэмульгирующейся мазевой массой, проницаема для воздуха и секрета, не приклеивается к ране, не оставляет остатков на ране, не имеет сенсибилизирующего действия, используется для фиксации матриксов при трансплантации клеток на барабанную перепонку, послеоперационную рану височной кости, перфорацию перегородки носа. При удалении не приклеивается к трансплантатам, тем самым не вызывает процесс повреждения молодых клеток. Рисунок 18.

Рисунок 18. Марлевая турунда Tampograss (Paul Hartman).Надежный фиксатор матриксов с аллофибробластами.
Синтетическая подложка Карбоксил-II
С целью объективной оценки эффективности трансплантации аллофибробластов в контрольных группах на тот или иной вид раны производилась укладывание синтетической подложки Карбоксил-II без напыленных фибробластов. Данная синтетическая пленка представляет собой крупноячеистый кремнеорганический полимер полисилоксан-поликарбонат (разрешение Минздрава) со следующими свойствами:
- прозрачен, бесцветен
- толщина 40-50 мкм
- повторяет рельеф раны
- гидрофобен
- покрыт 0.25% раствором коллагена
- влагопроницаем
- газопроницаем
- микроперфорирован
- подвержен стерилизации ( рис.19-20).
Рисунок 19
Поперечный разрез синтетической подложки Карбоксил-II
монослой коллагена
полимерная пленка
Формула
 Рисунок 20
Рисунок 20
Результаты исследования и их обсуждение
Заживление дефекта барабанной перепонки
Трансплантация аллофибробластов человека на поврежденную БП осуществлена 87 больным
Положительный морфологический результат после трансплантации аллофибробластов (ликвидация дефекта БП) отмечен у 61 больных (70.1%). Возраст излечившихся больных составил от 10 до 50 лет, из них 43 женщины и 35 мужчин. После использования куриного амниона положительный морфологический результат отмечен у 28 больных (47.5%). Возраст излечившихся больных составил от 15 до 47 лет, из них 19 женщин и 11 мужчин. После использования синтетической подложки положительный морфологический результат отмечен у 31 больного (60.8%). Возраст излечившихся больных составил от 17 до 43 лет, из них 17 женщин и 14 мужчин.
Сравнительная оценка результатов лечения после мирингопластики
 Рисунок 21.
Рисунок 21.
Эффективность лечения после трансплантации аллофибробластов оказалась на 22.6% выше использования куриного амниона и на 9.3% выше использования синтетической подложки.
Таблица 2
Эффективность методов лечения в зависимости от возраста пациентов
| возраст | Полное заживление % | Уменьшение размеров перфорации % | Сохранение размеров перфорации % | ||||||
| Фибробласты | амнион | подложка | Фибробласты | амнион | подложка | Фибробласты | амнион | подложка | |
| 10-20 | 92.3 | 61.1 | 56.3 | 7.7 | 38.9 | 43.7 | - | - | - |
| 20-30 | 70 | 45.4 | 40 | 20 | 36.4 | 40 | 10 | 18.2 | 20 |
| 30-40 | 54.8 | 47.6 | 41.2 | 16.1 | 28.6 | 35.3 | 29.1 | 23.8 | 29.4 |
| 40-50 | 84.6 | 22.2 | 25 | - | 11.1 | 25 | 15.4 | 66.6 | 50 |
Нами установлено, что во всех возрастных группах эффективность лечения после трансплантации аллофибробластов человека выше чем в других группах, особенно в детском и подростковом возрасте: на 31.2% выше чем при использовании амниона и на 36% синтетической подложки
Таблица 3
Сравнительные результаты методов лечения в зависимости от причины перфорации
| Причина перфорации | Положительный результат | Отрицательный результат | ||||
| Фибробласты | амнион | подложка | Фибробласты | амнион | подложка | |
| баротравма | 95 | 85 | 94.1 | - | 15 | 5.6 |
| Механическое повреждение | 80 | 66.6 | 83.3 | - | 33.4 | 16.7 |
| Термическое повреждение | 66.7 | - | 33.3 | 33.3 | 100 | 66.7 |
| Минно-взрывная травма | 100 | 50 | 66.7 | - | 50 | 33.3 |
| Хронический отит | 48.7 | 5 | 6.7 | 51.3 | 95 | 93.3 |
Результаты нашего исследования свидетельствуют о том, что при лечении больных с барометрическим или механическим повреждением барабанных перепонок во всех группах достигнут высокий результат, однако при лечении больных с термическим повреждением перепонки эффективность трансплантации аллофибробластов оказалась на 33.4% выше чем после использования только синтетической подложки без клеток. В группе где использовался куриный амнион эффект вообще не был достигнут. При лечении минно-взрывного повреждения перепонки эффективность трансплантации аллофибробластов оказалась на 50% выше чем после использования амниона и на 33.3% чем после применения синтетической подложки
Таблица 3
Сравнительная оценка методов лечения в зависимости от площади перфорации барабанной перепонки при минно-взрывной травме
| Площадь перфорации в % | Положительный результат % | Отрицательный результат % | ||||
| Фибробласты | амнион | подложка | Фибробласты | амнион | подложка | |
| 10-25 | 100 | - | - | - | - | - |
| 25-50 | 100 | 50 | 100 | - | 50 | - |
| >50 | 75 | 50 | 50 | 25 | 50 | 50 |
Таблица 4
Сравнительная оценка методов лечения в зависимости от площади перфорации барабанной перепонки при хронической перфорации
| Площадь перфорации в % | Положительный результат % | Отрицательный результат % | ||||
| Фибробласты | амнион | подложка | Фибробласты | амнион | подложка | |
| <10 | 71.4 | 11.1 | - | 28.6 | 88.9 | 100 |
| 10-25 | 36.4 | - | 20 | 63.6 | 100 | 80 |
| 25-50 | 44.4 | - | - | 55.6 | 100 | 100 |
| >50 | - | - | - | 100 | 100 | 100 |
Нами установлено, что при восстановлении целостности барабанной перепонки методом трансплантации аллофибробластов, отмечался высокий процент заживляемости при различной площади перфорации, но при заживлении хронической стойкой перфорации мы отметили, что хорошо поддавались восстановлению перепонки с площадью поражения менее одного квадранта. При такой площади поражения положительный результат в лечении достигнут у 71.4% больных. Наше исследование выявило, что при минно-взрывной травме эффективность трансплантации аллофибробластов человека на перфорацию более площади перепонки оказалась на 25% выше чем в 2 других группах, а при лечении стойкой хронической перфорации при перфорациях более площади перепонки эффективность метода оказалась 44.4%, в то время, как в контрольных группах у 100% пациентов наблюдался отрицательный результат лечения.
Таблица 5
Развитие среднего гнойного отита в исследуемых группах %
| Причина перфорации | Группы больных | ||
| Фибробласты | амнион | подложка | |
| баротравма | - | 5 | - |
| Механическое повреждение | - | 16.7 | - |
| Термическое повреждение | 33.3 | 33.3 | 33.3 |
| Минновзрывная травма | - | 25 | 33.3 |
| Хронический отит | 12.8 | 30 | 30 |
Проведенное нами исследование выявило, что вероятность развития среднего гнойного отита после мирингопластики куриным амнионом, или применения синтетической подложки, при лечении минновзрывной травмы составила 25% и 33.3% соответственно. После трансплантации аллофибробластов человека мы не наблюдали развития среднего отита ни в одном из клинических случаев при всех видах травм перепонки, за исключением лечения больных с гнойным отитом. При лечении стойкой хронической перфорации средний гнойный отит развивался у 12.8% больных, что на 17.2% ниже чем в 2 других группах. Рис.26

Рис. 26
Нами выявлено, что средний срок восстановления травмированной БП после трансплантации аллофибробластов при различной площади повреждения составляет от 3 до 21 дней, что укладывается в сроки стационарного лечения, при минновзрывном механизме травмы сроки восстановления увеличиваются, а при заживлении стойкой хронической перфорации сроки восстановления перепонки растягиваются на несколько месяцев ( рис. 27).
.
Рис. 27
При использовании куриного амниона средний срок восстановления травмированной БП при различной площади повреждения составляет от 2 до 9 недель, при минновзрывном механизме травмы сроки восстановления увеличиваются, а вероятность заживления стойкой хронической перфорации практически равна нулю (рис.28).

Рис.28
После применения синтетической подложки Карбоксил средний срок восстановления травмированной БП при различной площади повреждения составляет от 2 до 9 недель, при минновзрывном механизме травмы сроки восстановления увеличиваются, а заживление стойкой хронической перфорации произошло у одного больного, а срок заживления перепонки составил 87 суток.
После трансплантации аллофибробластов на БП, пострадавшую в результате травмы, либо минновзрывного воздействия, восстановившаяся тимпанальная мембрана при осмотре под микроскопом (х20), имела окраску, не отличающуюся от цвета нормальной перепонки. Отчетливо была видна сеть кровеносных сосудов, и нежные рубцовые изменения на месте сращения дефекта. БП была хорошо подвижной, с четким световым рефлексом. После трансплантации аллофибробластов на БП, поврежденную хроническим воспалением, восстановившаяся тимпанальная мембрана при осмотре под микроскопом (х20), имела окраску, несколько отличающуюся от цвета нормальной перепонки. Кровеносных сосудов было мало, либо они не идентифицировались, определялись старые петрификаты, в месте перфорации также появлялся петрификат. Восстановленная перепонка была подвижной, световoй конус в некоторых случаях был укорочен.
Отрицательный морфологический результат после трансплантации аллофибробластов (сохранение дефекта БП) отмечен у 26 больных (29.9%), в возрасте от 15 до 46 лет. Из них у 19 женщин и 7 мужчин. У 2 (33.3%) больных сохранился дефект после термической травмы (окалина), у 1 (5%) после барометрической травмы и 3 (20%) после механической травмы (травма острым предметом). У 20 (51.3%) больных с хронической стойкой перфорацией сохранился дефект барабанной перепонки. Причем у 2 (5.1%) больных в возрасте от 20-30 лет и 4 (10.2%) больных в возрасте от 30-40 лет края перфорации сблизились, а площадь уменьшилась. У 3 (7.6%) пациентов в возрасте 20-30 лет, 10 (25.6%) пациентов возрасте 30-40 лет и 1 (2.5%) больного 43 лет площадь перфорации не изменилась. В отдаленном периоде после лечения (через 12 месяцев) был осмотрен 71 пациент. Из них 56 больных с закрывшейся перфорацией после лечения и 15 больных с сохранившимся дефектом БП. У всех больных с зажившим дефектом БП при отоскопии перепонка была серого цвета с сохраненным цветовым конусом, подвижная при пробе Вальсальва, у 19 больных определялись петрификаты в области посттравматической перфорации. У 15 больных с сохранившейся перфорацией оставшаяся часть БП приобрела мутно-серый цвет, края дефекта уплотнились. Больным с сохранившимся дефектом БП после произведенной трансплантации аллофибробластов человека, была произведена тимпанопластика хрящом ушной раковины в плановом порядке.
Функциональные результаты.
У большинства больных до операции по трансплантации аллофибробластов человека отмечалось снижение слуха, выраженное в различной степени:
- шепотную речь с расстояния не более 1 м воспринимало 21 больной (24.1%), с расстояния 1-3 м - 41 больной (47.1%), с расстояния более 3 м - 25 больных (28.7%);
- разговорную речь с расстояния не более 3 м воспринимали 12 больных (13.7%), с расстояния 3-6 м - 34 больных (39%), с расстояния более 6 м - 36 больных (41.3%);
- пороги слуха по воздушной проводимости у 62 больных (71.2%) превышали 15 дБ, из них у 25 больного (28.7%) были выше 20 дБ;
- КВР у 54 больных (62%) превышал 20 дБ.
В ближайшем послеоперационном периоде у 59 больных (67.8%) отмечено восприятие разговорной речи с расстояния более 6 м, пороги слуха по воздушной проводимости до 10 дБ, КВР до 15 дБ. У 57 больных (65.5%) отмечена практически нормальная слуховая функция (восприятие шепотной речи с расстояния более 3 м, разговорной речи с расстояния более 6 м, пороги слуха по воздушной проводимости 10 дБ, КВР до 10 дБ). У 29 больных (33.3%) отмечена тугоухость, выраженная в различной степени: у 17 больных (58.6%) восприятие разговорной речи с расстояния 4-6 м, пороги слуха по воздушной проводимости 15-20 дБ, у 9 больных (31%) восприятие разговорной речи с расстояния до 3 м, пороги слуха по воздушной проводимости 20-30 дБ. В отдаленном периоде обследовано 45 больных. У 39 больных (86.6%) с восстановившейся БП, отмечена практически нормальная слуховая функция, у 4 больных (8.9%) восприятие разговорной речи с расстояния 5-6 м, пороги слуха по воздушной проводимости 20 дБ, у 1 больного (2.2%) восприятие разговорной речи с расстояния до 3 м, пороги слуха по воздушной проводимости 30 дБ.Динамика слуховой функции у больных, после трансплантации аллофибробластов человека с полным восстановлением барабанной перепонки представлена на следующих аудиограммах и тимпанограммах (рис 29-32).
Аудиограммы и тимпанограммы больной В.
Диагноз: посттравматическая перфорация левой БП.
Аудиограмма больной с травмой Аудиограмма больной через
барабанной перепонки. один месяц после трансплантации
культуры аллофибробластов человека.
Рис.29 Рис. 30
Тимпанограмма здорового уха. Рис 31 Тимпанограмма через шесть
месяцев после трансплантации
культуры аллофибробластов.
Рис.32
Таким образом, полученные после трансплантации аудиограммы и тимпанограммы типа "А", соответствующие аудиограммам и тимпанограммам со стороны здорового уха, позволили сделать вывод, что акустические свойства восстановленной тимпано-оссикулярной системы (при интактной цепи слуховых косточек) соответствовали норме.
Микрофлора раневой поверхности
Перед лечением нами оценивались показатели бактериальной обсемененности раны. При первоначальном взятии материала были выделены различные штаммы.

