Анализ динамики накопления контрастного вещества при многофазной магнитно-резонансной томографии в диагностике метастатических поражений печени
На правах рукописи
САВЧЕНКОВ
Юрий Николаевич
АНАЛИЗ ДИНАМИКИ НАКОПЛЕНИЯ КОНТРАСТНОГО ВЕЩЕСТВА
ПРИ МНОГОФАЗНОЙ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ
В ДИАГНОСТИКЕ МЕТАСТАТИЧЕСКИХ ПОРАЖЕНИЙ ПЕЧЕНИ
14.01.13 – лучевая диагностика, лучевая терапия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2013
Работа выполнена в Федеральном государственном казенном военном образовательном учреждении высшего профессионального образования «Военно-медицинская академия имени С.М. Кирова» Министерства обороны Российской Федерации
Научный руководитель:
доктор медицинских наук профессор Фокин Владимир Александрович
Официальные оппоненты:
Ратников Вячеслав Альбертович – доктор медицинских наук профессор, заместитель главного врача по медицинской части ФГУЗ «Клиническая больница № 122 имени Л.Г. Соколова Федерального медико-биологического агентства».
Семенов Игорь Иванович – доктор медицинских наук профессор, ведущий научный сотрудник ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России.
Ведущая организация:
ФГБУ «Российский научный центр радиологии и хирургических технологий» Министерства здравоохранения РФ
Защита диссертации состоится 15 ноября 2013 года в 14-00 часов на заседании диссертационного совета Д 215.002.11 в ФГКВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ (194044, г. Санкт-Петербург, ул. Академика Лебедева, 6)
С диссертацией можно ознакомиться в фундаментальной библиотеке ФГКВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ
Автореферат диссертации разослан «___» ____________ 2013 г.
Ученый секретарь диссертационного совета
доктор медицинских наук
Язенок Аркадий Витальевич
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы исследования.
Метастатическое поражение печени – сложная и актуальная проблема в современной онкологической практике. Печень является наиболее частым органом метастатического поражения после регионарных лимфатических узлов, и до 40% пациентов, которые умирают от рака любой этиологии, умирают с наличием метастазов в печени (Flanders V.L., Gervais D.A., 2010).
Заболеваемость метастатическим раком печени в России в несколько раз превышает заболеваемость первичным раком (Вашакмадзе Л.А., Трахтенберг А.Х., Сидоров Д.В. и соавт., 2007; Долгушин Б.И., Патютко Ю.И., Шолохов В.Н. и соавт., 2007). Относительная пропорция частоты поражения печени первичными и вторичными новообразованиями составляет 1:30 (Аксель Е.М., Давыдов М.И., Ушакова Т.П., 2001), достигая 95% случаев от числа всех очаговых образований печени злокачественного характера (Багненко С.Ф., Кабанов М.Ю., Яковлева Д.М. и соавт., 2010; Ганцев Ш.Х., Кулакеев О.К., Арыбжанов Д.Т. и соавт., 2010). Многие исследования указывают на стойкую тенденцию к увеличению частоты встречаемости метастатического поражения печени вне зависимости от локализации первичной опухоли (Балабанова А.А., 2010; Косырев В.Ю., 2011; Brown B., Geschwind J.H., Soulen M.C. et al., 2006).
Выявление метастазов печени, их количества и локализации, имеет не только диагностическое, но и важное прогностическое значение, поскольку целесообразность, объем и эффективность лечебных мероприятий зависят главным образом от стадии опухолевого заболевания (Ратников В.А., 2009; Ратников В.А., Кузнецов С.В., Савельева Т.В. и соавт., 2010; Bertolotto M., Bartolotta T.V., Belgrano M. et al., 2007; Maniam S., Szklaruk J., 2010).
Степень разработанности темы.
Рентгенологический метод в диагностике метастатического поражения печени не нашел широкого применения и играет незначительную роль (Miloevi Z., Gaji-Dobrosavljevi M., Stevanovi J., 2006). Обзорные рентгенограммы в условиях естественной контрастности малоинформативны и низкоспецифичны и позволяют выявить только косвенные признаки поражения печени – гепатомегалию, обызвествления и асцит (Араблинский А.В., Черняков Р.М., Хитрова А.Н. и др., 2000; Линденбратен Л.Д., Королюк И.П., 2000). Различные рентгеноконтрастные методики диагностики заболеваний и повреждений желчевыводящих путей и сосудистой системы печени предоставляют лишь косвенную информацию о возможном метастатическом поражении в виде деформаций, сужений просвета или блока пассажа контрастного вещества (Балахнин П.В., Таразов П.Г., Поликарпов А.А. и соавт., 2003; Ducreux M., Ychou M., Laplanche A. et al., 2005).
Ультразвуковое исследование (УЗИ) является методом выбора в первичной диагностике заболеваний печени (Лемешко З.А., 2011; Wilson S.R., Gupta C., Eliasziw M. et al., 2009). Однако очаговые образования диаметром до 3 см в большинстве случаев приводят к трудностям в дифференциальной диагностике, поскольку не имеют типичной эхографической и васкулярной картины, особенно на фоне диффузных заболеваний печени (Bolondi L., Gaiani S., Celli N. et al., 2005; Kim S.H., Lee J.M., Lee J.Y. et al., 2005). УЗИ с применением контрастного вещества, во время проведения которого требуется смена положения для диагностики всех фаз контрастного усиления, не позволяет одновременно оценивать все изменения в паренхиме печени (Ding H., Wang W.P., Huang B.J. et al., 2005). Субъективность и высокая аппаратозависимость метода ставит достоверность диагностического заключения в большую зависимость от опыта и квалификации врача.
Компьютерная томография (КТ) с применением методики контрастного усиления получила широкое распространение в выявлении метастатического поражения печени (Кармазановский Г.Г., 2005; Valette P., Pilleul F., Crombe-Ternamian A., 2003; Schima W., Kulinna C., Langenberger H. et al., 2005). Однако, метастатические очаги малых размеров на фоне диффузных заболеваний печени могут быть пропущены в виду низкой тканевой контрастности и эффекта частичного объемного усреднения (Балабанова А.А., 2010).
Ограниченное количество специфических туморотропных радиофармпрепаратов для однофотонной эмиссионной компьютерной томографии и позитронно-эмиссионной томографии в большинстве случаев не позволяет установить этиологию метастатических очагов (Kaltsas G.A., Besser G.M., Grossman A.B. et al., 2004; Dromain C., de Baere T., Lumbroso J. et al., 2005). Ввиду низкого пространственного разрешения определение точной локализации патологических изменений, выявленных при помощи методов радионуклидной визуализации, без совмещения с данными КТ или магнитно-резонансной томографии (МРТ) в значительной степени затруднено.
Метод МРТ обладает многими преимуществами по сравнению с другими методами лучевой диагностики. Применение контрастных препаратов и именно методики многофазной МРТ позволяет собрать максимум информации о характере васкуляризации метастатических очагов и состоянии печени в целом (Ратников В.А., Бакушкин И.А, Скульский С.К., 2008; Ратников В.А., Семенов И.И., Бакушкин И.А. и соавт., 2009). Однако, не до конца изучены методологические вопросы проведения многофазного сканирования, в частности активно обсуждается вопрос относительно времени задержки после введения контрастного вещества. Публикации в литературе, посвященные данной методике, с точки зрения дифференциальной диагностики метастатического поражения печени, как правило, ограничиваются лишь качественным анализом полученных данных и в значительной степени исчерпаны (Медведева Б.М., 2004; Semelka R.C., 2010).
Количественный анализ динамики накопления контрастного вещества при многофазной МРТ является наиболее перспективной методикой в улучшении качества диагностики метастатического поражения печени и контроля эффективности проводимого лечения. Публикации в литературе, посвященные данным методикам, как правило, ограничиваются лишь единичными данными без применения методов статистического анализа. В отечественной литературе комплексные работы в данной области отсутствуют.
Таким образом, все вышеизложенное обусловливает высокую актуальность, необходимость разработки новых алгоритмов обработки информации и целенаправленного изучения возможностей многофазной МРТ в дифференциальной диагностике метастатического поражения печени различной этиологии.
Цель исследования. Улучшение качества диагностики метастатических поражений печени методом высокопольной магнитно-резонансной томографии с многофазным динамическим контрастным усилением.
Задачи исследования:
- Определить роль и возможности высокопольной многофазной МРТ в дифференциальной диагностике метастатических поражений печени различной этиологии.
- По результатам количественного анализа данных многофазной МРТ определить для каждого гистологического типа метастатического поражения печени динамические кривые, основанные на изменении интенсивности сигнала в разные фазы динамического контрастного усиления.
- Уточнить МР-семиотику метастатических поражений печени различной этиологии на основе определения дифференциально-диагностических показателей по результатам количественного анализа данных МРТ с динамическим контрастным усилением.
- На основе комплексного статистического анализа количественных данных МРТ с динамическим контрастным усилением построить математические модели дифференциальной диагностики метастазов печени различной этиологии.
- Провести анализ информативности полученных моделей для различных методик многофазной МРТ.
Научная новизна исследования. Впервые на достаточном клиническом материале проведен углубленный количественный анализ динамики накопления контрастного вещества очагами метастатического поражения печени при многофазной МРТ.
Для каждой этиологической группы метастазов по результатам количественного анализа многофазной МРТ определены характерные динамические кривые, основанные на изменении интенсивности сигнала, позволяющие высказывать предположение о первоисточнике опухоли.
На основе углубленного количественного анализа уточнена МР-семиотика метастатических очагов различной этиологии при МРТ с динамическим контрастным усилением, основанная на их патоморфологических особенностях строения.
По результатам комплексного статистического анализа выявлены группы наиболее информативных показателей для проведения дифференциальной диагностики метастазов печени различной этиологии.
Разработаны дискриминантные модели дифференциальной диагностики метастатического поражения печени различной этиологии, позволяющие с высокой долей вероятности высказаться о природе метастатического очага, а также существенно снижающие роль субъективного фактора в принятии решения.
Определена информативность методик высокопольной МРТ с динамическим контрастным усилением в дифференциальной диагностике метастатических поражений печени различной этиологии.
Произведен сравнительный анализ информативности двух методик многофазной МРТ и ретроспективный анализ ошибок построенных математических моделей.
Обоснованы рекомендации по применению метода многофазной МРТ в диагностике метастатических поражений печени.
Теоретическая и практическая значимость. Количественный анализ динамики накопления контрастного вещества метастатическими очагами печени позволяет детально изучать характер изменений в выявляемых очагах, основанный на их гистологическом строении, и отслеживать происходящую в них трансформацию ткани.
Проведенная нами работа выявила ряд количественных показателей, статистически достоверно различающихся в группах пациентов с рассматриваемыми типами патологии, которые позволяют с высокой долей вероятности высказаться о первоисточнике опухоли.
Переход от качественной оценки к числовым значениям существенно снижает субъективность и позволяет в значительной степени автоматизировать процесс принятия решения.
Результаты проведенной научной работы могут быть полезны в проведении дифференциальной диагностики очагов метастатического поражения печени в тех случаях, когда характер первичной опухоли неизвестен.
Методология и методы исследования. Диссертационное исследование выполнялось в несколько этапов. На первом этапе изучалась отечественная и зарубежная литература, посвященная данной проблеме. Всего проанализировано 177 источников, из них отечественных – 58, зарубежных – 119.
На втором этапе научной работы были обследованы 103 пациента с метастатическим поражением печени различной этиологии.
На третьем этапе диссертационного исследования был произведен комплексный статический анализ количественных данных двух методик многофазной МРТ с построением математических моделей дифференциальной диагностики метастатического поражения печени различной этиологии.
Клиническая характеристика пациентов. Всего было обследовано 103 пациента с метастатическим поражением печени различной этиологии. Подтверждение этиологии первичного очага основано на результатах патоморфологических исследований, клинико-лучевых симптомах и совокупности данных анамнеза, инструментальных и лабораторных тестов, а также длительном динамическом наблюдении пациентов.
МРТ с многофазным динамическим контрастным усилением выполняли на кафедре рентгенологии и радиологии (с курсом ультразвуковой диагностики) ФГКВОУ ВПО «Военно-медицинская академия им. С.М. Кирова» МО РФ в период с 2010 по 2013 годы. Среди обследованных пациентов превалировали мужчины (68%). Лица в возрасте от 50 до 69 лет составили основную возрастную группу пациентов (82,5%). Средний возраст обследуемых пациентов составил 58,9±5,3 года. Минимальный возраст исследуемых – 38 лет, максимальный – 81 год.
Многофазное МР-исследование проводилось по одной из двух методик, отличие между которыми заключалось во времени начала сбора данных артериальной фазы после внутривенного введения парамагнитного контрастного вещества. По методике №1 (получение доминантной артериальной фазы) было обследовано 56, по методике №2 (получение поздней артериальной фазы) – 47 пациентов.
Всего было выявлено 549 очагов метастатического поражения печени различной этиологии, из числа которых 174 метастаза аденокарциномы толстой кишки, 154 – мелкоклеточного рака легкого, 119 – аденокарциномы поджелудочной железы, 57 – аденокарциномы желудка, 18 – аденокарциномы предстательной железы, 16 – аденокарциномы молочной железы, по 3 – почечно-клеточного рака почки, аденокарциномы языка и меланомы кожи, 2 – серозной цистаденокарциномы яичника.
Для комплексного статистического анализа отбирали не более 5 метастатических очагов у каждого пациента. Для злокачественных опухолей толстой кишки, поджелудочной железы, желудка, молочной железы и предстательной железы обязательным условием включения в комплексный статистический анализ было наличие гистологического заключения высокодифференцированной или умереннодифференцированной аденокарциномы. В комплексный статистический анализ не вошли по 3 очага почечно-клеточного рака почки, аденокарциномы языка и меланомы кожи, а также 2 очага серозной цистаденокарциномы яичника вследствие недостаточного объема данных для получения достоверных статистических результатов.
МР-исследование производили на высокопольных томографах ”Magnetom Symphony” и ”Magnetom Sonata” (Siemens, Германия) c индукцией магнитного поля 1,5 Тл. В протокол исследования входило получение Т1-ВИ и Т2-ВИ в стандартных плоскостях (в том числе с применением методик подавления сигнала от жировой ткани и различным временем эхо), диффузионно-взвешенных изображений, изображений химического сдвига, магнитно-резонансной холангиопанкреатографии по методикам толстого блока и тонких срезов, а также введение парамагнитного контрастного вещества с последующим сбором серий постконтрастных изображений.
В качестве парамагнитных контрастных веществ использовали разрешенные к клиническому применению в РФ препараты, содержащие хелаты гадолиния: Дотарем® (Gadoteric acid), Гадовист® (Gadobutrol), Магневист® (Gadopentetate dimeglumine), Омнискан® (Gadodiamide), Примовист® (Gd-EOB-DTPA). При использовании методики №1 (получение доминантной артериальной фазы) гадолинийсодержащие контрастные вещества, за исключением Гадовиста и Примовиста, всем пациентам вводили мануально из расчета 0,25 ммоль/10 кг (0,2 мл/кг) в неразведенном виде со скоростью 1,5-2,5 мл/сек, а при использовании методики №2 – 2,5-3,5 мл/сек. Поскольку контрастные препараты Гадовист (с внеклеточными свойствами) и Примовист (с комбинированными внутри- и внеклеточными свойствами) являются высококонцентрированными, дозу введения рассчитывали из учета 1 ммоль/10 кг (0,1 мл/кг) с аналогичными способом и скоростью введения.
При использовании методики №1 после внутривенного введения контрастного вещества сканирование проводили на 20-25 секундах, 60-65 секундах, 3 минуте и 7-10 минутах от момента введения контрастного вещества, что соответствовало доминантной артериальной, венозной, ранней и поздней интерстициальным фазам, соответственно. При использовании методики №2 начало сбора данных многофазного динамического контрастного усиления осуществляли на 11-13 секундах, что позволяло получить позднюю артериальную фазу.
Для дальнейших измерений динамики накопления контрастного вещества использовали импульсную последовательность 3D VIBE (Three Dimension Volume Interpolated Breath-hold Examination) с толщиной среза 2,5-3,5 мм, позволяющую получать как традиционные многофазные томограммы (Т1-ВИ с жироподавлением), так и строить ангиографические изображения с применением MIP-протоколов.
В виду неоднородности магнитного поля все измерения старались производить в пределах одного аксиального среза. Измеряли интенсивность сигнала (ИС) в патологическом очаге, интактной паренхиме печени, аорте, нижней полой вене и селезенке, выделяя в виде области интереса окружность в пределах их контуров. Оценивали не только средние значения интенсивности сигнала, но и среднеквадратичное отклонение данного показателя. Все расчеты осуществляли как на преконтрастных, так и на постконтрастных изображениях в артериальную, венозную, раннюю и позднюю интерстициальные фазы. Использовали коэффициенты, рассчитываемые на основании соотношения измеренных величин в различных участках печени или в одной и той же области печени, в нескольких органах (селезенка, аорта, нижняя полая вена) в разные фазы сканирования:
– ИСочаг до ДКУ/ИСочаг арт.фаза,
– ИСочаг до ДКУ/ИСочаг вен.фаза,
– ИСочаг до ДКУ/ИСочаг 3мин,
– ИСочаг арт.фаза/ИСочаг вен.фаза и т.д.
Также рассчитывали изменения первой группы показателей в различные фазы сканирования: (ИСочаг до ДКУ/ИСпечень до ДКУ)/(ИСочаг арт.фаза/ИСпечень арт.фаза) и т.п. При подобных вычислениях удается перейти к относительным величинам, тем самым решив (или существенно нивелировав) озвученную выше проблему. Всего было изучено 74 показателя и соотношения интенсивности сигнала для каждого выявленного очага метастатического поражения печени.
Дополнительно оценивали следующие характеристики накопления:
- интенсивность накопления (сильное, слабое);
- характер накопления (равномерный, неравномерный);
- время появления пика накопления контрастного вещества в зависимости от фазы (артериальная, интерстициальная, отсроченная на 3 и 7-10 минутах);
- тип динамической кривой.
В завершение исследования осуществляли постпроцессорную обработку полученных данных с использованием методики цифровой субтракции.
Положения, выносимые на защиту:
- Методика количественного анализа динамики накопления контрастного вещества является дополнительной методикой многофазной МРТ, применение которой позволяет детально изучать характер васкуляризации метастатических очагов, основываясь на их гистологическом строении, что особенно важно, когда первоисточник опухоли не установлен.
- Построение динамических кривых изменения интенсивности МР-сигнала в метастатических очагах при многофазной МРТ в некоторых случаях позволяет провести дифференциальную диагностику вторичных изменений.
- Количественный анализ данных многофазной МРТ позволяет осуществлять более качественную дифференциальную диагностику метастатических очагов различной этиологии в результате перехода от качественных характеристик к числовым значениям.
- Использование линейных дискриминантных моделей, построенных на основе наиболее информативных соотношений интенсивности МР-сигнала, способствует упрощению методики количественного анализа данных многофазной МРТ, позволяя автоматизировать процесс принятия решения относительно первоисточника опухолевого процесса.
- Информативность построенных линейных дискриминантных моделей в дифференциальной диагностике метастатических очагов мелкоклеточного рака легкого, аденокарцином толстой кишки, поджелудочной железы и желудка для методики №1 и методики №2 составляет 82,5% и 62,9%, соответственно, тем самым, определяя использование методики №1 как приоритетное.
Степень достоверности и апробация результатов. Степень достоверности результатов проведенного исследования определяется значительным и репрезентативным объемом выборки обследованных пациентов (n=103) и количеством метастатических очагов, вошедших в комплексный статистический анализ (n=326), применением современных методов исследования (высокопольная МРТ), а также обработкой полученных данных современными статистическими методами.
Результаты диссертационного исследования используются в практической работе клиники общей хирургии, факультетской хирургии, военно-морской и госпитальной хирургии, отделениях магнитно-резонансной томографии кафедры рентгенологии и радиологии (с курсом ультразвуковой диагностики) Военно-медицинской академии им. С.М. Кирова и внедрены в учебный процесс.
Основные результаты работы доложены и обсуждены на отечественных и международных конференциях: заседаниях Санкт-Петербургского радиологического общества (СПб., 2012, 2013); Невском радиологическом форуме (СПб., 2013); Европейском обществе магнитно-резонансной томографии в медицине и биологии (ESMRMB) (Лиссабон, 2012); Европейском конгрессе радиологов (EСR) (Вена, 2013).
Апробация диссертационной работы проведена на межкафедральном совещании кафедр: рентгенологии и радиологии (с курсом ультразвуковой диагностики), общей хирургии ФГБВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ (протокол №4 от 20.09.2013г.).
Личный вклад. Тема и план диссертации, ее основные идеи и содержание разработаны совместно с научным руководителем на основе многолетних целенаправленных исследований.
Автор самостоятельно обосновал актуальность темы диссертации, цель, задачи и этапы научного исследования. Разработана формализованная карта и на ее основе создана электронная база данных.
Диссертант лично провел МР-исследования 103 пациентам, самостоятельно проводил обработку полученных данных.
Личный вклад автора в изучение литературы, сбор, обобщение, анализ, статистическую обработку клинических материалов и написание диссертации — 100%.
Публикации. По теме диссертационного исследования опубликовано 9 печатных работ, из них 2 публикации в изданиях, рекомендованных ВАК Министерства образования и науки РФ. Внедрены 3 рационализаторских предложения (ВМедА № 12829/6 от 11.11.11 г.; № 13198/5 от 25.10.12 г.; № 13223/6 от 26.10.12 г.).
Структура и объем диссертации. Диссертационная работа состоит из введения, пяти глав, заключения и обсуждения результатов, выводов, практических рекомендаций и списка используемой литературы. Работа содержит 30 рисунков, 11 таблиц. Список литературы включает 177 источников (58 отечественных и 119 зарубежных). Текст диссертации изложен на 148 листах машинописного текста.
Методы статистической обработки результатов исследования.
Данные о пациентах и результаты МРТ с динамическим контрастным усилением заносили в специально разработанную электронную базу данных.
Статистический анализ результатов исследования выполняли с помощью пакетов прикладных программ: SPSS PASW Statistics 18, OpenEpi 2.2.1, StatSoft Statistica for Windows 8.0 – для статистического анализа, Microsoft Office 2003 – для организации и формирования матрицы данных.
Анализировали показатели интенсивности сигнала в метастатических очагах, интактной паренхиме печени, аорте, нижней полой вене и селезенке как на нативных, так и на постконтрастных изображениях.
Оценку связи этиологии метастатического поражения печени с показателями, измеренными в ходе исследования в количественной шкале, проводили с использованием однофакторного дисперсионного анализа. Изучали разложение дисперсии показателей на составляющие по влиянию контролируемого фактора (этиологии метастатического поражения печени) и дисперсию, вызываемую действием неконтролируемых, случайных факторов и ошибками измерения.
Для оценки эффективности высокопольной МРТ в дифференциальной диагностике метастатического поражения печени использовали следующие показатели:
- Показатель чувствительности, определяемый как относительная величина частоты положительных ответов в группе с истинной патологией. Показатель характеризует способность методики распознать патологию, когда она есть.
- Точность – комплексный показатель диагностической эффективности метода исследования, определяемый как относительная величина частоты правильных ответов в общем количестве наблюдений.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Результаты многофазной магнитно-резонансной томографии живота у пациентов с метастатическим поражением печени различной этиологии при использовании методики №1
При комплексном статистическом анализе данных МРТ с многофазным динамическим контрастным усилением по методике №1 у 56 пациентов на основе 74 показателей и соотношений интенсивности сигнала было выявлено, что наиболее информативными в плане дифференциальной диагностики исследуемых метастатических очагов являются коэффициенты:
- (ИСочаг арт.фаза/ИСселезенка арт.фаза)/(ИСочаг 3 мин/ИСселезенка 3 мин) (F=46,37, p<0,001);
- ИСочаг вен.фаза/ИСочаг 7-10 мин (F=13,47, p<0,001);
- ИСочаг 3 мин/ИСочаг 7-10 мин (F=7,2, p<0,001);
- (ИСочаг до ДКУ/ИСселезенка до ДКУ)/(ИСочаг арт.фаза/ИСселезенка арт.фаза) (F=6,75, p<0,001);
- (ИСочаг до ДКУ/ИСНПВ до ДКУ)/(ИСочаг арт.фаза/ИСНПВ арт.фаза) (F=6,68, p<0,001);
- (ИСочаг до ДКУ/ИСпечень до ДКУ)/(ИСочаг 7-10 мин/ИСпечень 7-10 мин) (F=6,41, p<0,001).
Метастазы аденокарциномы толстой кишки характеризуются наиболее высокими значениями коэффициента (ИСочаг до ДКУ/ИСпечень до ДКУ)/(ИСочаг 7-10 мин/ИСпечень 7-10 мин) (1,08±0,03), что при значении коэффициента >1 позволяет достоверно отнести метастатический очаг к данной группе (p<0,001).
Метастазы аденокарциномы поджелудочной железы имеют наиболее низкие значения коэффициента ИСочаг вен.фаза/ИСочаг 7-10 мин и ИСочаг 3 мин/ИСочаг 7-10 мин (0,21±0,13 и 0,23±0,15, соответственно), что при значении коэффициента <0,8 позволяет достоверно отнести метастатический очаг к данной группе (p<0,001).
Метастазы аденокарциномы желудка характеризуются высокими значениями коэффициента ИСочаг 3 мин/ИСочаг 7-10 мин и наиболее высокими значениями коэффициента (ИСочаг до ДКУ/ИСНПВ до ДКУ)/(ИСочаг арт.фаза/ИСНПВ арт.фаза) (1,08±0,02 и 2,27±0,12, соответственно). В случае с коэффициентом ИСочаг 3 мин/ИСочаг 7-10 мин это позволяет дифференцировать данные очаги с метастазами аденокарцином толстой кишки, поджелудочной железы и предстательной железы (p<0,001), а при использовании коэффициента (ИСочаг до ДКУ/ИСНПВ до ДКУ)/(ИСочаг арт.фаза/ИСНПВ арт.фаза) – метастазами мелкоклеточного рака легкого, аденокарцином поджелудочной железы и предстательной железы (p<0,001).
Одновременно с этим очаги метастатического поражения печени аденокарциномы предстательной железы характеризуются наиболее высокими значениями коэффициента (ИСочаг до ДКУ/ИСселезенка до ДКУ)/(ИСочаг арт.фаза/ИСселезенка арт.фаза) (2,15±0,07), что позволяет достоверно провести их дифференциальную диагностику с метастатическими очагами других групп при его значении больше 2 (p<0,001).
Очаги метастатического поражения печени мелкоклеточного рака легкого характеризуются наиболее низкими значениями коэффициента (ИСочаг до ДКУ/ИСселезенка до ДКУ)/(ИСочаг арт.фаза/ИСселезенка арт.фаза) и наиболее высокими значениями коэффициента (ИСочаг арт.фаза/ИСселезенка арт.фаза)/(ИСочаг 3 мин/ИСселезенка 3 мин) по сравнению с метастатическими очагами остальных групп (0,88±0,03 и 1,42±0,08, соответственно, p<0,001), что позволяет достоверно отнести метастатический очаг к данной группе при его значениях для данного коэффициента <1 и >1, соответственно.
По результатам дисперсионного однофакторного анализа была построена статистически значимая (F=36,3; p<0,0001) линейная дискриминантная модель и сформирована группа показателей наиболее информативных для решения поставленной задачи (таблица 1).
Таблица 1
Информативность признаков,
вошедших в линейную дискриминантную модель
| Коэффициенты | F | р |
| (ИСочаг арт.фаза/ИСселезенка арт.фаза)/(ИСочаг 3 мин/ИСселезенка 3 мин) | 46,37 | <0,0001 |
| ИСочаг 3 мин/ИСочаг 7-10 мин | 13,47 | <0,0001 |
| ИСочаг до ДКУ/ИСочаг арт.фаза | 6,92 | <0,003 |
F – критерий Фишера;
p – уровень значимости F-критерия Фишера.
При условии равной априорной вероятности принадлежности пациента к рассматриваемым группам получены линейные классификационные дискриминантные функции:
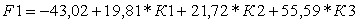 ;
;
 ;
;
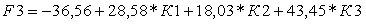 ;
;
 ,
,
где К1 – индекс (ИСочаг арт.фаза/ИСселезенка арт.фаза)/(ИСочаг 3 мин/ИСселезенка 3 мин);
К2 – индекс ИСочаг 3 мин/ИСочаг 7-10 мин;
К3 – индекс ИСочаг до ДКУ/ИСочаг арт.фаза.
Первая классификационная дискриминантная функция соответствует группе пациентов с метастазами аденокарциномы толстой кишки, вторая – с метастазами аденокарциномы поджелудочной железы, третья – с метастазами аденокарциномы желудка, четвертая функция – с метастазами мелкоклеточного рака легкого.
По результатам количественного анализа динамики захвата и выведения контрастного вещества метастатическими очагами на основании коэффициентов ИСочаг до ДКУ/ИСочаг арт.фаза, ИСочаг до ДКУ/ИСочаг вен.фаза, ИСочаг до ДКУ/ИСочаг 3 мин и ИСочаг до ДКУ/ИСочаг 7-10 мин были построены динамические кривые, отображающие изменения интенсивности МР-сигнала. Учитывая диапазоны колебаний значений стандартного отклонения, четкие различия во все фазы сканирования определяются только между метастатическими очагами аденокарциномы предстательной железы с одной стороны, и метастатическими очагами аденокарциномы желудка и мелкоклеточного рака легкого, с другой.
Также выявлены различия между метастазами аденокарциномы толстой кишки и мелкоклеточного рака легкого в артериальную и венозную фазы сканирования.
Широкие колебания значений диапазонов стандартного отклонения метастатических очагов аденокарцином толстой кишки, желудка и поджелудочной железы, в значительной степени перекрывающие друг друга, а также метастазы аденокарциномы предстательной железы и мелкоклеточного рака легкого, особенно в интерстициальные фазы сканирования, не позволяют провести точную дифференциальную диагностику на основании построения динамических кривых.
Результаты многофазной магнитно-резонансной томографии живота у пациентов с метастатическим поражением печени различной этиологии при использовании методики №2
При статистическом анализе данных многофазного динамического контрастного усиления у 47 пациентов на основе 74 показателей и соотношений интенсивности сигнала было выявлено, что наиболее информативными в плане дифференциальной диагностики исследуемых метастатических очагов при МР-исследовании с многофазным динамическим контрастным усилением являются соотношения:
- (ИСочаг до ДКУ/ИСселезенка до ДКУ)/(ИСочаг 7-10 мин/ИСселезенка 7-10 мин) (F=7,73, p<0,001);
- ИСочаг до ДКУ/ИСНПВ до ДКУ)/(ИСочаг арт.фаза/ИСНПВ арт.фаза) (F=7,21, p<0,001);
- (ИСочаг до ДКУ/ИСселезенка до ДКУ)/(ИСочаг арт.фаза/ИСселезенка арт.фаза) (F=6,32, p<0,001);
- (ИСочаг арт.фаза/ИСаорта арт.фаза)/(ИСочаг 7-10 мин/ИСаорта 7-10 мин) (F=5,51, p<0,001);
- ИСочаг арт.фаза/ИСочаг 7-10 мин, (F=5,5, p<0,001);
- ИСочаг арт.фаза/ИСочаг вен.фаза, (F=5,11, p<0,001).
Для метастатических очагов аденокарциномы толстой кишки характерны средние значения коэффициента (ИСочаг до дку/ИСНПВ до дку)/(ИСочаг арт.фаза/ИСНПВ арт.фаза) (1,26±0,08), позволяя производить их точную дифференциальную диагностику с метастазами других этиологических групп (p<0,001).
Очаги метастатического поражения печени мелкоклеточного рака легкого характеризуются более высокими значениями переменных (ИСочаг до ДКУ/ИСНПВ до ДКУ)/(ИСочаг арт.фаза/ИСНПВ арт.фаза), ИСочаг арт.фаза/ИСочаг 7-10 мин и ИСочаг арт.фаза/ИСочаг вен.фаза (1,65±0,02, 1,06±0,01, 0,96±0,01, соответственно) по сравнению с метастатическими очагами всех остальных групп (p<0,001).
Метастазы аденокарциномы молочной железы характеризуются наиболее высокими значениями переменной (ИСочаг до ДКУ/ИСселезенка до ДКУ)/(ИСочаг арт.фаза/ИСселезенка арт.фаза) (2,21±0,02), что при значениях коэффициента >2 позволяет отнести метастатический очаг к данной группе (p<0,001). Одновременно с этим метастатические очаги мелкоклеточного рака легкого демонстрируют наиболее низкие значения данного показателя (0,96±0,01), позволяя провести дифференциальную диагностику этих двух групп, используя только один коэффициент (p<0,001).
Очаги метастатического поражения печени аденокарциномы желудка и мелкоклеточного рака легкого характеризуются более низкими значениями для коэффициента (ИСочаг до ДКУ/ИСселезенка до ДКУ)/(ИСочаг 7-10 мин/ИСселезенка 7-10 мин) (0,84±0,1 и 0,81±0,01, соответственно), чем метастазы аденокарцином толстой кишки, поджелудочной железы и молочной железы. Определив значения метастатических очагов аденокарциномы желудка для коэффициента (ИСочаг до дку/ИСНПВ до дку)/(ИСочаг арт.фаза/ИСНПВ арт.фаза), можно достоверно провести их дифференциальную диагностику с метастатическими очагами мелкоклеточного рака легкого (1,01±0,05 и 1,65±0,02, соответственно) (p<0,001).
Определив значения коэффициентов (ИСочаг до дку/ИСНПВ до дку)/(ИСочаг арт.фаза/ИСНПВ арт.фаза) и ИСочаг арт.фаза/ИСочаг вен.фаза, возможно произвести дифференциальную диагностику метастатических очагов аденокарциномы поджелудочной железы с метастазами других этиологических групп (0,98±0,04 и 0,83±0,02, соответственно) (p<0,001).
После идентификации наиболее информативных коэффициентов, вошедших в итоговую модель, и оценки информативности каждого из них в дисперсионном однофакторном анализе, была разработана статистически значимая (F=6,04; p<0,0001) линейная дискриминантная модель и выделена группа показателей наиболее информативных для решения поставленной задачи (таблица 2).
Таблица 2
Информативность признаков,
вошедших в линейную дискриминантную модель
| Коэффициенты | F | р |
| (ИСочаг до ДКУ/ИСНПВ до ДКУ)/(ИСочаг арт.фаза/ИСНПВ арт.фаза) | 7,21 | <0,001 |
| (ИСочаг арт.фаза/ИСаорта арт.фаза)/(ИСочаг 7-10 мин/ИСаорта 7-10 мин) | 5,51 | <0,001 |
| (ИСочаг до ДКУ/ИСпечень до ДКУ)/(ИСочаг 7-10 мин/ИСпечень 7-10 мин) | 4,37 | <0,004 |
| ИСочаг арт.фаза/ИСочаг 7-10 мин | 3,08 | <0,02 |
F – критерий Фишера;
p – уровень значимости F-критерия Фишера.
Самым информативным показателем для прогнозирования этиологии метастатического поражения печени в полученной дискриминантной модели, таким образом, оказался коэффициент (ИСочаг до ДКУ/ИСНПВ до ДКУ)/(ИСочаг арт.фаза/ИСНПВ арт.фаза) (р<0,001). Данная переменная имеет наибольшие отношения межгрупповой и внутригрупповой дисперсий.
При условии равной априорной вероятности принадлежности пациента к рассматриваемым группам получены линейные классификационные дискриминантные функции:
 ;
; ;
; ;
; ,
,
где К1 – индекс (ИСочаг до ДКУ/ИСНПВ до ДКУ)/(ИСочаг арт.фаза/ИСНПВ арт.фаза);
К2 – индекс (ИСочаг арт.фаза/ИСаорта арт.фаза)/(ИСочаг 7-10 мин/ИСаорта 7-10 мин);
К3 – индекс (ИСочаг до ДКУ/ИСпечень до ДКУ)/(ИСочаг 7-10 мин/ИСпечень 7-10 мин);
К4 – индекс ИСочаг арт.фаза/ИСочаг 7-10 мин.
Первая классификационная дискриминантная функция соответствует группе пациентов с метастазами аденокарциномы толстой кишки, вторая – с метастазами аденокарциномы поджелудочной железы, третья – с метастазами аденокарциномы желудка, четвертая функция – с метастазами мелкоклеточного рака легкого.
При количественном анализе изменения интенсивности МР-сигнала в метастатических очагах различной этиологии в процессе многофазного динамического контрастного усиления наибольшие различия определяются во время артериальной и поздней отсроченной фаз. При этом с учетом колебаний средних значений стандартного отклонения четкие различия определяются между метастазами мелкоклеточного рака легкого и аденокарциномами желудка и молочной железы, а также между метастазами аденокарциномы толстой кишки и мелкоклеточного рака легкого в артериальную фазу сканирования.
В позднюю отсроченную фазу сканирования представляется возможным провести только дифференциальную диагностику между метастатическими очагами аденокарциномы молочной железы относительно метастазов аденокарциномы поджелудочной железы и мелкоклеточного рака легкого. При этом следует иметь в виду, что в позднюю интерстициальную фазу метастатические очаги аденокарциномы толстой кишки в значительной степени, а метастазы аденокарциномы желудка полностью перекрывают своими диапазонами колебаний среднего значения стандартного отклонения диапазоны друг друга и всех остальных исследуемых групп, что не позволяет провести точную дифференциальную диагностику на основании построения динамических кривых.
Оценка однородности метастатических очагов печени и ее изменения в процессе многофазного динамического контрастного усиления проведены на основании измерения стандартного отклонения коэффициентов ИСочаг до ДКУ/ИСочаг арт.фаза, ИСочаг до ДКУ/ИСочаг вен.фаза, ИСочаг до ДКУ/ИСочаг 3 мин и ИСочаг до ДКУ/ИСочаг 7-10 мин в каждой подгруппе пациентов, выраженное в процентах.
По результатам количественного анализа наибольшая неоднородность была выявлена в метастатических очагах аденокарцином толстой кишки, поджелудочной железы и желудка, значительно увеличивающаяся в процессе многофазного динамического контрастного усиления в метастазах аденокарциномы толстой кишки и желудка. Напротив, для метастатических очагов аденокарциномы поджелудочной железы было характерно увеличение однородности в течение многофазного сканирования. Метастазы аденокарциномы молочной железы демонстрировали увеличение гомогенности в период венозной и ранней интерстициальной фаз с последующим возрастанием неоднородности в позднюю интерстициальную фазу до уровня в артериальную фазу. Минимальные колебания величины стандартного отклонения коэффициентов были выявлены для метастатических очагов мелкоклеточного рака легкого и аденокарциномы предстательной железы, что отображало высокую однородность их структуры.
Таким образом, проведенный количественный анализ данных МРТ с динамическим контрастным усилением выявил ряд статистически достоверно отличающихся показателей для метастатических очагов разных этиологических групп, что позволяет производить их более качественную дифференциальную диагностику. Это особенно важно в тех случаях, когда характер первичной опухоли неизвестен.
ЗАКЛЮЧЕНИЕ
В результате выполненной научной работы на достаточном клиническом материале проведен углубленный количественный анализ динамики накопления контрастного вещества и определены возможности МРТ с многофазным динамическим контрастным усилением в дифференциальной диагностике метастатических поражений печени различной этиологии.
Количественный анализ динамики накопления контрастного вещества метастатическими очагами печени позволил детально изучить характер изменений васкуляризации в выявляемых очагах и отслеживать происходящую в них трансформацию ткани. На основании выявленных числовых характеристик изменения интенсивности сигнала в метастатических очагах при многофазной МРТ построены динамические кривые с определением средних значений стандартного отклонения, которые позволяют в некоторых случаях провести дифференциальную диагностику вторичных изменений.
По результатам углубленного количественного анализа данных МРТ с многофазным динамическим контрастным усилением была уточнена МР-семиотика метастатических очагов различной этиологии, основанная на их патоморфологических особенностях строения, и выявлены наиболее информативные показатели, которые способствуют проведению более качественной диагностики. Переход от качественных характеристик к числовым значениям позволяет в значительной степени снизить субъективность и операторозависимость, а также автоматизировать процесс принятия решения относительно характера первичной опухоли.
Разработанная многомерная математико-статистическая модель для МРТ с многофазным динамическим контрастным усилением по методике №1 (получение доминантной артериальной фазы) обладала большей чувствительностью и общей диагностической эффективностью в дифференциальной диагностике метастазов мелкоклеточного рака легкого, аденокарцином толстой кишки, поджелудочной железы и желудка, по сравнении с аналогичной моделью для методики №2 (получение поздней артериальной фазы). Чувствительность линейной дискриминантной модели методики №1 в диагностике метастазов аденокарциномы толстой кишки составила 78,9%, метастазов аденокарциномы поджелудочной железы – 71,4%, метастазов аденокарциномы желудка и мелкоклеточного рака легкого – 100%; линейной дискриминантной модели для методики №2 – 47,8%, 73,7%, 62,5%, 100%, соответственно. Общая диагностическая эффективность моделей для методики №1 и №2 составила 82,5% и 62,9%, соответственно.
Использование линейных дискриминантных моделей позволяет упростить методику количественного анализа данных многофазной МРТ, значительно сократив количество вычислений значений сложных коэффициентов.
МРТ с многофазным динамическим контрастным усилением целесообразно проводить пациентам с метастатическим поражением печени, выявленным при применении других методов лучевой диагностики в случаях, когда первичный очаг злокачественной опухоли не установлен, что позволит улучшить качество и эффективность диагностики и лечения.
Выводы
- Многофазная МРТ живота с количественным анализом динамики интенсивности сигнала является дополнительной методикой МР-обследования пациентов с метастатическими поражениями печени, которая позволяет улучшить их дифференциальную диагностику и определение первичного очага.
- Для каждого гистологического типа метастатических очагов по результатам количественного анализа многофазной МРТ определены характерные динамические кривые, основанные на изменении интенсивности сигнала, позволяющие высказывать предположение о первоисточнике опухоли.
- Определены наиболее информативные соотношения интенсивности МР-сигнала, как признаки лучевой семиотики мелкоклеточного рака легкого и аденокарцином толстой кишки, поджелудочной железы, желудка и предстательной железы:
– для диагностики метастазов аденокарциномы толстой кишки К=(ИСочаг до ДКУ/ИСпечень до ДКУ)/(ИСочаг 7-10 мин/ИСпечень 7-10 мин) (1,08±0,03);
– метастазов аденокарциномы поджелудочной железы К=ИСочаг вен.фаза/ИСочаг 7-10 мин и К=ИСочаг 3 мин/ИСочаг 7-10 мин (0,21±0,13 и 0,23±0,15, соответственно);
– метастазов аденокарциномы желудка К=ИСочаг 3 мин/ИСочаг 7-10 мин и К=(ИСочаг до ДКУ/ИСНПВ до ДКУ)/(ИСочаг арт.фаза/ИСНПВ арт.фаза) (1,08±0,02 и 2,27±0,12, соответственно);
– метастазов аденокарциномы предстательной железы и мелкоклеточного рака легкого К=(ИСочаг до ДКУ/ИСселезенка до ДКУ)/(ИСочаг арт.фаза/ИСселезенка арт.фаза) (2,15±0,07 и 0,88±0,03, соответственно).
- В результате анализа дифференциально-диагностической информативности совокупности данных динамики интенсивности сигнала при МРТ в разные фазы динамического контрастного усиления по методике №1 (получение доминантной артериальной фазы) в метастатических очагах и в сравнении с интактной паренхимой печен, аортой, нижней полой веной и селезенкой выявлены наиболее информативные индексы динамики интенсивности сигнала, которые вошли в линейную дискриминантную модель:
- отношение ИС в очаге к ИС в селезенке к аналогичному показателю в раннюю интерстициальную фазу:
К1 = (ИСочаг арт.фаза/ИСселезенка арт.фаза)/(ИСочаг 3 мин/ИСселезенка 3 мин).
- отношение ИС в метастатическом очаге в раннюю интерстициальную фазу к аналогичному показателю в позднюю интерстициальную фазу:
К2 = ИCочаг 3 мин/ИСочаг 7-10 мин.
- отношение ИС в метастатическом очаге до ДКУ к аналогичному показателю в артериальную фазу:
К3 = ИСочаг до ДКУ/ИСочаг арт.фаза.
Обоснованные в работе информативные количественные индексы динамики интенсивности МР-сигнала от метастатических очагов позволили построить линейные классификационные дискриминантные функции, позволяющие упростить процесс принятия решения относительно первичного источника.
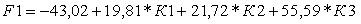 ;
;
 ;
;
 ;
;
 .
.
- Точность дифференциальной диагностики линейной дискриминантной модели для методики №1 для метастазов аденокарциномы толстой кишки составила 78,9%, метастазов аденокарциномы поджелудочной железы – 71,4%, метастазов аденокарциномы желудка и мелкоклеточного рака легкого – 100%. Общая диагностическая эффективность модели составила 82,5%.
Практические рекомендации
- Многофазная МРТ живота рекомендована пациентам с метастатическим поражением печени, выявленным при применении других лучевых методов исследования на фоне диффузных заболеваний печени, возникновения диагностических трудностей в дифференциальной диагностике с другими очаговыми образованиями печени, а также при отсутствии установленного первичного очага злокачественной опухоли.
- Проведение МРТ с динамическим контрастным усилением целесообразно всем пациентам с очаговыми образованиями печени, особенно в случае наличия онкологического процесса в органах, для которых характерно метастазирование в печень.
- Наиболее оптимальной для измерений динамики накопления контрастного вещества является импульсная последовательность 3D VIBE (Three Dimension Volume Interpolated Breath-hold Examination) с толщиной среза 2,5-3,5 мм, позволяющая получать как традиционные многофазные томограммы (Т1-ВИ с жироподавлением), так и строить ангиографические изображения с применением MIP-протоколов.
- При использовании количественного анализа на основе разработанных дискриминантных моделей методика №1, основанная на получении доминантной артериальной фазы, является более информативной и менее трудоемкой в дифференциальной диагностике метастатических очагов мелкоклеточного рака легкого и аденокарцином толстой кишки, поджелудочной железы и желудка.
- При использовании методики №1 требуются меньшие мануальные навыки по внутривенному введению контрастного вещества, а также отсутствует привязанность к наличию одномолярных контрастных веществ у пациентов с избыточной массой тела.
- Из количественного анализа целесообразно исключать метастатические очаги менее 12 мм в диаметре, расположенные субкапсулярно, на расстоянии менее 5 мм друг от друга, а также конгломераты метастазов.
Список работ, опубликованных по теме диссертации
- Багненко, С.С. Количественная оценка результатов магнитно-резонансной томографии с многофазным контрастным усилением у пациентов с очаговыми поражениями печени / С.С. Багненко, Г.Е. Труфанов, С.А. Алентьев, Ю.Н. Савченков // Диагностическая и интервенционная радиология. – 2011. – Т. 5, №2. – С. 44–45.
- Багненко, С.С. Методика количественного анализа динамики накопления контрастирующего препарата (в сосудистые фазы сканирования) при многофазной магнитно-резонансной томографии пациентов с опухолевыми и опухолеподобными поражениями печени / С.С. Багненко, Г.Е. Труфанов, М.В. Резванцев, Ю.Н. Савченков // Вестник Российской Военно-медицинской академии. – 2012. – №1 (37). – С. 182–187.
- Багненко, С.С. Количественный анализ диффузионно-взвешенных МР-томограмм в дифференциальной диагностике метастатического поражения печени колоректальной и панкреатической этиологии / С.С. Багненко, Ю.Н. Савченков, Г.Е. Труфанов // Материалы VI Всероссийского Национального конгресса лучевых диагностов и терапевтов «Радиология 2012». – М., 2012. – Т. 2, №2. – С. 44–45.
- Савченков, Ю.Н. Количественный анализ данных многофазного МР-исследования в дифференциальной диагностике метастатического поражения печени колоректальной и панкреатической этиологии / Ю.Н. Савченков, С.С. Багненко, Г.Е. Труфанов // Материалы VI Всероссийского Национального конгресса лучевых диагностов и терапевтов «Радиология 2012». – М., 2012.– Т. 2, №2. – С. 503–504.
- Багненко, С.С. Диффузионно-взвешенные изображения в диагностике поражений печени метастатического характера / С.С. Багненко, Г.Е. Труфанов, Ю.Н. Савченков // Вестник Российской Военно-медицинской академии. – 2012. – №4 (40). – С. 217–220.
- Багненко, С.С. Диффузионно-взвешенные изображения (ДВИ) в диагностике очаговых поражений печени / С.С. Багненко, Ю.Н. Савченков, Г.Е. Труфанов // Материалы VII Всероссийского Национального конгресса лучевых диагностов и терапевтов «Радиология 2013». – М., 2013. – Т. 3, №2. – С. 77.
- Савченков, Ю.Н. Количественный анализ диффузионно-взвешенных изображений в дифференциальной диагностике метастатического поражения печени / Ю.Н. Савченков, С.С. Багненко, Г.Е. Труфанов, В.А. Фокин // Материалы VII Всероссийского Национального конгресса лучевых диагностов и терапевтов «Радиология 2013». – М., 2013. – Т. 3, №2. – С. 135.
- Багненко, С.С. Возможности диффузионно-взвешенных изображений в дифференциальной диагностике метастатического поражения печени колоректальной и панкреатической этиологии / С.С. Багненко, Ю.Н. Савченков, Г.Е. Труфанов // Вестник морского врача. – 2013. – №11. – С. 205–207.
- Савченков, Ю.Н. Количественный анализ данных МР-исследования с динамическим контрастным усилением в дифференциальной диагностике очагов метастатического поражения печени колоректальной и панкреатической этиологии / Ю.Н. Савченков, С.С. Багненко, М.В. Резванцев, Г.Е. Труфанов // Вестник морского врача. – 2013. – №11. – С. 256–257.
Список сокращений и условных обозначений
Арт – артериальная
Вен – венозная
ВИ – взвешенные изображения
ДКУ – динамическое контрастное усиление
ИС – интенсивность сигнала
КТ – компьютерная томография
Мин – минута
МР- – магнитно-резонансное(-ого)
МРТ – магнитно-резонансная томография
НПВ – нижняя полая вена
Тл – Тесла (единица индукции магнитного поля)
УЗИ – ультразвуковое исследование
MIP – Maximum Intensity Projection
3D VIBE – Three Dimension Volume Interpolated Breath-hold Examination – трехмерная импульсная последовательность объемного интерполированного обследования с задержкой дыхания

