Хроническая мигрень: клиника, патогенез, лечение
На правах рукописи
Артеменко Ада Равильевна
Хроническая мигрень:
клиника, патогенез, лечение
14.00.13. – Нервные болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва 2009 г.
Работа выполнена в ГОУ ВПО Московская Медицинская Академия
имени И.М. Сеченова Росздрава
Научный консультант:
доктор медицинских наук, профессор Орлова Ольга Ратмировна
Официальные оппоненты:
Член-корреспондент РАМН, доктор медицинских наук, профессор Карлов Владимир Алексеевич
доктор медицинских наук, профессор Левин Олег Семенович
доктор медицинских наук Рачин Андрей Петрович
Ведущая организация:
Российский Университет Дружбы Народов
Защита состоится « » ________________2009 года в _____ часов на заседании диссертационного совета Д. 208. 040. 07. Московской Медицинской Академии им. И.М. Сеченова по адресу: 119991, Москва, ул. Трубецкая, д. 8, стр. 2.
С диссертацией можно ознакомиться в Фундаментальной библиотеке Московской Медицинской Академии им. И.М. Сеченова по адресу: 117998, Москва, Нахимовский проспект, д. 49.
Автореферат разослан « » ______________________ 2009 года.
Ученый секретарь
диссертационного совета Д. 208. 040. 07.
доктор медицинских наук, профессор Дамулин Игорь Владимирович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Мигрень – одно из самых известных и распространенных неврологических заболеваний, встречающихся во взрослой популяции со средней частотой 12% [Lipton, 2001]. Хроническая мигрень (ХМ), являясь известной клинической проблемой, была выделена в отдельную форму головной боли только в 2004 году в Международной классификации головной боли второго пересмотра. Хроническая мигрень отнесена к осложнениям мигрени.
Мигрень, не являясь фатальным заболеванием, значительно снижает качество жизни пациентов [Осипова, 2003]. Всемирная Организация Здравоохранения относит мигрень к группе наиболее дезадаптирующих хронических заболеваний. Финансово-экономические затраты, связанные с временной нетрудоспособностью, а также с диагностикой и лечением мигрени огромны и сравнимы с затратами при сердечно-сосудистых заболеваниях [Stovner et al., 2007; Burton et al., 2009].
При ХМ головные боли становятся практически ежедневными (более 15 дней в месяц), что приводит к ещё более тяжелой дезадаптации пациентов, нарастанию прямых и непрямых затрат, связанных с мигренью, что имеет большое фармако-экономическое и медико-социальное значение [Goldberg, 2005; Steiner et al, 2007].
Количество пациентов с ХМ в общей популяции составляет от 0,4% до 2,4% [Castillo, 1999; Katsarava et al., 2008; Scher et al., 2009]. ХМ также относят к категории хронических ежедневных головных болей – наиболее сложной в диагностическом и терапевтическом смысле группе цефалгий, где ХМ составляет от 55% до 87% всех случаев [Katsarava et al, 2004; Bigal et al., 2008].
Большая распространенность ХМ среди лиц молодого трудоспособного возраста, выраженная дезадаптация и снижение качества жизни пациентов, социально-экономические последствия определяют интерес к этой проблеме [Осипова, Табеева, 2007; Латышева, Филатова, 2008; Bigal, Lipton, 2008]. Особо следует отметить трудности в диагностике и терапии этой давно известной, но недавно выделенной в отдельную форму головной боли [Алексеев, 2006; Rothrock, 2008; Silberstein et al., 2009].
До конца не ясны патогенетические механизмы ХМ, среди которых активно обсуждаются дисфункция антиноцицептивных систем ЦНС, изменение возбудимости коры головного мозга, периферическая и центральная сенситизация [Латышева, 2009; Pietrobon et al., 2003; Goadsby, Hargreaves, 2008; Aurora, 2009]. При определении риска развития ХМ рассматриваются: роль депрессии, тревоги, злоупотребления лекарственными препаратами для купирования приступов головной боли, дисфункции перикраниальных мышц и другие факторы [Bussone G., 2003; Bigal, Lipton, 2006; Katsarava et al., 2007; Dodick et al., 2009].
Недостаточно разработаны вопросы терапии ХМ: стандартные профилактические схемы лечения мигрени оказались мало эффективными, что потребовало дифференцированных и патогенетически обоснованных подходов к терапии.
Цель исследования
Изучение клинических особенностей хронической мигрени, уточнение ее патогенетических механизмов и разработка оптимальных подходов к лечению.
Задачи исследования:
- Определить социо-демографический портрет пациентов с ХМ.
- Выявить клинические особенности пациентов с ХМ в сравнении с мигренью без ауры c частыми приступами с учетом данных анамнеза, степени дезадаптации и нарушения качества жизни.
- Оценить значимость использования лекарственных препаратов для купирования головной боли как возможного фактора риска развития ХМ.
- Выявить основные коморбидные расстройства у больных с ХМ.
- Оценить патогенетическую роль возбудимости коры головного мозга по данным транскраниальной магнитной стимуляции (ТМС).
- Оценить состояние ноцицептивных и антиноцицептивных систем на уровне ствола головного мозга по параметрам RIII компонента МР и НФР.
- Уточнить роль мышечно-тонической дисфункции перикраниальных и шейных мышц при ХМ по данным клинико-нейрофизиологического тестирования.
- Оценить эффективность и выявить предикторы положительного ответа для трех видов профилактического лечения, воздействующих на разные звенья патогенеза ХМ: антиконвульсанта последнего поколения топирамата, антидепрессанта – селективного ингибитора обратного захвата серотонина и норадреналина – дулоксетина и локального миорелаксанта длительного действия – ботулинического токсина типа А (БТА).
Научная новизна
Впервые проведен детальный клинико-неврологический анализ репрезентативной группы пациентов ХМ с выявлением клинических особенностей и вариантов течения заболевания. Уточнены клинические критерии диагностики ХМ и перечень коморбидных заболеваний и нарушений.
Впервые проведен анализ феномена «фоновой» головной боли при ХМ. Использование клинико-нейрофизиологического подхода показало что феномен «фоновой» головной боли является одним из клинических проявлений центральной сенситизации.
Проведенное исследование показало, что ХМ является результатом многоуровневых нарушений функционального состояния нервной системы, оценить которое возможно только при комплексном нейрофизиологическом обследовании. Корковые нарушения проявляются изменением возбудимости корковых нейронов зрительной и, в меньшей степени, моторной коры; дисфункция ноцицептивных систем на уровне ствола мозга выявляется по изменению порога RIII-компонента МР, в то время как нарушение габитуации RIII-компонента свидетельствует о недостаточности антиноцицептивных влияний.
Вовлечение периферической нервной системы подтверждается облигатными длительно существующими мышечно-тоническими и миофасциальными нарушениями в перикраниальных и шейных мышцах, что свидетельствует о сенситизации периферических ноцицепторов на этом уровне.
Впервые показана значимая роль сенситизации периферических ноцицепторов миофасциальных перикраниальных структур в поддержании болевого синдрома при ХМ. Регресс проявлений периферической и центральной сенситизации при снижении болевой афферентации миофасциальных перикраниальных структур в ответ на введение БТА доказывает патогенетическое значение периферической сенситизации в поддержании центральной сенситизации.
Эффективность профилактического лечения ХМ не зависит от наличия/отсутствия фактора злоупотребления лекарственными препаратами для купирования приступа головной боли. Это справедливо для всех оцениваемых видов терапии, направленных на три звена патогенеза ХМ: антиконвульсанта последнего поколения топирамата, действующего преимущественного на корковом уровне; антидепрессанта группы селективного ингибитора обратного захвата серотонина и норадреналина дулоксетина, влияющего на церебральные антиноцицептивные системы и БТА.
Практическая значимость работы
- Для успешной терапии ХМ необходимо выявлять и корректировать наиболее значимые для формирования низкого качества жизни такие коморбидные нарушения как: тревога, другие хронические болевые синдромы экстракраниальной локализации, вестибулопатия и астения.
- Выявленные предикторы эффективности трех использованных препаратов для профилактического лечения ХМ облегчают подбор адекватной фармакотерапии в ежедневной клинической практике.
- Профилактическое лечение ХМ должно быть направлено на восстановление первичного паттерна заболевания – мигрени с эпизодическими приступами.
- У пациентов с ХМ, злоупотребляющих препаратами для купирования приступа головной боли, положительный эффект профилактического лечения может быть достигнут без проведения предварительной детоксикации.
Положения, выносимые на защиту:
- ХМ является результатом многоуровневых нарушений функционального состояния нервной системы с вовлечением коры и ствола головного мозга, а также ноцицепторов миофасциальных перикраниальных структур. Многоуровневые изменения лежат в основе клинических проявлений, объективно подтверждающихся результатами комплексного нейрофизиологического и анкетного тестирования.
- ХМ является обратимым состоянием. Патогенетически обоснованное профилактическое лечение позволяет добиться клинического улучшения с восстановлением первичного эпизодического паттерна головной боли, способствует регрессу функциональных нарушений нервной системы поддерживающих хронический паттерна головной боли при ХМ.
- Периферическая сенситизация ноцицепторов миофасциальных перикраниальных структур лежит в основе облигатных для ХМ персистирующих мышечно-тонических и миофасциальных нарушений и играет значимую роль в поддержании хронического болевого синдрома, являясь важным звеном патогенеза ХМ.
- Фактор злоупотребления лекарственными препаратами для купирования приступа головной боли не оказывает значимого влияния на эффективность профилактического лечения независимо от механизма действия выбранного препарата у пациентов с ХМ.
Внедрение результатов в практику.
Материалы диссертации используются при обследовании и лечении пациентов с ХМ и МбезА с частыми приступами в Отделе патологии вегетативной нервной системы ГОУ ВПО ММА им. И. М. Сеченова, на кафедре нервных болезней ФППОВ ГОУ ВПО ММА им. И. М. Сеченова при подготовке врачей-интернов, ординаторов и на циклах усовершенствования неврологов, в Клинике головной боли и вегетативных расстройств академика А. Вейна, в Академической клинике неврологии «Сесиль+».
Апробация работы. Основные положения диссертации доложены и обсуждены на II-ом Международном конгрессе «Восстановительная медицина и реабилитация 2005» (Москва, 2005), XIII Российский национальный конгресс «Человек и лекарство» (Москва, 2006), 8-ом Международном конгрессе Европейской Федерации головной боли (Валенсия, 2006), Российской научно-практической конференции с международным участием «Головная боль-2007» (Москва, 2007), Научно-практической конференции «Транскраниальная магнитная стимуляция и вызванные потенциалы мозга в диагностике и лечении болезней нервной системы» (Москва, 2007), Первом Всероссийском съезде врачей восстановительной медицины «РеаСпоМед 2007» (Москва, 2007), Научно-практической конференции «Современные аспекты нейрореабилитации» (Москва, 2007), XIII Конгрессе Международного общества головной боли (Стокгольм, 2007), Научно-практической конференции «Высокие технологии в терапии и реабилитации заболеваний нервной системы» (Москва, 2008), 6-ой международной конференции “Токсины 2008” (Бавено, 2008), 102-ом симпозиуме Международного центра биокибернетики Польской академии наук «Стимуляция мозга: транскраниальная и глубокая, старое и новое» (Варшава, 2009), Межрегиональной научно-практической конференции «Головная боль – актуальная междисциплинарная проблема» (Смоленск, 2009), Республиканской научно-практической конференции «Новые диагностические и лечебные технологии в неврологии» (Уфа, 2009).
Публикации: по теме диссертации опубликована 61 печатная работа, в том числе 7 статей в журналах, рецензируемых ВАК. Материалы диссертации вошли в практическое руководство для врачей «Методические основы транскраниальной магнитной стимуляции в неврологии и психиатрии», в монографию «Болевые синдромы в неврологической практике», в Медицинскую технологию «Лечение хронических головных болей препаратом Лантокс» и Медицинскую технологию «Лечение миофасциальных болевых синдромов препаратом Лантокс».
Структура и объем диссертации. Диссертация изложена на 195 страницах машинописного текста и состоит из введения, 4 глав (обзор литературы, материала и методов, изложения экспериментальной части собственных исследований и обсуждения полученных результатов), выводов, практических рекомендаций, библиографического указателя использованной литературы, включающего 166 источников литературы (из них 36 отечественных и 130 зарубежных) и приложения. Диссертация иллюстрирована 49 таблицами и 26 рисунками.
Материал и методы исследования
В исследовании приняли участие 392 человека, из них 362 пациента (Основная группа – 183 пациента с ХМ, Группа сравнения – 179 пациентов с МбезА с частыми приступами) и 30 здоровых испытуемых (Группа контроля).
Критериями включения в исследование были: 1) Возраст от 18 лет до 60 лет; 2) Соответствие диагноза хронической мигрени критериям МКГБ-IIR 2006 года [Headache>
Критериями исключения из исследования были: 1) наличие других типов ГБ; 2) наличие текущего органического неврологического заболевания; 3) наличие эндогенного психического заболевания; 4) алкоголизм, наркомании или злоупотребление бензодиазепинами; 5) дебют мигрени старше 50 лет.
При оценке клинико-демографических и нейрофизиологических показателей исследование было одномоментным. При оценке разных видов профилактического лечения исследование носило проспективный характер. После клинико-неврологического исследования все пациенты проходили анкетное тестирование и нейрофизиологическое исследование (табл. 1).
Таблица 1. Участники исследования.
| Показатели | Число больных | Возраст, лет |
| Клинико-демографические показатели: ХМ МбезА | 183 179 | 40,9±12,3 36,3±11,6 |
| Эффективность топирамата: ХМ МбезА | 68 32 | 40,9±12,1 38,6±10,0 |
| Эффективность дулоксетина: ХМ | 46 | 43,6±12,5 |
| Эффективность БТА (Allergan): ХМ МбезА | 70 40 | 41,7±11,9 38,2±11,1 |
Методы исследования
1. Клинико-неврологический: жалобы, анамнез, дневники головной боли, общеклинический и неврологический осмотры, в т.ч. пальпация перикраниальных и шейных мышц, рутинное параклиническое и инструментальное обследование для исключения симптоматических ГБ.
2. Анкетное тестирование включало стандартный набор из анкет и опросников. По шкале Бэка определялся уровень депрессии; по тесту Спилбергера (адаптация Ю.Л. Ханина) – личностная и реактивная тревожность. По Шкале балльной оценки проявлений синдрома вегетативной дистонии выявляли частоту и выраженность вегетативных нарушений. Также использовали Анкету субъективной оценки нарушений сна, Комплексный болевой опросник, Опросник качества жизни, Шкалу жизненных событий Холмса-Рея. Для оценки выраженности степени дезадаптации пациентов применялся Опросник оценки дезадаптации при мигрени (MIDAS).
3. Исследование мигательного рефлекса было использовано для оценки возбудимости тригеминальной системы по порогам регистрации МР по стандартной методике на электромиографе Keypoint (фирма Medtronic, Дания). Анализировались порог перцепции электрического стимула, пороги возникновения RI, RII и RIII компонентов МР, габитуация амплитуды RIII компонента.
4. Транскраниальная магнитная стимуляция использовалась для оценки возбудимости моторной коры по порогу ВМО. Возбудимость зрительной коры оценивали по порогу появления фосфенов. Определяли порог ВМО для правого/левого полушарий, число пациентов имеющих фосфены и порог фосфенеза; использован магнитный стимулятор MS6000 (фирмы ESAOTE Biomedica).
5. Исследование ноцицептивного флексорного рефлекса (НФР). Порог боли и его динамику на фоне лечения у пациентов ХМ и МбезА оценивали по НФР при электростимуляции икроножного нерва на миографе “Keypoint Portable” (фирмы Medtronic). Определяли порог боли, порог рефлекса и отношение порога боли и порога рефлекса.
6. Накожная ЭМГ мышц использовалась для оценки состояния лобных, височных, задне-шейных и трапециевидных мышц с обеих сторон.
Статистический анализ
Статистический анализ проводился с помощью программы Statistica 6.0 for Windows. Для определения средних величин и стандартных отклонений использовалась программа описательной статистики. Достоверность групповых различий для совокупностей оценивали с помощью U-критерия Уилкоксона-Манна-Уитни. Для выявления связи переменных применялся ранговый коэффициент корреляции Спирмена. Достоверными считались различия при p<0,05. Все показатели приведены в формате М±.
Для выявления предикторов эффективности каждого из использованных методов лечения проводился сравнительный анализ подгрупп пациентов ХМ: подгруппа 1 – пациенты с отсутствием/низкой эффективностью профилактического лечения, оцениваемого по снижению числа дней с ГБ/мес менее чем на 30%; подгруппа 2 – пациенты со средней (число дней с ГБ/мес меньше на 30-50%) и высокой (число дней с ГБ/мес меньше 50% и более) эффективностью профилактического лечения. Статистический анализ проводился по 260 клинико-анамнестическим и 25 показателям инструментальных исследований, 70 показателям анкетных исследований.
Результаты исследования и их обсуждение
Общая характеристика пациентов групп с ХМ и МбезА с частыми приступами. Группа пациентов с ХМ представлена на 92,9% женщинами среднего возраста (40,9±12,3 лет), 73% состояли в браке и 85% имели детей. Высшее образование было у 95%, работали 90% со средним и высоким уровнями дохода в 95% случаев. Самой частой причиной развития ХМ пациенты считали стрессовые события в личной жизни (64,6%) и длительный период напряженной работы (54,5%). В группе ХМ, по сравнению с группой МбезА с частыми приступами, ещё реже встречались мужчины (7% и 14% соответственно), пациенты были старше (средний возраст 40,9 года и 36,3 года, соответственно), 3% имели инвалидность, чаще представлены овдовевшие женщины (5% и 0,5% пациентов, соответственно). Среди «биологических» провокаторов тяжелого течения мигрени (ХМ или МбезА с частыми приступами) пациенты отмечали прием препаратов половых гормонов, вторые/третьи роды и наступление менопаузы.
Анализ коморбидных расстройств и сопутствующих заболеваний при ХМ показал, что 5 факторов (тревога, другие хронические болевые синдромы экстракраниальной локализации, вестибулопатия, астения, дисфункция перикраниальных мышц) встречаются более чем у 90% пациентов и могут считаться облигатными для ХМ. Достоверно чаще в группе ХМ относительно МбезА представлены: депрессия (57,7% и 39,9% соответственно), нарушения сна (70,8% и 43,6%), артериальная гипертония (14,6% и 5,2%), панические атаки/гивервентиляционные кризы (35,4% и 21,1%), ожирение (31,2% и 21,1%), межприступная фото- и фоносенситивность (72,9% и 34,2% соответственно).
В группе ХМ выявлен специфический паттерн перехода первичной МбезА в хроническую ежедневную или почти ежедневную ГБ через период, условно названный «ухудшением» первичной ГБ, когда учащались приступы мигрени и увеличивалось потребление лекарств для купирования приступа, реже отмечалась рвота в типичных приступах ГБ, появлялись редкие тяжелые длительные приступы ГБ слабо чувствительные к приему таблеток и требующие постельного режима; также появлялась тревога ожидания тяжелого приступа, страх развития некупируемой сильной ГБ и страх не справиться с подобной ситуацией. Период трансформации первичной ГБ в ХЕГБ длился в среднем 2,7 лет. Для ХМ достоверно характерен более ранний дебют МбезА, более длительный анамнез МбезА и частая наследственность по мигрени. Средний возраст дебюта ХМ – 38,1 лет; средняя длительность ХМ – 4,0 года.
В группе ХМ среднее число болевых дней в месяц было 26 (табл. 2). Из них 12,9 дней пришлось на приступы ГБ, соответствующие критериям МбезА.
Таблица 2. Характеристика пациентов ХМ и МбезА с частыми приступами.
| № | Показатель | ХМ (n=183) | МбезА (n=179) |
| 1. | Число дней с ГБ/мес | 26,0±4,1* | 8,9±3,5 |
| 2. | Приступы МбезА: дни в месяц | 12,9±5,7* | 8,9±3,5 |
| длительность, часы | 9,7±3,7^ | 8,0±4,2 | |
| интенсивность ГБ, баллы | 5,8±0,7* | 7,3±0,8 | |
| латерализация ГБ, % пациентов правая/левая/двусторонняя | 54/ 25/ 5 | 44/ 35/ 8 | |
| 3. | Тяжелые приступы МбезА: дни в мес | 4,8±2,9* | 2,9±2,0 |
| длительность, сутки | 1,5±2,3 | 1,8±1,9 | |
| интенсивность ГБ, баллы | 9,2±0,7 | 9,5±0,6 | |
| 4. | Число факторов-провокаторов ГБ | 11,8±1,2* | 7,1±1,4 |
| 5. | % пациентов, с фоновой ГБ | 77,0% | - |
| Число дней/мес с фоновой ГБ | 26,0±4,1 | - | |
| Интенсивность фоновой ГБ, баллы | 3,4±0,8 | - |
Различия между группами: * – р0,01; ^ – р0,06 (тенденция).
Характерно, что у пациентов с ХМ достоверно более частые приступы мигрени провоцировались достоверно большим числом факторов, имелась тенденция к затяжному течению, интенсивность боли в среднем была ниже, чем в группе МбезА. Однако число дней с тяжелыми ГБ, с болью максимальной интенсивности и выраженной дезадаптацией - достоверно выше в группе ХМ.
У 77% пациентов группы ХМ выявлялся феномен «фоновой» ГБ (табл. 2), развитие которой совпадало с дебютом ХМ. «Фоновая» ГБ – это постоянно присутствующая ГБ постоянной интенсивности, любой локализации и характера, но обязательно «привязанная»/или пересекающаяся с приступом МбезА. Оказалось, что «фоновая» ГБ не совпадает с болью в приступе мигрени ни по локализации (из 76% случаев нет совпадения в 64,8%), ни по качественным характеристикам боли (100% случаев), ни по интенсивности боли и по сопровождающим симптомам, а также мало- или нечувствительна к любым обезболивающим препаратам.
Пациенты с ХМ в среднем применяли препараты для купирования ГБ 25,2 дня в месяц, что соответствовало злоупотреблению. Число доз препаратов, применявшихся как в типичных, так и при тяжелых приступах ГБ было достоверно выше при ХМ, пациенты чаще и в большем количестве употребляли комбинированные аналгетики и триптаны (р0,01), но злоупотребление касалось лишь приема комбинированных аналгетиков (табл. 3). Больше пациентов с ХМ прибегало к парентеральным НПВС в тяжелых приступах ГБ (р0,01). До 85,8% пациентов с ХМ, принимали препараты с психотропными веществами/психолептиками; 71,6% пациентов с ХМ злоупотребляли препаратами для купирования ГБ, из них 71% – аналгетиками, 8% – триптанами, а 21% – и аналгетиками и триптанами одновременно. Средняя продолжительность лекарственного злоупотребления составила 4,1 года, и не превышала длительности ХМ (4,0 года). Злоупотребляемые препараты имели низкую эффективность: у 89,5% пациентов ХМ интенсивность ГБ снижалась до «терпимой».
В группе МбезА злоупотребление лекарствами отмечено в 19,0% случаев и в основном касалось злоупотребления аналгетиками (62,5%). Относительно группы ХМ, при МбезА больше пациентов злоупотребляли триптанами (р0,01). Средний период злоупотребления при МбезА был 2,5, а период «ухудшения» с частыми приступов ГБ в среднем составил 4,6 года.
Таблица 3. Препараты для купирования ГБ, используемые пациентами с ХМ и МбезА с частыми приступами.
| № | Показатель | ХМ (n=183) | МбезА (n=179) |
| 1. | НПВС/простые анальгетики | ||
| число таблеток/ в месяц | 5,9±12,2 | 4,0±8,6 | |
| дни приема препаратов/ в месяц | 4,3±8,1^ | 2,1±3,9 | |
| число доз/ сутки в приступе МбезА | 1,1±0,5 | 1,4±0,8 | |
| в тяжелом приступе МбезА | 1,3±0,8^ | 2,1±1,1 | |
| при фоновой ГБ | 0,7±0,4 | - | |
| парентеральное введение: % пациентов число дней в месяц | 70,0* 2,4±0,8 | 35,0 2,1±0,9 | |
| 2. | Комбинированные анальгетики | ||
| число таблеток/ в месяц | 43,9±46,1* | 11,6±12,9 | |
| дни приема препаратов/ в месяц | 15,8±11,3* | 5,0±4,9 | |
| число доз/ в сутки: в типичном приступе МбезА | 2,0±1,4 | 2,1±0,8 | |
| в тяжелом приступе МбезА | 2,9±1,6 | 2,7±1,1 | |
| при фоновой ГБ | 1,3±1,0 | - | |
| 3. | Триптаны | ||
| число таблеток/ в месяц | 7,5±15,6* | 2,6±5,4 | |
| дни приема препаратов/ в месяц | 5,0±8,2* | 2,0±3,7 | |
| число доз/ в сутки: в типичном приступе МбезА | 0,9±0,7 | 1,1±0,4 | |
| в тяжелом приступе МбезА | 1,6±0,7 | 1,6±0,7 | |
| при фоновой ГБ | 0 | - | |
| 4. | Показатели по всем препаратам | ||
| число таблеток/ в месяц | 57,8±44,9* | 17,1±11,5 | |
| дни приема препаратов/ в месяц | 25,2±8,6* | 9,2±6,1 | |
| число доз/ в сутки: в типичном приступе МбезА | 2,7±1,2* | 1,6±0,8 | |
| в тяжелом приступе МбезА | 4,3±8,3* | 3,0±1,0 | |
| при фоновой ГБ | 1,1±1,0 | - |
различия между группами ХМ и МбезА: * – р0,01; ^ – р0,06 (тенденция).
Результаты инструментальных исследований. По данным ТМС выявлялись различия между ХМ и контролем по показателям порогов ВМО и фосфенеза, р0,01 (табл. 4). Достоверно группы ХМ и МбезА отличались лишь по числу больных, у которых выявлен фосфенез.
При регистрации МР, по сравнению с контролем в группе ХМ отмечен низкий порог и нарушение габитуации RIII компонента (р0,01), в т.ч. у 31,2% пациентов с ХМ габитуация была минимальной или отсутствовала (табл. 4). Сходные изменения выявлены при сравнении МбезА с контролем, но грубые нарушения габитуации RIII-компонента встречались реже – у 17,8% пациентов.
Исследование НФР при ХМ, по сравнению с нормой выявило снижение порога боли, порога НФР и отношения порог боли/порог рефлекса (табл. 4). Результаты ЭМГ показали, что в состоянии расслабления у всех пациентов с ХМ и МбезА в перикраниальных и шейных мышцах имеется низкоамплитудная активность, свидетельствующая о мышечно-тонических нарушениях. По сравнению с ХМ, в группе МбезА, имелись более высокие показатели амплитуды биопотенциалов для лобных мышц и височных мышц (р0,01).
Данные анкетного тестирования. Опросник оценки дезадаптации при мигрени (MIDAS) выявил максимальную, 4-ю степень, дезадаптации при ХМ и МбезА. Абсолютные суммарные показатели MIDAS в группе ХМ в несколько раз превышали пограничное значение для 4-ой степени дезадаптации.
Несмотря на высокую степень дезадаптации, связанной с ГБ, в группе ХМ средние показатели по Шкале депрессии Бэка соответствовали легкой степени, показатель качества жизни – умеренной степени снижения. Это подтвердили данные комплексного болевого опросника: сохранялся жизненный контроль, при высокой поддержке значимого человека на фоне умеренного влияния боли на разные сферы жизни и степень эмоционального страдания. Анкетные показатели тревожности соответствовали выраженной степени. Оценка по анкете СВД также соответствовала выраженной степени. Показатели Анкеты количественной оценки субъективных характеристик сна подтверждали наличие инсомнии. По Шкале жизненных событий Холмса-Рея средний суммарный показатель по группе ХМ был >150 баллов, что соответствовало высокому риску развития психосоматических заболеваний.
Таблица 4. Результаты нейрофизиологического исследования при ХМ и МбезА
| № | Показатель | ХМ, n=183 | МбезА, n=179 | Норма, n=30 |
| 1. | ТМС: | |||
| Порог ВМО ( %): прав.полушарие лев. полушарие | 41,5±6,4^ 40,4±6,7* | 43,4±6,5 46,3±6,6 | 44,9±3,5 45,0±4,0 | |
| Наличие фосфенеза, % пациентов | 84,0* | 71,9` | 90,0 | |
| Порог фосфенеза (%) | 54,9±10,9^ | 59,5±13,7 | 60,9±7,9 | |
| 2. | Мигательный-RIII рефлекс: | |||
| Порог перцепции (мА) | 1,5±0,29 | 1,5±0,25 | 1,5±0,5 | |
| Порог RI-компонента (мА) | 5,8±1,9 | 6,1±1,4 | 5,6±1,4 | |
| Порог RII-компонента (мА) | 3,3±0,8 | 3,0±0,7 | 3,1±1,3 | |
| Порог RIII-компонента (мА) | 8,6±2,2^ | 8,3±1,7` | 9,6±1,5 | |
| Габитуация (% пациентов): нет | 3,1*^ | 0 | 0 | |
| габитуация RIII-компонента < 50% | 28,1*^ | 17,8` | 4,7 | |
| габитуация RIII-компонента >50% | 31,2^ | 25,0` | 10,0 | |
| полная габитуация | 37,5*^ | 57,2` | 85,3 | |
| 3. | НФР: | |||
| Порог рефлекса | 8,2±1,7^ | - | 10,3±1,7 | |
| Субъективный порог боли | 6,8±2,8^ | - | 9,8±1,8 | |
| Порог боли/порог рефлекса | 0,83±0,15^ | - | 0,95±0,2 |
р0,01 – * между ХМ и МбезА; ^ – между ХМ и нормой; ` МбезА и нормой.
Анализ пациентов ХМ, злоупотребляющих (ХМ+ЛЗ) и незлоупотребляющих (ХМ-ЛЗ) препаратами для купирования ГБ, показал, что пациенты в подгруппах ХМ+ЛЗ (71,6%), по сравнению с подгруппой ХМ-ЛЗ (28,4%) были старше, чаще имели инвалидность, более высокий индекс массы тела, чаще имели наследственность по мигрени. Пациенты ХМ+ЛЗ чаще принимали препараты для лечения других заболеваний. Приступы МбезА провоцировались достоверно большим числом факторов, чаще выявлялись признаки тревоги, депрессии, нарушений сна, хронические болевые синдромы в области шеи, спины и поясницы. В подгруппе ХМ+ЛЗ отмечалось более позднее развитие основных событий болевого анамнеза жизни: позже дебютировала первичная ГБ (мигрень без ауры) и в более старшем возрасте развивалась ХМ (р0,01). Длительность анамнеза первичной ГБ и ХМ также была выше, как и общая длительность приема препаратов для купирования ГБ, как аналгетиков, так и триптанов (р0,01). При этом длительность периода злоупотребления препаратами для купирования ГБ соответствовала длительности анамнеза ХМ. Все основные клинические характеристики болевого синдрома были достоверно тяжелее в подгруппе ХМ+ЛЗ.
По данным ТМС в подгруппе ХМ+ЛЗ, по сравнению с подгруппой ХМ-ЛЗ, пороги ВМО для правого и левого полушарий были ниже (р=0,06), а порог фосфенеза был выше (р=0,06). Однако степень различий между группами по обоим показателям не достигала достоверности. По данным МР различия между подгруппами ХМ+ЛЗ и ХМ-ЛЗ касались только показателя габитуации RIII-компонента: в подгруппе ХМ+ЛЗ достоверно чаще габитуация отсутствовала или была менее 50%. Показатели ЭМГ перикраниальных мышц достоверно не различались между подгруппами ХМ+ЛЗ и ХМ-ЛЗ; ЭМГ-активность в покое регистрировалась во всех исследованных мышцах и наибольшие значения отмечены симметрично для обеих височных мышц. Подгруппа ХМ+ЛЗ характеризовалась достоверно более высокими показателями по всем пунктам MIDAS, что указывало на более тяжелую дезадаптацию. Показатель депрессии по Опроснику Бэка был достоверно выше, как и показатели реактивной и личностной тревожности по тесту Спилбергера. Также подгруппа ХМ+ЛЗ характеризовалась достоверно более высоким показателем по Шкале жизненных событий Холмса-Рея.
Исследование эффективности топирамата в профилактическом лечении ХМ состояло из фазы титрования (3 недели) и фазы лечения (9 недель). Начальная доза топирамата была 25мг/сут с последующим наращиванием дозы по 25мг в неделю до однократной целевой дозы 100мг. Весь комплекс клинико-нейрофизиологических и анкетных исследований проводился до и после лечения. На 15, 30 и 60 дни лечения планировались визиты пациента для клинической оценки и контроля ведения дневника головной боли и лечения. Из 68 пациентов четверо отказались от лечения. В группе МбезА курс лечения топираматом закончили все 32 включенных в исследование пациента.
Рис. 1. Число дней с ГБ в месяц при ХМ и МбезА на лечении топираматом
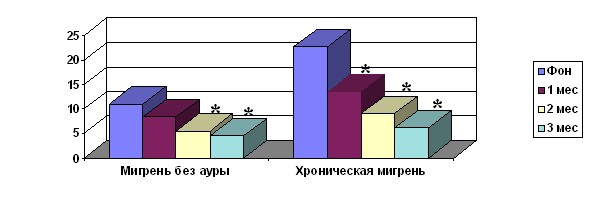
* – отличия от фоновых показателей (до лечения) (p < 0,05)
При ХМ прием топирамата привел к уменьшению числа дней с ГБ в месяц с 22,7±7,7 до 13,6±4,5 (p<0,05) в первый, до 9,1±3,6 (p<0,001) во второй и до 6,2±1,8 (p<0,001) в третий месяцы лечения (рис. 1). Таким образом, на фоне лечения топираматом среднее число дней с ГБ в месяц снизилось на 16,5 дней (p<0,001). Число респондеров составило 60,9% (для 3-го месяца лечения). Число приступов мигрени достоверно снижалось, начиная со 2-го месяца лечения: с 12,5±3,0 до 8,2±3,1 (p<0,05), а к окончанию лечения до 3,8±2,2; p<0,05. Интенсивность боли в приступе снижалась с 6,2±1,3 до 6,0±1,5 (p<0,08) в 1-й и до 5,0±1,2 (p<0,01) – во 2-ой месяцы, сохраняясь на этом уровне в течение 3-го месяца лечения (p<0,01). Наиболее заметно снижалась частота тяжелых приступов мигрени: с 5,7±1,7 до 1,5±2,7 (p<0,01) в 1-й, до 0,8±0,7 (p<0,001) – во 2-ой и до полного регресса в 3-й месяцы лечения (рис. 2).
Рис. 2 Число дней с тяжелыми приступами ГБ в месяц при ХМ и МбезА на лечении топираматом.
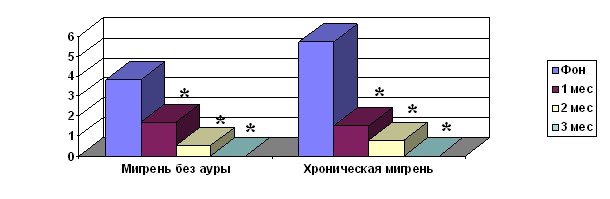
* – отличия от фоновых показателей (до лечения) (p < 0,05)
Прием топирамата снижал число пациентов с «фоновой» ГБ в группе ХМ, с 77% до 25% (p<0,01) через 1 месяц лечения, до 11,1% (p<0,001) через 2 и до полного регресса через 3 месяца лечения (p<0,001). Интенсивность «фоновой» ГБ снижалась с 3 баллов до 2 баллов (p<0,01) в 1-й и до 1 балла (p<0,01) во 2-ой месяцы. Общее число принимаемых таблеток для купирования ГБ уменьшалось с 52,5±12,8 до 14,9±9,2 (p<0,001) в 1-ый месяц, и с 13,4±6,0 во 2-ой месяц до 4,7±2,5 в 3-й месяц (p<0,001); число дней с приемом таблеток в месяц снизилось с 21,5±5,4 до 8,9±5,0 в 1-й месяц (p<0,01), до 7,3±3,0 во 2-ой и до 4,0±2,6 в 3-й месяцы (p<0,001). После приема топарамата в группе ХМ снижалась встречаемость и выраженность кожной аллодинии в зоне ГБ в приступе и в межприступном периоде, приводил к регрессу «фоновой» ГБ, исчезновению тяжелых длительных приступов, малочувствительных к препаратами для купирования приступа, что указывает на снижение центральной сенситизации болевых нейронов 2-го порядка.
На лечении топираматом снижалась встречаемость и интенсивность хронических болей экстракраниальной локализации, кожной аллодинии вне головы/лица, восстанавливалась эффективность привычных аналгетиков/триптанов, что вероятно связано со снижением центральной сенситизации болевых нейронов 3-го порядка.
На фоне лечения в группе МбезА снижалось число дней с ГБ в месяц с 11,0±2,5 до 8,4±3,7 (p<0,05) в 1-ый месяц, до 5,5±3,5 (p<0,001) во 2-ой и до 4,5±3,5 (p<0,001) в 3-й месяцы лечения. Число респондеров составило 56,2% (18 пациентов). Уменьшалась частота приступов, начиная с 8,4±1,8 до 5,6±2,8 (p<0,05) в 1-ый, до 4,4±1,9 (p<0,01) во 2-ой и до 3,6±2,6 (p<0,01) в 3-й месяцы.
При ХМ положительная клиническая динамика сочеталась с улучшением показателей качества жизни и показателей КБО по шкалам интенсивности боли, интерференции боли и степени эмоционального страдания (p<0,01). Наиболее показательной была динамика по MIDAS: суммарный показатель снизился с 96,7 до 10,5 дней (p<0,001) – пациенты из IV степени тяжести переходили во II степень с незначительной дезадаптацией. Показатели депрессии, тревоги, нарушений сна, вегетативных нарушений достоверно не изменились. В группе МбезА отмечена сходная динамика.
Лечение топираматом в группе ХМ привело к повышению порогов ВМО для правого полушария на 4,6±5,3%, для левого – на 4,2±6,7%, p<0,001 (табл. 5). Порог фосфенеза увеличился на 15,9±6,2% (p<0,001). После лечения топираматом в группе ХМ нет корреляции числа дней с ГБ в месяц и порогов ВМО и фосфенеза. Получена обратная корреляция (=0,355, p=0,01) между изменением числа дней с ГБ/мес и изменением порогов фосфенеза ХМ (до и 3 месяца после лечения). Получена обратная корреляция между числом дней с ГБ/мес и абсолютными показателями порогов ВМО как до, так и после лечения (коэффициент корреляции Спирмена): 1) порог ВМО для правого полушария до лечения – =0,534, p=0,002; 2) порог ВМО для левого полушария после лечения – =0,565, p=0,003; 3) порог ВМО для левого полушария до лечения – =0,523, p=0,002; 4) порог ВМО для левого полушария после лечения – =0,429, p=0,005.
Таким образом, клинический эффект топирамата при ХМ объясняется не только его влиянием на возбудимость зрительной коры, но также связан с его влиянием на возбудимость моторной коры. Низкие пороги ВМО могут считаться предикторами эффективности топирамата при ХМ.
В группе МбезА отмечены сходные изменения показателей ТМС относительно с группой ХМ (табл. 6). Пороги появления ВМО для правого полушария повысились на 4,3±5,1% (p<0,001), а для левого – на 4,2±6,9% (p<0,005). Порог фосфенеза возрос на 12,3±5,9% (p<0,001). Число пациентов с наличием фосфенеза увеличилось (p<0,01). Результаты свидетельствовали об однонаправленных изменениях в обеих группах ХМ и МбезА – прием топирамата снижал возбудимость моторной и зрительной коры.
Таблица 5. Возбудимость коры в группе ХМ (n=64) при лечении топираматом.
| Показатель | До лечения (%) | После лечения (%) |
| Порог ВМО, правое полушарие | 43,1±7,1 | 47,7±7,6* |
| Порог ВМО, левое полушарие | 45,3±8,2 | 49,5±10,2* |
| Наличие фосфенеза, % пациентов | 80,0 | 93,8* |
| Порог фосфенеза | 52,5±12,5 | 68,4±12,3* |
* – p<0,001 – отличия от фоновых показателей (до лечения)
Анализ изменений числа дней с ГБ в месяц и порогов фосфенеза при лечении топираматом в группе МбезА выявил обратную корреляцию (=0,553, p=0,002; рис. 3). Т.е., эффект топирамата при МбезА не объясняется его влиянием только на возбудимость зрительной коры. Нет корреляции между изменением дней с ГБ в месяц и изменением порога ВМО для правого (=0,115, p=0,53;) и левого полушария (=0,03, p=0,83).
Таблица 6. Возбудимость коры при МбезА (n=32) при лечении топираматом
| Показатель | До лечения (%) | После лечения (%) |
| Порог ВМО для правого полушария | 43,8±7,5 | 48,1±9,6* |
| Порог ВМО для левого полушария | 43,4±7,0 | 47,6±10,1 |
| Наличие фосфенеза, % пациентов | 71,9 | 80,2* |
| Порог фосфенеза | 59,5±11,0 | 71,9±12,3* |
* – p<0,01 – отличия от фоновых показателей (до лечения)
В группах ХМ и МбезА на лечении топираматом выявлялось повышение порогов RIII компонента МР, что предполагает ингибиторное действие топирамата на сенситизированные болевые нейроны 2-го порядка (нейроны ядра тройничного нерва) у пациентов ХМ и МбезА. Также увеличивалось число пациентов с габитуацией RIII компонента, что указывает на повышение активности антиноцицептивных систем ствола мозга. ЭМГ не выявила достоверных изменений показателей для перикраниальных и шейных мышц до и после лечения топираматом в группах ХМ и МбезА.
Рис. 3. Корреляция изменений дней с ГБ в месяц и изменения порогов фосфенеза при лечении топираматом в группе МбезА.
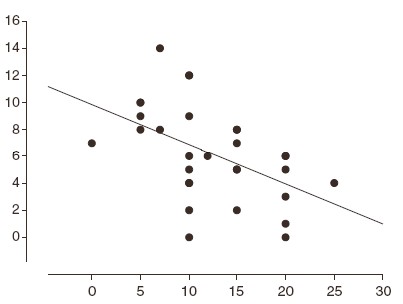
Выявлены следующие предикторы эффективности топирамата при ХМ:
- наличие тяжелых приступов МбезА; 2) кожная аллодиния в приступе МбезА; 3) наличие «фоновой» ГБ; 4) низкая эффективность предыдущего профилактического лечения; 5) низкие пороги ВМО и фосфенеза.
Сравнение пациентов с ХМ злоупотребляющих и не злоупотребляющих препаратами для купирования приступа ГБ показало, что факт злоупотребления не влияет на эффективность профилактического лечения топираматом.
Исследование эффективности дулоксетина в профилактическом лечении ХМ проводилось при монотерапии дулоксетином 60 мг/сут в течение 3 месяцев с комплексным клинико-нейрофизиологическим и анкетным тестированием до/после лечения. На фоне лечения дулоксетином снижалось среднее число дней с ГБ/мес с 25,8±5,3 до 10,5±3,9 дней (p<0,001) – в 3-й месяц лечения. Снизилась частота приступов мигрени с 11,3±3,8 до 6,8±2,5 (p<0,001) в 3-й месяц лечения. Уменьшилось количество дней приема препаратов для купирования ГБ: с 25,1±4,9 дней до 7,5±3,9 дней (p<0,001)– в 3-й месяц лечения. Снижалось число таблеток, принимаемых для купирования ГБ: с 46,6,0±14,7 до 8,5±10,6 таблеток (p<0,001) – в 3-й месяц лечения. Также снизилась интенсивность как «фоновой» ГБ – с 3,3±1,9 до 1,0±1,3 баллов (p<0,001), так и ГБ в приступе – с 6,4±2,5 до 4,1±1,9 баллов (p<0,01).
Число респондеров на лечении дулоксетином составило 50,0%. Достоверная динамика клинических показателей группы ХМ на лечении дулоксетином наблюдалась уже к концу 1-го месяца терапии. Регрессировали аллодиния на голове, лице, шее и руках и экстракраниальные хронические болевые синдромы. Снижались тревога, депрессия, проявления вегетативной дистонии, нарушений сна, улучшались показатели КБО, качества жизни в группе ХМ (табл. 7). Достоверно повышались субъективный порог боли и порог НФР. Отношение порог боли/порог НФР оставалось сниженным – 0,84±0,12. Увеличение порогов субъективной болевой чувствительности и НФР косвенно подтверждают повышение активности норадренергической и серотонинергической антиноцицептивных систем мозга. Нормализация порога и восстановление габитуации RIII предполагают влияние дулоксетина на активность антиноцицептивных систем ствола головного мозга (табл. 8).
Таблица 7. Анкетные показатели в группе ХМ на лечении дулоксетином.
| Показатель, баллы | До лечения | После лечения |
| Опросник Бэка | 10,8±3,7 | 3,8±1,9** |
| Опросник Спилбергера реактивная тревожность личностная тревожность | 41,2±8,8 48,9±9,6 | 35,4±8,0** 38,7±8,8* |
| Опросник СВД | 58,5±7,4 | 26,5±6,7* |
| Анкета нарушений сна | 17,8±4,9 | 21,1±6,3*** |
| Анкета качества жизни | 3,5±1,0 | 2,4±0,8* |
* p < 0,001; ** < 0,01; *** p < 0,05 – различия от показателей до лечения.
На лечении дулоксетином достоверно увеличивалось число пациентов, у которых выявлен фосфенез; порог фосфенеза снижался (p<0,01); значимых изменений порогов появления ВМО не отмечено. ЭМГ показатели перикраниальных мышц достоверно не менялись.
Таблица 8. Показатели МР в группе ХМ на лечении дулоксетином (n=46).
| Показатели | До лечения | После лечения |
| Порог RIII-компонента (мА) | 8,8±2,1 | 9,9±1,8* |
| % пациентов с габитуацией RIII | ||
| Отсутствует | 3,1 | 0* |
| Менее 50% | 57,0 | 19,0* |
| Более 50% | 28,7 | 25,0* |
| полная | 11,2 | 56,0* |
* p < 0,01 – различия от показателей до лечения (фон)
Выявлены следующие предикторы эффективности дулоксетина при ХМ: 1) наличие клинических признаков тревоги; 2) наличие клинических признаков депрессии; 3) наличие клинических признаков астении; 4) жалобы на нарушение ночного сна; 5) наличие панических атак; 6) жалобы на хронические болевые синдромы экстракраниальной локализации.
Фактор злоупотребления лекарственными препаратами для лечения приступа ГБ при ХМ не оказывал значимого влияния на эффективность профилактического лечения дулоксетином.
Исследование эффективности БТА в профилактическом лечении ХМ и МбезА проводилось в два этапа. На первом этапе у 70 пациентов с ХМ и 40 пациентов с МбезА оценивалась эффективность однократного введения 100 ЕД БТА. Комплексное клинико-нейрофизиологическое и анкетное тестирование проводилось до и через 3 месяца после введения БТА. На втором этапе оценивали эффективность повторных введений БТА: через 6 и 12 месяцев после первой инъекции.
При однократном введении БТА в группе ХМ число дней с ГБ/мес снижалось с 25 до 21– в 1-й месяц, до 16 – во 2-й и до 15 – в 3-й месяцы (рис. 4).
Рис. 4. Число дней с ГБ/мес после однократного введения БТА в группе ХМ (n=70) и группе МбезА (n=40).
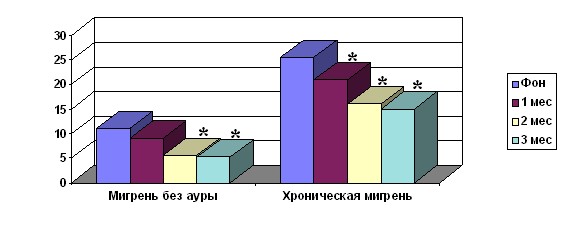
* – достоверные отличия от показателей до лечения (p < 0,05)
Интенсивность ГБ в приступе снижалась с 6,0 баллов до 5,5 баллов – в 1-й месяц, до 4,5 баллов (p<0,05) – во 2-й месяц и оставалось на этом уровне на 3-м месяце после инъекции БТА. Число таблеток препаратов для купирования ГБ снижалось с 60 до 45 таблеток (p<0,05) – в 1-й месяц, до 30 таблеток (p<0,01) – во 2-ой и до 25 таблеток (p<0,01) – в 3-й месяцы.
В группе МбезА с частыми приступами после введения БТА (рис. 4) число дней с ГБ/мес снижалось с 11,0 до 9,1 – в 1-й месяц, до 5,6– во 2-й и до 5,2 – в 3-й месяцы. Интенсивность боли в приступе снижалась с 7,3 баллов до 7,0 баллов в 1-й месяц, до 6,0 баллов (p<0,05) – во 2-й и до 5,5 балла (p<0,05) – в 3-й месяцы. Число таблеток для купирования ГБ менялось только со 2-го месяца (с 14 до 10 штук, p<0,05), а в 3-й месяц уже составляло 6 таблеток (p<0,01).
В группах ХМ и МбезА с частыми приступами динамика показателей анкетного тестирования была одинаковой: снижались показатели депрессии по Шкале Бэка, реактивной тревожности по Тесту Спилбергера, улучшалось качество жизни и показатели КБО (p<0,01).
Миорелаксирующий эффект БТА опережал начало обезболивающего действия на 2-3 недели. Катамнез показал, что обезболивающий эффект сохранялся до 6 месяцев (в среднем – 3,6 месяца). Выявляемые клинически мышечно-тонические нарушения в перикраниальных мышцах после однократного введения БТА значительно снижались и эффект удерживался до 3 месяцев. После однократного введения БТА у всех пациентов в группах ХМ и МбезА ЭМГ-активность перикраниальных мышц достоверно регрессировала (табл. 9).
После введения БТА, наряду с клиническим улучшением, отмечена нормализация порога и частичное восстановление габитуации RIII компонента МР (табл. 10).
Динамика числа респондеров была следующей: в группе ХМ: 27%, 40% и 41,4% через 1, 2 и 3 месяца, соответственно; в группе МбезА с частыми приступами: 29%, 48% и 50% через 1, 2 и 3 месяца, соответственно.
Таблица 9. ЭМГ-показатели через 3 месяца после однократного введения БТА в группе ХМ (n=70).
| Показатель справа/слева, мкВ | До лечения | После лечения |
| Лобная мышца | 20,0±9,1* /19,4±9,0* | 0 |
| Височная мышца | 26,7±7,6*/26,9±6,9* | 3,3±3,3/3,5±3,1 |
| Задне-шейная группа мышц | 14,9±9,0/14,6±9,4 | 15,0±9,2/14,7±8,9 |
| Трапециевидная мышца | 9,9±9,3*/9,4±7,4* | 5,0±5,2/5,1±4,8 |
* – p<0,01 – достоверные отличия от фоновых показателей
Таблица 10. Показатели МР в группе ХМ на лечении препаратом БТА (n=20).
| Показатели | До лечения | После лечения |
| Порог RIII-компонента (мА) | 8,4±2,2 | 9,6±1,6* |
| Габитуация RIII, % пациентов: нет | 5,0 | 0* |
| менее 50% | 55,0 | 25,0* |
| Более 50% и полная | 30,0 и 10,0 | 50,0* и 25,0* |
* p < 0,01 – различия от показателей до лечения (фон)
Выявлены следующие предикторы эффективности лечения БТА при ХМ: 1) напряжение и болезненность перикраниальных мышц при пальпации; 2) низкоамплитудная ЭМГ-активность покоя перикраниальных мышц; 3) кожная аллодиния в приступе ГБ; 4) низкая эффективность предыдущего профилактического лечения ХМ; 5) средние и низкие показатели тревоги по Тесту Спилбергера; 6) средние и низкие показатели депрессии по Шкале Бэка; 7) средние и низкие показатели вегетативных нарушений по Анкете вегетативных нарушений.
Во втором этапе исследования участвовали 30 пациентов с ХМ, которым повторно вводили 100 ЕД БТА в те же мышцы через 6 и 12 месяцев после первой процедуры. После второй процедуры в группе ХМ снизилось число дней с ГБ/мес с 22,2 до 19,0 – в 1-й месяц и до 13,9 (p<0,01) – в 3-й месяц после повторного введения БТА. Таким образом, после второй процедуры часть пациентов с ХМ перешли в группу с эпизодическими ГБ, перешагнув порог ГБ в 15 дней/мес. Однако, через 6 месяцев после второй процедуры число дней с ГБ/мес вновь увеличилось, и пациенты вернулись к исходному паттерну ХМ.
К сроку третьей процедуры введения БТА имелось достоверно меньшее число дней с ГБ в месяц по сравнению с показателем перед первым и вторым введением: 25,6 дней, 22,2 дней и 17,5 дней, соответственно. После третьей процедуры динамика изменения числа дней с ГБ/мес была такой же, как и после второй процедуры. Число дней с ГБ/мес снижалось с 17,5 до 15,0 – в 1-й и до 9,6 (p<0,01) –в 3-й месяцы после третьего введения БТА. Катамнез показал, что положительная динамика стабильно сохраняется в течение 6-ти месяцев и пациенты продолжают оставаться в группе МбезА с эпизодическими приступами: число дней с ГБ в месяц через 6 месяцев после последней инъекции составило 10,5 дней.
Число таблеток для купирования ГБ после второй процедуры в группе ХМ снижалось с 52,8 таблеток до 38,0 таблеток – в первый месяц и до 20,1 таблеток (p<0,01) – в третий месяц. К сроку третьей процедуры БТА пациенты употребляли достоверно меньше таблеток по сравнению с аналогичным показателем перед первым и вторым введением БТА: 60,9 таблеток, 52,8 таблеток и 38,5 таблеток, соответственно. После третьей инъекции число таблеток, применяемых для купирования приступов, снижалось с 38,5 таблеток до 31,0 таблеток – в 1-й и до 19,2 таблеток (p<0,01) – в 3-й месяцы. Мышечно-тонические нарушения перикраниальных и шейных мышц при ХМ, выявляемые пальпаторно, значительно регрессировали после введения БТА.
Через 6 месяцев после каждой процедуры введения БТА мышечно-тонические нарушения возвращались, что подтверждалось пальпацией и данными ЭМГ-обследования. Каждая последующая процедура введения БТА снижала мышечно-тонические нарушения не менее чем на 3 месяца. Число респондеров при лечении пациентов с ХМ введением БТА было следующим: 41,8% – после 1-ой, 50,0% – после 2-ой и 56,8% – после 3-ей процедур.
Заключение
Результаты анализа клинических, психометрических и анкетных показателей свидетельствуют о многоуровневых функциональных нарушениях нервной системы, участвующих в патогенезе хронической мигрени, а именно:
1) Гипервозбудимость коры головного мозга:
- максимальное число провоцирующих факторов приступа при ХМ – сенситивность к стимулам разных модальностей (зрительные, слуховые, ольфакторные, вестибулярные, эмоционально-аффективные и др.);
- повышенная чувствительность к свету, звукам, вестибулярным нагрузкам в межприступный период.
2) Центральная сенситизация болевых тригеминальных нейронов 2-го порядка:
- кожная аллодиния в приступе в зоне ГБ;
- «фоновая» ГБ, совпадающая по локализации с ГБ в приступе;
- кожная аллодиния в области головы и лица в межприступном периоде и при «фоновой» ГБ;
- неэффективность или низкая эффективность анальгетиков и триптанов, даже при условии адекватной дозы и своевременности приема;
- появление тяжелых длительных приступов мигрени, малочувствительных к лечению препаратами для купирования приступа.
3) Центральная сенситизация болевых таламических нейронов 3-го порядка:
- экстракраниальные хронические боли, высококоморбидные ХМ;
- кожная аллодиния за пределами головы/лица в приступе мигрени;
- кожная аллодиния за пределами головы/лица в межприступный период;
- «фоновая» головная боль, не совпадающая с ГБ в приступе по локализации, качественным характеристикам, интенсивности, сопутствующим симптомам, эффекту анальгетиков и триптанов.
4) Периферическая сенситизация ноцицепторов миофасциальных перикраниальных структур:
- облигатные длительно существующие мышечно-тонические и миофасциальные нарушения в перикраниальных и шейных мышцах;
- регресс мышечно-тонических и миофасциальных нарушений при снижении болевой афферентации в ответ на введение БТА.
5) Изменение эмоциональной, когнитивной и поведенческой модуляции боли. Вовлечение перечисленных уровней косвенно подтверждается изменением следующих анкетных показателей:
- снижение качества жизни;
- выраженная дезадаптация, связанная с ГБ;
- тревога, депрессия, вегетативные нарушения, нарушения сна;
- влияния ГБ на разные сферы жизни пациентов.
Комплексный клинико-нейрофизиологический анализ и анкетное тестирование показали, что для пациентов с ХМ+ЛЗ характерен достоверно более тяжелый синдром ГБ и степень дезадаптации. При этом, несмотря на достоверно более выраженные тревогу и депрессию относительно пациентов с ХМ-ЛЗ, уровни этих нарушений соответствовали легкой и умеренной степеням. Возможно, выбранный пациентами с ХМ+ЛЗ режим приема обезболивающих препаратов позволял справляться с тяжелым болевым синдромом и, тем самым, поддерживать работоспособность (до 95% из них продолжали активно работать) и удовлетворительный уровень качества жизни на фоне достоверно большего числа стрессовых жизненных событий.
Анализ фактора применения обезболивающих препаратов для купирования приступа мигрени в подгруппе ХМ+ЛЗ показал, что длительный регулярный прием препаратов на протяжении 18 лет не приводил к хронизации мигрени даже в подгруппе пациентов, применявших исключительно комбинированные анальгетики с входящими в их состав психолептиками. Развитию ХМ предшествовал период ухудшения течения первичной ГБ с нарастанием частоты и тяжести приступов и снижением эффективности купирующих приступ ГБ препаратов, длившийся в подгруппе ХМ+ЛЗ в среднем 2,7 года. Период ухудшения течения первичной МбезА и дебют ХМ совпадали со значимыми стрессовыми событиями в жизни пациентов и в дальнейшем с поддержанием большого количества стрессовых событий на протяжении длительного периода времени, что было подтверждено показателями Шкалы жизненных событий Холмса-Рея. Среди вероятных причин, способствующих развитию и стабильному поддержанию более тяжелого болевого синдрома при ХМ в подгруппе ХМ+ЛЗ, можно обсуждать:
- наследственность (семейный анамнез мигрени у 84% пациентов в подгруппе);
- возрастной фактор (поздний дебют первичной МбезА, более поздний дебют ХМ, более старший возраст пациентов подгруппы ХМ+ЛЗ);
- фактор длительности заболевания (длительность анамнеза первичной ГБ и анамнеза ХМ была достоверно выше);
- биологический/метаболический фактор (достоверно чаще дебют ХМ совпадал с наступлением менопаузы, пациенты имели достоверно более высокий индекс массы тела, чаще отмечался регулярный прием лекарственных препаратов по поводу соматических заболеваний);
- стрессовый фактор (значимые стрессовые события в дебюте ХМ и большое количество стрессовых событий на протяжении длительного периода времени).
В исследовании показана высокая клиническая эффективность длительного приема топирамата по 100 мг/сутки в лечении ХМ: статистически значимо снижались основные показателей тяжести мигрени (общего количества дней с ГБ в месяц, частоты и интенсивности приступов, особенно тяжелых приступов МбезА, а также количества препаратов, применяемых для купирования ГБ и регрессу «фоновой» ГБ). Отмечен высокий показатель числа респондеров (по критерию снижения количества дней с ГБ в месяц на 50% и более) – 60,9% в группе ХМ и 56,8% в группе МбезА с частыми приступами.
Терапевтический эффект топирамата развивался быстро, в течение первого месяца лечения. Медленное титрование дозы топирамата давало возможность амбулаторным пациентам хорошо и удовлетворительно переносить возникающие побочные эффекты и постепенно приспосабливаться к ним. Наряду с клиническим улучшением прием топирамата вызывал изменения параметров ТМС и мигательного рефлекса как в группе ХМ, так и группе МбезА. Характер изменений указывал на многоуровневое воздействие топирамата в ЦНС у пациентов ХМ и МбезА: на уровне коры головного мозга – снижение возбудимости нейронов моторной и зрительной коры, на уровне ствола головного мозга – воздействие на сенситизированные болевые нейроны второго порядка (нейроны собственного ядра тройничного нерва) и повышение активности антиноцицептивных систем ствола головного мозга.
Исследование эффективности дулоксетина в лечении ХМ показало его эффективность. Отмечено достоверное улучшение по всем клиническим параметрам, число респондеров составило 50,0%. Терапевтический эффект развивался медленно, только со второго месяца лечения. Наиболее значимыми для пациентов побочными эффектами были тошнота, тревога, повышение АД и дневная сонливость. Однако ни один из пациентов не прервал лечения из-за побочных эффектов, которые были преходящими и быстро регрессировали после отмены препарата. Прием дулоксетина приводил к достоверному повышению и субъективного порога боли, и порога НФР, а также к нормализации порога RIII компонента МР и восстановлению габитуации RIII компонента (по данным МР), что являлось косвенным подтверждением повышения активности норадренергической и серотонинергической антиноцицептивных систем мозга – основного механизма противоболевого действия антидепрессанта двойного действия. Хотя дулоксетин не обладает непосредственным аналгетическим действием, курсовой прием препарата приводил не только к снижению количества дней с ГБ в месяц, но и к достоверному уменьшению интенсивности ГБ. Таким образом, дулоксетин оказывает положительное влияние на основные клинические проявления ХМ и выраженность коморбидных нарушений. Клиническая эффективность дулоксетина вероятно связана с многоуровневым влиянием препарата на патогенетические механизмы ХМ: 1) влияние на активность антиноцицептивных систем на уровне ствола мозга, что выявлено при нейрофизиологическом тестировании; 2) влияние на активность ноцицептивных систем головного мозга (снижение центральной сенситизации болевых нейронов 2-го и, вероятно, 3-го порядка, что доказывается регрессом «фоновой» ГБ и аллодинии в области головы/ лица/ шеи/ рук, купированием хронических болевых синдромов другой локализации); 3) влияние на эмоциональную, когнитивную и поведенческую модуляцию боли, что проявляется снижением уровней тревоги, депрессии, регрессом пароксизмальных и перманентных вегетативных нарушений, нарушений сна и приводит к снижению влияния боли на различные сферы жизни пациента.
Исследование эффективности БТА при лечении ХМ показало, что однократное введение препарата БТА приводит к достоверному улучшению основных клинических показателей. Как правило, клинический «обезболивающий» эффект развивался более медленно, отставлено от миорелаксирующего действия БТА на 2-3 недели. Выявленный факт показывает, что миорелаксирующий и обезболивающий эффекты БТА напрямую не связаны между собой, что подтверждает наличие других механизмов обезболивающего действия БТА. Наряду с клиническим улучшением в группе ХМ на лечении БТА достоверно менялись показатели ЭМГ и мигательного рефлекса. Характер изменений указывал на многоуровневое воздействие препарата БТА: 1) снижение периферической сенситизации; 2) снижение центральной сенситизации на уровне ствола головного мозга; 3) повышение активности антиноцицептивных систем ствола головного мозга. В результате исследования выявлено, что наилучшие клинические результаты получены при повторных введениях БТА (трижды через шесть месяцев). Показатель респондеров после третьей инъекции – 56,8%. Повторное введение препаратов БТА пациентам с ХМ позволяет перевести их из группы ХЕГБ в группу с эпизодическими приступами мигрени, вернув паттерн первичной головной боли.
Сравнение подгрупп пациентов злоупотребляющих и незлоупотребляющих лекарственными препаратами для купирования ГБ не выявило достоверных различий по всем тестируемым клиническим параметрам. Таким образом, фактор злоупотребления лекарственными препаратами для лечения приступа ГБ при хронической мигрени не оказывал значимого влияния на эффективность профилактического лечения ни одного из исследованных препаратов.
ВЫВОДЫ
- Российская популяция пациентов с хронической мигренью имеет следующие социо-демографические характеристики: представлена в 92,9% случаев женщинами активного возраста (69% в возрасте 30-55 лет; средний возраст – 40,9±12,3 лет), имеющих благополучный семейный (73% в браке, 85% имеют детей) и социальный статусы (95% с высшим образованием, 90% работает, 95% со средним и высоким уровнями дохода). Субъективными причинами развития хронической мигрени в 64,6% являлись стрессовые события в личной жизни пациентов и период длительной напряженной работы, часто с ненормированным рабочим днем – в 54,5%; 84% пациентов обращались амбулаторно к врачам разных специальностей в среднем 3,4 раза в год; 71% пациентов обращались за скорой медицинской помощью в среднем 1,6 раз в месяц по поводу тяжелого приступа головной боли на фоне неэффективного использования «привычных» препаратов для купирования приступа.
- Для пациентов с хронической мигренью характерны следующие основные коморбидные расстройства: 1) тревога; 2) другие хронические болевые синдромы; 3) вестибулопатия; 4) астения и 5) напряжение перикраниальных мышц, каждое из которых отмечалось у 90% пациентов и более, что делает их облигатными для данной группы. Достоверно чаще в группе хронической мигрени, в сравнении с группой мигрени без ауры с частыми приступами, выявляются депрессия, нарушения сна, панические атаки/гивервентиляционные кризы, артериальная гипертония, ожирение, дискинезия желчевыводящих путей и/или холецистит.
- У всех пациентов с хронической мигренью в анамнезе выявлен специфический паттерн перехода первичной мигрени без ауры в хроническую ежедневную или почти ежедневную головную боль через период трансформации первичной головной боли. Период трансформации характеризуется учащением приступов мигрени, что сопровождалось повышенным потреблением лекарств для купирования головной боли, появлением тяжелых длительных приступов головной боли, малочувствительных к лечению таблетками и требующих постельного режима, развитием «фоновой» головной боли, при том, что рвота в приступах отмечалась реже и появлялась тревога ожидания тяжелого приступа, страх развития некупируемой сильной боли и страх самостоятельно не справиться с описанной ситуацией. Средняя продолжительность периода трансформации первичной головной боли в хроническую мигрень составляет 2,7 года.
- При хронической мигрени общее количество болевых дней в месяц составляло 26 дней, из них 12,9 дней приходилось на приступы, соответствующие критериям мигрени без ауры. По сравнению с группой мигрени без ауры с частыми приступами, в группе хронической мигрени приступы мигрени были достоверно чаще, с тенденцией к более затяжному течению, но менее интенсивные, провоцировались достоверно большим количеством факторов. Число дней с тяжелыми приступами мигрени с развитием максимальной интенсивности боли и выраженной дезадаптации было достоверно выше в группе хронической мигрени.
- У 77% пациентов с хронической мигренью выявлен феномен «фоновой» головной боли – постоянно присутствующей головной боли постоянной интенсивности, любой локализации и характера, но обязательно «привязанной»/или пересекающейся с приступами мигрени. Дебют «фоновой» головной боли совпадал с дебютом хронической мигрени, являясь одним из маркеров изменения привычного течения первичной головной боли. «Фоновая» головная боль не совпадала с ГБ приступа мигрени ни по локализации (у 76% пациентов), ни по качественным характеристикам боли (у 100% пациентов), ни по интенсивности болевого синдрома, ни по сопровождающим симптомам. «Фоновая» головная боль малочувствительна или нечувствительна к любым обезболивающим препаратам, и вероятнее всего вызвана развитием центральной сенситизации на уровне второго и, вероятно, третьего болевых нейронов.
- При хронической мигрени и мигрени без ауры с частыми приступами имеется сходная картина: по основным дескрипторам боли в приступе, локализации головной боли в приступе, сопровождающим симптомам, провоцирующим факторам, что подтверждает единство этих двух состояний. При хронической мигрени, по сравнению с мигренью без ауры, достоверно реже отмечается рвота и сонливость в приступе мигрени, а феномен аллодинии и необходимость постельного режима – отмечены достоверно чаще.
- Злоупотребление лекарственными препаратами для купирования головной боли при хронической мигрени отмечено у 71,6% пациентов. Из них 71% злоупотребляли аналгетиками, 8% – триптанами, 21% – злоупотребляли аналгетиками и триптанами одновременно. Средняя продолжительность лекарственного злоупотребления составила 4,1 года, что соответствовало длительности хронической мигрени как таковой (4,0 года). В группе хронической мигрени чрезмерно принимаемые препараты имели низкую эффективность: у 89,5% пациентов снижалась интенсивность боли до «терпимой».
- При хронической мигрени, по сравнению с контролем, выявлены следующие нейрофизиологические изменения: снижение порогов вызванных корковых моторных ответов и фосфенеза, снижение порога RIII компонента мигательного рефлекса, отсутствие/нарушение габитуации RIII компонента, появление низкоамплитудной ЭМГ-активности перикраниальных мышц. Независимо от информативности полученных нейрофизиологических изменений не выявлено биологических маркеров хронической мигрени вследствие значительных межиндивидуальных различий.
- Для профилактического лечения хронической мигрени из исследованных препаратов наиболее эффективным оказался топирамат: количество респондеров составило 60,9%. Предикторами эффективности топирамата являются: наличие тяжелых приступов мигрени без ауры с развитием аллодинии, низкая эффективность лекарственных препаратов для купирования острой боли, наличие «фоновой» головной боли интенсивностью от 4 баллов и выше, низкие пороги коркового вызванного моторного ответа и фосфенеза.
- При хронической мигрени на фоне лечения топираматом по данным ТМС достоверно снижается как возбудимость зрительной, так и в меньшей степени моторной коры. Между изменением числа дней с ГБ в месяц и изменением порогов фосфенеза на лечении топираматом выявлена обратная корреляция (=0,553, p=0,002), что не позволяет объяснить эффективность топирамата при хронической мигрени его влиянием только на возбудимость коры головного мозга. Нормализация порога RIII компонента мигательного рефлекса и восстановление габитуации RIII компонента предполагают влияние топирамата на сенситизированные болевые нейроны второго порядка (нейроны собственного ядра тройничного нерва).
- При хронической мигрени лечение дулоксетином является эффективным и приводит к достоверному снижению числа дней с головной болью в месяц, снижению частоты приступов головной боли, а также снижению количества препаратов, применяемых для купирования головной боли; показатель респондеров – 50,0%. Предикторами эффективности дулоксетина при хронической мигрени являются наличие выраженных коморбидных расстройств – тревоги, депрессии, астении, нарушений сна, панических атак, хронических болевых синдромов экстракраниальной локализации.
- Прием дулоксетина при хронической мигрени достоверно повышает субъективный порог боли и порог ноцицептивного флексорного рефлекса, а также нормализует порог RIII компонента и восстанавливает габитуацию RIII компонента мигательного рефлекса. Положительный эффект дулоксетина предполагает его влияние на активность антиноцицептивных систем головного мозга – как норадренергической, так и серотонинергической.
- При хронической мигрени эффективно лечение препаратом ботулинического токсина типа А. Наилучшие клинические результаты получены при повторных введениях препарата. Число респондеров составляет 41,8% – после первой процедуры, 50,0% – после второй и 56,8% – после третьей процедуры. Предикторами эффективности ботулинического токсина типа А при хронической мигрени являются: напряжение и болезненность перикраниальных мышц при пальпации, низкоамплитудная ЭМГ-активность перикраниальных мышц, кожная аллодиния, малая эффективность предыдущего лекарственного профилактического лечения, отсутствие или легкая степень коморбидных расстройств.
- Противоболевой эффект ботулинического токсина типа А, оцениваемый по данным клинического интервью, дневникам головной боли и анкетным данным и его миорелаксирующее действие по степени снижения ЭМГ-активности, не совпадают по времени относительно момента введения препарата и длительности эффекта. Выявленный факт показывает, что миорелаксирующий и обезболивающий эффекты ботулинического токсина типа А напрямую не связаны между собой, что подтверждает наличие других механизмов обезболивающего действия препарата.
- Сравнение подгрупп пациентов злоупотребляющих и незлоупотребляющих лекарственными препаратами для купирования приступа головной боли не выявило достоверных различий между группами пациентов по всем клиническим параметрам. Фактор злоупотребления лекарственными препаратами при хронической мигрени не оказывает значимого влияния на эффективность профилактического лечения взятых в исследование препаратов, причем, независимо от механизма их действия.
Практические рекомендации
- Для профилактики рецидива ХМ после эффективного профилактического лечения необходимо планирование следующих мероприятий: исключение факторов-провокаторов приступа, выявление и лечение коморбидных нарушений, индивидуальный подбор препаратов для лечения приступа мигрени. Соблюдение этих условий снижает риск повторного злоупотребления лекарственными препаратами для лечения головной боли и косвенно снижает финансовые затраты пациента на лечение.
- Клиническая оценка перикраниальных мышц является обязательной при работе с пациентами с ХМ для определения целесообразности использования препаратов БТА, обеспечивающих длительную локальную миорелаксацию тестированных мышц.
- Целью лечения ХМ должно быть восстановление паттерна первичной головной боли, что обеспечивает не только регресс симптомов заболевания, но и улучшение функционального состояния разных уровней центральной и периферической нервной системы.
- В случаях тяжелого течения ХМ для более точного определения препарата первого выбора рекомендовано комплексное нейрофизиологическое исследование с использованием ТМС для определения корковых порогов ВМО и порога фосфенеза, исследование мигательного рефлекса с определением порога RIII компонента и его габитуации, накожная ЭМГ для выявления низкоамплитудной ЭМГ-активности перикраниальных мышц в покое.
Список работ, опубликованных по теме диссертации
- Vein A.M., Kolosova O.A., Artemenko A.R., Ryabus M.V. Electromyography biofeedback versus Lerivon and Grandaxin in the treatment of episodic headaches. J. Cephalalgia Hungarica. 1999; N. 5: P. 438.
- Артеменко А.Р., Вейн А.М., Окнин В.Ю., Поморцева И.В. Грандаксин в коррекции психовегетативных расстройств невротической природы. Ж. Клиническая медицина. 1999; №6: 41-45.
- Mazurov A.V., Pukhalskaya T.G., Semenov A.V., Artemenko A.R., Petrova E.P., Vein A.M. Platelet aggregatory response and soluble P-selectin in migraine patients after treatment with vasobral. The International Journal of Neuropsychopharmacology. 2000; 3 (Suppl. 1): S256.
- Pukhalskaya T.G., Osipova V.V., Artemenko A.R., Menshikov M.Y., Efremova I.N., Vein A.M. Effects of steroid hormones on 5-HT uptake and release from rat brain synaptosomes and platelets of healthy subjects and migraine patients. The International Journal of Neuropsychopharmacology. 2002; 5 (Suppl. 1): S70.
- Pukhalskaya T.G., Artemenko A.R., Efremova I.N., Vein A.M. Sumatriptan inhibit adrenaline-sintesited human platelet aggregation induced by 5-HT. 14 Migraine trust international symposium. London, UK, 2002. Abstract LB 3. P. 23.
- Pukhalskaya T.G., Artemenko A.R., Mazurov A.V., Vein A.M. Biphasic platelet aggregation induced by 5-HT during aura phase of migraine attack: a case report. 6-th Headache congress EHF. Istanbul, Turkey, 2002. Abstract book. P. 59.
- Вейн А.М., Артеменко А.Р. Амигренин в лечении приступа мигрени. Журнал Лечение нервных болезней. 2003; Т. 4, №4 (12): 34-38.
- Окнин В.Ю., Артеменко А.Р. Азбука головной боли. Под редакцией А.М. Вейна. Москва: Эйдос Медиа, 2003. – 261 с.
- Артеменко А.Р., Орлова О.Р. Ботокс (токсин ботулизма типа А) в профилактическом лечении мигрени. Журнал Лечение нервных болезней. 2004; Т. 5, №2 (14): 14-18.
- Орлова O.Р., Мингазова Л.Р., Соколовай М.О., Артеменко А.Р., Куренков А.Л. Диагностические возможности электромиографии жевательных мышц при лицевых и головных болях мышечной природы и перспективы её использования в стоматологической практике. Материалы X Международной конференции челюстно-лицевых хирургов и стоматологов. Россия, Санкт-Петербург, 2005. С. 128-129.
- Артеменко А.Р., Куренков А.Л., Филатова Е.Г. Топамакс в профилактическом лечении мигрени (с оценкой влияния на возбудимость корковых нейронов двигательной и зрительной областей головного мозга). Журнал Лечение нервных болезней. 2005; Т. 6, №2 (16): 13-17.
- Артеменко А.Р., Орлова О.Р. Применение Ботокса в профилактическом лечении мигрени. Тезисы II Международного конгресса «Восстановительная медицина и реабилитация 2005». Россия, Москва, 2005. С. 6.
- Артеменко А.Р., Орлова О.Р. Изучение клинической эффективности Ботокса в профилактическом лечении мигрени. Тезисы XIII Российского национального конгресса «Человек и лекарство», Москва, 2006. С. 492.
- Артеменко А.Р., Орлова О.Р., Куренков А.Л. Применение препаратов ботулинического токсина типа А у пациентов с хронической мигренью. Тезисы IX Международной конференции «Высокие технологии восстановительной медицины: профессиональное долголетие и качество жизни». Россия, Сочи, 2006. С. 82-83.
- Артеменко А.Р., Орлова О.Р., Куренков А.Л. Возможности инъекций ботулотоксина типа А в лечении головных болей и их связь с эстетической коррекцией верхней половины лица. Тезисы V Международного симпозиума по эстетической медицине. Россия, Москва, 2006. С. 38.
- Куренков А.Л., Никитин С.С., Артеменко А.Р., Филатова Е.Г. Возбудимость зрительной и моторной коры в межприступный период у больных с мигренью. Тезисы IX Всероссийского съезда неврологов. Россия, Ярославль, 2006. С. 16.
- Артеменко А.Р., Орлова О.Р. Применение препаратов ботулинического токсина типа А в профилактическом лечении мигрени. Тезисы IX Всероссийского съезда неврологов. Россия, Ярославль, 2006. С. 6.
- Филатова Е.Г., Артеменко А.Р., Куренков А.Л. Симбалта в лечении хронической ежедневной головной боли. Тезисы IX Всероссийского съезда неврологов. Россия, Ярославль, 2006. С. 26.
- Артеменко А.Р., Куренков А.Л., Филатова Е.Г. Профилактическое лечение мигрени препаратом топамакс с оценкой влияния на возбудимость корковых нейронов. Тезисы IX Всероссийского съезда неврологов. Россия, Ярославль, 2006. С. 6.
- Никитин С.С., Куренков А.Л., Артеменко А.Р. Исследование возбудимости нейронов зрительной коры. В книге: Методические основы транскраниальной магнитной стимуляции в неврологии и психиатрии. – М.: ООО «ИПЦ МАСКА», 2006. – С. 36-39.
- Никитин С.С., Куренков А.Л., Артеменко А.Р. ТМС и мигрень. В книге: Методические основы транскраниальной магнитной стимуляции в неврологии и психиатрии. – М.: ООО «ИПЦ МАСКА», 2006. – С. 109-117.
- Никитин С.С., Куренков А.Л., Артеменко А.Р. рТМС в лечении мигрени. В книге: Методические основы транскраниальной магнитной стимуляции в неврологии и психиатрии. – М.: ООО «ИПЦ МАСКА», 2006. – С. 152-153.
- Артеменко А.Р., Орлова О.Р. Токсин ботулизма типа А в профилактическом лечении мигрени. Журнал «Consilium medicum». 2006; Т. 8, №2: 127-130.
- Артеменко А.Р., Куренков А.Л., Филатова Е.Г. Антидепрессант двойного действия Симбалта в лечении хронической ежедневной головной боли. Журнал Лечение нервных болезней. 2006; Т. 7, №2 (19): 29-33.
- Filatova E.G., Kurenkov A.L., Artemenko A.R., Nikitin S.S. Excitability of visual and motor cortex in migraine patients with and without aura. J. Headache Pain 2006; 7(Suppl. 1): S64-S65.
- Артеменко А.Р., Орлова О.Р., Куренков А.Л. Патофизиологические основы использования препаратов ботулинического токсина типа А в профилактическом лечении головных болей. Тезисы 1-го Всероссийского съезда врачей восстановительной медицины «РеаСпоМед 2007». Москва, 2007. С. 15-16.
- Артеменко А.Р. Возбудимость зрительной и моторной коры у больных с мигренью по данным ТМС. Материалы научно-практической конференции «ТМС и вызванные потенциалы мозга в диагностике и лечении болезней нервной системы». Москва, 2007. С. 3-7.
- Артеменко А.Р., Куренков А.Л., Филатова Е.Г., Никитин С.С. Динамика клинических проявлений и корковой возбудимости у пациентов с тяжелым течением мигрени на фоне лечения топираматом. Тезисы научно-практической конференции «Современные аспекты нейрореабилитации». Москва, 2007. С. 121.
- Артеменко А.Р., Орлова О.Р. Ботулинический токсин типа А: расширение возможностей терапии первичных головных болей. Журнал Врач. 2007; №5: С. 40-43.
- Артеменко А.Р., Куренков А.Л., Никитин С.С., Филатова Е.Г. Роль фармакологических нагрузок в изучении кортикальной возбудимости у больных мигренью. Журн. Неврологический вестник. 2007;Т.39,№ 1:С.49-53.
- Артеменко А.Р., Куренков А.Л., Филатова Е.Г. Эффективность дулоксетина при лечении хронической ежедневной головной боли. Журнал неврологии и психиатрии им. С.С. Корсакова. 2007; 107: 8: 24-28.
- Артеменко А.Р., Орлова О.Р. Ботулинотерапия – новый подход к профилактическому лечению первичных головных болей. Журнал неврологии и психиатрии им. С.С. Корсакова; Практическая неврология (приложение к журналу). 2007; 2: С. 45-49.
- Акарачкова Е.С., Воробьева О.В., Филатова Е.Г., Артеменко А.Р., Торопина Г.Г., Куренков А.Л. Патогенетические аспекты терапии хронических головных болей. Журнал неврологии и психиатрии им. С.С. Корсакова; Практическая неврология (приложение к журналу). 2007; 2: 8-12.
- Artemenko A.R., Kurenkov A.L., Filatova E.G., Kaube H., Katsarava Z. Effects of topiramate on migraine frequency and cortical excitability in patients with frequent migraine. Cephalalgia 2007; 27: 609.
- Артеменко А.Р., Орлова О.Р. Ботулинотерапия – новый подход к профилактическому лечению мигрени и других первичных головных болей. Журнал Эстетическая медицина. 2008; Т. VII, №2: 205-214.
- Артеменко А.Р., Орлова О.Р., Мингазова Л.Р., Куренков А.Л., Сойхер М.Г. Токсин ботулизма типа А в лечении болевых синдромов. Русский медицинский журнал. 2008; Специальный выпуск (Болевой синдром): 40-44.
- Артеменко А.Р., Орлова О.Р., Мингазова Л.Р., Куренков А.Л. Проблема боли в эстетической медицине. Журнал Kоsmetik international. 2008; 2: 52-60.
- Артеменко А.Р., Куренков А.Л., Никитин С.С. Оценка возбудимости зрительной и моторной коры у больных с мигренью с аурой и мигренью без ауры по данным ТМС. Тезисы научно-практической конференции «Высокие технологии в терапии и реабилитации заболеваний нервной системы». Москва, 2008. С. 20-21.
- Артеменко А.Р., Орлова О.Р., Куренков А.Л. Использование препаратов ботулинического токсина типа А в профилактическом лечении мигрени без ауры и хронической мигрени. Тезисы научно-практической конференции «Высокие технологии в терапии и реабилитации заболеваний нервной системы». Москва, 2008. С. 22-24.
- Куренков А.Л., Артеменко А.Р., Никитин С.С. Оценка состояния тригеминальной системы у больных с хронической мигренью по данным мигательного рефлекса. Тезисы научно-практической конференции «Высокие технологии в терапии и реабилитации заболеваний нервной системы». Москва, 2008. С. 113-115.
- Артеменко А.Р., Орлова О.Р., Куренков А.Л. Ботулинотерапия – новое направление в лечении первичных головных болей. Материалы Всероссийской научно-практической конференции «Головная боль-2007». Москва, 2008. С. 146-153.
- Куренков А.Л., Артеменко А.Р., Никитин С.С. Возбудимость головного мозга при первичных головных болях. Материалы Всероссийской научно-практической конференции «Головная боль-2007». Москва, 2008. С. 64-71.
- Артеменко А.Р., Куренков А.Л., Мингазова Л.Р., Орлова О.Р., Сойхер М.И. Комплексная реабилитация пациентов с эстетическими проблемами в области лица (с применением ботулотоксина типа А Лантокс). Журнал Экспериментальная и клиническая дерматокосметология. 2008; №5: С.53-58.
- Артеменко А.Р., Куренков А.Л., Мингазова Л.Р., Никитин С.С., Орлова О.Р. Ботулинический токсин типа А: на стыке неврологии и эстетики. Журнал Les nouvelles esthetiques. 2008; №6: С. 52-60.
- Яхно Н.Н., Орлова О.Р., Артеменко А.Р., Куренков А.Л., Мингазова Л.Р. Лечение головных болей препаратом лантокс. Медицинская технология. Разрешение на применение новой медицинской технологии – ФС №2008/288. Москва, 2008. 28 с.
- Яхно Н.Н., Орлова О.Р., Артеменко А.Р., Куренков А.Л., Мингазова Л.Р. Сойхер М.И. Лечение миофасциальных болевых синдромов препаратом лантокс. Медицинская технология. Разрешение на применение новой медицинской технологии – ФС №2008/287. Москва, 2008. 44 с.
- Artemenko A., Orlova O. Botulinum toxin type a in the treatment of chronic migraine and chronic tension-type headache. Toxicon 2008; 51: 45.
- Artemenko A.R., Kurenkov A.L., Filatova E.G., Nikitin S.S., Kaube H., Katsarava Z. Effects of topiramate on migraine frequency and cortical excitability in patients with frequent migraine. Cephalalgia 2008; 28: 203-208.
- Артеменко А.Р., Орлова О.Р., Куренков А.Л. Лечение вегетативных расстройств ботулиническим токсином типа А (Лантокс). Тезисы VIII Международного симпозиума по эстетической медицине. Москва, 2009.С.64.
- Куренков А.Л., Артеменко А.Р., Никитин С.С. Современные взгляды на механизмы действия ботулинического токсина типа А. Тезисы VIII Международного симпозиума по эстетической медицине. Россия, Москва, 2009. С. 64-65.
- Артеменко А.Р., Куренков А.Л. Амигренин (суматриптан): эффективное лечение приступа мигрени. Журнал Врач. 2009; №2: 23-26.
- Артеменко А.Р., Куренков А.Л., Никитин С.С. Оценка возбудимости зрительной и моторной коры у больных с хронической мигренью по данным ТМС. Тезисы Межрегиональной научно-практической конференции «Головная боль – актуальная междисциплинарная проблема». Россия, Смоленск, 2009. С. 147-149.
- Куренков А.Л., Артеменко А.Р., Никитин С.С. Состояние тригеминальной системы у больных с хронической мигренью по данным оценки мигательного рефлекса. Тезисы Межрегиональной научно-практической конференции «Головная боль – актуальная междисциплинарная проблема». Россия, Смоленск, 2009. С. 186.-187.
- Артеменко А.Р., Орлова О.Р., Куренков А.Л. Оценка эффективности и безопасности ботулинического токсина типа А в профилактическом лечении мигрени без ауры с частыми приступами и хронической мигрени. Тезисы Межрегиональной научно-практической конференции «Головная боль – актуальная междисциплинарная проблема». Смоленск, 2009. С.149-151.
- Бурсагова Б.И., Куренков А.Л., Кузенкова Л.М., Подклетнова Т.В., Артеменко А.Р. Детские периодические синдромы: взгляд детского невролога и педиатра. Тезисы Межрегиональной научно-практической конференции «Головная боль – актуальная междисциплинарная проблема». Россия, Смоленск, 2009. С. 161-162.
- Куренков А.Л., Артеменко А.Р., Никитин С.С., Орлова О.Р. Современные представления о механизмах действия ботулинического токсина типа А. Журнал Врач. 2009; № 7: С. 8-12.
- Артеменко А.Р., Орлова О.Р., Куренков А.Л. Ботулинотерапия вегетативных дисфункций препаратом Лантокс. Тезисы II ежегодной научно-практической конференции «Вегетативные расстройства в клинике нервных и внутренних болезней. Лечение вегетативных расстройств». Россия, Москва, 2009. С. 8-9.
- Куренков А.Л., Бурсагова Б.И., Артеменко А.Р., Кузенкова Л.М., Подклетнова Т.В. Детские периодические синдромы: подходы к лечению. Тезисы II ежегодной научно-практической конференции «Вегетативные расстройства в клинике нервных и внутренних болезней. Лечение вегетативных расстройств». Россия, Москва, 2009. С. 41.
- Артеменко А.Р., Куренков А.Л., Никитин С.С., Филатова Е.Г. Возможности эффективной патогенетической терапии хронической мигрени. Журнал Врач. 2009; № 11: С. 91-92.
- Nikitin S., Kurenkov A., Artemenko A. Excitability of visual cortex is a window for understanding of migraine pathophysiology: study with transcranial magnetic stimulation. 102nd ICB Seminar “Brain Stimulation: Superficial and Deep, Old and New”, Warsaw, Poland, 2009. Abstracts book. P. 34.
- Artemenko A., Kurenkov A., Nikitin S. Blink reflex and trigeminal system in chronic migraine. Cephalalgia 2009; 29 (Suppl. 1): 122.
Список сокращений
БТА – ботулинический токсин типа А
ВМО – вызванный моторный ответ
ВП – вызванные потенциалы
ГБ – головная боль
ГБН – головная боль напряжения
КБО – комплексный болевой опросник
МбезА – мигрень без ауры
МКГБ – международная классификация головных болей
МПП – межприступный период
МР – мигательный рефлекс
НПВС – нестероидные противовоспалительные средства
НФР – ноцицептивный флексорный рефлекс
ТМС – транскраниальная магнитная стимуляция
ХЕГБ – хроническая ежедневная головная боль
ХМ – хроническая мигрень
ХМ+ЛЗ –хроническая мигрень с лекарственным злоупотреблением препаратами, купирующими приступ головной боли
ХМ-ЛЗ –хроническая мигрень без лекарственного злоупотреблением препаратами, купирующими приступ головной боли
ЦНС – центральная нервная система
ЭМГ – электромиография

