Клинико-фармакологические подходы к оптимизации амбулаторной терапии бронхиальной астмы
На правах рукописи
Архипов Владимир Владимирович
Клинико-фармакологические подходы к оптимизации амбулаторной терапии
бронхиальной астмы
14.00.25 – «Фармакология, клиническая фармакология»
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва
2008
Работа выполнена в Научном Центре Экспертизы средств медицинского применения Росздравнадзора
Научные консультанты:
доктор медицинских наук, профессор Стародубцев Алексей Константинович
доктор медицинских наук, профессор Цой Алла Николаевна
Официальные оппоненты:
член-корр. РАМН, доктор медицинских наук, профессор
Гуськова Татьяна Анатольевна
академик РАМН, доктор медицинских наук, профессор
Палеев Николай Романович
академик РАМН, доктор медицинских наук, профессор
Орлов Владимир Аркадьевич
Ведущая организация:
ГОУ ВПО Московский Государственный Медико-стоматологический университет Росздрава
Защита диссертации состоится 15 сентября 2008 г на заседании Диссертационного Совета Д 208.040.13 при ГОУ ВПО Московская медицинская академия им. И.М. Сеченова Росздрава (119991, Москва, ул. Трубецкая, дом 8, стр. 2.)
С диссертацией можно ознакомиться в Центральной научной медицинской библиотеке ММА им. И.М. Сеченова по адресу:
117998, Москва, Нахимовский проспект 49.
Автореферат разослан «____»___________________ 2008 г.
Ученый секретарь
диссертационного совета Д 208.040.13
к.м.н. Архипов Владимир Владимирович: ___________________________
Общая характеристика работы
Актуальность работы
Данные первых фармакоэпидемиологических исследований, проведенных в нашей стране в последние годы (ФЕДА-2000 [Чучалин А.Г. с соавт., 2001], НАБАТ [Чучалин А.Г. с соавт., 2004], ИКАР [Чучалин А.Г. с соавт., 2003]) показывает, что общий уровень оказания медицинской помощи больным бронхиальной астмой (БА) далек от оптимального, а структура медикаментозных назначений часто не отвечает требованиям международных рекомендаций и национальных стандартов по фармакотерапии БА. Большинство больных, опрошенных в ходе подобных исследований, имели частые обострения БА и неоднократно госпитализировались в стационары. Кроме того, большая часть больных постоянно отмечали у себя те или иные симптомы БА и отличались низким уровнем качества жизни. В конечном счете, официальные статистические данные [Здоровье населения России и деятельность учреждений здравоохранения в 1999-2002г., 2003] свидетельствуют о сохранении высоких показателей смертности (более 750 случаев в год) и инвалидности среди больных БА.
В отечественной системе оказания медицинской помощи больным БА основная работа по подбору терапии и оценке ее эффективности ложится на терапевтов поликлиник, так как средняя обеспеченность специалистами – пульмонологами составляет только 14% от должного [Чучалин А.Г. с соавт., 2003]. Врачи, повседневно оказывающие помощь больным БА, нередко совершают ошибки в определении тяжести заболевания, выбирают дозы ингаляционных глюкокортикостероидов (ГКС), не несоответствующие тяжести течения БА, недостаточно интенсивно применяют современные противоастматические средства, а при неэффективности терапии неоправданно широко используют ГКС для приема внутрь, ксантины и другие препараты, прием которых связан с риском для пациентов.
Ошибки в фармакотерапии БА не только причиняют вред больным, но и тяжелым бременем ложатся на систему здравоохранения в целом, увеличивая число госпитализаций и объем экономически нецелесообразных затрат на льготное обеспечение больных лекарственными средствами. Таким образом, БА является также серьезной экономической проблемой [Геппе Н.А. с соавт. 2002; Медников Б.Л. с соавт., 1997], а общее бремя заболевания составляет более 100 тыс. рублей на одного больного в год [Цой А.Н. с соавт., 2007].
За последнее десятилетие международные и национальные рекомендации по фармакотерапии терапии БА неоднократно пересматривались. Например, русские версии «Глобальной инициативы для бронхиальной астмы» издавались в 1996, 2002 и 2006 гг. В 1999 г были подготовлены «Стандарты ведения больных с неспецифическими заболеваниями легких», а 2007 г - уже особый «Стандарт медицинской помощи больным астмой». Одновременно, в клиническую практику вошел ряд новых препаратов, рациональное применение которых у больных БА требует дополнительных знаний и навыков. В условиях быстрого обновления подходов к рациональной фармакотерапии БА трудно ожидать от врачей поликлинического звена быстрой адаптации к новым требованиям и стандартам.
Имеющиеся в нашем распоряжении руководства по фармакотерапии БА ориентированы в первую очередь на принципы доказательной медицины и результаты контролируемых клинических исследований. Между тем, в силу целого ряда причин, фармакодинамика и эффективность препаратов в реальной клинической практике может существенно отличаться от аналогичных показателей, полученных в более искусственных условиях клинических исследований. Например, в исследовании GOAL [Bateman E.D. с соавт., 2004] полный контроль над течением БА был достигнут почти у половины больных, получавших Серетид, в то время как российской практике, при использовании Серетида полный контроль булл получен только в 10% случаев [Цой А.Н. с соавт., 2006].
Подготовка национальных рекомендаций должна учитывать не только лишь данные международных контролируемых исследований, но и местные особенности: распространенность отдельных клинических вариантов течения БА, фармакодинамические показатели отдельных препаратов в реальной популяции российских больных, уровень знаний и навыков врачей.
На западе накоплен определенный опыт клинико-фармакологической и фармакоэпидемиологической оценки лечения БА. Материалы исследований «Asthma in America», AIRE [Rabe K.F. с соавт., 2000], INSPIRE [Partridge M.R., 2006] активно используются для оптимизации фармакотерапии БА. К сожалению, отечественным специалистам приходится сталкиваться с дефицитом фармакоэпидемиологических данных по РФ.
В итоге мы имеет целый комплекс проблем, требующих незамедлительного, по возможности простого и экономически оправданного решения, основанного на методах клинической фармакологии и фармакоэпидемиологии.
Цель исследования
На основании разнопланового клинико-фармакологического, фармакоэпидемиологического и экономического анализа ситуации с оказанием амбулаторной помощи больным БА разработать, обосновать и апробировать в ходе клинических исследований, комплекс мероприятий и подходов к оптимизации фармакотерапии БА в РФ.
Задачи исследования
- Дать клиническую оценку популяции больных БА, постоянно получающих противоастматические препараты.
- Охарактеризовать особенности фармакоэпидемиологии БА в различных регионах нашей страны.
- Выявить и дать оценку основных тенденций в использовании противоастматических препаратов за последние 5-7 лет.
- Идентифицировать типичные ошибки в фармакотерапии БА в различных регионах РФ.
- Оценить уровень знаний практических врачей по вопросам фармакотерапии БА и их представления о стратегии и тактике лечения больных БА.
- Изучить влияние обучения больных и врачей на качество фармакотерапии БА.
- Определить средний уровень эффективности рутинной фармакотерапии БА, оценить экономические затраты на ее проведение у различных групп больных. Охарактеризовать экономические последствия нерациональной фармакотерапии БА.
- Провести исследование фармакодинамики основных противоастматических препаратов в условиях реальной клинической практики.
- Оценить эффективность и экономические преимущества новых комбинированных препаратов (Формотерола/Будесонида и Сальметерола/Флутиказона) для фармакотерапии различных групп больных БА в условиях реальной практики и в условиях клинического исследования.
- Провести сравнительное исследование эффективности различных режимов дозирования комбинированного препарата Формотерол/Будезонид) для фармакотерапии БА.
- Оценить экономические преимущества терапии БА комбинированными препаратам.
- Разработать и обосновать комплекс рекомендаций по оптимизации фармакотерапии БА, опирающихся на результаты проведенных исследований.
Научная новизна
Работа является комплексным научным исследованием, посвященным всесторонней оценке качества фармакотерапии и обоснованию путей оптимизации медицинской помощи больным БА в амбулаторных условиях.
В ходе работы впервые в нашей стране проведено фармакоэпидемиологическое исследование БА, охватывающее 20 республик, краев и областей РФ (34 населенных пункта). На сегодняшний день это крупнейшее и наиболее репрезентативное фармакоэпидемиологическое исследование в нашей стране.
Впервые была проведена оценка фармакодинамики основных противоастматических средств в условиях реальной клинической практики. В результате были получены кривые «доза-эффект» для ингаляционных глюкокортикостероидов (ГКС), 2-адреностимуляторов длительного действия (LABA) и их комбинаций. Было доказано, что на определенном этапе даже значительно увеличение доз ингаляционных ГКС не приводит к дополнительному улучшению контроля над БА. Таким образом, впервые, были определены дозы этих препаратов, обеспечивающие максимальный терапевтический эффект в реальной практике, а не в условиях клинических исследований.
Впервые в нашей стране, на основании клинического исследования, доказана возможность обучения больных гибкому дозированию противоастматических средств, а так же эффективность подобного подхода для оптимизации терапии БА.
Впервые в стране выполнено крупное исследование качества знаний практических врачей по фармакотерапии БА, на основании которого можно сделать выводы о преобладающих представлениях и типичных ошибках в стратегии и тактике фармакотерапии БА. Исследование выявило взаимосвязь между «пробелами» в знаниях врачей и частотой ошибок в проведении фармакотерапии. В ходе работы были идентифицированы проблемные моменты, влияющие на качество медицинской помощи больным БА.
Впервые в мире проведено крупное проспективное наблюдательное исследование эффективности фиксированной комбинации Формотерол/Будезонида в условиях реальной клинической практики.
Практическая значимость
Результаты работы демонстрируют реальную и репрезентативную клинико-фармакологическую характеристику рутинной терапии БА в нашей стране и основные тенденции в фармакотерапии этого заболевания за последние 5 лет. Эти данные дополняются результатами экономического анализа проведенной терапии. Таким образом, материалы исследования позволяют научно обосновать административные мероприятия и целевые образовательные программы, направленные на уменьшения числа ошибок в амбулаторной фармакотерапии БА. Изучение представлений врачей о фармакотерапии БА и стратегии лечения этого заболевания могут быть использованы для планирования программ постдипломного обучения врачей.
Данные, полученные в ходе работы, позволяют экономически обосновать переход к более широкому использованию в клинической практике комбинированных лекарственных средств. Работа показывает, что не смотря на более высокую стоимость, применение таких препаратов существенно снижает общую стоимость терапии, благодаря уменьшению затрат на госпитализации и терапию обострений БА.
Результаты работы позволяют сформулировать комплекс предложений по оптимизации фармакотерапии БА в целом и по отдельным регионам нашей страны. В частности, полученные фармакоэкономические параметры имеют большое значение для планирования затрат на лечение больных БА на различном уровне и могут быть использованы при подготовке федеральных руководств по терапии БА. Представленные в работе данные позволяют научно обосновать отказ от использования более высоких доз ингаляционных ГКС в качестве единственного пути улучшения контроля над БА.
Внедрение в практику
Результаты исследования используются в учебном процессе на Кафедре клинической фармакологии и пропедевтики внутренних болезней ММА им. И.М.Сеченова. Кроме того, они применяются лись при разработке лекций для повышения квалификации врачей, проводимых в различных городах РФ Российским респираторным обществом в 2006-2008 гг. Материалы исследований применяются в работе Института клинической фармакологии и учебно-образовательных программах Учебного центра Научного центра Экспертизы средств медицинского применения Росздравнадзора.
Материалы исследования были использованы при подготовке ряда руководств для пульмонологов и терапевтов: раздел «Фармакология препаратов, воздействующих на дыхательные пути» в руководстве «Респираторная медицина» под ред. академика РАМН А.Г. Чучалина, соответствующие разделы в «Руководстве по проведению клинических исследований новых лекарственных средств», руководства для врачей «SMART – новая концепция терапии бронхиальной астмы» и «Бронхиальная астма: новые решения».
Положения, выносимые на защиту
1. Амбулаторная терапия БА в нашей стране требует существенной оптимизации. Значительная часть пациентов не получают адекватной терапии, соответствующей требованиям стандартов. Ошибки в фармакотерапии отрицательной сказываются на состоянии больных, увеличивают число обострений БА и госпитализаций, увеличивает общую стоимость лечения. Среди причин неадекватной терапии БА следует, в первую очередь, назвать недостаточный уровень знаний практических врачей, ошибки в диагностике БА и отсутствие у врачей навыков четкого выполнения стандартов лечения.
2. Фармакоэпидемиологическая и клинико-фармакологическая оценка рутинной фармакотерапии позволила идентифицировать ключевые проблемы, связанные с амбулаторным лечением больных (применение недостаточных доз ингаляционных ГКС, недостаточное использование длительнодействующих 2-адреностимуляторов и комбинированных средств). Мероприятия, направленные на решение этих проблем позволяют существенно увеличить качество медицинской помощи больным БА.
4. Исследование фармакодинамики ингаляционных ГКС в реальной популяции больных показывает, что даже значительное увеличение доз этих препаратов не позволяет существенно улучшить степень фармакологического контроля над БА. В то же время, комбинация ингаляционных ГКС с 2-адреностимуляторами длительного действия и гибкое дозирование комбинированных препаратов обладают существенно более высоким терапевтическим потенциалом, нежели высокие дозы ГКС.
5. Рутинная терапия БА, распространенная в нашей стране, является экономически неэффективной: сокращая расходы на приобретение препаратов базисной терапии, система здравоохранения теряет средства из-за неоправданно высокой частоты обострений БА и госпитализаций. Приобретение более современных препаратов для амбулаторного лечения БА позволит существенно снизить общее бремя заболевания благодаря уменьшению затрат на лечение больных в стационаре.
Апробация работы
Основные положения диссертации доложены и обсуждены на совместном заседании Института клинической фармакологии ФГУ Научный центра Экспертизы средств медицинского применения Росздравнадзора и Кафедры клинической фармакологии и пропедевтики внутренних болезней Московской медицинской академии им. И.М.Сеченова.
Результаты исследования были доложены на 16-м (Санкт-Петербург, 2006 г) и 17-м (Казань, 2007 г) Национальных Конгрессах по болезням органов дыхания; на XIII, XIV и XV Российских национальных конгрессах «Человек и лекарство» в 2006-2008 гг; на Конгрессе «Рациональное использование лекарственных средств: достижения и перспективы» (Москва, 2006 г). Основные положения диссертации в виде постерных докладов были представлены на Конгрессах Европейского респираторного общества (Мюнхен, 2006 г; Стокгольм, 2007 г) и на 10-м Конгрессе Международного общества фармакоэкономических исследований (Дублин, 2007 г).
Публикации
По теме диссертации опубликовано 25 печатных работ. В том числе, 9 статей в журналах, включенных в «Перечень ведущих рецензируемых научных изданий и журналов…» ВАК Министерства образования и науки РФ, одна монография и 4 публикации в коллективных монографиях и руководствах.
Объем и структура работы
Диссертация изложена на 216 страницах машинописи, иллюстрирована 104 рисунками, содержит 44 таблицы, состоит из введения, 16-ти глав, выводов и практических рекомендаций. Библиографический указатель содержит 188 отечественных и зарубежных источников.
Материалы и методы исследования
Работа основана на результатах нескольких исследований, проведенных автором в 2001-2007 гг. Часть из них относится к числу наблюдательных (неинтервенционных) исследований фармакоэпидемиологии и фармакоэкономики БА (см. таблицу 1). В ходе этих исследований у больных БА оценивался характер и объем врачебных назначений, сделанных по поводу БА. Интенсивность назначения отдельных препаратов оценивалась согласно утвержденной ВОЗ методологии по величине установленных суточных доз (DDD) на 100 пациентов. Кроме того, оценивались средние дозы ингаляционных ГКС и средняя потребность больных в приеме средств скорой помощи. Полученные данные анализировались в зависимости от тяжести течения БА.
В одном из этих исследований (Москва, 2001) была проведена парная оценка врачебных назначений в поликлиниках у больных до и после написания специалистом-пульмонологом индивидуального плана лечения, что позволило оценить эффективность данного мероприятия для повышения качества помощи больным БА.
Оценка качества фармакотерапии проводилась исходя из соответствия характера и объема назначений основным рекомендациям по клинической практике (Российская версия GINA) и одобренных МЗ и СР Стандартов лечения БА. Кроме того, путем анкетирования больных и из лечащих докторов, эффективность терапии оценивалась по числу обострений БА, частоте госпитализаций, количеству обращений за неотложной медицинской помощью. В московском исследовании 2003 г нами также была проведена оценка качества жизни пациентов по аналоговой шкале.
В Российском исследовании качества амбулаторной медицинской помощи больным БА мы также провели анкетирования 120 врачей из 20 регионов РФ. Это позволило определить представление врачей о стратегии фармакотерапии БА и получить сведения о мотивах, которыми врачи руководствуются при выборе отдельных противоастматических препаратов.
Анализ данных по фармакоэпидемиологии БА за последние несколько лет позволил нам определить долговременные тенденции в назначении лекарственных средств, выявить различия в качестве оказания медицинской помощи между Москвой и другими регионами РФ, а так же идентифицировать основные проблемы качества фармакотерапии БА в различных регионах страны.
Таблица 1. Наблюдательные исследования
| Название исследования, | Характеристика исследования | Число центров | Число больных |
| Фармакоэпидемиологическое исследование БА (Москва, 2001 г). Оценка влияния индивидуальных планов лечения на эффективность терапии БА | Проспективное наблюдательное фармакоэпидемиологическое исследование с оценкой результатов внедрения индивидуальных планов лечения | 1 | 70 |
| Фармакоэпидемиологическое исследование БА в Москве и Московской обл., 2003 г | Наблюдательное фармако-эпидемиологическое и фармакоэкономическое исследование | 56 | 338 |
| Российское исследование качества амбулаторной медицинской помощи больным БА в 34-х населенных пункта РФ | Наблюдательное фармако-эпидемиологическое исследование. Исследование затрат на терапию БА в условиях реальной практики. Оценка качества знаний врачей о фармакотерапии БА | 120 | 1362 (+ 120 анкет врачей) |
Наряду с наблюдательными исследованиями нами был проведен ряд клинических исследований у больных БА (см. таблицу 2). Эти исследования были посвящены оценке эффективности комбинированных препаратов для терапии БА при назначении в фиксированной дозе (2 исследования) и в режиме гибкого дозирования. Конечными точками для оценки эффективности препаратов в этих исследованиях были: обострения БА, качество жизни больных и степень контроля над течением БА.
Так же в работу включено исследование популяционной фармакодинамики ингаляционных ГКС, 2-адреностимуляторов длительного действия (LABA) и комбинированных препаратов. Данные для этого исследования были взяты из результатов фармакоэпидемиологических исследований.
На основании фармакоэкономической оценки реальной фармакотерапии БА в РФ было проведено сравнительное фармакоэкономическое модельное исследования «рутинная терапия» по сравнению с приемом Серетида и Симбикорта в режиме SMART.
Таблица 2. экспериментальные клинические исследования
| Название исследования | Характеристика исследования | Число центров | Число больных |
| Исследование клинической и фармакоэкономической эффективности формотерола/будесонида по сравнению с рутинной терапией БА | Сравнительное проспективное исследование с историческим контролем | 56 | 287 |
| Эффективность формотерола/будесонида в реальной клинической практике | Проспективное клиническое исследование в 34-х населенных пункта РФ | 120 | 1224 (1045 включено в анализ) |
| Исследование эффективности формотерола/будесонида при гибком и фиксированном дозировании | Сравнительное проспективное рандомизированное клиническое исследование | 40 | 501 |
Результаты исследований
1. Фармакоэпидемиология бронхиальной астмы в РФ: состояние проблемы
1.1 Характеристика больных БА, постоянно обращающихся в амбулаторные лечебные учреждения РФ
Проведенное нами анкетирование 1362 больных из 34 населенных пунктов РФ позволило получить представление о популяции больных, которые регулярно получают противоастматические препараты. В это исследование включались все больные старше 14 лет, давшие согласие на анкетирование, по мере их обращения в поликлиники и др. амбулаторные лечебные учреждения.
Среди больных, получающих медицинскую помощь по поводу БА, преобладали женщины (68%). Средний возраст таких больных составил 46 лет, в целом же 77% больных относились к лицам трудоспособного возраста. Средняя продолжительность заболевания у опрошенных больных составляет 12 лет. Анкетирование показало, что дебют БА может относится практически к любому возрасту, однако в большинстве случаев заболевание дебютировало в зрелом возрасте (31-50 лет). Большинство опрошенных больных (56%) обращались в поликлинику для получения рецепта или планового осмотра (20%), но в четверти случаев поводом для очередного посещения врача явилось обострение БА или ухудшение течения заболевания.
Считается, что в целом среди больных БА преобладают лица с легким течением заболевания, а на долю БА тяжелого течения приходится не более 10% случаев. Среди больных, которые регулярно обращаются за медицинской помощью в поликлиники, напротив, преобладают лица с тяжелым течением заболевания (71%) - см. рисунок 1. В восьми из 20-ти обследованных нами регионах (Краснодарский край, Брянская обл., Калужская обл., Кировская обл., Курская обл., Московская обл., Орловская обл., Ростовская обл.), на долю больных с тяжелым течением БА приходилось более всех случаев, попавших в поле зрения исследования.
Подавляющее большинство посетителей поликлиник даже в стабильном состоянии, следует отнести к категории лиц с неконтролируемым течением БА. Анкетирование показало, что в течение недели 84% больных отмечали одышку или удушье в дневные часы, 75% больных постоянно беспокоит кашель, а 74% - хотя бы один раз просыпались ночью из-за симптомов БА. Только 4% опрошенных не отмечали у себя никаких проявлений заболевания.
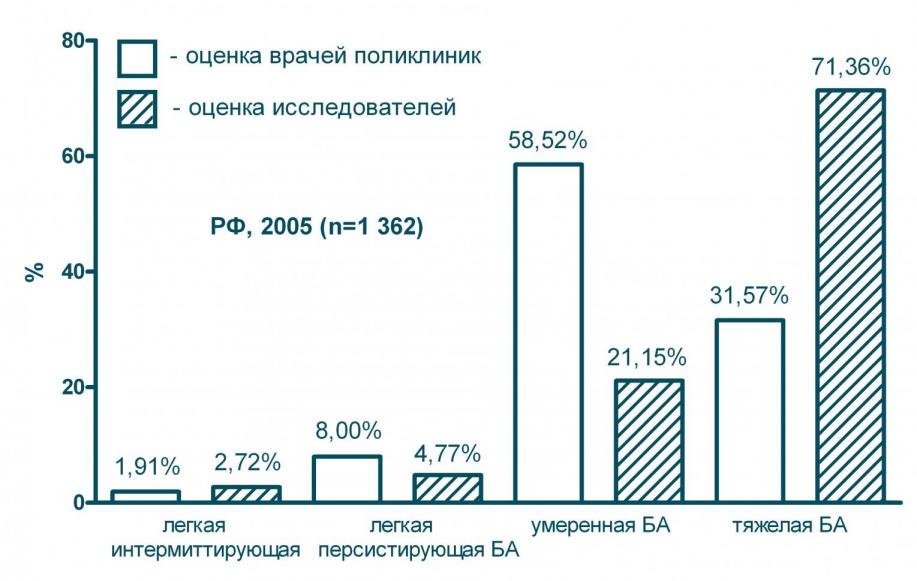
Рисунок 1. Распределение больных - посетителей амбулаторных лечебных учреждений РФ по тяжести течения БА
Из числа больных 64% применяют бронхолитики для купирования симптомов БА чаще одного раза в день, и еще 9,5% используют эти препараты, по крайней мере, 1 раз в день. Больные, заполнившие анкеты, в среднем только 13,9 ночей в месяц не отмечали пробуждений из-за симптомов БА, а число дней, свободных от симптомов БА и дней без использования средств скорой помощи составило в среднем 5,7 и 6,1, соответственно.
Количественное представление о среднем уровне контроля над БА дает оценка в баллах по шкале контроля над БА – ACQ [Juniper EF et al., 1999]. В 2003 г средний уровень контроля над БА у больных в г. Москве составлял 19,3 баллов [18,17 до 20,33] у взрослых и 18,6 баллов [17,09-20,01] у подростков и детей.
Опрошенные больные были вынуждены достаточно интенсивно использовать ресурсы системы здравоохранения: в среднем каждый больной за год 12,9 раз обращались в поликлинику и 5,6 раз вызывали скорую медицинскую помощь. Только 40% опрошенных не имели в течение года госпитализаций по поводу БА, в то же время у 18% за год насчитывалось две и более госпитализации. В среднем за год больные отмечали 9,5 случаев обострения БА любой тяжести.
1.2 Оценка больными своего состояния
Большинство больных (53%) полагают, что они получают наиболее эффективные препараты из числа существующих. Еще 21% опрошенных полагают, что им могли бы назначить более эффективные средства, нежели те, которые они получали (26% опрошенных затруднилось ответить на этот вопрос). Не смотря на доверие к назначаемым средства только 12% опрошенных считают свое лечение эффективным, 55% - недостаточно, а 33% - неэффективным. Интересно отметить, что оценка эффективности терапии, сделанные больными и их лечащими врачами практически полностью совпадают.
В 2003 г мы провели исследование качества жизни у 338 больных БА в г. Москве. Оказалось, что пациенты оценивали качество своей жизни (в % от максимально возможного) в среднем на уровне 38% [32,7 до 42,7], а при тяжелом течении БА - 48% [44,0 до 52,3].
Не смотря на то, препараты для лечения БА оплачивались в рамках ДЛО, большинство больных (59%) заявили, что готовы приобретать дополнительные средства (в среднем на 1269 руб./мес.) если это позволит улучшить их повседневное состояние.
1.3 Стратегия лечения БА – мнение врачей
В нашем исследовании приняло участие 120 врачей, регулярно оказывающих медицинскую помощь пациентам БА. Основная масса опрошенных нами врачей (51%) работала в районных поликлиниках, еще 7% - в поликлиниках при промышленных предприятиях. 36% - в различных клинико-диагностических центрах, наконец, 6% в качестве места работы назвали различные лечебные учреждения, осуществляющие медицинскую помощь на коммерческой основе. Таким образом, в нашем исследовании были представлены практически все виды лечебных учреждений, осуществлявших амбулаторную помощь больным БА. Средняя продолжительность работы по специальности у опрошенных нами врачей составляла 16±8 лет.
При решении вопросов связанных с диагностикой и фармакотерапией БА большинство (88%) врачей применяют сразу несколько руководств или стандартов различных лет, в том числе документы, содержащие разные критерии оценки тяжести течения БА и различные рекомендации по лечению БА. Вместе с тем, 95% опрошенных заявило, что в своей практике они ориентируются на требования российской версии GINA, а на официальные «Стандарты (протоколы) диагностики и лечения больных с неспецифическими заболеваниями легких» ориентировалось менее 70% опрошенных.
Исследование выявило существование «разрыва» между знаниями и представлениями врача с одной стороны и теми решениями, которые врач принимает в конкретных случаях. Например, в качестве основной цели фармакотерапии БА 41% опрошенных назвали «полное отсутствие симптомов», в то время как менее строгие требования, указанные в изданиях GINA 1996 и 2002 гг высказались лишь 28% опрошенных. Между тем, оценка анкет больных, которые наблюдались у сторонников более «мягких» и более «жестких» критериев не выявила достоверных различий в уровне контроля над БА.
Отвечая на другой вопрос 63% высказались за наращивания доз ингаляционных ГКС для достижения более хороший показателей контроля над БА, в то же время 37% опрошенных высказалось против данной тактики. Однако, как и в предыдущем случае, средние дозы, назначавшиеся врачами, исповедующими различные стратегии терапии не отличались между собой.
Отвечая на вопрос о наиболее эффективных препаратах для терапии БА большинство врачей отдали свои голоса препаратам Симбикорт, Серетид, Фликсотид и Пульмикорт. Однако на практике эти препараты были назначены только у 24% больных. Сказанное можно было бы отнести на счет недостатка средств, однако исследования показало, что четыре препарата, которые наиболее часто врачи расценивали как «неэффективные» назначались у 27% больных (кроме того, три из этих четырех препаратов – продукты западных фармацевтических компаний и не могут быть отнесены к числу дешевых).
Врачи, вынуждены признавать, что только в 13% случаев их пациенты получают потенциально эффективное лечение.
1.4 Фармакотерапия БА – роль врачебных ошибок
Анкеты, заполненные больными, позволили определить тяжесть течения заболевания у каждого пациента и сравнить результат с диагнозом, поставленным лечащим врачом. Оказалось, что в 55,2% случаев врачи неправильно оценивали тяжесть течения БА (см. рисунок 1). Ошибки в диагностике носили систематический характер: в 84% от всех неправильных диагнозов речь идет о недооценке тяжести заболевания. Высокая доля ошибок вероятно связана с недостаточным знанием критериев тяжести заболевания: интерпретируя состояние пациента врачи оценивали лишь частоту отдельных симптомов, но не учитывали характер проводимой базисной терапии.
Это приводит к полному несоответствию диагноза и назначенного лечения. Например, среди больных, у которых был установлен диагноз легкой интермиттирующей БА, 15% получали ингаляционные ГКС, еще столько же ингаляционные ГКС в сочетании с LABA, а у 11% больных с этим диагнозом ГКС были назначены внутрь.
Среди больных с диагнозом легкой персистирующей БА, вопреки рекомендациям GINA, 64% опрошенных не получали ингаляционные ГКС. А при БА умеренного течения 21% не получали ингаляционные ГКС, только 11% больных получали комбинированную (ингаляционные ГКС и LABA) терапию, но наряду с этим 9% пациентов принимали ГКС внутрь. Наконец, среди больных у которых течение заболевания врачи расценивали как тяжелое 6% пациентов не получали ингаляционные ГКС, на долю комбинированной терапии приходилось только 24% случаев и неоправданно большое число больных (39%) получало ГКС внутрь. Таким образом, адекватную тяжести состояния терапию получали в среднем 53,5% больных.
Еще одним следствием ошибок в определении тяжести БА больных является несоответствие доз ингаляционных ГКС состоянию больных. Поскольку в большинстве случаев речь идет о недооценке тяжести БА у больных с умеренным и тяжелым течением имеет место использование недостаточных доз ГКС (в среднем 92% и 63% от уровня, рекомендованного GINA, соответственно). У московских врачей ошибки в определении тяжести течения БА отмечались существенно реже, чем в целом по стране – 6,3% (по сравнению с 55,2% по 34-м городам РФ). Как следствие, средние дозы ингаляционных ГКС, применяемые в Москве у больных с умеренной и тяжелой БА достоверно выше, чем в регионах (P<0.0001).
1.5 Применение ингаляционных ГКС
Ситуация с назначением основных противоастматических препаратов – ингаляционных ГКС – до сих пор нуждается в оптимизации. Проведенные нами исследования показали, что из числа больных с персистирующей БА 20,3% до сих пор не получают эти препараты. В Москве доля пациентов, которые не получают эти средства составляет 18,9%. Таким образом, проблема недостаточного применения ингаляционных ГКС одинаково актуальна как для регионов РФ, так и для Москвы. Более того, отдельные регионы отличаются особенно низкой интенсивностью применения ГКС, например в Башкирии, Краснодарском крае и Курской области эти средства получает менее половины больных, в то же время в Смоленской и Белгородской областях эти препараты назначались практически всем больным. Низкая интенсивность назначения ингаляционных ГКС не может объясняться экономическими причинами, так как в распоряжении врачей имеется целый ряд доступных по стоимости генерических препаратов.
Другой важной особенностью использования ингаляционных ГКС в нашей стране является применение этих препаратов в недостаточных дозах. Моделирование с пересчетом доз ингаляционных ГКС эквивалент беклометазона дипропионата при БА умеренного течения показывает, что в большинстве регионов средние дозы препаратов не достигают рекомендованного GINA уровня. Так в 5-ти регионах из 20-ти 95% больных получающих ГКС, принимают их в дозах ниже оптимальных. И лишь в Московской, Калужской и свердловской областях большинство (95%) больных получают ингаляционные ГКС в достаточных дозах – см. рисунок 2.
В результате 41% больных БА в РФ получают ингаляционные ГКС в дозах ниже оптимальных (причем 10% получают не более 200 мкг в пересчете на БДП), 55% - адекватные дозы, а 4% - завышенные. В Москве ситуация с назначением ингаляционных ГКС – значительно лучше: эти препараты в дозах ниже необходимых получают только 11% пациентов.
Недостаток ингаляционных ГКС восполняется чрезмерно активным применением ГКС для приема внутрь. В регионах РФ их назначают 18% больных, для сравнения в Москве – только 2% больных (см. таблицу 3). В Московской и Курской областях, а также в Краснодарском крае ГКС внутрь получали более 30% больных, а для Башкирии и Орловской области аналогичный показатель составлял 20-30% от общего числа больных.
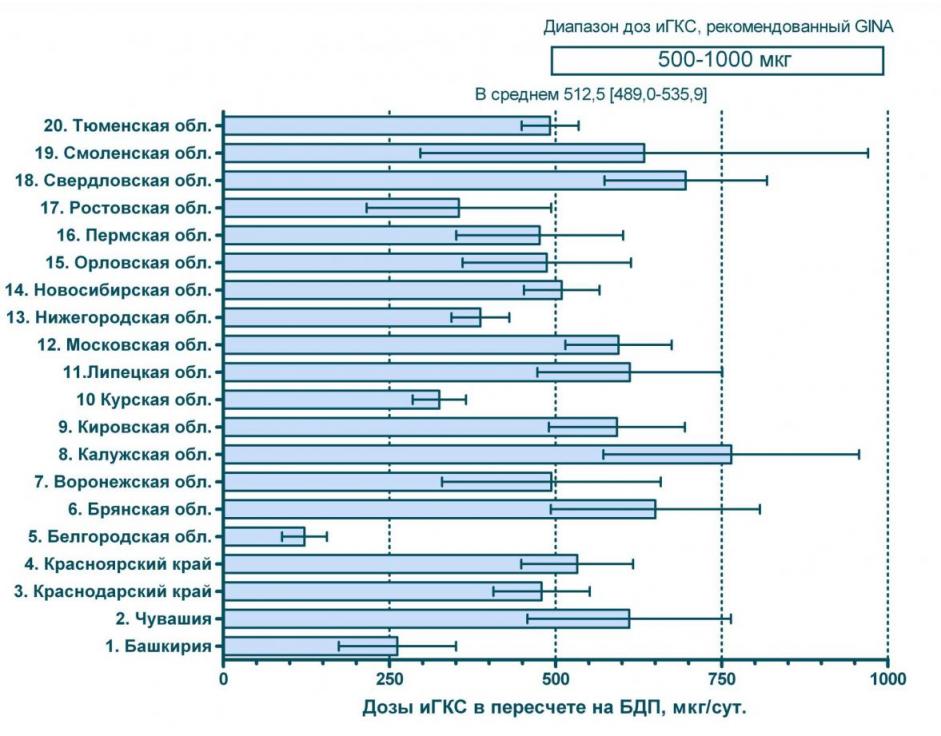
Рисунок 2 средние дозы ингаляционных ГКС по регионам
Проведенное нами анкетирование показывает, что ингаляционные ГКС назначаются у больных БА с существенным опозданием. Так для тех больных, которым эти препараты впервые были назначены в 1999 г интервал времени между появлением симптомов персистирующей БА и назначением ингаляционных ГКС составлял 6,9 лет [95% интервал 0,69 до 13,1]. В последующем этот интервал сокращался, но незначительно, составляя в 2002 г – 5,7 лет [95% интервал 2,95 до 8,37], а в 2005 г – 4,1 лет [95% интервал 2,72 до 5,46].
1.6 Применение 2-адреностимуляторов длительного действия (LABA) и комбинированных препаратов
LABA и комбинации LABA с ингаляционными ГКС используются в отечественной практике с конца 90-х годов и все еще не нашли широкого применения. В целом по РФ препараты этой группы получали только 8,7% больных, кроме этого еще 5,5% пациентов получали LABA в составе фиксированных комбинаций (Симбикорт, Серетид) – см. таблицу 3.
Помимо недостаточно активного применения LABA приходится констатировать случаи использования LABA без ингаляционных ГКС (ок. 2% от всех больных), что по данным исследований может повышать риск летальных исходов у больных БА.
Таблица 3 Маркеры качества терапии БА в РФ
| Маркеры качества фармакотерапии БА | РФ кроме г. Москвы n=1 362 | г. Москва n=501 |
| Доля больных, которые не применяют ингаляционные ГКС, % | 20,3 | 18,9 |
| Доля больных, получающих ингаляционные ГКС в дозах, ниже необходимых, % | 43,8 | 11,7 |
| Доля больных БА, которые получают LABA, % | 8,7 | 16,2 |
| Доля больных БА, получающих ингаляционные ГКС и LABA в виде фиксированных комбинаций, % | 5,5 | 8,5 |
| Доля больных БА, получающих ингаляционные ГКС внутрь, % | 17,9 | 2,0 |
1.7 Основные долгосрочные тенденции в применении ингаляционных ГКС и LABA
Исследования у больных БА в Москве (n=839) показали, что интенсивность применения ингаляционных ГКС неуклонно увеличивалась в течение последних 10-ти лет. В назначении этих препаратов можно выделить два периода (см. рисунок 3, периоды на рисунке отмечены стрелками). Первый период увеличения числа назначений ингаляционных ГКС в 1996-2000 гг был обусловлен внедрением российской версии GINA. В 2000 г наблюдается очередное повышение интенсивности назначений ГКС, связанное с внедрением «Стандарты ведения больных с неспецифическими заболеваниями легких» (1999 г) и системы «астма-школ», которые начали активно работать в г. Москве ок. 7-8-ми лет назад.
Применение LABA в виде свободных и фиксированных комбинаций с ингаляционными ГКС так же неуклонно увеличивается в последние 7-10 лет, однако эти препараты внедряются в клиническую практику существенно менее активно, по сравнению с ингаляционными ГКС.
Важной тенденцией в применении ингаляционных ГКС является рост средних доз этих препаратов. Так, например, в Москве средние дозы ингаляционных ГКС в 2005 г выросли почти в два раза по сравнению с 2000 г. В то же время, регионы РФ по этому показателю «отстают» от столицы на несколько лет (см. рисунок 4).
1.8 Применение препаратов других фармакологических групп
В целом, для лечения больных БА врачи используют 64 различных препарата, относящиеся к 10 фармакологическим группам. Лишь относительно небольшая часть назначаемых у больных БА препаратов можно отнести к разряду непрофильных (муколитики, М-холинолитики и т.д.). На долю таких препаратов приходится ок. 4% всех расходов, связанных с фармакотерапией БА. Следует так же иметь в виду относительно широкое применение кромонов (11,6 DDDs/100 больных), ксантинов (27,2 DDDs/100 больных) и других недостаточно эффективных лекарственных средств.
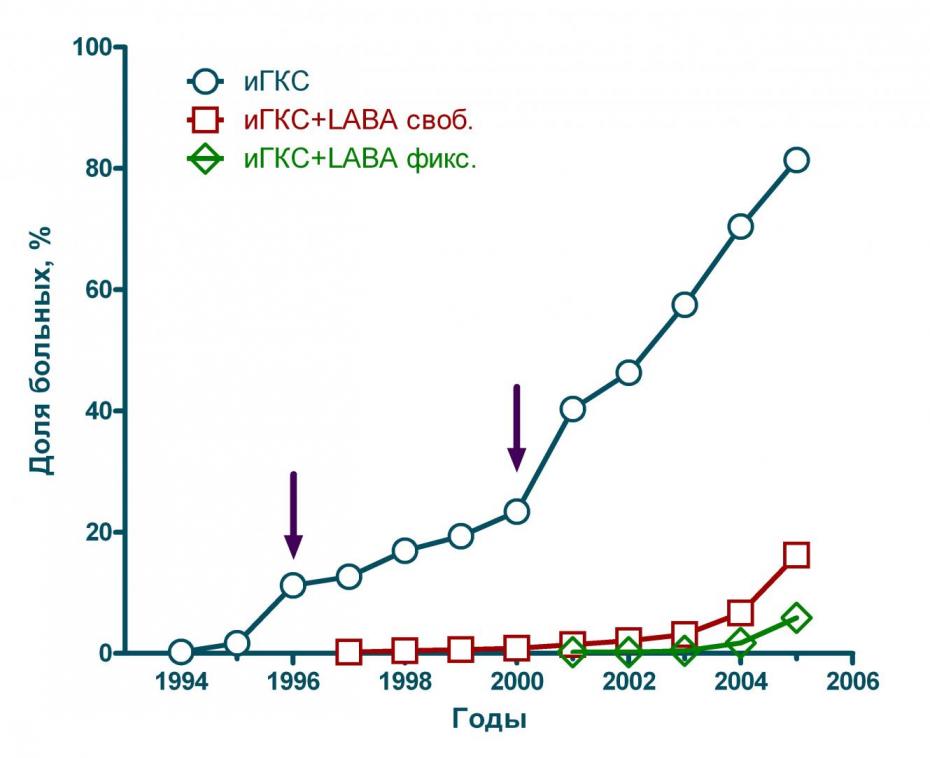
Рисунок 3 Динамика назначения ингаляционных ГКС и LABA
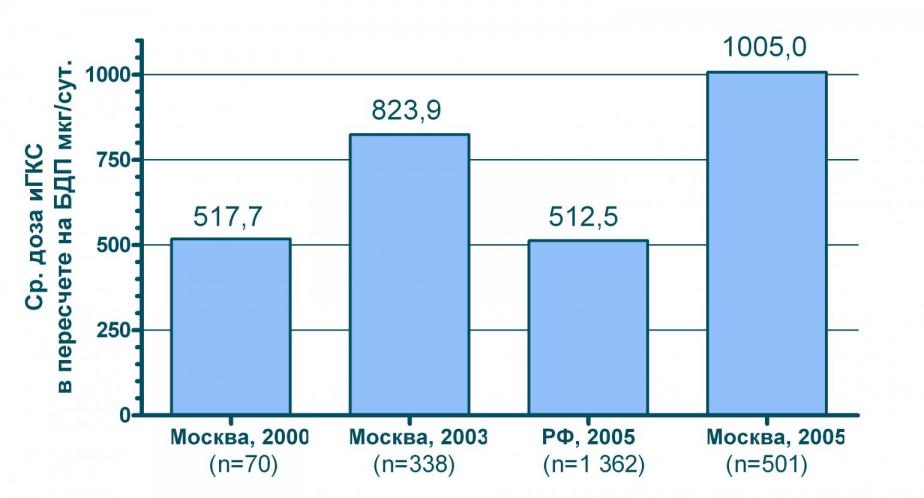
Рисунок 4 Средние дозы ингаляционных ГКС, назначенных у больных БА
Структура назначений для больных БА в Москве и регионах РФ может в ряде случаев существенно отличаться (см. рисунок 5). Так, в общей структуре назначений в г. Москве ингаляционным ГКС принадлежит гораздо более значительное место (43%), чем в регионах РФ (30%). Обратное соотношение наблюдается в случае с 2-адреностимуляторами короткого действия: эти препараты более интенсивно назначались в регионах, нежели в Москве.
Ксантины, кромоны и системные ГКС более интенсивно назначались в регионах, нежели в Москве, в то же время московские доктора применяли LABA и М-холинолитики более интенсивно, чем их коллеги в регионах.
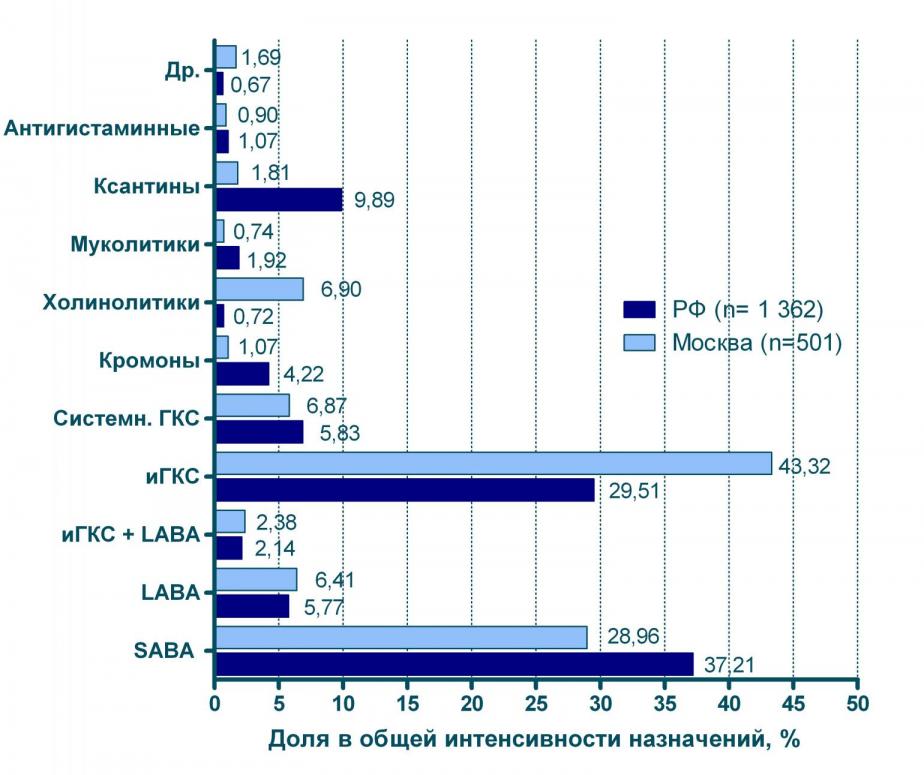
Рисунок 5 Доля отдельных групп препаратов в общей структуре назначений больным БА (Москва в сравнении с др. регионами РФ)
Большинство (более 90%) всех препаратов для фармакотерапии БА относится к продукции крупных западных компаний. Наиболее часто пациентам назначались препараты компании Boehringer Ingelheim (24% всех назначений) и GSK (17%), несколько реже больные использовали продукцию компаний Norton Healthcare, AstraZeneca, Aventis Pharma и Schering-Plough. На долю перечисленных 6-ти компаний приходится 63% от общей интенсивности назначений больным БА.
1.9 Наиболее распространенные в клинической практике модели фармакотерапии БА
В РФ не существует единого, соответствующего стандартам подходя к фармакотерапии БА. Отчасти это связано с недостаточным уровнем знания врачей и с частыми сменами стандартов и основных руководств по клинической практике. С другой стороны, ресурсы, которые могли использоваться для амбулаторной терапии БА в различных регионах существенно отличались в зависимости от эффективности системы ДЛО и готовности больных самостоятельно оплачивать свое лечение. По этому даже в соседних краях и областях средние расходы на амбулаторную фармакотерапию по нашим расчетам могли отличаться в 2-3 раза.
Исследование фармакоэпидемиологических данных позволяет выделить и сравнить между собой несколько наиболее распространенных в нашей стране моделей фармакотерапии БА. Как показали результаты в 49% назначенное больным лечение в принципе не соответствует требованиям российской версии GINA и утвержденных Минздравсоцразвитием России стандартов терапии БА. Речь идет о больных с персистирующим течением БА, которые не получают ингаляционные ГКС, о монотерапии кромонами и препаратами теофиллина, о применении ГКС внутрь без одновременного назначения этих средств в виде ингаляций. К грубым отклонением от стандартов мы отнесли так же использование ингаляционных ГКС в дозах, ниже рекомендованных для взрослых больных и монотерапию 2-адреностимуляторами длительного действия (LABA) при дальнейшем анализе случаи грубого отклонения от стандартов не рассматривались, таким образом, были проанализированы следующие модели: 1) монотерапия ингаляционными ГКС, 2) терапия ингаляционными ГКС в комбинации с LABA, 3) терапия ингаляционными ГКС и LABA в виде фиксированных комбинаций, 4) терапия ингаляционными ГКС в комбинации с ГКС для приема внутрь, 5) монотерапия ингаляционными ГКС в дозах ниже, чем рекомендованные в GINA, 6) монотерапия ингаляционными ГКС в дозах выше, чем рекомендованные в GINA.
Распространенность этих моделей в реальной практике (совместный анализ анкет 1362 больных по РФ и 501 больного по г. Москве) приведена в таблице 4. Эффективность моделей оценивалась нами по 6-ти основным показателям, которые характеризуют контроль над БА: среднее число симптомы в дневные часы, средняя частота пробуждений ночью из-за симптомов БА, среднее число ингаляций бронхолитиков для купирования симптомов в сутки, среднее число обострений БА, средние частота госпитализаций по поводу БА и число обращений за неотложной медицинской помощью. По каждому их этих показателей модели сравнивались между собой с применением рангового метода: модели, обеспечивающий наиболее высокий показатель качества лечения присваивался ранг 6, а остальным моделям присваивались ранги от 5 до 1 по мере убывания относительной эффективности. Суммарный ранговый показатель эффективности приведен в таблице 4.
Как видно из результатов наиболее эффективными моделями терапии оказались применение очень высоких (эквивалентных >1 500 мкг БДП) доз ингаляционных ГКС или использование комбинированного препарата Симбикорт. При этом больные, у которых применялся Симбикорт получали ингаляционные ГКС в средней дозе 437,5 мкг/сут. (в пересчете на БДП). На рисунке 6 показано, что больные, использующие Симбикорт в этой дозе, имели меньше обострений, чем пациенты, получавшие низкие и средние дозы ингаляционных ГКС, в том числе и в виде свободных комбинаций с LABA. Эффективность Симбикорта в дозе 437,5 мкг/сут. (в пересчете на БДП) оказалась сопоставимой с эффективностью ингаляционных ГКС в дозах более 1 500 мкг/сут. (см. рисунки 6 и 7).
Таблица 4 Распространенность и клиническая эффективность различных моделей терапии БА в реальной практике
| Сценарии базисной фармакотерапии | Доля больных, % | Ранг эффектив-ности** | Соотношение стоимость базисной терапии к общей стоимости лечения, % | |
| Терапия, не соответствующая требованиям GINA | 48,5 | - | - | |
| Прием только ингаляционных ГКС | дозы ниже рекомендованных GINA | 19,5 | 24 | 44 |
| дозы соответствуют рекомендациям GINA | 8,0 | 22 | 52 | |
| дозы ниже рекомендованных GINA | 2,3 | 41 | 74 | |
| Ингаляционные ГКС + ГКС внутрь | 10,3 | 11 | 42 | |
| Свободные комбинации инг. ГКС + LABA (ср. доза 504,2* мкг [454,2-554,3]) | 7,8 | 20 | 66 | |
| Фиксированные комбинации ингаляционных ГКС и LABA | Симбикорт (ср. доза 416,7* мкг [248,5-584,8]) | 1,8 | 35 | 76 |
| Серетид (ср. доза 478,0* мкг [388,6-567,3]) | 1,9 | 22 | 50 | |
| * - дозы указаны в пересчете на БДП ** - эффективность оценивалась по 6-ти показателям (симптомы в дневные часы, пробуждения ночью, прием бронхолитиков для купирования симптомов, обострения БА, госпитализации, обращения за скорой помощью) | ||||

Рисунок 6. Среднее число обострений БА при использовании различных моделей лечения.
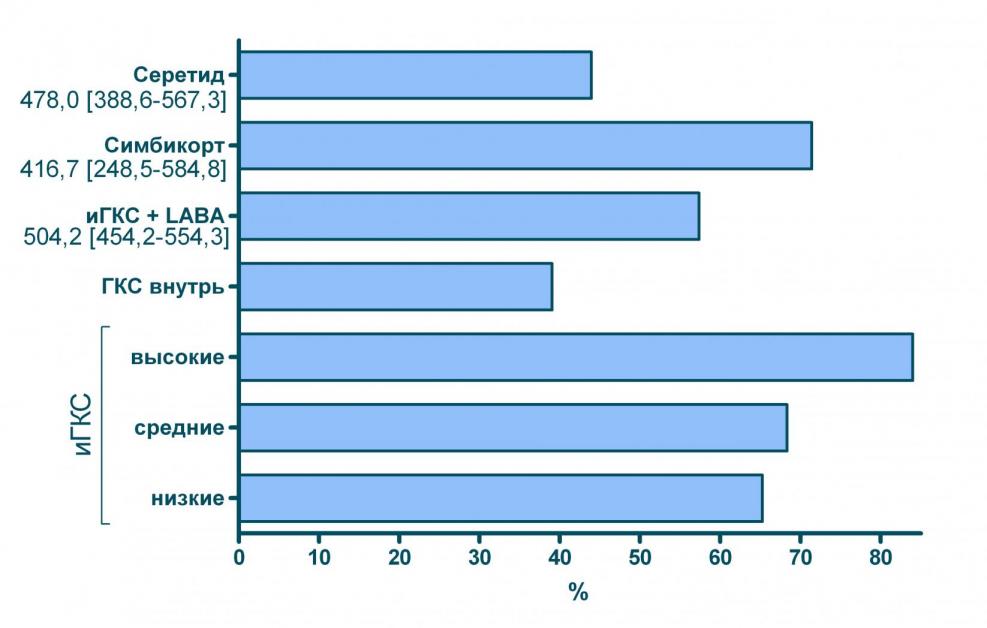
Рисунок 7 Доля больных, не имевших госпитализаций по поводу БА при использовании различных моделей лечения
При этом терапия Симбикортом отличалась лучшим показателем рентабельности: 76% затраченных на терапию средств шли на приобретение самого препарата. При использовании других моделей доля базисной терапии в структуре расходов оказалась значительно ниже. Например, при монотерапии ингаляционными ГКС на приобретение этих средств уходило 52% общих расходов, в то время как остальные средства составляли прямые расходы на лечение обострений (терапия в стационаре, обращение за неотложной помощью, прием бронхолитиков по потребности). В среднем (с учетом больных, получавших терапию, которая не соответствовала стандартам) на базисную терапию приходилось 29% от всех прямых медицинских затрат на оказание помощи больным. Таким образом, большая часть средств (71%) расходовалась на то, чтобы устранить последствия применения недостаточно эффективных препаратов для базисной терапии БА.
По нашим наблюдениям, фиксированные комбинации ингаляционных ГКС и LABA в составе одного ингалятора оказались в целом более эффективны и более рентабельны, чем использование этих же средств в виде свободных комбинаций. Различия в эффективности оказались достоверными не смотря на то, что больным, получающим свободные комбинации назначались более высокие дозы ингаляционных ГКС (в среднем 504 мкг/сут.), чем пациентам, которые использовали фиксированные комбинации (в среднем 417 – Симбикорт и 478 – Серетид, мкг/сут. в пересчете на БДП). Различия в эффективности на наш взгляд связаны в первую очередь с тем, что получая ингаляционные ГКС и LABA в виде отдельных препаратов больные нередко отказываются от приема ГКС, так как считают эти препараты опасными и, кроме того, не ощущают непосредственного действия этих средств в первые минуты после ингаляции [Cerveri I, 1997].
Исследование выявило существенные различия в эффективности между двумя сходными комбинированными средствами: Симбикортом (Будесонид /Формотерол) и Серетидом (Флутиказон/Салметерол). В частности, при терапии Симбикортом доля больных с полным отсутствием симптомов БА оказалась существенно выше, чем при использовании Серетида - 14,% и 9,1%, соответственно. По целому ряду параметров эффективность оба препарата оказались примерно эквивалентными, а среднее число симптомов в дневные часы у больных, получавших Симбикорт оказалось больше, чем у больных, использовавших Серетид. Однако, по сравнению с Серетидом Симбикорт достоверно более активно предотвращает развитие обострений БА (отношение шансов - 4,683 [1.220-17.98], р=0,0310) и, возможно, уменьшает число госпитализаций (отношение шансов - 3,190 [0.9069-11.22], р=0,0804).
1.9 Экономическая характеристика терапии БА в РФ
Оценка экономического бремени БА проводилась нами по результатам анкетирования 1362 больных БА из 43 городов РФ. Нами оценивались прямые медицинские затраты, связанные с терапией БА и ее обострений, а также стоимость немедицинских затрат и потерь, связанных с серьезными обострениями БА (социальные затраты по причине временной нетрудоспособности; потери налоговых поступлений в консолидированный бюджет РФ; объем непроизведенного внутреннего валового продукта (ВВП)). Полное бремя БА оценивалось как сумма прямых медицинских затрат, социальных выплат по причине нетрудоспособности, потери налоговых поступлений в консолидированный бюджет РФ.
Расчет стоимости лекарственной терапии показал, что рутинная терапия обходится в 19 899 рублей в год, причем 88% от этой суммы идет на приобретение препаратов для базисной терапии, а 12% - на средства для купирования симптомов в амбулаторных условиях.
Бремя БА (совокупность расходов на терапию и социальных затрат, связанных с заболеванием) при использовании рутинной терапии существенно зависит от средней продолжительности госпитализации по поводу обострений БА. Средняя продолжительность госпитализации мало зависит от тяжести обострения и обычно определяется главным образом местными стандартами и принятой в регионе практикой оказания медицинской помощи. При принятых средних сроках госпитализации в 14 койко-дней ср. величина бремени БА составляет 84 250 руб. в год, а при удлинении госпитализации до 21 койко-дня – 104 707 рублей на 1 больного в год. Основная доля расходов приходится на устранение последствий недостаточно эффективной терапии: оплата госпитализаций и вызов скорой медицинской помощью (47%) и выплаты по временной нетрудоспособности (34%). В то же время на приобретение препаратов базисной терапии приходиться только 19% от общего бремени БА.
Нами были рассчитаны социально-экономические последствия БА. По нашим оценкам на каждого больного БА в год в среднем приходятся потери ВВП на сумму 47,5-58,8 тыс. руб., потери налоговых сборов на сумму 13,3-16,5 тыс. руб., выплаты по временной нетрудоспособности на сумму 15,1-18,7 тыс. руб. (расчеты для средних сроков госпитализации в 14 и 21 койко-день соответственно).
2. Клинико-фармакологическая оценка концепции полного контроля над БА в РФ
Новое издание GINA (2006) в определении объема лечения, ориентируется на понятие контроля над симптомами БА. Считается, что объем терапии следует последовательно увеличивать до достижения полного или, по крайней мере, частичного контроля над заболеванием.
В ходе клинических исследований комбинированных препаратов [исследование GOAL, Bateman E.D. et al, 2000] полный контроль над БА был достигнуть у 29-50% больных с нетяжелым течением заболевания. Однако данные эпидемиологических исследований показывают, что в реальной практике полный контроль достигается лишь у 5% больных [AIRE, 2000] и даже менее строгие критерии «хорошего контроля» выдерживаются лишь у 28% больных [INSPIRE, 2006].
Принято называть несколько основных причин, в силу которых контроль над БА в реальных условиях ниже, чем в клинических исследованиях: назначение менее эффективных средств, низкий уровень обучения больных, недостаточная степень выполнения назначений врачей и более тяжелый контингент больных (медико-социальные проблемы, позднее начало лечения).
Результаты совместного анализа анкет больных в регионах РФ и г. Москве (всего 1863 пациента с различной тяжестью течения БА) показал, что в среднем в РФ полный контроль над БА достигнуть лишь у 4% больных. Несколько чаще в клинической практике встречаются случаи частичного контроля: 17,77% больных имеют лишь отдельные симптомы в дневные часы, 20,26% - не пользуются ингаляционными бронхолитиками короткого действия.
Сравнивая полученные результаты с аналогичными показателями для США, Канады и Западной Европы приходится констатировать, что доля больных, достигших полного контроля в нашей стране и развитых западных странах примерно одинакова. Но при этом отечественные больные в среднем существенно более часто испытывают симптомы БА, ограничение повседневной активности, обострений БА и чаще обращаются за медицинской помощью, чем пациенты в США и Западной Европе. Таким образом, наличие полного контроля отражает не столько эффективность лечения, сколько наличие небольшого числа больных с нетяжелым течением БА, хорошо отвечающих даже на далекую от оптимальной терапию.
Можно ли существенно увеличить долю больных с полным или хорошим контролем над БА? По-видимому, основным ограничением эффективности фармакотерапии в нашей стране является позднее начало лечения больных. Анкетирование, проведенное нами, показало, что больные, которым ингаляционные ГКС были впервые назначены в 1999 г, получили эти средства с «опозданием» на 6,9 лет. В последующем интервал между появлением симптомов и назначением ГКС сокращался (в 2002 г – 5,7 лет, в 2005 г – 4,1 лет), но все еще остается высоким. Исследования показывают, что 3-4 года «опоздания» с назначением ингаляционных ГКС приводит к формированию необратимой бронхообструкции и необратимому снижению ответа на все противоастматические препараты [Haahtela T et al., 1994].
Проведенное нами моделирование (дозы ингаляционных ГКС пересчитывались на эквивалент беклометазона дипропионата при БА умеренного течения) показывает, что даже значительное увеличение дозы (в 5 раз с 200 до 1 000 мкг в эквиваленте БДП) практические не дает дополнительного улучшения качества контроля над БА (см. рисунок 8) и лишь применение ингаляционных ГКС в дозах выше 1 000 мкг/сут. позволяет статистически значимо увеличить число дней и ночей, свободных от симптомов БА.
В целом же, как показывают наши расчеты, даже использование максимально возможных доз ингаляционных ГКС не позволяет обеспечить полный контроль над БА более чем у 15-17% больных.
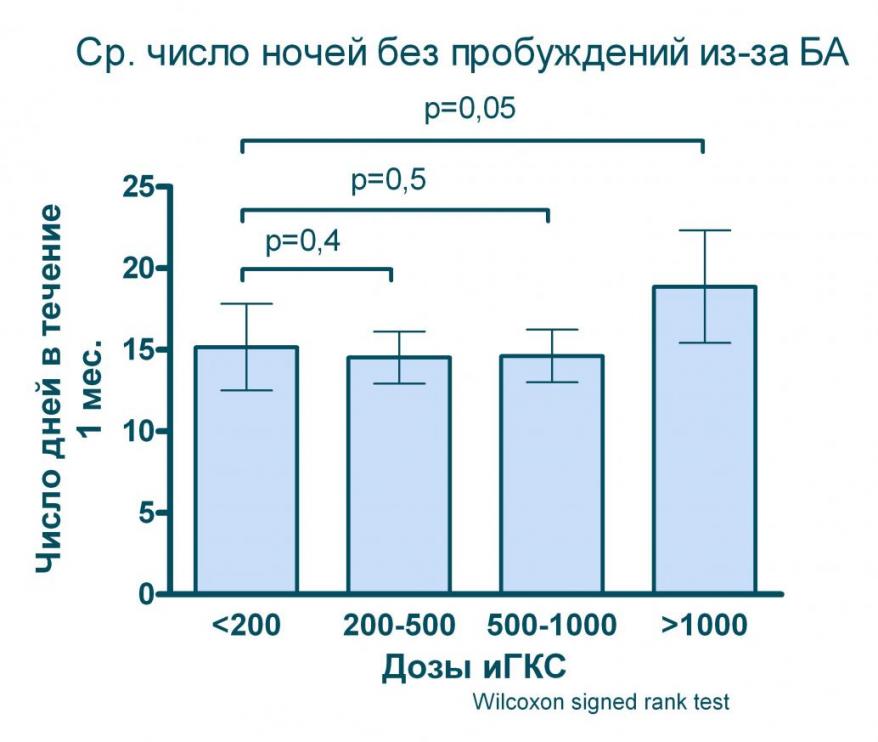 | 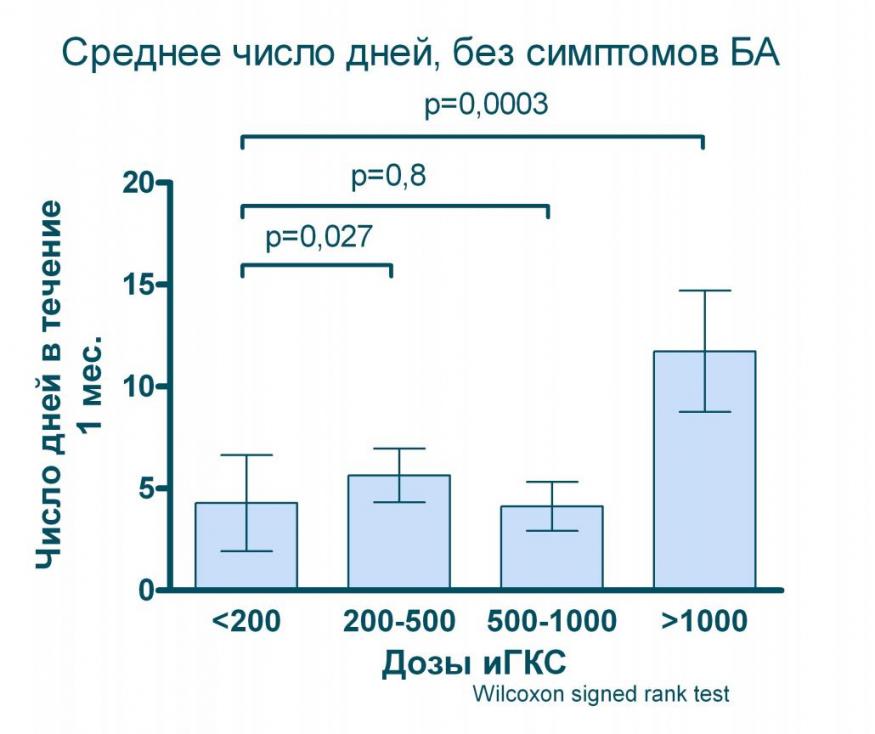 |
Рисунок 8. Влияние различных доз ингаляционных ГКС на показатели контроля БА
Нами был проведен анализ популяционной фармакодинамики ингаляционных ГКС, назначаемых по отдельности и в комбинации с LABA. Для этого мы построили кривые «доза-ответ» для 707 больных БА, получавших монотерапию ингаляционными ГКС, 340 больных, получавших ингаляционные ГКС и LABA в виде свободных комбинаций и 184, получавших комбинированные средства (Серетид, Симбикорт). Всего для этого в исследование было включено 1231 больной БА, принимавших участие в трех исследованиях Будесонида/Формотерола (см. таблицу 2), при наличие данных спирометрии и оценки качества жизни. У этих больных мы оценивали эффективность их рутинной терапии – то есть терапии, проводимой до начала исследования. Эффективность терапии у каждого больного оценивалась по 6-ти параметрам:
- объем форсированного выдоха (ОФВ1) или пиковая скорость выдоха (ПСВ) в % от должной величины,
- оценка качества жизни по аналоговой шкале (в % от максимальной),
- доля бессимптомных дней в течение месяца (%),
- доля бессимптомных ночей в течение месяца (%),
- доля дней без дополнительного использования бронхолитиков в течение месяца (%),
- доля месяцев в течение последнего года (%), в течение которых больные не прибегали к неотложной медицинской помощи (госпитализации, вызов скорой медицинской помощи).
На основании этих 6-ти критериев для каждого больного определялась условная средняя эффективность лечения в % от максимально возможной: полный контроль над БА, нормальные (>80%) показатели спирометрии и качества жизни, отсутствие необходимости в обращении за медицинской помощью. Затем проводилось сопоставление дозы ингаляционных ГКС и эффективности лечения методом нелинейной регрессии на двухфазной экспотенциальной модели (см. рисунок 9).
Полученная нами кривая «доза-эффект» показывает, что при монотерапии ингаляционными ГКС в условиях реальной практики эффективность терапии растет практически прямо пропорционально дозе ингаляционных ГКС и достигает максимума при приеме этих препаратов в суточной дозе 487 мкг в пересчете на БДП. Дальнейшее повышение дозы в целом не приводит к росту эффективности – очевидно, что более высокие дозы ингаляционных ГКС обычно назначаются тем больным, которые не реагируют на лечение или реагируют недостаточно. Речь может идти о больных, резистентных к действию ГКС, больных с необратимой бронхообструкцией [Barnes P, 2004] и, главным образом, о больных,которым из-за тяжести течения БА показано назначение наряду с ингаляционными ГКС других противоастматических средств.
Полученные нами данные хорошо согласуются с двумя аналогичными анализами «доза-эффект», проведенными за рубежом. Так Masoli M. с соавторами в 2004 на материале 1435 больных показал, что дозы Будесонида, обеспечивающие более 90% от максимального действия этого препарата, находятся в диапазоне от 400 до 600 мкг. Ранее (2001) в работе Holt S. с соавторами была определена доза Флутиказона, обеспечивающая 90% от максимального эффекта: 200-300 мкг (400-600 в пересчете на БДП). Проведенное нами исследование отличается от процитированных тем, что в качестве материала для расчетов мы использовали данные реальной клинической практики, а не результаты, полученные в ходе клинических исследований.
Кроме того, нами впервые были проведены расчеты для больных, получающих LABA наряду с ингаляционными ГКС (см. рисунок 9). Оказалось, что одновременное назначение LABA позволяет существенно снизить дозу ингаляционных ГКС, обеспечивающую максимальный эффект терапии: с 487 мкг БДП в сутки при монотерапии до 416 мкг/сут. при использовании свободных комбинаций с LABA и до 267 мкг/сут. при использовании комбинированных препаратов. Кроме того, в последнем случае удается на 8% увеличить максимальную эффективность лечения по сравнению с монотерапией ингаляционными ГКС.
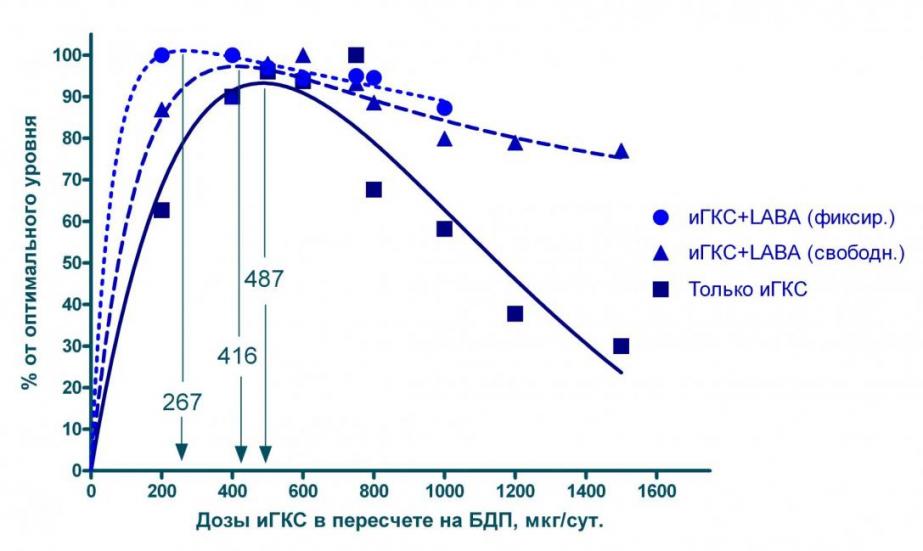
Рисунок 9. График «доза-эффект» для различных доз ингаляционных ГКС (иГКС), назначаемых в виде монотерапии и в виде свободных и фиксированных комбинаций с 2-адреностимуляторами длительного действия (LABA).
Проведенные подсчеты позволяют рекомендовать вместо наращивания дозы ингаляционных ГКС выше 500 мкг/сут. у больных, не отвечающих на лечение, переходить сразу к назначению комбинированной терапии.
3. Клинико-фармакологические методы оптимизации фармакотерапии БА
3.1 Идентификация проблемных аспектов фармакотерапии
Проведенные нами исследования позволили выявить ряд проблемных аспектов в фармакотерапии БА. В первую очередь речь идет о недостаточных знаниях врачей, оказывающих медицинскую помощь больным БА. Опросы показали, что врачи используют различные по содержанию и времени издания стандарты и руководства. Но даже в том случае, когда эти документы не содержат разночтений, отношение врачей к стратегии фармакотерапии БА может существенно отличатся. Например, среди врачей, оказывающих помощь больным нет общего мнения относительно целей лечения и способов дозирования ингаляционных ГКС (см. стр. 12).
С другой стороны ряд положений GINA усваивается врачами неточно или ошибочно упрощается. Это приводит, например, к систематической ошибке в оценке тяжести пациентов (55% всех диагнозов), что в свою очередь приводит к использованию заниженных доз ингаляционных ГКС у 41% больных. Подобные ошибки могут быть успешно преодолены, так в Москве, где обучению врачей уделяется больше внимания и есть условия для самообразования, ошибки в определении тяжести БА встречаются в 8,7 раз реже, чем в регионах.
Данные фармакоэпидемиологического анализа врачебных назначений в Москве и 34 других населенных пунктах РФ позволили идентифицировать ряд наиболее важных проблемных аспектов терапии БА. Причем, актуальность отдельных проблем для Москвы и регионов может значительно отличаться – см. таблицу 5. Речь идет о позднем (спустя 4-6 лет) назначении ингаляционных ГКС. Больным с персистирующей БА в 20,3% случаев не назначаются ингаляционные ГКС. В в 41% случаев больные получают ингаляционные ГКС в дозах ниже необходимых (в Москве – 11,7%). Недостаточно активно применяются LABA (16,2% больных в Москве и 8,7% больных в регионах), а фиксированные комбинации ингаляционных ГКС и LABA получают 8,5% больных в г. Москве и 5,5% в других регионах РФ. Больным неоправданно широко назначаются ГКС для приема внутрь (17,9% по РФ, по сравнению с 2,0% в Москве). Наконец, врачи используют препараты, эффективность которых не доказана в ходе современных клинических исследований (М-холинолитики, кромоны), - до 9,6% от общей интенсивности назначений в Москве и 7,8% - в др. регионах РФ.
3.2 Обучение больных БА как способ оптимизации фармакотерапии
Обучение больных БА: обсуждение с больным его индивидуального плана лечения, обучение групп пациентов в т.н. «астма-школах», создание партнерских взаимоотношений между врачом и его пациентами, является важным фактором, повышающим эффективность терапии [GINA, 2006]. C другой стороны, в условиях недостаточной информированности докторов и пациентов о новых подходах к фармакотерапии БА, обучение больных может оказывать положительное влияние на объем и характер амбулаторного лечения.
Обученные пациенты, получившие от специалиста-пульмонолога письменный индивидуальный план лечения, как правило, стремятся выполнять его на практике. Они реже отказываются от назначения ингаляционных ГКС, а иногда даже настаивают на выписке препаратов, указанных в индивидуальном плане. Терапевты поликлиник, со своей стороны, относятся к письменному индивидуальному плану с большим вниманием, нежели к обычным рекомендациям, указанным в выписном эпикризе больного.
Таблица 5 Проблемные аспекты фармакотерапии БА в Москве и др. регионах РФ
| Проблемные аспекты фармакотерапии БА | Актуальность | |
| г. Москва | др. регионы РФ | |
| Позднее назначение ингаляционных ГКС | +++ | +++ |
| Больным с персистирующей БА не назначаются ингаляционные ГКС | + | ++ |
| Назначение ингаляционных ГКС в дозах ниже необходимых | + | +++ |
| Недостаточно активное применение LABA | +++ | +++ |
| Недостаточно активное применение фиксированных комбинаций ингаляционных ГКС и LABA | +++ | +++ |
| Неоправданно широкое назначение ГКС внутрь | - | ++ |
| Применение препаратов, эффективность которых не доказана в ходе современных клинических исследований (М-холинолитики, кромоны) | - | - |
| Обозначения: +++ - крайне актуальная проблема (касается более 30% врачебных назначений) ++-очень актуальная проблема (касается 20-30% врачебных назначений) +- актуальная проблема (касается 10-20% врачебных назначений) (-) - проблема касается менее 10% врачебных назначений | ||
На материале 70-ти больных, находившихся на лечении в ГКБ №23 мы изучали фармакоэпидемиологические последствия внедрения «Астма-школы» и письменных индивидуальных планов лечения. Занятия в «Астма-школе» проводились врачом пульмонологом с небольшой (5-12 человек) группой больных. Полный цикл занятий включал в себя 3 занятия по 2 академических часа каждое. Все три занятия всегда проводились в течение одной недели.
Индивидуальный план лечения был составлен по образцу, данному в GINA 1996. План включал в себя перечень препаратов для базисной терапии и для купирования симптомов БА, меры немедикаментозного лечения (устранение контакта с аллергенами и т.п.), значение индивидуального лучшего показателя пиковой скорости выдоха (ПСВ) и действия больного в зависимости от показателя ПСВ. Все рекомендации полностью соответствовали требованиям GINA и национальных «Стандартов ведения больных с неспецифическими заболеваниями легких».
Каждый больной обсуждал свой план лечения с лечащим врачом накануне выписки. Последствия внедрения подобной практики в отделении оценивались нами спустя 4 мес., для чего больные специально приглашались для опроса и обследования.
Обучение больных приводило к существенному снижению риска повторных обострений БА. Например, спустя 4 месяца, после проведения «астма-школы» относительный риск обращения за скорой медицинской помощью снизился на 91% (р=0,006), риск госпитализации – на 93,0% (р<0,0001), а риск обострений БА любой тяжести на 84,7% (р=0,001).
С индивидуальным планом лечения ознакомились все врачи, участвовавшие в амбулаторном лечении пациентов. Можно выделить три варианта поведения участковых терапевтов. В 69% случаев участковые терапевты делали назначения, полностью соответствовавшие рекомендациям индивидуального плана. Еще в 27% случаев назначенное лечение принципиально соответствовала индивидуальному плану лечения, но при этом врачи поликлиник выбрали для терапии больных ингаляционные ГКС, отличавшиеся от указанных в индивидуальном плане лечения, или назначали эти препараты в более низких дозах. Как правило, речь шла о замене Флютиказона на более дешевые БДП или Будесонид (Бенакорт). При этом, к сожалению, как правило, не учитывалась сравнительная активность различных ингаляционных ГКС. Наконец, в 4% случаев назначения врачей поликлиник принципиально отличались от рекомендаций индивидуального плана (например, назначения ГКС внутрь у больного с умеренным течением БА).
Однако в целом приходится констатировать общее повышение уровня фармакотерапии у больных после создания индивидуального плана лечения.
3.3 Применение фиксированных комбинаций ингаляционных ГКС и 2-адреностимуляторов длительного действия для оптимизации терапии БА
Как уже отмечалось, материалы клинических исследований новых комбинированных (ингаляционные ГКС и LABA) средств дают более оптимистическое представление об эффективности этих препаратов, по сравнению с результатами их использования в реальной практике. В клинических исследованиях редко приходится сталкиваться с ошибками в выборе и дозировках препаратов, больные, принимающие участие в исследовании, как правило, достаточно точно выполняют указания врача, кроме того, в исследования обычно не включаются больные с очень тяжелым течением БА или серьезными медицинскими проблемами. В клинических исследованиях больные получают препараты бесплатно и своевременно, в то время как в ряде регионов нашей страны возможны перебои в обеспечении противоастматическими средствами по линии ДЛО.
Исходя из сказанного, существенный интерес для нас представляло изучение эффективности комбинированных препаратов в реальных клинических условиях. Для выполнения этой задачи мы провели анкетирование 1224 больных из 34-х городов и населенных пунктов РФ, которым впервые в жизни была назначена фиксированная комбинация Будесонида и Формотерола – Симбикорт.
Продолжительность исследования составляла 3 месяца. В ходе последующего анализа мы сравнивали среднее число симптомов БА, частоту обращения за неотложной медицинской помощью и число госпитализация на протяжении 3-х мес. терапии Симбикортом по сравнению с аналогичными показателями до включения больных в исследование.
Мы не ставили своей целью как-либо влиять на включение больных в исследование. В исследование мог быть включен любой больной старше 18 лет, независимо от формы и тяжести бронхиальной астмы. Единственными критериями включения в исследование являлось желание врача применить для терапии данного больного Симбикорт и согласие больного пройти анкетирование. Впоследствии оказалось, что для некоторых больных назначение Симбикорта было не вполне рациональным. Но это обстоятельство отражало существующий уровень знаний и навыков врачей, оказывающих помощь больным БА, то есть условия реальной клинической практики. В ходе исследования врачам не предоставлялся исследуемый препарат, не выдавались материалы рекламного или обучающего содержания. Также не было ограничений на применение иных (кроме Симбикорта) противоастматических препаратов, если врач считал это необходимым.
В результате нами были проанализированы результаты лечения Симбикортом 1045 больных БА (из 1224 больных часть была «потеряна» для дальнейшего наблюдения). Средний возраст пациентов (32% - мужчины, 68% - женщины) составил 50 лет [37,8-62,8], а средняя продолжительность заболевания - 11,4 года [10,83-11,88].
В 76% случаев Симбикорт был назначен больным с тяжелой БА, в 12% - при БА умеренного течения. Кроме того, в 12% больные, которым был назначен Симбикорт, имели легкое течение БА, таким образом, назначение им комбинированного препарата не следует считать рациональным.
До включения в исследование больные получали различную базисную терапию БА. Так, 42% получали только ингаляционные ГКС, еще 16,5% пациентов принимали свободные комбинации ингаляционных ГКС и LABA. Наряду с этим, 18% больных вообще не получали ингаляционные ГКС (из их числа 48% получали кромоны, а 34% - пролонгированные теофиллины). Наконец, 18,6% больных, включенных в исследование, принимали ГКС внутрь. Адекватные тяжести состояния дозы ингаляционных ГКС до начала исследования получали только 24% больных с тяжелым, 60% больных с умеренным и 21% больных с легким персистирующим течением БА.
Всем больным, включенным в исследование, был назначен Симбикорт, но выбор дозы препарата был предоставлен на усмотрение врачей, участвующих в исследовании. У 13,2% больных был назначен Симбикорт 80/4,5 мкг. Такие больные получали в день в среднем по 185,3 мкг [172,0-198,6] Будесонида в составе комбинированного препарата. В остальных 86,8% случаев применялся Симбикорт 160/4,5 мкг, а больные получали в среднем по 507,9 мкг [493,8-522,1] Будесонида в сутки (634,8 мкг/сут. в пересчете на БДП).
Следует отметить, что в среднем Симбикорт назначался в статистически значимо более низких дозах, нежели дозы ингаляционных ГКС, которые больные получали до начала исследования. При пересчете средних доз ингаляционных ГКС и Будесонида, входящего в состав Симбикорта, на эквивалентные дозы БДП оказалось, что с переходом на терапию Симбикортом больные с легким течением БА стали получать ГКС в дозе на 41% меньше исходной. Для больных с умеренным и тяжелым течением БА аналогичное снижение дозы ГКС с переходом на Симбикорт составило 37% и 33%, соответственно. Снижение дозы ингаляционных ГКС после начала терапии Симбикортом отмечалось также в подгруппе больных, ранее получавших ингаляционные ГКС в виде свободных сочетаний с LABA - на 34%.
Эффективность терапии Симбикортом оценивалась нами по целому ряду параметров. Мы оценили среднее число дней (в течение месяца), в течение которых больные не отмечали симптомы БА. Оказалось, что после перехода на терапию Симбикортом число бессимптомных дней возросло в среднем в 4 раза. Максимальное увеличение числа дней, свободных от симптомов БА, отмечалось у больных с тяжелым течением БА - в 4,8 раза по сравнению с рутинной терапией. Благодаря назначению Симбикорта, больные с легким и умеренным течением БА отмечали симптомы заболевания не чаще одного раза в неделю.
У больных также в среднем в 2 раза увеличилось число ночей без пробуждений из-за БА. Кроме того, после назначения Симбикорта в среднем в 3,4 раза уменьшилась интенсивность использования по потребности бронхолитиков короткого действия. Для больных с различной тяжестью течения БА это означало ежемесячно от 14 до 16 дополнительных дней, в течение которых они не использовали препараты для купирования симптомов.
Переход на терапию Симбикорт позволил увеличить число дней без симптомов БА в среднем на 16±2 в месяц и обеспечить в течение месяца дополнительно 14±1 ночей без пробуждений из-за БА. Среднее число дней без использования препаратов для купирования симптомов БА также увеличилось на 14±3 в месяц.
Терапия Симбикортом позволила статистически значимо сократить число обострений БА и частоту обращений за медицинской помощью по поводу обострений БА. Например, если в течение двухмесячного периода до начала исследования у 219 больных имели место госпитализации в стационар по поводу обострений БА, то в ходе исследования нами было зарегистрировано только 11 случаев госпитализаций. Число вызовов скорой медицинской помощи (в течение 2-х месяцев) сократилось с 468 до 24 случаев, а число посещений поликлиники снизилось в 2,6 раза. В последнем случае следует помнить, что больные БА были вынуждены регулярно обращаться в поликлинику в плановом порядке для выписки льготных рецептов. Отдельно нами была проанализирована эффективность Симбикорта у больных, которым ранее уже была назначена комбинированная терапия – свободные комбинации ингаляционных ГКС и LABA. Оказалось, что и в этой подгруппе использование Симбикорта позволяет существенно улучшить состояние больных.
В целом 91% врачей оценили терапию Симбикортом как эффективную, а 96% больных заявили о своем желании продолжить лечение этим препаратом.
Следует отметить, что, несмотря на то, что большинство врачей испытывали трудности в оценке тяжести состояния больных БА и выбором адекватных доз ингаляционных ГКС для базисной терапии, Симбикорт в целом назначался более корректно, чем предшествующая базисная терапия. Кроме того, применение Симбикорта оказалось существенно более эффективным, чем предшествующая терапия с использованием в среднем более высоких (на 33-41%) доз ингаляционных ГКС.
3.4 Влияние фиксированных комбинаций ингаляционных ГКС и 2-адреностимуляторов длительного действия на качество жизни больных и уровень контроля над БА
Мы также провели более детальное уточнение эффективности Симбикорта в условиях клинического исследования. Исследование проводилось в 53-х центрах в г Москве и 3-х центах Московской обл. В исследование были включены больные БА в возрасте от 10 до 70 лет, у которых на момент включения не был достигнут контроль над БА.
В ходе этого исследования все больные получали Симбикорт Турбухаллер 160/4,5 мкг. Больным, ранее не принимавшим ингаляционные ГКС, препарат исходно назначался по 160/4,5 мкг 2 раза в день. Те больные, которые ранее уже получали ингаляционные ГКС, начинали терапию Симбикортом с приема по 320/9 мкг (по 2 вдоха) – 2 раза в день.
В исследования было включено 329 больных. Завершили исследование в соответствии с протоколом и включено в анализ 287 больных: 66 подростков и 221 взрослый. Демографические и клинические данные этих больных приведены в таблице 6. Тридцать больных начали лечения с применения Симбикорта 160/4,5 по 1 вдоху два раза в день, у остальных пациентов препарат был назначен по 2 вдоха два раза в день.
В дальнейшем, протокол исследования предусматривал возможность изменения дозы препарата: на каждом визите врач в зависимости от эффективности лечения имел возможность снизить или увеличить дозу Симбикорта на 160/4,5 мкг/сут. Изменения в режиме дозирования и потребность в ингаляциях сальбутамола фиксировалась в записях исследователей. Продолжительность исследования составила 3 месяца. Эффективность терапии оценивалась: по динамике ПСВ, уровню качества жизни (аналоговая шкала), по уровню контроля за течением БА (опросника ACQ [Juniper EF et al. 1999], по числу обострений БА и по степени использования ресурсов здравоохранения (госпитализации, обращения за неотложной помощью, посещение поликлиники).
Таблица 6 Демографические и клинические параметры больных, включенных в исследование
| Параметры | Взрослые | Подростки | |
| Число больных | 221 | 66 | |
| Средний возраст, лет. | 49±14 | 12,9±2,4 | |
| Доля мужчины/женщины, %. | 38 / 62 | 72 / 28 | |
| Средняя продолжительность заболевания, лет. | 11,5±9,8 | 6,7±3,1 | |
| Средняя величина ПСВ в % к должному значению. | 66,1±11,3 | 71,8±9,4 | |
| Средняя потребность в ингаляционных бронхолитиках, сутки-1. | 2,9±1,6 | 2,2±0,9 | |
| Не получали ингаляционные ГКС, в % к числу больных. | 31,5 | 43,5 | |
| Течение БА, в % к числу больных. | легкое | 6,2 | 23,9 |
| умеренное | 47,3 | 34,8 | |
| тяжелое | 46,5 | 41,3 | |
В ходе исследования у 12-ти больных суточная доза Симбикорта была снижена на 160/4,5 мкг, а еще у 2 больных – на 320/9 мкг. Повышение дозы потребовалось у 13% больных.
У большинства больных, как взрослых, так и подростков, в ходе исследования было зафиксировано существенное увеличение ПСВ – в среднем на 30% у взрослых и на 28% у подростков, при этом достоверное статистически увеличение ПСВ (p<0,001) было зарегистрировано уже через 1 месяц лечения Симбикортом. Дополнительный анализ динамики ПСВ у взрослых больных в подгруппах с различной тяжестью заболевания показал, что этот показатель у больных с более тяжелым течением БА увеличивался почти также хорошо, как и пациентов с менее тяжелой БА.
Потребность в ингаляциях бронхолитиков для купирования симптомов за время исследования снизилась на 75% у взрослых и на 81,8% у подростков. В подгруппе больных с тяжелым течением БА снижение потребности в бронхолитиках также было достоверным, хотя и менее выраженным: с 3,2±1,5 до 1,0±0,9 раза в день.
Общий уровень контроля за течением заболевания оценивался нами в баллах по результатам заполнения вопросника ACQ. До начала лечения среднее число баллов по вопроснику ACQ составляло 19,3±6,4 у взрослых и 18,6±4,8 у детей. Однако через три месяца лечения уровень контроля над заболеванием существенно улучшился, а сумма балов по ACQ, достоверно сократилась до 5,9±4,6 у взрослых и до 4,6±4,3 у подростков. У больных с легким и умеренным течением БА уровень контроля за течением БА улучшился в 3,9 раза, а в подгруппе больных с тяжелым течением БА в 2,9 раза.
Исследование качества жизни проводилось только среди взрослых пациентов. На момент включения в исследование больные оценивали качество жизни на кровне 43,4±19,5%, а после 3-х месяцев терапии Симбикортом самооценка качества жизни у больных увеличилась до 83,4±12,5 % от максимально возможного значения. Повышение качества жизни оказалось особенно выраженным у больных с тяжелым течением БА.
Лечение Симбикортом позволило существенно снизить число обращений за медицинской помощью, как у взрослых, так и у подростков. Так на фоне лечения относительное снижение риска тяжелых обострений, требующих обращения за неотложной помощью, составило 97,8% (р=0,0058) и 94,4% (р=0.08), для взрослых и подростков, соответственно. В течение 3-х месяцев, предшествующих включению больных в исследования, случаи госпитализации больных по поводу обострения БА были отмечены у 5,8% больных. Однако, за аналогичный период исследования не было зарегистрировано ни одного случая госпитализации по поводу БА, а доля больных, имевших нетяжелые обострения БА, сократилась с 12,3% до 1,1%.
В целом, полученные данные свидетельствуют о высокой эффективности Симбикорта по целому ряду критериев (ПСВ, потребность в ингаляциях бронхолитиков, уровень контроля за течением БА, качество жизни больных, частота обращения за медицинской помощью, число обострений БА). Важно подчеркнуть, что положительное действие препарата проявлялось независимо от исходной тяжести заболевания. При этом такие показатели, как величина ПСВ и суточная потребность в бронхолитиках более выражено увеличилась у больных с легким и умеренным течением заболевания, однако изменения в качестве жизни были более выражены у больных с тяжелым течением БА.
Учитывая, что значительная часть больных, включенных в исследование, ранее не получали адекватной терапии и, в частности, ингаляционных ГКС мы провели анализ подгруппы больных, ранее принимавших высокие дозы Флютиказона (23% от всех взрослых больных, включенных в исследование). В среднем, до начала исследования, больные в этой подгруппе получали по 883±149 мкг Флютиказона в сутки. Однако и у таких больных Симбикорт (в суточной дозе 640/18 мкг) по всем показателям оказался более эффективным, чем предшествующая терапия.
3.5 Оптимизация терапии БА благодаря использованию альтернативных режимов дозирования
В последнее время на западе была предложена концепция гибкого подхода к дозированию ингаляционных ГКС: быстрое увеличение дозы при ухудшении течения БА и такое же быстрое снижение дозы при стабилизации состояния больного. Проведенное нами исследование ставило своей целью оценить эффективность гибкого дозирования фиксированной комбинации Будесонида/Формотерола в отечественной популяции больных БА.
В сравнительное рандомизированное исследование были включены больные с умеренным и тяжелым течением БА, не принимающие ГКС внутрь. Общая продолжительность наблюдения 120 суток.
После включения в исследование все больные в течение 30 сут. (вводный период) получали одинаковую терапию: Симбикорт (Будесонид/Формотерол) по 640/18 мкг/сут., а затем были рандомизированы для приема: Симбикорта в фиксированной дозе 640/18 мкг/сут. (по 2 вдоха Симбикорта 160/4,5 мкг утром и вечером) или Симбикорта в режиме гибкого дозирования (от 1 до 8-ми ингаляций препарата в зависимости от выраженности симптомов).
Оценка эффективности проводилась по таким параметрам, как число симптомов БА в дневные и ночные (пробуждения) часы, средней потребности в ингаляциях Сальбутамола/Фенотерола для купирования симптомов БА, уровень качества жизни (оценивался по аналоговой шкале в % от максимального уровня), величина ПСВ и ОФВ1 в % от должного и число тяжелых (потребность в госпитализациях или назначении ГКС внутрь) обострений БА. Сведения о частоте симптомов и дозах Симбикорта были получены при анализе выданных больным дневников самонаблюдения, спирометрия и тест качества жизни проводился при визитах больных в исследовательские центры.
Исследование проводилось в 40 центрах (поликлиники и клинико-диагностические центры) в г. Москве. В исследование был включен 501 больной, 30 больных были исключены из исследования из-за нестабильного течения БА во время вводного периода, рандомизировано - 471 больных. Закончили исследование согласно протоколу – 466 больных. Демографическая и клиническая характеристика рандомизированных больных приводится в таблице 7.
За период исследования в обеих группах отмечалось существенное снижение частоты проявлений БА. Например, средняя число ночей без пробуждения из-за симптомов БА в группе больных с гибким дозированием Симбикорта увеличилась на 24%, а в группе с приемом постоянной дозы – на 25%. За 3 мес. исследования доля дней без симптомов БА увеличилась в обеих группах на 31%. Число ночей без пробуждений из-за БА у больных, получавших Симбикорт в постоянной дозе и в режиме гибкого дозирования возросло на 30% и 28%, соответственно. По всем этим показателям между сравниваемыми группами не было статистически достоверных отличай.
За время лечения среднее значения ОФВ1 у больных увеличились в группе с гибким дозированием на 15,1%, а в группе с фиксированной дозой Симбикорта в постоянной дозе - на 18,4%. Статистически по степени и скорости прироста ОФВ1 и ПСВ исследуемые группы между собой не различались.
Таблица 7 Демографические и клинические параметры больных, включенных в исследование гибкого дозирования симбикорта
| Демографические и клинические параметры | Гибкое дозирование | Фиксированная доза |
| Всего больных | 383 | 88 |
| Средний возраст, лет | 44,36 [37,80-50,92] | 49,03 [46,28-51,79] |
| Мужчины/женщины | 262/121 | 68/20 |
| Средний стаж заболевания, лет | 10,49 [9,573-11,40] | 14,14 [11,86-16,42] |
| Ночные симптомы, раз в нед. | 3,227 [2,854-3,599] | 2,238 [1,788-2,688] |
| Дневные симптомы, раз в нед. | 3,478 [3,266-3,689] | 3,628 [3,082-4,174] |
Доля больных, у которых за период лечения не отмечалось обострений БА в группе с гибким дозированием составила 84%, а в группе с назначением Симбикорта в постоянной дозе – 87%. Сравниваемые группы также не различались между собой по уровню качества жизни. Таким образом, лечебный эффект Симбикорта в обеих группах оказался одинаковым, но при этом, больные в группе с гибким дозированием получили за период исследования в среднем на 38% меньше препарата, чем в группе, получавшей фиксированную дозу Симбикорта. Гибкое дозирование Симбикорта дает возможность поддерживать контроль над БА на высоком уровне, но использовать при более низкие дозы препарата, что снижает риск нежелательных эффектов и делает лечение дешевле. Кроме того, применение более низких доз препарата не сопровождается увеличением числа обострений БА.
3.6 Фармакоэкономическое обоснование комбинированной терапии БА
Нами было проведено фармакоэкономическое моделирования трех вариантов терапии БА: рутинная терапия по 20 регионам РФ, терапия Симбикортом в виде базисной терапии и для ингаляций по потребности (т.н. SMART) и терапия Серетидом в постоянной дозе.
В исследовании учитывались затраты системы здравоохранения (консолидированный бюджет системы здравоохранения и социального развития) и бремя бронхиальной астмы в целом, которое оценивалось как сумма прямых медицинских затрат, социальных выплат по причине нетрудоспособности, потери налоговых поступлений в консолидированный бюджет РФ.
Исследование показало, что применение Симбикорта в режиме SMART обходится в среднем в 1,2-1,4 раза дороже, чем те препараты, которые обычно назначаются больным БА в нашей стране (23 990 руб. в год и 19 899 руб. в год, соответственно). Стоимость лечения Серетидом (29 908 руб. в год), в сравнении с рутинной терапией, оказалась соответственно еще выше.
Более низкая стоимость рутинной терапии объясняется тем, что в РФ 49% больных получают лечение, несоответствующее рекомендациям GINA: у таких больных используются заниженные дозы ГКС и ряд малоэффективных, но сравнительно недорогих препаратов. Невыполнение рекомендаций GINA приводит к более частым обострениям БА и госпитализациям больных, но расходы на амбулаторное лечение при этом относительно невелики.
Благодаря более эффективной профилактике обострений БА, при использовании SMART, суммарные затраты на терапию обострений БА для больных, получающих SMART значительно ниже, чем при рутинной терапии: в среднем 2 390 руб. в год на одного больного, по сравнению с 49 589 руб. при рутинной терапии. Использование SMART, по сравнению с рутинной терапией также позволяет сократить социальные выплаты с 35 219 до 638 руб. в год на одного больного. Таким образом, дополнительное повышение стоимости амбулаторной терапии у больных, использующих SMART многократно компенсируется благодаря снижению расходов на госпитализации, неотложную помощь и сокращение выплат по больничным листам. Способность SMART эффективно предотвращать обострения БА, позволяет также снизить потери ВВП, связанные с временной нетрудоспособностью больных.
Проведенное нами моделирование показало, что при переходе с рутинной терапии к лечению Симбикртом в режиме SMART можно ожидать снижения общего бремени БА не менее чем на 57 тыс. рублей в год на каждого больного БА. При этом, максимальную экономическую выгоду из применения SMART (снижение общего бремени БА до 78 тыс. рублей) извлекут регионы, в которых средние сроки госпитализации по поводу БА выше.
Результаты исследования показывают, что каждый дополнительный рубль, потраченный на SMART, обеспечит дополнительное (по сравнению с рутинной терапией) снижение общих затрат системы здравоохранения на 3,19-10,45 рублей в зависимости от средней продолжительности госпитализаций. При использовании Серетида в постоянной дозе общие затраты снижаются на 2,33-3,65 руб. на каждый вложенный рубль.
По всем исследуемым параметрам, использование Серетида оказалось более предпочтительным по сравнению с рутинной терапией, однако уступало по экономической эффективности SMART.
Выводы и практические рекомендации
Выводы:
- Состояние с амбулаторной терапией БА в нашей стране требует существенной оптимизации. Из числа больных, регулярно получающих амбулаторную медицинскую помощь по поводу БА, только 4% имеют контроль над заболеванием. У 70-80% больных течение БА сопровождается выраженными симптомами, заметно снижающими качество жизни. В среднем каждый больной за год 12,9 раз обращается в поликлинику и 5,6 раз вызывает скорую медицинскую помощь. Только 40% больных не имели в течение года госпитализаций по поводу БА, в то же время у 18% за год насчитывалось две и более госпитализации.
- При решении вопросов о фармакотерапии больных БА большинство (88%) врачей использует различные по содержанию и по времени издания стандарты и руководства по клинической практике. Это приводит к отсутствию общих подходов в стратегии лечения. Высокая частота ошибок в определении тяжести течения заболевания (55% всех диагнозов) приводит к неправильному выбору объема провоастматической терапии. В результате лишь у 69% больных с умеренной и 55% больных с тяжелой БА выбранное лечение соответствует тяжести заболевания.
- Фармакоэпидемиологический анализ позволяет оперативно выявлять основные проблемные аспекты фармакотерапии. Например, данные анализа показывают, что в 20,3% случаев больные не получают ингаляционные ГКС, еще большая часть больных получает эти средства в недостаточных дозах. Анализ ситуации в 20 регионах РФ показывает, что в 5-ти регионах из 20-ти 95% больных получающих ГКС, принимают их в дозах ниже оптимальных. И лишь в Московской, Калужской и Свердловской областях большинство (95%) больных получают ингаляционные ГКС в достаточных дозах. Другими проблемными аспектами фармакотерапии являются: позднее (спустя 4-6 лет) начало лечения ингаляционными ГКС, недостаточно активное применение 2-адреностимуляторов длительного действия, неоправданно частое (у 18% больных) назначение ГКС внутрь.
- Политика внедрения национальных стандартов и руководств по фармакотерапии БА приводит к ощутимым положительным результатам, которые более заметны в Москве, по сравнению с другими регионами РФ. В частности с 1996 г существенно увеличилось число больных, получающих ингаляционные ГКС и LABA, имеется тенденция к увеличению средних доз, что терапию более эффективной. Вместе с тем, по большинству маркеров качества фармакотерапии регионы РФ «отстают» от Москвы на 4-5 лет.
- Фармакоэкономический анализ показывает, что средних сроках госпитализации больных БА в 14 койко-дней величина общего бремени БА составляет 84 250 руб. в год, а при удлинении госпитализации до 21 койко-дня – 104 707 рублей на 1 больного в год. При этом 19% всех расходов составляет амбулаторная терапия больных, 34% - выплаты по больничным листам и др. социальные платежи, в то время как неоправданно высокая доля расходов (47%) приходится на госпитализации больных с обострением БА. Проведенные нами исследования показали, что переход на более прогрессивные способы лечения (использование комбинированных средств, применение Формотрола/Будесонида как для базисной терапии, так и для купирования симптомов) позволяет снизить общее бремя БА примерно в 3 раза, при этом основная доля расходов приходится именно на базисную терапию, а затраты на госпитализации и социальные выплаты составляют лишь 9% и 2%, соответственно.
- Клинико-фармакологический анализ наиболее распространенных в клинической практике моделей фармакотерапии БА показывает, что наиболее хорошие клинические результаты удается достигнуть при использовании комбинированных (ингаляционные ГКС и 2-адреностимуляторы длительного действия) препаратов или высоких доз ГКС. При этом назначение комбинированных препаратов более рентабельно, так как увеличение затрат на базисную терапию приводит к более существенному снижению расходов на терапию обострений и госпитализации больных БА. Вместе с тем, распространенность фармакоэкономически обоснованных моделей лечения в клинической практике все еще не превышает 10%.
- Клинико-фармакологический анализ популяционной фармакодинамики ингаляционных ГКС показывает, что увеличение доз этих препаратов более 500 мкг/сут. не дает у большинства больных дополнительного увеличения степени контроля над заболеванием. Таким образом, в отечественной популяции больных проблема достижения адекватного уровня контроля над БА не может быть решена только за счет использования высоких доз ингаляционных ГКС. В то же время, использование комбинированной терапии позволяет улучшить ответ на лечения даже при использовании более низких доз ГКС.
- Обучение врачей поликлинического звена и создание пульмонологами индивидуальных планов лечения больных БА позволяет существенно улучшить качество амбулаторной помощи больным БА. Использование таких планов в 69% случаев позволяет обеспечить высокий уровень преемственности между специалистами и врачами поликлинического звена.
- Применение фиксированных комбинаций ингаляционных ГКС и 2-адреностимуляторов длительного действия является наиболее мощным инструментом оптимизации амбулаторного лечения БА. Например, после перехода с обычной терапии на применение комбинированных препаратов среднее число бессимптомных дней у больных БА увеличивается в 4 раза, в 3,4 раза уменьшается интенсивность использования по потребности бронхолитиков короткого действия, значительно увеличивается качество жизни и показатели спирометрии.
- Дополнительным способом оптимизации терапии БА является гибкое дозирование Формотрола/Будесонида, благодаря которому удается поддерживать адекватный контроль над БА при использовании меньших доз препарата и, как следствие, при меньших затратах на лечение.
Практические рекомендации:
- Рекомендуется периодически проводить фармакоэпидемиологический мониторинг терапии БА на уровне отдельных лечебных учреждений, городов, областей. В фокусе подобных исследований должны находиться проблемные аспекты фармакотерапии БА: число больных, применяющих ингаляционные ГКС, 2-адреностимуляторы длительного действия, ГКС для приема внутрь. Наряду с этим необходимо учитывать средние дозы ингаляционных ГКС и их соответствие тяжести течения БА. Полученные результаты должны использоваться при составлении формуляров лечебных учреждений, планировании образовательных программ для врачей, а так же для планирований инвестиционной политики в области здравоохранения.
- Необходим переход к единым и более простым стандартам терапии БА. Наряду с этим консультативная помощь врачей пульмонологов должна в обязательном порядке включать составление индивидуального плана лечения каждого больного БА.
- Следует административно ограничивать использование у больных БА средств, не имеющих доказанной эффективности (М-холинолитиик, муколитики) и ингаляционных ГКС в заведомо неэффективных дозах (менее 200 мкг/сут.).
- Необходимо более широко использовать комбинированные препараты для терапии БА. Больным, у которых контроль над БА не был достигнут при использовании ингаляционных ГКС в суточной дозе 500 мкг в пересчете на БДП, должны назначаться комбинированные препараты, в состав которых входят ингаляционные ГКС и 2-адреностимуляторы длительного действия.
- Использование комбинированных (ингаляционные ГКС и 2-адреностимуляторы длительного действия) препаратов можно также рекомендовать:
- больным, у которых контроль над БА не был достигнут при использовании ингаляционных ГКС и длительно действующих 2-агонистов, назначенных в виде разных ингаляторов;
- у больных, принимающих ГКС внутрь, для снижение дозы системных ГКС;
- у пациентов, получающих высокие дозы ингаляционных ГКС, для снижения дозы.
- У больных, способных точно выполнять рекомендации врача комбинированный препарат Формотрол/Будесонид 160/4,5 мкг может быть назначен альтернативных режимах дозирования:
- гибкое дозирование, при котором Формотрол/Будесонид назначается в дозах от 2-х ингаляций (при нормальных показателях пиковой скорости выдоха и отсутствии симптомов) до 6-8-и ингаляций в день (при появлении симптомов в ночные часы и снижении пиковой скорости выдоха до 50-70%). Больной должен быть предупрежден о необходимости обращения за неотложной помощью при снижении пиковой скорости выдоха ниже 50% или при возникновении некупирующегося приступа удушья).
- применение Формотрола/Будесонида (по 160/4,5 или 320/9 мкг утром и вечером) как для базисной терапии, так и для купирования симптомов (по 160/4,5 мкг по потребности). При этом общее число ингаляций не должно превышать 12-ти в сутки.
Публикации по теме диссертации
- Архипов В.В. Демидова Г.В., Лазарева Н.Б., Цой А.Н. Фармакоэпидемиологическая и клиническая оценка эффективности образовательных программ и внедрения индивилуальных планов лечения больных бронхиальной астмой. Пульмонология, 2002; 1: c. 105-109
- Цой А.Н., Архипов В.В. Фармакоэпидемиологический анализ амбулаторной терапии бронхиальной астмы у взрослых и подростков в г. Москве в 2003 г. Журнал «Consilium medicum», 2004; Том. 6, №4: с. 248-254
- Цой А.Н., Чучалин А.Г., Архипов В.В. Фармакотерапия бронхиальной астмы с точки зрения медицины, основанной на доказательствах. Терапевтический архив, 2003, 3, с. 73-77.
- Цой А.Н., Архипов В.В. Фармакоэкономический анализ терапии больных бронхиальной астмой комбинированным препаратом симбикорт турбухаллер. Пульмонология 2004; №2: 59-64.
- Цой А.Н., Демидова Г.В., Архипов В.В. Многоцентровое, сравнительное исследование эффективности и безопасности симбикорта турбухалер по сравнению с рутинной противоастматической терапией у больных со стабильным течением бронхиальной астмы. Пульмонология, 2004; №1: с. 83-88
- Цой А.Н., Архипов В.В. Комбинированные средства для терапии бронхообструктивного синдрома. Глава 7 в кн.: Рациональная фармакотерапия заболеваний органов дыхания: руководство для практических врачей. Под ред. Чучалина А.Г. - М.: Издательство «Литтерра», 2004 - с. 98-103
- Ноников В.Е., Цой А.Н., Маринин В.Ф., Чельцов В.В., Архипов В.В., Бердникова Н.Г., Петрова Е.С. Инструкция по проведению клинических исследований новых ингаляционных глюкокортикостероидов. Руководство по проведению клинических исследований новых лекарственных средств. Под ред. Р.У. Хабриева, И.Н. Денисова, В.Б. Герасимова, В.Г. Кукеса. - М.: Издание ФГУ «НЦ ЭСМП» Росздравнадзора, 2005 - с. 113-123
- Ноников В.Е., Цой А.Н., Маринин В.Ф., Чельцов В.В., Архипов В.В., Бердникова Н.Г., Петрова Е.С. Инструкция по проведению клинических исследований новых ингаляционных бета2-агонистов. Руководство по проведению клинических исследований новых лекарственных средств. Под ред. Р.У. Хабриева, И.Н. Денисова, В.Б. Герасимова, В.Г. Кукеса. - М.: Издание ФГУ «НЦ ЭСМП» Росздравнадзора, 2005 – с. 102-112
- Цой А.Н., Архипов В.В. Нежелательные эффекты бета2-адреномиметиков. Глава 11 в коллективной монографии «Молекулярные механизмы нежелательных лекарственных реакций» под ред. М.А. Пальцева. – М.: Издательский дом «Русский врач», 2005 - с. 178-189
- Arkhipov V.V., Tsoi A.N., Lazareva N.B. Pharmacoepidemiologic analysis outpatient treatment of bronchial asthma. European Respiratory Journal, 2005; Vol 26, suppl. 49 (September 2005): abstract 2467
- Чучалин А.Г., Цой А.Н., Архипов В.В., Гавришина Е.В. Бронхиальная астма в России: результаты национального исследования качества медицинской помощи больным бронхиальной астмой. Пульмонология, 2006; №6: с. 94-102
- Цой А.Н., Архипов В.В., Гавришина Е.В. Эффективность Симбикорта в реальной клинической практике: результаты Российского национального исследования. Пульмонология, 2006; №2: с. 60-66
- Цой А.Н., Архипов В.В., Гавришина Е.В. Какая модель базисной терапии бронхиальной астмы является оптимальной для российских больных? Пульмонология, приложение к журналу Consilium-medicum, 2006: c. 23-25
- Tsoi A.N., Gavrishina E.A., Lazareva N.B., Arkhipov V.V. Efficacy of the using budesonide/formoterol in patients with bronchial asthma (BA): the study of routine clinical practice. European Respiratory Journal, 16 ERS Annual Congress, Volume 28, Supplement 50, September 2006,-P.1486.
- Tsoi A.N., Arkhipov V.V., Lazareva N.B., Gavrishina E.A. The total control of bronchial asthma (BA)-clinician's and patient's opinion. European Respiratory Journal, 16 ERS Annual Congress, Volume 28, Supplement 50, September 2006,-P.1488.
- Цой А.Н., Архипов В.В., Гавришина Н.Б., Аверьянов М.Г. Российское многоцентровое наблюдательное исследование эффективности Симбикорта в условиях реальной клинической практики. Русский медицинский журнал, 2006; том. 14, №4: с. 182-187
- Архипов В.В., Цой А.Н., Гавришина Е.В. Клиническая и экономическая оценка наиболее распространенных в реальной клинической практике моделей базисной терапии бронхиальной астмы. Клиническая медицина. 2007;85(2):63-7.
- Архипов В.В. SMART – новая концепция терапии бронхиальной астмы. Руководство для врачей. – М.: Издательский дом «Атмосфера», 2007 – 56 с.
- Цой А.Н., Архипов В.В., Чапурин С.А., Чурилин Ю.Ю. Фармакоэкономическое исследование новой концепции применения Симбикорта у больных бронхиальной астмы. Пульмонология, 2007; 3: c. 34-40
- Чучалин А.Г., Цой А.Н., Архипов В.В. Симбикорт: одновременное применение в качестве базисной терапии и для купирования симптомов бронхиальной астмы. Пульмонология, 2007; 2: c. 98-103
- Lazareva N, Arkhipov V, Igonin A., Tsoy A. Pharmacoepidemiological analysis of the use of bronchodilators in bronchial asthma (BA) treatment in Russia. European Respiratory Society 17th Annular Confres Abstract Book. Stockholm 2007; р. 154.
- Lazareva N, Arkhipov V, Igonin A., Tsoy A. Effect of b2-agonists on severe asthma exacerbation and asthma-related hospitalization. European Respiratory Society 17th Annular Confres Abstract Book. Stockholm 2007; р. 352.
- Lazareva N, Arkhipov V, Tsoy A. Effectiveness of different models of maintenance therapy for bronchial asthma (BA) in routine clinical practice. European Respiratory Society 17th Annular Confres Abstract Book. Stockholm 2007; р. 70.
- Цой А.Н., Архипов В.В. Бронхиальная астма: новые решения. - M.: OOO «Медицинское информационное агентство», 2007. – 320 с.
- Цой А.Н., Архипов В.В. Фармакология препаратов, воздействующих на дыхательные пути. В Респираторная медицина. Руководство под ред. академика РАМН А.Г. Чучалина. - М.: Издательская группа «Геотар-Медия», 2007 – Том 1: с. 113-130

