Гинекологические и онкологические аспекты постменопаузы
На правах рукописи
Антонова Ирина Борисовна
ГИНЕКОЛОГИЧЕСКИЕ И ОНКОЛОГИЧЕСКИЕ АСПЕКТЫ ПОСТМЕНОПАУЗЫ
14.01.01 – «Акушерство и гинекология»
14.01.12 – «Онкология»
АВТОРЕФЕРАТ
диссертации на соискание
ученой степени доктора медицинских наук
Москва - 2010
Работа выполнена в ФГУ «Российский научный центр рентгенорадиологии Росмедтехнологий» и ГОУ ВПО «Московский государственный медико-стоматологический университет Росздрава»
Научные консультанты:
Заслуженный врач РФ,
доктор медицинских наук,
профессор Манухин Игорь Борисович
Заслуженный врач РФ,
доктор медицинских наук,
профессор Ашрафян Левон Андреевич
Официальные оппоненты:
Академик РАМН, доктор Серов Владимир Николаевич
медицинских наук,
профессор
Доктор медицинских наук, Подзолкова Наталья Михайловна
профессор
Доктор медицинских наук Кузнецов Виктор Васильевич
профессор
Ведущее учреждение: ГОУ ВПО «Московская медицинская академия
им. И.М. Сеченова Росздрава»
Защита состоится « » г. в час. на заседании диссертационного Совета
Д 208.041.06. при ГОУ ВПО «Московский государственный медико-стоматологический университет Росздрава» по адресу: 127427, Москва, ул. Делегатская, д. 20/1.
С диссертацией можно ознакомиться в библиотеке Московского государственного медико-стоматологического университета (127206, Москва, ул. Вучетича, д. 10а).
Автореферат разослан «___»_______________2010 г.
Ученый секретарь
диссертационного совета
д.м.н., профессор Умаханова М.М.
I. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Тенденции развития общества все с большей очевидностью свидетельствуют о постепенном росте числа пожилых людей в мировых масштабах. В России, не смотря на снижение продолжительности жизни в последнее десятилетие прошлого века, так же формируется подобная структура населения. Опыт наиболее развитых стран позволяют убедительно прогнозировать, что в дальнейшем две трети населения проживут 85 и более лет и свыше 90% проживут более 60 лет. Население развитых стран мира стареет. Стремление общества и каждого конкретного человека совпадают в желании продлить период активной и плодотворной жизнедеятельности пожилых. У женщин период старения наиболее ярко ассоциирован с менопаузой. В процессе и после менопаузы формируются сложные метаболические и гормональные сдвиги, происходит снижение адаптационных возможностей организма [Манухин И.Б. 2006] В целом можно выделить ряд важных (глобальных) процессов, формирующие основные «нормальные болезни» [В.М.Дильман 1989] этого возраста. К числу их, прежде всего, необходимо отнести метаболический синдром с сопутствующим атеросклерозом, выраженные атрофические процессы с сопутствующим хроническим воспалением, значительное накопление поломок в генетическом аппарате, наличие эпигенетических нарушений в опухоль-супрессорных генах. На фоне перечисленных процессов складывается весьма стойкое иммунологическое бессилие, в рамках которого совершенно по-новому формируются взаимоотношения с инфекцией. Иными словами, вектор гомеостаза в постменопаузе достаточно четко ориентирован на развитие широкого круга патологических процессов, которые мы постарались ранжировать в двух направлениях (понимая достаточную условность подобного подразделения): в направлении ограниченном интересами гинекологии и в направлении, относящегося интересам онкологии.
Важным представляется дальнейшее изучение особенностей формирования рецепторного аппарата в постменопаузе. Особый интерес вызывает определение вариантов постменопаузы с учетов возможного гoрмонального фона и уровня эстроген-рецепторов в тканях-мишенях [Ашрафян Л.А. и соавт. 2002г]. С этих же позиций представляет интерес и определение уровня минеральной плотности костной ткани в постменопаузе, особенностей формирования метаболического синдрома. Изучение причин и профилактика подобных изменений, связанных со старением могут значительно улучшить качество жизни и качество здоровья женщин в старших возрастных группах [Lauritzen C., Studd J. 2005]. В таком же ракурсе следует рассматривать и проблемы индуцированной менопаузы, когда резкое прекращение гормональной функции яичников переводит молодых в физиологическом смысле женщин в режим ускоренного метаболического старения. Правильная и своевременная терапия подобных изменений является одним из важнейших направлений современной гинекологии [Сметник В.П. 2006г]
Одной из основных причин смертности являются онкологические заболевания. По данным Международного агентства по изучению рака, в 2000г злокачественными опухолями в мире заболело более 10млн. человек, а количество умерших составило 8млн. В России первое место по заболеваемости злокачественными опухолями у женщин принадлежит раку молочной железы. Рак органов репродуктивной системы занимает 5-8 ранговые места [Чиссов В.И., Старинский В.Н., Петрова Г.В., 2008г]. Проблема изучения этиологии и патогенеза опухолевых заболеваний у женщин привлекает пристальное внимание ученых многих специальностей. В этой области, не смотря на определенные успехи, остается множество не решенных проблем. Требуют дальнейшего уточнения механизмы гормонально-метаболических нарушений и изменения уровня рецепторов половых гормонов в постменопаузе, приводящие к возникновению неоплазий. Представляет интерес и сравнительный анализ механизмов развития гинекологического рака у молодых и пожилых пациенток. Углубленное изучение канцерогенеза в последние два десятилетия привело многих исследователей к осознанию значительной роли инфекционных факторов в возникновении рака. В настоящее время отдельные авторы в качестве возможных этиологических кофакторов злокачественной трансформации при спорадическом гинекологическом раке рассматривают целый ряд вирусов: папилломавирусная инфекция, вирус Эпштейн-Барр, вирус простого герпеса, цитомегаловирус и ТТ-вирус [Е-M de Villiers et al, 2002; Q-J Wu et al, 2003; H. J. Yang, 2003; A.J. Littman, 2003; Максимов и соавт., 2003, Hoskins W. J, Perez C. A. Et al. 2005, Reznek R. H 2007]. Все это диктует необходимость проведения целенаправленного изучения вирусной инфекции (ВПЧ) при гинекологическом раке.
Природным и синтетическим эстрогенам неоднократно приписывалась существенная роль в этиопатогенезе некоторых опухолей у человека, в частности РЭ [Берштейн Л.М., 2000; Bosze P 2003; Coukos G., Rubin S.C. 2004, Eifel P.J., Gershenson D.M 2006]. Около 20 лет назад I.Berenblum отнес способность таких гормонов, как эстрогены самостоятельно вызывать опухоли к числу неразрешенных проблем канцерогенеза. Еще тогда существовало фундаментальное различие между влиянием гормонов на канцерогенез и гормональным канцерогенезом как таковым [Берштейн Л.М., 2000; под.ред. Заридзе Д.Г., 2004].
Накопившиеся за эти годы сведения дают возможность выделить два типа гормонального канцерогенеза: промоторный (физиологический) и генотоксический, связанный с действием некоторых эстрогенных метаболитов [Henderson B.E., Feigelson H.S., 2000; Yue W., Santen R.J., 2003]. Эстрогены подвергаются окислительно-восстановительным метаболическим реакциям. Формирующимся при этом метаболитам приписываются генотоксические свойства [Liehr J.G., 1997; Mas S., Laso N., 2003; Tang S.et al., 2004]. Изучение особенностей метаболизма эстрогенов в постменопаузе при гинекологическом раке позволит установить важное звено в этиопатогенезе гинекологического рака в постменопаузе.
Понимание механизма вирусного этиопатогенеза при спорадическом раке во взаимосвязи с обозначением роли метаболических процессов позволит приблизиться к созданию общей модели гинекологического рака, сформулировать важные пути реализации канцерогенного эффекта.
Данные вопросы имеют и значительное прикладное значение, как в совершенствовании собственно методов лечения рака, так и в рациональной терапии последствий этого лечения, а именно посткастрационных нарушений. Поскольку единственным патогенетически обоснованным вариантом лечебного воздействия в случае индуцированной менопаузы является заместительная гормонотерапия (ЗГТ), то необходимым представляется формулировка принципов ее применения у онкологических больных c учетом возможных рисков [Genazzani A.R. 2002, Schneider H.P.J.2003; Beral V. 2007; Calle E.E., Feigelson H.S. 2009].
Масштабы проблем, связанных с онкологическими заболеваниями органов репродуктивной системы у женщин заставляют обратить более пристальное внимание и на организационно-методологические аспекты этой проблемы. Без четко организованной системы лечебно-профилактических мероприятий не могут быть эффективно реализованы достижения современной медицинской науки. Комплекс мер, направленных на усовершенствование этой работы являются своевременными и важными.
Цель исследования
Cнижение заболеваемости гинекологическим раком у женщин постменопаузального возраста путем улучшения методов профилактики и ранней диагностики при различных этиопатогенетических вариантах онкогинекологических заболеваний
Задачи исследования
- Изучить ряд функциональных параметров (уровень эстрогеновых рецепторов в тканях-мишенях, особенности экспрессии эстрогенных метаболитов – соотношение 2ОН/16аОН) у пациенток в периoде постменопаузы.
- Сформировать концепцию патогенетических типов постменопаузы – фактора, определяющего своеобразие развития «нормальных болезней»
- Выявить особенности этих же параметров у пациенток с индуцированной менопаузой и сформировать стратегию заместительной гормональной терапии у этой категории больных.
- Изучить особенности рецепторного аппарата и характер экспрессии эстрогенных метаболитов при раке репродуктивных органов у пациенток постменопаузального возраста.
- Определить роль инфекционного фактора в этиопатогенезе гинекологического рака у пациенток постменопаузального периода.
- Обосновать концепцию патогенетической профилактики рака женских половых органов в группе больных постменопаузального периода.
- Сформулировать основные принципы лечебно-профилактических мероприятий на уровне первичной медико-санитарной помощи для женщин в постменопаузе.
Научная новизна
Определены патогенетические варианты постменопаузы в зависимости от уровня эстроген-рецепторов и гормонального фона организма с учетом индекса массы и тела и характера минерализации костной ткани.
Показаны особенности проявления и частота формирования постовариоэктомического синдрома у женщин после радикального лечения рака шейки матки. Сформулированы принципы гормональной коррекции у этой категории больных.
Установлена частота папилломавирусной инфекции при злокачественных эпителиальных опухолях яичников, раке вульвы. Зарегистрирован синтез онкобелка Е 7 в ВПЧ-позитивных образцах опухолевой ткани яичников и вульвы. Определено, что при раке эндометрия ВПЧ-инфицированность находится на низком уровне.
Впервые определено, что при раке эндометрия и раке яичников в постменопаузе имеется соотношение метаболитов эстрогенов с преобладанием высокого уровня 16-гидроксиэстрона, что, по-видимому, является своеобразным прогностическим маркером злокачественного процесса.
Полученные результаты позволяют отнести наличие ВПЧ-инфекции и низкого уровня соотношения метаболитов эстрогенов к экзо-эндогенным факторам этиопатогенеза гинекологического рака. Имеются существенные различия в значимости этих компонентов при раке различных локализаций.
Определены пути совершенствования лечебно-профилактической помощи женщинам в постменопаузе с целью снижения заболеваемости гинекологическим раком.
Практическая значимость
Полученные данные о частоте ассоциации ВПЧ со злокачественными эпителиальными опухолями яичников и раком вульвы позволяют установить кофакторы злокачественной трансформации. А сведения о метаболических гормональных сдвигах с преобладанием агрессивного метаболита 16--ОН при раке яичников и раке эндометрия позволяют сформулировать общие экзо- и эндогенные патогенетические механизмы развития гинекологического рака.
Исследование метаболических изменений и инфекционного фактора при опухолях женских половых органов служило целью сформировать группы риска злокачественных неоплазий у женщин постменопаузального возраста.
Изучение индуцированной менопаузы после радикального лечения рака шейки матки позволило сформулировать и обосновать принципы гормональной коррекции при данном заболевании.
Определение основных патогенетических вариантов постменопаузы позволяет более целенаправленно и углубленно изучать состояние здоровья пациенток в этом периоде жизни, создать систему профилактики и раннего выявления опухолей женской репродуктивной системы.
Основные положения, выносимые на защиту
- В постменопаузальном возрасте на основании определения эстрогенного фона организма женщины и рецепторного компонента (рецепторы эстрогенов) выделяются четыре варианта постменопаузы с различным сочетанием вышеуказанных составляющих.
- В этиопатогенезе злокачественных эпителиальных опухолей яичников присутствует как инфекционный фактор (ВПЧ), так и гормональная составляющая, с превалированием высокоагрессивного 16--гидросиэстрона. При раке эндометрия у больных имеются проявления метаболического синдрома с высокой экспрессией 16а-гидроксэстрона и низкой продукцией 2-гидроксиэстрона. Инфекционный фактор не является значимым.
- Определение экспрессии онкобелка Е7 позволяет подтвердить реализацию канцерогенного эффекта ВПЧ, что имеет наибольшее значение при начальном раке шейки матки. При раке вульвы, ввиду отсутствия детекции Е7 ранняя диагностика с помощью этого метода не целесообразна.
- Заместительная гормональная терапия у пациенток после радикального лечения рака шейки матки позволяет снизить проявления нейровегетативного и психоэмоционального синдромов средней и тяжелой степени, улучшение состояния минеральной плотности костной ткани более характерно для пациенток репродуктивного возраста. Проведение ЗГТ возможно после полного обследования с учетом всех факторов неблагоприятного прогноза как самого заболевания, так и общего состояния здоровья пациентки с индивидуальной коррекцией препарата, длительности и способа введения.
- В целях более эффективной профилактики и ранней диагностики гинекологического рака в существующую структуру женской консультации необходимо внедрение отделения патологии постменопаузы для реализации программ скрининга.
Апробация работы состоялась на научно-практической конференции ФГУ «Российский научный центр рентгенорадиологии Росмедтехнологий» 6 ноября 2009 года. Результаты исследований доложены на Невском радиологическом форуме «Из будущего в настоящее» (Санкт-Петербург 9-12 апреля 2003г); 4-ом Российском форуме «Радиология 2003» (Москва, 2003); на конференции, посвященной 80-летию российского научного центра рентгенорадиологии МЗ РФ (1924-2004) «Научно-технический прогресс отечественной лучевой диагностики и лучевой терапии» (Москва, 2004); на научно-практической конференции «Современные подходы к диагностике и лечению гинекологического рака» (Псков, 16-17 сентября 2004г); на Невском радиологический форуме 2005 «Наука-клинике» (Санкт-петербург 9-12 апреля 2005); на VII российском научном форуме «Радиология 2006» (Москва, 25-28 апреля 2006); на Всероссийской научно-практической конференции «Высокие медицинские технологии» ( Москва, 2006): на 8-м Всероссийском научном форуме «Мать и дитя» (Москва 3-6 октября, 2006); на Первом международном конгрессе по репродуктивной медицине (Москва, 8-12 июня 2006); на 10 конференции «Современные технологии в диагностике и лечении гинекологических заболеваний» (Москва, 2007); на XVI-ом Всероссийском конгрессе «Человек и лекарство» (Москва, 6-10 апреля 2009), на Российской конференции по онкогинекологии (Москва, 8-9 апреля 2009).
Публикации. По материалам диссертации опубликовано 46 работ, из них 12 в центральной, 6 - в зарубежной печати, главы в 1 монографии и 1 руководстве для врачей. Материалы диссертации использованы при подготовке методических рекомендаций.
Объем и структура диссертации. Диссертация изложена на 260 страницах машинописного текста и включает введение, обзор литературы, материал и методы исследования, 3 главы, в которых изложены результаты собственных исследований и наблюдений, заключение, выводы, практические рекомендации и указатель литературы. Работа иллюстрирована 42 рисунками, 47 таблицами и 1 фотографией. Библиография включает в себя 336 источников из них 116 отечественной и 220 зарубежной литературы.
Работа выполнена в ФГУ «Российский научный центр рентгенорадиологии Росмедтехнологий» и в ГОУ ВПО «Московский государственный медико-стоматологический университет Росздрава».
II. ХАРАКТЕРИСТИКА ОБСЛЕДОВАННЫХ БОЛЬНЫХ И МЕТОДЫ ИССЛЕДОВАНИЯ
1. Характеристика обследованных больных
В основу работы положен анализ клинических наблюдений за 627 пациентками
Группы составили больные гинекологическим раком постменопаузального возраста
- 153 больные раком шейки матки, из них 87 больных инвазивным раком шейки матки и 66 пациенток с cancer in situ
- 60 больных раком эндометрия
- 67 больных с эпителиальным раком яичников
- 80 больных раком вульвы
- группа больных раком шейки матки с индуцированной менопаузой: в репродуктивном возрасте - 60 женщин; и в перименопаузальном возрасте – 96 пациенток
- 111 женщин постменопаузального возраста без анамнестических данных о наличии рака любой локализации – контрольная группа
В группе пациенток постменопаузального возраста исследование уровня эстроген-рецепторов в тканях нормального эндометрия произведено у 64 пациенток из 111, в ткани неизмененной вульвы у 64 пациенток из 111.
Средний возраст пациенток в группе нормально протекающей менопаузы составил 56,4+1,6 года. Средний возраст обследуемых пациенток с диагнозом рак эндометрия составил 60,2 ± 1,0 года. По нашим данным средний возраст обследуемых пациенток с диагнозом эпителиальный РЯ составил 56,8+1,5 года. Средний возраст женщин с диагнозом рак вульвы составил 66,7 ± 0,7 года. Средний возраст пациенток с индуцированной менопаузой после радикального лечения рака шейки матки составил 45,6+0,9лет.
Средний возраст наступления менопаузы составил в группе больных РШМ 53.6+0,8, при РЭ 50,7+0,4 года, в группе больных РЯ 49,6+0,8, при РВ 49,6+0,8 года, в группе с нормально протекающей постменопаузой 49,8+0,5 года. Длительность периода постменопаузы варьировала в пределах от полугода до 36 лет. Средняя продолжительность постменопаузального периода в основной и контрольной группах была 12,2+1,4 и 9,9+1,6 года соответственно. Длительность постменопаузы для больных раком вульвы составила 17,2+0,5 года.
Анализ генеративной функции показал, что среднее соотношение беременностей, родов, искусственных абортов и самопроизвольных выкидышей, приходящихся на одну женщину в группе нормально протекающей постменопаузы составило 3,7+0,4; 1,6+0,1; 2,1+0,4; 0,1+0,1; в группе больных РШМ - 4,2+0,3; 1,6+0,2; 2,6+0,2; 0,1+0,2; в группе больных РЭ - 3,2 ± 0,3, 1,6 ± 0,1, 2,0 ± 0,3, 0,05 ± 0,03; в группе больных РЯ - 3,8+0,3; 1,5+0,1; 2,2+0,2; 0,1+0,0, в группе больных РВ – 3,42+0,4; 1,9+0,3; 2,6+0,3; 0,1+0,02.
При анализе сопутствующей экстрагенитальной патологии обследуемых нами пациенток в группах достоверных различий в структуре заболеваемости не выявлено.
У больных РШМ репродуктивного и перименопаузального периодов с индуцированной менопаузой из сопутствующих экстрагенитальных заболеваний отмечены заболевания желудочно-кишечного тракта -26,6%, сердечно-сосудистые заболевания – 27,7%, сахарный диабет – 17,7%, бронхиты – 13,2%.
Распределение больных раком эндометрия по стадиям было следующим: I стадия была у 43 (71,7%) больных, II стадия – у 7 (11,7%), III стадия – у 10 (16,6%).
Распределение больных РЯ по стадиям распространения злокачественной опухоли было следующим: I стадия была диагностирована у 19 (28,4%) больных, II стадия – у 11 (16,4%), III стадия – у 31 (46,3%) и IV стадия – у 6 (8,9%).
Распределение больных РВ по стадиям: I стадия была диагностирована у 17()больных, IIстадия - у 19(), IIIстадия - у 19 и IV стадия - у 25 женщин.
При морфологическом исследовании препарата РЭ выявлены следующие гистологические типы опухолей: аденокарцинома различной степени дифференцировки – 56 (93,3%). В 2 наблюдениях морфологическая структура была представлена железисто-плоскоклеточным раком, в 1 – мезонефроидный рак и в 1 – светлоклеточный мезонефроидный рак. Эти 4 (6,7%) наблюдения вошли в группу опухолей с низкой степенью дифференцировки.
При морфологическом исследовании удаленного препарата у больных РЯ выявлены следующие гистологические типы опухолей: серозная аденокарцинома – у 52 (77,6%) и муцинозная аденокарцинома (22,4%) высокой (52,2%), умеренной и низкой (47,8%) степени дифференцировки.
Основной морфологической формой заболевания при РВ был плоскоклеточный рак высокой – 28 больных и низкой 52 пациентки дифференцировки.
2. Методы исследования
Для оценки распространенности опухолевого процесса, качества жизни обследование наблюдаемых больных проводилось с использованием традиционных методов исследования. Диагностическая программа включала в себя сбор анамнеза, пальпацию, маммографию, сонографию малого таза и зон регионарного лимфатического аппарата, цитологию опухоли и лимфатических узлов, обязательное гистологическое исследование операционного или биопсированного материала.
В нашем исследовании мы использовали нормограммы индексов массы тела, наиболее точно соответствующие результатам денситометрических измерений. Индекс массы тела (индекс Quetelet) определялся по формуле - соотношение веса в килограммах к квадрату роста в метрах (кг/м2). ИМТ (вес в кг/рост в м2) подразделялся на следующие категории: нормальный уровень (ИМТ 18,50-24,99), повышенный уровень (ИМТ 25,00-29,99) и ожирение (ИМТ >30,00).
Диагностика уровня минеральной плотности костной ткани осуществлялась с использованием бифотонной (DXA) рентгеновской абсорбциометрии на денситометрах DTX-200 (Дания).
В соответствии с рекомендациями ВОЗ остеопения регистрируется в том случае, если снижение МПКТ у пациента находится в пределах от 1 до 2,5 стандартных отклонений ниже среднего значения у здоровых людей в возрасте 40 лет (показатель Т). Остеопороз диагностируется при снижении МПКТ более чем на 2,5 стандартных отклонения. О высоком уровне МПКТ можно судить при повышении МПКТ более, чем на 1 стандартное отклонение.
Иммуногистохимические реакции для выявления РЭ проводили на парафиновых срезах с моноклональными антителами Anti-human estrogen receptor, клон 1 Д 5, фирмы «Dakopatts». Реакцию считали отрицательной, если она регистрировалась в клетках от 0% до 5-10%, слабоположительной – 10-20%(+) (менее, чем 1/3 клеток), умеренно выраженной – 20-40%(++) (более, чем 1/3, но менее, чем 2/3 клеток), резко выраженной – 50-100%(+++) (более, чем 2/3 клеток).
Так же проводилось определение экспрессии эстрогеновых рецепторов (ESR) методом проведения полимеразной цепной реакции в «режиме реального времени» с предварительной реакцией обратной транскрипции (ОТ-ПЦР). В работе использовали стандартные коммерческие реактивы ЗАО «НПФ ДНК-Технология». Для выделения нуклеиновых кислот применяли модифицированную методику выделения по Хомченскому. Определение уровня экспрессии мРНК ЕSR1 относительно HPRT1 считали методом дельта-дельта Си-ти (Ct).
Для количественного определения соотношения метаболитов эстрогена в моче (2-гидроксиэстрон/16-гидроксиэстрон) в настоящей работе был использован иммуноферментный набор ESTRAMET 2/16 ELISA. Значения уровня метаболитов эстрогенов в моче у «здоровых» женщин постменопаузального возраста [Bradlow H.L. 2001; Lord S.L. et al. 2002; Guilemette C. et al. 2004] 16-ОН 0,6-10 нг/мл; 2-ОН 1-20 нг/мл. Уровень соотношения метаболитов в популяции «здоровых» женщин постменопаузального возраста – 0,6-6. Среднее значение соотношения 2-ОН/16-ОН – 2.
Для обнаружения вирусов и бактерий в образцах опухолевой и нормальной тканей в настоящей работе применяли метод полимеразной цепной реакции (ПЦР).
Для оценки клинических вариантов психосоматических проявлений естественной и индуцированной менопаузы, степени их тяжести, был использован модифицированный менопаузальный индекс (ММИ) Куппермана в версии Е.В.Уваровой и соавт (1983г).
III. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
- Гинекологические аспекты у женщин постменопаузального возраста.
При обследовании пациенток постменопаузального возраста мы произвели измерение индекса массы тела в группе женщин, обратившихся в РНЦРР, с отсутствием анамнестических данных на наличие рака и зафиксировали следующие данные: ИМТ превышал 30мг/м2 в 16,2%, 25,00-29,99кг/м2 – 27,0% и соответствовал норме в 56,8%. При анализе распределения пациенток с ИМТ более 30кг/м2 в зависимости от длительности менопаузы следует констатировать, что в первые ее годы продолжает увеличиваться число женщин с ожирением. Дальнейшее уменьшение этого показателя отражает, к сожалению, вполне закономерную ситуацию большей смертности в популяции людей с лишним весов от различных причин. В группе пациенток постменопаузального возраста в 73,8% наблюдений характерно снижение минеральной плотности костной ткани. Остеопения выявлена в 37,8% наблюдений, а остеопороз - в 36%. У четверти пациенток (26,1%) имело место нормальное (13,5%) или высокое (12,6%) состояние уровня минеральной плотности костной ткани. Полученные данные свидетельствуют о постепенном снижении уровня МПКТ в постменопаузе. Более отчетливо подобные тенденции прослеживаются при рассмотрении средней величины МПКТ в зависимости от длительности менопаузы (рисунок 1).
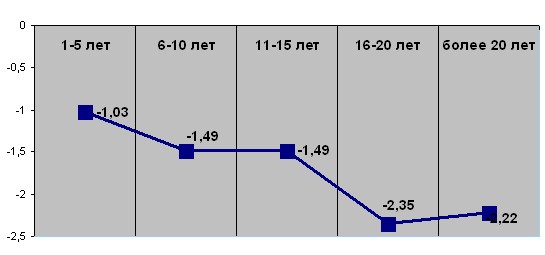
Рисунок 1. Результаты денситометрии (Ultra BMD T-score, средняя величина) у пациенток в зависимости от продолжительности постменопаузы.
В рамках нашего исследования было проведено изучение уровня ЭР в тканях молочной железы, эндометрия и вульвы у 64 пациенток постменопаузального возраста с отсутствием данных о наличии рака любой локализации в анамнезе и в момент проведения обследования.
Обращают на себя внимание следующие моменты: уровень рецепторов эстрогенов в ткани молочной железы падает с увеличением продолжительности постменопаузы (ЭР+ с 22,8% (менопауза до 5 лет) до 14,2% (более 15 лет); ЭР+++ с 27,2% (менопауза до 5 лет) до 12,5% (более 15 лет). При этом значительно увеличивается количество отрицательных ЭР проб с 50% при длительности менопаузы до 5 лет, до 71,4 при менопаузе более 15 лет. Анализ динамики снижения количества рецепторов свидетельствует о более интенсивном их убывании в первые 5 лет менопаузы.
Уменьшение количества случаев ЭР+++ в зависимости от длительности менопаузы в эндометрии столь же существенно, как и в молочной железе (более чем в 3 раза). А вот оценка состояния эндометрия с числом ЭР слабо- и умеренно выраженным, демонстрирует более низкие и равномерные темпы снижения.
Можно отметить, что в ткани вульвы не отмечается выраженных колебаний уровня ЭР. Число случаев ЭР+++ остается стабильным вне зависимости от длительности менопаузы (от 36,2% при менопаузе менее 5 лет, до 33,3% при менопаузе более 15 лет), что является с большей вероятностью отражением программы старения и генетически детерминировано. Интересным является сравнительный анализ высокого уровня ЭР в изученных образцах тканей. При продолжительности постменопаузы менее 5 лет во всех изученных тканях-мишенях (молочная железа, эндометрий, вульва) высокий уровень рецепторов эстрогенов (ЭР+++) был зарегистрирован практически в одинаковом соотношении (31,8%, 36,1% и 36,3% наблюдений соответственно). При длительности постменопаузы более 15 лет выявлено значительное снижение уровня рецепторов эстрогенов (ЭР+++) в гормонозависимых тканях-мишенях – 12,5% в ткани молочной железы и 11,1% в эндометрии, в ткани вульвы динамика снижения не столь существенна (33,3%).
Таким образом, гормонозависимые ткани в гораздо большей степени реагируют на менопаузальные изменения, чем относительно резистентные.
В целом, можно констатировать, что в постменопаузе складываются две группы женщин с различным рецепторным статусом, а именно с высоким и низким уровнем ЭР.
При проведении анализа вышеизложенных данных складывается совершенно определенное представление о патогенетических вариантах постменопаузы. Представляется очевидным, что в постменопаузе формируютмя два варианта состояния гормональной системы – гипоэстрогенный и относительно гиперэстрогенный. Полученные данные свидетельствуют, что во всех исследованиях, где отмечены высокие уровни эстроген-рецепторов, имеется превалирование повышенного ИМТ, причем, результаты, полученные для молочной железы и эндометрия, весьма схожи: 72,8% и 78,6% соответственно. Для вульвы этот показатель несколько ниже – 52,4%. Таким образом, одно из проявлений метаболического синдрома, выражающегося в висцеральном ожирении и, соответственно, в относительной гиперэстрогении, обеспечено достаточно высоким пулом эстроген-рецепторов в тканях–мишенях. Наряду с этим у определенной части пациенток при высоком уровне эстроген-рецепторов в органах – мишенях, ИМТ не превышает границы нормальных величин и наоборот, там, где имеется ожирение, сохраняется процент наблюдений с низким уровнем рецепторов: при молочной железе – 32,1%, вульве – 20,9%, эндометрии – 28%.
Вполне очевидно, что вероятная модель варианта постменопаузы должна формироваться не только с учетом возможного гормонального и метаболического фона, но и с учетом уровня эстроген-рецепторов в органах-мишенях. Патогенетические варианты гормонального гомеостаза в постменопаузе представлены на рисунке 2.
Вариант I Вариант II
Вариант III Вариант IV
Рис.2 Патогенетические варианты постменопаузы.
Подобное разделение постменопаузы дает возможность более дифференцированно планировать вопросы заместительной гормональной терапии, целенаправленно и обоснованно пролонгировать или отменять гормональное лечение. Наряду с этим, возникает достаточно реальная перспектива по профилактике и ранней диагностике гормонозависимых опухолей женской репродуктивной системы.
2. Проблемы индуцированной менопаузы у онкологических больных (при раке шейки матки)
Одним из значительных событий современной онкологии явилось успешное лечение рака шейки матки, позволившее достигнуть стабильно высоких (до 80%) отдаленных результатов лечения [Бохман Я.В., 1989; Hoskins W. J, Perez C. A., et al 2005; Eifel P.J., Gershenson D.M. et al, 2006]. Эти пациентки нуждаются в сохранении высокого качества жизни и по возможности наиболее полной реабилитации.
На момент обследования у подавляющего числа больных имелись нейро-вегетативные, психоэмоциональные и обменно-эндокринные нарушения в различных сочетаниях. (таблицы 1,2,3)
Таблица 1.
Распределение больных по степени выраженности психоэмоционального синдрома после радикального лечения РШМ.
| Степень выраженности ПЭС | Периоды жизни | |||||
| Репродуктивный N=60 | Перименопаузальный N=96 | Постменопаузальный N=47 | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Легкая | 25 | 41,6+6 | 29 | 30,2+5 | 21 | 44,7+7 |
| Средняя | 19 | 31,7+6 | 24 | 25,0+4* | 20 | 42,5+7 |
| Тяжелая | 16 | 26,6+6* | 43 | 44,8+5** | 6 | 12,8+5 |
*P<0,05 **P<0,01
Значение ММИ для психоэмоционального синдрома не имеет существенных различий в зависимости от возраста. Тяжелая степень выраженности ПЭС значительно ниже в постменопаузе (12,8%).
Таблица 2.
Распределение больных по степени выраженности нейровегетативного синдрома после радикального лечения РШМ.
| Степень выраженности НВС | Периоды жизни | |||||
| Репродуктивный N=60 | Перименопаузальный N=96 | Постменопаузальный N=47 | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Легкая | 25 | 41,6+6** | 12 | 12,5+4** | 26 | 55,3+7 |
| Средняя | 22 | 36,7+6 | 46 | 47,9+5 | 16 | 34,1+7 |
| Тяжелая | 13 | 21,7+6* | 38 | 39,6+5 | 5 | 10,6+4 |
*P<0,05 **P<0,01
ММИ средней степени выраженности не имеет статистичеcких различий во всех возрастных группах. С учетом тяжелых проявлений НВС следует констатировать, что симптоматика наиболее выражена в перименопаузальном периоде.
Таблица 3.
Распределение больных по степени выраженности обменно-эндокринного синдрома после радикального лечения РШМ.
| Степень выраженности ОЭС | Периоды жизни | |||||
| Репродуктивный N=60 | Перименопаузальный N=96 | Постменопаузальный N=47 | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Легкая | 10 | 16,7+5 | 25 | 26,0+4 | 8 | 17,0+6 |
| Средняя | 15 | 25,0+6 | 32 | 33,3+5 | 14 | 29,8+7 |
| Тяжелая | 35 | 58,3+6* | 39 | 40,7+5 | 25 | 53,2+7 |
*P<0,05
В отличие от нейровегетативного синдрома, проявления которого могут претерпевать обратное развитие, обменно-эндокринные нарушения усугубляются с течением времени в прямо пропорциональной зависимости от продолжительности выключения функции яичников.
Таблица 4.
Состояние костной ткани по данным периферической двухфотонной абсорбциометрии у пациенток после радикального лечения РШМ.
| Состояние костной ткани | Периоды жизни | |||||
| Репродуктивный N=60 | Перименопаузальный N=96 | Постменопаузальный N=47 | ||||
| Абс. | % | Абс. | % | Абс. | % | |
| Норма | 35 | 58,3+6 | 41 | 42,7+5 | 18 | 38,3+7* |
| Остеопения | 18 | 30,0+6 | 41 | 42,7+5 | 19 | 40,4+7 |
| Остеопороз | 7 | 11,7+5 | 14 | 14,6+4 | 10 | 21,3+6 |
*P<0,05
Закономерно наиболее низкие показатели минеральной плотности костной ткани (МПКТ) регистрируются у пациенток в пери- и постменопаузальном возрасте. Увеличение числа выраженного снижения МПКТ регистрируется в первые 3 года после наступления ИМ.
Мы проводили заместительную гормонотерапию для коррекции выявленных нарушений. С учетом различных противопоказаний лечение было возможно только у 40% больных. В наших исследованиях таких больных было 121: в репродуктивном периоде – 43, в перименопаузальном периоде – 34, в постменопаузе – 44.
За 6 месяцев практически полностью удалось ликвидировать проявления нейровегетативных расстройств. Легкие проявления сохранились у 8,3% больных. Через 12 месяцев этот показатель снизился до 5%. Что касается психоэмоционального симптомокомплекса, то через 6 месяцев проведения ЗГТ удалось купировать все случаи тяжелых проявлений, снизить до 8,3% частоту средней степени выраженности. Наряду с этим увеличилась группа пациенток с легкой степенью психоэмоционального симптомокомплекса – 68,6%. Лишь спустя год после непрерывного лечения удалось снизить частоту этих расстройств до 40,0%. Однако, эти последние данные должны рассматриваться с учетом возможности спонтанного восстановления психического статуса.
Данные о состоянии МПКТ (норма, остеопения, остеопороз), в различных возрастных группах представлены на рисунках 2, 3, 4.
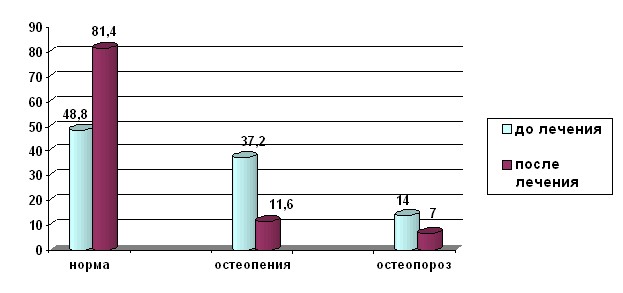 Рис. 2. Состояние костной ткани у пациенток репродуктивного периода после радикального лечения РШМ через 1 год использования ЗГT
Рис. 2. Состояние костной ткани у пациенток репродуктивного периода после радикального лечения РШМ через 1 год использования ЗГT
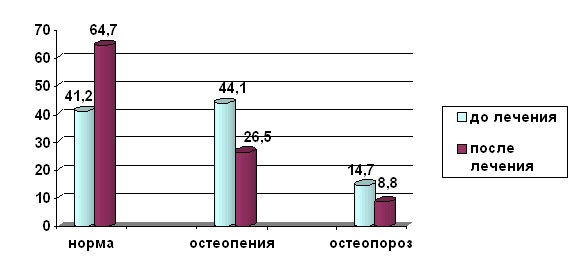
Рис. 3. Состояние костной ткани у пациенток перименопаузального периода после радикального лечения РШМ через 1 год использования ЗГТ.
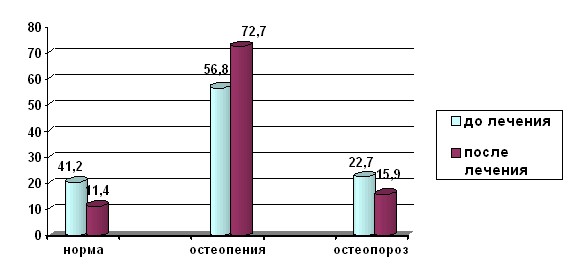
Рис. 4. Состояние костной ткани у пациенток постменопаузального периода после радикального лечения РШМ через 1 год использования ЗГТ.
Наиболее эффективно гормональное лечение в группе пациенток репродуктивного возраста: более чем в 3 раза снизилась частота остеопении и в 2 раза число наблюдений с остеопорозом. Подобная тенденция сохраняется и в группе пациенток перименопаузального возраста. В постменопаузе ситуация не столь однозначна. Через год после начала ЗГТ отмечено достоверное увеличение числа больных с остеопенией – 72,7%. Увеличение количества пациенток этой группы происходит как за счет больных с остеопорозом, так и за счет тех, кто имел нормальные показатели МПКТ.
Изучение клинических симптомов индуцированной менопаузы помогло нам сформулировать особенности гормональной коррекции при данном заболевании. Важнейшими условиями являются совместные действия гинеколога и онколога, информированное согласие и предпочтения пациентки (использовать ЗГТ - избежать ЗГТ). Учитываются общие показания и противопоказания. К дополнительным факторам, неблагоприятным для назначения ЗГТ мы относим:
- Гистологический тип опухоли (снижение дифференцировки опухоли, железистый рак) и/или наличие раковых эмболов в кровеносных и лимфатических сосудах.
- Сочетание с беременностью.
- Резистентность опухоли к химиотерапии и лучевой терапии.
- При хирургическом лечении – обнаружение комплексов опухолевых клеток по границе или в непосредственной близости (до 1см) от края резекции влагалища.
- Метастатическое поражение лимфатических узлов.
- Воспалительные процессы органов малого таза.
- Такие сопутствующие поражения молочной железы, как мастопатия (дисгормональная гиперплазия), узловая и диффузная, в особенности с атипической пролиферацией эпителия, которые могут в определенном проценте случаев являться предшественниками рака молочной железы.
- Мутация генов BRCA1, BRCA2, которая приводит к заболеванию РМЖ у 80% женщин.
Для лечения мы использовали монофазную комбинированную терапию (эстрогены с гестагенами в непрерывном режиме). При метаболическом синдроме и изменениях со стороны сердечно-сосудистой системы отдавали предпочтение низкодозированным препаратам (фемостон 1/5, анжелик), с гестагенами-производными прогестерона. У пациенток с благоприятным прогнозом после лечения РШМ и смещением соотношения метаболитов эстрогенов в сторону более активных и «агрессивных компонентов» (16-ОН), считаем целесообразным парентеральный путь введения. Мы использовали пластыри с эстрогенами (климара), с добавлением гестагена (утрожестан).
3. Онкологические аспекты у женщин постменопаузального возраста
Рассматривая постменопаузальный возрастной период с позиций онколога, мы определили несколько значимых для создания в последующем комплекса профилактических и диагностических мероприятий, проблем, а именно – определение роли инфекционных и метаболических составляющих в развитии онкогинекологических заболеваний. Интеграция вирусной ДНК в клеточной геном хозяина ведет к суперэкспрессии гена Е6 ВПЧ высокого онкологического риска, продукт которого – онкобелок Е6, взаимодействуя с супрессорным белком р53 приводит к ингибированию последнего, онкобелок Е7 так же играет ключевую роль в репликации ВПЧ, подавляет индукцию генов, отвечающих активацией экспрессии под влиянием эндогенного интерферона. Метаболиты эстрогенов стимулируют экспрессию двух вирусных генов Е6 и Е7, вызывающих онкогенную активность.
Папилломавирусная инфекция и онкобелок Е7 у пациенток с онкогинекологическими заболеваниями.
Рак шейки матки. Инфицированность ВПЧ при микроинвазивном раке шейки матки превышает 90%., при cr in situ достигает 70%.
Таблица 5.
Частота определения ВПЧ (абс. Число/%) в образцах опухолевой и нормальной ткани шейки матки с использованием метода ПЦР
| Группа исследования | Число больных | ВПЧ-позитивные образцы | ВПЧ-негативные образцы |
| Рак шейки матки в том числе: Cr in situ Микроивазивный рак шейки матки Инвазивный рак шейки матки | 128 100% | 100 78,1% | 28 21,9% |
| 66 100% | 46 69,7% | 20 30,3% | |
| 25 100% | 23 92% | 2 8% | |
| 37 100% | 31 83,8% | 9 6 6,2% | |
| Контрольная группа | 49 100% | 24 49% | 25 51% |
Р>0,05
Мы определяли ВПЧ высокого и низкого риска. Этим объясняется факт достаточно широкого носительства этой инфекции в контрольной группе. Случаи выявления ВПЧ среднего и низкого риска отмечались только в группе CIS – 3 случая (выявили 33 серотип) и в контрольной группе, где с наибольшей частотой обнаруживались вирусы 6 и 11 серотипов (6 наблюдений), а также по 1 случаю 33, 52, 83 серотипы. Что касается микроивазивного и инвазивного рака шейки матки, то в 100% вируспозитивных наблюдений мы зарегистрировали наличие ВПЧ высокого риска (16 и 18 серотипы).
Экспрессия онкобелка Е7 при cr in situ составляет 58%, а при микроивазивном раке 92%, что свидетельствует о полностью реализовавшемся канцерогенном эффекте ВПЧ в последнем случае.
В группе больных инвазивным раком шейки матки отмечено уменьшение числа наблюдений с позитивными анализами на ВПЧ и одновременным обнаружением онкобелка Е7 (64,7%), свидетельствует о присоединении других механизмов злокачественной трансформации в ситуации обширного, прогрессирующего опухолевого процесса.
Полученные результаты позволяют сделать вывод о значительной роли онкобелка Е7, как маркера начальных этапов злокачественной неоплазии шейки матки. Несомненно, наибольший клинический интерес представляет выявление Е7 при Cr in situ (CIN 3), а также CIN 1-2.
Рак яичников. Предметом изучения явились образцы ткани яичников 67 больных эпителиальным РЯ и 25 пациентов контрольной группы без признаков патологии яичников (таблица 6). Определение ВПЧ-инфекции в ткани яичников выполнено методом ПЦР с использованием типоспецифических праймеров.
Таблица 6.
Частота определения ВПЧ (абс. число/%) в образцах опухолевой и нормальной тканях яичников с использованием метода ПЦР
| Группа исследования | Число больных | ВПЧ-позитивные образцы | ВПЧ-негативные образцы |
| Эпителиальный рак яичников в том числе: Серозный рак яичников Муцинозный рак яичников | 67 100% | 51* 76,1% | 16 23,9% |
| 52 100% | 39** 75,0% | 13 25,0% | |
| 15 100% | 12** 80,0% | 3 20,0% | |
| Контрольная группа | 25 100% | 2* 8,0% | 23 92,0% |
*p<0,001; **p>0,05
При ДНК-диагностике ПВИ в 51 (76,1%) из 67 случаев ЗЭОЯ ВПЧ был положительным (p<0,001). И только в 2 из 25 случаев (8,0%) нормальных тканей яичников зарегистрированы позитивные результаты (p<0,001). Причем, частота определения ВПЧ в образцах серозного (n=52) и муцинозного (n=15) РЯ имела практически одинаковые значения – 75,0% и 80,0% соответственно (p>0,05). Эти данные позволяют сделать предположение о значимости инфекционного фактора в возникновении и развитии ЗЭОЯ.
Установлено, что с наибольшей частотой эпителиальный РЯ ассоциируется с ВПЧ-18 (29,9%), ВПЧ-52 (29,9%), ВПЧ-55 (26,9%), ВПЧ-83 (17,9%), ВПЧ-39 (16,4%). Муцинозный РЯ с наибольшей частотой сочетается с ВПЧ 18 (80,0%) серотипа, а при серозном РЯ в большинстве овариальных проб выявлено присутствие ВПЧ 52 (36,5%) и 55 (32,7%) типов.
Онкобелок Е7 определялся в подавляющем (76%) большинстве ВПЧ позитивных проб рака яичников.
Рак вульвы. Был изучен спектр ВПЧ в образцах опухоли у 80 больных раком вульвы. Данные о наличии ВПЧ представлены в таблице 7.
С наибольшей частотой при раке вульвы установлено наличие 6 и 11 серотипов ВПЧ. Причем, как правило, эти два серотипа выявлялись одновременно. Доля пациенток, у которых выявлены серотипы 16 и 18 на нашем материале установлены в 43,8% наблюдений.
Таблица 7.
Частота (абс.число/ %) ДНК вируса папилломы человека при инвазивном раке вульвы.
| Метод исслед. | Число больных | Не обнаружено | Серотипы | ||||||
| 6 | 11 | 16 | 18 | 55 | 59 | 83 | |||
| ПЦР-Диагностика | 80 100% | 19 23,8% | 24** 30,0% | 24** 30,0% | 21 26,3% | 14(3**) 17,5% | 2** 2,5% | 3** 3,8% | 4(2**) 5,0% |
Р<0,05
** число серотипов, сочетающихся с другими серотипами.
При I стадии заболевания в большинстве наблюдений (58,8%) характерно наличие 6/11 серотипов (при p<0,05). С равной частотой (11,8%) отмечено присутствие 16, 18 и 83 серотипов, причем в одном наблюдении 18 серотип сочетался с 83. В группе больных с I стадией выявлено еще одно сочетание серотипов – 59 с 83. В группе пациенток со II стадией рака вульвы частота 6/11 серотипов несколько меньше – 47,4%, но уже значительно с большей частотой диагностируется 16 и 18 серотипы – 21,1% наблюдений. При III и IV стадии заболевания в основном доминируют 16 и 18 серотипы. В группах пациенток с III и IV стадиями рака вульвы отмечено отсутствие вирусной инфекции (26,3% и 48,0% соответственно), при невысоких показателях 6/11 серотипов (5,3% и 8,0% соответственно). В целом при выраженных формах рака вульвы (III и IV стадии вместе) частота отсутствия ВПЧ составляет 38,6%, в то время, как при I-II стадиях этот показатель всего 5,6% (при р<0,01). Сочетание серотипов чаще всего имеет место при I-II стадиях заболевания. При распространенных вариантах рака вульвы этот показатель резко падает.
В нашей работе иммуноферментный анализ на наличие онкобелка Е7 выполнен у 27 больных вирусассоциированным раком вульвы, у 20 из которых присутствовали ВПЧ 16 и 18. В 7 наблюдениях установлены ВПЧ 6 и 11 серотипа, в 1 наблюдении 83 серотип. Во всех наблюдениях вирусассоциированного рака определялся онкобелок Е7.
Рак эндометрия. В подавляющем большинстве проб РЭ (53 из 60) ВПЧ не был обнаружен. Из оставшихся 7 образцов распределение по серотипам было таковым: в 4(6,7%) образцах был обнаружен 16 серотип ВПЧ, в 1 образце(1,7%) 18 серотип, и по одному образцу (1,7% соответственно) 54 и 51 серотипы. Другие же серотипы вируса папилломы человека выявлены не были. В контрольной группе из 40 образцов только 4 образцах (10%) был обнаружен вирус папилломы человека 16 серотипа. Полученные данные свидетельствуют об отсутствии значимого участия ВПЧ в патогенезе этого вида опухолей.
Роль эндокринно-метаболических нарушений в этиопатогенезе гинекологического рака у больных постменопаузального возраста.
Вовлечение эндогенных и экзогенных гормонов в механизм этиопатогенеза давно не подлежит сомнению. С точки зрения женского здоровья, в том числе в период постменопаузы, наибольшее значение имеют эстрогены, проходящие путь конверсии из андростендион в метаболиты под влиянием ароматазы и ферментов печени. 16-ОНЕ1 является мощным агонистом эстрадиола. Активность этого метаболита в 8 раз превышает активность эстрадиола. Он способен образовывать стойкие связи со специфическими рецепторами. Представление об общем пуле эстрогенов в постменопаузе и интенсивности их периферического воздействия можно получить при измерении индекса массы тела и минеральной плотности костной ткани. В группах пациенток с гинекологическим раком в постменопаузальном возрасте мы измерили индекс массы тела и минеральную плотность костной ткани
ИМТ в группе больных раком эндометрия превышал 30 мг/м2 в 41,7%, 25,00-29,99кг/м2 – в 20% и соответствовал норме – в 38,3%. ИМТ в группе больных раком яичников был более чем 30 кг/м2 в 31,3%, 25,00-29,99 кг/м2 – 50,7% и в норме – 18,0%. ИМТ в группе женщин со злокачественными заболеваниями вульвы был более чем 30 кг/м2 в 43,7%, 25,00-29,99 кг/м2 – 35,5% и нормальный в 21,3%. ИМТ при раке шейки матки выше чем 30 кг/м2 был констатирован в 28,7%, 25,00-29,99 кг/м2 – 39,0% и в норме в 32,3%. ИМТ в контрольной группе превышал 30мг/м2 в 13,5%, 25,00-29,99кг/м2 – 19,8% и соответствовал норме в 66,7% (р<0,05).
Высокий уровень МПКТ чаще всего регистрировался у больных раком эндометрия (в 25,1% наблюдений) и у больных раком вульвы (18,7%). В контрольной группе пациенток постменопаузального периода в 73% наблюдений характерно снижение минеральной плотности костной ткани. Остеопения выявлена в 37,8% наблюдений, а остеопороз - в 35,2%. Более чем у четверти пациенток (27,0%) имело место нормальное (13,5%) или высокое (13,5%) состояние уровня минеральной плотности костной ткани.
Наибольшее количество пациенток с высокой МПКТ (25,1%) наблюдается в группе больных раком эндометрия. Несколько меньшее количество (18,7%), но, тем не менее, превышающее показатели контрольной группы (13,5%), регистрируется в группе больных раком вульвы.
При раке яичников велико количество случаев остеопороза (37,3%), превышающее показатели контрольной группы (35,2%).
Если оценивать МПКТ как маркера совокупного воздействия эстрогенов, то наибольшую значимость она имеет при раке эндометрия и раке вульвы.
Более углубленное изучение эстрогенного статуса, а именно определение метаболитов эстрогенов, мы провели в группах больных раком эндометрия и раком яичников. При этом выяснилось, что низкий коэффициент соотношения метаболитов с преобладанием «агрессивного» 16-ОНЕ1 был зафиксирован в обеих группах 1,16 и 1,04 соответственно, в контрольной группе 2,32. Таблица 8.
Средний уровень и соотношение метаболитов эстрогенов 2-ОН/16-ОН при раке эндометрия и раке яичников
| Группы пациенток | Средний уровень метаболитов (нг/мл) | Соотношение метаболитов 2-ОН/16-ОН | |
| 2-ОН | 16-ОН | ||
| Рак эндометрия N=60 | 6,82 | 6,66 | 1,16 |
| Рак яичников N=67 | 8,25 | 8,69 | 1,04 |
| Контр. группа N=30 | 9,31 | 4,43 | 2,32 |
Р<0,001
При этом, наиболее неблагоприятное (низкое) соотношение метаболитов мы констатировали при повышенном ИМТ (РЭ – 1,08; РЯ - 0,88) и ожирении (РЭ – 1,36; РЯ - 1,11).
Для определения рецепторного статуса при раке эндометрия мы провели иммуногистохимические исследования, свидетельствующие о том, уровень эстроген-рецепторов 50-100%, т.е. более чем в 2/3 клеток присутствует в 42% наблюдений, в контрольной группе лишь 22%.
Параллельно эти же фрагменты эндометрия были исследованы методом полимеразной цепной реакции в «режиме реального времени» с предварительной реакцией обратной транскрипции (ОТ-ПЦР). Во всех образцах опухоли отмечена экспрессия эстроген-рецепторов
При любом варианте рака эндометрия и, при эпителиальном раке яичников присутствует гормональная составляющая. Причем, эстроген-рецептор способен взаимодействовать с любым лигандом, у которого «молекулярный диапазон» близок к эстрогенам. Очевидно, что молекулярная формула 16а-гидроксистерона, в этом смысле, наиболее близка. Комплекс рецептор+16а-ОН является весьма прочным и формирует весьма длительный пролиферативный импульс.
В целом, следует отметить, что мы исследовали и определили те значимые компоненты в этиопатогенезе рака женских половых органов, возможно с достаточной эффективностью выявлять на этапе первичного медицинского звена.
Таким образом, следует четко обозначить ряд процессов и состояний, формирующих особенности гомеостаза в постменопаузе, которые могут быть ключевыми кофакторами онкологического процесса. Мы, в первую очередь, относим метаболический синдром с выраженной продукцией агрессивных эстрогенных метаболитов, нарушенный микробиоценоз генитального тракта, доминирование атрофических процессов. Весь спектр этих изменений формирует высокий риск патологической пролиферации – в основе которой и реализуется канцерогенез. С учетом этих позиций следует на сегодняшний день рассматривать профилактику и раннюю диагностику гинекологического рака в постменопаузальном возрасте. Не будет преувеличением сказать, что постменопауза – этап жизни женщины, на котором уже сегодня можно дифференцировать ряд состояний, предшествующих тем или иным патологическим процессам. Понимание этого тезиса формирует совершенно новую идеологию подходов к профилактике и ранней диагностике многих заболеваний, в том числе и онкологических. Однако для полноценной реализации всех этих достижений необходимо в корне пересмотреть существующие принципы оказания помощи этой категории женщин на уровне первичной медико-санитарной помощи. Мы, в первую очередь, имеем в виду работу женской консультации. Необходимо обозначить наиболее важные направления её деятельности:
-акушерство; -маммология;
-детская и подростковая гинекология -скрининг и профилактика;
-репродуктивная гинекология; -диагностическое отделение.
-гинекология постменопаузального
возраста ;
Структура гинекологического диагностического центра представлена на рисунке 5.
Рис. 5. Структура гинекологического диагностического центра
В план обследования пациенток постменопаузального возраста кроме общепринятых методов исследования целесообразно включать такие простые и доступные исследования как остеоденситометрия и определение соотношения метаболитов в моче. Результаты этих обследований позволят выделить группы, подлежащие более углубленной диагностике. Кроме того, учет комплекса факторов риска (или этиопатогенетических компонентов гинекологического рака) на этапе первичного звена позволит более адекватно формировать показания для лечения пациенток постменопаузального возраста (с преобладанием активной, радикальной тактики).
Тесная интеграция задач по ранней диагностике рака репродуктивных органов в сферу гинекологической службы позволить динамично и в короткие сроки (с учетом существующих административных рычагов) изменить отрицательные тенденции в сфере заболеваемости и смертности, сформированные за последние годы, и целенаправленно внедрять новые технологии в рамках профилактики и ранней диагностики. В рамках женской консультации необходимо расширение структуры с выделением отдельной группы по реализации программ профилактики и скрининга и отделения проблем постменопаузального возраста с соответствующим диагностическим оборудованием.
ВЫВОДЫ
- Высокий уровень эстроген-рецепторов в органах-мишенях (молочная железа, эндометрий, вульва) сочетается с повышенным индексом массы тела в 72,8% наблюдений для молочной железы, 78,6%-для эндометрия и 52,4% - для вульвы. Минерализация костной ткани в постменопаузе соответствует высокому уровню в 13%. Выделены варианты постменопаузы с гипоэстрогенией и высоким или низким уровнем рецепторов эстрогенов в тканях-мишенях и с гиперэстрогенией и, соответственно, высоким или низким уровнем рецепторов.
- При индуцированной менопаузе после радикального лечения рака шейки матки у больных формируется комплекс посткастрационных изменений различной степени тяжести. У пациенток постменопаузального возраста частота обменно-эндокринных нарушений в сроки до 1 года достигает 72,3%. В перименопаузальном возрасте нейроэндокринные нарушения выявлены у 39,6% и психоэмоциональные у - 44,8% больных. Во всех возрастных группах отмечено значительное снижение минеральной плотности костной ткани. Заместительная гормональная терапия после радикального лечения рака шейки матки может быть проведена при условии тщательного мониторинга и отсутствия общих противопоказаний и при наличии – благоприятного прогноза заболевания.
- Инфицированность ВПЧ при микроинвазивном раке шейки матки превышает 90%., при cr in situ достигает 70%. Экспрессия онкобелка Е7 при cr in situ составляет 58%, а при микроивазивном раке 92%. Злокачественные эпителиальные опухоли яичников в 76,1% наблюдений сочетаются с ВПЧ. Наличие онкобелка Е 7 в ВПЧ-18 позитивных образцах опухолевой ткани яичников зарегистрировано в 70,0% случаев. Плоскоклеточный рак вульвы в 76,2% наблюдений сочетается с ВПЧ. При раке эндометрия не выявлено значимого присутствия ВПЧ в пробах опухоли (11,6% при РЭ, 13,3%-в контрольной группе).
- У больных раком эндометрия и раком вульвы имеются проявления метаболического синдрома с высоким индексом массы тела (42%) и (44%) и высоким уровнем минеральной плотности костной ткани (25%) и (21%) соответственно. При раке яичников и раке шейки матки – практически идентичные показатели ожирения – около 30%, в 2 раза превышающие показатели контрольной группы.
- При раке эндометрия и раке яичников имеется неблагоприятное соотношение метаболитов эстрогенов по сравнению с контрольной группой (1,16, 1,04 и 2,10 соответственно), с преобладанием «агрессивного» метаболита 16-ОНЕ1, что расширяет представление о гормональной составляющей в этиопатогенезе этих заболеваний.
- Во всех образцах рака эндометрия исследованных методом полимеразной цепной реакции в «режиме реального времени» с предварительной реакцией обратной транскрипции имеется экспрессия эстроген-рецепторов, что свидетельствует о возможности дифференцированного подхода к гормональному лечению этой категории больных.
- Необходим комплексный подход к профилактике и ранней диагностике рака репродуктивных органов. При диспансерном наблюдении и обследовании женщин постменопаузального возраста наряду с общепринятыми мероприятиями (осмотр, цитологическое исследование, УЗИ, маммография, остеоденситометрия) необходимо тестирование на ВПЧ высокого онкологического риска и определение соотношения метаболитов эстрогенов 2-ОНЕ1/16-ОНЕ1 в моче. При реформировании работы женской консультации целесообразно выделение отдельного направления «гинекология постменопаузального возраста».
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Формирование групп онкологического риска у женщин постменопаузального возраста должно проходить с учетом инфицированности ВПЧ и соотношением уровня метаболитов эстрогенов 2-ОН/16-ОН.
- При обследовании женщин постменопаузального возраста необходимо использование комплекса мероприятий, включающих, кроме общепринятых, проведение остеоденситометрии, определение уровня и соотношения метаболитов эстрогенов и наличия вируса папилломы человека,
- При неблагопрятном соотношении уровня метаболитов эстрогенов 2-ОН/16-ОН с преобладанием «агрессивного» компонента, высокой или нормальной минеральной плотности костной ткани, что косвенно свидетельствует о значительной эстрогенной составляющей в рецепторном статусе организма. Этим пациенткам следует проводить более углубленное изучение органов-мишеней половых гормонов с использованием эндоскопических методик, дополнительных УЗ исследований с изучением кровотока в тканях, определение онкомаркеров. Желательно проведение динамического наблюдения 1 раз в 6 месяцев.
- При неблагоприятном 2-ОН/16-ОН статусе пациенток и инфицированности ВПЧ следует сузить показания к органосохраняющему лечению в постменопаузальном возрасте, даже при наличии доброкачественных процессов в матке и яичниках, отдавая предпочтение радикальному хирургическому лечению.
- Индуцированная менопауза после радикального лечения рака шейки матки нередко проявляется тяжелым симптомокомплексом, значительно снижающего качество жизни больных. Показаниями для проведения системной заместительной гормональной терапии является полное отсутсвие факторов неблагоприятного прогноза рака шейки матки. В этой ситуации лечение может начинаться сразу же после завершения специальной терапии. В других случаях отсутствие рецидива основного заболевания (РШМ) более 3 лет при наличии у пациентки постовариоэктомического синдрома, является основанием для принятия решения о проведении ЗГТ. Местное лечение (маза, кремы, содержащие эстрогены, не оказывающие системного воздействия, может проводиться в любое, необходимое для этого время.
- Рекомендуется сформировать диагностические группы (гинекологи, маммологии) по наблюдению и обследованию женщин постменопаузального возраста на базе женских консультаций с оснащением, необходимым для определения групп повышенного онкологического риска.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Ашрафян Л.А., Харченко Н.В., Огрызкова В.Л., Антонова И.Б., Крейнина Ю.М., Постникова Н.А. Современные возможности сонографии в первичной и уточняющей диагностике рака эндометрия. // Вопросы онкологии. -1999.-Т.45.-№1.- С. 87-91.
- Ашрафян Л.А, Харченко Н.В., Огрызкова В.Л., Антонова И.Б. Принципы лечения пре- и микроивазивного рака шейки матки. // Практическая онкология. – 2002-Т.3.-№3.- С. 173-177.
- Ашрафян Л.А., Харченко Н.В., Антонова И.Б., Карсанашвили Х.Н., Те С.А., Бударина С.О., Лифенко Р.А.Современные возможности скрининга рака женских половых органов. // Сборник научных трудов конференции «Ранняя диагностика и лечение предраковых и злокачественных заболеваний органов репродуктивной системы».- М.- 2003.- С. 5-6.
- Ашрафян Л.А., Те С.А., Крейнина Ю.М., Ивашина С.В., Антонова И.Б. Ультразвуковой мониторинг противоопухолевой терапии рака шейки матки.//Сборник научных трудов конференции «Ранняя диагностика и лечение предраковых и злокачественных заболеваний органов репродуктивной системы».- М.- 2003.-С. 124-127.
- Ашрафян Л.А., Карсанашвили Х.Н., Те С.А., Антонова И.Б., Мухтарулина С.В., Лифенко Р.А. Комплексное использование допплерографических методик в оценке внутриопухолевого кровотока при раке яичников. // Сборник научных трудов конференции «Ранняя диагностика и лечение предраковых и злокачественных заболеваний органов репродуктивной системы».- М.- 2003.-С. 128-131.
- Антонова И.Б., Ашрафян Л.А., Моцкобили Т.А., Чазова Н.Л. Состояние эндометрия и диагностическая тактика у больных раком молочной железы на фоне длительной антиэстрогенной тарапии. // Материалы II Всероссийской научно-практической конференции с международным участием «Научно-организационные аспекты и современные лечебно-диагностические технологии в маммологии».- М.- 2003.- С. 252-253.
- Бабаева Н.А., Антонова И.Б., Ашрафян Л.А. Результаты периферической остеоденситометрии при дистрофии вульвы у пациенток в постменопаузе.// Материалы Невского радиологического форума «Из будущего в настоящее». -СПб.-2003.- С. 80.
- Ашрафян Л.А., Те С.А., Крейнина Ю.М., Ивашина С.В., Антонова И.Б., Алешикова О.И. Ультразвуковой мониторинг противоопухолевой терапии рака шейки матки. // Материалы 4-го Российского форума «Радиология 2003».- М.- 2003.- С. 23.
- Ашрафян Л.А., Карсанашвили Х.Н., Те С.А., Антонова И.Б., Мухтарулина С.В., Лифенко Р.А. Комплексное использование допплерографических методик в оценке внутриопухолевого кровотока при раке яичников. // Материалы 4-го Российского научного форума «Радиология 2003».- М.- 2003. – С. 24.
- Ашрафян Л.А., Антонова И.Б., Ивашина С.В., Акопова Н.Б., Алешикова О.И. Результаты профилактики и лечения посткастрационного остеопороза (после радикального лечения рака шейки матки миакальциком и эстрогенами). // Остеопороз и остеопатии. -М.-2003.-№3.- С.14-16.
- Ашрафян Л.А., Антонова И.Б., Харченко Н.В., Бабаева Н.А., Моцкобили Т.А., Мухтарулина С.В. Возможности заместительной гормональной терапии (ЗГТ) в онкологии после хирургической и лучевой кастрации. // Журнал Российского общества акушеров-гинекологов. -2004.-№1.-С. 35-37.
- Ашрафян Л.А., Бабаева Н.А., Антонова И.Б., Харченко В.П., Акопова Н.Б., Ивашина С. В., Степанова Е.В.// Оценка минеральной плотности кости и индекса массы тела при дистрофии вульвы. // Журнал Российского общества акушеров-гинекологов. -2004.-№1.- С. 31-32.
- Ашрафян Л.А., Антонова И.Б.Ивашина С.В. Акопова Н.Б., Саратян А.А., Алешикова О.И. Оптимальная терапия и профилактика остеопороза у больных после радикального лечения рака шейки матки.//Материалы конференции, посвященной 80-летию российского научного центра рентгенорадиологии МЗ РФ (1924-2004) « Научно-технический прогресс отечественной лучевой диагностики и лучевой терапии».- М.- 2004.- С. 13-15.
- Ашрафян Л.А., Антонова И.Б., Моцкобили Т.А., Чазова Н.Л., Альбицкий И.А. Гистероскопия в определении гиперпластических процессов у пациенток в постменопаузе на фоне приема тамоксифена.//Материалы конференции, посвященной 80-летию российского научного центра рентгенорадиологии МЗ РФ (1924-2004) « Научно-технический прогресс отечественной лучевой диагностики и лучевой терапии».- М.- 2004.- С. 15-16.
- Ашрафян Л.А., Харченко Н.В., Огрызкова В.Л., Антонова И.Б. Принципы лечения пре- и микроивазивного рака шейки матки.// Глава 4. В книге «Практическая онкология. Избранные лекции» под редакцией С.А. Тюляндина и В.М. Моисеенко».- СПб.- 2004.- С. 644-649.
- Ашрафян Л.А., ХарченкоН.В., Бабаева Н.А., Степанова Е.В., Антонова И.Б., Ивашина С.В. Крауроз (склеротический лишай) как предрак вульвы. // Вопросы онкологии. - 2004.-№3.- Т.50.- С. 320-326.
- Ашрафян Л.А., Алешикова О.И., Огрызкова В.Л., Ивашина С.В., Крейнина Ю.М., Антонова И.Б., Сергеева Н.С., Дубовецкая О.Б. Предварительные результаты комплексного лечения рака шейки матки с использованием неоадъювантной полихимиотерапии.// Материалы научно-практической конференции «Современные подходы к диагностике и лечению гинекологического рака».- Псков-2004.- С. 4-6.
- Antonova I., Ashrafian L. Tamoxifen in the early breast cancer treatment. Gynecological aspects. (Тамоксифен в лечении раннего рака молочной железы. Гинекологические аспекты). // J. The Breast.-2005.-Vol.14.-S.1.- P.s. 37.
- Ашрафян Л.А., Огрызкова В.Л., Ивашина С.В., Антонова И.Б., Алешикова О.И. Сонография в мониторинге неоадъювантной химиотерапии рака шейки матки. // Материалы международного конгресса: Невский радиологический форум 2005 «Наука-клинике». - СПб.- 2005.- С.12.
- Ашрафян Л.А., Антонова И.Б., Чазова Н.Л., Моцкобили Т.А., Бабаева Н.А., Альбицкий И.А. Некоторые особенности воздействия тамоксифена на эндометрий у женщин в постменопаузе. // Вопросы онкологии.- 2005-Т. 51.-№2.- С. 200-205.
- Ашрафян Л.А., Антонова И.Б., Алешикова О.И., Огрызкова В.Л., Ивашина С.В. Оценка эффективности неоадъювантной полихимиотерапии при местнораспространенном раке шейки матки с использованием ультразвуковой сонографии и магнитно-резонансной томографии. // Материалы VII российского научного форума «Радиология 2006».- М.- 2006.- С 8.
- Ашрафян Л.А., Ивашина С.В., Антонова И.Б., Бабаева Н.А., Монопьянц Г.А. Оценка минеральной плотности костной ткани у пациенток, получивших радикальное лечение по поводу лимфогранулематоза. // Материалы VII российского научного форума «Радиология 2006».- М.-2006.- С. 8.
- Ашрафян Л.А., Антонова И.Б., Ивашина С.В., Акопова Н.Б. Периферическая остеоденситометрия и индекс массы тела при гинекологическом раке в постменопаузе. // Материалы VII российского научного форума «Радиология 2006».- М.-2006.- С. 10.
- Ашрафян Л.А., Антонова И.Б., Алешикова О.И., Добровольская Н.Ю. //Неоадъювантная полихимиотерапия как этап комплексного лечения местнораспространенного рака шейки матки// материалы Всероссийской научно-практической конференции «Высокие медицинские технологии».- М.-2006.- С. 34-35.
- Ашрафян Л.А., Антонова И.Б., Снегирева Г.П., Боженко В.К., Басова И.О.// Вирусный фактор и особенности метаболизма эстрогенов при раке эндометрия в постменопаузе// Материалы 8-го Всероссийского научного форума «Мать и дитя». -М.- 2006.- С. 323.
- Ашрафян Л.А., Антонова И.Б., Бабаева Н.А., Бударина С.О., Басова И.О.// Онкобелок Е7 как диагностический маркер цервикальных интраэпителиальных неоплазий и рака шейки матки// Материалы 8-го Всероссийского научного форума «Мать и дитя».- М.-2006. – С. 323.
- Ashrafian L.A., Antonova I.B., Aleshikova O.I. Neoadjuvant chemotherapy and surgical treatment for patients with stage IIb-IIIb of thecervical cancer (Неоадъювантная химиотерапия и хирургическое лечение у больных раком шейки матки IIb-IIIb стадий). // Int. J. of Gynecological cancer. -2006.- V.16.-S.3.- P. 730.
- Antonova I., Ashrafian L., Basova I.//Urinary estrogen metabolites and risk of breast cancer and epitelian ovarian cancer.(Метаболиты эстрогенов в моче и риск рака молочной железы и эпителиального рака яичников). // J. The Breast.- 2007.-Vol.16.- S.1.- P.s. 17.
- Ашрафян Л.А., Антонова И.Б., Боженко В.К., Басова И.О. Особенности метаболизма эстрогенов при раке эндометрия в постменопаузе. // Сибирский онкологический журнал, приложение №1, материалы российской научно-практической конференции «Современные аспекты этиопатогенеза, диагностики и лечения рака эндометрия».-Томск.- 2007.- С. 121.
- Ашрафян Л.А., Антонова И.Б., Огрызкова В.Л., Бабаева Н.А., Басова И.О., Моцкобили Т.А., Мягкова А.А. Клинико-морфологическое обоснование микроинвазивного рака эндометрия.// Материалы российской научно-практической конференции «Современные аспекты этиопатогенеза, диагностики и лечения рака эндометрия». Сибирский онкологический журнал. Приложение №1. -Томск.- 2007.- С. 8-15.
- Ашрафян Л.А., Антонова И.Б., Алешикова О.И., Добровольская Н.Ю. Хирургический этап как один из основных компонентов в комплексном лечении рака шейки матки IIB-IIIB стадии. // Российский онкологический журнал. - 2007.-№3.- С. 21-25.
- Ашрафян Л.А., Антонова И.Б., Бударина С.О., Бабаева Н.А., Басова И.О., Хунова Л.З. Молекулярно-биологические аспекты злокачественной трансформации цервикальных интраэпителиальных неоплазий. //Материалы 10 конференции «Современные технологии в диагностике и лечении гинекологических заболеваний».- М.- 2007.- Гл.XII.- С. 440-441.
- Ашрафян Л.А., Антонова И.Б., Снегирева Г.П., Боженко В.К., Басова И.О. Рак эндометрия в постменопаузе – особенности канцерогенного эффекта метаболитов эстрогенов и вируса папилломы человека.//Материалы 10 конференции «Современные технологии в диагностике и лечении гинекологических заболеваний».- М.-2007.- Гл. XII. - С. 442-444.
- Ашрафян Л.А., Антонова И.Б., Басова И.О., Бабаева Н.А., Ивашина С.В. Рак вульвы, эндометрия, яичников в постменопаузе: роль инфекционного фактора. // Опухоли женской репродуктивной системы. Маммология/онкогинекология. - 2007. - №4. – С. 72-78.
- Ашрафян Л.А., Антонова И.Б., Алешикова О.И., Добровольская Н.Ю., Чазова Н.Л.. Диагностические критерии и факторы прогноза эффективности неоадъювантной химиотерапии местно-распространенного рака шейки матки (IIb-IIIb стадии). // Опухоли женской репродуктивной системы. Маммология/онкогинекология. - 2007. - №4. – С. 63-71.
- L.A.Ashrafyan, I.B.Antonova, N.A.Babayeva,, I.O.Basova. Е7 as a marker of malignant transformation cervical intraepitelial neoplasias. (Е7 как маркер злокачественной трансформации при цервикальных интраэпителиальных неоплазиях).// 15th International meeting of the European society of gynaecological oncology.- 2007.- Berlin.-. P.c566.
- Ashrafyan L.A., Antonova I.B., Basova I.O. Urinary estrogen metabolites to predict risk of endometrial cancer and epitelian ovarian cancer in postmenopause. (Уровень метаболитов эстрогенов в моче и прогнозирование рака эндометрия и эпителиального рака яичников в постменопаузе).// 15th International meeting of the European society of gynaecological oncology. -2007.- Berlin.-.P.d.568.
- Прокопьева Т.А., Антонова И.Б. Приоритет морфологических критериев при планировании заместительной гормональной терапии после радикального лечения рака шейки матки.// Международный морфологический журнал «Морфологические ведомости».- 2007.- Москва-Берлин.-№3-4.- С. 275-276.
- Прокопьева Т.А., Антонова И.Б., Горбунова Е.Е. Гормональная коррекция психоэмоциональных нарушений у больных с индуцированной менопаузой после радикального лечения рака шейки матки. // Проблемы репродукции. Спец. выпуск по материалам II международного конгресса по репродуктивной медицине «Репродуктивное здоровье семьи».- 2008.- Гл.10.- С. 387-388.
- Ашрафян Л.А., Антонова И.Б. Опухоли и опухолевидные образования женских половых органов. // В.Н. Серова, Е.Ф. Кира. Гинекология. Руководство для врачей. -М.: «Литтерра», 2008.- 840с.
- Ашрафян Л.А., Антонова И.Б., Басова И.О., Ивашина С.В., Люстик А.В., Антошечкина М.А. Возможные пути реорганизации первичной медико-санитарной помощи в гинекологии в аспекте эффективной ранней диагностики рака репродуктивных органов. // Опухоли женской репродуктивной системы. Маммология/Онкогинекология. - 2008.-№4.- С. 57-63.
- Ашрафян Л.А., Антонова И.Б., Алешикова О.И., Ивашина С.В. Люстик А.В., Алимардонов Д.Б. Современные лучевые методы диагностики (сонография и магнитно-резонансная томография) в оценке эффективности неоадъювантной химиотерапии местно-распространенного рака шейки матки (IIb-IIIb стадии). // Сибирский онкологический журнал.- 2008.-№5.- С 17-22.
- Antonova I.B, Ashrafian L.A, Basova I.O. Importance of estrogen metabolites in the pathogenesis of breast, ovarian and endometrial cancer.(Значение метаболитов эстрогенов в патогенезе рака молочной железы, рака яичников и эндометрия).// J. The Breast.-2009.- Vol.18.- S.1.- P.s.20.
- Ashrafyan L.A., Antonova I.B., Basova I.O. Estrogen metabolites (2-OH/16-OH) in the pathogenesis of ovarian and endometrial cancer in postmenopausal women. (Метаболиты эстрогенов (2-OH/16-OH) в патогенезе рака яичников и рака эндометрия у женщин постменопаузального возраста).//16th International meeting of the European society of gynaecological oncology.- Belgrade.-2009.- P.a 426.
- Ашрафян Л.А., Антонова И.Б., Ивашина С.В., Люстик А.В., Ульянова А.В., Вашакмадзе С.Л. Ранняя диагностика рака эндометрия и яичников.// Практическая онкология.- 2009.- Т.10.-№2.- С. 71-75.
- Ашрафян Л.А., Антонова И.Б., Алешикова О.И., Добровольская Н.Ю., Чазова Н.Л., Ивашина С.В., Алимардонов Д.Б. Комплексная оценка эффективности неоадъювантной химиотерапии местнораспространенного рака шейки матки (IIB-IIIB стадий).// Вопросы онкологии.-2009.-Т. 55.-№4.-С.463-470.

