Факторы прогноза в лечении местно-распространенного и метастатического рака предстательной железы
На правах рукописи
ЖЕРНОВ АЛЕКСЕЙ АЛЕКСАНДРОВИЧ
ФАКТОРЫ ПРОГНОЗА
В ЛЕЧЕНИИ МЕСТНО-РАСПРОСТРАНЕННОГО
И МЕТАСТАТИЧЕСКОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
14.00.14 – онкология
Автореферат
диссертации на соискание учёной степени
кандидата наук
Томск
2008
Работа выполнена в ГОУ ДПО “Иркутский государственный институт усовершенствования врачей Федерального агентства по здравоохранению и социальному развитию” и на базе ГУЗ Иркутский областной онкологический диспансер
Научный руководитель:
доктор медицинских наук Дворниченко Виктория Владимировна
Научный консультант:
доктор медицинских наук, профессор Русаков Игорь Георгиевич
Официальные оппоненты:
д.м.н., профессор Слонимская Е.М.
Д.м.н., профессор Гудков А.И.
Ведущая организация: ГУ РОНЦ им. Н.Н. Блохина РАМН
Защита диссертации состоится «____»_______________ 2008 г. в ____ часов, на заседании диссертационного совета Д 001.032.01 при ГУ Научно-исследовательский институт онкологии Томского научного центра СО РАМН по адресу 634009 г. Томск, пер. Кооперативный, 5
С диссертацией можно ознакомиться в библиотеке ГУ НИИ онкологии ТНЦ СО РАМН.
Автореферат разослан «____» _______________2008 г.
Ученый секретарь диссертационного совета
Д.м.н. Фролова Ирина Георгиевна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Проблема рака предстательной железы (РПЖ) приобрела на сегодняшний день особую актуальность вследствие неуклонного роста заболеваемости и смертности, а также в связи с трудностями своевременной диагностики.
За последние 10 лет в России произошло практически двукратное увеличение общего числа наблюдаемых больных с данной патологией, как в абсолютных, так и относительных показателях (Чиссов В.И., 2005).
В связи с особенностями клинического течения и несовершенством ранней диагностики от 60 до 80 % больных РПЖ при первичном обращении имеют запущенные формы заболевания, не позволяющие достичь излечения. При этих формах заболевания пациентам проводятся различные варианты медикаментозной гормональной терапии. (Коган М.Н. и др., 1999; Русаков И.Г., 2000; Сивков А.В. и др., 2001; Moul J.W., 2002; Павлов А.С., 2003; Шевченко А.Н., 2005). По данным разных авторов, радикальному оперативному лечению подлежат 10–15% обратившихся пациентов (Борщ В.Ю. и др., 1999; Гориловский Л.М., 1999; Лопаткин Н.А. и др., 1999; Аляев Ю.Г., 2000; Пушкарь Д.Ю., 2002; Биктимиров Р.Г., 2003; Петров С.Б., 2005).
В последние годы в лечении распространенного РПЖ достигнут серьезный прогресс, связанный с введением в лечебную практику новых препаратов (антиандрогенов и аналогов гонадотропин-релизинг-гормона) (Свиридова Т.В., 1991; Голубцов Ф.С., 2001; Алфимов А.Е., 2002; Лопаткин Н.А., 2003; Арзуманов А.А. и др., 2003). Тем не менее, в этой области остается ряд сложных нерешенных проблем:
- большое число осложнений гормонотерапии: до 30 % больных погибают от осложнений гормонального лечения (Козлов В.П., 1999; Велиев Е.И., 2001; Гурина Л.И., 2003);
- отсутствуют эффективные схемы лечения при развитии гормонорезистентности, которая по данным ряда авторов, развивается уже через 18–25 месяцев после начала антиандрогенной терапии (Каприн А.Д., 2001; Карякин О.Б., 2001; Матвеев Б.П., 2001);
- высокая летальность среди больных РПЖ: на первом году жизни после установления диагноза погибают до 32 % пациентов. Пятилетняя выживаемость в зависимости от стадии составляет от 18 до 62 % (Матвеев Б.П. и др., 2003);
- высокая экономическая стоимость современных схем гормональной терапии (D’Amico A.V., 2001);
- сохранение и улучшение качества жизни пациента на фоне проводимой гормональной терапии (Матвеев Б.П. и др., 2003.)
Одним из наиболее эффективных инструментов для решения задачи по определению тактики гормонального лечения распространённых форм рака предстательной железы является индивидуальное прогнозирование течения злокачественного процесса (Атаев А.А., 1994., Мурадян А.А., 2000; D’Amico A.V., 2001).
Клинический прогноз при РПЖ осуществляется в зависимости от стадии опухолевого процесса по системе TNM (размер опухоли по отношению к размеру предстательной железы, прорастание капсулы предстательной железы, поражение регионарных лимфоузлов, наличие отдаленных метастазов), категории G (степень дифференцировки опухоли), уровня ПСА и возраста пациента (Schroeder F.H. et al., 1985; Billebaud T. et al., 1992; Partin A.W. et al., 1996; Trimble E.L. et al., 2001; Матвеев Б.П. и др., 2003).
Однако, использование отдельных факторов, непосредственно связанных лишь с самой опухолью, не всегда приводит к успешному прогнозированию отдаленного метастазирования рака предстательной железы (Матвеев Б.П. и др., 1999; Кушлинский Н.Е., 2002; D. Murray, Krahn et al., 2002).
При появлении новых сведений о механизмах развития злокачественного процесса оказалось, что изолированный клинический подход к прогнозированию недостаточен. Кроме того, такой подход, в основном, обеспечивает реализацию схем группового прогноза, не учитывая индивидуальных особенностей организма и биологического потенциала опухоли у данного пациента.
В связи с вышеизложенным, следует отметить, что сложная проблема определения исхода заболевания при раке предстательной железы не может быть решена без учета взаимосвязей между отдельными прогностическими факторами, связанными как с самой опухолью, так и с организмом больного. Решение этой проблемы позволит обеспечить индивидуальный подход к выбору объёма и метода гормональной терапии для каждого пациента, а также разработать критерии эффективности проводимой гормональной терапии для этой группы больных и, в целом, улучшить отдаленные результаты лечения распространенных форм рака предстательной железы. Всё вышеизложенное определило цель и задачи настоящего исследования.
Цель исследования: Обосновать и разработать подходы к индивидуальному прогнозированию, определяющие продолжительность жизни больных местно-распространенным и метастатическим раком предстательной железы.
Задачи исследования:
1. Определить наиболее значимые факторы прогноза, влияющие на продолжительность жизни у больных с местно-распространенным и метастатическим раком предстательной железы до и после гормональной терапии.
2. Разработать прогностические модели расчёта ожидаемой продолжительности жизни для больных местно-распространенным и метастатическим РПЖ до и после проведенного лечения – на основании выделенных факторов.
3. Разработать алгоритм выбора лечебной тактики для больных местно-распространенным и метастатическим РПЖ на основе индивидуального прогнозирования ожидаемой продолжительности жизни.
4. Создать компьютерную программу, позволяющую обеспечить индивидуальный подход к выбору схемы лечения на всех этапах гормональной терапии.
Научная новизна исследования.
В работе впервые выполнена сравнительная оценка прогностических факторов до и после проводимой гормональной терапии у больных с местно-распространённым и метастатическим раком предстательной железы. Статистико-математическими методами выделены 10 стандартных клинических параметров, позволяющих построить индивидуальное прогностическое заключение у любого пациента с распространённой формой РПЖ.
Впервые, на основании многофакторного анализа, созданы 4 математические уравнения, позволяющие определять ожидаемую продолжительность жизни пациентов, как до начала лечения, так и после проведённой гормональной терапии.
Впервые предложен алгоритм выбора лечебной тактики для больных местно-распространенным и метастатическим РПЖ на основе индивидуального прогнозирования ожидаемой продолжительности жизни до и после гормонального лечения.
Впервые создана компьютерная программа для определения ожидаемой продолжительности жизни больных с местно-распространенным и метастатическим раком предстательной железы, позволяющая выбрать адекватную тактику при планировании гормональной терапии и после наступления гормональной резистентности, используя стандартные клинические параметры.
Все вышеизложенное впервые дало возможность осуществить индивидуальный подход в лечении одной из наиболее сложных групп больных с местно-распространённым и метастатическим раком предстательной железы.
Практическая значимость работы
Созданная компьютерная программа прогнозирования ожидаемой продолжительности жизни и разработанный алгоритм по выбору лечебной тактики для больных местно-распространенным и метастатическим РПЖ позволяют на основе стандартных клинических параметров определить тактику планируемой гормональной терапии у конкретного больного.
Кроме того, вышеописанные математические инструменты позволяют адекватно оценить клинический эффект от метода гормонального лечения пациента, провести своевременную коррекцию схемы гормональной терапии в соответствии с клиническими показателями, а также определить тактику при наступлении гормональной резистентности опухоли.
Таким образом, выполненная работа позволила создать математический инструмент, при помощи которого любой клиницист может осуществить индивидуальный подход к лечению больного с местно-распространенным и метастатическим РПЖ.
Внедрение результатов работы в практику
Для онкологов и врачей общей лечебной сети разработаны методические рекомендации “Гормональная терапия при местно-распространенном и метастатическом раке предстательной железы” по определению тактики лечения распространенных форм рака предстательной железы (Иркутск, 2005).
Получены приоритетные справки от 20.06.07 и 25.06.07 по заявкам на изобретения “Способ прогнозирования продолжительности жизни у больных метастатическим раком предстательной железы” №2007123214 и “Способ прогнозирования продолжительности жизни у больных местно-распространенным раком предстательной железы” №2007123891. Получено Свидетельство о государственной регистрации программы для ЭВМ №2008610446 “Компьютерный Онкопрогноз 3.0” от 23.01.08.
Результаты исследования и разработанная компьютерная программа “Компьютерный Онкопрогноз 3.0” внедрены в практику при лечении больных распространенным РПЖ в Иркутском областном онкологическом диспансере, а также в Усольском, Ангарском, Братском и Омском онкодиспансерах. Получено 4 акта внедрения.
Положения, выносимые на защиту:
- Использование стандартных прогностических факторов позволяет с помощью определённых подходов получить индивидуальный прогноз клинического течения заболевания у больных с местно-распространённым и метастатическим раком предстательной железы на этапах лечения: до и после проводимой гормональной терапии.
- Разработанный алгоритм по определению лечебной тактики позволяет индивидуально определить наиболее адекватную схему гормонального лечения для каждого пациента с местно-распространённым и метастатическим раком предстательной железы.
- Разработанная компьютерная программа “Компьютерный Онкопрогноз 3.0” даёт возможность составить индивидуальное прогностическое заключение и определить тактику на всех этапах лечения больного с местно-распространенным и метастатическим раком предстательной железы.
Апробация работы
Материалы диссертации доложены и обсуждены: на съезде Ассоциации хирургов Иркутской области (Иркутск, 1998 г.), на региональной научно-практическая конференции “Проблемы терапии онкоурологических заболеваний” (Новосибирск, 1998 г.); на 3-ей Всероссийской научной конференции с участием стран СНГ “Актуальные вопросы лечения онкоурологических заболеваний” (Москва, 22-23 апреля 1999 г.); на Пленуме Правления Российского общества урологов (Омск 22-24 сентября 1999); на X Российском съезде урологов (Москва, 1-3 октября 2002 г.); на 5-ой Всероссийской научно-практической конференции с международным участием “Актуальные вопросы лечения онкоурологических заболеваний” (Обнинск, 2-3 октября 2003 г.); на “Global prostate cancer summit” (Греция, Афины, 4-9 июня 2005 г.); на 6-ой Всероссийской научной конференции “Актуальные вопросы лечения онкоурологических заболеваний” (Москва, 4-5 октября 2005 г.); на 6-ой Дальневосточной урологической конференции “Актуальные вопросы урологии” (Хабаровск, 19-20 мая 2006 года); на XXI Конгрессе Европейской ассоциации урологов (EAU) (Париж, 5-8 апреля 2006 года).
Публикации:
По теме диссертации опубликовано 14 научных работ, в том числе две журнальных статьи в издании, рекомендуемом ВАК РФ.
Структура и объем диссертации
Диссертация изложена на 1841страницах машинописного текста, состоит из введения, 4 глав, выводов, практических рекомендаций, приложения и указателя используемой литературы. Она иллюстрирована 42 рисунками и 24 таблицами. Список используемой литературы включает 316 работ, из них 174 отечественных и 142 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Клинический материал и методы обследования
Материалом для настоящего исследования послужили клинико-морфологические данные 165 больных местно-распространенным и метастатическим раком предстательной железы, находившихся на обследовании и лечении в отделении урологии Иркутского областного онкологического диспансера с 2001 по 2006 гг. Отбор пациентов проводился методом случайной выборки. В исследование включены больные, о которых имеются сведения по продолжительности жизни или причинах смерти на 01.01.2007 г.
В группу больных РПЖ со стадией Т3 включено 36 (21,8%) больных, со стадией Т4 – 59 (35,8%), а у 70 (42,4%) пациентов наблюдался генерализованный рак простаты. При исследовании больных использовалась разработанная нами стандартизированная карта, куда вносились паспортные и анамнестические данные, показатели инструментальных и лабораторных методов обследования, результаты лечения.
На основе полученных результатов в программе Microsoft Excel (с использованием персонального компьютера типа IBM) была создана информационная база данных, включающая в себя подробную клиническую и патоморфологическую информацию об исследуемых больных.
Средний возраст пациентов на момент включения в исследование составлял 65,0 лет ± 0,6 (от 33 до 82 лет), медиана – 66 лет, стандартное отклонение – 8,2. Возрастной пик заболеваемости приходился на период 60–69 лет. Эта группа пациентов составила 47,0 % (76 чел.) от всех больных местно-распространенным и метастатическим раком предстательной железы. Наименьшее количество пациентов находилось в возрастной группе младше 40 лет – 2 чел. (1,2 %), группа в возрасте от 40 до 59 лет насчитывала 41 чел. (24,8%), на группу 70 – 79 лет приходилось 26,7 % от всех больных местно-распространённым и метастатическим РПЖ (44 чел.), а пациенты старше 80 лет составили 2,4% (4 человека).
Средний объём простаты был наибольшим при стадии Т4 и составил 83,1 ±6,3см3.Средний уровень ПСА при стадии Т3 составил 11,1±2,4 нг/мл, при Т4 – 21,0 ±3,8 нг/мл и при метастатическом раке простаты – 19,5±2,0 нг/мл. Средний уровень тестостерона был наибольшим в группе с генерализованным раком и составлял 6,7±0,3 нг/мл.
Основные исходные клинические параметры больных представлены в таблице 1.
Таблица 1
Клиническая характеристика больных местно-распространенным
и метастатическим раком предстательной железы
| Клинические показатели | Стадия | ||||||||||
| Т3 | Т4 | М+ | |||||||||
| абс. | % | абс. | % | абс. | % | ||||||
| Всего больных | 36 | 21,8 | 59 | 35,8 | 70 | 42,4 | |||||
| Возраст, годы менее 60 60-69 более 70 | 10 18 8 | 27,8 50,0 22,2 | 15 26 18 | 25,4 44,1 30,5 | 17 31 22 | 24,3 44,2 31,4 | |||||
| Средний возраст, годы Медиана Станд. отклонение | 63,9±1,1 64 6,6 | 64,7±1,1 66 8,1 | 65,9±1,1 66 9,0 | ||||||||
| Объём простаты, см3 менее 20 20-40 40-60 60-80 более 80 | 6 20 6 - 4 | 16,7 55,5 16,7 - 11,1 | - 7 19 11 22 | - 11,9 32,2 18,6 37,3 | 2 19 30 9 10 | 2,8 27,1 42,9 12,9 14,3 | |||||
| Средний объем простаты, см3 Медиана Станд. отклонение | 38,4,9±4,1 30,1 25,2 | 83,1±6,3 65 48,7 | 55,3±4,1 48 34,1 | ||||||||
| Степень дифференцировки опухоли G0 G1 G2 G3 G4 | 6 2 24 4 - | 16,7 5,6 66,6 11,1 - | 6 2 25 17 9 | 10,2 3,4 42,4 28,8 15,2 | 2 5 27 25 11 | 2,9 7,1 38,6 35,7 15,7 | |||||
| Уровень ПСА в сыворотке крови, нг/мл Средний ПСА Медиана Станд. отклонение | 11,1±2,4 2,4 14,3 | 21,0±3,8 7,5 29,1 | 19,5±2,0 14,7 17,1 | ||||||||
| Уровень тестостерона в сыворотке крови, нг/мл Средний тестостерон Медиана Станд. отклонение | 2,5±0,6 2,6 2,6 | 2,8±0,8 2,5 0,1 | 6,7±0,3 7 2,4 | ||||||||
| Длительность анамнеза, мес. менее12 более12 | 20 16 | 55,6 44,4 | 21 38 | 35,6 64,4 | 35 35 | 50,0 50,0 | |||||
| Состояние пациента по шкале ECOG-ВОЗ, баллы 0 1 2 3 4 | 21 11 2 1 1 | 58,3 30,5 5,6 2,8 2,8 | 18 20 14 4 3 | 30,5 33,9 23,7 6,8 5,1 | 10 20 17 20 3 | 14,3 28,6 24,3 28,5 4,3 | |||||
| Степень нарушения мочеиспускания по шкале IPSS, баллы менее 20 более 20 | 14 22 | 38,9 61,1 | 47 12 | 79,7 20,3 | 41 29 | 58,6 41,4 | |||||
| Степень выраженности болевого синдрома, баллы 0 1 2 3 4 | 24 12 - - - | 66,7 33,3 - - - | 17 16 9 15 2 | 28,8 27,2 15,2 25,4 3,4 | 7 25 12 21 5 | 10,0 35,8 17,1 30,0 7,1 | |||||
Основными клиническими проявлениями местно-распространенного и метастатического РПЖ были: дизурический синдром – 140 чел. (84,8%), болевой синдром – 117 чел. (70,9%), гематурия – 51 чел. (30,9%).
В качестве основных методов исследования предстательной железы использовались: пальцевое ректальное исследование (ПРИ), УЗИ трансабдоминальное и трансректальное (ТРУЗИ) с использованием аппаратов «Aloka» SSD-2000 (Япония), «Philips» SDR-1550 (Швеция), «Siemens» SL-450 (Германия) и применением бипланового ректального датчика с частотой 7,5 МГц.; рентгенография легких, костей поясничного отдела позвоночника и костей таза; остеогаммасцинтиграфия при помощи аппаратов «Гамма» (Венгрия) и КПРДИ-3 (Киев) с препаратом Технеций-99m-пентотех; рентгенография пораженного отдела костей скелета с использованием компьютерного томографа «Siemens» (Германия), компьютерная и МРТ-томография. Объём предстательной железы и метастазов во внутренние органы определялся во время ультразвукового исследования. Также исследовались общеклинические и биохимические анализы крови и мочи.
Уровень ПСА определялся непрямым иммуно-ферментным методом с помощью коммерческих наборов ИФА “Сobas Core” компании “Roche”. Концентрация ПСА в сыворотке определялась при первичном обследовании, затем через один и три месяца после начала лечения, а в дальнейшем каждые три месяца. Во время перерыва в лечении (при интермиттирующей андрогенной блокаде) уровень ПСА определялся ежемесячно.
В морфологическое исследование опухоли входило определение гистологического строения и степени дифференцировки опухоли. Для уточнения полученных данных был проведен ретроспективный пересмотр микропрепаратов, использованы архивные клинические и лабораторные материалы. Гистологическое подтверждение диагноза имели 165 больных РПЖ (100 %). При изучении состояния пациента проводилась: оценка общего состояния (статуса больного) по 5-балльной шкале ECOG, рекомендованной в 1988 году комитетом экспертов ВОЗ, и представляющей собой модификацию шкалы Карновского; исследование степени нарушений мочеиспускания по международной шкале IPSS (от 0 до 35 баллов), 1991 г.; оценка болевого синдрома по 5-ти бальной шкале (от 0 до 4 баллов) по Coleman et al., 1988 и 1991 гг.
В исследование включены только те пациенты, у которых основным методом лечения была гормональная терапия. Распределение больных по стадиям в зависимости от метода лечения было сравнительно однородным:
- стадия Т3 – получали МАБ – 14 (38,8%), МАГ– 6 (16,7%), ЭТ – 10 (27,8%), ИАС – 6 (16,7%);
- стадия Т4 – получали МАБ – 26 (44,1%), МАГ– 4 (6,8%), ЭТ – 20 (33,9%), ИАС – 9 (15,2%);
- стадия М(+) – получали МАБ – 32 (45,7%), МАГ– 5 (7,1%), ЭТ – 24 (34,3%), ИАС – 9 (12,9%).
Гормональная терапия продолжалась до развития признаков гормональной резистентности. Больные наблюдались весь последующий период вплоть до смерти: от 2 до 84 месяцев. Среднее время наблюдения за пациентами – 34,5±1,5 мес, медиана 29, стандартное отклонение – 19,3.
Средний уровень ПСА во всех группах до начала лечения составил 24 нг/мл при колебаниях значений от 2,5 до 100 нг/мл. Средний период до наибольшего снижения ПСА составил 151 день (5 мес.), в первой группе – 120 дней (4 мес.), во второй – 201 день (6,7 мес.), в третьей – 132 дня (4,4 мес.), а в четвертой – 145 (4,8 мес.). Средняя продолжительность цикла (лечение/перерыв) в группе ИАС составила 9,8 месяца. Средняя длительность перерыва в лечении в той же группе составила 145 дней (4,8 мес.).
Оценка результатов лечения проводилась согласно “Новым предложениям Всемирной Организации Здравоохранения (ВОЗ) по стандартизации оценки результатов лечения онкологических больных”. В соответствие с рекомендациями ВОЗ, продолжительность общего эффекта отсчитывается от даты начала лечения до даты первого наблюдения прогрессирования заболевания. Продолжительность полного эффекта должна измеряться от даты, когда этот полный эффект впервые зарегистрирован, до даты, когда впервые были отмечены признаки прогрессирования болезни. Для частичного эффекта отсчет делается от начала лечения. В качестве основного критерия оценки отдаленных результатов лечения принималась продолжительность жизни (общая выживаемость), которая определялась для каждого пациента как время от начала лечения до даты последнего визита или смерти. Также оценивалось время до развития гормонорезистентности, которое определялось для каждого пациента как время от начала лечения до даты установления прогрессирования заболевания (повышение уровня ПСА более чем на 100,0% от минимального исходного уровня при посткастрационном уровне тестостерона).
При анализе полученных данных вычисляли минимальные и максимальные значения признака, его среднее значение, стандартное отклонение от среднего, для сравнения качественных признаков – -критерий Пирсона. Качественные признаки описывались простым указанием абсолютного значения и доли (в процентах) для каждой категории. Анализ выживаемости проводился по методу Каплана-Майера путем сравнения кривых по градациям, а так же по таблицам дожития. Достоверность различия в выживаемости между выделенными группами больных определялась методом построения таблиц сопряжённости с использованием критерия 2 (Пирсона).
Оценку показателей “чувствительность”, “специфичность” выполняли референтным методом. В качестве результата исследования нами была принята продолжительность жизни пациента: отрицательным результатом считали продолжительность жизни больного свыше 24 мес. – отсутствие прогрессирования заболевания, приводящего к смерти пациента в сроки от 24 мес. и более, положительным результатом считали продолжительность жизни больного менее 24 мес. – прогрессирование заболевания приводило к смерти пациента в сроки менее 24 мес.
Статистически достоверными считали различия с уровнем значимости р < 0,05. Оценка степени значимости исследуемых факторов для расчёта ожидаемой продолжительности жизни больных с местно-распространённым и метастатическим раком предстательной железы выполнялась до и после проводимой гормональной терапии. На основании выделенных наиболее информативных клинических показателей разработаны прогностические модели ожидаемой продолжительности жизни для больных местно-распространенным и метастатическим РПЖ до и после проведенного лечения.
Расчеты коэффициентов, констант математических моделей прогнозирования продолжительности жизни и программы ЭВМ “Компьютерный Онкопрогноз 3.0” проведены на кафедре информатики и компьютерных технологий Иркутского ГИУВа (зав. кафедрой – доц. И. М. Михалевич) – с помощью комплекса математических методов, включающих корреляционный, кластерный и регрессионный статистические анализы. Формулы этих расчётов запрограммированы в пакете статистической программы “Statistica 6.0”. Авторами данных методов являются В.П. Боровиков и В.И. Юнкеров.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
1. Анализ влияния прогностических факторов на отдаленные
результаты гормонального лечения больных местно-распространенным
и метастатическим РПЖ.
В задачи нашего исследования входило определение значимости исследуемых факторов для построения прогноза местно-распространенного и метастатического рака предстательной железы. Эту оценку мы проводили в соответствии с требованиями CONSORT (Consolidated Standards of Reporting Trials).
В качестве факторов, имеющих возможное влияние на прогноз продолжительности жизни больных с местно-распространённым и метастатическим раком предстательной железы, первоначально исследованы 22 клинических параметра, определяемых в ходе стандартного обследования пациента. Референтный и кластерный анализ, проведённый при помощи пакета статистических программ “Statistica 6,0”, позволил отобрать из них 10 наиболее информативных признаков, оказывающих значимое влияние на прогноз общей выживаемости больных с местно-распространённым и метастатическим раком предстательной железы. Такими параметрами явились следующие: возраст, объем простаты, степень дифференцировки опухоли, длительность анамнеза заболевания, уровень ПСА и тестостерона, оценка общего состояния пациента по шкале ЕСОG, степень нарушений мочеиспускания по международной шкале IPSS, степень выраженности болевого синдрома по 5-балльной шкале, время до развития гормонорезистентности.
На первом этапе анализа мы оценивали выживаемость больных в сравниваемых группах по методу Каплана-Мейера в зависимости от отобранных прогностических факторов.
Общая 3-летняя выживаемость для всех пациентов (n =165) составила 32,4%, а 5-летняя – 18,6%. Средняя продолжительность жизни больных составила 33,5 ± 1,7 месяцев, медиана – 29 месяцев, стандартное отклонение – 22,4 месяца.
При рассмотрении продолжительности жизни больных раком предстательной железы в зависимости от стадии заболевания получены следующие данные (рис. 1).
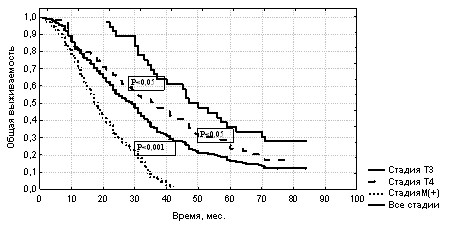
Рис. 1. Общая выживаемость больных в зависимости от стадии РПЖ
Показатель 3-летней выживаемости при стадии Т3 составил 63,9%, а при стадии Т4 – 48,3% (р < 0,05, 2=4,94). При генерализованном раке простаты только 5,7% больных дожили до 3 лет. Полученные различия в показателях 3-летней выживаемости при местно-распространённом и метастатическом РПЖ – статистически значимы (р1,2 < 0,001, 21 = 46, 22 = 74,6). Пятилетняя выживаемость достигнута пациентами с местно-распространённым раком простаты: при стадии Т3 она составила 36,3% с медианой наблюдения 47,5 мес., при Т4 – 23,3% с медианой наблюдения 38,0 мес. Полученные различия между стадиями Т3 и Т4 также оказались статистически значимыми (Р < 0,05, 2 = 4,04). Таким образом, наилучшую выживаемость продемонстрировали больные со стадией Т3.
Для определения возможного влияния возраста больных раком предстательной железы на отдаленные исходы лечения этого заболевания пациентов разделили на 3 группы: в первую вошли больные в возрасте младше 60 лет, во вторую – от 60 до 69 лет, а в третью – все пациенты, старше 70 лет (рис. 2, 3, 4).



Рис. 2. Общая выживаемость больных РПЖ Рис. 3. Общая выживаемость больных РПЖ Рис. 4. Общая выживаемость больных
в зависимости от возраста при стадии в зависимости от возраста при стадии с метастатическим РПЖ
заболевания Т3 заболевания Т4 в зависимости от возраста
Анализируя общую выживаемость в зависимости от возраста, при стадии Т3 мы выявили статистически значимые различия в показателях 5-летней выживаемости между группой 60–69 лет (42,9%) с медианой наблюдения 53,0 мес. и больными старше 70 лет (68,6%) при медиане наблюдения 70,5 мес., (р<0,001, 2 = 13,4). При стадии Т4 5-летняя выживаемость больных в возрасте от 60 до 69 и старше 70 лет составила 15,4% и 55,6% с медианами наблюдения 32,0 мес. и 71,0 мес., соответственно (р<0,001, 2 = 35,3), а 3-летняя выживаемость для тех же возрастных градаций составили 13,3%, 46,1% и 77,8%, соответственно (р1,2,3<0,001, 21 = 26,2, 22 = 21,7, 23 = 85,2). При генерализованном раке предстательной железы, разница в 3-летней выживаемости пациентов в возрасте 60-69 (3,1%) и старше 70 лет (11,3%) также статистически достоверна (р<0,05, 2 = 5,03). Таким образом, значимыми критериями выживаемости при стадиях Т3 и Т4 были возрастные группы от 60 до 69 и старше 70 лет. Эти критерии при М (+) были показательными только для 3-летней выживаемости.
При анализе выживаемости в зависимости от объёма предстательной железы все больные были разделены на 3 группы: первая – пациенты, у которых объём простаты после лечения был менее 40 см3, вторая – больные с объёмом простаты от 40 до 60 см3 и третья – пациенты, у которых объём простаты после лечения оставался более 60 см3 (рис. 5, 6, 7).



Рис. 5. Общая выживаемость больных Рис. 6. Общая выживаемость больных Рис. 7. Общая выживаемость больных
РПЖ в зависимости от объёма РПЖ в зависимости от объёма с метастатическим РПЖ в
простаты при стадии Т3 простаты при стадии Т4 зависимости от объёма простаты
Для стадии Т3 отмечено значимое различие между показателями 3-летней выживаемости во всех группах: 84,6% – 33,3% – 0% (р < 0,001, 2 = 55,9–39,5–147,8). Пятилетняя выживаемость при этой распространённости опухоли наблюдалась только у пациентов с объёмом простаты менее 40 см3 (46,1%) с медианой наблюдения 60,5 мес. При стадии Т4 пятилетняя выживаемость также наблюдалась только у больных с объёмом простаты менее 40 см3 (75,0%) с медианой наблюдения 72,0 мес., а при объёме от 40 до 60 см3 – у 11,1% пациентов с медианой наблюдения 47,0 мес. Показатели 3-летней выживаемости больных со стадией Т4 были следующими: в первой группе – 87,5%, во второй – 77,8%, а в третьей – 8,0%. При наличии генерализованного РПЖ самая высокая 3-летняя выживаемость получена при объёме простаты менее 40 см3 – 14,3%, при объеме 40 – 60 см3 она составила 6,7%. Статистически достоверных различий в показателях выживаемости между выделенными группами не наблюдалось. Таким образом, значимым критерием выживаемости при стадиях Т3 и Т4 был объём простаты, который после лечения оставался более 60 см3. Этот критерий при генерализованном РПЖ не оказал существенного влияния на выживаемость больных.
При анализе зависимости показателей выживаемости в зависимости от длительности анамнеза заболевания была выделена группа с анамнезом более 12 месяцев и группа с историей заболевания менее 12 месяцев (рис. 8, 9, 10).

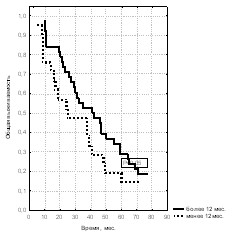
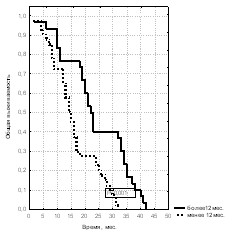
Рис. 8. Общая выживаемость больных Рис. 9. Общая выживаемость больных Рис. 10. Общая выживаемость больных
РПЖ в зависимости от длительности РПЖ в зависимости от длительности с метастатическим РПЖ в
анамнеза при стадии Т3 анамнеза при стадии Т4 зависимости от длительности анамнеза
При местно-распространённой стадии Т3 5-летняя выживаемость наблюдалась в обеих выделенных группах. Несмотря на отсутствие значимых различий в 3-летней выживаемости, таковые были выявлены между показателями 5-летней выживаемости (56,2% и 20,0%) с медианами наблюдения 42,5 мес. и 72,0 мес. (р<0,001, 2 = 27,5). Для пациентов из первой группы при стадии Т4 также выявлена лучшая 5-летняя выживаемость (28,9%) с медианой наблюдения 25,8 мес., чем для пациентов с коротким анамнезом заболевания (14,3%) при медиане наблюдения 41,5 мес. (р<0,05, 2 = 6,29). У пациентов с генерализованным раком простаты 3-летняя выживаемость выявлена только в первой группе (с длительностью анамнеза более 12 месяцев) и составила 16,7%. Таким образом, значимым критерием выживаемости при стадиях Т3 и Т4 является длительность анамнеза заболевания более 12 месяцев. А при генерализованном раке простаты этот показатель влиял только на 3-летнюю выживаемость.
По степени дифференцировки опухоли все обследованные больные были разделены на три группы. В первую вошли больные с высокодифференцированной аденокарциномой 30,3%, во вторую – с умеренной степенью дифференцировки 37,6%, а в третью были включены пациенты с низкодифференцированной опухолью 32,1% (рис. 11, 12, 13).
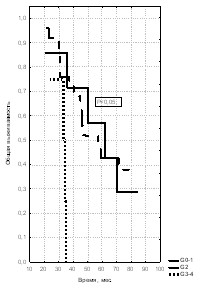
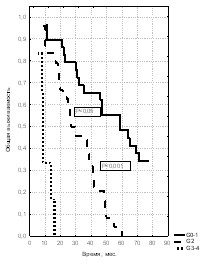
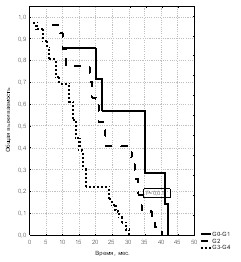
Рис. 11. Общая выживаемость больных Рис. 12. Общая выживаемость больных Рис. 13. Общая выживаемость больных
РПЖ в зависимости от степени РПЖ в зависимости от степени с метастатическим РПЖ в
дифференцировки при стадии Т3 дифференцировки при стадии Т4 зависимости от степени дифференцировки
Трехлетняя выживаемость при стадии Т3 в группе с высокой степенью и дифференцированной аденокарциномой (71,4%) и группе с умеренно-дифференцированным РПЖ (72%) не имела статистически значимых различий. При анализе пятилетней выживаемости (57,1% и 42,5% с медианами наблюдения 62,0 мес. и 53,0 мес.) обнаружена достоверная разница в указанных группах (р < 0,05, 2 = 4,5). У больных со стадией рака простаты Т4 также были выявлены статистически значимые различия в показателях 3-летней (65,5% и 45,8%, р < 0,05, 2 = 7,86) и пятилетней выживаемости (48,3% и 4,7%, р < 0,001, 2 = 48,8, медианы наблюдения – 59,0 мес. и 28,0 мес.) между больными с высокой степенью и дифференцированной аденокарциномой и группой с умеренно-дифференцированным РПЖ. При генерализованном раке простаты 3-летняя выживаемость выявлена у больных с высокой степенью и дифференцированной аденокарциномой (28,6%) и у пациентов с умеренно-дифференцированной опухолью (11,1%) при достоверных различиях (р < 0,01, 2 = 9,2). Таким образом, значимым критерием выживаемости при стадиях Т3 и Т4 была высокодифференцированная аденокарцинома и опухоль с умеренной степенью дифференцировки. Эти факторы при генерализованном раке простаты были важны только для определения 3-летней выживаемости.
С целью изучения прогностического влияния общего состояния (статуса) пациента на течение рака предстательной железы проведена оценка качества жизни больных, получавших гормонотерапию по поводу местно-распространённого и метастатического РПЖ по шкале ECOG, рекомендованной ВОЗ (рис. 14, 15, 16).
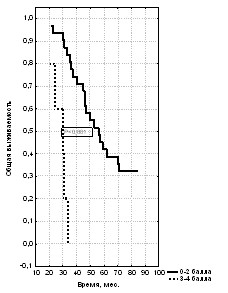
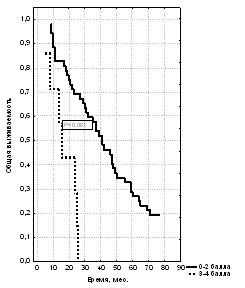

Рис. 14. Общая выживаемость больных Рис. 15. Общая выживаемость больных Рис. 16. Общая выживаемость больных
РПЖ в зависимости от статуса РПЖ в зависимости от статуса с метастатическим РПЖ в
по шкале ECOG при стадии Т3 по шкале ECOG при стадии Т4 зависимости от статуса по шкале ECOG
Анализ общей выживаемости в зависимости от состояния больного по шкале ECOG-ВОЗ в 0-2 балла, показал, что 5-летняя выживаемость при Т3 составила 40,4% с медианой наблюдения 56,0 мес., а при Т4 – 38,2% с медианой наблюдения 41,0 мес. Различия в этих показателях между стадиями местно-распространённого РПЖ не были значимыми (р > 0,1). Значение 3-летней выживаемости в этих же группах пациентов для стадии Т3 равно 74,2%, а для Т4 – 57,7%. Необходимо отметить, что только у больных с местно-распространённым РПЖ (Т3 и Т4), имеющих статус по шкале ECOG в 0-2 балла, выявлена 3- и 5-летняя выживаемость. Таким образом, значимым критерием выживаемости при стадиях Т3 и Т4 было состояние по шкале ECOG-ВОЗ в 0-2 балла.
Был проведен анализ влияния степени нарушений мочеиспускания на выживаемость больных с местно-распространённым и метастатическим раком предстательной железы (рис. 17, 18, 19).


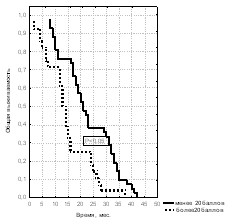
Рис. 17. Общая выживаемость больных Рис. 18. Общая выживаемость больных Рис. 19. Общая выживаемость больных
РПЖ в зависимости от степени РПЖ в зависимости от степени с метастатическим РПЖ в
нарушений мочеиспускания нарушений мочеиспускания зависимости от степени нарушений
по шкале IPSS при стадии Т3 по шкале IPSS при стадии Т4 мочеиспускания по шкале IPSS
При анализе данных для стадии Т3 получены значимые различия в показателях 5-летней (64,3% против 18,2%, с медианами наблюдения 36,5 мес. и 72,5 мес.) и 3-летней (92,9% против 54,5%) выживаемости между пациентами с оценкой менее 20 баллов и больными со степенью нарушения мочеиспускания, оцененной в более чем 20 баллов. При стадии Т4 пятилетняя выживаемость (29,8% с медианой наблюдения 42,0 мес.) достигнута только больными, имеющими “хороший” балл по шкале IPSS (менее 20). При генерализованном заболевании мы выявили прогностическую значимость этого показателя только в сравнении с местно-распространёнными опухолями. Таким образом, степень нарушения мочеиспускания менее 20 баллов является важным критерием выживаемости при стадиях Т3 и Т4.
Для определения возможного влияния болевого синдрома на показатели выживаемости, мы разделили всех пациентов на тех кто не испытывал боли – 0 баллов по 5 балльной шкале, и тех, у кого наблюдался болевой синдром – 1-4 балла (рис. 20, 21, 22).



Рис. 20. Общая выживаемость больных Рис. 21. Общая выживаемость больных Рис. 22. Общая выживаемость больных
РПЖ в зависимости от степени РПЖ в зависимости от степени с метастатическим РПЖ
выраженности болевого выраженности болевого в зависимости от степени
синдрома при стадии Т3 синдрома при стадии Т4 выраженности болевого синдрома
Представляется очень показательным тот факт, что при стадии Т3 5-летней выживаемости достигли 50,0% больных (медиана наблюдения 60,5 мес.), не имеющих болевого синдрома и только 8,3% пациентов (медиана наблюдения 33,5 мес.), испытывающих боль. Достоверные различия между выделенными группами отмечались и для показателей 3-летней выживаемости. Также убедительно выглядят различия 3-летней выживаемости (76,9% против 39,1%) и 5-летней (61,5% против 13,0%, медианы наблюдения 73,0 мес. и 29,5 мес.) между первой и второй группами больных при стадии Т4. Для метастатической стадии РПЖ найдена достоверная разница в показателях 3-летней выживаемости (17,6% против 1,9%) между больными, не имеющим болевого синдрома, и теми, кто испытывал боль той или иной интенсивности. Таким образом, важным критерием выживаемости при стадиях Т3 и Т4 было отсутствие боли. Этот фактор для метастатического РПЖ был значимым только для определения 3-летней выживаемости.
В связи с тем, что рак предстательной железы является гормонозависимой опухолью, оценка гормонального статуса больного может служить решающим критерием в определении выбора тактики гормонального лечения, а также для оценки ее эффективности.
Для сравнительного анализа выживаемости больных раком предстательной железы в зависимости от исходного уровня тестостерона в сыворотке крови были выделены две группы больных. В первую группу вошли пациенты, исходный уровень сывороточного тестостерона которых составил менее 3,0 нг/мл. Во вторую группу вошли пациенты, начальный уровень сывороточного тестостерона которых составил более 3,0 нг/мл (рис. 23, 24, 25).

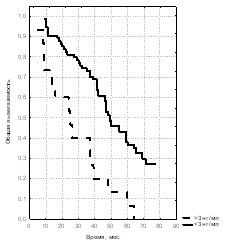

Рис. 23. Общая выживаемость больных Рис. 24. Общая выживаемость больных Рис. 25. Общая выживаемость больных
РПЖ в зависимости от уровня РПЖ в зависимости от уровня с метастатическим РПЖ
тестостерона при стадии Т3 тестостерона при стадии Т4 в зависимости от уровня тестостерона
Анализ полученных данных показал, что при распространенности РПЖ, оцениваемой как Т3, нет значимых различий как в показателях 3-летней (75,0% и 62,5%, р > 0,1, 2 = 3,6), так и 5-летней выживаемости (41,7% и 38,3%, р > 0,1, 2 = 0,33, медианы наблюдения 57,0 мес. и 45,5 мес.) в указанных группах больных. Для стадии Т4, выявлено, что 3-летняя выживаемость при уровне тестостерона менее 3 нг/мл составила 71,6%, а при уровне тестостерона более 3 нг/мл – 40,0% (р < 0,001, 2 = 19,4). В показателях 5-летней выживаемости (36,49% и 6,7%, медианы наблюдения 41,5 мес. и 25,0 мес.) также были получены статистически значимые различия (р < 0,001, 2 = 26,2). При анализе выживаемости больных с метастатическим РПЖ в зависимости от уровня тестостерона 3-летняя выживаемость в первой группе составила 22,2%, в то время как во второй – этот показатель был равен 3,3% (р < 0,001, 2 = 16). Таким образом, значимым критерием выживаемости при стадиях Т3 и Т4 был исходный уровень сывороточного тестостерона менее 3,0 нг/мл. При метастатическом РПЖ этот фактор влиял только на 3-летнюю выживаемость.
В задачу нашего исследования входило изучение влияния уровня простатического специфического антигена у больных РПЖ на прогноз исхода заболевания. Значение данного маркера определялось до начала лечения, в процессе лечения и после проведенного лечения. Для объективной оценки результатов исследования пациенты были распределены по группам в зависимости от уровня ПСА (в качестве пороговых значений выбраны значения ПСА, равные 10 и 30 нг/мл.) (рис. 26, 27, 28).



Рис. 26. Общая выживаемость больных Рис. 27. Общая выживаемость больных Рис. 28. Общая выживаемость больных
РПЖ в зависимости от уровня РПЖ в зависимости от уровня с метастатическим РПЖ
ПСА при стадии Т3 ПСА при стадии Т4 в зависимости от уровня ПСА
Пятилетняя выживаемость при стадии Т3 местно-распространённого рака простаты в группе меньше 10 нг/мл составила 62,5% с медианой наблюдения 75,5 мес., при уровне ПСА, равном от 10 до 30 нг/мл – 41,7% с медианой наблюдения 56,5 мес., а при ПСА более 30 нг/мл – 18,7% с медианой наблюдения 36,5 мес.. Анализ выживаемости в зависимости от уровня ПСА для стадии Т4 выявил, что показатели 3-летней и 5-летней выживаемости также выше у больных с меньшим исходным уровнем ПСА, однако, воздействие этого фактора на показатели выживаемости при этой распространённости опухолевого процесса не было статистически значимым. При генерализованном раке простаты 3-летняя выживаемость в группе менее 10 нг/мл была равна 23,1%, а при 10-30 нг/мл – 16,7%. Таким образом, важным критерием выживаемости при стадиях Т3 и Т4 был исходный уровень простатического специфического антигена менее 10 нг/мл. При метастатическом РПЖ этот показатель также был значимым для определения 3-летней выживаемости.
При оценке показателей выживаемости зависимости от метода гормонотерапии нами получены данные, представленные на рисунке 29.
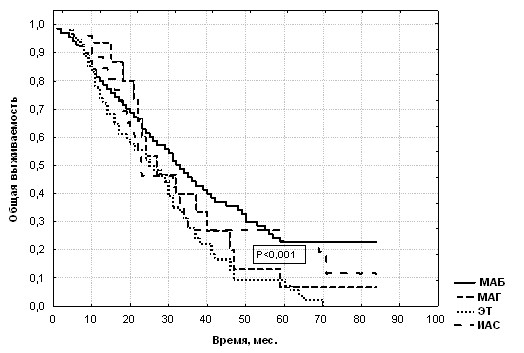
Рис. 29. Общая выживаемость больных местно-распространённым и генерализованным РПЖ
в зависимости от метода гормонотерапии
Лучшие показатели 5-летней выживаемости определялись в группах пациентов с максимальной андрогенной блокадой (22,9%), и интермиттирующей андрогенной супрессией (23,1%). Самую низкую выживаемость продемонстрировала группа монотерапии антиандрогенами – 6,7% и эстрогенотерапии – 6,8% больных. Различия в пятилетней выживаемости пациентов при лечении с использованием максимальной андрогенной блокады по сравнению с монотерапией антиандрогенами были статистически значимы (р < 0,001, 2 = 13,78). При этом разница в 5-летней между МАБ и эстрогенотерапией также была достоверной (р < 0,001, 2 = 28,57). При сравнении 5-летней между ИАС и ЭТ (р < 0,001, 2 = 13,33), а также ИАС и МАГ (р < 0,05, 2 = 6,1) выявлены статистически значимые различия. Таким образом, наиболее эффективными методами лечения для больных местно-распространённым и генерализованным РПЖ являются максимальная андрогенная блокада и интермиттирующая андрогенная супрессия.
Также был проведен анализ выживаемости пациентов с местно-распространённым и метастатическим раком предстательной железы в зависимости от времени до наступления резистентности к проводимой гормональной терапии. Для этого все пациенты были разделены на 2 группы: в первую вошли те, у кого гормонорезистентность наступила позже, чем через 2 года от начала лечения, во вторую – те, у кого она наступила раньше, чем через 2 года от начала гормонотерапии (рис. 30, 31, 32).
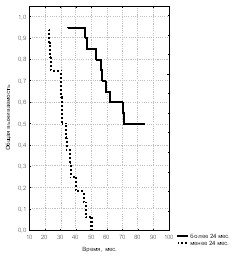

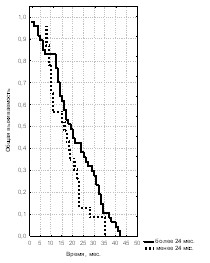
Рис. 30. Общая выживаемость больных Рис. 31. Общая выживаемость больных Рис. 32. Общая выживаемость больных
РПЖ в зависимости от времени РПЖ в зависимости от времени с метастатическим РПЖ
до наступления гормональной до наступления гормональной в зависимости от времени до наступления
резистентности при стадии Т3 резистентности при стадии Т4 гормональной резистентности
При распространённости опухоли, оцененной как Т3, более пяти лет прожили только те больные, у которых гормональная резистентность опухоли возникла позже, чем через 2 года от начала гормональной терапии. Трёхлетняя выживаемость пациентов этой группы, имеющих стадию РПЖ Т3 составила 95%, а 5-летняя – 60% при медиане наблюдения 30,0 мес. В то же время больные, у которых гормонорезистентность наступила ранее 24 месяцев от начала лечения, достигли только 3-летней выживаемости, показатель которой при этой стадии равен 37,5%. Кроме того, несмотря на то, что при стадии Т4 все пациенты дожили до 5 лет, показатели 3-летней (88,3% против 17,2%) и 5-летней (43,3% против 3,4% с медианами наблюдения 59,0 мес. и 19,0 мес.) выживаемости также имеют достоверные различия в выделенных группах. При генерализованном раке простаты с поздним наступлением гормональной резистентности 3-летняя выживаемость составила 10,6%. Таким образом, значимым критерием выживаемости при стадиях Т3 и Т4 было время до развития гормональной резистентности опухоли, которая возникла позже, чем через 2 года от начала гормональной терапии. Этот показатель при метастатическом РПЖ раке также был значимым для определения 3-летней выживаемости.
2. Эффективность гормонотерапии
Сравнительные данные об эффективности различных схем лечения представлены в таблице 2. В исследуемых группах полной регрессии в указанные сроки наблюдения не отмечалось ни у одного больного. Частичный эффект гормональной терапии отмечен у 100 (60,6%) больных.
Таблица 2
Эффективность гормонотерапии при РПЖ в зависимости от стадии
| Стадии | Количество больных, % | |||
| Частичная регрессия | Стабилизация | Прогрессирование | Всего | |
| Т3 | 25(69,4%) | 8 (22,2%) | 3 (8,4%) | 36(21,8%) |
| Т4 | 37 (62,7%) | 14 (23,7%) | 8 (13,6%) | 59(35,7%) |
| M(+) | 38 (54,3%) | 13 (18,6%) | 19(27,1%) | 70(42,4%) |
| Всего | 100 (60,6%) | 35 (21,2%) | 30(18,2%) | 165(100,0%) |
Значимых различий эффективности гормональной терапии между стадиями Т3 и Т4 не выявлено (Р > 0,1). Достоверно значимые различия наблюдались в частоте частичной регрессии между стадиями Т3 и М+ (р < 0,05, 2 = 4,75).
Стабилизация опухоли выявлена у 35 (21,2%) человек. При этом также не было значимых различий между стадиями заболевания (Р > 0,1). Прогрессирование наблюдалось у 30 (18,2%) обследованных, значимые отличия отмечены между стадиями Т3 – М+ (р < 0,001, 2 = 11,97), и Т4 – М(+) (р < 0,01, 2 = 5,62). Таким образом, процент частичной регрессии во всех группах превышал 50,0% и был наибольшим при стадии Т3.
3. Прогностическая оценка факторов, алгоритм и способы
математического индивидуального прогнозирования
продолжительности жизни больных местно-распространенным и
метастатическим РПЖ
3.1.Определение чувствительности и специфичности прогностических
факторов
Для решения одной из задач нашей работы мы должны были провести оценку факторов прогноза продолжительности жизни отдельно у больных местно–распространенным и у больных метастатическим раком предстательной железы, для того, чтобы выбрать из них наиболее информативные и обладающие высокой чувствительностью и специфичностью.
Факторами прогноза, обладающими наибольшей чувствительностью в прогнозировании продолжительности жизни пациентов с местно-распространенным РПЖ, мы считаем: длительность анамнеза заболевания (91,9%), время до развития гормонорезистентности (82,7%), уровень ПСА в сыворотке крови (81,2%), степень дифференцировки опухоли (81,0%), возраст пациента (77,1%). Наибольшей специфичностью обладают: степень нарушения мочеиспускания по шкале IPSS (33,9%), выраженность болевого синдрома (32,5%), оценка общего состояния по шкале ECOG (31,5%), уровень тестостерона (29,3%) и возраст больного (28,0%) (табл. 3).
Таблица 3
Оценка прогностической ценности факторов прогноза развития местно-распространенного рака предстательной железы по продолжительности
жизни (24 мес.)
| Факторы прогноза | Чувствительность | Специфичность |
| Возраст | 77,1% | 28,0% |
| Длительность заболевания | 91,9% | 21,9% |
| Дифференцировка опухоли | 81,0% | 21,7% |
| Объем простаты | 75,0% | 25,2% |
| IPSS | 76,7% | 33,9% |
| Болевой синдром | 53,3% | 32,5% |
| ECOG | 42,9% | 31,5% |
| ПСА | 81,2% | 26,0% |
| Тестостерон | 71,7% | 29,3% |
| Гормонорезистентность | 82,7% | 25,4% |
Между тем, факторами, обладающими наибольшей чувствительностью в прогнозировании продолжительности жизни пациентов с метастатическим РПЖ, являются: возраст пациента (94,3%), уровень тестостерона в сыворотке крови (91,0%), степень дифференцировки опухоли (93,1%), степень нарушения мочеиспускания (шкала IPSS) (88,2%), уровень ПСА в сыворотки крови (86,1%). Наибольшую специфичность показали: время до наступления гормонорезистентности (32,6%) возраст (27,0%), уровень тестостерона (26,9%) и степень дифференцировки опухоли (26,4%) (табл. 4).
Таблица 4.
Оценка прогностической ценности факторов прогноза развития метастатического рака предстательной железы по продолжительности
жизни (24 мес.)
| Факторы прогноза | Чувствительность | Специфичность |
| Возраст | 94,3% | 27,0% |
| Длительность заболевания | 67,6% | 20,0% |
| Дифференцировка опухоли | 93,1% | 26,4% |
| Объем простаты | 61,9% | 25,0% |
| IPSS | 88,2% | 21,9% |
| Болевой синдром | 60,0% | 25,7% |
| ECOG | 61,1% | 19,3% |
| ПСА | 86,1% | 25,5% |
| Тестостерон | 91,0% | 26,9% |
| Гормонорезистентность | 71,4% | 32,6% |
3.2. Математические модели индивидуального прогнозирования ожидаемой продолжительности жизни больных с местно-распространенным и метастатическим РПЖ
Результатом проведенного исследования стало построение математических моделей индивидуального прогнозирования ожидаемой продолжительности жизни для больных местно-распространенным и метастатическим раком предстательной железы до лечения и после проведенного лечения. Для селекции наиболее значимых прогностических факторов при построении моделей использована процедура пошагового дискриминантного анализа показателей, полученных при стандартном клиническом обследовании пациентов с местно-распространенным и метастатическим РПЖ.
3.2.1. Математические модели прогнозирования ожидаемой продолжительности жизни больных с местно-распространенным РПЖ
В нижеприведенной таблице представлены факторы для прогнозирования ожидаемой продолжительности жизни больных местно-распространенным РПЖ (Т3–Т4) до начала лечения (табл. 5).
При проведении индивидуального прогноза авторами была определена величина градаций каждого прогностического фактора (Х1– Х8).
Таблица 5
Набор факторов для прогнозирования ожидаемой продолжительности жизни больных местно-распространенным РПЖ (Т3-Т4) до начала лечения
| Факторы прогноза | Градации | Обозначения, используемые в уравнениях |
| Т3-Т4 стадия | ||
| 1. Состояние больного по международной шкале ECOG 2. Содержания тестостерона в 1 мм сыворотки крови. 3. Нарушение мочеиспускания по шкале IPSS 4. ПСАобщ. 5. Дифференцировка опухоли 6. Объем простаты 7. Уровень болевых ощущений пациента по 5-балльной шкале (Coleman et al., 1988 и 1991 гг.) 8. Возраст | 0-4 балла нг/мл 0-35 баллов нг/мл G0, G1,G2,G3, G4 см3 0-4 балла Количество полных лет | Х1 Х2 Х3 Х4 Х5 Х6 Х7 Х8 |
На основании регрессионного анализа была построена математическая модель индивидуального прогнозирования ожидаемой продолжительности жизни для больных Т3– Т4 стадии РПЖ (формула 1– Ф1).
Уравнение регрессии для Т3-Т4 стадии до начала лечения:
Y = 109,08 + 3,97•Х1 + 3,39•Х2 – 1,99•Х3 – 0,19•Х4 – 7,95•Х5 + 0,17•Х6 –
7,32•Х7 – 0,44•Х8
где Y – ожидаемая продолжительность жизни, Х1 – состояние пациента по шкале ECOG, Х2 – уровень тестостерона, Х3 – нарушение мочеиспускания по шкале IPSS, Х4 – уровень ПСА, Х5 – дифференцировка опухоли, Х6 – объём простаты, Х7 – уровень болевых ощущений, Х8 – возраст.
Вклад восьми факторов, включенных в модель Т3-Т4 стадии, составляет 83,3% от общей подгруппы квадратов отклонений прогнозируемого параметра Y (ожидаемая продолжительность жизни).
Достоверность прогноза: Оценка качества модели свидетельствует, что данная модель информативна, т. к. коэффициент детерминации R2 = 0,96. По величине F – критерия (8,43) = 68,347; с уровнем значимости р < 0,00001 – модель считается статистически значимой, достоверной (по F – критерию р 0,05). Стандартная ошибка для прогнозируемого значения, т.е. для продолжения жизни равна 5,8.
В нижеприведенной таблице представлены факторы для прогнозирования ожидаемой продолжительности жизни больных местно-распространенным РПЖ (Т3–Т4) после проведенного лечения (табл. 6).
При проведении индивидуального прогноза авторами была определена величина градаций каждого прогностического фактора (Х1– Х8).
Таблица 6
Набор факторов для прогнозирования ожидаемой продолжительности жизни больных местно-распространенным РПЖ (Т3-Т4) после лечения
| Факторы прогноза | Градации | Обозначения, используемые в уравнениях |
| Т3-Т4 стадия | ||
| 1.Возраст 2.Дифференцировка опухоли 3.Содержания тестостерона в 1 мм сыворотки крови. 4.Время до развития гормоноре-зистентности 5. Уровень болевых ощущений пациента по 5-балльной шкале (Coleman et al., 1988 и 1991 гг.) 6.Состояние больного по между-народной шкале ECOG 7. ПСАобщ. 8. Нарушение мочеиспускания по шкале IPSS | Количество полных лет G0, G1,G2,G3, G4 нг/мл От 1 до 80 мес. 0– 4 балла. 0-4 балла нг/мл 0-35 баллов | Х1 Х2 Х3 Х4 Х5 Х6 Х7 Х8 |
На основании регрессионного анализа была построена математическая модель индивидуального прогнозирования ожидаемой продолжительности жизни для больных Т3– Т4 стадии РПЖ (формула 2– Ф2).
Уравнение регрессии для Т3-Т4 стадии после проведенного лечения:
Y = – 9,17 + 0,47•Х1 + 1,94•Х2 – 0,698•Х3 + 0,01•Х42 + 0,07•Х32 – 1,66•Х52 +
1,86•Х6 2 – 0,0003•Х72 + 0,01•Х82
где Y – ожидаемая продолжительность жизни, Х1 – возраст, Х2 – дифференцировка опухоли, Х3 – тестостерон, Х4 – время развития гормонорезистентности, Х5 – уровень болевых ощущений, Х6 – состояние пациента по шкале ECOG, Х7 – уровень ПСА, Х8 – нарушение мочеиспускания по шкале IPSS.
Вклад восьми факторов, включенных в модель Т3-Т4 стадии, составляет 92,4% от общей подгруппы квадратов отклонений прогнозируемого параметра Y (ожидаемая продолжительность жизни).
Достоверность прогноза: Оценка качества модели свидетельствует, что данная модель информативна, т. к. коэффициент детерминации R2 = 0,89. По величине F – критерия (9,76) = 33,095; с уровнем значимости р < 0,00001 – модель считается статистически значимой, достоверной (по F – критерию р 0,05). Стандартная ошибка для прогнозируемого значения, т.е. для продолжения жизни равна 9,4.
3.2.2. Математические модели прогнозирования ожидаемой продолжительности жизни больных с метастатическим РПЖ
В нижеприведенной таблице 7 представлены факторы, выбранные для прогнозирования ожидаемой продолжительности жизни больных метастатическим (M+) РПЖ.
При проведении индивидуального прогноза авторами была определена величина градаций каждого прогностического фактора (Х1- Х5).
Таблица 7
Набор факторов для прогнозирования ожидаемой продолжительности жизни больных метастатическим РПЖ до лечения
| Факторы прогноза | Градации | Обозначения, используемые в уравнениях |
| М+ | ||
| 1.Длительность заболевания 2.Дифференцировка опухоли 3.Состояние пациента по шкале ECOG 4. ПСАобщ. 5. Возраст | время от появления симптомов заболевания до обращения пациента к врачу, в месяцах G0, G1,G2,G3, G4 0-4 балла в нг/мл количество полных лет | Х1 Х2 Х3 Х4 Х5 |
На основании регрессионного анализа была построена математическая модель индивидуального прогнозирования ожидаемой продолжительности жизни для больных M+ стадии РПЖ до лечения (формула 3– Ф3).
Уравнение регрессии для M+ стадии:
Y= 0,56•Х1 – 2,12•Х2 + 1,86•Х3 – 0,02•Х12 + 0,0006•Х42 + 0,29•Х5
где Y – ожидаемая продолжительность жизни, Х1 – длительность заболевания, Х2 – дифференцировка опухоли, Х3 – состояние пациента по шкале ECOG, Х4 – уровень ПСА, Х5 – возраст.
Вклад пяти факторов, включенных в модель M+ стадии, составляет 93,7% от общей суммы квадратов отклонений прогнозируемого параметра Y (ожидаемая продолжительность жизни).
Достоверность прогноза: Оценка качества модели свидетельствует, что данная модель информативна, т. к. коэффициент детерминации R2 = 0,9377. По величине F – критерия (6,43) = 107,9; с уровнем значимости р < 0,00001 – модель считается статистически значимой, достоверной (по F – критерию р 0,05). Стандартная ошибка для прогнозируемого значения, т.е. для продолжения жизни, равна 4,68.
В нижеприведенной таблице представлены факторы для прогнозирования
ожидаемой продолжительности жизни больных метастатическим РПЖ (М+) (табл. 8).
При проведении индивидуального прогноза авторами была определена величина градаций каждого прогностического фактора (Х1- Х5).
Таблица 8
Набор факторов для прогнозирования ожидаемой продолжительности жизни больных метастатическим РПЖ после проведенного лечения
| Факторы прогноза | Градации | Обозначения, используемые в уравнениях |
| М+ стадия | ||
| 1.Время до развития гормоноре-зистентности 2.Уровень болевых ощущений пациента по 5-балльной шкале (Coleman et al., 1988 и 1991 гг.) 3. ПСАобщ. 4. Нарушение мочеиспускания по шкале IPSS 5.Объем простаты | От 1 до 80 мес. 0– 4 балла. нг/мл 0-35 баллов см3 | Х1 Х2 Х3 Х4 Х5 |
На основании регрессионного анализа была построена математическая модель индивидуального прогнозирования ожидаемой продолжительности жизни для больных M+ стадии РПЖ после лечения (формула 4–Ф4).
Уравнение регрессии для М+ стадии:
Y = 13,8 – 0,086•Х1 + 0,95•Х2 – 0,23•Х3 + 0,057•Х4 + 0,98•Х5
где Y – ожидаемая продолжительность жизни, Х1 – объем простаты, Х2 – уровень болевых ощущений, Х3 – нарушение мочеиспускания по шкале IPSS, Х4 – уровень ПСА, Х5 – время развития гормонорезистентности.
Вклад пяти факторов, включенных в модель М+ стадии, составляет 93% от общей подгруппы квадратов отклонений прогнозируемого параметра Y (ожидаемая продолжительность жизни).
Достоверность прогноза: Оценка качества модели свидетельствует, что данная модель информативна, т. к. коэффициент детерминации R2 = 0,93. По величине F – критерия (5,59) = 160,27; с уровнем значимости р < 0,00001 – модель считается статистически значимой, достоверной (по F – критерию р 0,05). Стандартная ошибка для прогнозируемого значения, т.е. для продолжения жизни равна 4,1.
3.2.3. Прогностическое заключение, алгоритм и технический результат
способа математического моделирования индивидуального прогнозирования ожидаемой продолжительности жизни больных с местно-распространенным и метастатическим РПЖ.
Анализ качества моделей свидетельствует о том, что нами получены вполне информационно способные, статистически значимые уравнения прогноза ожидаемой продолжительности жизни больных РПЖ в зависимости от конкретных клинических факторов, что свидетельствует о добротности данных, отобранных в матрицу наблюдений и адекватности используемых методов моделирования данных. Технический результат способа достигается тем, что у конкретного больного определяют величину установленных прогностических факторов. Затем показатели вводят в компьютерную программу с заложенными в ней математическими моделями прогнозирования. Прогностическое заключение принимается по следующим параметрам, определенными нами опытным путем в соответствии с рекомендациями “Математическое моделирование медицинских и биологических систем”, 1988 г.:
– менее 12 месяца – неблагоприятный прогноз;
– 12 – 24 месяца – промежуточный прогноз;
– более 24 месяцев – благоприятный прогноз.
На основании полученных данных был разработан алгоритм (рис. 33), который предусматривает последовательное использование четырех моделей (Ф1–Ф4), позволяющих рассчитать ожидаемую продолжительность жизни у больных распространенным раком предстательной железы и определить наиболее адекватную тактику лечения. Способ основан на применении данных стандартного минимума клинико-лабораторных и инструментальных методов обследования, используемые параметры имеют однозначную оценку и не зависят от субъективного выбора врача.
Рис.33. Алгоритм индивидуального прогнозирования ожидаемой
продолжительности жизни и лечебной тактики для больных местно-
распространенным и метастатическим РПЖ
На основании разработанного алгоритма была создана компьютерная программа “Компьютерный Онкопрогноз 3.0”, которая позволяет унифицировать и упростить для онкологов и врачей общей лечебной сети процедуру составления прогностического заключения при распространённом раке предстательной железы. После того, как в программу введены значения клинических показателей, определённых в ходе стандартного обследования пациента (что занимает 1–2 минуты), она выполняет прогноз ожидаемой продолжительности жизни больного и выдаёт рекомендации по дальнейшему лечению и наблюдению.
ВЫВОДЫ
- К прогностически значимым факторам, влияющим на выживаемость больных местно-распространённым и метастатическим РПЖ относятся как факторы, характеризующие особенность организма больного: возраст старше 60 лет, уровни ПСА менее 10 нг/мл и тестостерона менее 3 нг/мл, оценка статуса пациента по шкале ECOG-ВОЗ в 0-2 балла, степень выраженности болевого синдрома в 0 балла и степень нарушений мочеиспускания менее 20 баллов, так и факторы, связанные с особенностью опухоли – стадия опухолевого процесса – Т3, степень дифференцировки опухоли – G1-2, объём простаты менее 60 м3.
- Разработанные математические способы индивидуального прогнозирования позволяют с высокой степенью надёжности (89,0%) прогнозировать ожидаемую продолжительность жизни больных местно-распространённым и метастатическим РПЖ, как до начала лечения, так и после проведённой гормональной терапии.
- Предложенный алгоритм лечебной тактики для больных местно-распространенным и метастатическим РПЖ на основе индивидуального прогнозирования ожидаемой продолжительности жизни позволяет выбрать рациональную схему гормональной терапии, имеющую наибольшую эффективность для каждого пациента и сохраняющую при этом возможное качество его жизни.
- Созданная компьютерная программа позволяет, используя стандартные клинические параметры, определить прогноз продолжительности жизни для больного с местно-распространённым и метастатическим РПЖ на любом этапе лечения и обеспечить индивидуальный подход к выбору схемы гормональной терапии.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
I. Выбор схемы лечения для пациентов с распространенным раком предстательной железы должен зависеть от комплексной оценки факторов прогноза, определяющих развитие заболевания. Перед началом терапии проводится определение ожидаемой продолжительности жизни больного путём ввода данных, полученных при стандартном обследовании, в компьютерную программу “Компьютерный Онкопрогноз 3,0”.
1. При неблагоприятном прогнозе (рассчитанная программой ожидаемая продолжительность жизни < 12 месяцев) лечение проводится по схеме максимальной андрогенной блокады: 1) билатеральная орхидэктомия или препараты-аналоги ЛГРГ (например, золадекс – 3,6 мг, подкожно, 1 раз в 28 дней или диферелин – 3,75 мг, подкожно, 1 раз в 28 дней); 2) антиандрогены (например, андрокур – по 300 мг внутримышечно, 1 раз в 2 недели или касодекс – по 50 / 150 мг в сутки, per os или калумид – по 50 / 150 мг в сутки, per os или флутамид – по 250 мг 3 раза в сутки, per os). Первый приём антиандрогенов в случае “медикаментозной кастрации” назначается за 7 суток до первой инъекции аналога ЛГРГ – для профилактики хорошо известного “синдрома вспышки”. Гормональная терапия проводится до развития гормональной резистентности.
2. При промежуточном прогнозе (рассчитанная программой ожидаемая продолжительность жизни от 12 до 24 месяцев) в качестве метода гормонального лечения мы рекомендуем схему интермиттирующей андрогенной супрессии. В этом случае лечение также начинается с максимальной андрогенной блокады (включая “медикаментозную кастрацию”). При достижении регрессии или стойкой стабилизации процесса, перманентном снижении уровня ПСА ниже 1 нг/мл (в двух последовательных измерениях с интервалом в 3 месяца), отсутствии болевого синдрома и обструктивных симптомов – в назначении/приёме препаратов делается перерыв. В дальнейшем всем пациентам каждые 4 недели выполняется мониторинг ПСА, и оценивается качество жизни. Поводом для возобновления терапии является: удвоение уровня ПСА (регистрируемое в двух последовательных измерениях с интервалом в 3 месяца), возобновление болевого синдрома или инфравезикальной обструкции. Гормональная терапия продолжается до развития признаков гормональной резистентности.
3. При благоприятном прогнозе (рассчитанная программой ожидаемая продолжительность жизни более 24 месяцев) в качестве метода гормонального лечения мы рекомендуем схему монотерапии антиандрогенами. В этом случае больному назначается один из препаратов - антиандрогенов (например, андрокур – по 300 мг внутримышечно, 1 раз в 2 недели или касодекс – по 50 / 150 мг в сутки, per os или калумид – по 50 / 150 мг в сутки, per os или флутамид – по 250 мг 3 раза в сутки, per os). Лечение проводится до появления признаков прогрессии заболевания. Дальнейшая терапия проводится по схеме интермиттирующей андрогенной супрессии до регистрации гормональной резистентности.
II. Наиболее информативными критериями эффективности проводимого гормонального лечения распространенного рака предстательной железы являются уровень ПСА и время до развития гормонорезистентности опухолевого процесса к проводимому методу лечения.
- При проведении лечения по схемам МАБ и МАГ мониторинг ПСА осуществляется каждые 3 месяца, при назначении схемы ИАС, уровень ПСА сыворотки пациента определяется ежемесячно.
После возникновения гормональной резистентности опухоли данные, полученные при контрольном обследовании пациента (на момент регистрации ГР), вновь вводятся в компьютерную программу “Компьютерный Онкопрогноз 3,0”.
А) При неблагоприятном прогнозе (рассчитанная программой ожидаемая продолжительность жизни <12 месяцев) проводится симптоматическая терапия под наблюдением онколога в поликлинике по месту жительства.
В) При промежуточном прогнозе (рассчитанная программой ожидаемая продолжительность жизни от 12 до 24 месяцев) проводится химиотерапия по одной из следующих схем:
- Паклитаксел 135 мг/м2 в/в 1-й день + эстрацит 250 мг внутрь 2 раза день 1-6-й дни.
- Доксорубицин 50 мг/м2 в/в + цисплатин 50 мг/м2 в/в 1-й день.
- Митоксантрон 12 мг/м2 в/в 1-й день, преднизолон 5 мг внутрь 2 раза в день постоянно.
С) При благоприятном прогнозе (рассчитанная программой ожидаемая продолжительность жизни более 24 месяцев) проводится динамическое наблюдение и симптоматическая терапия под наблюдением онколога поликлиники по месту жительства. При возникновении болевого синдрома, не купируемого ненаркотическими анальгетиками, может быть проведена антидолорозная лучевая терапия на метастатический очаг поражения и/или химиотерапия по одной из следующих схем:
- Паклитаксел 135 мг/м2 в/в 1-й день + эстрацит 250 мг внутрь 2 раза день 1-6-й дни.
- Доксорубицин 50 мг/м2 в/в + цисплатин 50 мг/м2 в/в 1-й день.
- Митоксантрон 12 мг/м2 в/в 1-й день, преднизолон 5 мг внутрь 2 раза в день постоянно.
Список работ, опубликованных по теме диссертации
1. Жернов А.А. Исследование качества жизни при раке предстательной
железы / А.А. Жернов, В.В. Дворниченко, Перепечин Д.В., Е.В. Ковалёв // Российский онкологический журнал. – М., 2007. – №5. – С. 39-42.
- Жернов А.А. К вопросу о значении ПСА для диагностики рака предстательной железы / А.А. Жернов, В.Ф. Онопко, А.М. Кузнецов // Актуальные вопросы лечения онкоурологических заболеваний: Материалы III Всеросс. конф. с участием стран СНГ, 22-23 апр. 1999. – М., 1999. – С. 72-73.
- Жернов А.А. К вопросу о скрининг-диагностике рака предстательной железы / А.А. Жернов, В.Ф. Онопко // Актуальные вопросы онкологии: Сб. тр. под ред. В.Г. Лалетина. - Иркутск, 1998. – С. 50–51.
- Качество жизни при лечении рака предстательной железы / А.А. Жернов [и др.] // Бюллетень ВСНЦ СО РАМН. – 2007. – №1. – С. 26-28.
- Жернов А.А. Консервативное и оперативное лечение рака предстательной железы: Материалы съезда Ассоциации хирургов Иркутской области / А.А. Жернов. – Иркутск, 1998. – С. 33–34.
- Жернов А.А. Лечение распространённых форм рака предстательной железы / А.А. Жернов // Проблемы терапии онкоурологических заболеваний: Материалы регион. науч. – практ. конф., 8 окт. 1998. – Новосибирск, 1998. – С. 51–52.
- Жернов А.А. Оценка качества жизни больных при лечении рака предстательной железы / А.А. Жернов, В.Ф. Онопко // Актуальные вопросы онкологии: Сб. тр. под ред. В.В. Дворниченко, В.Г. Лалетина. – Иркутск, 2004. – С. 33–35.
- Жернов А.А. Прогностические факторы при распространённом раке предстательной железы / А.А. Жернов // Актуальные вопросы урологии: Материалы 6-ой Дальневосточной урологической конф., 19-20 мая 2006. – Хабаровск, 2006. – С. 53–54.
- Жернов А.А. Роль ПСА в скрининг-диагностике рака предстательной железы: Материалы Пленума Правления Российского общества урологов, 22–24 сент. 1999 / А.А. Жернов, В.Ф. Онопко. – Омск, 1999. – С. 59–60.
- Жернов А.А. Современные подходы к лечению распространённых форм рака предстательной железы / А.А. Жернов // Проблемы терапии онкоурологических заболеваний: Материалы регион. науч. – практ. конф. – Новосибирск, 1998. – С. 11–12.
- Онопко В.Ф. Комплексное лечение генерализованных форм рака предстательной железы / В.Ф. Онопко, О.А. Федоров, А.А. Жернов // Актуальные вопросы лечения онкоурологических заболеваний: Материалы II Всерос. науч. конф. с участием стран СНГ, 21–22 ноября 1997. – Обнинск, 1997. – С. 50–51.
- Онопко В.Ф. Мониторинговый контроль гормональной терапии у больных распространенным раком предстательной железы: Материалы Пленума Правления Российского общества урологов, 22–24 сент. 1999 / В.Ф. Онопко, И.М. Быков, А.А. Жернов. – Омск, 1999. – С. 188–189.
- Пути улучшения результатов лечения больных с распространённым раком предстательной железы / А.А. Жернов [и др.] // Актуальные вопросы онкологии: Сб. тр. под ред. В.Г Лалетина. – Иркутск, 1998. – С. 65–66.
- Федоров О.А. Принципы лечения диссеминированных форм рака предстательной железы / О.А. Федоров, В.Ф. Онопко, А.А. Жернов // Актуальные вопросы современной клинической медицины: Сб. тр. под ред. А.Г. Шантурова. – Иркутск, 1997. – С. 356–358.
Список сокращений, используемых в автореферате
ПСА – простат-специфический антиген
РПЖ – рак предстательной железы
УЗИ – ультразвуковое исследование
ТРУЗИ – трансректальное ультразвуковое исследование
ПРИ – пальцевое ректальное исследование
МРТ – магнитно- резонансная томография
ПИН – простатическая интраэпителиальная неоплазия
МАГ – монотерапия антиандрогенами
МАБ – максимальная андрогенная блокада
ЭТ – эстрогенотерапия
ИАС – интермиттирующая андрогенная супрессия
ООД – областной онкологический диспансер
Ф – формула
ГТ – гормонотерапия

