Лечение раннего метастатического рака молочной железы
На правах рукописи
ДАВИДЕНКО
Ирина Сергеевна
ЛЕЧЕНИЕ РАННЕГО
МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
14.01.17 – хирургия
14.01.12 – онкология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Барнаул – 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Алтайский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» (г. Барнаул), в Алтайском филиале Российского онкологического научного центра им. Н.Н. Блохина Российской Академии медицинских наук, в государственном учреждении здравоохранения «Клинический онкологический диспансер №1» Департамента здравоохранения Краснодарского края (г. Краснодар)
Научные консультанты:
член-корр. РАМН, доктор медицинских наук, профессор Я.Н. Шойхет
доктор медицинских наук, профессор А.Ф. Лазарев
Официальные оппоненты:
доктор медицинских наук, профессор В.Г. Лубянский
доктор медицинских наук, профессор Ю.В. Шишкин
доктор медицинских наук, профессор С.В. Сидоров
Ведущая организация: ГОУ ВПО «Омская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
Защита состоится «28» июня 2010 г. в «_10_» часов на заседании диссертационного совета Д 208.002.02 при ГОУ ВПО «Алтайский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» по адресу: 656038, Россия, г. Барнаул, пр. Ленина, 40.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Алтайский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» (656031, Россия, г. Барнаул, ул. Папанинцев, 126).
Автореферат разослан: «___»_______________2010 г.
![]()
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Е.А. Цеймах
Актуальность проблемы
Рак молочной железы (РМЖ) занимает третье место по заболеваемости среди всех злокачественных опухолей (23%), от него страдают 8-9% женщин [Silva O.E., et al, 2005]. Каждый год в мире диагностируется более миллиона новых случаев рака молочной железы, а умирают более 100 000 женщин [Silva O.E., et al, 2005].
В последние годы во всем мире, в том числе в России, отмечается тенденция роста заболеваемости раком молочной железы. В 2007 году в России зарегистрировано 51 865 новых больных раком молочной железы. По сравнению с 2002 годом прирост составил 13,1% [Давыдов М.И., 2009]. В 2007 г. заболеваемость раком молочной железы у женщин России составила 67,9 (в 1998 г. – 54,7); [Чиссов В.И., 2009]. Тенденция роста заболеваемости раком молочной железы наблюдается в течение последних пяти лет в Алтайском и Краснодарском краях (показатель заболеваемости в 2007 году составил 64,7 и 70,6 соответственно на 100 тыс.женского населения); [Лазарев А.Ф., 2008; Пефти Е.Б, 2008]. Высокие показатели заболеваемости и смертности от рака молочной железы обусловливают необходимость поиска новых видов лечение.
Высокая степень жизнеспособности опухолевых клеток при попадании их в другие органы и ткани является одной из причин невысокой эффективности лечения, что обосновывает необходимость дальнейшего изучения биологии опухоли с целью индивидуализации лечебной тактики [Spector N.L.,2009]. Достижения последних лет в области молекулярной биологии позволили узнать некоторые особенности фенотипа опухоли, механизмы канцерогенеза: индукцию опухолью сигналов роста, высокий уровень репликационного потенциала, резистентность к рост-ингибиторным сигналам, уклонение от апоптоза, ангиогенез, тканевую инвазию и метастазирование. Изучены прогностические факторы рака молочной железы, которые способствуют опухолевой дифференцировке (НЕR-2/neu), апоптозу (р53, BCL-2, BAX, mTOR и др.), показатели пролиферативной активности (Ki-67), ангиогенеза (VEGF); [Tindon A.K., 1990; Mita A.C., 2008].
Наряду с этим остается неизвестным, какие механизмы оказывают влияние на метастазирование раннего рака молочной железы.
Изучение биологических особенностей раннего рака молочной железы, несомненно, откроет новые возможности для повышения эффективности лечения, что позволит обеспечить лучший контроль над заболеванием и на раннем этапе предотвратить метастазирование.
Цель исследования:
Повышение эффективности лечения раннего метастатического рака молочной железы путем применения новых схем комплексного лечения, включающих в себя биотерапевтические препараты в первой линии, на основе изучения биологических особенностей и факторов прогноза этой формы злокачественных новообразований.
Задачи исследования:
- Изучить клинико-морфологические особенности раннего метастатического рака молочной железы (T1N1-3M0-1).
- Изучить биологические особенности и факторы прогноза при раннем метастатическом раке молочной железы (T1N1-3M0-1).
- Исследовать причины неблагоприятного исхода у больных с ранним неметастатическим раком молочной железы (T1N0M0).
- Разработать алгоритм лечения раннего неметастатического рака молочной железы (T1N0M0) больных с неблагоприятными факторами прогноза.
- Разработать новый алгоритм лечения раннего метастатического рака молочной железы (T1N1-3M0, T1N1-3M1) с неблагоприятными факторами прогноза.
- Изучить ближайшие и отдаленные результаты лечения больных ранним метастатическим раком молочной железы.
- Разработать методику коррекции анемии, вызванной химиотерапией первой линии по схеме FAC у больных метастатическим раком молочной железы.
Научная новизна работы
Установлены биологические факторы, влияющие на раннее метастазирование рака молочной железы, – наличие экспрессии рецепторов HER 2/neu, VEGF. Кроме того, развитие метастазов зависело от числа родов (4 и более).
Разработана новая схема адьювантной терапии с применением герцептина при раннем неметастатическом раке молочной железы, имеющем высокий уровень экспрессии HER 2/neu.
Разработан новый алгоритм комплексного лечения раннего метастатического рака молочной железы с использованием биотерапевтических препаратов (блокаторы факторов роста опухоли: герцептин и авастин и фактор-стимулятор гемопоэза – рекормон).
Практическая значимость работы
Исследование биологических особенностей рака молочной железы (определение факторов роста) позволяет выделить группу пациентов с прогнозируемым неблагоприятным исходом и внести коррекцию в лечение на ранних этапах. Применение герцептина в адъювантной терапии неметастатического рака молочной железы позволит предупредить у таких больных развитие метастазов в ближайшие и отдаленные сроки наблюдения. Совместное использование герцептина и авастина у больных ранним метастатическим раком молочной железы позволяет существенно улучшить выживаемость у этих больных.
Основные положения, выносимые на защиту:
- Ранний метастатический рак молочной железы отличается биологическими особенностями – наличием высокого уровня экспрессии факторов роста (HER2/neu и VEGF).
- Случаи неблагоприятного исхода раннего неметастатического рака молочной железы обусловлены наличием высокого уровня экспрессии факторов роста в опухоли у этих больных, приводящих к развитию метастазирования в ближайшие и отдаленные сроки наблюдения.
- Перспективы улучшения результатов лечения раннего метастатического рака молочной железы связаны с ранним применением биотерапевтических препаратов (герцептин и авастин) у больных, имеющих высокий уровень экспрессии факторов роста.
- Возможность коррекции анемии, вызванной химиотерапией первой линии по схеме FAC у больных метастатическим раком молочной железы, с помощью рекормона – рекомбинантного человеческого эритропоэтина.
5. Возможность увеличения безрецидивного и безметастатического периода у больных с ранним метастатическим раком молочной железы путем применения биотерапевтических препаратов (герцептин, авастин, рекормон) в первой линии в сочетании с полихимиотерапией.
Апробация результатов исследования
Основные положения работы доложены и обсуждены на научно-практических конференциях с международным участием (г. Барнаул): «Современные методы диагностики и лечения онкологических больных: достижения и неудачи», июль 2006 г.; «Профилактика и лечение злокачественных новообразований в современных условиях», июль 2007 г.; «Совершенствование онкологической помощи в современных условиях», июнь, 2008 г.; «Проблемы современной онкологии», июнь 2009 г.
Апробация диссертационной работы проводилась на объединенном заседании кафедр факультетской хирургии с курсом хирургии ФПК ППС, госпитальной хирургии, оперативной хирургии и топографической анатомии, онкологии, гистологии, патологической анатомии с секционным курсом Алтайского государственного медицинского университета.
Объем и структура диссертации
Диссертация состоит из введения, 5 глав, заключения, выводов, практических рекомендаций, списка литературы, включающего 27 работ отечественных и 299 работ зарубежных авторов. Диссертация изложена на 192 страницах машинописного текста, текст иллюстрирован 19 рисунками и 39 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В основу работы положены данные о 300 больных раком молочной железы, у которых наибольший размер опухоли был до 2 см (T1). У 84,0% больных размеры опухоли в наибольшем измерении были от 1,0 до 2,0 см (Т1с), у 13,0% – от 0,5 до 1,0 см (Т1b).
Пациентки были разделены на 2 группы: I группа – 148 пациенток (49,3%), у которых метастазы в регионарные лимфоузлы и отдаленные метастазы не выявлялись (T1N0M0); II группа – 152 пациентки (50,7%), которые имели метастазы в регионарные лимфоузлы и отдаленные метастазы (ранний метастатический рак). Последняя группа была разделена на 2 подгруппы: 1 подгруппа – 117 больных (39%) с раком молочной железы T1N1-3M0, имевших только метастазы в регионарные лимфоузлы, 2 подгруппа – 35 пациенток (11,7%) с T1N1-3M1 с отдаленными метастазами при наличии метастазов в регионарные лимфоузлы.
Полученные результаты были обработаны с помощью метода вариационной статистики с определением показателя вероятности разницы по таблице Стьюдента. Статистически значимыми принимались различия при р<0,05.
Для определения взаимосвязи переменных использовался критерий сопряженности ![]() (хи-квадрат) – непараметрический критерий, позволяющий сравнивать распределения частот вне зависимости от того, распределены они нормально или нет.
(хи-квадрат) – непараметрический критерий, позволяющий сравнивать распределения частот вне зависимости от того, распределены они нормально или нет.
Анализ клинической эффективности проводился согласно критериям Европейской организации по исследованию и лечению рака (RECIST,2000):
Полная ремиссия (ПР) – полное исчезновение всех проявлений болезни на срок не менее 4 недель.
Частичная ремиссия (ЧР) – больше или равное 30% уменьшение суммы площадей измеряемых очагов на срок не менее 4 недель, при этом нет прогрессирования хотя бы одного очага или появления новых.
Стабилизация процесса (СП) – уменьшение менее чем на 30% суммарной площади всех измеряемых проявлений болезни или увеличение более чем на 20% хотя бы одного или нескольких опухолевых очагов и появление нового очага.
Прогрессирование процесса (ПП) – увеличение размеров опухолей на 20% площади одного или нескольких опухолевых очагов.
Продолжительность полной ремиссии – период времени между датой регистрации полной клинической регрессии опухоли и датой прогрессирования.
Продолжительность частичной ремиссии – период времени между датой начала лечения и датой прогрессирования.
Объективный эффект (ОЭ) объединяет полный (ПР) и частичный (ЧР) регресс опухоли.
Длительность ремиссии определялась в случаях, когда у пациенток была достигнута полная и частичная ремиссия. Медиану длительности ремиссии определяли по методу Kaplan-Meier, с помощью компьютерной программы GraphPad PRISM версия 5.00 (2006).
Длительность безрецидивного периода – период времени между датой начала лечения и датой появления метастазов определяли у пациенток обеих групп с учетом биологических особенностей опухоли (экспрессия Her 2/neu,VEGF).
Клинико-морфологические и медико-биологические особенности раннего метастатического рака молочной железы
Наиболее часто рак молочной железы у больных с ранним его метастазированием локализовался в наружных квадрантах. Ранний метастатический рак молочной железы (T1N1-3M0-1), по сравнению с опухолью T1N0M0, характеризовался относительно более частой (на 12,4%; p<0,05) величиной опухоли на уровне Т1с за счет рака молочной железы T1N1-3M0, более частой пальпацией опухоли (на 9,2%; p<0,05) и солидной формой рака (на 7,2%; p<0,05); (табл.1,2,3). При раке молочной железы T1N1-3M1, по сравнению с опухолью T1N1-3M0, на 19,7% (p<0,05) чаще встречалась аденокарцинома (табл. 4).
Таблица 1
Локализация первичной опухоли у больных раком молочной железы с величиной опухоли Т1
| Локализация опухоли (квадранты) | Группы больных | |||||||||||||||||||
| I | II | |||||||||||||||||||
| T1N0M0 | T1N1-3M0-1 | T1N1-3M0 | T1N1-3M1 | |||||||||||||||||
| абс. число | % | абс. число | % | р > | р2 > | р2c > | абс. число | % | р > | р2 > | р2c > | абс. число | % | р | р2 | р2c > | р1 | p12 | p12c | |
| Верхне-наружный | 41 | 27,7 | 35 | 23 | 0,05 | 0,05 | 0,05 | 32 | 27,3 | 0,05 | 0,05 | 0,05 | 3 | 8,6 | <0,05 | <0,05 | 0,05 | <0,05 | <0,05 | >0,05 |
| Нижне- наружный | 35 | 23,6 | 33 | 21,7 | 0,05 | 0,05 | 21 | 17,9 | 0,05 | 0,05 | 12 | 34,3 | >0,05 | >0,05 | <0,05 | >0,05 | ||||
| На границе наружных | 14 | 9,4 | 21 | 13,8 | 0,05 | 0,05 | 18 | 15,4 | 0,05 | 0,05 | 3 | 8,6 | >0,05 | >0,05 | >0,05 | >0,05 | ||||
| Верхне-внутренний | 22 | 14,8 | 24 | 15,7 | 0,05 | 0,05 | 19 | 16,2 | 0,05 | 0,05 | 5 | 14,3 | >0,05 | >0,05 | >0,05 | >0,05 | ||||
| Нижне-внутренний | 15 | 10,1 | 16 | 10,5 | 0,05 | 0,05 | 11 | 9,4 | 0,05 | 0,05 | 5 | 14,3 | >0,05 | >0,05 | ||||||
| На границе внутренних | 10 | 6,7 | 11 | 7,2 | 0,05 | 0,05 | 8 | 6,8 | 0,05 | 0,05 | 3 | 8,6 | >0,05 | >0,05 | ||||||
| Центральная (за соском) | 11 | 7,4 | 12 | 7,9 | 0,05 | 0,05 | 8 | 6,8 | 0,05 | 0,05 | 4 | 11,4 | >0,05 | >0,05 | ||||||
| ВСЕГО | 148 | 100,0 | 152 | 100,0 | 117 | 100,0 | 35 | 100,0 | ||||||||||||
Таблица 2
Размеры опухоли у больных раком молочной железы с величиной опухоли Т1
| Размеры опухоли в наибольшем измерении (в см) | Группы больных | ||||||||||||||||||
| I | II | ||||||||||||||||||
| T1N0M0 (n=148) | T1N1-3M0-1 (n=152) | T1N1-3M0 (n=117) | T1N1-3M1 (n=35) | ||||||||||||||||
| абс. число | % | абс. число | % | р | р2 < | р2c < | абс. число | % | р | р2 < | р2c | абс. число | % | р | р2 > | р2c > | р1 > | p12c > | |
| T1mic (<0,1) | 1 | 0,7 | - | - | - | 0,05 | - | - | - | <0,05 | - | - | 0,05 | 0,05 | |||||
| T1a (от 0,1 до 0,5) | 5 | 3,4 | 3 | 2,0 | >0,05 | 3 | 2,6 | >0,05 | - | - | |||||||||
| T1b (от 0,5 до 1,0) | 27 | 18,2 | 12 | 7,9 | <0,05 | 0,05 | 9 | 7,7 | <0,05 | 0,05 | 3 | 8,6 | >0,05 | 0,05 | 0,05 | ||||
| T1c (от 1,0 до 2,0) | 115 | 77,7 | 137 | 90,1 | <0,05 | 0,05 | 105 | 89,7 | <0,05 | 0,05 | 32 | 91,4 | <0,05 | 0,05 | 0,05 | ||||
| ВСЕГО | 148 | 100,0 | 152 | 100,0 | 117 | 100,0 | 35 | 100,0 | |||||||||||
Таблица 3
Данные о пальпируемости опухоли и лимфоузлов (в %)
| Группы больных | Т1 (размеры опухоли в наибольшем измерении, см) | Опухоль | Лимфоузлы | ||||||
| пальпируема | болезненна | пальпируемы | болезненны | ||||||
| абс.число | % | абс.число | % | абс.число | % | абс.число | % | ||
| T1N0M0 (n=148) | T1mic (<0,1) | - | - | - | - | - | - | - | - |
| T1a (от 0,1 до 0,5) | 3 | 1,3 | - | - | - | - | - | - | |
| T1b (от 0,5 до 1,0) | 21 | 14,1 | - | - | - | - | - | - | |
| T1c (от 1,0 до 2,0) | 115 | 80,9 | 3 | 2 | - | - | - | - | |
| T1N1-3M0-1 (n=152) | T1a (от 0,1 до 0,5) | 2 | 1,3 | - | - | 2 | 1,3 | - | - |
| T1b (от 0,5 до 1,0) | 11 | 7,2 | - | - | 12 | 7,9 | 1 | 0,6 | |
| T1c (от 1,0 до 2,0) | 137 | 90,1 | 5 | 3,2 | 132 | 86,8 | 3 | 1,9 | |
| T1N1-3M0 (n=117) | T1mic (<0,1) | - | - | - | - | - | - | - | - |
| T1a (от 0,1 до 0,5) | 2 | 1,7 | - | - | 2 | 1,7 | - | - | |
| T1b (от 0,5 до 1,0) | 9 | 7,6 | - | - | 9 | 7,6 | 1 | 0,8 | |
| T1c (от 1,0 до 2,0) | 105 | 89,7 | 4 | 3,4 | 101 | 86,3 | 2 | 1,7 | |
| T1N1-3M1 (n=35) | T1mic (<0,1) | - | - | - | - | - | - | - | - |
| T1a (от 0,1 до 0,5) | - | - | - | - | - | - | - | - | |
| T1b (от 0,5 до 1,0) | 2 | 5,7 | - | - | 3 | 8,5 | - | - | |
| T1c (от 1,0 до 2,0) | 32 | 91,4 | 1 | 2,8 | 31 | 88,6 | 1 | 2,8 | |
Таблица 4
Гистологические формы первичной опухоли у больных раком молочной железы с величиной опухоли Т1
| Гистологи-ческие формы рака | Группы больных | |||||||||||||||||||
| I | II | |||||||||||||||||||
| T1N0M0 | T1N1-3M0-1 | T1N1-3M0 | T1N1-3M1 | |||||||||||||||||
| абс. число | % | абс. число | % | р | р2 | р2c | абс. число | % | р | р2 > | р2c > | абс. число | % | р | р2 < | р2c < | р1 | p12 | p12c | |
| Дольковый | 12 | 8,1 | 18 | 11,8 | >0,05 | >0,05 | <0,05 | 15 | 12,8 | >0,05 | 0,05 | 0,05 | 3 | 8,6 | >0,05 | 0,05 | >0,05 | <0,05 | ||
| Инфильтра-тивный протоковый | 117 | 79,1 | 103 | 67,8 | <0,05 | <0,05 | 85 | 72,6 | >0,05 | 0,05 | 18 | 51,4 | <0,05 | 0,05 | <0,05 | <0,05 | ||||
| Аденокар-цинома | 15 | 10,1 | 16 | 10,5 | >0,05 | >0,05 | 7 | 6,0 | >0,05 | 0,05 | 9 | 25,7 | <0,05 | <0,05 | ||||||
| Солидный | 4 | 2,7 | 15 | 9,9 | <0,05 | <0,05 | 10 | 8,5 | <0,05 | 0,05 | 5 | 14,3 | >0,05 | >0,05 | ||||||
| ВСЕГО | 148 | 100,0 | 152 | 100,0 | 117 | 100,0 | 35 | 100,0 | ||||||||||||
Существенной взаимосвязи раннего метастатического рака молочной железы (T1N1-3M0-1) с локализацией опухоли, соотношением размеров ее, перитуморальной инвазией сосудов и степенью дифференцировки не выявлено (табл. 5, 6).
Таблица 5
Наличие перитуморальной инвазии сосудов у больных раком молочной железы с величиной опухоли Т1
| Группа больных | Распространенность опухоли | Абс. число | % | |
| I | T1N0M0 | 18 | 12,2 | |
| II | T1N1-3M0-1 P P 2 | 23 | 15,1 >0,05 >0,05 | |
| T1N1-3M0 P P 2 | 15 | 12,5 >0,05 >0,05 | ||
| T1N1-3M1 P P 2 P1 P1 2 | 8 | 22,9 >0,05 >0,05 >0,05 >0,05 | ||
У больных ранним метастатическим раком молочной железы (T1N1-3M0-1), по сравнению с пациентами с опухолью T1N0M0, не выявлены особенности по показаниям ЭРПР и Ki-67 (табл.7,8).
Медико-биологическими особенностями раннего метастатического рака молочной железы (T1N1-3M0-1), по сравнению с опухолью T1N0M0, являются: большая выявляемость рецепторов HER2/neu 2+ на 18,6% (p<0,05), HER2/neu 3+ – на 24,6% (p<0,05), более частая положительная реакция на VEGF рецепторы (на 34,1%; p<0,05) (табл.9,10). У больных раком молочной железы T1N1-3M1, по сравнению с пациентами с опухолью T1N1-3M0, рецепторы HER2/neu 3+ отмечены чаще на 31% (p<0,05), а рецепторы VEGF – на 15% (p<0,05).
Таблица 6
Степень дифференцировки опухоли у больных раком молочной железы с величиной опухоли Т1
| Степень дифференцировки | Группы больных | |||||||||||||||||||
| I | II | |||||||||||||||||||
| T1N0M0 | T1N1-3M0-1 | T1N1-3M0 | T1N1-3M1 | |||||||||||||||||
| абс. число | % | абс число | % | р> | p2> | P2c> | абсчисло | % | р> | P2> | p2c> | абсчисло | % | Р | p2> | p2c> | р1> | p12> | P12c> | |
| G1 | 17 | 16,5 | 19 | 17,1 | 0,05 | 0,05 | 0,05 | 18 | 20,5 | 0,05 | 0,05 | 0,05 | 1 | 4,3 | <0,05 | 0,05 | 0,05 | 0,05 | ||
| G2 | 29 | 28,2 | 22 | 19,8 | 0,05 | 0,05 | 17 | 19,3 | 0,05 | 0,05 | 5 | 21,7 | >0,05 | 0,05 | ||||||
| G3 | 57 | 55,3 | 70 | 63,1 | 0,05 | 0,05 | 53 | 60,2 | 0,05 | 0,05 | 17 | 73,9 | >0,05 | 0,05 | 0,05 | 0,05 | ||||
| ВСЕГО | 103 | 100,0 | 111 | 100,0 | 88 | 100,0 | 23 | 100,0 | ||||||||||||
Таблица 7
ЭР и ПР рецепторы у больных раком молочной железы с величиной опухоли Т1
| ЭРПР рецепторы | Группы больных | |||||||||||||||||||
| I | II | |||||||||||||||||||
| T1N0M0 | T1N1-3M0-1 | T1N1-3M0 | T1N1-3M1 | |||||||||||||||||
| абс. число | % | абс. число | % | р > | p2 > | p2c > | абс. число | % | р > | p2 > | p2c > | абс. число | % | р > | p2 > | p2c > | р1 > | p12 > | p12c > | |
| ЭР+ПР+ | 47 | 37,0 | 49 | 35,5 | 0,05 | 0,05 | 0,05 | 38 | 35,5 | 0,05 | 0,05 | 0,05 | 11 | 35,5 | 0,05 | 0,05 | 0,05 | 0,05 | 0,05 | 0,05 |
| ЭР-ПР- | 38 | 29,9 | 59 | 42,8 | 0,05 | 0,05 | 43 | 40,2 | 0,05 | 0,05 | 16 | 51,6 | 0,05 | 0,05 | 0,05 | 0,05 | ||||
| ЭР-ПР+ | 25 | 19,7 | 18 | 13,0 | 0,05 | 0,05 | 16 | 15,0 | 0,05 | 0,05 | 2 | 6,4 | 0,05 | 0,05 | 0,05 | 0,05 | ||||
| ЭР+ПР- | 17 | 13,4 | 12 | 8,7 | 0,05 | 0,05 | 10 | 9,3 | 0,05 | 0,05 | 2 | 6,4 | 0,05 | 0,05 | 0,05 | 0,05 | ||||
| ВСЕГО | 127 | 100,0 | 138 | 100,0 | 107 | 100,0 | 31 | 100,0 | ||||||||||||
Таблица 8
Показатели Ki-67 у больных раком молочной железы с величиной опухоли Т1
| Показатели Ki-67 (%) | Группы больных | |||||||||||||||||||
| I | II | |||||||||||||||||||
| T1N0M0 (n=148) | T1N1-3M0-1 (n=152) | T1N1-3M0 (n=117) | T1N1-3M1 (n=35) | |||||||||||||||||
| абс. число | % | абс. число | % | р | p2 | p2c > | абс. число | % | р> | p2> | p2c> | абс. число | % | Р | p2 | p2c > | р1 > | p12 > | p12c > | |
| 0-25 | 7 | 21,2 | 6 | 12,0 | >0,05 | >0,05 | 0,05 | 5 | 15,2 | 0,05 | 0,05 | 0,05 | 1 | 5,9 | >0,05 | >0,05 | 0,05 | 0,05 | 0,05 | 0,05 |
| 26-50 | 9 | 27,2 | 5 | 10,0 | <0,05 | <0,05 | 3 | 9,1 | 0,05 | 0,05 | 2 | 11,8 | <0,05 | <0,05 | 0,05 | 0,05 | ||||
| 51-75 | 12 | 36,3 | 27 | 54,0 | >0,05 | >0,05 | 18 | 54,4 | 0,05 | 0,05 | 9 | 52,9 | <0,05 | >0,05 | 0,05 | 0,05 | ||||
| 76-100 | 5 | 15,2 | 12 | 24,0 | >0,05 | >0,05 | 7 | 21,2 | 0,05 | 0,05 | 5 | 29,4 | >0,05 | >0,05 | 0,05 | 0,05 | ||||
| ВСЕГО | 33 | 100,0 | 50 | 100,0 | 33 | 100,0 | 17 | 100,0 | ||||||||||||
Таблица 9
HER2/neu рецепторы у больных раком молочной железы с величиной опухоли Т1
| HER2/neu рецепторы | Группы больных | |||||||||||||||||||
| I | II | |||||||||||||||||||
| T1N0M0 (n=148) | T1N1-3M0-1 (n=152) | T1N1-3M0 (n=117) | T1N1-3M1 (n=35) | |||||||||||||||||
| абс. число | % | абс. число | % | р < | p2 | p2c > | абс. число | % | р | p2 | p2c > | абс. число | % | р | p 2 | p2c > | р1 | p12 > | p12c < | |
| Отрицатель-ные | 56 | 48,6 | 23 | 16,7 | 0,05 | >0,05 | 0,05 | 17 | 15,7 | <0,05 | >0,05 | 0,05 | 6 | 20 | <0,05 | <0,05 | 0,05 | >0,05 | 0,05 | 0,05 |
| 1+ | 34 | 29,6 | 25 | 18,2 | 0,05 | <0,05 | 23 | 21,2 | >0,05 | >0,05 | 3 | 10 | <0,05 | <0,05 | >0,05 | 0,05 | ||||
| 2+ | 8 | 6,9 | 35 | 25,5 | 0,05 | >0,05 | 33 | 30,5 | <0,05 | >0,05 | 2 | 6,6 | >0,05 | >0,05 | <0,05 | 0,05 | ||||
| 3+ | 17 | 14,8 | 54 | 39,4 | 0,05 | >0,05 | 35 | 32,4 | <0,05 | <0,05 | 19 | 63,4 | <0,05 | >0,05 | <0,05 | 0,05 | ||||
| ВСЕГО | 115 | 100,0 | 137 | 100,0 | 108 | 100,0 | 30 | 100,0 | ||||||||||||
Таблица 10
VEGF рецепторы у больных раком молочной железы с величиной опухоли Т1
| VEGF рецепторы | Группы больных | |||||||||||||||||||
| I | II | |||||||||||||||||||
| T1N0M0 (n=148) | T1N1-3M0-1 (n=152) | T1N1-3M0 (n=117) | T1N1-3M1 (n=35) | |||||||||||||||||
| абс. число | % | абс. число | % | р< | p2> | p2c > | абс. число | % | р< | p2 > | p2c > | абс. число | % | р< | p2 > | p2c > | р1 < | p12 | p12c > | |
| Отрицательный | 32 | 56,2 | 26 | 22,1 | 0,001 | 0,05 | 0,05 | 22 | 26,5 | 0,01 | 0,05 | 0,05 | 4 | 11,4 | 0,001 | 0,05 | 0,05 | 0,05 | >0,05 | 0,05 |
| Положительный | 25 | 43,8 | 92 | 77,9 | 0,001 | 0,05 | 61 | 73,5 | 0,01 | 0,05 | 31 | 88,6 | 0,001 | 0,05 | 0,05 | <0,05 | ||||
| ВСЕГО | 57 | 100,0 | 118 | 100,0 | 83 | 100,0 | 35 | 100,0 | ||||||||||||
Лечение рака молочной железы с наибольшим размером первичной опухоли Т1.
Лечение пациенток проводилось в зависимости от стадии заболевания, у больных применялись различные схемы лечения. План лечения составлялся с учётом локализации опухоли, возраста пациентки, сопутствующих заболеваний, общего состояния больной.
Радикальная секторальная резекция выполнена у 33 (22,3%) пациенток I группы и у 8 (5,2%) II группы (табл. 11, 12). Радикальная мастэктомия по Маддену выполнена у 86 (58,2%) пациенток I группы и у 85 (55,9%) пациенток II группы. Радикальная мастэктомия по Пейти у 29 (19,5%) пациенток I группы и у 16 (10,5%) пациенток II группы.
Лучевая терапия выполнена у 116 (78,3%) пациенток I группы и у 109 (71,7%) – II группы.
Адъювантная системная терапия в I группе проводилась у 100 (67,5%) больных, во II группе – у 109 (71,7%).
Адъювантную химиотерапию проводили с использованием схемы FAC. Обычно химиотерапия проводилась на 20-28-е сутки после операции. У 91 (61,4%) пациенток I группы и 91(59,8%) пациенток II группы проведено по 6 курсов FАС. У 9 (6,1 %) пациенток I группы и 18(11,8%) пациенток II группы с HER2 /neu 3+ использовали схему TAD (таксотер 75 мг/м2 + доксорубицин 50 мг/м2, 1 день, каждый 21 день, 6 курсов). По окончанию курсов химиотерапии, пациентки получали герцептин по 6 мг/кг (первое введение 8 мг/кг) 1 раз в 3 недели или 2 мг/кг (первое введение 4 мг/кг) еженедельно.
При неоадъювантной химиотерапии также использовали схему FАС. Как правило, проводили 3-4 цикла, затем проводили операцию. В послеоперационном периоде пациентки получали 6 циклов FAC.
Химиотерапия раннего метастатического рака молочной железы (T1N1-3M1) у 35 пациенток проведена по схемам TAD, Nav/Dox FАС, PA.
Таблица 11
Схемы лечения I группы больных
| Схемы лечения | Распространение рака | |||||||||
| I группа | TisN0M0 | T1аN0M0 | T1бN0M0 | T1сN0M0-1 | ||||||
| абс. число | % | абс. число | % | абс. число | % | абс. число | % | абс. число | % | |
| Хирургический в том числе: - РСР - РМЭ | 148 33 115 | 100,0 22,3 77,7 | 1 1 - | 0,67 0,67 | 5 1 4 | 3,3 0,67 2,7 | 27 5 22 | 18,2 3,4 14,8 | 115 26 89 | 77,7 17,5 60,1 |
| Лучевая терапия | 116 | 78,3 | - | 1 | 0,67 | 13 | 7,6 | 100 | 67,5 | |
| Адъювантная химиотерапия | 100 | 67,5 | - | - | 3 | 2 | 97 | 65,5 | ||
| ВСЕГО | 148 | 100,0 | 1 | 0,67 | 5 | 3,3 | 27 | 18,2 | 115 | 77,7 |
РМЭ – радикальная мастэктомия
РСР – органосохраняющая операция – радикальная секторальная резекция
Таблица 12
Схемы лечения пациенток 2 группы
| Схемы лечения | Распространение рака | |||||||||
| II группа | Т1N1М0 (IIA) | Т1N2М0 (IIIA) | Т1N3М0 (IIIС) | Т1N1-3М1 (IV) | ||||||
| абс. число | % | абс. число | % | абс. число | % | абс. число | % | абс. число | % | |
| Хирургический в том числе: - РСР - РМЭ | 109 8 101 | 71,7 5,2 66,4 | 78 5 73 | 51,3 3,2 48,1 | 23 2 21 | 15,1 1,3 13,8 | 5 - 5 | 3,2 3,2 | 3 1 2 | 2,0 0,6 1,3 |
| Неоадъювантная химиотерапия | 23 | 15,1 | 2 | 1,3 | 13 | 8,6 | 5 | 3,2 | 3 | 2,0 |
| Адъювантная терапия | 109 | 71,7 | 78 | 51,3 | 23 | 15,1 | 5 | 3,2 | 3 | 2,0 |
| Лучевая терапия | 109 | 71,7 | 78 | 51,3 | 23 | 15,1 | 5 | 3,2 | 3 | 2,0 |
| Химиолучевая терапия | 35 | 23,0 | - | - | - | - | 11 | 7,2 | 24 | 15,7 |
| Химиотерапия | 8 | 5,2 | - | - | - | - | - | - | 8 | 5,2 |
| ВСЕГО | 152 | 100 | 78 | 51,3 | 23 | 15,1 | 16 | 10,5 | 35 | 23,0 |
Химиотерапия метастатического рака молочной железы 1 линии проведена у 35 (21,1%) больных 2 подгруппы II группы (T1N1-3M1), у 37 (25%) пациенток I группы (T1N0M0) и у 70 (46%) пациенток 1 подгруппы II группы T1N1-3M0, у которых возникли метастазы после проведенного ранее лечения. Химиотерапия проводилась по схемам: таксотер и доксорубицин (TAD – группа А, 37 больных), навельбин и доксорубицин (Nav/Dox – группа Б, 30 больных), циклофосфан, доксорубицин, 5-фторурацил (FАС – группа К, 40 пациентов), паклитаксел и доксорубицин (PA – группа В, 35 больных). Кроме того, 10 пациенток группы TAD с HER 2 /neu 3+и VEGF+ параллельно получали Авастин в дозе 10 мг/кг 1 раз в 3 недели. После окончания курсов химиотерапии пациентки получали авастин в прежней дозе и герцептин 6 мг/кг 1 раз в 3 недели (первое введение 8 мг/кг).
В исследование были включены 142 пациентки, распределенные в четыре группы. Отбор пациенток при формировании групп осуществлялся согласно стандартным клиническим и лабораторным критериям.
Среди 40 больных раком молочной железы, получавших химиотерапию по схеме FAC(К), в 7 (17,5%) случаях были метастазы в кожу, в 20 (50,0%) – в периферические лимфоузлы, в 20 (50,0%) – в легкие, в 25 (62,5%) – в печень, в 2 (5,0%) – в мягкие ткани, в 14 (35,0%) – в кости, головной мозг 1 (2,5%).
У 37 больных раком молочной железы, получавших химиотерапию по схеме TAD(А), в 7 (18,9%) случаях были метастазы в кожу, в 17 (45,9%) – в периферические лимфоузлы, в 16 (43,2%) – в легкие, в 22 (59,4%) – в печень, в 2 (5,4%) – в мягкие ткани, в 10 (27%) – в кости, головной мозг 1 (2,7%).
Среди 30 больных раком молочной железы, получавших химиотерапию по схеме Nav/Dox(Б), в 5 (16,6%) случаях были метастазы в кожу, в 14 (46,6%) – в периферические лимфоузлы, в 15 (50,0%) – в легкие, в 15 (50,0%) – в печень, в 3 (10,0%) – в мягкие ткани, в 7 (23,3%) – в кости.
У 35 больных, получавших химиотерапию по схеме РА(В), в 7 (20,0%) случаях были метастазы в кожу, в 11 (31,4%) – в периферические узлы, в 17 (48,5%) – в легкие, в 15 (42,8%) – в печень, в 2 (5,7%) – в мягкие ткани, в 8 (22,8%) – в кости и 1 (2,8%) – головной мозг.
Статистически значимых различий в частоте метастазов в отдельные органы между группами, в зависимости от примененных схем химиотерапии не выявлено.
Анализ эффективности терапии показал, что в группе К (FAC) общий эффект составил 37,5%, полная ремиссия – 10%,частичная ремиссия – 27,5%, стабилизация процесса отмечена у 37,5% больных, прогрессирование процесса – 25% больных (табл. 13).
В группе А (группа TAD) общий эффект составил 64,8%, полная ремиссия отмечена у 29,7% больных, частичная ремиссия – у 35,1%.
При сравнении клинического эффекта в группах TAD и FAC отмечались статистически значимые различия. Частота общего и полного эффектов в группе (TAD) была больше.
В группе больных Б (Nav/Dox) общий эффект составил 60,0%, полная ремиссия наблюдалась у 23,3% больных, частичная – у 36,6%, стабилизация опухолевого процесса – у 23,3%, прогрессирование его – у 16,6%. При сравнении клинического эффекта в группах Nav/Dox и FAC не отмечалось статистически значимой разницы. При сравнении показателей эффективности в группах Nav/DOX и TAD статистически значимых различий не отмечено.
В группе больных В (PA) общий эффект составил 62,8%, полная ремиссия наблюдалась у 28,5%, частичная – у 34,2% больных, стабилизация опухолевого процесса – у 17,2%, прогрессирование его – у 20,0%. При сравнении клинического эффекта в группах PA (В) и FAC (К) отмечались статистически значимые различия – частота общего и полного эффектов в группе В была больше.
Таблица 13
Сравнительная оценка клинического эффекта в исследуемых группах
| Оценка клинического эффекта | TAD(А) N=37 | FAC(К) n=40 | Nav/Dox(Б) n=30 | PA(В) n=35 | ||||||||||
| абс. число | % | Рс-1 | абс. число | % | абс. Число | % | Рс-2 | Р1-2 | абс. Число | % | Рс- | Р1-33 | Р2-3 | |
| ОЭ | 24 | 64,8 | <0,02 | 15 | 37,5 | 18 | 60 | >0,1 | >0,5 | 22 | 62,8 | <0,2 | >0,5 | >0,5 |
| ПР | 11 | 29,7 | <0,02 | 4 | 10 | 7 | 23,3 | >0,1 | >0,5 | 10 | 28,5 | <0,02 | >0,5 | >0,5 |
| ЧР | 13 | 35,1 | >0,5 | 11 | 27,5 | 11 | 36,6 | >0,5 | >0,5 | 12 | 34,2 | >0,5 | >0,5 | >0,5 |
| СП | 7 | 18,9 | <0,02 | 15 | 37,5 | 7 | 23,3 | >0,5 | >0,25 | 6 | 17,2 | >0,05 | >0,5 | >0,5 |
| ПП | 6 | 16,2 | >0,25 | 10 | 25 | 5 | 16,6 | >0,25 | >0,5 | 7 | 20 | >0,5 | >0,5 | >0,5 |
Частота стабилизации опухолевого процесса в группе FAC была статистически больше, чем в группе PA. Различия показателей эффективности химиотерапии между группой PA и группами TAD и Nav/Dox были статистически недостоверны.
Сравнение эффективности различных схем химиотерапии в отношении различных метастазов выявило следующие различия (табл. 14). В группе FAC общий эффект при метастазах в кожу составил 28,5%, (ПР – 0%), в периферические лимфоузлы – 50,0% (ПР – 15,0%), в печень – 56,0% (ПР – 32,0%). Метастазы в легкие оказались чувствительными к лечению в 45,0%, при этом полный эффект отмечен в 20,0%. Наименьшую чувствительность к лечению имели метастазы в мягкие ткани. При костных метастазах общий эффект составил 21,4% (ПР – 0%). Наибольший эффект терапии отмечен на опухоль в самой молочной железе – 78,5% (ПР – 28,5%).
В группе TAD наибольший эффект достигнут при метастазах в лимфоузлы – 70,5% (ПР – 41,1%). Высокий эффект отмечен в самой опухоли молочной железы – 71,4% (ПР – 42,8%), метастазах в легкие – 75% (ПР – 43,7%), печень – 50,0% (ПР – 36,3%), кожу – 57,1% (ПР – 28,6%). Малочувствительными к терапии оказались метастазы в кости – 10% (ПР – 0%). При сравнении клинического эффекта в группах TAD и FAC отмечались статистически значимые различия в частоте общего и полного эффектов при метастазах в кожу, в кости. Метастазы в кожу были более чувствительны к схеме TAD, а в кости – к схеме FAC.
В группе Nav/Dox наибольший эффект терапии достигнут при метастазах в лимфоузлы – 71,4% (ПР – 54,5%). Высокий эффект отмечен в самой опухоли молочной железы – 60,0% (ПР – 40,0%), метастазах в легкие – 46,6% (ПР – 20,0%), печень – 53,3% (ПР – 33,3%), кожу – 60,0% (ПР – 20,0%). Малочувствительными к терапии оказались метастазы в кости – 14,2% (ПР-0%). При сравнении клинического эффекта в группах Nav/Dox и FAC отмечались статистически значимые превышения частоты общего и полного эффектов при метастазах в кожу и в мягкие ткани.
Таблица 14
Сравнительная оценка клинического эффекта в исследуемых группах
| Локализация метастазов | Эффек-тивность | Группы больных в зависимости от схемы химиотерапии | |||||||||||||
| FAС (К); n=40 | TAD(А) n=37 | Nav/Dox(Б); n=30 | PA(В); n=35 | ||||||||||||
| абс. число | % | Абс. Число | % | РК-А | абс. число | % | РК-Б | РА-Б | абс. число | % | РК-В | РА-В | РБ-В > | ||
| Кожа | ОЭ | 2 | 28,5 | 4 | 57,1 | <0,05 | 3 | 60,0 | <0,05 | >0,5 | 3 | 42,8 | >0,05 | >0,5 | 0,5 |
| ПЭ | - | - | 2 | 28,6 | 1 | 20,0 | 1 | 14,2 | |||||||
| Лимфоузлы | ОЭ | 10 | 50,0 | 12 | 70,5 | >0,25 | 10 | 71,4 | >0,25 | >0,5 | 6 | 54,5 | >0,5 | >0,5 | 0,5 |
| ПЭ | 3 | 15,0 | 7 | 41,1 | 6 | 54,5 | 2 | 18,1 | |||||||
| Легкие | ОЭ | 9 | 45,0 | 12 | 75,0 | >0,5 | 7 | 46,6 | >0,5 | >0,5 | 11 | 64,7 | >0,25 | >0,5 | 0,5 |
| ПЭ | 4 | 20,0 | 7 | 43,7 | 3 | 20,0 | 6 | 35,2 | |||||||
| Печень | ОЭ | 14 | 56,0 | 11 | 50,0 | >0,5 | 8 | 53,3 | >0,5 | >0,5 | 9 | 60,0 | >0,5 | >0,5 | 0,5 |
| ПЭ | 8 | 32,0 | 8 | 36,3 | 5 | 33,3 | 5 | 33,3 | |||||||
| Мягкие ткани | ОЭ | - | - | - | - | >0,5 | 1 | 33,3 | <0,05 | <0,05 | 1 | 50,0 | <0,05 | <0,05 | 0,5 |
| ПЭ | - | - | - | - | 0 | 0 | - | - | |||||||
| Кости | ОЭ | 3 | 21,4 | 1 | 10 | <0,05 | 1 | 14,2 | >0,05 | >0,5 | 1 | 12,5 | >0,5 | >0,5 | 0,5 |
| ПЭ | - | - | - | - | - | - | - | - | |||||||
| Молочная железа | ОЭ | 11 | 78,5 | 5 | 71,4 | >0,5 | 3 | 60,0 | >0,25 | >0,5 | 7 | 77,7 | >0,5 | >0,5 | 0,5 |
| ПЭ | 4 | 28,5 | 3 | 42,8 | 2 | 40,0 | 4 | 57,1 | |||||||
| Головной мозг | ОЭ | 1 | 100,0 | 1 | 100,0 | 1 | |||||||||
| ПЭ | - | - | - | - | - | ||||||||||
В группе Nav/Dox по сравнению с группой TAD определялось статистически значимое превышение эффективности воздействия на метастазы в мягкие ткани.
В группе PA наибольший эффект терапии достигнут в опухоли молочной железы – 77,7% (ПР – 57,1%) Высокий эффект наблюдался при метастазах в легкие – 64,7% (ПР – 35,2%), печень – 60,0% (ПР – 33,3%), кожу – 42,8% (ПР –14,2%), лимфоузлы – 54,5 (ПР – 18,1%), мягкие ткани – 50,0% (ПР – 0%). Невысокую чувствительность к терапии имели метастазы в кости – 12,5% (ПР – 0%). При сравнении клинического эффекта в группах PA и FAC, а также TAD, отмечались статистически значимые различия в частоте общего эффекта при метастазах в мягкие ткани. Он был выше в группе PA. Разницы в эффективности групп PA и Nav/Dox не отмечено.
Полная и частичная ремиссия в группе TAD отмечена у 24 (64,8%) из 37 (100%) пациенток. Медиана длительности ремиссии в группе TAD – 15,5 мес.
Медиана длительности ремиссии в группе FAC у 15 (37,5%) больных составила 10 месяцев.
Полная и частичная ремиссия в группе Nav/Doх отмечена у 18 (60%) больных. Медиана длительности ремиссии у них составила 14 месяцев.
Полная и частичная ремиссия в группе РА отмечена у 22 (62,8%) больных. Медиана длительности ремиссии у них составила 14 месяцев. Длительность ремиссии во всех группах больных с различными схемами химиотерапии (FAC, TAD, Nav/Dox, PA) была примерно одинаковой (рис. 1).
Для коррекции анемии у больных метастатическим раком молочной железы, получавших в качестве химиотерапии первой линии комбинацию FAC, дополнительно был назначен Рекормон – рекомбинантный человеческий эритропоэтин (патент на изобретение №2314122). Рекормон в дозе 10000 МЕ вводился подкожно за сутки до начала химиотерапии, затем введения повторялись в той же дозе еженедельно в течение 6 недель.

Рис. 1. Длительность ремиссии у пациенток, получавших лечение по схемам TAD, FAC, Nav/Dox, PA
Оценка влияния рекормона на динамику уровня гемоглобина при химиотерапии по схеме FAC у больных раком молочной железы осуществлена путем сравнения двух групп больных. В первой из них (основной), включавшей 17 пациенток, был применен рекормон, а у 23 пациенток (группа сравнения) – он не применялся. Установлено, что исходные параметры гемоглобина в двух группах были одинаковыми, однако после лечения число больных с уровнем гемоглобина 120 г/л и выше в основной группе было больше на 38,4% (р<0,05), чем в группе сравнения. Кроме того, в группе сравнения у 26,1% больных уровень гемоглобина был ниже 100г/л, что не наблюдалось в основной группе. Все это свидетельствует об эффективности рекормона в профилактике анемии у больных раком молочной железы, при проведении химиотерапии.
Отдаленные результаты лечения больных ранним метастатическим раком молочной железы с опухолью Т1
Рецидивы рака в самой молочной железе возникли у 7 (4,7%) из 148 больных I группы и у 4 (3,4%) из 152 пациентов 2 группы (p>0,1). Среди больных раком молочной железы с Т1N1-3M0 рецидивы опухоли возникли в 3,4% случаев.
Метастазы в лимфоузлы были отмечены у 10 (6,8%) больных 1 группы и у 52 (34,2%) пациентов 2 группы (p<0,05). У больных с раком T1N1-3M0 метастазы в лимфоузлы обнаружены у 38 (32,4%), а у больных с раком молочной железы T1N1-3M1 метастазы в лимфоузлы после проведенного лечения определялись в 14 (40%) случаях (p<0,05); (табл. 15).
Статистически значимые различия в частоте появления метастазов в отдаленные органы между 1 и 2 группами больных были выявлены при метастазах в легкие (16,8% и 28,3%, p <0,05), в печень (20,3% и 30,9%; p<0,05).
При локализации их в коже (6,1% и 11,2%; p>0,1), в мягких тканях (2,7% и 4,6%; p>0,5), в костях (14,2% и 11,8%; p>0,5), в головном мозге (0,7% и 1,3%; p>0,5) статистически значимых различий не отмечено (табл. 15).
Не отмечено также статистически значимой разницы в частоте метастазов в кожу, легкие, мягкие ткани, кости у больных раком молочной железы с T1N1-3M0 и T1N1-3M1. У больных раком молочной железы с T1N1-3M1 метастазы в печень выявлялись чаще на 34,0% (p<0,005), чем при раке T1N1-3M0.
У больных раком молочной железы T1N1-3M0 уже через 1 год после лечения число больных без метастазов опухоли, по сравнению с больными раком молочной железы T1N0M0, было меньше на 18,5% (р<0,001), (рис. 2). Это различие между группами в дальнейшем возрастало, достигнув максимума к 4,5 годам после лечения, когда оно составило 85,1% (р<0,05), а затем стало уменьшаться и достигло к 8-ми годам после лечения 15,8% (р<0,05).
Таблица 15
Локализация метастазов у больных раком молочной железы с величиной опухоли Т1
| Локализация отдаленных метастазов | Группы больных | |||||||||||||||||||
| I | II | |||||||||||||||||||
| T1N0M0 (n=148) | T1N1-3M0-1 (n=152) | T1N1-3M0 (n=117) | T1N1-3M1 (n=35) | |||||||||||||||||
| абс. число | % | абс. число | % | р | px2 | px2c > | абс. число | % | р | px2 | px2c < | абс. число | % | р | px2 | px2c > | р1 | p1x2 | p1x2c > | |
| Кожа | 9 | 6,1 | 17 | 11,2 | >0,05 | >0,05 | 0,05 | 15 | 12,8 | >0,05 | >0,05 | 0,05 | 2 | 5,7 | >0,05 | >0,05 | 0,05 | >0,05 | >0,05 | 0,05 |
| Лимфоузлы | 10 | 6,8 | 52 | 34,2 | <0,05 | >0,05 | 38 | 32,4 | <0,05 | <0,05 | 14 | 40,0 | <0,05 | <0,05 | >0,05 | >0,05 | ||||
| Легкие | 25 | 16,9 | 43 | 28,3 | <0,05 | <0,05 | 31 | 26,5 | >0,05 | >0,05 | 14 | 40,0 | <0,05 | <0,05 | >0,05 | >0,05 | ||||
| Печень | 30 | 20,3 | 47 | 30,9 | <0,05 | <0,05 | 27 | 23,1 | >0,05 | >0,05 | 20 | 57,1 | <0,05 | >0,05 | <0,05 | <0,05 | ||||
| Мягкие ткани | 4 | 2,7 | 7 | 4,6 | >0,05 | >0,05 | 5 | 4,2 | >0,05 | >0,05 | 2 | 5,7 | >0,05 | >0,05 | >0,05 | >0,05 | ||||
| Кости | 21 | 14,2 | 18 | 11,8 | >0,05 | >0,05 | 11 | 9,4 | >0,05 | >0,05 | 7 | 20,0 | >0,05 | >0,05 | >0,05 | >0,05 | ||||
| Головной мозг | 1 | 0,6 | 2 | 1,3 | >0,05 | >0,05 | 2 | 1,7 | >0,05 | >0,05 | - | |||||||||

Рис. 2. Динамика частоты безрецидивного течения рака молочной железы с T1 после лечения в зависимости от показателя N
Сопоставление периодов безрецидивного течения рака молочной железы T1N0M0 в зависимости от вида лечения до 8,5 лет после лечения не выявило статистически значимых различий (рис. 3). Через 8,5 лет после комбинированного лечения не было метастазов и рецидивов у 21,1% больных, а после комплексного лечения рецидивы и метастазы были у всех больных.
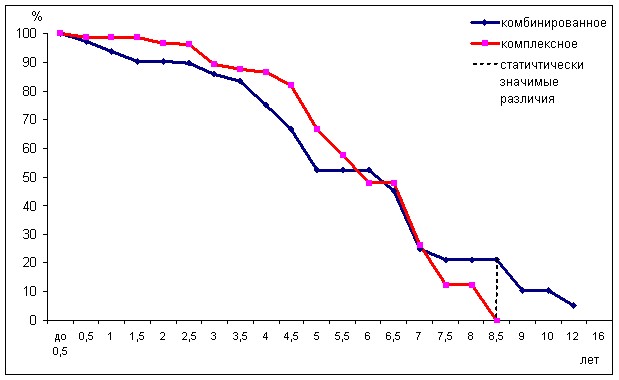
Рис. 3. Динамика частоты безрецидивного течения рака молочной железы T1N0M0 после комбинированного и комплексного лечения
Среди больных раком молочной железы T1N0M0 проведено лечение различными схемами химиотерапии с отсутствием рецепторов HER2/neu и наличием HER2/neu 1+ и 2+, и частота больных с безрецидивным течением после лечения на протяжении 7,5 лет была одинаковой, за исключением в период после 3,5 лет после лечения, когда у пациентов с HER2/neu- она была выше, чем у больных с HER2/neu1+ и 2+ на 27,2% (р<0,05), (рис. 4). У больных с HER2/neu 3+ уже к 2 годам после лечения разница с двумя другими группами составила 33,4% (р<0,002).
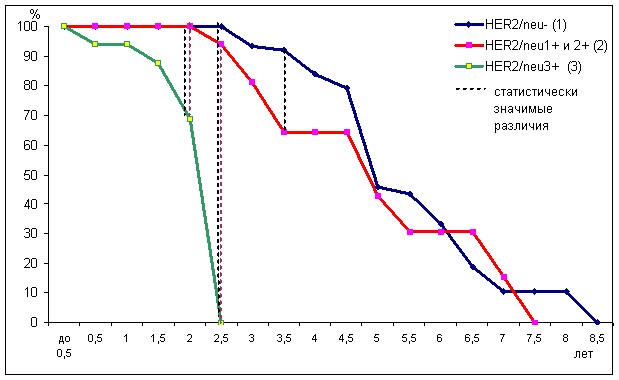
Рис. 4. Динамика частоты безрецидивного течения рака молочной железы T1N0M0 после лечения в зависимости от наличия рецепторов HER2/neu и без учета схемы химиотерапии
При применении химиотерапии по схеме FAC разницы между больными с HER2/neu3+ и пациентами HER2/neu- и HER2/neu 1+ и 2+ к 2 годам после лечения составила 66,7% (р<0,001), (рис. 5).
При применении у больных раком молочной железы T1N0M0 при наличии HER2/neu 3+ химиотерапии по схеме TAD с герцептином в течение 2-х лет ни у одного из 9 больных после лечения не были выявлены метастазы (рис. 6). В то же время при их лечении с использованием схемы FAC без рецидивов и метастазов было лишь 33,3% больных (р<0,01).

Рис. 5. Динамика безрецидивного течения рака молочной железы T1N0M0 после лечения с применением химиотерапии по схеме FAC в зависимости от наличия рецепторов HER2/neu

Рис. 6. Динамика частоты безрецидивного течения рака молочной железы T1N0M0 при наличии HER2/neu3+ после лечения в зависимости от применения схемы химиотерапии
У больных раком молочной железы T1N1-3M0 после лечения при HER2/neu- рецидивы и метастазы не выявлялись до 3,5 лет включительно (рис. 7). Не было также рецидивов и метастазов у больных с HER2/neu 1+ и 2+ до 1 года после лечения включительно. Через 1,5 года разница между этими группами больных составила 14,6% (р<0,01) и стала возрастать, достигнув к 3,5 годам 95,7% (р<0,001), а затем снизилась до 43,3% (р<0,01) к 4 году после лечения. У пациенток с наличием HER2/neu 3+ уже через полгода число больных без рецидивов и метастазов стало меньше на 12,1% (р<0,05), и к 3 годам после лечения таких больных уже не было.

Рис. 7. Динамика частоты безрецидивного течения рака молочной железы T1N1-3M0 в зависимости от наличия маркера HER2/neu и независимо от схемы химиотерапии
При комплексном лечении больных раком молочной железы T1N1-3M0 с применением химиотерапии по схеме FAC при раке с HER2/neu- в течение 3,5 лет рецидивов и метастазов не было (рис. 8).
У больных раком с HER2/neu 1+ и 2+ этот период составил 1 год. Через 1,5 года после лечения разница между этими группами составила 14,6% (р<0,01) и возросла к 3 году до 95,7% (P<0,001), а затем уменьшилась до 43,3% через 4 года после лечения.
У больных раком молочной железы с HER2/neu 3+ уже через полгода после лечения количество больных без рецидивов и метастазов уменьшилось до 73,3% (р<0,05), а к 1 году после лечения до 13,3% (р<0,001). Через 2,5 года у всех больных этой группы были рецидивы и метастазы.
Рис. 8. Динамика частоты безрецидивного течения рака молочной железы T1N1-3M0 с применением схемы химиотерапии FAC в зависимости от наличия рецепторов HER2/neu
Сопоставление безрецидивного течения рака молочной железы T1N1-3M0 при HER2/neu 3+ после комплексного лечения с применением химиотерапии со схемой FAC и TAD с герцептином показало, что во втором случае в течение 1 года у больных не было рецидивов и метастазов (рис. 9).
У 26,7% больных, получавших FAC, уже через 0,5 года после лечения были метастазы, а через 1 год они имели место у 86,7% пациентов. Через 1,5 года разница между анализируемыми группами больных составила 60,0% (р<0,001), а через 2 года – 43,3% (р<0,01).
Среди больных раком молочной железы T1N0M0 с HER2/neu- у 12 пациентов определялось отсутствие рецепторов VEGF-, а у 21 – VEGF+ (рис. 10). Сравнительная оценка течения заболевания после лечения показала, что через 4 года у пациентов с VEGF- число пациентов без метастазов было на 28,6% больше (p<0,005), чем при наличии рецепторов VEGF+.

Рис. 9. Динамика частоты безрецидивного течения рака молочной железы T1N1-3M0 при наличии HER2/neu3+ в зависимости от применения схемы химиотерапии (FAC или TAD с герцептином)

Рис. 10. Динамика частоты безрецидивного течения рака молочной железы T1N0M0 с HER2/neu- после лечения в зависимости от наличия рецепторов VEGF
Среди больных раком молочной железы T1N0M0 с HER2/neu 1+ и 2+ после лечения наблюдались 5 пациентов с VEGF- и 13 – с VEGF+ (рис. 11). В течение 1 года после лечения в обеих группах пациентов не было метастазов. Через 3,5 года после лечения число больных в группе с VEGF – стало меньше, чем в группе пациентов с VEGF+ на 52,7% (p<0,05). Эта разница между группами сохранялась до к 4,5 лет годам после лечения 52,7% (p<0,05), а затем к 5 годам уменьшилась до 25,5% (p>0,05), при этом в группе больных с VEGF+ у 8 больных были метастазы.
Рис. 11. Динамика частоты безрецидивного течения рака молочной железы T1N0M0 с HER2/neu 1+ и 2+ после лечения в зависимости от наличия рецепторов VEGF
Среди больных раком молочной железы T1N0M0 с HER2/neu 3+ после лечения у 5 пациентов наблюдались метастазы с VEGF - и 11 – с VEGF+ (рис. 12). Все 5 пациентов с раком молочной железы с VEGF- на протяжении 2-х лет наблюдения не имели метастазов, а у 1 больного с VEGF+ появились метастазы в течение полугода. Через 2 года после лечения из больных в группе с VEGF- 4 из 5 больных не имели метастазов, а среди больных VEGF+ их не было у 5 из 11 пациентов: разница в 20% была статистически незначимой (p>0,5). Эта ситуация сохранялась до 2,5 лет, включительно, после лечения.
У больных раком молочной железы с HER 2/neu3+ период безрецидивного течения не зависел от наличия рецепторов VEGF.

Рис. 12. Динамика частоты безрецидивного течения рака молочной железы T1N0M0 с HER2/neu 3+ после лечения в зависимости от наличия рецепторов VEGF
У больных раком молочной железы T1N1-3M0 с HER2/neu- продолжительность безрецидивного течения к 4,5 года после лечения зависела от наличия рецепторов VEGF. При отсутствии рецепторов VEGF не было рецидивов и метастазов у 42,9% больных (рис.13).
У больных раком молочной железы T1N1-3M0 с HER2/neu 1+ и 2+ при наличии рецепторов VEGF период безрецидивного течения меньше, чем у пациентов с отсутствием рецепторов VEGF с 1,5 лет после лечения. Разница возрастала с 23,3% (р<0,05) через 1,5 года до 91,1% (р<0,05) через 2,5 года, а затем снизилась до 22,2% (р<0,05) к 3 годам после лечения после лечения (рис.14).
У больных раком молочной железы T1N1-3M0 с HER2/neu 3+ при наличии рецепторов VEGF уровень безрецидивного течения был ниже, чем при их отсутствии к 1 году после лечения на 44,9% (р<0,05), к 1,5 годам – на 40% (р<0,05); ( рис.15).
Рис.13 Динамика частоты безрецидивного течения рака молочной железы T1N1-3M0 с HER2/neu - после лечения в зависимости от наличия рецепторов VEGF
Рис.14 Динамика частоты безрецидивного течения рака молочной железы T1N1-3M0 с HER2/neu 1+ и 2+ после лечения в зависимости от наличия рецепторов VEGF

Рис.15 Динамика частоты безрецидивного течения рака молочной железы T1N1-3M0 с HER2/neu 3+ после лечения в зависимости от наличия рецепторов VEGF
Таким образом, рак молочной железы у больных группы T1N1-3M0-1 характеризовался более частым выявлением рецепторов HER2/neu 3+ и VEGF по сравнению с пациентами I группы (T1N0M0), что повлияло на безрецидивный период. Применение комбинации таксотер и доксорубицин в сочетании с таргетной терапией (герцептин, авастин) позволило повысить эффективность лечения раннего метастатического рака молочной железы.
ВЫВОДЫ
- Для повышения эффективности лечения раннего метастатического рака молочной железы необходимо учитывать медико-биологические особенности опухолевого процесса, позволяющие своевременно обосновывать целесообразность таргетной терапии в комплексном лечении.
- Клинико-морфологически ранний метастатический рак молочной железы (Т1N1-3M0-1), по сравнению со злокачественным новообразованием T1N0M0, характеризуется относительно более частой (на 12,4%) величиной опухоли на уровне T1c за счет группы T1N1-3M0, более частой пальпацией опухоли (на 9,2%), солидной формы рака (на 7,2%). При раке молочной железы T1N1-3M1, по сравнению с опухолью T1N1-3M0, чаще (на 19,7%) встречается аденокарцинома.
- Медико-биологическими особенностями раннего метастатического рака молочной железы (T1N1-3M0-1), по сравнению с опухолью T1N0M0, являются: увеличение выявляемости рецепторов HER2/neu 2+ (на 18,6%), HER2/neu 3+ (на 24,6%), более частая положительная реакция на VEGF рецепторы (на 34,1%). У больных раком молочной железы T1N1-3M1, по сравнению с пациентами с опухолью T1N1-3M0, отмечены чаще рецепторы HER2/neu 3+ (на 31,0%), рецепторы VEGF (на 15%).
- Длительность ремиссии у больных раком молочной железы T1N1-3M0-1 при комплексном лечении с применением адъювантной химиотерапии по схемам FAC, TAD, Nav/Dox, PA примерно одинаковая.
- У больных раком молочной железы T1N0M0 прогноз неблагоприятен при регистрации высокого уровня экспрессии генов HER2/neu и VEGF.
- В алгоритм комплексного лечения раннего метастатического рака молочной железы при обнаружении экспрессии HER2/neu 1+, 2+, 3+ и VEGF целесообразно включать в неоадъювантном и адъювантном режиме полихимиотерапию (TAD, FAC) в сочетании с герцептином, авастином.
- Применение для коррекции анемии, вызванной химиотерапией первой линии по схеме FAC у больных метастатическим раком молочной железы, рекормона – рекомбинантного человеческого эритропоэтина улучшает качество жизни за счет повышения и стабилизации уровня показателей гемоглобина, способствует своевременному проведению курсов химиотерапии.
- Метастазы в кожу более чувствительны к химиотерапии по схеме TAD, а в кости – по схеме FAC.
- Применение биотерапевтических препаратов (герцептин, авастин, рекормон) в первой линии в сочетании с полихимиотерапией позволяет увеличить безрецидивный период у больных с ранним метастатическим раком молочной железы.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- В целях повышения эффективности лечения раннего (T1N0M0) неметастатического и раннего метастатического (T1N1-3M0-1) рака молочной железы необходимо у всех больных исследование в опухоли уровня экспрессии HER2/neu, VEGF, Ki67 до начала лечения.
- При экспрессии HER2/neu 1,2,3+, VEGF у таких больных рекомендовать раннее назначение таргетных лекарственных препаратов герцептин и авастин в неоадъювантном и адъювантном режимах.
- При высоком риске развития анемии, в случае применения режимов полихимиотерапии FAC и TAD, необходимо профилактическое назначение колониестимулиующего фактора роста (рекормон).
СПИСОК РАБОТ,
ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Давиденко И.С. Сравнительный анализ комбинаций интаксел+доксорубицин и CAF в первой линии терапии метастатического рака молочной железы [Текст] / И.С. Давиденко, М.В. Казанцева, О.А. Гончарова // «Российский онкологический журнал». – 2006. – №4. – С. 36-38.
- Давиденко И.С. Опыт применения комбинации препаратов таксотер и доксорубицин в терапии первой линии метастатического рака молочной железы. [Текст] / И.С. Давиденко, Е.Б. Пефти // «Российский биотерапевтический журнал». – 2007. – №3. – С. 80-82.
- Давиденко И.С. Роль бевацизумаба (авастина) в терапии метастатического рака молочной железы. [Текст] / И.С. Давиденко, Е.Б. Пефти, А.Н. Фокин // «Российский биотерапевтический журнал». – 2007. – №3. – С. 76-79.
- Давиденко И.С. Сравнительный анализ различных комбинаций в терапии первой линии метастатического рака молочной железы. [Текст] / И.С. Давиденко, Е.Б. Пефти, О.А. Гончарова, О.П. Бурдик // «Российский биотерапевтический журнал». – 2007. – №4. – С. 22-24.
- Давиденко И.С. Значение ангиогенеза в терапии первой линии метастатического рака молочной железы. [Текст] / И.С. Давиденко, Е.Б. Пефти, А.Н. Фокин // «Российский биотерапевтический журнал». – 2007. – №4. – С. 8-12.
- Шойхет Я.Н. Лечение раннего и раннего первично-диссеминированного рака молочной железы. [Текст] / Я.Н. Шойхет, А.Ф. Лазарев, И.С. Давиденко // «Российский биотерапевтический журнал». – 2008. – №3, том 7. – С. 86-89.
- Давиденко И.С. Динамика ультразвуковых исследований у больных диссеминированным раком молочной железы в ходе лечения препаратами таксотером и адриабластином. [Текст] / И.С. Давиденко, Е.А. Стрыгина // «Паллиативная медицина и реабилитация». – 1999. – №2. – С. 60.
- Давиденко И.С. Таксотер в комбинации с адриабластином в терапии первой линии у больных диссеминированным раком молочной железы с метастазами в легкие. [Текст] / И.С. Давиденко // «Паллиативная медицина и реабилитация». – 1999. – № 2. – С. 35.
- Аркадьева Т.В. Навельбин в комбинации с доксорубицином в терапии I линии у больных первично-диссеминированным и метастатическим раком молочной железы. [Текст] / Т.В. Аркадьева, И.С. Давиденко, Л.Р. Розенбаум, И.В. Поддубная // «Современная онкология». – 2000. – том 2, №2. – С. 56.
- Поддубная И.В. Фармакоэкономический анализ «стоимость – полезность» как критерий экономической обоснованности использования бюджетных средств в онкологии. [Текст] / И.В. Поддубная, Т.В. Аркадьева, И.С. Давиденко, Л.Р. Розенбаум // «Современная онкология». – 2001. – том 3, №3. – С. 114-117.
- Казанцева М.В. Анализ анемии у пациенток с метастатическим раком молочной железы, получавших комбинацию CAF в качестве 1-й линии химиотерапии. [Текст] / М.В. Казанцева, И.С. Давиденко, Т.А. Ригер, Е.М. Мамаева // Материалы Российской научно-практической конференции с международным участием – Барнаул, 2005. – С. 74-75.
- Давиденко И.С. Опыт применения Зометы у больных с костными метастазами рака молочной железы. [Текст] / И.С. Давиденко, М.В. Казанцева // Материалы VI Всероссийского съезда онкологов. – Ростов, 2005. – Том 2. – С. 296.
- Давиденко И.С. Новая комбинация первой линии метастатического рака молочной железы. [Текст] / И.С. Давиденко, М.В. Казанцева, Л.А. Мнацаканян // «Проблемы клинической медицины». – 2006. – №5. – С. 54-56.
- Казанцева М.В. Применение рекормона в терапии анемии у пациентов со злокачественными новообразованиями. [Текст] / М.В. Казанцева, И.С. Давиденко // Современные методы лечения онкологических больных: достижения и неудачи / Материалы Российской научно-практической конференции с международным участием. – Барнаул, 2006. – С. 80.
- Давиденко И.С. Сравнительный анализ различных комбинированных режимов в терапии первой линии метастатического рака молочной железы. [Текст] / И.С. Давиденко, М.В. Казанцева, О.П. Бурдик // Современные методы лечения онкологических больных: достижения и неудачи / Материалы Российской научно-практической конференции с международным участием. – Барнаул, 2006. – С. 113.
- Чурилова Л.А. Использование современных цитостатиков в решении проблемы лечения метастатического рака молочной железы. [Текст] / Л.А. Чурилова, Л.С. Скрябина, О.А. Кремлёва, С.И. Маркосян, В.Н. Кузнецова, Т.С. Фролова, О.А. Матяш, Н.Е. Бутина, А.А. Половинкин, С.Н. Евдокимов, И.С. Давиденко, А.Ф. Лазарев // Совершенствование онкологической помощи в современных условиях / Материалы Российской научно-практической конференции с международным участием. – Барнаул, 2008. – С. 245-247.
- Давиденко И.С. Лечение раннего неметастатического и раннего первично-диссеминированного рака молочной железы. [Текст] / И.С. Давиденко, Я.Н. Шойхет, А.Ф. Лазарев // Проблемы современной онкологии / Материалы Российской научно-практической конференции с международным участием. – Барнаул, 2009. – С. 207.
ПАТЕНТ
1. Патент 2314122 Российская Федерация / Способ профилактики и коррекции анемии у больных с метастатическим раком молочной железы / Лазарев А.Ф., Давиденко И.С., Казанцева М.В., Ригер Т.А.; заявители и патентообладатели Лазарев А.Ф., Давиденко И.С. – № 2005137263; заявлено 30.11.2005; опубликовано 10.01.2008.

