Использование природных соединений в каталитическом синтезе хиральных биологически активных веществ
На правах рукописи

ВОЛЧО КОНСТАНТИН ПЕТРОВИЧ
ИСПОЛЬЗОВАНИЕ ПРИРОДНЫХ СОЕДИНЕНИЙ
В КАТАЛИТИЧЕСКОМ СИНТЕЗЕ
ХИРАЛЬНЫХ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
доктора химических наук
Уфа, 2008
Работа выполнена в Новосибирском институте органической химии
им. Н. Н. Ворожцова СО РАН
Научный консультант доктор химических наук, старший научный сотрудник
Салахутдинов Нариман Фаридович
Официальные оппоненты:
доктор химических наук, профессор
Томилов Юрий Васильевич
доктор химических наук, доцент
Зибарев Андрей Викторович
доктор химических наук, доцент
Казакова Оксана Борисовна
Ведущая организация: Учреждение Российской академии наук Институт физиологически активных веществ РАН
Защита состоится «____» ____________ 2009 г. в ___ часов на заседании диссертационного совета по защите докторских и кандидатских диссертаций Д 002.062.01 при Учреждении Российской академии наук Институте нефтехимии и катализа РАН по адресу: 450075, Уфа, Проспект Октября, 141. Тел./ факс: (347) 2312750; e-mail: ink@anr b.ru
С диссертацией можно ознакомиться в библиотеке Учреждения Российской академии наук Института нефтехимии и катализа РАН
Автореферат разослан «___» __________ 200 г.

Ученый секретарь диссертационного совета
доктор химических наук, профессор Булгаков Р.Г.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Важную роль в разработке новых биологически активных соединений играют вещества, выделенные из природных источников. Достаточно упомянуть, что большая часть низкомолекулярных лекарственных средств, созданных с 1981 по 2006 гг., так или иначе связана с природными соединениями[1]. Еще одной тенденцией медицинской химии последних десятилетий является широкий переход к разработке методов получения хиральных агентов, нередко рацемические лекарственные средства рассматриваются как вещества, «содержащие 50% примесей»[2]. Быстрое развитие каталитических методов в тонкой органической химии предоставляет многочисленные новые возможности проведения направленных трансформаций органических молекул, в том числе с сохранением или индукцией хиральности. В то же время, уровень использования каталитических методов в химии природных соединений, за исключением многостадийных полных синтезов сложных природных веществ, в настоящее время явно не достаточен для полноценного использования потенциала распространенных природных соединений в медицинской химии. Актуальность диссертации обусловлена необходимостью разработки новых синтетических подходов к созданию хиральных биологически активных веществ на базе природных соединений.
Цель работы: изучение каталитических трансформаций доступных природных соединений, их производных и аналогов для получения веществ, в основном хиральных, с ценными фармакологическими свойствами.
Для достижения этой цели решались следующие задачи:
- Исследование реакционной способности кислородсодержащих оптически активных монотерпеноидов в присутствии кристаллических кислотных катализаторов. Выбор этой системы катализатор-субстрат обусловлен ранее показанной на ряде примеров способностью кристаллических кислотных катализаторов направлять реакции терпеноидов по новым неожиданным путям, что может приводить к получению потенциально полезных продуктов, труднодоступных другими способами синтеза.
- Изучение возможности проведения реакций,-ненасыщенных карбонильных соединений терпеноидного ряда, в том числе оптически активных, с СН-кислотами в присутствии кристаллических оснвных катализаторов. Хотя реакции такого типа широко используются в синтезе биологически активных соединений, до настоящего момента данные о взаимодействии терпеноидов с СН-кислотами на кристаллических оснвных катализаторах практически отсутствовали.
- Разработка методов металлокомплексного асимметрического окисления прохиральных сульфидов, интересных с точки зрения биологической активности, в том числе со значительным промышленным потенциалом, включая синтез новых лигандов, получаемых химическими трансформациями терпеноидов. Несмотря на то, что целый ряд биологически активных соединений содержит хиральную сульфоксидную группу, в настоящее время не существует универсальной каталитической системы, подходящей для асимметрического окисления различных по строению сульфидов.
- Синтез и отбор перспективных веществ, получаемых при выполнении вышеупомянутых задач, для проведения фармакологических исследований.
Научная новизна. В результате проведенного исследования обнаружен набор ранее неизвестных реакций хиральных терпеноидов, протекающих под действием кислотных кристаллических катализаторов и приводящих к образованию широкого спектра оптически активных кислородсодержащих гетероциклических соединений разнообразных структурных типов. Наблюдающаяся высокая зависимость результатов реакций от даже небольших изменений в строении субстратов или катализатора приближает некоторые из изученных превращений к биомиметическим процессам.
Для п-мента-1,8-диен-5,6-диола, у которого обнаружена высокая противосудорожная активность, разработан и успешно осуществлен стереоспецифичный синтез четырех пространственных изомеров из коммерчески доступных (+)- и (-)--пиненов. Ключевыми стадиями этих методик являются перегруппировки изомерных эпоксидов цис- и транс-вербенолов, катализируемые кислотными глинами.
Изучение превращений хиральных диэпоксидов лимонена на сульфатированной окиси циркония с варьированием количества закрепленных сульфатных групп позволило впервые обнаружить, что концентрация нанесенных кислотных центров может определять и строение, и стереохимию продуктов реакции.
Впервые показано, что кристаллические оснвные катализаторы (оснвный цеолит Сs, импрегнированный оксидами цезия, оснвная глина гидротальцит) являются эффективными гетерогенными катализаторами реакций Михаэля и Кнёвенагеля,-ненасыщенных карбонильных соединений терпеноидного ряда с СН-кислотами, при этом в зависимости от структуры субстратов, могут протекать либо реакция Михаэля, либо реакция Кнёвенагеля, либо тандемные превращения. На примере реакции 5,5,8-триметилнона-3,7-диен-2-она с малононитрилом показана возможность регулирования регио- и энантиоселективности каталитического действия цеолита Сs путем модификации его оптически активными соединениями.
Разработана новая группа гомогенных ванадий-содержащих катализаторов энантиоселективного окисления сульфидов, основанных на применении новых хиральных оснований Шиффа, получаемых из терпеноидов. Впервые разработан метод получения оптически активного омепразола с использованием каталитических количеств хирального металлсодержащего комплекса ацетилацетоната ванадила с синтезированными нами лигандами, впервые обнаружено положительное влияние добавки диизопропилэтиламина на ход ванадий-катализируемого асимметрического сульфоксидирования. Показано, что одновременное использование в катализируемом ионами титана асимметрическом металлокомплексном окислении сульфидов двух различных оптически активных лигандов позволяет получить эзомепразол, действующее вещество современного противоязвенного препарата Нексиум, с недостижимым ранее выходом. Впервые успешно осуществлен синтез оптически активных оксидов замещенного 1,2,3-бензотритиола, являющихся аналогами варацинов B и C. В ходе выполнения этой работы обнаружен новый простой путь синтеза замещенного аминобензопентатиепина.
Практическая значимость. Полученные новые данные значительно расширяют представления о реакционной способности природных соединений и их аналогов в присутствии катализаторов. Разработанные в работе методы позволяют осуществлять синтез большого количества новых веществ, в основном хиральных, многие из которых представляют интерес для изучения их фармакологической активности. Высокая практическая значимость этого исследования подтверждается обнаружением веществ с высокими противосудорожной, анксиолитической и анти-ВИЧ активностями, а также разработкой первых отечественных патентночистых методов эффективного синтеза противоязвенного препарата эзомепразола.
Апробация работы. Материалы работы представлялись на Международной конференции по природным и физиологически активным соединениям (Новосибирск, 1998, 2004), IX Международном симпозиуме по гетерогенному катализу (Varna, Bulgaria, 2000), 23-ем Международном симпозиуме ИЮПАК по химии природных соединений (Florence, Italy, 2002), Всероссийской конференции «Химия и технология растительных веществ» (Казань, 2002; Саратов, 2004; Сыктывкар, 2006; Уфа, 2008), Международной научной конференции «Химия, технология и медицинские аспекты природных соединений» (Алматы, Казахстан, 2003, 2007), Международном рабочем совещании «Происхождение и эволюция биосферы» (Новосибирск, 2005), IV Тихоокеанском азиатском конгрессе по катализу (Singapore, 2006), Всероссийской научной конференции «Современные проблемы органической химии» (Новосибирск, 2007), II Международной конференции «Происхождение и эволюция биосферы» (Loutraki, Greece, 2007), III Международной конференции «Катализ: фундаментальные положения и приложение» (Новосибирск, 2007), Всероссийской конференции «Фундаментальные науки – медицине» (Новосибирск, 2008), Всероссийской конференции «Органическая химия для медицины (Орхимед-2008)» (Черноголовка, 2008).
Публикации. По теме диссертации опубликовано 3 монографии, 25 статей, тезисы 22 докладов на конференциях, получены положительные решения по 4 заявкам на патенты.
Объем и структура работы. Диссертация изложена на 366 страницах и состоит из введения, обсуждения результатов (4 главы), экспериментальной части, выводов и списка цитируемой литературы (523 наименования). При обсуждении результатов использовано 157 схем, 38 таблиц и 50 рисунков.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Превращения оптически активных терпеноидов в присутствии кристаллических кислотных катализаторов
Кислородсодержащие производные соединений терпенового ряда представляют большой интерес с точки зрения биологической активности. Как правило, для проявления той или иной биологической активности этих соединений критическое значение имеет их абсолютная конфигурация.
Мы впервые систематически изучили внутримолекулярные превращения целого ряда хиральных кислородсодержащих производных соединений пинанового ряда на монтмориллонитовых глинах и обнаружили, что реакционная способность этих соединений на глинах, как правило, существенно отличается от их поведения в присутствии традиционных кислотных катализаторов, а образующиеся продукты являются оптически активными.

Среди наиболее интересных реакций можно отметить, например, превращения в присутствии глины эпоксидов нопола, вербенона и вербенола, чье поведение значительно отличается от их ранее[3] изученной реакционной способности в присутствии ZnBr2, что позволяет получать новые оптически активные соединения (2-5, 7, 8, 10).

В ходе изучения фармакологических свойств некоторых из полученных соединений нами обнаружено, что диол (-)-10, образующийся из эпоксида цис-вербенола в присутствии глины, сочетает низкую токсичность и выдающуюся противосудорожную активность, значительно, в десятки раз, превосходя по терапевтическому индексу применяющиеся в настоящее время противосудорожные препараты.
При проведении более крупной наработки соединения (-)-10 на глине, мы обнаружили, что в реакционной смеси, помимо ранее полученных продуктов, присутствует еще одно соединение – -гидроксиальдегид 11, образующийся с выходом 10%. Расположение метильных групп в нем очень необычно, а его образование не может быть объяснено обычным набором перегруппировок, ведущих к получению из эпоксида -пинена и его производных соединений с камфоленовым или изо-камфоленовым остовами. Один из возможных механизмов образования альдегида 11 приведен на схеме. Немаловажно, что, хотя в процессе образования соединения 11 затрагиваются почти все имеющиеся в исходной молекуле асимметрические центры, реакция протекает стереоспецифично, без снижения оптической чистоты.

В качестве исходного соединения в синтезе диола (-)-10 нами использовался коммерчески доступный (-)-вербенон с 60%-ной оптической чистотой, тогда как, с учетом значительной зависимости биологической активности терпеноидов от их абсолютной конфигурации, необходим синтез обоих энантиомеров соединения 10 для дальнейшего определения их фармакологической активности.
Энантиоспецифичный синтез (+)-вербенона мы осуществили исходя из (+)--пинена по приведенной схеме.

Дальнейший синтез (+)-диола 10 из полученного вербенона проводили в соответствии с разработанной нами методикой.

Аналогично был синтезирован и (-)-изомер соединения 10.
Получение других изомеров этого диола затрудняется малой доступностью соответствующих эпоксидов транс-вербенолов – провести эпоксидирование транс-вербенола обычными эпоксидирующими агентами не удавалось, по-видимому, из-за низкой устойчивости образующегося эпоксида в условиях окисления. Для синтеза эпоксида транс-вербенола мы разработали методику каталитического эпоксидирования транс-вербенола трет-бутилгидропероксидом в присутствии VO(acac)2, дальнейшая изомеризация полученного эпоксида привела к цис-диолу (+)-12 (выход приведен в расчете на (+)-транс-вербенол). (-)-Изомер соединения 12 был получен по этой же методике из (-)--пинена.

Таким образом, нами впервые осуществлены многостадийные стереоспецифичные синтезы четырех изомеров п-мента-1,8-диен-5,6-диола ((+)- и (-)-10, (+)- и (-)-12) с высокой оптической чистотой (ее 94-98%), исходя из коммерчески доступных (+)- и (-)--пиненов.
При сопоставлении результатов превращений полифункциональных лабильных терпеноидов в присутствии различных кристаллических кислотных катализаторов становится очевидно, что роль последних не ограничивается только ролью донора протонов, но большое значение имеют и такие особенности этих катализаторов, как наличие трехмерной структуры, определяющей характер адсорбции молекул, определенное взаимное расположение различных типов льюисовских и бренстедовских кислотных центров и т.д.
К сожалению, при проведении реакций в присутствии глин и цеолитов, имеющих многочисленные неоднородности в структуре, чрезвычайно сложно изучать влияние особенностей строения катализатора на ход превращений. Этих недостатков во многом лишены так называемые твердые суперкислоты, приготавливаемые, например, закреплением сульфатных групп на поверхности кристаллов оксидов циркония. В этом случае появляется возможность достаточно точного контроля как за кристаллической структурой исходной подложки, так и за количеством нанесенных кислотных центров. Исходя из вышесказанного, мы изучили взаимосвязь между маршрутами превращения лабильного монотерпеноида – диэпоксида лимонена, с одной стороны, и количеством нанесенных на диоксид циркония сульфатных групп (от 0.9 до 30.3%), с другой. Катализаторы с заданным количеством нанесенных кислотных центров были синтезированы и охарактеризованы в Лаборатории катализа глубокого окисления ИК СО РАН.

Очевидно, что реакция может начинаться либо с раскрытия протонированной 1,2-эпоксидной группы (путь А), либо 8,9-эпоксидной группы (путь B). Из приведенных графиков (рис. 1) видно, что при небольшом проценте сульфатирования в основном образовывались продукты, соответствующие первоначальному раскрытию 8,9-эпоксидной группы (путь B), тогда как повышение концентрации кислотных центров способствовало увеличению содержания в реакционной смеси соединений, образующихся при первоначальном раскрытии 1,2-эпоксидной группы (путь А).
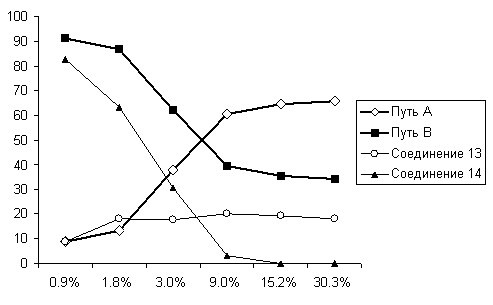
Рис. 1. Зависимость содержания продуктов от количества нанесенных кислотных центров.
Варьирование концентрации нанесенных кислотных центров оказывает существенное влияние и на стереохимическое строение продуктов. Например, соединения 13 и 14 образуются, очевидно, из близких по строению катионов C и D, отличающихся только экзо- или эндо- расположением гидроксиметиленовой группы. Тем не менее, если соединение 14 является основным продуктом при небольшом проценте сульфатирования и практически полностью исчезает из реакционной смеси при увеличении количества сульфатных групп до 9%, то трициклическое вещество 13 присутствует в заметных количествах в реакционной смеси во всем диапазоне кислотности используемых нами катализаторов.

Таким образом, нами впервые обнаружено, что варьирование только одного параметра твердой суперкислоты – концентрации нанесенных кислотных центров – приводит к изменению и предпочтительного места возникновения первоначального катионного центра в исходном полифункциональном терпеноиде, и строения образующихся продуктов.
Еще одним возможным путем получения хиральных потенциально биологически активных кислородсодержащих соединений из терпеноидов, помимо их внутримолекулярных превращений, является взаимодействие терпенов и их производных с кислородсодержащими реагентами, например, ацилирующими. Хотя ацилирование широко используется для функционализации природных соединений, взаимодействие терпеноидов с ацилирующими агентами в присутствии кристаллических кислотных катализаторов ранее исследовано не было. Мы изучили взаимодействие большого набора хиральных терпенов и их кислородсодержащих производных с ацилирующими агентами в присутствии кислотных алюмосиликатных катализаторов.

Соотношение продуктов реакций ацилирования и ацетоксилирования зависело как от строения субстрата, так и от типа агента (уксусный ангидрид или хлористый ацил), а также природы катализатора – глины или цеолита. В результате проведенной работы получен широкий набор разнообразных кислородсодержащих соединений с разными типами остовов, структуры части из них приведены на рисунке.


Нами обнаружено что, как правило, превращения развивались не только теми путями, которые наблюдались в присутствии гомогенных кислот. Часть полученных соединений не описана в литературе. Во всех случаях, исключая использование в качестве исходных камфена и его эпоксида, мы получили оптически активные продукты.
Другой интересной межмолекулярной реакцией терпеноидов является их взаимодействие с альдегидами в присутствии глин. Например, ранее было обнаружено,[4] что дипентен на глине вступает в необычную реакцию с альдегидами, ведущую к бициклическим соединениям 15, интерес к которым обусловлен недавно обнаруженной у них существенной биологической активностью в качестве агонистов эстрогеновых рецепторов - и -типа.[5] Интересные превращения протекали и при взаимодействии дипентена с салициловым альдегидом. Мы обнаружили, что проведение некоторых из этих реакций без растворителя позволяет значительно увеличить выход целевого продукта. Например, использование этого метода позволило нам повысить выход соединения 16 с ранее наблюдавшихся 28% до 73% при уменьшении времени реакции с 9 ч до 30 мин.
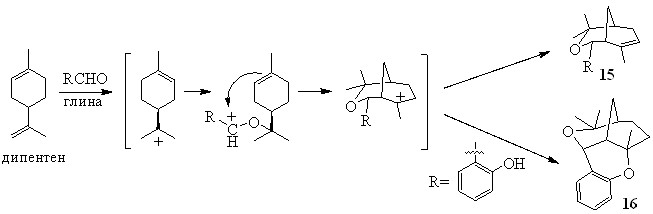
Нами показано, что взаимодействие вербенола с альдегидами в присутствии глины ведет к образованию оптически активных соединений 17 и 18, близких по строению к веществам 15 и 16, получаемым из дипентена, при этом относительное расположение гидроксильной группы в исходном вербеноле и даже ее замена на метокси-группу не оказывают влияния на направление межмолекулярных реакций. В то же время, наличие гидроксильной группы или ее эфира в положении 4 терпеноида имеет принципиальное значение в изучаемых превращениях, поскольку многие другие кислородсодержащие производные соединений пинанового ряда вообще не вступают в реакции с альдегидами на глине.


В то время, как эпоксиды многих терпеноидов (миртеналя, миртенола, пинокарвеола, нопола) не взаимодействуют с альдегидами в присутствии глины, реакции эпоксида вербенона с ароматическими и алифатическими альдегидами на глине привели к образованию оптически активных гетероциклических -дикетонов 19, находящихся в енольной форме. Взаимодействие эпоксида цис-вербенола с ароматическими альдегидами в присутствии глины также приводит к межмолекулярным продуктам, однако, они существенно отличаются по строению от продуктов реакции эпоксида цис-вербенона с этими же альдегидами, что, очевидно, объясняется различиями в механизмах превращений.

Из схемы видно, что структуры катионов, которые могут образовываться из транс- и цис-вербенолов, эпоксидов пиненов и вербенона при взаимодействии их с альдегидами на глине, очень близки к строению катиона 21, образующегося, как мы полагаем, из эпоксида цис-вербенола. Тем не менее, если в первых пяти случаях были получены исключительно продукты, соответствующие протеканию карбоциклизации на последней стадии процесса, то из эпоксида вербенола – только продукты гетероциклизации, то есть даже относительно небольшие изменения в структуре терпеноида в случае использования в качестве катализатора монтмориллонитовой глины могут привести к резкому изменению направления реакции.

При переходе от ароматических альдегидов к алифатическому кротоновому альдегиду появляется новый путь реакции. При взаимодействии эпоксида цис-вербенола с кротоновым альдегидом помимо соединения 22, являющегося аналогом соединений 20, мы получили смесь двух диастереомеров 23.

При рассмотрении возможного механизма образования этих соединений видно, что в качестве промежуточной нейтральной частицы в этой реакции может выступать диол (-)-10, и действительно, при выдерживании соединения (-)-10 на глине мы получили искомые соединения 23.
Вещества типа 20, 22 и 23 представляют большой интерес для изучения их биологической активности, поскольку могут рассматриваться как аналоги тетрагидроканабинолов.
Превращения терпеноидов в присутствии кристаллических оснвных катализаторов
Глава начинается с литературной справки, которая содержит современный обзор реакций Кнёвенагеля и Михаэля в присутствии оснвных цеолитов и родственных им мезопористых МСМ-41 материалов. Применение таких катализаторов позволило получать продукты превращений с хорошими выходами и высокой селективностью. Как правило, наибольшую каталитическую активность в реакциях Михаэля и Кнёвенагеля демонстрировали оснвные цеолиты, содержащие в своей структуре оксиды и/или кластеры щелочных или щелочно-земельных металлов. Реакция Кневенагеля изучалась, в основном, на примерах взаимодействия замещенных бензальдегидов с СН-кислотами и применялась, за редким исключением, в качестве тестовой. В то же время, в качестве субстратов в присоединении по Михаэлю, катализируемом оснвными цеолитами и МСМ-41 материалами, использовался достаточно большой набор разнообразных соединений, как доноров, так и акцепторов, что позволило получить целый ряд интересных веществ.
На настоящий момент весьма мало исследована возможность применения оснвных цеолитов и МСМ-41 материалов для проведения тандемных превращений, включающих в качестве одной из стадий реакции Кневенагеля и/или Михаэля, а реакционная способность в этих условиях природных соединений и их производных вообще не изучена.
Нашей задачей стало изучение возможности применения кристаллических оснвных катализаторов для получения новых потенциально биологически активных соединений, в том числе хиральных, из природных веществ и их аналогов.
Сотрудниками Лаборатории каталитических превращений углеводородов Института катализа СО РАН был синтезирован оснвный цеолит Cs, содержащий кластеры оксидов цезия; гидротальциты (слоистые оснвные минералы) получены нами из оксидов магния и алюминия в соответствии с известными методиками.
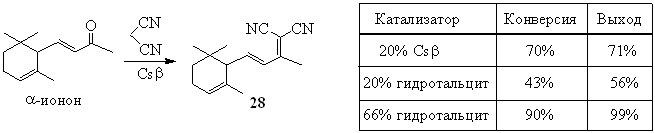
Нами обнаружено, что в присутствии оснвного цеолита Cs гладко протекают реакции Кнёвенагеля с малононитрилом альдегидов терпенового ряда, в том числе содержащих лабильные эпоксидные группы, ведущие к образованию триенов 24, 25 и полифункциональных эпоксидиенов 26 и 27.


Кетоны существенно реже альдегидов используются в качестве субстратов в реакции Кнёвенагеля из-за их значительно меньшей реакционной способности, однако, и они взаимодействуют с малононитрилом на цеолите Cs. Например, реакция терпеноидного кетона -ионона с малононитрилом привела исключительно к продукту реакции Кнёвенагеля 28 с выходом 71%. При проведении этой реакции в присутствии гидротальцита для достижения высоких конверсии и выхода динитрила оказалось необходимым значительно увеличить соотношение катализатор/субстрат.
Реакция -дамаскона с малононитрилом в присутствии цеолита Сs привела к образованию продукта реакции Михаэля – соединению 29. По аналогии с -иононом можно было бы ожидать дальнейшей (или конкурирующей) атаки малононитрилом по карбонильной группе, однако, в реакционной смеси такие продукты нами обнаружены не были. В то же время, мы неожиданно выделили соединение 30, являющееся продуктом взаимодействия малононитрила с олефиновой двойной связью, имеющей два заместителя в -положении к карбонильной группе. Такого типа процессы чрезвычайно редки.

Взаимодействие карвона с этилцианоацетатом было изучено Кнёвенагелем,[6] который получил смесь продуктов реакции Михаэля с выходом от 25 до 33%, в зависимости от используемого катализатора (диэтиламин, пиперидин). Нами при проведении этой реакции была получена смесь 3 диастереомеров 31а-в, также являющихся продуктами реакции Михаэля, с общим выходом до 84%.

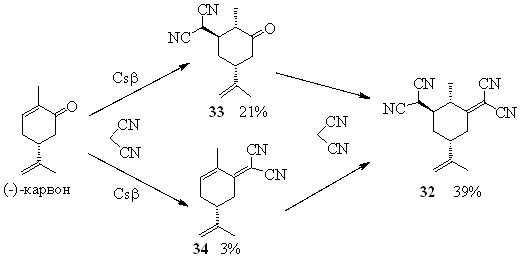
В отличие от реакции (-)-карвона с этилцианоацетатом, ведущей к образованию исключительно продуктов реакции Михаэля, при взаимодействии (-)-карвона с малононитрилом было получено только соединение 32, являющееся продуктом тандемных реакций Михаэля и Кнёвенагеля.

При проведении этой реакции с небольшим количеством малононитрила, недостаточным для присоединения двух молекул к карвону, мы получили и продукт присоединения по Михаэлю 33, и продукт конденсации Кнёвенагеля 34, а также соединение 32, то есть образование последнего протекает через оба возможных промежуточных соединения.
Обращает на себя внимание высокая стереоселективность образования соединений 32 и 33, из четырех возможных стереоизомеров в обоих случаях образовывался только один.
Взаимодействие кетонов 35 и 36 с малононитрилом в присутствии цеолита Сs привело к получению продуктов реакции Кнёвенагеля, а также необычных веществ 39 и 40, которые образуются, очевидно, в результате тандемных реакций Михаэля и Кнёвенагеля с последующими внутримолекулярной карбоциклизацией и замещением нитрильной группы на гидроксигруппу. Предложенный механизм образования соединений 39 и 40 подтверждается тем, что выдерживание в условиях реакции соединения 37 с малононитрилом не приводит к образованию каких-либо продуктов, а исходный динитрил 37 возвращается в неизмененном виде. Хотя соединения 39 и 40 имеют по два новых асимметрических центра, мы в обоих случаях наблюдали образование только одного рацемического диастереомера.

При использовании в качестве катализатора реакции терпеноида 35 с малононитрилом оксидов цезия вместо цеолита единственным выделенным продуктом был динитрил 37. Таким образом, применение цеолита Сs не только способствует упрощению обработки реакционной смеси, но и может приводить к образованию новых интересных продуктов. Регенерация цеолита Сs прокаливанием его в присутствии воздуха позволила провести реакцию соединения 35 с малононитрилом без потери каталитической активности.
Близкие по строению продукты были получены и при взаимодействии с малононитрилом в присутствии цеолита Сs -амвирона, содержащего такой же структурный блок, что и соединение 35, но имеющего объемный углеводородный заместитель у 7,8-двойной связи.

Соединение 39 содержит набор различных функциональных групп и является перспективным для изучения его биологической активности. Нами обнаружено, что оно является ингибитором репродукции вируса иммунодефицита человека; эффективность подавления репликации ВИЧ-1 в культуре клеток МТ-4 соединением 39 превышает этот же показатель у пентаникотината глицирризиновой кислоты в 3.7 раза.
Образование в реакции Михаэля новых асимметрических центров стимулирует попытки создания хиральных катализаторов на базе основных цеолитов. Например, реакцию Михаэля тиофенола с циклогексеноном ранее[7] проводили в присутствии ряда оснвных цеолитов, модифицированных хиральным аминоспиртом 41, однако, на всех модифицированных катализаторах были получены рацемические смеси. Немаловажно, что, не оказывая никакого влияния на энантиоселективность реакции Михаэля, модификация цеолитов приводила к значительному подавлению побочной реакции образования дисульфида.

Мы решили создать на основе цеолита Cs хиральные катализаторы и изучить влияние типа и количества оптически активного модификатора, нанесенного на цеолит, как на соотношение продуктов реакции соединения 35 с малононитрилом, так и на оптическую чистоту соединения 39.

В качестве первого хирального модификатора нами был выбран L-метионин, который, взаимодействуя с оксидами цезия, содержащимися в структуре цеолита, превращался в метионат цезия, надежно удерживающийся на катализаторе.
При использовании в качестве катализатора реакции соединения 35 с малононитрилом цеолита, содержащего 8% L-метионина, нам удалось впервые получить оптически активное полифункциональное соединение 39, энантиомерный избыток составил 3% (таблица 1), повышение содержания L-метионина до 11% позволило увеличить оптическую чистоту соединения 39 до 6%.
Таблица 1. Взаимодействие кетона 35 с малононитрилом на цеолите Met-Cs.
| № | Катализатор | Конверсия, % | Выходa, % | 37/39 | ee, % | |
| 37 | 39 | |||||
| 1 | 8%L-Met-Cs | 98 | 28 | 10 | 2.8 | 3 |
| 2 | 11%L-Met-Cs | 67 | 44 | 11 | 4 | 6 |
| 3 | 14%L-Met-Cs | 100 | 5 | 25 | 0.2 | 0 |
| 4 | L-Met-Cs | 100 | 10 | 15 | 0.7 | 0 |
a Выход на прореагировавший кетон 35.
Неожиданно, дальнейшее увеличение содержания L-метионина до 14% привело к образованию рацемического соединения 39. Это может быть объяснено, например, тем, что из-за слишком большого количества L-метионина, нанесенного на цеолит, реакция катализируется метионатом цезия, находящимся на поверхности цеолита, без влияния кристаллической структуры последнего. Действительно, при проведении этой реакции с использованием в качестве катализатора оксидов цезия, модифицированных L-метионином, выделенное соединение 39 оказалось оптически не активным. Таким образом, наличие кристаллической структуры цеолита оказалось важным фактором для протекания энантиоселективного катализа.
Проводя поиск более эффективного оптически активного модификатора, мы использовали вместо метионина другие оптически активные вещества, часть из которых успешно используется в асимметрическом катализе. Оказалось, что строение модификатора оказывает большое влияние как на соотношение образующихся продуктов, так и на оптическую чистоту соединения 39. Наибольший выход соединения 39 (29%) наблюдался при использовании цеолита Cs, модифицированного L-фенилаланином, а наилучшее значение энантиомерного избытка (10%) было достигнуто на катализаторе L-пролин-Cs.

Наблюдающаяся величина энантиомерного избытка в этом случае сравнима с оптической чистотой продуктов, получаемых на близких по типу кислотных и нейтральных катализаторах.[8] Необходимо отметить, что, как правило, энантиомерный избыток, достигаемый на гетерогенных хиральных катализаторах, заметно ниже, чем у соответствующих гомогенных каталитических систем. Хотя нам не удалось подобрать гомогенный асимметрический катализатор, который позволял бы получать оптически активное полифункциональное соединение 39, во многих случаях именно применение гомогенных асимметрических катализаторов приводит к образованию хиральных биологически активных продуктов.
Логичным продолжением наших исследований стал переход от использования оптически активных природных веществ в качестве субстратов в каталитических превращениях к применению их для создания лигандов хиральных гомогенных каталитических систем, в частности, для асимметрического окисления сульфидов.
Металлокомплексное асимметрическое окисление сульфидов
Хиральные сульфоксиды являются важным классом органических соединений, находящим широкое применение в асимметрическом синтезе. Обнаруженная высокая биологическая активность целого ряда хиральных сульфоксидов,[9] как природного, так и синтетического происхождения, стимулирует поиск новых способов их синтеза. Существует несколько подходов к получению хиральных сульфоксидов с высокой энантиомерной чистотой, среди которых асимметрическое окисление соответствующих сульфидов с использованием энантиоселективного металлокомплексного катализа представляется наиболее общим и перспективным.

В начале этой главы дана литературная справка, посвященная асимметрическому окислению сульфидов, катализируемому ионами титана и ванадия, в оптически активные сульфоксиды. В настоящее время в результате многочисленных исследований разработан целый ряд металлокомплексных каталитических систем для асимметрического окисления, позволяющих во многих случаях эффективно окислять сульфиды в хиральные сульфоксиды, наиболее проработанными и универсальными являются системы на основе ионов титана и ванадия. К сожалению, все эти каталитические системы не являются универсальными и, как правило, мало пригодны для асимметрического окисления сульфидов, содержащих дополнительные функциональные группы или сравнимые по объему заместители. В этих случаях необходимо подбирать подходящие условия окисления для каждого конкретного сульфида, варьируя условия реакций, лиганды, ахиральные добавки, и т.д. Из анализа структур лигандов, применяющихся в обеих сульфоксидирующих системах, следует, что в качестве источников хиральности практически не используются терпеноиды, многие из которых широко распространены в природе и коммерчески доступны в оптически чистом виде, причем, нередко, оба энантиомера.
Нашей задачей стал каталитический синтез биологически активных хиральных сульфоксидов с использованием как уже имеющихся каталитических систем, так и с применением модифицированных нами методик.
Наиболее востребованным оптически активным сульфоксидом в настоящее время является эзомепразол – современный высокоэффективный противоязвенный препарат, продающийся под торговой маркой Нексиум и входящий в число лидеров мировых продаж в денежном выражении среди лекарственных средств.
Эзомепразол представляет из себя (S)-энантиомер омепразола и значительно превосходит последний по клиническому эффекту. Первое время эзомепразол получали разделением энантиомеров, одновременно предпринимались усилия по разработке методов асимметрического окисления сульфида 42.

Необходимо отметить, что при окислении сульфида 42 возможно образование целого ряда побочных веществ – сульфона, продуктов окисления по пиридиновому атому азота, деструкции и т.д., что оказывает значительное влияние на выход целевого продукта и накладывает серьезные ограничения на выбор реагентов и условий окисления.
Первая эффективная методика получения эзомепразола каталитическим асимметрическим окислением сульфида 42 была предложена[10] химиками фармацевтической кампании Astra-Zeneka и основывалась на глубокой модификации сульфоксидирующей системы Кагана. Окисление проводилось гидропероксидом кумола в присутствии каталитического комплекса, состоящего из изопропилата титана (30 моль%), D-диэтилтартрата (D-ДЭТ, 60 моль%), воды и диизопропилэтиламина. После экстрактивной обработки реакционной смеси, взаимодействия сырого продукта с NaOH и кристаллизации была получена натриевая соль эзомепразола с выходом до 55% и энантиомерной чистотой близкой к 100%. Существенным недостатком этой методики является образование в заметных количествах (до 4%) сульфона, очистка от которого связана со значительными трудностями.
Позже была предложена модификация этой методики, включающая в себя замену диэтилтартрата на метиловый эфир миндальной кислоты 43.[11] Лиганд 43 использовался в более чем семикратном избытке по отношению к изопропилату титана, выход натриевой соли эзомепразола составлял 40% и был существенно ниже, чем в оригинальной методике, но содержание примеси сульфона в полученном продукте не превышало 1%.
Из приведенных данных видно, что до сих пор не существует полностью удовлетворительной методики, позволившей бы получать эзомепразол с высоким выходом и низким (менее 1%) содержанием примеси сульфона.
Одним из существенных факторов, влияющих на энантиоселективность этих превращений является проведение реакции в присутствии диизопропилэтиламина. Его роль до сих пор не ясна, но использование ряда других аминов, таких как триэтиламин 44, 1,1,3,3-тетраметилгуанидин 45, 1,8-диазабицикло[5.4.0]ундец-7-ен 46 и N,N-диэтиланилин 47, приводило к резкому снижению оптической чистоты или выхода продукта.

Таким образом, строение амина оказывает значительное влияние на ход энантиоселективного окисления. Мы предположили, что удачный подбор оптически активного амина, который образовывал бы комплекс с изопропилатом титана, даст возможность влиять на энантиоселективность реакции и чистоту эзомепразола.
Действительно, мы обнаружили, что при проведении окисления в присутствии каталитического комплекса, образованного изопропилатом титана, D-диэтилтартратом и N,N-диметил-(S)-фенилэтиламином (S)-48, выход натриевой соли эзомепразола с оптической чистотой не менее 99.5% составляет 57%, при этом содержание сульфона не превышает 0.3%.

Замена соединения (S)-48 на его оптический антипод (R)-48 позволила повысить выход натриевой соли эзомепразола до 64% при той же, высокой, оптической чистоте и незначительном (менее 0.3%) содержании сульфона (таблица 2).
По-видимому, высокий выход эзомепразола при синтезе по предложенной нами методике во многом обусловлен высокой хемоселективностью протекающих процессов, что подтверждается, в том числе, образованием только незначительного количества сульфона.
Заметная разница в оптической чистоте сырого продукта (84% при использовании соединения (R)-48 против 79%, полученных в присутствии соединения (S)-48) и выходах натриевой соли эзомепразола позволяет говорить о существенном влиянии на энантиоселективность реакции абсолютной конфигурации N,N-диметилфенилэтиламина 48, то есть он выступает, в том числе, и в качестве второго хирального лиганда. Нами не обнаружено в литературе примеров использования комплексов из двух различных хиральных лигандов для асимметрического металлокомплексного окисления сульфидов.
Таким образом, нами разработан первый отечественный патентночистый способ высокоселективного синтеза эзомепразола асимметрическим окислением прохирального сульфида 42 с использованием каталитического комплекса, образованного из изопропилата титана и двух различных хиральных лигандов D-ДЭТ и (R)-48, позволяющий получать эзомепразол с недостижимыми ранее препаративным выходом и химической чистотой без дополнительных стадий очистки.
Таблица 2. Выход и чистота эзомепразола в зависимости от используемых лигандов.
| Лиганд(ы) | Выход натриевой соли эзомепразола, % | ее, % | Содержание сульфона, % |
| D-ДЭТ10 | 55 | >99.5 | до 4%11 |
| 4311 | 40 | >99.5 | 1%< |
| D-ДЭТ + (S)-48 | 57 | >99.5 | 0.3%< |
| D-ДЭТ + (R)-48 | 64 | >99.5 | 0.3%< |
К сожалению, предложенный нами способ имеет ряд недостатков, неизбежно возникающих при использовании систем на основе изопропилата титана. Это, во-первых, повышенные требования к контролю за влажностью среды, связанные с тем, что изопропилат титана неустойчив в присутствии влаги, и, во-вторых, необходимость применения значительных количеств катализатора.
В качестве альтернативы уже существующим методам асимметрического окисления сульфида 42 можно рассматривать каталитические системы на основе комплексов ванадила, которые лишены практически всех перечисленных выше недостатков. Однако, мы не обнаружили в литературе примеров использования для синтеза оптически активного омепразола ванадийсодержащих хиральных каталитических комплексов.
Нами показано, что классическая система Больма, основанная на окислении водной перекисью водорода в присутствии каталитических количеств комплекса VO(acac)2 с хиральным основанием Шиффа (мы использовали коммерчески доступное соединение 49), не применима для получения оптически активного омепразола, что связано с низкой конверсией исходного сульфида 42 и протеканием значительного количества побочных реакций.

Мы модифицировали систему Больма и изучили влияние различных факторов, таких как строение и скорость прибавления окислителя, температура реакции, природа растворителя, применение различных добавок и т.д. Нам удалось подобрать подходящие условия для асимметрического окисления сульфида 42 с использованием комплекса ванадила с соединением 49, в качестве окислителя мы применили гидропероксид кумола, растворителя – толуол. Энантиомерная чистота сульфоксида 50 составила в этих условиях 14%, а выход продукта – 62%.
Использование различных добавок – как хиральных ((-)-диэтилтартрат, натриевая соль эзомепразола), так и ахиральной (диизопропилэтиламин) не приводило к повышению энантиомерной чистоты образующегося сульфоксида 50, однако способствовало увеличению выхода продукта.
Отметим простоту предложенной методики окисления, по сравнению с методиками, основанными на применении комплексов изопропилата титана, – смешение реагентов и дальнейшее окисление происходят в присутствии атмосферного воздуха, а полученный продукт отделяется простым фильтрованием, что существенно повышает привлекательность метода для последующего применения.
Для дальнейшего повышения оптической чистоты продукта было необходимо провести широкое варьирование используемых лигандов. К сожалению, в системе Больма, как правило, используется только один тип лигандов, получаемых взаимодействием замещенных салициловых альдегидов с гидрированными аминокислотами; единственным коммерчески доступным из них является соединение 49.

В то же время, для превращения сложных полифункциональных соединений с использованием хиральных металлокомплексных систем весьма желательно иметь выбор различных оптически активных лигандов, существенно отличающихся по строению друг от друга. Одним из возможных путей получения лигандов новых типов для сульфоксидирования является замена аминокислот, традиционно использующихся в качестве источников хиральности, на терпеноиды.
Синтез аминоспиртов (-)- и (+)-52 и 53 осуществлен нами исходя из (+)- и (-)--пиненов и (+)-3-карена в соответствии с модифицированными нами литературными методиками.[12]
Необходимо отметить, что при проверке биологической активности полученных терпеноидных аминоспиртов и аминоэфиров нами впервые обнаружено, что эти соединения оказывают значительное воздействие на нейромедиаторные системы, при этом большое значение имеют как тип функциональной кислородсодержащей группы, так и абсолютная конфигурация указанных соединений, а соединение (-)-51 проявляет высокую противосудорожную активность.

Синтезированные хиральные аминоспирты мы ввели в реакции с широким набором салициловых альдегидов, содержащих различные по объему и электронным эффектам заместители. Основания Шиффа 54-57 образовывались с хорошими (75-100%) выходами, при необходимости очистку проводили перекристаллизацией или колоночной хроматографией.

Как уже упоминалось, обычно хиральные основания Шиффа, использующиеся в качестве лигандов в асимметрическом окислении сульфидов, получают взаимодействием оптически активных аминов с замещенными салициловыми альдегидами. Мы впервые осуществили обратный вариант, использовав в качестве источников хиральности оптически активные альдегиды, для этого мы из пирокатехина в соответствии с приведенной схемой синтезировали ди-трет-бутиламинофенол 58 с общим выходом по трем стадиям 60%.

Взаимодействием соединения 58 с (-)-миртеналем, его эпоксидом и альдегидоспиртом 59, полученным из (-)-кариофиллена, мы синтезировали 3 новых хиральных лиганда 60-62.

Таким образом, нами впервые на основе распространенных терпенов синтезирован ряд хиральных оснований Шиффа, пригодных для использования в качестве лигандов в катализируемом ионами ванадия асимметрическом окислении сульфидов. Полученные лиганды существенно отличаются друг от друга по пространственной затрудненности и электронным факторам, что делает перспективным их использование для подбора условий окисления сложных полифункциональных сульфидов.
Значительная часть новых лигандов была использована нами для получения оптически активного омепразола 50 в найденных ранее условиях окисления. Наиболее интересные результаты были достигнуты с хиральными основаниями Шиффа 61 и 54б.
Замена соединения 49 лигандом 61 позволила нам поднять выход оптически активного омепразола до 83% при ее 10%, а использование пространственно менее затрудненного лиганда 54б привело к повышению энантиомерной чистоты сульфоксида 50 до 19%.

Нами неожиданно обнаружено, что при окислении сульфида 42 с использованием комплекса VO(acac)2 с лигандом 54б в присутствии диизопропилэтиламина энантиомерная чистота сульфоксида 50 увеличивается с 19 до 31%. Для изучения процессов, протекающих при сульфоксидировании соединения 42 этой системой, мы провели окисление с контролем в ходе реакции энантиомерной чистоты продукта. Оказалось, что энантиомерная чистота омепразола существенно повышается в процессе реакции (рис. 2), что может быть объяснено кинетическим разделением образующегося сульфоксида 50.


Рис. 2. Зависимость оптической чистоты сульфоксида 50 от времени реакции.
Для проверки этого предположения мы выдержали рацемический омепразол в условиях реакции и действительно получили преимущественно (S)-изомер омепразола 50 с ее 50%, тогда как в отсутствии диизопропилэтиламина расходовались оба энантиомера, что вело к образованию сложной смеси продуктов, практически не содержащей сульфоксид 50.
Интересно, что такой рост оптической чистоты продукта в присутствии диизопропилэтиламина наблюдался только при использовании комплекса ванадила с лигандом 54б.
Таким образом, нами разработан новый патентночистый метод получения оптически активного омепразола с использованием в качестве катализатора окисления комплекса ванадила с хиральным основанием Шиффа, полученным из доступного монотерпена (+)--пинена. Хотя оптическая чистота полученного омепразола составляет 31%, дальнейшее её повышение может быть осуществлено перекристаллизацией в соответствии с разработанными ранее методиками.[13] Предложенный метод позволяет проводить реакцию в присутствии атмосферного воздуха, а продукт отделять простым фильтрованием. Подчеркнем, что это первый метод получения оптически активного омепразола, в котором хиральный металлсодержащий комплекс используется в действительно каталитических количествах.
Другими важными биологически активными сульфоксидами являются варацины В и С, выделенные из дальневосточной асцидии Polycitor и обладающие высокой противораковой активностью.[14] Наиболее интересным является варацин С, значительно превосходящий по своему цитотоксическому эффекту применяемые в медицине противоопухолевые препараты. Высокую активность против некоторых видов рака продемонстрировал и более простой бензотритиол-2-оксид 63.[15]

Несмотря на то, что данные об энантиомерном составе природных варацинов в литературе отсутствуют, известно, что во многих случаях абсолютная конфигурация сульфоксидной группы оказывает решающее влияние на биологическую активность сульфоксидов.
Основываясь на этих данных и с учетом накопленного нами опыта в асимметрическом сульфоксидировании, мы решили провести синтез обоих энантиомеров бензотритиолов (аналогов варацинов В и С) для дальнейшего изучения их биологической активности.
Необходимо отметить, что в настоящее время известен только один пример успешного синтеза оптически активных бензотритиолоксидов. Ранее[16] асимметрическим окислением соединения 64, содержащего два различных полисульфидных кольца, системой Ti(OiPr)4/диэтилтартрат/t-BuOOH при -24оС была получена смесь четырех моносульфоксидов 65-68, при этом соединения 67 и 68 не были хиральными, а сульфоксиды 65 и 66 обладали оптической активностью. Диастереомерия в этих соединениях обусловлена наличием двух элементов хиральности – асимметрического атома серы сульфоксидной группы и плоскости хиральности. Продукты реакции были разделены колоночной хроматографией, оптическая чистота соединений 65 и 66 составила 71 и 79%, соответственно.

Для получения обоих энантиомеров замещенного бензотритиолоксида, являющегося аналогом варацинов B и C и содержащего только одну стереогенную группу, мы выбрали в качестве субстрата бензотритиол 69 – один из наиболее доступных в своем классе, синтез его с приемлемым выходом может быть осуществлен из относительно недорогого соединения 70 с использованием доступных реагентов.[17]

Нами обнаружено, что окисление соединения 69 системой Больма (водная Н2О2, CH2Cl2, комплекс VO(acac)2 с лигандом 49, 20-40oC) протекает очень медленно, при проведении реакции в течение 7 суток конверсия бензотритиола 69 не превысила 10%.
При использовании каталитических систем, основанных на применении изопропилата титана (методы Кагана и Модены), скорость реакции существенно увеличилась, однако и здесь полная конверсия исходного соединения достигалась только при выдерживании реакционной смеси в течение 48 ч при комнатной температуре (обычные условия сульфоксидирования этими реагентами -24оС и ниже).

Окисление бензотритиола 69 по методу Кагана (Ti(OiPr)4/(R,R)-ДЭТ (диэтилтартрат)/H2O/гидропероксид кумола в соотношении 1:2:1:1.25, соответственно) привело к образованию оптически активного сульфоксида (+)-72. В отличие от соединений 65 и 66, бензотритиолоксид 72 оказался неустойчив в условиях колоночной хроматографии на силикагеле, его удалось выделить из реакционной смеси кристаллизацией из этанола. Чистое соединение (+)-72 получили с выходом 34%, энантиомерный избыток составил 18%.
Переход к использованию метода Модены, основанного на применении большого избытка ДЭТ по отношению к изопропилату титана в отсутствии воды, позволил получить бензотритиолоксид (+)-72 со значительно большим энантиомерным избытком, составившим 61%, однако выход продукта уменьшился до 20%. Очевидно, меньший выход соединения (+)-72 объясняется, по крайней мере частично, сложностями отделения его от избытка ДЭТ.
Применение вместо (R,R)-ДЭТ его энантиомера, (S,S)-ДЭТ, привело к образованию (-)-изомера соединения 72. Как и в предыдущих случаях, большая оптическая чистота сульфоксида достигалась при использовании метода Модены. Если при сульфоксидировании бензотритиола 69 с помощью системы Кагана энантиомерный избыток в полученном сульфоксиде 72 составил 7% (при выходе 25%), то окисление в отсутствии воды с использованием большого избытка ДЭТ позволило получить продукт 72 с энантиомерным избытком 47% (выход 21%).
Таким образом, нами впервые осуществлено асимметрическое окисление замещенного бензотритиола, не содержащего иных прохиральных групп или асимметрических центров, и получены оба энантиомерных сульфоксида.
Исследования биологической активности соединения (-)-72 показали, что оно является ингибитором репликации вируса иммунодефицита человека, степень подавления репликации которого в культуре клеток МТ-4 превышает тот же показатель у пентаникотината глицирризиновой кислоты в 12 раз.
Необходимо отметить, что, вопреки литературным данным,17 при взаимодействии соединения 71 с гидросульфидом натрия нами помимо бензотритиола 69 в качестве основного продукта неожиданно был получен аминобензопентатиепин 73. Соотношение образующихся соединений зависело от величины избытка гидросульфида натрия, но во всех случаях аминобензопентатиепин присутствовал в реакционной смеси.

Интересно, что восстановление нитрогруппы проходило только в случае образования бензопентатиепина и нами в реакционной смеси не наблюдалось образования ни бензотритиола, содержащего аминогруппу, ни бензопентатиепина с сохранившейся нитрогруппой.
Подчеркнем, что это беспрецедентно простой метод получения замещенного бензопентатиепина, благодаря чему соединение 73 оказалось доступным, что позволило изучить его фармакологические свойства. Оказалось, что оно сочетает низкую токсичность, существенные противосудорожные свойства и значительную противотревожную активность.
Результаты фармакологических испытаний некоторых полученных соединений
В результате биотестирования части полученных веществ (около 40 соединений) на воздействие на нейромедиаторную систему и противовирусную активность выявлены соединения, являющиеся перспективными для разработки на их основе новых противосудорожных и противотревожных средств, а также анти-ВИЧ препаратов. В этой главе приведены результаты тех фармакологических испытаний, которые на настоящий момент уже оформлены в виде статей или заявок на получение патента.
Изучение противосудорожной и анксиолитической активности проводилось в лаборатории фармакологических исследований НИОХ СО РАН под руководством д.б.н. проф. Толстиковой Т.Г., анти-ВИЧ активности – в лаборатории ретровирусов ГНЦ ВБ «Вектор» под руководством д.м.н. проф. Покровского А.Г.
При изучении биологической активности полученных нами в процессе выполнения этой работы соединений, оказалось, что часть из них можно рассматривать в качестве соединений лидеров для разработки новых лекарственных средств, а именно:
- Впервые обнаружена высокая противосудорожная активность хирального п-ментадиола 10, не уступающая активности лучших противоэпилептических средств, применяющихся в настоящее время; сочетание низкой токсичности и отсутствия существенного влияния на психо-локомоторную активность с высокой активностью делают соединение 10 высокоперспективным для разработки нового лекарственного препарата.
- Впервые установлено, что оптически активные аминокислоты пинанового ряда и их производные оказывают значительное воздействие на нейромедиаторные системы, при этом большое значение имеют как тип функциональной кислородсодержащей группы, так и абсолютная конфигурация указанных соединений. Найдено, что аминоэфир (-)-51 проявляет in vivo высокую противосудорожную активность в тестах «коразоловая токсичность» и «никотиновая токсичность», имеет ЛД50 более 1000 мг/кг и в изучаемой дозе оказывает незначительное седативное влияние на двигательную активность. Учитывая вышесказанное, а также то, что соединение (-)-51 может быть в две стадии получено из распространенного монотерпена -пинена, аминоэфир (-)-51 можно рассматривать в качестве базового соединения для разработки новых низкотоксичных противосудорожных агентов.
- Впервые найдена высокая противосудорожная и противотревожная активность для соединения с пентатиепиновым циклом. Сочетание высокой активности с низкой токсичностью и отсутствием потенцирования действия снотворных препаратов позволяет рассматривать соединение 73 в качестве перспективного соединения для разработки новых низкотоксичных противосудорожных агентов с анксиолитическим действием. Обнаружено, что превращение аминогруппы в соединении 73 в амидную ведет к резкому изменению биологической активности изучаемых соединений.
- Найдены новые ингибиторы репродукции вируса иммунодефицита человека – 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-дикарбонитрил 39 и оптически активный (-)-4-нитро-6-трифторметил-1,2,3-бензотритиол-1-оксид 72.
Экспериментальная часть
В этой главе приведено подробное описание проведенных экспериментов и установления строения полученных соединений. В работе широко использовались современные физико-химические методы: спектроскопия ЯМР, масс-спектрометрия высокого разрешения и другие. Для определения оптической чистоты веществ применялся ряд методов – спектроскопия ЯМР 1Н с различными хиральными реагентами сдвига, хроматография (ВЭЖХ и ГЖХ) на хиральных колонках, сравнение измеренных значений оптической активности с известными ранее.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И ВЫВОДЫ
- Сформулировано и реализовано новое направление каталитического синтеза, основанное на исследовании ранее неизвестных реакций хиральных терпеноидов, протекающих под действием кислотных кристаллических катализаторов и приводящих к образованию широкого спектра оптически активных кислородсодержащих гетероциклических соединений разнообразных структурных типов.
- Установлено, что новые каталитические реакции по степени влияния на них структурных факторов, присущих субстратам и катализаторам, могут быть отнесены к процессам, подобным биомиметическим.
- Впервые показано, что в реакциях, катализируемых твердыми суперкислотами, природа и концентрация нанесенных кислотных центров, воздействуя на процесс возникновения катионных центров, определяет строение и стереохимию продуктов реакции. Найденная закономерность продемонстрирована на превращениях диэпоксидов лимонена на сульфатированной окиси циркония.
- Разработан и успешно осуществлен стереоспецифичный синтез четырех пространственных изомеров п-мента-1,8-диен-5,6-диола, обладающего высокой противосудорожной активностью. Ключевыми стадиями этих методик являются стереоспецифичные кислотно-катализируемые перегруппировки соответствующих эпоксидов вербенолов.
- Впервые показано, что оснвный цеолит Сs и оснвная глина гидротальцит открывают новую группу гетерогенных катализаторов реакций,-ненасыщенных карбонильных соединений терпеноидного ряда с СН-кислотами. Установлено влияние структурных факторов реагентов на тип протекающих реакций (присоединение по Михаэлю, конденсации Кнёвенагеля, тандемные превращения).
- На примере реакции 5,5,8-триметилнона-3,7-диен-2-она с малононитрилом показана возможность регулирования регио- и энантиоселективности каталитического действия цеолита Сs путем модификации его оптически активными соединениями.
- На основе новых хиральных оснований Шиффа, полученных из терпеноидов, разработана группа не известных ранее гомогенных ванадий-содержащих катализаторов энантиоселективного окисления сульфидов.
- Разработан патентночистый метод получения оптически активного омепразола с использованием каталитических количеств комплекса ацетилацетоната ванадила с новыми хиральными основаниями Шиффа; обнаружено положительное влияние добавки диэтилизопропиламина на ход ванадий-катализируемого асимметрического сульфоксидирования. Показано, что использование в асимметрическом металлокомплексном окислении сульфидов одновременно двух различных оптически активных лигандов позволяет получить эзомепразол с недостижимым ранее выходом.
- Впервые успешно осуществлен каталитический синтез оптически активных сульфоксидов замещенного 1,2,3-бензотритиола как аналогов природного варацина C, обладающего выдающейся противоопухолевой активностью. Обнаружен новый простой метод синтеза замещенного аминобензопентатиепина. Полученные бензополисульфиды представляют интерес для фармакологических исследований.
- В результате биотестирования на противовирусную активность и воздействие на нейромедиаторные системы выявлены соединения, являющиеся перспективными для разработки новых противосудорожных и противотревожных средств, а также анти-ВИЧ препаратов. Совокупность выявленных свойств позволяет рекомендовать для дальнейших фармакологических исследований следующие вещества: (1R,2R,6S)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диол, этиловый эфир (1S,2S,3R,5S)-2-амино-2,6,6-триметилбицикло[3.1.1]гептан-3-карбоновой кислоты и 8-(трифторметил)бензо[f][1,2,3,4,5]пентатиепин-6-амин – в качестве противосудорожных средств, 8-(трифторметил)бензо[f][1,2,3,4,5]пентатиепин-6-амин – в качестве анксиолитического средства, 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-дикарбонитрил и (-)-4-нитро-6-трифторметил-1,2,3-бензотритиол-1-оксид – в качестве ингибиторов репликации вируса иммунодефицита человека.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ДИССЕРТАЦИОННОЙ РАБОТЫ ИЗЛОЖЕНЫ В СЛЕДУЮЩИХ ПУБЛИКАЦИЯХ:
- Волчо, К.П., Салахутдинов, Н.Ф., Бархаш, В.А. Новый способ увеличения скорости катализируемых глинами реакций // ЖОрХ. – 1999. – T. 35. – Вып. 10. – С. 1583-1584.
- Волчо, К.П., Татарова, Л.Е., Суслов, Е.В., Корчагина, Д.В., Салахутдинов, Н.Ф., Бархаш, В.А. Взаимодействие некоторых терпенов и их производных с ацилирующими агентами на алюмосиликатных катализаторах // ЖОрХ. – 2001. – Т. 37. – Вып. 10. – С. 1488-1499.
- Волчо, К.П., Курбакова, С.Ю., Корчагина, Д.В., Салахутдинов, Н.Ф., Бархаш, В.А. Взаимодействие некоторых терпеноидов с малононитрилом на основном цеолите Сs-. Влияние ультразвука на ход реакции // Химия и компьютерное моделирование. Бутлеровские сообщения. – 2002. – № 7. – С. 81-84.
- Volcho, K.P., Kurbakova, S.Yu., Suslov, E.V., Korchagina, D.V., Salakhutdinov, N.F., Toktarev, A.V., Echevskii, G.V., Barkhash, V.A. Competing Michael and Knoevenagel reactions of terpenoids with malononitrile on basic Cs-beta zeolite // J. Mol.Cat. A: Chem. – 2003. – V. 195. – №1-2. – Р. 263-274.
- Толстиков, А.Г., Толстиков, Г.А., Ившина, И.Б., Гришко, В.В., Толстикова, О.В., Глушков, В.А., Хлебникова, Т.Б., Салахутдинов, Н.Ф., Волчо, К.П. Современные проблемы асимметрического синтеза. – Екатеринбург: УрО РАН, 2003.
- Татарова, Л.Е., Корчагина, Д.В., Волчо, К.П., Салахутдинов, Н.Ф., Бархаш, В.А. Реакции эпоксидов некоторых монотерпенов с уксусным ангидридом на алюмосиликатных катализаторах // ЖОрХ. – 2003. – Т. 39. – Вып. 8. – С. 1147-1153.
- Волчо, К.П., Салахутдинов, Н.Ф., Толстиков, А.Г. Металлокомплексное асимметрическое окисление сульфидов // ЖОрХ. – 2003. – Т. 39. – N. 11. – С. 1607-1622.
- Волчо, К.П., Суслов, Е.В., Курбакова, С.Ю., Корчагина, Д.В., Салахутдинов, Н.Ф., Бархаш, В.A. Взаимодействие некоторых терпеноидов с СН-кислотами в присутствии оснoвного цеолита Сs- // ЖОрХ. – 2004. – Т. 40. – Вып. 5. – C. 691-700.
- Ильина, И.В., Волчо, К.П., Корчагина, Д.В., Салахутдинов, Н.Ф., Бархаш, В.А. Превращения эпоксида нопола на глине асканит-бентонит // ЖОрХ. – 2004. – Т. 40. – Вып. 10. – С. 1483-1487.
- Хоменко, Т.М., Волчо, К.П., Токтарев, А.В., Ечевский, Г.В., Салахутдинов, Н.Ф., Бархаш, В.A. Взаимодействие некоторых терпеноидов с малононитрилом в присутствии гидротальцита // ЖОрХ. – 2005. – Т. 41. – Вып. 6. – С. 859-863.
- Il’ina, I.V., Volcho, K.P., Korchagina, D.V., Barkhash, V.A., Salakhutdinov. N.F. Synthesis of Optically Active, Cyclic
 -Hydroxy Ketones and 1,2-Diketones from Verbenone Epoxide // Helv. Chim. Acta. – 2006. – V. 89. – N 3. – P. 507-514.
-Hydroxy Ketones and 1,2-Diketones from Verbenone Epoxide // Helv. Chim. Acta. – 2006. – V. 89. – N 3. – P. 507-514. - Suslov, E.V., Korchagina, D.V., Komarova, N.I., Volcho, K.P., Salakhutdinov, N.F. New Chiral Basic Heterogeneous Catalyst Based on Cs Zeolite // Mendeleev Commun. – 2006. – N 4. – P. 202-204.
- Хоменко, Т.М., Саломатина, О.В., Курбакова, С.Ю., Ильина, И.В., Волчо, К.П., Комарова, Н.И., Корчагина, Д.В., Салахутдинов, Н.Ф., Толстиков, A.Г. Новые хиральные лиганды на основе миртеналя и кариофиллена для металлокомплексного асимметрического окисления сульфидов // ЖОрХ. _ 2006. _ Т. 42. _ № 11. _ C. 16661673.
- Suslov, E.V., Khomenko, T.M., Il’ina, I.V., Korchagina, D.V., Komarova, N.I., Volcho, K.P., Salakhutdinov, N.F. Asymmetric Induction in Catalyzed Synthesis of Organic Compounds as an Important Stage in the Evolution of Life on Earth // Paleontol. J. – 2006. – V. 40. – Supp. 4. – P. S532–S537.
- Волчо, К.П., Рогоза, Л.Н., Салахутдинов, Н.Ф., Толстиков, А.Г., Толстиков, Г.А. Препаративная химия терпеноидов. Часть 1. Бициклические монотерпеноиды. – Новосибирск: ГУ Издательство СО РАН, 2006. 280с.
- Ильина, И.В., Волчо, К.П., Корчагина, Д.В., Салахутдинов, Н.Ф., Бархаш, В.А. Превращения эпоксида (-)-миртеналя на глине асканит-бентонит // ЖОрХ. – 2007. – V. 43. – N 1. – P. 56–59.
- Волчо, К.П., Яровая, О.И., Курбакова, С.Ю., Корчагина, Д.В., Бархаш, В.А., Салахутдинов, Н.Ф. Получение из цитраля эпоксидинитрилов и их кислотнокатализируемые превращения // ЖОрХ. – 2007. – T. 43. – N 4. – C. 514–520.
- Salomatina, O.V., Kuznetsova, Т.G., Korchagina, D.V., Moroz, E.M., Volcho, K.P., Barkhash, V.A., Salakhutdinov, N.F. Effects of the properties of SO4/ZrO2 solid-phase catalysts on the products of R-(+)-limonene diepoxides transformation and reaction mechanism // J. Mol. Cat. A: Chem. – 2007. – V. 269. – P. 72-80.
- Il’ina, I.V., Volcho, K.P., Korchagina, D.V., Barkhash, V.A.. Salakhutdinov, N.F. Reactions of Allyl Alcohols of the Pinane Series and of Their Epoxides in the Presence of Montmorillonite Clay // Helv. Chim. Acta. – 2007. – V. 90. – N 2. – P. 353-368.
- Конева, Е.А., Волчо, К.П., Корчагина, Д.В., Комарова, Н.И., Кочнев, А.И., Салахутдинов, Н.Ф., Толстиков, A.Г. Синтез новых хиральных оснований Шиффа на основе (+)- и (-)--пиненов для использования в асимметрическом металлокомплексном окислении сульфидов // Изв. РАН. Сер. Хим. _ 2008. _ № 1. _ P. 105-113.
- Заявка на получение патента № 2007113738 от 12.04.2007. Способ получения эзомепразола / Хоменко, Т.М., Волчо, К.П., Салахутдинов, Н.Ф., Толстиков, Г.А.; НИОХ СО РАН, РФ. Решение о выдаче патента от 12.05.2008.
- Заявка на получение патента № 2007116401 от 02.05.2007. Способ получения оптически активного 5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1H-бензо[d]имидазола / Климова, Е.А., Хоменко, Т.М., Курбакова, С.Ю., Комарова, Н.И., Волчо, К.П., Салахутдинов, Н.Ф., Толстиков, Г.А., Толстиков, А.Г.; НИОХ СО РАН, РФ. Решение о выдаче патента от 05.06.2008.
- Шульц, Э.Э., Ралдугин, В.А., Волчо, К.П., Салахутдинов, Н.Ф., Толстиков, Г.А. Растительные метаболиты флоры Сибири. Химические превращения и возможности практического использования // Успехи химии. – 2007. – V. 76. – V. 7. – P. 707-723.
- Ильина, И.В., Волчо, К.П., Салахутдинов, Н.Ф. Кислотно-катализируемые превращения терпеноидов пинанового ряда – новые возможности // ЖОрХ. – 2008. – Т. 44. – N 1. –P. 11–31.
- Хоменко, Т.М., Волчо, К.П., Комарова, Н.И., Салахутдинов, Н.Ф. Эффективный способ получения эзомепразола с использованием комплекса хиральных лигандов // ЖОрХ. _ 2008. _ Т. 44. _ N. 1. _ C. 126–129.
- Заявка на получение патента № 2007133066 от 03.09.2007. Производное бензопентатиепина, обладающее противосудорожной и противотревожной активностью / Хоменко, Т.М., Корчагина, Д.В., Болкунов, А.В., Долгих, М.П., Волчо, К.П., Толстикова, Т.Г., Салахутдинов, Н.Ф.; НИОХ СО РАН, РФ. Решение о выдаче патента от 02.06.2008.
- Заявка на патент. Рег. № 2007129294 от 30.07.2007. Противосудорожное средство / Ильина, И.В., Болкунов, А.В., Долгих, М.П., Волчо, К.П., Толстикова, Т.Г., Салахутдинов, Н.Ф.; НИОХ СО РАН, РФ, ООО «Томская фармацевтическая фабрика», РФ. Решение о выдаче патента от 13.10.2008.
- Ardashov, O.V., Il’ina, I.V., Korchagina, D.V., Volcho, K.P., Salakhutdinov, N.F. Unusual -hydroxyaldehyde with a cyclopentane framework from verbenol epoxide // Mendeleev Commun. 2007. – V. 17. – N 5. – P. 303-305.
- Толстикова, Т.Г., Морозова, Е.А., Павлова, А.В., Болкунов, А.В., Долгих, М.П., Конева, Е.А., Волчо, К.П., Салахутдинов, Н.Ф., Толстиков, Г.А. Производные аминокислот пинанового ряда – новые противосудорожные агенты // Доклады Академии Наук. Химия. – 2008. – Т. 422. – № 4. – С. 490-492.
- Суслов, Е.В., Корчагина, Д.В., Самуков, В.В., Волчо, К.П., Салахутдинов, Н.Ф. Влияние модификации цеолита Cs хиральными веществами на ход реакции 5,5,8-триметилнона-3,7-диен-2-она с малононитрилом // Химия в интересах устойчивого развития. – 2008. – № 4. – С. 441–447.
- Волчо, К.П., Рогоза, Л.Н., Салахутдинов, Н.Ф., Толстиков, Г.А. Препаративная химия терпеноидов. Часть 2/1. Моноциклические монотерпеноиды: лимонен, карвон и их производные. – Новосибирск: Арт-Авеню, 2008. 229 с.
- Koneva, E.A., Volcho, K.P., Gatilov, Yu.V., Korchagina, D.V., Salnikov, G.E., Salakhutdinov, N.F. Synthesis of the Derivatives of the Optically Active -Amino Acids from (+)-2-Carene // Helv. Chim. Acta. – 2008. – V. 91. – P. 1849-1856.
Публикации в сборниках тезисов конференций
- Volcho, K.P., Tatarova, L.E., Korchagina, D.V., Salakhutdinov, N.F., Barkhash, V.A. Reactions of Cis- and Trans-Epoxides (+)-3-Carene and Limonene with Aldehydes on Askanite-Bentonite Clay // International Conference on Natural Products and Physiologically Active Substances. Book of Abstracts. – Novosibirsk, 1998. – P. 185.
- Volcho, K.P., Korchagina, D.V., Salakhutdinov, N.F., Barkhash, V.A. Camphene interaction with acylation reagents on wide-pore zeolite // Heterogeneous catalysis. Proceedings of the ninth international symposium. – Varna, Bulgaria, September 2000.
- Volcho, K.P., Kurbakova, S.Yu., Korchagina, D.V., Salakhutdinov, N.F., Barkhash, V.A. Michael and Knoevenagel reactions of terpenoids with malononitrile on basic Cs- zeolite // 23rd IUPAC Int. Symposium on the Chemistry of Natural Products. Book of abstracts. – Florence, Italy, July 2002. – P 241.
- Волчо, К.П., Курбакова, С.Ю., Корчагина, Д.В., Салахутдинов, Н.Ф., Бархаш, В.А. Взаимодействие некоторых терпеноидов с малононитрилом на основном цеолите Сs-. Влияние ультразвука на ход реакции // Материалы II всероссийской конференции Химия и технология растительных веществ. – Казань, июнь 2002. – С. 31-32.
- Волчо, К.П., Суслов, Е.В., Курбакова, С.Ю., Корчагина, Д.В., Салахутдинов, Н.Ф., Бархаш, В.A. Взаимодействие некоторых терпеноидов с СН-кислотами в присутствии основного цеолита Сs- // Международная научная конференция Химия, технология и медицинские аспекты природных соединений. – Алматы, Казахстан, октябрь 2003.
- Волчо, К.П., Яровая, О.И., Курбакова, С.Ю., Корчагина, Д.В., Салахутдинов, Н.Ф., Бархаш, В.А. Взаимодействие эпоксидов цитраля с малононитрилом на оснвном цеолите Сs // Тезисы докладов III Всероссийской конференции «Химия и технология растительных веществ». – Саратов, сентябрь 2004. – C. 80-81.
- Suslov, E.V., Volcho, K.P., Komarova, N.I., Korchagina, D.V., Salakhutdinov, N.F. Asymmetric Reactions of,-Unsaturated Carbonyl Compounds with Malononitrile on Chyral Met-Cs- Zeolite // 2nd International conference on natural products and physiologically active substances. Book of abstracts. – Novosibirsk, September 2004. – P. 115.
- Khomenko, T.M., Salomatina, O.V., Kurbakova, S.Yu.. Volcho, K.P., Komarova, N.I., Korchagina, D.V., Salakhutdinov, N.F., Tolstikov, A.G. New Chiral Ligand Derived from Caryophyllene Useful for Vanadium Catalyzed Asymmetric Oxidation of Sulfides // 2nd International conference on natural products and physiologically active substances. Book of abstracts. – Novosibirsk, September 2004. – P. 72.
- Суслов, Е.В., Хоменко, Т.М., Ильина, И.В., Корчагина, Д.В., Комарова, Н.И., Волчо, К.П., Салахутдинов, Н.Ф. Передача хиральности в каталитическом синтезе органических молекул как важный этап возникновения жизни на земле // Международное рабочее совещание «Происхождение и эволюция биосферы». Тезисы докладов. – Новосибирск, 26-29 июня 2005 г. – C. 56-57.
- Салахутдинов, Н.Ф., Ильина, И.В., Волчо, К.П. Каталитические превращения эпоксидов монотерпеноидов // IV Всероссийская научная конференция Химия и технология растительных веществ. – Сыктывкар, 25-30 июня 2006 г. – С. 17.
- Климова, Е.А., Курбакова, С.Ю., Комарова, Н.И., Корчагина, Д.В., Волчо, К.П., Салахутдинов, Н.Ф. Синтез новых хиральных лигандов для асимметрического сульфоксидирования на основе монотерпенов // Химия и технология растительных веществ. – Сыктывкар, 25-30 июня 2006 г. – С. 92.
- Kuznetsova, T., Sadykov, V., Burgina, E., Moroz, E., Batuev, L., Salomatina, O., Volcho, K. The influence of the synthesis parameters on the defect structure of zirconia and its catalytic properties // Proc. Fourth Asia Pacific Congress on Catalysis. – Singapore, December 2006. – A1-P59.
- Ильина, И.В., Волчо, К.П., Корчагина, Д.В., Бархаш, В.А., Салахутдинов, Н.Ф.Синтез новых полифункциональных соединений из эпоксида (-)-цис-вербенола // Всероссийская научная конференция Современные проблемы органической химии, посвящённая 100-летию со дня рождения академика Н. Н. Ворожцова. – Новосибирск, 5 - 9 июня 2007 г. – C. 134.
- Климова, Е.А., Волчо, К.П., Корчагина, Д.В., Комарова, Н.И., Кочнев, А.И., Салахутдинов, Н.Ф., Толстиков, A.Г. Синтез новых хиральных оснований Шиффа на основе (+)- и (-)--пиненов для использования в асимметрическом металлокомплексном окислении сульфидов // Всероссийская научная конференция Современные проблемы органической химии", посвящённая 100-летию со дня рождения академика Н. Н. Ворожцова. – Новосибирск, 5 - 9 июня 2007 г. – C. 138.
- Суслов, Е.В., Корчагина, Д.В., Комарова, Н.И., Волчо, К.П., Салахутдинов, Н.Ф. Новые гетерогенные хиральные катализаторы для асимметрического катализа реакций,-ненасыщенных кетонов с малононитрилом // Всероссийская научная конференция "Современные проблемы органической химии", посвящённая 100-летию со дня рождения академика Н. Н. Ворожцова. – Новосибирск, 5 - 9 июня 2007 г. – C. 159.
- Суслов, Е.В., Корчагина, Д.В., Комарова, Н.И., Волчо, К.П., Салахутдинов, Н.Ф. Синтез новых гетерогенных хиральных катализаторов для асимметрического катализа реакций,-непредельных карбонильных соединений с СН-кислотами // Материалы международной научной конференции «Химия, технология и медицинские аспекты природных соединений». – Алматы. 10-13 октября 2007. – C. 201.
- Хоменко, Т.М., Корчагина, Д.В., Долгих, М.П., Толстикова, Т.Г., Волчо, К.П., Салахутдинов, Н.Ф. Синтез и асимметрическое окисление бензотритианов – аналогов Варацина С // Всероссийская научная конференция Современные проблемы органической химии, посвящённая 100-летию со дня рождения академика Н. Н. Ворожцова. – Новосибирск, 5 - 9 июня 2007 г. – C. 137.
- Il`ina, I.V., Suslov, E.V., Khomenko, T.M., Korchagina, D.V., Volcho, K.P., Salakhutdinov, N.F. Natural montmorillonite clay as prebiotic catalyst // II International conference Biosphere origin and evolution. Abstracts. – Loutraki, Greece, October 2007.– P. 86.
- Salomatina, O.V., Kuznetsova, Т.G., Korchagina, D.V., Paukshtis, E.A., Moroz, E.M., Volcho, K.P., Barkhash, V.A., Salakhutdinov, N.F. Effects of the properties of SO4/ZrO2 solid-phase catalysts on the products of R-(+)-limonene diepoxides transformation and reaction mechanism // III International Conference catalysis: fundamentals and application. Abstracts. – Novosibirsk, July 4-8, 2007. – V. II. – P. 365-366.
- Волчо, К.П., Салахутдинов, Н.Ф. Необычные превращения терпеноидов в присутствии кислотных глин // V Всероссийская научная конференция Химия и технология растительных веществ. Тезисы докладов. – Уфа, 8-12 июня 2008. – С. 17.
- Салахутдинов, Н.Ф., Волчо, К.П., Хоменко, Т.М., Конева, Е.А. Синтез биологически активных соединений асимметрическим металлокомплексным сульфоксидированием // Фундаментальные науки – медицине. Сборник трудов конференции. – Новосибирск, 2-5 сентября 2008 г. – С. 16-27.
- Салахутдинов, Н.Ф., Волчо, К.П., Хоменко, Т.М., Конева, Е.А. Асимметрическое металлокомплексное окисление сульфидов в синтезе биологически активных соединений // Органическая химия для медицины (Орхимед-2008). Сборник тезисов. – Московская обл., Черноголовка, 7-11 сентября 2008 г. – С. 223-224.
Формат бумаги 60х84 1/16. Объем 2 печ. л.
Заказ № Тираж 100 экз.
Отпечатано на ротапринте Новосибирского института
органической химии СО РАН им. Н. Н. Ворожцова.
630090, Новосибирск, 90, пр. акад. Лаврентьева, 9
[1] Newman, D.J. J. Med. Chem. – 2008. – V. 51. – P. 2589–2599.
[2] Кубиньи, Г. Рос. Хим. Ж. – 2006. – Т. L. – № 2. – С. 5-17.
[3] Chapuis, C., Brauchli, R. Helv. Chim. Acta. – 1992. – V. 75. – N 5. – P. 1527-1546; Bessiere-Chretien, Y., Montheard, J.P., El Gaied, M.M., Bras, J.P. C. R. Acad. Sci. Ser C. – 1971. – V. 273. – N 3. - P. 272-275; Amri, H., El Gaied, M.M., M’Hirsi M. J. Soc. Chim. Tunis. – 1983. – N 10. – P. 25-32.
[4] Salakhutdinov, N.F., Volcho, K.P., Il’ina, I.V., Korchagina, D.V., Tatarova, L.E., Barkhash, V.A. Tetrahedron. – 1998. – V. 54. – P. 15619-15642.
[5] Hamman, L.G., Meyer, J.H., Ruppar, D.A., Marschke, K.B., Lopez, F.G., Allegretto, E.A., Karanewsky, D.S. Bioorg. Med. Chem. Lett. – 2005. – V. 15. – N 5. – P. 1463-1466.
[6] Knoevenagel, E., Mottek, S. Chem. Ber. – 1904. – Bd. 37. – N 4. – S. 4464-4476.
[7] Kumarraja, M., Pitchumani, K. J. Mol. Catal. A: Chem. – 2006. – V. 256. – N 1-2. – P. 138-142.
[8] Sundarababu, G., Leibovitch, M., Corbin, D.R., Scheffer, J.R., Ramamurthy, V. Chem. Commun. – 1996. – № 18. – P. 2159-2160; Hutchings, G.J. Сhem. Commun. – 1999. – № 18. – Р. 301-306.
[9] Bentley, R. Chem. Soc. Rev. – 2005. – V. 34. – P. 609–624; Юнусов, С.Ю. Алкалоиды. Ташкент: ФАН, 1981. _ P. 212.
[10] Patent 9602535 WO. Larsson, E.M., Stenhede, U.J., Sorensen, H., von Unge, P.O.S., Cotton, H.K.; 01.02.1996.
[11] Patent 2003089408 WO. Thennati, R., Rehani, R.B., Soni, R.R., Chhabada, V.C., Patel, V.M.; 30.10.2003.
[12] Szakonyi, Z., Martinek, T., Hetenyi, A. Tetrahedron: Asymmetry. _ 2000. _ V. 11. _ P. 4571-4579; Gyonfalvi, S., Szakonyi, Z., Fulop, F. Tetrahedron: Asymmetry. _ 2003. _ V. 14. _ P. 3965-3972.
[13] Patent 9702261 WO. von Unge, S.; 23.01.1997.
[14] Makarieva, T.N., Stonik, V.A., Dmitrenok, A.S., Grebnev, B.B., Isakov, V.V., Rebachyk, N.M., Rashkes, Y.W. J. Nat. Prod. _ 1995. _ V. 58. _ P. 254-258; Lee, A.H.F., Chen, J., Liu, D., Leung, T. Y., Chan, A.S., Li, T. J. Am. Chem. Soc. _ 2002. _ V. 124. _ P. 13972-13973.
[15] Lee, A.H.F., Chan, A.S.C., Li, T. Bioorg. Med. Chem. Lett. _ 2002. _ V. 12. _ P. 3259-3261.
[16] Kimura, T., Hanzawa, M., Tsujimura, K., Takahashi, T., Kawai, Y., Horn, E., Fujii, T., Ogawa, S., Sato, R. Bull. Chem. Soc. Jpn. _ 2002. _ V. 75. _ P. 817-824.
[17] Rasheed, K. Warkentin, J.D. J. Org. Chem. _ 1979. _ V. 44. _ P. 267-274.

