Физико-химические ос новы и технологические принципы извлечения соединений цинка и меди аммиачно-аммонийной экстракцией
На правах рукописи
Перетрутов Анатолий Анатольевич
Физико-химические основы и технологические принципы извлечения соединений цинка и меди
аммиачно-аммонийной экстракцией
02.00.04 – Физическая химия
(технические науки)
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора технических наук
Нижний Новгород – 2010
Работа выполнена в Дзержинском политехническом институте Нижегородского
государственного технического университета им. Р.Е. Алексеева
Научный консультант: доктор химических наук, профессор
Карташов Виктор Романович
Официальные оппоненты: доктор технических наук, профессор
Михаленко Михаил Григорьевич
доктор технических наук, профессор
Живайкин Леонид Яковлевич
доктор химических наук, профессор
Зеленцов Сергей Васильевич
Ведущая организация:
Ивановский химико-технологический университет
Защита диссертации состоится «17» сентября 2010 года в 1300 часов на заседании диссертационного совета Д 212.165.06 при Нижегородском государственном техническом университете им. Р.Е. Алексеева по адресу: 603950, г. Нижний Новгород, ул. Минина, д. 24.
С диссертацией можно ознакомиться в библиотеке Нижегородского государственного технического университета им. Р.Е. Алексеева
Автореферат разослан « » августа 2010 г.
Ученый секретарь диссертационного совета Соколова Т.Н.
Общая характеристика работы
Актуальность проблемы. Диссертационная работа посвящена решению научно-технической проблемы формирования принципов организации технологий извлечения цветных металлов цинка и меди из поликомпонентных отходов на основе физико-химических характеристик, отражающих имманентные свойства перерабатываемых систем. Решением сформулированной проблемы обеспечивается экономически оправданная переработка медь и цинк содержащих отходов и вовлечение оставшихся компонентов (отвал) в производство строительных конструкций, плит, блоков и улучшение экологической обстановки в процессах производства серной кислоты, вискозного волокна, цинковых белил, цианистой меди, гальванических производствах и других. Химические превращения природных ресурсов приводят к образованию кроме целевых продуктов, используемых и неиспользуемых отходов, стоков и выбросов. Важной, современной, научной, технологической и эколого-экономической задачей является вовлечение в производственный процесс «текущих» и уже накопленных ранее на химических и других предприятиях отходов, содержащих тяжелые цветные металлы (ТЦМ), являющихся к настоящему времени источником загрязнения окружающей среды. Переработка отходов должна быть комплексной, исключающей образование вторичных неиспользуемых отвалов, стоков и решать проблему ресурсосбережения, поскольку использование отходов при внедрении различных методов извлечения позволяет увеличить выпуск ТЦМ на 1,9 миллиона тонн и сократить затраты первичного сырья белее чем на 10 млн. т.
Перспективными являются гидрометаллургические методы, как наименее энергоемкие по сравнению с термическими. Наиболее эффективными экстрагентами, позволяющими извлекать цинк и медь селективно от железа и других оксидов, являются, как это нами установлено, водные растворы аммиака, содержащие хлорид аммония.
Физико-химические основы и технологические принципы извлечения цинка и меди аммиачно-аммонийной экстракцией базируются на свойствах системы H2O-NH3-NH4Сl, содержащей аммиакаты цинка и меди, фазовых равновесиях жидкость – твердое, жидкость – пар. Преимущества разрабатываемой концепции заключается в применимости водно-аммиачно-аммонийной экстракции цинка и меди из различного типа отходов: огарков, шлаков, обезвоженных шламов, отработанных катализаторов и др.
Цель работы. Разработка технологических принципов утилизации твердых, шламовых и жидких отходов, содержащих цинк и медь на основе физико-химических свойств водно-аммиачно-аммонийной системы, содержащей аммиакаты цинка и меди.
Методическая часть. Объектами научной разработки были выбраны: пиритный огарок производства серной кислоты из колчедана, содержащий оксиды цинка и меди в сопоставимых количествах, шлак производства цинковых белил из цинкового лома, содержащий металлический цинк и оксиды цинка и меди с многократным превышением концентрации цинка над медью, шлам производства вискозного волокна, содержащий гидроксид цинка и остатки ксантагената целлюлозы, травильные растворы радиозаводов, содержащие хлорид меди в присутствии хлоридов железа, маточные растворы производства цианистой меди, содержащие ионы меди, цианиды, сульфаты, сульфиты и свободную серную кислоту.
Выбор широкого спектра отходов- объектов исследования позволил предметно определить общую методологию их переработки. Решению поставленных задач способствовало применение спектрофотометрического, термогравиметрического, хроматографического, рентгенофазового, микрорентгеноструктурного, кондуктометрического и других методов анализа. Исследование и проверка технологических решений были проведены на лабораторных, опытных и опытно-промышленных установках в условиях действующих цехов. По данным выполненных исследований предложены технологические схемы комплексной утилизации промышленных отходов.
Научная новизна. 1. Впервые сформулированы физико-химические основы извлечения соединений цинка и меди аммиачно-аммонийной экстракцией из промышленных отходов, содержащих оксиды железа и других металлов, выбран наиболее эффективный экстрагент. Экспериментально установлено наличие фазового равновесия в системах ZnO-CuO-NH3-NH4Cl-H2O, определены физико-химические свойства ненасыщенных и эвтонических растворов (pH, плотность, вязкость, поверхностное натяжение, удельная электропроводность), вычислены параметры физико-химических свойств (функция образования амминов металлов, коэффициент объемного расширения, энергия вязкого течения жидкости, парахор, ортохор). Динамическим методом определены характеристики паро-жидкостного равновесия в системе ZnO-CuO-NH3-NH4Cl-H2O, определены парциальное давление и энтальпии испарения воды и аммиака, нормальные температуры кипения растворов.
2. Установлены кинетические закономерности селективного выщелачивания цинка и меди из огарковых и шлаковых отходов; определены физико-химические структурные (пористость, удельная внутренняя поверхность, радиус пор) и физико-механические (грануляционный состав, насыпная плотность, механическая прочность, угол естественного откоса) свойства отходов, содержащих цинк и медь, оптимальные параметры обезвоживания цинксодержащих шламов и экстракции цинка из них.
3. Разработана технология выделения цинка и меди из аммиакатных растворов гидролитическим методом, меди из маточных растворов производства цианистой меди цементационно-сорбционным способом и реагентным методом из травильных растворов. Определены оптимальные параметры окисления цианидов и травильных растворов озоном малых концентраций. Разработаны, созданы, испытаны и внедрены образцы герметичных генераторов озона безбарьерного типа, отличающиеся простотой и надежностью конструкции. Дополнены сведения по растворимости систем CuCl2-NH4Cl-H2O и FeCl3-NH4Cl-H2O и физико-химическим свойствам ненасыщенных и эвтонических растворов.
4. Разработаны технологические основы использования пиритного огарка в качестве катализатора термического разложения отработанной серной кислоты с получением концентрированного оксида серы (IV).
5. Разработаны основы утилизации твердых отходов, освобожденных от цинка и меди в производстве красного железо-окисного пигмента и бетонных смесей.
Практическая значимость и реализация результатов работы:
1. Разработаны технологические схемы комплексной переработки огарков и шлаков, шламов и растворов. Оксид цинка, получаемый при селективной переработке огарка и шлака, испытан на ОАО «Корунд», признан пригодным в качестве белого пигмента для приготовления цветных красок. Комплексные растворы выщелачивания и двойная соль хлорной меди и хлорида аммония признаны НИУИФ в качестве источника микроэлементов для производства удобрений.
2. Испытаны отработанные огарок и шлак на ДОЗ-4 ОАО «Стройдеталь», ОАО «Силикатный завод» и ОАО «Авангард КНАУФ» в качестве заполнителей бетонных смесей в количестве до 15% от массы смеси; огарок - в качестве заменителя 10% воздушного вяжущего для силикатного кирпича, 10% гидравлических вяжущих в производстве бетонных блоков, гипсоцементных плит и перегородок, стеновых панелей, брусчатки, гипсоволокнистых плит; в качестве катализатора термического разложения отработанной серной кислоты, содержащей изопропиловый спирт, формалин, уротропин и др. органические примеси; в качестве сорбента сернистого ангидрида из выхлопных газов сернокислотных цехов и котельных установок.
3. Испытаны образцы отработанного огарка в качестве красного пигмента, по результатам составлены технические условия на пигмент.
4. Отработано обезвоживание цинксодержащего шлама вискозных производств на подложке из крошки каменного угля и кокса, шлаке производства цинковых белил; обезвоженный шлам рекомендовано использовать в соответствие с разработанными техническими условиями ТУ-48-6-104-88 в печах вельцевания заводов цветной металлургии.
5. Выявлено, что маточные растворы после удаления меди и окисления цианистых соединений озоном служат полуфабрикатами в производстве сульфата аммония, а травильные растворы, освобожденные от меди и окисленные озоно-воздушной смесью, используются для травления печатных плат.
Новизна, практическая значимость и реализация работы подтверждается актами внедрения, актами испытаний, 14 авторскими свидетельствами, 5 патентами Российской Федерации, 2 свидетельствами на полезные модели.
Основные результаты и положения, выносимые на защиту:
1. Физико-химические характеристики системы вода-аммиак-хлорид аммония, содержащей аммиакаты цинка и меди: фазовое равновесие в системе жидкость-твердое при растворении оксидов цинка и меди в аммиачной воде и водно-аммиачных растворах хлорида аммония; фазовое равновесие в системе жидкость – пар при удалении аммиака из аммиакатных растворов.
2. Совместная растворимость аммиакатов цинка и меди и характеристики эвтонических растворов и твердых фаз.
3. Технологические принципы водно-аммиачно-аммонийной экстракции цинка и меди из твердых и шламообразных промышленных отходов.
4. Технологические основы переработки аммиакатных экстрактов и жидких отходов гидролитическим и реагентным методами.
5. Технологические закономерности вовлечения отвалов, освобожденных от цинка и меди, в производство катализаторов, пигментов и строительных конструкций.
6. Комплексная технология утилизации отходов производства серной кислоты из колчедана и шлака производства цинковых белил.
Личный вклад автора. Обоснование и постановка теоретических и экспериментальных исследований. Разработка физико-химических основ изучаемого процесса. Разработка аппаратуры и методик экспериментальных исследований, участие в получении экспериментального материала, анализе и систематизации расчетных и экспериментальных данных, формулировании выводов и рекомендаций для использования в промышленности, участие в разработке комплексных технологических схем утилизации твердых, жидких и шламообразных отходов, содержащих цинк и медь.
Апробация работы. Материалы диссертации доложены и обсуждены на научных конференциях Нижегородского государственного технического университета им. Р.Е. Алексеева в 2000-2010гг.; на Всероссийской научно-технической конференции по Технологии неорганических веществ в 2001г. (Казань-Менделеевск); на Международной научно-практической конференции «Хозяйственно-питьевая и сточные воды. Проблемы очистки и использования» в 2000, 2001, 2005, 2008гг. (Пенза); Общероссийской научно-технической конференции «Новые технологии в азотной промышленности» 2003, 2007г (Ставрополь).
Публикации. Основные результаты диссертации опубликованы в 97 работах, среди которых 16 статей в центральных рецензируемых научных журналах, определенных Высшей аттестационной комиссией. По результатам работы получено 14 авторских свидетельств, 5 патентов РФ, 2 свидетельства на полезную модель.
Структура и объем работы. Диссертация состоит из введения, 6 глав, выводов, списка литературы и приложений. Содержание изложено на 370 страницах, включает 150 рисунков и 137 таблиц. Список литературы содержит 330 наименований.
ОСНОВНОЕ СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Литературный обзор
Выполнен анализ современного состояния использования промышленных отходов, содержащих тяжелые цветные металлы. Проведена классификация и составлен кадастр отходов, на основании литературных данных и результатов обследования более чем 70 предприятий химической, радиоэлектронной и местной промышленности.
Анализ публикаций по способам переработки отходов различного агрегатного состояния позволил выявить преимущества и недостатки известных методов, определить наиболее перспективные варианты извлечения цветных металлов из пиритного огарка, шлаков, зольников, шламов и других отходов, методы переработки получаемых экстрактов, промышленных жидких отходов и сточных вод. В итоге обобщения и оценки известных теоретических сведений и прикладных решений сформулированы цели и основные направления исследований, обоснован подход к разработке физико-химических закономерностей ресурсосберегающей технологии аммонийно-аммиачной экстракции цинка и меди и утилизации отвалов.
Разнообразие отходов и недостаточная изученность их свойств вызывает необходимость детального исследования состава отходов и их физико-химических структурных и физико-механических характеристик, определения экстрагирующей способности аммиачно-аммонийных растворов, изучения совместной растворимости оксидов тяжелых цветных металлов и принятия корректирующих решений для их переработки по защищаемой методологии, опирающейся на научные и технические разработки автора.
Растворимость оксидов меди и цинка в водных растворах, содержащих аммиак и хлорид аммония. О составе образующихся координационных соединений
Для решения поставленной задачи нами был проведен анализ химических процессов, которые можно было бы применить для селективного извлечения оксида меди и оксида цинка, содержащихся в относительно небольших количествах в твердых промышленных объектах.
На основе результатов анализа был сделан вывод, что химической основой при технологическом решении поставленной задачи может быть реакция оксидов меди и цинка с водно-аммиачным раствором, содержащим соли аммония. В качестве аммонийных солей был использован хлорид аммония. Проведенные опыты показали, что он является наиболее удобным с точки зрения полноты извлечения оксидов. Согласно литературным данным в этой реакции образуются координационные соединения с амминными лигандами, число которых зависит от соотношения реагентов.
МО(т) + х NH3(р-р) + 2 NH4Cl(р-р) [M(NH3)n]2+2Cl- +H2O(р-р), (1)
где М = Cu, Zn, n = x+2.
Реакция образования амминных комплексов переходных металлов на ранней стадии развития координационной химии, принадлежала к числу основополагающих и была предметом исследования значительного числа работ. С использованием растворимых солей металлов и растворов аммиака были проведены систематические исследования комплексообразования в этой системе и определены ступенчатые константы устойчивости.
М2+(р-р) + NH3(р-р) ![]() [M(NH3)n]2+(р-р) (2)
[M(NH3)n]2+(р-р) (2)
М2+ = Cu2+, Zn2+; n = 1 – 5.
Что касается реакций оксидов меди и цинка с аммиаком и хлоридом аммония в водном растворе в литературе по этому вопросу имеются лишь отрывочные сведения.
В связи с этим нами изучена растворимость оксидов меди и цинка в аммиачных растворах, содержащих NH4Cl, в широком интервале концентраций аммиака и хлористого аммония и проведен анализ состава образующихся координационных соединений. Для определения растворимости был использован изотермический метод снятия пересыщения, позволяющий исследовать не только состав жидкой фазы, но и твердой, находящейся в равновесии с жидкой. Это дало возможность определить растворимость CuО и ZnО как отдельно, так и при их совместном присутствии. Равновесные концентрации металлов, аммиака и хлорида аммония определены по известным методикам с погрешностью не более 0,1 – 0,05%.
Полученные данные по растворимости представлены на рисунках 1 – 3. В чистом виде CuО и ZnО практически не растворимы (так растворимость ZnО в воде составляет около 3 мг/л). Как видно из рисунков 1а и 1б в аммиачных растворах растворимость оксидов значительно возрастает за счет образования гидроксид амминных комплексов.
МО(т) + 2 NH3(р-р) + H2O ![]() [M(NH3)2]2+(ОН-)2(р-р), (3)
[M(NH3)2]2+(ОН-)2(р-р), (3)
Но для оксида меди она и в этом случае остается низкой (не более 0,1 моль/л), очевидно из-за неблагоприятного состояния равновесия в реакции 3.
Рис. 1. Влияние концентрации хлорида аммония и аммиака на равновесную растворимость оксидов меди (а) и цинка (б) при 293 К. Содержание аммиака, моль/л: 1 - 2,87; 2 - 5,62; 3 - 8,27; 4 - 10,84; 5 - 13,34
В присутствии хлорида аммония растворимость оксидов, особенно цинка, значительно возрастает (рис 1а и 1б). Это обусловлено тем, что катион аммония обладает хотя и слабыми, но кислотными свойствами (рКа = 9,3). Образующийся при диссоциации ион водорода способствует переходу оксидов металлов в их гидроксиды, которые согласно литературным данным вступают далее в реакции комплексообразования с аммиаком.
Н+
МО(т) + H2O ![]() M(ОН)2(р-р), (4)
M(ОН)2(р-р), (4)
M(ОН)2(р-р) + NH3(р-р) ![]() [M(NH3)2]2+(ОН-)2(р-р), (5)
[M(NH3)2]2+(ОН-)2(р-р), (5)
Другим фактором, способствующим увеличению растворимости оксидов под действием хлорида аммония, является переход гидроксидных комплексов (реакция 3) в хлоридные (реакция 1), которые термодинамически более стабильны.
[M(NH3)2]2+(ОН-)2(р-р) + 2НСl(р-р) ![]() [M(NH3)n]2+2Cl- +H2O(р-р), (6)
[M(NH3)n]2+2Cl- +H2O(р-р), (6)
Хлористая кислота, необходимая для превращения (5) в комплекс (6), образуется при диссоциации катиона аммония по реакции
NH4Cl(р-р) +H2O![]() НСl(р-р) + NH3(р-р) (7)
НСl(р-р) + NH3(р-р) (7)
Как видно из рисунка 1а растворимость CuO при определенной концентрации аммиака монотонно увеличивается при возрастании концентрации хлорида аммония, выходя в области больших концентраций на плато. Такое влияние хлорида аммония объясняется смещением равновесия (реакция 6) в сторону хлоридных комплексов и достижением максимальной полноты превращения исходного гидроксидного комплекса[M(NH3)2]2+(ОН-)2, где М = Cu. C другой стороны из результатов, представленных на рисунке 1а, также следует, что при заданной концентрации хлорида аммония растворимость резко возрастает при увеличении концентрации аммиака. Такая закономерность очевидно связана с образованием комплексов с более высоким числом лигандов.
[Cu(NH3)n]2+2Cl- (р-р) + NH3(р-р) ![]() [Cu(NH3)n]2+2Cl-(р-р), n>2 (8)
[Cu(NH3)n]2+2Cl-(р-р), n>2 (8)
Как видно из рисунка 1а при концентрациях аммиака около 10моль/л и высоких концентрациях хлорида аммония растворимость оксида меди приближается к максимальному значению. С учетом данных по комплексообразованию в реакции 8, можно сделать вывод, что растворимость в этой области определяется образованием тетракоординированных комплексов.
CuО (т) + 2 NH4Cl(р-р) + 2NH3(р-р) ![]() [Cu(NH3)4]2+(Cl-)2(р-р) (9)
[Cu(NH3)4]2+(Cl-)2(р-р) (9)
В литературе отмечалось, что при очень больших концентрациях аммиака в реакции 8 возможно образование пентакоординированных соединений, однако для исследуемого процесса эта стадия не наблюдается. Действительно, как видно из рисунка 1а при увеличении концентрации аммиака с 10,8 до 13,3 моль/л растворимость CuО практически остается постоянной. Это означает, что, если и существует принципиальная возможность присоединения пятого лиганда, константа полного образования пятикоординированного комплекса 5, при условиях, отмеченных на рисунке 1а, очень мала.
Известно, что константа химического равновесия в растворах очень сильно зависит от ионной силы. Учитывая это, нами изучена растворимость CuO при высоких концентрациях аммиака и хлорида аммония вплоть до границы образования насыщенного раствора соли. Как видно из рисунка 2 при концентрации NH4Cl 6 моль/л и выше кривые постоянной концентрации аммиака 4 и 5 существенно расходятся и максимальная растворимость CuO увеличивается до 3,3 моль/л. Полученные данные показывают, что при растворении оксида меди также происходит координация пятого лиганда с образованием [Cu(NH3)5]2+(Cl-)2, но при высоких значениях ионной силы.
Рис. 2. Равновесная растворимость растворов аммиаката меди. Содержание аммиака, (% масс.): 1– 0; 2– 2; 3– 5; 4– 10; 5– 15; 6- 20; 7- 25; А-А - линия равновесной растворимости хлорида аммония
Хотя при растворении ZnО наблюдаются близкие закономерности, этот процесс имеет и существенные отличия. Одно из них выражается в том, что при всех концентрациях аммиака при увеличении концентрации NH4Cl растворимость монотонно возрастает без ярко выраженного участка замедления (рис 1б). Другое отличие состоит в том, что при одинаковых параметрах исходного раствора растворимость ZnО существенно выше, чем растворимость CuO. При интерпретации этих особенностей на наш взгляд необходимо иметь в виду то обстоятельство, что в реакции 1 при постоянной ионной силе ступенчатые и полные константы образования для Zn2+ значительно меньше, чем для Cu2+, так полная константа образования 4 для тетраэдрического комплекса Zn2+ равна 2,9·109, а для меди 4,7·1012. Кроме того, даже при больших концентрациях аммиака предельное координационное число в реакции 1 не превышает 4. Как следует из данных, представленных на рисунке 1б при растворении ZnО закономерности координации аммиачных лигандов существенно другие, как по отношению к реакции 6, так и по отношению к процессу растворения CuO.
Более высокая растворимость ZnО говорит не только об увеличении констант равновесия под влиянием ионной силы, но и о том, что повышение констант в этом случае происходит в большей степени, чем в реакции с CuO, причем отсутствие участка с плато показывает, что эта тенденция сохраняется вплоть до границы насыщения раствора ( кривая А-А рис 3).
Рис. 3. Равновесная растворимость растворов аммиаката цинка. Содержание аммиака, (% масс.): 1– 0; 2– 2; 3– 5; 4– 10; 5– 15; 6- 20; 7- 25; А-А - линия равновесной растворимости хлорида аммония
Ход кривых равновесия 4 и 5 на рисунке 3 может свидетельствовать и о том, что растворимость ZnО при высоких значениях ионной силы определяется не только увеличением констант комплексообразования, но также и образованием комплексов с числом лигандов более 4, подобно тому как это имеет место в реакции с CuO.
В целом полученные данные показывают, что при растворении CuO и ZnО имеет место другая схема взаимодействия металла с лигандами, по сравнению с той, которая наблюдается в реакции 1 при постоянной ионной силе.
Парожидкостное равновесие в системе H2O-NH3-NH4Cl, содержащей амминные соединения цинка и меди
Для нахождения теплот испарения аммиака и воды при термической обработке растворов амминных соединений цинка и меди нами была определена температурная зависимость парциальных давлений аммиака и паров воды над растворами, содержащими указанные выше координационные соединения.
Для определения давления насыщенных паров использовалась описанная в литературе установка, модернизированная нами с учетом особенностей изучаемой системы. Сравнение данных по парциальным давлениям водяных паров и аммиака, полученных в настоящей работе, с имеющимися в литературе, показало их хорошую сходимость.
Объектом исследования был раствор, содержащий 2,87 моль/л аммиака, 1,13 моль/л хлорида аммония, 0,016 моль/л оксида меди и 0,382 моль/л оксида цинка. Раствор данного состава, как будет показано ниже, оказался наиболее оптимальным для экстракции оксидов металлов по предложенной технологии.
Парциальные давления аммиака и паров воды определяли в интервале температур 293,2 – 323,2 К (рис. 4). При определении теплот испарения паровая фаза рассматривалась в обычном предположении как смесь идеальных газов.
В соответствии с термодинамикой фазового равновесия жидкость – пар при температуре Т для воды имеет место соотношение:
0(п) + RTlnPH2O = 0(ж) + RTlnхН2ОН2О (10)
где 0(п), 0(ж) – стандартные химические потенциалы пара и жидкой воды соответственно; PH2O – парциальное давление водяных паров при температуре Т; хН2О, Н2О – мольная доля и коэффициент активности воды в растворе i – го состава.
После деления обеих частей уравнения (10) на температуру и дифференцирования полученного соотношения по данному параметру с учетом уравнения Гиббса – Гельмгольца для химических потенциалов имеем:
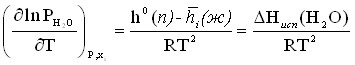 (11)
(11)
где h0(п) – мольная энтальпия пара со свойствами идеального газа; ![]() – мольная парциальная энтальпия воды в растворе i-го состава; Нисп (Н2О) – энтальпия испарения воды из раствора i-го состава.
– мольная парциальная энтальпия воды в растворе i-го состава; Нисп (Н2О) – энтальпия испарения воды из раствора i-го состава.
Аналогично для аммиака получаем:
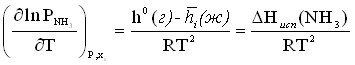 (12)
(12)
где h0(г) – мольная энтальпия газообразного аммиака; ![]() – мольная парциальная энтальпия аммиака в растворе i-го состава; Нисп(NН3) – энтальпия испарения жидкого аммиака из раствора i-го состава в равновесный с ним пар.
– мольная парциальная энтальпия аммиака в растворе i-го состава; Нисп(NН3) – энтальпия испарения жидкого аммиака из раствора i-го состава в равновесный с ним пар.
При интегрировании выражений (11) и (12) в предположении постоянства Нисп получаем уравнение (13):
![]() (13)
(13)
Соотношение (13) в небольшом температурном интервале в координатах lnPi – f(1/T) для однокомпонентных систем обычно выражается линейной зависимостью. Для данной системы она также линейна (рис. 4б). Это позволило на основании экспериментальных данных рассчитать Нисп аммиака и воды. Вычисленные энтальпии испарения аммиака и воды из аммиачных растворов приведены в таблице.
Таблица. Энтальпии испарения
| Концентрация: аммиак, хлорид аммония, цинк, медь, моль/л | 1,146 - - - | 1,412 - - - | 2,87 - - - | 2,87 1,13 0,382 0,016 |
| 33,1 | 33,2 | 34,3 | 34,7 | |
| 43,7 | 43,8 | 44,0 | 44,9 |
Рис. 4. Влияние температуры на парциальное давление аммиака (1) и паров воды (2) над растворами аминов; а – Р = f(T); б – lnP = f(1/T)
Как видно из приведенных данных Нисп из аммиачных растворов практически совпадают с теплотами испарения из технологического раствора. Это свидетельствует о том, что координационные соединения и растворенный NH4Cl оказывают мало влияния на теплоты испарения.
Увеличение концентрации меди и цинка в аммиачно-аммонийных растворах вызывает изменение не только парциального давления, но и физико-химических свойств, в частности плотности, вязкости, поверхностного натяжения, электропроводности. Названные свойства полученных растворов аммиакатов меди и цинка были определены по известным методикам при температурах 293 – 323 К. Проведена обработка результатов и рассчитаны парахор, ортохор, энергия активации вязкого течения жидкости, коэффициент объемного расширения, степень и константа диссоциации. Нарастание плотности растворов в области концентраций выше 180 г/л хлорид-иона (рис. 2 и 3) происходит вследствие увеличения концентрации хлорид-иона и растворенного металла. Вязкость при этом тоже увеличивается, несмотря на повышение концентрации аммиака.
Совместная растворимость оксидов меди и цинка в водных растворах, содержащих аммиак и хлорид аммония
Совместную растворимость CuО и ZnО изучали при различных концентрациях аммиака и хлорида аммония, которые в определенном интервале концентраций Zn2+ и Cu2+ поддерживали постоянной, то есть с использованием изоконцентрат аммиака и хлорида аммония. Полученные данные в прямоугольных координатах представлены на рис 5 и 6.
Основные особенности совместной растворимости рассмотрим сначала на примере диаграммы состояния с различными изоконцентратами аммиака, но при одной и той же концентрации хлорида аммония (5,07 моль/л), рис 5.
На диаграмме состояния (рис. 5) область I ниже линии изоконцентраты 5 область ненасыщенных растворов амминных комплексов цинка и меди. Аналогичный смысл имеют области ниже линий изоконцентрат 4, 3, 2 и 1.
Фигуративные точки а, b, с, d, e – точки, определяющие состав жидких эвтоник, находящихся в равновесии с твердыми фазами [Zn(NH3)n]2+(Cl-)2 и [Cu(NH3)n]2+(Cl-)2.
Линия Fe – линия равновесия между раствором, содержащим амминные комплексы Zn2+ и Cu2+, насыщенным по отношению к комплексу Zn2+. Аналогично линия eD – линия равновесия между раствором комплексов Cu2+ и Zn2+, но насыщенным по отношению к комплексу Cu2+. Как видно из рис. 5 амминные комплексы Zn2+ и Cu2+ по отношению друг к другу проявляют эффект высаливания, причем высаливающий эффект комплексов цинка значительно больше, чем комплексов меди. Так, в отсутствие комплексов цинка растворимость CuО при указанной выше концентрации хлорида аммония равной 5,07 моль/л, и для изоконцентраты «5» составляет 2,72 моль/л. В присутствии комплексов Zn2+ растворимость CuО быстро снижается и для эвтонического раствора она составляет 0,29 моль/л. Из данных, приведенных на рис 5 видно, что в присутствии комплексов меди растворимость ZnО также уменьшается, но в значительно меньшей степени: с 3 моль/л до 2,9 моль/л (эвтонический раствор).
Аналогичным образом интерпретируются данные и для других изоконцентрат аммиака (4, 3, 2, 1). Точки эвтоник укладываются на прямую линию, уравнением которой может быть зависимость концентрации цинка (z) или меди (y) от массовой доли аммиака (x) в исходном растворе:
z =6,8197x + 21,363; y =0,5684x + 0,956. (14)
На рис 6 представлена полная диаграмма состояния, отображающая растворимость ZnО и CuО при различных изоконцентратах аммиака (% масс.) и хлорида аммония, выраженных через грамм хлорид-аниона/литр, что удобнее для технологических расчетов.
В правой части рис. 6 в увеличенном масштабе даны результаты растворимости для изоконцентрат по аммиаку в отсутствие хлорид-иона. Эвтонические точки, как и в случае с концентрацией хлорида аммония 150 г/л укладываются на линии, уравнением которых является z = кy, где z – концентрация цинка, г/л; y – концентрация меди, г/л; к – коэффициент пропорциональности. В изученных пределах концентраций аммиака и хлорида аммония уравнение, охватывающее их влияние, представляется в виде z = (к0 – аеbr)y, где r – концентрация хлорида аммония, в пересчете на хлорид-ион, г/л; к0, а, b – коэффициенты, к0 = 17; а = 11,95; b = – 0,0076.
Рис. 6. Равновесная растворимость цинка и меди в аммиачно-хлоридных растворах при 293,15 К: изоконцентраты хлор-иона, г/л I - 0; II - 43,7; III - 150; IV - max; изоконцентраты аммиака, % 1 - 2; 2 - 5; 3 - 10; 4 - 15; 5 - 20; 6- 25; а - левая часть диаграммы; б - правая часть диаграммы; в - область малых концентраций
Первая область насыщенных растворов, равновесных с твердой фазой с полюсом оксида цинка, представленная линиями с уравнением z = py + s, где p и s – коэффициенты пропорциональности, которые могут быть рассчитаны из выражений: p1 = (510-5r + 0,0018)x – 0,0009r – 0,5444;
s1 = (0,0199r + 1,9352)x + 0,0876r + 10,894, где х – концентрация аммиака, %.
Вторая область насыщенных растворов, равновесных с твердой фазой с полюсом оксида меди, представленная линиями с аналогичным уравнением, в котором коэффициенты пропорциональности p и s определяются из уравнений:
p2 =(510-5r + 0,005)x –0,0006r–1,5122; s2=(0,0197r + 2,409)x +0,0903r+ 12,813.
Изменение совместной растворимости цинка и меди при постоянной концентрации аммиака в зависимости от хлорида аммония на линиях эвтоник описываются уравнениями экспонент в виде z = hejy, где h и j – коэффициенты пропорциональности, равные: h = 0,2241x + 2,251; j = – 0,0241x + 0,7377.
Таким образом, с помощью приведенных уравнений может быть описана вся область растворимости в изученных пределах при постоянной температуре.
Увеличение температуры от 293 до 323 К повышает совместную растворимость оксидов меди и цинка во всех исследованных растворах аммиака. В равновесных растворах вблизи эвтонических точек физико-химические свойства проявляют экстремальный характер. Для подтверждения наличия эвтоник было проведено изучение физико-химических свойств доэвтонических, эвтонических и заэвтонических растворов: плотность, вязкость, поверхностное натяжение, удельная электропроводность. Численные значения плотности, вязкости, поверхностного натяжения, удельной электропроводности в направлении эвтоники возрастают, в послеэвтонических точках уменьшаются.
Результаты химического анализа твердых фаз показали содержание в них цинка, меди, ионов хлора и аммония.
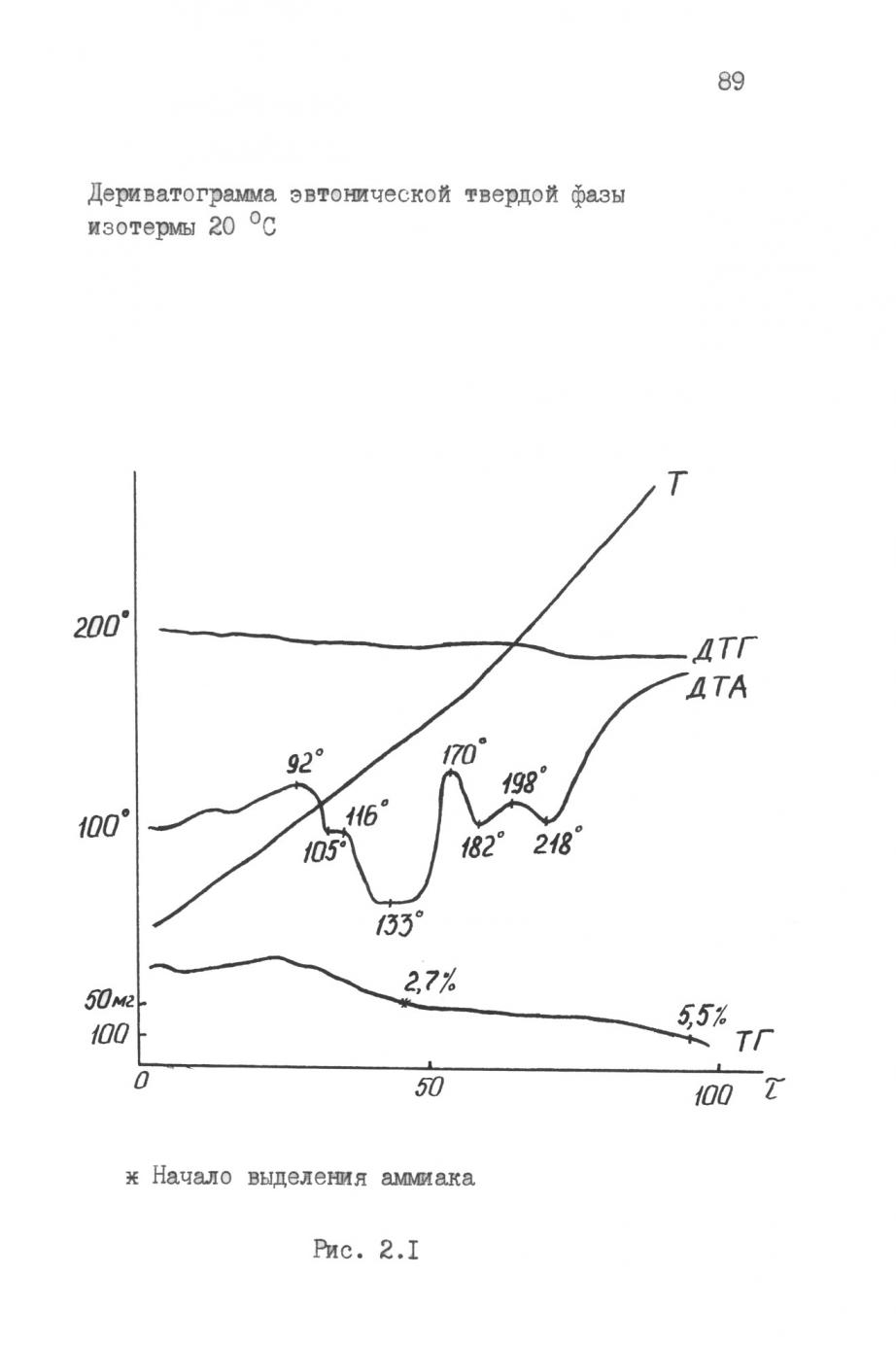
Помимо химического были проведены дериватографический (рис. 7), рентгенофазовый и ИК-спектроскопический анализы эвтонических твердых фаз. Полученные данные показывают присутствие ионов хлорида и аммония в твердых фазах, равновесных с эвтоническими растворами, причем для растворов с массовой долей аммиака 5 % твердая фаза содержит больше хлорид-иона, чем твердая фаза 10%-ного раствора. Это характерно для всех температур от 293 до 323 К. Отмеченное более, чем двукратное превышение концентрации хлорид-иона говорит о наличии более значительного эффекта высаливания хлорида аммония в растворах с низким содержанием аммиака. Химический анализ эвтонических твердых фаз также показал, что содержание цинка в твердой фазе всегда превалирует по сравнению с медью. Предполагая, что ион аммония в твердой фазе полностью связан с хлорид-ионом, можно заключить, что количество хлорид-иона, не связанное в NH4Cl практически эквивалентно соединению [Zn(NH3)2]Cl2. Это одна предполагаемая твердая фаза, второй твердой фазой более вероятно соединение [Cu(NH3)2]Cl2.
Анализ дериватограмм подтверждает наличие кристаллизационной воды в соединении для всех эвтонических комплексов. С увеличением температуры растворения количество кристаллизационной воды в твердых эвтонических фазах уменьшается. Подтверждено наличие аммиака в соединении, процесс выделения которого идет при температурах от 180 до 220 °С. Соединение характеризуется как достаточно прочное, т.к. заметная потеря веса начинается при температуре более 100 °С. В этой области наблюдается экзотермический пик. При температуре 120 °С начинается разложение соединения, о чем свидетельствуют эндотермические пики. При анализе рентгенограмм эвтонических твердых фаз были идентифицированы следующие соединения: Zn(NH3)2Cl2, ZnO, Cu(NH3)2Cl2, CuO.
Соединение, анализ которого выполнен ИК-спектроскопическим методом, относится к аминным комплексам, однако колебательные частоты и относительные полосы конкретно для соединений аммиакатов меди и цинка смещены.
Проведенные химический, дериватографический, ИК-спектроскопический и рентгенофазовый анализы позволили сделать предположение о присутствии нового соединения, ранее не установленного, отвечающего эвтонической точке и представляющего собой, в соответствие с химическим анализом эвтоники, равномерную механическую смесь, в которой отношение цинка к меди 1,5 : 1. В соответствии с этим вероятной представляется брутто формула нового соединения: Zn3Cu2(NH3)8Cl2.
В завершении исследований фазового равновесия в системе жидкое-твердое определили плотность и вязкость насыщенных растворов, находящихся в равновесии с тремя твердыми фазами, а также в до и после эвтонических точках. В эвтонических точках физико-химические свойства экстремально увеличены.
Из приведенных результатов растворимости был выполнен прогноз о применимости аммиачной воды для выщелачивания меди и цинка из отходов с низким содержанием оксидов (пиритный огарок) с последующим концентрированием экстрактов с помощью обратноосмотических мембран. Отходы с высоким содержанием цинка и меди (шлак производства цинковых белил), следует экстрагировать аммиачно-аммонийными растворами с промежуточным донасыщением хлоридом аммония.
Разработка стадий извлечения цинка и меди из твердых отходов
Предварительно был проанализирован химический и фракционный состав пиритного огарка, определены насыпная масса, угол естественного откоса, механическая прочность гранул; пористость, удельная внутренняя поверхность, размер пор. По принятой классификации пористой структуры пиритный огарок является дисперсным веществом глобулярной структуры с пористостью 0,48см3/см3, удельной внутренней поверхностью от 5,69 до 12,12 м2/см3, размером первичных частиц от 130 до 270 нм, с радиусом пор от 45 до 95 нм, что позволяет по эффективному радиусу кривизны поры отнести к переходным, а огарок к макропористым структурам.
Совместную экстракцию цинка и меди осуществляли водным раствором аммиака при Т:Ж=1:10. Для экстракции использовали пиритный огарок после печи КС, содержащий 1% цинка и 0,43 % меди. С ростом исходной концентрации аммиака в экстрагенте и времени экстракции возрастает степень извлечения обоих компонентов, однако, для цинка выявлена оптимальная концентрация аммиака, близкая к 5 %, оптимум для меди отсутствует. В водорастворимой форме в огарке присутствует до 10 - 11% меди и цинка, причем полное извлечение водорастворимых соединений происходит в начале опыта. Определено влияние отношения Т:Ж на процесс водно-аммиачной экстракции цветных металлов при концентрациях аммиака 5 и 10 %, с увеличением Т:Ж возрастает концентрация извлекаемых компонентов в растворе, и одновременно уменьшается степень извлечения. При Т:Ж=1:20 достигается извлечение более 85 % цветных металлов, содержащихся в огарке, с практической точки зрения приемлемым отношением является Т:Ж равное 1:5 – 1:10. Метод выщелачивания может быть реализован при использовании шаровой мельницы мокрого помола, обеспечивающей более высокую (95 – 97%) степень извлечения цветных металлов, благодаря механической активации, дополнительному измельчению частиц огарка и вскрытию зерна оксида железа, что в последствии обеспечит возможность использования отвала огарка для производства красного железо-окисного пигмента.
В работе проведено шесть серий опытов экстракции водно-аммиачными растворами, содержащими анионы аммонийной соли. По результатам выщелачивания всеми использованными экстрагентами установлено, что наиболее эффективным является раствор хлорида аммония в аммиачной воде, содержащий 12,96 % аммиака и 6,7% хлорида аммония, который извлекает одновременно цинк и медь на 99,6 и 96,1% соответственно при 293 К за 240 минут и Т:Ж =1:10.
Определено, что процесс интенсивной экстракции ограничивается 30 минутами. За кинетическую модель может быть принята дисперсная система с неизменяющейся поверхностью и концентрацией ионов цинка в пиритном огарке. Порядок реакции по аммиаку принимается равным нулю, так как аммиак в избытке. В этом случае скорость реакции пропорциональна первой степени концентрации реагирующего вещества и описывается уравнением:
![]() , где f – удельная внутренняя поверхность частиц огарка, м2/см3, а К – константа скорости реакции:
, где f – удельная внутренняя поверхность частиц огарка, м2/см3, а К – константа скорости реакции:![]()
![]() , где СА – исходная концентрация реагирующего хлорида аммония, моль/л; Х концентрация образующегося вещества, моль/л в момент времени. Величина энергии активации извлечения меди и цинка (3819,063 и 6684,01 Дж/(моль·К) соответственно) указывает, что процесс лимитируется диффузионными факторами. Численные значения константы скорости извлечения меди из огарка 3,09·10–6–2,02·10–6 1/с имеют тенденцию к снижению с увеличением температуры, а численные значения константы скорости экстракции цинка из огарка 1,64·10–5–2,35·10–5 1/с увеличиваются с повышением температуры.
, где СА – исходная концентрация реагирующего хлорида аммония, моль/л; Х концентрация образующегося вещества, моль/л в момент времени. Величина энергии активации извлечения меди и цинка (3819,063 и 6684,01 Дж/(моль·К) соответственно) указывает, что процесс лимитируется диффузионными факторами. Численные значения константы скорости извлечения меди из огарка 3,09·10–6–2,02·10–6 1/с имеют тенденцию к снижению с увеличением температуры, а численные значения константы скорости экстракции цинка из огарка 1,64·10–5–2,35·10–5 1/с увеличиваются с повышением температуры.
Полнофакторный эксперимент и его оптимизация позволили найти уравнения адекватно описывающие процесс выщелачивания меди и цинка:
Y = 44,562 – 2,05Х1 – 6,4919Х2 – 3,2Х3 + 19,92Х4 + 27,83Х5; (15)
Y = 61,082 + 3,712Х1 + 8,314Х2 + 28,703Х3 - 4,194Х4 - 14,278Х5, (16)
где Х1 – температура, которая варьировалась от 283 °К до 313 °К; Х2 – соотношение Т:Ж, которое изменялось от 1:2 до 1:10 (0,5-0,1); Х3 – изменение концентрации аммиачно-буферного раствора по хлориду аммония от 0 % до 6,7 %; Х4 – время от 30 до 120 минут; Х5 – изменение концентрации аммиачно-буферного раствора по аммиаку от 0 % до 12,96 %.
Вторым твердым отходом, из которого было отработано извлечение цинка и меди был шлак производства цинковых белил, представляющий собой сухие твердые агломераты спекшихся частиц серого и темно-серого цвета, с содержанием оксида цинка более 10 %. Были проведены рентгенофазовые, рентгеноструктурные и микроскопические исследования (прибор EU/CHAN) поверхности шлака, которые показали наличие оксидов меди и цинка в изучаемых образцах, а также металлических частиц цинка. Определены физико-механические свойства шлака: насыпная масса, удельная внутренняя поверхность, пористость, угол естественного откоса различных фракций. Аналитические и рентгенографические исследования показали, что шлак представляет собой сложную систему, содержащую в своем составе соединения кремния, кальция, магния, меди, железа, цинка и металлический цинк.
В ходе технологических исследований определено влияние размера фракций, отношения Т:Ж, температуры, количественного соотношения аммиака и хлорида аммония между собой и к извлекаемым металлам на полноту и скорость процесса выщелачивания цинка и меди аммонийно-аммиачно-хлоридным и аммонийно-аммиачно-сульфатным экстрагентами. Оптимальная концентрация хлорида аммония в растворе составляет 6,7 – 10 %. Максимум извлечения цинка приходится на массовые доли аммиака и хлорида аммония соответственно 5 и 10 %, то есть при их отношении, равном 1:2. Извлечение цинка и меди из шлака следует производить селективно с двухстадийным выщелачиванием, при котором на первой стадии проводится обработка шлака 5 %-ным аммиаком (степень извлечения меди 99,3 %), а на второй стадии обработка раствором с массовой долей аммиака 5 % и 10 % хлорида аммония (степень извлечения цинка 91 %). Из двух растворов, первый содержит медь с массовой концентрацией 1,5 г/л, а второй – цинк с массовой концентрацией 24,5 г/л.
Выполнена проверка выщелачивания шлака аммиачно-хлоридным и аммонийно-сульфатным растворами на укрупненной установке с реактором объемом 10 л, результаты исследований близки к лабораторным.
Ввиду того, что при обработке шлака образуются растворы, содержащие 20 – 30 г/л цинка, периодическая экстракция протекает в условиях понижающейся концентрации аммиака и хлорида аммония, что снижает скорость и полноту выщелачивания. Для компенсации затраченных количеств аммиака и хлорида аммония необходимо дополнительно вводить эквивалентные количества реагентов. Влияние компенсации затраченных реагентов было определено в серии опытов с одно- и двухкомпонентным укреплением растворов (рис. 8). При компенсации и трехкратной обработке новых порций шлака конечная концентрация цинка в растворе составила 40,3 г/л, меди – 1,28 г/л.
Из крупных фракций шлака цинк и медь трудно выщелачиваются в виду неразвитой удельной поверхности, недостаточного вскрытия частиц оксидов цинка и меди при помоле. Металлический цинк, обладая пластичностью, при размоле шлака не дробится, а деформируется, превращаясь в пластинки, поверхность которых незначительна. В этих же фракциях присутствуют ферраты цинка Fe3Zn10 и FeZn7. Был исследован состав фракций шлака рентгенофазовым анализом, определены удельная поверхность, удельный объем пор и средний радиус пор. Удельная внутренняя поверхность всех фракций от 0,25 до 2,3 мм составляет порядка 1,4 м2/г, то есть внутренняя поверхность не развита. Средний радиус пор для мелких фракций 13,5 нм, в крупных фракциях значительно ниже – 8,6 нм. При подборе режима выщелачивания можно увеличить полноту извлечения цветных металлов даже из трудно выщелачиваемого шлака и осуществить селективное извлечение вначале меди, а потом цинка.
При совместном добавлении аммиака и хлорида аммония для той же фракции шлака конечная достигнутая концентрация цинка и меди составила 53,3 г/л и 0,91 г/л соответственно, для более крупной фракции 41,86 г/л и 0,95 г/л, что значительно выше результатов экспериментов с однокомпонентной компенсацией хлоридом аммония и отдельно аммиаком. Концентрация цинка при этом в растворе значительно превышает результаты первичного выщелачивания, и растворы могут быть использованы для получения чистых оксидов или в качестве источника микроэлементов для комплексных удобрений.
Для интенсификации водно-аммиачно-аммонийной экстракции цинка и меди из шлака была использована шаровая мельница, где процесс измельчения твердых частиц шарами совмещается с образованием тетрааммиакатных комплексов. Сопутствующие оксиды Ca, Mg, Fe не растворимы в буферных растворах и оставались в шлаке. Для шаровых мельниц выбранного диаметра (0,14 и 0,2 м) рассчитаны критическая (114 и 95 об/мин) и оптимальная (94 и 78 об/мин) скорости вращения, масса загрузки (20 и 50 г), диаметр мелющих тел (35 мм) и производительность (3,810-5 т/ч). В связи с тем, что процесс выщелачивания находится во внутренне диффузионной области, измельчение частиц в процессе выщелачивания облегчает доступ к извлекаемому компоненту, уменьшает путь обратной диффузии в порах и в целом ускоряет массообменный процесс и увеличивает полноту извлечения. Было изучено влияние времени выщелачивания, отношения твердой и жидкой фаз, размера фракций шлака, массы загружаемых шаров, диаметра барабана шаровой мельницы на степень выщелачивания цинка и меди из производственного отхода. Аналогично опытам в реакторе с мешалкой было проведено выщелачивание цинка с промежуточным добавлением реагентов в раствор в ходе процесса. Степень извлечения цинка за 4 часа при промежуточном укреплении экстрагента через 0,5 часа в 1,33 раза превышает таковую в опыте без него (рис. 9). Отмечено, что, как и в опытах в реакторе с мешалкой, укрепление раствора, вызывающее увеличение концентрации тетрааммиаката цинка, приводит к высаливанию тетрааммиаката меди, в результате общая степень выщелачивания меди не превышает 13,5 процентов при концентрации меди в растворе 0,2 г/л, т.е. обеспечивается довольно высокая селективность извлечения цинка, что важно для дальнейшей переработки растворов на оксид цинка.
Методика извлечения цинка из шлака путем выщелачивания аммиачно-аммонийным раствором использована для экстракции цинка из шламовых отходов производства вискозного волокна. Отличие заключается в необходимости обезвоживания шлама как текущего, так и из накопителей. Обезвоживание шлама разработано с использованием подложек из зернистого материала на бельтинговой перегородке при фильтровании шлама. Способ обезвоживания шлама зарегистрирован в реестре изобретений под №1660716, способ извлечения цинка из обезвоженного шлама - под №1680788. По результатам экспериментов определены постоянные фильтрования, удельные сопротивления осадков и удельные сопротивления фильтровальных перегородок с подложкой.
Результаты испытаний в условиях опытного цеха НПО “Химволокно” г. Мытищ и ПО “Химволокно” г. Тверь на нутч-фильтре диаметром 0,5 м с использованием бельтинговой фильтровальной перегородки при постоянном разряжении 0,059 МПа подтвердили возможность обезвоживания шлама на крошке каменного угля или коксика до 36,9-39,9 %-ной влажности при 99,6-99,8 %-ной степени очистки. Последующее использование подложки и шлама предусмотрено в печах вельцевания. По результатам разработана опытно-промышленная схема для непрерывного ведения процесса с использованием ленточного фильтра с подложкой.
Полученные растворы тетрааммиаката цинка могут служить источником цинка для производства микроудобрений, цинковых белил методом отгонки аммиака и гидролитического осаждения оксида цинка или производства металлического цинка электрохимическим способом.
Разработка стадии выделения тяжелых цветных металлов из растворов
При отгонке аммиака из полученных аммиачных экстрактов путем кипячения происходит постепенное удаление свободного аммиака, а затем и аммиака, входящего в аммиачный комплекс. При этом аммиачный комплекс из тетрааммиакатного превращается в диаммиакатный, а затем и в гидроксид комплексообразователя. Эти процессы сопровождаются снижением рН раствора при отгонке аммиака, выделением меди и цинка в осадок различного состава. Теплота для выделения в осадок 1 моля цинка складывается из теплоты нагрева раствора до заданной температуры, теплоты разложения тетрааммиаката, теплоты отгонки аммиака и теплоты испарения воды.
Путем дробной отгонки аммиака из растворов выщелачивания пиритного огарка получаются концентраты, содержащие до 97,8 % оксида цинка при рН=9,1 – 9,0 и до 75 – 80% оксида меди при рН=7,0. При совместном осаждении и полном удалении аммиака получаемые концентраты содержат 63,4 – 60,5 % цинка и 44,0 – 73,0 % меди. Переработка экстрактов селективного выщелачивания пиритного огарка проходит практически со 100%-м осаждением оксида цинка при рН = 9,1, медь в концентрате не содержится.
В результате аммиачной экстракции тяжелых цветных металлов образуются растворы, концентрация которых не превышает 0,5 г/л меди, цинка – 2,0 г/л. Малоэнергоемким методом концентрирования таких растворов является обратный осмос. На пористой обратноосмотической мембране МГП-95 в циркуляционном режиме под давлением 4,0 МПа селективность по тяжелым цветным металлам при мембранном концентрировании аммиачных вытяжек пиритного огарка составляет практически 100 %, селективность по аммиаку 22 и 29,3 % при 5 и 10% NH3 соответственно, проницаемость мембраны 2,8 л/часм2. Следовательно, происходит одновременное уменьшение концентрации аммиака в растворе в 3 – 4 раза, поэтому последующая переработка концентрата требует во столько же раз меньшего расхода теплоты для отгонки аммиака при осаждении оксидов металлов.
Переработка аммиачно-аммонийных экстрактов после обработки шлака производства цинковых белил и обезвоженного шлама производства вискозного волокна, содержащих до 49 г/л цинка, осуществляется гидролитическим осаждением после отгонки аммиака за 30 минут под остаточным давлением 70 кПа. В результате образуется концентрат, производственные испытания высушенной при 105°С опытной партии которого показали, что потеря массы при прокаливании составляет 16,8 %, остаток на сите 0,0056 – 0,0063 соответственно 7 и 5 %, маслоемкость 39,4 г на 100 г пигмента. Указанные характеристики свидетельствуют о возможности использования получаемого оксида в качестве цинковых белил в соответствии с ОСТ 6-10-448-83 для цветных красок.
Разработана технология утилизации маточных растворов производства цианистой меди, которые получаются при осаждении и фильтровании Cu2(CN)2 и содержат сульфат аммония 163,7-175,6г/л, цианиды 0,43-3,3г/л, серную кислоту 9,4-23,3г/л, оксид серы(IV) 1,62-2,85г/л, медь(II) 0,02-0,45г/л, среда имеет рН =1,0, плотность при 20°С 1000 кг/м3. Для производства гранулированного азотсодержащего удобрения из них необходимо предварительное удаление меди и окисление цианидов. Извлечение меди осуществляли сорбционно-цементационным методом. В статическом и динамическом режиме определены СОЕ и ДОЕ шлака производства цинковых белил, которые позволили выбрать оптимальные параметры очистки растворов от меди и цинка: фракция шлака 0,631,0 мм, средняя скорость пропускания 13,5 м3/м2ч, рН среды 9, процесс цементации двух стадийный. Первая стадия в динамическом режиме для очистки от ионов меди, вторая - отстаивание раствора в статическом режиме для удаления ионов цинка. Определены константы скорости процесса цементации меди на металлическом цинке, содержащемся в шлаке. Процесс контролируется и диффузионным и химическим сопротивлениями и лежит в промежуточной области, в которой скорость процесса определяется как скоростью самой реакции, так и скоростью диффузии
М = [V/(·S)].[C0 ln(C0/C) – ·Cх], (17)
где М – константа цементации (как результирующая скорости самого процесса и скорости диффузии), г/м2с; V – объём раствора, м3; S – поверхность шлака, м2; C0 – начальная концентрация ионов вытесняемого металла, г/м3; C - концентрация ко времени, г/м3; - время цементации, с; Cх - концентрация ионов вытесняемого металла осажденных из единицы объема раствора, г/м3; - коэффициент диффузионного торможения процесса (0<<1). При = 0 уравнение превращается в кинетическое уравнение первого порядка, при = 1 реализуется внутренний диффузионный режим, а в случае соизмеримых скоростей диффузии и химической реакции значение лежит между нулем и единицей.
Константа цементации, определенная по уравнению (7), имеет значение 2,79.10-8 г/м2.с во всем изученном интервале концентраций и может быть применена для расчета аппарата колонного типа.
Окисление цианидов осуществляли озонированием с использованием безбарьерного генератора озона. Результаты окисления цианидов в маточных растворах с их содержанием в пересчете на синильную кислоту от 0,34 до 2,12 г/л ОВС с малой концентрацией озона (от 0,7 до 3,1 мг/л) свидетельствуют о возможности глубокого их обезвреживания с достаточной скоростью. Рекомендуемыми параметрами процесса являются: начальная концентрация ОВС 2,4–3,1 мг/л, время обработки 20-30 минут, рН 9–11, время пребывания 0,019–0,028 с, фиктивная линейная скорость ОВС 3,2–4,1 м/с. В этих условиях остаточная концентрация цианидов не превышает 18–30 мг/л, что позволяет маточный раствор после смешения с раствором разложения сульфит-сульфатных щелоков производства жидкого сернистого ангидрида и упаривания использовать для производства удобрительного сульфата аммония. Вычислены кинетические параметры окисления цианидов. Определено, что скорость процесса озонирования описывается уравнением второго порядка по цианид-иону. Исследования показали, что для окисления цианид-ионов методом озонирования рациональным является использование сочетания барботажного аппарата и насадочной колонны, которые обеспечивают суммарную степень окисления 99,8-99,9 % (остаточная концентрация 0,75 мг/л).
Медьсодержащими также являются отработанные травильные растворы на основе хлорного железа, применяемые в технологии производства медных печатных плат, при травлении латуни и бронзы.
Высокая начальная концентрация хлорного железа (30-40%) обеспечивает большую емкость раствора по иону меди, которая достигает 50-60 г/л. Сущность регенерации заключается в осаждении хлорной меди из отработанного травильного раствора в виде двойной соли CuCl2·2NH4Cl·2H2O и окислении хлористого железа в хлорное кислородом воздуха при компенсации иона хлора добавлением соляной кислоты.
Движущей силой процесса осаждения является разность концентраций пересыщенного и насыщенного растворов в системе CuCl2-NH4Cl-H2O.
Проведены графические расчеты полноты осаждения двойных солей при температурах 353, 293 и 265К (рис. 10). Установлено, что количество хлорида аммония, равное 150% от стехиометрии соответствует области насыщения и, как это было определено экспериментально, обеспечивает полноту осаждения на 97% из реального травильного раствора. Изотермы 265, 293, 353К свидетельствуют о том, что образуемые двойные соли конгруэнтны, в тоже время, растворение NH4Cl почти до насыщения при температуре 353К и интенсивное охлаждение, образуют в осадке две соли: CuCl2.2NH4Cl.2H2O и CuCl2.1,5NH4Cl.2H2O, при чем первая в метастабильном состоянии, способная к перекристаллизации. Выполнен дериватографический анализ двойной соли.
Соосаждение ионов железа с двойной солью меди изучено на основании диаграммы растворимости в системе FeCl3-NH4Cl-H2O (рис. 11). В виду того, что процессы осаждения меди и соосаждения железа протекают одновременно и являются конкурирующими при взаимодействии с хлоридом аммония, были выполнены расчеты соосаждения железа остаточным количеством хлорида аммония после осаждения меди. Из диаграммы растворимости системы FeCl3-NH4Cl-H2O при 265К следует, что остаточные количества NH4Cl (3,39 %) не образуют пересыщенного раствора. Точка системы находится на линии равновесия с твердой фазой FeCl36H2O, хлорид железа кристаллизуется как индивидуальное соединение с 6 молями воды, не образует двойной соли, сокристализация с двойной солью меди не происходит, соосаждение происходит вследствие пересыщения раствора хлоридом железа и захвата маточного раствора при кристаллизации в пространство между кристаллами двойной соли меди. Для ускорения осаждения путем снятия диффузионных торможений доставку вещества к поверхности кристалла осуществили перемешиванием без разрушения кристаллической структуры. Эксперименты проводили в реакторе с рубашкой и мешалкой. С помощью рототабельного центрального композиционного планирования второго порядка была найдена математическая модель процесса осаждения меди и соосаждения железа в виде двух уравнений второго порядка, которые с 95 % вероятностью описывают указанные зависимости при изменении температуры в интервале от – 263 до 293К, концентрации меди от 20 до 100 г/л, железа от 50 до 200 г/л, количества добавляемого хлорида аммония от 100 до 400 % от стехиометрии и времени осаждения от 10 до 60 минут, а также уравнения зависимости вязкости и плотности раствора от температуры и состава.
=-3,934 –1,705t + 5,80610-1 +1,004С1+2,50910-1С2 + 2,81410-1К +1,06410-2t+ +7,31510-3tС1+2,0710-3tК +2,1510-3tС2 –2,810-3С1 -2,1610-3С2 – 6,2410-4 К – – 1,110-3С1К –3,510-4С2К –8,810-3t2 – 3,7510-3С12 – 2,910-4С22 – 2,410-4К2. (18)
= 21,4 – 1,0931t – 1,3310-2 – 2,26710-1С1 – 1,90410-1С2 – 1,310-3К + +1,0710-2t + 3,410-3tС2 + 2,610-3С1С2 + 8,010-4С1К + 4,010-4С22. (19)
где – степень осаждения меди, %; – степень соосаждения железа, %; t – температура, С; С1 – концентрация меди, кг/м3; С2 – концентрация железа, кг/м3; К – количество добавляемого хлорида аммония, % от стехиометрии; – время, мин.
= 4,3241 – 5610-3t + 2110-3С1 + 2,410-3С2 + 1110-3С3 + 2710-3С4 – 0,210-3tС1 – –0,210-3tС2 – 0,210-3tС3 – 0,110-3tС4 – 0,110-3С1С3 + 0,110-3С1С4 + 0,110-3tС2С4 – –0,0310-3С3С4 + 0,810-3t2 + 0,510-3С12 + 0,110-3С22 + 0,210-3С32 + 0,210-3С42 (20)
– коэффициент кинематической вязкости, м2/с.
= 1,1934 + 1,078910-3С3 + 0,648510-3С2 + 0,474110-3С1 + 0,013910-3С4 + +2,33610-6С3С2+2,3110-6С3С1+0,39610-6С3С4 +1,54910-6С2С1+0,26010-6С1С4+ + 0,26610-6С2С4 – 0,47610-3t (21)
– плотность, кг/м3.
Определены суммарный тепловой эффект осаждения CuCl2·2NH4Cl·2H2O при одновременном растворении в исходном растворе хлорида аммония (Q = 580кДж/кмоль), скорость фильтрования двойной соли (v = 2,7910-4 м3/м2с), константы фильтрования (К = 1,8310-5 м2/с, С = 7,62 м3/м2), сопротивления осадка (1,74109 м/кг) и фильтровальной перегородки (10,331012 м/м2).
Окисление хлористого железа в хлорное является основной стадией регенерации травильных растворов. Процесс является хемосорбционным, зависящим от множества параметров: температуры, концентрации Fe2+ и Fe3 в исходном растворе, присутствия остаточных количеств хлорида аммония и хлорида меди после ее осаждения; гидродинамических факторов: объемного расхода воздуха или другого окислителя, линейной скорости подачи, высоты столба обрабатываемой жидкости, размера отверстий и свободного сечения тарелки или диаметра сопла барботера, типа окислительного аппарата. Экспериментальные результаты окисления железа в реакторе на фильтре Шотта с практически максимально возможным диспергированием воздуха, при подаче его в 6-кратном избытке, стехиометрической подаче соляной кислоты обработаны по уравнению реакции первого порядка в случае протекания ее в изотермическом реакторе идеального перемешивания. Константа скорости реакции определяется как тангенс угла наклона изотерм к оси абсцисс в координатах - ln(1-U) = f(![]() ), где: U – степень окисления; k – константа скорости реакции, мин-1 ;
), где: U – степень окисления; k – константа скорости реакции, мин-1 ; ![]() - время реакции, мин. Энергия активации составляет 28000 Дж/моль, что говорит о переходной области процесса, лимитируемого как диффузией, так и химической реакцией. Влияние диффузионного фактора подтверждается экстремальной зависимостью температурного коэффициента ускорения b, равного отношению скоростей Wt+10/Wt, от температуры (максимум его при 50оС равен 1,32). Наибольшее повышение степени окисления за один час происходит при увеличении количества соляной кислоты от 100 до 200% от стехиометрической нормы Интенсивность окисления при 80оС за тот же промежуток времени при подаче кислоты в расчете 80, 100, 200, 300% соответственно составляет: 8,05; 10,72; 14,22; 17,47кг/м2час. Совместное присутствие в растворе CuCl2 и NH4Cl ускоряет процесс окисления.
- время реакции, мин. Энергия активации составляет 28000 Дж/моль, что говорит о переходной области процесса, лимитируемого как диффузией, так и химической реакцией. Влияние диффузионного фактора подтверждается экстремальной зависимостью температурного коэффициента ускорения b, равного отношению скоростей Wt+10/Wt, от температуры (максимум его при 50оС равен 1,32). Наибольшее повышение степени окисления за один час происходит при увеличении количества соляной кислоты от 100 до 200% от стехиометрической нормы Интенсивность окисления при 80оС за тот же промежуток времени при подаче кислоты в расчете 80, 100, 200, 300% соответственно составляет: 8,05; 10,72; 14,22; 17,47кг/м2час. Совместное присутствие в растворе CuCl2 и NH4Cl ускоряет процесс окисления.
С целью интенсификации процесса окисления хлористого железа в хлорное на ситчатой тарелке в ходе исследований были применены: воздух с повышенным содержанием кислорода и озонированный воздух. Значительно быстрее осуществляется окисление озоно-воздушной смесью: интенсивность окисления на ситчатой тарелке при диаметре отверстий 1 мм воздухом при температуре 80 С составляет 3,525 кг/м2час, озоно-воздушной смесью с концентрацией озона 20г/м3 при комнатной температуре на той же тарелке 57,86 кг/м2час, т.е. более чем в 16 раз. Использование озона для окисления железа при комнатных температурах позволяет совместить осаждение меди и окисление железа в одном аппарате, в котором появление осадка не сказалось бы на изменении живого сечения устройства для распределения окислителя. Таким аппаратом может быть реактор с мешалкой и с подачей озоно-воздушной смеси в слой раствора через барботирующее устройство. Для полноты использования озона такой реактор должен быть обеспечен внутренней циркуляцией озоно-воздушной смеси. Наиболее подходящим способом циркулирования отработанной ОВС является установка импеллерной мешалки, в которой забор окислителя осуществляется из под крышки аппарата. Для окисления железа использовали озоно-воздушную смесь с концентрацией озона 8 г/м3, полученную в безбарьерном генераторе с охлаждением периферийного коаксиального электрода водой. Исследования проводили при 20 С, подаче ОВС в количестве 220 л/час, стехиометрической подаче соляной кислоты. За 60 минут, степень окисления составила 85,7 %. При использовании избытка соляной кислоты (1,6 раза от нормы) степень окисления возросла до 91,5 %. Последующие охлаждение и нейтрализация избытка кислоты аммиаком при соотношении NH3/ HCl = 1,725 в течение 30 минут при барботировании воздуха осаждает двойную соль меди на 73,9 %.
Скорость травления меди растворами регенерированного хлорного железа в присутствии добавок CuCl2, NH4Cl, FeCl2, HCl, не только не снижается, но и возрастает на 2 – 3 г/м2мин.
Разработка стадии использования обезмедненных и обесцинкованных вторичных ресурсов
Отходы, освобожденные от меди и цинка, содержащие оксиды кремния, железа, алюминия - пиритные огарки, шлаки производства цинковых белил, отработанные брикеты производства безводного хлористого алюминия, использовали в процессе схватывания и затвердевания бетонных смесей. При этом получали термодинамически устойчивые гидраты полиминеральных вяжущих по схеме гидратации безводного сульфоалюмината и сульфосиликата, а также по схеме совмещенной гидратации, осложненной присутствием и образованием ферратов. Использование железосодержащих отходов в производстве бетонных смесей приводит к образованию низкосульфатной 3CaO.Fe2O3.CaSO4.12H2O и высокосульфатной формы 3CaO.Fe2O3.3CaSO4.32H2O гидросульфоферрата кальция, что отражается на свойствах бетонного теста и бетонных конструкций. Выполнены ИК-спектроскопический, дериватографический и рентгенофазовый анализы смесей с заменой 10 % заполнителя на брикеты и огарок в соотношении 1:2 и 20 % вяжущих на те же добавки при соотношении 2:1 при производстве гипсоцементных плит. Дериватографическим анализом установлено смещение эндоэффекта от 120 до 110 С, что соответствует дегидратации сорбированной воды. ИК- спектроскопический анализ подтвердил наличие сульфатов и каолинита. Рентгенофазовым анализом идентифицированы соединения: Al2O3·SiO2, SiO2 (x-кварц), HAlO2(примесь железа), Al2O3·3H2O, Al2O3·2H2O, 3CaO·5Al2O3 и ряд других, соответствующих гидратации сульфосиликата.
Путем дробной замены заполнителя-песка на пиритный огарок установлено, что максимальный предел прочности на сжатие достигается при замене 10% заполнителя на огарок. Нагрузка на образец в этом случае составляет 4235 кг в среднем, что соответствует допускаемому напряжению на сжатие 86,5 кг/см2, что в 1,2 раза выше требований технологического регламента и почти в 1,4 раза прочнее контрольного образца. Положительным эффектом введения огарка является упрочнение массы, увеличение ее пластичности и способности к заполнению формы. Замена заполнителя до 30 % на брикеты и огарок при соотношении 1:1 и 2:2 позволяет увеличить прочность, превосходящую прочность контрольного образца и требования ТУ. Проведены исследования использования шлака производства цинковых белил для приготовления образцов с заменой вяжущих, установлено, что максимум прочности приходится на замену 10 % вяжущих и соответствует 4300 кг или 87,8 кг/см2, что в 1,3 раза превышает прочность контрольного образца и в 1,2 раза выше прочности, требуемой по ТУ. Замена 10% вяжущих на шлак, брикеты и огарок в соотношении 1:1:1 обеспечивает прочность 75,5 кг/см2. Проведенные промышленные испытания в условиях цеха перегородок г. Дзержинска, прокатанная половая плита (ГЦП) при замене 10 % вяжущих на шлак, брикеты и огарок в соотношении 1:1:1 по характеристикам превосходила типично изготовляемые строительные конструкции, что подтверждено актом испытания.
Разработаны условия частичной замены гипса в производстве гипсо-волокнистых плит на брикеты, огарок и шлак. Максимальная прочность образцов на сжатие 42 кг/см2 и изгиб 21 – 22 кг/см2, что соответствует замене 10 % вяжущего на брикеты и огарок в соотношении 1:2.
Образец высокой прочности, в 1,5 раза превышающий прочность контрольного образца, получен в производстве силикатного кирпича с заменой заполнителя на брикеты и огарок в соотношении 2:1 и заменой извести на 10 %.
Термическое каталитическое разложение отработанных серных кислот проводят на оксиде железа Fe2O3, активность которого в нанесенном состоянии 5 % Fe2O3 на Al2O3 сравнима с активностью платины, нанесенной в количестве 5 % на Al2O3. Нами установлены каталитические свойства пиритного огарка, проявляемые в процессе термолиза серной кислоты, при этом появляется возможность получения сернистого ангидрида высокой концентрации. Термолиз отработанной серной кислоты был изучен на пиритном огарке, объем которого в реакторе составлял 72,010-6м3 со средним размером частиц 1–1,510-3м и свободным объемом катализатора 26,010-6 м3. Рассчитана удельная наружная поверхность(27,59210-3м2). Проведено исследование влияния температуры (773 – 1373 К), объемной скорости (1500 – 2000 ч-1) на степень разложения SO3, определены константы скорости по уравнению необратимой реакции первого порядка для потока, рассчитаны числа Рейнольдса по фиктивной линейной скорости газовой смеси для характеристик гидродинамического режима (режим ламинарный).
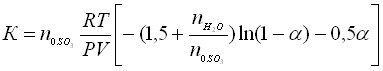 , мин-1. (22)
, мин-1. (22)
где n – число молей; – степень разложения SO3, R – универсальная газовая постоянная, Дж/моль·К; Т – температура, К; Р – давление, Па; V – объем, м3.
Выполнен расчет суммарного эндотермического теплового эффекта физических процессов и химических превращений, складывающийся из теплоты нагревания серной кислоты до температуры кипения, теплоты испарения серной кислоты, теплоты диссоциации серной кислоты, теплоты нагревания продуктов диссоциации серной кислоты, теплоты диссоциации триоксида серы. Интенсивность теплоотдачи от катализатора к реакционной среде определена по критериальному уравнению, соответствующему вязкостно-гравитационному режиму (![]() ), определены коэффициенты теплоотдачи (4,16 и 4,53 Вт/м2К для 973К и 1173К) и тепловой поток, передаваемый от огарка реакционной смеси конвекцией, количество теплоты, отдаваемое излучением. Сравнивая численные значения теплоты, необходимой на протекание процесса и передаваемой огарком с помощью конвекции и лучеиспусканием, можно сделать вывод, что поддержание температуры реакционной смеси теплоотдачей от внутренней поверхности катализатора обеспечено, стационарность режима - тоже. Суммарный тепловой поток даже при низких коэффициентах конвективной теплоотдачи (4,16 и 4,53 Вт/м2К) обеспечивает терморазложение отработанной серной кислоты при значительно больших скоростях подачи кислоты. В качестве меры активности катализатора приняли разность скоростей химических реакций в присутствии катализатора (uкат) и без него (u) с учетом доли объема реакционного пространства кат, занимаемого катализатором и недоступного для реагирующих веществ: А = uкат – u(1 – кат) = 3673,4моль/м3мин. Степень использования внутренней поверхности характеризуется модулем Тиле, который составил 4,6 и 3,77 для 973 и 1173 К. Таким образом процесс для сферического катализатора протекает во внутридиффузионной области со степенью использования внутренней поверхности 0,22 и 0,26, а скорость каталитического процесса, равная скорости, отнесенной к единице объема катализатора, соответственно равна 12,74103 и 15,24103 моль/м3час. Расчитаны энергии активации терморазложения серной кислоты с использованием катализатора и без него, Е = Енекат – Екат = 13431,2 Дж/моль. Предложен механизм гетерогенного катализа окислительно-восстановительной реакции на пиритном огарке, заключающийся в том, что на первой стадии идет активированная адсорбция SO3 с образованием соединения Кат-О- SO2, на второй стадии под действием высокой температуры происходит отщепление SO2 с образованием промежуточного соединения Кат-О-, следующая стадия – регенерация катализатора при взаимодействии соседних активных центров с освобождением молекулы кислорода.
), определены коэффициенты теплоотдачи (4,16 и 4,53 Вт/м2К для 973К и 1173К) и тепловой поток, передаваемый от огарка реакционной смеси конвекцией, количество теплоты, отдаваемое излучением. Сравнивая численные значения теплоты, необходимой на протекание процесса и передаваемой огарком с помощью конвекции и лучеиспусканием, можно сделать вывод, что поддержание температуры реакционной смеси теплоотдачей от внутренней поверхности катализатора обеспечено, стационарность режима - тоже. Суммарный тепловой поток даже при низких коэффициентах конвективной теплоотдачи (4,16 и 4,53 Вт/м2К) обеспечивает терморазложение отработанной серной кислоты при значительно больших скоростях подачи кислоты. В качестве меры активности катализатора приняли разность скоростей химических реакций в присутствии катализатора (uкат) и без него (u) с учетом доли объема реакционного пространства кат, занимаемого катализатором и недоступного для реагирующих веществ: А = uкат – u(1 – кат) = 3673,4моль/м3мин. Степень использования внутренней поверхности характеризуется модулем Тиле, который составил 4,6 и 3,77 для 973 и 1173 К. Таким образом процесс для сферического катализатора протекает во внутридиффузионной области со степенью использования внутренней поверхности 0,22 и 0,26, а скорость каталитического процесса, равная скорости, отнесенной к единице объема катализатора, соответственно равна 12,74103 и 15,24103 моль/м3час. Расчитаны энергии активации терморазложения серной кислоты с использованием катализатора и без него, Е = Енекат – Екат = 13431,2 Дж/моль. Предложен механизм гетерогенного катализа окислительно-восстановительной реакции на пиритном огарке, заключающийся в том, что на первой стадии идет активированная адсорбция SO3 с образованием соединения Кат-О- SO2, на второй стадии под действием высокой температуры происходит отщепление SO2 с образованием промежуточного соединения Кат-О-, следующая стадия – регенерация катализатора при взаимодействии соседних активных центров с освобождением молекулы кислорода.
Исследовано использование пиритного огарка в качестве катализатора для получения концентрированного сернистого ангидрида из ОСК, содержащей органические примеси. В ряде производств высокоэнергетических веществ имеются растворы серной кислоты, содержащие органические примеси: формалин, уротропин, изопропиловый спирт. Теоретически возможность протекания процесса в направлении разложения серного ангидрида до SO2 в присутствии восстановителей, была установлена термодинамическими расчетами теплового эффекта и энергии Гиббса реакций восстановления SO3 до SO2 перечисленными примесями. G всех восстановительных реакций отрицательны.
Наибольшей отрицательной величиной изобарно-изотермического потенциала на моль SO3 обладают реакции восстановления с формалином и уротропином (до сернистого ангидрида -237,3 и -260,6 кДж/моль). Максимальная степень разложения (94,5 %) при температуре 873 К соответствует концентрации уротропина 8,86 %.
Механизм каталитического расщепления SO3 до SO2 с использованием органических восстановителей помимо активированной адсорбции SO3, отщепления SO2 содержит стадию взаимодействия промежуточного соединения Кат-О- с углеводородным радикалом или с водородом в случае формальдегида с образованием конечных продуктов термолиза. Экспериментальные результаты разложения серной кислоты с добавками уротропина в зависимости от температуры с достаточной сходимостью (коэффициент корреляции в пределах 0,978 – 0,995) описываются уравнением вида у = ахвесх, где у- степень разложения до SO2,%; x- температура, оС; а,в,с – коэффициенты уравнения. Изученные физико-химические свойства: плотность, вязкость, поверхностное натяжение сернокислотных растворов, содержащих формальдегид, уротропин, отход производства спирта сырца и определенные парахор, ортохор, энергия активации вязкого течения жидкости, коэффициент объемного расширения использованы для расчетов не только термокаталитического разложения, но и для восстановительной денитрации ОСК.
Разработка принципиальных технологических схем и технические рекомендации по практическому использованию результатов
Полученные теоретические данные и результаты прикладных исследований в ходе реализации цели работы позволили разработать эффективные экстрагенты выщелачивания тяжелых цветных металлов из огарковых, шлаковых и шламовых отходов, определить оптимальные условия выщелачивания, переработки растворов, утилизации вторичных обезмедненных и обесцинкованных отходов в строительной промышленности, лакокрасочной отрасли, технологии серной кислоты. Разнообразие отходов по минералогическому составу, источникам, агрегатному состоянию потребовали в каждом отдельном случае принимать конкретные технические решения к подготовке исходных данных и разработке технологических схем.
Низкое процентное содержание оксидов цинка и меди в пиритном огарке предопределили использование в качестве экстрегента аммиачной воды 3 – 5 % концентрации. Выщелачивание осуществляется в шаровой мельнице мокрого помола, обеспечивающей высокую степень извлечения цветных металлов, дополнительное измельчение частиц огарка и вскрытие зерна оксида железа. Переработка полученных растворов гидроксокомплексов цинка и меди рекомендована концентрированием с использованием модулей с обратноосмотическими мембранами МГП-95, что сокращает объем ретантов по сравнению с объемом растворов выщелачивания, подлежащих нагреванию, отгонке аммиака и осаждению оксидов цинка и меди, в 10 – 12 раз. Выбор концентрации аммиачной воды обусловлен практическим отсутствием задержания аммиака указанным типом мембраны. Дальнейшая переработка ретанта нагреванием и отгонкой аммиака под разрежением проводится для получения концентрата оксидов меди и цинка. Концентрат сушится и прокаливается. Пермеат смешивается с аммиачным конденсатом и возвращается на выщелачивание. Пиритный огарок, промытый и высушенный, передается в производство строительных конструкций в качестве красного железо-окисного пигмента (рис. 12).
Технологическая схема переработки шлака производства цинковых белил содержит шаровую мельницу мокрого помола, работающую в циклическом режиме с промежуточным добавлением хлорида аммония и аммиака, что позволяет увеличить степень извлечения и концентрацию комплексного раствора по цинку, который передается на переработку электролизом с получением металлического цинка. Конечными продуктами при гидролитической обработке являются белый пигмент – окись цинка, вторичный шлак, используемый в качестве заполнителя при изготовлении строительных конструкций и медный экстракт для производства микроудобрений.
Разработана принципиальная технологическая схема установки по обезвоживанию текущего шлама производства вискозного волокна и шлама из накопителей. Основными стадиями обезвоживания шлама производства вискозного волокна является распульповывание шлама в накопителях, передача его в цех обезвоживания на ленточном фильтре с подложкой из коксика, сушка, рассев, возврат коксикового ретура на фильтрацию, отправка сухого шлама на склад и погрузку. Сухой шлам в соответствии с ТУ 48-6-104-88 передается предприятию цветной металлургии на последующее использование шлама и части неотсеянной подложки из коксика в печах вельцевания.
Технологическая схема очистки маточных растворов от меди сорбционно-цементационным методом содержит четыре колонны, загруженные шлаком, три из них работают на сорбцию-цементацию, а четвертая – на регенерацию шлака аммиачно-аммонийным раствором, который после промывки колонны направляется в производство микроудобрений. Отработанный шлак направляется в производство бетонных смесей. Раствор после сорбции-цементации подают на окисление цианидов методом озонирования и далее в производство сульфата аммония.
Разработана технология регенерации травильных растворов, состоящая из смесителя хлористого аммония с отработанным травильным раствором, импеллерного реактора, пиролюзитового разлагателя, компрессора, генератора озона, вакуумного фильтра, сушильного барабана. Достоинством схемы является осуществление осаждения меди и окисление хлористого железа в хлорное озоно-воздушной смесью в одном аппарате. Осажденная двойная соль меди является ценным микроудобрением, а окисленное железо возвращается на травление.
Ожидаемый предотвращенный ущерб при использовании предлагаемых технологий составит: для технологии комплексного использования и переработки пиритного огарка 1500 тыс. руб/год; для производства цианистой меди 694 тыс. руб/год; для производства вискозного волокна 3700 тыс. руб/год; для производства цинковых белил 300 тыс. руб/год; для технологии регенерации травильных растворов 500 тыс. руб/год.
ОСНОВНЫЕ ВЫВОДЫ
1.Определены физико-химические основы комплексной переработки промышленных отходов, включающей в качестве основной стадии извлечение цинка и меди аммиачно-аммонийной экстракцией.
2. Впервые определено фазовое равновесие жидкость – твердое и жидкость – пар в системе оксид меди - оксид цинка - аммиак водный - хлорид аммония - вода и другие характеристики цинк- и медьсодержащих комплексных растворов.
3. Разработаны технологические принципы переработки экстрактов и промышленных медь- и цинксодержащих растворов методом осаждения с отгонкой аммиака и гидролитической диссоциацией, цементационной сорбцией на вторичных рудах, реагентным осаждением с использованием хлорида аммония и концентрированием на полупроницаемых перегородках.
4. Впервые разработана физико-химическая модель регенерации травильных растворов путем осаждения двойной соли хлорной меди на основе данных по фазовому равновесию в системе медь хлорная – аммоний хлористый – вода, и окислением хлористого железа в хлорное озоно-воздушной смесью в импеллерном реакторе (=85,7 91,5%).
5. Выявлены оптимальные параметры окисления цианидов металлов из маточных растворов производства цианистой меди озоном, получаемым в безбарьерных генераторах (=99,8 99,9 %), и осаждения меди цементационно-сорбционным методом на шлаке производства цинковых белил, разработана технология получения полуфабрикатов в производстве сульфата аммония.
6. Установлено, что использование освобожденных от меди и цинка отходов в производстве строительных конструкций в качестве заменителя вяжущих и заполнителя упрочняет типовые элементы в 1,2 – 1,5 раза.
7. Разработаны технические условия использования огарка в качестве красного железо-окисного пигмента и катализатора термического разложения отработанной серной кислоты, содержащей органические примеси.
8. Показано, что цинковый концентрат может быть использован в качестве пигмента для цветных красок, комплексные растворы цинка, меди и двойная соль меди с хлоридом аммония - в качестве микродобавок к минеральным удобрениям. Результаты подтверждены производственными испытаниями.
Основное содержание диссертации опубликовано в научных работах:
Статьи в ведущих рецензируемых научных журналах и изданиях,
определенных Высшей аттестационной комиссией
- Перетрутов А.А., Чубенко М.Н., Ким П.П., Якунин Ю.И. Совместная растворимость оксидов меди и цинка в аммиачно-аммонийных растворах // Журнал физической химии. – 2009. - №8, С. 1594 – 1597.
- Перетрутов А.А., Чубенко М.Н., Ким П.П. Физико-химические свойства эвтонических водных растворов тетрааммиакатов цинка и меди при 293 – 323 К // Журнал физической химии. – 2009. - №10, С. 1998 – 2000.
- Ким П.П., Пастухова Г.В., Катраев А.Н., Перетрутов А.А. Денитрация отработанной серной кислоты сернокислотным раствором уротропина и некоторые его физико-химические свойства. // Журнал прикладной химии. – 1989. – №1. – с.97 – 100.
- Ким П.П., Перетрутов А.А., Пастухова Г.В. Денитрация отработанной серной кислоты отходом переработки спирта-сырта и некоторые его физико-химические свойства. // Журнал «Химическая промышленность». – 1998. – №12. – с.34 – 36.
- Ким П.П., Пастухова Г.В., Перетрутов А.А. Использование сернокислых отходов, содержащих уротропин и формальдегид для регенерации отработанной серной кислоты. // Журнал прикладной химии. – 2000. – №7. – с.1220 – 1223.
- Ким П.П., Перетрутов А.А., Никандров И.С. Исследование процесса переработки концентрированного сернистого газа.//Журнал прикладной химии.– 1988.– №9. –с.2109 – 2111.
- Ким П.П., Пастухова Г.В., Перетрутов А.А. Исследование состава газовой фазы при денитрации серной кислоты восстановителями.//Журнал «Химическая промышленность». – 1998. – №11. – с.28 – 30.
- Ким П.П., Пастухова Г.В., Перетрутов А.А. Использование сернокислых отходов, содержащих уротропин и формальдегид, для регенерации отработанной серной кислоты. // Журнал прикладной химии. – 2000. – №7. – с.1220 – 1223.
- Ким П.П., Тимин К.И., Борисенко А.С., Перетрутов А.А. Обезвреживание отходящих газов концентрирования серной кислоты. // Журнал «Химическая промышленность». – 2002. – №3. – с.53 – 55.
- Перетрутов А.А., Чубенко М.Н., Ким П.П., Пастухова Г.В., Горюнов С.И. Разработка технологии утилизации маточных растворов производства цианистой меди//Журнал «Химическая промышленность», №3, 2001 г., С. 14-18.
- Перетрутов А.А., ЧубенкоМ.Н., Ким П.П., Пастухова Г.В., Горюнов С.И. Озонирование маточных растворов и каталитическая очистка от озона в производстве цианистой меди //Журнал «Химическая промышленность», №4, 2001 г., С. 42-45.
- Перетрутов А.А., Чубенко М.Н., Горюнов С.И. Использование цинксодержащего шлака для очистки маточных растворов от меди //Журнал «Химическая промышленность».-2002.-.№6, С26-28.
- Ким П.П., Катраев А.Н., Перетрутов А.А., Пастухова Г.В. Плотность, вязкость и поверхностное натяжение сернокислотных растворов формальдегида. // Журнал прикладной химии. – 1987. – №4. – с.1404 – 1406.
- Когтев С.Е., Никандров И.С., Борисенко А.С., Перетрутов А.А Исследование термического разложения серной кислоты, содержащей органические примеси Журнал прикладной химии, №4, 1986.
- Перетрутов А.А., Малин К.М., Иошпа И.Е., Ким П.П. Абсорбция концентрированных окислов азота известковым молоком.// Известия высших учебных заведений. Химия и химическая технология. – 1975. – вып. 5. – с. 779 – 783.
- Иошпа И.Е., Перетрутов А.А., Ким П.П. Равновесное давление окислов азота над нитрозами, содержащими свободную азотную кислоту. Журнал прикладной химии, т. 46, Вып. 5 1973.
Авторские свидетельства, патенты РФ и свидетельства на полезную модель
- БеловА.А., Перетрутов А.А., Ким П.П, Пастухова Г.В. Устройство для озонирования воздуха Патент №2109221 от20.04.1998 по заявке №96109022
- Перетрутов А.А., Белов А.А., Ким П.П., Пастухова Г.В. Устройство для озонирования воздуха Патент №2109220 от20.04.1998 по заявке №96109021
- Перетрутов А.А., Ким П.П., Пастухова Г.В., Белов А.А. Установка очистки питьевой воды Свидетельство на полезную модель № 6793 от 16.06 98 г.по заявке № 96118908.
- Перетрутов А.А., Ким П.П., Пастухова Г.В., Белов А.А. Установка очистки газов сварочных постов. Свидетельство на полезную модель № 8280 от 18.11.98 г. по заявке № 97107239.
- Перетрутов А.А., Белов А.А., Ким П П., Пастухова Г.В. Трубчатый озонатор Патент №2117628 от 20.08.1998 по заявке №96109023
- Перетрутов А.А., БеловА.А., Пастухова Г.В., Ким П.П. Устройство для озонирования питьевой воды Патент №2117638 от20.08.1998 по заявке №96109020
- Перетрутов А.А., Белов А.А., Пастухова Г.В., Ким П.П. Устройство для озонирования воды Патент №2122526 от27.11.1998 по заявке №96109018
- Перетрутов А.А., Ким П.П., Овчинников В.Д., Корнишина Е.Н. Способ получения двойной соли хлоридов меди и аммония Авторское свидетельство №716977 опубл. 25.02.80 Б.И. № 7
- Перетрутов А.А., НикандровИ.С., Ксандров Н.В., Ким П.П. Способ извлечения меди из колчеданного огарка Авторское свидетельство №812849 опубл. 15.03.81 Б.И. № 10
- Перетрутов А.А., Ким П.П., Ксандров Н.В., Овчинников В.Д. Способ получения сернистого ангидрида из отработанной серной кислоты Авторское свидетельство №990647 оп. Б.И. №3, 1983
- Перетрутов А.А., Ким П.П., Пастухова Г.В., Лукашов С.Г. Способ получения сернистого ангидрида Авторское свидетельство №1096204 оп. 07.06.84 Б.И. №21
- Перетрутов А.А., Ксандров Н.В., Никандров И.С. Способ выделения меди и цинка из водно-аммиачных растворов Авторское свидетельство №1146331 оп. Б.И. № 11, 23.03.85
- Перетрутов А.А., Ким П.П., Ксандров Н.В. Способ извлечения меди из растворов. Авторское свидетельство №1157102 оп. Б.И. № 19, 23.05.85
- Перетрутов А.А., Ким П.П., Корнишина Е.Н. Катализатор для термолиза серной кислоты Авторское свидетельство №1142161 оп. Б.И. № 8, 28.02.85
- Перетрутов А.А., НикандровИ.С., Пастухова Г.В. Способ термолиза серной кислоты А.С. /СССР/ №268467, по заявке № 3135807 от 11.02.86
- Перетрутов А.А., Ким П.П., Никандров И.С, Калашникова И.В., Павлов В.П., Горшилов А.К. Способ очистки сточных вод А.С. № 1660716 по заявке 4642731/26 от 07.07.91 Б.И. № 25
- Перетрутов А.А., Ким П.П., Никандров И.С, Горшилов А.К. Способ извлечения цинка из отходов производства вискозного волокна, преимущественно шлама А.С. № 1680788 по заявке № 4690263/02 от 05.04.89 оп. 30.09.91 Б.И. № 36
- Перетрутов А.А., Ким П.П., Никандров И.С, Грачев В.В., Рудыка В.И. Способ выделения оксидов цинка и меди из водно-аммиачных растворов А.С. № 1712433 по заявке № 4783719/02 от 18.01.90 оп. 15.02.92 Б.И. № 6
- Перетрутов А.А., Ким П.П., Никандров И.С, Колобов В.О., Литвинова М.В. Способ селективного извлечения цинка и меди из пиритного огарка А.С. № 1486534 по заявке № 4295680 оп. 15.06.89 Б.И. № 22
- Перетрутов А.А., Ким П.П., Пастухова Г.В., Колобов В.О. Способ извлечения цинка и меди из полупродуктов переработки цинковых руд А.С. № 1444379 по заявке № 4259090/31-02 оп. 15.12.88 Б.И. № 46
- Ким П.П., Никандров И.С., Перетрутов А.А. Способ получения серной кислоты А.С. № 1632937 по заявке № 4424315/26 от 12.05.88 оп. 07.03.91 Б.И. № 9
Статьи, опубликованные в других изданиях
- Перетрутов А.А., Чубенко М.Н. Растворимость оксидов меди и цинка в насыщенных хлоридом аммония аммиачных растворах // Журнал «Естественные и технические науки». Неорганическая химия, № 2 (34), 2008.- С.59-61.
- Перетрутов А.А., Чубенко М.Н. Обезвоживание и переработка шлама производства вискозного волокна // Журнал «Техника и технология». Процессы и аппараты химических технологий, № 3, 2008.- С 44-45.
- Перетрутов А.А., Колобов В.О., Никандров И.С, Мырков А.В. Получение цинкосодержащих удобрений с использованием отходов шлака и огарка Межвузовский сборник по технологии минеральных удобрений и солей, ЛТИ им. Ленсовета, Л, 1988, с. 58-62.
- Перетрутов А.А., Колобов В.О., Никандров И.С, Ким П.П., Иешин А.Э. Плотность, вязкость и поверхностное натяжение растворов в системе ZnO (CuO) -NH4Cl-NH3-H2O Библиографический указатель ВИНИТИ «Депонированные научные работы», №9, 1987.
- Перетрутов А.А., Горюнов С.И., Ксандров Н.В., Солдатов А.В. Водно-аммиачное выщелачивание соединений цветных металлов из промышленных отходов как перспективный метод их утилизации/ Депонировано в ВИНИТИ 21.07.97 № 2323-В97 Нижегород. гос. тех. университет. 1997.
- Перетрутов А.А., Колобов В.О., Никандров И.С. Осаждение меди и цинка из аммиачных растворов Библиографический указатель ВИНИТИ «Депонированные научные работы» №11, 1986, с.142, справка №868-XII-86.
- Перетрутов А.А., Горюнов С.И., Чубенко М.Н., Лещук Е.В., Погодина С.Ю. Равновесная растворимость оксидов меди и цинка в аммиачно-аммонийных растворах/ Депонировано в ВИНИТИ № 3797-В98 от 21.12.98. Дзержинский филиал Нижегород. гос. тех. Университета, Дзержинск 1998.
- Перетрутов А.А., Когтев С.Е., Чубенко М.Н., Горюнов С.И., Яблокова З.К. Технологические приемы очистки гальваностоков и сточных вод, содержащих тяжелые цветные металлы/ Депонировано в ВИНИТИ № 544-В99 от 24.02.99. Дзержинский филиал Нижегород. гос. тех. Университета, Дзержинск 1998.
- Перетрутов А.А., Чубенко М.Н., Когтев С.Е., Ким П.П. Очистка сточных вод вискозных производств от соединений цинка/ Депонировано в ВИНИТИ № 1024-В00 от 17.04.00. Дзержинский филиал Нижегород. гос. тех. Университета, Дзержинск 2000г.
- Перетрутов А.А., Чубенко М.Н., Когтев С.Е., Газейчева Е.Г. Исследование сорбционно-цементационного метода очистки сточных вод от тяжелых цветных металлов/ Сборник материалов Международной научно-практической конференции «Хозяйственно-питьевая и сточные воды: Проблемы очистки и использования». Пенза, 2000 г.
- Перетрутов А.А., Чубенко М.Н., Горюнов С.И.Физико-химические основы растворения тяжелых цветных металлов аммиачно-аммонйными растворами/ Депонировано в ВИНИТИ № 1857-В00 от 04.07.00. Дзержинский филиал Нижегород. гос. тех. университета, Дзержинск 2000г.
- Перетрутов А.А., Ким П.П., Белов А.А., Пастухова Г.В., Ерунов В.Ф. Опыт эксплуатации озонаторной установки доочистки питьевой воды/ Сборник материалов 3 Международной научно-практической конференции «Хозяйственно-питьевая и сточные воды: Проблемы очистки и использования». Пенза, 2001.
- Перетрутов А.А., Чубенко М.Н. Равновесное парциальное давление аммиака и паров воды над растворами тетрааммиакатов цинка и меди/ Сборник трудов Общероссийской научно-технической конференции «Новые технологии в азотной промышленности».- Северо-кавказский государственный технический университет. Ставрополь, 2003.
- Перетрутов А.А., Чубенко М.Н. Утилизация маточных растворов в производстве цианистой меди Труды Нижегородского государственного технического университета «Химическая и пищевая промышленность: современные задачи техники, технологии, автоматизации, экономики», том 45, 2004.
- Перетрутов А.А., Чубенко М.Н. Пути утилизации промышленных отходов, содержащих соединения тяжелых цветных металлов Труды Нижегородского государственного технического университета «Химическая и пищевая промышленность: современные задачи техники, технологии, автоматизации, экономики», том 45, 2004.
- Перетрутов А.А., Чубенко М.Н. Использование вторичных ресурсов в качестве заполнителей и заменителей вяжущих/ Деп. В ВИНИТИ 08.12.05, №1624-В2005.
- Перетрутов А.А., Чубенко М.Н., Ким П.П., Тарасов В.А. Исследование очистки сточных вод травления меди методом мембранного разделения/ Сборник статей VIII Международной научно-практической конференции «Проблемы энергосбережения и экологии в промышленном и жилищно-коммунальном комплексах».- Пенза: ПГУАС, 2007.- С.298-300.
- Перетрутов А.А., Ким П.П., Чубенко М.Н., Тарасов В.А. Мембранная очистка сточных вод производства цианистой меди обратным осмосом/ Сборник статей IХ Международной научно-практической конференции «Новые химические технологии: производство и применение».- Пенза: ПГУ, 2007.- С.58-60.
- Перетрутов А.А., Ким П.П., Чубенко М.Н., Тарасов В.А. Мембранное концентрирование аммиачных вытяжек пиритного огарка/ там же.-С.61-64.
- Перетрутов А.А., Ким П.П., Чубенко М.Н. Исследование обезвоживания шлама производства вискозного волокна/ Деп. В ВИНИТИ 11.01.08, №24-В2008
Тезисы докладов конференций
- Перетрутов А.А., Колобов В.О., Никандров И.С. Извлечение оксидов меди и цинка из пиритных огарков. Тезисы докладов Всесоюзной научно-технической конференции «Разработка и внедрение энергосберегающих и малоотходных технологий в металлургии цветных и редких металлов, М., МИСИС, 1986, с 239
- Перетрутов А.А., Колобов В.О., Никандров И.С. Извлечение оксидов меди и цинка из пиритных огарков. Тезисы докладов Всесоюзной научно-технической конференции «Разработка и внедрение энергосберегающих и малоотходных технологий в металлургии цветных и редких металлов, М., МИСИС, 1986, с 239
- Перетрутов А.А., Научные и технологические основы переработки отходов тяжелых цветных металлов Тезисы докладов Межрегиональной научно-технической конференции. Д/Ф НГТУ. Нижн. Новгород, 1999 г.
- Перетрутов А.А., Казимиров О.Е., Никандров И.С., Кострова Н.А. Изучение растворимости и физико-химических свойств системы CuO-ZnO-NH3-NH4Cl-H2O Тезисы докладов научно-производственной конференции «Перспективы развития и использования минеральных удобрений с микроэлементами», Киев, из-во УСХА, 1990, с. 43
- Перетрутов А.А., Чубенко М.Н., Когтев С.Е., Газейчева Е.Г. Исследование сорбционно-цементационного метода очистки сточных вод от тяжелых цветных металлов Сборник материалов Международной научно-практической конференции «Хозяйственно-питьевая и сточные воды: Проблемы очистки и использования». Пенза, 2000 г.
- Перетрутов А.А., Горюнов С.И., Чубенко М.Н., Ельцова А.Г. Исследование растворимости оксидов меди и цинка в аммиачно-солевых растворах Тезисы докладов Всероссийской научно-технической конференции по технологии неорганических веществ, Казань, Менделеевск, 2001 г.
- Перетрутов А.А., Горюнов С.И., Чубенко М.Н., Тимин М.К. Аммиачно-аммонийное выщелачивание соединений цветных металлов из промышленных отходов Тезисы докладов Всероссийской научно-технической конференции по технологии неорганических веществ, Казань, Менделеевск, 2001 г.

