Реакция фурфурола с пероксидом водорода при воздействии постоянного электрического тока и синтезы гидрофуранонов на ее основе
На правах рукописи
Яковлев Михаил Михайлович
РЕАКЦИЯ ФУРФУРОЛА С ПЕРОКСИДОМ ВОДОРОДА ПРИ ВОЗДЕЙСТВИИ ПОСТОЯННОГО ЭЛЕКТРИЧЕСКОГО ТОКА
И СИНТЕЗЫ ГИДРОФУРАНОНОВ НА ЕЕ ОСНОВЕ
Специальность 02.00.03 – Органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Краснодар – 2012
Работа выполнена в ФГБОУ ВПО
Кубанский государственный технологический университет
Научный руководитель: доктор химических наук, профессор
Посконин Владимир Владимирович
Официальные оппоненты: доктор химических наук, профессор
Рахимов Александр Иммануилович
доктор химических наук, профессор
Стрижов Николай Константинович
Ведущая организация: Нижегородский государственный
университет им. Н.И. Лобачевского
(г. Нижний Новгород)
Защита состоится 13 марта 2012 г. в 1440 часов на заседании диссертационного совета Д 212.100.01 в Кубанском государственном технологическом университете по адресу: 350072 г. Краснодар, ул. Красная, 135,
ауд. 94.
С диссертацией можно ознакомиться в библиотеке Кубанского государственного технологического университета по адресу: 350072, г. Краснодар, ул. Московская, 2, корпус А
Автореферат разослан 11 февраля 2012 г.
Ученый секретарь
диссертационного совета,
кандидат химических наук, доцент Кожина Н.Д.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Важной задачей химической науки является создание рациональных способов получения веществ с высокой реакционной и биологической активностью, перспективных для использования в тонком органическом синтезе и сельском хозяйстве. К таким веществам относятся 2(5Н)-фуранон и 5-гидрокси-2(5Н)-фуранон (далее – фураноны), которые являются основой для синтезов широкого ряда функционально замещенных гетероциклических соединений и карбоновых кислот. Как исходные фураноны, так и полученные на их основе соединения обладают широким спектром биологической активности. Наиболее распространенные, ранее разработанные в КубГТУ, способы получения фуранонов основаны на реакциях окисления фурфурола водным пероксидом водорода в условиях кислотного автокатализа и в присутствии соединений V и VI групп. 5-Гидрокси-2(5Н)-фуранон (в основном в виде 5-метокси-2(5Н)-фуранона) получают также фотохимическим окислением кислородом фурана или фурфурола в безводных спиртовых растворах. Благодаря этим синтезам фураноны были использованы как химические реактивы и всесторонне изучаются как биологически активные вещества, однако они не получили широкой доступности из-за ряда сложностей в реализации указанных методов их получения. Реакции фотохимического окисления весьма длительны и высокоэнергоемки, требуют специального оборудования. Реакции каталитического перекисного окисления фурфурола осложняются интенсивным тепловыделением и образованием, наряду с фуранонами, сложных смесей побочных продуктов. Это требует постоянного отвода тепла в процессе окисления и значительно затрудняет выделение целевых веществ.
Тем не менее, реакции фурфурола с водным пероксидом водорода представляют значительный интерес для дальнейших научных исследований в качестве синтетической базы. В них используются доступное и нетоксичное исходное сырье, в качестве растворителя – вода, технологии с их использованием малоотходны и не загрязняют окружающую среду. В результате всестороннего изучения этих реакций в КубГТУ установлена их высокая «отзывчивость» на действие различных факторов. Это позволило управлять направленностью окисления фурфурола с получением различных продуктов: 2(5Н)-фуранона, янтарной, 2-фуранкарбоновой, -формилакриловой кислот и их производных.
В то же время такой фактор, как воздействие постоянного электрического тока на реакционную систему «фурфурол – водный пероксид водорода» никем ранее не изучался, несмотря на высокую перспективность использования электрохимических методов в синтезах органических соединений. Известно, что электрохимическое разложение Н2О2 приводит к образованию частиц с высокой реакционной способностью, в том числе ООН и О2, которые способны активно взаимодействовать с кратными связями и функциональными группами органических соединений.
С учетом вышеизложенного, актуальным является изучение реакции фурфурола с водным пероксидом водорода при воздействии на реакционную систему постоянного электрического тока с целью создания новых, более рациональных по сравнению с известными, методов синтеза 2(5Н)-фуранона и 5-гидрокси-2(5Н)-фуранона.
Диссертационная работа является составной частью НИР КубГТУ и выполнена в соответствии с темой НИР кафедры общей химии 5.10.11-15 «Разработка методов синтеза и новых путей практического использования циклических и ациклических гетероатомных соединений, изучение реакций, лежащих в основе синтезов» (номер государственной регистрации 01201152034).
Цель и задачи исследования. Целью работы является изучение реакции фурфурола с водным пероксидом водорода при воздействии на реакционную систему постоянного электрического тока, установление ее особенностей, состава продуктов и возможностей изменения направленности окисления под действием тока, создание на основе этой реакции новых методов синтеза 5-гидрокси-2(5Н)-фуранона и 2(5Н)-фуранона.
В рамках поставленной цели решались следующие задачи:
- выявление особенностей влияния постоянного электрического тока на реакцию фурфурола с пероксидом водорода в условиях анодного окисления и катодного восстановления с использованием графитовых электродов;
- установление влияния различных, в том числе электрохимических факторов на продолжительность, направленность и состав продуктов реакции фурфурола с Н2О2 при воздействии постоянного электрического тока;
- формирование на основе полученных результатов представлений о механизме изученной реакции и возможностях управления ее направленностью;
- разработка способов получения 5-гидрокси-2(5Н)-фуранона и 2(5Н)-фуранона, а также малеиновой и яблочной кислот на основе реакции фурфурола с Н2О2 при воздействии постоянного электрического тока;
- изучение рострегулирующего действия полученных продуктов электрохимического перекисного окисления фурфурола.
Научная новизна. Впервые проведена реакция фурфурола с Н2О2 при воздействии постоянного электрического тока. Изучено влияние тока на ее продолжительность, направленность и состав продуктов, что позволило расширить представление о процессах перекисного окисления фурановых соединений и их синтетических возможностях.
Выявлен характер влияния на изученный анодный процесс различных факторов: мольного соотношения реагентов, силы тока, типа графитового электрода, химического состава и концентрации фонового электролита, температуры, перемешивания, добавок CaCO3 и VOSO4.
Установлено, что воздействие постоянного электрического тока в условиях анодного окисления приводит к заметному ускорению реакции фурфурола с пероксидом водорода, резко снижает ее экзотермичность и приводит, в зависимости от условий, к преимущественному образованию 5-гидрокси-2(5Н)-фуранона, 2(5Н)-фуранона и яблочной кислоты.
Определены оптимальные условия для получения 5-гидрокси-2(5Н)-фуранона и 2(5Н)-фуранона в условиях анодного перекисного окисления фурфурола.
Впервые методом конкурирующих акцепторов установлено активное образование гидроксильных радикалов в системе «Н2О2 – анод» и существенное замедление анодного перекисного окисления фурфурола в присутствии ингибиторов свободнорадикальных реакций. Это позволило предположить заметную роль свободных радикалов в данном процессе.
Установлено, что воздействие постоянного электрического тока на реакцию фурфурола с пероксидом водорода в условиях катодного восстановления не оказывает заметного влияния на состав продуктов по сравнению с «бестоковой» реакцией.
Впервые установлено преимущественное образование яблочной кислоты из 2(5Н)-фуранона при его анодном окислении пероксидом водорода.
Предложена схема механизма реакции фурфурола с водным Н2О2 в условиях анодного окисления, учитывающая установленные отличия изученного электрохимического процесса от «бестоковой» реакции.
Практическая значимость. На основе реакции фурфурола с водным пероксидом водорода в условиях анодного окисления разработаны новые, более рациональные по сравнению с известными, методы синтеза важных в практическом отношении гидрофуранонов – 5-гидрокси-2(5Н)-фуранона и 2(5Н)-фуранона.
Разработаны способы получения малеиновой и яблочной кислот анодным перекисным окислением фурфурола.
Впервые установлено преимущественное образование яблочной кислоты в реакции 2(5Н)-фуранона с пероксидом водорода в условиях анодного окисления, что создает основу для создания нового способа ее получения.
Получен биологически активный препарат ВАП-1, представляющий собою композицию 5-гидрокси-2(5Н)-фуранона и 2(5Н)-фуранона в мольном соотношении 3 : 1. Установлен высокий ростстимулирующий эффект этого препарата на винограде и на семенах риса и пшеницы.
Апробация работы. Основные положения работы представлены на XIX Менделеевском съезде по общей и прикладной химии (Волгоград, 2011 г), I и II Международных конференциях «Новые направления в химии гетероциклических соединений» (Кисловодск, 2009 г; Железноводск, 2011 г), II Международной научной конференции «Фундаментальные и прикладные проблемы современной химии» (Астрахань, 2008 г), V Всероссийской научной конференции молодых ученых и студентов «Современное состояние и приоритеты развития фундаментальных наук в регионах» (Анапа, 2010 г), Молодежной научной конференции «Международный год химии» (Казань, 2011 г).
Публикации. Основное содержание диссертационной работы изложено в 11 научных работах, в т.ч. в 4 статьях (2 статьи в журналах, рекомендованных ВАК РФ) и 7 тезисах докладов.
Объем и структура работы. Диссертация изложена на 171 страницах и состоит из введения, обзора литературы, обсуждения результатов исследований, экспериментальной части, выводов и приложений. Диссертация включает 8 рисунков, 47 схем, 17 таблиц и 4 приложения. Список литературы включает 231 наименование работ отечественных и зарубежных авторов.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1 Аналитический обзор литературы
Приведены и проанализированы известные данные:
– о реакциях фурфурола и других 2-замещенных фуранов с водным пероксидом водорода в различных условиях без использования тока;
– о реакциях электрохимического окисления фурфурола и других фурановых соединений, насыщенных и ароматических углеводородов, гидроксипроизводных, карбонильных соединений и карбоновых кислот;
– об известных методах синтеза 5-гидрокси-2(5Н)-фуранона 1 и 2(5Н)-фуранона 2.
Анализ литературных данных показывает следующее: известные способы получения фуранонов 1 и 2 имеют ряд существенных недостатков, в связи с этим и с учетом важности этих веществ, существует необходимость разработки новых способов их получения; реакция фурфурола с Н2О2 при воздействии на реакционную систему электрического тока ранее не изучалась, в то же время она представляет значительный интерес как основа для создания новых методов синтеза фуранонов 1 и 2.
2 Реакция фурфурола с водным пероксидом водорода при воздействии на реакционную систему постоянного электрического тока
2.1 Изучение влияния различных факторов на реакцию фурфурола с пероксидом водорода в условиях анодного окисления
В настоящем исследовании использовался снабженный мешалкой термостатируемый электролизер с разделенными электродными пространствами, содержащими растворы перхлоратов щелочных металлов в качестве фоновых электролитов и электроды из прессованного пористого графита.
Реакцию фурфурола с Н2О2 изучали в условиях анодного окисления и катодного восстановления. В первом случае в анодную ячейку помещали реагенты и раствор электролита, а в катодную – раствор электролита. В случае катодного восстановления реагенты вносили в катодную ячейку.
Определены следующие исходные условия для проведения анодной реакции фурфурола с пероксидом водорода: [Фурфурол]0 = 1,0 моль/л; [Фурфурол]0 : [Н2О2]0 : [LiClO4]0 = 1 : 1,6 : 0,1; температура реакционной среды 50 оС; сила тока 0,03 А; скорость вращения мешалки 250 об/мин. Фурфурол и 30 %-ный водный раствор пероксида водорода вносили в анодную ячейку, содержащую раствор фонового электролита при заданной температуре, вели реакцию при перемешивании в термостатируемом режиме до полного расхода Н2О2. В принятых исходных условиях реакционная среда гомогенизировалась в течение первой минуты после внесения всех ее компонентов, реакция проходила без заметного тепловыделения и смолообразования, через 8 ч достигалось полное превращение обоих реагентов. Продолжительность реакции определялась по моменту расхода Н2О2. Выходы продуктов определяли от прореагировавшего фурфурола.
В исходных условиях анодного окисления (табл. 1, опыт 1) реакция фурфурола с Н2О2 значительно ускоряется по сравнению с реакцией, проведенной в этих же условиях в отсутствие электрического тока (опыт 2) и приводит к образованию 5-гидрокси-2(5Н)-фуранона 1, 2(5Н)-фуранона 2 и яблочной кислоты 3 в качестве основных продуктов (схема 1). В отсутствие тока преимущественно образуются фуранон 2 и янтарная кислота 4.
Таблица 1 – Результаты реакции фурфурола (Фл) с Н2О2 в условиях анодного окисления (опыт 1): [Фл]0 = 1,0 моль/л; [Фл]0 : [Н2О2]0 : [LiClO4]0 = 1 : 1,6 : 0,1; 50 оС; 0,03 А, и в отсутствие тока (опыт 2)
| № опыта | Фл 1/2, мин | Продолжи-тельность реакции а, ч | Выходы продуктов б, % | |||
| Гидрокси- фуранон 1 | Фуранон 2 | Кислота 3 | Кислота 4 | |||
| 1 | 45 | 8 | 46-50 | 14-16 | 24-26 | – |
| 2 | 220 | 20 | 8-10 | 38-42 | 3-4 | 20-22 |
а здесь и далее: определялась на момент полного расхода Н2О2
б здесь и далее: от прореагировавшего фурфурола
Схема 1
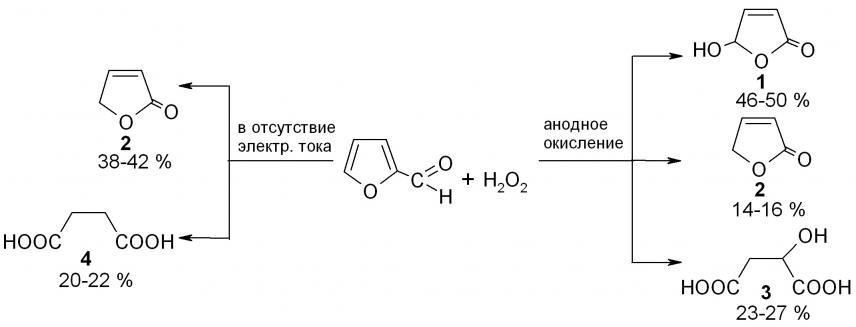
В принятых условиях анодной реакции фурфурол в отсутствие Н2О2 практически не окисляется. Это позволило исключить возможное участие в изучаемом процессе воды в качестве реагента.
Анодная реакция, как и «бестоковый» процесс, характеризуется образованием органических пероксидов в качестве промежуточных продуктов и постепенным уменьшением рН реакционной среды (от рН 6,5 в момент гомогенизации до рН 2 в конце процесса), обусловленным накоплением кислотных продуктов.
С целью получения данных об особенностях анодного процесса и возможностях управления его направленностью изучено влияние на него следующих факторов: мольное соотношение реагентов, температура, тип графитового электрода, сила тока, состав и концентрация фонового электролита, добавки CaCO3 и VOSO4. Исследование проводилось в указанных выше исходных условиях анодного окисления. Во всех опытах общая продолжительность реакции определялась по полному расходу Н2О2, при этом, как правило, достигалось полное превращение обоих реагентов.
Из таблицы 2 видно, что при мольном соотношении фурфурола и Н2О2, равном 1 : 1,6, наблюдается наибольший выход гидроксифуранона 1. При этом достигается полное превращение обоих реагентов. С учетом этого все последующие опыты по изучению влияния факторов проводили при этом мольном соотношении.
Таблица 2 – Результаты реакции фурфурола (Фл) с Н2О2 в условиях анодного окисления при различном мольном соотношении реагентов: [Фл]0 = 1,0 моль/л; [Фл] 0 : [LiClO4] 0 = 1 : 0,1; 50 оС; 0,03 А
| № опыта | Мольное соотношение Фл : Н2О2 | Фл 1/2, мин | Продолжительность реакции, ч | Степень превращения Фл, % | Выходы продуктов, % | ||
| Гидрокси- фуранон 1 | Фура- нон 2 | Кислота 3 | |||||
| 3 | 1,0 : 0,6 | 80 | 6,0 | 60 | 15-18 | 43-48 | 15-18 |
| 1 | 1,0 : 1,6 | 45 | 8,0 | 100 | 46-50 | 14-16 | 23-27 |
| 4 | 1,0 : 2,6 | 40 | 8,5 | 100 | 33-36 | 19-21 | 27-29 |
При повышении температуры от 25 до 50 оС (табл. 3) выходы гидроксифуранона 1 и кислоты 3 несколько возрастают, тогда как выход фуранона 2 незначительно снижается. При температуре выше 55 оС выходы обоих фуранонов 1 и 2 снижаются.
Таблица 3 – Результаты реакции фурфурола (Фл) с Н2О2 в условиях анодного окисления при различных температурах: [Фл]0 = 1,0 моль/л; [Фл] 0 : [Н2О2] 0 : [LiClO4] 0 = 1 : 1,6 : 0,1; 0,03 А
| № опыта | Темпе-ратура, оС | Фл 1/2, мин | Продолжительность реакции, ч | Выходы продуктов, % | ||
| Гидрокси-фуранон 1 | Фура- нон 2 | Кислота 3 | ||||
| 5 | 25 | 65 | 12 | 42-46 | 19-21 | 20-24 |
| 6 | 40 | 55 | 10 | 44-48 | 15-17 | 21-25 |
| 1 | 50 | 45 | 8 | 46-50 | 14-16 | 23-27 |
| 7 | 55 | 40 | 7 | 41-44 | 12-14 | 25-27 |
При изучении влияния фактора перемешивания установлено, что в отсутствие перемешивания 1/2 фурфурола увеличивается с 45 до 50 мин, выходы продуктов 1-3 при этом не изменяются.
Изучение влияния силы тока (табл. 4) показало, что анодная реакция в наибольшей степени ускоряется при воздействии тока 0,03 А, а общая продолжительность анодного процесса уменьшается по мере увеличения силы тока от 0,01 до 0,05 А (табл. 4). Ток 0,01 – 0,03 А способствует преимущественному образованию продукта 1. Повышение силы тока до 0,05 А способствует увеличению выхода фуранона 2.
Таблица 4 – Результаты реакции фурфурола (Фл) с Н2О2 в условиях анодного окисления при различных значениях силы тока: [Фл]0 = 1,0 моль/л; [Фл] 0 : [Н2О2] 0 : [LiClO4] 0 = 1 : 1,6 : 0,1; 50 оС
| № опыта | Сила тока, А | Фл 1/2, мин | Продолжительность реакции, ч | Выходы продуктов, % | ||
| Гидрок- сифуранон 1 | Фура- нон 2 | Кислота 3 | ||||
| 8 | 0,01 | 50 | 8,2 | 46-50 | 14-16 | 23-27 |
| 1 | 0,03 | 45 | 8 | 46-50 | 14-16 | 23-27 |
| 9 | 0,05 | 60 | 7,2 | 31-35 | 24-28 | 17-19 |
Установлено, что при замене пористых графитовых электродов на низкопористые пирографитовые (таблица 5, опыт 10) анодный процесс резко замедляется, выходы гидроксифуранона 1 и кислоты 3 значительно снижаются, тогда как выход фуранона 2 заметно возрастает. При этом в качестве одного из основных продуктов образуется янтарная кислота 4. Эти результаты указывают на существенное влияние структуры поверхности графитового анода на изучаемый процесс.
Таблица 5 – Результаты реакции фурфурола (Фл) с Н2О2 в условиях анодного окисления с использованием пористого графитового (опыт 1) и пирографитового (опыт 10) электродов: [Фл]0 = 1,0 моль/л; [Фл] 0 : [Н2О2] 0 : [LiClO4]0 = 1 : 1,6 : 0,1; 50 оС; 0,03 А
| № опыта | Фл 1/2, мин | Продолжительность реакции, ч | Выходы продуктов, % | |||
| Гидрокси-фуранон 1 | Фуранон 2 | Кислота 3 | Кислота 4 | |||
| 1 | 45 | 8 | 46-50 | 14-16 | 24-26 | – |
| 10 | 85 | 15 | 14-16 | 33-37 | 9-11 | 19-21 |
Состав и количество фонового электролита (сравнивались перхлораты щелочных металлов) влияют на продолжительность изучаемой реакции (табл. 6). Увеличение количества перхлоратов в диапазоне 0,01-1,0 моль на моль фурфурола способствует ускорению процесса, причем наиболее быстро он протекает в случае LiClO4. Наибольший выход гидроксифуранона 1 наблюдается в присутствии 0,1 моль LiClO4 или NaClO4 на моль фурфурола.
При использовании 0,01 М раствора НСlO4 в качестве фонового электролита процесс резко ускоряется, выходы продуктов 2 и 3 значительно снижаются (их суммарный выход не превышает 15 %). В этих условиях кислота 5 образуется, наряду с гидроксифураноном 1, в качестве одного из основных продуктов с выходом до 32 %. Характер кинетических кривых, полученных для анодной реакции в растворах перхлоратов и хлорной кислоты, позволяет предположить, что НClO4 способствует образованию промежуточных органических пероксидов и их превращению в карбоновые кислоты.
Таблица 6 – Результаты реакции фурфурола (Фл) с Н2О2 в условиях анодного окисления в зависимости от состава и количества фонового электролита: [Фл]0 = 1,0 моль/л; [Фл] 0 : [Н2О2] 0 = 1 : 1,6; 50 оС; 0,03 А
| № опыта | Фоновый элект-ролит | Количество моль/моль фурфурола | Продолжительность реакции, ч | Выходы продуктов, % | ||
| Гидрокси-фуранон 1 | Фуранон 2 | Кислота 3 | ||||
| 11 | LiClO4 | 0,01 | 9,3 | 40-44 | 19-21 | 25-27 |
| 1 | 0,1 | 8 | 46-50 | 14-16 | 24-26 | |
| 12 | 1,0 | 6,3 | 42-46 | 17-19 | 23-25 | |
| 13 | NaClO4 | 0,01 | 12 | 38-42 | 19-21 | 20-22 |
| 14 | 0,1 | 9,5 | 43-47 | 17-19 | 21-23 | |
| 15 | 1,0 | 7 | 41-45 | 21-23 | 18-20 | |
| 16 | KClO4 | 0,01 | 14 | 28-32 | 38-42 | 9-11 |
| 17 | 0,1 | 11 | 35-39 | 24-26 | 17-19 | |
С целью выявления особенностей анодной реакции в условиях постоянного значения рН реакционной среды изучено влияние добавки карбоната кальция (1 моль на моль фурфурола). В присутствии CaCO3 уровень рН анолита поддерживался на уровне 3,5 – 4 на всем протяжении реакции. В этих условиях процесс тормозится по сравнению с опытом 1, при этом выходы продуктов 1-3 заметно уменьшаются, в качестве основного продукта образуется кислота 4 (выход 30-34 %).
Установлено, что введение в анодную реакцию VOSO4 (0,003 моль/моль фурфурола) способствует ускорению процесса и повышению выхода гидроксифуранона 1 до 57 %, что заметно превышает его выход (35-40 %) в ранее изученной в КубГТУ «бестоковой» реакции в присутствии этого катализатора.
Представленные результаты показывают, что большинство изученных факторов заметно влияют на скорость и состав продуктов анодного перекисного окисления фурфурола, что позволило определить пути управления этим процессом и его оптимальные условия для преимущественного образования гидрофуранонов 1 и 2.
Установлено, что реакция фурфурола с Н2О2 в условиях катодного восстановления по своему характеру приближается к «бестоковой» реакции и идет с образованием 2(5Н)-фуранона 2 и янтарной кислоты 4 в качестве основных продуктов.
2.2 Изучение некоторых особенностей механизма реакции фурфурола с пероксидом водорода при воздействии постоянного электрического тока
Изучен состав промежуточных и побочных продуктов анодной, катодной и «бестоковой» реакций. За ходом изучаемой реакции наблюдали по превращению исходных реагентов, образованию промежуточных и конечных продуктов с помощью комплекса физико-химических методов. По результатам исследования построены соответствующие кинетические кривые, которые говорят о следующем.
Изученный анодный процесс отличается от «бестоковой» и катодной реакций отсутствием начального индукционного периода и значительным ускорением при воздействии постоянного электрического тока: 1/2 фурфурола сокращается в 5 раз, а общая продолжительность процесса – в 2,5 раза по сравнению с «бестоковой» реакцией. Разложение Н2О2 под действием анодного тока в присутствии фурфурола протекает заметно быстрее, чем в его отсутствие (1/2 Н2О2 1,5 и 7 ч соответственно).
Анодный процесс характеризуется накоплением карбоновых кислот в течение всей реакции. Через 20 мин после ее начала начинают накапливаться органические пероксиды, в составе которых обнаружен характерный интермедиат «бестоковой» реакции – гидроксигидропероксид фурфурола (ГГПФ) 6. После 3 ч реакции начинает накапливаться гидроксифуранон 1. В условиях катодной и «бестоковой» реакций ГГПФ 6 и кислоты накапливаются значительно медленнее.
В составе конечных продуктов анодного окисления фурфурола не обнаружены янтарная кислота 4 и другие характерные продукты «бестоковой» реакции – 2-фуранкарбоновая кислота 7, малеиновая и фумаровая кислоты 5 и 8. Общий выход винной 9, малоновой 10 и щавелевой 11 кислот в условиях анодной реакции не превышает 10-15 %. Такие побочные продукты «бестоковой» реакции, как муравьиная кислота, СО2 и О2, образуются и в анодном процессе.
Изучены особенности образования и превращения основных продуктов перекисного окисления фурфурола 1, 2, 4, 5 и 7 в условиях анодной реакции (схема 2). При окислении кислоты 7 образуются продукты 1 и 5, однако степень ее превращения не превышает 8 %. Это, с учетом отсутствия кислоты 7 в составе продуктов анодного окисления фурфурола, указывает на то, что она не является промежуточным продуктом в данном процессе.
Основными продуктами анодного окисления гидроксифуранона 1 являются малеиновая и фумаровая кислоты 5 и 8. Однако степень его превращения в этих условиях всего 3 %, что объясняет отсутствие заметного количества кислот 5 и 8 в составе продуктов электрохимического окисления фурфурола. В то же время в присутствии HClO4 степень превращения гидроксифуранона 1 резко возрастает, процесс ускоряется и идет в сторону преимущественного образования кислоты 5.
Схема 2
В результате анодного окисления фуранона 2 образуется яблочная кислота 3 с небольшой примесью янтарной кислоты 4 и 2(3Н)-фуранона 12. В присутствии ингибитора свободнорадикальных процессов (триэтаноламина) направленность окисления фуранона 2 коренным образом меняется – единственным продуктом реакции является кислота 4.
Продуктами анодного перекисного окисления малеиновой кислоты 5 являются яблочная 3 и винная 9 кислоты, кроме того происходит ее частичная изомеризация в фумаровую кислоту 8.
Янтарная кислота 4 в условиях анодной реакции с Н2О2 не взаимодействует, что исключает возможность образования из нее кислоты 3 в процессе электрохимического окисления фурфурола.
Установлено, что в присутствии ингибиторов свободнорадикальных реакций (гидрохинона, пирогаллола, триэтаноламина) анодное перекисное окисление фурфурола существенно замедляется (табл. 7), что является признаком образования в данной реакционной системе свободных радикалов и их активного участия в изученном анодном процессе.
В присутствии ингибиторов направленность анодного окисления фурфурола коренным образом меняется: главным продуктом реакции в этих условиях является янтарная кислота 4 с выходом от 40 до 90 % в зависимости от типа ингибитора. Выход гидрофуранона 1 при этом резко снижается по сравнению с опытом 1, тогда как выход фуранона 2 уменьшается незначительно.
Таблица 7 – Результаты реакции фурфурола (Фл) с Н2О2 в условиях анодного окисления в присутствии ингибиторов свободнорадикальных процессов: [Фл]0 = 1,0 моль/л; [Фл]0 : [Н2О2]0 : [LiClO4]0 : [ингибитор]0 =
1 : 1,6 : 0,1 : 0,005; 50 оС; 0,03 А
| № опыта | Ингибитор | Фл 1/4, мин | Фл 1/3, мин | Фл 1/2, мин | Продолжительность реакции, ч | Степень превращения Фл, % |
| 1 | – | 27 | 32 | 45 | 8 | 98 |
| 18 | Триэтаноламин | 156 | 220 | 450 | 54 | 17 |
| 19 | Гидрохинон | 107 | 160 | 320 | 50 | 20 |
| 20 | Пирогаллол | 55 | 80 | 180 | 49 | 20 |
В условиях катодного восстановления ингибиторы не оказывают заметного влияния на скорость реакции и выходы основных продуктов. Это указывает на то, что в данном случае радикальные частицы активного участия в процессе превращения фурфурола не принимают.
Методом конкурирующих акцепторов определена константа скорости модельного акцептора (этанола) с радикалами НО. в условиях анодного перекисного окисления (kэт = 0,367 · 10 – 9 л/моль·с; [тимин]0 : [этанол]0 : [Н2О2]0 = 1 : (0,5-2,5) : 10; рН=2, 25±0,1 0С). Полученная величина kэт близка по своей величине к константам гидроксилирования этанола, ранее полученным в «бестоковых» системах «FeSO4 – H2O2» и «VOSO4 – H2O2», для которых характерна интенсивная генерация радикалов НО.. Это свидетельствует об образовании свободных гидроксильных радикалов при разложении пероксида водорода на графитовом аноде.
На основе полученных результатов, с учетом литературных данных, сформировано предположительное представление о механизме реакции фурфурола с Н2О2 в условиях анодного окисления. В соответствии со схемой 3 изученный анодный процесс преимущественно протекает по направлениям А и Б.
Схема 3
Направление А обусловлено присоединением радикалов НО. (направление А1) и НОО. (направление А2), генерируемых из Н2О2 под действием анодного тока, во 2 и 5 положения фуранового ядра фурфурола. Предположительно образующиеся при этом интермедиаты 13 и 14, согласно литературе, неустойчивы и легко превращаются в гидроксифуранон 1, который в исходных условиях анодного процесса устойчив, а в присутствии НClO4 окисляется до кислоты 5.
Конкурирующим является известное направление Б, характерное для «бестоковой» реакции, связанное с образованием пероксида 6 на начальной стадии процесса и его последующим превращением в неустойчивый 2-гидроксифуран 15 и далее в 2(5Н)-фуранон 2. Полученные результаты позволяют говорить об ускорении этого направления реакции под действием тока. Соотношение направлений А и Б, по-видимому, меняется в достаточно широких пределах в зависимости от рассмотренных выше факторов.
Полученные результаты, с учетом литературы, позволяют предположить, что яблочная кислота 3 является продуктом радикального гидроксилирования 2(3Н)-фуранона 12, образующегося в результате изомеризации фуранона 2 в принятых условиях анодного окисления. В отсутствие свободных радикалов фуранон 12 превращается в янтарную кислоту 4 по известному направлению, характерному для «бестоковой» реакции.
3 Синтезы на основе реакции фурфурола с водным пероксидом водорода при воздействии постоянного электрического тока
На основе полученных результатов созданы новые способы синтеза 5-гидрокси-2(5Н)-фуранона 1 и 2(5Н)-фуранона 2 (схема 4), которые обладают рядом важных преимуществ по сравнению с известными способами их получения фотохимическим окислением фурана или фурфурола кислородом, а также окислением этих фурановых соединений пероксидом водорода в отсутствие тока.
Разработано два варианта способа получения гидроксифуранона 1. По одному из них реакцию проводят в анодной ячейке, фурфурол смешивают с 30 %-ным Н2О2 и раствором перхлората лития при мольном соотношении фурфурола, Н2О2 и LiClO4, равном 1 : 1,6 : (0,1 – 0,2), исходной концентрации фурфурола 1,0 моль/л при 50 0С и силе тока 0,01 – 0,03 А.
Схема 4
По окончании реакции, определяемом на момент полного превращения реагентов (через 8 ч после начала процесса), реакционную смесь нейтрализуют NaHCO3 до рН около 7, удаляют 70-80 % воды, удаляют 2(5Н)-фуранон 2 экстракцией CCl4, остаток подкисляют раствором HCl до рН около 2, упаривают досуха, из сухого остатка извлекают 5-гидрокси-2(5Н)-фуранон 1 методом постоянной жидкостной экстракции бензолом в аппарате Сокслета. Выход гидроксигидрофуранона 1 составляет 48 % от исходного фурфурола.
По другому варианту синтез гидроксигидрофуранона 1 проводят по аналогичной методике в присутствии сульфата ванадила VOSO4 в количестве 0,001 – 0,003 моль на моль фурфурола. В этих условиях время реакции сокращается до 3,5 – 4 ч, выход целевого продукта 1 увеличивается до 57 %.
Новый способ получения гидроксифуранона 1 позволяет существенно сократить расход Н2О2 (по сравнению со способами, основанными на «бестоковых» реакциях) и продолжительность процесса (по сравнению с фотохимическим способом), исключает использование токсичных и легковоспламеняющихся органических растворителей (ацетона и метанола); вследствие незначительного тепловыделения значительно повышается степень управляемости процессом; в связи с отсутствием в составе продуктов примесей кислот 4 и 5 способ позволяет выделять гидроксифуранон 1 непосредственно из реакционной смеси, минуя стадию его предварительного превращения в 5-алкокси-2(5Н)-фураноны.
Согласно разработанному нами способу получения 2(5Н)-фуранона 2 фурфурол смешивают с 30 %-ным Н2О2 и раствором перхлората калия при мольном соотношении фурфурола, Н2О2 и KClO4, равном 1 : 1,6 : 0,01 при 50 0С и силе тока 0,03 А. По окончании реакции электролизат нейтрализуют до рН около 7, удаляют 70-80 % воды, экстракцией CCl4 извлекают 2(5Н)-фуранон 2, перегоняют при пониженном давлении, получают целевой продукт 2 с выходом 40 % от исходного фурфурола.
Новый способ получения фуранона 2 отличается от ранее известного способа его получения, основанного на «бестоковой» реакции фурфурола с Н2О2, возможностью более легкого управления процессом и сокращением расхода пероксида водорода.
Разработанные методики позволяют раздельно извлекать из реакционной смеси оба гидрофуранона 1 и 2. Их максимальный суммарный выход, равный 70 % (выход продукта 1 – 30 %, выход продукта 2 – 40 %), достигнут в условиях опыта 1.
Разработаны также новые способы получения малеиновой кислоты 5 и яблочной кислоты 3. Кислоту 5 получают в условиях синтеза гидроксифуранона 1 при мольном соотношении фурфурола и Н2О2, равном 1 : 5,5, в качестве фонового электролита используют НClO4 (0,01 моль/моль фурфурола). Через 6 ч реакции достигается полное превращение фурфурола, оксидат упаривают, удаляют примесь фуранона 2 экстракцией ССl4, остаток экстрагируют этилацетатом, сушат, кипятят с активированным углем, отфильтровывают, полученные кристаллы после удаления растворителя перекристаллизовывают из петролейного эфира и CHCl3, получают кислоту 5 с выходом 41 % от исходного фурфурола.
Кислоту 3 получают в условиях синтеза гидроксифуранона 1. Оксидат упаривают, экстрагируют фураноны 1 и 2 этилацетатом, остаток экстрагируют ацетоном, кипятят с активированным углем, после удаления растворителя сушат и перекристаллизовывают из этилацетата, получают кислоту 3 с выходом 24 % от исходного фурфурола.
Строение продуктов 1, 2, 3 и 5 подтверждено спектрами ИК и ПМР, хроматографическими методами и качественными реакциями.
4 Результаты исследования биологической активности компози-
ционного препарата ВАП-1
Анодным перекисным окислением фурфурола в условиях опыта 1 получен препарат ВАП-1, представляюший собой композицию 5-гидрокси-2(5Н)-фуранона 1 и 2(5Н)-фуранона 2 в соотношении 3 : 1. В результате его биологических испытаний, проведенных в НИИ ХГС КубГТУ, КубГАУ и СКЗНИИСиВ, установлено следующее.
Препарат, в результате обработки его 0,001 %-ным раствором семян риса, увеличивает высоту растений, длину и сырую массу их корней, что способствует повышению урожайности этой культуры на 15,4 %, при этом существенно улучшается качество зерна риса.
Препарат ВАП-1, при обработке его 0,005 %-ным раствором семян пшеницы, увеличивает длину корней на 42,2 %, их биомассу на 46,3 %, высоту и биомассу проростков на 42,9 и 52,1 % соответственно по сравнению с контролем. Препарат обладает выраженным антистрессовым действием: в условиях подсушивания проростков пшеницы он в оптимальной дозе 0,0001 % увеличивает высоту и биомассу подсушенных проростков на 25,7 и 14,1 % соответственно, длину и биомассу корней на 60,34 % и 58,75 % соответственно по сравнению с контролем. Полученные результаты показывают, что препарат ВАП-1 обладает более высокой ростстимулирующей и антистрессовой активностью на культуре пшеницы по сравнению с индивидуальными гидрофуранонами 1 и 2.
Препарат ускоряет созревание винограда сорта «Шардоне» на 7 дней, на 22 % повышает сахаристость сока ягод.
Результаты испытаний свидетельствуют о высокой эффективности препарата ВАП-1 в качестве стимулятора роста указанных сельскохозяйственных культур и перспективности его расширенных испытаний.
ВЫВОДЫ
1. Впервые проведено и изучено окисление фурфурола водным пероксидом водорода при воздействии постоянного электрического тока с использованием графитовых электродов. Данная реакция в условиях анодного окисления отличается от реакции без тока меньшей продолжительностью и более высокой селективностью с преимущественным образованием 5-гидрокси-2(5Н)-фуранона, 2(5Н)-фуранона и яблочной кислоты. В условиях катодного процесса реакция по составу продуктов не отличается от «бестоковой».
2. Особенностью реакции анодного окисления фурфурола пероксидом водорода является участие в ней образующихся из Н2О2 свободных радикалов, что подтверждено действием ингибиторов свободнорадикальных процессов и методом конкурирующих акцепторов.
3. Разработаны новые, более рациональные по сравнению с известными, способы получения важных в практическом отношении гидрофуранонов. 5-Гидрокси-2(5Н)-фуранон получен с выходом до 57 % при мольном соотношении фурфурола, пероксида водорода и LiClO4, равном 1,0 : 1,6 : (0,1 – 0,2); 50 оС и силе тока 0,01 – 0,03 А. В качестве второго продукта в этих условиях получена яблочная кислота с выходом 24 %.
2(5Н)-Фуранон получен с выходом 40 % при мольном соотношении фурфурола, Н2О2 и KClO4, равном 1,0 : 1,6 : 0,01 (50 оС, 0,03 А).
4. Разработан новый способ получения малеиновой кислоты при использовании в качестве электролита раствора хлорной кислоты. Малеиновая кислота получена с выходом 41 % при мольном соотношении фурфурола, пероксида водорода и HClO4, равном 1,0 : 5,5 : 0,01 (50 оС, 0,03 А).
5. Композиция 5-гидрокси-2(5Н)-фуранона и 2(5Н)-фуранона в мольном соотношении 3 : 1, полученная реакцией фурфурола с пероксидом водорода в условиях анодного окисления, проявляет высокое ростстимулирующее действие при обработке ее растворами винограда, семян риса и пшеницы, что определяет перспективность препарата для широкой апробации и использования.
Основное содержание диссертации изложено в следующих работах:
1. Яковлев М.М., Посконин В.В. Реакция фурфурола с водным пероксидом водорода в условиях анодного синтеза // Известия высших учебных заведений. Северо-Кавказский регион. Естественные науки. – 2010. – № 5 (159). – С. 60 – 64.
2. Яковлев М.М., Посконин В.В. Синтез 2(5Н)-фуранона и 5-гидрокси-2(5Н)-фуранона в системе «фурфурол – пероксид водорода – анолит» под действием постоянного электрического тока // Фундаментальные исследования. – 2011. – № 8. – Ч. 1. – С. 207 – 210.
3. Яковлев М.М., Посконин В.В. О составе основных продуктов электрохимического превращения фурфурола в водном растворе пероксида водорода // Альманах современной науки и образования. – 2009. – № 5 (24). – С. 189 – 190.
4. Посконин В.В., Яковлев М.М. О некоторых особенностях реакции фурфурола с водным пероксидом водорода в условиях электролиза на разделенных графитовых электродах // Альманах современной науки и образования. – 2008. – № 5 (12). – С. 101 – 102.
5. Сивочубова А.А, Яковлев М.М., Посконин В.В., Шабунина В.А. Новые подходы к синтезу эффективных регуляторов роста растений на основе реакций окисления 2-формил и 2-гидроксиметилфуранов // Сборник трудов 2-й международной конференции «Фундаментальные и прикладные проблемы современной химии». – Астрахань, 2008. – С 87 – 88.
6. Посконин В.В., Яковлев М.М., Сивочубова А.А., Шабунина В.А. Некоторые особенности превращений фурфурола и 2-оксиметилфурана в новых системах их каталитического перекисного окисления // Материалы научной конференции «Научные исследования высшей школы по приоритетным направлениям науки и техники». – Москва, 2008. – С. 38.
7. Посконин В.В., Яковлев М.М., Шабунина В.А. Новые реакции фурфурола в системах, содержащих водный пероксид водорода // Материалы 1-й международной конференции «Новые направления в химии гетероциклических соединений». – Кисловодск, 2009. – С. 67.
8. Яковлев М.М., Посконин В.В. Электрохимическое перекисное окисление фурфурола: новый путь к синтезу -формилакриловой кислоты // Труды IV Всероссийской научной конференции молодых ученых и студентов «Современное состояние и приоритеты развития фундаментальных наук в регионах». – Анапа – Краснодар: «Просвещение-Юг», 2010. – Т.1. – С. 105.
9. Яковлев М.М., Посконин В.В. Постоянный электрический ток – новый фактор управления направленностью реакции фурфурола с водным пероксидом водорода // Материалы 2-й международной конференции «Новые направления в химии гетероциклических соединений». – Железноводск, 2011. – С. – 70.
10. Яковлев М.М., Посконин В.В. Синтезы гидрофуранонов перекисным окислением фурфурола под действием постоянного электрического тока // XIX Менделеевский съезд по общей и прикладной химии. – В 4 т. Т. 1: Тез. докл. – Волгоград, 2011. – С. 449.
11. Яковлев М.М., Посконин В.В. Влияние катализаторов VOSO4 и Nb2O5 на направленность окисления фурфурола пероксидом водорода в присутствии постоянного электрического тока // Молодежная конференция «Международный год химии»: Сборник материалов; Министерство образования и науки, Казанский национальный исследовательский технологический университет. – Казань, 2011. – С. 156 – 157.
Подписано в печать 31.01.2012г. Зак.1208. Тираж 100.
Типография КубГТУ. 350058. Краснодар, ул. Старокубанская, 88/4.

