Синтез, реакции и биологическое действие 2-алкилтионикотинонитрилов, ди- и тетра-гидропиридо [3 ',2':4,5]тиено[3,2- d ]пиримидин-4-онов и 2-гетарилтиено [2,3- b ] пиридинов
На правах рукописи
Костенко Екатерина Сергеевна
Синтез, реакции и биологическое действие
2-алкилтионикотинонитрилов, ди- и тетра-гидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-онов
И 2-гетарилтиено[2,3-b]пиридинов
Специальность 02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Краснодар – 2008
Работа выполнена в Кубанском государственном технологическом
университете
Научный руководитель: доктор химических наук, старший научный
сотрудник Кайгородова Елена Алексеевна
Официальные оппоненты: доктор химических наук
Стрелков Владимир Денисович
кандидат химических наук, доцент
Пушкарева Кира Степановна
- Ведущая организация: Ставропольский государственный университет
Защита состоится 17 февраля 2009г. в 14:30 на заседании диссертационного совета Д 212.100.01 в Кубанском государственном технологическом
университете по адресу: 350072, г. Краснодар, ул. Красная, 135, ауд. 174.
С диссертацией можно ознакомиться в библиотеке Кубанского государственного технологического университета по адресу: г. Краснодар,
ул. Московская, 2, корпус А.
Автореферат разослан « 12 » января 2009г.
Ученый секретарь
диссертационного совета,
к.х.н., доцент Кожина Н.Д.
Общая характеристика работы
Актуальность проблемы. Среди аннелированных пиридинов в последние годы широкое распространение получили тиенопиридины. Наиболее известными из них являются производные тиено[2,3-b]-пиридинов, проявляющие иммуномоделирующее, противовоспалительное, противовирусное, нейротропное, анальгетическое, антиаллергическое, противоопухолевое, противомикробное, антибактериальное, рострегу-лирующее действия. Доступность исходного сырья, большой синте-тический потенциал тиено[2,3-b]пиридинов, делает их привлекательными объектами для тонкого органического синтеза. Особый интерес представляют мало изученные реакции замещенных тиено[2,3-b]пириди-нов и полученных на их основе дигидропиридотиенопиримидинонов с никелем Ренея, которые открывают путь к различным гетероциклическим системам. Последние могут являться перспективными БАВ. В этой связи разработка методов синтеза новых замещенных и аннелированных пиридинов, изучение их химических свойств является актуальной задачей.
Работа является частью плановых исследований кафедры органической химии КубГТУ 04.39.1 «Химический дизайн новых конденсированных гетероциклических систем с целью создания физиологически активных веществ с направленным биологическим действием» (номер госрегистрации 01200509784).
Цель работы заключалась в оптимизации методов синтеза новых
2-алкилтионикотинонитрилов, ди- и тетрагидропиридо[3',2':4,5]тиено-
[3,2-d]пиримидин-4-онов и 2-гетарилтиено[2,3-b]пиридинов; исследовании трансформаций 3-амино-3,4-дигидропиридо[3',2':4,5]тиено[3,2-d]пирими-дин-4-онов и 2-гетарилтиено[2,3-b]пиридинов под действием никеля Ренея в замещенные и аннелированные пиридины; систематическом изучении реакционной способности 3-амино-3,4-дигидропиридо[3',2':4,5]тиено-
[3,2-d]пиримидин-4-онов и 2-гетарилтиено[2,3-b]пиридинов при взаимо-действии их с электрофильными реагентами (уксусным ангидридом, галогенангидридами карбоновых кислот, 2,5-диметокситетрагидрофуран-ом), а для 3-амино-3,4-дигидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-онов ещё и с формамидом; поиске путей практического использования синтезированных веществ.
Научная новизна. Синтезирован широкий ряд новых 2-алкил(арил, гетарил)-3-амино(алкил)-3,4-дигидропиридо[3',2':4,5]тиено[3,2-d]пирими-дин-4-онов. На основе реакций 3-амино-3,4-дигидропиридо[3',2':4,5]тиено-[3,2-d]пиримидин-4-онов с электрофильными реагентами: альдегидами, 2,5-диметокситетрагидрофураном, уксусным ангидридом синтезированы соответственно арилметилиден-, 3-(1-пирролил)-, диацетилпроизводные, с формамидом получены пиридо[3’,2’:4,5]тиено[2,3-е][1,2,4]триазоло[1,5-c]-пиримидин и 3,4-дигидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-оны.
Впервые исследована реакция 3-амино-3,4-дигидропиридо[3',2':4,5]-тиено[3,2-d]пиримидин-4-онов с никелем Ренея, в ходе которой наблю-далась восстановительная десульфуризация тиофенового цикла и расщеп-ление N-N-связи. Впервые получены 4-(3-пиридил)-1,6-дигидро-6-пири-мидиноны и 3,4-дигидропиридо[3',2':4,5]тиено[3,2-d]-пиримидин-4-оны.
Осуществлен синтез новой гетероциклической системы – 6,8,12b,13-тетрагидропиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидо[2,1-a]изоиндол-6,8-диона путем взаимодействия 3-аминотиено[2,3-b]пиридин-2-карбоксамида с о-формилбензойной кислотой за одну синтетическую стадию.
Обнаружено, что реакция 3-аминотиено[2,3-b]пиридин-2-карбокс-амида с 3-формил-1H-2-индолкарбоновыми кислотами в спирте заканчи-вается образованием 2-(4-оксо-1,2,3,4-тетрагидропиридо[3',2':4',5']тиено-[3,2-d]пиримидин-2-ил)-1Н-3-индолкарбоновых кислот.
Найдены условия (кипячение в АсОН) получения 2-(4-оксо-3,4-ди-гидропиридо[3',2':4',5']тиено[3,2-d]пиримидин-2-ил)бензойных кислот при взаимодействии (1Н-бензимидазол-2-ил)тиено[2,3-b]пиридин-3-аминов с о-формилбензойными кислотами.
Впервые осуществлен синтез новых 3-амино-2-гетарилтиено[2,3-b]-пиридинов, содержащих изоксазольный, оксадиазольный, пиридиновый, три-азиновый, хиназолиноновый фрагменты. На их основе получены моно- и ди-ацилпроизводные, а также 3-(1-пирролил)-2-гетарилтиено[2,3-b]-пиридины.
В результате изучения реакции 2-гетарилтиено[2,3-b]пиридин-3-аминов с никелем Ренея разработаны методы направленного синтеза новых гетероциклических соединений: 4-аминотиено[2,3-b;4,5-b]дипири-дина и 5-(4-аминопиридин-2-ил)пиридина при введении в реакцию
2-(3-изоксазолил)тиено[2,3-b]пиридин-3-амина; 3-(3-пиридил)-3-(1-пир-ролил)пропанамида при использовании в качестве исходного соединения 5-(3-(1-пирролил)тиено[2,3-b]пиридин-2-ил)-2,3-дигидро-1,3,4-оксадиазол-2-тиона.
Оптимизированы методики синтеза 2-(2-пропинилсульфанил)нико-тинонитрилов, что дало возможность повысить их выход.
Практическая значимость. В результате проведенных исследова-ний на основе доступных 2-алкилтионикотинонитрилов разработаны препаративные методы синтеза производных 2-алкилтионикотино-нитрилов, ди- и тетрагидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-онов, 2-гетарилтиено[2,3-b]пиридинов и 3-замещенных пиридинов.
Проведённые биологические испытания позволили выявить ряд соединений, обладающих рострегулирующей и антибактериальной активностью.
Апробация работы. Отдельные результаты работы докладывались и обсуждались на Всероссийской научно-технической конференции «Коршуновские чтения» (Тольятти, 2005), Международной конференции «Химия и биологическая активность азотсодержащих гетероциклов» (Черноголовка, 2006), Международной научной конференции «Фунда-ментальные и прикладные проблемы современной химии в исследованиях молодых ученых» (Астрахань, 2006), Четвертой Евразийской конференции по гетероциклической химии (Салоники, Греция, 2006), Восьмой региональной научно-практической конференции молодых ученых «Научное обеспечение агропромышленного комплекса» (Краснодар, КубГАУ, 2006).
Публикации. По теме диссертации опубликовано 9 печатных работ, в том числе 2 статьи в журналах, рекомендованных ВАК РФ.
Объём и структура. Диссертация изложена на 155 страницах машинописного текста, содержит 28 таблиц, 6 рисунков и состоит из введения, литературного обзора, 4 глав обсуждения результатов, экспериментальной части, выводов, списка литературы из 114 наименований и 3 приложений.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
В качестве исходных соединений были выбраны доступные 2-тиок-со-1,2-дигидро-3-пиридинкарбонитрилы 1, реакционная способность кото-рых позволяет осуществлять синтез ценных 2-алкилтионикотинонитри-лов, продуктов их изомеризации по Торпу-Циглеру 3-аминотиено[2,3-b]-пиридинов, а также три- и полициклических систем.
1. Синтез и реакции 2-алкилтионикотинонитрилов
Наиболее приемлемый метод синтеза 2-алкилтионикотинонитрилов – алкилирование 2-тиоксо-1,2-дигидро-3-пиридинкарбонитрилов -галоген-
алканами в присутствии эквивалентных количеств щелочи. Так, реакция
6-метил-4-метоксиметил-2-тиоксо-1,2-дигидро-3-пиридинкарбонитрила 1а с гидрохлоридом 2-хлорэтил(диметил)амина 2 в этаноле в присутствии гидроксида калия при комнатной температуре приводит к образованию
2-(2-диметиламиноэтилсульфанил)метилникотинонитрила 3 (выход 50%).

Растворимость химических соединений в воде является важной характеристикой и облегчает их дальнейшее использование в качестве потенциальных биологических активных веществ. Наличие в молекуле соединения 3 фрагмента третичного амина позволило осуществить синтез солей аммония 4а-з, которые могли оказаться водорастворимыми. Соли 4а-з получены взаимодействием толуольного раствора соединения 3 с газообразным бромоводородом (соединение 5а) или -галогеналканами (соединения 5б-з). Выход солей 4а-з – 48-66%.
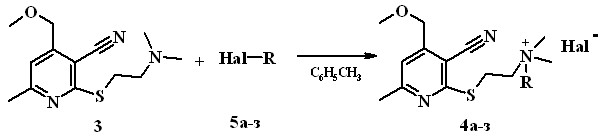
5а-д Hal=Br; 5е-з Hal=Сl; 4а, 5а R=H; 4б, 5б R=CH2CH=CH2;
4в, 5в R=CH2C6H4(4); 4г, 5г R=CH2C(O)C6H5; 4д, 5д R=CH2C(O)C6H4Br(4);
4е, 5е R=CH2C(O)NHC6H5; 4ж, 5ж R=CH2C(O)NHC6H4CH3(2);
4з, 5з R= CH2C(O)NHC6H4CF3(2)
Растворимость соединений 4 в воде резко падает при увеличении молекулярной массы радикала R. Хорошо растворяются в воде соединения 4а,б. Вещества 4е-з практически не растворяются в воде.
Оптимизирована методика синтеза 2-(2-пропинилсульфанил)-никотинонитрилов 6. Алкилированием 3-цианопиридин-2(1Н)-тионов 1а,б с 3-бром-1-пропином 7 в присутствии 1 моль КОН в этаноле при темпе-ратуре 0-5 С синтезированы 2-(2-пропинилсульфанил)никотинонитрилы 6а,б с выходом 85-87%. Понижение температуры на 15-20 С позволило повысить выход продуктов соответственно на 12% и 23% по сравнению с описанными в литературе методиками их синтеза.
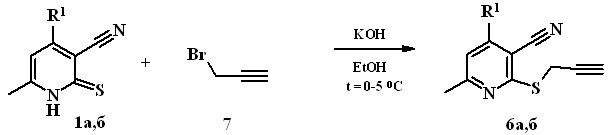
1а, 6а R1=CH2OCH3, 1б, 6б R1=CH3
Соединения 6а,б являются перспективными полупродуктами для тонкого органического синтеза.
2. Синтез и реакции 3,4-дигидропиридо[3',2':4,5]тиено-
[3,2-d]пиримидин-4-онов
Широкий ряд новых 2-алкил(арил, гетарил)-3-амино-3,4-дигидро-пиридо[3’,2’:4,5]тиено[3,2-d]пиримидин-4-онов 10, перспективных БАВ и прекурсоров для тонкого органического синтеза, получен двустадийным синтезом. Реакцией этил 3-аминотиенопиридинкарбоксилата 8 с хлор-ангидридами карбоновых кислот в толуоле получают амиды 9a-з (выход 56-94%). Кипячение последних в спирте с пятикратным избытком гидразингидрата приводит к замыканию пиримидинового цикла и образованию соединений 10а-з (выход 42-84%). Такой подход позволяет варьировать заместители в положении 2 путем использования различных галогенангидридов карбоновых кислот на первой стадии. Применение в качестве растворителя одного из спиртов (EtOH,
i-PrOH, BuOH) обусловлено различной растворимостью исходных амидов и скоростью образования конечных продуктов реакции циклизации.
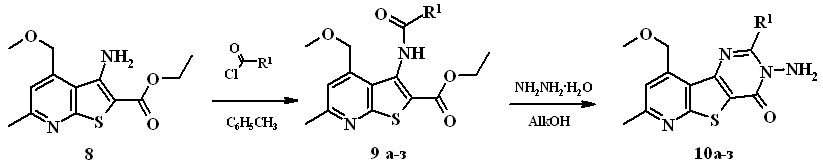
9а, 10а R1 = Et, 9б, 10б R1 = n-Bu, 9в, 10в R1 = i-Bu, 9г, 10г R1 = Fur,
9д, 10д R1 = Ph, 9е, 10е R1 = С6Н4-ОCH3(4), 9ж, 10ж R1 = С6Н4-NO2(2),
9з, 10з R1 = С6Н4-NO2(4), Alk = Et, i-Pr, n-Bu
Соединения 10 использованы в качестве объектов для изучения биологической активности и исследования их реакционной способности.
Азометины 11a-к синтезируют реакцией 3-аминопиримидинона 10б с ароматическими альдегидами в толуоле в присутствии р-TsOH (азеотропная отгонка воды). Выход соединений 11а-к составляет 66-98%.
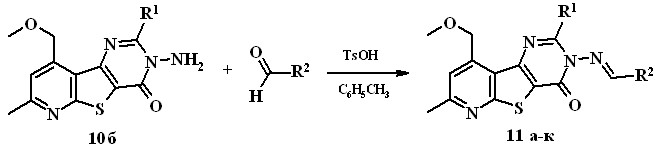
10b, 11a-к R1=n-Bu, 11a R2 = С6Н4Me(4), 11б R2 = С6Н4-ОСH3(4),
11в R2 = С6Н4-OC2H5(4), 11г R2 = С6Н4-NO2(4), 11д R2 = С6Н4-NHCOCH3(4),
11е R2 = С6Н4-N(CH3)2(4), 11ж R2 = С6Н3-Сl2(3,4), 11з R2 = С6Н4-Br(4),
11и R2 = С6Н3-OН(2)Br(5), 11к R2 = ![]()
Установлено, что 3-аминопиримидиноны 10в,д,е реагируют с
2,5-диметокситетрагидрофураном при кипячении в ледяной уксусной кислоте или смеси АсОН-DMF (синтез соединения 12в) при соотношении реагентов 3-аминопиримидинон : ДМТГФ – 1 : 1,2. В результате получены новые 3-(1-пирролил)-3,4-дигидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-оны 12а-в с высоким выходом (75–86%).

10в, 12а R1 = i-Bu; 10д, 12б R1 = Ph, 10е, 12в R1 = С6Н4-ОСН3(4)
Кипячением соединения 10в в уксусном ангидриде в течение 6 ч получают продукт диацилирования 13 с выходом 80%.

10в, 13 R1 = i-Bu
Литературные данные свидетельствуют о том, что 3-аминопиридо-тиенопиримидиноны взаимодействуют с формамидом с образованием пиридотиенотриазолопиримидинов. Установлено, что реакция 3-амино-пиридотиенопиримидинонов 10 с формамидом протекает неоднозначно.
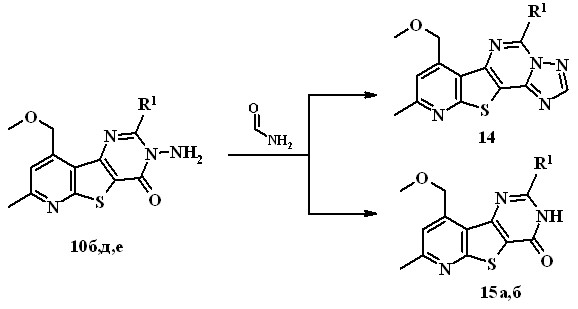
10б, 14 R1=n-Bu, 10д, 15а R1=Ph, 10е, 15б R=С6Н4-ОСН3(4)
Так, при кипячении пиримидинона 9б, содержащего в качестве заместителя в положении 2 н-бутильный фрагмент, в формамиде в течение 30 мин образуется пиридо[3’,2’:4,5]тиено[2,3-е][1,2,4]триазоло[1,5-c]-пиримидин 14 с выходом 57%. В то же время, кипячение пиримидинонов 10д,е в формамиде в течение 1,5-2 ч сопровождается расщеплением связи N-N, что приводит к образованию незамещенных в положении 3 пиримидинонов 15a,б (выход 53, 62%).
В литературе [А.В. Кадушкин, и др. // Хим.-фарм. журн. 1993. Т. 27. № 3. С. 40.] имеется единственный пример реакции восстановительной десульфуризации пиридотиенопиримидина, 3-аминопроизводные в этой реакции не изучались. Установлено, что введение в реакцию 3-амино-3,4-дигидропиридотиенопиримидинона 10б с никелем Ренея по методике, описанной в литературе (кипячение в этаноле, 10-кратный избыток Ni/Ra) с выходом 50% выделен единственный продукт 15в, которому на основании данных ИК и ЯМР 1Н и масс-спектров была приписана структура 2-бутил-7-метил-9-метоксиметил-3,4-дигидропиридо[3',2':4,5]-тиено[3,2-d]пиримидин-4-она.
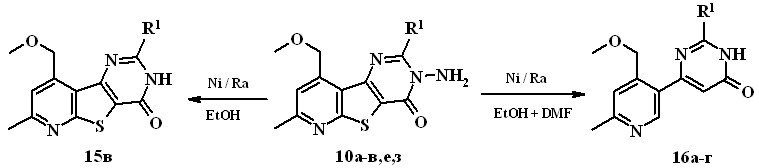
10а, 16a R1 = Et, 10б, 15в R1 = n-Bu, 10в, 16б R1 = i-Bu,
10е, 16в R1 = С6Н4-ОСН3(4),10з R1 = С6Н4-NO2(4), 16г R1 = С6Н4-NH2(4)
В отличие от 3-аминопиримидинона 10б низкая растворимость соединений 10а,в,е,з в спирте не позволяет осуществить реакцию с Ni/Ra в указанных условиях. Для увеличения растворимости исходных веществ и повышения температуры при проведении реакции в качестве растворителя используют смесь этанола и диметилформамида (объемное соотношение 1:1). Реакцию продолжают до тех пор, пока все исходное вещество израсходуется и в реакционной смеси образуется единственный продукт. Данные элементного анализа, масс-спектрометрии, ИК и ЯМР 1Н спектров свидетельствуют о расщеплении связи N-N исходных веществ и протекании реакции восстановительной десульфуризации, с образованием 4-(3-пиридил)-1,6-дигидро-6-пиримидинонов 16а-г с выходом 25-68%.
При использовании в качестве исходного 3-амино-2-(4-нитрофенил)-3,4-дигидропиридотиенопиримидинона 10з, помимо расщепления связи
N-N, десульфуризации тиофенового цикла происходит, как мы и ожидали, восстановление нитрогруппы до аминогруппы.
В спектрах ЯМР 1Н соединений 16а-г характерный синглетный сигнал протона пиримидинового цикла в положении 5 прописывается в об-ласти 6,32-6,50 м. д. Сигнал при 8,50-8,60 м. д. отнесен к протону пириди-нового кольца в положении 2, а уширенный сигнал с интегральной интен-сивностью 1Н при 12,35-12,71 м. д. – протону группы NH пиримидинона.
3. Синтез новых 3-алкил-3,4-дигидропиридо[3',2':4,5]-
тиено[3,2-d]пиримидин-4-онов
3,4-Дигидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-оны обладают иммуномоделирующим, противовоспалительным, противовирусным, анальгетическим, антиаллергическим, противомикробным видами актив-ности. С целью расширения ряда перспективных биологически активных веществ синтезированы новые 3-алкил-3,4-дигидропиридо[3',2':4,5]тиено-[3,2-d]пиримидин-4-оны 17а-щ.
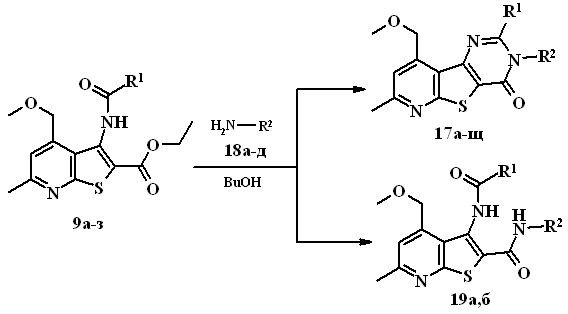
9а, 17а-д R1=Et; 9б, 17с-и R1=n-Bu; 9в, 17к-м R1=i-Bu; 9г, 17н,о R1=Fur; 9д, 17п-с, 19а,б R1=Ph; 9е, 17т,у R1=С6Н4-ОСН3(4); 9ж, 17ф-ц R1=С6Н4-NO2(2); 9з, 17ч-щ R1=С6Н4-NO2(4); 17а,е,к,н,п,т,ф,ч 18а R2=n-Bu; 17б,ж,л,о,р,у,х,ш, 18б R2=С2Н4ОН; 17в,з,м,с,ц,щ, 18в R2=(СН2)3N(С2Н5)2; 17г,и, 18г, 19а R2=СН2Ad1; 17д, 18д, 19б R2=(СН2)2ОAd1
Соединения 17а-щ получали при кипячении (10-15 ч) амидов 9 с алифатическими аминами 18 в бутаноле. Варьирование заместителя R1 в амидах 9а-з и заместителя R2 в аминах 18а-д позволяет вводить различные группировки соответственно во 2-е и 3-е положения пиримидинового кольца пиридотиенопиримидинонов 17а-щ. Выход продуктов – 25-88%.
Обнаружено, что при проведении реакции между амидом 10д и
1-адамантилметиламином 18г или 2-(1-адамантилокси)этиламином 18д вместо ожидаемых пиридотиенопиримидинонов образовывались
N2-(1-адамантилметил)- и N2-[2-(1-адамантилокси)этил]-3-фенилкарбокс-амидотиено[2,3-b]пиридин-2-карбоксамиды 19а,б (выход 47 и 59%), что объясняется, по-видимому, стерическими факторами, затрудняющими реакцию гетероциклизации.
4. Синтез замещенных и аннелированных тетрагидропиридотиенопиримидинов
Расширены рамки реакции 3-аминотиено[2,3-b]пиридин-2-карбокс-амида 20 с альдегидами за счет вовлечения в неё альдегидов пиррольного,
пиразольного, фуранового рядов.

| Cоеди- нение | Het | Cоеди- нение | Het | Cоеди- нение | Het |
| 2.21а, 2.22а |  | 2.21в, 2.22в | 2.21д, 2.22д | 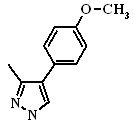 | |
| 2.21б, 2.22б |  | 2.21г, 2.22г |  | 2.21е, 2.22е | 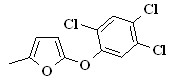 |
Реакцию проводят при кипячении исходных соединений в абсолют-ном этаноле в присутствии каталитических количеств п-TsOH и соотноше-нии реагентов амид 20 : альдегид 21а-е – 1:1,05 (толуол непригоден из-за низкой растворимости в нем альдегидов). Выход продуктов 22а-е - 59-79%.
Впервые изучены реакции 3-аминотиено[2,3-b]пиридин-2-карбокс-амидов с альдегидокислотами. Исходя из структуры 3-аминотиено[2,3-b]-пиридин-2-карбоксамида 20 и о-формилбензойной кислоты (о-ФБК) 23а можно ожидать образования пяти различных продуктов (А-Д) или их смесей.
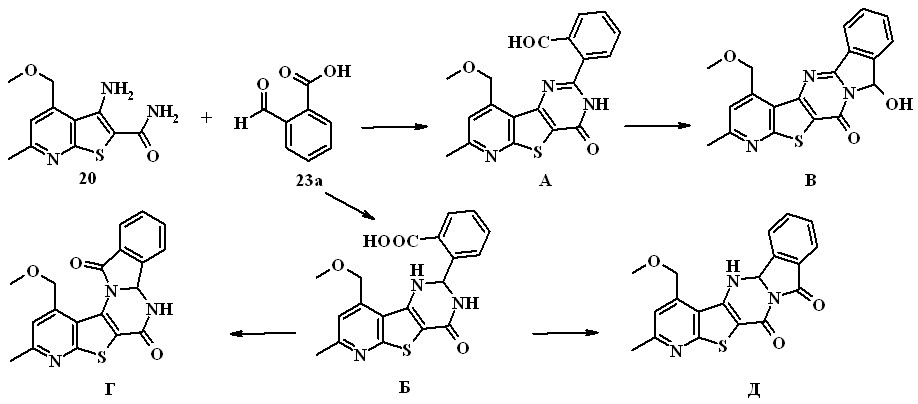
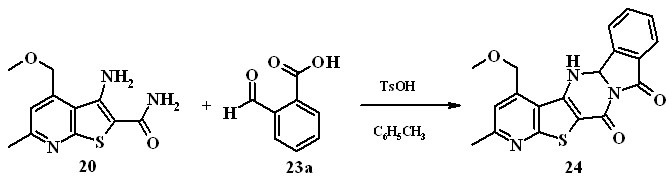
Установлено, что при длительном (около 30 ч) кипячении реагирующих веществ в толуоле при азеотропной отгонке воды с выходом 64% образуется единственный продукт – 6,8,12b,13-тетрагидропиридо-[3'',2'':4',5']тиено[3',2':4,5]пиримидо[2,1-a]изоиндол-6,8-дион 24.
Структура соединения 24 установлена на основании данных ИК, ЯМР 1Н и масс-спектров. Однозначно структура соединения была доказана с помощью двумерного гомоядерного спектра 1Н-1Н NOESY, в котором присутствует кросс-пик, соответствующий спин-спиновому взаимо-действию протонов ОСН2 и NH групп (рисунок 1).
Анализ структуры соединения 24 позволяет заключить, что на первом этапе реакции 3-аминотиено[2,3-b]пиридин-2-карбоксамида 20 с
о-ФБК образуется дигидропиримидинон Б, который в дальнейшем подвергается реакции внутримолекулярной гетероциклизации, приводящей к конечному соединении Д.
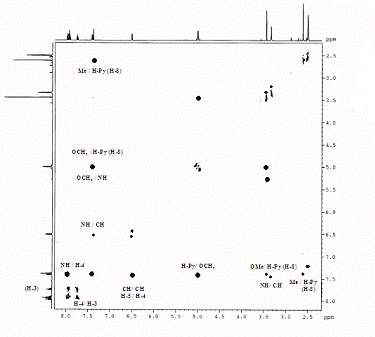
Рисунок 1. – Спектр 1Н-1Н NOESY соединения 24.
В отличие от реакции с о-ФБК взаимодействие 3-аминотиено[2,3-b]-пиридин-2-карбоксамида 20 с 3-формил-1H-2-индолкарбоновыми кисло-тами 25а-в в этаноле в присутствии p-TsOH протекает только по альдегидной группе. При этом получают 3-(4-оксо-1,2,3,4-тетрагидро-пиридо[3',2':4,5]тиено[3,2-d]пиримидин-2-ил)-1H-2-индолкарбоновые кис-лоты 26а-в. Соединения 26 выпадают в осадок после кипячения реакционной массы в течение 10-12 ч. Выход продуктов 26а-в – 47-56%.

20а, 26а-в R1=СН2ОСН3; 25а, 26а R2=R3=Н;
25б, 26б R2=ОСН3, R3=Н; 25в, 26в R2=ОСН3, R3=ОСН3
При изучении реакции 2-(1H-бензо[d]имидазо-2-ил)тиено[2,3-b]-пиридин-3-амина 27 с о-формилбензойными кислотами 23а-в было найдено, что при использовании в качестве растворителя уксусной кислоты (кипячение в течение 15-40 мин) протекает не только замыкание дигидропиримидинового кольца, но и окисление связи C–N, что приводит к 2-бензо[4,5]имидазо[1,2-c]пиридо[3',2':4,5]тиено[2,3-e]пиримидин-6-илбензойным кислотам 28а-в (выход 73-84%).
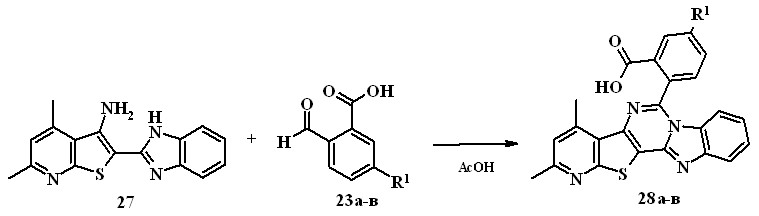
23а, 28а R1=Н; 23б, 28б R1=Cl; 23а, 28а R1=Br
Структура соединений 28 однозначно подтверждена данными ИК, ЯМР 1Н и масс-спектров.
5. Синтез и реакции 3-амино-2-гетарилтиено[2,3-b]пиридинов
Синтез новых 2-гетарилтиено[2,3-b]пиридин-3-аминов осуществлен 3-циано-2(1Н)пиридинтионов 1а-в с -галогенметилпроизводными 30а-ш, содержащими в своем составе изоксазольный, оксадиазольный, пири-диновый, триазиновый, хиназолиноновый фрагменты, в присутствии двукратного количество гидроксида калия (реакция алкилирования и последующая изомеризация по Торпу-Циглеру продукта алкилирования). В результате соединения 30 получают быстро (5 мин. – 1ч) и с хорошими выходами (62-98%).
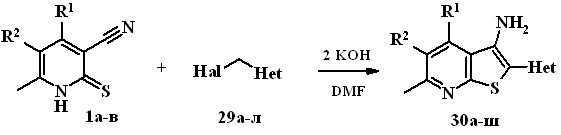
29а-л Hal = Cl,1a, 30а,г,е,и,к,н,п,с,у,х,ч,щ R1 = CH2OCH3, R2 = H;
1б, 30б,д,ж,л,о,р,т,ф,ц,ш,э R1 = CH3, R2 = H;1в, 30в,з,м R1 = CH3, R2 = Cl
| Соеди-нение | Het | Соеди-нение | Het | Соеди-нение | Het |
| 30а, 31а-в | 30д, 31к-м | 30и, 31у,ф | |||
| 30б, 31г,д | 30е, 31н,о | 30к, 31х,ц |  | ||
| 30в, 31е-з | 30ж, 31п,р | ||||
| 30г, 31и | 30з, 31с,т | 30л, 31ч,ш |
Исследование свойств 3-амино-2-гетарилтиено[2,3-b]пиридинов 30 направлено на изучение реакционной способности как аминогруппы, так и самого структурного каркаса 2-гетарилтиенопиридинов.
3-Амино-2-гетарилтиено[2,3-b]пиридины легко ацилируются как уксусным ангидридом с образованием диацилпроизводных 31а-в (выход 62-76%), так и хлорангидридами карбоновых кислот с образованием амидов 32а-к (выход 60-92%).

30a,щ, 31a, 32а-д,ж,и,к R1=CH2OCH3, R2=H; 30б, 31б,в, 32е,з R1=CH3, R2=H, 32а R3=i-Bu, 32б,е,з,и R3=Ph; 32в R3=С6Н4Me(2), 32г,к
R3=С6Н4ОMe(4), 32д,ж R3=С6Н4NO2(4), 30а,б, 31а,б 32а-е Het=![]() ,
,
30е,ж, 31в, 32ж,з Het=![]() , 30щ, 31к Het=
, 30щ, 31к Het=![]()
Установлено, что соединения 30а-в,г,е,ж,и-л,н-с,у,ф вступают в реакцию с 2,5-диметокситетрагидрофураном при кипячении в уксусной кислоте, образуя соответствующие 3-(1-пирролил)-2-гетарилтиено[2,3-b]-пиридины 33а-р (выход 68-97 %).

30a,г,е,и,к,н,п,с,у, 33а,г,д,ж,з,к,м,о,п R1=CH2OCH3, R2=H, 30б,ж,л,о,р,ф, 33б,е,и,л,н,р R1=CH3, R2=H, 30в, 33в R1=CH3, R2=Cl
| Cоеди- нение | Het | Cоеди- нение | Het | Cоеди- нение | Het |
| 30а-в, 33а-в | 30и, 33ж | 30п,р, 33м,н |  | ||
| 30г, 33г |  | 30к,л, 33з,и | 30с, 33о |  | |
| 30е,ж, 33д,е |  | 30н,о, 33к,л |  | 30у,ф, 33п,р |
Впервые исследована возможность осуществления реакции восста-новительной десульфуризации соединений ряда 2-гетарилтиено[2,3-b]-пиридинов под действием никеля Ренея. Обнаружено, что при кипячении
2-(3-изоксазолил)тиено[2,3-b]пиридин-3-амина 30a с 10-кратным избытком никеля Ренея в смеси этанол-ДМФА при соотношением растворителей 5:1 в течение 10ч. образуется пиридо[2',3':4,5]тиено[2,3-b]пиридин-4-амин 34 с выходом 62%. Вероятно, под действием водорода, адсорбированного на никеле происходит гидрогенолиз связи N-O изоксазольного цикла с образованием -енаминоальдегида 35, который при дальнейшем нагревании подвергается реакции внутримолекулярной циклизации, приводящей к конечному пиридотиенопиридину 34.
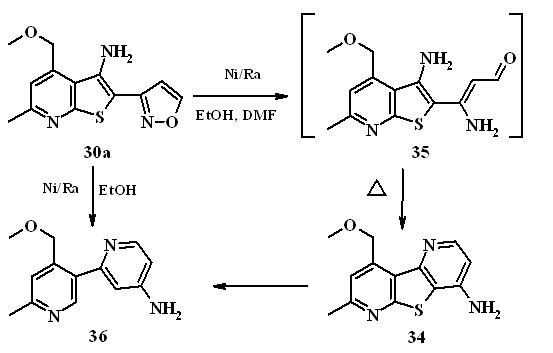
Дальнейшие исследования показали, что при увеличении времени реакции до 25-30 ч и проведении реакции в этаноле с 15-кратным избытком никеля Ренея продуктом реакции является 2-(3-пиридил)-4-пиридинамин 36. Согласно данным ТСХ в ходе реакции первоначально образуется пиридотиенопиридиамин 34, который расходуется вступая в реакцию десульфуризации, и дает конечный продукт 36 (выход 48%).
Изучено взаимодействие 5-[3-(1-пирролил)тиено[2,3-b]пиридин-2-ил]-2,3-дигидро-1,3,4-оксадиазол-2-тиона 33с с никелем Ренея (кипячение соединения 33с в этаноле с 10-кратным избытом Ni/Ra).

В ходе реакции помимо десульфуризации и восстановления двойной связи происходит деструкция оксадиазольного цикла, приводящая к формированию амидной группы, что позволяет получить 3-(3-пиридил)-3-(1-пирролил)пропанамид 37 с выходом 51%.
6. Биологическая активность синтезированных соединений
Синтезированные нами 2-алкилтионикотинонитрилы, дигидро-пиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-оны и 2-гетарилтиено[2,3-b]пи-ридины были подвергнуты скринингу на рострегулирующее действие на кафедре физиологии и биохимии растений Кубанского государственного аграрного университета.*
Установлено, что 3-амино-3,4-дигидропиридотиенопиримидин-4-он 10д, содержащий в положении 2 пиримидиного цикла н-бутильный заместитель, а также ранее полученные 3-амино-2-гетарилтиено[2,3-b]-пи-ридины 30щ,ю,я, имеющие в положении 2 тиофенового кольца изохино-линовый фрагмент, повышают показатели продуктивности растений риса (озерненность – 78 шт., 127 шт., 106 шт., 76 шт, в контроле – 67 шт.; масса зерна с растения – 2,28 г, 2,74 г, 2,36 г, 2,25 г, в контроле – 1,12 г) и качество зерна (масса 1000 зерен – 36,4 г, 28,2 г, 27,0г, 36,8 г, в контроле – 24,6 г; стекловидность – 97,0%, 100%, 98,5%, 98,5%, в контроле – 92,5%).
Скриниг обширной серии синтезированных ди- и тетрагидропиридо-[3',2':4,5]тиено[3,2-d]пиримидин-4-онов, 3-амино(ацил-, пирролил)-2-гет-арилтиено[2,3-b]пиридинов на наличие антибактериальной активности проведен на кафедре эпизоотологии и вирусологии Кубанского государст-венного аграрного университета.*
Исследование антибактериальной активности синтезированных соединений проводилось на двух тест-культурах –Staphylococcus aureus 209Р и Echerihia colli. Контрольный препарат – бензилпенициллин.
Выявлено, что 2-гетарил-1,2,3,4-тетрагидропиридо[3',2':4,5]тиено-
________________________________________________________________
* Автор выражает глубокую признательность доц. каф. физиологии и биохимии растений КГАУ Барчуковой А.Я. и её сотрудникам за проведение испытаний синтезированных соединений на рострегулирующее действие, зав. каф. физиологии и биохимии растений КГАУ Терехову В.И. и ассистенту Сердюченко И.В. за проведение испытаний синтезированных соединений на анти-бактериальную активность.
[3,2-d]пиримидин-4-оны 2.21а-в,д,е и 3-пирролил-2-гетарилтиено[2,3-b]-пиридины 2.33а,г обладают подавляющим действием в отношении культуры Echerihia colli. Наибольшую антибактериальную активность проявляют 2-гетарил-1,2,3,4-тетрагидропиридо[3',2':4,5]тиено[3,2-d]пири-мидин-4-оны 22б и 22е, содержащие в качестве заместителя положении 2 пиримидинового цикла 3-нитрофенил-1H-3-пирролил и 4-(2,4,5-трихлор-фенил)-3-фурил соответственно (зона задержки роста (ЗЗР) составляет 20мм и 27 мм соответственно, контроль – 28 мм).
При проведении скрининга на культуре Staphylococcus aureus 209Р выявлено, что антибактериальной активностью обладают: 3-амино-3,4-дигидропиридотиенопиримидинон 10д (ЗЗР 12мм), 3-алкил-3,4-дигидро-пиридотиенопиримидиноны 17м,р,с,ч,щ (ЗЗР 13-24мм), 2-гетарил-1,2,3,4-тетрагидропиридотиенопиримидин-4-оны 22а-в,д,е,(ЗЗР 12-30 мм), 3-ами-но-2-гетарил-тиенопиридины 30а-в,ж (ЗЗР 10-21). Контроль – 26 мм.
Для пиридотиенопиримидинонов 17м,р,с,ч,щ, обладающих высокой растворимостью в смеси вода-диметилсульфоксид, методом серийных разведений установлена минимальная подавляющая концентрация. Наилучшие результаты показали соединения 2.17м (МПК – 31,25 мкг/мл) и 2.17с (МПК – 62,5 мкг/мл).
Выводы
- Проведено систематическое исследование химических свойств 3-ами-но(алкил)-3,4-дигидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-онов в реакциях в электрофильными реагентами: альдегидами, 2,5-диметокси-тетрагидрофураном, уксусным ангидридом и формамидом. Найдено, что взаимодействие 3-амино-3,4-дигидропиридотиенопиримидинонов с формамидом протекает неоднозначно: образуются пиридотиенотри-азолопиримидины или незамещенные в положении 3 пиридотиено-пиримидиноны.
- На основе исследования взаимодействия 3-амино-3,4-дигидропиридо-[3',2':4,5]тиено[3,2-d]пиримидин-4-онов с никелем Ренея разработаны методы синтеза 3,4-дигидропиридо[3',2':4,5]тиено[3,2-d]-пиримидин-4-онов и 4-(3-пиридил)-1,6-дигидро-6-пиримидинонов.
- Впервые изучена реакция 3-аминотиено[2,3-b]пиридин-2-карбоксамида с о-ФБК в присутствии катализатора п-толуолсульфокислоты. Установлено, что в толуоле о-ФБК первоначально реагирует как ароматический альдегид, образуя тетрагидропиримидиновый цикл, а затем протекает реакция гетероциклизации, приводящая к новой гетероциклической системе – 6,8,12b,13-тетрагидропиридо[3'',2'':4',5']-тиено[3',2':4,5]пиримидо[2,1-a]изоиндол-6,8-диону.
- Показано, что в отличие от о-ФБК 3-формил-1H-2индолкарбоновые кислоты реагируют с 3-аминотиено[2,3-b]пиридин-2-карбоксамидом только по альдегидной группе с образованием 3-(4-оксо-1,2,3,4-тетра-гидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-2-ил)-1H-2-индолкарбо-новых кислот.
- Найдена и изучена новая реакция образования 2-пиридо[3'',2'':4',5']-тиено[3',2':4,5]пиримидо[1,6-a]бензимидазоло-6-илбензойных кислот при взаимодействии (1Н-бензимидазол-2-ил)тиено[2,3-b]-пиридин-3-аминов с о-формилбензойными кислотами в уксусной кислоте. Уста-новлено, что замыкание частично гидрированного пиримидинового цикла сопровождается окислением связи С-N.
- Установлено, что деградация изоксазольного цикла 2-(3-изоксазолил)-тиено[2,3-b]пиридин-3-амина при взаимодействии с никеля Ренея проходит быстрее, чем тиофенового. На основе данной реакции выполнен синтез 4-аминотиено[2,3-b;4,5-b]дипиридина и 5-(4-амино-пиридин-2-ил)пиридина.
- Обнаружено, что действие никеля Ренея в этаноле на 5-[3-(1-пирро-лил)тиено[2,3-b]пиридин-2-ил]-2,3-дигидро-1,3,4-оксадиазол-2-тион сопровождается восстановительной десульфуризацией и расщеплением оксадиазольного цикла, в результате чего получен 3-(3-пиридил)-3-(1-пирролил)пропанамид.
- Среди синтезированных веществ выявлены соединения, обладающие рострегулирующей и антибактериальной активностью.
Основное содержание диссертации изложено в следующих работах:
- Костенко Е.С. Синтез и реакционная способность 3-амино-7-метил-9-метоксиметил-3,4-дигидропиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-онов / Костенко Е.С., Липунов М.М., Кайгородова Е.А., Конюш-
кин Л.Д. // Химия гетероциклических соединений. – 2007. – № 11. –
С. 1720-1732. - Костенко Е.С., Кайгородова Е.А., Конюшкин Л.Д. Взаимодействие
2-(3-изоксазолил)-6-метил-4-метоксиметилтиено[2,3-b]пиридин-3-амина с никелем Ренея // Известия Академии наук. Серия химическая. – 2008. – № 3. – С. 669-670. - Костенко Е.С. Синтез и антибактериальная активность 3,4-дигидро-пиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-онов / Костенко Е.С., Сер-дюченко И. В., Терехов В.И., Кайгородова Е.А. // Профилактика и лечение болезней животных: Сб. научн. трудов Кубан. гос. аграр. ун-т. Краснодар. - 2007. С. 111-118.
- Костенко Е.С., Кайгородова Е.А., Крапивин Г.Д. 2-Изобутил-4-(4-ме-токсиметил-6-метил-3-пиридил)-1,6-дигидро-6-пиримидинон // Труды Третьей Международной конференции «Химия и биологическая активность азотсодержащие гетероциклов» (том 2). Черноголовка. – 2006. С. 354.
- Костенко Е.С. Синтез и антибактериальная активность пиридотиено-пиримидинов / Костенко Е.С., Кайгородова Е.А., Сердюченко И. В., Терехов В.И. // Научное обеспечение агропромышленного комплекса: материалы 8-й регион. науч.-практ. конф. молод. ученых. – Краснодар: КубГАУ. – 2006. С. 85-86.
- Kostenko E.S. Synthesis and reactions of 3-amino-2-hetarylthieno[2,3-b]-pyridines / Kostenko E.S., Fin’ko A.V., Dolya O.A., Kaigorodova Ye.A. // 4th Eurasian meeting on heterocyclic chemistry. Thessaloniki, Greece. August 27-31, 2006. – P. 222-223.
- Костенко Е.С. 3-Амино-2-гетарилтиено[2,3-b]пиридины: синтез и пре-вращения / Костенко Е.С., Финько А.В., Доля О.А., Кайгородова Е.А. // Сб. трудов Всероссийской конференции «Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых», Астрахань, АГУ. – 2006. – С. 85-89.
- Костенко Е.С., Кайгородова Е.А., Крапивин Г.Д. Синтез 4-(3-пиридил)-1,6-дигидро-6-пиримидинонов // Труды Третьей Между-народной конференции «Химия и биологическая активность азот-содержащие гетероциклов» (том 2). Черноголовка. – 2006. С. 149-150.
- Костенко Е.С., Финько А.В. Синтез и реакции 3-амино-3,4-дигидро-пиридо[3',2':4,5]тиено[3,2-d]пиримидин-4-онов // Всероссийская науч-но-техническая конференция «Коршуновские чтения». Тез. докл., Тольятти. – 2005. – С. 47.

