Физико – химический анализ систем с наличием окислительно - восстановительных процессов
На правах рукописи
КАСТЕРИНА Татьяна Витальевна
ФИЗИКО – ХИМИЧЕСКИЙ АНАЛИЗ
СИСТЕМ С НАЛИЧИЕМ
ОКИСЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ
02.00.04 – физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Саратов - 2008
Работа выполнена в Самарском государственном техническом университете.
Научный руководитель: доктор химических наук, профессор,
Трунин Александр Сергеевич
Официальные оппоненты: доктор физико-математических наук,
профессор Кленин Виталий Иосифович
кандидат химических наук
Герасимова Галина Викторовна
Ведущая организация: Московский государственный университет им. М.В.Ломоносова
Защита состоится «24» апреля 2008 года в 1400 часов на заседании диссертационного совета Д 212.243.07 по химическим наукам при Саратовском государственном университете им. Чернышевского по адресу: 410012, г. Саратов, ул. Астраханская, 83, 1 корпус, химический факультет.
С диссертацией можно ознакомиться в библиотеке Саратовского государственного университета им. Чернышевского по адресу: 410012, г. Саратов, ул. Астраханская, 83.
Автореферат разослан «21» марта 2008 г.
Ученый секретарь
диссертационного совета В. В. Сорокин
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Физико-химический анализ является наиболее общим методом исследования превращения веществ и широко применяется в химии и химической технологии. Физико-химический анализ многокомпонентных систем рассматривается как основа современного материаловедения, в том числе активно развивающихся в последнее время нанотехнологий.
До настоящего времени физико-химический анализ исследовал обменные реакции, реакции соединения, а одним из распространенных реакций, окислительно-восстановительным (ОВР), при изучении фазовых диаграмм внимание практически не уделялось. Так, в доступной нам литературе отсутствуют диаграммы, на которых представлены области протекания окислительно-восстановительных реакций и способы их изображения. В тоже время разработка энергонасыщенных композиций с использованием окислительно-восстановительных реакций (ОВР) является перспективным направлением современной физической химии. Окислители и восстановители, взаимодействуя между собой, могут выделять значительное количество энергии, которую можно превратить в механическую работу. Компоненты ОВР могут вступать в реакцию, как в присутствии воздуха, так и без него. Такие композиции могут применяться как в различных средах, так и разнообразных отраслях промышленности, в том числе и военных. Таким образом, развитие топологии фазовых диаграмм с участием окислительно-восстановительных реакций является важным для решения ряда теоретических и прикладных задач, связанных с разработкой энергонасыщенных композиций.
Автор работы выражает глубокую благодарность научному руководителю д.х.н., проф. Трунину Александру Сергеевичу, коллективу лаборатории физико-химического анализа многокомпонентных систем СамГТУ, к.х.н. Моргуновой Ольге Евгеньевне, с.н.с. Макарову Андрею Фадеевичу (Вост НИИ г. Кемерово), к.х.н. Юлиной Ирине Викторовне за помощь, полезные дискуссии и советы при подготовке настоящей работы.
Цель работы. Получение физико-химических характеристик систем с наличием окислительно-восстановительных процессов для разработки неуглеводородных энергонасыщенных композиций.
Задачи исследований:
- Проанализировать современное состояние проблемы поиска альтернативных источников энергии.
- Обосновать выбор ингредиентов и формирование двух-, трех-, четырехкомпонентных систем для разработки энергонасыщенных композиций.
- Установить характеристики эвтоник двухкомпонентных систем: CO(NH2)2 * НNO3 – H2O, NH4СlO4 – H2O, NaСlO4 – H2O, NH4NO3 – NaСlO4, NH4NO3 – NH4СlO4.
- Построить политермы кристаллизации трехкомпонентных систем с использованием современных методов и аппаратуры ФХА.
- Моделирование и экспериментальное подтверждение характеристик эвтоник четырехкомпонентных систем: NH4NO3 – NH4СlO4 – CO(NH2)2 – H2O, NH4NO3 – NaСlO4 – CO(NH2)2 – H2O, NH4NO3 – CO(NH2)2 – С2Н5NО – H2O.
Методы исследования
Для решения поставленных задач использовался комплекс аналитических (математическое и компьютерное моделирование) и экспериментальных методов физико-химического анализа: визуально - политермический метод (ВПА), дифференциальный термический анализ (ДТА).
Научная новизна:
- Показано наличие окислительно-восстановительных процессов в двухкомпонентных системах: CO(NH2)2 *НNO3 – H2O, NH4СlO4 – H2O, NaСlO4 – H2O, NH4NO3 – NaСlO4, NH4NO3 – NH4СlO4.
- Построены политермы кристаллизации трехкомпонентных систем: NH4NO3 – NH4СlO4 – H2O, NaСlO4– CO(NH2)2 – H2O, NH4СlO4 – CO(NH2)2 – H2O, CO(NH2)2 *НNO3 – С2Н5NО – H2O, NH4NO3 – С6Н12N4 – H2O.
- На фазовых диаграммах трехкомпонентных систем выделены области и температура начала окислительно-восстановительных реакций.
- Рассчитаны и экспериментально подтверждены характеристики эвтоник четырехкомпонентных систем: NH4NO3 – NH4СlO4 – CO(NH2)2 – H2O, NH4NO3 – NaСlO4 – CO(NH2)2 – H2O, NH4NO3 – CO(NH2)2 – С2Н5NО – H2O.
Практическая ценность работы. Результаты диссертационного исследования предложены для разработки энергоемких композиций, в том числе позволяющих снижать расход дефицитного углеводородного сырья.
На защиту автор выносит. Полученные диаграммы состояния двух-, трех-, четырехкомпонентных эвтонических систем, в том числе с наличием окислительно-восстановительных процессов между компонентами.
Апробация работы и публикации. Основные результаты работы докладывались и обсуждались на: 5-ой Международной конференции молодых учёных «Актуальные проблемы современной науки» (Самара, 2004); 1-3 Международных форумах (6 - 8 Международных конференциях молодых учёных) «Актуальные проблемы современной науки» (Самара, 2005 – 2007); Международной научной конференции «Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых» (Астрахань, 2006); Международной научной конференции «Актуальные проблемы науки и образования» (Москва, 2006). По материалам диссертации опубликовано 15 статей, в том числе в изданиях, рекомендованных ВАКом.
Личный вклад соискателя заключается в постановке и решении основных задач исследования, проведении эксперимента, обработке, интерпретации полученных результатов, подготовке и написании статей.
Структура и объём работы. Диссертационная работа состоит из введения, трёх глав, выводов, списка литературы (144 наименования). Общий объем работы составляет 150 страниц, содержит 30 таблиц и 67 рисунков.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность работы, сформулирована цель, определены задачи исследования, научная новизна и практическая ценность исследований.
В первой главе приводится обзор литературы по проблемам современной энергетики. С каждым годом уровень потребляемой энергии заметно растет, в то время как запасы органического топлива сокращаются. Производство и использование энергии всегда сопровождалось рассмотрением экологических проблем. Огромные выбросы продуктов сгорания отрицательно влияют на биосферу в целом.
Настоящая работа посвящена исследованию физико-химических систем с наличием окислительно-восстановительных процессов. Приводится обоснование и анализ выбора компонентов данных систем.
В отличие от привычных представлений о "топливе", в качестве которого до сих пор рассматривались лишь горючие органические вещества минерального, синтетического или биологического происхождения, предложены смеси на основе недефицитных синтетических продуктов, молекулярный состав которых основан на сочетаниях (Н,N,О)-атомов.
Новым видом предлагаемых энергоносителей, в частности, являются растворы неагрессивных азотных соединений, реализуемых по принципу совместного присутствия окислителей, горючих веществ и воды: "окислитель + горючее + вода". В качестве окислителей топливных систем были исследованы нитраты и перхлораты натрия и аммония, а в качестве сорастворимых горючих – некоторые амины невзрывчатой природы, богатые химически связанным водородом. Общим растворителем водо-нитратных топливных смесей является вода, что в обычных условиях исключает горючесть и неспособность к взрыву энергонасыщенных смесей (в отсутствии добавок взрывчатых соединений). Выбранные ингредиенты топливных систем характеризуются возобновляемой сырьевой базой при высоком уровне эксплуатационной безопасности образуемых энергонасыщенных композиций; с резко выраженным эффектом снижения температур плавления образуемых эвтектик, а в присутствии воды – весьма морозостойких эвтоник. Окислительно-восстановительные реакции предлагаемых топливных композиций выше некоторой температуры разложения характеризуются высоким тепловым эффектом, достаточным для испарения всей присутствующей воды-растворителя – с образованием перегретой парогазовой фазы, что необходимо для совершения полезной механической работы при расширении газовых продуктов. Многообразие возможных сочетаний топливных компонентов позволило сформировать ряд перспективных энергонасыщенных композиций (систем), состоящих из двух-, трёх- и четырёх компонентов.
Таким образом, наибольший интерес представляют водосодержащие эвтектические системы недефицитных окислителей и горючих веществ, богатых химически связанным водородом.
Исследование систем является трудоемким процессом, поэтому оно проводилось на основе общего алгоритма оптимизации исследования многокомпонентных систем. Он предполагает наличие трёх информационных уровней (табл. 1) и их реализацию с целью минимизации трудозатрат на исследование систем.
Таблица 1
Общий алгоритм комплексной методологии исследования
многокомпонентных систем
| Уровень | Содержание уровня |
| Постановка задачи исследования | |
| 0. | Нулевой информационный уровень – база данных |
| 0.1. | Формирование и моделирование физико-химической системы |
| 0.2. | Обзор литературы по состоянию изученности системы |
| 0.3. | Кодирование информации на модели системы |
| 1.0. | Первый информационный уровень - качественное описание системы |
| 1.1. | Дифференциация системы на фазовые единичные блоки; формирование древа фаз |
| 1.2. | Формирование древа кристаллизации |
| 1.3. | Описание химического взаимодействия в системе |
| 2.0. | Второй информационный уровень - количественное описание системы |
| 2.1. | Определение характеристик нонвариантных равновесий |
| 2.2. | Определение характеристик моновариантных равновесий |
| 2.3. | Определение характеристик поливариантных равновесий |
Постановка задачи исследования определяется тем реализуемым высшим информационным уровнем и его этапом, который отвечает конечной цели исследования. Из содержания каждого уровня вытекает задача построения алгоритмов использования и получения информации при минимальном ее избытке. Однако, несмотря на совершенствование экспериментальных методов и использование ПК, эксперимент остается самым трудоемким и длительным этапом исследования фазовых диаграмм.
Во второй главе приводится описание методов исследования, использованных в данной работе. Описаны методы моделирования эвтектик, а также инструментальное обеспечение. Отражены основы визуально - политермического анализа, дифференциального термического анализа.
Третья глава посвящена экспериментальным исследованиям. Приведены исходные вещества с указанием основных термодинамических свойств, которые в свою очередь являются основой для формирования двух-, трёх- и более сложных систем. Данные соединения используются для разработки различных составов энергоемких композиций. Квалификация исходных веществ, используемых в исследованиях “о.с.ч.” и “х.ч.”.
Были рассчитаны термохимические эффекты основных окислителей, которые использовались в работе. Наиболее эффективные (мощные) окислители – те, которые имеют максимальное содержание активного кислорода при минимальных теплозатратах на разложение единицы массы. При разложении аммиачных солей-окислителей теплота выделяется, а при разложении нитратов металлов (натриевой селитры) – поглощается. Таким образом, перхлораты являются более сильными окислителями (табл. 2).
Таблица 2
Термохимические эффекты окислителей
| Вещество | КБ (содержание активного кислорода) | Теплота разложения чистого окислителя, Дж/г | Тепловой эффект выделения 1 г О2, кДж/г |
| NH4NO3 | 20 | +1481 | +7,4 |
| NH4ClO4 | 34 | +1457 | +4,29 |
| NaNO3 | 47 | -3031 | -6,44 |
| NaClO4 | 52,3 | +222,3 | +0,43 |
Исследован ряд двухкомпонентных систем с ингредиентами энергонасыщенных композиций. Анализ имеющихся справочных данных показал, что ряд систем ранее был исследован в узком диапазоне концентраций. В связи с этим были исследованы полные диаграммы состояния систем NH4СlO4 – H2O, NaСlO4 – H2O, определены составы и температуры двухкомпонентных эвтоник.
Впервые изучены двухкомпонентные системы: С2Н5NО – H2O, CO(NH2)2 *НNO3 – H2O, NH4NO3 – NaСlO4, NH4NO3 – NH4СlO4. Характеристики нонвариантных точек исследованных двухкомпонентных систем представлены в табл. 3.
При рассмотрении вышеприведенных систем было установлено наличие окислительно-восстановительных процессов между компонентами. В ходе исследований было установлено, что при концентрации CO(NH2)2*НNO3 в системе CO(NH2)2 *НNO3 – H2O, начиная с 70 % масс., наблюдается «пенообразование». Это свидетельствует о протекании окислительно - восстановительной реакции. Области ОВР выявлены также в системе NaСlO4 – H2O, начиная с 83 % NаClO4 (масс.), и в системе NH4СlO4– H2O, начиная с 70 % NH4СlO4 (масс.).
В результате проведенных исследований было установлено, что перхлораты образуют эвтектики при содержании около 10 % масс. перхлоратов: для системы NH4NO3 – NаСlO4 при 129 0С, а для системы NH4NO3 – NH4СlO4 при 146 0С.
Таблица 3
Характеристики эвтектик и эвтоник двухкомпонентных систем
| Система | Характер точек | Состав | Температура | |||||
| масс. % | мол. % | |||||||
| А | В | А | В | А | В | °С | оК | |
| NH4NO3 | NaClO4 | е | 90 | 10 | 93,2 | 6,7 | 129 | 402 |
| NH4NO3 | NH4ClO4 | е | 90 | 10 | 92,9 | 7,041 | 146 | 419 |
| CO(NH2)2 *HNO3 | H2O | е | 10 | 90 | 1,6 | 98,4 | -4,5 | 268,5 |
| C2H5NO | H2O | е | 48 | 52 | 21,97 | 78,03 | -36,2 | 236,8 |
| NaClO4 | H2O | е | 57,5 | 42,5 | 16,6 | 83,4 | -31,4 | 241,6 |
| NH4ClO4 | H2O | е | 11 | 89 | 1,86 | 98,14 | -3,2 | 269,8 |
Сплавы NH4NO3 с перхлоратами интенсивно разлагаются выше 180 0С с газообразованием (выделением продуктов реакции). Для системы NH4NO3 - NH4ClO4 ОВР наблюдается при содержании NH4ClO4 более 20 % масс., для системы NH4NO3 - NaClO4 ОВР - при содержании NаClO4 более 30 % масс.
Данный эффект связан с окислительно-восстановительной реакциями между компонентами:
NH4NO3 + 2NH4ClO4 = 2N2 + 2HCl + 5H2O + 3O2
NH4NO3 + 2NaClO4 = N2 + 2NaCl + 2H2O + 4,5O2
Возможен также термолиз перхлората аммония, который заметно возгоняется и разлагается выше 150 0С по схеме:
4NH4ClO4 = 2Cl2 + 2N2O + 3NO2 + 8H2O
Для систем NH4ClO4 - CO(NH2)2 и NaClO4 - CO(NH2)2 экспериментально определены составы и температуры двойных эвтектик, соответственно: 50 % масс. NH4ClO4 при 55 0С и 37,5 % масс. NaClO4 при 60 0С.
Протекание ОВР наблюдается при содержании более 80 % масс. NH4ClO4 для системы NH4ClO4 - CO(NH2)2, и более 80% масс. NaClO4 для системы NаClO4 - CO(NH2)2.
Модели химических реакции в рассматриваемых системах:
5CO(NH2)2 + 6NH4ClO4 = 8N2 + 6HCl + 19H2O + 5CO2
4CO(NH2)2 + 3NaClO4 = 4N2 + 3NaCl + 8H2O + 4CO2
Таким образом, было установлено, что перхлораты натрия и аммония образуют легкоплавкие эвтектики с карбамидом и аммселитрой. Добавки перхлоратов к нитратным окислителям могут повышать энергоёмкость и легкоплавкость синтезируемых систем.
Наличие окислительно-восстановительных реакций выявлено в системах: NH4NO3 - C6H12N4, CO(NH2)2*HNO3 - C2H5NO. В системе NH4NO3 - C6H12N4 эвтектика содержит 20 % масс. C6H12N4 при 122 0С; а для системы CO(NH2)2*HNO3 - C2H5NO 70 % масс. C2H5NO при 42 0С.
Для системы NH4NO3 - C6H12N4 эффект ОВР наблюдается при содержании C6H12N4 более 30 % (масс.), для системы CO(NH2)2*HNO3 - C2H5NO - при содержании CO(NH2)2*HNO3 более 70 % (масс.).
С помощью методов математического моделирования были смоделированы и экспериментально подтверждены характеристики эвтоник ряда трехкомпонентных систем: NH4NO3 – NH4СlO4 – H2O, NaСlO4– CO(NH2)2 – H2O, NH4СlO4 – CO(NH2)2 – H2O, CO(NH2)2*НNO3 – С2Н5NО – H2O, NH4NO3 – С6Н12N4 – H2O (табл. 4).
Таблица 4
Характеристики эвтоник трехкомпонентных систем
| Система | Состав, % мас. | Температура | |||||
| А | В | С | А | В | С | оС | К |
| NH4NO3 | NH4СlO4 | Н2О | 39,41 | 6,29 | 54,31 | -18 | 255 |
| NaСlO4 | CO(NH2)2 | Н2О | 48,13 | 16,32 | 35,56 | -41,7 | 231,3 |
| NH4СlO4 | CO(NH2)2 | Н2О | 4,41 | 30,08 | 65,5 | -11,6 | 261,4 |
| CO(NH2)2 *НNO3 | С2Н5NО | Н2О | 6,87 | 44,73 | 48,4 | -37,3 | 235,7 |
| NH4NO3 | С6Н12N4 | Н2О | 39,86 | 9,49 | 50,65 | -18 | 255 |
В ходе исследований было установлена особенность этого ряда систем: наличие процессов с выделением газов («пенообразованием»). Это явление при построении диаграмм установлено впервые и в доступной нам литературе по физико-химическому анализу ранее не обсуждалось.
Эксперимент показал наличие эвтектического участка кривой ликвидуса прежде, чем начинается ОВР с выделением газов. К данному ряду соединений относятся системы с сильными окислителями или нестойкими соединениями, такими как, например, перхлораты аммония и натрия, нитрат карбамида, уротропин и др.
Был проведен ряд экспериментов, заключающихся в дополнительном исследовании серии разрезов трехкомпонентных систем.
Совокупностью аналитических, проекционных и экспериментальных методов построены полные поверхности кристаллизации систем с нанесением изотерм. Определены области температурной и концентрационной кривых ОВР. Это дало наглядное представление о поведении системы в целом, что свидетельствует о большом вкладе в изучение данных систем по физико-химическим показателям (рис. 1-5).
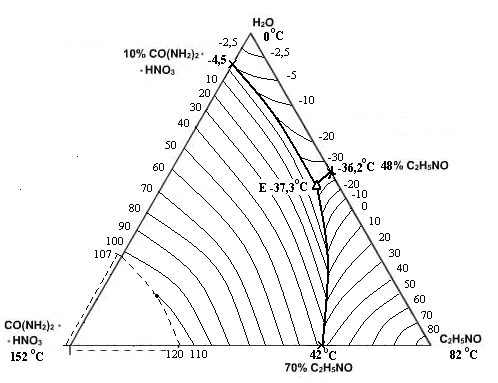
Рис. 1. Политерма кристаллизации системы CO(NH2)2 *НNO3 – С2Н5NО – H2O
с расположением моновариантных кривых совместной кристаллизации
(масс. %, t0С)
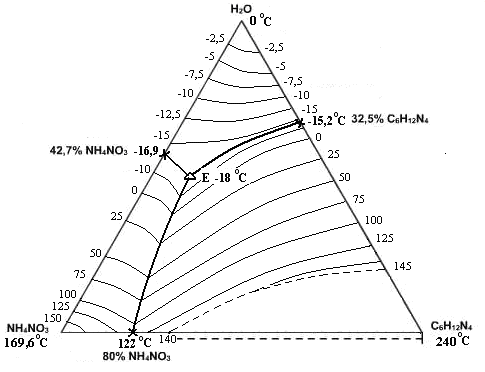
Рис. 2. Политерма кристаллизации системы NH4NO3 – С6Н12N4 – H2O
с расположением моновариантных кривых совместной кристаллизации
(масс. %, t0С)
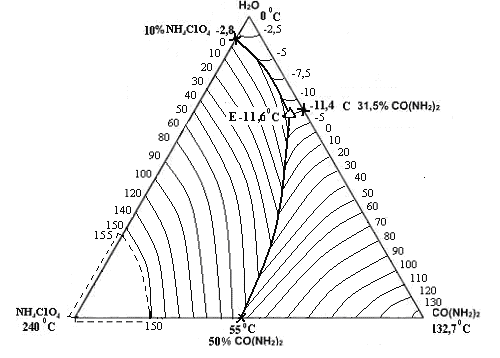
Рис. 3. Политерма кристаллизации системы NH4СlO4– CO(NH2)2 – H2O
с расположением моновариантных кривых совместной кристаллизации
(масс. %, t0С)
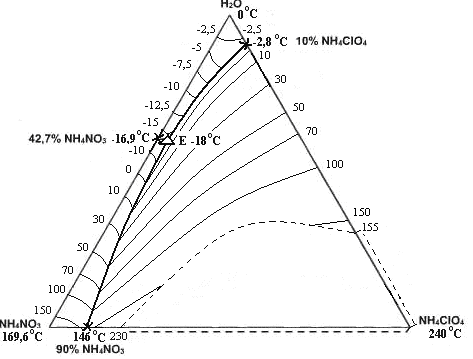
Рис. 4. Политерма кристаллизации системы NH4NO3 –NH4СlO4– H2O
с расположением моновариантных кривых совместной кристаллизации
(масс. %, t0С)
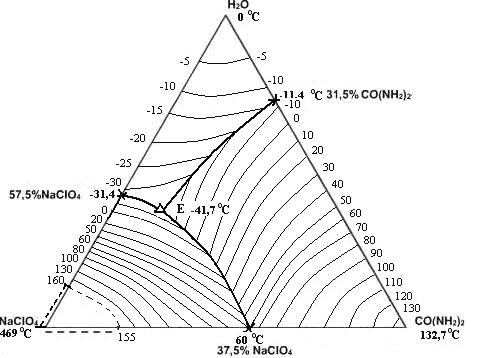
Рис. 5. Политерма кристаллизации системы NaСlO4– CO(NH2)2 – H2O
с расположением моновариантных кривых совместной кристаллизации
(масс. %, t0С)
Для исследованных систем были рассчитаны тепловые эффекты химических реакций на 1 г безводных смесей, где вода - пар. Отрицательные значения энтальпии указывают на экзотермичность реакций.
5CO(NH2)2 + 6NH4ClO4 8N2 + 6HCl + 19H2O + 5CO2
Н = -3,77 кДж/г
4CO(NH2)2 + 3NaClO4 4N2 + 3NaCl + 8H2O + 4CO2
Н = -3,76 кДж/г
13NH4NO3 + NH4ClO4 13,5N2 + HCl + 7,5O2 + 27,5H2O
Н = -1,51 кДж/г
7NH4NO3 + C6H12N4 + 11/2{4N2 + O2} 31N2+ 20H2O + 6CO2
Н = -6,51 кДж/г
CO(NH2)2*HNO3 + 6C2H5NO + 16,75{4N2 + O2} 38N2+ 17,5H2O +
+ 13CO2
Н = -14 кДж/г
Впервые рассчитаны и экспериментально подтверждены характеристики четырехкомпонентных систем: NH4NO3 – NH4СlO4 – CO(NH2)2 – H2O, NH4NO3 – NaСlO4 – CO(NH2)2 – H2O, NH4NO3 – CO(NH2)2 – С2Н5NО – H2O.
Понижение температуры эвтоники при добавлении четвертого компонента важно для технологических целей, например, для получения составов, характеризующихся пониженной температурой замерзания. При этом существенно расширяются низкотемпературные области кристаллизации составов, что является важным эксплуатационным показателем.
В табл. 4. представлены данные по составам и температурам эвтоник исследованных четырёхкомпонентных систем.
Таблица 4
Характеристики эвтоник четырёхкомпонентных систем
| Состав компонентов, % мас. | Температура эвтоники | ||||||
| NH4NO3 | NH4СlO4 | CO(NH2)2 | NaСlO4 | С2Н5NО | H2O | Т, К | t, 0C |
| 27,77 | 5,05 | 21,04 | - | - | 46,14 | 244 | -29 |
| 17,91 | - | 13,73 | 38,12 | - | 30,24 | 230 | -43 |
| 23,44 | - | 8,17 | - | 32,85 | 35,54 | 199 | -73 |
На рисунке 6 представлена модель системы NH4NO3 - С2Н5NО - CO(NH2)2 - H2O с нанесенной эвтонической точкой и объемами кристаллизации компонентов.

Рис. 6. Модель четырёхкомпонентной системы
NH4NO3 - С2Н5NО - CO(NH2)2 - H2O
Полученные данные по четырёхкомпонентным системам являются важными физико-химическими характеристиками композиций, применяемых для разработки энергонасыщенных композиций.
Проведенный цикл исследований позволяет сделать следующие выводы.
Выводы:
- Анализ современного состояния проблемы поиска альтернативных источников энергии показал, что одним из перспективных видов энергоносителей являются растворы окислительсодержащих азотноводородных соединений. Выбранные ингредиенты характеризуются недефицитностью, заметной реакционной способностью, минимальным содержанием углерода, при достаточно высоких значениях энтальпий окислительно-восстановительных реакций и уровне газообразования жидких смесей.
- В двухкомпонентных системах: CO(NH2)2 *НNO3 – H2O, NH4NO3 – NaСlO4, NH4NO3 – NH4СlO4 экспериментально установлено наличие эвтектик и впервые обозначены области окислительно-восстановительных реакций на диаграмме состояния.
- В трехкомпонентных системах: NH4NO3 – NH4СlO4 – H2O, NaСlO4 – CO(NH2)2 – H2O, NH4СlO4 – CO(NH2)2 – H2O, CO(NH2)2 *НNO3 – С2Н5NО – H2O, NH4NO3 – С6Н12N4 – H2O построены политермы кристаллизации фазовых диаграмм с выделением поля окислительно-восстановительных реакций. Показано, что реакции протекают при температуре ниже температуры плавления чистого окислителя, что важно для разработки альтернативных энергоносителей
- Полученные характеристики эвтоник четырехкомпонентных систем: NH4NO3 – NH4СlO4 – CO(NH2)2 – H2O, NH4NO3 – NaСlO4 – CO(NH2)2 – H2O, NH4NO3 – CO(NH2)2 – СН3СОNН2 – H2O существенно расширяют низкотемпературные области кристаллизации составов, что является важным эксплуатационным показателем в условиях их возможного применения.
- Результаты диссертационного исследования показывают принципиальную возможность осуществления окислительно-восстановительных реакций между реагентами типа "окислитель + горючее" в фазе совместных водных растворов, что, с учётом тепловыделения и образования газовых продуктов, может быть использовано в некоторых областях науки и техники.
Основное содержание диссертации опубликовано:
- Трунин А.С., Кастерина Т.В., Юлина И.В. Исследование водонитратных систем как компонентов альтернативных энергоносителей // Вестник АГТУ. № 6. 2006. - С. 143-149.
- Трунин А.С., Кастерина Т.В., Бодня М.С. Физико-химический анализ систем как компонентов неуглеводородных энергонасыщенных композиций // «Известия Вузов. Химия и химическая технология». № 5. 2008. С. 33-38.
- Трунин А.С., Юлина И.В., Макаров А.Ф., Кастерина Т.В., Зипаев Д.В. Исследование физико-химических систем с ингредиентами альтернативных энергоносителей // Аспирантский вестник Поволжья. №1(11). 2006. С. 66-70.
- Трунин А.С., Кастерина Т.В. Исследование многокомпонентных систем, как составляющих альтернативных топлив // Современные проблемы науки и образования. № 3. 2006. С.108-110.
- Трунин А.С., Кастерина Т.В. Исследование водносолевых систем, как составляющих альтернативных топлив. Материалы междунар. научной конференции «Фундаментальные и прикладные проблемы современной химии». АГУ. Астрахань, 2006. С. 156-158.
- Трунин А.С., Кастерина Т.В., Юлина И.В. Исследование системы перхлорат натрия – вода как составляющей альтернативных топлив // Актуальные проблемы современной науки: Тр. 6-й Междунар. конф. молодых ученых. - Ч.19. Альтернативные энергоносители на возобновляемых ресурсах. Самара, 2005. С.70-73.
- Трунин А.С., Кастерина Т.В., Юлина И.В. Исследование системы перхлорат аммония – вода как составляющей альтернативных топлив // Актуальные проблемы современной науки: Тр. 6-й Междунар. конф. молодых ученых. - Ч.19. Альтернативные энергоносители на возобновляемых ресурсах. Самара, 2005. С.50-54.
- Трунин А.С., Юлина И.В., Кастерина Т.В. Исследование системы нитрат карбамида - вода как составляющей альтернативных топлив // Актуальные проблемы современной науки: Тр. 6-й Междунар. конф. молодых ученых. - Ч.19. Альтернативные энергоносители на возобновляемых ресурсах. Самара, 2005. С. 54-57.
- Трунин А.С., Юлина И.В., Кастерина Т.В. Исследование двухкомпонентной системы ацетамид – вода // Актуальные проблемы современной науки: Тр. 6-й Междунар. конф. молодых ученых. - Ч.19. Альтернативные энергоносители на возобновляемых ресурсах. Самара, 2005. С.57-60.
- Трунин А.С., Кастерина Т.В., Моргунова О.Е. Политерма кристаллизации системы NH4NO3 – С6Н12N4 – H2O // Тр. 8-й Междунар. конф. молодых ученых «Актуальные проблемы современной науки». Ч.9.Физико-химический анализ. Вып. 2. Самара. 2007. 134-143.
- Трунин А.С., Юлина И.В., Кастерина Т.В., Макаров А.Ф. Исследование системы карбамид – перхлорат аммония как окислительной фазы неуглеводородных топлив // Тр. 8-й Междунар. конф. молодых ученых «Актуальные проблемы современной науки». Ч.9. Физико-химический анализ. Вып. 2. Самара. 2007. С. 56-59.
- Трунин А.С., Кастерина Т.В., Моргунова О.Е. Политерма кристаллизации системы NH4NO3 – NH4СlO4 – H2O // Тр. 8-й Междунар. конф. молодых ученых «Актуальные проблемы современной науки». Ч.9. Физико-химический анализ. Вып. 2. Самара. 2007. С. 116-125.
- Трунин А.С., Кастерина Т.В., Моргунова О.Е. Политерма растворения системы NH4СlO4 – CO(NH2)2 – H2O // Тр. 8-й Междунар. конф. молодых ученых «Актуальные проблемы современной науки». Ч.9. Физико-химический анализ. Вып. 2. Самара. 2007. С. 125-134.
- Трунин А.С., Кастерина Т.В., Моргунова О.Е. Исследование системы нитрат аммония – уротропин как окислительной фазы неуглеводородных топлив // Тр. 8-й Междунар. конф. молодых ученых «Актуальные проблемы современной науки». Ч.9. Физико-химический анализ. Вып. 2. Самара. 2007. С. 43-47.
- Трунин А.С., Моргунова О.Е., Кастерина Т.В. Политерма кристаллизации системы CO(NH2)2 *НNO3 – С2Н5NО – H2O // Тр. 8-й Междунар. конф. молодых ученых «Актуальные проблемы современной науки». Ч.9. Физико-химический анализ. Вып. 2. Самара. 2007. С. 143-153.
КАСТЕРИНА Татьяна Витальевна
ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ
СИСТЕМ С НАЛИЧИЕМ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ
02.00.04 – физическая химия
А в т о р е ф е р а т
Диссертации на соискание учёной степени
кандидата химических наук
____________________________________________________
Подписано в печать
Формат 60x84 1/16. Объем 1,25 п.л. Тираж 100 экз. Заказ №
__________________________________________________
Отпечатано в типографии

