Взаимосвязь структуры и реакционной способности имидазолидов 1 адамантанкарбоновых кислот
На правах рукописи

Склюев Прокофий Витальевич
Взаимосвязь структуры и реакционной способности имидазолидов 1адамантанкарбоновых кислот
02.00.04 – Физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Самара - 2013
Работа выполнена на кафедре органической, биоорганической и медицинской химии ФГБОУ ВПО «Самарский государственный университет»
| Научный руководитель: | доктор химических наук, профессор Пурыгин Пётр Петрович |
| Официальные оппоненты: | Ворончихина Людмила Ивановна доктор химических наук, профессор, ФГБОУ ВПО «Тверской государственный университет», заведующий кафедрой органической химии |
| Яшкин Сергей Николаевич кандидат химических наук, доцент ФГБОУ ВПО «Самарский государственный технический университет», доцент кафедры аналитической и физической химии | |
| Ведущая организация: | ФГБОУ ВПО «Саратовский государственный университет» им. Н. Г. Чернышевского |
Защита состоится «26» декабря 2013 г. в 17 час 00 мин. на заседании совета по защите докторских и кандидатских диссертаций Д 212.263.02 при ФГБОУ ВПО «Тверской государственный университет» по адресу: 170002, г. Тверь, Садовый пер., 35, ауд. 226.
С диссертацией можно ознакомиться в научной библиотеке ФГБОУ ВПО «Тверской государственный университет» по адресу: 170100, Тверь, ул. Володарского, 44 А.
Автореферат разослан «25» ноября 2013 г.
| Ученый секретарь диссертационного совета Д 212.263.02 к.х.н., доц. |  | М.А.Феофанова |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. В настоящее время проводятся исследования по поиску новых конденсирующих агентов для синтеза амидов, пептидов, олигонуклеотидов и других соединений, обладающих биологической активностью. В качестве ацилирующих агентов нашли широкое применение N-ацилазолы, обладающих высокой реакционной способностью. Среди Nацилазолов наибольший интерес представляют производные адамантанкарбоновых кислот, поскольку производные адамантана нашли практическое применение в качестве лекарственных препаратов, обладающих противовирусной, антипаркинсонической активностью.
Однако отсутствие критериев оценки реакционной способности Nацилазолов затрудняет разработку подходов к синтезу новых биологически активных веществ. В связи с этим, актуальным в настоящее время является решение вопроса о разработке квантово-химических методов подхода к решению проблемы взаимосвязи структуры и реакционной способности Nацилазолов, что позволит получать новые биологически активные соединения заданной структуры и активности.
Целью работы являлось установление взаимосвязи между структурой и реакционной способностью новых производных имидазолидов 1адамантанкарбоновых кислот с использованием квантово-химических методов.
Для достижения поставленной цели необходимо было решить следующие задачи:
1) синтез имидазолидов 1-адамантанкарбоновых кислот;
2) кинетические исследования гидролиза имидазолидов;
3) квантово-химические расчеты структур синтезированных имидазолидов 1-адамантанкарбоновых кислот и выбор критериев для оценки реакционной способности;
4) кинетические исследования устойчивости азолидов для установления зависимости реакционной способности азолидов от природы гетероцикла;
5) получение соединений, потенциально обладающих биологической активностью, с использованием имидазолидов адамантансодержащих кислот в качестве конденсирующих агентов.
Научная новизна. Впервые проведены квантово-химические расчеты геометрических характеристик и распределения заряда в молекулах имидазолидов 1адамантанкарбоновых кислот и определены критерии оценки их реакционной способности. Исследована гидролитическая устойчивость имидазолидов в нейтральной водной среде. С использованием имидазолидов 1-адамантанкарбоновых кислот впервые получены новые производные 2-аминобензотиазола, потенциально обладающие биологической активностью.
Практическая значимость.
Изучение химических свойств и реакционной способности имидазолидов 1адамантанкарбоновых кислот представляет практический интерес в связи с возможностью их использования для синтеза ряда биологически активных веществ. Полученные результаты квантово-химических расчетов позволили оптимизировать условия синтеза Nацильных производных 2аминобензотиазола.
Общая характеристика методов исследования. Экспериментальные исследования выполнены с применением ИК-, ЯМР-спектроскопии, рентгеноструктурного анализа, методов очистки веществ: перекристаллизация, перегонка (в т. ч. вакуумная, фракционная). Также был использован потенциометрический метод для кинетического изучения гидролитического распада имидазолидов 1-адамантанкарбоновых кислот.
Личный вклад автора. Экспериментальные исследования были выполнены непосредственно диссертантом, а также их обсуждение, написание литературного обзора и экспериментальной части работы.
На защиту выносятся результаты исследований по:
– разработке методов синтеза имидазолидов 1адамантанкарбоновой и 1адамантилуксусной кислот и модификации 6-замещенных 2аминобензотиазолов полученными соединениями;
– кинетике гидролиза имидазолидов 1адамантанкарбоновой и 1адамантилуксусной кислот;
– установлению взаимосвязей между структурой синтезированных соединений и их реакционной способностью в реакциях нейтрального гидролиза методами квантовой химии.
Апробация работы. Основные результаты работы представлены на Всероссийской рабочей химической конференции «Бутлеровское наследие-2011», посвященной 10-летию журнала «Бутлеровские сообщения» и году химика, III международной молодежной научно-практической конференции «Коршуновские чтения» (Тольятти, 2012), XXXVIII Самарской областной студенческой научной конференции (Самара, 2012), XIX Молодежной конференции студентов, аспирантов и молодых ученых «Ломоносов-2012» (Москва, 2012).
Публикации. По теме диссертации опубликовано 10 работ: 5 статьи в научных журналах, рекомендованных ВАК, и 5 тезисов докладов Международных и Российских конференций.
Структура и объем диссертации. Диссертационная работа состоит из введения, литературного обзора, экспериментально части, обсуждения результатов эксперимента, выводов и списка литературы. Работа изложена на 112 страницах, содержит 5 рисунков и 32 таблицы. Библиография содержит 136 наименований.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность работы, сформулированы задачи, дана общая характеристика работы, включая научную новизну и практическую значимость результатов.
Первая глава (литературный обзор) посвящена реакционной способности азолидов карбоновых кислот; способам получения азолидов и бисазолидов карбоновых и фосфорных кислот. Во второй главе приведены сведения о методах очистки исходных веществ, синтеза целевых соединений (имидазолидов 1-адамантанкарбоновых кислот, карбокс- и ацетамидов ряда 2-аминобензотиазола), методе изучения гидролитического распада имидазолидов.
Третья глава представляет собой обсуждение экспериментальных данных.
1. Синтез (1Н-имидазолил-1)(адамантил-1)метанонов и -этанонов
Нами разработан общий способ синтеза имидазолидов 1адаманкарбоновых кислот по следующей схеме:
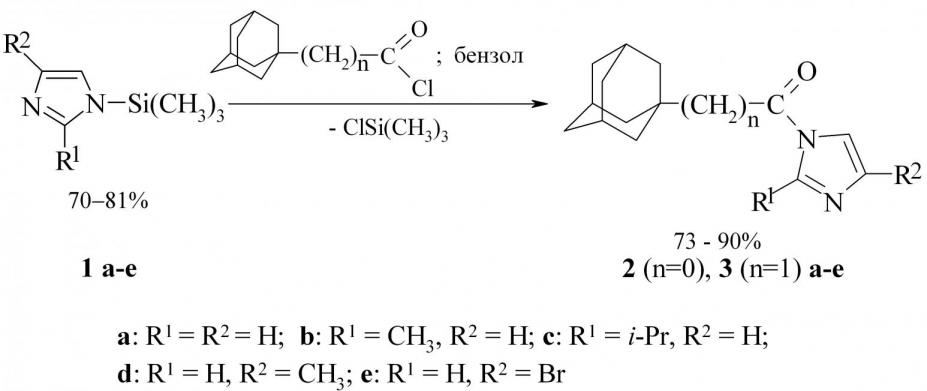
Использование N-триметилсилильных производных азолов облегчает образование имидазолидов соответствующих кислот вследствие легкости замещения триметилсилильной группы ацильным остатком хлорангидрида соответствующей кислоты. N-Триметилсилильные производные 1a-e получены при кипячении соответствующих имидазолов в гексаметилдисилазане с последующей отгонкой образующихся продуктов в вакууме.
В спектрах 1Н ЯМР 2a-e, 3a-e присутствуют три сигнала протонов адамантанового каркаса в области 1.621.75 (6H), 1.791.98 (6H) и 1.952.10 м.д. (3H), сигналы протонов имидазольного фрагмента 7.10–8.68 (2H) м.д. Для (1Нимидазолил-1)(адамантил-1)этанонов 3a-e также характерен сигнал протонов метиленовой группы 2.50–2.72 (2Н) м.д.
2. Кинетика гидролиза имидазолидов 1адамантанкарбоновых кислот
Для сравнительной оценки реакционной способности (1Н-имидазолил-1)(адамантил-1)метанонов и этанонов в реакциях нуклеофильного замещения нами было проведено исследование гидролитической устойчивости в условиях 1000-кратного избытка воды.
Исследование кинетики гидролиза имидазолидов 1адамантанкарбоновых кислот осуществляли потенциометрическим методом при температуре 25 °С и pH 7 с использованием потенциометра pH 211 (Hanna Instruments, Германия), откалиброванного по стандартным буферным растворам. Применяли комбинированный хлорсеребряный стеклянный электрод со встроенным электродом сравнения.
Для исследования использовали 2·10-3 М растворы имидазолидов в смеси ацетонитрил – вода 3 : 7 по объему при постоянном перемешивании магнитной мешалкой. Измеряли pH раствора, меняющегося во времени из-за выделения в результате гидролиза 1-адамантанкарбоновой кислоты и имидазола. pH раствора контролировали через равные промежутки времени.
Таблица 1
Константы скорости нейтрального гидролиза и времена полураспада имидазолидов 1-адамантанкарбоновых кислот
| № соединения | Краткая формула соединения | Константа скорости, с-1 | Время полураспада 1/2, мин |
| 2a | AdCOIm | 6.98·10–4 | 16.5 |
| 2c | AdCO-2-iPrIm | 3.42·10–4 | 33.8 |
| 2d | AdCO-4-MeIm | 9.27·10–4 | 12.5 |
| 3a | AdCH2COIm | 9.71·10–4 | 11.9 |
| 3b | AdCH2CO-2-MeIm | 8.70·10–3 | 13.3 |
| 3d | AdCH2CO-4-MeIm | 9.97·10–4 | 11.6 |
Из приведенной таблицы видно, что при данных условиях реакционная активность (1Н-имидазолил-1)(адамантил-1)метанонов в реакции гидролиза убывает в ряду 2d > 2a > 2с, а (1Н-имидазолил-1)(адамантил-1)этанонов – в ряду 3d > 3a > 3b.
Из всех изученных метанонов и этанонов, соединения 2с и 3b проявляют наименьшую реакционную способность в реакциях гидролиза, что можно объяснить наличием алкильного заместителя в положении 2 имидазола. Изопропильная группа в 2с создает большие стерические затруднения для атаки нуклеофилом реакционного центра, чем метильная группа в 3b. Это приводит к более резкому изменению реакционной способности соединений при переходе от 2a к 2c, чем при переходе от 3a к 3b. Исследованные (1Н-имидазолил-1)(адамантил-1)этаноны проявляют более высокую реакционную способность по сравнению с (1Н-имидазолил-1)(адамантил-1)метанонами, т. к. в них карбонильный атом углерода, который является реакционным центром, удален от объемного адамантильного фрагмента на одну CH2-группу. Близкое расположение объемного адамантанового ядра в 2a, 2c и 2d затрудняет протекание реакции нуклеофильного замещения за счет стерических препятствий.
3. Выбор расчетного квантово-химического метода для сравнительной оценки реакционной способности
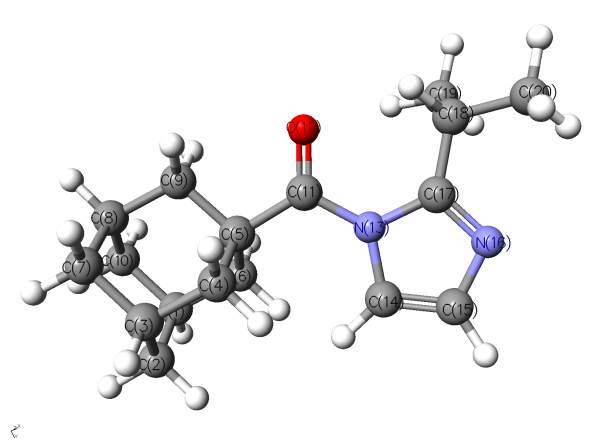
Нами были проведены квантово-химические расчеты геометрических характеристик молекулы имидазолида 1-адамантанкарбоновой кислоты 2а с различными базисными наборами в рамках теории DFT. Было показано, что полученные результаты для геометрических характеристик этой молекулы обладают хорошей сходимостью с данными рентгеноструктурного анализа (1Н-имидазолил-1)(1,2,3,4-тетрагидро-изохинолин-2-ил)кетона[1] 4а в базисном наборе 6-311G+(d,p). Наиболее важным структурным фрагментом для изучения реакционной способности имидазолидов является карбонильный атом углерода, связанный с имидазолом.
Таблица 2
Сравнение геометрических характеристик (1Н-имидазолил)(адамантил-1)метанона, полученные методом DFT в различных базисных наборах с данными РСА (1Н-имидазолил-1)(1,2,3,4-тетрагидро-изохинолин-2-ил)кетона
| С=O | C(O)-N1 | N1-C2 | C2-N3 | N3-C4 | C5-N1-C2 | C2-N3-C4 | O-C(O)-N2 | |
| Данные РСА | 1.218 | 1.431 | 1.365 | 1.308 | 1.384 | 105.99 | 104.6 | 118.7 |
| 631G | 1.217 | 1.425 | 1.394 | 1.301 | 1.387 | 105.16 | 105.2 | 116.9 |
| 631G+ | 1.217 | 1.426 | 1.395 | 1.303 | 1.388 | 105.16 | 105.2 | 116.9 |
| 631G++ | 1.219 | 1.428 | 1.396 | 1.304 | 1.388 | 105.20 | 105.4 | 116.8 |
| 6311G | 1.210 | 1.428 | 1.394 | 1.299 | 1.386 | 105.13 | 105.4 | 116.0 |
| 6311G+ | 1.218 | 1.429 | 1.392 | 1.300 | 1.386 | 105.13 | 105.6 | 117.9 |
| 6311G++ | 1.211 | 1.429 | 1.394 | 1.300 | 1.386 | 105.13 | 105.6 | 116.9 |
Из таблицы 2 видно, что выбранный нами базисный набор 6-311G+(d,p) имеет наилучшую сходимость с данными РСА для соединения 4а, приведенными в литературе.
4. Взаимосвязь между структурой имидазолидов 1адамантанкарбоновых кислот и их реакционной способностью с базисным набором B3LYP/6-311+G(d,p) в рамках теории DFT
Для сравнительной оценки реакционной способности исследуемых (1Н-имидазолил-1)(адамантил-1)метанонов и -этанонов в реакции нуклеофильной атаки нами были проведены квантово-химические расчеты геометрических характеристик молекул, а также распределения заряда в них. Оптимизацию геометрии молекул проводили с базисным набором B3LYP/6-311+G(d,p) в рамках теории DFT в пакете программ GAUSSIAN 09.
В качестве возможных дескрипторов для оценки реакционной способности (1Н-имидазолил-1)(адамантил-1)метанонов и -этанонов были рассчитаны индексы локальной электрофильности.
Таблица 3
Индексы локальной электрофильности
(1Н-имидазолил-1)(адамантил-1)метанонов и -этанонов
| Атом | 2a | 2c | 2d | 3a | 3b | 3d |
| O1 | 0.300 | 0.209 | 0.273 | 0.318 | 0.205 | 0.286 |
| C2 | 0.230 | 0.545 | 0.230 | 0.175 | 0.310 | 0.146 |
| N3 | 0.029 | 0.008 | 0.034 | 0.071 | 0.006 | 0.073 |
| C4 | 0.149 | 0.101 | 0.183 | 0.224 | 0.096 | 0.262 |
| N5 | 0.120 | 0.067 | 0.111 | 0.106 | 0.080 | 0.103 |
| C6 | 0.105 | 0.488 | 0.159 | 0.099 | 0.037 | 0.162 |
| C7 | 0.161 | 0.244 | 0.312 | 0.251 | 0.158 | 0.364 |
Анализируя полученные индексы локальной электрофильности, а также стерические препятствия, создаваемые заместителями в положении 2 или 4 гетероцикла, можно предположить следующие ряды убывания реакционной способности имидазолидов при взаимодействии с нуклеофилами атома углерода карбонильной группы:
1) для (1Н-имидазолил-1)(адамантил-1)метанонов: 2 d 2 a > 2 c
2) для (1Н-имидазолил-1)(адамантил-1)этанонов: 3 d > 3 a > 3 b
По данным таблицы 3 можно предположить, что имидазолиды 1адамантилуксусной кислоты должны быть более реакционно-способными в реакциях с нуклеофилами, чем соответствующие производные 1адамантанкарбоновой кислоты, т. к. индексы локальной электрофильности имеют меньшее значение. Данные закономерности, полученные с использованием расчетных методов, хорошо согласуются с экспериментальными данными.
Кроме того, нами рассчитан ряд физико-химических характеристик, которые могут быть критериями для оценки реакционной способности синтезированных соединений в реакциях гидролиза, а именно: полные и относительные энергии возможных конформеров, величины их дипольных моментов и торсионных углов для амидного фрагмента. Конформации для наиболее сложной структуры – (2-изопропил-1Н-имидазолил-1)(адамантил-1)метанона – приведены на рисунках 2–5.
| Цисоидные конформации на примере (2-изопропил-1Н-имидазолил-1)(адамантил-1)метанона | |
 | 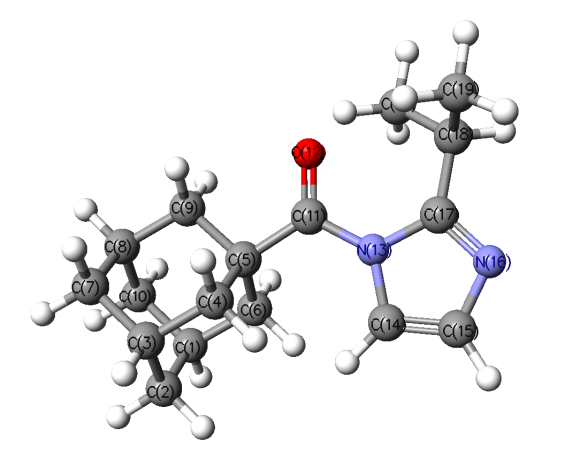 |
| Рис. 2 | Рис. 3 |
| Трансоидные конформации на примере (2-изопропил-1Н-имидазолил-1)(адамантил-1)метанона | |
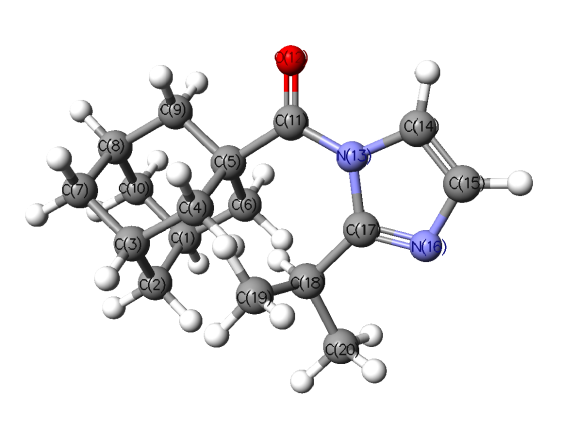 | 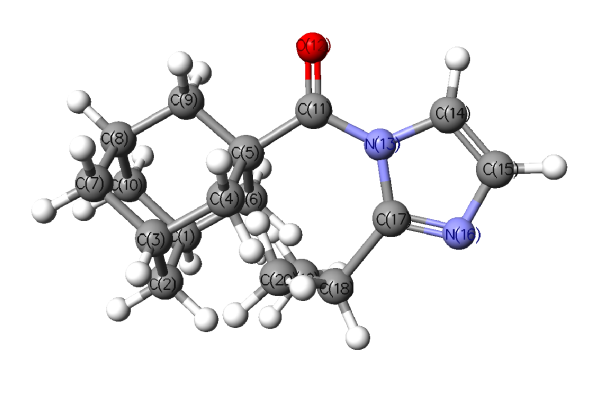 |
| Рис. 4 | Рис. 5 |
Таблица 4
Физико-химические характеристики молекул имидазолидов 1адамантанкарбоновых кислот
| Соединение (конформация молекулы) | E, а.е. Eотн, кДж/моль | Торсионные углы, град O(12)–C(11)– N(13)–C(17)* / N(13)–C(17)–C(18)–H)** | , D | Заряды на атомах по Малликену, дол. эл. | |
| AdCOIm (цисоидная) | 728.79718575 (0) | 0.5 | 4.57 | O(12) = 0.435 C(11) = 0.540 N(13) = 0.436 C(17) = 0.277 | |
| AdCOIm (трансоидная) | 728.79708535 (0.02636) | 179.5 | 2.52 | O(12) = 0.435 C(11) = 0.532 N(13) = 0.418 C(17) = 0.091 | |
| AdCO-2-iPrIm (цисоидная) Рис. 2 | 846.67835129 (0) | 2.3 / 39.5 | 3.83 | O(12) = 0.439 C(11) = 0.534 N(13) = 0.481 C(17) = 0.443 | |
| AdCO-2-iPrIm (цисоидная; iPr + 180°) Рис. 3 | 846.67788596 (0.12219) | 2.3 / 141.3 | 5.25 | O(12) = 0.337 C(11) = 0.513 N(13) = 0.484 C(17) = 0.445 | |
| AdCO-2-iPrIm (трансоидная) Рис. 4 | 846.67698878 (0.35779) | 177.9 / 39.5 | 2.48 | O(12) = 0.438 C(11) = 0.528 N(13) = 0.471 C(17) = 0.441 | |
| AdCO-2-iPrIm (трансоидная; iPr + 180°) Рис. 5 | 846.67311002 (1.37636) | 177.9 / 141.3 | 7.72 | O(12) = 0.507 C(11) = 0.470 N(13) = 0.466 C(17) = 0.078 | |
| AdCO-4-MeIm (цисоидная) | 768.09709810 (0) | 0.6 | 4.26 | O(12) = 0.440 C(11) = 0.535 N(13) = 0.441 C(17) = 0.416 | |
| AdCO-4-MeIm (трансоидная) | 768.09697380 (0.03264) | 179.9 | 2.01 | O(12) = 0.435 C(11) = 0.540 N(13) = 0.436 C(17) = 0.277 | |
| AdCH2COIm (цисоидная) | 768.09409421 (0) | 1.4 | 3.76 | O(13) = 0.432 C(12) = 0.544 N(14) = 0.421 C(18) = 0.276 | |
| AdCH2COIm (трансоидная) | 768.09407031 (0.00628) | 179.8 | 2.02 | O(13) = 0.429 C(12) = 0.539 N(14) = 0.414 C(18) = 0.271 | |
| AdCH2CO-2-MeIm (цисоидная) | 807.39400816 (0) | 0.4 | 3.06 | O(13) = 0.440 C(12) = 0.538 N(14) = 0.447 C(18) = 0.421 | |
| AdCH2CO-2-MeIm (трансоидная) | 807.39381534 (0.05064) | 179.244 | 2.07 | O(13) = 0.444 C(12) = 0.538 N(14) = 0.437 C(18) = 0.423 | |
| AdCH2CO-4-MeIm (цисоидная) | 807.39395079 (0) | 0.8 | 3.44 | O(13) = 0.437 C(12) = 0.541 N(14) = 0.428 C(18) = 0.282 | |
| AdCH2CO-4-MeIm (трансоидная) | 807.39392051 (0.00795) | 179.9 | 1.35 | O(13) = 0.434 C(12) = 0.538 N(14) = 0.420 C(18) = 0.276 | |
В изученных соединениях полные энергии молекул и заряды на атомах реакционного центра различаются незначительно и, вследствие этого, не позволяют оценить реакционную способность. В связи с этим нами были рассмотрены дипольные моменты молекул имидазолидов, которые значительно различаются в зависимости от их структуры и конформации. Возрастание дипольного момента молекул приводит к увеличению реакционной способности соответствующего соединения при взаимодействии с полярными нуклеофильными агентами. Как видно из приведенной таблицы 4, величины дипольных моментов (1Н-имидазолил-1)(адамантил-1)метанонов выше, чем для соответствующих этанонов. Этим может объясняться повышенная устойчивость соединений 3a, 3b, 3d в реакциях гидролиза по сравнению с 2a, 2с, 2d, что согласуется с экспериментальными данными.
5. Гидролитическая устойчивость азолидов с разными гетероциклами
Для установления влияния природы гетероцикла на реакционную способность азолидов исследовали кинетику гидролиза бензолсульфокислот общей структурной формулой:
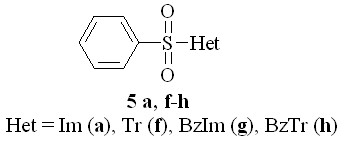
Гидролиз этих соединений проводили спектрофотометрическим методом при 25 °С в условиях 1000-кратного избытка воды. При кислотном гидролизе их реакционная способность убывает в следующем ряду (в скобках указан обсуждаемый фрагмент):
5f (Tr) > 5a (Im) > 5g (BzIm) > 5h (BzTr)
В условиях щелочного гидролиза изменение реакционной способности 5a, 5f-g иное:
5f (Tr) > 5a (Im) > 5h (BzTr) > 5g (BzIm)
В кислой среде скорость гидролиза бензотриазолида 5h уменьшается вследствие того, что при увеличении концентрации H+ легче происходит протонирование молекул воды, чем молекул 5h, что связано с различной гидратацией гетероциклов. Протонированная молекула воды является очень слабыми нуклеофилом, поэтому с увеличением концентрации протонов скорость гидролиза 5h уменьшается. В случае щелочного гидролиза азолидов лимитирующей стадией является атака гидроксид-ионом молекулы 5h.
Увеличение реакционной активности при переходе от имидазолидов к триазолидам является следствием замены атомов углерода в кольцах азолов более электроотрицательными атомами азота, что смещает частично отрицательный заряд на атоме азота N1 в область положительных значений. В результате атом азота N1 проявляет электроноакцепторный эффект по отношению к карбонильной группе, делая эту группу более восприимчивой к нуклеофильной атаке. Кроме того, с растущим числом атомов азота азолы становятся лучшими уходящими группами. Бензольный фрагмент в 5g и 5h оказывает дополнительное стабилизирующее действие на молекулу азолида и делает связь S–N этих соединений более прочной, а 5g и 5h более устойчивыми.
6. Синтез N-(1,3-бензотиазолил-2)-адамантан-1-ацетамидов и карбоксамидов и N-(адамантил-1-метил)(1,3-бензотиазол-2)аминов
Полученные квантово-химические и кинетические данные о реакционной способности имидазолидов 1-адамантанкарбоновых кислот позволили оптимизировать синтез амидов на основе 2-аминобензотиазола с применением имидазолидов в качестве N-ацилирующих агентов. 6Замещенные N-(1,3-бензотиазолил-2)-адамантан-1-ацетамиды и карбоксамиды получены кипячением в течение 6 ч замещенного 2аминобензотиазола и имидазолида соответствующей кислоты в мольном соотношении 1 : 1 в среде сухого хлороформа. Выходы целевых соединений составили 22 – 39 %.
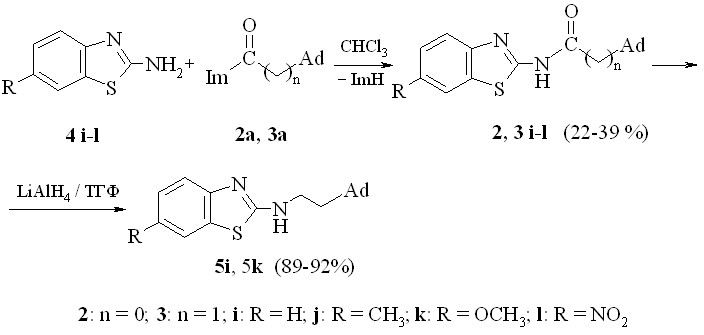
В ИК спектрах 2-3 i-l имеются характерные полосы поглощения 3420–3408 см-1 — (N–Н) и 1698–1675 см-1 (C=О), отвечающие валентным колебаниям связей амидного фрагмента.
В спектрах 1Н ЯМР 2-3 i-l присутствуют три сигнала протонов каркаса адамантана в области 1.621.75 (6H), 1.791.98 (6H) и 1.952.10 м.д.(3H), а также характерен сигнал протона амидной группы 11.7012.64 (1Н).
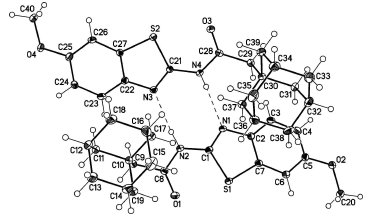
Структура ацетамида 3k была также подтверждена данными РСА:
Соединения 3i и 3k восстанавливали алюмогидридом лития до соответствующих N-(адамантил-1-метил)(1,3-бензотиазол-2)аминов 6i и 6k в среде ТГФ.
В спектрах 1Н ЯМР 5i и 5k присутствуют три группы сигналов протонов адамантильного каркаса (м.д.): 1.621.75 (6H), 1.791.98 (6H) и 1.952.10 (3H), а также характерны сигналы протонов аминогруппы 3.203.40 (2Н) и метиленового звена 1.40–1.51(2H).
8. Прогноз биологической активности производных
Nацил-2-аминобензотиазолов
Виртуальный скрининг исследуемых соединений был выполнен с использованием программы PASS Professional 2007 (В.В. Поройков и сотр., НИИ ИБМХ РАМН им. В.Н. Ореховича).
На основании проведенного скрининга можно предположить, что в спектре биологического действия полученных соединений наиболее вероятно проявление противовирусной (2i – 2k, 3i – 3k), антипаркинсонической активности (2i – 2k, 3i , 3k), а также возможно их применение для лечения почечной недостаточности (2i, 3j) и бокового амиотрофического склероза (2l).
Для амидов 1адамантанкарбоновой и 1-адамантилуксусной кислот, содержащих фрагменты 6-замещенного 2-аминобензотиазола, были рассчитаны значения логарифма коэффициентов распределения lg P с использованием программы Spartan’10 (Wavefunction Inc., США) с целью установления характера влияния заместителя в положении 6 1,3-бензотиазольного фрагмента и адамантилсодержащих остатков на изменение липофильности у исследуемых амидов.
Таблица 5
Значения lg P для исходных 1,3-бензотиазоламинов и
(адамантил-1)(1,3-бензотиазолил-2)карбокс- и ацетамидов
| Заместитель | 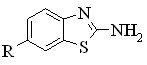 | 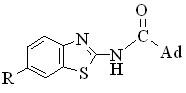 | 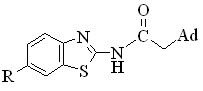 |
| H | 0.09 | 4.51 | 4.46 |
| 6-CH3 | 0.26 | 5.00 | 4.94 |
| 6-OCH3 | -0.89 | 4.38 | 4.33 |
| 6-NO2 | -2.35 | 2.80 | 2.75 |
Как видно из приведенных данных таблицы 5, все полученные амиды липофильны, т. к. их lg P > 0 и находится в пределах от 2.75 до 5.00. Наиболее липофильным является N(6-метил-1,3-бензотиазолил-2)-адамантан-1-карбоксамид, а наименее – N(6-нитро-1,3-бензотиазолил-2)-адамантан-1-ацетамид, что связано с присутствием полярной нитрогруппы. В целом производные 1адамантанкарбоновой кислоты более липофильны. Как видно из таблицы, липофильность полученных амидов значительно выше по сравнению с исходными 6замещенными 2-амино-1,3-бензотиазолами. Это должно способствовать их лучшему проникновению через биологические мембраны.
Выводы
1. Разработаны подходы к синтезу новых 2- и 4-замещенных имидазолидов 1адамантанкарбоновой и 1адамантилуксусной кислот с выходами 73–90%.
2 .Установлено, что взаимодействие синтезированных имидазолидов и 6-замещенных 2-амино-1,3-бензотиазолов приводит к образованию соответствующих N(1,3-бензотиазолил-2)-адамантан-1-карбоксамидов и –ацетамидов.
3. Проведены кинетические исследования гидролиза для ряда имидазолидов 1адамантанкарбоновой и 1адамантилуксусной кислот в системе ацетонитрил вода 3 : 7 при pH 7 и 25 °С. Показано, что их реакционная способность уменьшается в ряду AdСH2CO-4-MeIm > AdСH2COIm > AdСH2CO-2-MeIm > AdCO-4-MeIm > AdCOIm > AdCO-2-iPrIm.
4. Для молекул исследуемых имидазолидов 1-адамантанкарбоновых кислот с учетом ориентации имидазольного фрагмента (цисоидная и трансоидная конформации молекул) был рассчитан ряд физико-химических характеристик (DFT B3LYP, базисный набор 6-311G+), из которых в качестве критериев оценки реакционной способности наиболее значимыми являются индексы локальной электрофильности и величины дипольных моментов. Показано, что реакционная способность полученных соединений уменьшается в следующем ряду AdСH2CO-4-MeIm > AdСH2COIm > AdСH2CO-2-MeIm > AdCO-4-MeIm > AdCOIm > AdCO-2-iPrIm.
4. Изучена сравнительная гидролитическая устойчивость азолидов бензолсульфокислот. Показано, что их реакционная способность зависит от числа атомов азота в гетероцикле и в условиях щелочного гидролиза убывает в ряду Tr > Im > BzTr > BzIm;
5. Компьютерный скрининг возможной биологической активности N(1,3-бензотиазолил-2)-адамантан-1-ацетамидов и карбоксамидов, а также исходных 6-замещенных 1,3-бензотиазолил-2-аминов показал повышенную биологическую активность полученных ацетамидов и карбоксамидов по сравнению с исходными 1,3-бензотиазолил-2-аминами.
Список работ, в которых опубликованы основные положения диссертации
а) в журналах, рекомендованных ВАК Минобрнауки России:
1. Склюев, П.В. Синтез и антибактериальная активность 1-[алкил(арил)сульфонил]-1Н-азолов / П.В. Склюев, З.П. Белоусова, Ю.П. Зарубин, П.П. Пурыгин // Бутлеровские сообщения. – 2011. – Т. 25, №6. – C. 47–54.
2. Тырина, Е. В. Гидролиз имидазолилпроизводных адамантана / Е.В. Тырина, П.В. Склюев, С.В. Курбатова, П.П. Пурыгин, Е.А. Колосова // Бутлеровские сообщения. – 2012. – Т. 32, №13. – С. 37–42.
3. Константинов, А.В. Изучение корреляционных зависимостей «хроматографическое удерживание – физико-химическое свойство сорбата» имидазольных производных адамантана методом ОФ ВЭЖХ / А.В. Константинов, Р.В. Шафигулин, П.В. Склюев, А.В. Буланова, П.П. Пурыгин // Физикохимия поверхности и защита материалов. – 2012. – Т. 49, №6. – С. 597–599.
4. Склюев, П.В. Синтез и структура имидазолидов 1-адамантилуксусной кислоты / Ю.П. Зарубин, П.П. Пурыгин, А.В. Константинов // Вестник СамГУ. Естественнонаучная серия. – 2013. – № 3(104). – С. 140–145.
5. Bunev A.S. 2-(1-Adamantyl)-N-(6-methoxy-1,3-benzothiazol-2-yl)acetamide / A.S. Bunev, P.V. Sklyuev, V.E. Statsyuk, P.P. Purygin, V.N. Khrustalev // Acta Cryst. Sect. E. – 2013. – E69. – o1472.
б) в тезисах докладов Всероссийских конференций:
6. Склюев, П.В. Синтез, структура и реакционная способность имидазолидов 1адамантанкарбоновой кислоты / П.В. Склюев, Ю.П. Зарубин, П.П. Пурыгин // Материалы III Международной молодежной научно-практической конференции «Коршуновские чтения», 26–28.09.2012 г., Тольятти, ТГУ. С. 67–68.
7. Склюев, П.В. Синтез и физико-химические свойства имидазолидов 1адамантилуксусной кислоты / П.В. Склюев, Ю.П. Зарубин, П.П. Пурыгин // Материалы III Международной молодежной научно-практической конференции «Коршуновские чтения», 26–28.09.2012 г., Тольятти, ТГУ. С. 80–81.
8. Соколова, Ю.Л. Синтез имидазолидов адамантанкарбоновой и адамантилуксусной кислот / Ю.Л. Соколова, П.П. Пурыгин, П.В. Склюев // Тез. докл. XXXVIII Самарской областной студенческой конференции,
10–20.04.2012 г., Самара, СГУ. С. 207.
9. Константинов, А.В. Адсорбция имидазольных производных адамантана на сверхсшитом полистироле / А.В. Константинов, Р.В. Шафигулин, А.В. Буланова, П.В. Склюев, П.П. Пурыгин // Тез. докл. Всероссийского симпозиума «Кинетика и динамика обменных процессов», 25.11–2.12.2012 г., Краснодарский край. С. 85.
10. Склюев, П.В. Синтез и изучение реакционной способности имидазолидов 1-адамантанкарбоновой и 1-адамантилуксусной кислот / П.В. Склюев, И.В. Барановский, Ю.П. Зарубин, П.П. Пурыгин // Тез. докл. XIX молодежной конференции студентов, аспирантов и молодых ученых «Ломоносов-2012», 9–13.04.2012 г., Москва, МГУ. С. 384.
[1] Grzyb J. A., Lough A. J., Batey R. A. Acta Crystallographica Section C. 2004.V.60. P. 730-732

