Диэлектрические свойства водных растворов солей щелочных металлов, галогеноводородных кислот и щелочей
На правах рукописи
Анциферов Евгений Александрович
ДИЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ВОДНЫХ РАСТВОРОВ
СОЛЕЙ ЩЕЛОЧНЫХ МЕТАЛЛОВ, ГАЛОГЕНОВОДОРОДНЫХ
КИСЛОТ И ЩЕЛОЧЕЙ
Специальность 02.00.01 – неорганическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата
химических наук
Иркутск – 2006 г.
Работа выполнена на кафедре общей и неорганической химии химического факультета Иркутского государственного университета.
Научный руководитель: Заслуженный деятель науки и техники РФ
доктор технических наук, профессор
Бегунов Альберт Иванович
Официальные оппоненты: доктор технических наук, профессор
Щербаченко Лия Авенировна
кандидат химических наук, с.н.с.
Пархоменко Ирина Юльевна
Ведущая организация: Ангарская государственная
техническая академия
Защита состоится 20 декабря 2006 г. в 10 час. на заседании специализированного совета Д 212.074.03 по защите диссертации на соискание учёной степени кандидата химических наук при Иркутском государственном университете по адресу: 664033, г. Иркутск, ул. Лермонтова, 126, химический факультет ИГУ.
С диссертацией можно ознакомиться в научной библиотеке ИГУ, с авторефератом диссертации - на сайте ИГУ http://www.isu.ru
Автореферат разослан « 8 » ноября 2006 г.
Отзывы на автореферат высылать по адресу: 664003, Иркутск, ул. К. Маркса, 1, ИГУ, химический факультет, учёному секретарю диссертационного совета
Д 212.074.03 C.А. Скорниковой
Учёный секретарь диссертационного совета,
к.х.н., c.н.с. Скорникова С.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Тема диссертационной работы относится к изучению сложных конденсированных систем диэлектрическим методом, в основе которого лежит диэлькометрия высокого разрешения. Знание свойств и поведения растворов в широкой области концентраций имеет большое значение для целого ряда областей науки, смежных с химией растворов. Это, например, электрохимия, биохимия, химия и технология жидкофазных материалов. Исследование диэлектрических свойств водных растворов в СВЧ-диапазоне является эффективным методом исследования растворов электролитов, так как позволяет получить информацию о молекулярно-кинетическом состоянии молекул воды в сетке водородных связей и гидратационных взаимодействиях в растворе. При этом переход от молекулярных растворов к растворам электролитов делает их диэлектрическое описание более затруднительным. Одной из таких трудностей является аномальное поведение диэлектрической проницаемости, обнаруженное на частоте 9,1 ГГц у некоторых водных растворов электролитов. Раскрытие природы таких эффектов во многом будет зависеть от понимания и интерпретации собственно процессов поляризации в электролитических растворах.
Целью работы является исследование аномального поведения диэлектрической проницаемости в области высоких концентраций водных растворов электролитов, заключающегося в увеличении и превышении воды.
Методы исследования. Для достижения поставленной цели проведены экспериментальные исследования водных растворов электролитов на СВЧ-диэлектрографе с использованием методов точечных измерений, непрерывной записи выходных параметров, методов бесконечного разбавления и теплового удара.
Научная новизна. Впервые в широком интервале концентраций и температур проведено систематическое изучение аномального поведения диэлектрической проницаемости водных растворов электролитов на частоте 9,1 ГГц.
- получены концентрационные, температурные зависимости и диэлектрограммы аномального поведения диэлектрической проницаемости (ДП) ряда водных растворов галогенидов щелочных металлов, галогеноводородных кислот и щелочей.
- исследовано влияние изменения состава растворителя (вода-метанол, вода-ацетон) на рассматриваемый эффект.
- получены концентрационные диэлектрограммы тройных систем NaBr-HBr-H2O и NaBr-NaOH- H2O. Установлена зависимость увеличения с ростом концентрации протонов и анионов гидроксила.
Практическая значимость. Теоретическая и практическая значимость полученных результатов заключается в том, что они являются одной из составных частей задачи совершенствования и понимания процессов поляризации, что в свою очередь отвечает за структурные характеристики и кинетические процессы, происходящие в растворах. Полученные данные могут использоваться в качестве справочного материала исследователями, работающими с водными растворами электролитов, в том числе, при разработке новых и оптимизации существующих технологий (гидрометаллургические, гидрохимические технологии).
Апробация работы. Материалы диссертационной работы докладывались и обсуждались на научно-практической конференции химико-металлургического факультета ИрГТУ «Перспективы развития технологии, экологии и автоматизации химических, пищевых и металлургических производств» (Иркутск, 2004-2006), XXV Российской школе по проблемам науки и технологий (Миасс, 2005), 1-ом Международном форуме (6-ой Международной конференции) молодых учёных и студентов «Актуальные проблемы современной науки» (Самара, 2005).
Публикации. Результаты работы отражены в 8 публикациях, среди которых имеется глава в коллективной монографии «Физическая химия водных растворов солей легких и щелочных металлов».
Структура и объём работы. Диссертация состоит из введения, четырёх глав, приложения, списка использованных источников, включающего 126 наименований. Работа изложена на 134 страницах, содержит 56 рисунков и 16 таблиц.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введение обоснована актуальность темы диссертации, сформулирована цель работы, изложены основные положения, выносимые на защиту.
В первой главе обобщены и систематизированы литературные данные, характеризующие закономерности поляризации, современное состояние исследования диэлектрических свойств растворов электролитов в разных концентрационных областях в широком температурном интервале, а также молекулярно-кинетические и структурные изменения воды в растворах электролитов и их связь с диэлектрическими характеристиками. Отмечено, что увеличение диэлектрической проницаемости в СВЧ-области водных растворов электролитов в экспериментальном отношении изучено недостаточно и по литературным данным нельзя провести полного сравнения диэлектрических характеристик исследуемых растворов.
Во второй главе изложен метод и конкретные методики измерений комплексной диэлектрической проницаемости растворов при различных температурах. Приведены блок-схема установки, общий вид измерительной ячейки на основе сдвоенных резонаторов Е010. В ней описано приготовление и условия хранения растворов. Выполнена оценка ошибок измерений.
В третьей главе представлены экспериментальные данные диэлектрических характеристик водных растворов галогенидов щелочных металлов. У растворов KCl, RbCl и CsCl (рис.1) зависимости '(С) значительно отличаются от зависимостей для растворов LiCl и NaCl. При этом водные растворы KCl, RbCl и CsCl представляют системы, в которых оба иона не образуют гидратных комплексов. K+, Rb+, Cs+ характеризуются отрицательной гидратацией, а ион Cl- проявляет почти нулевую гидратацию. Особенности в поведении '(с) в области больших концентраций у этих растворов проявляются в смене направления зависимости '(С). С ростом концентрации растворов KCl, RbCl и CsCl происходит увеличение действительной составляющей диэлектрической проницаемости ', что приводит к превышению ' над диэлектрической проницаемостью воды.
Рис. 1. Зависимость ' и '' от концентрации для растворов хлоридов щелочных металлов при T=293 K (1-LiCl, 2-NaCl, 3-KCl, 4-RbCl, 5-CsCl)
Установлено, что в результате изменения температуры у растворов KCl, RbCl и CsCl (рис. 2А, 2Б) наблюдается увеличение ' c повышением концентрации. У растворов LiCl и NaCl изменения не превышают ' воды, но у растворов КСl это превышение наблюдается при температуре 50 0С и концентрации 33,5 моль/л. Такие системы как RbCl, CsCl характеризуются еще большим увеличением ' относительно воды.
Частично такое поведение объясняется увеличивающейся нежесткостью гидратных оболочек этих катионов, что проявляется в ослаблении центральных (ион-дипольных) взаимодействий и в усилении направленных (ион-ионных) взаимодействий, ускоряющих процессы кристаллизации в растворах. «Рыхлость» ионных атмосфер К+, Rb+, Cs+ по сравнению с катионами Li+, Na+ становится достаточно большой, что приводит к недостаточной жесткости гидратных оболочек и способствует более интентенсивным ион-ионным взаимодействиям. При этом образуются полярные ассоциаты, вклад которых в диэлектрическую проницаемость раствора обуславливает некоторый подъем зависимости ' (С) при концентрациях, близких к насыщению растворов KCl, RbCl и CsCl. Ионные ассоциаты типа K+-H2O-Cl- для растворов галогенидов калия, рубидия и цезия в концентрированных растворах (KCl:10H2O, RbCl:5H2O, CsCl:3H2O) не образуются совсем, а наличие контактных ионных пар приводит к образованию ионных группировок с большим дипольным моментом.
Рис. 2А. Концентрационные зависимости '(с) и ''(с) растворов хлоридов щелочных металлов при различных температурах; у зависимостей цифрами проставлены температуры измерения
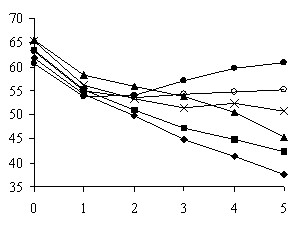
Рис. 2Б. Концентрационные зависимости '(с) и ''(с) растворов хлоридов щелочных металлов при различных температурах; у зависимостей цифрами проставлены температуры измерения
Потери на СВЧ-проводимость '' рассчитанные по литературным данным, вносят основной вклад в общее значение ''. Они не только компенсируют ожидаемое уменьшение диэлектрических потерь, но и дают заметное повышение над потерями воды. Поэтому наблюдаемое поведение ''(С) в значительной мере определяется (С) раствора. В частности, происхождение максимумов ''(С) можно объяснить действием встречных эффектов, когда, с одной стороны, электропроводность увеличивается в соответствии с увеличением концентрации ионов в растворе, а с другой – она уменьшается в связи со снижением подвижности ионов при уменьшении расстояния между ними. Характерное для данного эффекта увеличение диэлектрической проницаемости раствора в области средних и больших концентраций сопровождается соответствующим увеличением коэффициента диэлектрических потерь ''(с). Действие температуры на зависимость ''(с) также находит свое объяснение в рамках понимания действующих механизмов зависимости электропроводности от концентрации и температуры. С ростом температуры подвижность ионов возрастает, что приводит к увеличению потерь на СВЧ-проводимсть (рис. 3).
По полученным данным '' и '', были рассчитаны дебаевские потери ''D, характеризующие переориентацию молекул воды. Дебаевские потери растворов хлоридов лития и натрия имеют почти одинаковые значения, что связано c одинаковым характером механизма поляризации и образованием гидраторазделенных ионных пар (ГИП). Значения величины ''D для растворов хлоридов калия, рубидия и цезия только в области малых концентраций совпадают со значениями хлоридов лития и натрия, что согласуется с дебаевской теорией релаксации. В области средних и высоких концентраций у растворов KCl, RbCl и CsCl возможно образование ассоциатов, что влияет на механизм поляризации. Это с свою очередь объясняет характер изменения зависимостей ''D(с) для данных растворов (рис. 3). При концентрациях больше 3 моль/л величины ''D растворов KCl, RbCl и CsCl имеют отрицательные значения. Скорее всего, это является следствием того, что при расчете величины '' не была учтена частотная дисперсия проводимости.
Рис. 3. Зависимость '', '', ''d от концентрации для растворов хлоридов щелочных
металлов при T=293K (1-5 зависимости ''(с), 6-10 зависимости ''(с))
Исследование добавки метанола на изменение '(с) раствора хлорида калия показало, что в этом случае полученный растворитель, содержащий 1%, 16% метанола, приводит к уменьшению начального уровня отсчёта (рис. 4). Характер изменения величины ' остаётся таким же, как без добавки метанола. Столь сильное уменьшение при концентрации метанола 16% связано с аддитивностью величины ' по составу растворителя. Статическая диэлектрическая проницаемость метанола равна 31 ед.
Коэффициент диэлектрических потерь '' с добавкой метанола (16%) не столь сильно изменился по сравнению с '.
Рис. 4. Зависимость ', '' от концентрации для раствора КСl с добавлением метанола
Установлено, что изменение '(с) для растворов LiBr, LiI, NaBr, NaI имеет нормальный характер поведения, согласующийся с литературными данными (рис. 5). С ростом концентрации при Т=293К действительная составляющая диэлектрической проницаемости ' планомерно уменьшается и приближается к своим асимптотическим значениям. В диапазоне высоких концентраций у растворов водная матрица вытесняется, структура раствора становится «гомогенной», представляя собой «плотную упаковку» из сферических оболочек, которыми являются ионные атмосферы. При дальнейшем повышении концентрации ионов структура раствора остается неизменной и радиус ионных сфер уменьшается. При этом жесткость ионных атмосфер повышается, что приводит к уменьшению их поляризуемости и, как следствие, к наблюдаемому уменьшению диэлектрической проницаемости. В области высоких концентраций зависимости '(С) приближаются к своим асимптотическим значениям, что говорит о достижении у ионных атмосфер минимальных радиусов, соответствующих мономолекулярному водному слою гидратной оболочки. Структурные изменения, вносимые ионом лития в структуру растворителя, существенно отличаются от изменений, вызванных другими ионами щелочных металлов. Эту особенность в литературе связывают с исключительной способностью иона лития внедряться в структуру воды и образовывать большие кластеры, а также было установлено формирование достаточно прочного комплекса Li(H2O)4+. Влияние на величину ' замены аниона Br- на I- не столь существенно, как замена катиона. Как правило смена аниона не влияет на параметры гидратации катионов, а увеличение размера галогенид-ионов влияет на структуру растворителя.
С ростом температуры есть, однако некоторые различия в поведении '(с). Из концентрационных зависимостей '(с) видно, что по мере увеличения температуры крутизна зависимостей '(с) у всех растворов постепенно снижается, а при ещё больших температурах наблюдается перегиб в сторону увеличения диэлектрической проницаемости. Температурная зависимость '(с) для раствора бромида лития свидетельствует о независимости изменения данного фактора.
У растворов бромидов и иодидов калия, как и для растворов хлоридов калия, рубидия и цезия, проявляется эффект увеличения диэлектрической проницаемости. Её значение при Т=293К достигает величины ' воды (61,8 ед.) и незначительно превышает её. С ростом температуры проявляется ещё большее увеличение ', достигающей при концентрации 4 моль/л и температуре 343 К у бромида калия ' 100 ед., а у иодида калия ' 110 ед. Причем у раствора KI величина ' выходит на свои асимптотические значения.
Рис. 5. Концентрационные зависимости '(с) и ''(с) растворов бромидов и иодидов
щелочных металлов при различных температурах
Значения коэффициента диэлектрических потерь ''(с) растворов (рис. 6) закономерно увеличиваются с повышением температуры, свидетельствует о дебаевской природе поляризации этих систем. Из рис. 6 видно, что с ростом концентрации потери на СВЧ-проводимость становятся преобладающими над коэффициентом диэлектрических потерь и вносят основной вклад в них. Рост температуры значительно увеличивает проводимость растворов, что затрудняет расчет дебаевских потерь. Поэтому наблюдаемое поведение ''(с) в значительной мере определяется проводимостью раствора. Так же для растворов хлоридов щелочных металлов максимумы ''(с) и ''(с) смещаются в область больших концентраций в направлении от LiBr к KBr и от LiI к KI (рис. 6).
Диэлектрические потери D'' на переориентацию молекул в процессе их поляризации в области бесконечного разбавления растворов согласуются с дебаевской теорией релаксации. Значения D'' растворов LiI, LiBr, NaBr, NaI в области средних и больших концентраций практически ложатся на одну кривую (рис. 7). Это можно объяснить тем, что изоморфность ионных структур разных ионов обеспечивает одинаковый механизм поляризации и обуславливает одинаковый вклад диэлектрических потерь D'' у соответствующих растворов. Для данных растворов характерно образование в области высоких концентраций (LiCl:6H2O, LiBr:2H2O, LiI:7H2O, NaCl:8H2O, NaI:2H2O) гидраторазделённых ионных пар. Значения D'' растворов KI, KBr (рис. 7) не легли на общую кривую D''(с). Этот факт можно объяснить тем, что образование дипольных ассоциатов, обеспечивает дополнительный вклад диэлектрических потерь, и зависимости ''(с) не могут быть такими же, как у бездипольных «ионных» структур.
Рис. 6. Зависимость '', '' от концентрации для растворов бромидов и иодидов щелочных
металлов при T=293K (1-3 зависимости ''(с), 4-6 зависимости ''(с))
Рис. 7. Зависимость D'' от концентрации для растворов галогенидов щелочных металлов
при T=293K
В четвёртой главе исследованы водные растворы ряда щелочей и кислот. Получены концентрационные зависимости '(с) и ''(с) этих растворов и диэлектрограммы. Для построения последних использован метод непрерывной записи ' в процессе смешения компонентов раствора, воды и концентрированных растворов кислот и щелочей (рис. 8).
У раствора LiOH аномальное увеличение ДП не наблюдается, а у растворов NaOH и КОН эффект становится вполне заметным.
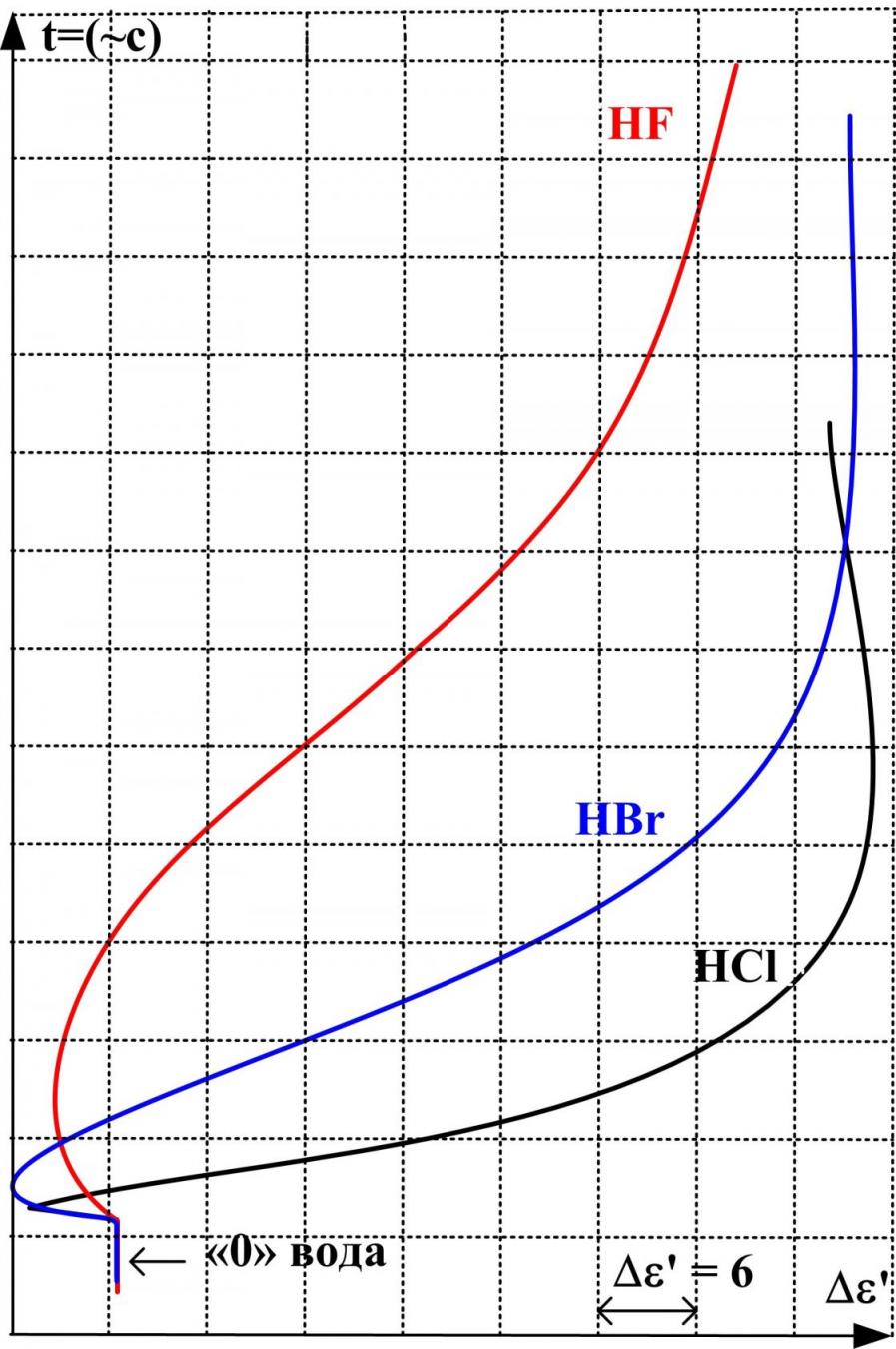
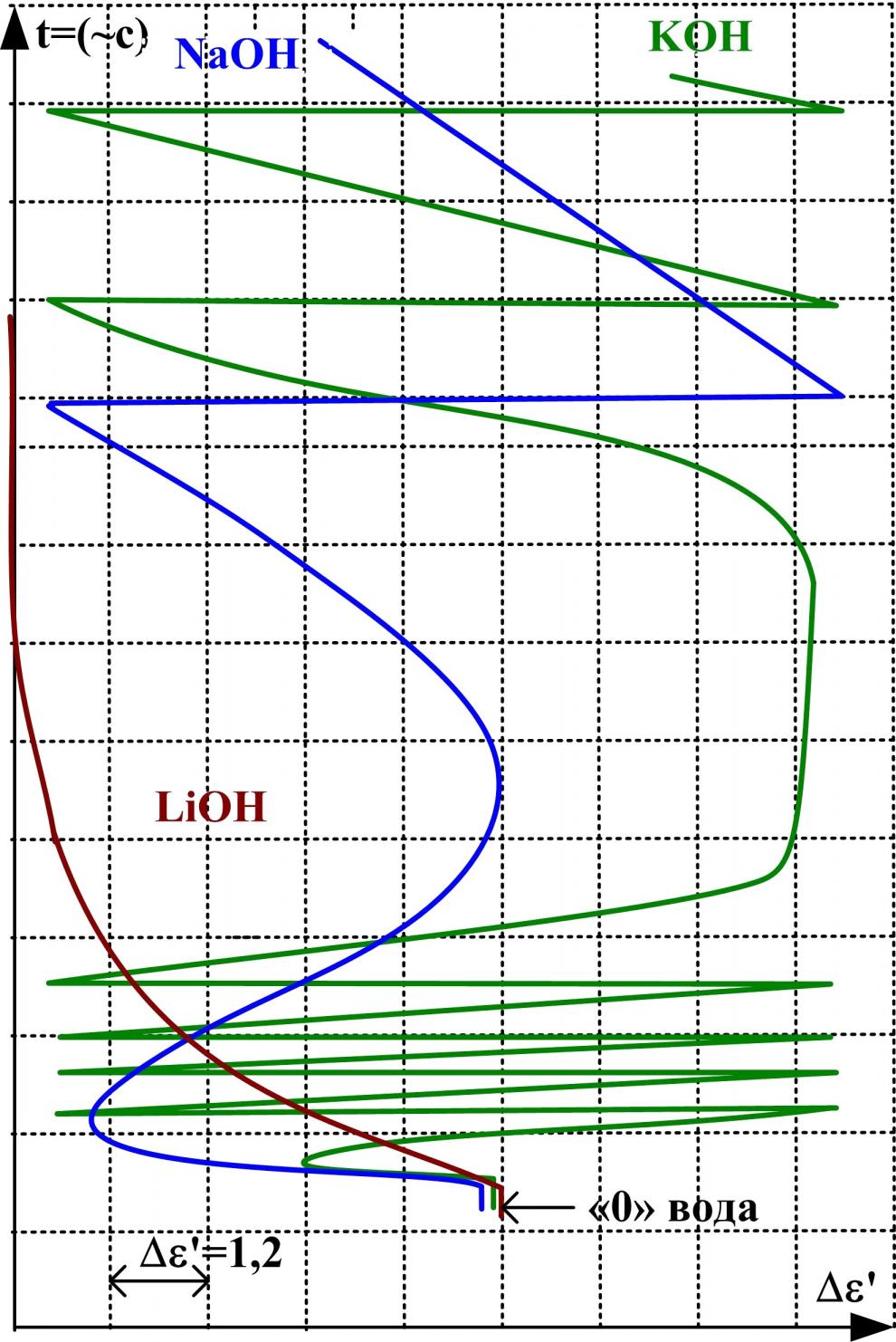
Рис. 8. Диэлектрограмма водных растворов щелочей и кислот при температуре 293 К
При этом у раствора NaOH увеличение ' достигает значения воды, а у KOH превышает 'H2O на 44 единицы. Еще сильнее этот эффект проявляется у растворов HF, HCl, HBr. ДП растворов достигает '=100120. Вместе с этим в области низких концентраций растворов наблюдается хорошо различимый участок '(с), на котором диэлектрическая проницаемость (соответствующая концентрации менее 1моль/л) уменьшается (рис. 9), а затем меняет направление и быстро увеличивается. Как и в случае растворов солей калия, рубидия и цезия, здесь обнаруживается некоторая зависимость эффекта увеличения ДП от радиуса аниона. Под воздействием поля анионов происходит разрушение собственной структуры воды в растворах. Причем с увеличением галогенид-ионов влияние их на структуру растворителя усиливается так, что в системе HI-H2O тетраэдрическая упорядоченность молекул воды полностью отсутствует.
Рис. 9. Зависимость ' от концентрации для растворов HBr при различных температурах
Анализ полученных зависимостей показывает, что температура оказывается стимулирующим изучаемый эффект фактором. С ростом температуры у всех растворов наблюдается увеличение ' относительно концентрации. При температуре 343 К у растворов HCl и HBr величина ' достигает 130150 единиц.
Изменение структуры растворителя приводит к уменьшению начального уровня отсчета ', но сохраняется первоначальная крутизна зависимости '(с) растворов HBr (рис. 10). Этот результат может свидетельствовать об аддитивности величины ' по составу раствора. Столь сильное изменение начального уровня связано с низким значением ' ацетона относительно воды. Увеличение '(с) раствора связано с возрастающей долей водного раствора бромистого водорода, так как в растворе 2 моль/л доля ацетона больше, чем воды. И наоборот, в растворе 5моль/л воды больше, чем ацетона, что влияет на поляризацию. Таким образом, именно водные растворы исследуемых кислот, щелочей и солей проявляют аномальное поведение.
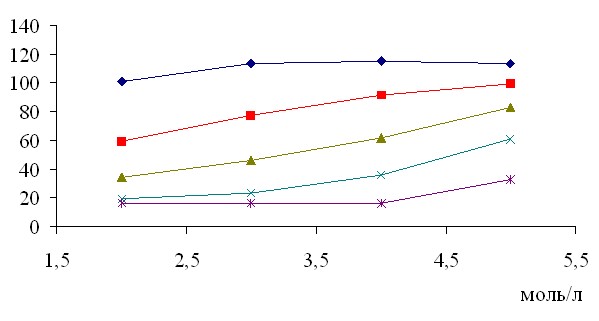
Рис. 10. Зависимость ' от концентрации для растворов бромистоводородной кислоты
с разным содержанием ацетона. (содержание ацетона: 1 – 0%; 2 – 25%; 3 – 50%;
4 – 75%; 5 – 100%)
Исследование тройных систем NaBr-HBr-Н2О, NaBr-NaOH-Н2О, методом непрерывной записи выходных параметров (рис. 11), показало, что с ростом концентрации NaBr характер зависимости меняется и при высокой концентрации NaBr аномальное увеличение ' не наблюдается. Анализ исследуемых систем показывает, что эффект увеличения диэлектрической проницаемости растворов HBr и NaOH в области средних и больших концентраций обязан ионам H+ и OH-. Наблюдаемый эффект не связан с присутствием в растворах анионов галогенов, а эффективное действие катионов начинается только при достижение у них достаточно большого радиуса (кроме H+), как у K+, Rb+ и Cs+ (для Li+ и Na+ эффект не наблюдается).
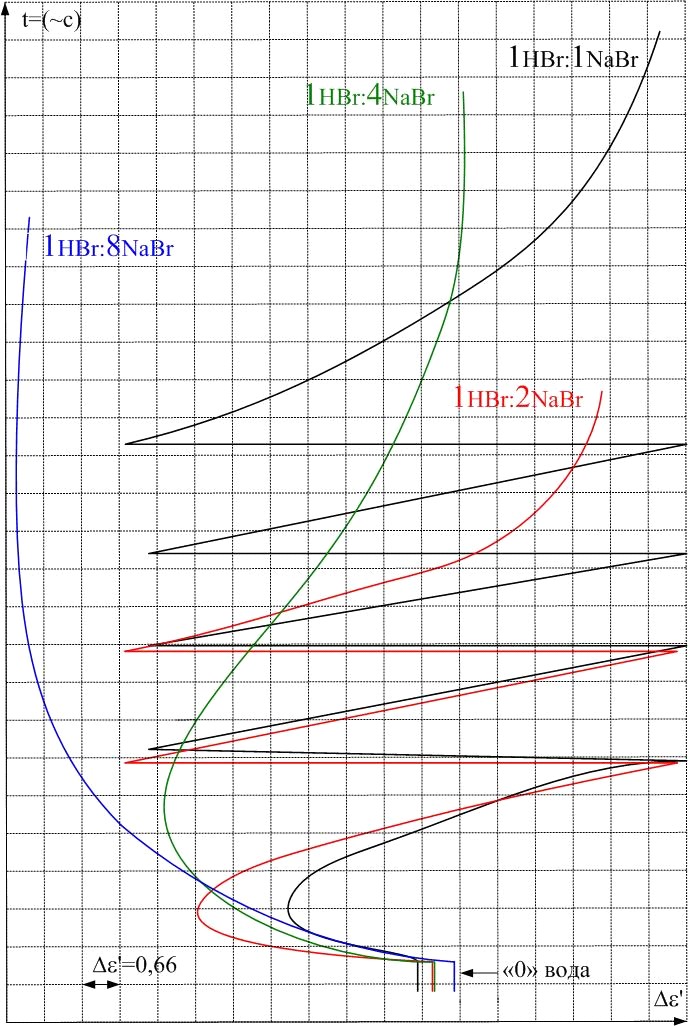
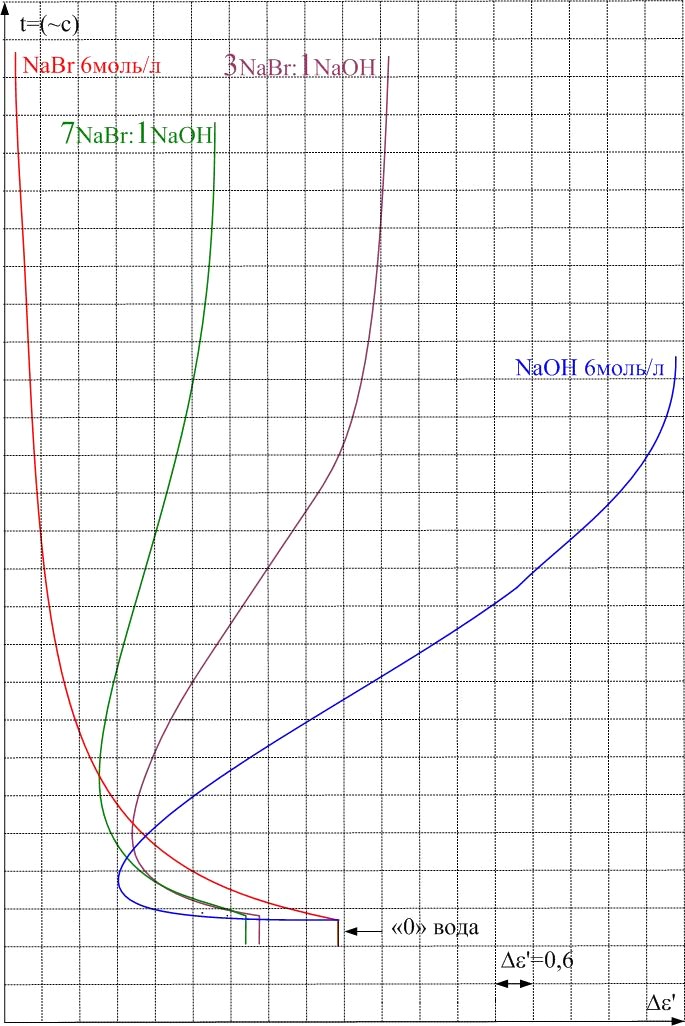
Рис. 11. Диэлектрограммы водных растворов тройных системы HBr-NaBr-Н2О и
NaBr-NaOH-Н2О при температуре 293 К
Влияние температуры на изменение ' водных растворов хлористоводородной кислоты исследовано методом «теплового удара». Концентрация кислоты изменяли от 1 до 7 моль/л. Установлено, что резкое увеличение температуры от 200С до 900С не приводит к резкому скачку увеличения ', а сопровождается постепенным повышением ' с последующей стабилизацией на уровне величины, соответствующей этой температуре.
ВЫВОДЫ
- Исследовано аномальное увеличение действительной составляющей e' диэлектрической проницаемости на частоте 9,1ГГц водных растворов галогенидов щелочных металлов, ряда кислот и щелочей в широкой области концентраций при температурах от 293 до 353К. Рассчитаны потери '' и диэлектрические потери ''d для Т=293К.
- Установлено, что наблюдаемый эффект не связан с присутствием в растворах анионов, а эффективное действие катионов начинается только при достижении у них достаточно большого радиуса, как у K+, Rb+ и Сs+ (для Li+ и Na+ эффект не наблюдается). Эффект увеличения '(с) наблюдается в области высоких концентраций, как для растворов галогенидов K, Rb, Сs, так и для щелочей и кислот. В области бесконечного разбавления и малых концентраций ' уменьшается с ростом концентрации.
- Установлено, что для кислот в ряду HF, HCl, HBr обнаруживается зависимость эффекта увеличения ДП от радиуса аниона. Показано, что основной вклад вносят концентрация ионов водорода Н+, также как для щелочей - концентрация ОН-. У раствора КОН обнаруживается аддитивное влияние ионов К+ и ОН-.
- Показано, что при увеличении температуры крутизна зависимостей '(с) у большинства растворов постепенно снижается, а при ещё больших температурах наблюдается перегиб в сторону увеличения ДП. Анализ зависимостей '(с) и ''(с) растворов при разных температурах показывает, что температура оказывается стимулирующим фактором, наблюдаемый эффект.
- Установлено, что изменение природы и структуры растворителя приводит к уменьшению начального уровня '(с) раствора НBr, KCl, но сохраняется первоначальная крутизна зависимости '(с).
- Определено, что коэффициент диэлектрических потерь d'' растворов в области больших концентраций незначителен, но наблюдаемая величина не может быть отнесена к дебаевской (ориентационной) поляризации. Она имеет подобно ионным кристаллам «решеточную» природу. При этом в ряду LiClNaClKClRbCl вероятность образования контактных ионных пар увеличивается, а гидраторазделённых ионных пар – уменьшается
- Установлено, что в области обращения ' диэлектрические потери ''(с) не уменьшаются, а увеличиваются. Это может означать что, координационные числа катионов K+, Rb+ и Сs+ повышаются и обеспечиваются возникновением у ионных атмосфер дипольного момента. В ряду Li+Na+K+Rb+Cs+ координация катиона усиливается, что предопределяет снижение способности аниона к образованию водородных связей с молекулами воды с увеличением радиуса положительно заряженных ионов.
СПИСОК НАУЧНЫХ ТРУДОВ ПО ТЕМЕ ДИССЕРТАЦИИ
- Анциферов Е.А. Исследование водных растворов электролитов в области сверхвысоких частот. // Вестник ИрГТУ. 2006. Т.2, № 4(28) (принята в печать).
- Анциферов Е.А. Аномальное увеличение диэлектрической проницаемости растворов хлоридов щелочных металлов. / Матер. докл. научно-практ. конф., посвященной памяти С.Б. Леонова «Перспективы развития технологии, экологии и автоматизации химических, пищевых и металлургических производств». Иркутск: Изд-во ИрГТУ, С.91. 2004.
- Физическая химия водных растворов солей легких металлов. Гл. 5 / [Анциферов Е.А., Бегунова Л.А., Рыбникова В.Г., Филатова Е.Г., Яковлева А.А] Под. общ. ред. А.И. Бегунова. Иркутск: Изд-во ИрГТУ, 2006. – 228 с.
- Анциферов Е.А. Аномальное увеличение диэлектрической проницаемости водных растворов электролитов. / Матер. докл. научно-практ. конф., посвященной 75-летию ИрГТУ «Перспективы развития технологии, экологии и автоматизации химических, пищевых и металлургических производств». Иркутск: Изд-во ИрГТУ, С.136. 2005.
- Анциферов Е.А. Аномальное увеличение диэлектрической проницаемости растворов хлоридов щелочных металлов. ВИНИТИ, « Депонированные научные работы», №7, 2005, б/о. №700-В 2005.
- Анциферов Е.А. Диэлектрические свойства водных растворов ряда кислот и щелочей. Тезисы докладов XXV Российской школы по проблемам науки и технологий. – Миасс: МСНТ,- С.42. 2005.
- Анциферов Е.А. Аномальное увеличение диэлектрической проницаемости в области дебаевской релаксации. Труды 1-го Международного форума (6-й Международной конференции) «Актуальные проблемы современной науки» Самара, 2005. С. 16-18.
- Анциферов Е.А. Диэлектрические характеристики водных растворов электролитов. / Матер. докл. II Всероссийской школы-семинара молодых ученых, с международным участием, посвященной 75-летию со дня рождения члена-корреспондента РАН С.Б. Леонова «Обогащение руд». Иркутск: Изд-во ИрГТУ, С.199-203. 2006.

