Физико-химические свойства стеклообразных и кристаллических фаз в системе sro b 2 o 3 sio 2
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Институт химии силикатов им. И.В. Гребенщикова РАН
На правах рукописи
Тюрнина Наталья Геральдовна
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА СТЕКЛООБРАЗНЫХ И КРИСТАЛЛИЧЕСКИХ ФАЗ В СИСТЕМЕ SrOB2O3SiO2
Специальность 02.00.04 – физическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Санкт-Петербург 2009
Работа выполнена в Учреждении Российской академии наук Ордена Трудового Красного Знамени Институте химии силикатов им. И.В. Гребенщикова (ИХС РАН)
Научный руководитель:
доктор химических наук, в.н.с. Свиридов Сергей Иванович
Официальные оппоненты:
доктор химических наук, в.н.с. Голубков Валерий Викторович
доктор химических наук, профессор Соколов Иван Аристидович
Ведущая организация:
Санкт-Петербургский государственный технологический институт (ТУ)
Защита диссертации состоится «11 » февраля 2009 года в _11_ час на заседании диссертационного совета Д 002.107.01 по защите диссертаций на соискание ученой степени кандидата химических наук в Институте химии силикатов им. И.В. Гребенщикова РАН по адресу: 199034, Санкт-Петербург, наб. Макарова, д. 2.
С диссертацией можно ознакомиться в библиотеке Институте химии силикатов РАН.
Автореферат разослан «____» 2009 года
Ученый секретарь
диссертационного совета
кандидат химических наук СЫЧЕВА Г.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. создание новых стеклообразных и керамических материалов является важной задачей современного материаловедения. Разработка технологии получения оксидных материалов с заданными свойствами требует всестороннего изучения их физико-химических и термодинамических свойств. Известно, что установление связи структура–свойство, является одной из важнейших задач химии и материаловедения. Получение информации о физико-химических свойствах исследуемых систем наряду с уже имеющимися данными для других боросиликатных систем, содержащих катионы щелочноземельных металлов, и имеющиеся структурные данные, необходимы для понимания природы стеклообразного состояния и влияния катиона на структуру стекла.
Термодинамические свойства, как индивидуальных оксидов, так и многокомпонентных систем на их основе, определяют энергетические характеристики материалов, позволяют описать процессы взаимодействия и образования соединений, прогнозировать летучесть и реакционную способность компонентов. Систематическая информация о термодинамических характеристиках боросиликатных систем, а в частности величины стандартных потенциалов образования, используются в качестве исходного параметров при численном моделировании термодинамических функций, структуры и свойств исследуемых систем, методы которого, в последнее время, успешно развиваются. Критерием достоверности таких расчетов по-прежнему остаются экспериментальные данные, достоверность и надежность которых необходимо проверять.
Система SrO–B2O3–SiO2 является составляющей многих стекол, стеклокерамических и керамических материалов, используемых в электронике и в оптоэлектронике, поскольку обладает рядом ценных свойств таких как, химическая стойкость, высокий показатель преломления, низкая проводимость, способность задерживать рентгеновской излучение. интерес к исследованию боратных систем обусловлен их важностью для жидкой флюсовки радиоактивных отходов, поскольку они характеризуются высокой долей включения радиоактивных отходов и устойчивостью к радиолизу. Боросиликатные системы, содержащие катионы щелочных и щелочноземельных металлов характеризуются широкой областью ликвации (фазовой дифференциации). На основе боросиликатных систем возможно получение стекломатериалов с эффектом глушения, пористых стёкол, которые используются в качестве базовой матрицы для создания композитных материалов с заданными свойствами. Учитывая важность и отсутствие информации о физико-химические свойствах системы SrO–B2O3–SiO2, настоящее исследование, несомненно, является весьма актуальным.
Цель работы. Систематическое исследование физико-химических свойств стеклообразных и кристаллических фаз в системе SrOB2O3SiO2, таких как стеклообразование, фазообразование, вязкость, коэффициент термического расширения, температура стеклования, плотность, микротвёрдость, светопропускание, удельное сопротивление, термодинамические свойства.
Основные задачи работы:
- Установление области стеклообразования и порядка образования кристаллических фаз, построение линий ликвидуса;
- Изучение влияния температуры и состава на физико-химические свойства: вязкость, коэффициент термического расширения, температуру стеклования, плотность, микротвёрдость, светопропускание, удельное сопротивление стёкол и расплавов;
- Определение термодинамических свойств расплавов систем SrOB2O3 и SrOSiO2.
Научная новизна. Настоящее исследование содержит следующие оригинальные экспериментальные и теоретические результаты:
- При изучении фазовых равновесий в системе SrOB2O3SiO2 установлен порядок образования кристаллических фаз и определены температуры плавления и фазовых переходов исследованных образцов. На основе полученных данных построены фазовая диаграмма псевдобинарной системы SrB2O4–SrSiO3 и фрагменты изотермы ликвидуса в тройной системе, а также определена температура конгруэнтного плавления соединения Sr3B2SiO8.
- Исследованы зависимости вязкости, коэффициента термического расширения, температуры стеклования, плотности, микротвёрдости, светопропускания, удельного сопротивления от температуры и состава стронциевоборосиликатных стёкол.
- Определены активности, химические потенциалы компонентов стеклообразующих расплавов, величины интегральной и избыточной энергий Гиббса в системах SrOB2O3 и SrOSiO2.
- Впервые установлены структуры и определены стандартные энтальпии образования и атомизации газообразных силикатов стронция SrSiO2 и SrSiO3.
Практическая значимость. Наличие корректных физико-химических и термодинамических данных для стёкол и расплавов исследуемых систем, являющихся составной частью многокомпонентных промышленных стекол, позволяет: оценить характер взаимодействия расплава стекла с огнеупорными материалами; выбрать оптимальный температурный режим варки стекла; охарактеризовать склонность расплавов стекол к кристаллизации; выбрать оптимальный состав с надежными эксплуатационными характеристиками, в зависимости от условий использования. Полученные данные могут быть включены в базы данных по термодинамическим и другим физико-химическим свойствам. В связи с тем, что в настоящее время всё большое развитие получают модельные расчёты по прогнозированию различных свойств стеклообразующих систем, критерием достоверности которых по-прежнему остаются экспериментальные данные, полученные нами величины являются весьма значимыми.
Основные положения выносимые на защиту:
- Область стеклообразования в системе SrOB2O3SiO2.
- Порядок образования кристаллических фаз в области составов с содержанием 50-75 мол.% SrO, фазовая диаграмма псевдобинарной системы SrB2O4–SrSiO3, фрагменты изотермы ликвидуса.
- Концентрационные и температурные зависимости вязкости, ТКЛР, электропроводности, температуры стеклования, плотности, микротвёрдости, светопропускания стёкол и расплавов системы SrO–B2O3–SiO2.
- Термодинамические свойства, такие как активность, химический и избыточный химический потенциал, интегральная и избыточная энергия Гиббса для расплавов 17 составов в системах SrOB2O3 и SrOSiO2.
- Структуры и величины стандартных энтальпий образования и атомизации газообразных силикатов стронция SrSiO2 и SrSiO3.
Достоверность полученных данных.
Достоверность полученных результатов обусловлена применением в экспериментах стандартной измерительной аппаратуры, корректностью применения общепризнанных методик. Воспроизводимость полученных результатов подтверждается проведением неоднократных повторных экспериментов с использованием нескольких образцов. Стандартное отклонение определения физико-химических величин не превышало ±10 %.
Личный вклад автора.
Экспериментальные исследования, связанные с синтезом образцов, обработкой и анализом результатов, изучением физико-химических свойств исследуемых систем, таких как плотность, вязкость, микротвердость, коэффициент расширения, электропроводность, светопропускание, а также установление области стеклообразования, порядка фазообразования, и других свойств, осуществлялось непосредственно автором. Так же автором были изучены термодинамические свойства стронциевосиликатной и стронциевоборатной систем, освоена методика расчета структуры и термодинамических функций на основе методов квантовой химии с использованием программного комплекса GAMESS и метода статистической термодинамики в приближении «жесткий ротаторгармонический осциллятор».
Апробация работы.
Материалы диссертационной работы докладывались на 2-ой Международной Школе-семинаре «Масс-спектрометрия в химической физике, биофизике и экологии» (Звенигород, 2004), Всероссийской конференции «Химия твердого тела и функциональные материалы» (УрО РАН, Екатеринбург. 2004), XV Международной конференции по химической термодинамике в России (Москва, 2005), V Школе-семинаре «Актуальные проблемы современной неорганической химии и материаловедения» (Звенигород, 2005), Молодежных научных конференциях ИХС РАН (Санкт-Петербург 2004, 2005, 2008), XII Российской конференции «Строение и свойства металлических и шлаковых расплавов» (Екатеринбург. 2008).
Публикации.
По материалам диссертации опубликовано 14 работ, в том числе 6 статей в рецензируемых журналах перечня Высшей Аттестационной Комиссии.
Объем и структура работы. Диссертация изложена на 124 страницах, содержит 48 рисунков, 17 таблицы, состоит из введения, 3 глав, выводов и списка цитируемой литературы, включающего 100 наименований.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность темы диссертации, сформулирована цель, задачи исследования, научная новизна работы и практическая значимость, изложены основные положения, выносимые на защиту.
В первой главе дан обзор литературных данных, связанный с задачей и объектами настоящей работы. Проанализированы результаты современных исследований физико-химических свойств, таких как плотность, микротвёрдость, тепловое расширение, температура стеклования, вязкость, электропроводность, процессы парообразования и термодинамические свойства оксидов стронция, бора и кремния, бинарных систем SrO–B2O3, SrO–SiO2. Отмечено, что систематических исследований по изучению термодинамических свойств расплавов стронциевоборатной и стронциевосиликатной, а также физико-химических свойств стронциевоборосиликатной систем ранее не проводилось.
Вторая глава посвящена методике синтеза исследуемых образцов в количестве 137 составов, а также идентификации кристаллических фаз и определению температур фазовых переходов и температур плавления. Описана процедура получения экспериментальных данных физико-химических свойствах стёкол и расплавов системы SrO–B2O3–SiO2.
Рентгенофазовый анализ (РФА) образцов проводили на дифрактометре ДРОН УМ 1, температуры плавления и фазовых переходов определяли на высокотемпературном микроскопе (ВТМ), дериватографе Q–1500 D и дифференциальном сканирующем калориметре NETZSCH STA 429. Измерение вязкости выполнено на кварцевом вискозиметре методом изгиба. Тепловое расширение исследованных стекол измеряли на кварцевом дилатометре с малым измерительным усилием в режиме охлаждения и нагревания со стандартной скоростью 3±0.2 K/мин. Плотность образцов стекла определяли методом гидростатического взвешивания в этиловом спирте при температуре 25 °C. Микротвердость (по Виккерсу) измеряли на приборе ПМТ–3. Удельное сопротивление стекол измеряли на постоянном токе с помощью тераомметра Е6-13А. Спектральные зависимости светопропускания стёкол снимали на спектрофотометре U3410 «Hitachi». ИК-спектры поглощения получали на приборе FTIR-8300 «Shimadzu».
Для определения термодинамических свойств изученных расплавов систем SrO–B2O3 и SrO–SiO2 использовался метод высокотемпературной масс-спектрометрии, представляющий собой сочетание эффузионного метода Кнудсена с масс-спектрометрическим анализом состава пара. Работа выполнена на масс-спектрометре МС–1301 при энергии ионизирующих электронов 25 эВ. Температуру измеряли оптическим пирометром ЭОП-66. Образцы испаряли из сдвоенных однотемпературных молибденовых камер, нагреваемых электронной бомбардировкой. Величины активности компонентов расплавов в системах SrOB2O3 и SrOSiO2 определяли как методом дифференциальной масс-спектрометрии, используя индивидуальные оксиды в качестве стандартов, так и методом Белтона-Фруехана.
В третьей главе приведены и проанализированы экспериментальные результаты по концентрационной и температурной зависимости физико-химических свойств системы SrO–B2O3–SiO2 и составляющих бинарных.
Область стеклообразования в системе SrO–B2O3–SiO2. Область стеклообразования, очерченная по результатам настоящей работы, представлена на рис. 1. Граница области однофазных стёкол, лежащая в области с большим содержанием оксида стронция, расположена вблизи секущей 50 мол. % SrO и занимает промежуточное значение между результатами имеющихся работ, которые являются, на наш взгляд, в большей степени оценочными. Граница области однофазных стекол, лежащая в области с меньшим содержанием SrO в системе SrO–B2O3–SiO2 практически совпадает с границей области двухфазных стекол и расположена вблизи сечения 30 мол. % SrO, как и было показано другими авторами. Следует отметить, что в настоящей работе подтвердили положение области ликвации по наведению опалесценции после стандартной процедуры закалки.
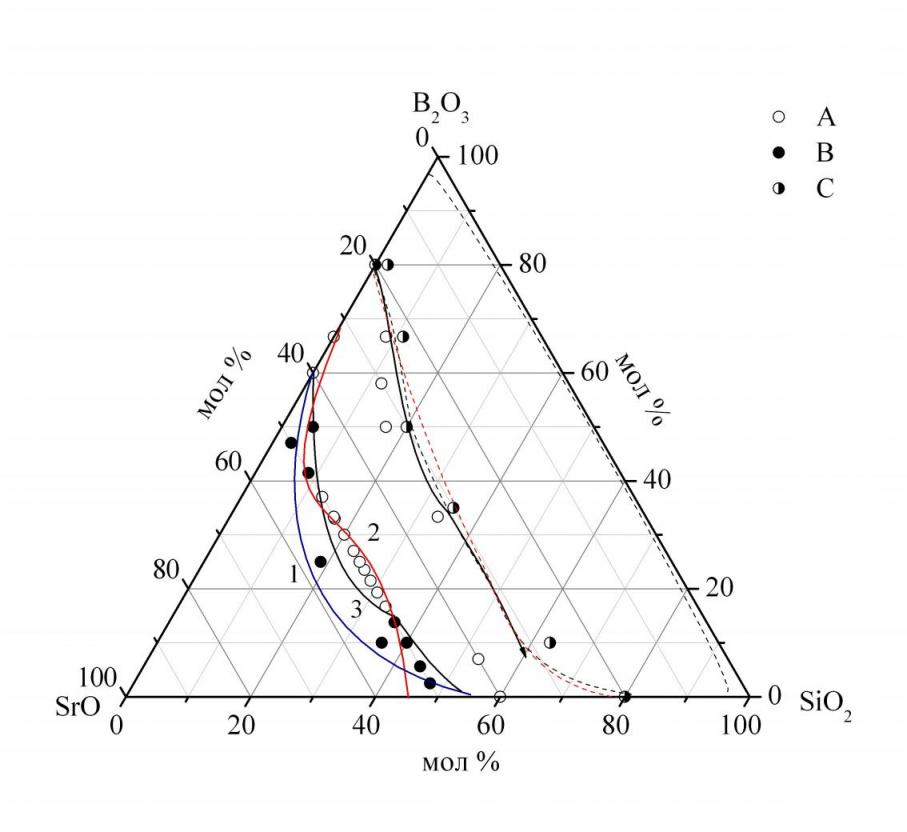
рис. 1. область стеклообразования в системе SrO–B2O3–SiO2, 1, 2 – литературные данные, 3–по данным настоящей работы (где A – стекло, B – закристаллизованные образцы, C – двухфазные стекла).
Порядок образования кристаллических фаз и линии ликвидуса в системе SrO–B2O3–SiO2. Для установления порядка образования кристаллических фаз в системе SrO–B2O3–SiO2, в области с большим содержанием оксида стронция методом твёрдофазового синтеза были получены образцы с концентрацией SrO 50, 66.6, 70 и 75 мол.%. РФА позволяет говорить о том, что во всех исследованных образцах, независимо от состава, при температурах 800–900 С в качестве первых кристаллических фаз образуются
соединения Sr2SiO4 и Sr3B2O6. В областях богатых SiO2, при содержании SrO >66.0 мол.%, наряду с Sr2SiO4, образуется Sr3SiO5, а при содержании SrO порядка 50.0 мол. % Sr2SiO4 реагирует с SiO2 и образуется SrSiO3. В области богатой B2O3, наряду с Sr3B2O6 образуется Sr2B2O5. При содержании SrO порядка 50.0 мол. %, Sr3B2O6 переходит в Sr2B2O5, а затем, при повышении температуры, в SrB2O4.
Можно отметить, что данные о порядке образования кристаллических фаз в исследуемой системе хорошо согласуются с величинами стандартной энтальпии образования (fH°(298 K)) кристаллических боратов и силикатов стронция.
Температуры эндотермических эффектов, полученные методом ДТА, и температуры плавления, полученные ВТМ, для образцов сечения SrB2O4–SrSiO3, позволили построить линию ликвидуса и обозначить линию солидуса в исследуемой системе. Обобщая полученные результаты, можно с уверенностью говорить о том, что секущая SrB2O4–SrSiO3 является псевдобинарной системой, а область эвтектики располагается в близи состава 21 мол.% B2O3 (рис. 2). Температуры плавления, полученные для четырех сечений 50, 66.6, 70 и 75 мол.% SrO позволили построить фрагменты изотерм ликвидуса (рис. 3), а также обозначить предполагаемую область тройной эвтектики в системе Sr3B2O6–Sr2B2O5–Sr2SiO4.
 | 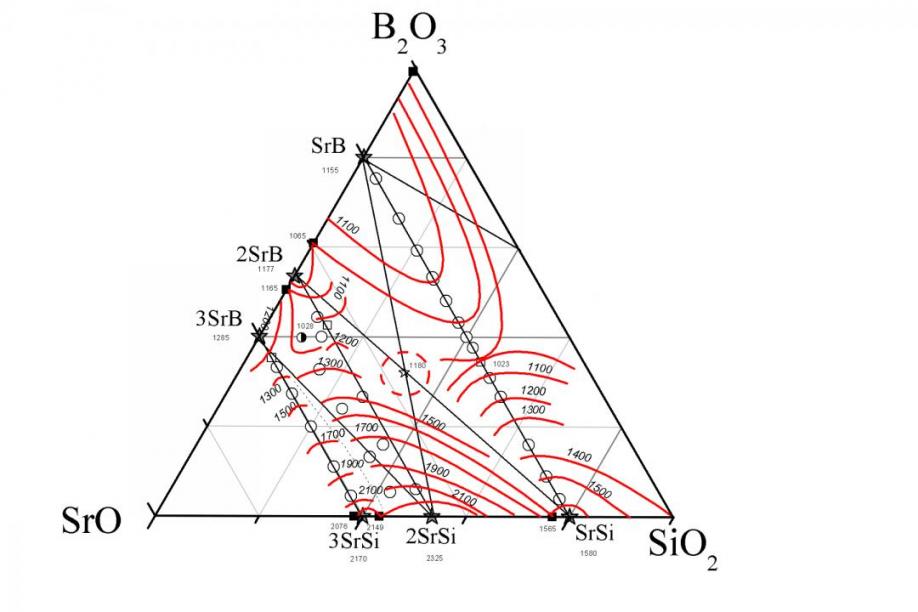 |
| Рис. 2. Линия ликвидуса и солидуса в псевдобинарной системе SrB2O4–SrSiO3, где (1 – данные ДТА, 2 – ВТМ). | Рис. 3. Изотермы ликвидуса в системе SrO–B2O3–SiO2, где Sr – SrO, B – B2O3, Si – SiO2; и – эвтектики, и – кристаллические соединения, – тройная эвтектика. |
Методом твердофазового синтеза из смеси SrCO3, H3BO3 и SiO2 было получено соединение Sr3B2SiO8, структура которого ранее была изучена в литературе. Методом ДСК определили его температуру конгруэнтного плавления, равную 1180±10 °C.
Физико-химические свойства стёкол и расплавов системы SrO–B2O3–SiO2
Вязкость. Температурная зависимость вязкости в интервале 1010–1013 пз для всех исследованных стекол является линейной и описывается уравнением Аррениуса. Энергия активации вязкого течения для расплавов стёкол системы SrO–B2O3–SiO2 лежит в интервале 398–588 кДж/моль. Отмечено, что с увеличением содержания SrO с 35 до 45 мол. % вязкость уменьшается. Это может быть вызвано увеличением количества немостиковых атомов кислорода и как следствие уменьшение степени связанности анионной матрицы. Замена SiO2 на B2O3 также приводит к значительному уменьшению вязкости (рис. 4), поскольку, вероятно, качественно и количественно изменяются единицы вязкого течения.
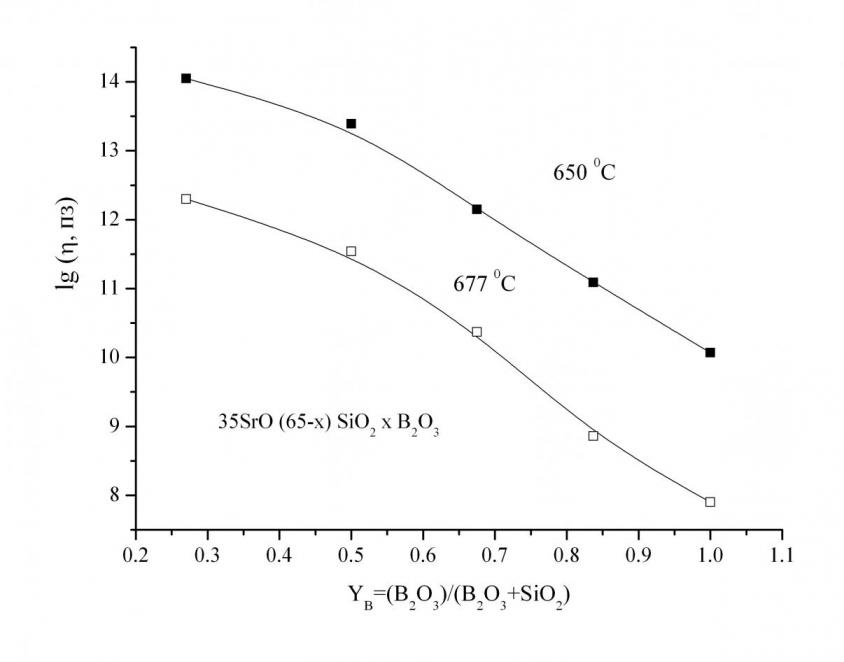 Рис. 4. Зависимость вязкости расплавов от содержания B2O3 и температуры.
Рис. 4. Зависимость вязкости расплавов от содержания B2O3 и температуры.
Термический коэффициент линейного расширения и температура стеклования (Тg). Для стекол и расплавов в системе SrO–B2O3–SiO2 были определены ТКЛР выше (![]() ) и ниже (
) и ниже (![]() ) интервала стеклования, а также Тg. Величина температуры стеклования хорошо согласуется с температурой, при которой вязкость расплава равна примерно 1013 пз, что указывает на корректность полученных нами результатов.
) интервала стеклования, а также Тg. Величина температуры стеклования хорошо согласуется с температурой, при которой вязкость расплава равна примерно 1013 пз, что указывает на корректность полученных нами результатов.
Можно отметить, что с увеличением мол. % B2O3, т.е. при переходе от силикатного к боратному стеклу с постоянным содержанием оксида стронция, Tg уменьшается экспоненциально (рис. 5). При постоянном значении YB величина температуры стеклования уменьшается с увеличением мол. % SrO, поскольку, вероятно, количество сильных ковалентных связей Si–O и B–O уменьшается, а ненаправленных ионных связей катиона с боратными или силикатными анионами увеличивается. В пользу данного факта свидетельствует то, что наблюдается отрицательное отклонение от аддитивности, т. е. Tg стёкол, содержащих два оксида стеклообразователя, ниже, чем это следовало бы из правила простой аддитивности. Причем величина отклонения увеличивается с увеличением содержания SrO.
При замене диоксида кремния на B2O3 ![]() увеличивается, проходя через максимум при YB=0.7, и затем снижается (рис. 6). Это происходит, вероятно, вследствие того, что количественно изменяется, а качественно увеличивается число структурно-химических группировок (к силикатным группировкам добавляются боратные), которые различным образом влияют на исследуемые свойства. Поскольку в системе SrO–B2O3–SiO2 существует соединение Sr3B2SiO8, плавящееся конгруэнтно, то наличие максимума на зависимости
увеличивается, проходя через максимум при YB=0.7, и затем снижается (рис. 6). Это происходит, вероятно, вследствие того, что количественно изменяется, а качественно увеличивается число структурно-химических группировок (к силикатным группировкам добавляются боратные), которые различным образом влияют на исследуемые свойства. Поскольку в системе SrO–B2O3–SiO2 существует соединение Sr3B2SiO8, плавящееся конгруэнтно, то наличие максимума на зависимости ![]() от состава может быть связано с доминирующим влиянием структурно-химической группировки соответствующего состава в исследованных расплавах.
от состава может быть связано с доминирующим влиянием структурно-химической группировки соответствующего состава в исследованных расплавах.
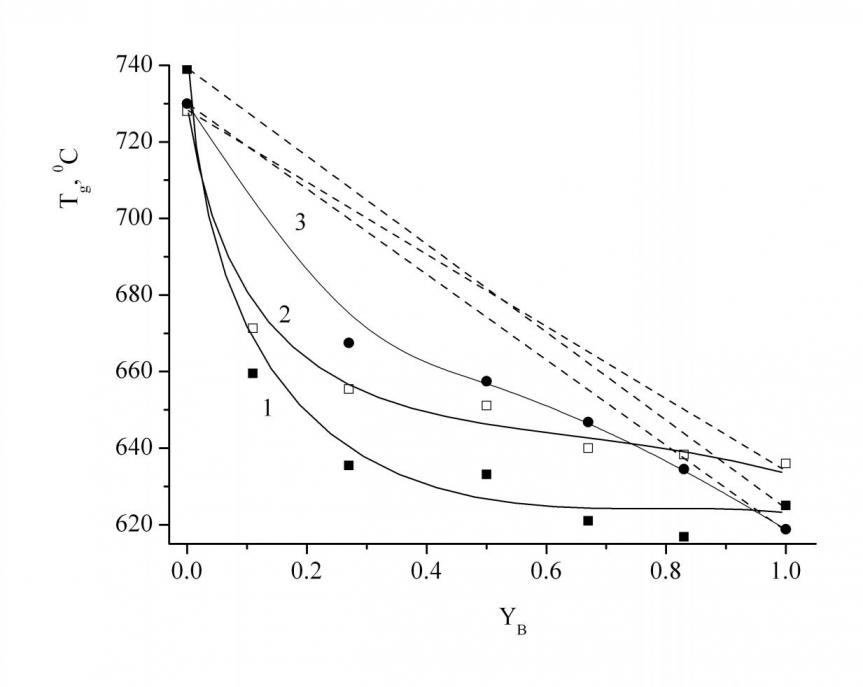 | 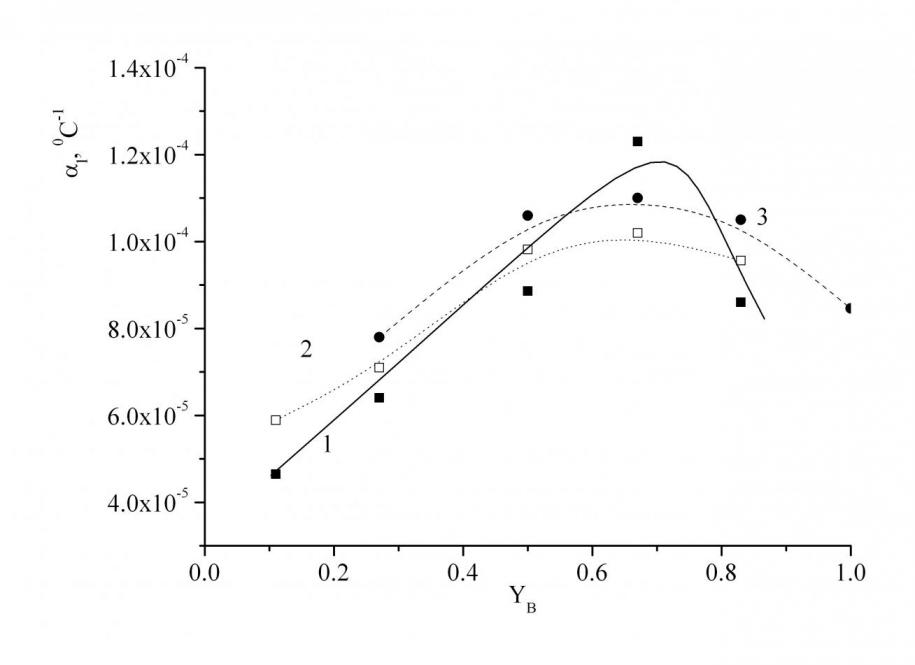 |
| Рис. 5. Зависимость Тg от концентрации B2O3 для серии стекол с содержанием SrO, равным 45 (1), 40 (2) и 35 (3) мол. %, (пунктиром обозначены линии аддитивности). | Рис. 6. Зависимость |
плотность и микротвердость. Установлено, что при замене SiO2 на B2O3 плотность уменьшается и достигает минимальных значений для боратных стекол. При увеличении содержания SrO плотность стекол возрастает независимо от соотношения B2O3 и SiO2. Полученные нами величины плотности стёкол тройной системы хорошо согласуются с данными для бинарных стёкол, имеющимися в литературе. По результатам определения плотности (d) и значениям молярной массы стекла (M) был вычислен молярный объём (Vмол) исследованных стёкол. С увеличением содержания B2O3 молярный объём стекол возрастает, причём для трёх сечений с различной концентрацией SrO величины Vмол очень близки (рис. 7). Таким образом, количество оксида модификатора в интервале 35–45 мол.% SrO практически не влияет на молярный объём стекла.
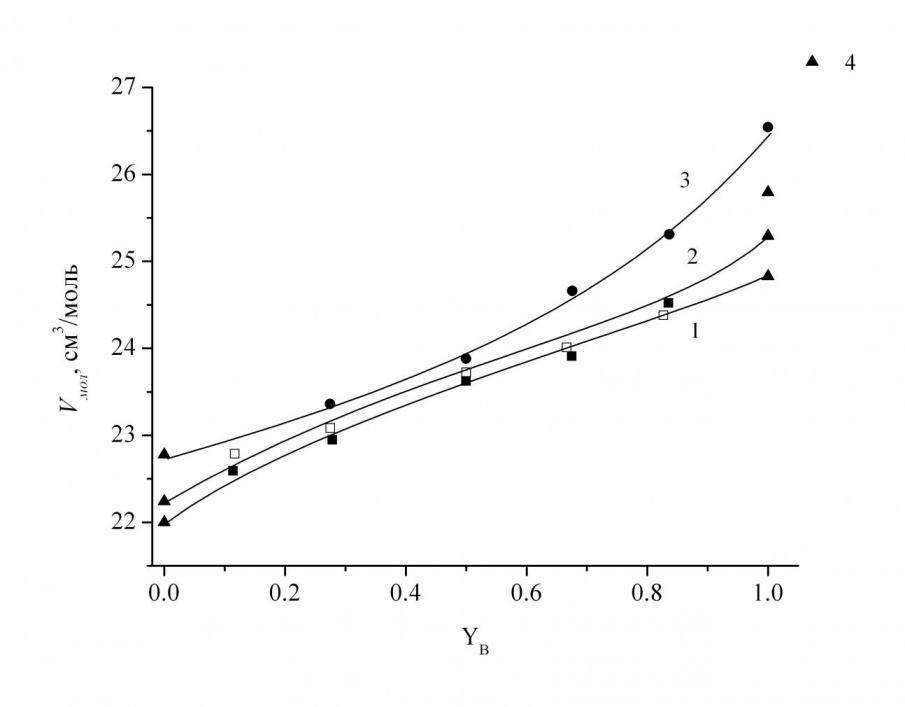 | 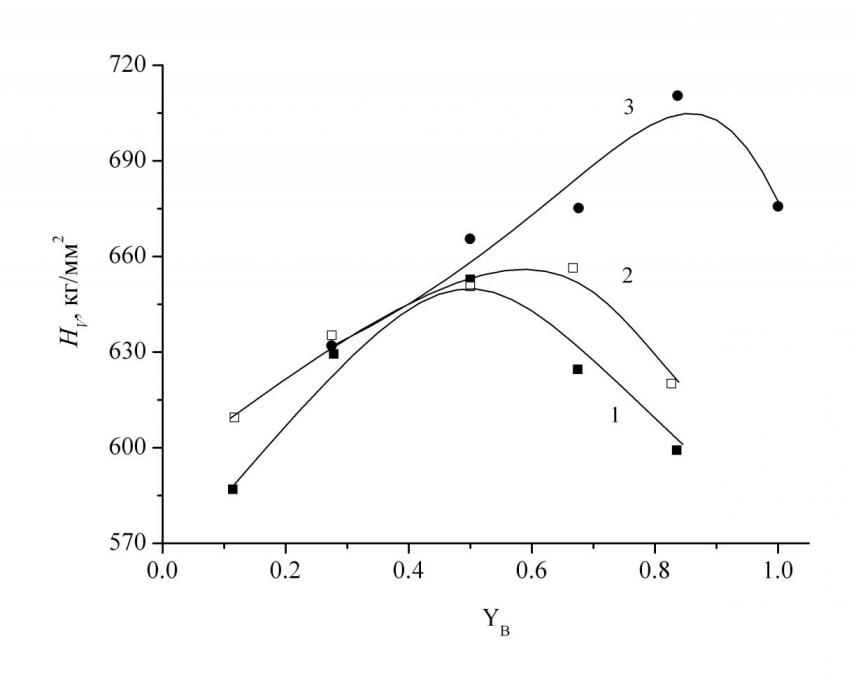 |
| Рис. 7. Зависимость Vмол от концентрации B2O3 для серии стекол с содержанием SrO, равным 45 (1), 40 (2) и 35 (3) мол. %, справочные данные (4). | Рис. 8. Зависимость HV от концентрации B2O3 для серии стекол с содержанием SrO, равным 45 (1), 40 (2) и 35 (3) мол. %, (при нагрузке 100г). |
Из концентрационных зависимостей микротвёрдости исследованных стёкол (рис. 8) видно, что с увеличением содержания B2O3 микротвёрдость возрастает, проходя через максимум, и затем снижается. Для стекол, в которых содержание SiO2 больше чем B2O3 величины микротвердости трех исследованных сечений практически совпадают.
Исходя из структуры бинарных боратных и силикатных стёкол можно предположить, что в области богатой B2O3 с увеличением содержания оксида стронция с 35 до 45 мол. % количество бора в четверной координации уменьшается, а количество бора в тройной координации с немостиковыми атомами кислорода увеличивается. В области богатой диоксидом кремния с увеличением содержания оксида стронция количество Q4 (кремнекислородные тетраэдры с четырьмя мостиковыми атомами кислорода) уменьшается, а Q2 (кремнекислородные тетраэдры с двумя мостиковыми атомами кислорода) увеличивается. Эти два обстоятельства, по-видимому, должны приводить к уменьшению степени связанности анионной матрицы стекла. Можно ожидать, что в областях близких к бинарным системам, свойства стёкол будут определяться либо боратными структурно-химическими группировками, либо силикатными структурно-химическими группировками, отвечающими по своей стехиометрии кристаллическим соединениям, имеющимся на фазовой диаграмме. Средняя область, вероятно, будет определяться суммарным вкладом как боратных, так и силикатных структурно-химических группировок, а также группировкой, отвечающей по стехиометрии соединению Sr3B2SiO8. Сравнение величин физико-химических свойств стронциевоборосиликатных стёкол с соответствующими величинами для бариевоборосиликатных стёкол, имеющимися в литературе, показало, что значения молярного объёма уменьшаются, в то время как значения температуры стеклования и микротвёрдости увеличиваются при замене бария на стронций. Подобная тенденция в изменении вышеуказанных свойств в бинарных боратных и силикатных стёклах при последовательной замене катиона в ряду барий – стронций – кальций, связана с увеличением силы поля катиона.
Электропроводность. Для стёкол системы SrO–B2O3–SiO2 при содержании SrO 35 мол.% получена температурная зависимость удельного сопротивления () в интервале температур 250–550 °C. Зависимость lg от обратной температуры для всех исследованных стёкол является линейной. Сопоставление значений энергии активации проводимости (E) и предэкспоненциального множителя в уравнении ![]() показывает, что исследованные стёкла попадают в область, для которой предполагается ионный характер проводимости. Анализ рис. 9 и 10 показал, что характер изменения электропроводности аналогичен изменению энергии активации. При добавлении SiO2 к боратному стеклу происходит некоторое повышение удельного сопротивления, а при YB равном 0.67 сопротивление уменьшается, а энергия активации резко снижается с 131 кДж/моль до 105 кДж/моль.
показывает, что исследованные стёкла попадают в область, для которой предполагается ионный характер проводимости. Анализ рис. 9 и 10 показал, что характер изменения электропроводности аналогичен изменению энергии активации. При добавлении SiO2 к боратному стеклу происходит некоторое повышение удельного сопротивления, а при YB равном 0.67 сопротивление уменьшается, а энергия активации резко снижается с 131 кДж/моль до 105 кДж/моль.
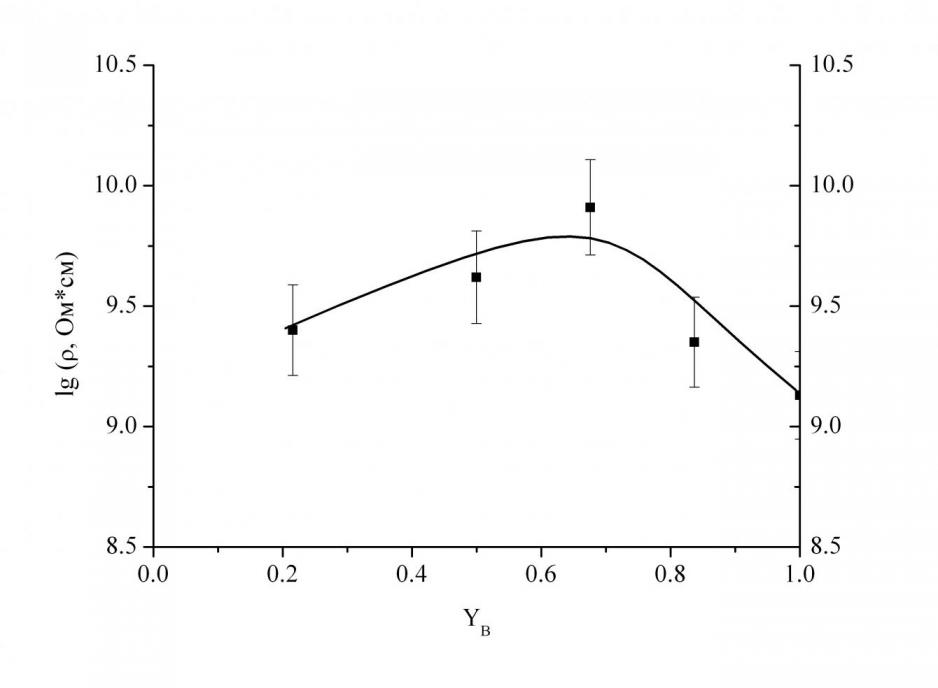 | 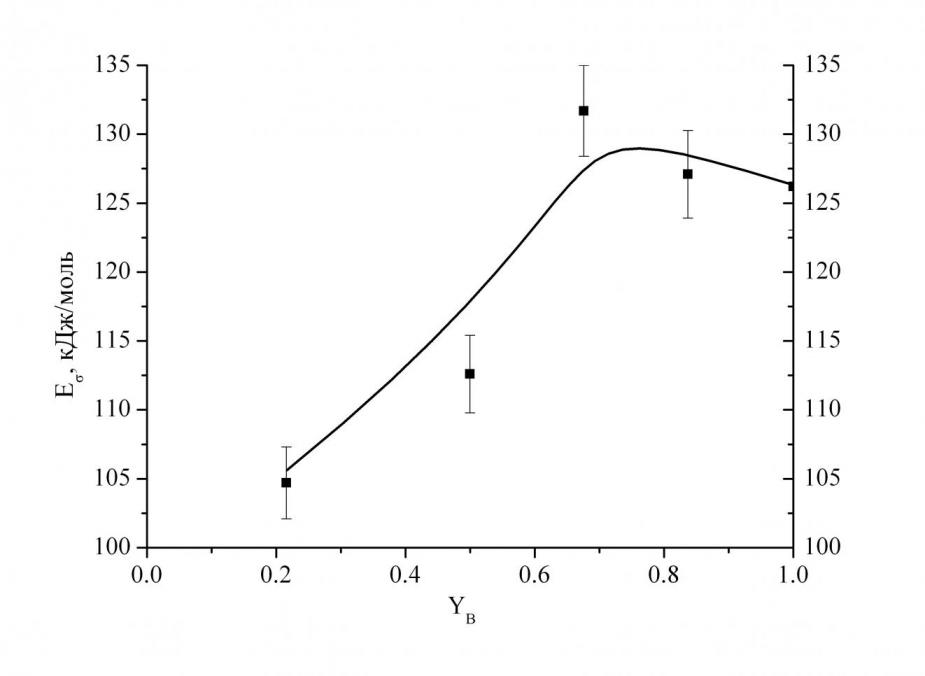 |
| Рис. 9. Зависимость lg стёкол в системе SrO–B2O3–SiO2 от содержания оксида бора при 35 мол.% SrO (при 500 °C). | Рис. 10. Зависимость E стёкол в системе SrO–B2O3–SiO2 от содержания оксида бора при 35 мол.% SrO. |
Можно отметить, что E бариевоборосиликатных стёкол выше, чем в стронциевоборосиликатных. Данный факт, с одной стороны, объясняется тем, что ион бария прочнее удерживается как силикатной, так и боратной сеткой, чем ион стронция в силу различия кислотно-основных свойств. С другой стороны, согласуется с моделью Андерсена и Стюарта, согласно которой E зависит от радиуса мигрирующего катиона и увеличивается при переходе от стронция к барию. Увеличение энергии активации при переходе от силикатного стекла к боратному, также хорошо согласуется с разницей кислотно-основных свойств между стронцием и двумя оксидами стеклообразователями.
Оптические свойства. Спектральные зависимости относительного светопропускания стекол с содержанием оксида стронция 45 мол.% представлены на рис. 11. Нижняя граница светопропускания, для всех исследованных стекол, лежит в области 240–270 нм.
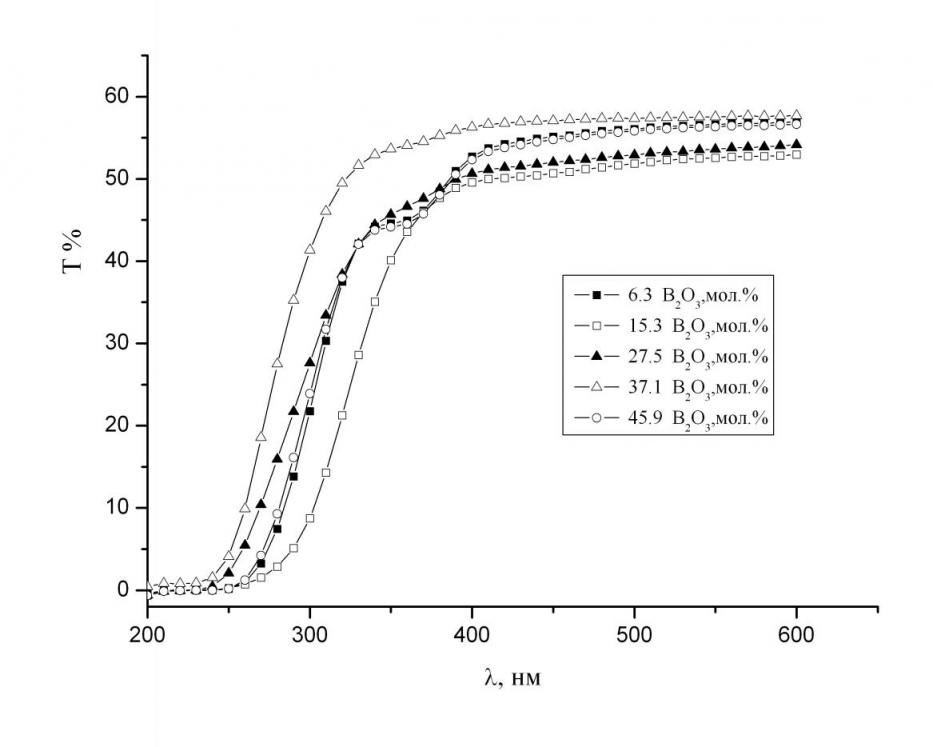
Рис. 11. Спектральные зависимости относительного светопропускания стекол с содержанием SrO 45 мол.%.
Термодинамические свойства расплавов системы SrO–B2O3 и SrO–SiO2
Система SrOB2O3. При анализе полученных масс-спектров установлено, что в паре над образцами системы SrOB2O3 в температурном интервале 15001630 K присутствуют молекулы B2O3 и SrB2O4. Активности компонентов системы определялись в области гомогенного расплава в концентрационном интервале от 10 до 67 мол. % SrO.
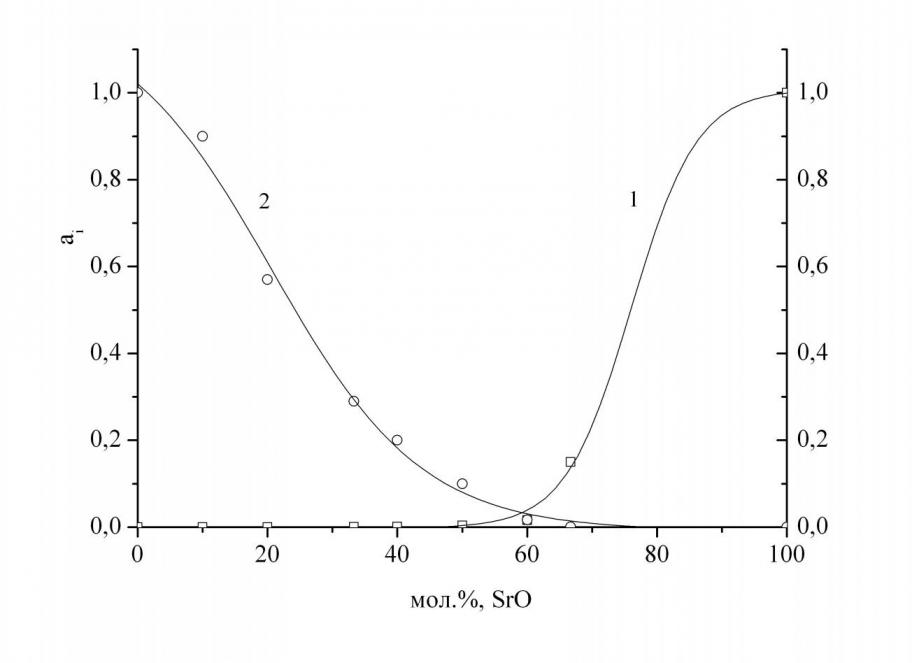 | 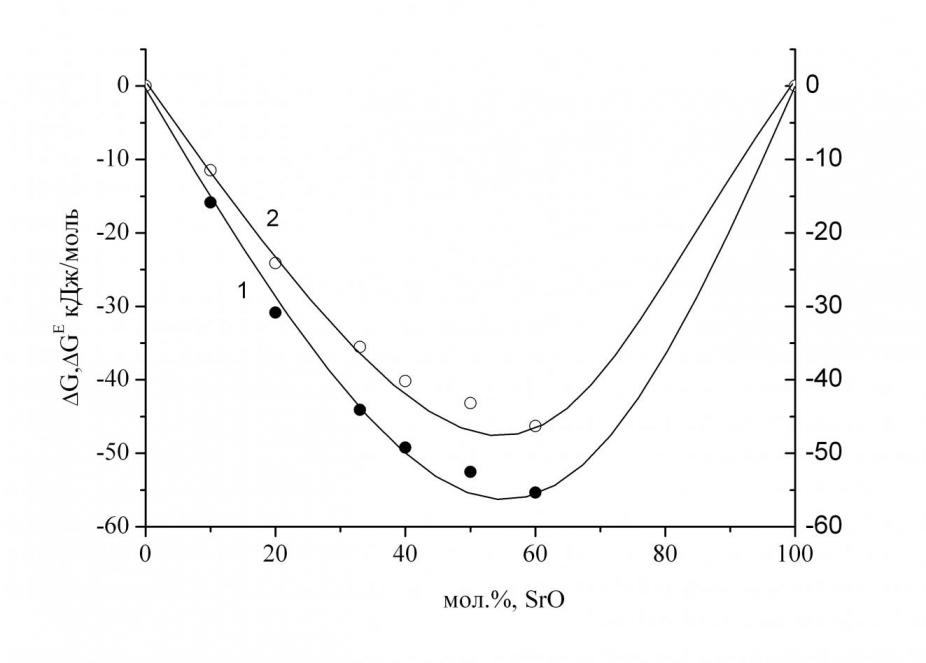 |
| Рис. 12. Зависимость активностей (аi) компонентов системы SrO–B2O3 от мол. % SrO при температуре 1620 K (1–SrO, 2–B2O3). | Рис. 13. Зависимость изменения энергии Гиббса в системе SrO–B2O3 от мол. % SrO при температуре 1620 K (1–G, 2GE). |
Анализ зависимости величин активностей компонентов расплава, G и GЕ от состава конденсированной фазы (рис. 12–13) указывает на то, что система SrO–В2О3 характеризуется значительным отклонением от идеального поведения, что связано с образованием термически прочных соединений в конденсированной фазе. Об этом же свидетельствует и факт присутствия в паре над системой SrO–В2О3 молекул SrВ2О4. Максимальное отклонение от идеального поведения наблюдается при эквимолярном составе, соответствующем по своей стехиометрии соединению SrВ2О4. Избыточные энергии Гиббса расплавов системы SrOВ2О3, полученные в настоящей работе, хорошо согласуются с литературными данными, согласно которых отклонения от идеальности становятся более отрицательными при переходе от системы СаO–B2O3 к BaO–B2O3, вследствие увеличения различия кислотно-основных свойств оксидов, образующих систему.
Система SrOSiO2. Анализ масс-спектров пара над образцами системы SrOSiO2 в температурном интервале 18401970 K показал, что пар состоит из смеси молекул SiO, SrО, Sr, МоO2, МоO3. Оксиды молибдена образуются при взаимодействии образцов с материалом камеры. Область гомогенного расплава в системе SrOSiO2, согласно фазовой диаграмме, в температурной области 18401970 K находится в концентрационном интервале от 20 до 66.7 мол. % SrO. Определенные величины активностей SrO и SiO2 (рис. 14) свидетельствуют о том, что исследованная система характеризуется значительным отклонением от идеального поведения, что подтверждается наличием силикатов стронция в конденсированной фазе согласно фазовой диаграмме системы SrO–SiO2. При образовании силикатного расплава из оксида стронция и диоксида кремния реализуется вариант с сильным химическим взаимодействием, при этом разрываются мостиковые связи SiOSi и образуются на их месте два концевых атомов кислорода. На зависимостях G и GЕ от состава конденсированной фазы (рис. 15) минимумы наблюдаются при составе ортосиликата стронция (Sr2SiO4), обусловленные тем, что при данном составе все мостиковые атомы и свободные атомы кислорода превращаются в немостиковые. Сравнение термодинамических данных, полученных для систем МОSiO2, где М = щелочноземельный металл, показало, что при одинаковом содержании оксида кремния, величины энергий Гиббса смешения становятся более отрицательными в ряду MgOCaOSrOBaO.
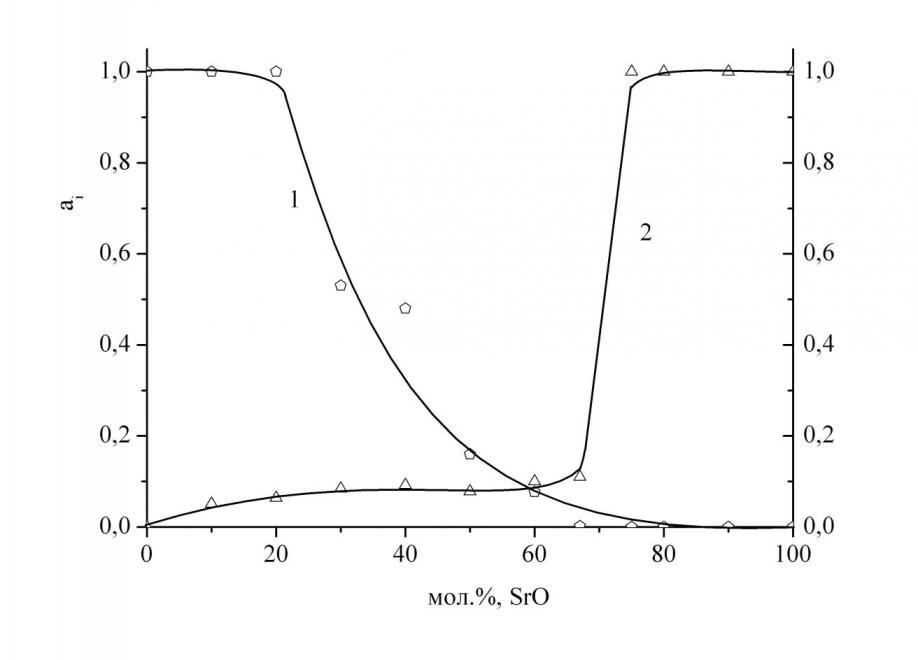 | 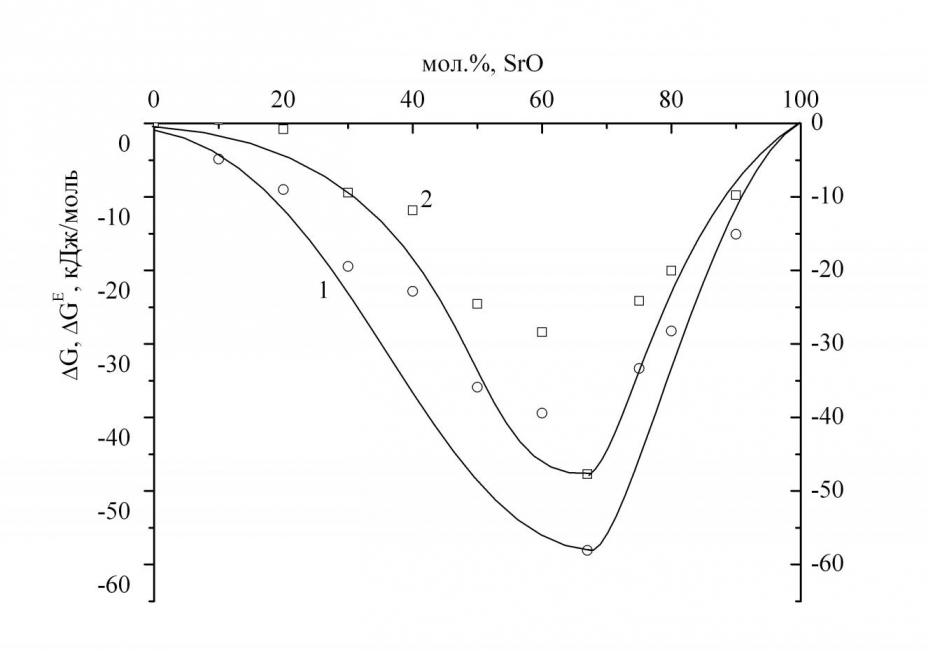 |
| Рис. 14. Зависимость активностей (ai) компонентов системы SrO–SiO2 от концентрации SrO в конденсированной фазе при 1970 K (1–SiO2; 2–SrO). | Рис. 15. Зависимость энергий Гиббса в системе SrOSiO2 от концентрации SrO в конденсированной фазе при 1970 K (1–G, 2GE). |
В масс-спектрах пара над образцами системы SrOSiO2 в температурном интервале 2180–2340 K, кроме ионов Sr+, SrО+, SiO+, SiO2+, регистрировались пики ионов SrSiO+, SrSiO2+ и SrSiO3+. Величины энергий появления ионов и сопоставление полученных результатов с литературными данными показали, что в паре, кроме атомарного стронция, оксидов стронция и кремния присутствуют и силикаты стронция.
Для определения стандартных энтальпий образования впервые обнаруженных газообразных силикатов стронция измеряли константы равновесия газофазных реакций (1, 2).
SrO + SiO = SrSiO2, (1)
SrO + SiO2 = SrSiO3. (2)
Необходимые для вычисления энтальпий реакций (1, 2) термодинамические функции газообразных оксидов брали из справочных данных, а для SrSiO3 и SrSiO2 (газ) рассчитывали методом статистической термодинамики в приближении «жесткий ротаторгармонический осциллятор». Для молекул SrSiО2 и SrSiO3 приняты циклические структуры симметрии С2v, аналогичные структурам молекул силикатов бария, представляющие собой плоский четырехугольник с атомами стронция и кремния, бидентатно связанными с атомами кислорода. Для температуры 298 K величины энтальпий реакций (1) и (2), вычисленные по II и III законам термодинамики, составили (кДж/моль) –366±48 и –360±5 для реакции (1) и –505±56 и –505±5 для реакции (2), соответственно. Комбинации средневзвешенных величин энтальпий реакций (1, 2) с энтальпиями образования газообразных SrO, SiO и SiO2 позволили вычислить стандартные энтальпии образования и атомизации газообразных силикатов стронция, равные соответственно (кДж/моль) 474±18 и 1583±20 для SrSiO2; 841± 20 и 2199±22 для SrSiO3.
Величины стандартных энтальпий образования газообразных силикатов стронция менее отрицательные, чем у силикатов бария, что хорошо согласуется с закономерностями изменения термической устойчивости газообразных солей кислородсодержащих кислот. Полученные в настоящем исследовании результаты, в совокупности с известными величинами энтальпий атомизации газообразных солей стронция, позволили получить для изокатионного ряда газообразных солей стронция зависимость величин стандартных энтальпий атомизации солей от энтальпий атомизации анионобразующих оксидов, представленную в виде уравнения (3). Коэффициенты k и b уравнения (3) составили 1.028±0.017 и 896.2±26.8, соответственно.
at 0(MmXOn, газ, 298) = at 0(XOn-1, газ, 298) + b (3)
Высокий коэффициент регрессии (0.998) и величина стандартного отклонения, равная 70.3, служат доказательством корректности определенных нами величин стандартных энтальпий образования и атомизации газообразных солей SrSiO2 и SrSiO3.
выводы
1. Границы области стеклообразования в системе SrO–B2O3–SiO2 лежат между секущими 30 и 50 мол. % SrO.
2. Установлено, что при температурах, порядка 900 °C, из смеси SrCO3, H3BO3 и SiO2, всегда образуются Sr3B2O6 и Sr2SiO4. Увеличение температуры приводит к образованию различных боратов и силикатов стронция, стехиометрия которых зависит от состава исходной смеси. Подтверждено существование и впервые определена температура плавления Sr3B2SiO8, равная 1180±10 °C
3. Построена фазовая диаграмма псевдобинарной системы SrB2O4–SrSiO3 и обозначены изотермы ликвидуса в тройной системе.
4. Установлено, что вязкость расплавов, температура стеклования уменьшаются при увеличении содержания оксида стронция и по мере замены SiO2 на B2O3. Коэффициент термического расширения, который слабо зависит от концентрации оксида модификатора, имеет максимум в области составов, обогащенных оксидом бора.
5. Показано, что величина молярного объёма возрастает с увеличением концентрации B2O3 и не зависит от содержания SrO.
6. В стеклах системы SrO–B2O3–SiO2 в разрезах с постоянным содержанием оксида стронция увеличение концентрации B2O3 приводит к росту удельного сопротивления и энергии активации электропроводности. Сопоставление параметров температурной зависимости указывает на ионный характер проводимости.
7. Методом высокотемпературной масс-спектрометрии, впервые определены термодинамические свойства (активности, химические и избыточные химические потенциалы компонентов, интегральная и избыточная энергии Гиббса) расплавов следующих систем:
- SrO–B2O3 в интервале концентраций от 10 до 66.6 мол. % SrO в интервале температур 1545–1620K;
- SrO–SiO2 в области составов от 10 до 90 мол. % SrO при температурах 1840–1970K;
Установлено, что в системах SrO–B2O3, SrO–SiO2 наблюдается отрицательное отклонение от идеального поведения системы. Обнаружен минимум энергии Гиббса для составов SrB2O4 и Sr2SiO4, что служит доказательством существования устойчивых химических группировок.
8. Впервые обнаружено существование и установлено строение газообразных силикатов стронция SrSiO2 и SrSiO3. Определены константы равновесия реакций газофазного синтеза этих солей из газообразных оксидов, а также величины стандартных энтальпий образования и атомизации газообразных силикатов стронция.
Список публикаций
- Столярова В.Л., Лопатин С.И., Шугуров С.М., Тюрнина Н.Г. Термодинамические свойства газообразных оксидов стронция. // Дан. 2006. т. 411. № 2. с. 220-222.
- Столярова В.Л., Тюрнина Н.Г., Лопатин С.И. Масс-спектрометрическое исследование процессов испарения и термодинамических свойств расплавов системы SrO–SiO2. // Дан. 2006. т. 411. №1. с.309-311.
- Тюрнина Н.Г., Лопатин С.И, Столярова В.Л. Термодинамические свойства силикатных стекол и расплавов II. Система SrO–SiO2. // ЖОХ. 2006. Т. 76. Вып. 12. С. 1966–1973.
- Лопатин С.И., Столярова В.Л., Тюрнина Н.Г., Тюрнина З.Г. Термодинамические свойства расплавов систем SrO–B2O3 и BaO–B2O3. // ЖОХ. 2006. Т. 76. Вып. 11. С. 1761–1767.
- Тюрнина Н.Г., Плотников Е.Н. Термодинамические свойства расплавов системы SrO–SiO2, рассчитанные на основе обобщенной теории ассоциированных растворов. // Физики и химии стекла. 2008. Т. 34. № 2. С. 182–188.
- Столяр С.В., Тюрнина Н.Г., Тюрнина З.Г., Доронина Л. А. Вязкость расплавов стёкол системы SrO–B2O3–SiO2. // Физика и химия стекла. 2008. Т. 34. № 4. С. 662–664.

