Синтез и комплексообразующие свойства стереоизомеров тетразамещенных по нижнему ободу п-трет-бутилтиакаликс[4]аренов, содержащих би- и поли функциональные группы
На правах рукописи
Жуков Аркадий Юрьевич
Синтез и комплексообразующие свойства стереоизомеров тетразамещенных по нижнему ободу
п-трет-бутилтиакаликс[4]аренов, содержащих би- и полифункциональные группы
02.00.03 Органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Казань – 2009
Работа выполнена на кафедре органической химии Химического института им. А.М.Бутлерова Государственного образовательного учреждения высшего профессионального образования “Казанский государственный университет им. В.И.Ульянова-Ленина” Министерства образования и науки Российской Федерации.
Научный руководитель: доктор химических наук, доцент
Стойков Иван Иванович
Официальные оппоненты: доктор химических наук, профессор
Пудовик Михаил Аркадьевич
кандидат химических наук, доцент
Гаврилова Елена Леонидовна
Ведущая организация: Институт элементоорганических соединений им. А.Н. Несмеянова РАН, г. Москва.
Защита диссертации состоится «19» ноября 2009 года в 14.30 ч. на заседании диссертационного совета Д 212.081.03 по химическим наукам при Казанском государственном университете им. В. И. Ульянова-Ленина по адресу: 420008, г. Казань, ул. Кремлёвская, 18, Химический институт им. А. М. Бутлерова, Бутлеровская аудитория.
С диссертацией можно ознакомиться в научной библиотеке им. Н.И. Лобачевского Казанского государственного университета. Отзывы на автореферат просим направлять по адресу: 420008, г. Казань, ул. Кремлёвская, 18, Казанский государственный университет, научная часть.
Автореферат разослан «___» октября 2009 г.
Ученый секретарь
диссертационного совета Д 212.081.03
кандидат химических наук, доцент М. А.Казымова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. В последние десятилетия приоритетным направлением развития органической химии является синтез обладающих заданными свойствами веществ, удовлетворяющих потребности современных областей науки и техники: химической, био- и нанотехнологии, фармацевтической химии, материаловедения, природоохранных технологий. В частности, бурное развитие биоорганической химии, молекулярной биологии, а также более глубокое понимание и применение принципов молекулярного распознавания, используемых при создании искусственных биомиметических систем, требует получения химических структур с заданным расположением в пространстве заместителей. Это необходимо для реализации определенных функций, например, переноса через мембрану, образования устойчивых комплексов с различными субстратами и т.д. Проблема связывания относительно простых субстратов - неорганических катионов и анионов - успешно решается в настоящее время благодаря стремительному развитию супрамолекулярной химии и пограничных с ней дисциплин. Однако задача связывания субстратов, содержащих несколько функциональных групп, например, амино- и гидроксикислот, биополимеров, в настоящее время является нерешенной и актуальной.
п-трет-Бутилтиакаликс[4]арен выгодным образом отличается от остальных представителей класса метациклофанов, прежде всего, легкостью функционализации гидроксильных групп нижнего обода с получением производных в конфигурациях конус, частичный конус, 1,3-альтернат и оптимальным размером полости, образуемой ароматическими фрагментами макроцикла. Это позволяет использовать его в качестве макроциклической платформы для создания эффективных комплексообразователей и экстрагентов. Известно, что производные п-трет-бутилтиакаликсарена, содержащие карбамоильные функции по нижнему ободу, используются в качестве комплексообразователей ряда низкомолекулярных субстратов, в частности, катионов щелочных металлов и серебра, галогенид-анионов. Установлено, что введение амидных групп в тиакаликсарен позволяет управлять связыванием «гостей» за счет наличия/отсутствия водородных связей между соседними NH-группами. В связи с этим, интересным представляется введение в нижний обод тиакаликсарена одновременно амидных и протонодонорных (протоноакцепторных) функций с целью создания комплексонов ди- и полифункциональных субстратов: гидрокси-, дикарбоновых кислот, белков, ДНК.
Целью работы является направленный синтез новых полифункциональных производных тиакаликсарена в конфигурациях конус, частичный конус и 1,3-альтернат, содержащих как протонодонорные (глицинатные, иминодиацетатные, гидроксильные), так и протоноакцепторные (пиридиновые и морфолиновые) группы по нижнему ободу, способных выступать в качестве синтетических рецепторов по отношению к ряду важных субстратов: анионам, гидрокси- и дикарбоновым кислотам, ДНК.
Научная новизна работы.
- Установлены особенности химического поведения функционализированных тиакаликсаренов в реакциях с рядом моно- и бифункциональных реагентов, связанные с пространственной организацией реакционных центров на макроциклической платформе.
- Предложены новые и оптимизированы известные пути синтеза полифункциональных производных тиакаликсаренов, обеспечивающие высокую хемоселективность реакции.
- Впервые синтезированы стереоизомеры тетразамещенных по нижнему ободу п-трет-бутилтиакаликс[4]аренов, содержащие одновременно вторичные амидные и глицинатные, иминодиацетатные, гидроксильные, пиридиновые, морфолиновые группы, структура соединений установлена комплексом физических методов; в том числе, впервые получены представители новых групп производных п-трет-бутилтиакаликс[4]арена – стереоизомеры конус, частичный конус и 1,3-альтернат, содержащие N-пропилморфолиновый, пиридилметиламидные, ацетамидный, диацетамидный фрагменты.
- Установлено, что производные тиакаликсарена, содержащие -гидроксиэтиламидные и -ацетилэтиламидные фрагменты по нижнему ободу, в конфигурации частичный конус наиболее эффективно связывают однозарядные анионы.
- Показано, что производные тиакаликсарена, содержащие изомерные амидо- и (амидометил)пиридиновые заместители по нижнему ободу, являются эффективными рецепторами на дикарбоновые и гидроксикислоты.
- Методом динамического светорассеяния установлено, что тиакаликсарены, содержащие протоноакцепторные группы (морфолиновые и (амидометил)пиридиновые), образуют с ДНК молоков лососевых рыб наноразмерные агрегаты.
Практическая значимость. Разработаны методы синтеза полифункциональных производных п-трет-бутилтиакаликс[4]арена в конфигурациях конус, частичный конус и 1,3-альтернат. На основе полученных экспериментальных данных по комплексообразованию однозарядных анионов с производными п-трет-бутилтиакаликс[4]арена выявлены закономерности, важные для молекулярного дизайна синтетических рецепторов. Показана возможность использования производных п-трет-бутилтиакаликс[4]арена, содержащих (амидометил)пиридиновые группы, в качестве синтетических рецепторов на некоторые дикарбоновые и гидроксикислоты. Впервые показано, что тетразамещенные по нижнему ободу п-трет-бутилтиакаликс[4]арены, содержащие морфолиновые и амидометилпиридиновые фрагменты, в конфигурации конус, частичный конус и 1,3-альтернат могут быть использованы для получения агрегатов с ДНК молоков лососевых рыб с гидродинамическим диаметром 600-1400 нм.
Апробация работы. Результаты исследований докладывались на XV Российской студенческой научной конференции Уральского государственного университета (Екатеринбург, 2005), X Международном семинаре по соединениям включения (ISIC-10) (Казань, 2005), IV международном симпозиуме “Дизайн и синтез супрамолекулярных архитектур” (Казань, 2006), X Молодежной конференции по органической химии (Уфа, 2007), XVIII Менделеевском съезде по общей и прикладной химии (Москва, 2007), XV Всероссийской конференции “Структура и динамика молекулярных систем” (Яльчик, Республика Марий-Эл, 2008), VIII Научной конференции молодых ученых, аспирантов и студентов научно-образовательного центра Казанского государственного университета “Материалы и технологии XXI века” (Казань, 2008), IV международной летней школе “Супрамолекулярные системы в химии и биологии” (Туапсе, 2008), I международном симпозиуме “Супрамолекулы и нанохимия: будущее применение SNCTA-2008” (Харьков, Украина, 2008), итоговой научной конференции Казанского государственного университета (Казань, 2007, 2008).
Публикации. По материалам диссертации опубликовано 3 статьи в международных журналах, 1 патент на полезную модель, а также 12 тезисов докладов в материалах различных конференций и симпозиумов.
Работа выполнена в рамках госбюджетной темы Минобрнауки РФ “Дизайн и закономерности молекулярного распознавания биологически значимых соединений природными и синтетическими наноразмерными рецепторами” (рег. № 1.11.06 308752), являющейся частью исследований по основному научному направлению “Строение и реакционная способность органических, элементоорганических и координационных соединений”. Исследования проводились при поддержке гранта РФФИ № 04-03-32178-а “Дизайн, синтез и применение синтетических рецепторов на основе функционализированных каликсаренов для молекулярного распознавания ряда катионов, обуславливающих радиоактивное загрязнение окружающей среды” (2004-2006), гранта РФФИ совместно с Инвестиционно-венчурным фондом Республики Татарстан № 04-03-97511-р_офи “Разработка супрамолекулярных систем каликс[4]арен-(био)полимер для создания сенсоров с регулируемой селективностью в отношении ряда биологически значимых соединений” (2006), грантов Федерального агентства по науке и инновациям № 2005-ИН-12.1/012 “Разработка <интеллектуальных> органических и гибридных наноструктурированных пленок” (2005-2006), № РИ-19.0/001/184 “Разработка супрамолекулярных систем на основе функционализированных тиакаликс[4]аренов как компонентов программируемых органических наноразмерных материалов следующего поколения”.
Объем и структура работы. Диссертационная работа изложена на 142 страницах машинописного текста, включает 47 рисунков и 25 таблиц. Состоит из введения, трех глав, выводов и списка использованных библиографических источников, включающего 114 ссылок. В первой главе представлен обзор литературных данных, касающихся современного состояния научного знания в области функционализации нижнего обода тиакаликс[4]арена. Основные результаты экспериментальных исследований и их обсуждение приведены во второй главе. Экспериментальная часть работы, включающая описание проведенных синтетических и спектральных экспериментов, а также экспериментов по изучению агрегации, приведена в третьей главе диссертации.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1 Синтез полифункциональных производных п-трет-бутилтиакаликс[4]арена
Задача синтеза полифункциональных производных тиакаликсарена к настоящему моменту не решена и представляется комплексной, поскольку взаимодействие макроцикла с би- и трифункциональными реагентами, как правило, приводит к смеси веществ, реакция часто протекает по нескольким направлениям, и возникают сложности при выделении целевого продукта. Для синтеза тетразамещенных по нижнему ободу п-трет-бутилтиакаликсаренов, содержащих би- и полифункциональные заместители, с хорошими выходами необходима высокая хемоселективность протекания реакции по каждой из четырех групп макроцикла. Кроме того, близкое расположение нескольких реакционных центров в молекуле тиакаликсарена оказывает влияние на конечные продукты реакций, - часто происходит образование трудноразделимых смесей макроциклов с разной степенью замещения в различных конфигурациях.
В качестве исходных реагентов для синтеза полифункциональных производных п-трет-бутилтиакаликс[4]арена мы остановили свой выбор на синтетически доступных стереоизомерах конус, частичный конус и 1,3-альтернат производных п-трет-бутилтиакаликс[4]арена – тетраэфирах 1-3 и тетракислотах 4-6. При получении амидов из тетраэфиров 1-3 на основе п-трет-бутилтиакаликс[4]арена возможно использование двух путей: а) прямой аминолиз тетраэфира соответствующим амином (рис.1a); б) гидролиз тетраэфиров на основе п-трет-бутилтиакаликс[4]арена до тетракислот, перевод последних в хлорангидриды и их обработка соответствующим амином в дихлорметане в присутствии основания (рис.1б).
Преимущества первого пути (рис.1а) очевидны: сокращение числа стадий синтеза, более простые методики выделения целевого соединения и, как следствие, увеличение выхода продукта. Однако условия, в которых происходит аминолиз, и требования к исходному амину накладывают ряд ограничений. Во-первых, как правило, используются только первичные амины. Во-вторых, легкоокисляющиеся и полимеризующиеся амины также не могут использоваться ввиду их высокой химической активности. Кроме того, на реакционную способность первичных аминов значительное влияние оказывает стерическая загруженность атома азота.
Второй путь (рис.1б) более универсален, подавляющее большинство первичных и вторичных аминов ацилируются хлорангидридом кислоты, причем с достаточно высокой скоростью. Однако, очевидным ограничением является высокая химическая активность ацилирующего агента, поскольку наличие в структуре амина других функций, например, гидроксильных групп или гетероциклических фрагментов, содержащих нуклеофильные центры, приводит к протеканию побочных реакций, резко уменьшая выход амида.
1.1 Синтез производных п-трет-бутилтиакаликс[4]арена, содержащих протоноакцепторные гетероциклические фрагменты по нижнему ободу
Была изучена возможность протекания реакции аминолиза тетраэфиров 1-3 2-, 3-, 4-амино- и 2-, 3-, 4-(аминометил)пиридинами, а также N-(3-аминопропил)морфолином. Даже после 10 ч выдерживания реакционной смеси при 160С по ТСХ не наблюдалось изменения количества исходных тетраэфиров. С увеличением времени и температуры происходило осмоление и окисление исходных амино- и аминометилпиридинов. Исследование аминолиза тетраэфиров 1-3 N-(3-аминопропил)морфолином в различных условиях показало, что либо образуются трудноразделимые смеси частично замещенных продуктов (согласно данным спектров ЯМР 1Н и ТСХ), либо реакция не идет. Варьирование условий аминолиза (применение полярных растворителей, таких как ТГФ, увеличение времени синтеза, изменение соотношений реагентов) не привело к получению целевых продуктов. Таким образом, получить целевые амиды, содержащие протоноакцепторные гетероциклические фрагменты по нижнему ободу прямым аминолизом, не удалось.
В связи с этим был использован второй подход (рис.1б): кипячением в тионилхлориде тетракислоты на основе п-трет-бутилтиакаликс[4]арена 4-6 были превращены в хлорангидриды, которые были введены в реакцию с N-(аминопропил)морфолином в дихлорметане в присутствии триэтиламина; выходы ожидаемых продуктов составили 90-95%.
Однако, в случае изомерных 2-, 3-, 4-амино- и 2-, 3-, 4-(аминометил)пиридинов целевые амиды были выделены с низкими выходами 10-30%, а в ряде случаев не удалось зафиксировать образование целевого продукта. Использование катализаторов (триэтиламин, пиридин, диметиламинопиридин, N,N-диметиланилин), варьирование температуры и природы растворителя не привели к заметному повышению выходов. Были выделены смеси различно замещенных производных, наблюдалось осмоление реакционной массы. В связи с полученными результатами методика синтеза амидопиридинов была модифицирована, для связывания выделяющегося хлороводорода был использован исходный амин. Также, для уменьшения вероятности протекания побочной реакции ацилирования по пиридиновому атому азота, температура синтеза была понижена до -5 С. Это привело к увеличению выходов до 60-80 %.

1.2 Синтез п-трет-бутилтиакаликс[4]аренов, содержащих остатки глицина и иминодиуксусной кислоты
Взаимодействием тетракислот 4-6 с хлористым тионилом были получены соответствующие хлорангидриды, которые обрабатывали гидрохлоридом метилового эфира глицина и иминодиуксусной кислоты в среде дихлорметана в присутствии триэтиламина. Далее был проведен гидролиз тетраамидов 27-32, содержащих фрагменты метиловых эфиров глицина и иминодиуксусной кислоты. В связи с тем, что соединения 27-32 содержат как амидный, так и сложноэфирный фрагменты, условия проведения гидролиза сложноэфирной группы должны быть достаточно мягкими, чтобы не началось разрушение амидной связи. Для этого был использован водный раствор гидроксида лития в тетрагидрофуране. Были получены кислоты в конфигурациях конус 33, 36, частичный конус 34, 37 и 1,3-альтернат 35, 38 с выходами 80-90 %.

Конфигурация тетразамещенных тиакаликс[4]аренов 27-32 была установлена по мультиплетности и величинам хим.сдвигов сигналов оксиметиленовых и трет-бутильных протонов в спектрах ЯМР 1H. Частичный конус 28 является единственным стереоизомером, обладающим тремя неэквивалентными трет-бутильными группами, проявляющимися в спектрах ЯМР 1H в виде трех синглетов с соотношениями интенсивностей 2:1:1.
В спектрах ЯМР 1H тетраамидов 27 (рис.2) и 29, находящихся в конфигурациях конус и 1,3-альтернат, соответственно, и имеющих более симметричную структуру, чем частичный конус, картина значительно упрощается: наблюдаются синглеты протонов трет-бутильных, метильных и оксиметиленовых групп, а также ароматических колец макроцикла. Амидные и амидометиленовые протоны проявляются в виде триплета и дублета соответственно, с константой спин-спинового взаимодействия 5.8 Гц.

Рис.2. Спектр ЯМР 1Н соединения 27 (в CDСl3, 25 С, 300 МГц).
В конфигурации 1,3-альтернат протоны -ОСН2С(О)- групп находятся в области экранирования двух смежных арильных фрагментов, и их сигнал проявляется в более сильном поле, чем сигнал соответствующих протонов стереоизомера конус (4.09 и 4.90 м.д., соответственно). трет-Бутильные протоны стереоизомера 1,3-альтернат находятся в зоне дезэкранирования двух смежных арильных фрагментов, поэтому сигналы трет-бутильных групп обычно проявляются в более слабых полях по сравнению с сигналами протонов трет-бутильных групп стереоизомера конус (1.19 и 1.10 м.д., соответственно). Таким образом, структуры соединений 27 и 29 отвечают стереоизомерам конус и 1,3-альтернат, соответственно.
2.3 Синтез п-трет-бутилтиакаликс[4]аренов, содержащих сложноэфирные и амидные фрагменты
Было исследовано взаимодействие тетраэфиров 1-3 с бифункциональным реагентом - этаноламином. Реакция тетраэфиров на основе п-трет-бутилтиакаликс[4]арена 1-3 с этаноламином была изучена в различных условиях. В качестве растворителей были выбраны тетрагидрофуран, этанол, диметилсульфоксид и этаноламин. Наиболее высокие выходы амидов 39-41 достигаются при проведении реакции в тетрагидрофуране. Следует отметить высокую региоселективность реакции – в изученных условиях протекает только аминолиз, продуктов переэтерефикации обнаружить не удалось.

Далее было изучено ацилирование этаноламина хлорангидридами тетракислот 4-7. Оказалось, что тетрамиды 39-41 образуются селективно с высокими выходами (80-95 %). Следует отметить, что выходы тиакаликс[4]аренов 39-41 при ацилировании аминоспирта ниже, чем при аминолизе сложных эфиров 1-3.
При ацилирования макроциклов 39-41 хлор- и бромангидридами карбоновых кислот (уксусной и бензойной) образовывалась смесь продуктов, разделить которую не удалось. По-видимому, это связано с высокой химической активностью использованных галогенангидридов. Кроме того, выделяющийся в ходе этой реакции галогеноводород способен реагировать с невступившими в реакцию гидроксильными группами исходного макроцикла. Оказалось, что в ряду ангидридов янтарной, бензойной и уксусной кислот в реакцию с тетраамидами на основе п-трет-бутилтиакаликс[4]арена 39-41 вступает только ангидрид уксусной кислоты, а в остальных случаях были количественно выделены исходные макроциклы 39-41. Реакция с уксусным ангидридом протекает в тетрагидрофуране в течение 3 часов с высокими выходами для всех трех стереоизомеров 42-44.
Структура полученных производных п-трет-бутилтиакаликс[4]арена была охарактеризована комплексом физических методов – ЯМР 1Н и 13С, ИК-спектроскопией, масс-спектрометрией. Например, в ЯМР 1Н спектрах в ДМСО-d6 соединений конус 39 и 1,3-альтернат 41 (рис.3) наблюдается одинаковое количество и мультиплетность сигналов протонов: протоны трет-бутильных, оксиметиленовых и ароматических фрагментов проявляются в виде синглетов; амидные протоны заместителей – в виде триплета с КССВ 5.9 Гц; протоны метиленовых групп при амидном фрагменте – в виде неразрешившегося дублета триплетов, а гидроксильные – в виде уширенного синглета.

Рис.3. Спектры ЯМР 1Н соединений 39 и 41 (в (CD3)2SO, 25 С, 300 МГц).
2 Изучение комплексообразующих свойств синтезированных производных п-трет-бутилтиакаликс[4]арена
2.1 Изучение экстракционных свойств тетразамещенных по нижнему ободу п-трет-бутилтиакаликс[4]аренов, содержащих -гидроксиэтиламидные и -ацетилэтиламидные фрагменты, по отношению к однозарядным анионам
Синтетические рецепторы успешно применяются для молекулярного распознавания, разделения и определения различных биологически значимых соединений. Хорошо известно, что анионы играют ключевую роль во многих биологических и химических процессах. С целью изучения влияния ряда структурных факторов (конфигурации макроцикла и природы заместителей) на комплексообразующие свойства тетразамещенных по нижнему ободу п-трет-бутилтиакаликс[4]аренов методом ЯМР 1Н спектроскопии в дейтерохлороформе была проведена оценка рецепторной способности стереоизомеров 39-44 – конус, частичный конус и 1,3-альтернат, содержащих -гидроксиэтиламидные и -ацетилэтиламидные фрагменты, по отношению к анионам различного типа: сферическим (F-, Cl-, Br-, I-), Y-образным (СН3СОО-), тригональным (NO3-), и тетраэдрическим (Н2РО4-) (табл. 1).

В качестве критерия эффективности связывания анионов использовались изменения в химических сдвигах амидных, гидроксиметиленовых и арильных протонов макроцикла (табл. 1). При взаимодействии со всеми изученными анионами (F-, Cl-, Br-, I-, СН3СОО-, NO3-, Н2РО4-) величины смещения химических сдвигов сигналов амидных и оксиметиленовых ОСН2СО протонов макроциклов 39-44 уменьшаются в ряду частичный конус > конус >> 1,3-альтернат. Также было установлено, что в случае стереоизомера тиакаликс[4]арена частичный конус (рис.4) образуемая заместителями псевдополость по размеру и расположению центров связывания наиболее предорганизована для взаимодействия с изученными анионами, в то время как в случае стереоизомера 1,3-альтернат центры связывания экранированы объемными трет-бутильными группами.
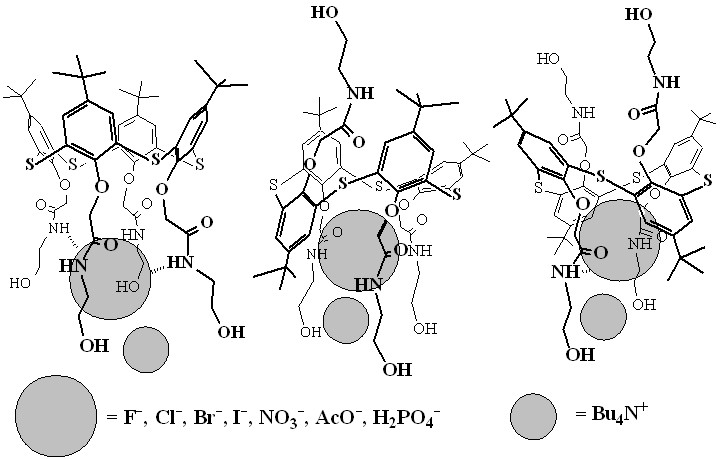
Рис.4. Предполагаемая схема связывания анионов тиакаликсаренами 39-44.
Таблица 1. Величины изменений химических сдвигов протонов () макроциклов 39-44 при взаимодействии с анионами (макроцикл:анион = 1:10, CDCl3, 25 C).
| макроцикл | протоны | , м.д. | |||||||
| F- | Cl- | Br- | I- | H2PO4- | CH3COO- | NO3- | |||
| 39 | ArH | -0.09 | -0.1 | -0.06 | -0.07 | -0.08 | -0.08 | -0.05 | |
| OCH2 | -0.02 | -0.05 | -0.07 | -0.07 | 0.03 | -0.04 | -0.05 | ||
| NH | - | 0.22 | 0.12 | 0.01 | 0.68 | 0.57 | 0.09 | ||
| 40 | NH (A) | - | 0.39 | 0.33 | 0.22 | 0.85 | 0.63 | 0.43 | |
| NH (В) | - | 0.68 | 0.43 | 0.12 | 1.30 | 1.29 | 0.47 | ||
| NH (C) | - | 1.07 | 1.01 | 0.72 | 1.72 | 1.62 | 1.52 | ||
| ArH (A) | -0.18 | 0.04 | 0.03 | 0.03 | 0.04 | 0.05 | 0.03 | ||
| ArH (В) | -0.06 | -0.05 | -0.06 | -0.04 | -0.01 | -0.04 | -0.03 | ||
| ArH (В’) | -0.29 | -0.19 | -0.18 | -0.13 | -0.21 | -0.26 | -0.23 | ||
| ArH (C) | -0.19 | -0.17 | -0.16 | -0.10 | -0.22 | -0.16 | -0.14 | ||
| OCH2 (A) | -0.03 | 0.02 | 0.02 | -0.01 | 0.06 | 0.16 | 0.20 | ||
| OCH2 (В) | 0.22 | 0.13 | 0.10 | 0.05 | 0.40 | 0.17 | 0.19 | ||
| OCH2 (В’) | - | -0.15 | -0.13 | -0.07 | -0.34 | -0.18 | -0.19 | ||
| OCH2 (C) | -0.12 | -0.26 | -0.27 | -0.21 | -0.24 | -0.24 | -0.23 | ||
| 41 | ArH | -0.2 | -0.14 | -0.11 | -0.07 | -0.12 | -0.15 | -0.07 | |
| OCH2 | 0.2 | 0.06 | 0.03 | 0.00 | 0.17 | 0.09 | 0.03 | ||
| NH | - | -0.21 | -0.20 | -0.14 | -0.18 | -0. 13 | -0.15 | ||
| HOCH2 | -0.26 | -0.11 | -0.09 | -0.06 | -0.15 | -0.06 | -0.07 | ||
| 42 | ArH | -0.08 | -0.07 | -0.07 | -0.05 | -0.07 | -0.08 | -0.04 | |
| OCH2 | 0.03 | -0.02 | -0.03 | -0.03 | 0.03 | 0.00 | -0.01 | ||
| NH | - | 0.32 | 0.17 | 0.06 | 0.81 | 0.70 | 0.20 | ||
| 43 | NH (A) | - | 0.16 | 0.05 | 0.02 | 0.27 | 0.18 | 0.12 | |
| NH (В) | - | 0.50 | 0.15 | 0.03 | 1.14 | 0.93 | 0.23 | ||
| NH (C) | - | 0.64 | 0.3 | 0.25 | 1.02 | 0.76 | 0.46 | ||
| ArH (A) | -0.05 | -0.08 | -0.03 | -0.05 | -0.05 | -0.06 | -0.04 | ||
| ArH (B) | -0.10 | -0.11 | -0.05 | -0.07 | -0.11 | -0.11 | -0.06 | ||
| ArH (B’) | -0.08 | -0.10 | -0.04 | -0.02 | -0.08 | -0.08 | -0.05 | ||
| ArH (C) | -0.12 | -0.12 | -0.06 | -0.07 | -0.12 | -0.12 | -0.07 | ||
| OCH2 (A) | -0.04 | -0.04 | -0.02 | -0.04 | -0.00 | -0.03 | -0.02 | ||
| OCH2 (B) | 0.16 | 0.14 | 0.07 | 0.04 | 0.19 | 0.13 | 0.08 | ||
| OCH2 (B’) | -0.20 | -0.19 | -0.09 | -0.10 | -0.25 | -0.21 | -0.13 | ||
| OCH2 (C) | 0.07 | 0.02 | 0.02 | -0.01 | 0.08 | 0.05 | 0.03 | ||
| 44 | ArH | -0.03 | -0.06 | -0.05 | -0.04 | -0.03 | -0.06 | -0.03 | |
| OCH2 | -0.04 | -0.06 | -0.05 | -0.04 | -0.03 | -0.05 | -0.03 | ||
| NH | - | -0.06 | -0.05 | -0.04 | -0.03 | -0.03 | -0.03 | ||
2.2 Изучение экстракционных свойств тетразамещенных по нижнему ободу п-трет-бутилтиакаликс[4]аренов, содержащих амидопиридиновые и (амидометил)пиридиновые фрагменты, по отношению к органическим кислотам
Одним из основных подходов к распознаванию белковых поверхностей является селективное связывание карбоксильных и карбоксилатных групп на поверхности водорастворимых белков. В связи с этим синтетические рецепторы карбоновых кислот перспективны как низкомолекулярные эффекторы белковых взаимодействий, открывающие пути к высокоэффективным лекарствам и диагностическим средствам. Эффективность и селективность взаимодействия макроциклов 7-23 с винной, щавелевой, гликолевой, малоновой, янтарной, фумаровой и малеиновой кислотами были оценены с помощью УФ-спектроскопии.

Спектрофотометрическое исследование растворов тиакаликс[4]аренов 7-23, содержащих амидометил- и амидопиридиновые фрагменты, с дикарбоновыми и гидроксикислотами в дихлорметане выявило изменения в электронных спектрах макроциклов при взаимодействии с изученными «гостями». Оказалось, что среди исследованных соединений наиболее существенные изменения наблюдаются для макроциклов, находящихся в конфигурации 1,3-альтернат (рис.5).
Методом построения кривых изомолярных серий была установлена стехиометрия, а методом разбавления была определена константа устойчивости для исследуемых комплексов в дихлорметане (рис.6, табл. 2). Стехиометрия для всех изученных систем составила 1:1. Значения логарифмов констант устойчивости комплексов тиакаликс[4]аренов 7-23 с рядом изученных дикарбоновых и гидроксикислот изменяются от 2.3 до 7.4 M-1, что свидетельствует об эффективном и, в ряде случаев, селективном связывании изученных «гостей». Очевидно, что взаимодействие макроциклов и субстратов возможно, в первую очередь, вследствие водородного связывания карбоксильных и гидроксильных групп кислот с пиридиновыми фрагментами заместителей «хозяев».
![УФ-спектр (1·10-6 М, 1 см кювета) в дихлорметане каликс[4]арена 15 (1)-8](/images1/345487/uf-spektr-1-10-6-sm-kyuveta-dihlorm.png)
Рис.5. УФ-спектр (1·10-6 М, 1 см кювета) в дихлорметане каликс[4]арена 15 (1) и его комплексов с некоторыми органическими кислотами: винной (2), щавелевой (3), гликолевой (4), малоновой (5), янтарной (6), фумаровой (7).

Рис.6. A) УФ-спектры комплекса тиакаликсарена 15 (1·10-5 М) с щавелевой кислотой в дихлорметане в соотношениях (мл) раствор комплекса/дихлорметан равными: 1) 9:1, 2) 4:1, 3) 7:3, 4) 3:2, 5) 1:1, 6) 2:3, 7) 3:7, 8) 1:4, 9) 1:9; где А - оптическое поглощение раствора. B) График Жоба для комплексообразования тиакаликсарена 15 и щавелевой кислоты, где А – наблюдаемое оптическое поглощение; АТС – оптическое поглощение раствора каликсарена; Ак – оптическое поглощение щавелевой кислоты.
Таблица 2. Значения логарифмов констант устойчивости (lgКа) комплексов каликсаренов 7-23 с некоторыми -гидрокси- и дикарбоновыми кислотами в CH2Сl2 (при 25 C).
| соединение | lgКа, M-1 | ||||||
| Винная кислота | Щавелевая кислота | Гликолевая кислота | Малоновая кислота | Янтарная кислота | Фумаровая кислота | Малеиновая кислота | |
| 7 | 4.2±0.2 | 4.6±0.1 | 4.8±0.3 | 3.5±0.3 | 4.6±0.2 | 4.5±0.1 | 4.8±0.1 |
| 8 | 3.9±0.1 | 4.6±0.1 | 4.1±0.2 | 4.1±0.0 | 4.4±0.2 | 4.9±0.2 | 5.5±0.1 |
| 9 | 2.5±0.2 | 3.3±0.2 | 2.3±0.1 | 3.1±0.1 | 2.7±0.2 | 2.4±0.2 | 4.7±0.1 |
| 10 | 3.5±0.2 | 2.6±012 | 2.4±0.1 | 3.2±0.2 | 3.2±0.2 | 3.0±0.3 | 4.9±0.1 |
| 11 | 5.1±0.1 | 4.8±0.2 | 5.2±0.2 | 5.1±0.2 | 5.0±0.1 | 4.1±0.2 | 3.7±0.1 |
| 12 | 6.7±0.1 | 5.8±0.2 | 5.7±0.0 | 5.4±0.2 | 4.2±0.1 | 2.8±0.1 | 5.3±0.1 |
| 13 | 4.8±0.1 | 5.9±0.2 | 4.7±0.2 | 5.2±0.2 | 4.8±0.1 | 4.8±0.1 | 4.3±0.2 |
| 14 | 3.7±0.1 | 6.3±0.2 | 3.9±0.2 | 5.6±0.2 | 3.9±0.2 | 4.0±0.2 | 2.3±0.1 |
| 15 | 5.5±0.2 | 7.1±0.1 | 4.2±0.0 | 6.1±0.1 | 5.1±0.2 | 4.3±0.0 | 4.9±0.1 |
| 16 | 4.9±0.2 | 3.8±0.0 | 4.9±0.3 | 3.7±0.2 | 3.2±0.1 | 3.9±0.2 | 5.5±0.1 |
| 17 | 5.9±0.0 | 5.6±0.0 | 5.9±0.2 | 5.4±0.0 | 5.1±0.1 | 4.9±0.1 | 6.7±0.1 |
| 18 | 7.0±0.2 | 5.5±0.1 | 7.4±0.2 | 4.5±0.2 | 4.9±0.2 | 4.9±0.2 | 5.4±0.1 |
| 19 | 3.9±0.2 | 4.9±0.0 | 3.9±0.1 | 4.7±02 | 3.2±0.3 | 3.7±0.2 | 5.8±0.1 |
| 20 | 3.9±0.1 | 5.4±0.0 | 4.8±0.0 | 5.3±01 | 4.6±0.3 | 2.7±0.0 | 6.7±0.1 |
| 21 | 4.9±0.2 | 4.8±0.2 | 5.5±0.0 | 5.2±0.2 | 4.4±0.2 | 4.8±0.2 | 6.3±0.2 |
| 22 | 3.0±0.2 | 5.4±0.0 | 2.5±0.2 | 5.4±0.2 | 2.5±0.2 | 3.3±0.0 | 6.8±0.1 |
| 23 | 5.2±0.1 | 6.2±0.1 | 5.2±0.0 | 5.4±0.2 | 4.4±0.2 | 4.9±0.0 | 5.2±0.1 |
±, стандартное отклонение
Исследование взаимодействия полученных синтетических рецепторов –полифункционализированных тетразамещенных по нижнему ободу п-трет-бутилтиакаликсаренов - с рядом однозарядных анионов, гидрокси- и дикарбоновых кислот показало, что полученные макроциклы способны к молекулярному распознованию изученных низкомолекулярных субстратов.
2.3 Исследование рецепторных свойств производных тиакаликс[4]арена, содержащих пиридиновые и аминоморфолиновые группы, по отношению к ДНК
В настоящее время необычайно интенсифицируется химический дизайн синтетических молекул, способных связываться с поверхностью биологических макромолекул и модифицировать физиологически и биотехнологически значимые межмолекулярные взаимодействия. Одной из областей применения наноразмерных агрегатов синтетических рецепторов с ДНК является создание синтетических векторов для доставки генетического материала в живые клетки. Это направление имеет высокий потенциал применения в научных исследованиях, биотехнологии и медицине.
Методом динамического светорассеяния была проведена оценка способности соединений, содержащих третичные аминные (морфолиновые) (24–26) и (амидометил)пиридиновые группы (16–19, 21, 22) образовывать супрамолекулярные ассоциаты с ДНК молоков лососевых рыб. Исследования проводились в фосфатном буферном растворе в физиологической области pH 7.5. Было установлено, что некоторые исследованные каликсарены образуют супрамолекулярные ассоциаты с ДНК при концентрации 10-5 М (табл.3).
Таблица 3. Комплексообразование ДНК с тиакаликс[4]аренами, содержащими пиридиновые и морфолиновые фрагменты.
| соединение | 16 | 17 | 18 | 19 | 21 | 22 | 24 | 25 | 26 | ДНК |
| диаметр частиц, нм | 588 | 734 | - | - | - | 970 | 897 | 980 | 1350 | 226 |
Были определены гидродинамические диаметры ассоциатов синтезированных тиакаликсаренов с модельной ДНК. Было установлено, что конфигурация макроциклов 24–26 не влияет на их способность к образованию наноразмерных агрегатов с ДНК, но влияет на размер образующихся агрегатов. Макроциклы 24–26, содержащие морфолиновые заместители, образуют наночастицы с ДНК, причем в ряду конус – частичный конус - 1,3-альтернат размер агрегатов увеличивается, в то время как каликсарены в конфигурации частичный конус и 1,3-альтернат, содержащие 2-(амидометил)пиридиновые заместители, не образуют наноразмерных агрегатов. Полученные результаты открывают новые возможности для создания систем для доставки генетического материала в живые клетки и разработки генотерапевтических препаратов.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И ВЫВОДЫ
1. Получены стереоизомеры тетразамещенных по нижнему ободу п-трет-бутилтиакаликс[4]аренов, содержащих одновременно вторичные амидные и глицинатные, иминодиацетатные, гидроксильные, пиридиновые, морфолиновые группы, структура соединений установлена комплексом физических методов (ЯМР 1Н и 13С, ИК спектроскопией, масс-спектрометрией); в том числе впервые получены представители новой группы производных п-трет-бутилтиакаликс[4]арена – стереоизомеры конус, частичный конус и 1,3-альтернат 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетракис[(N-пропилморфолин) амидокарбонил)метокси]-2,8,14,20-тетратиакаликс[4]арена, 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(пиридилметиламидокарбонил)метокси]-2,8,14,20-тетратиакаликс[4]арена, 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(пиридиламидокарбонил)метокси]-2,8,14,20-тетратиакаликс[4]арена, 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(ацетамидокарбонил) метокси]-2,8,14,20-тетратиакаликс[4]арена, 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(диацетамидокарбонил)метокси]-2,8,14,20-тетратиакаликс[4]арена.
2. Установлены условия хемоселективного образования амидных групп в реакции бифункционального реагента (аминоэтанола) со сложноэфирными группами стереоизомеров конус, частичный конус и 1,3-альтернат 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(этоксикарбонил)метокси]-2,8,14,20-тетратиакаликс[4]арена.
3. Показано, что, в отличие от реакций с первичными алифатическими аминами, аминолиз N-(3-аминопропил)морфолином сложноэфирных групп стереоизомеров конус, частичный конус и 1,3-альтернат 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(этоксикарбонил) метокси]-2,8,14,20-тетратиакаликс[4]арена приводит к трудноразделимой смеси частично замещенных по нижнему ободу производных, в то время как взаимодействие N-(3-аминопропил)-морфолина с хлорангидридами стереоизомеров конус, частичный конус и 1,3-альтернат 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(гидроксикарбонил)метокси]-2,8,14,20-тетратиакаликс[4]арена приводит к получению целевых амидов.
4. Установлено, что ацилирование хлор- и бромангидридами уксусной и бензойной кислот свободных гидроксильных групп -гидроксиэтиламидных фрагментов стереоизомеров конус, частичный конус и 1,3-альтернат 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетракис[1-(2`-гидроксиэтил)амидокарбонил)метокси]-2,8,14,20-тетратиакаликс[4]арена не приводит к образованию целевых тетразамещенных продуктов. Ангидриды янтарной и бензойной кислот не вступают в данную реакцию, продукт полного ацилирования четырех ОН групп с высоким выходом образуется при использовании уксусного ангидрида.
5. Установлено, что реакции хлорангидридов стереоизомеров конус, частичный конус и 1,3-альтернат 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(гидроксикарбонил)метокси]-2,8,14,20-тетратиакаликс[4]арена) с изомерными амино- и (аминометил)пиридинами приводят к образованию с хорошими выходами продуктов полного ацилирования только в случае использования в качестве основания самих исходных аминопиридинов. Применение в данной реакции широко известных оснований (триэтиламина, пиридина, диметиламинопиридина) не позволяет получить по данной реакции целевые амиды на основе всех трех стереоизомеров.
6. На примере стереоизомеров конус, частичный конус и 1,3-альтернат 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(метилацетамидокарбонил)метокси]-2,8,14,20-тетратиакаликс[4]арена и 5,11,17,23-тетра-трет-бутил-25,26,27,28-тетра[(диметил-ацетамидокарбонил)-метокси]-2,8,14,20-тетратиакаликс[4]арена показано, что для введения аминокислотных остатков на нижний обод тикаликсарена наиболее эффективными реагентами для проведения реакции с соответствующими хлорангидридами являются гидрохлориды метиловых эфиров аминокислот в присутствии триэтиламина.
7. Методом спектроскопии ЯМР 1Н установлено, что тетразамещенные по нижнему ободу п-трет-бутилтиакаликс[4]арены, содержащие -гидроксиэтиламидные и -ацетилэтиламидные фрагменты, в конфигурации частичный конус наиболее эффективны при связывании изученных однозарядных анионов по сравнению со стереоизомерами конус и 1,3-альтернат.
8. Найдены новые рецепторы, способные эффективно и селективно экстрагировать винную, щавелевую, гликолевую и малоновую кислоты в ряду структурно подобных соединений, – тетразамещенные по нижнему ободу п-трет-бутилтиакаликс[4]арены, содержащие амидо- и амидометилпиридиновые фрагменты. Установлены закономерности молекулярного дизайна рецепторов дикарбоновых и -гидроксикарбоновых кислот:
- производные п-трет-бутилтиакаликс[4]арена, содержащие амидометилпиридиновые фрагменты, более эффективно связывают -гидрокси- и дикарбоновые кислоты по сравнению с п-трет-бутилтиакаликс[4]аренами, содержащими амидопиридиновые фрагменты;
- при связывании геометрических изомеров (малеиновой и фумаровой кислот) в случае цис-изомера вследствие стерической предорганизации структуры субстрата достигаются более высокие значения констант устойчивости.
- в ряду стереоизомеров конус - частичный конус – 1,3-альтернат наибольшей эффективностью связывания кислот обладают производные п-трет-бутилтиакаликс[4]арена, содержащие амидо- и амидометилпиридиновые фрагменты в конфигурации 1,3-альтернат.
9. Впервые показано, что тетразамещенные по нижнему ободу п-трет-бутилтиакаликс[4]арены, содержащие морфолиновые и амидометилпиридиновые фрагменты, в конфигурации конус, частичный конус и 1,3-альтернат могут быть использованы для получения агрегатов с ДНК молоков лососевых рыб с гидродинамическим диаметром 600-1400 нм.
Основное содержание работы отражено в следующих публикациях
1. Evtugyn G.A. Ag selective electrode based on glassy carbon electrode covered with polyaniline and thiacalix[4]arene as neutral carrier [Text] / G.A. Evtugyn, I.I. Stoikov, S.V. Beljyakova, R.V. Shamagsumova, E.E. Stoikova, A.Yu. Zhukov, I.S. Antipin, H.C. Budnikov // Talanta.- 2007.- V.71.- I.4.- P.1720-1727.
2. Evtugyn G.A. Selectivity of solid-contact Ag potentiometric sensors based on thiacalix[4]arene derivatives [Text] / G.A. Evtugyn, I.I. Stoikov, S.V. Belyakova, E.E. Stoikova, R.V. Shamagsumova, A.Yu. Zhukov, I.S. Antipin, H.C. Budnikov // Talanta.- 2008.- V. 76.- I. 2.- P.441-447.
3. Жуков А.Ю. Синтез стереоизомеров тетразамещенных по нижнему ободу п-трет-бутилтиакаликс[4]аренов, содержащих вторичные амидные группы, и их комплексообразование с рядом однозарядных анионов [Текст] / А.Ю. Жуков, Т.А. Финк, И.И. Стойков, И.С. Антипин // Известия академии наук. Серия химическая.- 2009.- № 5.- C. 982-989.
4. Пленочный твердоконтактный потенциометрический сенсор для определения ионов серебра. Антипин И.С., Коновалов А.И., Стойков И.И., Жуков А.Ю., Евтюгин Г.А., Стойкова Е.Е., Будников Г.К. Патент на полезную модель № 61886 от 12.10.06.
5. Zhukov A.Yu. Thick-film potentiometric sensors based on pyridine containing thiacalix[4]arenes as synthetic metal receptors [Text] / A.Yu. Zhukov, I.S. Antipin, H.C. Budnikov // Book of abstracts of International Congress on Analytical Sciences (ICAS-2006). - Moscow, June 23-30, 2006.- V.1.- P.56.
6. Gafiullina L.I. Novel thiacalix[4]arene based receptors for cation recognition [Text] / L.I. Gafiullina, A.Yu. Zhukov, J.B. Puplampu, V.A. Smolentsev, I.I. Stoikov, I.S. Antipin, A.I. Konovalov // Book of abstracts of IV International Symposium “Design and Synthesis of Supramolecular Architectures”.- Kazan, May 13 – 17, 2006.- P.155.
7. Ситдиков Р.Р. Синтез стереоизомеров ряда аминопиридинов на основе п-трет-бутилтиакаликс[4]арена [Текст] / Р.Р. Ситдиков, Я.В. Небрадовская, А.Ю. Жуков, И.И. Стойков, И.С. Антипин // Сборник тезисов VII научной конференции молодых учёных, аспирантов и студентов научно-образовательного центра Казанского государственного университета «Материалы и технологии XXI века». – Казань, 26 – 27 апреля 2007. – С.115.
8. Алексеева О.В. Тетразамещённые по нижнему ободу п-трет-бутилкаликс[4]арены, содержащие сложноэфирные и амидные функции [Текст] / О.В. Алексеева, А.Ю. Жуков, И.И. Стойков, И.С. Антипин, А.И. Коновалов // X Молодёжная конференция по органической химии. - Уфа, 26-30 ноября 2007.– С. 30.
9. Жуков А.Ю. Синтез пиридинсодержащих тиакаликс[4]аренов-перспективных синтетических рецепторов [Текст] / А.Ю. Жуков, М.Н. Агафонова, И.И. Стойков, И.С. Антипин, А.И. Коновалов // Тезисы докладов XV всероссийской конференции «Структура и динамика молекулярных систем». - Яльчик, 2008.– С.74.
10. Жуков А.Ю. Синтез и пространственная структура стереоизомеров новых производных тиакаликс[4]арена [Текст] / А.Ю. Жуков, В.А. Смоленцев, И.И. Стойков, И.С. Антипин, А.И. Коновалов // Тезисы докладов XI всероссийской конференции «Структура и динамика молекулярных систем». - Яльчик, 2004.– С.103.
11. Жуков А.Ю. Синтез тетраамидов на основе тиакаликс[4]арена [Текст] / А.Ю. Жуков, В.А. Смоленцев, И.И. Стойков // Тезисы докладов XIV российской студенческой научной конференции «Проблемы теоретической и экспериментальной химии», посвященной 80-летию со дня рождения профессора В.Ф. Барковского. - Екатеринбург, 20-23 апреля 2004.– С.310-311.
12. Жуков А.Ю. Стереоселективный синтез пространственно предорганизованных соединений на основе п-трет-бутилтиакаликс[4]арена, содержащих амидные фрагменты [Текст] / А.Ю. Жуков, В.А. Смоленцев, Д.Ш. Ибрагимова, И.И. Стойков // Тезисы докладов XV российской молодежной научной конференции «Проблемы теоретической и экспериментальной химии», посвященной 85-летию Уральского государственного университета им. А.М. Горького.- Екатеринбург, 19-22 апреля 2005.– С.383-384.
13. Stoikov I.I. New thiacalix[4]arene N-containing derivates: synthesis and binding properties [Text] / I.I. Stoikov, A.Yu. Zhukov, L.I. Gafiullina, V.A. Smolentsev, I.S. Antipin, A.I. Konovalov // Book of abstracts of X International Seminar on Inclusion Compounds “ISIC-10”.-Kazan, September 18 – 22, 2005.- P.147.
14. Zhukov A.Yu. Synthesis and study of the complex agent capability of the new thiacalix[4]arene derivatives to a range of organic acids [Text] / A.Yu.Zhukov, M.N.Agafonova, I.I.Stoikov, I.S.Antipin, A.I.Konovalov // Book of abstracts of first International Simposium “Supramolecular and nanochemistry: toward applications”.- Kharkov, Ukraine, August 25 – 29, 2008.- P.1-6.
15. Zhukov A.Yu. The synthesis of new derivates of p-tert-butylthiacalix[4]arene:ligands of the contrast agents for magnetic resonance imaging [Text] / A.Yu.Zhukov, I.I.Stoikov, R.R.Amirov, I.S.Antipin, A.I.Konovalov // Book of abstracts of IV International Summer School “Supramolecular systems in Chemistry and Biology”.- Tuapse, September 28 – October 2, 2008.- P.142.
16. Жукова С.В. Агрегация стереоизомеров аминотиакаликс[4]арена с модельными ДНК [Текст] / С.В. Жукова, А.Ю. Жуков, И.И. Стойков, Г.А. Евтюгин, И.С. Антипин // Сборник тезисов VIII научной конференции молодых учёных, аспирантов и студентов научно-образовательного центра Казанского государственного университета «Материалы и технологии XXI века». – Казань, 28 – 29 октября 2008.– С.33.

