Ациклические аналоги нуклеозидов и их амфифильные производные
На правах рукописи
Шамшин Дмитрий Викторович
ациклиЧескиЕ аналогИ нуклеозидов
и ИХ АМФИФИЛЬНЫЕ ПРОИЗВОДНЫЕ
02.00.10 – Биоорганическая химия.
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Москва, 2006
Работа выполнена на кафедре Биотехнологии Московской государственной академии тонкой химической технологии им. М.В. Ломоносова.
Научный руководитель: доктор химических наук,
профессор Василенко И.А.
Официальные оппоненты: доктор химических наук,
профессор Юркевич Александр Морисович
доктор химических наук,
Балакин Константин Валерьевич
Ведущая организация: ЦХЛС - ВНИХФИ
Защита диссертации состоится «___»_____________ 2006 г. в «___» часов на заседании Диссертационного Совета Д212.120.01 при Московской государственной академии тонкой химической технологии им. М.В. Ломоносова (119571, Москва, пр. Вернадского, д. 86).
С диссертацией можно ознакомиться в библиотеке МИТХТ им. М.В. Ломоносова.
Автореферат разослан «___»_____________ 2006 г.
Ученый секретарь диссертационного Совета,
кандидат химических наук,
старший научный сотрудник Лютик А.И.
Общая характеристика работы.
Актуальность работы. В настоящее время в биохимии и медицине идет интенсивный поиск новых биологически активных веществ, обладающих антивирусной активностью. Среди потенциальных веществ подобного рода большое внимание уделяется аналогам нуклеозидов, в том числе, ациклическим аналогам нуклеозидов и их фосфорсодержащим и амфифильным производным. На их основе созданы и внедрены в практику такие препараты, как ацикловир, ганцикловир и др. (Erik De Clercq and Hugh J Field // Review. Antiviral prodrugs – the development of successful prodrug strategies for antiviral chemotherapy. / British Journal of Pharmacology. 2006. 147. Р. 1–11. published online 14 November 2005.).
Поиск эффективных противовирусных препаратов предполагает модификацию структуры нуклеозида. При выборе направлений химических модификаций необходимо исходить из следующих соображений: 1) поиск вещества, обладающего наибольшей активностью по отношению к молекулярной мишени; 2) модификация структуры нуклеозида, обеспечивающая перенос вещества во внутрь клетки. Такой подход связан с тем, что вещества проявляющие высокую активность по отношению к молекулярной мишени не проявляют активность на клеточном уровне всвязи с затрудненным транспортом через мембрану. Как правило, в процессе транспорта аналогов нуклеозидов через биологические мембраны лимитирующей стадией является их включение в мембрану. Для оценки способности аналогов нуклеозидов преодолевать биологические мембраны, необходим доступный метод изучения взаимодействия амфифильных аналогов нуклеозидов с мембранами, позволяющий оценить солюбилизирующую способность аналогов нуклеозидов.
Таким образом, актуальными представляются следующие направления работы: синтез новых аналогов нуклеозидов модифицированной структуры с целью поиска наиболее эффективного субстрата вирусных ДНК-полимераз; модификация структуры аналогов нуклеозидов, облегчающих их встраивание в мембрану; разработка метода изучения взаимодействия амфифильных аналогов нуклеозидов с модельными мембранами, позволяющего сделать сравнительную оценку солюбилизирующей способности модифицированных аналогов нуклеозидов по отношению к мембранам, для сравнения эффективности дальнейшей модификации аналогов нуклеозидов липофильными фрагментами.
Работа является частью научных исследований, проводимых на кафедре Биотехнологии МИТХТ им. М. В. Ломоносова в рамках госбюджетной темы „Синтез новых аналогов нуклеозидов – потенциальных агентов против ретровирусных инфекций и препаратов пролонгированного действия“ 1Б-21-866 (1994-1997гг).
Целями работы явились: 1) синтез новых ациклических аналогов нуклеозидов, обладающих противовирусной активностью и содержащих кратные связи в алкильном фрагменте; 2) установление связи „структура – биологическая активность“ синтезированных соединений; 3) для сравнения эффективности дальнейшей модификации аналогов нуклеозидов липофильными фрагментами – разработка метода изучения взаимодействия дейтерий меченых амфифильных аналогов нуклеозидов с мембранами методом 2H и 31P ЯМР-спектроскопии и 4) с целью отработки этого метода – синтез дейтерий меченого и немеченого амфифильного аналога нуклеозида.
Научная новизна. В настоящей работе предложены эффективные методы получения тринадцати новых ациклических аналогов нуклеозидов с кратными связями в алкильной части молекулы. По результатам тестирования полученных аналогов нуклеозидов установлена зависимость анти-ВИЧ-активности от их строения. Синтезированы новые амфифильные аналоги нуклеозидов, в том числе и с дейтериевой меткой. Для сравнения эффективности дальнейшей модификации аналогов нуклеозидов липофильными фрагментами, отработана методика изучения взаимодействия дейтерий меченых аналогов нуклеозидов с модельными мембранами посредством ЯМР-спектроскопии, позволяющая изучать кинетику процесса встраивания амфифильных аналогов нуклеозидов в мембрану и получать сравнительную оценку солюбилизирующей способности аналогов нуклеозидов.
Практическая ценность. Синтезированы новые аналоги нуклеозидов, проявляющие противовирусную активность. Некоторые из синтезированных нами аналогов нуклеозидов проявили хорошую активность (сравнимую с активностью азидотимидина) против ВИЧ на культуре лимфобластоидных клеток. Синтезирован дейтерий меченый и немеченый конъюгат дидезоксидидегидротимидина с додеканолом, с использованием которого разработана методика, позволяющая изучать взаимодействие амфифильных аналогов нуклеозидов с модельными мембранами и оценивать их солюбилизирующую способность, на основании чего можно оценивать способность аналогов нуклеозидов преодолевать клеточные мембраны.
На защиту выносятся следующие положения:
- Синтез алкильных синтонов состава С5: 5-ацетокси-1-бром-2-транс-пентена, 5-ацетокси-1,1-диметоксипент-2-ена.
- Использование последних для получения новых ациклических аналогов нуклеозидов, содержащих в качестве алкильного фрагмента 5-гидроксипентеновый и 5-гидрокси-1-метоксипентеновый остатки с природными и модифицированными азотистми основаниями.
- Корреляция активности со структурой синтезированных аналогов нуклеозидов на основе сравнительной оценки их анти-ВИЧ-активности.
- Синтез немеченого и дейтерий меченого конъюгата 3-О-додецил-1-О-фосфо-5-(2,3-дидезокси-2,3-дидегидро)-тимидина и 3-О-(-2H2)-додецил-1-О-фосфо-5-(2,3-дидезокси-2,3-дидегидро)-тимидина.
- Разработка методики исследования взаимодействия амфифильных аналогов нуклеозидов с модельной мембраной и сравнительной оценки солюбилизирующей способности амфифильных аналогов нуклеозидов на примере синтезированных конъюгатов методом 2H и 31P ЯМР-спектроскопии. На основании сравнительной оценки солюбилизирующей способности аналогов нуклеозидов можно оценивать способность этих аналогов нуклеозидов преодолевать биологические мембраны.
Публикации. По материалам диссертации опубликовано три статьи и тезисы четырех докладов.
Апробация работы. Материалы диссертационной работы частично изложены на конференциях: Abstr.14th International Symposium on Heterocyclic Chem. Antwerp August 1-6, P01-65, (1993г.); Abstr. 13th International Symposium on Medicinal Chemistry, Paris, P201, (1994г.); Юбилейная научная сессия, посвящённая 100-летию со дня рождения проф. Н. А. Преображенского, Россия, Москва, октябрь, 21-25, с. 145-146, 1996; Конференция „Наукоемкие технологии“, Россия, Москва, октябрь 25-29, с.179-180, 1999.
Структура и объем диссертации. Диссертационная работа изложена на ___ страницах, содержит ___ схем, ___ таблиц, ___ рисунков. Она состоит из введения, литературного обзора, обсуждения полученных результатов, экспериментальной части, выводов и списка цитируемой литературы ( ___ ссылок на литературные источники).
результаты работы и их обсуждение.
Несмотря на большое количество синтезированных аналогов нуклеозидов, обладающих потенциальной биологической активностью, интерес исследователей к новым ациклическим производным известных противовирусных препаратов не ослабевает. Какой должна быть структура нуклеозида для проявления им противовирусной, в частности, анти-ВИЧ активности, до сих пор не выяснено.
Очевидно, что целый ряд структурных параметров одновременно может обуславливать наличие или отсутствие биологической активности. Ранее высказано предположение, что одним из определяющих факторов для узнавания трифосфата нуклеозида ДНК-полимеразами является присутствие в молекуле „жесткого фрагмента“ с сохранением расстояния между N-1 (или N-9) атомом гетероцикла и 5-OH группой углеводного или ациклического фрагмента, имитирующее переходное состояние субстрата в компетентном для реакции комплексе ДНК-полимераз. Подтверждением этого предположения служит обнаружение у трифосфатов (Z)-гидроксипентеновых аналогов аденозина, тимидина и цитидина, синтезированных в нашей лаборатории ранее (1) (рис. 1), способности ингибировать синтез ДНК, катализируемый различными ДНК-полимеразами, в том числе ДНК-полимеразой ВИЧ. Основываясь на этом предположении нами осуществлен синтез новых аналогов нуклеозидов с ациклическим фрагментом С5 (2-5).
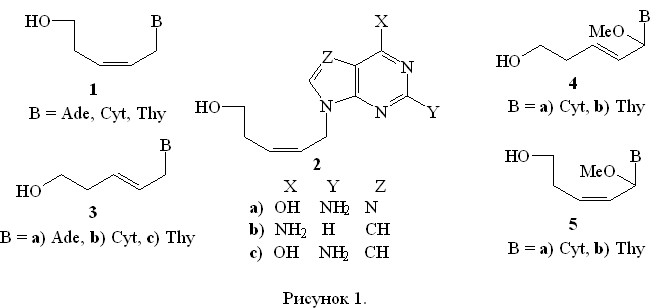
Синтез гуанидинового аналога (2а), которое по аналогии с ацикловиром, может оказаться также и противогерпесным препаратом, является логичным продолжением серии синтезов нуклеозидов типа (1). 7-Деаза-аналоги пуриновых нуклеозидов выбраны нами ввиду того, что дидезоксинуклеозиды, содержащие такие модифицированные основания, показали умеренную анти-ВИЧ активность in vitro. (E)-Производные синтезированы с целью проверки гипотезы о влиянии расстояния от 5-гидрокси-группы до атома азота гетероцикла на антивирусную активность аналогов нуклеозидов. Расстояния между атомом кислорода 5ОН-группы и атомом азота гетороциклов (N-1 или N-9), рассчитанные по программе hyperchem 6.01, для (Z)-изомеров близки к расстояниям в природных нуклеозидах, а для (E)-изомеров отличаются в большую сторону на 1,5-2. Метокси-соединения (4 и 5) выбраны нами исходя из предположения, что в процессе распознавания нуклеозидов при синтезе ДНК атом кислорода метокси-группы может имитировать кислород рибозного цикла природных нуклеозидов.
1. Синтез ациклических аналогов нуклеозидов.
1.1. Синтез аналогов нуклеозидов, содержащих цис-пентеновый фрагмент.
1.1.1. Получение исходного синтона для синтеза цис-пентеновых аналогов нуклеозидов.
В качестве ациклического фрагмента для синтеза производных (2а-c) был выбран (Z)-5-ацетокси-1-бромпент-2-ен (6) использовавшийся ранее для получения производных (1). Для получения бромида (6) применяли разработанную ранее методику с использованием легко доступных пропаргилового спирта и оксиэтилена (схема 1). Для защиты НО- группы в молекуле пропаргилового спирта использовали тетрагидропиранильную группу (Thp), устойчивую в условиях металлоорганического синтеза. Размыкание оксиэтилена проводили комплексом эфирата трехфтористого бора с Thp-защищенным пропаргилидом лития (получен с применением н-бутиллития) с образованием соединения (7), использованного далее как исходное для получения всей серии синтонов С5. Выход продукта составил 75%. Далее для получения бромида (6): ацетилировали хлористым ацетилом в пиридине в присутствии диметиламинопиридина (выход продукта (8) 92%), затем снимали Thp-защитную группу в метаноле с применением Dowex-50W (выход продукта (9) 70%), после чего гидрировали на катализаторе Линдлара в смеси гексана и этилацтата (выход продукта (10) 98%), бромировали в хлористом метилене тетрабромметаном в присутствии трифенилфосфина (выход продукта (6) 66%).
1.1.2. Синтез аналогов нуклеозидов, содержащих цис-пентеновый фрагмент.
Нами проведено сравнение эффективности применения различных методов конденсации на примере синтеза производного гуанина (2а). При введении в реакцию конденсации с (6) триметилсилильного производного N2-лауроилгуанина не удалось добиться удовлетворительных результатов ввиду низкой эффективности реакции (выход продуктов конденсации не превышал 10%) и большого числа побочных продуктов.
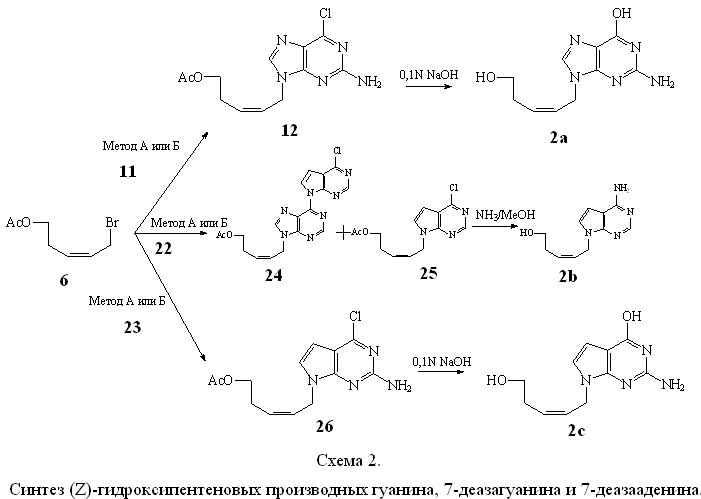
Другие использованные нами методы конденсации предусматривали предварительное получение соли 2-амино-6-хлорпурина (11) обработкой гидридом натрия (метод А) или КОН в присутствии 18-краун-6 (метод Б). Затем натриевую (или калиевую) соль гетероциклического основания выдерживали с бромидом (6) в DMF или ацето-
нитриле соответственно. Условия проведения реакции, и выход целевого продукта приведены в табл. 1. Оба метода нуклеозидной конденсации селективны: практически не наблюдалось образование других региоизомеров, кроме 9-замещенного 2-амино-6-хлорпурина. Наиболее эффективным оказался метод А (гидридный), позволивший получить замещенное (Z)-гидроксипентеновое производное гуанина (12) (схема 2) с выходом 52%. Удаление 5'-ацетокси-группы и замену Cl на ОН в гетероцикле проводили в одну стадию обработкой 0,1 N раствором NaOH, при этом выход 9-(5-гидрокси-2-пентен-1-ил)гуанина (2а) составил 66%. Структуру продукта конденсации (6) и (Z)-гидроксипентенового производного гуанина (2а) подтверждали методами УФ- и 1Н-ЯМР-спектроскопии (табл. 2, 3).
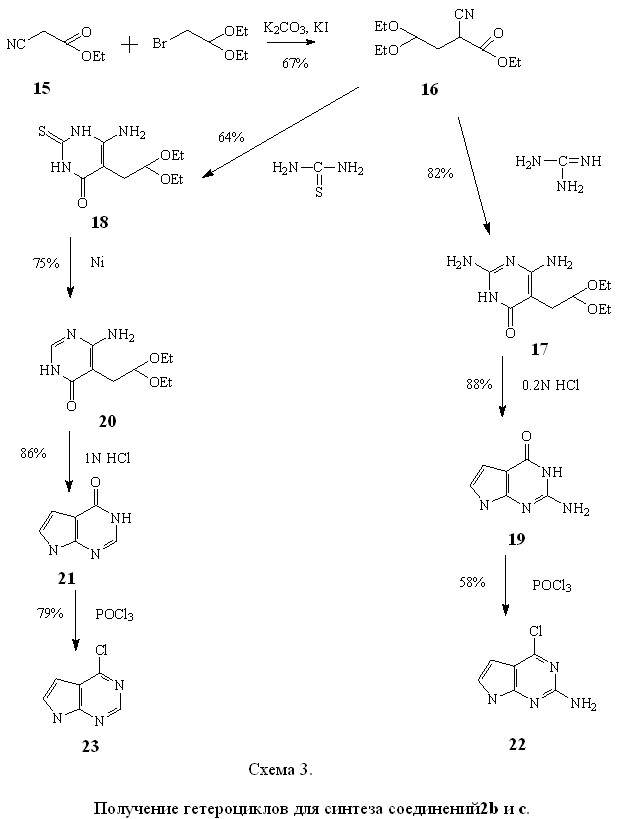
В качестве гетероциклических компонентов для синтеза 7-деазааналогов нуклеозидов (2b, c) нами были выбраны 4-хлорпирроло[2,3-d]пиримидин (22) и 2-амино-4-хлорпирроло[2,3-d]пиримидин (23). Оба гетероцикла были получены из общего предшественника – этилового эфира 4,4-диэтокси-2-цианомасляной кислоты (16) по схеме, представляющей собой комбинацию методов, известных из литературы (схема 3).
Конденсация (16) с гуанидином или тиомочевиной в щелочных условиях привела к замещенным аминопиримидинам, соответственно (17) (выход 82%) и (18) (выход 64%). Циклизацией производного (17) в кислой среде был получен 2-амино-4-гидроксипирроло[2,3-d]пиримидин (19) с выходом 88%. В случае вещества (18), циклизации предшествовало десульфирование (выход 75%), затем полученное соединение (20), в кислой среде, превращалось в 4-гидроксипирроло[2,3-d]пиримидина (21) (выход 86%). Обработка (19) и (21) хлорокисью фосфора привела к целевым гетероциклическим фрагментам (23) (выход 79%) и (22) (выход 58%) в форме, удобной для нуклеозидной конденсации, с суммарным выходом 42 и 33% на соединение (15) соответственно. Физико-химические параметры и спектральные характеристики (22) и (23) совпадают с приведенными в литературе.
Для алкилирования пирроло[2,3-d]пиримидинов (22) и (23) ациклическим бромидом (6) (схема 2) были опробованы два метода – А и Б. Эти методы применялись для синтеза различных углеводных производных 7-деазагуанина и 7-деазааденина, причем метод А давал наиболее высокие выходы конечных продуктов. В нашем случае (табл. 1), наиболее эффективным оказался метод Б (с использованием межфазного катализатора), который позволил получить ацилированные ациклические аналоги нуклеозидов (25) и (26) с выходом 42 и 56% соответственно.
Структура продуктов конденсации (25) и (26) подтверждена методами УФ- и 1Н-ЯМР-спектроскопии (табл.2,3). УФ-Спектры соединений (25) и (26) соответствуют
спектрам 7-замещенных пирроло[2,3-d]пиримидинов, в спектрах 1Н-ЯМР сигналы от Н-5 и Н-6 протонов присутствуют в виде двух дублетов, что также соответствует спектрам 7-замещенных пирроло[2,3-d]пиримидинов. Кроме того, положение сигналов от Н-2 и Н-3-протонов в спектрах 1Н-ЯМР соединений (25) и (26) с характерной константой спин-спинового взаимодействия J2,3 = 11 Гц близко к таковому в бромиде (6), что свидетельствует о сохранении цис-конфигурации двойной связи ациклического фрагмента при конденсации.
При синтезе соединения (25) наряду с целевым продуктом конденсации получено небольшое количество (8%) ди-замещенного пирроло[2,3-d]пиримидина (24), структура которого подтверждена данными УФ-, ЯМР-спектроскопии и масс-спектрометрии. В спектре 1Н-ЯМР соединения (24) сигналы протонов Н-5 и Н-6 присутствуют в виде двух пар дублетов, в спектре 13С-ЯМР – два набора сигналов атомов углерода гетероцикла, один из которых соответствует сигналам гетероцикла в (24) (табл. 3). Возможное образование побочных продуктов с аналогичной структурой отмечено в публикациях при синтезе рибозидов пирроло[2,3-d]пиримидинов.
После деблокирования 5-гидроксильной группы и замещения атома хлора в положении С-4 гетероцикла были получены целевые аналоги 7-деазааденозина (2b) и 7-деазагуанозина (2c) с выходом 85 и 56%, соответственно. Соединение (25) обрабатывали насыщенным раствором аммиака в метаноле в автоклаве при 100оС 36 ч, соединение (26) обрабатывали 0,1 N раствором NaOH при кипении в течение 40 мин.
Структуру целевых соединений (2b, c) подтверждали методами УФ- и 1Н-ЯМР-спектроскопии (табл. 2,3). УФ-Спектры аналогов нуклеозидов (2b, c) соответствуют спектрам 9-замещенных производных 7-деазааденина и 7-деазагуанина; в спектрах 1Н-ЯМР присутствуют все ожидаемые сигналы гетероциклов и ациклического фрагмента (табл. 3).
Данные тестирования биологической активности соединений (2а-с) приведены в таблице 5.
1.2. Синтез аналогов нуклеозидов, содержащих транс-пентеновый фрагмент и оксиметильную группу в положении 1 цис- и транс- пентенового фрагмента.
1.2.1. Синтез ациклических фрагментов для получения аналогов нуклеозидов, содержащих транс-пентеновый фрагмент и оксиметильную группу в положении 1 цис- и транс- пентенового фрагмента.
В качестве ациклических реагентов для получения аналогов нуклеозидов типа (3), (4) и (5) использовали соответствующий ациклический бромид (27) и ацеталь (28), синтез которых приведен на схеме 4. Для получения (E)-5-ацетокси-1-бром-пент-2-ена (27) исходный 1-тетрагидропиранилоксипент-2-ин-1-ол (7) гидрировали в присутствии литийалюмогидрида (выход 50,5%), ацетилировали (выход 97,9%), удаляли тетрагидропиранильную защитную группу в присутствии Dowex 50 (H+) (выход 70%) и бро-
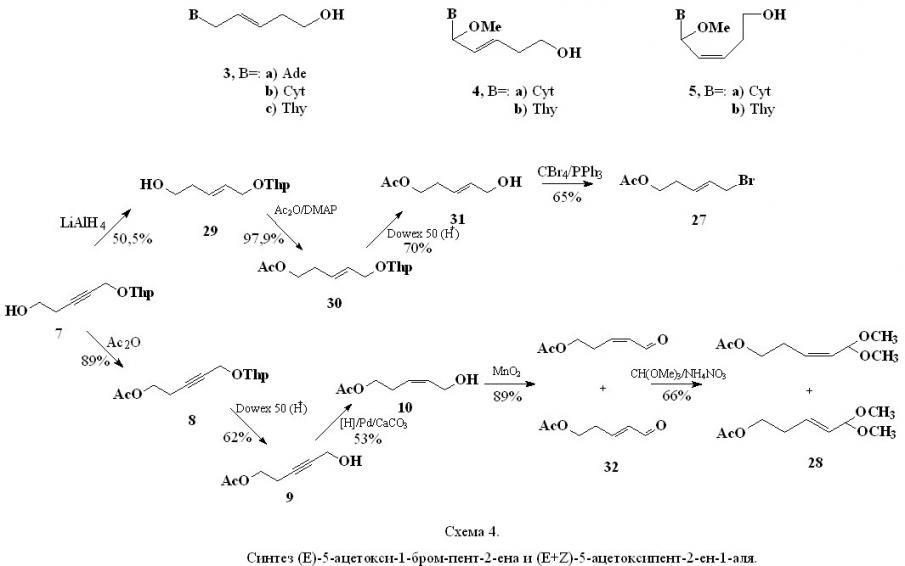
мировали тетрабромметаном в присутствии трифенилфосфина (выход 65%). Структура соединений (27), (29), (31) подтверждена с помощью ИК- и 1Н-ЯМР спектроскопии. В спектрах этих соединений сигнал от протонов при атомах C-2 и С-3 присутствует в виде дублета триплетов с константой спин-спинового взаимодействия 15 Гц, что, при сравнении с описанными Z-аналогами (около 11 Гц), соответствует (E)-конфигурации двойной связи.
Диметилацеталь (28) (схема 4) получали окислением 5-ацетоксипент-2-ен-1-ола (10) диоксидом марганца (выход 89%) с последующей ацетализацией триметилортоформиатом (выход 66%). Уже на стадии окисления спирта (10) в альдегид (32) происходит изомеризация двойной связи, что приводит к образованию смеси (Z+E)-5-ацетоксипент-2-ен-1-алей в эквимолярном количестве (по данным 1H-ЯМР спектроскопии). (Разделение (Z)- и (E)-изомеров проводили после получения аналогов нуклеозидов. До этой стадии реакции проводили со смесью изомеров.) Так в спектре реакционной смеси (рис. 2) соединению (10) соответвуют два набора сигналов от протонов при атомах С-2 и С-3: дублет триплетов при 6,35 м.д. и неразрешившийся сигнал, вероятно тоже дублет триплетов, 6,18 м.д. с константой спин-спинового взаимодействия 11,1 Гц (Z-двойная связь) и дублеты триплетов при 7,01 и 6,80 м.д. константой спин-спинового взаимодействия 15,7 Гц (E-двойная связь). Интегральная интенсивность сигналов этих двух групп протонов одинакова и соответствует одному протону, что свидетельствует об эквимолярном соотношении (Z)- и (E)- изомеров. Структура соединений (28) и (32) подтверждена данными ИК- и 1Н-ЯМР-спектроскопии.
1.2.2. Получение аналогов нуклеозидов, содержащих транс-пентеновый фрагмент и оксиметильную группу в положении 1 цис- и транс- пентенового фрагмента.
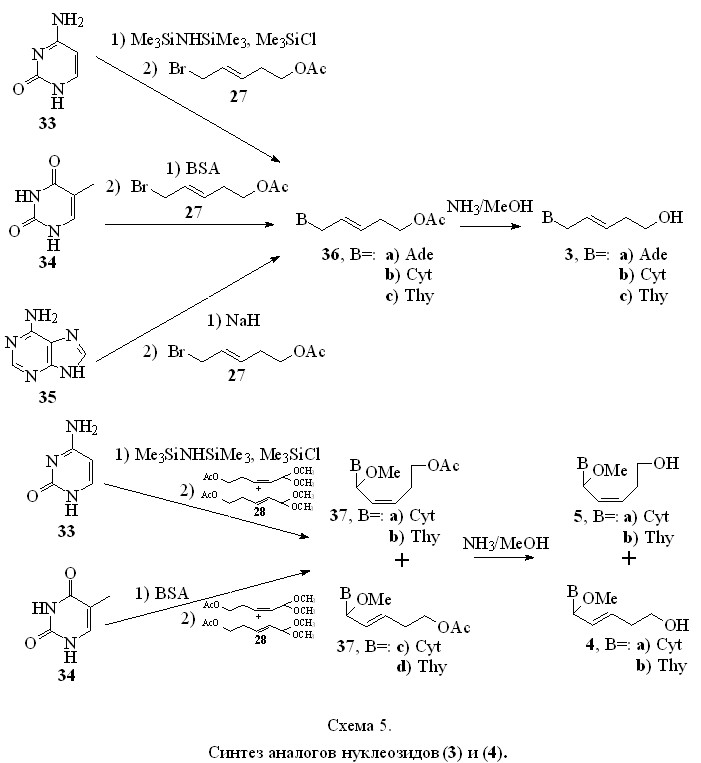
Синтез аналогов нуклеозидов проводили для соединений (3) по ранее отработанной нами методике (схема 5). Для этого в конденсацию с бромидом (27) вводили триметилсилильные производные пиримидиновых оснований (33) и (34) и натриевую соль аденина (35). После деблокирования соединения (36) насыщенным аммиаком в метаноле целевые (Е)-гидроксипентеновые производные тимина (3с), цитозина (3b) и аденина (3a) получены с выходами на исходный бромид (27) 67, 69 и 73 %, соответственно. Строение аналогов нуклеозидов (3) подтверждено данными УФ- и 1Н-ЯМР-спектроскопии (табл. 4).
Конденсацию тимина (33) и цитозина (34) со смесью (Z)- и (Е)- ацеталей (28) (схема 5) проводили при комнатной температуре в ацетонитриле в присутствии четыреххлористого олова по методике, предложенной для конденсации азотистых оснований с ацеталями в работах Флорентьева и соавт. (Z)- и (E)-Изомеры ациклических аналогов нуклеозидов (37a-d) после стадии деблокирования гидроксильной группы разделяли методом тонкослойной препаративной хроматографии (выделение оптических изомеров по 1С-атому пентенового фрагмента не производили). Деблокирование ацетилзащищенной гидроксильной группы в тех же условиях, что и для соединений (3) привело к соединениям (4) и (5). Суммарные выходы (в расчете на смесь (Z) и (Е)-изомеров) составили: для производных тимина (4b) и (5b) 54 % и для производных цитозина (4a) и (5a) 63 %. Структуру целевых соединений (4) и (5) подтверждали с помощью данных УФ- и 1Н-ЯМР-спектроскопии (табл. 4), а также данных элементного анализа.
1.3. Результаты биологического тестирования ациклических аналогов нуклеозидов.
Биологическое тестирование аналогов нуклеозидов (1-4) проводилось в Научно-исследовательском институте эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН группой сотрудников под руководством д. б. н. Г. Г. Миллер. Результаты тестирования приведены в таблице 5.
Предположение о зависимости биологической активности от расстояния между атомом кислорода 5-OH группы и атомом азота (N-1 или N-9) гетероцикла подтверждается результатами тестирования биологической активности: (Z)-аналоги (1a-c, 2a) проявили большую активность, чем (E)-аналоги (3a-c). Замена N-7 атома азота в гетероциклах на атом углерода не привела к повышению биологической активности аналогов нуклеозидов с ациклическим фрагментом (Z)-С5. Это следует из результатов тестирования для 7-деазасоединений (2b и 2c) и аналогов нуклеозидов с немодифицированными гетероциклами (1a и 2a). Введение метокси-группы в положении 1 (соединения (4 и 5)), как и предполагалось, повысило активность аналогов нуклеозидов относительно соответствующих аналогов нуклеозидов без метокси-группы (соединения (1b, c и 3b, c)). Таким образом, установлена связь биологической активности: а) с удаленностью 5OH-группы от атома азота гетероцикла (N-1 – для пиримидиновых и N-9 – для пуриновых аналогов нуклеозидов), б) с наличием 1-метокси-группы, атом кислорода которой, вероятно, имитирует атом кислорода рибозного цикла.
2. Синтез амфифильных аналогов нуклеозидов и изучение их взаимодействия с модельной мембраной.
Поиск новых противовирусных препаратов включает синтез новых соединений с последующим биологическим скринингом. Однако не все новые соединения оказываются активными как на молекулярном, так и на клеточном уровне. Это может быть связано с трудностью образования монофосфатов аналогов нуклеозидов в клетке, а также с трудностью преодоления аналогами нуклеозидов клеточных мембран. Липофильные фрагменты, присоединенные к действующим на молекулярном уровне веществам, способны облегчить их транспорт через мембрану. Логичным продолжением работы в направлении получения новых противовирусных препаратов является синтез конъюгатов фосфатов аналогов нуклеозидов с липофильными фрагментами. В этом направлении определенную сложность представляет выбор липофильного фрагмента для конъюгата.
Предварительно оценить липофильность вещества можно с помощью расчета коэффициента распределения в системе октанол/вода – Log. Так, например, для 2,3-дидезокси-2,3-дидегидротимидина значение Log составляет -0,49, а для 3-О-додецил-1-О-фосфо-5-(2,3-дидезокси-2,3-дидегидро)-тимидина 5,7 (рассчитано при помощи программы DayLight). Однако значение Log не всегда линейно соотносится со способностью веществ проникать через мембрану. Более близким к этой способности по природе взаимодействия может оказаться способность встраивания веществ в модельную мембрану. Для сравнения влияния липофильных фрагментов на солюбилизирующие свойства конъюгатов нами разработан метод изучения взаимодействия амфифильных аналогов нуклеозидов с модельной мембраной. Из всех возможных методов исследования мембранных массообменных процессов наиболее информативным нам представляется метод ЯМР спектрометрии на ядрах дейтерия и фосфора. Известно, что дейтериевые метки не изменяют химических свойств препаратов и не влияют на их солюбилизирующие свойства. С целью демонстрации возможностей метода анализа взаимодействия амфифильных аналогов нуклеозидов с модельной мембраной с использованием ЯМР спектрометрии на ядрах 2Н и 31Р нами были получены 3-О-додецил-1-О-фосфо-5-(2,3-дидезокси-2,3-дидегидро)-тимидин (46a) (конъюгат d4T) и его дейтерий-меченый аналог (46b) (рис. 3). Для сравнения солюбилизирующей способности конъюгата использовался ДФХ.
2.1. Синтез 3-О-додецил-1-О-фосфо-5-(2,3-дидезокси-2,3-дидегидро)-тимидина (46a, b).
Для демонстрации возможностей предлагаемой методики исследования 2Н ЯМР спектроскопии в изучении взаимодействия амфифильных молекул с мембранами, был выбран дейтерий-меченый конъюгат проявляющего антивирусную активность 2,3-дидезокси-2,3-дидегидро-тимидина (d4T) с додеканолом. Для получения конъюгатов d4T с додеканолом и -2H2-додеканолом использовали фосфитный триэфирный метод (схема 6). Фосфитилирующий агент – 2-цианоэтилтетраизопропилфосфородиамидит (38) получали в две стадии. На первой стадии получали дихлорцианоэтилфосфит (39) из треххлористого фосфора и цианоэтанола. На второй стадии к дихлорцианоэтилфосфиту (39) прибавляли диизопропиламин. Дейтерий-меченый додеканол (40b) получали изотопным обменом, восстанавливая метиллаурат литийалюмодейтеридом LiAl2H4. Далее синтез дейтерий-меченого и немеченого конъюгатов вели по общей методике. На первой стадии получали 3-О-додецил-1-(N,N-диизопропиламидо)-цианоэтилфосфит (42a) и 3-О--2H2-додецил-1-(N,N-диизопропиламидо)-цианоэтилфосфит (42b), взаимодействием 2-цианоэтилтетраизопропилфосфоро-диамидита (38) соответственно с додеканолом и -2H2-додеканолом в присутствии диизопропиламмонийтетразолида (41).
Затем, на второй стадии, полученные 3-О-додецил-1-(N,N-диизопропиламидо)-цианоэтилфос-фиты (42a, b) вводились в реакцию с d4T (43). Таким образом, были получены дейтерий-меченый и немеченый 5-О-(О-додецилцианоэтилфосфит)-2,3-дидезокси-2,3-дидегидротимидин (44a, b), которые, без выделения, окисляли трет-бутилгидроперекисью до 5-О-(О-додецилцианоэтилфосфо)-2,3-дидезокси-2,3-дидегидротимидина (45a, b). Далее продукт (45a, b) обрабатывали последовательно триэтиламином и натриевой солью

этилендиаминтетрауксусной кислоты. Так получали целевые 3-О-додецил-1-О-фосфо-5-(2,3-дидезокси-2,3-дидегидро)-тимидин (46a) и 3-О--2H2-додецил-1-О-фосфо-5-(2,3-дидезокси-2,3-дидегидро)-тимидин (46b). Структура соединений (46a, b) подтверждена данными 1Н- (табл. 6), 2Н- и (табл. 7) 13С-ЯМР-спектроскопии.
2.2. Синтез додецил-(-2H3)фосфорилхолина.
Додецилфосфорилхолин (ДФХ) был выбран как потенциальный детергент биологических мембран в качестве сильно липофильного вещесва, способного встраиваться в мембрану. В настоящее время ДФХ находит применение, в частности, при изучении мембранных белков. Поскольку концентрации меченых соединений весьма низки (не более 5-7 мг на образец), необходимо было использовать дейтериевую метку с возможно большей интенсивностью пика ЯМР-сигнала. Этому требованию отвечает метка в -положении холина (дейтерий введён в N–СН3-группу).
Таблица 6. 1Н ЯМР-спектры додеканолов, d4T и конъюгатов.
| Химические сдвиги, (м. д.), вид сигнала | |||||||||||||
| № | Раство- | Сигналы додеканола | Сигналы d4T | ||||||||||
| ритель | дидезоксидидегидрорибозного фрагмента | тимина | |||||||||||
| –СН3 | 9(–СН2–) | –СН2– | –СН2– | 5–СН2– | 4–СН– | 3–СН– | 2–СН– | 1–СН– | –СН3 | –СН– | NH/OH | ||
| 40a | А | 0.74, т | 1.93, м | 3.41, т | 1.38, м | — | — | — | — | — | — | — | —/4.17, с |
| 46a | C | 0.88, т | 1.27, м | 3.89, м | 1.63, м | 4.13, м | 5.01, м | 6.43, м | 5.89, м | 7.00, м | 1.91, с | 7.55, с | —/— |
| 40b | A | 0.79, т | 1.18, м | 3.50* | 1.45, м | — | — | — | — | — | — | — | —/— |
| 46b | D | 0.81, т | 1.19, м | 3.75* | 1.51, м | 4.05, м | 4.89, м | 6.43, м | 5.83, м | 6.87, м | 1.77, с | 7.39, с | 11.19, с/– |
| 43 | B | — | — | — | — | 3.59, м | 5.05, м | 6.39, м | 5.91, м | 6.82, м | 1.72, с | 7.66, с | 11.30, с/– |
Где А — С2HCl3, B — C2H3O2H, C — С2HCl3 + C2H3O2H + 2H2O, D — С2HCl3 + (C2H3)2SO.
* — слабый сигнал остаточного 1Н-водорода.
Таблица 7. 13C ЯМР-спектры додеканолов, d4T и конъюгатов.
| Химические сдвиги, (м. д.), вид сигнала | ||||||||||||||
| № | Раство- | Сигналы додеканола | Сигналы d4T | |||||||||||
| ритель | Дидезоксидидегидрорибозного фрагмента | тимина | ||||||||||||
| CH3 | 10(-СН2-) | –СН2– | 5–СН2– | 4–СН– | 3–СН– | 2–СН– | 1–СН– | 6–C | 5–C | 4–C=O | 2–C=O | CH3 | ||
| 40a | А | 13.84 | 22.65, 25.89, 29.37, 29.56, 29.72, 31.95, 32.67 | 62.28 | — | — | — | — | — | — | — | — | — | — |
| 46a | C | 13.49 | 21.86, 24.81, 28.50, 28.81, 29.43, 29.54, 31.07 | 61.33 | 65.82 | 88.80 | 133.21 | 126.39 | 84.47 | 135.61 | 109.56 | 163.68 | 150.55 | 11.57 |
| 40b | A | 13.87 | 21.61, 25.78, 29.34, 29.53, 29.66, 31.90, 32.37 | — | — | — | — | — | — | — | — | — | — | |
| 46b | D | 13.55 | 21.89, 24.84, 28.53, 28.84, 29.47, 29.61, 31.12 | 65.86 | 88.84 | 133.22 | 126.42 | 84.51 | 135.65 | 109.61 | 163.70 | 150.57 | 11.58 | |
| 43 | B | — | — | — | 62.91 | 90.68 | 135.27 | 125.80 | 88.03 | 136.66 | 111.13 | 166.84 | 152.62 | 11.61 |
Где А — С2HCl3, B — C2H3O2H, C — С2HCl3 + C2H3O2H + 2H2O, D — С2HCl3 + (C2H3)2SO.
Додецил-(-2H3)фосфорилхолин (47) синтезировали фосфорилированием додецилового спирта (40a) по Брокерхоффу с использованием п-толуолсульфоната холина, селективно меченого дейтерием по одной из N-метильных групп (Схема 7.).
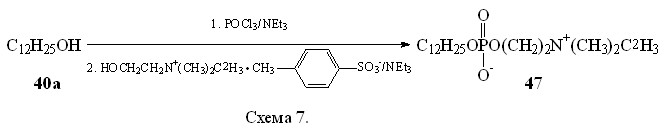
В отличие от классической методики Брокерхоффа, разработанной для получения холиновых фосфодиэфиров с сильно гидрофобными компонентами (диглицериды, холестерин), выделение продукта методом экстракции оказалось в нашем случае неэффективно. При экстракции, выраженные детергентные свойства додецил-(-2H3)-фосфорилхолина проявлялись в образовании стойких эмульсий и в значительной потере вещества за счет растворения в водной фазе. Экстракция нами была заменена дополнительной хроматографической очисткой в обращеннофазовых условиях (силикагель/метанол–вода 4:1), позволяющей выделить смесь производных, содержащих алифатическую цепь. Далее полученную смесь разделяли прямофазной хроматографией на силикагеле. Полученный додецил-(-2H3)-фосфорилхолин охарактеризован данными 1Н- и 2Н-ЯМР-спектров.
2.3. Исследования взаимодействия с мембраной ДФХ и конъюгата d4T.
В спектрах 31Р ЯМР в водной фазе конъюгат d4T (46) дает узкий изотропный сигнал ~ 0 м.д. (рис. 4а), подтверждающий, что в водных дисперсиях в данных условиях сформированы мицеллы, в которых молекулы алкилфосфонуклеозида совершают быстрое изотропное движение. В спектрах 31Р ЯМР липосом яичного фосфатидилхолина, размер которых более 10000, наблюдается анизотропный сигнал (рис. 4б), свидетельствующий об анизотропном характере движения молекул фосфатидилхолина. При инкубации дисперсии липосом с водной дисперсией конъюгата d4T (46), образующего мицеллы, в спектре 31Р ЯМР наблюдается сигнал, представляющий суперпозицию изотропного и анизотропного сигналов (рис 4в). Соотношение площадей изотропного и анизотропного сигналов отражает мольное соотношение конъюгата (46), встроившегося в мембрану и находящегося в водной фазе.
Нами были исследованы водные растворы со следующими мольными соотношениями конъюгат (46)/лецитин: 1/4, 1/8, 1/17. Растворы готовились двумя способами: 1. смешением раздельно приготовленных водных дисперсий лецитина и конъюгата (46) (нами впервые предложен такой способ подготовки образца); 2. совместным диспергированием конъюгата (46) и лецитина (контрольный эксперимент при мольном соотношении 1/17). Кинетику разрушения бислоя наблюдали с помощью 31Р ЯМР спектроскопии. Установили, что наиболее стабильное состояние бислоя наблюдается при соотношении конъюгат (46)/лецитин 1/17. При таком соотношении, влияние температуры и времени на фазовое распределение конъюгата оказалось мало (табл. 8).
В спектрах 2Н ЯМР водной дисперсии конъюгата d4T (46b) наблюдается узкий изотропный сигнал (рис 4е), подтверждающий формирование мицелл. При совместном формировании липосом фосфатидилхолина и конъюгата (46b) проявляется широкий сигнал с характерным квадрупольным расщеплением (рис 4д), свидетельствующий, что молекулы в составе липосом претерпевают анизотропное движение. При совместной инкубации мицелл конъюгата d4T (46b) с липосомами фосфатидилхолина в спектрах 2Н ЯМР наблюдается сигнал, представляющий суперпозицию трех сигналов (рис 4г): двух узких изотропных сигналов воды 2H1НО и конъюгата d4T (46b) в составе мицелл, и анизотропного сигнала с квадрупольным расщеплением, что свидетельствует о прошедшем массообмене между липосомами и мицеллами. Соотношение площадей одного изотропного (за вычетом сигнала 2H1НО) и анизотропного сигнала дает значение коэффициента распределения молекул алкилфосфонуклеозида между мицеллами и липосомами.
При сравнении действия мицелл конъюгата d4T (46b) и ДФХ на липосомы яичного фосфатидилхолина начальные стадии солюбилизации наблюдаются: для конъюгата d4T (46b) при мольном соотношении 1/17 и для ДФХ при соотношении 1/67. Это подтверждает, что ДФХ, по отношению к мембранам, обладает более активным солюбилизирующим действием, чем алкилфосфонуклеозид. Таким образом, предложенным методом можно проводить сравнение солюбилизирущего действия амфифильных конъюгатов аналогов нуклеозидов и других амфифильных веществ, а также исследовать кинетику процесса встраивания веществ в мембрану, при условии проведения ЯМР-экспериментов через выбранные промежутки времени после приготовления образцов. На основании данных о солюбилизирующей способности можно делать предположения о способности исследованных соединений преодолевать биологические мембраны.
ВЫВОДЫ
- Синтезированы алкильные синтоны для получения аналогов нуклеозидов состава С5: (Е)-5-ацетокси-1-бромпент-2-ен, (Z) + (Е)-5-ацетокси-1,1-диметокси-пент-2-ен.
- На основе полученных синтонов состава С5 синтезировано десять новых ациклических аналогов нуклеозидов (2a-c), (3a-c), (4a, b), (5a, b).
- Произведено биологическое тестирование синтезированых соединений на анти-ВИЧ-активность, установлена связь биологической активности: а) с удаленностью 5OH-группы от атома азота гетероцикла (N-1 – для пиримидиновых и N-9 – для пуриновых аналогов нуклеозидов), б) с наличием 1-метокси-группы, атом кислорода которой, вероятно, имитирует атом кислорода рибозного цикла, в) со структурой гетероцикла (модификация пуриновых гетероциклов). Следует отметить, что все соединения проявили заметную активность и не проявляли токсичности при концентрациях до 100 мкг/мл.
- Для отработки методики изучения взаимодействия амфифильных аналогов нуклеозидов с мембранами синтезированы амфифильные дейтерий меченый и немеченый аналоги дидезоксидидегидротимидина.
- На основе синтезированных амфифильных аналогов нуклеозидов отработана методика изучения кинетики встраивания и распределения амфифильных молекул в системе вода – модельные мембраны методом 2H, 31P ЯМР-спектроскопии. Данные, полученные по этой методике, позволяют оценить способность амфифильных аналогов нуклеозидов преодолевать биологические мембраны.
Основное содержание диссертации изложены в следующих работах:
1. Цытович А.В., Шамшин Д.В., Бурковский В.Б., Швец В.И. // Ациклические аналоги нуклеозидов II. Ациклические аналоги гуанозина, 7-дезазагуанозина и 7-дезазааденозина, содержащие цис-гидроксипентеновый фрагмент. / Биоорганическая химия. – 1995. – Т. 21, № 11. – С. 874-880.
2. Василенко И.А., Шамшин Д.В., Цытович А.В., Кан А.Н., Алексеева С.Г., Швец В.И. // Ациклические аналоги нуклеозидов III. Синтез новых ациклических аналогов 2,3-дидезокси-2,3-дидегидронуклеозидов. / Биоорганическая химия. – 2004. – Т. 30, № 6. – С. 607-612.
3. Василенко И.А., Шамшин Д.В., Маликова Н.Н., Алексеева С.Г., Швец В.И. // Синтез амфифильных аналогов нуклеозидов и изучение их взаимодействия с модельными мембранами. / Биологические мембраны. – 2005. – Т. 22, № 4. – С. 356-360.
4. Tsytovith A.V., Philippov D.V., Shamshin D.V.. / Acyclic anallogs of didieoxynucleosides containing modified heterocycles // Abstr. 14th Internat. Symp. on Heterocyclic Chem. 1993. – Antwerp. – P. 01-65.
5. Tsytovith A.V., Shamshin D.V., Burkovsky V.B.. / Acyclic didioxydidehydronucleoside analogs – potential antiretroviral agents (structure-activity relationship). // Abstr. 13th Internat. Congr on Medicinal Chemistry. – 1994. – Paris. – P. 201.
6. Цытович А. В., Шамшин Д.В., Коваленко А.В., Покидышева Л. Н., Титова И. В., Миллер Г. Г.. / Новые ациклические аналоги нуклеозидов, содержащие гидроксипентеновый фрагмент (тезисы) // Юбилейная научная сессия, посвящённая 100-летию со дня рождения проф. Н. А. Преображенского. – 1996. – Россия, Москва. – С. 145-146.
7. Василенко И.А., Коваленко А.Н, Шамшин Д.В. / Разработка методов введения дейтерий-меченных липофильных фрагментов в различные биологическиактивные соединения. (тезисы) // 6-ая международная конференция „Наукоемкие технологии“. – Россия, Москва, 1999. – С.179-180.

