Синтетические пептиды, взаимодействующие с различными типами холинорецепторов.
УЧРЕЖДЕНИЕ РОССИЙСКОЙ АКАДЕМИИ НАУК
ИНСТИТУТ БИООРГАНИЧЕСКОЙ ХИМИИ
ИМ. М.М. ШЕМЯКИНА И Ю.А. ОВЧИННИКОВА
____________________________________________________________
на правах рукописи
Хрущев Алексей Юрьевич
СИНТЕТИЧЕСКИЕ ПЕПТИДЫ, ВЗАИМОДЕЙСТВУЮЩИЕ С РАЗЛИЧНЫМИ ТИПАМИ ХОЛИНОРЕЦЕПТОРОВ.
Специальность: 02.00.10 – Биоорганическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
МОСКВА – 2011
Работа выполнена в Учреждении РАН Институте биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова.
Научные руководители: доктор химических наук, профессор, член-корр. РАН В.И. Цетлин
кандидат химических наук Жмак М.Н.
Официальные оппоненты: доктор химических наук, профессор Г.А. Коршунова
доктор химических наук, профессор Л.Д. Румш
Ведущая организация: Московская государственная академия тонкой химической технологии имени М.В. Ломоносова
Защита диссертации состоится « 20 » апреля 2011 г. в часов на заседании специализированного совета Д 002.019.01 при Учреждении Российской академии наук Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН по адресу: 117997, г. Москва, ул. Миклухо-Маклая, д. 16/10.
С диссертацией можно ознакомиться в библиотеке Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН.
Автореферат разослан « 17 » марта 2011 г.
Ученый секретарь
![]()
специализированного совета,
доктор физико-математических наук В.А. Олейников
Общая характеристика работы.
Актуальность проблемы. Нарушение работы некоторых подтипов никотиновых ацетилхолиновых рецепторов (нАХР) может вызывать или быть следствием ряда заболеваний, таких как мышечные дистрофии (миастении) и некоторые виды эпилепсии. Также была показана взаимосвязь между шизофренией, болезнями Альцгеймера, Паркинсона и нарушением в уровне определенных подтипов нейрональных нАХР, что диктует необходимость изучения структуры и механизмов функционирования этого класса лиганд-управляемых каналов. Для проведения подобных исследований необходимо иметь адекватные инструменты, которыми являются пептидные и белковые нейротоксины, выделенные из различных природных источников. Значительный вклад в понимание механизмов передачи нервного импульса был сделан в Институте биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН благодаря использованию нейротоксинов из ядов змей и членистоногих. В последнее время появилась задача различать особенности отдельных подтипов рецепторов, и для этого необходимо использовать более «тонкие» инструменты. Так, в случае нАХР такими инструментами являются -конотоксины, обладающие уникальной способностью различать не только нейрональные и мышечные типы рецепторов, но также их подтипы и даже разные участки связывания на рецепторе. -Конотоксины – небольшие пептиды, выделенные из ядов хищных морских моллюсков Conus, содержащие 12-22 аминокислотных остатка и две дисульфидные связи. Поскольку выделение значительных количеств индивидуальных пептидных компонентов из яда моллюсков Conus является достаточно сложной задачей, -конотоксины и их аналоги получают методами пептидного синтеза.
Цели и задачи работы. Целью настоящего исследования являлась разработка эффективных подходов к синтезу -конотоксинов, а также получение новых биологически активных синтетических аналогов -конотоксинов для исследований нАХР. При этом решались следующие задачи: 1. Выбор оптимальных условий замыкания дисульфидных связей; 2. Получение ряда -конотоксинов в препаративных количествах; 3. Изучение взаимосвязи между структурой и биологической активностью -конотоксинов.
Научная новизна и практическая ценность работы. Разработаны эффективные схемы синтеза препаративных количеств природных -конотоксинов и их аналогов. Практическая ценность разработанных методик заключается в достижении максимальных выходов реакций синтеза -конотоксинов. Методические подходы к синтезу пептидов, содержащих две дисульфидные связи, разработанные в рамках данной диссертационной работы, могут быть использованы в синтезе не только -конотоксинов, но и для получения других биологически активных коротких пептидов, содержащих две дисульфидные связи – таких, как апамины или эндотелины. Получены два новых аналога -конотоксина PnIA, которые показали более высокое сродство, чем природный пептид, к 7 нАХР и к модели лиганд-связывающего домена нАХР – ацетилхолин-связывающему белку (АХСБ) A. сalifornica. Показано, что увеличение длины первой цистеиновой петли -конотоксина MI не приводит к переключению специфичности с нАХР мышечного типа Torpedo californica в пользу нейронального 7 нАХР человека. С использованием молекулярного моделирования и последующего синтеза были получены аналоги -конотоксина PnIA, обладающие повышенной селективностью к АХСБ из A. californica. С помощью синтезированных изомеров -конотоксина ImII и его аналога [W10Y]ImII было впервые показано наличие дополнительного участка связывания на Torpedo нАХР, отличного от сайта связывания агонистов и/или конкурентных антагонистов.
Публикации. По материалам диссертации опубликовано 10 работ.
Апробация работы. Результаты настоящего исследования доложены на ряде российских и международных симпозиумов: на VI и VII Летней нейропептидной конференции Европейского нейропептидного клуба (Зальцбург 2009 и Печ 2010., соответственно), на ХХI зимней молодежной школе «Перспективные направления физико-химической биологии и биотехнологии» (Москва, 2009), на конференции «Ионные каналы: структура и функции» (С.-Петербург, 2009), на совещании «Нейродегенеративные заболевания: современные представления о патогенезе, диагностике и лечении» (Москва, 2010).
Объем работы. Диссертация изложена на 135 страницах, состоит из введения, 3 глав и выводов, содержит 19 рисунков, 8 таблиц, в списке литературы цитировано 181 название. В глава I приведен обзор литературных данных по исследованию никотинового ацетилхолинового рецептора с помощью -конотоксинов и их аналогов, а также приведены данные по химическому синтезу -конотоксинов. В главе II содержатся результаты исследований и их обсуждение, в главе III изложены экспериментальные методы.
Обсуждение результатов.
-Конотоксины - небольшие пептиды, содержащие 12-22 аминокислотных остатка, выделенные из морских улиток семейства Conus. Жесткость структуры этих пептидов обеспечивается двумя дисульфидными связями, соединяющими 1-3 и 2-4 остатки цистеина: 
где Х - любые аминокислотные остатки, в подстрочном индексе указано их возможное число, С1,2,3,4 – остатки цистеина, С-концевой остаток большинства -конотоксинов амидирован. Задача разработки методов синтеза -конотоксинов продиктована тем, что эти пептиды присутствуют в яде Conus в очень небольших количествах, тогда как для проведения структурно-функциональных исследований самих -конотоксинов, а также для изучения
механизмов их взаимодействия с АХР1, требуются препаративные количества этих пептидов. С помощью химического синтеза, на основании методов молекулярного моделирования и/или эмпирического анализа последовательностей, можно получать разнообразные аналоги -конотоксинов, которые могут превосходить природные пептиды по эффективности и/или избирательности действия. Химический синтез также позволяет получать аналоги, содержащие модифицированные аминокислотные остатки.
Несмотря на то, что современные методы твердофазного синтеза позволяют получать пептиды, содержащие более 100 аминокислотных остатков и с этой точки зрения синтез линейной последовательности -конотоксинов не представляет больших трудностей, однако наличие двух дисульфидных связей в -конотоксинах значительно усложняет синтез и требует тщательного подбора как стратегии синтеза, так и методов, применяемых на каждой стадии синтеза.
Особенности синтеза -конотоксинов.
В синтезе -конотоксинов используют два подхода к замыканию дисульфидных связей. Наиболее часто в литературе встречаются примеры синтеза с поэтапным замыканием дисульфидных мостиков. Особенность этого метода заключается в использовании защитных групп, удаляемых в разных условиях (ортогональных) для двух пар цистеинов (первый-третий, второй-четвертый), образующих впоследствии две дисульфидные связи. При этом для защиты тиольных функций первой пары остатков цистеина используют кислотолабильные группы (Trt1-группа в случае Fmoc-схемы защитных групп), которые удаляют при деблокировании пептида вместе с остальными защитными группами. После удаления защитных групп проводят замыкание первой дисульфидной связи. Вторую пару остатков цистеина защищают кислотостабильными группами (например, Acm1 или tBu1), которые удаляют селективными реагентами, при этом часто выбирают условия синтеза, при которых происходит одновременное образование второй дисульфидной связи. Основным недостатком этого метода является низкий выход целевого продукта, составляющий не более 10% в расчете на стартовую аминокислоту. Однако, эта стратегия имеет очевидное достоинство: в результате синтеза получается индивидуальное соединение с известным расположением дисульфидных связей.
Вторым подходом, используемым при синтезе -конотоксинов, является одновременное замыкание двух дисульфидных связей. Отличительной чертой этого метода является использование кислотолабильных защитных групп для обеих пар остатков цистеина.
__________________________________________________________________
1 Принятые сокращения: Trt - тритил-; Аcm – ацетамидометил-; tBu – третбутил-; ВЭЖХ – высокоэффективная жидкостная хроматография; АХР – ацетилхолиновый рецептор; АХСБ – ацетилхолин-связывающий белок; Bgt – -бунгаротоксин.
В результате деблокирования образуется линейный пептид, содержащий 4 свободные сульфгидрильные группы. В результате одновременного замыкания сразу двух дисульфидных связей часто образуются 3 изомера.
При этом показано, что в случае «природных» -конотоксинов в качестве основного продукта образуется изомер с природным расположением дисульфидов, тогда как аналоги токсинов, содержащие одну или более аминокислотных замен, часто образуют смесь изомеров, без преобладания какого-либо продукта. Это приводит к необходимости использования дополнительных методов анализа для определения порядка замыкания дисульфидных связей. Однако, главным достоинством этого метода является высокий выход целевого продукта, который составляет 30-50% в расчете на стартовую аминокислоту.
В результате выполнения данной работы были разработаны оптимальные условия получения препаративных количеств природных -конотоксинов и их аналогов. Наибольшие выходы целевого продукта получены при синтезе с одновременным замыканием дисульфидных связей действием кислорода воздуха в смеси вода-ацетонитрил (1:1 v/v) при рН=8,5. В данной работе также был исследован метод поэтапного замыкания дисульфидных связей. Установлено, что расположение защитных tBu-групп на остатках цистеина в положениях Cys1 и Cys3 приводит к увеличению выхода -конотоксина RgIA в 3,7 раза по сравнению с синтезом, в котором tBu-группы расположены в положениях Cys2 и Cys4. В синтезе [Y10]ImII для удаления tBu-защитных групп и одновременного образования дисульфидной связи мы использовали трифторацетат таллия. В данной работе впервые предложен метод разрушения комплексных соединений молекулы пептида с ионами таллия путем обработки раствором ЭДТА. Такие комплексные соединения часто образуются при замыкании дисульфидных связей раствором трифторацетата таллия в трифторуксусной кислоте. Предложенный метод позволяет увеличить практическую значимость высокоэффективного метода замыкания дисульфидных связей с применением трифторацетата таллия. Благодаря использованию роботизированного пептидного синтезатора в одновременном синтезе серии аналогов -конотоксинов удалось значительно уменьшить время синтеза, а также сделать процесс более экономичным. Это открывает новые возможности в исследовании структурно-функциональных особенностей -конотоксинов.
Выбор последовательностей -конотоксинов для синтеза.
Природные -конотоксины, такие как GI и MI, проявляют высокую избирательность к нАХР мышечного типа. Большая группа -конотоксинов специфически блокирует нейрональные нАХР, однако, они очень редко избирательны по отношению к какому-либо определенному подтипу нейрональных АХР. Данная работа является частью структурно-функциональных исследований никотиновых рецепторов, проводимых в Отделе молекулярных основ нейросигнализации ИБХ РАН. Важным этапом является детальный анализ взаимодействия рецептора с пептидными и белковыми нейротоксинами. Объектами исследования являются нАХР мышечного типа из электрического органа ската Torpedo californica, нейрональный 7 нАХР, нарушение деятельности которого связано с такими нейродегенеративными заболеваниями как болезнь Альцгеймера, а также 9 нАХР, антагонисты которого рассматриваются как потенциальные анальгетики. Ранее, в результате совместного проекта нашей лаборатории с Нидерландским институтом рака, была установлена кристаллическая структура комплекса аналога -конотоксина PnIA с ацетилхолин-связывающим белком (АХСБ) A. californica. В настоящее время в нашей лаборатории продолжаются работы по исследованию взаимодействия -конотоксинов и их аналогов с ацетилхолин-связывающими белками, которые являются моделями лиганд-связывающих доменов холинорецептора. Таким образом, задачей диссертационной работы являлась оптимизация синтеза -конотоксинов и их аналогов, мишенями которых служат перечисленные подтипы рецепторов и АХСБ
Таблица 1. Структуры синтезированных -конотоксинов и их аналогов.
| Название пептида | Аминокислотная последовательностьа |
| -конотоксины, блокирующие 7 нАХР. | |
| [L10]PnIA | GCCSLPPCALNNPDYC* |
| [H5]PnIA | GCCSHPPCAANNPDYC* |
| [H5,R14]PnIA | GCCSHPPCAANNPRYC* |
| [R5,L10]PnIA | GCCSRPPCALNNPDYC* |
| [D7,L10]PnIA | GCCSLPDCALNNPDYC* |
| [L10,K14]PnIA | GCCSLPPCALNNPKYC* |
| [D5,L10]PnIA | GCCSDPPCALNNPDYC* |
| [R7, L10]PnIA | GCCSLPRCALNNPDYC* |
| [R5,D7,L10]PnIA | GCCSRPDCALNNPDYC* |
| [R5,L10,R14]PnIA | GCCSRPPCALNNPRYC* |
| [D5,R7,L10]PnIA | GCCSDPRCALNNPDYC* |
| [D5,R7,V10]PnIA | GCCSDPRCAVNNPDYC* |
| [R5,D7,L10,R14]PnIA | GCCSRPDCALNNPRYC* |
| [D5,R7,L10,R14]PnIA | GCCSDPRCALNNPRYC* |
| [Y10]ImI | GCCSDPRCAYRC* |
| [L11, D16]ArIB | DECCSNPACRLNNPHDCRRR |
| [S0, L11, D16]ArIB | SDECCSNPACRLNNPHDCRRR |
| [(SGGG)0, L11, D16]ArIB | SGGGDECCSNPACRLNNPHDCRRR |
| -конотоксины, блокирующие 9 нАХР. | |
| Vc1.1 | GCCSDPRCNYDHPEIC* |
| [R5]Vc1.1 | GCCSRPRCNYDHPEIC* |
| [D7]Vc1.1 | GCCSDPDCNYDHPEIC* |
| [R11]Vc1.1 | GCCSDPRCNYRHPEIC* |
| [R5,D7]Vc1.1 | GCCSRPDCNYDHPEIC* |
| RgIA | GCCSDPRCRYRCR |
| RgIAизо | GCCSDPRCRYRCR |
| -конотоксин, блокирующий 32 и 6 нАХР. | |
| [Y0]MII | YGCCSNPVCHLEHSNLC* |
| -конотоксины, блокирующие 7 и мышечный нАХР. | |
| ImII | ACCSDRRCRWRC* |
| ImIIизо | ACCSDRRCRWRC* |
| [Y10]ImII | ACCSDRRCRYRC* |
| [R5,D7]ImII | ACCSRRDCRWRC* |
| -конотоксины, блокирующие мышечный тип нАХР. | |
| MI | GRCCHPACGKNYSC* |
| [L10]MI | GRCCHPACGLNYSC* |
| [GRCCS]MI(6-15) | GRCCSHPACGKNYSC* |
| [GCCS]MI(6-15) | G-CCSHPACGKNYSC* |
| [GCCS, L10]MI(6-15) | G-CCSHPACGLNYSC* |
* - С-концевое амидирование.
а – Во всех пептидах дисульфидные связи образованы между первым и третьим, а также вторым и четвертым остатками цистеина.
Пептиды, представленные в таблице 1, являются аналогами природных -конотоксинов PnIA, Vc1.1, ImI, ImII, RgIA, ArIB и MI. Пептиды [L10]PnIA, [R5, L10]PnIA и [L10, K14]PnIA были синтезированы в качестве контрольных образцов, поскольку в ряде работ они показали повышенное сродство к 7 подтипу нАХР. Кроме того, для доказательства влияния положительного заряда в 5 положении аналогов пептида [L10]PnIA мы синтезировали пептид [D5, L10]PnIA, содержащий замену R5D. Для изучения влияния положительного заряда в 5 и 14 положении на сродство -конотоксина PnIA к 7 подтипу нАХР были синтезированы аналоги [H5]PnIA и [H5,R14]PnIA. Для исследования влияния знака заряда в 7 позиции мы синтезировали пептиды [R7, L10]PnIA и [D7, L10]PnIA. Пептиды [R5,D7,L10]PnIA, [D5,R7,V10]PnIA, [D5,R7,L10]PnIA, [R5,L10,R14]PnIA, [R5,D7,L10,R14]PnIA, и [D5,R7,L10,R14]PnIA, содержащие, кроме базовой мутации A10L (или A10V), также аминокислотные остатки аргинина или аспарагиновой кислоты в положениях 5, 7 и 14, были синтезированы для изучения совместного влияния заряженных аминокислотных остатков на сродство к 7 подтипу нАХР и ацетилхолин-связывающим белкам.
Последовательности аналогов [D5,L10]PnIA, [R7,L10]PnIA, [D5,R7,L10]PnIA, [D5,R7,V10]PnIA и [D5,R7,L10,R14]PnIA были выбраны с помощью метода молекулярного моделирования.
Остаток тирозина в пептидах [Y0]MII, [Y10]ImI и [Y10]ImII мы ввели для получения соответствующих производных меченным радиоактивным изотопом иода (125I) и последующего анализа связывания их с никотиновым холинорецептором. Пептиды Vc1.1, ImII, RgIA и MI представляют собой природные -конотоксины без каких-либо модификаций. Мы провели также синтез ribbon-изомеров (дисульфидные связи между Сys1Сys4 и Сys2Сys3 ) -конотоксинов ImII и RgIA, поскольку аминокислотная последовательность этих токсинов была получена при анализе библиотеки кДНК, полученной из мРНК, содержащейся в ядовитых железах моллюсков Conus, что не позволяет установить порядок замыкания дисульфидных связей.
Аналоги [R5]Vc1.1 и [R11]Vc1.1 были синтезированы для изучения влияния положительного заряда на активность -конотоксина Vc1.1. Для исследования дополнительного отрицательного заряда мы синтезировали аналог [D7]Vc1.1, содержащий «мутацию» R7D. Пептид [R5,D7]Vc1.1 содержит двойную замену - отрицательный заряд в 5 позиции и положительный в 7 исходного -конотоксина Vc1.1 поменяны местами. Тот же прием мы использовали для синтеза аналога [R5,D7]ImII, заменив в природном пептиде ImII D5 на R и R7 на D.
Для изучения влияния положительного заряда в положении 10 на активность -конотоксина MI мы синтезировали аналог [L10]MI, содержащий «мутацию» K10L. Основное отличие -конотоксинов, селективно действующих на мышечные или нейрональные подтипы нАХР, заключается в числе аминокислотных остатков между остатками Cys2 и Сys3 (первая цистеиновая петля) Так, «мышечные» -конотоксины, принадлежащие к 3/5-семейству (например GI, GII, MI, SI, SIA и др.) имеют по 3 остатка в первой цистеиновой петле, тогда как «нейрональные» -конотоксины имеют по 4 остатка (например ImI, ImII, MII, PnIA, GID и др.). Для получения аналогов «мышечного» -конотокина MI, обладающих повышенным сродством к нейрональному подтипу нАХР (7), мы синтезировали пептиды, которые содержат добавочный остаток серина в первой цистеиновой петле (между остатком Cys4 и His5), что переводит их в число представителей 4/5-семейства -конотоксинов. Таким образом, мы выбрали последовательности и синтезировали пептид [GRCCS]MI(6-15), а также пептиды [GCCS]MI(6-15) и [GCCS, L10]MI(6-15), в которых удалены остатки аргинина во 2 положении, а также лизин-10 заменен на лейцин, что часто встречается среди «нейрональных» токсинов, например в MII и PnIA.
Аналог [L11, D16]ArIB был синтезирован в качестве контроля, поскольку по литературным данным известно, что он обладает наномолярным сродством к 7 подтипу нАХР. Пептид [S0, L11, D16]ArIB содержит дополнительный N-концевой остаток серина, который был введен для дальнейшей модификации и присоединения пептида к твердому носителю, что позволит получить высокоактивный сорбент для аффинной хроматографии. Аналог [(SGGG)0, L11, D16]ArIB содержит тетрапептидный фрагмент Ser-Gly-Gly-Gly в N-концевой части, остаток серина был введен для его последующей модификации с образованием активированного производного пептида, необходимого для иммобилизации -конотоксина на твердом носителе. Остаток серина отделен от основной последовательности пептида тремя остатками глицина, которые увеличивают конформационную подвижность системы токсин-полимер.
Синтез -конотоксинов.
Синтез проводили как с использованием автоматического пептидного синтезатора Syro II для больших серий пептидов, содержащих замены различных остатков и варьирование длины первой цистеиновой петли, так и в ручном режиме для аналогов -конотоксинов ImII, RgIA, PnIA, Vc1.1 и ArIB. Для активации защищенных аминокислот использовали 2 метода: DIPCDI/HOBt-метод для синтеза на автоматическом пептидном синтезаторе, и TBTU/DIPEA-метод для синтеза в ручном режиме. В реакциях конденсации использовали 3-5–кратные избытки активированной аминокислоты.
Для окисления линейных предшественников -конотоксинов мы использовали подход как с одновременным, так и с поэтапным замыканием дисульфидных связей. В случае одновременного замыкания дисульфидных мостиков мы провели исследование влияния состава буферной смеси на выход целевого продукта. Для сравнения использовали смесь вода-ацетонитрил в соотношении 1:1 (для поддержания рН=8,5 в раствор добавляли диизопропилэтиламин) и буферную смесь, содержащую 10 mМ Tris-HCl и 0,2 mM EDTA (рН 8,5). В стандартную процедуру замыкания SS связей были внесены изменения: значение рН раствора пептида было увеличено с 7.5 до 8.5.
Увеличение рН позволило сократить время реакции с 36-72 до 18-35 ч, в случае применения для окисления дисульфидных связей водно-органической смеси в качестве основного продукта синтеза получали изомер с природным расположением дисульфидных связей. Процесс окисления контролировали при помощи теста Эллмана. Полученные -конотоксины очистили с использованием препаративной ВЭЖХ. Все синтезированные соединения были охарактеризованы при помощи аналитической ВЭЖХ и масс-спектрометрии.
Для сравнения эффективности вышеуказанных методик окисления ряд пептидов был синтезирован с поэтапным замыканием дисульфидов. Было исследовано влияние порядка расположения ортогональных защитных групп остатков цистеина на выход целевого продукта, а также был применен метод удаления tBu-групп с помощью солей таллия (III) в трифторуксусной кислоте.
Индивидуальные особенности синтеза конкретных -конотоксинов рассмотрены в следующих разделах.
Сравнение эффективности двух буферных смесей для замыкания дисульфидных связей в аналогах -конотоксинов.
Окисление линейных предшественников -конотоксинов [H5,R14]PnIA, [D7,L10]PnIA, [R5,L10,R14]PnIA, [Y5,R6,R7,L10,R14,W15]PnIA, [R5]Vc1.1, [GRCCS]MI(6-15), [R11]Vc1.1, [R5,D7]Vc1.1, [Y10]ImI, RgIA, ImII, [R5,D7]ImII, [L10]MI, [GCCS]MI(6-15), [GCCS, L10]MI(6-15) и [D7]Vc1.1 проводили в 50 мл буфера, содержащего 10 мМ Tris-HCl и 0,2 мМ EDTA при рН 8,5, при концентрации окисляемых пептидов 0,5 мг/мл. Для окисления пептидов [H5]PnIA, [L10,K14]PnIA, [D5,L10]PnIA, [R7, L10]PnIA, [R5,D7,L10]PnIA, [D5,R7,L10]PnIA, [D5,R7,V10]PnIA, [R5,D7,L10,R14]PnIA, MI и [D5,R7,L10,R14]PnIA использовали раствор ацетонитрила в воде в объемном соотношении (1:1) и концентрации пептида 0,5 мг/мл. Контроль за реакцией осуществляли при помощи обращенофазовой ВЭЖХ в градиенте ацетонитрила. Об окончании реакции судили по тесту Эллмана. Сравнение хроматографических профилей реакционных смесей показало большую эффективность метода с использованием смеси вода-ацетонитрил. Было отмечено, что скорость замыкания дисульфидных мостиков при использовании вышеуказанных буферных смесей практически одинакова (18-35ч.), однако выход целевого продукта был больше в случае использования водно-ацетонитрильной смеси. При окислении в водно-солевом буфере всегда наблюдалось образование нескольких дисульфидных изомеров и часто в сопоставимых количествах с целевым продуктом, в то время как при окислении в водно-органической фазе наблюдали образование одного изомера.
Исследование влияния расположения ортогональных защитных групп остатков цистеина на выход -конотоксина RgIA.
В настоящее время отсутствуют литературные данные по исследованию оптимального расположения ортогональных защитных групп в синтезе -конотоксинов. В большинстве работ в равной степени указываются оба способа расположения защит – tBu-группы (либо Acm и StBu) в положениях Cys1/Cys3, а также в положениях Cys2/Cys4. Синтез -конотоксина RgIA был проведен на полимере Ринка с использованием Fmoc-схемы защитных групп аминокислот. Реакции конденсации проводили DIC/HOBt-методом с использованием 5-кратных избытков защищенной аминокислоты, при этом среднее время конденсации составляло 3 часа. В данной работе мы исследовали влияние порядка расположения ортогональных групп на выход -конотоксина RgIA. Для этого мы синтезировали пептид RgIA, в котором тиольные функции остатков цистеина большой петли (Cys2/Cys4) имели тритильную защиту, а остатки Cys1/Cys3 защищены с помощью трет-бутильной группы, а также -конотоксин RgIA, в котором остатки цистеина большой петли были защищены трет-бутильной группой, а малой - тритильной группой. Поскольку стратегия поэтапного замыкания дисульфидных связей подразумевает на первом этапе формирование SS-мостика между остатками цистеина содержащими свободные SH-группы, то в первом случае замыкание дисульфидной связи происходит с образованием петли, состоящей из 10 аминокислотных остатков, во втором случае петля состоит из 7 аминокислотных остатков (рис. 1):
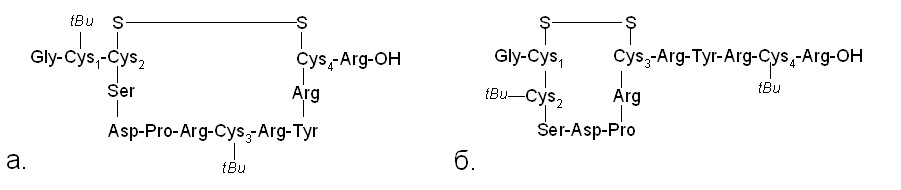
Рисунок 1. Строение 10- (а) и 7-членной петли (б) -конотоксина RgIA.
Реакцию окисления проводили в 50% ацетонитриле, т.е. в условиях, оказавшихся оптимальными в случае синтеза с одновременным замыканием дисульфидов. Интересно, что формирование 10-членной петли проходило с выходом 75%, тогда как пептид, содержащий 7-членную петлю, получили с выходом 45%.
Для замыкания второй пары остатков цистеина использовали смесь дифенилсульфоксида с метилтрихлорсиланом в трифторуксусной кислоте в присутствии анизола в качестве скэвенджера. Поскольку -конотоксины представляют собой бициклические соединения, для описания этой реакции, так же удобно использовать представление о петлях, содержащих разное количество аминокислотных остатков. Так при реакции образования второй дисульфидной связи (между остатками Cys1/Cys3) происходит формирование 7-членной петли, выход этой реакции составил 28%. Тогда как замыкание второй связи между остатками Cys2/Cys4 идет через формирование 10-членной петли с выходом 21%. Идентичность полученных пептидов доказали с помощью масс-спектрометрии, а также совместным элюированием.
По результатам данной работы установлено, что максимальный выход -конотоксина RgIA достигается в случае расположения трет-бутильных групп в позициях Cys1/Cys3. При этом можно предположить, что на этапе формирования первой SS-связи высокий выход достигается благодаря меньшим конформационным напряжениям, которым подвержена 10-членная петля. Можно предположить, что более высокий выход реакции замыкания второго дисульфидного мостика между остатками Cys1/Cys3, обусловлен формированием жесткой циклической структуры, при этом остатки цистеина оказываются сближенными в пространстве, а остаток пролина в 6 положении, способствует закреплению конформации в положении близком к структуре пептида в окисленном состоянии.
Сравнение методов замыкания дисульфидных связей на примере синтеза двух изомеров -конотоксина [Y10]ImII.
Синтез двух изомеров -конотоксина [Y10]ImII (globular - дисульфидные связи между Cys2/Cys8 и Cys3/Cys12, ribbon –дисульфидные связи между Cys2/Cys12 и Cys3/Cys8) был осуществлен на полимере Ринка с использованием Fmoc-схемы защитных групп аминокислот. Тиольные функции остатков Cys2/Cys8 «природного» изомера и остатки Cys2/Cys12 «ribbon» изомера защищали с помощью tBu-групп. В качестве ортогональный защиты использовали кислотолабильные Trt-группы. Для активации защищенных аминокислот применяли TBTU/DIPEA-метод. Окисление первой дисульфидной связи линейных предшественников проводили в 50% ацетонитриле. Для замыкания второго SS-мостика использовали раствор трифторацетата таллия в трифторуксусной кислоте. Окисление проводили в трифторуксусной кислоте при 0С в течении 30 мин в присутствии 2 экв. анизола, который добавляли для связывания образующихся карбокатионов. После завершения реакции было обнаружено формирование сложного хроматографического профиля, однако MS-анализ реакционной смеси показал наличие одной молекулярной массы, соответствующей целевому продукту – -конотоксину [Y10]ImII (рис. 2):
![Хроматограмма -конотоксина [Y10]ImII и масс-спектр смеси пептидных-3](/images1/345308/hromatogramma-konotoksina-y10-im.png)
Рисунок 2. Хроматограмма -конотоксина [Y10]ImII и масс-спектр смеси пептидных компонентов, образовавшихся после обработки раствором соли таллия (III).
Это обстоятельство позволило предположить, что в процессе деблокирования образовалась смесь комплексных соединений ионов таллия (I и III) c молекулами пептидов [Y10]ImII и [Y10]ImIIизо, которые разрушаются в процессе регистрации масс-спектра с образованием молекулярных ионов -конотоксинов [Y10]ImII и [Y10]ImIIизо. Для проверки этого предположения мы провели качественную реакцию на ионы таллия с иодид ионом, который дает ярко-желтый осадок как с ионом Tl3+, так и Tl+ [17]. Однако добавление иодида калия не привело к видимым изменениям, что могло говорить, либо о высокой устойчивости комплексов, либо о неправомерности утверждения об их образовании. Поэтому мы провели предварительный кислотный гидролиз пептида соляной кислотой. После удаления избытка кислоты и добавления раствора иодида калия, наблюдали появление желтого осадка малорастворимых солей TlI3 и TlI. Чтобы исключить возможное окрашивание молекулярным иодом в смесь был добавлен бензол, который экстрагирует его из водного раствора. В качестве контроля мы использовали пептид [Y10]ImII, полученный по методике с одновременным замыканием дисульфидных связей, который после кислотного гидролиза не вызвал окрашивания при добавлении раствора иодида калия.
Случаи комплексообразования были описаны в литературе, однако, практических рекомендаций по разрушению подобных комплексов не приводится. Мы предложили использовать метод замещения лиганда (в данном случае пептида) на более сильный комплексообразователь ионов таллия. В качестве такого соединения выбрали этилендиаминтетрауксусную кислоту (ЭДТА), которая образует устойчивые хелатные комплексы с ионами тяжелых металлов, выступая в качестве пента- или гексадентатного лиганда. Для разрушения комплексных соединений к пептидам, содержащим одну дисульфидную связь, добавили 1 М раствор ЭДТА. Для исключения возможности дисульфидного обмена, использовали раствор с рН 4,5. Как показано на рис. 3, с течением времени наблюдалось постепенное уменьшение числа хроматографических пиков, вплоть до образования одного вещества (через 56ч.) с молекулярной массой 1485.7 Da (расчетная молекулярная масса -конотоксина [Y10]ImII 1485.6 Da) время удерживания которого в дальнейшем не изменялось.
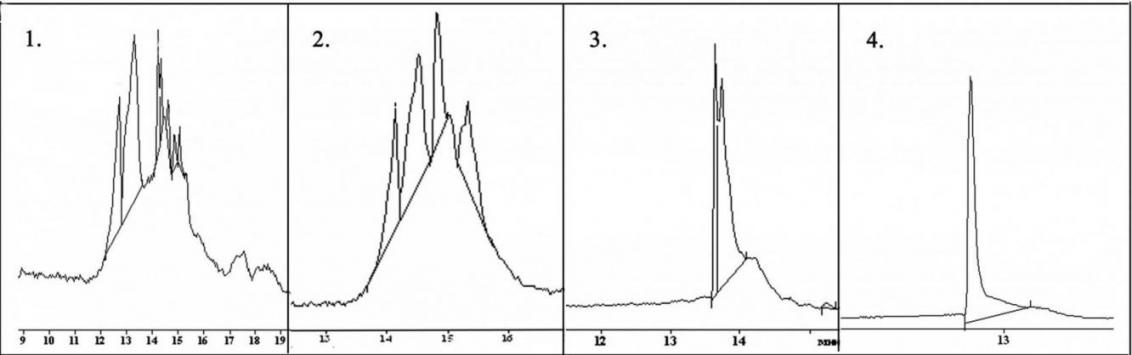
Рисунок 3. Разрушение комплексных соединений ионов таллия с пептидом [Y10]ImII. Через 5 мин. после добавления ЭДТА (1), через 16 часов (2), через 32 часа (3) и через 56 часов (4).
Следует отметить, что выходы пептидов на этапе окисления трифторацетатом таллия были достаточно высокими – 73% для globular-изомера, и 60% в случае ribbon-изомера. Это примерно в 2-3 раза превышает выходы целевого продукта по сравнению с использованием смеси дифенилсульфоксида с метилтрихлорсиланом для окисления второй дисульфидной связи -конотоксинов RgIA, Vc1.1, [Y0]MII, [L11, D16]ArIB, [S0, L11, D16]ArIB и [(SGGG)0, L11, D16]ArIB (синтез этих пептидов рассмотрен в следующих разделах). Выходы globular-изомера -конотоксина [Y10]ImII составил 15% в расчете на стартовую аминокислоту, ribbon-изомера 8%.
Для наработки препаративных количеств -конотоксина [Y10]ImII мы провели синтез с использованием одновременного замыкания дисульфидных связей. Окисление проводили в 50% ацетонитриле, что привело к образованию одного основного продукта. В результате совместного элюирования в условиях аналитической ВЭЖХ продуктов реакции одновременного замыкания дисульфидных связей с globular-изомером, который был получен с использованием поэтапного замыкания дисульфидов был идентифицирован изомер с природным расположением дисульфидных мостиков. Выход -конотоксина [Y10]ImII, синтезированного с использованием одновременного замыкания дисульфидных связей, составил 33%.
Синтез -конотоксинов Vc1.1, [Y0]MII, [L11, D16]ArIB, [S0, L11, D16]ArIB и [(SGGG)0, L11, D16]ArIB.
Синтезы -конотоксинов Vc1.1 и [Y0]MII были осуществлены на полимере Ринка, а [L11, D16]ArIB, [S0, L11, D16]ArIB и [(SGGG)0, L11, D16]ArIB на полимере Ванга. Для защиты функциональных групп использовали Fmoc-схему. Синтез проводили с использованием поэтапного замыкания дисульфидных связей. На основании экспериментов, описанных в предыдущем разделе, выбрали оптимальный порядок расположения защитных групп остатков цистеина - Cys1/Cys3 содержали tBu-группы, а Cys2/Cys4 - тритильные группы. Деблокирование с одновременным отщеплением пептида от полимера проводили в одну стадию с использованием смеси трифторуксусной кислоты с анизолом, водой и этандитиолом в качестве скевенджеров. По данным аналитической обращено-фазовой ВЭЖХ содержание линейных предшественников -конотоксинов после реакции деблокирования во всех синтезах составило более 70%
Для замыкания первой дисульфидной связи, между остатками Cys2/Cys4, использовали метод окисления кислородом воздуха в 50% растворе ацетонитрила. Для замыкания второй дисульфидной связи использовали смесь дифенилсулфоксида с метилтрихлорсиланом в трифторуксусной кислоте, содержащей анизол в качестве ловушки карбокатионов.
В заключение этого раздела необходимо отметить, что предлагаемая нами схема синтеза -конотоксинов разрабатывалась в течение нескольких лет на примере синтеза пептидов, необходимых для наших исследований ацетилхолиновых рецепторов, и неоднократно видоизменялась, вбирая в себя черты как работ зарубежных авторов, так и наше видение оптимальных путей синтеза. В конечном итоге, основные черты нашего подхода к синтезу природных -конотоксинов (но не их аналогов) заключаются в следующем:
1. Для защиты тиольных функций всех остатков цистеина использовать кислотолабильные защитные группы.
2. В случае получения линейного продукта высокой степени чистоты целесообразно не применять предварительную очистку, а сразу проводить реакцию замыкания дисульфидных связей.
3. Оптимальным для замыкания дисульфидных мостиков является использование смеси вода-ацетонитрил в объемном соотношении 1:1, при рН 8,5-9. Это позволяет уменьшить время окисления и получить целевой продукт с высоким выходом.
Можно полагать, что эта схема окажется полезной и для получения других биологически активных коротких пептидов, содержащих две дисульфидные связи – таких, как апамины или эндотелины. Эта схема в целом пригодна и для синтеза аналогов -конотоксинов, если в распоряжении исследователей имеются возможности с помощью структурного анализа или функциональных тестов идентифицировать изомер с природным расположением дисульфидных связей. Однако при отсутствии такой возможности оправдано использование ортогональных защит тиольной группы остатков цистеина и последовательное замыкание дисульфидных связей. Большим недостатком подхода, использующего ортогональные защиты, является низкий выход целевого продукта. Вследствие этого он мало подходит для синтеза препаративных количеств пептида, необходимых для проведения углубленных структурно-функциональных исследований. Поэтому нам кажется оптимальным использовать комбинацию этих подходов: для этого препаративные количества пептида следует получать с использованием одновременного замыкания дисульфидных связей, а для установления порядка расположения дисульфидных связей в полученных изомерах использовать совместное элюирование с пептидом, полученным по методу поэтапного замыкания SS-мостиков в аналитических количествах.
Исследование влияния структуры на биологическую активность -конотоксинов и их аналогов.
Определение биологической активности аналогов -конотоксина MI.
-Конотоксин MI принадлежит к классу токсинов, связывающихся с мышечными холинорецепторами. Общим для этого класса является наличие 3 аминокислотных остатков в первой цистеиновой петле. С другой стороны, -конотоксины, действующие на нейрональные нАХР (например ImII, MII, PnIA, GID) имеют по 4 остатка в первой петле. Можно предположить, что увеличение длины первой цистеиновой петли «мышечных» -конотоксинов может привести к увеличению сродства полученных аналогов к нейрональным подтипам нАХР. Для удлинения первой петли мы ввели остаток серина в положение 5 токсина MI.
Биологическую активность -конотоксина MI и его аналогов определяли по их способности взаимодействовать с мембраносвязанным никотиновым ацетилхолиновым рецептором из электрического органа ската Torpedo сalifornica. Для определения того, насколько увеличение длины первой цистеиновой петли повлияет на селективность пептида MI, была исследована способность взаимодействовать с нейрональным рецептором - 7 подтипом нАХР, трансфецированным в клетки GH4C1 (табл. 2).
Для проведения анализов без введения дополнительных модификаций в исследуемые соединения использовали метод конкурентного радиолигандного анализа, который основан на способности исследуемых аналогов подавлять связывание иодированного производного -бунгаротоксна ([125I]Bgt) с препаратами АХР2. Для этой цели было синтезировано радиоактивное производное -бунгаротоксина с введенным в остаток Tyr радиоактивным изотопом иода. В работе было использовано только моно-[125I]-иодированное производное -бунгаротоксина.
Ингибирующая активность всех полученных аналогов -конотоксина MI в концентрации 0,003 мМ представлена в Табл. 2.
Таблица 2. Ингибирующая активность аналогов -конотоксина MI.
| -конотоксин | Ингибирующая активность (Torpedo сalifornica), % | Ингибирующая активность (7), % |
| MI | 89 | 1 |
| [L10]MI | 62 | 5 |
| [GRCCS]MI(6-15) | 73 | 2 |
| [GCCS]MI(6-15) | 34 | 1 |
| [GCCS, L10]MI(6-15) | 20 | 1 |
Из приведенных данных видно, что наибольшую ингибирующую активность на рецепторе из Torpedo сalifornica проявил -конотоксин МI. Кроме того, достаточно высокую активность показал аналог с увеличенной длиной первой цистеиновой петли [GRCCS]MI(6-15). Следует отметить, что большое значение для активности имеет остаток аргинина во 2 положении, поскольку его удаление приводит к резкому падению активности пептидов [GCCS]MI(6-15) и [GCCS, L10]MI(6-15).
В тоже время -конотоксин [GRCCS]MI(6-15), имеющий увеличенную длину первой петли, а также аналоги [GCCS]MI(6-15) и [GCCS, L10]MI(6-15) не проявили высокого сродства к нейрональному подтипу холинорецептора.
Замена остатка лизина в 10 положении -конотоксина MI на лейцин несколько ухудшила сродство полученного аналога к холинорецептору Torpedo сalifornica по сравнению с немодифицированным пептидом. Однако, сродство этого аналога ([L10]MI) к нейрональному подтипу холинорецептора было наибольшим среди синтезированных аналогов, хотя его активность была значительно ниже, чем у «нейрональных» -конотоксинов.
Таким образом было показано, что увеличение длины первой цистеиновой петли не приводит к увеличению сродства соответствующих аналогов -конотоксина MI к 7 подтипу нАХР.
Определение биологической активности аналогов -конотоксина PnIA.
Для изучения влияния заряженных и гидрофобных аминокислотных остатков на сродство аналогов -конотоксина PnIA к 7 полтипу нАХР, был синтезирован ряд аналогов, в которых остаток в определенном положении пептидной цепи, несущий заряд, заменяли на гидрофобный остаток, либо заменяли на противоположно заряженный остаток.
Для исследования изменения сродства к 7 нАХР мы синтезировали ряд пептидов, в которых в качестве основы была выбрана последовательность пептида [A10L]PnIA.
2 Эта часть работы была выполнена совместно с д.х.н. И.Е. Кашеверовым в лаборатории лиганд-рецепторных взаимодействий
Также мы синтезировали пептиды, не несущие этой базовой мутации [A10L], но имеющие положительный заряд в 5 и 14 положениях - [H5]PnIA и [H5,R14]PnIA. Исследование их биологической активности проводили на 7 подтипе нАХР, трансфецированном в клетки GH4C1, а также на ацетилхолин-связывающих белках из A. californica и L. stagnalis.
Ингибирующая активность всех полученных аналогов -конотоксина PnIA в концентрации 0,003 мМ представлена в Табл. 3:
Таблица 3. Ингибирующая активность аналогов -конотоксина PnIA.
| -конотоксин | Ингибирующая активность (7), % | Ингибирующая активность (A. californica), % | Ингибирующая активность (L. stagnalis), % |
| [L10]PnIA | 65 | 100 | 100 |
| [H5]PnIA | 55 | 100 | 90 |
| [H5,R14]PnIA | 65 | 100 | 90 |
| [R5,L10]PnIA | 75 | 100 | 100 |
| [D7,L10]PnIA | 5 | 35 | 0 |
| [L10,K14]PnIA | 80 | 100 | 100 |
| [D5,L10]PnIA | 20 | 85 | 50 |
| [R7, L10]PnIA | 0 | 90 | 20 |
| [R5,D7,L10]PnIA | 0 | 50 | 30 |
| [R5,L10,R14]PnIA | 95 | 100 | 100 |
| [D5,R7,L10]PnIA | 10 | 100 | 50 |
| [D5,R7,V10]PnIA | 7 | 100 | 75 |
| [R5,D7,L10,R14]PnIA | 35 | 85 | 90 |
| [D5,R7,L10,R14]PnIA | 50 | 100 | 95 |
Интересно, что наиболее активным из всей серии аналогов оказался пептид [R5,L10,R14]PnIA: его сродство к 7 АХР оказалось больше, чем у описанных -конотоксинов [L10]PnIA, [R5,L10]PnIA и [L10,K14]PnIA, а с ацетилхолин-связывающими белками из A. сalifornica и L. stagnalis этот пептид показал 100% ингибирование. По-видимому, важную роль играет остаток пролина в 7 положении, поскольку аналоги [R5,D7,L10,R14]PnIA и [D5,R7,L10,R14]PnIA, в которых Pro7 заменен на аргинин или на аспарагиновую кислоту, резко снижали свою активность при взаимодействии с 7 АХР (снижениe сродства к ацетилхолин-связывающим белкам было выражено слабее).
При замене остатка пролина-7, а также аспарагиновой кислоты в 14 позиции, наблюдалось значительное снижение сродства полученных аналогов -конотоксина PnIA к 7 подтипу нАХР. Пептиды [D7,L10]PnIA, [R5,D7,L10]PnIA, [R7,L10]PnIA, [D5,R7,L10]PnIA и [D5,R7,V10]PnIA либо вообще не проявили активность, либо показали очень слабое взаимодействие с 7 АХР при концентрации 0,003 мМ; при этом первые два токсина проявили слабое сродство к обоим АХСБ, тогда как остальные обладали большим сродством к белку из A. сalifornica. Следует отдельно упомянуть -конотоксин [R7, L10]PnIA, который в исследуемой концентрации обладал высоким сродством к АХСБ из A. сalifornica, тогда как с белком из L. Stagnalis взаимодействовал достаточно слабо (ингибирующая активность 20%) и практически не связывался с 7 подтипом нАХР.
Влияние заряда в N-концевой части пептида было наглядно проиллюстрировано путем сравнения активностей -конотоксинов [D5,L10]PnIA и [R5,L10]PnIA. Последний обладал в несколько раз более высоким сродством к 7 подтипу нАХР и обоим ацетилхолин-связывающим белкам, по сравнению с аналогом, содержащим отрицательный заряд в пятом положении.
Было также установлено, что не только [A10L]-мутация приводит к появлению высокоактивных лигандов к 7 подтипу нАХР. Так, нами были синтезированы пептиды [H5]PnIA и [H5,R14]PnIA, содержащие соответствующие замены - [L5H] и [L5H, D14R], которые обладают такой же активностью, как и описанный ранее -конотоксин [A10L]PnIA. Сродство этих аналогов к ацетилхолин-связывающим белкам было также достаточно высоким.
Исследование влияния дополнительных N-концевых аминокислотных остатков на активность [L11, D16]ArIB.
Данная работа была проведена с использованием трех аналогов -конотоксина ArIB - [L11, D16]ArIB, [S0, L11, D16]ArIB и [(SGGG)0, L11, D16]ArIB. Первый аналог был описан в литературе как мощный антагонист 7 нАХР, который связывался с мембранами мышиного гиппокампа со сродством 1,1 нМ. Синтез этого аналога является хорошим примером того, как из «полиспецифичного» природного пептида ArIB путем замены нескольких аминокислотных остатков зарубежными авторами были получены эффективные и высокоспецифичные к 7 нАХР лиганды – [V11L,V16A] ArIB и [V11L,V16D] ArIB(Whiteaker P. et al., 2008).
Синтез новых аналогов был осуществлен с целью их последующей иммобилизации на твердом носителе и получения сорбента для аффинной хроматографии для выделения 7 подтипа нАХР из биологического материала. Для этого нами были получены аналоги, содержащие N-концевой остаток серина, отделенный от последовательности пептида в первом случае одним, а во втором – тремя остатками глицина. Эти остатки образуют «ножку», которая, как предполагается, не вносит конформационных ограничений в систему токсин-полимер. Для определения влияния дополнительных аминокислотных остатков на активность, исследовали способность полученных пептидов взаимодействовать с 7 подтипом нАХР трансфецированным в клетки GH4C1. Так IC50([L11, D16]ArIB,)= 0,84 М, IC50([S0, L11, D16]ArIB)= 0,81 М и IC50([(SGGG)0, L11, D16]ArIB)= 1,24 М. Показано, что добавление N-концевых остатков не привело к снижению активности -конотоксина [S0, L11,D16]ArIB, тогда как аналог [(SGGG)0, L11, D16]ArIB, содержащий четыре дополнительных N-концевых аминокислотных остатка, проявил сродство к 7 нАХР всего в 1,5 раза более низкое чем исходный пептид [L11, D16]ArIB. Высокое сродство к 7 подтипу нАХР позволит использовать эти аналоги для получения эффективного носителя для аффинной хроматографии.
Определение сродства -конотоксинов Vc1.1 и RgIA к 7 нАХР и АХБС из L. stagnalis.
Мы осуществили синтез природных -конотоксинов Vc1.1 и RgIA, ранее описанных в ряде работ. Интерес к ним вызван их способностью подавлять нейропатическую боль на моделях in vivo, что, как предполагается, связано с их способностью эффективно взаимодействовать с 910 подтипом холинорецептора. Ингибирующая активность -конотоксинов Vc1.1 и RgIA в концентрации 0,003 мМ представлена в табл. 4:
Таблица 4. Ингибирующая активность -конотоксинов Vc1.1 и RgIA.
| -конотоксин | Ингибирующая активность (7), % | Ингибирующая активность (L. stagnalis), % |
| RgIA | 55 | 45 |
| Vc1.1 | 50 | Не исследовано |
Определение биологической активности аналогов -конотоксинов ImII.
Особенность -конотоксина ImII заключается в том, что его аминокислотная последовательность, как и ряда других пептидов (BuIA, GIC, PIA, Vc1.1, PeIA и Lp1.1.), была выведена из анализа библиотеки кДНК, полученной из мРНК, содержащейся в ядовитых железах моллюсков. Однако, этот подход не позволяет установить порядок расположения дисульфидных связей и наличие посттрансляционных модификаций. Для анализа возможной активности разных дисульфидных изомеров -конотоксина ImII, мы синтезировали изомер с характерным для «природных» -конотоксинов расположением дисульфидных связей (Сys1/Сys3 и Сys2/Сys4), а также изомер, содержащий другой порядок замыкания дисульфидов- Сys1/Сys4 и Сys2/Сys3.
Пептид [Y10]ImII был синтезирован для последующего иодирования и анализа прямого связывания с никотиновым холинорецептором. Проведенные опыты показали, что исследуемые пептиды обладают высоким сродством к 7 нАХР и ацетилхолин-связывающим белкам из A. californica и L. stagnalis. Ингибирующая активность обоих изомеров -конотоксина ImII и [Y10]ImII в концентрации 0,003 мМ представлена в Табл. 5
Таблица 5. Ингибирующая активность -конотоксинов ImII, ImIIизо и [Y10]ImII.
| -конотоксин | Ингибирующая активность (7), % | Ингибирующая активность (A. californica), % | Ингибирующая активность (L. stagnalis), % |
| ImII | 95 | 80 | 90 |
| ImIIизо | 93 | 60 | 70 |
| [Y10]ImII | 85 | 80 | 55 |
С использованием полученных аналогов была проведена работа, в результате которой был найден дополнительный сайт связывания на Torpedo нАХР, отличный от сайта связывания агонистов и/или конкурентных антагонистов (Kasheverov et al., J. Neurochem., 2009).
Известно, что -конотоксины взаимодействуют с сайтами связывания агонистов и/или конкурентных антагонистов нАХР и АХСБ. -Конотоксины, связывающиеся с мышечным подтипом нАХР или 7 нАХР, конкурируют с -бунгаротоксином. Синтезированные нами -конотоксин ImII, его «ribbon» изомер, а также аналог содержащий замену W10Y, обладают схожим сродством к 7 нАХР человека и мышечному подтипу нАХР. Globular- и ribbon-изомеры -конотоксина ImII, а также аналог [W10Y]ImII вытесняли радиоактивно-меченный -бунгаротоксин из комплекса с 7 нАХР, экспресированным в клеточной линии GH4C1 (IC50 17, 23 М и 27 µМ соответственно), а также АХСБ L. stagnalis и A. californica (IC50 2.0-9.0 М).
Согласно данным, полученным с помощью поверхностного плазмонного резонанса (выполнено Rucktooa P., Амстердам), оба изомера связываются с иммобилизированными АХСБ, а также конкурируют с АХСБ за иммобилизованный -бунгаротоксин (Кd и IC50 2.5-8.2 М). Токсин [I125]ImII(W10Y) показал специфическое связывание с нАХР из Torpedo (Kd 1.5-6.1М) и вытеснялся -конотоксином ImII и его «ribbon» изомером, а также ImII(W10Y) с IC50 2.7, 2.2 и 3.1 µМ, соответственно. При этом -кобратоксин и -конотоксин ImI вытесняли [I125]ImII(W10Y) только при очень высоких концентрациях (IC50 более 90 µМ). Таким образом, полученные результаты показывают, что -конотоксин ImII и его аналоги имеют дополнительный сайт связывания на Torpedo нАХР, отличный от сайта связывания агонистов и/или конкурентных антагонистов.
Заключение.
Результатом данной работы является подбор оптимальных условий синтеза препаративных количеств природных -конотоксинов и их аналогов. Показано, что наибольших выходов целевого продукта можно достичь при синтезе с одновременным замыканием дисульфидных связей действием кислорода воздуха в смеси вода-ацетонитрил (1:1 v/v) при рН=8,5. Однако, такой подход требует дальнейшего анализа порядка замыкания дисульфидных связей. В данной работе также был исследован метод поэтапного замыкания дисульфидных связей. Установлено, что расположение защитных tBu-групп на остатках цистеина в положениях Cys1 и Cys3 приводит к увеличению выхода -конотоксина RgIA в 3,7 раза по сравнению с синтезом, в котором tBu-группы расположены в положениях Cys2 и Cys4. В данной работе впервые предложен метод разрушения комплексных соединений молекулы пептида с ионами таллия путем обработки раствором ЭДТА. Такие комплексные соединения могут образовываться (в зависимости от аминокислотной последовательности) при замыкании дисульфидных связей раствором трифторацетата таллия в трифторуксусной кислоте. Предложенный метод позволяет увеличить практическую значимость этого высокоэффективного реагента.
Синтезированные соединения были исследованы в опытах по связыванию с никотиновыми ацетилхолиновыми рецепторами двух типов – природным мышечным нАХР из электрического органа ската T. californica и нейрональным 7 подтипом нАХР человека, трансфецированным в клетках GH4C1, а также ацетилхолин-связывающими белками из A. сalifornica и L. stagnalis. Новые аналоги [Н5]PnIA и [Н5, R14]PnIA показали более высокое сродство, чем природный пептид, к 7 нАХР и АХСБ из A. сalifornica. Пептиды, последовательности которых были выбраны на основании молекулярного моделирования, а именно [D5,R7,V10]PnIA, [D5,R7,L10,R14]PnIA и особенно [D5,R7,L10]PnIA, имели высокую селективность к Ас-АХСБ. Влияние замен в положениях 10 и 14 конотоксинов оказалось незначительным, хотя эффект этих модификаций был очевиден в случае Ls-АХСБ. Так, аналоги [L10]PnIA и [L10, R14]PnIA не различались по сродству к Ac-АХБС, так же, как и [D5,R7,V10]PnIA, [D5,R7,L10,R14]PnIA и [D5,R7,L10]PnIA. В целом, полученные результаты подтверждают предсказательную способность построенных моделей взаимодействия пептидных лигандов и АХСБ и их применимость в разработке веществ с заданными параметрами.
Выводы.
1. Разработаны оптимальные условия синтеза -конотоксинов с использованием одновременного замыкания обеих дисульфидных связей при получении препаративных количеств в сочетании с поэтапным замыканием как для проверки корректности образования дисульфидов в природных -конотоксинах, так и для получения их аналогов.
2. Исследовано влияние расположения пар ортогональных защитных групп остатков цистеина на выход конечного продукта; показана возможность использования трифторацетата таллия при замыкании дисульфидных связей для повышения выхода аналогов -конотоксинов.
3. С использованием разработанных методик синтезированы 4 различных природных -конотоксинов и 29 новых аналогов, в том числе с неприродным порядком замыкания дисульфидных связей.
4. Показано, что изменение размера первой цистеиновой петли в -конотоксине MI не переключает его специфичность с никотинового ацетилхолинового рецептора (нАХР) мышечного типа Torpedo californica в пользу нейронального 7 нАХР человека. На основе -конотоксина PnIA получены аналоги, имеющие высокое сродство к 7 нАХР, а также аналог, селективный для ацетилхолин-связывающего белка A. californica.
5. С использованием -конотоксина ImII и его ImIIизо аналога и радиоактивного производного [W10Y]ImII показано, что на 7 нАХР эти соединения взаимодействуют с классическим центром связывания агонистов и конкурентных антагонистов, но имеют иной центр связывания на АХР Torpedo californica.
Основные результаты работы изложены в следующих публикациях:
- Kasheverov I.E., Zhmak M.N., Fish A., Rucktooa P., Khruschov A.Yu., Osipov A.V., Ziganshin R.H., D.D`hoedt, Bertrand D., Sixma T.K., Smit A.B. and Tsetlin V.I. Interaction of -conotoxin ImII and its analogs with nicotinic receptors and acetylcholine-binding proteins: additional binding sits on Torpedo receptor. J. Neurochem, 2009, 111 (4), 934-944.
- Хрущёв А.Ю., Жмак М.Н., Кашеверов И.Е., Цетлин В.И. Синтетические аналоги -конотоксинов в исследовании лиганд-связывающих сайтов никотиновых рецепторов. Биологические мембраны, 2009, 26(4), 333-334.
- Koval L., Lykhmus O., Zhmak M., Khruschov A., Tsetlin V., Magrini E., Viola A., Chernyavsky A., Qian J., Grando S., Komisarenko S., Skok M. Differential involvement of 42; 7 and 910 nicotinic acetylcholine receptors in B lymphocyte activation in vitro. Int. J. Biochem. Cell Biol., 2011, 43(4), 516-524.
- Хрущёв А.Ю., Жмак М.Н., Цетлин В.И. Оптимизация ситеза -конотоксинов. Тезисы докладов ХХI зимней молодежной школы «Перспективные направления физико-химической биологии и биотехнологии», 2009, Москва, 11.
- Khruschov A.Yu., Zhmak M.N., Kasheverov I.E., Tsetlin V.I. Synthetic analogues of alfa-conotoxins in research of binding sites of nicotinic receptors.. Abstracts of the 6 Joint meeting of the European neuropeptide club and the summer neuropeptide conference, 2009, Salzburg, 79.
- Khruschov A.Yu., Slovochotov I., Zhmak M.N., Kasheverov I.E., Tsetlin V.I. Radioactive derivatives of alpha-conotoxins for studies on nicotinic acetilcholone receptors. Abstracts of the 6 Joint meeting of the European neuropeptide club and the summer neuropeptide conference, 2009, Salzburg, 80.
- Khruschov A.Yu., Slovochotov I., Zhmak M.N., Kasheverov I.E., Tsetlin V.I. Synthesis and characterization of novel alpha-conotoxin MII and PnIA analogs. Abstracts of the 7 Joint meeting of the European neuropeptide club and the summer neuropeptide conference, 2010, Pecs, 88.
- Шелухина И.В., Струков А.С., Хрущёв А.Ю., Крюкова Е.В., Кашеверов И.Е., Цетлин В.И. Никотиновые рецепторы мозга, вовлеченные в развитие нейродегенеративных и психических заболеваний. Тезисы докладов совещания «нейродегенеративные заболевания: современные представления о патогенезе, диагностике и лечении», 2010, Москва, 48.
- Патентная заявка №2011104595. Аналог альфа-конотоксина PnIA, обладающий высоким сродством и селективностью к ацетилхолин-связывающему белку из Apysia californica. / Хрущев А.Ю., Жмак М.Н., Кашеверов И.Е., Цетлин В.И., дата поступления заявки 10.02.2011.
- Патентная заявка №2011104596. Аналог альфа-конотоксина PnIA, обладающий высоким сродством к альфа7 типу никотинового ацетилхолинового рецептора. / Хрущев А.Ю., Жмак М.Н., Кашеверов И.Е., Цетлин В.И., дата поступления заявки 10.02.2011.

