Координационные соединения галогенидов марганца и кобальта с протонированным ацетамидом
УДК 546.711+546.73]:549.4:547.46'054.4 На правах рукописи
МАСАКБАЕВА СОФЬЯ РУСЛАНОВНА
Координационные соединения галогенидов марганца и кобальта с протонированным ацетамидом
02.00.01 - неорганическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Республика Казахстан
Караганда, 2010
Работа выполнена на кафедре химии и химических технологий Павлодарского государственного университета имени С.Торайгырова.
| Научные руководители: | доктор химических наук, профессор Еркасов Р.Ш. кандидат химических наук, доцент Рыскалиева Р.Г. |
| Официальные оппоненты: | доктор химических наук, профессор Баткибекова М.Б. кандидат химических наук, доцент Оралова А.Т. |
| Ведущая организация | Южно-Казахстанский государственный университет имени М. Ауезова |
Защита состоится «21» декабря 2010 г. в 1100 часов на заседании диссертационного совета ОД 14.07.01. при Карагандинском государственном университете имени Е.А. Букетова по адресу: 100028, г. Караганда, ул. Университетская, 28, химический факультет, актовый зал.
С диссертацией можно ознакомиться в библиотеке КарГУ Е.А. Букетова, по адресу: г. Караганда, ул. Университетская, 28.
Автореферат разослан «___» ноября 2010г
Ученый секретарь

диссертационного ответа ОД 14.07.01
д.х.н., профессор Салькеева Л.К.
ВВЕДЕНИЕ
Общая характеристика работы. В диссертационной работе рассматриваются закономерности взаимодействия в системах галогенид марганца (кобальта) – ацетамид – неорганическая кислота – вода и условия синтеза образующихся соединений, их строение и физико-химические характеристики.
Актуальность темы. Координационные соединения с органическими лигандами, обладающие рядом полезных свойств, находят широкое применение в химической промышленности, медицине, что обуславливает необходимость расширения их ассортимента. Ранее были изучены процессы и продукты взаимодействия ряда солей s- и d- металлов (магний, бериллий, кальций, никель) с протонированным ацетамидом. Было показано, что соединения, образующиеся в изученных системах могут сочетать полезные качества исходных компонентов с вновь приобретенными. Они весьма перспективны в качестве органических и аналитических реагентов, исходных продуктов в химической промышленности, важна их роль в различных биохимических процессах. Помимо практических аспектов интерес к ним определен и тем, что они являются интересными объектами фундаментальных исследований из-за особенностей их строения.
Теоретический интерес к амидам, как объектам фундаментального исследования, вызван, прежде всего, тем, что в их молекулах присутствуют два электронодонорных центра – атомы карбонильного кислорода и аминного азота, взаимодействие между которыми обеспечивает молекулам амидов значительные дипольные моменты и уникальные физико-химические свойства.
Установлено, что соединения амидов с неорганическими кислотами обладают рядом полезных свойств. Введение в их молекулу солей биометаллов может существенно расширить область практического их применения и увеличить теоретические моменты по их структуре и строению, а также кислотно – основному взаимодействию.
Степень разработанности проблемы.
В научной литературе описаны отдельные способы получения координационных соединений, содержащих в своем составе соль металла, амид и неорганическую кислоту. Так ранее были исследованы системы гидрохлорид(тио)семикарбазида с неорганическими солями в Ошском педагогическом университете (профессор Мурзубраимов Б.). В настоящее время разработкой основ получения разнолигандных координационных солей биометаллов, карбамида (ацетамида) и неорганических кислот систематически занимаются сотрудники кафедры неорганической химии КазНУ им. аль-Фараби и кафедры химии ЕНУ им. Л.Н. Гумилева. Ими разработаны не только способы получения координационных соединений и найдены закономерности их образования, но и установлены перспективные области практического применения новых соединений. Исследования четырехкомпонентных систем: типа соль металла – ацетамид – неорганическая кислота – вода практически единичны.
Целью работы была разработка физико-химических основ синтеза координационных соединений галогенидов марганца (кобальта) с протонированным ацетамидом на основе изучения процессов взаимодействия этих солей с ацетамидом в водных растворах неорганических кислот методом растворимости при 25 0С и определение строения и физико-химических свойств полученных соединений.
В задачу исследования входило: изучение растворимости в четырехкомпонентных системах галогенид марганца (кобальта) – неорганическая кислота – ацетамид – вода; установление составов образующихся соединений и областей их кристаллизации в системах; установление закономерностей взаимного влияния компонентов на растворимость; идентификация синтезированных соединений химическими, физическими и физико-химическими методами исследования, поиск областей их практического применения.
В связи с тем, что в литературе нет данных о структурах координационных соединений галогенидов марганца (кобальта) с протонированным ацетамидом, в работе также была поставлена задача по изучению строения образующихся соединений.
Объектами исследования являются галогениды (хлорид, бромид, йодид) марганца (кобальта), протонированный ацетамид.
Предметом исследования являются растворимость в четырехкомпонентных системах галогенид марганца (кобальта) – ацетамид –неорганическая кислота (хлороводородная, бромоводородная, иодоводородная) – вода, закономерности образования новых соединений, их строение и свойства, перспективы их практического применения.
Методы исследования. В работе использованы следующие методы исследования: метод растворимости, метод Къельдаля, титриметрия, пикнометрия, капиллярный метод, метод «сухого остатка», метод рентгенофазового анализа, квантово-химический метод РМ3.
Научная новизна исследования. В работе впервые изучена: растворимость при 25 0С в шести четырехкомпонентных системах галогенид марганца (кобальта) – ацетамид – кислота – вода; свойства 14 новых разнолигандных координационных соединений, содержащих одновременно в своем составе галогенид марганца (кобальта), ацетамид и неорганическую кислоту, а также установлены закономерности влияния компонентов на растворимость изученных систем, растворимость двойных и тройных соединений, характер растворения образующихся координационных соединений; разработаны оптимальные условия синтеза в лабораторных условиях 14 новых координационных соединений; проведена идентификация синтезированных соединений методами химического, рентгенофазового анализов, определением температур плавления, плотности, растворимости в органических растворителях; ИК – спектроскопическим и квантово – химическим методом РМЗ установлено строение синтезированных соединений, найдены геометрические, энергетические и электронные параметры молекул.
Теоретической и практической значимостью является то, что результаты по растворимости в изученных системах, физико-химическим свойствам и строению впервые синтезированных соединений относятся к справочному материалу. Установленные закономерности взаимодействия компонентов в системах являются теоретической основой синтеза разнолигандных координационных соединений.
Разработанные способы и методики синтеза образующихся 14 новых координационных соединений могут быть использованы для получения других комплексов солей металлов с протонированными амидами.
Результаты по растворимости в системах используются при чтении специальных курсов в ЕНУ им. Л.И. Гумилева по дисциплинам «Химия координационных соединений» и «Физико – химический анализ многокомпонентных систем», в ПГУ им.С.М. Торайгырова внедрены в курсы по дисциплинам «Химия комплексных соединений», «Квантовая механика и компьютерная химия». Некоторые из синтезированных соединений могут использоваться в качестве микроудобрений при выращивании зерновых и кормовых культур.
Достоверность и обоснованность полученных данных подтверждается воспроизводимостью экспериментов, использованием классических и современных физических и физико-химических методов анализа, согласованностью результатов ИК-спектроскопических исследований соединений с квантово-химическим расчетом строения соединений.
Связь темы с планом научно – исследовательских работ. Работа проводилась в соответствии с Планом тематических научно – исследовательских работ Павлодарского государственного университета имени С.Торайгырова по теме «Разработка основ получения координационных соединений s- и d- металлов с протонированными амидами, обладающими физиологической активностью», на кафедре химии и химических технологий.
Основные положения, выносимые на защиту:
- изотермы растворимости и закономерности процессов комплексообразования в системах хлорид (бромид, иодид) марганца (кобальта) – ацетамид – хлороводородная (бромоводородная, иодоводородная) кислота – вода при 25 0С;
- методики синтеза 14 новых координационных соединений галогенидов марганца (кобальта) с протонированным ацетамидом;
- физико-химические характеристики и методики синтеза в лабораторных условиях впервые полученных соединений;
- структурные и энергетические параметры соединений составов:
| СоCl2 · 2 CH3CONH2· HCl | СоCl2 · 4 CH3CONH2· HCl |
| СоCl2 · 2 CH3CONH2· 2HCl | СоCl2 · 4 CH3CONH2· 4HCl |
Апробация работы. Материалы работы докладывались на Международных научно – практических конференциях: «Валихановские чтения - 13» (Кокшетау, 2008), «Vda: teorie a praxe - 2008» (Прага, 2008 ), VI Беремжановский съезд по химии и химической технологии (Караганда, 2008), «Валихановские чтения - 14» (Кокшетау, 2009).
Личный вклад автора заключается в выборе объектов исследования, теоретическом обосновании методологии подхода их решения, в выполнении экспериментальной части диссертационной работы и обобщении результатов проведенных исследований.
Публикации. По материалам диссертации опубликовано 8 статей в научных журналах, рекомендованных, Комитетом по контролю в сфере образования и науки МОН РК, и 4 тезисов докладов в материалах Международных научных конференций.
Структура и объем диссертации Работа изложена на 105 страницах машинописного текста, включающего введение, 3 раздела, заключение, список литературы из 120 наименований и приложения. Диссертация иллюстрирована 7 рисунками и 15 таблицами.
Основные результаты диссертации опубликованы в 12 печатных работах.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении дано обосновании актуальности темы исследования, ее новизны и научной значимости, обозначены цели и задачи исследования.
1 Свойства исходных компонентов и основные закономерности их взаимодействия
В первом разделе представлен литературный обзор, в котором приведены данные по физико-химическим свойствам исходных компонентов; процессам взаимодействия ацетамида с неорганическими кислотами и солями марганца и кобальта.
1.1 Физико – химические свойства исходных компонентов. В данном подразделе проанализированы литературные данные по основным характеристикам исходных компонентов: ацетамида, галогенидов марганца (кобальта), неорганических кислот.
1.2 Взаимодействие ацетамида с неорганическими кислотами и солями. Рассмотрены основные закономерности процессов взаимодействия ацетамида с неорганическими кислотами и солями марганца и кобальта.
2 Физико-химические основы получения координационных соединений галогенидов марганца и кобальта с протонированным ацетамидом
Во втором разделе приведены методики эксперимента, обобщены результаты изучения растворимости при 25 0С в четырехкомпонентных системах галогенид (хлорид, бромид, йодид) марганца (кобальта) – ацетамид – неорганическая кислота (хлороводородная, бромоводородная, иодоводородная) - вода и установлен ряд закономерностей взаимодействия в этих системах.
2.1 Методики эксперимента. Для исследования процессов взаимодействия галогенидов марганца (кобальта) с протонированным ацетамидом был выбран классический метод растворимости. Полученные результаты по растворимости в системах галогенид металла - ацетамид - неорганическая кислота - вода при температуре 250С изображены в виде центральной проекции пространственной изотермы. Фигуративные точки на проекции диаграммы выражают солевой состав системы, для учёта содержания воды рассчитаны значения водного числа
2.2 Растворимость в системах галогенид марганца – ацетамид – неорганическая кислота – вода. В качестве примера на рисунке 1 приведена центральная проекция растворимости системы MnCl2 - CH3CONH2 - HCl – H2O при 25о С.
Ветвь изотермы, включающая точки 1 – 6, отвечает насыщению растворов эвтонической смесью системы хлорид марганца – ацетамид – вода, состоящей из ацетамида и тетраацетамид хлорида марганца. Прибавление в эвтонический раствор хлороводородной кислоты приводит к образованию нового тройного соединения MnCl2 · 4CH3CONH2· 2HCl. Концентрация хлорида марганца в растворе при этом увеличивается от 10,83 % до 12,18 %, а ацетамида уменьшается от 69,52 % до 63,19 %. Водное число с ростом концентрации хлороводородной кислоты в растворе уменьшается от 0,86 до 0,68, что свидетельствует о незначительном всаливающем влиянии кислоты на растворимость смеси.

Рисунок 1 – Центральная проекция изотермы растворимости в системе хлорид марганца – ацетамид – хлороводородная кислота – вода при 25 0С
Точки системы 6 – 12 отвечают выделению из растворов образовавшегося нового тройного соединения MnCl2 · 4CH3CONH2· 2HCl. Рост количества HCl в растворе от 7,68 % до 12,37 % приводит к снижению содержания хлорида марганца от 12,18 % до 5,49 % и снижению количества ацетамида в растворе от 63,19 % до 47,19 %. С увеличением концентрации хлороводородной кислоты в растворе водное число увеличивается от 0,68 до 1,64, что указывает на её высаливающее влияние, на растворимость тройного соединения.
Ветвь изотермы, соответствующая точкам 12-15, отвечает кристаллизации из насыщенных растворов эвтонической смеси системы ацетамид – хлороводородная кислота – вода, состоящей из ацетамида и хлорида бис(ацетамида). Увеличение концентрации хлорида марганца до 4,32 % приводит к снижению количества ацетамида и хлороводородной кислоты от 57,02 до 49,47 % и 12,94 до 12,39 % соответственно. Рост водного числа от 1,34 до 1,66 свидетельствует о высаливающем влиянии хлорида марганца на растворимость исходной эвтонической смеси.
Ветвь изотермы включающая точки 11, 16-22, соответствует выделению в твердую фазу хлорида бис(ацетамида). Рост концентрации хлороводородной кислоты в растворе от 12,37 до 20,34% приводит к уменьшению количества ацетамида от 47,19 до 36,26 % и увеличению концентрации хлорида марганца от 5,49 до 7,80%. Хлороводородная кислота оказывает высаливающее влияние на растворимость 2CH3CONH2·HCl.
Точки 23-27 соответствуют выделению в твердую фазу эвтонической смеси системы ацетамид – хлороводородная кислота – вода, состоящей из хлоридов ацетамида состава 2:1и 1:1 в интервале концентраций кислоты 25,13 – 22,28%, хлорида марганца 0 – 5,46 %, ацетамида 38,87 – 35,38 %. Рост количества хлорида марганца до 5,46 % приводит к снижению концентрации хлороводородной кислоты и ацетамида в вышеуказанных интервалах. Увеличение водного числа от 1,48 до 1,63 свидетельствует о высаливающем влиянии хлорида марганца на растворимость амидкислот.
Ветвь изотермы, включающая точки 27-36 отвечает насыщению растворов гидрохлоридом ацетамида CH3CONH2· HCl. Увеличение количества хлороводородной кислоты в растворе от 22,28 до 30,80 % приводит к снижению концентрации ацетамида от 35,38 % до 13,99 %. Количество хлорида марганца при этом изменяется в интервале 5,46 – 8,38 %. Водное число с ростом концентрации хлороводородной кислоты увеличивается от 1,62 до 2,27, что указывает на высаливающее ее влияние на растворимость гидрохлорида ацетамида.
Прибавление в эвтонический раствор системы ацетамид – хлорид марганца – вода, содержащий 33,11% хлорида марганца и 39,42 % ацетамида, возрастающий до 11,69% хлороводородной кислоты, сопровождается снижением количества хлорида марганца от 33,11% до 18,86% и увеличением количества ацетамида от 39,42 % до 46,44 %. Уменьшение водного числа от 1,64 до 1,02 указывает на всаливающее действие хлороводородной кислоты на растворимость эвтонической смеси, состоящей из хлорида марганца и тетраацетамид хлорида марганца.
Ветвь изотермы, включающая точки 44-49, соответствует выделению в твердую фазу образовавшегося нового соединения состава MnCl2 · 2CH3CONH2 · HCl. Увеличение количества хлороводородной кислоты в растворе от 14,19 до 20,98 % приводит к снижению концентрации хлорида марганца от 16,28 до 8,59 % и ацетамида от 44,84 до 36,66%. Рост водного числа от 1,07 до 1,48, что свидетельствует о высаливающем влиянии кислоты на растворимость образовавшегося нового тройного соединения.
Ветвь изотермы, включающая точки 44, 50-53, отвечает выделению в твердую фазу соединения MnCl2 · 4CH3CONH2 · 2Н2О. Его кристаллизация происходит в следующих интервалах концентраций компонентов: хлороводородной кислоты от 8,67 до 14,19 %, ацетамида от 44,84 до 58,85 %, хлорида марганца от 14,51 до 17,19%. Водное число с ростом концентрации хлороводородной кислоты возрастает от 0,74 до 1,16, что указывает на высаливающее действие хлороводородной кислоты на растворимость дигидрат тетраацетамида хлорида марганца.
Точки 44,72, 54-61 соответствуют кристаллизации из насыщенных растворов гидрата бис(ацетамид) хлорида марганца. Рост концентрации хлороводородной кислоты от 13,51 до 20,98 % приводит к изменению количества хлорида марганца и ацетамида в растворе в интервалах 16,28 – 26,76 % и 22,18 – 45,4 % соответственно. Увеличение водного числа от 0,99 до 1,48, свидетельствует о высаливающем влиянии хлороводородной кислоты на растворимость соединения MnCl2 · 2CH3CONH2 · Н2О.
Прибавление в эвтонический раствор системы хлорид марганца – ацетамид – вода хлороводородной кислоты до концентрации 18,37% вызывает снижение количества хлорида марганца от 43,41 до 27,25 % и рост содержания ацетамида от 15,68 до 23,40 % (точки 62-71). Водное число при этом снижается от 3,72 до 1,54, что указывает на сильное всаливающее действие хлороводородной кислоты на растворимость эвтонической смеси.
Ветвь изотермы, соответствующая точкам 72-80, отвечает кристаллизации из насыщенных растворов исходной соли хлорида марганца MnCl2 · 4Н2О. Рост концентрации хлороводородной кислоты в растворе от 20,41 до 33,89 % уменьшает количество ацетамида от 22,18 до 2,09 %. Концентрация хлорида марганца при этом постепенно снижается до 19,07 %. Водное число с ростом концентрации кислоты возрастает от 1,48 до 2,24, что указывает на высаливающее действие хлороводородной кислоты на растворимость исходной соли марганца.
При изучении растворимости в четырехкомпонентной системе МnBr2 – CH3CONH2 – HBr – H2O были установлены концентрационные границы образования новых тройных координационных соединений следующих составов МnBr2 · 2CH3CONH2 · HBr, МnBr2 · 4 CH3CONH2 · HBr и установлены области кристаллизации двойных соединений и эвтонических составов составляющих трехкомпонентных систем: МnBr2 – CH3CONH2 – H2O и CH3CONH2 – HBr – H2O.
В системе MnI2 – CH3CONH2 – HI – H2O определены области кристаллизации двойных соединений и эвтонических составов составляющих трехкомпонентных систем йодид марганца – ацетамид – вода и ацетамид – йодоводородная кислота – вода, а также установлены области выделения в твердую фазу новых соединений составов: MnI2 · 4CH3CONH2· HI, MnI2 · 2CH3CONH2 ·HI, MnI2 · CH3CONH2 · HI.
2.3 Растворимость в системах галогенид кобальта – ацетамид – неорганическая кислота – вода. При изучении растворимости в системе CoCl2 –CH3CONH2 – HCl – H2O установлены концентрационные границы кристаллизации двойных соединений и эвтонических составов трехкомпонентных систем: CoCl2 –CH3CONH2 –H2O и CoCl2 – HCl – H2O, и определены концентрационные границы кристаллизации новых соединений составов: СоCl2 · 4CH3CONH2· 2HCl, СоCl2 · 2CH3CONH2· HCl
В четырехкомпонентной системе СоBr2 – CH3CONH2 – HBr – H2O найдены концентрационные границы кристаллизации исходных эвтонических составов и двойных соединений образующихся в трехкомпонентных системах: бромид кобальта – ацетамид –вода и ацетамид – бромоводородная кислота – вода и определены области выделения в твердую фазу новых соединений, содержащих в своем составе одновременно три исходных компонента: СоBr2 · 4CH3CONH2 · HBr и СоBr2 · 2CH3CONH2 · 2HBr.
Изучение растворимости в четырехкомпонентной системе CoI2 – CH3CONH2 – HI – H2O позволило установить области кристаллизации двойных соединений и эвтонических составов трехкомпонентных систем: CoI2 – CH3CONH2 – H2O и CH3CONH2 – HI – H2O, а также найдены концентрационные границы кристаллизации образования новых тройных соединений: СоI2· 4CH3CONH2·HI, СоI2 · 2CH3CONH2 ·HI, СоI2 · CH3CONH2·HI.
2.4 Закономерности взаимодействия в системах соль металла – ацетамид – неорганическая кислота – вода. Анализ хода изотерм растворимости исследованных систем позволил установить ряд закономерностей взаимного влияния компонентов, на концентрационные границы кристаллизации как двойных и тройных координационных соединений, так и исходных компонентов:
– увеличение концентрации неорганической кислоты при кристаллизации новых тройных соединений приводит к снижению водного числа, что свидетельствует о всаливающем действии кислоты на растворимость нового соединения, при этом уменьшается содержание ацетамида в насыщенном растворе;
– при кристаллизации двойных соединений галогенидов марганца (кобальта) с ацетамидом увеличение концентрации кислоты преимущественно вызывает уменьшение водного число, что указывает на всаливающее действие кислоты на растворимость соединений, при этом образуются новые тройные соединения, менее обогащенные ацетамидом, исключение составляют системы иодид марганца (кобальта) – йодоводородная кислота – ацетамид – вода в которых образование аналогичных тройных соединений происходит при высаливающем действии кислоты;
– кристаллизация в изученных системах амидкислот происходит по следующей закономерности: увеличение содержания солей кобальта (марганца) приводит к снижению количества ацетамида и уменьшению водного число, то есть добавление соли Мn2+(Со2+) оказывает всаливающее влияние на растворимость образующихся в системах амидкислот, при этом образуются новые тройные соединения менее обогащенные ацетамидом;
- рост концентрации кислот при кристаллизации исходных солей марганца (кобальта) оказывают на них высаливающее действие.
Анализируя полученные изотермы растворимости в четырехкомпонентных системах галогенид металла – кислота – ацетамид – вода можно сделать вывод, что образование новых соединений происходит как при взаимодействии амидкислоты с раствором соли металла, так и при взаимодействии соединения соли металла с ацетамидом и раствором, соответствующей кислоты. Таким образом, реакции, протекающие с образованием координационных соединений, содержащих в своем составе исходные компоненты можно объединить в следующие группы:
– сопровождаются соединением соли металла с амидкислотой:
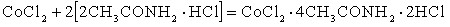
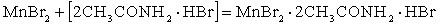
– сопровождается вытеснением из состава амидкислоты свободных молекул кислоты:
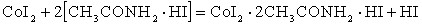
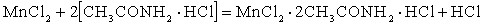
– сопровождается образованием новой амидкислоты:
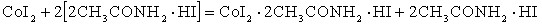

– сопровождается вытеснением из состава соединения амида с солью металла свободных молекул амида:
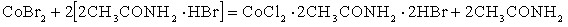
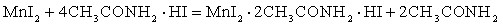
3 Синтез и некоторые физико-химические характеристики координационных соединений галогенидов марганца и кобальта с протонированным ацетамидом
В третьем разделе рассмотрены синтез, некоторые физико-химические характеристики новых координационных соединений. Соединения солей кобальта и марганца с протонированным ацетамидом идентифицировались методами химического и рентгенофазового анализа. Строения синтезированных соединений установлены при помощи анализа положения в ИК – спектрах характеристических полос поглощения различных функциональных групп амидов, а также проведением квантовохмических расчетов для некоторых из них.
3.1 Методики эксперимента. На основании данных по растворимости при температуре 250С в шести четырёхкомпонентных системах разработаны методики синтеза 14 новых координационных соединений.
3.2 Синтез и некоторые физико-химические характеристики полученных соединений. Физико-химические характеристики полученных тройных соединений приведены в таблице 1.
Из таблицы видно, что соединения солей кобальта и марганца с протонированным ацетамидом в основном разлагаются до плавления при температурах значительно ниже температур плавления исходных солей, но выше температуры плавления ацетамида.
Пикнометрические плотности тройных соединений имеют значения меньшие, чем исходные соли кобальта и марганца, но большие по сравнению с ацетамидом. С увеличением молярной массы соединений наблюдается увеличение плотности синтезированных соединений.
Полученные координационные соединения нерастворимы в бензоле и толуоле, плохо растворимы в диэтиловом эфире, хорошо растворимы в ацетоне и этаноле.
Новые соединения солей кобальта и марганца имеют собственный набор углов отражения, что свидетельствует об их структурной индивидуальности, но в положениях характеристических частот отражения нет закономерностей в их смещениях в ту или иную область углов.
Таблица 1 – Физико – химические характеристики галогенидов кобальта и марганца с протонированным ацетамидом
| Соединение | d, кг·м– 3 | t0пл(разл) 0С | Растворимость, г / 100 г растворителя | ||||
| бензол | толуол | этанол | ацетон | Диэтило-вый эфир | |||
| 1970 | (158) | 0,02 | н.р | 8,9 | 6,8 | 6,1 | |
| 2260 | 174 | н.р | н.р | 7,7 | 5,4 | 7,7 | |
| 2145 | (170) | 0,01 | н.р | 12,7 | 7,8 | 1,9 | |
| 2435 | 185 | н.р | н.р | 10,1 | 6,4 | 4,3 | |
| 2375 | (160) | 0,02 | н.р | 12,7 | 6,9 | 6,2 | |
| 2510 | 185 | н.р | н.р | 8,3 | 6,2 | 4,8 | |
| 2845 | 198 | н.р | н.р | 9,2 | 7,4 | 5,2 | |
| 1770 | (140) | 0,01 | н.р | 7,6 | 5,2 | 6,4 | |
| 1855 | 164 | н.р* | н.р | 5,3 | 4,7 | 4,2 | |
| 1875 | 164 | 0,01 | н.р | 15,3 | 8,7 | 2,7 | |
| 2230 | 182 | н.р | н.р | 14,0 | 6,3 | 3,2 | |
| 2100 | (174) | н.р | н.р | 8,7 | 6,2 | 5,2 | |
| 2340 | 193 | н.р | н.р | 6,3 | 5,8 | 2,6 | |
| 2420 | 210 | н.р | н.р | 4,8 | 3,4 | 3,3 | |
*н.р. – нерастворим
3.3 ИК – спектроскопия. Для идентификации соединений и установления центра координации в молекулах амидов и солей марганца (кобальта) положение полос поглощения в ИК– спектрах было сопоставлено с характеристическими частотами основных групп молекулы исходного ацетамида.
Частота валентных колебаний С=О связи ацетамида в спектрах координационных соединений смещается в низкочастотную область на 25 – 40 см– 1. Частота валентных колебаний связи С– N соединений ацетамида смещена в высокочастотную область на 10 – 35 см– 1, что свидетельствует об образовании связи через карбонильный кислород. Появление в ИК – спектрах соединений полос поглощения в области 3330 – 3390 см – 1 и 1705 – 1715 см – 1 указывает на О – протонирование, так как эти полосы поглощения относятся к валентным и деформационным колебаниям ОН – группы.
Частоты валентных антисимметричных колебаний NН – связи соединений ацетамида на 10 – 40 см – 1 смещаются в низкочастотную область. Полосы валентных симметричных колебаний NН – связи также смещены в низкочастотную область на 10 – 20 см – 1. Такие изменения характерны при участии аминогруппы амидов в образовании новых Н – связей NН…Х, где Х – анион кислоты.
Таким образом, синтезированные соединения предположительно имеют следующее строение:
- для соединений состава:
МеНаl2·4CH3CONH2·2ННаl:[Mе(CH3CO(Н)NH2)2+ Наl2 (CH3CONH2)2] Наl2-
- для соединений состава:
МеНаl2· 4CH3CONH2·ННаl: [Mе(CH3CO(Н)NH2)+ (CH3CONH2)3Наl2] Наl –;
- для соединений состава:
МеНаl2· 2CH3CONH2·ННаl: [Mе(CH3CO(Н)NH2)+ (CH3CONH2) Наl2]Наl –;
- для соединений состава:
МеНаl2· CH3CONH2·ННаl: [Mе(CH3CO(Н)NH2)+ Наl2Наl-]
3.4 Квантово – химические исследования. Квантово – химические расчеты, проводились по программе МОРАС 7, полуэмпирическим методом РМЗ.
Протонирование молекулы ацетамида по атому карбонильного кислорода, а также координация ацетамида с катионом кобальта приводят к заметному изменению электронных характеристик как атомов молекулы амида (С, N, О), так и в молекул комплекса в целом.
Присоединение даже одной молекулы неорганической кислоты приводит к заметному изменению электронных параметров (эффективных зарядов) на всех атомах в данных соединениях. Процесс протонирования по атому карбонильного кислорода ацетамида существенно меняет и другие важные электронные характеристики исследуемых моделей – ПИ и дипольные моменты.
Величина первого потенциала ионизации и дипольных моментов в протонированных кислотой молекулах ацетамида, хлорида ди– и тетраацетамидкобальта в различном мольном соотношении (2:1, 2:2, 4:1 и 4:2) значительно увеличивается по сравнению с непротонированными формами.
Как показывают проведенные квантово– химические расчеты взаимодействие исследуемых соединений с хлороводородной кислотой приводит к увеличению стабильности протонированных молекул ацетамида, хлорида ди– и тетраацетамидкобальта. При этом устойчивость протонированных моделей в различном мольном отношении хлорид ацетамидкобальта : кислота возрастает в ряду:
СоCl2 · CH3CONH2< СоCl2 · 4CH3CONH2· 2HCl < СоCl2 · 4CH3CONH2· HCl < < СоCl2 · 2CH3CONH2· HCl < СоCl2 · 2CH3CONH2· 2HCl
на что указывает увеличение энтальпий образования указанных моделей по абсолютной величине, наблюдающееся в том же направлении.
Сравнение полученных квантово–химическим методом величин полной энергии позволяет сделать вывод, что для всех рассчитанных моделей значения полной энергии зависят от их качественного состава и строения, что указывает на корректность расчета выбранного метода исследования.
3.5 Практическое применение. Результаты по растворимости в системах используются при чтении специальных курсов лекций в ЕНУ им. Л.И. Гумилева и в ПГУ им.С. Торайгырова. Некоторые из впервые полученных соединений показали эффективность в качестве добавки при выращивании зерновых культур.
ЗАКЛЮЧЕНИЕ
Выводы по результатам диссертационных исследований:
1. При изучении растворимости в 6 четырехкомпонентных системах, содержащих ацетамид, водные растворы хлоридов (бромидов, йодидов) кобальта (марганца) и соответствующие неорганические кислоты при 25оС, установлено, что кислотно – основное взаимодействие в системах соль металла – ацетамид – кислота – вода приводит к образованию в этих системах как соединений, существование которых было доказано при изучении растворимости в составляющих трехкомпонентных системах, так и 14 новых соединений, содержащих в своем составе одновременно галогенид марганца (кобальта), ацетамид, галогенводородную кислоту. Для которых, определен состав, характер растворения, концентрационные пределы их образования.
2. Из анализа полученных изотерм растворимости следует, что:
а) введение возрастающих количеств неорганической кислоты в эвтонические растворы систем галогенид марганца (кобальта) – ацетамид – вода снижает водное число, что свидетельствует о всаливающем действии кислот на растворимость эвтонических составов, которое приводит к образованию новой тройной соли;
б) при добавлении в эвтонические растворы систем ацетамид – неорганическая кислота – вода возрастающих количеств галогенидов марганца (кобальта) снижается содержание ацетамида в насыщенном растворе, и возрастает водное число, что указывает на высаливающее действие соли марганца (кобальта) на растворимость эвтонических составов, при этом также образуются новые тройные соли;
в) увеличение концентрации кислот в растворах, из которых кристаллизируются новые координационные соединения, содержащие в своем составе одновременно соль марганца (кобальта), ацетамид и кислоту, приводит преимущественно к уменьшению водного числа, что указывает на всаливающее влияние кислот на их растворимость.
Таким образом, образование новых соединений происходит как при взаимодействии амидкислоты с раствором соли металла, так и при взаимодействии соединения соли металла с амидом и раствором, соответствующей кислоты.
3. На основании диаграмм растворимости четырехкомпонентных систем дано обоснование способов получения и разработаны методики синтеза в лабораторных условиях 14 новых тройных соединений. Их индивидуальность доказана методами химического и рентгенофазового анализа. Для синтезированных соединений определены температуры плавления, плотности, растворимости в ряде органических растворителей. Плотности солей металлов с протонированным ацетамидом имеют промежуточные значения между плотностями ацетамида и солей металлов. Полученные соединения практически нерастворимы в бензоле и толуоле, малорастворимы в эфире, лучше растворимы в этиловом спирте.
4. Смещение в ИК – спектрах полос валентных колебаний С = О связи в низкочастотную область, С – N связи в высокочастотную область, появление в спектрах соединений полос поглощения ОН – групп свидетельствует о протонировании ацетамида по атому кислорода карбонильной группы.
5. Квантово– химический расчет показывает, что энергетически и геометрически более выгодным для комплексов кобальта и марганца является образование искаженной октаэдрической структуры. На состав и структуру координационных соединений значительное влияние оказывает протонирование ацетамида. Из полученных данных рассчитаны энтальпии образования, длины связей, энергии межэлектронного и межядерного взаимодействия и сродства к протону.
6. Результаты испытаний ряда впервые полученных соединений показали их эффективность в качестве добавки при выращивании зерновых культур (повышение урожайности на 25 – 28%) и они могут быть рекомендованы к использованию в сельском хозяйстве.
Оценка полноты решений поставленных задач. Задачи, поставленные в диссертационной работе, решены полностью. Изучены растворимости в четырехкомпонентных системах: галогенид (хлорид, бромид, иодид) марганца (кобальта) – неорганическая кислота (хлороводородная, бромоводородная, иодоводородная) – ацетамид – вода; установлены составы образующихся новых координационных соединений и области их кристаллизации в системах; установлены закономерности взаимного влияния компонентов в изученных системах; приведена идентификация 14 синтезированных соединений химическими, физическими и физико-химическими методами исследования, а также поиск областей их практического применения.
Сравнение результатов диссертации с лучшими достижениями в данной области и конкретные практические рекомендации по их использованию. В научной литературе описаны отдельные способы получения координационных соединений, содержащих в своем составе соль металла, амид и неорганическую кислоту, однако исследования систем хлорид (бромид, иодид) марганца (кобальта) – ацетамид – хлороводородная (бромоводородная, иодоводородная) – вода и сведений о соединениях, образующихся в них в научной литературе до настоящего времени не приводилось.
В данной работе на основании теоретических и экспериментальных исследований установлены закономерности взаимодействия компонентов в системах, которые являются теоретической основой синтеза разнолигандных координационных соединений. Результаты по растворимости в изученных системах, а также физико-химические свойства и строения, впервые синтезированных соединений относятся к справочному материалу.
Список опубликованных работ по теме диссертации
1 Еркасов Р.Ш., Масакбаева С.Р. Растворимость в системе MnСl2 –CH3CONH2 – HСl – H2O при 25о С // Вестник ПГУ. Сер. Химико-биологическая. 2007, № 3. – С. 93-101
2 Масакбаева С.Р. Еркасов Р.Ш., Рыскалиева Р.Г. Растворимость в системе MnI2 – CH3CONH2 – HI – H2O при 25о С // Вестник ПГУ. Сер. Химико-биологическая. 2007, № 4. – С. 164-174
3 Масакбаева С.Р., Еркасов Р.Ш., Рыскалиева Р.Г. Растворимость в системе CoCl2 – CH3CONH2 – HCl – H2O при 25о С // Вестник Карагандинского университета. Сер. Химия. 2007., № 4(48). – С.11-15
4 Еркасов Р.Ш., Масакбаева С.Р. Рыскалиева Р.Г. Растворимость в системе СоBr2 – CH3CONH2 – HBr – H2O при 25о С// Вестник ЕНУ им.Л.Н.Гумилева. 2007., №.6(60). – С.148-151
5 Еркасов Р.Ш., Масакбаева С.Р. Рыскалиева Р.Г., Аубакирова А.Ж. Растворимость в системе СоI2 – CH3CONH2 – HI – H2O при 25о С // Вестник Карагандинского университета им.Е.А. Букетова. Сер. Химия. 2008., № 2(50). –С.16-21
6 Еркасов Р.Ш., Колпек А., Абдуллина Г.Г., Рыскалиева Р.Г., Масакбаева С.Р. Закономерности взаимодействия некоторых галогенидов биометаллов с протонированными амидами // Материалы IV Международной научно- практической конференции «Валихановские чтения - 13» (24-26 апреля 2008), Том 7. Химия и методики преподавания. Биология и методики преподавания. Экология и охрана окружающей среды. Медицина. Кокшетау. – С. 11-12
7 Абдуллина Г.Г., Еркасов Р.Ш., Масакбаева С.Р., Рыскалиева Р.Г. Синтез координационных соединений хлоридов марганца (кобальта) и иодида никеля с протонированными амидами// Materily IV mezinrodni vdeko-praktik conference «Vda: teorie a praxe - 2008» (16-31 srpna 2008 roku) – Dl 10. Chemie a chemick tehnologie. Ekologie. Zempis a geologie. Praha. – C.16-19
8 Еркасов Р.Ш., Рыскалиева Р.Г., Масакбаева С.Р., Колпек А.К., Абдуллина Г.Г. Координационные соединения солей s– и d–металлов с протонированными амидами и перспективы их применения// Труды VI Международного Беремжановского съезда по химии и химической технологии (2-3 октября 2008 г.). Караганда, 2008. – С.348-352
9 Рыскалиева Р.Г., Еркасов Р.Ш., Масакбаева С.Р. Растворимость в системе МnBr2 – CH3CONH2 – HBr – H2O при 25о С // Вестник Национальной академии наук Республики Казахстан. 2008. – №5. – С. 11-14
10 Еркасов Р.Ш., Таутова Е.Н., Тугамбаева Т.Б., Жапаргазинова К.Х., Масакбаева С.Р., Агабекова А., Жиенбаева Д. Сравнительный анализ электронных и энергетических параметров протонированных ацетамидных комплексов хлорида кобальта // Вестник Карагандинского университета им.Е.А. Букетова. Сер. Химия. 2008. – № 4 (56). – С.19-23
11 Еркасов Р.Ш., Колпек А.К., Масакбаева С.Р., Мажитова А., Жумабеков А. ИК – спектроскопическое исследование координационных галогенидов марганца с протонированными амидами. // Материалы Международной научно- практической конференции «Валихановские чтения - 14» - Кокшетау. – 2009, – С. 128-131
12 Еркасов Р.Ш., Жапаргазинова К.Х., Тугамбаева Т.Б., Масакбаева С.Р., Е.Н. Таутова, Рыскалиева Р.Г. Квантово – химическая оценка геометрического строения протонированных ацетамидных комплексов кобальта // Вестник ПГУ. Сер. Химико-биологическая. 2009. – № 3. – С. 12- 20
Масакбаева Софья Русланызы
Марганец жне кобальт галогенидтеріні протондалан ацетамидпен кешенді осылыстары
«02.00.01 – бейорганикалы химия» мамандыы бойынша химия ылымдарыны кандидаты ылыми дрежесін алу шін дайындалан автореферат
Тйін
Таырыпты зектілігі. Біратар пайдалы асиеттерге ие болатын, органикалы лигандалары бар кешенді осылыстар химиялы нерксіпте ке олданыс табуда. Бл оларды трлеріні кеею ажеттілігін талап етеді.
Алдында алашы компоненттерді асиеттерімен бірге жаа асиеттерге ие болатын, кешенді осылыстарды жаа трі – амидышылдарды актуалдылыы крсетілген болатын. Оларды молекуласына биометалдар тздарын егізу оларды тжірибелік олдану аймаын елеулі арттыруы ммкін, сонымен атар рылымы мен рылысы, сонымен атар ышыл– негіздік рекеттесуі жайлы теориялы мліметтерді кбеюіне келуі ммкін.
Жмысты масаты марганец (кобальт) галогенидтеріні протондалан ацетамидпен кешенді осылыстарын осы тздарды ацетамидпен бейорганикалы ышылдарды сулы ерітінділерінде рекеттесу процестерін 25 0С-да ерігіштігі дісімен зерттеу негізінде синтездеуді физика– химиялы негіздерін зірлеу жне алынан осылыстарды рылысы мен физика – химиялы асиеттерін анытау болып табылады.
Зерттеу міндеті: марганец (кобальт) галогениді – бейорганикалы ышыл – ацетамид – су трткомпонентті жйелерде ерігіштікті зерттеу; тзілетін осылыстарды рамдары мен жйелердегі оларды кристалдану айматарын анытау; компоненттерді ерігіштікке зара сер ету задылытарын анытау; синтезделген осылыстарды химиялы, физикалы жне физика-химиялы зерттеу дістерімен идентификациялау, оларды тжірибеде олданылу айматарын табу.
Зерттеуді ылыми жаалыы. Жмыста алаш рет зерттелді: алты марганец (кобальт) галогениді – ышыл – ацетамид – су трткомпонентті жйелерде 25 0С-да ерігіштік; рамында бір мезгілде марганец (кобальт) галогениді, ацетамид жне бейорганикалы ышыл бар 14 жаа ртрлі лигандалы кешенді осылыстарды асиеттері; сонымен атар компоненттерді зерттелген жйелерді ерігіштіктеріне серлеріні задылытары, екілік жне штік осылыстарды ерігіштігі, тзілетін кешенді осылыстарды еру сипаты аныталды; лабораториялы жадайларда 14 жаа кешенді осылыстарды синтездеуді оптималды жадайлары дайындалды; синтезделген осылыстарды химиялы, рентгенфазалы талдаулар дістерімен сйкестендіру, балу температуралары, тыыздытары, органикалы еріткіштердегі ерігіштіктері бойынша сйкестендіру орындалды; синтезделген осылыстарды рылысы И – спектроскопиялы жне РМЗ квант – химиялы діспен аныталды, молекулаларды геометриялы, энергетикалы жне электронды параметрлері табылды.
Зерттеу нтижелері:
1. рамында ацетамид, марганец (кобальт) хлоридтеріні (бромидтеріні, иодидтеріні) сулы ерітінділері жне олара сйкес бейорганикалы ышылдар бар 6 трткомпонентті жйелерді 25оС-даы ерігіштіктерін зерттеуде металл тзы – ацетамид – ышыл – су жйелеріндегі ышыл-негіздік рекеттесу шкомпонентті жйелерді раушыларды ерігіштіктерін зерттеуде аныталан осылыстарды тзілуімен атар, рамдары, еру ерекшелітері, оларды тзілуіні концентрациялы шекаралары аныталан, рамында бір мезгілде марганец (кобальт) хлориді (бромиді, иодиді), ацетамид, хлорсутекті (бромсутекті, иодсутекті) ышыл бар, 14 жаа ртрлі осылыстарды тзілуіне келетіні аныталды
2. Алынан ерігіштік изотермаларыны талдауынан шыады: ацетамид – бейорганикалы ышыл – су жйелеріні эвтоникалы ерітінділеріне марганец (кобальт) тздарыны сетін млшерлерін осанда, аныан ерітіндідегі ацетамид млшері тмендейді жне су крсеткіші артады, бл марганец (кобальт) тзыны еріткіш емес асиетін, эвтоникалы рамдарды ерігіштігін крсетеді; з рамдарында бір мезгілде марганец (кобальт) тзы, ацетамид жне ышыл бар жаа кешенді осылыстар кристалданатын ерітінділерде ышылдарды концентрациялары артуы су крсеткішіні азаюына келеді, бл оларды ерігіштігіні еріткіш сер етуін крсетеді.
3. Трткомпонентті жйелерді ерігіштік диаграммалары негізінде алу дістеріні негіздемесі берілді жне лабораториялы жадайларда 14 жаа штік осылысты синтездеу дістемесі зірленді. Оларды даралыы химиялы жне рентгенфазалы талдау дістерімен длелденді.
4. И – спектрлерінде С = О байланысыны валенттік тербелістеріні тменжиілікті аймаа, С – N байланысыны жоарыжиілікті аймаа ыысуы, осылыстарды спектрлерінде ОН – топтарыны сііру жолатарыны пайда болуы, ацетамидті протондалуы карбонил тобыны оттегі атомы бойынша жретінін крсетеді.
5. Квант – химиялы есептеу кобальт жне марганец кешендері шін энегетикалы жне геометриялы трылардан арастыранда, брмаланан октаэдрлік рылымны тзілуі небары тиімді болатынын крсетеді. Кешенді осылыстарды рамы мен рылымына ацетамидті протондау небары кп сер етеді. Алынан мліметтер бойынша тзілу энтальпиялары, байланыстар зындытары, электронаралы жне ядроаралы рекеттесу энергиялары жне протона штарлы есептелді.
6. Алаш рет алынан біратар осылыстарды сынау нтижелері оларды днді даылдарды сіруде оспалар ретінде олдану тиімді болатынын (німділік 25 – 28%-а артады) крсетті жне олар ауыл шаруашылыында олдануа сынылуы ммкін.
ойылан міндеттерді шешілу толытыын баалау. Диссертациялы жмыста ойылан міндеттер толы шешілді. Трткомпонентті: марганец (кобальт) галогениді (хлорид, бромид, иодид) – бейорганикалы ышыл (хлорсутекті, бромсутекті, иодсутекті) – ацетамид – су жйелердегі ерігіштіктер зерттелді; тзілген жаа кешенді осылыстарды рамдары жне оларды жйелердегі кристалдану айматары аныталды; зерттелген жйелерде компоненттерді бір-біріне серлеріні задылытары аныталды; синтезделген 14 осылысты зерттеуді химиялы, физикалы жне физика-химиялы дістерімен сйкестендіру берілді, сонымен атар оларды тжірибеде олдану айматарын іздеу орындалды.
олдану аймаы. Жйелердегі компоненттерді рекеттесуіні аныталан задылытары ртрлі лигандалы кешенді осылыстарды синтездеуді теориялы негізі болады. Зерттелген жйелердегі ерігіштілік жайлы мліметтер, сонымен атар алаш рет синтезделген осылыстарды физика-химиялы асиеттері мен рылыстары анытамалы материалдар болып табылады.
Masakbaeva Sofia Ruslanovna
Coordination compounds manganese and cobalt halogenides with protonated acetamide
SUMMARY
The abstract of the thesis presented
for candidate scientific degree on specialty 02.00.01 – Inorganic Chemistry
Urgency of the research subject. Coordination compounds with organic ligands, possessing of useful properties, find wide application in chemical industry, medicine which caused necessity of their assortment expansion.
Earlier, it was shown urgency of new type complex compounds as amides acid, which combine the properties of initial component with newly gained one. Bringing in their molecule of the biometals salts can greatly increase the area of their practical using and enlarge the theoretical moments of their structure, as well acid - basic interaction.
The purpose of the research. The purpose of the work was a development of physical-chemical bases of the syntheses of manganese (cobalt) halogenides coordination compounds with protonated acetamide based on the study of interaction of these salts with acetamide in water solution of the inorganic acids by solubility method at 25 0С and determination of the structure and physical-chemical properties of the obtained compounds.
In problem of the study entered: study of solubility in four-component systems as: manganese (cobalt) halogenides - inorganic acid - acetamide - water; the establishment of composition of resulting compounds and their crystallizations area in systems; determination of regularities of the mutual influence components on solubility; identification of the synthesized compounds by chemical, physical and physical-chemical methods, searching of their practical application areas.
Scientific novelty of the research. In work for the first time is studied: solubility at 25 0С in six four-component systems as: manganese (cobalt) halogenides - acetamide - inorganic acid - water; the properties of 14 new coordination compounds, containing simultaneously in its composition manganese (cobalt) halogenides, acetamide and inorganic acid; the regularities of the influence of components on solubility studied systems, solubility of double and triple compounds, dissolution nature of rezulting coordination compounds; the optimum conditions of 14 new coordination compounds for laboratory synthesis is worked out; the identification of the synthesized compounds is realized by chemical methods, X-ray рhase analysis and by determination of melting temperature, density, solubility in organic solvent; by IR - spectroscopic and quantum - chemical method PM3 is established structure of the synthesized compounds, geometric, energy and electronic parameters of the molecules are found.
The results of the research:
1) At study solubility in 6 four-component systems, containing acetamide, water solutions manganese (cobalt) chloride (bromide, iodide) and corresponding inorganic acids at 250С is established that acid- basic interaction in system metal salt - acetamide - inorganic acid - water lead to formation compounds, which existence was proved by study solubility in forming three-component system, and 14 new compounds, containing in its composition simultaneously manganese (cobalt) chloride (bromide, iodide), acetamide, hydrochloric (hydrobromic, hydroiodic) acid, for which are determined composition, nature of dissolution, concentration limits of their formation.
2. From the analysis of solubility isotherm have been made the following conclusions: аt addition of increasing amount manganese (cobalt) salts into ephotonical solutions systems acetamide - an inorganic acid - water, the content of acetamide in saturated solution decreases and increases the water number which points a salting effect to manganese (cobalt) salts, solubility of ephotonical compositions; increase of the inorganic acid concentrations at crystallizations of new triple compounds containing simultaneously salt and protonated acetamide, brings to reduction of the water number and reduction of the acetamide contents are evidence of salting effect on solubility of new compounds.
3 The methods of obtaining of 14 new four-component triple compounds on the base of solubility diagrams for laboratory condition are given. Their individuality is proved by chemical and X-ray рhase methods.
4. The removing in IR-spectroscopic of valence fluctuations strips of C=O bound to low-frequency field, C - N bond to high-frequency field, also the appearance of absorb strips of OH-group are evidence of O – protonation of acetamide by oxygen atom of carbonilyc group.
5. Quantum- chemical calculation shows that energy and geometric more beneficial for cobalt, manganese complex is a formation of distorted octahedronion structure. The protonation of acetamide influences on composition and structure of coordination compounds.
6. The test results of series obtained new compounds showed their efficiency as additives in growing corn cultures (increasing to productivities on 25 - 28%) and they can be recommended to use in agricultures.
Evaluation of fulfillment of the problem solving. The stated problems in thesis are solved completely. The solubility in 6 four-component systems: manganese (cobalt) halogenides (the chloride, bromide, iodide) - inorganic acid (hydrochloric, hydrobromic, hydroiodic) - acetamide - water is studied; compositions which form new coordination compounds and their crystallization area in systems are established; the regularities of the mutual influence of components in studied system are established; 14 synthesized compounds are identified by chemical, physical and physical-chemical methods; search of their practical application areas is given.
The fields of application. The established regularities of the components interaction in systems are theoretical base of the syntheses coordination compounds. The results on solubility in studied system, physical-chemical characteristic and structures synthesized new compounds related to reference book.
Подписано в печать 15.11.10
Бумага офсетная. Формат 60х84 1/16
Объем 1,0. Тираж 120 экз.
Заказ №
Издательство «Print Shop»
г. Караганда, ул. Язева 2, тел.: 8(7212)73 12 14

