Факторы, влияющие на кинетику и механизм растворения диоксида титана и титанатов в серной кислоте
На правах рукописи
Русакова Светлана Михайловна
Факторы, влияющие на кинетику и механизм растворения диоксида титана и титанатов в серной кислоте
Специальность 02.00.01 – неорганическая химия
02.00.04 – физическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Москва-2011
Работа выполнена на кафедре химии конструкторско-технологического факультета Московского государственного технического университета «МАМИ»
| Научный руководитель | доктор химических наук профессор Горичев Игорь Георгиевич |
| Научный консультант | кандидат химических наук доцент Артамонова Инна Викторовна |
| Официальные оппоненты: | доктор химических наук профессор Зайцев Борис Ефимович доктор химических наук Евтушенко Юрий Михайлович |
Ведущая организация:
Институт металлургии и материаловедения им. А.А. Байкова РАН
Защита диссертации состоится 6 июня в 17 часов на заседании диссертационного совета Д 212.154.25 при Московском педагогическом государственном университете по адресу: 119021, Москва, Несвижский переулок, д.3.
С диссертацией можно ознакомиться в библиотеке МПГУ по адресу:
119991, Москва, ул. Малая Пироговская, д.1, стр.1.
Автореферат разослан «__» _________ 2011г.
Ученый секретарь
диссертационного совета Н.М. Пугашова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Диоксид титана входит в двадцатку основных продуктов химической промышленности. Российская Федерация обладает крупными мировыми запасами ильменита (титановой руды), а производство титанового пигмента отсутствует. Hеобходимо изыскивать новые технологии и условия выделения соединений титана из титансодержащего сырья. Кинетика выщелачивания ![]() из ильменита недостаточно изучена. Не известна природа лимитирующей стадии растворения и факторы, на нее влияющие, что не позволяет оптимизировать технологические процессы. Необходимо изучить отдельные стадии механизма растворения ильменита. Для этого требуется введение представлений из гетерогенной, электрохимической и химической кинетики, детальное изучение адсорбционных явлений на титане и его оксидах, изучение механизма и подбор условий кинетических процессов выщелачивания.
из ильменита недостаточно изучена. Не известна природа лимитирующей стадии растворения и факторы, на нее влияющие, что не позволяет оптимизировать технологические процессы. Необходимо изучить отдельные стадии механизма растворения ильменита. Для этого требуется введение представлений из гетерогенной, электрохимической и химической кинетики, детальное изучение адсорбционных явлений на титане и его оксидах, изучение механизма и подбор условий кинетических процессов выщелачивания.
В отечественной и зарубежной литературе накоплен экспериментальный материал по растворению оксидов титана и титанатов, но еще не разработаны обобщенные модели растворения титансодержащего сырья.
Результаты систематических исследований в этом направлении позволили бы количественно описать процессы растворения оксидов титана и титанатов.
Цель работы состоит в изучении влияния различных факторов (концентрации, pH, температуры, природы вещества, размера частиц, электрохимического потенциала) на кинетику растворения ![]() и титанатов в серной кислоте.
и титанатов в серной кислоте.
Для реализации этой цели были поставлены следующие задачи:
- Исследовать влияние различных параметров раствора электролита на кинетику растворения
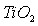 и титанатов в серной кислоте.
и титанатов в серной кислоте. - Детально изучить кислотно-основные характеристики
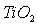 для определения заряда поверхности оксида и его адсорбционных свойств.
для определения заряда поверхности оксида и его адсорбционных свойств. - Исследовать зависимость адсорбционных характеристик
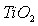 в зависимости от рН.
в зависимости от рН. - Выявить особенности электрохимического поведения пассивированного титана в растворах серной кислоты.
- Предложить механизм и рациональные технологические режимы выщелачивания
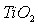 из титансодержащего сырья в серной кислоте.
из титансодержащего сырья в серной кислоте.
Научная новизна работы
- Предложены условия выщелачивания
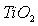 из ильменита, позволяющие предложить рациональные технологические режимы.
из ильменита, позволяющие предложить рациональные технологические режимы. - Выявлены механизмы растворения диоксида титана и ильменита и природа лимитирующей стадии, заключающаяся в переходе иона
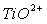 в раствор серной кислоты.
в раствор серной кислоты. - Исследована и математически описана анодная стадия растворения титана в серной кислоте, позволяющая выбрать условия влияния потенциала на кинетику растворения оксидных фаз титана.
- Изучены кислотно-основные равновесия, возникающие на границе
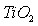 /электролит. Разработаны методики определения констант кислотно-основных равновесий на границе
/электролит. Разработаны методики определения констант кислотно-основных равновесий на границе 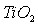 /электролит из данных потенциометрического титрования и анализа зависимости электрокинетического потенциала от рН.
/электролит из данных потенциометрического титрования и анализа зависимости электрокинетического потенциала от рН.
Практическая значимость работы
- Предложены технологические условия выщелачивания
 из титансодержащего сырья в серной кислоте (T=363K, концентрация 12-14 М, электрохимический потенциал -0.2В).
из титансодержащего сырья в серной кислоте (T=363K, концентрация 12-14 М, электрохимический потенциал -0.2В). - Найдены закономерности выщелачивания
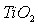 из титанатов (ильменита) в растворах концентрированной серной кислоты при условии предварительного получения плава на основе КHSO4, позволяющие усовершенствовать технологические процессы растворения и переработки титансодержащего сырья.
из титанатов (ильменита) в растворах концентрированной серной кислоты при условии предварительного получения плава на основе КHSO4, позволяющие усовершенствовать технологические процессы растворения и переработки титансодержащего сырья.
На защиту выносятся
- Экспериментальные результаты по влиянию различных факторов (рН, температура, величина электрохимического потенциала, концентрация электролита, размер частиц) на кинетическое и электрохимическое поведение пассивированного титана, его оксидов, титанатов.
- Методика анализа и обработки экспериментальных данных по кинетике растворения титанатов (ильменита), диоксида титана, пассивированного титана как гетерогенного процесса с использованием фрактальной геометрии.
- Экспериментальные результаты изучения кислотно-основных характеристик
 и пассивированного титана.
и пассивированного титана. - Результаты моделирования электрохимических процессов на пассивированном титановом электроде в среде серной кислоты.
Диссертация выполнена по плану НИР кафедры «Химия» Московского государственного технического университета «МАМИ», в рамках федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы, проект «Разработка новых технологий стимулирования растворения оксидов и гидроксидов металлов с целью утилизации отходов техногенных образований и переработки обедненных руд» (Государственный контракт № П205 от 22 июля 2009 г.)
Апробация работы
Материалы исследований докладывались на международных и всероссийских научно-технических конференциях Московского государственного технического университета «МАМИ», Российского университета дружбы народов, Института металлургии и материаловедения им. А.А. Байкова РАН, Белорусского государственный университета (г.Минск).
Публикации
По материалам диссертации имеется 12 публикаций, из них 4 в журналах из Перечня ведущих рецензируемых научных журналов и изданий, рекомендованных ВАК.
Структура и объем диссертации
Диссертация состоит из введения, 6 глав, выводов, списка использованных литературных источников, приложения. Материал работы изложен на 175 страницах машинописного текста, иллюстрирован 55 рисунками и 15 таблицами. Список литературы включает 157 наименований работ.
ОСНОВНОЕ СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Во введении обоснована актуальность темы и сформулированы цели исследования.
В ГЛАВЕ 1 рассмотрены физико-химические свойства оксидов титана и титанатов. Изложены современные представления о процессах, происходящих на границе оксид/электролит, рассмотрены кинетические закономерности процессов растворения оксидов титана на границе раздела фаз, обсуждаются основные модели гетерогенных реакций растворения и влияния на них кислотно-основных свойств оксидов и солей. Дан критический анализ состояния адсорбционных закономерностей на Ti и ![]() . Изучены электрохимические особенности поведения титана в кислых средах.
. Изучены электрохимические особенности поведения титана в кислых средах.
Проведенный критический анализ литературных данных показал, что в настоящее время процессы растворения оксидов титана и титанатов детально не изучены, так как не известна природа лимитирующей стадии и механизм процесса растворения.
ГЛАВА 2 посвящена объектам и методам исследования. В качестве объекта электрохимических испытаний использовали дисковый электрод, изготовленный из запрессованного в тефлон титана ВТ-2. Кислотно-основные, адсорбционные и кинетические исследования проводились с образцами диоксида титана модификации анатаз марки «хч» и титанатов железа, кальция, свинца, калия.
С целью идентификации исходного образца диоксида титана и титанатов использовались следующие методы и приборы:
- ИК-спектроскопия (ИК-фурье спектометр Nexus “Nicolet” в диапазоне волновых чисел 400-4000 см-1).
- Дифференциальный термический анализ (прибор ДТА-М-5).
- Рентгенофазовый анализ РФА (прибор ДРОН 3, CuK).
- Сканирующая электронная микроскопия СЭМ (прибор SCAN-S2). Найденные характеристики используемых образцов соответствуют стандартам.
Методика кинетических исследований растворения диоксида титана и титанатов. Навеску исследуемого вещества массой 0.5г вводили в термостатируемый реакционный сосуд, содержащий 0.25 л водного раствора Н2SO4 различной концетрации. Кинетику растворения оксидных фаз проводили при перемешивании смеси магнитной мешалкой при различных значениях температуры и скорости вращения. Пробы объемом 5 мл периодически отбирали с помощью стеклянного шоттовского фильтра №4. Готовили исследуемый и стандартные растворы и измеряли их оптические плотности по отношению к нулевому раствору на спектрофотометре СФ-56.
Методика изучения кислотно-основных равновесий. Изучение кислотно-основных свойств проводили методом потенциометрического титрования с использованием комбинированного (стеклянного и хлорсеребряного) электрода и термодатчика. Измерение рН осуществлялось рН-метром марки Эксперт 001. ![]() модификации «хч» массой 1г (на 50мл раствора) помещался в герметичную термостатируемую ячейку.Растворы гидроксида калия предварительно освобождались от карбонатов.
модификации «хч» массой 1г (на 50мл раствора) помещался в герметичную термостатируемую ячейку.Растворы гидроксида калия предварительно освобождались от карбонатов.
Методика изучения адсорбционных закономерностей на TiO2. Исследования проводились в термостатируемой ячейке объемом 250 мл при постоянной конвекции. Применялась продувка ячейки аргоном для предотвращения попадания атмосферной углекислоты.
Суспензию готовили непосредственно в ячейке. Значение рН среды регулировали с помощью НСl и NaOH.
Методика электрохимических исследований на титане в кислых средах. Исследования проводились в растворах серной кислоты с различными значениями рН (0-14) и концентрации фосфат-ионов (0,001М, 0,01М, 0,1М) на дисковом электроде из титана площадью 9мм2. Измерения проводили в потенциодинамическом режиме (потенциостат IPC PRO-2000). Электрод сравнения хлорсеребряный, потенциалы приведены по н.в.э., вспомогательный электрод платиновый.
В ГЛАВЕ 3 представлены результаты экспериментального изучения влияния различных факторов на кинетику растворения диоксида титана и титанатов в среде серной кислоты.
3.1. Влияние различных параметров электролита на кинетику растворения диоксида титана и титанатов в серной кислоте.
3.1.1. Экспериментальные данные зависимости доли растворенного диоксида титана от концентрации серной кислоты.
Изучена зависимость кинетики растворения диоксида титана от концентрации серной кислоты. Долю растворенной оксидной фазы рассчитывали по уравнению ![]() (1),
(1),
где ![]() – оптическая плотность раствора при полном растворении навески. Экспериментальные данные представлены в координатах доля растворенного оксида() – время (t) на рис.1, из которого следует, что с увеличением концентрации H2SO4 от 9 до 14.5 М доля растворенного
– оптическая плотность раствора при полном растворении навески. Экспериментальные данные представлены в координатах доля растворенного оксида() – время (t) на рис.1, из которого следует, что с увеличением концентрации H2SO4 от 9 до 14.5 М доля растворенного ![]() увеличивается. Характерной особенностью кинетических кривых (рис.1), является наличие двух участков – ускоренного растворения и замедленного, стремящегося к равновесию.
увеличивается. Характерной особенностью кинетических кривых (рис.1), является наличие двух участков – ускоренного растворения и замедленного, стремящегося к равновесию.
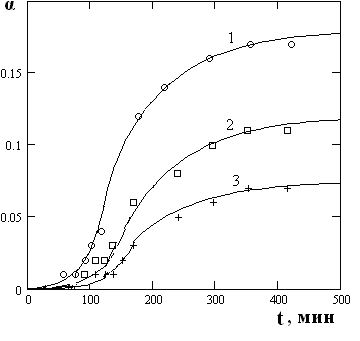 | Рис.1. Зависимость доли растворенного диоксида титана () от времени (t) при различной концентрации серной кислоты, моль/л: 1 – 14.5; 2 – 13.5; 3 – 9; T=363K |
3.1.2. Экспериментальные результаты зависимости степени растворения титанатов в серной кислоте от вида титаната Экспериментально изучено влияние природы титанатов на кинетику растворения их в серной кислоте для К2ТiO3, СаТiO3, FeТiO3, РbТiO3.
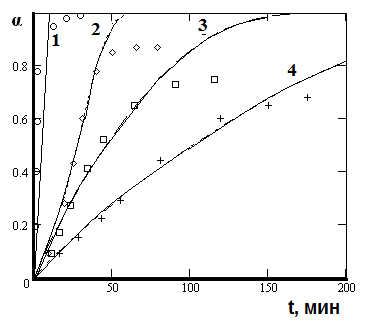 | Рис.2. Зависимость доли растворенных титанатов () от времени (t) в 14.5М Н2SO4 1-K2TiO3, 2-PbTiO3, 3-FeTiO3, 4-СaTiO3 Точки – экспериментальные данные, линии – графическое решение уравнения =1-exp(-Ash(W•)) |
Из анализа рис.2 видно, что более высокой скоростью растворения обладает титанат калия. Титанат железа, являющийся основным компонентом минерала ильменит, отличается более низкой скоростью растворения, что говорит о целесообразности перевода титаната железа в титанат калия для более полного извлечения ![]() из ильменита.
из ильменита.
3.1.3 Кинетика растворения ильменита в серной кислоте при различных значениях температуры.
Данные зависимости доли растворенного ильменита () в 10М H2SO4 от времени (t) при различных значениях температуры представлены на рис.3.
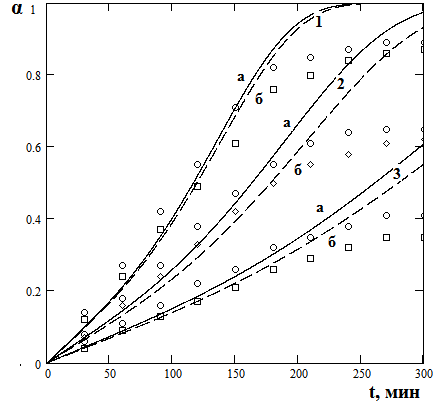 | Рис. 3. Зависимость растворения ильменита в 10М H2SO4 от времени при различных значениях температуры, K: 1 – 343; 2 – 353; 3 – 363. а – кривые растворения титана; б – кривые растворения железа Точки – экспериментальные данные, линии – графическое решение уравнения =1-exp(-Ash(W•)) |
Из рис.3 следует, что с увеличением температуры доля растворенного ильменита по ионам титана (IV) и железа (II) увеличивается.
3.1.4. Зависимость скорости растворения ильменита от интенсивности перемешивания.
Исследована зависимость растворения ильменита в 18М H2SO4 при T=370K от скорости перемешивания раствора (250, 350, 500 об./мин). В результате эксперимента выявлено, что степень растворения ильменита не зависит от скорости перемешивания, что указывает на кинетический контроль процесса.
3.2. Разработка методов анализа кинетических данных по растворению TiO2 и ильменита с позиций формальной гетерогенной кинетики
Для количественного описания данных процессов нами предлагается методика анализа кинетических кривых (a-t) с целью определения удельной скорости растворения (W), выявления математического выражения зависимости удельной скорости растворения от различных параметров, расчета порядков скорости растворения по ионам водорода и анионам и расчета эффективной энергии активации.
3.2.1. Анализ кинетических кривых с помощью метода аффинных преобразований координат.
Экспериментальные данные, представленные на рис.3, перестраивались в координатах a-t/t0.5, где t0.5-время растворения 50% навески (рис.4).
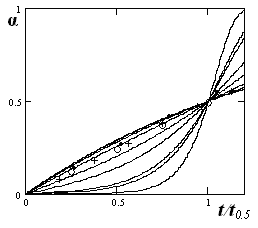 | Рис. 4. Зависимость доли растворенного ильменита в 10М H2SO4 от приведенного времени t/t0.5 Точки – экспериментальные данные, линии – графическое изображение уравнения (3) при различных значениях A. |
При обработке кинетических данных по растворению диоксида титана и титанатов в координатах —t/t0-5 выяснилось, что все точки ложатся на одну линию. Это указывает на то, что механизм растворения титанатов не зависит от природы катиона, концентрации серной кислоты и температуры.
3.2.2. Методы расчета удельной скорости растворения титанатов и TiO2 с использованием уравнений гетерогенной кинетики
Для определения величины удельной скорости растворения (W) все кинетические кривые в координатах -t описывались уравнениями гетерогенной кинетики. Использовались уравнения:
-модели участия всей поверхности в процессе растворения:
| (2), |
![]() где d – фрактальная размерность объема растворяющихся частиц
где d – фрактальная размерность объема растворяющихся частиц
-уравнение зависимости доли растворенного оксида от времени при различном количестве активных центров (А) (рис.5):
| -ln(1-) =А sh( Wt) =А sh | (3) | ||
| d/dt= W(1-)(A2+ln2(1-)), где А=0,2; 0.5=1,956; Wg= 0.5/ t0.5 | (4) | ||
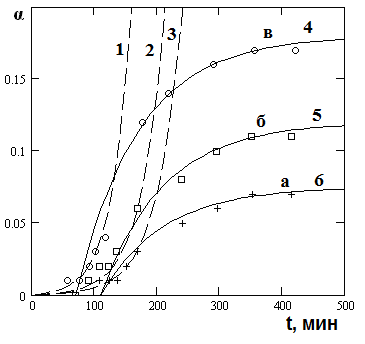 | Рис.5. Зависимость доли растворенного диоксида титана от времени при различной концентрации серной кислоты: а – 9; б – 13.5; в – 14.5 моль/л. (363K) 1,2,3 – моделирование начальных участков кинетических кривых с помощью уравнений цепного механизма (4); 4,5,6 – моделирование кинетических кривых с помощью уравнения обратимой реакции первого порядка: ln(1-/)=kt. | ||
Из анализа данных рис.5 следует, что с увеличением концентрации H2SO4 от 9 до 14.5 М доля растворенного ![]() увеличивается. Кинетические кривые описываются уравнениями гетерогенной кинетики.
увеличивается. Кинетические кривые описываются уравнениями гетерогенной кинетики.
![]() 3.3. Результаты исследования кинетических закономерностей диоксида титана в серной кислоте
3.3. Результаты исследования кинетических закономерностей диоксида титана в серной кислоте
3.3.1.Влияние концентрации серной кислоты на удельную скорость растворения диоксида титана
С увеличением концентрации кислоты скорость растворения оксида титана растет. (Рис.6)
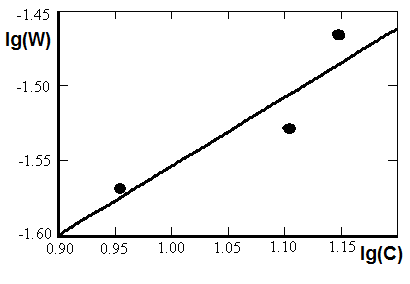 | Рис.6. Зависимость логарифма скорости растворения (lg(W)) TiO2 от логарифма концентрации (lg(C)) H2SO4. Точки – экспериментальные данные, линии – решение уравнения (5) |
Из зависимости lg(W)-lg(c), представленной на рис.6, рассчитаны значения скорости, констант и порядков растворения ![]() . Кинетические параметры растворения представлены в табл.1
. Кинетические параметры растворения представлены в табл.1
Таблица 1
Кинетические параметры растворения TiO2 в серной кислоте при T=371К
| Оксид | Начальные участки, цепной механизм | Конечные участки 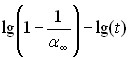 | |||
| А104 | 103W, мин-1 | 10-3W, мин-1 | |||
| TiO2 | 9,0 | 6,7 | 25 | 1,3 | 0,17 |
| 13,5 | 9,3 | 31 | 2,1 | 0,21 | |
| 14,5 | 17,0 | 33 | 6,4 | 0,19 | |
В общем виде, эмпирическая зависимость скорости растворения оксида титана от концентрации кислоты определяется уравнением:
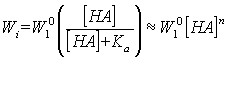 | (5) |
-Влияние рН. С ростом концентрации ионов водорода скорость процесса растворения увеличивается и описывается уравнением вида:
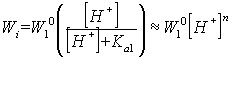 | (6) |
-Влияние анионов. Анионы активируют процесс растворения. Зависимость скорости растворения ильменита при постоянной концентрации ft выражается уравнением:
![]()
3.4. Кинетические закономерности растворения титанатов в серной кислоте
3.4.1. Влияние радиуса частиц ильменита на кинетику растворения.
Изучена зависимость удельной скорости растворения ильменита от размера частиц в 18М Н2SO4 при Т=370К. Из рис.7 видно, что с увеличением размера частиц скорость растворения уменьшается
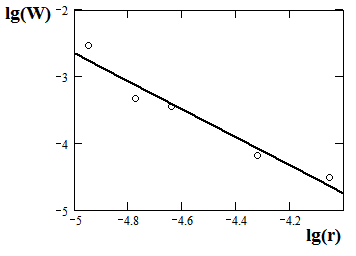 | Рис. 7. Зависимость логарифма удельной скорости растворения ильменита (lg(W)) от логарифма радиуса частиц (lg(r)) |
Удельная скорость растворения увеличивается с уменьшением размера частиц (r), так как уменьшается поверхностное натяжение оксидной фазы () по уравнению Толмена: = 0·1/(1+2·/r) (8)
3.4.2. Влияние природы титанатов на кинетику их растворения.
Рассчитаны зависимость удельной скорости растворения от природы титанатов. Для расчета скорости реакции использовали уравнение (4). Результаты расчетов представлены в табл.2. Показано, что К2ТiO3 (плав KHSO4 c TiO2) резко интенсифицирует процесс растворения.
Таблица 2.
Значения величин скорости растворения для различных титанатов
| Титанат | t0.5, мин | W, мин-1 | Титанат | t0.5, мин | W, мин-1 |
| К2ТiO3 | 5.31 | 0.9 | FeТiO3 | 46.68 | 0.015 |
| СаТiO3 | 28.12 | 0.03 | РbТiO3 | 101.33 | 0.007 |
3.4.3. Влияние температуры раствора на кинетические процессы.
С ростом температуры раствора от 343 до 363К скорость растворения ильменита FeТiO3 увеличивается (табл.3). Для расчета эффективной энергии активации экспериментальные данные перестраивались в координатах ln(W)-1/T.
Расчет показал, что эффективная энергия активации равна:
Еа(TiO2) = 41 ± 1 кДж/моль; Еа(FeTiO3) = 44 ± кДж/моль.
Таблица3.
Зависимость скорости растворения ильменита от температуры
| T,K | 343 | 353 | 363 |
| W104, мин-1 | 8,6 | 13,9 | 25,9 |
ГЛАВА 4 посвящена исследованию адсорбционных и кислотно-основных свойств ![]() .
.
4.1.Результаты изучения кислотно-основных характеристик TiO2. Предложены методики изучения кислотно-основных характеристик, основанные на использовании метода потенциометрического титрования и данных зависимости электрокинетического потенциала от рН.
4.1.1. Экспериментальные данные кислотно-основных равновесий на границе TiO2/электролит и результаты расчета констант равновесия из данных потенциометрического титрования
Методом потенциометрического титрования проведено экспериментальное исследование кислотно-основных характеристик суспензий диоксида титана. На границе ![]() /электролит существуют 4 кислотно-основных равновесия, описываемые следующими уравнениями:
/электролит существуют 4 кислотно-основных равновесия, описываемые следующими уравнениями:
| (9) |
Этапы расчета констант кислотно-основных равновесий методом потенциометрического титрования:
А. Математическое описание кривых титрования
С помощью уравнений кривых титрования фонового электролита (10) и суспензии ![]() (11) были рассчитаны концентрации ионов водорода
(11) были рассчитаны концентрации ионов водорода ![]() , которые адсорбировались на поверхности диоксида титана.
, которые адсорбировались на поверхности диоксида титана.
| (10) |
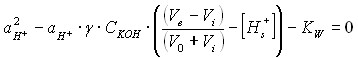 | (11) |
где ![]() – активность ионов водорода; V0 – объем исходного раствора; Ve - объем раствора щелочи, соответствующий точке эквивалентности; Vi – объем добавленной щелочи;
– активность ионов водорода; V0 – объем исходного раствора; Ve - объем раствора щелочи, соответствующий точке эквивалентности; Vi – объем добавленной щелочи; ![]() – коэффициент активности ионов водорода, Kw – ионное произведение воды.
– коэффициент активности ионов водорода, Kw – ионное произведение воды.
Б. Расчет заряда поверхности осуществлялся по уравнению:
| (12) |
где т — масса оксида в суспензии (г/л), S — поверхность оксида (см2/г).
В. Константы равновесия рассчитаны с помощью уравнения:
| (13) |
Расчет констант основан на сопоставлении экспериментальных и теоретических значений заряда по уравнению (13). Результаты расчета представлены в табл. 4. На рис. 8 представлена экспериментальная зависимость заряда поверхности ![]() от рН раствора (рНт.н.з=5.8).
от рН раствора (рНт.н.з=5.8).
Из рис.8 видно, что при рН меньше рНт.н.з. поверхность имеет положительный заряд, возникающий за счет адсорбции ионов водорода, при рН больше рНт.н.з. отрицательный.
 | Рис.8 Зависимость заряда поверхности |
Таблица 4.
Значения констант кислотно-основных равновесий для разных концентраций фонового электролита
| С(КNO3), моль/л | рНт.н.з.±0,2 | ||||
| 0,001 | 3,0 | 9,6 | 5,8 | 6,8 | 6,3 |
| 0,01 | 3,1 | 9,1 | 6,0 | 6,0 | 6,0 |
| 0,1 | 3,5 | 8,1 | 6,6 | 5,0 | 5,8 |
4.1.2. Методика расчета констант равновесия из данных зависимости электрокинетического потенциала от рН электролита
Суть методики состоит в анализе зависимости -рН, которые пересчитываются на величину заряда при разных значениях рН.
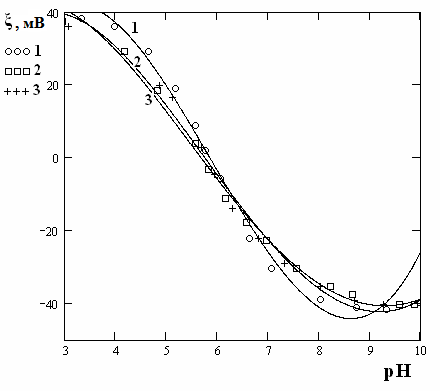 | 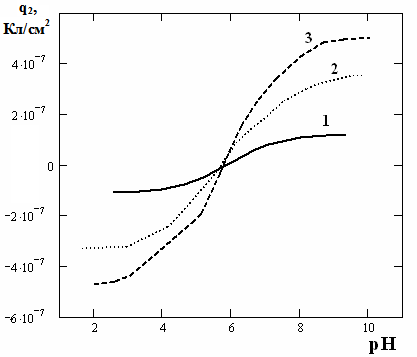 |
| Рис.9 Зависимость электрокинетического потенциала от рН, возникающего на границе TiO2/ KNO3 для разных концентраций фонового электролита (1-0,1M; 2-0,01M, 3-0,001М) | Рис.10 Зависимость заряда поверхности TiO2 от рН при различных концентрациях фонового электролита KNO3 (0,1M; 0,01M, 0,001М) |
Из рис.9 и рис.10 следует, что величина электрокинетического потенциала уменьшается с увеличением значения рН, а заряда увеличивается.
Таблица 5.
Сопоставление значений термодинамических констант, определенных из зависимости электрокинетического потенциала от рН и данных потенциометрического титрования
| Метод определения | С(КNO3), моль/л | рНт.н.з. ±0,2 | ||||
| Потенцио- метрия | 0,001 | 3,0 | 9,6 | 5,8 | 6,8 | 6,3 |
| Из зависимости -pH | 0,01 | 4.4 | 9 | 6.33 | 7.07 | 6.7 |
Из анализа данных, представленных в табл.5 следует, что результаты, полученные двумя различными методами близки по значениям, что доказывает правильность выбранных подходов.
4.2. Изучение адсорбции ионов на границе поверхность TiO2/электролит.
Процесс растворения начинается с адсорбции ионов водорода на поверхности диоксида титана. Из данных потенциометрического титрования и найденных значений констант проведено распределение различных форм гидроксосоединений титана, образующихся на поверхности ![]() в зависимости от значений pH раствора (рис.11). Основной поверхностной частицей, являющейся активным центром растворения является
в зависимости от значений pH раствора (рис.11). Основной поверхностной частицей, являющейся активным центром растворения является ![]()
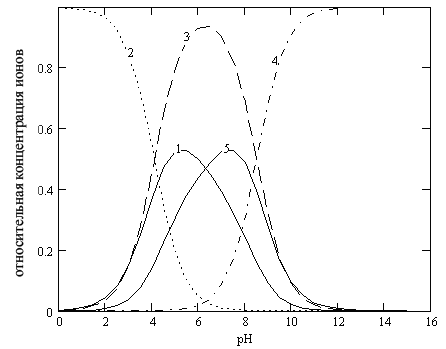 | Рис.11. Зависимость относительной концентрации поверхностных ионов титана от рН раствора |
Экспериментально определена поверхностная концентрация ионов водорода ![]() на поверхности диоксида титана при различных значениях рН. (рис.12)
на поверхности диоксида титана при различных значениях рН. (рис.12)
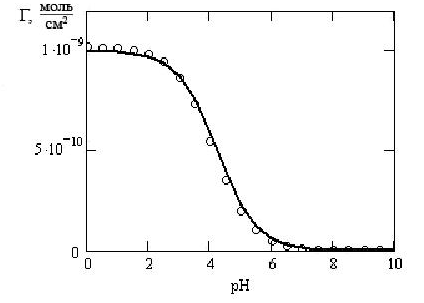 | Рис.12 Зависимость адсорбции ионов водорода на поверхности TiO2 от рН раствора Точки – экспериментальные данные, линии – графическое решение уравнения (14) |
Проведенное моделирование экспериментальных данных по адсорбции ионов водорода (![]() ) с помощью изотермы Ленгмюра показало, что зависимость адсорбции от концентрации ионов в растворе выражается уравнением вида:
) с помощью изотермы Ленгмюра показало, что зависимость адсорбции от концентрации ионов в растворе выражается уравнением вида:
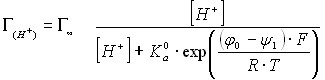 | (14) |
где ![]() – скачок потенциала между поверхностью оксида и внутренней плоскостью Гельмгольца. Особенностью изотермы является зависимость константы равновесия от потенциала в ДЭС.
– скачок потенциала между поверхностью оксида и внутренней плоскостью Гельмгольца. Особенностью изотермы является зависимость константы равновесия от потенциала в ДЭС.
ГЛАВА 5 посвящена изучению влияния потенциала на электрохимическое поведение титана и восстановительное растворение диоксида титана в серной кислоте. Экспериментально изучено электрохимическое поведение титана в среде серной и фосфорной кислот.
5.1. Результаты экспериментального изучения зависимости стационарного потенциала титанового электрода от рН
Экспериментально изучено влияние фосфат-ионов на стационарное значение потенциала титанового электрода при различных условиях его пассивирования. Зависимость стационарного потенциала от рН представлена на рис.13.
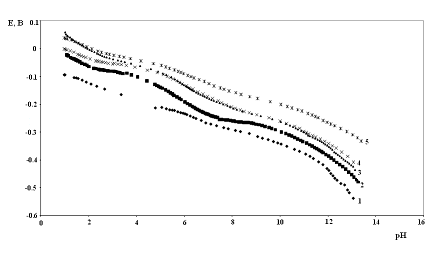 | Рис. 13. Влияние условий формирования пассивной плёнки на зависимость Eст. – pH. 1 – 10N H3PO4 в течение 20 часов; 2 – 1N H3PO4 при рН 0.99, Е 300 мВ в течение 7 суток; 3 – 1N H3PO4 при рН 0.99, Е 300 мВ в течение 30 минут; 4 – 1N H3PO4 при рН 3.10, Е 300 мВ в течение 30 минут; 5 – 1N H3PO4 при рН 10.72, Е 300 мВ в течение 30 минут |
Из данных рис.13 следует, что с увеличением рН стационарный потенциал смещается в катодную область, а фосфат ионы смещают стационарный потенциал в анодную область. В кривой 1, соответствующей 10N H3PO4, наблюдается линейная зависимость между Eст. и pH, которая характеризуется следующими параметрами:
| E0 = 0.08±0.01В, |
что соответствует протеканию реакции:
| TiO2 + 1e + 3H+ = TiOH2+ + H2O, |
а величина потенциала описывается уравнением Нернста
| E = –0.08 + 0.240pH – 0.059lg[Ti3+] |
Найдено, что на поверхности пассивного электрода адсорбируются различные формы фосфат ионов. Сопоставляя данные потенциометрического титрования суспензии TiO2 и H3PO4, рассчитано распределение фосфат ионов на поверхности TiO2 в зависимости от pH, представленное на рис.14 Титан, покрытый фосфат-ионами может являться ионселективным индикаторным электродом на различные фосфат-ионы при определенных значениях рН среды.
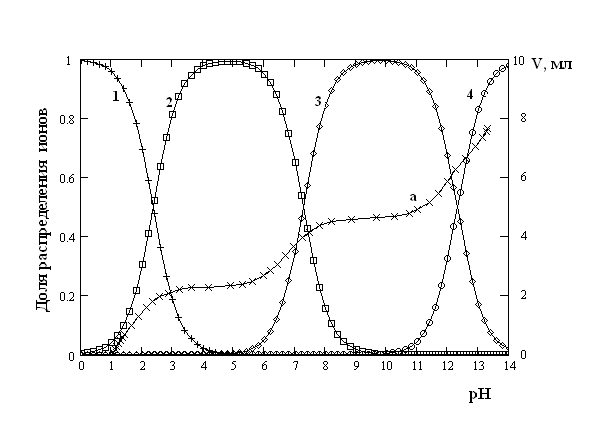 | Рис.14. Зависимость относительной доли распределения различных ионов фосфорной кислоты от рН. 1 – H3PO4; 2 – H2PO4-; 3 – HPO42-; 4 – PO43-; a – кривая титрования 1N Н3PO4 щелочью КОН (9.97N) pK1=2.3±0.1; pK2=7.3±0.1; pK3=12.3±0.1 |
Результаты расчета областей адсорбции соответствуют распределению различных ионов Н3PO4 на поверхности TiO2. (рис.15)
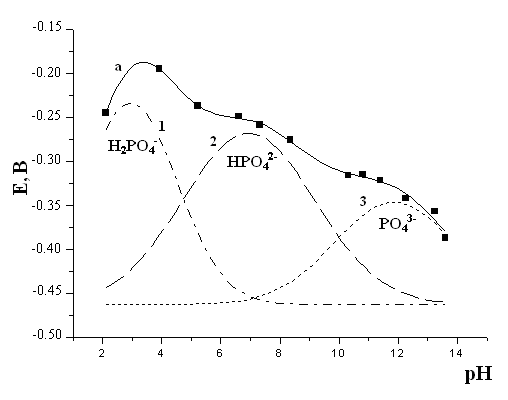 | Рис. 15. Сравнение зависимости Eст.(a) и распределения различных ионов фосфорной кислоты от рН. 1 – H2PO4-; 2 – HPO42-; 3 – PO43-. Точки – экспериментальные данные, линии – распределение ионов фосфорной кислоты по Гауссу. |
5.2. Результаты экспериментального исследования электрохимических процессов при анодной поляризации титанового электрода в среде серной кислоты
5.2.1.Влияние рН на величину анодного тока при поляризации титанового электрода в растворах серной кислоты.
На рис.16 представлены экспериментальные данные анодной поляризации титанового электрода в серной кислоте, из анализа которых следует, что на кривых I-E наблюдается активное образование Ti(OH)3. Величина тока максимума зависит от значений рН раствора. При потенциалах больше, чем - 0.2В Ti(OH)3 переходит в Ti(OH)2
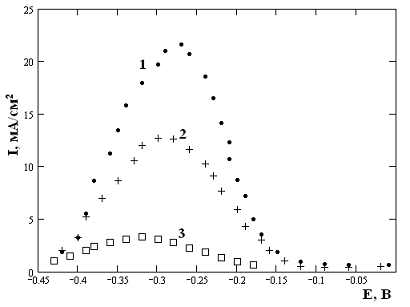 | Рис. 16 Зависимость логарифма тока максимума при поляризации титанового электрода от значений рН: 1 – 0.25; 2 – 0.5, 3 – 1. |
В активной области поляризации наблюдается зависимость:
| Е(i) = -0.674 + 0.099lg(i), |
- Моделирование анодного процесса при поляризации титанового электрода в серной кислоте.
Проведено компьютерное моделирование зависимости I-E, которое определяется уравнениями реакций:
| Ti(OH)2+H2O D Ti(OH)3 + H+ + е | (15) |
| Ti(OH)2+H+ TiOH++H2O | (16) |
| Ti(OH)3+H2O D Ti(OH)4+ H+ + е | (17) |
| Ti(OH)3 + H+ Ti(OH)2++H2O | (18) |
Этапы моделирования:
А. Расчет степеней покрытия гидроксидами титана различной степени окисления.
Б. Расчет парциальных токов электрохимического поведения различных гидроксидов.
В. Расчет суммарного тока.
Используя математические уравнения зависимости парциальных токов реакций (15) – (18), рассчитана зависимость суммарного тока анодной стадии растворения пассивного титана от потенциала(рис.17).
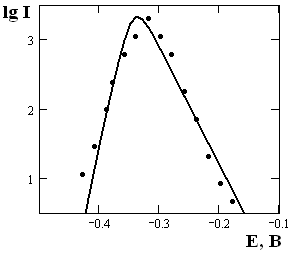 | Рис.17. Моделирование зависимости логарифма тока от потенциала при анодной поляризации титанового электрода (рН 1). Точки – экспериментальные данные, линия – графическое решение зависимости суммарного тока от потенциала для различных стадий (а – г) |
В результате электрохимических исследований было установлено, что для увеличения скорости растворения TiO2 нужно создавать потенциал -0.3В (т.е. в раствор добавлять восстановители)
ГЛАВА 6 посвящена моделированию механизма растворения диоксида титана и ильменита FeTiO3 в серной кислоте. Анализ влияния различных параметров на удельную скорость растворения ![]() и FeTiO3 в растворах серной кислоты показал, что такую зависимость можно представить уравнением:
и FeTiO3 в растворах серной кислоты показал, что такую зависимость можно представить уравнением:
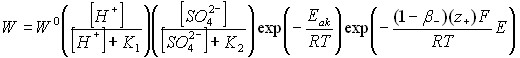 | (19) |
6.1.Схема механизма растворения диоксида титана в серной кислоте. Совокупность полученных экспериментальных данных позволяет предложить следующую схему механизма растворения диоксида титана:
1.Поверхностная гидратация диоксида титана (по результатам ИК-спектроскопии)
![]()
2.Протонирование связей металл-кислород (Ti-O-Ti-O) и их разрыв (ИК-спектроскопия, кислотно-основные характеристики):
![]()
![]()
3.Лимитирующая стадия растворения TiO2 (переход в раствор титанил-иона ![]() )
)
Суммарно: ![]()
Используя метод стационарных концентраций при анализе кинетической схемы, найдено, что скорость лимитирующей стадии определяется теоретическим уравнением:
| (20) |
Используя принцип Хоугена-Ватсона можно описать зависимость скорости растворения ![]() от концентрации ионов водорода и анионов уравнением (20), где H+ А-, – степень покрытия поверхности TiO2 ионами водорода и сульфат-ионами соответственно.
от концентрации ионов водорода и анионов уравнением (20), где H+ А-, – степень покрытия поверхности TiO2 ионами водорода и сульфат-ионами соответственно.
Выразив степени покрытия ионов через изотермы Ленгмюра, получим теоретическое уравнение:
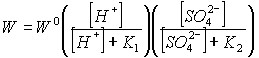 | (21) |
Где К1, К2 – обратные константы адсорбционных равновесий по указанным ионам. Найденная теоретическая зависимость (21) соответствует эмпирическому уравнению. Найденная закономерность позволяет использовать константы, полученные при титровании суспензии TiO2. (см.главу 4)
6.2. Схема механизма растворения ильменита в серной кислоте
В основу моделирования процессов растворения ильменита положена эмпирическая зависимость (22).
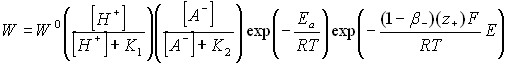 | (22) |
Для теоретического обоснования эмпирической зависимости нами предлагается следующая схема механизма растворения ильменита в серной кислоте, которая состоит из следующих стадий:
1.Поверхностная гидратация ильменита (по результатам ИК-спектроскопии)
![]()
2.Протонирование связей металл-кислород (Ti-O-Ti-O) и их разрыв (ИК-спектроскопия, кислотно-основные характеристики): ![]()
![]()
3.Лимитирующая стадия растворения ильменита (переход в раствор титанил- ионов ![]() и Fe2+):
и Fe2+):
4.Реакция в объеме раствора:
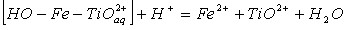
Суммарно: ![]()
Для теоретического вывода уравнения, описывающего природу лимитирующей стадии, использовали принцип Хоугена-Ватсона, который описывает зависимость скорости растворения от концентрации ионов водорода и анионов уравнением вида:
| W=W0H+ А- | (23) |
где H+ А-, – степень покрытия поверхности ильменита ионами водорода и анионами соответственно.
Для расчета степеней покрытия ионами водорода и анионами составлялись уравнения зависимости скорости образования и растворения промежуточных и конечных продуктов, возникающих в процессе растворения.
Для выражения степени покрытия поверхности ионами водорода и анионами использовали изотермы Ленгмюра:
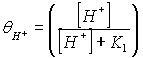 и и 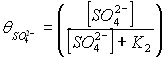 | (24) |
Подставив уравнения (24) в уравнение (23), получим теоретическую зависимость удельной скорости растворения от концентрации ионов H+ и SO42-
Проверка адекватности модели осуществлялась путем сопоставления экспериментальных и теоретических данных. Представленный механизм и уравнение (22) позволяет объяснить причину близкой скорости перехода ионов ![]() и
и ![]() в раствор. Найденная закономерность связана с тем, что в раствор выходит гидратированный промежуточный комплекс
в раствор. Найденная закономерность связана с тем, что в раствор выходит гидратированный промежуточный комплекс ![]() , что следует из УФ-спектров продуктов растворения.
, что следует из УФ-спектров продуктов растворения.
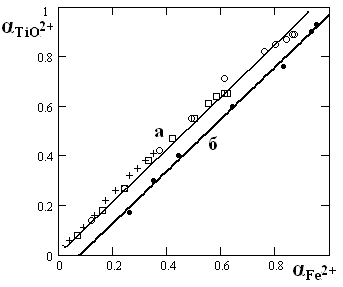 | Рис.18. Зависимость доли растворенного титана (в виде TiO2+) от доли растворенного железа (Fe2+) из ильменита: а - в 10М Н2SO4 при T=353, 363, 373К. б - при разных концентрациях серной кислоты от 4 до 18 моль/л. |
Из анализа данных рис.18 следует, что в процессе растворения ильменита скорости перехода ионов железа и титана близки по значению, что указывает на то, что ионы переходят в раствор в составе одного комплекса. При более детальном описании кинетических процессов в будущем следует учитывать, что на поверхности растворяющегося ильменита в зависимости от концентрации серной кислоты может наблюдаться образование различных промежуточных соединений в виде оксисульфатов (![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() )
)
Таким образом, из анализа экспериментальных данных, представленных в главах 3, 5 следует, что для интенсификации процесса растворения ильменита необходимо руду переводить в плав на основе карбонатов щелочных металлов.
Основные выводы
1. Из анализа влияния различных параметров на удельную скорость растворения ![]() и
и ![]() в растворах серной кислоты, представленных уравнением:
в растворах серной кислоты, представленных уравнением:
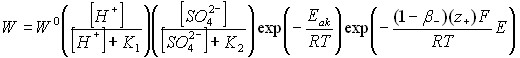 , , |
следует, что лимитирующая стадия связана с переходом в раствор ионов TiO2+ (для ![]() ) и
) и ![]() (для ильменита).
(для ильменита).
2. Предложены 4 кислотно-основных равновесия, устанавливающихся на границе ![]() /электролит. Рассчитаны значения констант кислотно-основных равновесий для разных концентраций фонового электролита, которые позволили провести моделирование распределения ионов на поверхности, возникающих за счет адсорбции Н+.
/электролит. Рассчитаны значения констант кислотно-основных равновесий для разных концентраций фонового электролита, которые позволили провести моделирование распределения ионов на поверхности, возникающих за счет адсорбции Н+.
3. Найдено, что при рН меньшем рНт.н.з. поверхность имеет положительный заряд, возникающий за счет адсорбции Н+, при рН большем рНт.н.з. поверхность заряжена отрицательно, что позволяет объяснить адсорбционные закономерности.
4. Показано, что титан, покрытый фосфат-ионами является ионселективным индикаторным электродом на различные фосфат-ионы при определенных значениях рН среды.
5. При моделировании процесса анодного растворения титана установлено, что первый пик кривых анодной поляризации титанового электрода соответствует переходу оксида титана (III) в оксид титана (IV).
6. Предложенные схемы механизмов растворения диоксида титана и ильменита включают процессы гидратации, протонирования поверхности, перехода ионов в раствор и позволяют объяснить полученные экспериментальные данные: влияние концентрации серной кислоты, эффективной энергии активации, температуры электролита, эффективные порядки по ионам H+ и SO42-.
Основное содержание диссертации изложено в следующих публикациях:
- Русакова С.М., Горичев И.Г., Артамонова И.В., Забенькина Е.О. / Адсорбция ионов на поверхности оксида титана (IV) // Перспективные материалы, 2010, №9, с.215-218 (0,4 п.л., авторский вклад 40%).
- Русакова С.М., Горичев И.Г., Артамонова И.В., Забенькина Е.О. / Очистка вод с помощью TiO2 // Экология промышленного производства 2010, №1, с.28-31 (0,3 п.л., авторский вклад 40%).
- Русакова С.М., Горичев И.Г., Артамонова И.В., Агеева Ю.С. / Влияние фосфат-ионов на стационарное значение потенциала титанового электрода при различных значениях рН // Экология промышленного производства, 2011, №1, с.63-65 (0,23 п.л., авторский вклад 40%).
- Русакова С.М., Горичев И.Г., Клюев А.Л., Лайнер Ю.А., Артамонова И.В. / Влияние фосфат-ионов на анодное растворение титана // Химическая технология, Т. 12, № 3, 2011, с.1079-1085 (0,45 п.л., авторский вклад 40%).
- Русакова С.М., Горичев И.Г., Артамонова И.В., Агеева Ю.С., Забенькина Е.О. / Электрохимическое поведение титана в кислых средах. // Материалы Международной научно-технической конференции ААИ «Автомобиле- и тракторостроение в России: приоритеты развития и подготовка кадров», М.: МГТУ «МАМИ», 2010, с.88-94 (0,3 п.л., авторский вклад 50%).
- Русакова С.М., Горичев И.Г., Артамонова И.В., Агеева Ю.С., Забенькина Е.О. / Изучение свойств диоксида титана в контексте решения научно-практических проблем промышленного производства // Автомобильная промышленность, 2011, №1,с.37-39 (0,3 п.л., авторский вклад 50%).
- Русакова С.М., Горичев И.Г., Артамонова И.В. / Адсорбция ионов бария, кальция, ЭДТА оксидом титана (IV) // Свиридовские чтения, 2011, №7 (0,4 п.л., авторский вклад 40%)
- Артамонова И.В., Горичев И.Г., Изотов А.Д., Степанов В.М., Русакова С.М. / Изучение кислотно-основных характеристик TiO2 // XLIV Всероссийская конференция по проблемам математики, информатики, физики, химии. Секция неорганической химии: Сборник. Тезисы докладов. М.: РУДН, 2008 г, с.4 (авторский вклад не разделен).
- Артамонова И.В., Горичев И.Г., Изотов А.Д., Пичугина Н.М., Русакова С.М. / Моделирование адсорбции ионов водорода на поверхности TiO2 // XLIV Всероссийская конференция по проблемам математики, информатики, физики, химии. Секция неорганической химии: Сборник. Тезисы докладов. М.: РУДН, 2008 г, с.90 (авторский вклад не разделен).
- Русакова С.М., Артамонова И.В., Горичев И.Г. / Оценка адсорбционных свойств TiO2 на основе изучения кислотно-основных характеристик // Материалы 65-ой Международной научно-технической конференции «Автотракторостроение – 2009». Книга 8 (Секция 8. Наноматериалы и нанотехнологии в автотракторостроении), Москва, МГТУ «МАМИ», 2009, с. 21-26 (авторский вклад не разделен).
- Русакова С.М., Артамонова И.В., Горичев И.Г., Гуськов В.Н. / Исследование процессов выщелачивания TiO2 из техногенного сырья и обедненных руд // Ресурсно-экологические проблемы в XXI веке: инновационное недропользование, энергетика, экологическая безопасность и нанотехнологии. Москва-Алушта, 2009, с.165 (авторский вклад не разделен).
- Rusakova S.M., Gorichev I.G., Artamonova I.V. / Adsorption properties of TiO2 // 5-th International Conference on Chemistry and Chemical Education «Sviridov Readings 2010». – Minsk: Krasiko-Print, 2010. Р. 46 (авторский вклад не разделен).

