Новые многокомпонентные реакции в бесхлорном синтезе фосфор - и халькоген о фосфор органических кислот и их производных
На правах рукописи
АРТЕМЬЕВ
Александр Викторович
НОВЫЕ МНОГОКОМПОНЕНТНЫЕ РЕАКЦИИ В БЕСХЛОРНОМ СИНТЕЗЕ ФОСФОР- и халькогенофосфорОРГАНИЧЕСКИХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
Специальность 02.00.08 – химия элементоорганических соединений
А В Т О Р Е Ф Е Р А Т
диссертации на соискание ученой степени
доктора химических наук
Иркутск – 2013
Работа выполнена
в Федеральном государственном бюджетном учреждении науки
Иркутском институте химии им. А.Е. Фаворского
Сибирского отделения РАН
| Официальные оппоненты: | Синяшин Олег Герольдович доктор химических наук, академик РАН ФГБУН Институт органической и физической химии им. А.Е. Арбузова КНЦ РАН, директор |
| Амосова Светлана Викторовна доктор химических наук, профессор ФГБУН Иркутский институт химии им. А.Е. Фаворского СО РАН, заведующая лабораторией | |
| Руссавская Наталья Владимировна доктор химических наук, доцент ФГБОУ ВПО Иркутский государственный университет путей сообщения, профессор | |
| Ведущая организация | ФГБУН Институт элементоорганических соединений им. А.Н. Несмеянова РАН |
Защита состоится 26 апреля 2013 года в 9 часов на заседании диссертационного совета Д 003.052.01 на базе Иркутского института химии им. А.Е. Фаворского СО РАН по адресу: 664033, Иркутск, ул. Фаворского, 1.
С диссертацией можно ознакомиться в библиотеке Иркутского института химии им. А.Е. Фаворского СО РАН (ИрИХ СО РАН).
Автореферат разослан “ ” марта 2013 г.
Ученый секретарь
диссертационного совета
д.х.н. Тимохина Людмила Владимировна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Фосфорорганические кислоты, а также их производные сейчас широко и направленно используются как уникальные лиганды для дизайна каталитических систем, экстрагенты благородных, редкоземельных и трансурановых элементов, флотореагенты, антипирены для получения негорючих полимеров, строительные блоки для органического синтеза. На основе фосфорорганических кислот и их производных созданы и создаются материалы для микро- и наноэлектроники, когерентной и нелинейной оптики, препараты для медицины и сельского хозяйства. Особое внимание в последние годы уделяется применению фосфорорганических кислот, а также их ангидридов и солей в качестве прекурсоров и стабилизирующих растворителей в синтезе многофункциональных наноматериалов специального назначения.
Вместе с тем традиционные способы получения фосфорорганических кислот и их производных базируются на хлорных технологиях, включающих использование агрессивных и высокотоксичных галогенидов фосфора. Эти технологии являются энергозатратными и экологически малоприемлемыми, поскольку сопровождаются образованием больших количеств трудноутилизируемых кислых и ядовитых отходов производства.
В связи с этим актуальной задачей на сегодняшний день является создание простых, технологичных и экологически более безопасных (бесхлорных) методов синтеза фосфорорганических кислот и их производных кратчайшим путем – с использованием элементного фосфора в качестве фосфорилирующего реагента.
Данная работа является логическим продолжением и развитием исследований, выполняемых под руководством академика Б.А. Трофимова и посвященных созданию и разработке новых прямых реакций элементного фосфора с электрофилами в присутствии сильных оснований.
Результаты, представленные в настоящей диссертационной работе, получены в соответствии с планами НИР Иркутского института химии им. А.Е. Фаворского СО РАН по теме: “Разработка методов направленного синтеза новых веществ и материалов (в том числе, наноструктурированных) для критических технологий на основе ацетилена и его производных” (№ государственной регистрации 01.2.00704816). Основные разделы работы выполнялись при государственной поддержке ведущих научных школ (научная школа академика Б.А. Трофимова, гранты НШ-263.2008.3, НШ-3230.2010.3 и НШ-1550.2012.3) и молодых российских ученых (грант МК-629.2010.3). Эта работа многократно поддерживалась Российским фондом фундаментальных исследований (проекты № 08-03-00251; 11-03-00286-а; 11-03-00334-а; 12-03-31097-мол_а; совместный проект РФФИ Россия-Тайвань № 11-03-92003-ННС_а).
Целью работы была разработка общих рациональных подходов к бесхлорному синтезу фосфорорганических кислот и их производных на основе новых многокомпонентных реакций с использованием доступных исходных соединений.
Научная новизна и практическая значимость работы. Получила дальнейшее логическое развитие многокомпонентная реакция между элементным фосфором, электрофилами и сильными основаниями (реакция Трофимова-Гусаровой). Впервые в эту реакцию введены представители аллиларенов (аллилбензол и его производные), функционализированных виниларенов (4-метоксистирол), конденсированных циклопентадиенов (1Н-инден) и гетарилгалогенидов (2-бромпиридин). В результате разработаны высокоэффективные и хемоселективные одностадийные методы синтеза ранее неизвестных или труднодоступных фосфонистых и фосфиновых кислот, третичных фосфинов и фосфиноксидов.
Открыты и разработаны новые многокомпонентные реакции между первичными или вторичными фосфинами (а также их халькогенидами), халькогенами (элементными серой и селеном) и основаниями или алкенами.
Предложена новая общая стратегия бесхлорного синтеза функционализированных эфиров диселенофосфиновых кислот на основе ранее неизвестной трехкомпонентной атом-экономной реакции между вторичными фосфинами, элементным селеном и алкенами (арил- или гетарилэтены, виниловые эфиры, винилсульфиды и винилселениды).
Открыта и детально изучена трехкомпонентная атом-экономная реакция между вторичными фосфинсульфидами, элементным селеном и виниловыми эфирами. В результате разработан новый удобный подход к синтезу функциональных S- и Se-эфиров тиоселенофосфиновых кислот без использования хлорсодержащих соединений.
Предложена эффективная методология синтеза солей тритио- или триселенофосфиновых кислот на основе новой трехкомпонентной реакции между первичными фосфинами, элементной серой или селеном и основаниями (гидроксиды щелочных металлов или амины).
Открыта и систематически исследована трехкомпонентная реакция между вторичными фосфинами, элементным селеном и основаниями (гидроксиды щелочных и щелочноземельных металлов, аммиак и гидразин, амины и природные алкалоиды). В результате разработаны общие высокоэффективные и хемоселективные методы синтеза неизвестных или труднодоступных солей диселенофосфиновых кислот различного строения.
Предложен принципиально новый общий бесхлорный подход к синтезу солей тиоселенофосфиновых кислот на основе оригинальных многокомпонентных реакций с участием вторичных фосфинов, оснований (гидроксиды щелочных металлов, амины и природные алкалоиды), элементных серы и селена.
Результаты пионерских исследований реализованных многокомпонентных реакций заложили фундаментальные основы их использования для направленного синтеза неизвестных или труднодоступных фосфорорганических кислот и их производных из доступных исходных соединений (без применения хлорсодержащих интермедиатов).
В результате исследования синтетического потенциала синтезированных производных халькогенсодержащих фосфорорганических кислот стали доступными следующие классы соединений:
малоизученные бис(диорганохалькогенофосфинил)халькогениды (R2P=X)2X' и -полихалькогениды (R2P=X)2X'n (X, X' = S, Se; n = 2, 3);
востребованные тиоселенофосфинатные и диселенофосфинатные комплексы Ni(II), Sb(III), Bi(III) и Cr(III);
новые восьмиядерные кластеры Cu(I), стабилизированные диселенофосфинатными лигандами.
Окислением диселенофосфинатов щелочных металлов перекисью водорода в присутствии арабиногалактана синтезированы оригинальные водорастворимые нанобиокомпозиты элементного селена, проявляющие люминесцентные свойства полидисперсных “квантовых точек”. Результаты этих исследований отнесены к важнейшим достижениям фундаментальных исследований РАН за 2011 год (“Отчетный доклад РАН: научные достижения РАН в 2011 году”, Наука, Москва, 2012 г, с. 42).
Личный вклад автора состоял в постановке темы исследований; разработке методов синтеза большинства описанных в диссертации соединений; непосредственном выполнении большей части экспериментов; анализе полученного материала и формулировке выводов.
Публикации и апробация работы. По материалам диссертации опубликована 1 монография, 1 обзор, 47 статей в ведущих зарубежных и отечественных журналах, а также 12 тезисов докладов на научных конференциях всероссийского и международного уровня.
Объем и структура работы. Диссертация содержит 450 страниц машинописного текста (35 таблиц, 75 рисунков). Первая глава (обзор литературы) посвящена анализу традиционных методов синтеза селенофосфорорганических кислот и их производных; во второй главе изложены и обсуждены результаты собственных исследований; необходимые экспериментальные подробности приведены в третьей главе. Завершается рукопись выводами и списком цитируемой литературы (270 источников).
В работе синтезировано около 280 новых фосфорсодержащих соединений. Молекулярные структуры более 40 веществ установлены методом монокристального рентгеноструктурного анализа (РСА). Для доказательства строения использованы методы ЯМР (1Н, 13С, 31P и 77Se, включая 2D методики), ИК- и УФ-спектроскопии, а также масс-спектрометрии.
Автор выражает искреннюю признательность коллегам, принимавшим участие в этой работе на разных ее этапах: д.х.н. С.Ф. Малышевой, к.х.н. Л.А. Опариной, к.х.н. Б.Г. Сухову, к.х.н. Н.А. Белогорловой, аспирантке А.О. Корочевой, к.х.н. В.А. Куимову, к.х.н. Е.П. Дорониной, к.х.н. О.А. Тарасовой, к.х.н. Н.И. Ивановой, д.х.н. В.Ф. Сидоркину, а также профессору Чен-Вэй Лю и его сотрудникам (Университет Донг-Хуа, Тайвань) за плодотворное сотрудничество. Автор благодарен д.х.н. Ю.В. Гатилову и д.х.н. И.Ю. Багрянской (НИОХ СО РАН), а также к.х.н. О.Н. Кажевой и д.х.н. О.А. Дьяченко (ИПХФ РАН) за проведение РСА синтезированных соединений.
Особая благодарность моим учителям – академику Борису Александровичу Трофимову и д.х.н., профессору Нине Кузьминичне Гусаровой за постоянную помощь и внимание.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Новые многокомпонентные реакции элементного фосфора в сверхосновной системе КОН/ДМСО: хемоселективный синтез фосфинистых, фосфонистых и фосфиновых кислот
Проведены систематические исследования по развитию прямого фосфорилирования электрофилов элементным фосфором в присутствии сильных оснований (реакция Трофимова-Гусаровой). В данной работе в эту реакцию впервые введены представители новых классов ненасыщенных соединений – аллилбензолы, 1Н-инден, 4-метоксистирол и 2-бромпиридин.
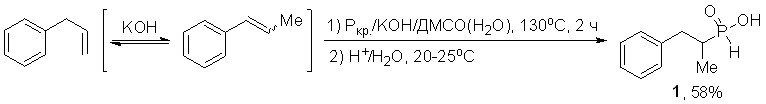
1.1. Прямое фосфорилирование аллилбензолов элементным фосфором и генерируемым из него фосфином
Впервые реализовано прямое фосфорилирование аллилбензола красным фосфором. Реакция эффективно протекает в суперосновной системе КОН/ДМСО(Н2О) (130оС, 2 ч) и приводит хемоселективно к неизвестной ранее 1-метил-2-фенилэтилфосфонистой кислоте (1) с выходом 58%. На первой стадии, очевидно, образуется 1-метил-2-фенилэтен – продукт [1,3]H изомеризации аллилбензола под действием сверхоснования.
Общий характер реакции продемонстрирован на ряде замещенных аллилбензолов (в том числе, природных метилэвгенолов и о-эстрагола), при фосфорилировании которых красным фосфором в системе КОН/ДМСО(Н2О) (130оС, 3 ч) хемоселективно образуются соответствующие 1-метил-2-арилэтилфосфонистые кислоты 2 с выходом более 50%.
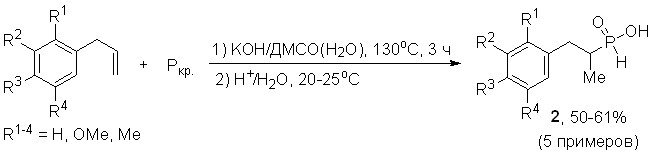
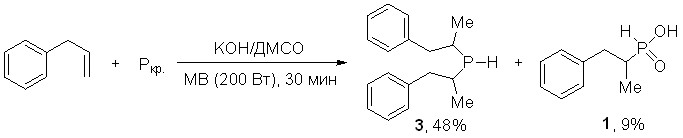
Вместе с тем микроволновое промотирование данной реакции неожиданно приводит к изменению ее хемоселективности. Так, при микроволновом облучении системы “аллилбензол/красный фосфор/КОН/ДМСО” в качестве основного продукта получен бис(1-метил-2-фенилэтил)фосфин (3) (выход 48%). Фосфонистая кислота 1 в этих условиях образуется с выходом 9%. Следует отметить, что данная реакция является редким примером одностадийного синтеза вторичного фосфина непосредственно из элементного фосфора.
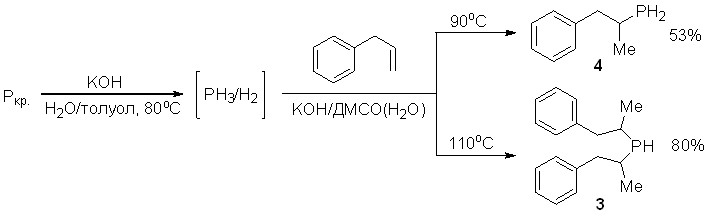
Фосфин, генерируемый в виде смеси с водородом (под действием щелочи на красный фосфор), легко присоединяется к аллилбензолу в сверхосновной системе КОН/ДМСО(Н2О) при 90-120oC, образуя аддукты Марковниковского строения – 1-метил-2-фенилэтилфосфин (4) и бис(1-метил-2-фенилэтил)фосфин (3). Найдены условия, позволяющие селективно получать указанные первичный и вторичный фосфины с выходом 53 и 80%, соответственно.
1.2. Прямое фосфорилирование 1Н-индена элементным фосфором
Прямое фосфорилирование 1Н-индена (промышленно доступный алкен) элементным (красным) фосфором хемоселективно протекает в сверхосновной системе KOH/ДМСО(H2O) при 120oC (2.5 ч), приводя к неизвестной ранее 2,3-дигидро-1H-инден-2-илфосфонистой кислоте (5) с выходом 55%. Молекулярная структура последней установлена методом РСА.
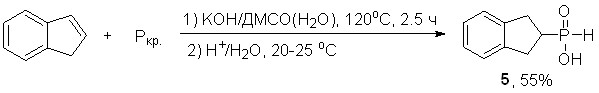
Действие микроволнового облучения практически не сказывается на хемоселективности реакции.
1.3. Прямое фосфорилирование 4-метоксистирола элементным фосфором и фосфином
Фосфорилирование 4-метоксистирола красным фосфором или его нанокомпозитами легко реализуется в высокоосновной суспензии КОН/ДМСО(Н2О) при 130оС (3 ч) с образованием трис[2-(4-метоксифенил)этил]фосфиноксида (6) и 2-(4-метоксифенил)этилфосфонистой кислоты (7) с выходом 30% и 10%, соответственно.
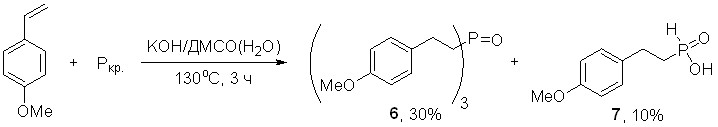
В условиях микроволнового содействия (600 Вт, 6 мин) происходит изменение хемонаправленности данной реакции: наряду с ожидаемым фосфиноксидом 6 образуются третичный фосфин 8 (суммарный выход 80%) и бис[2-(4-метоксифенил)этил]фосфиновая кислота (9, 7%).
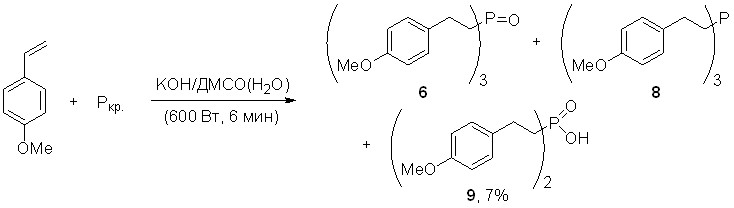
Нуклеофильное присоединение фосфина к 4-метоксистиролу селективно протекает в суперосновной среде КОН/ДМСО(Н2О), приводя, в зависимости от выбранных температурных условий, к бис[2-(4-метоксифенил)этил]фосфину (10) или трис[2-(4-метоксифенил)этил]фосфину (8) с выходами 67% и 80%, соответственно.
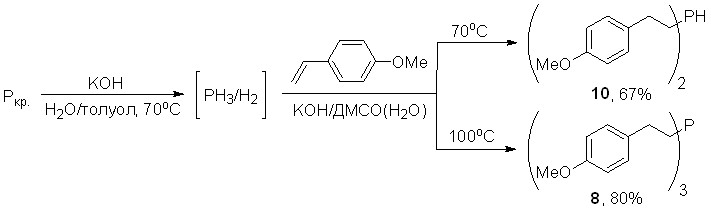
Окислением вторичного (10) и третичного (8) фосфинов кислородом воздуха, элементными серой (S8) или селеном получены с высоким выходом (95-99%) соответствующие фосфинхалькогениды, которые были использованы в качестве исходных соединений для синтеза производных дихалькогенофосфиновых кислот.
1.4. Фосфорилирование 2-бромпиридина: эффективный синтез трис(2-пиридил)фосфина
Прямая реакция 2-бромпиридина с элементным фосфором легко протекает в суперосновной системе КОН/ДМСО(Н2О) при 75оС (для белого фосфора) или 100оС (для красного фосфора) за 3 ч, неожиданно приводя к трис(2-пиридил)фосфину (11) с выходом до 62%. Кроме того, зарегистрировано образование следовых количеств трис(2-пиридил)фосфиноксида (31Р ЯМР).
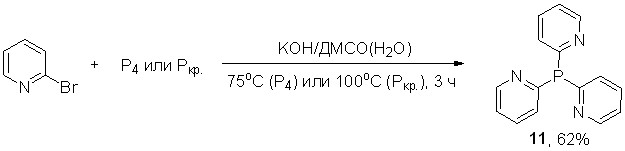
Микроволновая активация (300 Вт) позволяет значительно сократить время реакции (20 мин), хотя выход трис(2-пиридил)фосфина при этом незначительно снижается (53%).
Нуклеофильное ароматическое замещение брома в 2-бромпиридине под действием фосфид-анионов, генерируемых из фосфина в суперосновной среде КОН/ДМСО(Н2О), приводит исключительно к трис(2-пиридил)фосфину с выходом 50%. В данных условиях реакция хемоселективна: образование ожидаемых первичного и вторичного фосфинов не наблюдается (31Р ЯМР реакционных смесей).
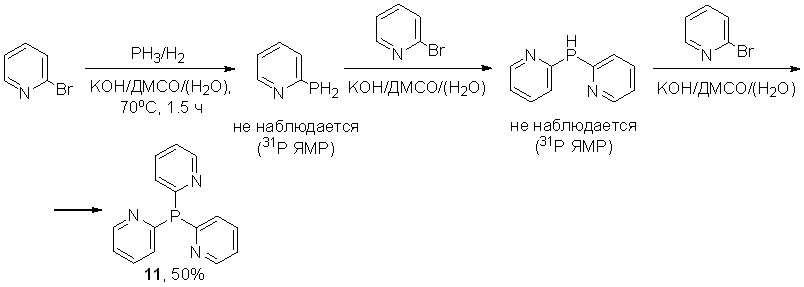
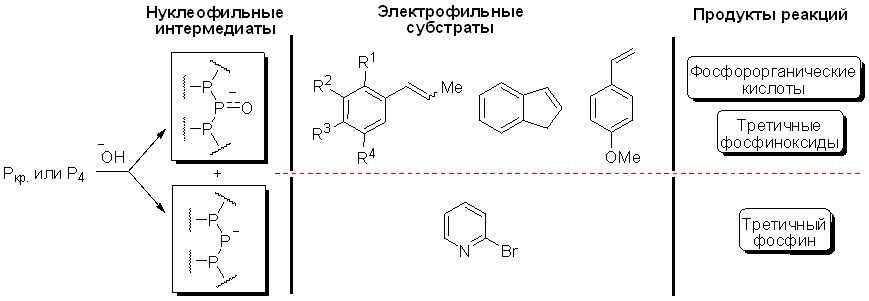
Таким образом, исследование многокомпонентных реакций с участием элементного фосфора, алкенов или 2-бромпиридина и супероснования КОН/ДМСО показало, что строение образующихся продуктов зависит, в основном, от природы используемого электрофильного субстрата и условий процесса. По-видимому, результат реакции определяется орбитальной и/или зарядовой комплементарностью в парах “электрофил/фосфорцентрированный нуклеофил”. В роли фосфорцентрированных нуклеофилов выступают фосфид- и фосфинит-анионы – предполагаемые интермедиаты, образующиеся при расщеплении Р-Р связей элементного фосфора под действием супероснования.
Например, фосфинит-анионы оказались комплементарными алкенам (1-пропен-1-илбензолы, стиролы, 1Н-инден). Наблюдаемыми продуктами реакции, таким образом, были соединения с P=O связями – фосфорорганические кислоты или фосфиноксиды. Напротив, комплементарность 2-бромпиридина фосфид-анионам приводит к преимущественному образованию трис(2-пиридил)фосфина.
1.5. Одностадийный синтез вторичных фосфинхалькогенидов из арил- или гетарилэтенов и элементных фосфора, серы и селена
Разработан эффективный общий способ получения вторичных фосфинсульфидов и -селенидов 12 (тио- и селенофосфинистых кислот) в одну препаративную стадию из слабоэлектрофильных алкенов (стиролы, 2-винилнафталин, 2-винилфуран, 5-винил-2-метилпиридин) и элементных фосфора, серы и селена.
Этот удобный подход основан на схеме, включающей: а) реакцию красного фосфора с КОН в водно-толуольной среде (80-90оС); б) хемоселективное гидрофосфинирование арил- или гетарилэтенов образующейся фосфиново-водородной смесью (PH3/H2) в присутствии сверхоснования КОН/ДМСО(H2O) (55-75оС) с образованием вторичных фосфинов и в) последующее их окисление в толуольном экстракте (без выделения и очистки) элементной серой S8 или селеном (20-40оС). Выходы фосфинхалькогенидов 12, рассчитанные на исходные алкены, превышают 55%.

Следует подчеркнуть, что представленный синтез осуществляется в одном аппарате, представляющем сообщающиеся сосуды, что исключает необходимость выделения промежуточных продуктов – как вторичных фосфинов, так и смеси PH3/H2.
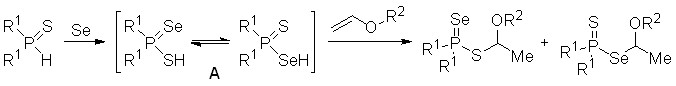
2. Трехкомпонентные реакции между вторичными фосфинами, элементным селеном и алкенами: эффективный синтез эфиров диселенофосфиновых кислот
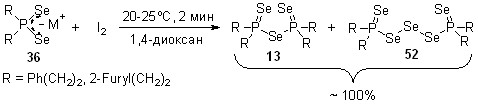
С целью разработки атом-экономного и эффективного метода синтеза ранее неизвестных или труднодоступных эфиров диселенофосфиновых кислот мы реализовали трехкомпонентные реакции между вторичными фосфинами, селеном и различными алкенами (включая функциональные и оптически активные). Результат таких реакций был далеко не однозначен. Например, оказалось, что взаимодействие вторичных фосфинов с элементным селеном в мольном соотношении 1:2 (85оС, толуол, 3 ч) неожиданно приводит к бис(диорганоселенофосфинил)селенидам 13 с выходом 75-92%. Реакция имеет общий характер и протекает хемоселективно: ожидаемые диселенофосфиновые кислоты R2P(Se)SeH не образуются. Структура селенидов 13 однозначно доказана методом РСА.
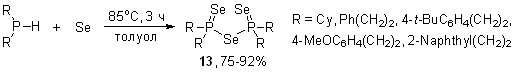
Таким образом, можно было ожидать, что результатом трехкомпонентного взаимодействия вторичных фосфинов с селеном и различными алкенами будет образование селенидов (R2P=Se)2Se (13) и/или продуктов их реакции с алкенами. Кроме того, не исключалась возможность как полимеризации алкенов под действием селена, так и радикального присоединения к их двойным связям вторичных фосфинов.
2.1. Трехкомпонентная реакция между вторичными фосфинами, элементным селеном и арил- или гетарилэтенами
Вторичные фосфины реагируют одновременно с элементным селеном и арилэтенами (стиролы, 2-винилнафталин) или гетарилэтенами (2-винилфуран, N-винилпиррол) в мягких условиях (85оС, 1,4-диоксан, 3 ч), образуя первые представители Se-[1-арил(гетарил)этил]диселенофосфинатов 14 с выходом до 95%.

Сборка диселенофосфинатов 14, по-видимому, происходит через первоначальное окисление вторичных фосфинов до вторичных фосфинселенидов A, взаимодействие последних с селеном и электрофильное присоединение образующихся диселенофосфиновых кислот B к алкенам.
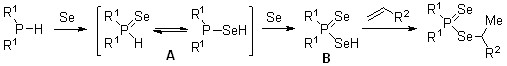
Подчеркнем, что последняя стадия – присоединение Se-H кислоты B к алкену протекает строго в соответствии с правилом Марковникова, хотя известно, что соединения с Se-H связями (из-за легкости гомолиза последних) проявляют повышенную склонность к реакциям радикального присоединения.
Косвенным подтверждением предложенной схемы является факт образования Se-[1-арил(гетарил)этил]диселенофосфинатов 14 из вторичных фосфинселенидов, элементного селена и алкенов. Эта трехкомпонентная реакция легко протекает при 85оС (1,4-диоксан, 3 ч), приводя к эфирам 14 с выходом более 88%.
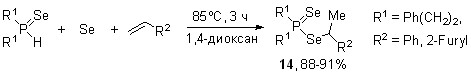
2.2. Реакция между вторичными фосфинами, элементным селеном и виниловыми эфирами
Одновременное взаимодействие вторичных фосфинов с элементным селеном и виниловыми эфирами (мольное соотношение 1:2:1) легко протекает в 1,4-диоксане (90oC, 1-1.5 ч) с образованием неизвестных ранее Se-[1-(органилокси)этил]диселенофосфинатов 15 (87-99%).

Реакция является общей, что было продемонстрировано на широких рядах вторичных фосфинов и виниловых эфиров (алкил- и арилвиниловые, включая полифторированные).
Дивиниловые эфиры также успешно вступают в открытую трехкомпонентную реакцию. Например, диэфир диселенофосфиновой кислоты 16 синтезирован с выходом 96% из вторичного фосфина, элементного селена и дивинилового эфира гидрохинона (мольное соотношение 2:4:1, 90oC, 1,4-диоксан, 1.5 ч).
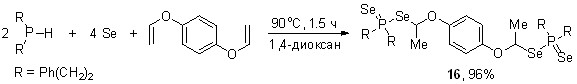
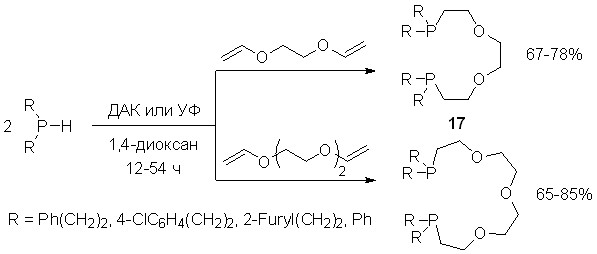
Мы показали также, что в условиях радикального инициирования (1,4-диоксан, ДАК, 65оС или УФ-облучение, 12-50 ч) вторичные фосфины исчерпывающе присоединяются к дивиниловым эфирам различных диолов, образуя диаддукты анти-марковниковского строения 17 с высоким выходом (65-85%).
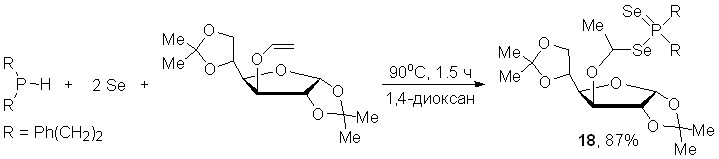
Первый представитель оптически активных эфиров диселенофосфиновых кислот 18 удалось получить в аналогичных условиях с выходом 87% при взаимодействии бис(2-фенилэтил)фосфина с элементным селеном и виниловым эфиром диацетон-D-глюкозы.
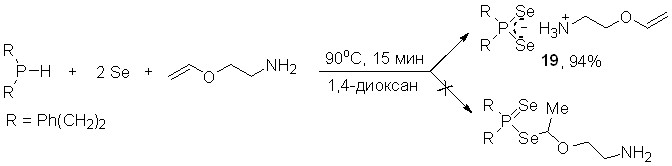
В то же время трехкомпонентная реакция между вторичными фосфинами, селеном и виниловым эфиром моноэтаноламина не приводит к образованию формальных продуктов присоединения диселенофосфиновой кислоты по винилокси-группе. Вместо этого наблюдается хемо- и региоселективное образование 2-(винилокси)этиламмониевой соли диселенофосфиновой кислоты 19 (выход 94%).
2.3. Трехкомпонентная реакция между вторичными фосфинами, элементным селеном и винилсульфидами или винилселенидами
Вторичные фосфины одновременно реагируют с элементным селеном и винилсульфидами (стехиометрическое соотношение) в 1,4-диоксане (100оС, 1.5 ч), практически количественно (83-94%), образуя Se-[1-(органилтио)этил]диселенофосфинаты 20 – неизвестные ранее эфиры диселенофосфиновых кислот с редкими S,Se-ацетальными функциями.

Взаимодействие винилселенидов с вторичными фосфинами и элементным селеном (100оС, 1,4-диоксан, 2.5 ч) приводит к функциональным диселенофосфинатам 21, содержащим редкие Se,Se-ацетальные фрагменты (выход 86-91%).

3. Арил- и гетарилацетилены в реакциях с вторичными фосфинами (или их селенидами) и элементным селеном
При нагревании (90оС, 3 ч, 1,4-диоксан) фенилацетилена с вторичными фосфинами (или фосфинселенидами) и элементным селеном вместо ожидаемых Se-этениловых эфиров диселенофосфиновых кислот образуются бис(диорганоселенофосфинил)селениды 13. В то же время при микроволновом облучении смеси “вторичный фосфинселенид/аморфный селен/ фенилацетилен” наряду с селенидами (R2P=Se)2Se происходит минорное образование диорганил(2-фенилэтенил)фосфинселенидов 22 – продуктов присоединения вторичных фосфинселенидов к фенилацетилену.
Мы показали также, что в условиях радикального инициирования (ДАК, 65оС, 5-7 ч) вторичные фосфинселениды хемо- и региоселективно присоединяются к арил- и гетарилацетиленам, образуя моноаддукты 22 (соотношение Z/E-изомеров составляет 9:1) с выходом 53-80%. Микроволновое промотирование (600 Вт, ДАК) значительно сокращает время реакции (до 8 мин), но приводит к снижению ее стереоселективности: Z- и E-изомеры 22 образуются при этом в равных количествах.
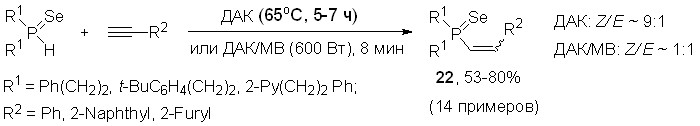
Подчеркнем, что данная реакция представляет первый пример присоединения вторичных фосфинселенидов к ацетиленам.
4. Трехкомпонентная реакция между вторичными фосфинсульфидами, элементным селеном и виниловыми эфирами: эффективный синтез S- и Se-эфиров тиоселенофосфиновых кислот
Впервые показано, что вторичные фосфинсульфиды легко реагируют с элементным селеном и виниловыми эфирами (их соотношение 1:1:1) в 1,4-диоксане (100оС, 20-60 мин), образуя региоизомерные S- и Se-эфиры тиоселенофосфиновых кислот 23 (выход 73-95%). Соотношение последних зависит от природы заместителей R1 и R2, но в общем случае S-эфиры являются мажорными продуктами. Эта трехкомпонентная реакция является общей как для алкил- и арилвиниловых эфиров, так и для вторичных фосфинсульфидов различной природы.
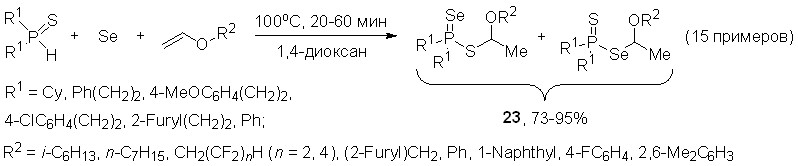
Строение S- и Se-эфиров 23 однозначно доказано по данным ЯМР спектроскопии. Кроме того, молекулярная структура S- и Se-эфиров c R1 = Cy и R2 = 1-naphthyl, образующих сокристаллы (1:1), установлена методом РСА.
Формирование S- и Se-тиоселенофосфинатов 23 в трехкомпонентной реакции происходит, вероятно, в результате электрофильного присоединения к виниловым эфирам тиоселенофосфиновых кислот А, генерируемых при окислении вторичных фосфинсульфидов элементным селеном.
Следует отметить, что тиоселенофосфинаты 23, полученные из алкилвиниловых эфиров, относительно легко подвергаются гидролизу, тогда как тиоселенофосфинаты с арильными заместителями (R2 = арил) – устойчивы. Например, хранение раствора тиоселенофосфинатов 23а,б во влажном эфире (20-25оС, несколько суток) приводит к смеси бис(диорганохалькогенофосфинил)селенидов 24 и 25. Образование последних, по-видимому, является результатом конденсации (двумя способами) тиоселенофосфиновой кислоты A, образующейся при гидролизе этих эфиров.
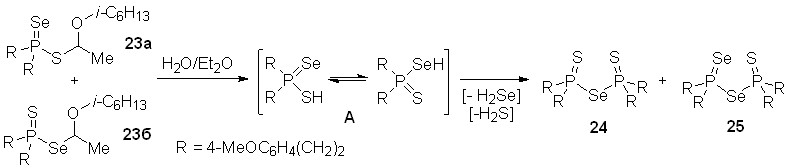
Молекулярные структуры селенидов 24 и 25 установлены методом РСА их сокристаллов (1:1).
С целью изучения механизма этой новой трехкомпонентной реакции мы впервые исследовали взаимодействие вторичных фосфинсульфидов с элементным селеном. Установлено, что в растворе 1,4-диоксана при 100оС (20 мин) селективно образуются SH-тиоселенофосфиновые кислоты 26 (без примеси SeH-изомеров). Последние устойчивы в растворе, но разлагаются при удалении растворителя.
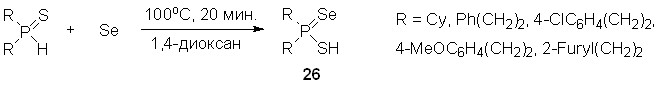
Квантово-химические расчеты [MP2/aug-cc-pVTZ//B3LYP/6-311++G(d,p)] двух таутомерных форм Cy2P(Se)SH и Cy2P(S)SeH в растворе 1,4-диоксана (C-PCM) также продемонстрировали энергетическую предпочтительность SH-кислоты (E = 0.80 ккал/моль).
В то же время при более длительном нагревании вторичных фосфинсульфидов с элементным селеном (100оС, 1,4-диоксан, 3 ч) происходит выделение H2Se и селективное образование неизвестных ранее бис(диорганотиофосфинил)селенидов 27 с выходом 75-92%. Молекулярная структура селенида (Cy2P=S)2Se установлена методом РСА.
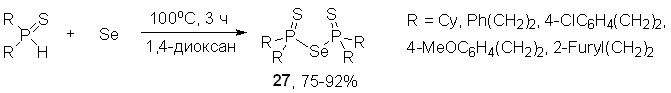
Таким образом, новая реакция между вторичными фосфинсульфидами, элементным селеном и виниловыми эфирами открывает удобный подход к синтезу ранее неизвестных S- и Se-эфиров тиоселенофосфиновых кислот 23, представляющих несомненный теоретический и практический интерес.
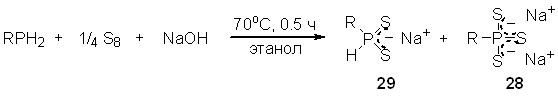
5. Трехкомпонентные реакции между первичными фосфинами, элементными халькогенами и основаниями: синтез производных трихалькогенофосфоновых кислот
Открыты новые трехкомпонентные реакции с участием первичных фосфинов, элементных серы или селена и оснований (гидроксиды щелочных металлов или амины). На основе этих новых реакций разработаны эффективные бесхлорные методы синтеза труднодоступных и неизвестных солей тритиофосфоновых и триселенофосфоновых кислот.
5.1. Эффективный синтез тритиофосфонатов
Трехкомпонентное взаимодействие первичных фосфинов с элементной серой и гидроксидами Na, K и Cs (мольное соотношение 1:3:2) протекает в мягких условиях (70оС, этанол, 0.5 ч) и хемоселективно приводит к солям тритиофосфоновых кислот 28 (выход 72-90%). Строение последних однозначно доказано с использованием РСА, а также методов ЯМР и ИК-спектроскопии.
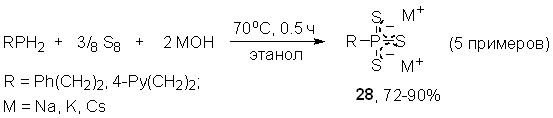
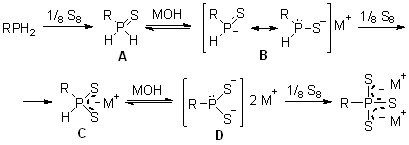
Важно отметить влияние мольного соотношения реагентов на хемоселективность реакции. Так, при соотношении RPH2/S/MOH, равном 1:2:1, наблюдается образование дитиофосфонитов (29) и тритиофосфонатов (28) щелочных металлов в соотношении ~ 70:30 (данные 31Р ЯМР). Вместе с тем варьированием температуры, растворителя и порядка смешения реагентов не удается направить реакцию на селективное образование дитиофосфонитов 29 – перспективных, но труднодоступных представителей гидротиофосфорорганических соединений.
Таким образом, наиболее вероятная схема открытой трехкомпонентной реакции включает окисление первичных фосфинов до первичных фосфинсульфидов A, депротонирование последних гидроксидами и взаимодействие генерируемой при этом соли B со вторым эквивалентом серы. Образующиеся дитиофосфониты С последовательно реагируют с МОН и элементной серой, завершая образование тритиофосфонатов.
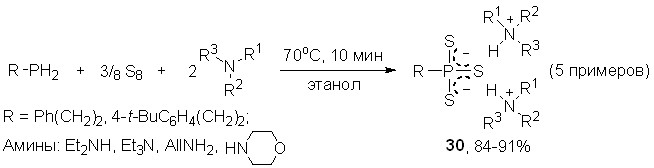
Открытая трехкомпонентная реакция является общей. Например, при использовании первичных, вторичных или третичных аминов (включая циклические и ненасыщенные) в качестве оснвной компоненты удается селективно синтезировать неизвестные тритиофосфонаты алкиламмония 30 (выход более 83%) в мягких условиях (70оС, этанол, 10 мин).
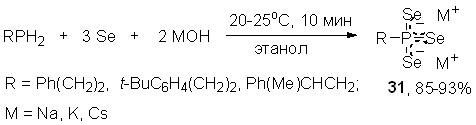
5.2. Хемоселективный синтез триселенофосфонатов щелочных металлов
Разработан новый удобный способ получения редких и неизученных солей триселенофосфоновых кислот на основе трехкомпонентного взаимодействия первичных фосфинов с селеном и гидроксидами щелочных металлов (мольное соотношение 1:3:2). Эта реакция легко протекает при комнатной температуре (этанол, 10 мин), приводя к триселенофосфонатам щелочных металлов 31 с высоким выходом (85-93%).
6. Трехкомпонентные реакции между вторичными фосфинами, элементными халькогенами и основаниями: синтез солей дихалькогенофосфиновых кислот
6.1. Хемоселективный синтез дитиофосфинатов гидразиния
Впервые реализовано трехкомпонентное взаимодействие вторичных фосфинов с элементной серой и гидратом гидразина. Отметим, что результат этой реакции был неоднозначным, поскольку известно, например, что гидразин легко восстанавливает серу S8 до полисульфидов гидразиния.
Эксперименты показали, что реакция вторичных фосфинов с элементной серой и гидразин-гидратом (мольное соотношение 1:2:1.1, 70-75оС, 20 мин, этанол) хемоселективно приводит к ранее неизвестным дитиофосфинатам гидразиния 32 с выходом 84-92%.
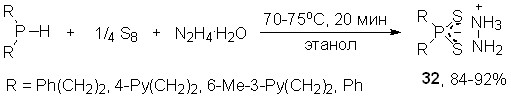
6.2. Направленный синтез производных алкалоидов с дитиофосфинатными группами
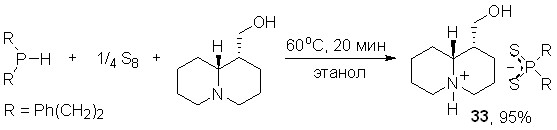
На основе трехкомпонентной атом-экономной реакции между вторичными фосфинами, элементной серой и природными лупинином, анабазином или хинином нами осуществлен направленный синтез ранее неизвестных дитиофосфинатов указанных алкалоидов.
Лупинин реагирует с бис(2-фенилэтил)фосфином и элементной серой в мягких условиях (60оС, этанол, 20 мин), образуя дитиофосфинат лупининия 33 с выходом 95%.
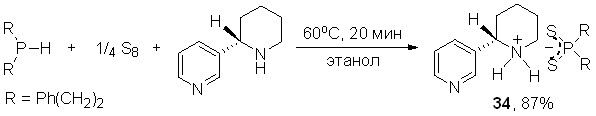
Трехкомпонентная реакция с участием анабазина, бис(2-фенилэтил)фосфина и элементной серы протекает в аналогичных условиях с образованием дитиофосфината анабазиния 34 (87%).
Производные хинина с дитиофосфинатными группами 35 были синтезированы с высоким выходом (84-90%) при нагревании (60оС, этанол, 20 мин) основания хинина с вторичными фосфинами и элементной серой.
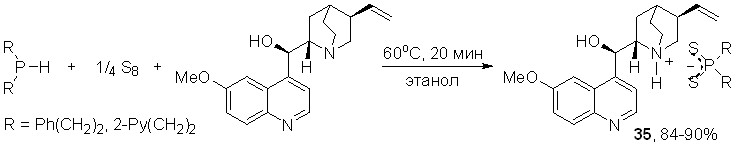
Полученные новые производные алкалоидов являются потенциальными фармакологически активными препаратами и перспективными агрохимикатами.
6.3. Трехкомпонентные реакции между вторичными фосфинами (или их селенидами), элементным селеном и гидроксидами щелочных или щелочноземельных металлов
Нами разработан эффективный однореакторный метод синтеза диселенофосфинатов щелочных металлов из вторичных фосфинов, элементного селена и гидроксидов щелочных металлов. Эта новая трехкомпонентная реакция протекает в мягких условиях (20-25оС, этанол, 5 мин), приводя к целевым диселенофосфинатам Li, Na, K, Rb и Cs 36 с выходом 81-98%.
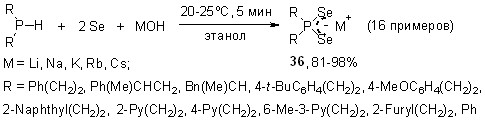
Общий характер реакции продемонстрирован на широком ряде вторичных фосфинов, содержащих арильные, арилалкильные и гетарилалкильные заместители (в том числе, стерически затрудненные).
В качестве оснований в этой трехкомпонентой реакции могут быть использованы также гидроксиды Ca(OH)2 и Ba(OH)2. Так, взаимодействием последних с вторичными фосфинами и элементным селеном в мягких условиях (70-75оС, водный этанол, 10 мин) синтезированы первые представители диселенофосфинатов щелочноземельных металлов 37 с выходом 78-89%.
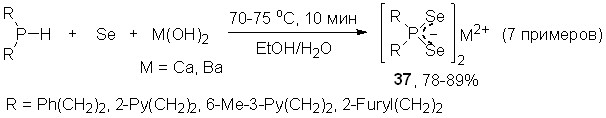
Схема трехкомпонентной реакции, по-видимому, включает окисление вторичных фосфинов селеном до вторичных фосфинселенидов А, депротонирование которых щелочью МОН приводит к генерированию P,Se-амбидентных селенофосфинитов B. Взаимодействие последних со вторым эквивалентом селена завершает образование диселенофосфинатов.
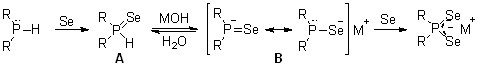
Диселенофосфинаты 36 могут быть встречно синтезированы из вторичных фосфинселенидов. Действительно, последние в мягких условиях (20-25оС, ТГФ/этанол, 1 мин) реагируют с элементным селеном и гидроксидами щелочных металлов MOH (M = Li, Na, K, Rb, Cs), количественно образуя соответствующие диселенофосфинаты 36 (94-100%).
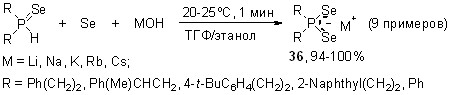
Необходимо отметить, что эта реакция, помимо фундаментальной новизны, имеет большое препаративное значение, поскольку использование вторичных фосфинселенидов (кристаллические соединения, устойчивые на воздухе) экспериментально более удобно по сравнению со вторичными фосфинами (легкоокисляющиеся жидкости или легкоплавкие порошки с неприятным запахом).
С целью исследования механизма последней реакции нами осуществлены двухкомпонентые взаимодействия вторичных фосфинселенидов с основаниями и элементным селеном.
Впервые показано, что вторичные фосфинселениды при комнатной температуре (этанол, 2-3 мин) реагируют с КОН (мольное соотношение 2:1), неожиданно образуя диселенофосфинаты калия и вторичные фосфины с количественным выходом (31Р ЯМР реакционных смесей). При использовании алкиламинов вместо КОН получаются соответствующие диселенофосфинаты алкиламмония и вторичные фосфины.
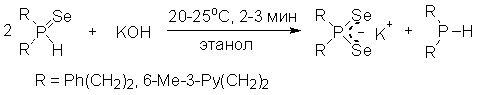
Реакция вторичных фосфинселенидов с КОН в присутствии алкилиодидов (20-25оС, ТГФ) приводит к третичным фосфинселенидам 38 с хорошим выходом. Образование последних происходит, очевидно, в результате региоселективного Р-алкилирования P,Se-амбидентного селенофосфинит-аниона, генерируемого при депротонировании щелочью вторичного фосфинселенида.
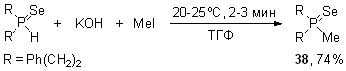
Впервые обнаружено, что вторичные фосфинселениды при взаимодействии с элементным селеном (80-85оС, толуол, 3 ч) вместо ожидаемых диселенофосфиновых кислот R2P(Se)SeH, неожиданно образуют бис(диорганоселенофосфинил)селениды 13 с выходом 78-80%.
6.4. Трехкомпонентный синтез диселенофосфинатов аммония и гидразиния из вторичных фосфинов, элементного селена и гидридов азота
Представленная в разделе 6.3 трехкомпонентная реакция, приводящая к диселенофосфинатам металлов, имеет фундаментальное значение в химии фосфорорганических соединений и открывает широкие возможности для синтеза различных диселенофосфинатов путем варьирования природы основания и строения используемых вторичных фосфинов.
Мы показали, что взаимодействие вторичных фосфинов различного строения с элементным селеном и простейшим N-основанием – аммиаком – легко осуществляется в водном (50-55оС, 10 мин) или 96% этаноле (20-25оС, 10 мин) и приводит к первым представителям диселенофосфинатов аммония 39 (выход 76-96%). Молекулярная структура одного из них (R = PhCH2CH2) установлена методом РСА.
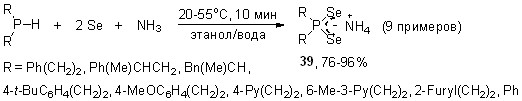
Вместо вторичных фосфинов в синтезе диселенофосфинатов аммония можно успешно использовать и вторичные фосфинселениды [при мольном соотношении R2P(Se)H/Se = 1:1]. Выходы целевых продуктов 39 в аналогичных условиях составляют более 84%.
Использование гидразина в трехкомпонентной реакции с вторичными фосфинами и элементным селеном позволило осуществить направленный синтез неизвестных диселенофосфинов гидразиния 40 (выход 81-95%). Реакция селективно протекает в этаноле (70-75оС, 20 мин) без образования ожидаемых продуктов восстановления элементного селена гидразином (полиселенидов гидразиния).
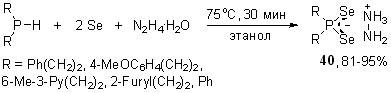
6.5. Трехкомпонентная реакция вторичных фосфинов и их селенидов с элементным селеном и аминами
Разработан общий эффективный способ получения труднодоступных и неизвестных диселенофосфинатов моно-, ди- и триалкиламмония из вторичных фосфинов, элементного селена и аминов различной природы. Данное трехкомпонентное взаимодействие реализуется в мягких условиях (45-50oC, этанол, 30 мин), выходы диселенофосфинатов алкиламмония 41 составляют 85-97%.
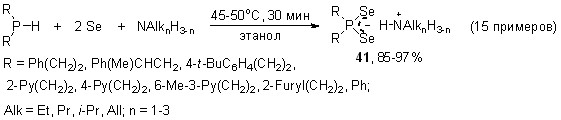
Следует отметить, что предложенный синтез диселенофосфинатов алкиламмония, в отличие от традиционных методов, является полностью атом-экономным.
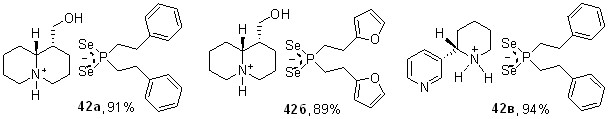
Амины природного происхождения также участвуют в представленной трехкомпонентной реакции, что дополнительно демонстрирует ее мощные синтетические возможности. Так, взаимодействием вторичных фосфинов с элементным селеном и природными анабазином или лупинином в мягких условиях (70оС, этанол, 60 мин) синтезированы первые оптически активные соли диселенофосфиновых кислот 42а-в (89-94%).
Для синтеза диселенофосфинатов алкиламмония можно успешно использовать также вторичные фосфинселениды. Мы нашли, что последние реагируют с аминами и элементным селеном в мягких условиях (этанол, 75oC, 10-90 мин), практически количественно образуя алкиламмониевые соли диселенофосфиновых кислот 41 (79-98%).
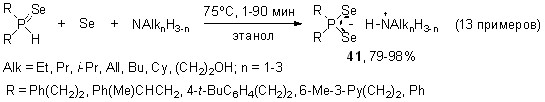
При использовании в этой реакции тетрахлорметана в качестве растворителя вместо образования диселенофосфинатов происходит катализируемое аминами (показано на примере Et3N) хлорирование вторичных фосфинселенидов, легко (20-25oC, 1 ч) и количественно приводящее к хлорангидридам селенофосфиновых кислот 43.
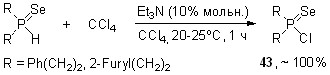
7. Новый удобный синтез солей тиоселенофосфиновых кислот на основе многокомпонентных реакций с участием вторичных фосфинов, серы, селена и оснований
7.1. Однореакторный синтез тиоселенофосфинатов Li, Na, K, Rb и Cs
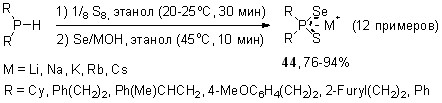
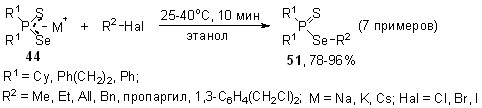
Впервые показано, что вторичные фосфинсульфиды в мягких условиях (45оС, этанол, 10 мин) реагируют с элементным селеном и гидроксидами щелочных металлов MOH (эквимольное соотношение), образуя тиоселенофосфинаты Na, K и Cs 44 с выходом 76-94%.
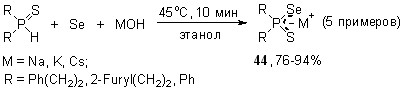
Родственная реакция, но с участием вторичных фосфинселенидов, элементной серы и щелочей (стехиометрическое соотношение) осуществляется практически мгновенно при комнатной температуре, количественно приводя к тиоселенофосфинатам щелочных металлов 44.
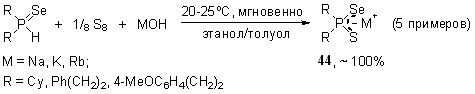
Важно отметить, что для данной реакции (в отличие от вышеприведенных) существенную роль играет порядок смешения реагентов, поскольку при контакте щелочи с вторичными фосфинселенидами происходит быстрое образование диселенофосфинатов и вторичных фосфинов. Мы нашли, что оптимальным является прибавление раствора MOH к гомогенной смеси вторичных фосфинселенидов с элементной серой.
Предложенные оригинальные многокомпонентные реакции взаимодополняют друг друга и имеют общий характер, что позволяет направленно синтезировать на их основе новые или труднодоступные Na, K, Rb и Cs соли различных тиоселенофосфиновых кислот 44, содержащих алифатические, ароматические и гетероциклические заместители (в том числе стерически затрудненные).
Более того, тиоселенофосфинаты 44 можно синтезировать в одну препаративную стадию непосредственно из вторичных фосфинов. Так, последние окисляются элементной серой в растворе этанола (20-25оС, 30 мин), образуя вторичные фосфинсульфиды, взаимодействие которых (без выделения) с элементным селеном и гидроксидами Li, Na, K, Rb и Cs (45оС, этанол, 10 мин) приводит к целевым тиоселенофосфинатам 44 с высоким выходом (76-94%).
Образование тиоселенофосфинатов в трехкомпонентных реакциях происходит, очевидно, через стадию депротонирования вторичных фосфинхалькогенидов под действием основания MOH. Генерируемые при этом P,X-амбидентные халькогенофосфинит-анионы далее окисляются элементной серой или селеном, давая тиоселенофосфинаты.
По данным 31P и 77Se ЯМР спектроскопии в тиоселенофосфинат-анионах синтезированных солей 44 наблюдается делокализация заряда с участием атомов серы и селена. Исследование пространственного [B3LYP/6-31+G(d,p)], электронного [MP2(Full)/6-311++G(2d,p)] и орбитального [HF/6-31+G(d,p)] строения изолированных дифенилтиоселенофосфинатов Li, Na и K показало, что природа катиона практически не влияет на зарядовое распределении в триаде S-P-Se (рис. 1). Значения AIM индексов делокализации и индексов Виберга связей P-S и P-Se также свидетельствуют о значительной делокализации отрицательного заряда в амбидентных анионах.
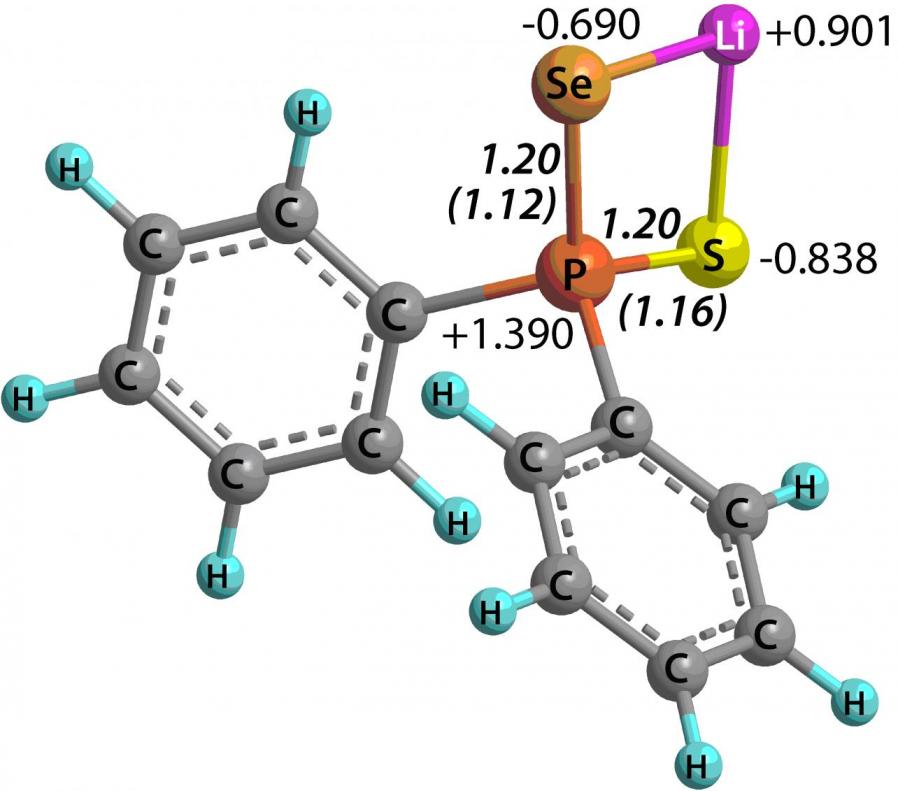 | 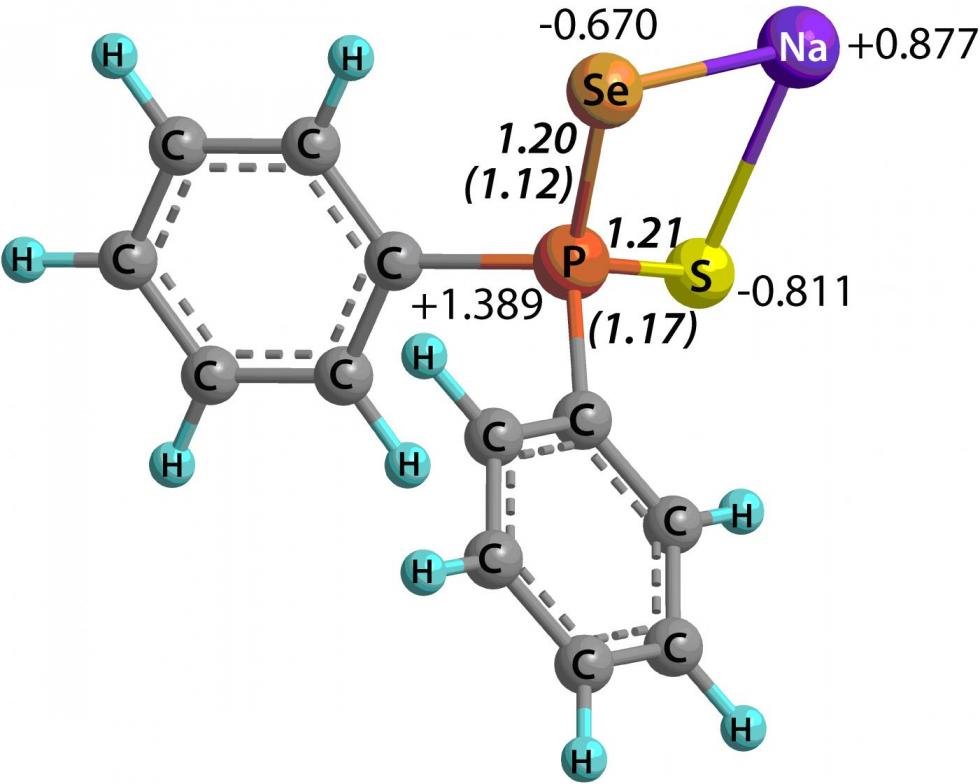 | 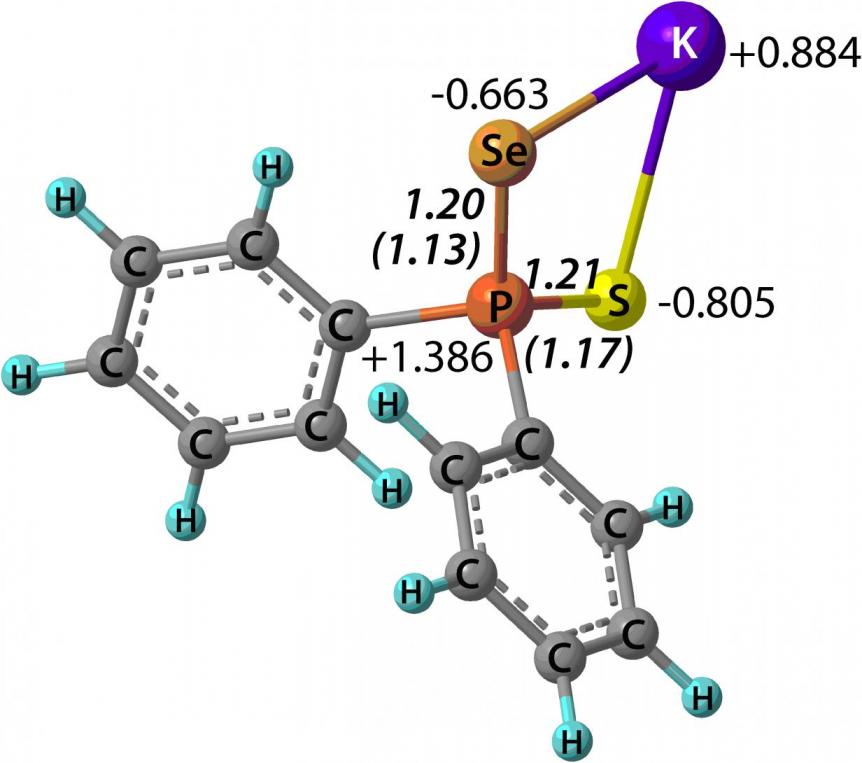 |
Рис. 1. AIM заряды (подход “атомы в молекулах”), AIM индексы делокализации и индексы Виберга (в скобках) в дифенилтиоселенофосфинатах Li, Na и K
7.2. Однореакторный синтез органиламмониевых солей тиоселенофосфиновых кислот
Разработан однореакторный атом-экономный метод синтеза моно-, ди- и триалкиламмониевых солей различных тиоселенофосфиновых кислот, включающий генерирование in situ вторичных фосфинселенидов (из вторичных фосфинов и элементного селена) и их последующее взаимодействие с элементной серой и аминами в мягких условиях (70оС, 20 мин). Реакция практически не сопровождается образованием побочных продуктов, а выходы тиоселенофосфинатов 45 превышают 76%. Структура трех соединений 45 установлена методом РСА.
Общность данного метода продемонстрирована на фосфинах различного строения (включая фосфины с оснвными пиридиновыми и фурановыми кольцами), а также на первичных, вторичных и третичных аминах (в том числе с ненасыщенными заместителями).
Разработанный подход позволяет направленно синтезировать также тиоселенофосфинаты, содержащие фармакологически активные катионы. Так, используя природные лупинин, анабазин и хинин, мы синтезировали первые оптически активные тиоселенофосфинаты 46-48 с высоким выходом (78-90%). Молекулярная структура соли лупинина 46 (R = PhCH2CH2) установлена методом РСА.
Тиоселенофосфинаты алкиламмония 45 могут быть также получены с высоким выходом по трехкомпонентной реакции между вторичными фосфинсульфидами, селеном и аминами, реализуемой в растворе этанола (70-75оС, 1 ч). Продукты 45 охарактеризованы методами ЯМР и ИК-спектроскопии, а также РСА.
Общий характер этой реакции показан на широком ряде различных фосфинсульфидов и аминов – функциональных, оптически активных и содержащих ненасыщенные заместители.
Следует отметить, что способ получения тиоселенофосфинатов из вторичных фосфинсульфидов, кроме фундаментального значения, имеет препаративные преимущества, заключающиеся в удобстве хранения и использования исходных фосфинсульфидов – устойчивых на воздухе веществ со слабым запахом.
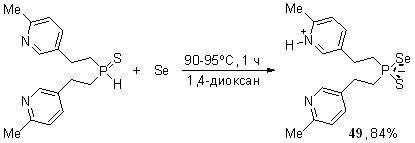
На основе вторичных фосфинсульфидов, содержащих оснвные пиридиновые циклы, реализован “внутримолекулярный” вариант этой реакции. Показано, что реакция бис[2-(2-метилпирид-5-ил)этил]фосфинсульфида c элементным селеном (эквимольное соотношение, 90-95oC, 1,4-диоксан, 1 ч) приводит к цвиттер-ионному тиоселенофосфинату пиридиния 49 (выход 84%).
8. Исследование свойств полученных фосфорорганичеких соединений
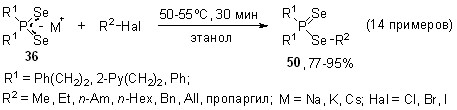
8.1. Реакция диселенофосфинатов щелочных металлов с органилгалогенидами
На основе реакции диселенофосфинатов Na, K и Cs с органилгалогенидами различной природы (алкилгалогениды, бензилхлорид, аллил- и пропаргилбромиды) разработан эффективный общий метод синтеза ранее неизвестных или труднодоступных эфиров диселенофосфиновых кислот. Показано, что алкилирование диселенофосфинатов 36 легко осуществляется в мягких условиях (50-55oC, этанол, 30 мин), а выходы целевых эфиров 50 достигают 95%.
8.2. Региоселективное алкилирование тиоселенофосфинатов органилгалогенидами
Тиоселенофосфинат-анионы, благодаря наличию двух региоцентров (S,Se-амбидентные системы), потенциально способны выступать в роли как S-, так и Se-нуклеофилов. Квантово-химический анализ электронного [MP2(Full)/6-311++G(2d,p)] и орбитального [HF/6-31+G(d,p)] строения изолированного [Ph2PSSe] аниона свидетельствует, что наибольшая плотность ВЗМО локализована на атоме селена, тогда как максимальный по абсолютной величине отрицательный заряд (-0.764) приходится на атом серы (рис. 2).
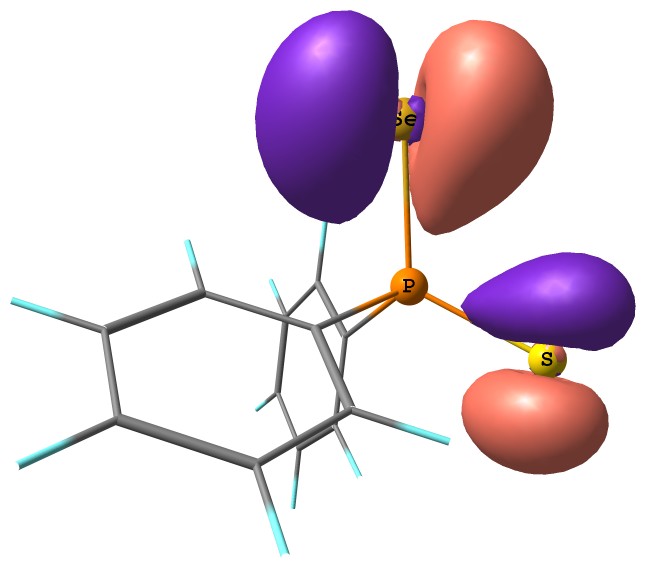 | 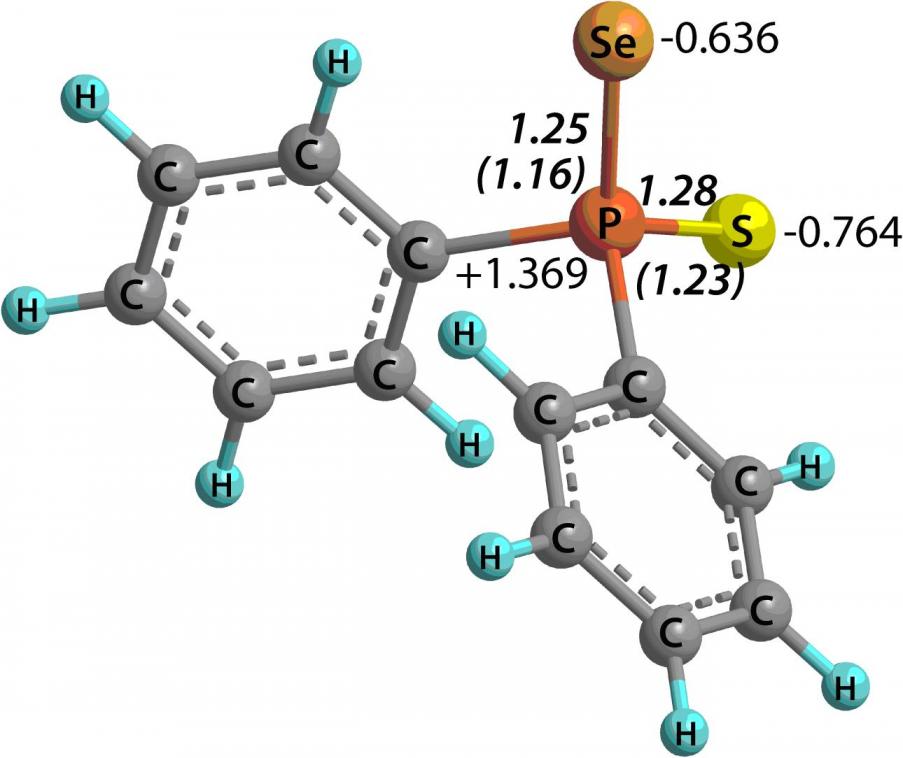 | Рис. 2. Слева: вид ВЗМО (E = -4.11 эВ), справа: AIM заряды и индексы делокализации, а также индексы Виберга (в скобках) в [Ph2PSSe] анионе |
Эксперименты показали, что алкилирование тиоселенофосфинатов Na, K или Cs 44 органилгалогенидами различной природы (sp3-хлориды, -бромиды и -иодиды) реализуется в мягких условиях (25-40oC, 10 мин) регио- и хемоселективно по атому селена, приводя к Se-эфирам тиоселенофосфиновых кислот 51 с выходом 78-96%. Региоизомерные S-эфиры не образуются (31Р ЯМР).
B3LYP/6-31+G(d,p) расчет изолированных состояний региоизомерных эфиров Ph2P(S)SeMe и Ph2P(Se)SMe также свидетельствует об энергетической предпочтительности Se-эфира (G = 4.5 ккал/моль).
8.3. Редокс-реакция диселенофосфинатов с иодом
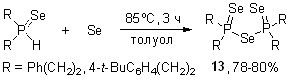
Известно, что дитиофосфинат-анионы [R2PS2] под действием молекулярного иода легко подвергаются окислительному сочетанию, образуя дисульфиды R2P(S)SS(S)PR2. Мы нашли, что окисление иодом диселенофосфинатов натрия и калия 36 (мольное соотношение 1:2, 1,4-диоксан, 20-25оС) происходит практически мгновенно с образованием эквимольных количеств моноселенидов (R2P=Se)2Se (13) и триселенидов (R2P=Se)2Se3 (52). Ожидаемые диселениды (R2P=Se)2Se2 в реакционных смесях не идентифицированы (31Р ЯМР).
Молекулярные структуры моно- и триселенида (R = PhCH2CH2), образующих сокристаллы (1:1), установлены методом РСА.
8.4. Окислительная димеризация тиоселенофосфинатов под действием иода
В свете полученных данных о взаимодействии диселенофосфинатов Na и K с иодом, можно ожидать, что подобное окисление тиоселенофосфинатов приведет к образованию моно- и триселенидов или моно- и трисульфидов, либо к смеси всех возможных продуктов. С другой стороны, результатом такой реакции могут быть продукты окислительной димеризации тиоселенофосфинат-анионов – дисульфиды, диселениды или тиоселениды.
Мы нашли, что обработка тиоселенофосфинатов 44 элементным иодом (мольное соотношение 2:1, 1,4-диоксан, 20-25оС, ~ 5 c) хемо- и региоселективно приводит к диселенидам 53 с выходом 87-90%. Альтернативные дисульфиды (R2P=Se)2S2 или тиоселениды R2P(Se)S-Se(S)PR2 не образуются (31P ЯМР). Молекулярные структуры диселенидов 53 (R = Cy и PhCH2CH2) установлены методом РСА.
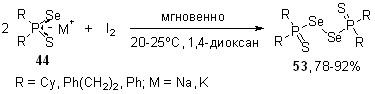
Хемоселективность этой реакции интерпретируется данными UB3LYP/6-31+G(d,p) орбитального анализа вероятного ключевого интермедиата – тиоселенофосфинат-радикала [R2PSeS], в котором (при R = Me) наибольшая спиновая плотность приходится на атом Se (~60%). Кроме того, расчет [B3LYP/6-31+G(d,p)] модельных продуктов – (Me2P=S)2Se2, Me2P(Se)S-Se(S)PMe2 и (Me2P=Se)2S2 также показывает, что диселенид является энергетически более выгодным, чем тиоселенид (E = 7.9 ккал/моль) и дисульфид (E = 17.8 ккал/моль).
8.5. Синтез и структурная характеристика диселенофосфинатов и тиоселенофосфинатов Ni(II)
Разработан эффективный однореакторный синтез новых диселенофосфинатов Ni(II) 54а,б на основе реакции Ni(OAc)24H2O с диселенофосфинатами диэтиламмония, полученными in situ трехкомпонентным взаимодействием вторичных фосфинов с селеном и диэтиламином в мягких условиях (50оС, этанол, 30 мин). Выходы целевых комплексов 54а,б достигают 90%.
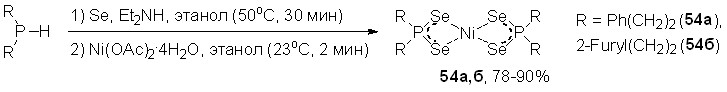
По данным РСА, в структуре 54б атом Ni находится в центре симметрии и имеет почти плоско-квадратную координацию из четырех атомов селена (рис. 3). Оба диселенофосфинат-аниона выступают как изобидентатные хелатирующие лиганды: длины связей Ni-Se и P-Se – в пределах 2.356 ± 0.006 и 2.167 ± 0.003, соответственно.
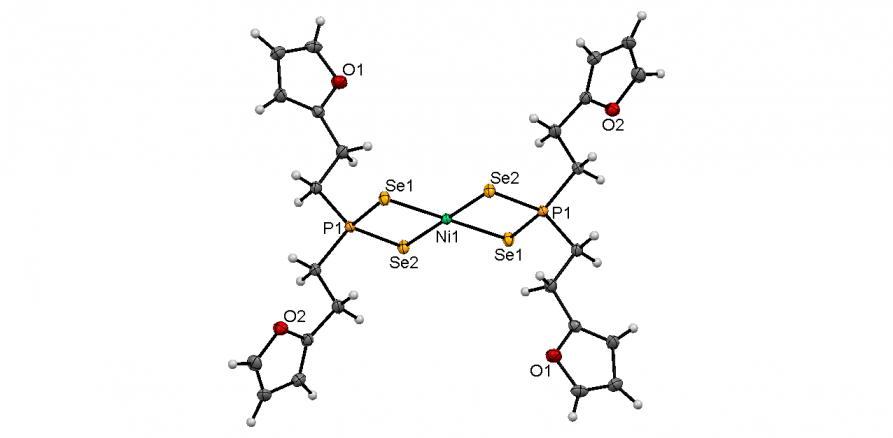
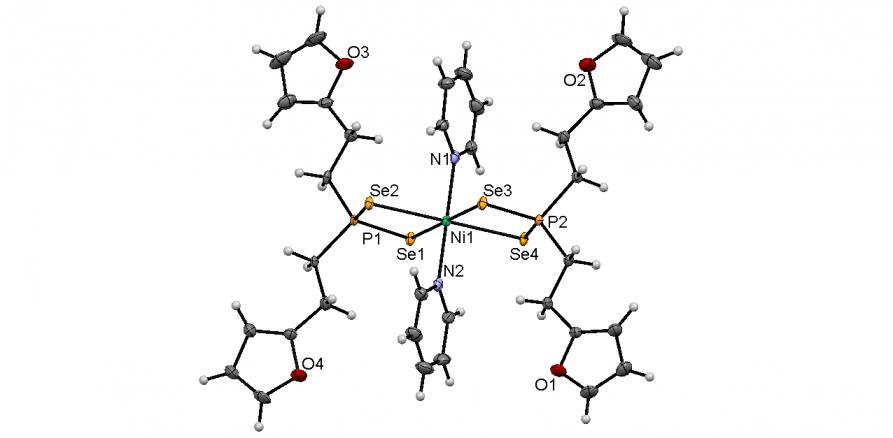
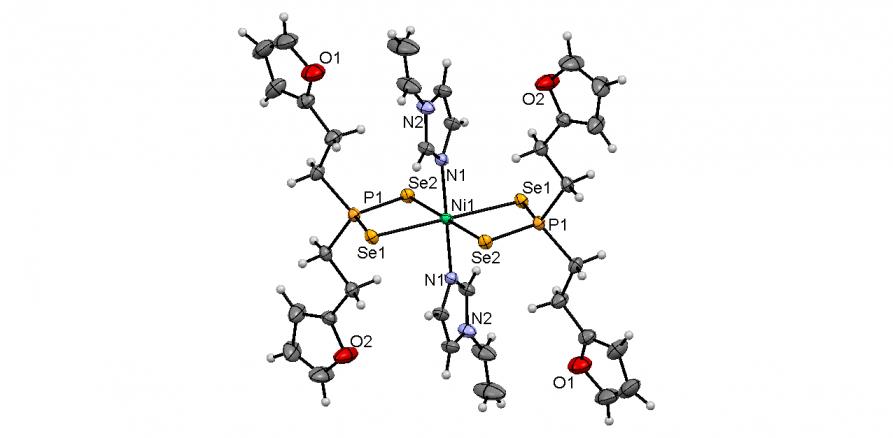
Рис. 3. Слева направо: молекулярные структуры диселенофосфинатов 54б и 55а,б
Синтезированы первые октаэдрические комплексы никеля(II) с лигандами [R2PSe2] типа. Мы показали, что диселенофосфинат 54б под действием N-оснований – пиридина или 1-винилимидазола (L), легко (20-25oC, CH2Cl2, ~ 1 мин) и количественно превращается в комплексы типа [Ni(Se2PR2)22L] (55а,б). По данным РСА (рис. 3), атом Ni в структурах 55а,б находится в центре инверсии и координирует четыре атома Se двух изобидентатных [Se2PR2] лигандов и два атома N пиридинового или имидазольного циклов (длины связей Ni-N – 2.066-2.131 ). Координационный полиэдр Se4N2 имеет форму искаженного октаэдра. Расстояния Ni-Se и P-Se лежат в пределах 2.616-2.644 и 2.147-2.161, соответственно.
Синтезированы и впервые охарактеризованы тиоселенофосфинатные комплексы Ni(II). Удобный способ их получения разработан на основе реакции Ni(OAc)24H2O c тиоселенофосфинатами Na, генерируемыми in situ из вторичных фосфинов, серы, селена и NaOH в этанольном растворе. Выходы тиоселенофосфинатов 56а-в, как правило, превышают 80%.
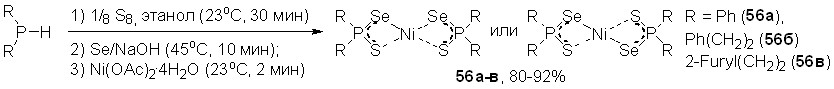
Методом РСА установлено, что атом Ni в структурах 56а-в является центром инверсии и имеет плоско-квадратное координационное окружение из четырех атомов халькогенов двух тиоселенофосфинатных лигандов (рис. 4). Атомы S и Se разупорядочены по двум позициям с сохранением их цис-расположения; соотношение заселенностей Se/S:S'/Se' составляет ~ 0.6:0.4. Отметим, что данные B3LYP/6-311++G(df,p) расчёта модельного тиоселенофосфината Ni(SeSPMe2)2 свидетельствует о энергетической предпочтительности его транс-изомера (Eцис/транс = 0.2 ккал/моль).
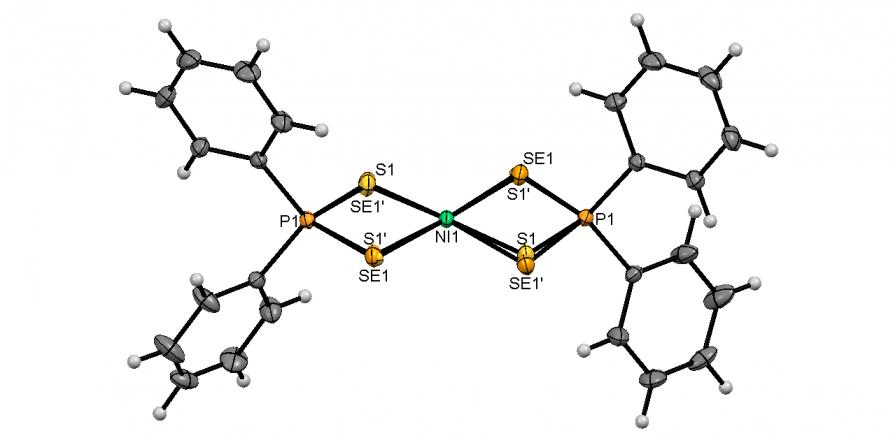
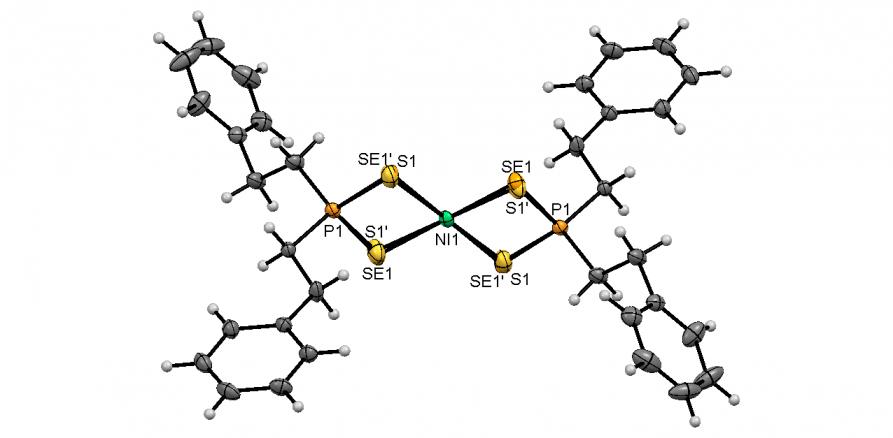
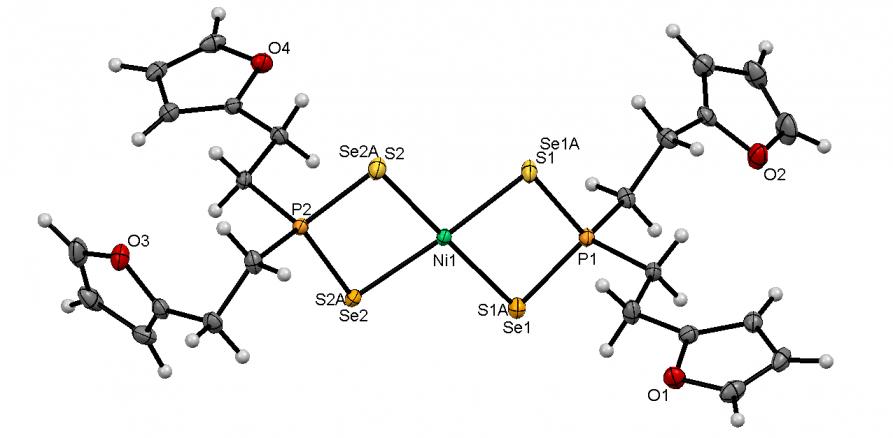
Рис. 4. Слева направо: молекулярные структуры тиоселенофосфинатов Ni(II) 56a-в
8.6. Синтез и структурная характеристика диселенофосфинатов Sb(III), Bi(III) и Cr(III)
Обменной реакцией между диселенофосфинатами аммония 39 и SbCl3, Bi(NO3)3 или CrCl3 в растворе ТГФ (-50оС, 3 ч) нами синтезированы диселенофосфинатные комплексы Sb(III), Cr(III) и Bi(III) 57а-д с выходом 82-90%. Их молекулярное строение впервые установлено методом РСА (5 структур).
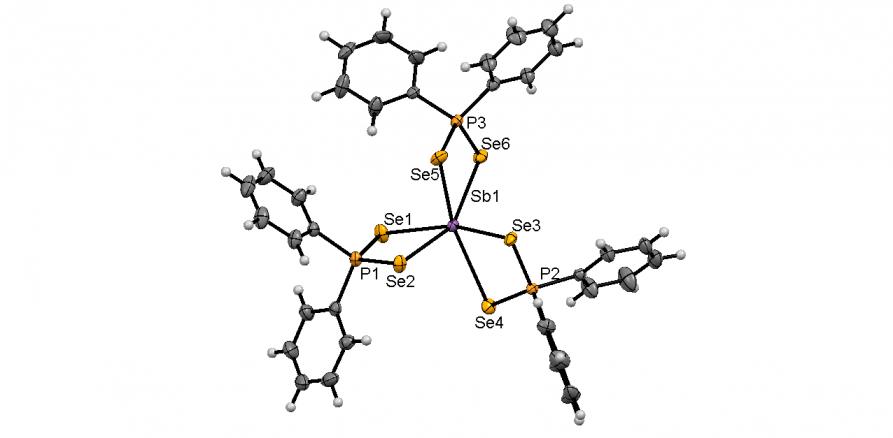
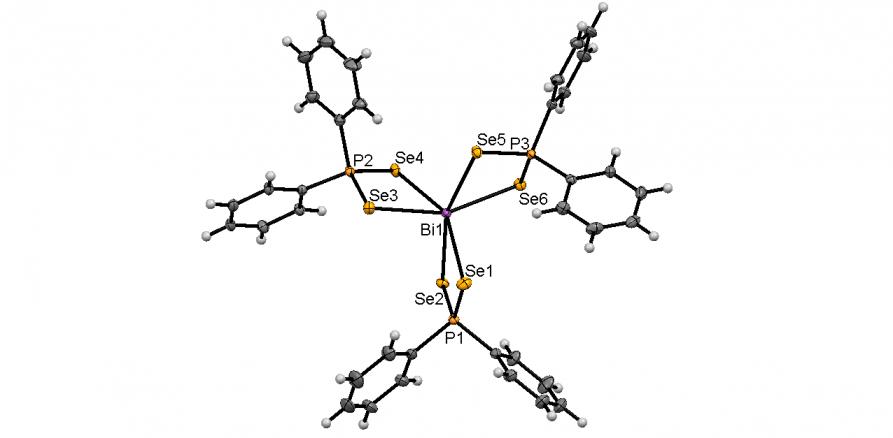
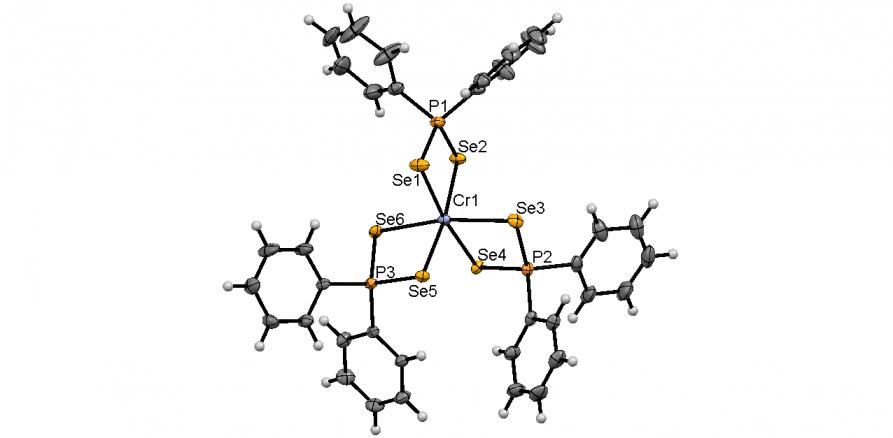
Рис. 5. Слева направо: молекулярные структуры M(Se2PPh2)3 (M = Sb, Bi, Cr) 57a-в
Атом Sb в Sb(Se2PPh2)3 (57а) имеет искаженное октаэдральное окружение из шести атомов Se трех диселенофосфинатных лигандов (рис. 5). Атомы Se каждой из [Ph2PSe2] групп неэквивалентны: их средние длины связей с атомом Sb составляют 2.703 и 3.062, а с атомом P – 2.138 и 2.200.
Атом Bi в Bi(Se2PPh2)3 (57б) также имеет искаженную октаэдральную координацию со стереохимически неактивной неподеленной электронной парой (рис. 5). Каждый из [Se2PPh2] лигандов является изобидентатным: длины всех связей Bi-Se эквивалентны (~ 2.930 ).
Структура комплекса Cr(Se2PPh2)3 (57в) подобна Bi(Se2PPh2)3: атом Cr находится в центре искаженного октаэдра Se6, образованного тремя изобидентатным [Ph2PSe2] лигандами, рис. 5. Все расстояния Cr-Se (~ 2.554 ) и P-Se (~ 2.161 ) практически эквивалентны.
8.7. Синтез первых восьмиядерных кластеров меди Cu(I), стабилизированных диселенофосфинатными лигандами[1]
Мы нашли, что взаимодействие гексафторфосфата меди(I) [Cu(MeCN)4]PF6 с диселенофосфинатом аммония 39 (мольное соотношение 4:3) в мягких условиях (20-25оС, ТГФ, 1 ч) приводит к самосборке дикатионного восьмиядерного кластера 58а с выходом 87%. По данным РСА, структура 58а образована кубом Cu8, стабилизированным шестью диселенофосфинатными группами, каждая из которых выступает в роли тетрадентатного мостикового (2, 2) лиганда (рис. 6). Атомы селена расположены в вершинах образованного ими икосаэдра Se12, внутрь которого вписан куб Cu8.
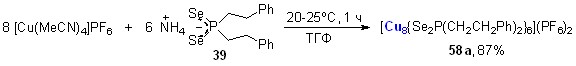
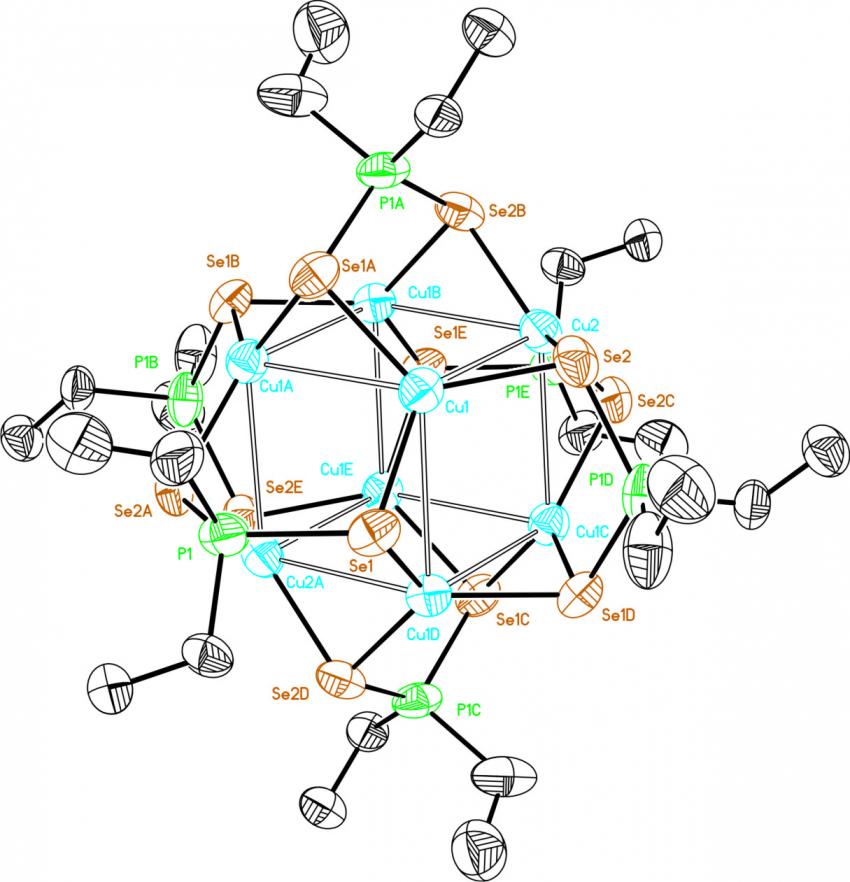 | 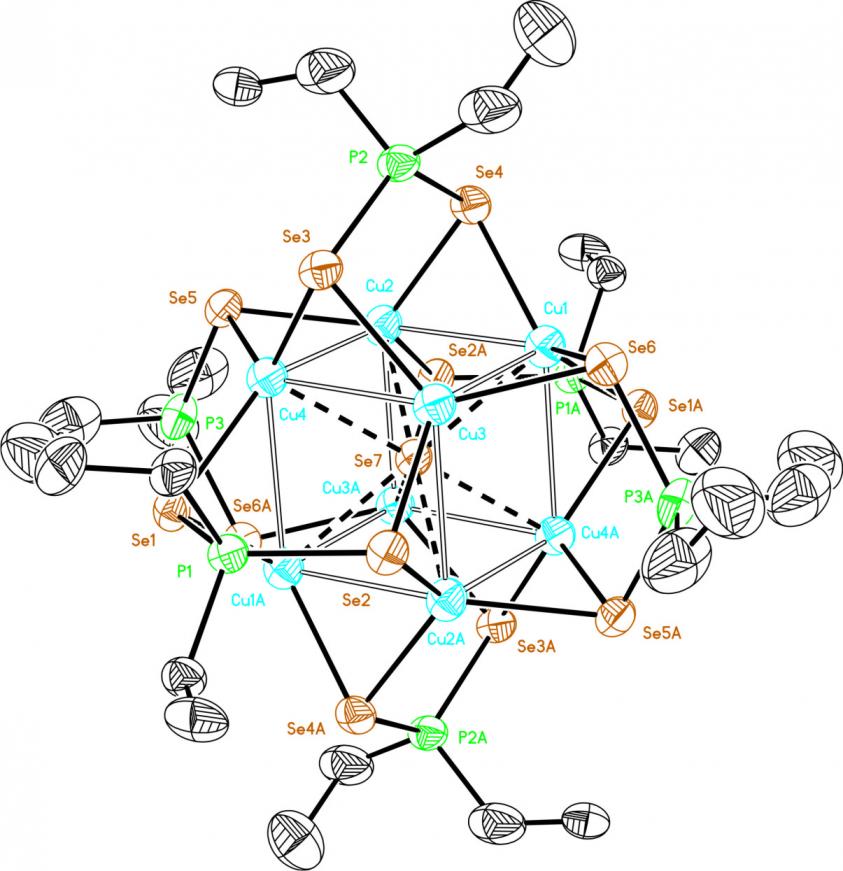 | Рис. 6. Слева направо: молекулярные структуры катионной части кластера 58а и нейтрального кластера 58б (атомы водорода и фенильные группы не показаны) |
Вместе с тем проведение этой реакции в тех же условиях, но в присутствии доноров Se2- анионов, например, селенофосфата цезия [Cs4(P2Se6)(H2O)4], приводит к самосборке нейтрального Se-центрированного кубического кластера 58б (выход 56%), стуктура которого представлена на рис. 6.
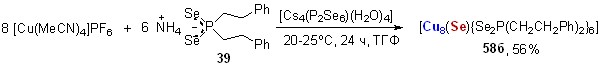
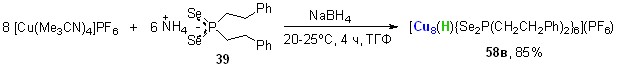
При взаимодействии [Cu(MeCN)4]PF6 с диселенофосфинатом аммония 39 (20-25оС, ТГФ, 4 ч) в присутствии борогидрида натрия (донор H-анионов) образуется монокатионный восьмиядерный кластер 58в (выход 85%), содержащий четырехшапочный тетраэдр Cu8, в центре которого расположен гидрид-ион (рис. 7).
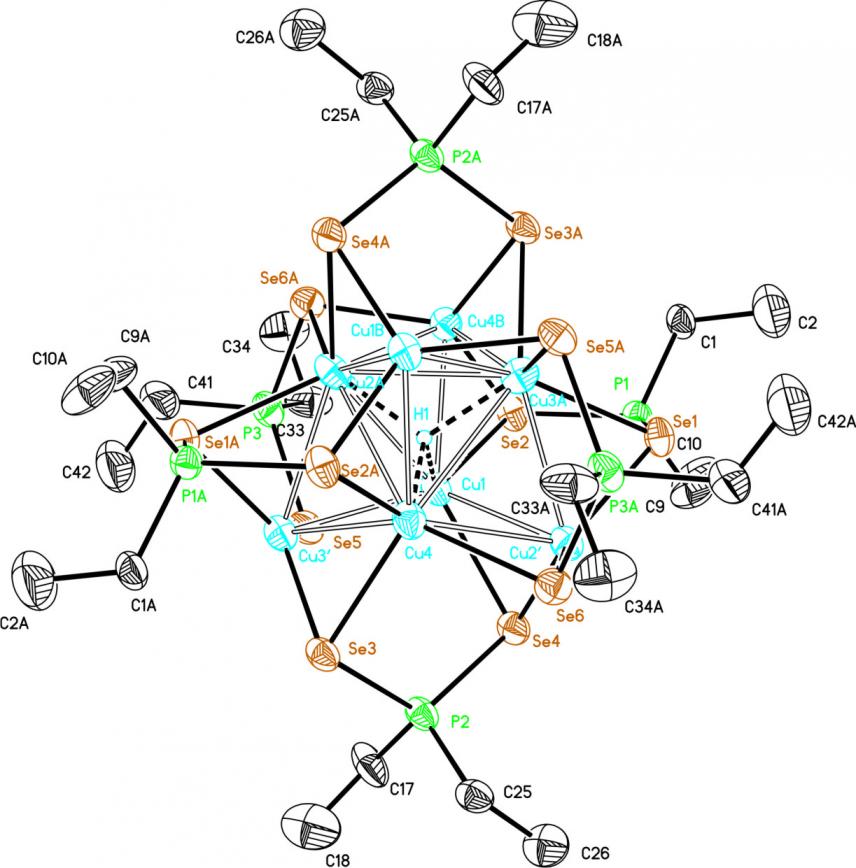 | 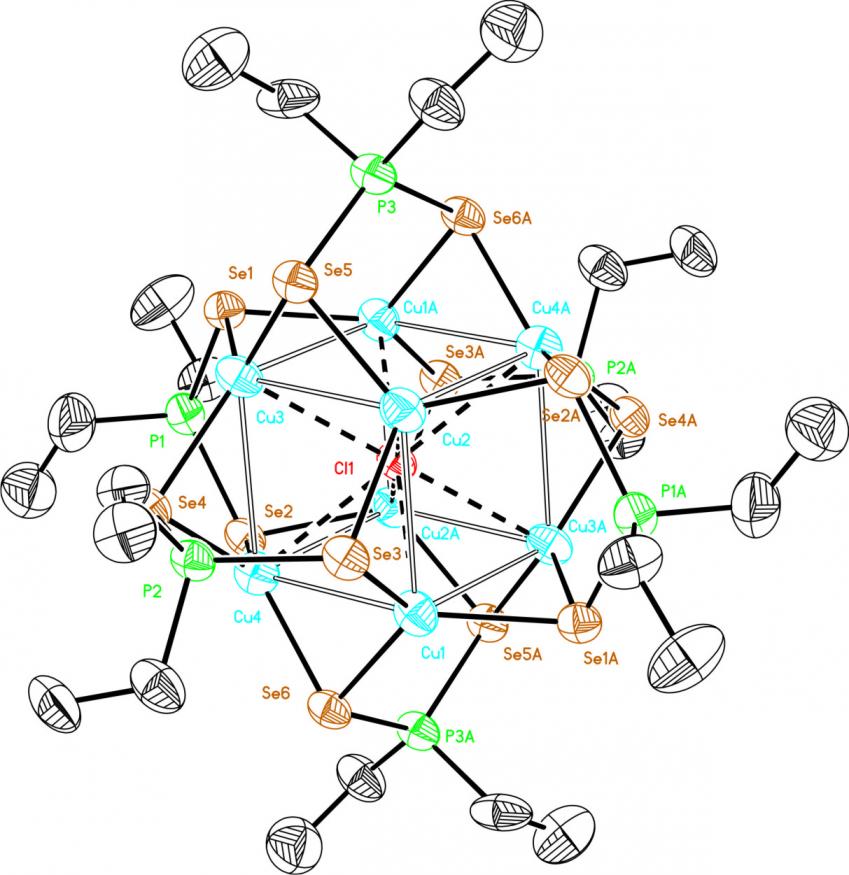 | 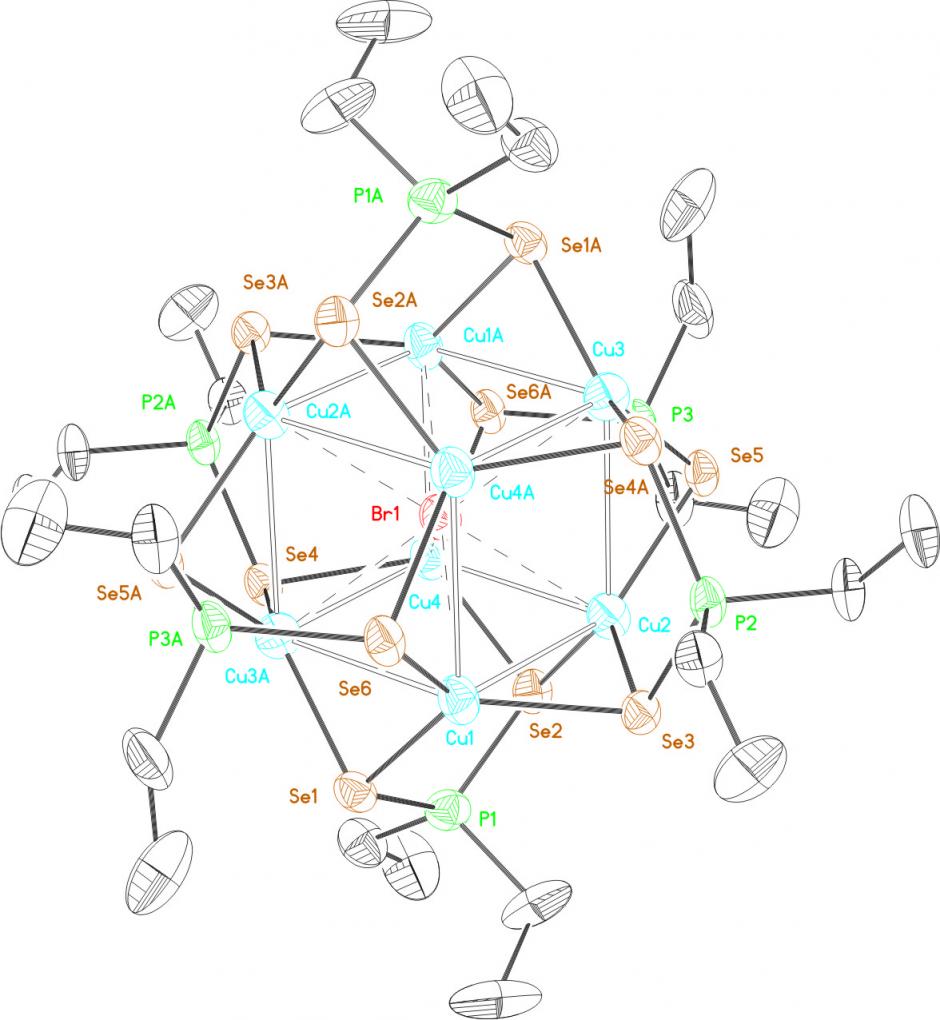 |
Рис. 7. Слева направо: молекулярные структуры катионных частей кластеров 58в-д (атомы водорода и фенильные группы не показаны)
В присутствии источников галогенид-анионов, например, хлорида или бромида тетрабутиламмония [Bu4N]X, реакция [Cu(MeCN)4]PF6 с диселенофосфинатом аммония 39 (соотношение 8:6) в мягких условиях (20-25оС, ТГФ, 4 ч) приводит к самосборке Cl- или Br-центрированных восьмиядерных кубических кластеров 58г,д с выходом до 80%. Структуры последних, установленные методом РСА, представлены на рис. 7.
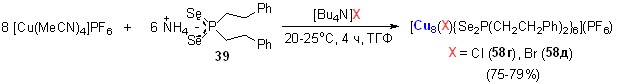
8.8. Синтез комплексов Pd(II), Co(II) и Eu(III) на основе трис(2-пиридил)фосфина и его халькогенидов
Мы показали, что реакция трис(2-пиридил)фосфина (2-Py3P) с PdCl2 (мольное соотношение 2:1) в мягких условиях (30-35oC, CH2Cl2, 30 мин) приводит к неизвестному ранее комплексу цис-[Pd(PPy3)2Cl2]CH2Cl2 (59) с выходом 90%. По данным РСА (рис. 8), координационный узел Pd(II) в 59 имеет почти плоскоквадратное строение, а обе молекулы 2-Py3P, выступающие в роли Р-монодентных лигандов, находятся в цис-положении относительно атомов хлора.
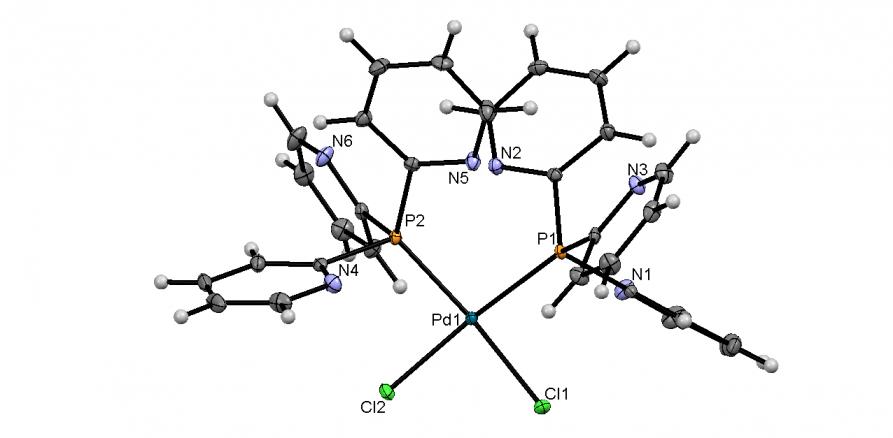 | 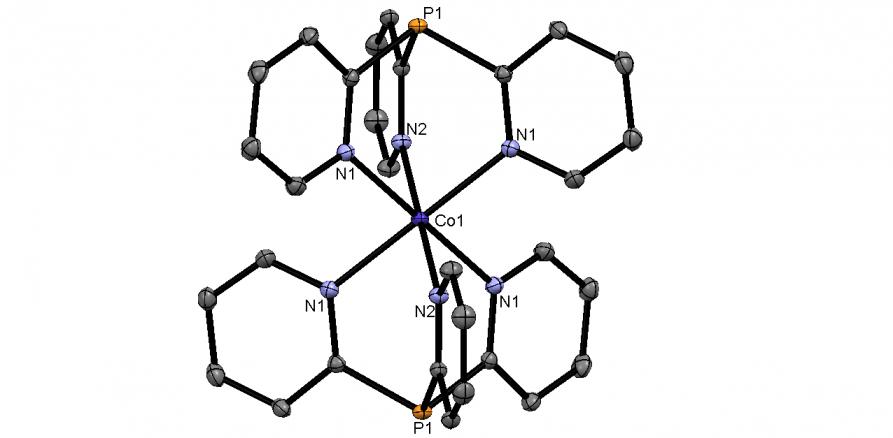 | Рис. 8. Слева направо: молекулярные структуры Pd(II) комплексов 59 и 60 (молекулы кристаллизационных растворителей не показаны) |
Реакцией CoCl26H2O с двукратным мольным количеством 2-Py3P (45-50oC, этанол, 30 мин) синтезирован с выходом 78% неизвестный ранее комплекс [Co(2-Py3P)2]Cl28H2O (60). В структуре последнего обе молекулы 2-Py3P координируют Co2+ как N,N,N-триподальные лиганды, образуя катион “сэндвичевого” типа [Co(2-Py3P)2]2+ (рис. 8). Атом кобальта, таким образом, находится в окружении шести атомов азота, образующих деформированный октаэдр.
Синтезирован первый комплекс европия(III) на основе пиридилфосфинов. Мы нашли, что в реакции 2-Py3P с Eu(NO3)36H2O (20-25oC, этанол/CH2Cl2, 30 мин) количественно образуется “полусэндвичевый” комплекс [Eu(2-Py3P)(NO3)3]CH2Cl2 (61), содержащий 9-координированный Eu(III) (рис. 9). Методом РСА установлено, что координационным полиэдром последнего является искаженная трехшапочная тригональная призма, основания которой образованы тремя атомами азота 2-Py3P (N,N,N-триподальный лиганд) и тремя атомами кислорода трех NO3-групп (O,O-бидентатные лиганды).
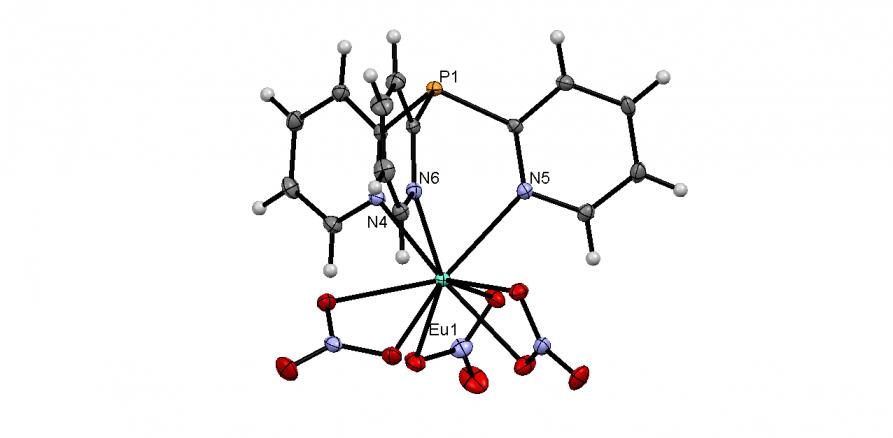 | 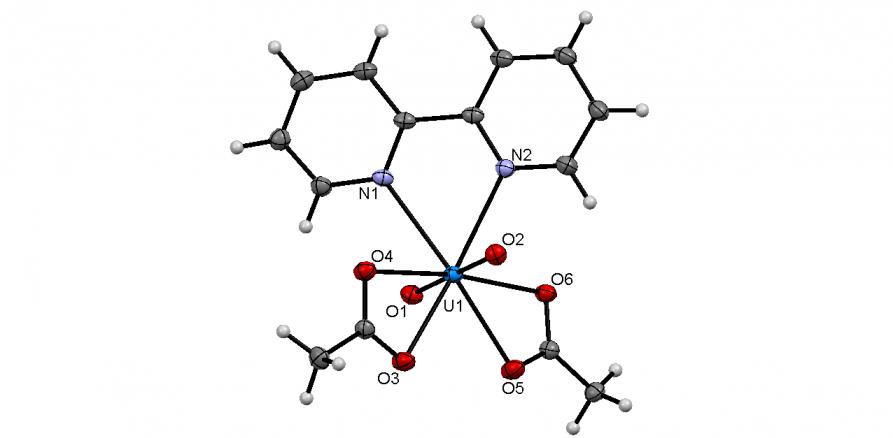 | Рис. 9. Слева направо: молекулярные структуры комплексов 61 и 62 (молекулы кристаллизационных растворителей не показаны) |
С целью синтеза первого актиноидного комплекса на основе трис(2-пиридил)фосфина, нами осуществлено взаимодействие последнего с UO2(OAc)23H2O в мягких условиях (20-25oC, водный этанол). Однако, вместо ожидаемого аддукта, из реакционной смеси был выделен комплекс ацетата уранила с 2,2-дипиридилом, [UO2(2,2-Bipy)(OAc)2] (62), структура которого установлена методом РСА (рис. 9).
Синтезированы первые комплексы Pd(II) на основе трис(2-пиридил)фосфинхалькогенидов. Фосфиноксид и -сульфид, полученные обработкой 2-Py3P перекисью водорода (20-25оС, этанол/вода) или серой S8 (80оС, толуол), при взаимодействии с эквимольным количеством PdCl2 легко (30оС, CH2Cl2, 2 ч) образуют комплексы состава [Pd(2-Py3P=X)Cl2]CH2Cl2 (X = O, 63а; X = S, 63б) с выходом 78 и 91%, соответственно. По данным РСА, атомы Pd в обоих комплексах имеют плоско-квадратное окружение и координируют фосфинхалькогениды (2-Py)3P=X по двум атомам азота, образуя 6-членные металлоциклы “ванноподобной” формы (рис. 10).
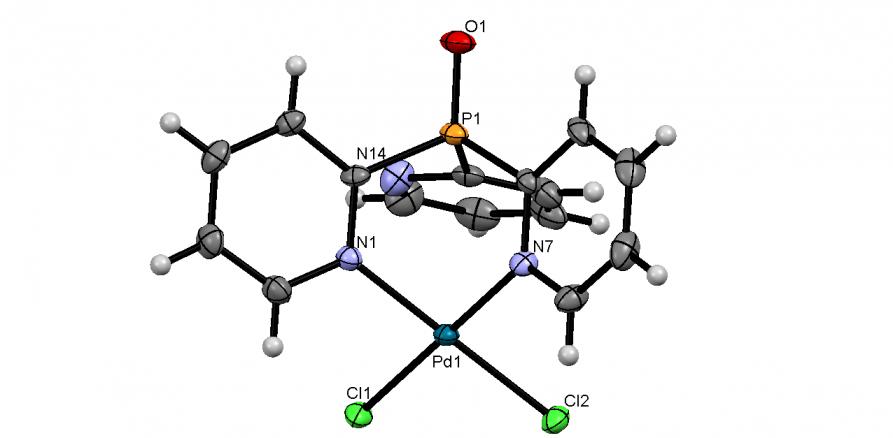 | 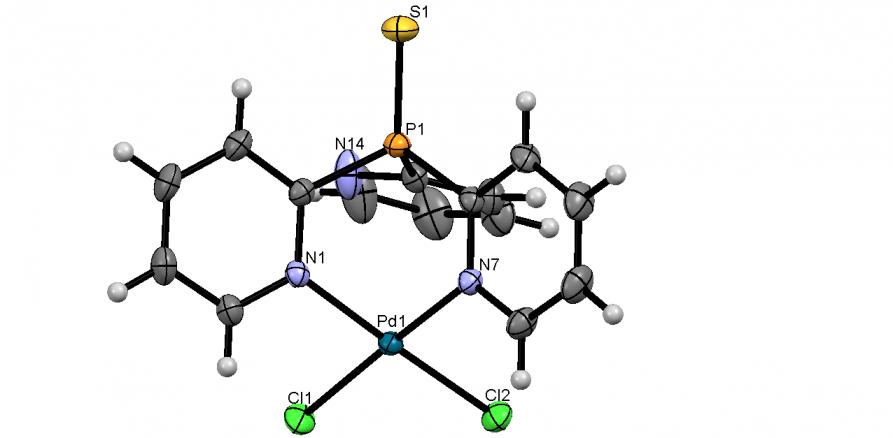 | Рис. 10. Слева направо: молекулярные структуры Pd(II) комплексов 63а,б (молекулы CH2Cl2 не показаны) |
8.9. Нанобиокомпозиты элементного селена из диселенофосфинатов щелочных металлов и арабиногалактана [2]
Окислением диселенофосфинатов щелочных металлов 36 водной перекисью водорода в присутствии арабиногалактана (20-25оС, 30 мин) впервые получены инкапсулированные в макромолекулы арабиногалактана наночастицы элементного селена. Средний размер последних по данным просвечивающей электронной микроскопии (ПЭМ, рис. 11) составляет 5 нм.
Эти водорастворимые нанобиокомпозиты отличаются от таковых, полученных восстановлением H2SeO3 гидразин-гидратом, меньшими размерами наночастиц селена (единицы нанометров против десятков нанометров), а также рентгеноаморфной малоэлектроноконтрастной (разупорядоченной) кристаллической структурой селеновых наночастиц. Однако, несмотря на относительную неупорядоченность кристаллической решетки, селеновые наночастицы проявляют люминесцентные свойства полидисперсных “квантовых точек” – возбуждаются и излучают свет практически во всем видимом диапазоне частот (рис. 11).
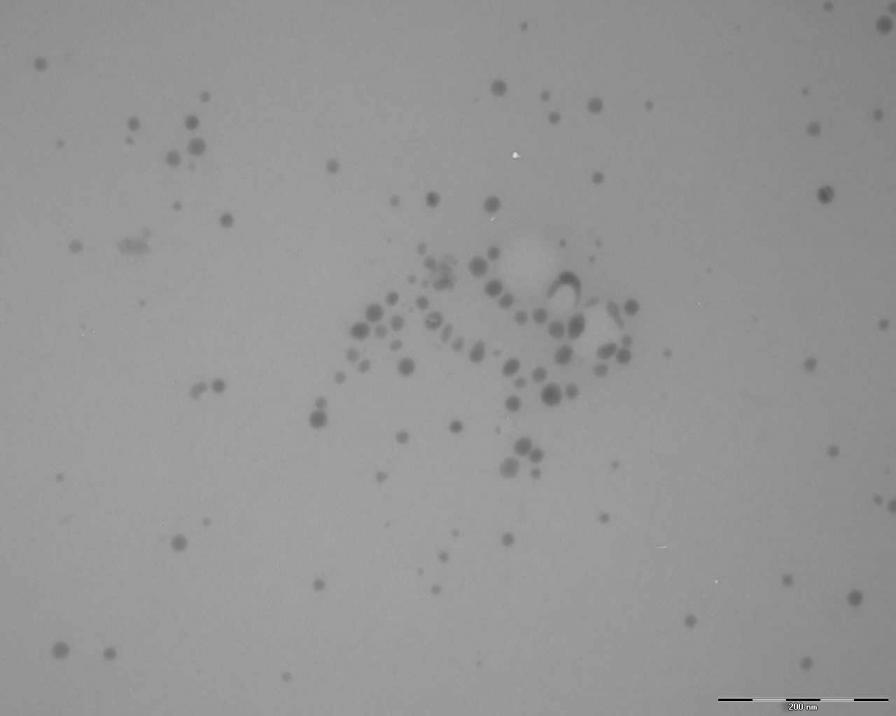

Рис. 11. Слева: ПЭМ наночастиц Se в нанокомпозите; справа: один и тот же твердофазный микронный агломерат нанокомпозитных частиц селен/арабиногалактан, снятый люминесцентным микроскопом при максимальном наборе выделенных частотных каналов возбуждения и испускания люминесценции
8.10. Антимикробная активность диселенофосфината натрия и нанобиокомпозитов элементного селена [3]
Изучено взаимодействие синтезированных бис(2-фенилэтил)диселено- фосфината натрия и нанокомпозитов элементного селена с клеточной микробной культуры Clavibacter michiganensis subsp. sepedonicus штамм Ac 1405 (Cms), вызывающей кольцевую гниль клубней картофеля. Установлено, что на “голодных” микробных диетах диселенофосфинат натрия и нанокомпозиты селен/арабиногалактан являются высокоэффективными антимикробными средствами по отношению к указанному фитопатогену. Однако, на питательных средах (с альтернативными, помимо арабиногалактана, пищевыми источниками – дрожжевой экстракт, казеин-пептон и глюкоза) токсический эффект полностью исчезает. Из этого можно сделать вывод, что ключевой стадией антимикробного действия нанобиокомпозитов элементный селен/арабиногалактан является биоспецифический “пищевой” захват нанобиокомпозита через биоутилизируемый микробом арабиногалактан.
основные Выводы
1. Принципиально расширены синтетические возможности прямого фосфорилирования электрофилов элементным фосфором в суперосновных средах: в реакцию вовлечены первые представители аллиларенов (аллилбензол и его производные), функционализированных виниларенов (4-метоксистирол), конденсированных циклопентадиенов (1Н-инден) и галогенгетаренов (2-бромпиридин) и на этой основе разработаны бесхлорные препаративные методы синтеза 1-метил-2-арилэтилфосфонистых кислот и бис(1-метил-2-фенилэтил)фосфина, трис[2-(4-метоксифенил)этил]фосфиноксида и 2-(4-метоксифенил)этилфосфонистой кислоты, 2,3-дигидро-1H-инден-2-илфосфонистой кислоты и трис(2-пиридил)фосфина. На примере 2-бромпиридина впервые реализовано нуклеофильное замещение галогена в гетероароматическом ядре фосфид-анионами, генерируемыми из элементного фосфора под действием супероснований.
2. Разработаны новые бесхлорные методы синтеза ранее неизвестных или труднодоступных солей, эфиров и ангидридов ряда фосфорорганических, тиофосфорорганических и селенофосфорорганических кислот на основе открытых многокомпонентных реакций с участием первичных или вторичных фосфинов (или вторичных фосфинхалькогенидов), элементных серы или селена и алкенов или оснований.
3. Открыты и детально изучены новые трехкомпонентные реакции между вторичными фосфинами, элементным селеном и широким рядом алкенов различной природы (арил- и гетарилэтены, виниловые эфиры, винилсульфиды и винилселениды). Показано, что эти реакции характеризуются полной хемоселективностью, 100% экономией атомов и приводят к ранее неизвестным эфирам диселенофосфиновых кислот с редкими O,Se-, S,Se- и Se,Se-ацетальными функциями.
4. Показано, что результатом трехкомпонентной реакции между вторичными фосфинсульфидами, элементным селеном и виниловыми эфирами является образование S- и Se-эфиров тиоселенофосфиновых кислот, соотношение которых зависит от природы заместителей во вторичных фосфинсульфидах и в виниловых эфирах.
5. Открыта новая трехкомпонентная реакция между первичными фосфинами, элементными серой или селеном и основаниями (гидроксиды щелочных металлов и амины), хемоселективно приводящая к солями тритио- и триселенофосфоновых кислот с высокими выходами.
6. Предложена новая общая методология синтеза солей диселенофосфиновых кислот, основанная на трехкомпонентной реакции с участием вторичных фосфинов или их селенидов, элементного селена и различных оснований (гидроксиды щелочных и щелочноземельных металлов, аммиак и гидразин, простейшие амины и природные алкалоиды).
7. Разработана принципиально новая общая стратегия синтеза солей тиоселенофосфиновых кислот, основанная на оригинальных многокомпонентных реакциях с участием вторичных фосфинов, элементных серы и селена, различных оснований (гидроксиды щелочных металлов, алифатические амины, алкалоиды).
8. Исследован синтетический потенциал синтезированных соединений в реакциях, направленных на развитие существующих и зарождение новых направлений химии фосфорорганических кислот и их производных, а именно:
- систематически изучена реакция диселенофосфинатов щелочных металлов с органилгалогенидами различной природы и на ее основе предложен общий эффективный путь к синтезу эфиров диселенофосфиновых кислот;
- осуществлено регио- и хемоселективное алкилирование органилгалогенидами амбидентных тиоселенофосфинат-анионов, приводящее к Se-эфирам тиоселенофосфиновых кислот;
- обнаружена редокс-реакция диселенофосфинатов с молекулярным иодом, неожиданно приводящая к моно- (R2P=Se)2Se и триселенидам (R2P=Se)2Se3;
- показано, что тиоселенофосфинат-анионы под действием молекулярного иода хемо- и региоселективно подвергаются Se-Se окислительному сочетанию, образуя соответствующие диселениды (R2P=S)2Se2;
- синтезированы и впервые охарактеризованы комплексы Ni(II), Sb(III), Bi(III) и Cr(III) с диселено- и тиоселенофосфинатными лигандами;
- показано, что взаимодействие гексафторфосфата меди(I) с диселенофосфинатом аммония в присутствии доноров H, Cl, Br или Se2- анионов приводит к самосборке новых восьмиядерных кластеров меди(I);
- диселенофосфинаты щелочных металлов впервые использованы для направленного синтеза нанобиокомпозитов элементного селена и арабиногалактана, проявляющих свойства квантовых точек.
Основные результаты работы изложены в следующих публикациях:
Монография
- Артемьев А.В., Гусарова Н.К., Малышева С.Ф. Трехкомпонентные реакции вторичных фосфинов с селеном и основаниями: новая стратегия синтеза диселенофосфинатов // LAP Lambert Academic Publishing, 2012. – 155 с. ISBN: 978-3-659-30562-7.
Обзор
- Artem’ev A.V., Gusarova N.K., Malysheva S.F., Trofimov B.A. Diselenophosphinates. Synthesis and applications // Org. Prep. Proced. Int. – 2011. – Vol. 43, № 5. – P. 381-449.
Статьи
- Гусарова Н.К., Иванова Н.И., Малышева С.Ф., Артемьев А.В., Тимохин Б.В., Трофимов Б.А. Первый пример алкилирования вторичных фосфинселенидов // ЖОХ. – 2008. – Т. 78, № 8. – С. 1393-1395.
- Малышева С.Ф., Артемьев А.В., Гусарова Н.К., Тимохин Б.В., Татаринова А.А., Трофимов Б.А. Синтез новых вторичных фосфинхалькогенидов с объемными заместителями из арил(гетарил)этенов, красного фосфора, серы и селена // ЖОХ. – 2009. – Т. 79, № 8. – С. 1259-1263.
- Трофимов Б.А., Артемьев А.В., Малышева С.Ф., Гусарова Н.К. Новый метод синтеза диселенофосфинатов // ДАН. – 2009. – Т. 428, № 3. – С. 338-341.
- Trofimov B.A., Gusarova N.K., Arbuzova S.N., Ivanova N.I., Artem’ev A.V., Volkov P.A., Ushakov I.A., Malysheva S.F., Kuimov V.A. Stereoselective free-radical addition of secondary phosphine selenides to aromatic acetylenes // J. Organomet. Chem. – 2009. – Vol. 694, № 5. – P. 677-682.
- Trofimov B.A., Artem’ev A.V., Malysheva S.F., Gusarova N.K. Reaction of secondary phosphine selenides with the system Se/MOH (M = Li, Na, K, Rb, Cs): A novel three-сomponent synthesis of diorganodiselenophosphinates // J. Organomet. Chem. – 2009. – Vol. 694, № 25. – P. 4116-4120.
- Trofimov B.A., Artem’ev A.V., Gusarova N.K., Malysheva S.F., Fedorov S.V., Kazheva O.N., Alexandrov G.G., Dyachenko O.A. One-pot reaction of secondary phosphine selenides with selenium and nitrogen bases: a novel synthesis of diorganodiselenophosphinates // Synthesis. – 2009. – № 19. – P. 3332-3338.
- Gusarova N.K., Artem’ev A.V., Malysheva S.F., Fedorov S.V., Kazheva O.N., Alexandrov G.G., Dyachenko O.A., Trofimov B.A. Diselenophosphinates of lupinine or anabasine via a new three-component reaction of secondary phosphines, elemental selenium and amines // Tetrahedron Lett. – 2010. – Vol. 51, № 14. – P. 1840-1843.
- Artem’ev A.V., Gusarova N.K., Malysheva S.F., Ushakov I.A., Trofimov B.A. A novel facile synthesis of bis(diorganoselenophosphoryl)selenides (R2PSe)2Se from secondary phosphines and elemental selenium // Tetrahedron Lett. – 2010. – Vol. 51, № 16. – P. 2141-2143.
- Artem’ev A.V., Malysheva S.F., Gusarova N.K., Belogorlova N.A., Trofimov B.A. Facile atom-economic synthesis of ammonium diselenophosphinates via three-component reaction of secondary phosphines, elemental selenium and ammonia // Synthesis. – 2010. – № 11. – P. 1777-1780.
- Artem’ev A.V., Malysheva S.F., Gusarova N.K., Trofimov B.A. Rapid and convenient one-pot method for the preparation of alkali metal phosphinodiselenoates // Synthesis. – 2010. – № 14. – P. 2463-2467.
- Artem’ev A.V., Gusarova N.K., Malysheva S.F., Kraikivskii P.B., Belogorlova N.A., Trofimov B.A. Efficient general synthesis of alkylammonium diselenophosphinates via multicomponent one-pot reaction of secondary phosphines with elemental selenium and amines // Synthesis. – 2010. – № 21. – P. 3724-3730.
- Gusarova N.K., Malysheva S.F., Artem’ev A.V., Belogorlova N.A., Albanov A.I., Trofimov B.A. Reaction of phosphine with allylbenzene in KOH-DMSO system: regioselective synthesis of (1-methyl-2-phenylethyl)phosphine and bis(1-methyl-2-phenylethyl)phosphine // Mendeleev Commun. – 2010. – Vol. 20, № 4. – P. 275-276.
- Artem’ev A.V., Gusarova N.K., Malysheva S.F., Mamatyuk V.I., Gatilov Yu.V., Ushakov I.A., Trofimov B.A. One-pot atom-economic synthesis of thioselenophosphinates via a new multi-component reaction of secondary phosphanes with elemental sulfur, selenium and amines // Eur. J. Org. Chem. – 2010. № 32. – P. 6157-6160.
- Артемьев А.В., Гусарова Н.К., Малышева С.Ф., Трофимов Б.А. Трехкомпонентная реакция вторичных фосфинов с элементным селеном и аминами // ЖОрХ. – 2010. – T. 46, № 4. – С. 599-600.
- Артемьев А.В., Гусарова Н.К., Малышева С.Ф., Трофимов Б.А. Селективный синтез диселенофосфинатов гидразиния из вторичных фосфинов, элементного селена и гидразина // Изв. АН. Сер. хим. 2010. – № 8. – С. 1626-1628.
- Малышева С.Ф., Артемьев А.В., Гусарова Н.К., Клыба Л.В., Татаринова А.А., Трофимов Б.А. Хлорирование вторичных фосфинселенидов системой CCl4/NEt3 // ЖОХ. – 2010. – Т. 80, № 5. – С. 873-874.
- Артемьев А.В., Гусарова Н.К., Малышева С.Ф., Татаринова А.А., Трофимов Б.А. Атом-экономный синтез диселенофосфинатов аммония из вторичных фосфинселенидов, элементного селена и аммиака // ЖОХ. – 2010. – T. 80, № 7. – С. 1217-1218.
- Малышева С.Ф., Гусарова Н.К., Белогорлова Н.А., Куимов В.А., Артемьев А.В., Тарасова Н.П., Сметанников Ю.В., Трофимов Б.А. Нанокомпозиты красного фосфора в реакции с 4-метоксистиролом // ЖОХ. – 2010. – T. 80, № 7. – С. 1214–1216.
- Артемьев А.В., Гусарова Н.К., Малышева С.Ф., Белогорлова Н.А., Альперт М.Л., Трофимов Б.А. Реакция вторичных фосфинов с элементной серой и гидразином: атом-экономный синтез дитиофосфинатов // ЖОХ. – 2010. – Т. 80, № 9. – С. 1571-1573.
- Артемьев А.В., Гусарова Н.К., Малышева С.Ф., Ушаков И.А., Трофимов Б.А. Реакция вторичных фосфинселенидов с элементным селеном: синтез бис(диорганоселенофосфорил)селенидов // ЖОХ. – 2010. – Т. 80, № 10. – С. 1743-1744.
- Gusarova N.K., Malysheva S.F., Belogorlova N.A., Artem’ev A.V., Kuimov V.A., Trofimov B.A. Reaction of red phosphorus with 4-methoxystyrene in KOH-DMSO system: one-pot synthesis of tris[2-(4-methoxyphenyl)ethyl]phosphane oxide // Phosphorus, Sulfur, and Silicon. – 2011. – Vol. 186, № 1. – P. 98-104.
- Malysheva S.F., Belogorlova N.A., Gusarova N.K., Artem’ev A.V., Albanov A.I., Trofimov B.A. Reaction of red phosphorus with allylbenzene in superbasic system KOH-DMSO // Phosphorus, Sulfur, and Silicon. – 2011. – Vol. 186, № 8. – P. 1688-1693.
- Artem’ev A.V., Chernysheva N.A., Gusarova N.K., Malysheva S.F., Yas’ko S.V., Albanov A.I., Trofimov B.A. An efficient and general synthesis of Se-esters of diselenophosphinic acids via reaction of alkali metal diselenophosphinates with organic halides // Synthesis. – 2011. – № 8. – P. 1309-1313.
- Artem’ev A.V., Gusarova N.K., Malysheva S.F., Mamatyuk V.I., Gatilov Y.V., Trofimov B.A. Reaction of primary phosphines with elemental sulfur and MOH (M = Na, K, Cs): a novel facile three-component synthesis of trithiophosphonates // Tetrahedron Lett. – 2011. – Vol. 52, № 3. – P. 398-400.
- Gusarova N.K., Artem’ev A.V., Malysheva S.F., Tarasova O.A., Trofimov B.A. A three-component reaction between alkenes, secondary phosphanes, and elemental selenium: a novel, efficient, atom-economic synthesis of diselenophosphinic esters // Tetrahedron Lett. – 2011. – Vol. 52, № 51. – P. 6985-6987.
- Малышева С.Ф., Белогорлова Н.А., Артемьев А.В., Гусарова Н.К., Трофимов Б.А. Синтез 1-метил-2-фенилэтил- и бис(1-метил-2-фенилэтил)фосфиновых кислот из красного фосфора и аллилбензола // ЖОХ. – 2011. – Т. 81, № 1. – С. 144-146.
- Артемьев А.В., Малышева С.Ф., Гусарова Н.К., Трофимов Б.А. Новый синтез диселенофосфинатов тяжелых металлов // ЖОХ. – 2011. – Т. 81, № 7. – С. 1100-1103.
- Artem’ev A.V., Malysheva S.F., Korocheva A.O., Gatilov Yu.V., Mamatyuk V.I., Gusarova N.K. Novel atom-economic synthesis of thioselenophosphinates via three-component reaction between secondary phosphine sulfides, elemental selenium, and amines // J. Sulfur Chem. – 2011. – Vol. 32, № 6. – P. 599-610.
- Артемьев А.В., Малышева С.Ф., Белогорлова Н.А., Гусарова Н.К. Синтез первых представителей диселенофосфинатов щелочноземельных металлов // Изв. АН. Сер. хим. – 2012. – № 2. – С. 453-455.
- Gusarova N.K., Artem’ev A.V., Oparina L.A., Kolyvanov N.A., Malysheva S.F., Vysotskaya O.V., Trofimov B.A. Three-component reaction between vinyl ethers, secondary phosphanes and elemental selenium: one-pot synthesis of 1-(alkoxy)- and 1-(aroxy)ethyl diselenophosphinates // Synthesis. – 2012. – № 3. – P. 431-438.
- Malysheva S.F., Gusarova N.K., Artem’ev A.V., Belogorlova N.A., Smirnov V.I., Shagun V.A., Kuimov V.A., Trofimov B.A. Superbase-assisted addition of phosphine to 1-methoxy-4-vinylbenzene: toward to rare family of organic phosphines // Synthetic Comm. – 2012. – Vol. 42, № 11. – P. 1685-1694.
- Artem’ev A.V., Malysheva S.F., Sukhov B.G., Belogorlova N.A., Gatilov Yu.V., Mamatyuk V.I., Gusarova N.K. Unexpected redox reaction of alkali metal diselenophosphinates with elemental iodine // Mendeleev Commun. – 2012. – Vol. 22, № 1. – P. 18-20.
- Artem’ev A.V., Gusarova N.K., Malysheva S.F., Gatilov Yu.V., Mamatyuk V.I. Efficient synthesis of lupininium, anabasinium and quininium thioselenophosphinates via a multi-component reaction between secondary phosphines, sulfur, selenium and alkaloids // Org. Prep. Proced. Int. – 2012. – Vol. 44, № 3. – P. 262-270.
- Артемьев А.В., Малышева С.Ф., Гусарова Н.К., Белогорлова Н.А., Федоров С.В., Тимохин Б.В., Смирнов В.И., Трофимов Б.А. Новые производные лупинина, анабазина и хинина с дитиофосфинатными группами // ХГС. – 2012. – № 3. – C. 478-482.
- Trofimov B.A., Artem’ev A.V., Malysheva S.F., Gusarova N.K., Belogorlova N.A., Korocheva A.O., Gatilov Yu.V., Mamatyuk V.I. Expedient one-pot organometallics-free synthesis of tris(2-pyridyl)phosphine from 2-bromopyridine and elemental phosphorus // Tetrahedron Lett. – 2012. – Vol. 53, № 19. – P. 2424-2427.
- Trofimov B.A., Gusarova N.K., Artem’ev A.V., Malysheva S.F., Belogorlova N.A., Korocheva A.O., Kazheva O.N., Alexandrov G.G., Dyachenko O.A. Tris(2-pyridyl)phosphine: a straightforward microwave-assisted synthesis from 2-bromopyridine and red phosphorus and coordination with cobalt(II) dichloride // Mendeleev Commun. – 2012. – Vol. 22, № 4. – P. 187-188.
- Trofimov B.A., Gusarova N.K., Artem’ev A.V., Malysheva S.F., Belogorlova N.A., Korocheva A.O. The reaction of 2-bromopyridine with PH3/H2 system in the KOH/DMSO suspension: a short route to tris(2-pyridyl)phosphine // Heteroatom Chem. – 2012. – Vol. 23, № 4. – P. 411-414.
- Artem’ev A.V., Malysheva S.F., Korocheva A.O., Bagryanskaya I.Yu. One-pot halogen-free synthesis of 2,3-dihydro-1H-inden-2-ylphosphinic acid from 1H-indene and elemental phosphorus via Trofimov-Gusarova reaction // Heteroatom Chem. – 2012. – Vol. 23, № 6. – P. 568-573.
- Artem’ev A.V., Gusarova N.K., Malysheva S.F., Kazheva O.N., Alexandrov G.G., Dyachenko O.A., Trofimov B.A. Synthesis and structural characterisation of the first europium(III) pyridylphosphine complex, [Eu(N,N,N-2-Py3P)(NO3)3] // Mendeleev Commun. – 2012. – Vol. 22, № 6. – P. 294-296.
- Liao P.-K., Shi D.-R., Liao J.-H., Liu C.W., Artem’ev A.V., Kuimov V.A., Gusarova N.K., Trofimov B.A. Facile self-assembly synthesis and characterization of diselenophosphinato octanuclear Cu(I) clusters inscribed in a twelve-vertex selenium polyhedron // Eur. J. Inorg. Chem. – 2012, № 30. – P. 4921-4929.
- Oparina L.A., Gusarova N.K., Vysotskaya O.V., Kolyvanov N.A., Artem’ev A.V., Trofimov B.A. Atom-economic, metal- and halogen-free synthesis of podands:,-diphosphines and their chalcogenides separated by alkane diol spacers // Synthesis. – 2012. – № 18. – P. 2938-2946.
- Малышева С.Ф., Куимов В.А., Артемьев А.В., Белогорлова Н.А., Албанов А.И., Гусарова Н.К., Трофимов Б.А. Синтез 1-метил-2-(метоксиарил)этилфосфонистых кислот из красного фосфора и аллилметоксибензолов // Изв. АН. Сер. хим. – 2012. – № 9. – С. 1771-1775.
- Малышева С.Ф., Артемьев А.В., Белогорлова Н.А., Корочева А.О., Гусарова Н.К., Трофимов Б.А. Первый пример образования Сsp2-P связи в реакции красного фосфора с гетарилгалогенидами // ЖОХ. – 2012. – Т. 82, № 7. – С. 1210-1211.
- Малышева С.Ф., Корочева А.О., Белогорлова Н.А., Артемьев А.В., Гусарова Н.К., Трофимов Б.А. Синтез трис(2-пиридил)фосфина из красного фосфора и 2-бромпиридина в суперосновной системе CsF-NaOH-ДМСО // ДАН. – 2012. – Т. 445, № 6. – С. 637-638.
- Artem’ev A.V., Gusarova N.K., Bagryanskaya I.Yu., Doronina E.P., Verkhoturova S.I., Sidorkin V.F., Trofimov B.A. Alkali metal thioselenophosphinates, M[SeSPR2]: one-pot multi-component synthesis, DFT study and synthetic application // Eur. J. Inorg. Chem. – 2013, № 3. – P. 415-426.
- Artem’ev A.V., Malysheva S.F., Belogorlova N.A., Gusarova N.K. Three-component reaction between elemental sulfur, primary phosphines and amines: straightforward synthesis of organylammonium trithiophosphonates // J. Sulfur Chem. – 2013. – Vol. 34. DOI: 10.1080/17415993.2012.735235.
- Artem’ev A.V., Chernysheva N.A., Gusarova N.K., Trofimov B.A. One-pot atom-economic synthesis of Se-[alkyl(aryl)sulfanylethyl]diselenophosphinates from vinyl sulfides, secondary phosphines and elemental selenium // J. Sulfur Chem. – 2013. – Vol. 34. DOI: 10.1080/17415993.2012.757615.
Тезисы докладов
- Артемьев А.В., Малышева С.Ф., Гусарова Н.К., Трофимов Б.А. Направленный синтез диселенофосфинатов на основе элементного фосфора: дизайн перспективных прекурсоров для полупроводниковых наноматериалов // Тезисы докладов XI Молодежной конференции по органической химии. – Екатеринбург, Россия. – 2008. – С. 15-17.
- Артемьев А.В., Малышева С.Ф., Гусарова Н.К., Трофимов Б.А. Трехкомпонентная реакция вторичных фосфинселенидов с элементным селеном и основаниями: новый путь к синтезу диселенофосфинатов // Тезисы докладов Всероссийской конференции «Итоги и перспективы химии элементоорганических соединений». – Москва, Россия. – 2009. – С. 192.
- Гусарова Н.К., Артемьев А.В., Малышева С.Ф., Трофимов Б.А. Новое в химии вторичных фосфинселенидов // Тезисы докладов Всероссийской конференции по органической химии, посвященной 75-летию со дня основания института органической химии им. Н.Д. Зелинского. – Москва, Россия. – 2009. – С. 94.
- Артемьев А.В., Малышева С.Ф., Гусарова Н.К., Трофимов Б.А. Трехкомпонентная атом-экономная реакция лупинина и анабазина с вторичными фосфинами и элементным селеном: синтез диселенофосфинатов // Тезисы докладов Всероссийской конференции «Актуальные проблемы органической химии». – Казань, Россия. – 2010. – С. 142.
- Артемьев А.В., Малышева С.Ф., Гусарова Н.К., Трофимов Б.А. Одностадийный синтез диселенофосфинатов тяжелых металлов из вторичных фосфинов, элементного селена, диэтиламина и солей Ni, Zn, Cd, Sn, Hg, Pb и Bi // Тезисы докладов Всероссийской конференции «Неорганические соединения и функциональные материалы». – Казань, Россия. – 2010. – С. 5.
- Артемьев А.В., Малышева С.Ф., Гусарова Н.К., Трофимов Б.А. Трехкомпонентная реакция вторичных фосфинов с элементной серой, селеном и гидратом гидразина: селективный синтез дихалькогенофосфинатов // Тезисы докладов IV Молодежной конференции института органической химии им. Н.Д. Зелинского. – Москва, Россия. – 2010. – С. 78-79.
- Артемьев А.В., Малышева С.Ф. Трехкомпонентная реакция между первичными фосфинами, элементной серой и гидроксидами щелочных металлов: новый эффективный синтез тритиофосфонатов // Тезисы докладов V Молодежной конференции института органической химии им. Н.Д. Зелинского – Москва, Россия. – 2012. – С. 73-74.
- Колыванов Н.А., Высоцкая О.В., Артемьев А.В. Однореакторный атом-экономный синтез (1-органилоксиэтил)диселенофосфинатов из виниловых эфиров, вторичных фосфинов и элементного селена // Тезисы докладов III Всероссийской молодежной школы-конференции «Химия под знаком сигма: исследования, инновации, технологии». – Омск, Россия. – 2012. – С. 399-400.
- Артемьев А.В., Корочева А.О., Малышева С.Ф. Прямое фосфорилирование 1Н-индена элементным фосфором в условиях реакции Трофимова-Гусаровой // Тезисы докладов Всероссийской молодежной научной конференции «Актуальные проблемы органической химии». – Москва, Россия. – 2012. – С. 46.
- Артемьев А.В., Малышева С.Ф., Корочева А.О., Белогорлова Н.А. Удобный однореакторный синтез трис(2-пиридил)фосфина по реакции Трофимова-Гусаровой // Тезисы докладов Второй Всероссийской научной конференции с международным участием «Успехи синтеза и комплексообразования». – Москва, Россия. – 2012. – С. 193.
- Куимов В.А., Малышева С.Ф., Артемьев А.В., Белогорлова Н.А., Корочева А.О. Прямое фосфорилирование аллилбензолов красным фосфором в условиях реакции Трофимова-Гусаровой // Тезисы докладов Второй Всероссийской научной конференции с международным участием «Успехи синтеза и комплексообразования». – Москва, Россия. – 2012. – С. 233.
- Артемьев А.В., Опарина Л.А., Чернышева Н.А., Колыванов Н.А., Высоцкая О.В., Гусарова Н.К., Трофимов Б.А. Трехкомпонентный синтез эфиров диселенофосфиновых кислот из вторичных фосфинов, алкенов и элементного селена // Тезисы докладов Всероссийской молодежной научной конференции «Актуальные проблемы органической химии». – Москва, Россия. – 2012. – С. 47.
[1] Совместно с группой профессора Чен-Вэй Лю (Университет Донг-Хуа, Тайвань)
[2] Совместно с к.х.н. Б.Г. Суховым, д.м.н. И.А. Шурыгиной и д.м.н. М.Г. Шурыгиным
[3] Совместно с сотрудниками СИФИБР СО РАН и к.х.н. Б.Г. Суховым

