Полианнелированные гетероциклические системы, содержащие тиенопиридиновый фрагмент: синтез, стереостроение и реакционная способность
На правах рукописи
Косулина Дарья Юрьевна
Полианнелированные гетероциклические системы, содержащие тиенопиридиновый фрагмент: синтез, стереостроение и реакционная способность
Специальность: 02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Краснодар – 2009
Работа выполнена в Кубанском государственном технологическом
университете
Научный руководитель: доктор химических наук, профессор
Крапивин Геннадий Дмитриевич
Официальные оппоненты: доктор химических наук, профессор
Кайгородова Елена Алексеевна
кандидат химических наук, доцент
Андреев Алексей Алексеевич
Ведущая организация: Научно-исследовательский институт
физической и органической химии
Южного федерального университета
Защита состоится « 22 » декабря 2009 г. в 14-40 часов на заседании диссертационного совета Д 212.100.01 Кубанского государственного технологического университета по адресу: г. Краснодар, ул. Красная, 135, КубГТУ, ауд. 94. (Адрес для переписки: 350072, г. Краснодар, ул. Московская, 2, КубГТУ)
С диссертацией можно ознакомиться в библиотеке Кубанского государственного технологического университета по адресу: 350072, г. Краснодар, ул. Московская, 2
Автореферат разослан «20» ноября 2009 г.
Ученый секретарь
диссертационного совета,
канд. хим. наук, доцент Кожина Н.Д.
Введение
Актуальность темы. Гетероциклические соединения, молекулы которых имеют в своем составе тиенопиридиновый фрагмент, вызывают большой интерес как известные биологически активные вещества, проявляющие в фармакологии кардиотоническую, нейротропную, фунгицидную, бактерицидную, антивирусную (в том числе, антиСПИДовую), противосудорожную и многие другие виды активности. На появление новых свойств производных тиенопиридина оказывает влияние его аннелирование с другими гетероциклами. До сих пор остается практически неизученной конденсированная система тиенопиридодиазепин-2-она и 2,5-диона, аналоги которой - 1,2-дигидро-3Н-1,4-бензодиазепин-2-оны – применяются как транквилизаторы, обладающие ярко выраженными анксиолитическими (успокаивающими), седативно-гипнотическими свойствами. 3-Аминотиено[2,3-b]пиридины так же интересны тем, что на их основе возможно создание полициклических систем с изоиндольным фрагментом, который встречается в природных алкалоидах, обладающих широким спектром биологического действия. Такого рода полиядерные конденсированные гетероциклические соединения являются потенциальными электролюминофорами и перспективны для использования в OLED технологиях при создании новых источников света. Получение новых полианнелированных гетероциклических соединений из доступных 2-замещенных 3-аминотиено[2,3-b]пиридинов за счет двух орто-расположенных нуклеофильных центров в каскадных реакциях с электрофильными реагентами изучено недостаточно, поэтому разработка новых подходов к их синтезу является актуальной задачей.
Диссертационная работа является составной частью НИР НИИ ХГС КубГТУ, проводимой по тематическому плану Министерства науки и образования РФ: ''Создание теории и разработка новых методов направленного синтеза О-, N-, S-содержащих полифункциональных соединений, перспективных для химии биологически активных веществ с избирательными свойствами", а также по теме кафедры органической химии КубГТУ 01.2007 09409 (Код ВНТИЦ 02 0302 2810302) «Химический дизайн новых конденсированных гетероциклических систем с целью создания потенциальных физиологически активных веществ с направленным биологическим действием».
Цель и задачи работы. Целью настоящей работы явилась разработка методов синтеза поликонденсированных соединений с частично или полностью ароматической системой на основе производных 3-аминотиено[2,3-b]пиридина, изучение их свойств и стереостроения.
Исходя из этого, были сформулированы следующие задачи:
- разработка методов синтеза линеарных и ангулярных орто-конденсированных пиридотиенопиримидоизоиндолонов, изучение их свойств и стереостроения;
- разработка методов синтеза новых производных диазепинона на основе тиено[2,3-b]пиридина;
- разработка последовательного синтеза производных пиридотиенопирролов через промежуточные гетарилметановые структуры с использованием реакции рециклизации фуранового цикла для аннелирования пиррольного кольца;
- установление структуры вновь полученных соединений спектральными методами и изучение их физико-химических характеристик;
- поиск среди синтезированных соединений веществ с полезными свойствами и определение пути их использования.
Научная новизна. Установлено, что изоиндоло[1',2':2,3] пиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидо[1,6-a]бензимидазол-6(10bH)-оны получаются в две стадии через образование ключевых ароматических аминокислот - 2-(5,6-дигидропиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидо[1,6-a]- бензимидазол-6-ил)бензойных кислот, тогда как дигидропиридо- [3'',2'':4',5']тиенопиримидо[2,1-a]изоиндолдионы образуются в одну стадию без выделения соответствующих промежуточных ароматических кислот. Установлено, что полученные бензойные кислоты легко подвергаются дегидрированию за счет пиримидинового цикла, что приводит к образованию полностью ароматической структуры.
Однозначно установлена линеарная структура 12b,13-дигидропиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидо[2,1-a]изоиндол-6,8-ди- онов и ангулярное строение 7,7a-дигидропиридо[3'',2'':4',5']тиено[2',3':5,6]- пиримидо[2,1-a]изоиндол-6,12-дионов.
Разработаны методики последовательного получения новых производных 1,3-дигидро-2H-пиридо[3',2':4,5]тиено[3,2-e][1,4]диазепин-2-онов и 3,4-дигидро-1H-пиридо[3',2':4,5]тиено[3,2-e][1,4]диазепин-2,5-дионов через промежуточные N-(2-бензоилтиено[2,3-b]пиридин-3-ил)-2-хлорацетамиды и 3-[(хлорацетил)амино]-N-замещенныхтиено[2,3-b]пиридин-2-карбокса- миды.
Предложена последовательная серия методик синтеза N-{4,6-дизамещенных-2-[(5-метил-2-фурил)(фенил)метил]тиено[2,3-b]пиридин-3-ил}амидов, являющихся ключевыми полупродуктами в реакции рециклизации фуранового цикла в пиррольный, в синтезе трициклической гетероароматической системы пирролотиенопиридина. Установлена способность N-{2-[(5-метил-2-фурил)(фенил)метил]тиено[2,3-b]пиридин-3-ил}ацет- амидов к рециклизации в целевые продукты - 4-(3-фенил-1Н-пирроло- [2',3':4,5]тиено[2,3-b]пиридин-2-ил)бутан-2-оны.
Практическая значимость. Получены ряды новых орто-конденсированных полициклических соединений - изоиндоло[1',2':2,3]пиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидо[1,6-a]бензимидазол-6(10bH)онов и дигидропиридо[3'',2'':4',5']тиенопиримидо[2,1-a]изоиндол- дионов, представляющих собой перспективные объекты для поиска биологически активных соединений.
Разработаны новые препаративные методы синтеза дигидропиридо[3',2':4,5]тиено[3,2-e][1,4]диазепин-2-онов и -2,5-дионов – аналогов биологически активных бензодиазепинонов.
Разработан синтетический путь получения ранее неизвестных (тиенопиридин-2-ил)(фенил)(5-метилфур-2-ил)метанов и осуществлена их рециклизация с образованием новых соединений - пирролотиенопиридинов.
Предложена новая жидкофазная трехкомпонентная каталитическая система для алкилирования фурановых соединений, позволяющая избежать осмоления и раскрытия фуранового кольца в условиях кислотного катализа.
Установлена высокая рострегулирующая активность синтезированных нами фурилгетарилметановых структур на рисе и некоторых амидов и пирролов тиенопиридиного ряда на семенах озимой пшеницы.
Апробация работы. Результаты диссертационной работы были представлены на IX Научной школе по органической химии (Звенигород, 2006 г), XVII Российской Молодежной научной конференции «Проблемы теоретической и экспериментальной химии» (Екатеринбург, 2007 г), IV Всероссийской научной конференции молодых ученых и студентов (Анапа, 2007 г), X Молодежной конференции по органической химии (Уфа, 2007 г), II Международной конференции "Фундаментальные и прикладные проблемы современной химии" (Астрахань, 2008 г), Всероссийской конференции "Карбонильные соединения в синтезе гетероциклов" (Саратов, 2008 г), Международной научно-практической конференции "Актуальные проблемы химической науки, практики и образования" (Курск, 2009 г), 1-ой Международной конференции "Новые направления в химии гетероциклических соединений" (Кисловодск, 2009 г).
Структура и объем диссертации. Диссертационная работа общим числом 123 страницы машинописного текста состоит из введения, обзора литературы, обсуждения результатов собственных исследований, экспериментальной части, практического применения, выводов и 6 приложений. Список литературы включает 160 наименований работ отечественных и зарубежных авторов.
Основное содержание работы
1 Синтез и свойства производных новой гетероциклической
системы – пиридо[3'',2'':4',5']тиено[2',3':5,6]пиримидо[2,1-a]
изоиндола
Несмотря на определенную изученность взаимодействия производных 3-аминотиено[2,3-b]пиридинов с карбонильными соединениями, эта реакция, по-прежнему, вызывает интерес как способ синтеза производных дигидропиримидинов, аннелированных с тиенопиридиновым кольцом. Весьма привлекательным является использование в этой реакции орто-формилбензойной (о-ФБК) кислоты, которая благодаря наличию в ее молекуле двух электрофильных групп с разной электрофильностью, представляет собой подходящий реагент для проведения каскадных циклизаций.
1.1 Синтез, свойства и стереостроение изоиндоло[1',2':2,3]пиридо
[3'',2'':4',5']тиено[3',2':4,5]пиримидо[1,6-a]бензимидазол-6
(10bH)онов
Для синтеза производных гептациклической системы – изоиндолопиридотиенопиримидобензимидазолона - нами использована последовательность двух реакций: взаимодействия 3-амино-2-бензимидазолитиенопиридинов 1 с орто-формилбензойной кислотой и замыкания изоиндольного кольца. Аннелирование дигидропиримидинового кольца и формирование промежуточных кислот 2 протекает при кипячении эквимольных количеств реагентов в толуоле (схема 1). Выходы 2-(2,4-дизамещенных-5,6-дигидропиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидо[1,6-a]бензимидазол-6-ил) бензойных кислот (2a-e) составляют 64 – 90 %.
Схема 1
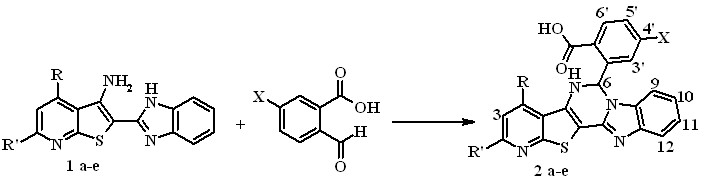
1,2a R = H, R' = CH3, X = H, b CH2OCH3, R' = CH3, X = H, c R = CH2OCH3, R' = CH3, X = I; d R = 2-фурил, R' = Ph, X = H, e R = п-C6H4CH3, R' = Ph, X = H.
Образующиеся бензойные кислоты 2а-е представляют собой ярко-желтые или оранжевые кристаллы. В ИК спектрах соединений 2а-е присутствуют характеристичные сигналы NH и С=О групп в областях 3394 – 3260 и 1684 – 1633 см-1, соответственно. В спектрах ЯМР 1Н соединений 2 имеются два однопротонных дублета, соответствующие резонансу протонов группировки CH-NH, в областях 5.9 - 6.1 и 7.5 - 7.7 м.д., соответственно. Уширенный синглет, отвечающий резонансу протона карбоксильной группы, находится в слабом поле при 10.17 - 14.6 м.д.
В масс-спектрах кислот 2а-е присутствуют пики молекулярных ионов слабой интенсивности (0.3 – 14 %). Наличие интенсивного пика [M-2] (до 70%) свидетельствует о легкости отщепления молекулы водорода, что приводит к более устойчивым структурам с ароматическим -электронным контуром.
Легкость дегидрирования СН-NH-группировки проявляется и при обычном нагревании соединений 2а-е до высоких температур, например, в ДМСО или ДМФА. Оказалось, что для дегидрирования кислот 2b,d достаточно ее кратковременного кипячения в ДМФА. Ароматические кислоты также 3b,d получены: а) при пропускании воздуха через кипящий раствор соединений 2b,d в ДМФА и б) в результате кратковременного нагревания в смеси муравьиная кислота – 30 % -ная Н2О2.
Кислоты 3b,d бесцветны, имеют более высокие температуры плавления и лучше растворяются в органических растворителях, чем вещества 2.
Схема 2
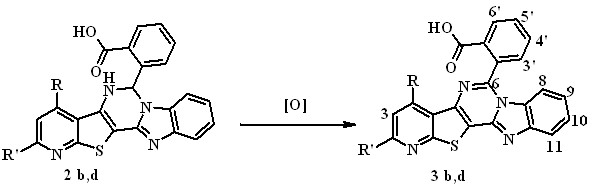
2,3 b R = CH2OCH3, R' = CH3, d R = 2-фурил, R' = Ph
В результате окислительного дегидрирования две сопряженные 10-электронные системы тиенопиридина и бензимидазола легко образуют единую 22-электронную гетероароматическую систему пиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидино[1,6-a]бензимидазолов, что проявляется в смещении сигналов ароматических протонов кора в слабое поле по сравнению со спектрами ЯМР 1Н исходных веществ и исчезновению полос NH-групп в ИК-спектрах.
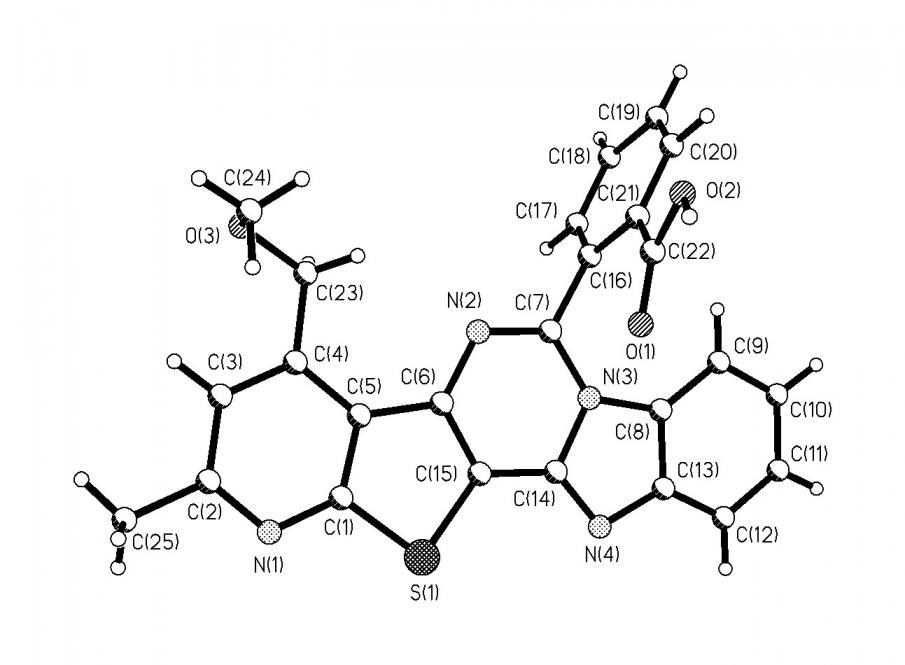
Рисунок 1 – Проекция пространственной модели молекулы 3b
По данным РСА гетероароматический кор молекулы 3b практически плоский (рис. 1). Фенильный заместитель повернут к гетероароматическому остову на 86.5, что практически исключает взаимодействие его -электронов с 22-электронной ароматической системой гетероцикла.
Внутримолекулярная дегидратация, приводящая к гептациклической системе 4a-c (выход 40 – 70 %), происходит при нагревании кислот 2a-с в ПФК при 110-120 C в течение 2-4 часов (схема 4).
Схема 4
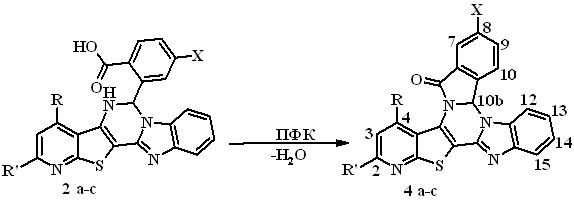
2,4 a R = H, R' = CH3, X = H; b R = CH2OCH3, R' = CH3, X = H;
c R = CH2OCH3, R' = CH3, X = I
В ИК спектрах соединений 4a-c присутствуют характеристичные полосы поглощения валентных колебаний С=О группы в области 1728 – 1736 см-1. Сигнал метинового протона 10b в лактамном цикле смещается в аномально слабые для алифатических протонов поля – в область 7.4 - 7.5 м.д., тогда как у исходных веществ 2 соответствующий метиновый протон резонирует в области 5.8 - 6.2 м.д.
Согласно данным РСА молекула 4c имеет "двускладчатую" структуру (рис. 2): две линии перегиба - по оси атомов азота N(3)…N(4) дигидропиримидинового кольца и общей связи пиримидинового и изоиндольного фрагментов N(4)-C(9). Центральный гидропиримидиновый цикл имеет конформацию слегка искаженной софы (полукресла). Метиновый атом углерода С(9) выходит из плоскости основания софы на 0.5396 и вместе с атомами N(3) и N(4) образует плоскость "спинки" софы.
Угол между этими плоскостями равен 141.9о (первая складка). Плоский изоиндольный фрагмент располагается под углом 116.7о к плоскости "спинки" софы (вторая складка). В результате метиновый sp3-гибридизованный атом углерода 10b практически не имеет каких-либо напряжений по валентным углам.
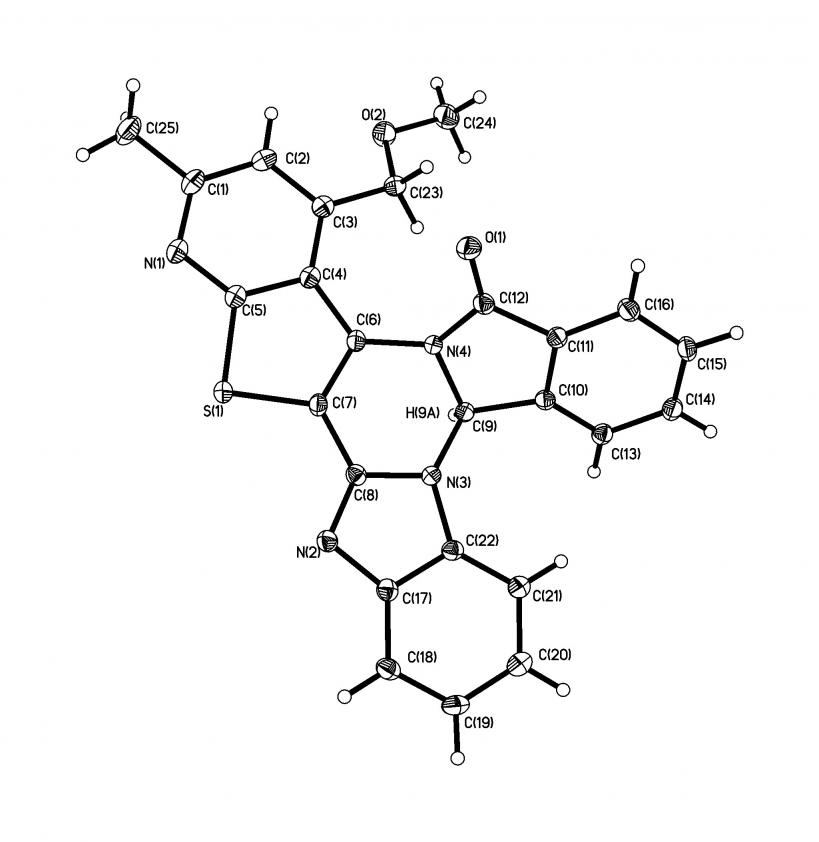
Рисунок 2 – Проекция пространственной модели молекулы 4с
1.2 Синтез, ствойства и стереостроение 7,7a-дигидропиридо[3'',2'':
4',5']тиено[2',3':5,6]пиримидо[2,1-a]изоиндол-6,12-дионов
Аминоамиды 5 – аналоги 3-аминобензимидазолилпроизводных 1 - в реакции с формилбензойной кислотой могут, в принципе, давать продукты линеарного или ангулярного строения. Собственно реакция о-ФБК с аминоамидами 5 протекает несколько иначе, чем с соединениями 1. В большинстве случаях две последовательные циклизации происходят в режиме one-pot, так что даже выделять кислоты 6 не всегда удается.
Первичные амиды 5а-е в результате реакции образуют исключительно продукты линеарной циклизации 7а-е.
N-Фурфурил 5f и N-бензил и этилфенилпроиводные 5k,l в ходе реакции теряют заместитель у амидного азота, но образуют разные продукты: соединение 5f даёт продукт линеарной циклизации 7f, а соединения 5k,l продукты ангулярного строения 11. Очевидно, в случае фурфурилпроизводного 5f "потеря" заместителя происходит до замыкания второго гетероцикла, а в случае бензилпроизводных – уже после завершения каскада гетероциклизаций.
Схема 5
5-7, 10, 11а R = H, R' = R''' = CH3, R'' = H, X = H; b R = H, R' = CH2OCH3, R'' = H, R''' = CH3, X = H; c R = H, R' = CH2OCH3, R'' = H, R''' = CH3, X = I; d R = H, R' = R''' = Ph, R'' = H, X = H; e R = H, R' = 5-метилфурил-2, R'' = H, R''' = Ph, X = H, f R = 5-метилфурил-2, R' = CH2OCH3, R'' = Br, R''' = CH3, X = H; g R = п-С6Н4I, R' = R''' = CH3, R'' = H; h R = п-С6Н4I, R'=CH2OCH3, R'' = H, R''' = CH3, i R = С6Н5, R' = CH2OCH3, R'' = H, R''' = CH3, j R = п-С6Н4CH2CH3, R' = CH2OCH3, R'' = H, R''' = CH3, Х = Н; k R = CH2C6H5, R' = CH2OCH3, R'' = Br, R''' = CH3, X = H; l R = п-C6H4CH2CH3, R' = 5-метилфурил-2, R'' = H, R''' = Ph, X = H
Другие вторичные N-алкил и N-ариламиды 5g-j дают ожидаемые продукты ангулярной циклизации 10. Соединения линеарного строения 7 окрашены в ярко-желтый цвет, в то время как все ангулярные соединения 10, 11 бесцветны.
Соединения 5 имеют в спектрах ЯМР 1Н характеристичный сигнал NH аминогруппы в области 6.9 – 7.1 м.д., в то время как сигнал NH амидного протона у продуктов 7 и 11 находится в области 8.1 – 9.5 м.д.
Линеарное и ангулярное строения соединений 7 и 10 подтверждено данными РСА (рис. 3, 4).
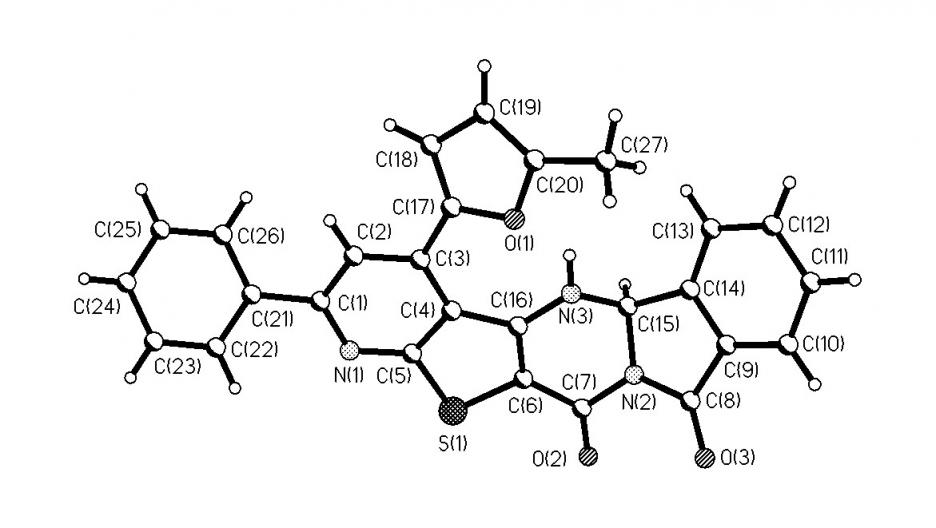
Рисунок 3 - Проекция пространственной модели молекулы 7е
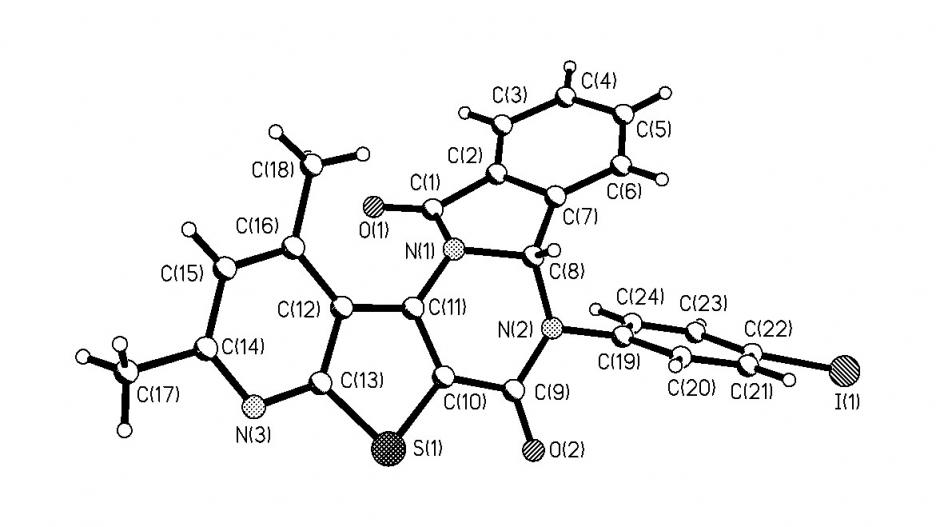
Рисунок 4 - Проекция пространственной модели молекулы 10а
Пентациклические соединения 7 и 10 имеют такую же "двускладчатую" структуру, как и гептациклические структуры 4, немного отличающиеся величиной углов "складок". В кристалле соединения 10а фенильный заместитель располагается практически перпендикулярно плоскости "основания софы". В растворах при комнатной температуре согласно ЯМР 1Н (отнесение сигналов в спектрах сделано с помощью COSY и NОЕSY техники эксперимента) наблюдается только осцилляция фенильного заместителя относительно перпендикулярного положения и только с повышением температуры начинается его относительно свободное вращение.
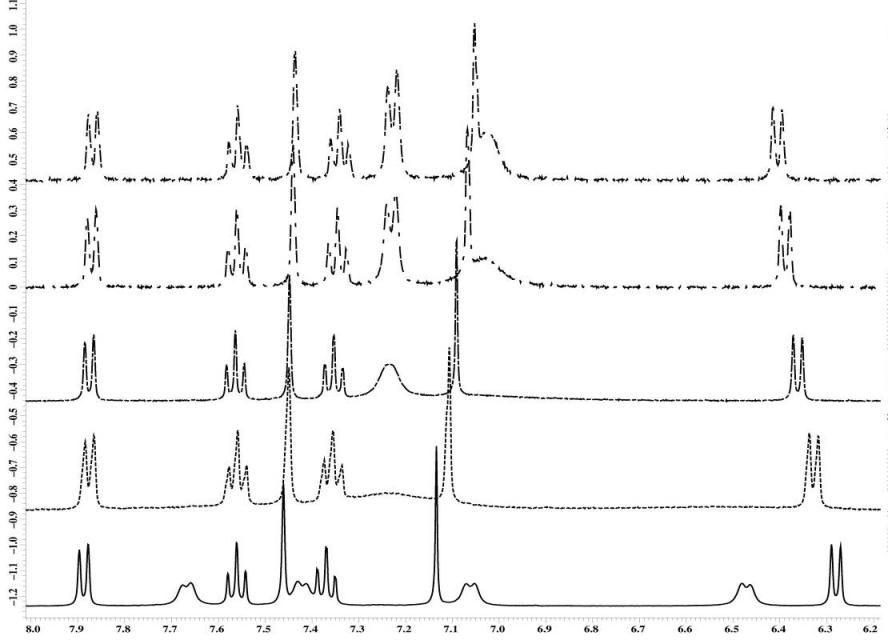
Рисунок 5 – Эволюция спектра ЯМР 1Н соединения 10d при изменении
температуры от 25 до 170 С
По эволюции сигналов протонов фенильного фрагмента определены константы скорости вращения п-этилфенильного заместителя (рис. 5) и рассчитаны термодинамические параметры активационного барьера G = 65.8 ± 5 кДж/ моль, H24.3 = 62,0 ± 5 кДж/моль, S = -16.3 ± 5 Дж/моль*К.
Только в нескольких случаях ярко-окрашенные промежуточные продукты 6i,k,l удалось выделить из реакционной смеси. В ЯМР 1Н спектрах которых присутствуют сигналы протонов CH – NH группы в области 6.5 – 7.2 и 7.5 – 7.7 м.д. соответственно. Более того, наличие хирального центра в молекуле соединения 6k приводит к диастереотопности протонов прохиральной –СН2ОСН3 группы, в результате чего протон 6' метиленовой группы резонируют в виде пары дублетов с геминальной константой 2J = 14 Гц.
2 Синтез и свойства производных тиенопиридодиазепин-2-онов
и 2,5-дионов
Задачей данной части исследования явилась разработка способов синтеза новых производных 1,4-диазепина, которые перспективны в поиске биологически активных соединений. Получение тиенопиридодиазепин-2-онов 14 и 2,5-дионов 16 проводится в две стадии (схема 6). Первая стадия – ацилирование 3-аминотиенопиридинов 12а-i хлорацетилхлоридом до соответствующих амидокетонов 13a-d (выходы 54 – 74 %) или диамидов 13e-i (выходы 76 – 88 %).
Схема 6
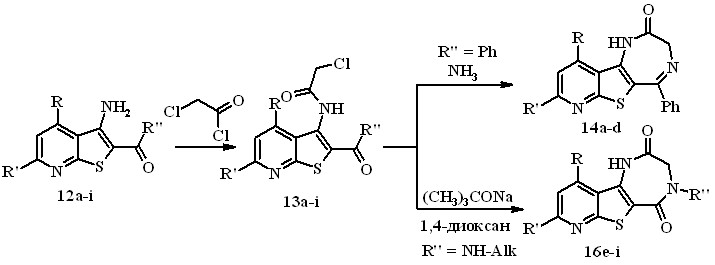
12 – 14, 16 а R = R' = CH3, R'' = Ph; b R = CH2OCH3, R' = CH3, R'' = Ph; c R = R' = R'' = Ph, d R = 2-фурил, R' = Ph, R'' = Ph; e R = H, R' = CH3, R'' = NHCH2CH2C6H3(OC2H5)2, f R = H, R' = CH3, R'' = NHCH2CH2C6H5; h R =CH2OCH3,R' = CH3, R'' = NHCH2C6H5, i R = CH2OCH3, R' = CH3, R'' = NHCH2CH2C6H3(OC2H5)2
Хлорацетамиды 13 представляют собой бесцветные вещества, в ЯМР 1Н спектрах которых имеются характеристичные сигналы протонов метиленового звена хлорацетильной группы в области 3.1-3.8 м.д. (соединения 13а-d) и 4.3 – 4.8 м.д. (соединения 13е-i), однопротонный синглет резонанса амидного протона в слабом поле – 9.6-10.3 м.д. (13а-d) и сигналы двух NH групп у соединений 13 e-i в областях 7.6 – 8.6 м.д. и 10.2 – 10.7 м.д.
Масс-спектры соединений 13а-i имеют достаточно интенсивные кластеры молекулярных ионов с типичным для хлорпроизводных дублетом М и М+2 с соотношением интенсивностей пиков ~ 3 : 1.
Условия замыкания диазепинового цикла, естественно, зависят от характера заместителя R''. Так, нагревание раствора амидокетонов 13а-d в ДМФА в токе аммиака в течение 4-5 часов приводит к соответствующим диазепинам 14а-d, которые представляют собой желтые кристаллы (выход 40 – 75%).
В случае диамидов 13 e-i гетероциклизация происходит только под действием такого сильного основания как трет-бутилат натрия (эквимольные количества) при кипячении в диоксане в течение 3 – 5 часов. Диазепины 16e-i, в отличие от 14 а-d, представляют собой бесцветные кристаллические вещества (выход 75 – 89 %).
В спектрах ЯМР 1Н соединений 14 и 16 присутствуют сигнал протонов метиленового звена с химическим сдвигом при 4.6 – 5.0 м.д. Масс-спектры диазепиндионов 16 не всегда имеют пик молекулярного иона, особенно спектры соединений с арилэтильными заместителями R" у атома азота 4-N. В тех случаях, когда молекулярный ион имеется (соединения 16f,g), характеристичным является процесс [M - H]+, при этом образующиеся катионы имеют максимальную интенсивность в спектрах.
3 Синтез производных (3-аминотиено[2,3-b]пиридин-2-ил)(фе-
нил)(5-метил-2-фурил)метана
Производные 3-амино-2-бензоилтиено[2,3-b]пиридина 12 являются удобными исходными соединениями для получения неописанной ранее гетероциклической системы – пиридотиенопиррола, для синтеза которой использована последовательность реакций: защиты аминогруппы, восстановления карбонильной группы до спиртовой и замещение ОН группы на фурановый цикл (схема 7).
Фурилгетарилметаны 19а-n получены (выходы 65 - 95%) алкилированием 2-метилфурана спиртами 18а-n при кипячении эквимолярных количеств реагентов в абсолютном диоксане (3-12 ч) в присутствии специально подобранного катализатора, представляющего собой смесь 70 %-ной хлорной кислоты, уксусного ангидрида и ледяной уксусной кислоты (0,056 : 0,033 : 0,052 моль).
В спектрах ЯМР 1Н соединений 19 присутствуют сигналы двух -протонов фуранового кольца в виде двух дублетов в области 6.0-6.1 м. д. и синглетный сигнал протонов метильной группы в положении 5 фуранового кольца.
Схема 7
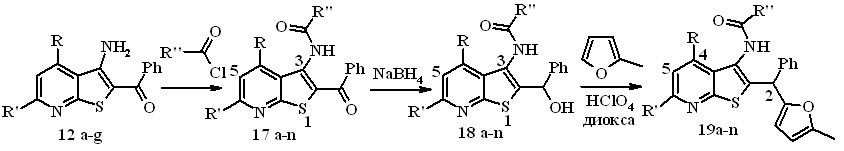 12 a R = R' = CH3; b R = CH2OCH3, R' = CH3; c R = R' = Ph, d R = 5-метилфурил-2, R' = Ph; e R = п-C6H4Br, R' = Ph; f R = CH3, R' = H; g R = 2-фурил, R' = Ph; 17 – 19 a R = R' = CH3, R'' = Ph; b R = CH2OCH3, R' = CH3, R'' = Ph; c R = R' = R'' = Ph; d R = 5-метилфурил-2, R' = Ph, R'' = Ph; e R = п-C6H4Br, R' = Ph, R'' = Ph; f R = CH3, R' = H, R'' = CH3; g R = R' = Ph, R'' = CH3; h R = 2-фурил, R' = Ph, R'' = CH3; i R = R' = R'' = CH3, j R = CH2OCH3, R' = R'' = CH3, k R = R' = CH3, R'' = (CH2)3CH3; l R = R' = CH3, R'' = 2-фурил; m R = CH2OCH3, R' = CH3, R'' = 2-фурил, n R = CH2OCH3, R' = CH3, R'' = 2-тиенил.
12 a R = R' = CH3; b R = CH2OCH3, R' = CH3; c R = R' = Ph, d R = 5-метилфурил-2, R' = Ph; e R = п-C6H4Br, R' = Ph; f R = CH3, R' = H; g R = 2-фурил, R' = Ph; 17 – 19 a R = R' = CH3, R'' = Ph; b R = CH2OCH3, R' = CH3, R'' = Ph; c R = R' = R'' = Ph; d R = 5-метилфурил-2, R' = Ph, R'' = Ph; e R = п-C6H4Br, R' = Ph, R'' = Ph; f R = CH3, R' = H, R'' = CH3; g R = R' = Ph, R'' = CH3; h R = 2-фурил, R' = Ph, R'' = CH3; i R = R' = R'' = CH3, j R = CH2OCH3, R' = R'' = CH3, k R = R' = CH3, R'' = (CH2)3CH3; l R = R' = CH3, R'' = 2-фурил; m R = CH2OCH3, R' = CH3, R'' = 2-фурил, n R = CH2OCH3, R' = CH3, R'' = 2-тиенил.
Метиновый протон у центрального sp3-гибридизованного атома углерода резонирует как синглет при = 5.8 - 6.0 м.д. Диастереотопные протоны метиленового звена группы CH2OCH3 соединений 19b,j,n,o также как и в спектрах соответствующих спиртов 18b,j,n,o, резонируют как пара однопротонных дублетов с 2J = 14.0 Гц.
Молекулярные ионы метанов 19 малоинтенсивны. Типичная последовательность реакций фрагментации молекулярного иона (или иона [M – CH3OH]+) – отщепление радикала R''CO и последующая перегруппировка с экструзией молекулы кетена. Отметим присутствие во всех масс-спектрах этого ряда соединений пика характеристического (фенил)(5-метил-2-фурил)метильного катиона с m/z 171.
3.1 Превращения (3-аминотиено[2,3-b]пиридин-2-ил)(фенил)(5-
метил-2-фурил) метанов в кислой среде
Исследование поведения фурилметанов 19 в кислой среде (уксусная кислота с добавлением соляной кислоты или этанол, насыщенный сухим HCl) показало, что характер протекающих превращений зависит от типа ацильной защиты у атома азота и, в ряде случаев, от типа заместителя в положении 4 пиридинового кольца.
Нами обнаружено, что длительное кипячение (до 8 ч) соединений 19b-d,k,n,m, имеющих ароильную (бензоильную, фуроильную и тиенилкарбонильную) и бутаноильную защиту, приводит только к продуктам гидролитического раскрытия фуранового кольца 20b-d,k,m,n, без образования целевой системы пиридотиенопиррола 22 (схема 8). В ходе реакции устанавливается равновесие между исходными фуроилметанами 19 и дикетонами 20 (2 : 3), что видно по данным ТСХ и ЯМР 1Н. Причем равновесие достигается в уксусной кислоте заметно быстрее, чем в этаноле.
Дикетоны 20 представляют собой бесцветные кристаллические вещества. В спектрах ЯМР 1Н имеются два триплетных сигнала метиленовых протонов в области 2.6-2.9 м.д. и синглетный сигнал протонов ацетильной группы при 2.0-2.1 м.д. Формально диастереотопные протоны метиленового звена метоксиметильной группы соединений 20b,m,n резонируют как гомотопные сигналом в виде синглета при 4.74-4.76 м.д. Возможно, это следствие быстропротекающей инверсии асимметрического центра в результате кето-енольной таутомерии с участием атома водорода метинового звена и соседней с ним карбонильной группы.
В отличие от соединений 19b-d,m,n, содержащих ароильную защитную группу, ацетиламинопроизводное 19i в кислой среде гладко превращается в целевой продукт - производное пирролотиенопиридина 22i, причем трансформации сопровождаются снятием ацетильной защитной группы (схема 8).
Отметим, что превращение 19i 22i происходит в этаноле, насыщенным сухим НСl, за более короткое время и с более высоким выходом, чем в смеси уксусной и соляной кислот. Рециклизация фуранового кольца и формирование пирролотиенопиридина 22j протекает уже на стадии синтеза соответствующего фурилметана 19j.
При алкилировании сильвана спиртом 18j в диоксане в присутствии HClO4 наблюдается накопление соединения 19j, которое по мере образования сразу же превращается в продукт рециклизации – соединение 22j. В связи с этим выделить фурилметан 19j из реакционной смеси не удалось.
Схема 8
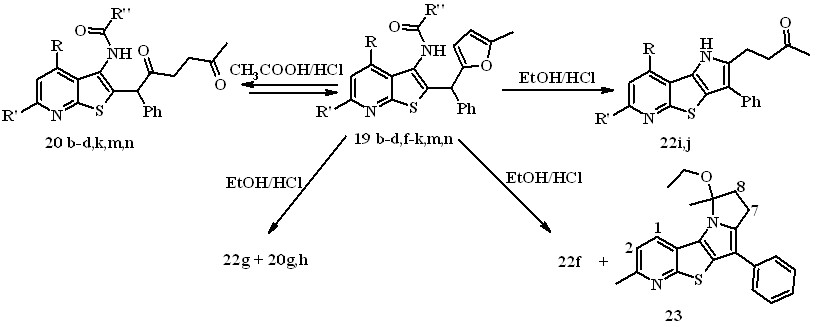 20 b R = CH2OCH3, R' = CH3, R'' = Ph; c R = R' = R'' = Ph; d R = 5-метилфурил-2, R' = Ph, R'' = Ph; g R = R' = Ph, R'' = CH3; h R = 2-фурил, R' = Ph, R'' = CH3; k R = R' = CH3, R'' = (CH2)3CH3; m R = CH2OCH3, R' = CH3, R'' = 2-фурил, n R = CH2OCH3, R' = CH3, R'' = 2-тиенил; 22 g R = 2-фурил, R' = Ph; f R = CH3, R' = H; i R = R' = CH3, j R = CH2OCH3, R' = CH3.
20 b R = CH2OCH3, R' = CH3, R'' = Ph; c R = R' = R'' = Ph; d R = 5-метилфурил-2, R' = Ph, R'' = Ph; g R = R' = Ph, R'' = CH3; h R = 2-фурил, R' = Ph, R'' = CH3; k R = R' = CH3, R'' = (CH2)3CH3; m R = CH2OCH3, R' = CH3, R'' = 2-фурил, n R = CH2OCH3, R' = CH3, R'' = 2-тиенил; 22 g R = 2-фурил, R' = Ph; f R = CH3, R' = H; i R = R' = CH3, j R = CH2OCH3, R' = CH3.
В отличие от рассмотренных выше тиенопиридинов 19i,j, соединение 19g, содержащее в положении 4 пиридинового кольца фенильный заместитель, в ходе реакции дает смесь двух продуктов: пирролотиенопиридина 22g и продукта протолитического раскрытия фуранового кольца - дикетона 20g, а метан 19h с фурильным заместителем в пиридиновом цикле превращается только в соответствующий дикетон 20h (схема 8).
Пирролотиенопиридины 22 – бледно-желтые кристаллические вещества. Метиленовые протоны 3-оксобутильного заместителя резонируют в виде двух триплетов с химическим сдвигом = 2.9 - 3.1 м.д., а протоны концевой метильной группы – в виде синглета c = 2.1 м.д. Пиррольный протон группы NH резонирует в слабом поле (11.3 - 11.5 м.д.).
Молекулярные ионы соединений 22 достаточно устойчивы. Характерный процесс их фрагментации – простой разрыв -углерод-углеродной связи в 3-оксобутильном заместителе, который приводит к катиону "бензильного" типа [M – 57]+.
Весьма необычным оказалось поведение в кислой среде 4 незамещенного 2-фурфурилтиено[2,3-b]пиридина 19f. В этом случае из реакционной смеси методом колоночной хроматографии удалось выделить два вещества, одним из которых по совокупности спектральных данных является ожидаемое соединение 22f, а вторым – 9-этокси-3,9-диметил-6-фенил-8,9-дигидро-7H-пиридо[3',2': 4,5]тиено[2,3-b]пирролизин (23) (схема 8).
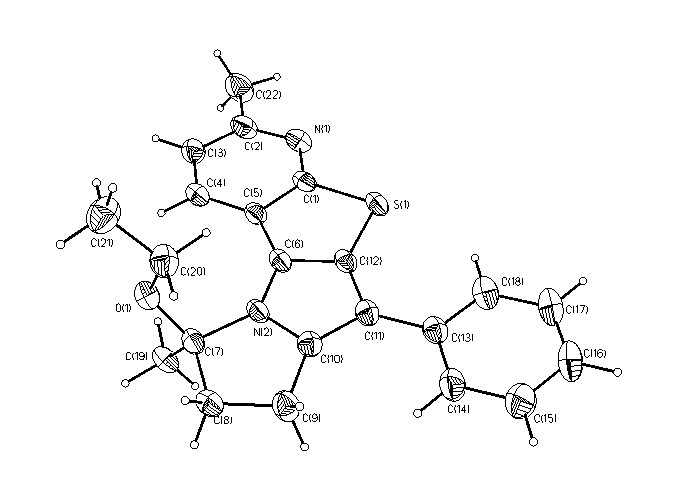
Рисунок 6 - Проекция пространственной модели молекулы 23
На наш взгляд, соединение 23 образуется как продукт параллельной реакции внутримолекулярной циклизации с участием карбонильной группы, атома азота пиррольного фрагмента и молекулы спирта. Образующийся на первой стадии гетероциклический аналог полуаминаля далее взаимодействует с молекулой спирта.
В ЯМР спектре соединения 23 имеются сигналы, соответствующие атомам водорода этоксигруппы: триплет протонов СН3 группы, с химическим сдвигом = 1.05 м.д. и квартет метиленового звена = 3.35 м.д. с вицинальной КССВ 3J = 6.6 Гц.
Структура 23 однозначно доказана методом РСА (рис. 6).
Тетрациклический кор молекулы плоский (среднее отклонение атомов от плоскости не превышает 0.0430 ), причем все атомы неароматического пирролидинового кольца принадлежат этой плоскости. Более того, фенильный заместитель рактически "лежит" в плоскости кора – угол между их плоскостями составляет только 5.7.
Таким образом, рассмотренные в данном разделе превращения фурилметанов тиено[2,3-b]пиридинового ряда 19 в кислой среде свидетельствуют о том, что тип ацильной защиты аминогруппы определяет возможность протекания циклизации, следующей за протолитическим раскрытием фуранового кольца. В данном случае проявляется различие в основности бензоил- и ацетиламидов, а так же в легкости снятия защиты с аминогруппы (ацетильная защита снимается, бензоильная нет), что в итоге приводит к разному результату реакций.
3.2 Необычная трансформация N-[2-(2,5-диоксо-1-фенилгексил)
тиено[2,3-b]пиридин-3-ил]амидов в щелочной среде
Известно, что 1,4-дикетоны являются удобными исходными реагентами для синтеза производных циклопентенонов. Предполагалось, что в щелочной среде соединения 20 b,с дадут производные циклопентенона 24 (схема 9).
Схема 9
 20, 25 b R = CH2OCH3, R' = CH3; c R = R' = Ph
20, 25 b R = CH2OCH3, R' = CH3; c R = R' = Ph
Однако вместо ожидаемых соединений 24 получены вещества, которые по данным элементного анализа, ЯМР 1Н и масс-спектров являются 2-бензилтиенопиридинами 25 b,c (схема 9). Превращение 20 25 в щелочной среде, видимо, протекает как своеобразное "кислотное" расщепление по связи метиновый центр – карбонильная группа. Такого рода 2-бензилтиенопиридины практически невозможно получить из соответствующих 2-S-алкил-3-цианопиридинов по реакции Торпа-Циглера.
3.4. Исследование рострегулирующей активности
Исследование рост регулирующей активности на семенах пшеницы и рисе позволило выявить ряд соединений перспективных для дальнейших полевых испытаний в качестве стимуляторов роста растений: таковыми оказались спирты 18f,m, метаны 19b,d,l,m,n, дикетон 20m и пирролотиенопиридин 22f.
Выводы
1. Предложены новые подходы к синтезу многоядерных конденсированных гетероциклических систем – изоиндолопиридотиено-пиримидобензимидазола и родственных пиридотиенопиримидоизоиндолов, пиридотиенодиазепин-2-онов и 2,5-дионов, пирролотиенопиридинов, исходя из доступных производных 3-амино-2-ацил(аминокарбонил, бензимидазолил)тиенопиридинов.
2. Показано, что переход от 3-амино-2-бензимидазолилтиенопири- динов к изоиндоло[1',2':2,3]пиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидо[1,6-a]бензимидазол-6(10bH)-онам требует выделения промежуточных 2-(5,6-дигидропиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидо[1,6-a]бензимидазол-6-ил)бензойных кислот, которые циклизуются в целевые продукты в полифосфорной кислоте. Установлено, что промежуточные дигидропиримидилбензойные кислоты исключительно легко окисляются в 2-(пиридо[3'',2'':4',5']тиено[3',2':4,5]пиримидино[1,6-a]бензимидазол-6-ил)бе-нзойные кислоты с 22-электронным гетероароматическим контуром.
3. Установлено, что 3-амино-2-аминокарбонилтиенопиридины реагируют с орто-формилбензойной кислотой в одну стадию - как каскад последовательных гетероциклизаций без выделения промежуточных 2-гетарилзамещенных бензойных кислот. Доказано, что N-незамещенные и N-фурфуриламиды образуют линеарные структуры - 12b,13-дигидропиридо[3'',2'':4',5']тиено-[3',2':4,5]пиримидо[2,1-a]изоиндол-6,8-дионы, а N-арилзамещенные аминоамиды - ангулярные структуры - 7,7a-дигидропиридо[3'',2'':4',5']тиено-[2',3':5,6]пиримидо[2,1-a]изоиндол-6,12-дионы.
4. Предложены два подхода к синтезу пиридотиенодиазепинонов из 3-амино-2-бензоил- и 2-аминокарбонилтиенопиридинов через соответствующие 3-хлорацетиламинотиенопиридины, что позволяет замыкать диазепиновый цикл в относительно мягких условиях и с высоким выходом.
5. Разработан подход к синтезу новой гетероциклической системы – пирроло[2',3':4,5]тиено[2,3-b]пиридину - из 3-амино-2-бензоилтиенопири-динов в результате последовательности реакций введения ацильной защиты аминогруппы, восстановления кетонной группы, алкилирования полученными спиртами 2-метилфурана и рециклизации фуранового цикла в пиррольный с одновременным снятием ацетильной защиты. Для стадии алкилирования предложена новая жидкофазная трехкомпонентная каталитическая система, позволяющая свести к минимуму процессы осмоления и раскрытия фуранового кольца.
6. Среди синтезированных соединений найдены вещества, улучшающие посевные качества семян озимой пшеницы и риса.
Основные результаты исследований отражены в работах:
1. Косулина Д.Ю., Василин В.К., Строганова Т.А., Сбитнева Е.А., Бутин А.В., Крапивин Г.Д. Фенилфурилтиено[2,3-b]пиридинилметаны: синтез и реакции трансформации фуранового цикла / Химия гетероциклических соединений, 2009. - № 9. – С. 1480 - 1494.
2. Косулина Д.Ю., Василин В.К., Милич Е.А., Сбитнева Е.А., Крапивин Г. Д Синтез поликонденсированных гетероциклических систем на основе бензимидазолилтиенопиридинов // IX Научная школа по органической химии, Звенигород: Тез. докл. – М., 2006. – С. 211.
3. Косулина Д.Ю., Василин В.К., Гнездилов Е.Ю., Крапивин Г. Д. Некоторые особенности реакции производных тиено[2,3-b]пиридина с формилбензойными кислотами // Материалы Всероссийской конференции "Карбонильные соединения в синтезе гетероциклов". – Саратов: "Науч.Книга", 2008. – С.143 – 145.
4. Косулина Д.Ю., Василин В.К., Крапивин Г.Д. Исследование реакции аминотиено[2,3-b]пиридинов с формилбензойными кислотами // X молодежная конференция по органической химии: Тез. докл. – Уфа, 2007. – С.59.
5. Косулина Д.Ю., Василин В.К., Крапивин Г.Д. Синтез и изучение стереостроения 12b,13-дигидропиридо [3'',2'':4',5'] тиено [3',2':4,5]пиримидо [2,1-a]изоиндол-6,8-дионов // "Актуальные проблемы химической науки, практики и образования": Тез. докл. Международной научно-практической конференции. – Курск, 2009. – С. 65
6. Крапивин Г.Д., Василин В.К., Косулина Д.Ю. Молекулярная и кристаллическая структура 1,3-диметил-7-фенил-7,7А-дигидропиридо [3'',2'':4'',5'']тиено[2',3':5,6]пиримидо[2,1-а]изоиндол–6,12-диона // Материалы Всероссийской конференции "Карбонильные соединения в синтезе гетероциклов". – Саратов: "Науч.Книга", 2008. – С.151 – 153.
7. Косулина Д.Ю., Василин В.К., Крапивин Г.Д. Синтез производных пиридотиенодиазепинов // Материалы 1-ой международной конференции "Новые направления в химии гетероциклических соединений". - Кисловодск, 2009. – С.117.
8. Косулина Д.Ю., Сбитнева Е.А., Василин В.К., Строганова Т.А. Крапивин Г. Д Синтез 2-фурилтиено[2,3-b]пиридинов // «Проблемы теоретической и экспериментальной химии»: Тез. докл. XVII Российской молодежной науч. конф. - Екатеринбург, 2007. - C. 261 – 262.
9. Косулина Д.Ю., Сбитнева Е.А., Крапивин Г.Д. Синтез и реакции метановых структур ряда тиено[2,3-b]пиридина // Сборник студенческих научных работ, отмеченных наградами на конкурсах. - Краснодар: Изд. КубГТУ.-Вып.8, 2007 – С. 43-44.
10. Косулина Д.Ю., Сбитнева Е.А., Крапивин Г.Д. Синтез и реакции 2-фурилтиено[2,3-b]пиридинов // «Современное состояние и приоритеты развития фундаментальных наук в регионах»: Труды IV Всероссийской науч. конф. молодых ученых и студентов, Анапа, 1- 4 октября 2007г. - Краснодар: "Просвещение-Юг", 2007. - Т.1. - С. 120 – 121.
11. Косулина Д.Ю., Василин В.К., Строганова Т.А., Крапивин Г.Д. 2-фурфурилтиено[2,3-b]пиридины:синтез и превращения под действием кислот // Фундаментальные и прикладные проблемы современной химии: Материалы II Международной конференции, 15-17 апреля, 2008 г. – Астрахань. - С. 54 – 55.
12. Косулина Д.Ю., Василин В.К, Строганова Т.А., Крапивин Г.Д. Кетоны ряда [2,3-b]пиридина в синтезе конденсированных пирролов // Материалы Всероссийской конференции "Карбонильные соединения в синтезе гетероциклов". – Саратов: "Науч.Книга", 2008. – С.146 – 147.
13. Патент РФ 2346947, МПК С07D 495/04. Способ получения фурилгетарилметанов, содержащих тиено[2,3-b]пиридиновый фрагмент / Косулина Д.Ю., Василин В.К., Строганова Т.А., Сбитнева Е.А., Крапивин Г.Д. - 2007130827/04; Приоритет 13.08.07; Опуб.: 20.02.2009, Бюл. №5
Подписано в печать _______________ Зак. № _________ Тираж ______
Лиц. ПД № 10-47020 от 11.09.2000
Типография КубГТУ, 350058, Краснодар, ул. Старокубанская, 88/4

