Синтез и химические свойства дикарбонильных соединений адамантанового ряда
На правах рукописи
Коньков Сергей Александрович
СИНТЕЗ И ХИМИЧЕСКИЕ СВОЙСТВА ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ АДАМАНТАНОВОГО РЯДА
02.00.03 – Органическая химия
Автореферат
диссертация на соискание ученой степени
кандидата химических наук
Самара – 2010
Работа выполнена на кафедре органической химии Самарского государственного технического университета – СамГТУ
Научный руководитель: доктор химических наук, профессор Моисеев Игорь Константинович
Официальные оппоненты: доктор химических наук, профессор
Пурыгин Петр Петрович
доктор химических наук, профессор
Гидаспов Александр Александрович
Ведущая организация: Институт органической химии им. Н.Д. Зелинского РАН, г. Москва
Защита состоится «21» сентября 2010 года в 16 часов на заседании диссертационного совета Д 212.217.05 в ГОУВПО «Самарский государственный технический университет» по адресу: 443100, г. Самара, ул. Молодогвардейская, 244, Главный корпус, ауд. 200.
Отзывы по данной работе в двух экземплярах, заверенные печатью, просим направлять на имя ученого секретаря диссертационного совета Д 212.217.05 по адресу: Россия, 443100, Самара, ул. Молодогвардейская 244, Главный корпус; тел./факс: (846) 3335255, e-mail: [email protected].
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Самарского государственного технического университета.
Автореферат разослан «20» августа 2010 г.
Учёный секретарь
диссертационного совета Д 212.217.05,
к.х.н., доцент Саркисова В.С.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. В последние десятилетия химия адамантана и его производных интенсивно развивается. На основе химии адамантана возникла и развилась одна из областей современной органической химии – химия органических полиэдранов. Производные адамантана уже нашли практическое применение в качестве лекарственных препаратов, обладающих противовирусной активностью, а также средств против болезни Паркинсона, на основе адамантана разрабатываются полимерные материалы и композиции с улучшенными эксплуатационными свойствами, термостабильные смазочные материалы и т.п. Большое практическое значение имеют исследования взаимосвязи строения производных адамантана с их противовирусным действием. Это, несомненно, связано с тем, что введение фрагмента адамантана в органические соединения модифицирует их биологическую активность, изменяя и часто усиливая ее за счет липофильности соединений, содержащих каркас адамантана, а следовательно создают благоприятные условия для транспорта органической молекулы через биологические мембраны.
Перспективным направлением в химии адамантана является синтез и изучение химических свойств дикарбонильных соединений. Этот класс соединений мало изучен в химии адамантана. Особенно интересным является тот факт, что на основе дикарбонильных соединений можно синтезировать большое количество гетероциклических соединений. Химия пятичленных азотсодержащих гетероциклов, а именно пиразолов, пиразолонов и изоксазолов, привлекает к себе внимание исследователей в связи с их практической ценностью и биологической активностью. Соединения этого ряда представляют интерес как пиразолоновые красители и лекарственные препараты. Среди них известны – антипирин, пиримидон, анальгин. Кроме того, есть перспективы введения в гетероциклические соединения атомов фтора, амино- и нитрозогрупп, которые существенно могут улучшить их биологическую активность.
Работа выполнена при поддержке Минобрнауки РФ (ФЦП «Научные и научно-педагогические кадры инновационной России», грант НК-262П/5).
Цель работы – синтез и изучение химических свойств дикарбонильных соединений адамантанового ряда.
Научная новизна. В ходе синтеза 1,3-дикетонов адамантанового ряда выделены и охарактеризованы устойчивые борфторатные комплексы.
Изучены реакции гетероциклизации, нитрозирования, восстановления, азосочетания адамантилсодержащих 1,3-дикетонов.
Исследовано направление реакции нессиметричных 1,3-дикетонов адамантанового ряда с монопроизводными гидразина с использованием базиса DFT B3LYP/6-31G** и спектроскопии ЯМР (гетероядерные методики 1H, 13C и 1H, 15N HMBC). Показано, что в ходе реакции образуется только один из двух возможных изомеров, а именно продукт первоначальной атаки азотом бинуклеофила углерода карбонильной группы, находящейся около алифатического заместителя.
Установлено, что в реакциях 1,3-диоксоэфиров адамантанового ряда с бинуклеофилами в зависимости от условий реакции происходит либо расщепление диоксоэфиров с образованием 5-(1-адамантил)-2,4-дигидро-3Н-пиразол-3-она и гидразидов кислот, либо образование карбэтоксипиразолов.
Практическая значимость.
Совместно с Московским государственным текстильным университетом им. А.Н. Косыгина были проведены испытания синтезированных азосоединений в качестве красителей с потенциальными гидрофобными и бактерицидными свойствами. Установлено, что адамантилсодержащие азосоединения возможно использовать в качестве красителей ткани из капрона.
Проведены испытания in vitro синтезированных соединений в отношении вируса осповакцины. 1,4-Бис(1-адамантил)-1,4-бутандиол обладает выраженной способностью подавлять размножение вируса осповакцины.
Апробация работы. Основные результаты работы докладывались на XI Всероссийской научной конференции «Карбонильные соединения в синтезе гетероциклов» (Саратов, 2008); XI Международной конференции по органической химии, посвященной 110-летию со дня рождения И.Я. Постовского (Екатеринбург, 2008); Международных научно-технических конференциях «Химические реактивы, реагенты и процессы малотоннажной химии» (Уфа, 2008, 2009); XI Международной научно-технической конференции «Перспективы развития химии и практического применения алициклических соединений» (Волгоград, 2008); Всероссийской научно-практической конференции “Коршуновские чтения” (Тольятти, 2008); Всероссийской конференции по органической химии, посвященной 75-летию со дня основания ИОХ им. Н.Д. Зелинского РАН (Москва, 2009).
Публикация результатов. По теме диссертации опубликованы 5 статей и тезисы 9 научных докладов.
Объем и структура работы. Диссертация изложена на 118 страницах и включает в себя введение, литературный обзор, посвященный общим методам получения 1,3- и 1,4-дикетонов, синтезу моно- и дикарбонильных соединений адамантанового ряда, обсуждение результатов, экспериментальную часть и выводы. Список литературы содержит ссылки на 173 литературных источника.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1.1. Синтез 1,3- и 1,4-дикетонов адамантанового ряда
1,3-Дикетоны адамантанового ряда синтезированы при взаимодействии кетонов с ангидридами кислот в присутствии эфирата трехфтористого бора.
Для синтеза 1,3-дикетонов выбраны (1-адамантил)метилкетон и ангидриды уксусной, бензойной, пропионовой и адамантанкарбоновой кислот.
Ad = 1-Адамантил.
R = Me (1а), Ph (1b), Et (1c), Ad (1d).
В ходе ацилирования в присутствии эфирата трехфтористого бора образовывался устойчивый борфторатный комплекс. Комплекс разлагали кипячением в 15%-ном водном растворе ацетата натрия в течение 5-6 ч. На примере дикетона (1а) был выделен и охарактеризован борфторатный комплекс (1е). Строение комплекса (1е) подтверждается данными ИК-спектроскопии, масс-спектрометрии и ЯМР 1Н.
В ИК спектре комплекса (1е) присутствует полоса (С=С) 1542 см-1, в спектре ЯМР 1Н имеются характерные сигналы протонов метильной группы 2.31 м.д. и сигнал протона метинового фрагмента 6.01 м.д. (СН=С). В масс-спектре присутствует пик молекулярного иона m/z 268 [M]+.
Наименьший выход в реакциях наблюдался в случае 1,3-ди(1-адамантил)пропан-1,3-диона (1d), что, скорее всего, связано с невысокой реакционной способностью ангидрида адамантанкарбоновой кислоты.
В ИК спектрах 1,3-дикетонов (1а-d) содержатся полосы поглощения в области 1646 – 1730 см-1, характеризующие валентные колебания карбонильных групп С=О(кет.). В спектрах ЯМР 1Н (ДМСО-d6) соединений (1а-d) зарегистрирован сигнал протона гидроксильной группы в области 14.60 – 16.60 м.д. Из спектров следует, что в растворе ДМСО адамантилсодержащие 1,3-дикетоны существуют в енольной форме, а в твердом состоянии в кетонной.
1,4-Дикетоны адамантанового ряда получены по реакции алкилирования этилового эфира 3-(1-адамантил)-3-оксопропановой кислоты замещенными (1-адамантил)бромметилкетонами, с последующим щелочным гидролизом. Реакции проводились в абсолютном диэтиловом эфире, в качестве конденсирующего агента применялся металлический натрий. В результате реакции выделены дикетоны (3а-с). Выходы 1,4-дикетонов составляют 38-50%.
R = 3-Хлор-1-адамантил (3а), 3-бром-1-адамантил (3b), 3,5-диметил-1-адамантил.
1.2. Синтез 1,3- и 1,4-диоксоэфиров адамантанового ряда
Для синтеза 1,3-диоксоэфиров широко используется реакция ацилирования хлорангидридами кислот этилового эфира 3-(1-адамантил)-3-оксопропановой кислоты, цианоуксусного, ацетоуксусного, малонового эфиров и их производных. Однако в этих реакциях образуются не только продукты С-ацилирования, но и продукты О-ацилирования.
Соответствующие 1,3-диоксоэфиры получены по реакции ацилирования этилового эфира 3-(1-адамантил)-3-оксопропановой кислоты хлорангидридами 3-R-1-адамантанкарбоновых кислот. Реакции проводились в абсолютном диэтиловом эфире, в качестве конденсирующего агента применяли металлический натрий. Выходы 1,3-диоксоэфиров (2a-g) составили 60-87%.
R = 3,5-Диметил-1-адамантил (2а), 3-хлор-1-адамантил (2b), 3-бром-1-адамантил (2c), 3-фенил-1-адамантил (2d), 4-фторфенил (2e), 2,3,4,5-тетрафторфенил (2f), 2-хлор-4-фторфенил (2g).
В ИК спектрах всех синтезированных 1,3-диоксоэфиров (2a-g) содержатся полосы поглощения в областях 1730 – 1797 см-1, характеризующие валентные колебания группы С=О(слож.эф.) и по две полосы в области 1647 – 1735 см-1, относящиеся к колебаниям связи С=О(кет.). В спектрах ЯМР 1Н соединений (2a-g) сигналы метинового протона находятся в области 5.01 – 6.42 м.д. Можно сделать вывод, что в результате реакций были выделены только продукты С-ацилирования.
Адамантилсодержащие 1,4-диоксоэфиры (кетоэфиры, в случае 3d) получены аналогично 1,4-дикетонам (3а-с). Этил-4-(1-адамантил)-2-R-4-оксобутаноат (3d, e) [R= CN, C(O)CH3] и этил-2-(1-адамантаноил)-4-оксо-4-фенилбутаноат (3f) получены при взаимодействии (1-адамантил)бромметилкетона с цианоуксусным и ацетоуксусным эфирами, а также этилового эфира 3-(1-адамантил)-3-оксопропановой кислоты с бромацетофеноном. Выходы диоксоэфиров равны 31-60%.
R1 = CN, R2 = Ad (3d), R1 = C(O)Me, R2 = Ad (3e), R1 = С(О)Ad, R2 = Ph (3f).
2. ХИМИЧЕСКИЕ СВОЙСТВА ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ АДАМАНТАНОВОГО РЯДА
Дикарбонильные соединения в своем составе имеют два ярко выраженных электрофильных центра. Поэтому одной из характерных реакций 1,3-дикетонов является образование циклических соединений при действии различных бинуклеофильных реагентов (гидразин, фенилгидразин и т.д.), которое изучено в данной работе. Кроме того, интересно рассмотреть, например, реакции восстановления карбонильных групп и реакции по активному метиленовому звену 1,3-дикетонов.
2.1. Взаимодействие адамантилсодержащих 1,3-дикетонов с бинуклеофилами
1,3-Дикетоны (1a-d) введены в реакции с бинуклеофильными реагентами (гидразин, фенилгидразин, семикарбазид и др.). Реакции 1,3-дикетонов с бинуклеофильными реагентами проводились в этиловом спирте при нагревании. В результате выделены твердые кристаллические вещества (4a-l) с выходами 40-76%.
R1 = Me; R2 = H (4a), Ph (4b), C(O)NH2·HCl (4c), C(S)NH2 (4d), 3-метил-4-фенил-1Н-пиразол-5-ил, (4e), 3,5-дихлорпиридин-2-ил (4f);
R1 = Ph; R2 = H (4g);
R1 = Et; R2 = H (4h), Ph (4i), C(O)NH2·HCl (4j), C(S)NH2 (4k);
R1 = Ad; R2 = H (4l).
Борфторатный комплекс (1е) также вводили в реакцию с гидразингидратом в спирте. Под действием гидразина борфторатный комплекс, по-видимому, разлагался, а 1,3-дикетон генерировался in situ и взаимодействовал с гидразингидратом. В результате получен 5-(1-адамантил)-3-метил-1Н-пиразол (4а).
Однако реакции несимметричных 1,3-дикетонов с монозамещенными гидразинами приводят к образованию изомерных пиразолов. Данные ИК-спектроскопиии, ЯМР 1Н, не могут точно определить структуру того или иного изомера.
С целью изучения взаимодействия несимметричных 1,3-дикетонов с монозамещенными гидразинами проводили квантово-химическое моделирование двух альтернативных путей реакции. За основу расчетов принимали реакцию 1-(1-адамантил)-1,3-бутандиона (1а) с фенилгидразином. При их взаимодействии реакция возможна по двум направлениям – первоначальная атака азотом фенилгидразина углерода карбонильной группы (С1), находящегося в положении 1 (путь I), либо атака углерода карбонильной группы (С3) в положении 3 (путь II).
Расчет проводили методом DFT B3LYP/6-31G** в программе GAMESS. Исходя из полученных данных, маршрут реакции можно описать следующими стадиями:
1) координация молекул дикетона и фенилгидразина, при этом идет образование комплекса К1;
2) переход комплекса К1 в интермедиат И1 происходит через переходное состояния ПС1 с энергией активации 47.25 ккал/моль (I путь) и 31.25 ккал/моль (II путь);
3) отщепление молекулы воды (интермедиат И2) происходит через переходное состояние ПС2, энергия активации 60.11 ккал/моль (I путь) и 52.29 ккал/моль (II путь);
4) состояние И2 переходит в координационное состояние с образованием комплекса К2 (координация И2 с отщепившейся водой на схеме не указана);
5) переход комплекса К2 в интермедиат И3 происходит через переходное состояние ПС3, энергия активации 80.53 ккал/моль (I путь) и 76.81 ккал/моль (II путь);
6) отщепление молекулы воды и образование пиразольного кольца П происходит через переходное состояние ПС4, энергия активации 32.21 ккал/моль (I путь) и 30.37 ккал/моль (II путь).
II Путь реакции является более энергетически выгодным (рис. 1).
Маршрут (энергии) I и II пути по методу DFT B3LYP/6-31G** реакции представлен на рисунке 1.
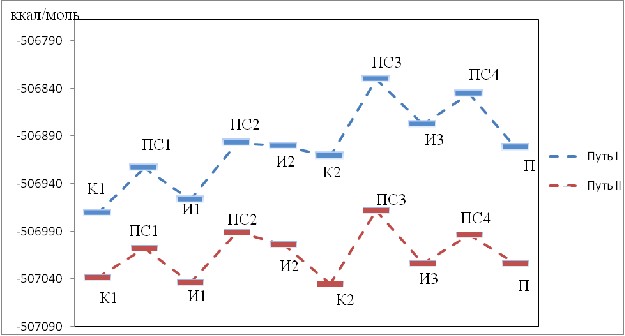
Рис. 1. Энергии стадий реакции фенилгидразина с 1-(1-адамантил)-1,3-бутандионом (1а) по методу DFT B3LYP/6-31G**.
В подтверждение теоретического расчета структура была однозначно установлена с помощью спектроскопии ЯМР, включая ее двумерные гетероядерные методики 1H, 13C и 1H, 15N HMBC.
Химические сдвиги для протонов и атомов углерода отсчитывались от ТМС, для атомов азота – от нитрометана. В спектре 1H, 15N HMBC присутствуют корреляционные пики для орто-протонов фенильного кольца H18 и H22 и атома азота N1 с химическим сдвигом -158 м.д. и протонов метильной группы H16 и другого атома азота N2 с химическим сдвигом -59 м.д., что однозначно свидетельствует о протекании реакции по пути II.
При протекании реакции по пути I H18, H22 и H16 коррелировали бы с одним и тем же атомом азота N1.
При взаимодействии 1,3-дикетонов (1a,c) с гидрохлоридом гидроксиламина в этиловом спирте получены изоксазолы (5a,c). В результате были выделены твердые кристаллические вещества (5a,c) с выходом 80-87%.
R = Me (5а), Et (5c).
Структура изоксазола (5а) однозначно установлена с помощью спектроскопии ЯМР, включая ее двумерные гетероядерные методики 1H, 13C и 1H, 15N HMBC.
В спектре 1H, 15N HMBC имеется корреляционный пик для H16 метильной группы и атома азота N2 с химическим сдвигом -5 м.д., что однозначно свидетельствует о протекании реакции по пути II. При протекании реакции по I пути не было бы корреляционного пика для метильной группы и атома азота.
2.2. Реакции азосочетания солей (гет)арилдиазония с 1,3-дикетонами адамантанового ряда
По реакции Яппа-Клингеманна, в ходе которой происходит сочетание солей (гет)арилдиазония с 1,3-дикетонами и 3-оксоэфирами, могут быть синтезированы 2-(гет)арилгидразоно-1,3-дикарбонильные соединения. В качестве азосоставляющих соединений выбраны 1,3-дикетоны (1а-с). В качестве диазосоставляющей выбран п-нитроанилин.
Реакция азосочетания соли диазония с 1,3-дикетонами (1а-с) протекает в щелочной среде при комнатной температуре в течение 1-1,5 ч. Соответствующие гидразоны (18а-с) получены с выходами 69-83%.
R = Me (18а), Ph (18b), Et (18c).
Гидразоны (18а-с) были введены в реакцию с гидразином. В результате реакции образовывались соответствующие пиразолы (19а-с).
R = Me (19а), Ph (19b), Et (19c).
Нитрогруппу соединения (19а) восстанавливали до аминогруппы сульфидом натрия в этиловом спирте. В результате выделен 4-[(3-метил-5-адамантил-1-1Н-пиразол-4-ил)диазенил]анилин (20) с выходом 93%.
4-[(3-Метил-5-адамантил-1-1Н-пиразол-4-ил)диазенил]анилин (20) использовался в качестве соли диазония в реакции азосочетания с -нафтолом.
2.3. Реакции нитрозирования адамантилсодержащих 1,3-дикетонов
Известно, что интересным направлением в химии является синтез пиразолов с нитрозогруппой, т.к. нитрозогруппу можно легко восстановить до аминогруппы, что открывает путь синтеза аминопиразолов, обладающих противовирусной активностью. Нами получен 1-(1-адамантил)бутан-1,2,3-трион-2-оксим (6) взаимодействием 1-(1-адамантил)-1,3-бутандиона (1а) с нитритом натрия в уксусной кислоте. Из оксима (6) с гидразином в этиловом спирте при комнатной температуре и эквимолярном соотношении реагентов образуется 3-(1-адамантил)-5-метил-4-нитрозо-1Н-пиразол зелено-голубого цвета (7). При нагревании оксима (6) с избытком гидразина, образующийся пиразол (7) восстанавливается до бесцветного 3-(1-адамантил)-4-амино-5-метил-1Н-пиразола (8).
В ИК спектре 1-(1-адамантил)бутан-1,2,3-трион-2-оксима (6) содержатся полосы поглощения гидроксильной группы 3356 см-1, двух карбонильных групп (С=Окет.) 1674, 1713 см-1. В ИК спектре 3-(1-адамантил)-5-метил-4-нитрозо-1Н-пиразола (7) содержатся полосы поглощения NН-группы пиразольного кольца 3202 см-1 и полоса 1578 см-1 (N=О). В спектре 3-(1-адамантил)-4-амино-5-метил-1Н-пиразола (8) содержатся полосы поглощения: 3221, 3203 см-1 валентные колебания группы (NН, NH2). В спектре ЯМР 1Н оксима (6) имеется сигнал протона гидроксильной группы 12.80 м.д., в спектре нитрозопиразола (7) сигнал протона NН-группы 13.10 м.д., а в спектре аминопиразола (8) сигнал трех протонов (NH + NH2) групп в области 11.08 м.д.
Нами изучены некоторые химические свойства полученного 3-(1-адамантил)-4-амино-5-метил-1Н-пиразола (8). Мы провели реакцию с альдегидами (бензальдегид, 4-(диметиламино)бензальдегид, 4-метоксибензальдегид) в этиловом спирте в присутствии концентрированной соляной кислоты. Реакцию N-ацилирования с двумя молями хлорангидрида 4-фторбензойной кислоты проводили в абсолютном толуоле.
R = H (9a), NMe2 (9b), OMe (9c).
2.4. Восстановление 1,3-и 1,4-дикетонов адамантанового ряда
Известно, что карбонильную группу можно легко восстановить до гидроксильной. Восстановление 1-(1-адамантил)-1,3-бутандиона и 1,3-пентандиона (1а, 1c), а также 1,4-бис(1-адамантил)-1,4-бутандиона проводилось борогидридом натрия в абсолютном этиловом спирте при кипячении в течение 5 ч. В результате были выделены соответствующие гликоли (17а-с) с выходом 58-75%.
R = Me (17а), Et (17b).
2.5. Реакции 1,3- и 1,4-диоксоэфиров
2.5.1. Взаимодействие адамантилсодержащих 1,3-и 1,4-диоксоэфиров с бинуклеофилами
Особый интерес к 1,3-и 1,4-диоксоэфирам связан с тем, что в их составе имеется три электрофильных центра – два углерода карбонильных групп и один углерод сложноэфирной группы. Поэтому мы решили изучить взаимодействие полученных соединений с гидразином и его производными и выяснить направление реакции. При взаимодействии несимметричных 1,3-диоксоэфиров (2a-g) с гидразином происходило расщепление исходных диоксоэфиров, в результате выделен 5-(1-адамантил)-2,4-дигидро-3Н-пиразол-3-он и гидразиды замещенных адамантанкарбоновых и фторбензойных кислот.
R = 3,5-Диметил-1-адамантил (2а), 3-хлор-1-адамантил (2b), 3-бром-1-адамантил (2c), 3-фенил-1-адамантил (2d), 4-фторфенил (2e), 2,3,4,5-тетрафторфенил (2f), 2-хлор-4-фторфенил (2g).
Диоксоэфиры (2e-g) были введены в реакцию с гидрохлоридом гидразина в спирте, т.е. в более «мягких» условиях, при этом образовывались карбэтоксипиразолы (11a-c). Реакция в этом случае идет только по кетонным группам, без участия сложноэфирной группы.
R = 4-Фторфенил (2e, 11a), 2,3,4,5-тетрафторфенил (2f, 11b), 2-хлор-4-фторфенил (2g, 11c).
В ИК спектрах пиразолов (11a-с) присутствуют полосы поглощения NH-группы в области 3230 – 3240 см-1, полоса группы (С=Осл.эф.) смещается в область 1710 – 1713 см-1 (в исходных 1,3-диоксоэфирах (2e-g) 1732 – 1740 см-1). В спектрах ЯМР 1Н всех соединений (11а-с) имеются сигналы протона NН-группы в области 9.88 – 10.10 м.д.
2.5.2. Поведение 1,3-диоксоэфиров в кислотных и щелочных средах
1,3-Диоксоэфиры (2a-d) могут быть перспективными исходными соединениями для синтеза труднодоступных 1,3-дикетонов. Известно, что сложноэфирную группу в 1,3-диоксоэфирах возможно отщепить в условиях щелочного или кислого гидролиза. Наши попытки гидролизовать сложноэфирную группу не привели к желаемым дикетонам. В случае щелочного гидролиза (MeOH – KOH) происходило, по-видимому, омыление сложноэфирной группы и уже дальнейшее расщепление промежуточных 1,3-дикетонов с образованием карбоновых кислот и кетонов. Выделить целевые дикетоны не удалось. В случае кислотного гидролиза (AcOH – H2SO4 – H2O) происходило кетонное расщепление, образовывалась также смесь соответствующих кетонов и карбоновых кислот.
R = 3,5-Диметил-1-адамантил (2а), 3-хлор-1-адамантил (2b), 3-бром-1-адамантил (2c), 3-фенил-1-адамантил (2d).
2.6. Химические свойства 1,3-диацетил- и 1,3-диацетониладамантана
Наиболее доступные адамантилсодержащие 1,5- и 1,7-дикетоны – 1,3-диацетил- и 1,3-диацетониладамантан. Нами рассмотрены некоторые химические свойства этих дикетонов с целью дальнейшего изучения биологической активности вновь синтезированных соединений.
Взаимодействием 1,3-диацетил- и 1,3-диацетониладамантана с гидроксиламином в спиртовом растворе получены диоксимы (12а,b).
n = 0 (12a); 1 (12b).
По реакции Лейкарта-Валлаха из 1,3-диацетиладамантана получен гидрохлорид 1-(3-ацетиладамантил)этиламина (13). Реакциями 1,3-диацетиладамантана с гидрохлоридами гидразина, семикарбазида, тиосемикарбазида выделены соответствующие дигидразон (14а), дисемикарбазон (14b), дитиосемикарбазон (14c).
R = H (14a); C(O)NH2 (14b); C(S)NH2 (14c).
Взаимодействием 1,3-диацетиладамантана с ароматическими альдегидами (бензальдегид, анисовый альдегид, 4-нитробензальдегид) в 2-пропаноле в присутствии KOH по реакции Кляйзена-Шмидта синтезированы халконы (15а-c).
R = C6H5 (15а); 4-NO2-C6H4 (15b); 4-CH3O-C6H4 (15c).
1,3-Диацетиладамантан с этилформиатом и натрием образует натриевую соль, взаимодействием которой с гидрохлоридом 1-аминоадамантана в 50%-ном водном этаноле синтезировано соединение (16).
3. БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ СИНТЕЗИРОВАННЫХ СОЕДИНЕНИЙ
Некоторые синтезированные соединения были исследованы на антивирусную активность в отношении вируса осповакцины на культуре клеток Vero. В качестве исследуемых вирусов использовали следующие ортопоксвирусы: вирус осповакцины (штамм ЛИВП), применяемый для вакцинации населения, вирус оспы коров (штамм Гришак) и вирус оспы мышей (штамм К-1). Все испытания проводились в ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора РФ (п. Кольцово, Новосибирская обл.)*
[1]. Результаты тестирования представлены в таблицах 1 и 2.
Таблица 1
Противовирусная активность в отношении вируса осповакцины(штамм вируса ЛИВП) на культуре клеток Vero
| Соединение, № | Цитотоксическая активность, (ЦТД50, мкг/мл) | Противовирусная активность, (ИК50, мкг/мл) | Индекс селективности, (ЦТД50 / ИК50) |
| 4a | 81 | 5.37 | 15.08 |
| 4b | 5.21 | н/а | - |
| 4f | >100 | 20.1 | 4.98 |
| 4h | >100 | 4.37 | >22.88 |
| 4i | >100 | 26.3 | >3.80 |
| 4j | >100 | 4.7 | >21.28 |
| 4l | 100 | 3.26 | 30.67 |
| 6 | 30.9 | 6.4 | 4.83 |
| 7 | 58.0 | 2.32 | 25 |
| 10 | >100 | 34.2 | 2.92 |
| 17a | >100 | 58.1 | >1.72 |
| 17c | >100 | 0.75 | >133.33 |
Таблица 2
Противовирусная активность соединения 17c в отношении вируса оспы коров (штамм Гришак), эктромелии (штамм вируса К-1) на культуре клеток Vero
| Вирус | Цитотоксическая активность, (ЦТД50, мкг/мл) | Противовирусная активность, (ИК50, мкг/мл) | Индекс селективности, (ЦТД50 / ИК50) |
| Cowpox | >100 | 1.87 | >53.48 |
| Ectromelia | >100 | 3.79 | >26.39 |
Как видно из приведенных в таблицах 1 и 2 данных, у значительного количества исследованных производных адамантана в экспериментах на культуре клеток обнаружены вирусингибирующие свойства в отношении вируса осповакцины. 1,4-Бис(1-адамантил)-1,4-бутандиол (17с) обладают выраженной способностью подавлять размножение вируса осповакцины в концентрации 0.75 мкг/мл, индекс селективности составляет ~ 133.3. Кроме того, вирусингибирующее действие 1,4-бис(1-адамантил)-1,4-бутандиола (17с) было изучено на культуре клеток Vero в отношении вируса оспы коров (штамм Гришак) и вируса оспы мышей (штамм К-1).
Таким образом, среди рассмотренных производных адамантана наиболее высокой эффективностью в отношении вируса осповакцины обладает 1,4-бис(1-адамантил)-1,4-бутандиол (17с).
4. ИСПОЛЬЗОВАНИЕ АДАМАНТИЛСОДЕРЖАЩИХ АЗОСОЕДИНЕНИЙ ДЛЯ ОКРАШИВАНИЯ ТЕКСТИЛЬНЫХ МАТЕРИАЛОВ
В последние годы появились сообщения, указывающие на высокую фунгицидную активность пиразолсодержащих азокрасителей. Синтезированные соединения (18а-с), (19а-с), (20,21) имеют строение, позволяющее рассматривать их как потенциальные дисперсные азокрасители для крашения поликапроамида.
Азосоединения (18а), (19а) и (21) испытаны в качестве дисперсных красителей для крашения полиамидного волокна (капрон), в условиях стандартного крашения дисперсными красителями. Полученные окрашенные образцы исследовали на устойчивость к сухому и мокрому трению (ГОСТ 9733.27-83) и мокрой обработке (ГОСТ 9733.4-83)*
[2]. Устойчивость окраски образцов оценивалась по пятибалльной шкале серых эталонов (таблица 3).
В случае сухого и мокрого трения первая цифра соответствует оценке изменения первоначальной окраски окрашенного образца, вторая цифра соответствует оценке степени закрашивания белого хлопкового волокна.
В случае мокрых обработок первая цифра соответствует оценке изменения первоначальной окраски окрашенного образца, вторая цифра соответствует оценке степени закрашивания белого материала из того же волокна, третья цифра соответствует оценке степени закрашивания смежной хлопчатобумажной ткани.
Таблица 3
Устойчивость окрашенных материалов к физико-химическим воздействиям
| Краситель | Сухое трение | Мокрое трение | Стирка | Пот |
| 18а | 5/5 | 5/5 | 4/4/5 | 5/4/3 |
| 19а | 5/5 | 5/5 | 4/5/5 | 5/3/3 |
| 21 | 5/5 | 5/5 | 2/5/5 | 5/4/3 |
Как видно из таблицы 3, окрашенные образцы имеют высокую устойчивость к сухому и мокрому трению, среднюю к мокрым обработкам. Первоначальная окраска окрашенных образцов при стирке изменяется на 1-3 балла, зато смежные ткани практически не меняются, при испытании на пот, наоборот, первоначальная окраска окрашенных образцов остается такой же, зато окраска смежных образцов из капрона и хлопчатобумажной ткани снижалась на 1-2 балла.
ВЫВОДЫ
1. Синтезирован ряд адамантилсодержащих 1,3- и 1,4-дикетонов и диоксоэфиров. В ходе синтеза 1,3-дикетонов адамантанового ряда выделены устойчивые борфторатные комплексы; установлено, что данные комплексы могут использоваться для синтеза различных пиразолов и изоксазолов.
2. Найдено, что взаимодействие 1,3-диоксоэфиров адамантанового ряда с гидразингидратом зависит от условий проведения реакции. Реакции могут протекать либо с образованием 5-(1-адамантил)-2,4-дигидро-3Н-пиразол-3-она и гидразидов замещенных адамантанкарбоновых и фторбензойных кислот, либо пиразольного кольца, с сохранением сложноэфирной группы.
3. Синтезированы адамантилсодержащие гидразоны по реакции Яппа-Клингеманна из солей арил(гетарил)диазония и 1,3-дикетонов адамантанового ряда.
4. Изучены химические свойства 1,3-диацетил- и 1,3-диацетониладамантана как по карбонильным группам (нуклеофильное присоединение-отщепление гидроксиламина, гидразина, семикарбазида, тиосемикарбазида и восстановление), так и метильным группам (синтез халконов и енаминокетона).
5. Квантово-химическим методом расчета (DFT B3LYP/6-31G**) и спектроскопией ЯМР (гетероядерные методики 1H,13C и 1H,15N HMBC) показано, что в реакции 1,3-дикетонов адамантанового ряда с монозамещенными гидразина образуется только один из двух возможных изомеров – 5-(1-адамантил)-3-R1-1-R2-1H-пиразол.
6. Обнаружено, что адамантилсодержащие азосоединения могут использоваться в качестве красителей с потенциальными гидрофобными и бактерицидными свойствами. Проведены противовирусные испытания в отношении ортопоксовирусов. 1,4-Бис(1-адамантил)-1,4-бутандиол обладает выраженной способностью подавлять размножение вируса осповакцины.
Основное содержание диссертации опубликовано в следующих работах
Статьи
1. Коньков С.А., Моисеев И.К. Получение 1,3- и 1,4-дикетонов и кетоэфиров адамантанового ряда. Синтез гетероциклов на основе 1,3-дикетонов // Башкирский химический журнал. – 2008. – Т. 18, №3. – С. 106-109.
2. Коньков С.А., Моисеев И.К. Синтез пиразолов и пиразолонов на основе 1,3- и 1,4-дикетонов адамантанового ряда // Журнал органической химии. – 2009. – Т. 45, Вып. 12. – С. 1828-1831.
3. Коньков С.А., Моисеев И.К. Синтез и химические свойства 1,3-дикетонов адамантанового ряда // Бутлеровские сообщения. – 2009. – Т. 16, Вып. 4. – С. 9 - 20.
4. Коньков С.А., Моисеев И.К. Кетоны ряда адамантана. Методы получения и химические свойства (обзор) // Изв. вузов. Сер. хим. и хим. технол. – 2010. – Т. 53, Вып. 2. – С. 3-16.
5. Коньков С.А., Моисеев И.К. Синтез нитрозо- и аминопиразолов адамантанового ряда // Журнал органической химии. – 2010. – Т. 46, Вып. 4. – С. 614-615.
Тезисы
1. Коньков С.А., Моисеев И.К. Получение 1,3- и 1,4-дикетонов адамантанового ряда. Синтез и химические свойства // Сборник научных трудов “Карбонильные соединения в синтезе гетероциклов.” – Саратов, 2008. – С. 130-135.
2. Коньков С.А., Моисеев И.К. Синтез 1,3- и 1,4-дикетонов адамантанового ряда. Исследование реакций циклизации и восстановления // XI Международная конференция по органической химии, посвященная 110-летию со дня рождения И.Я. Постовского. – Екатеринбург, 2008. – С. 66.
3. Коньков С.А., Киляева Н.М., Нечаева О.Н., Моисеев И.К. Некоторые 1,3- и 1,4-дикетоны, амидразоны и гетероциклы в химии адамантана // Материалы XXI Международной научно-технической конференции “Химические реактивы, реагенты и процессы малотоннажной химии.” – Уфа, 2008. – С. 91-94.
4. Коньков С.А., Бормашева К.М., Моисеев И.К. Исследование реакций эфиров кетокарбоновых кислот ряда адамантана с гидразином и фенилгидразином // XI Международная научно-техническая конференция “Перспективы развития химии и практического применения алициклических соединений.” – Волгоград, 2008. – С. 152.
5. Коньков С.А., Моисеев И.К. Исследование реакций циклизации и восстановления 1,3- и 1,4-дикетонов ряда адамантана // Всероссийская научно-практическая конференция “Коршуновские чтения”, сборник научных трудов. – Тольятти, 2008. – С. 34-38.
6. Коньков С.А., Моисеев И.К. Синтез адамантилсодержащих гетероциклов // “Сборник тезисов докладов Всероссийской конференции по органической химии”, посвященной 75-летию со дня основания ИОХ им. Н.Д. Зелинского РАН. – Москва, 2009. – С. 229.
7. Бормашева К.М., Коньков С.А., Моисеев И.К. Некоторые химические свойства адамантилсодержащих пиразолонов // “Сборник тезисов докладов Всероссийской конференции по органической химии”, посвященной 75-летию со дня основания ИОХ им. Н.Д. Зелинского РАН. – Москва, 2009. – С. 112.
8. Коньков С.А., Крылов К.С., Моисеев И.К. Синтез новых фторсодержащих гетероциклов с фрагментом адамантана // Материалы XXII Международной научно-технической конференции “Химические реактивы, реагенты и процессы малотоннажной химии” – Уфа, 2009. – С. 42-44.
9. Klimochkin Yu, Osyanin V., Golovin E., Leonova M., Konkov S., Kilyaeva N., Bormotov N., Serova O., Balakhnin S., Belanov E. The Activity of the New Adamantane Derivatives Against the Orthopoxviruses // Antiviral Research. – 2010. – Vol. 86, N1. – P. A59.
Отпечатано с разрешения диссертационного Совета Д 212.217.05
ГОУ ВПО «Самарский государственный технический университет»
Протокол № 17 от 13 июня 2010 г.
Заказ № Объем п.л. Тираж 110 экз.
Формат 60х84/16. Отпечатано на ризографе.
_____________________________________________________________
ГОУ ВПО «Самарский государственный технический университет»
Отдел типографии и оперативной полиграфии
443100, г. Самара, ул. Молодогвардейская, 244
* Автор выражает искреннюю благодарность сотрудникам ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора РФ Балахнину С.М., Бормотову Н.И., Серовой О.А., Беланову Е.Ф.
* Автор выражает искреннюю благодарность сотрудникам МГТУ им. А.Н. Косыгина профессору, доктору химических наук Кобракову Константину Ивановичу и аспиранту Кузнецову Дмитрию Николаевичу

