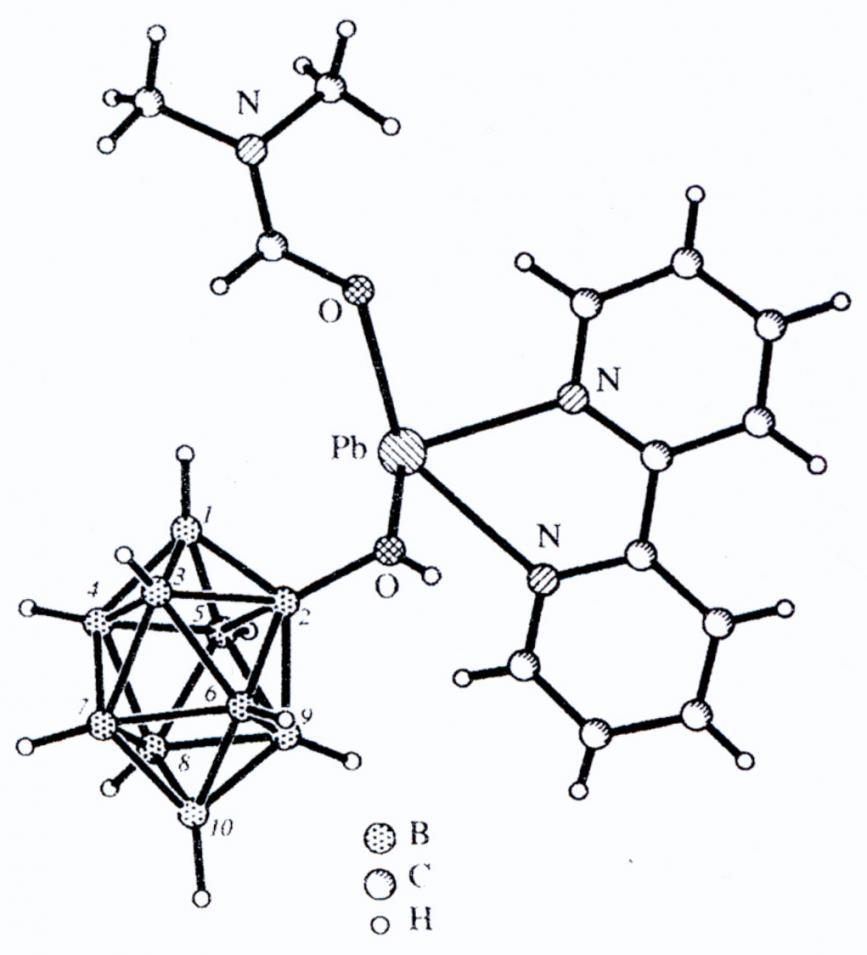
Кластерные анионы бора bnhn2- (n = 10,12) в качестве лигандов в координационных соединениях металлов iб-группы и свинца(ii)
На правах рукописи
МАЛИНИНА Елена Анатольевна
кластерные анионы бора BnHn2- (n = 10,12) В КАЧЕСТВЕ ЛИГАНДОВ В координационныХ соединенияХ
МЕТАЛЛОВ IБ-ГРУППЫ и СВИНЦА(II)
02.00.01- неорганическая химия
Автореферат
диссертации на соискание ученой степени
доктора химических наук
Москва 2009
Работа выполнена в Учреждении Российской академии наук Институте общей и неорганической химии имени Н.С. Курнакова РАН
Официальные оппоненты: доктор химических наук, профессор
Булычев Борис Михайлович,
Московский государственный
Университет им. М.В.Ломоносова
доктор химических наук,
Сергиенко Владимир Семенович,
Институт общей и неорганической химии
им. Н.С. Курнакова РАН
доктор химических наук, профессор
Чижевский Игорь Тимофеевич,
Институт элементоорганических соединений
им. А.Н. Несмеянова РАН
Ведущая организация: Московская государственная академия
тонкой химической технологии
им. М.В.Ломоносова
Защита состоится « 24 » июня 2009 г. в 1100 часов на заседании диссертационного совета Д 002.021.01 при ИОНХ РАН по адресу: 119991, ГСП-1, г. Москва, Ленинский проспект, д. 31.
С диссертацией можно ознакомиться в библиотеке ИОНХ РАН по адресу: 119991, ГСП-1, г. Москва, Ленинский проспект, д. 31.
Автореферат разослан «___» мая 2009 г.
Ученый секретарь
диссертационного совета
Д 002.021.01 при ИОНХ РАН Генералова
кандидат химических наук Надежда Борисовна
Актуальность проблемы. Кластерные анионы бора BnHn2- (n = 6 - 12) составляют самостоятельный раздел в химии бора и представляют собой сравнительно новый и необычный тип лигандов в координационных соединениях переходных и непереходных металлов. Необычность полиэдрических анионов BnHn2- заключается в том, что они являются электронодефицитными структурами, в то время как классические лиганды имеют в своем составе атомы, способные к донированию электронной пары для образования связи с центральным атомом. Наличие делокализованной электронной плотности отличает этот класс ацидолигандов и от лигандов, содержащих -электронные системы (бензол, циклопентадиенил и др.). Высокая кинетическая и термическая устойчивость анионов BnHn2- в растворах и твердом состоянии, а также уникальная возможность варьирования размера, заряда анионов, их геометрических параметров обусловливает широкие перспективы их использования в синтетической координационной химии.
Особенности строения ацидолигандов BnHn2- существенно расширяют круг проблем, обсуждаемых в классической координационной химии, и заслуживают особого внимания исследователей, поскольку открывают широкие возможности для фундаментальных исследований, проводимых на стыке химии координационных соединений и специфической химии бороводородов. Среди таких проблем можно выделить: получение и исследование строения и свойств комплексных соединений с различными типами связей металл-кластер бора; изучение вторичных взаимодействий, обусловленных природой кластерных анионов бора BnHn2-, их влияния на формирование координационной сферы и элементарной ячейки комплексов; рассмотрение изомерии образующихся комплексов.
В силу специфических свойств бороводородных анионов и их производных, кластерные анионы бора BnHn2- следует рассматривать как уникальный класс полидентатных ацидолигандов в координационной химии.
Целью исследования является синтез координационных соединений металлов IБ-группы и Pb(II) с полиэдрическими анионами BnHn2- (n = 10, 12) в качестве лигандов и исследование фундаментальных проблем особенностей координации кластерных анионов бора к металлам.
В качестве объектов исследования выбраны высшие полиэдрические анионы бора: декагидро-клозо-декаборатный B10H102- и додекагидро-клозо-додекаборатный B12H122- анионы и некоторые замещенные аниона B10H102- - (B10H10-mXm)2-; в качестве металлов-комплексообразователей – металлы IБ-группы в низших степенях окисления (Cu(I), Ag(I), Au(I)), а также Cu(II) и Pb(II).
Предметом исследования является способность кластерных анионов бора выступать в роли лигандов в координационных соединениях переходных и непереходных металлов; структура, спектральные характеристики, характер и особенности строения комплексных соединений металлов с анионами BnHn2- в качестве лигандов.
Задачами настоящего исследования являются:
- исследование реакций комплексообразования меди(I) и серебра(I) с анионами BnHn2- в различных средах; установление влияния размера катиона исходного клозо-бората, мольного соотношения реагентов на формирование координационной сферы центрального атома; определение строения образующихся комплексных соединений, закономерности их образования; рассмотрение возможных механизмов реакций;
- исследование реакций комплексообразования меди(I) и серебра(I) с кластерными анионами бора в условиях протонирования бороводородных анионов; изучение протекающих процессов в динамике; определение строения образующихся комплексов;
- исследование реакций комплексообразования металлов IБ-группы с кластерными анионами бора BnHn2- в присутствии других мягких оснований; установление влияния условий протекания реакций на состав и строение образующихся комплексов;
- исследование реакций комплексообразования Cu(II) и Pb(II) с анионами B10H102- и B12H122-, а также с некоторыми производными аниона B10H102- - (B10H10mXm)2-, в том числе в присутствии других конкурентноспособных лигандов;
- исследование особенностей координации кластерных анионов бора BnHn2-, касающееся вопросов многоцентровых взаимодействий, вторичных взаимодействий и изомерии.
Научная новизна. Проведено фундаментальное исследование процесса комплексообразования металлов IБ-группы и Pb(II) c клозо-бороводородными анионами B10H102- и B12H122- в качестве лигандов, показавшее правильность выбранной концепции образования комплексов металлов с бороводородными анионами, за основу которой взято отнесение кластерных анионов бора к мягким основаниям по Пирсону. Этот подход позволил по оригинальным методикам синтезировать и систематически исследовать серию новых теоретически важных комплексов металлов с анионами BnHn2-, подойдя вплотную к проблемам многоцентровых взаимодействий (образование комплексов с различным типом связей металл- BnHn2-), вторичных взаимодействий и изомерии.
Впервые в ряду клозо-боратов BnHn2- с широким спектром ониевых катионов и катионов щелочных металлов проведено систематическое исследование реакционной способности анионов B10H102- и B12H122- в реакциях комплексо-образования с металлами (Cu(I) и Ag(I)), показано влияние размера катиона исходного клозо-бората, мольного соотношения реагентов на формирование координационной сферы центрального атома, определены типы образующихся комплексов Cat[MBnHn] или [M2BnHn] и закономерности их образования.
Впервые проведено исследование процесса комплексообразования в условиях протонирования кластерных анионов бора BnHn2-; проведена оценка степени участия протонированных анионов BnHn+1- в реакциях комплексообразования, предложен возможный механизм процесса. В результате синтезированы комплексные соединения меди(I) и серебра(I) с анионом B10H102- необычной геометрии – с одной и двумя четырехугольными гранями.
Предложено рассматривать реакции протонирования как модельные реакции комплексообразования.
На примере кристаллических структур дискретных комплексных соединений состава [M2(Ph3P)4B10H10] (M = Cu(I), Ag(I)) установлен новый вид изомерии комплексов с клозо-декаборатным анионом; методом РСА определено строение 1-2, 1-4-, 1-2, 5-8- и 1-2, 9-10-изомеров для [Ag2(Ph3P)4B10H10] и 1-2, 6-10- и 1-2, 9-10-изомеров в случае [Cu2(Ph3P)4B10H10].
Синтезированы и охарактеризованы новые комплексы золота с кластерными анионами бора BnHn2- с различными типами связей М-BnHn2-: в комплексе [1(Au(Ph3P))3В10Н9] наблюдается впервые установленная координация метало-кластера к атому бора кластерного аниона с образованием прямой связи Au-В (кластер золота Au3 связан с анионом В10Н9- посредством -связывания атома бора с гранью металлокластера, в отсутствии атома водорода у апикальной вершины борного полиэдра); комплекс [Au(PPh3)2][AgB12H12] относится к анионным комплексам Ag(I) общей формулы Cat[MB12Н12], где в качестве катиона выступает комплексный катион дифенилфосфинзолото(I); в [Au9(PPh3)8](В24Н23) кластер золота состоит из девяти атомов и находится в катионной части комплекса, а в качестве противоиона выступает димерный трианион В24Н233-.
Впервые синтезированы анионные и нейтральные комплексы Pb(II) с анионами BnHn2- и производными (B10H10-mXm)2-, в которых реализуются способы связывания, обнаруженные в комплексах M(I).
Проведены обобщения по вопросам многоцентровых связей; вторичных взаимодействий; изомерии координационных соединений металлов с кластерными анионами бора BnHn2-.
Практическая значимость работы. Установленная в работе способность полиэдрических анионов BnHn2- выступать в роли лигандов в координационной химии открывает широкие возможности синтеза на их основе новых классов координационных соединений переходных и непереходных металлов различного состава и строения. Разносторонний подход в синтезе координационных соединений металлов с кластерными анионами бора, а именно: варьирование металла-комплексообразователя (переходный, непереходный металл), степени его окисления (M(I) или M(II)), природы ацидолиганда BnHn2- и нейтральных органических лигандов L, а также разработанные в ходе исследования методы влияния на процесс комплексообразования открывают широкие возможности перспективного практического применения полученных комплексов. Комплексы металлов с кластерными анионами бора могут найти свое применение при создании металломатричных композитов с наполнителями из соединений бора, боридов различных металлов; кроме того, анионы BnHn2- могут быть использованы в качестве хелатирующих лигандов для селективного выделения тяжелых металлов.
Следует отметить, что комплексы с кластерными анионами бора, содержащие в качестве металла-комплексообразователя атомы Cu(I) и Pb(II), были предложены нами в качестве компонентов топливных систем (авторское свидетельство СССР № 317049, 1990).
Апробация работы. Результаты работы в период с 1987 по 2008 гг. докладывались на следующих международных и отечественных конференциях и совещаниях: IV Всесоюзном совещании «Химия гидридов» (Душанбе, 1987), VI Всесоюзном совещании «Спектоскопия координационных соединений» (Краснодар, 1990), V Всесоюзной конференции «Химия гидридов» (Душанбе, 1991), IX International meeting on boron chemistry (Germany, 1996), III Национальной конференции по применению РСНЭ (Москва, 2001), XX-XXIII Международных Чугаевских конференциях по координационной химии (Ростов-на-Дону, 2001, Киев, 2003, Кишинев, 2005, Одесса 2007), European Symposium on Boron Chemistry EUROBORON 2 (France, 2001), International Conference on Boron Chemistry IMEBORON XI, XIII (Moscow, 2002, Spain, 2008), III Национальной конференции по кристаллохимии (Черноголовка, 2003), V Всероссийской конференции по химии кластеров и полиядерных комплексов КЛАСТЕРЫ-2006 (Астрахань, 2006), International Conference on Coordination Chemistry ICCC 37-38 (Cape Town, 2006, Israel, 2008), XVIII Менделеевском съезде по общей и прикладной химии (Москва, 2007).
Отдельные разделы исследования вошли в работы, отмеченные премией им. Л.А.Чугаева РАН за 2006 г., Главной Премией МАИК/Наука 2003 г.
Публикации. Основные результаты работы опубликованы: в 24 статьях в реферируемых отечественных периодических изданиях, 1 статье в сборнике научных трудов, 1 авторском свидетельстве и 27 тезисах докладов всероссийских и международных научных конференций и совещаний.
Личный вклад автора. Автором самостоятельно сформулированы основные задачи, разработаны оригинальные методы синтеза координационных соединений металлов с кластерными анионами бора и выполнен основной объем синтетической части работы, совместно с соавторами проведены физико-химические исследования синтезированных соединений. Автором проанализирован весь массив полученных физико-химических данных синтезированных комплексных соединений, на основании которого предложен механизм протекания процессов комплексообразования и сформулированы особенности координации кластерных анионов бора BnHn2- (n = 10, 12) в комплексах металлов, включающие вопросы многоцентровых связей, вторичных взаимодействий и изомерии, сделаны выводы.
Связь работы с научными программами. Работа проводилась при поддержке Программ Президиума РАН (№8), ОХНМ (№7), РФФИ (проекты 96-03-32674, 99-03-32589, 02-03-32778, 03-03-32531, 05-03-32885, 07-03-00637, 07-03-00552).
Структура диссертации. Работа состоит из введения, пяти глав, включающих проблемы комплексообразования металлов с кластерными анионами бора BnHn2-, а также экспериментальной части, выводов и списка литературы. Диссертация изложена на 270 страницах, содержит 10 таблиц и 61 рисунок. Библиография включает 132 ссылки.
Благодарности. Автор особо благодарен академику Н.Т.Кузнецову за постоянное внимание и научные консультации по вопросам, обсуждаемым в работе. Особо хотелось бы отметить своего первого учителя академика К.А.Солнцева, стоявшего у истоков настоящего исследования.
Экспериментальная работа выполнена при участии к.х.н., с.н.с. В.Н. Мустяцы, к.х.н., н.с. В.В. Дроздовой, ведущих технологов О.О. Вовк и О.Н. Белоусовой, магистра А.Э. Дзиовой.
Автор благодарен к.х.н., с.н.с. И.Н. Поляковой, выполнившей основную часть рентгеноструктурных исследований и к.х.н., с.н.с. Л.В. Гоевой, в соавторстве с которой проанализированы данные спектральных исследований.
Аналитические исследования выполнены в ЦКП ИОНХ РАН к.х.н., с.н.с. Л.И. Очертяновой. Автор выражает искреннюю благодарность сотрудниками лаборатории химии фторидов ИОНХ РАН к.ф-м.н. В.И. Привалову и н.с. Г.А. Разгоняевой за съемку 11B и 11B {1H} ЯМР – спектров, а также д.х.н. К.Ю. Жижину и всем соавторам за участие в выполнении данной работы.
Содержание работы
Введение включает актуальность темы выполняемого исследования, выбор объектов и предмета исследования, определение цели и задач диссертационной работы. По результатам исследования определена научная новизна и практическая значимость работы.
Глава I (литературный обзор) посвящена обзору литературы по теме: «Электронодефицитные кластерные полиэдрические анионы BnHn2- (n = 6-12) и их донорно-акцепторные свойства». В главе обобщены литературные теоретические и экспериментальные данные о строении и особенностях химической связи кластерных анионов бора BnHn2-; проведена оценка современного состояния химии комплексных соединений металлов с клозо-бороводородными анионами BnHn2- и их производными; проанализированы методики синтеза комплексных соединений, подробно рассмотрено строение комплексов.
Глава II. Координационные соединения меди(I) и серебра(I) с клозо-бороводородными анионами BnHn2- (n = 10, 12).
II.1. Синтез и закономерности образования анионных и нейтральных комплексов [MBnHn]- и [M2BnHn] (М = Cu(I), Ag(I); n = 10, 12). В разделе описаны оригинальные методики синтеза комплексов Cu(I) и Ag(I) с декагидро-клозо-декаборатным B10H102- и додекагидро-клозо-додекаборатным B12H122- анионами[1] в качестве лигандов, характеризующиеся высоким выходом и чистотой продуктов. Определены условия образования комплексов состава [M2BnHn] и Cat[MBnHn]. Реакции комплексообразования проводили в воде и ацетонитриле в ряду клозо-боратов с органическими катионами RnNH4-n+ (R = Me, Et, Pr, Bu; n = 0-4), GuH+, AguH+ (Gu = CN3H5, гуанидин; Agu = CN4H6, аминогуанидин), Ph4P+, Ph4As+, (NaphCH2)PhЗP+ (Naph - нафтил) и катионами щелочных металлов Li+ - Cs+.
В водном растворе комплексы Сu(I) первоначально синтезировали по окислительно-восстановительной реакции при взаимодействии хорошо растворимых в воде клозо-декаборатов с солями Cu(II). В этом случае восстановителем в реакции выступал сам анион B10Н102-, что приводило к его частичной деградации и, как следствие, значительному уменьшению выхода образующихся продуктов (не более 50%). В дальнейшем этот метод был модифицирован введением в систему «соль Cu(II)/ анион B10Н102-» восстановителя Na2SO3 (или SO2), что позволило значительно увеличить выход комплексов. Модифицированный способ оказался эффективным для синтеза комплексов Сu(I) с клозо-додекаборатным анионом («соль Cu(II)/анион B12Н122-/Na2SO3(SO2)»), что обусловлено низкой реакционной способностью аниона B12Н122- по сравнению с анионом B10H102-. Необходимо отметить, что по этой методике удается выделить только комплексы состава Cat[CuB12H12] с внешнесферными крупными катионами.
Комплексы Ag(I) в водном растворе получали при взаимодействии растворимых в воде клозо-боратов Cat2BnHn с водным раствором нитрата серебра.
В ацетонитриле комплексы Сu(I) и Ag(I) с анионами B10H102- и B12H122- получали при взаимодействии клозо-боратов Сu(I) или Ag(I) [M2BnHn] с ониевыми клозо-боратами Cat2BnHn.
В результате проведенных реакций были выделены комплексы состава Cat[MBnHn] и [М2BnHn], и установлены закономерности их образования (табл.1).
Таблица 1. Типы комплексов Cu(I) и Ag(I) с анионами BnHn2- (n = 10, 12).
| Металл | cреда реакции | В10Н102- | В12Н122- |
| Комплексы Cu(I) | вода | [Cu2B10H10] [2] Cat(1)[CuB10Н10] | [Cu2B12H12] Cat(3)[CuB12Н12] |
| ацетонитрил | Cat(2)[CuB10Н10] | Cat(4)[CuB12Н12] | |
| Комплексы Ag(I) | вода | [Ag2B10H10] Cat(1)[AgB10Н10] | [Ag2B12H12 ] [3] Cat(3)[AgB12H12] |
| ацетонитрил | Cat(2)[AgB10Н10] | Cat(4)[AgB12H12] |
Cat(1)= RnNH4-n+ (R = Me Bu; n = 2-4), Cs+, AGuH+, K+
Cat(2) = RnNH4-n+ (R = Me Bu; n = 2-4), Ph4P+, Ph4As+, (NaphCH2)PhЗP+
Cat(3) = RnNH4-n+ (R = Me Bu; n = 3-4), Cs+
Cat(4) = RnNH4-n+ (R = Me Bu; n = 3-4), Ph4P+, Ph4As+, (NaphCH2)PhЗP+
В воде или ацетонитриле при мольном соотношении металл/ВnНn2-, равном 1:1, и наличии в растворе крупных катионов (для аниона В10Н102-: ди-, три-, тетраалкиламмония, AguH+, Ph4P+, Ph4As+, (NaphCH2)PhЗP+, K+, Cs+; для аниона В12Н122-: три-, тетраалкиламмония, Ph4P+, Ph4As+, (NaphCH2)PhЗP+, Cs+)) образуются комплексы состава Cat[MBnHn] (M = Cu+, Ag+). При соотношении металл/ВnНn2-, равном 1:1, и присутствии в растворе небольших по размерам катионов (для аниона В10Н102-: Li+, Na+, GuH+, (RхNH4x)+ (R = Me, Et, Pr, Bu, x = 0, 1); для аниона В12Н122-: Li+ - K+, (RхNH4x)+ (R = Me, Et, Pr, Bu, x = 0, 2)) образуются комплексы состава [M2BnHn] (кроме [Cu2B12H12]);
- в воде независимо от размера катиона исходного клозо-бората при соотношении металл/ВnНn2-, равном 2:1, образуются [M2BnHn] (кроме [Cu2B12H12]).
Комплекс [Cu2B12H12] получали только взаимодействием Cu2O c (H3O)2B12H12.
II.2. Строение комплексов [MBnHn]- и [M2BnHn] (М = Cu(I), Ag(I); n = 10, 12).
Информативность колебательных спектров поглощения для синтезированных комплексов позволяет на первом этапе исследований идентифи-цировать тип образующего комплекса [M2BnНn]/Cat[MBnНn], вид основных координационных связей металл–клозо-боратный анион, а также наличие вторичных взаимодействий в случае их образования. Любое изменение состояния аниона BnHn2-, будь то донорно-акцепторное взаимодействие (образование трехцентровых связей) или вторичные взаимодействия с внешнесферным катионом отчетливо проявляется в ИК-спектрах поглощения. Этот факт позволяет данному физико-химическому методу анализа выступать в роли экспресс-метода.
При анализе строения синтезированных в работе комплексов основное внимание будет акцентировано на способе координации кластерных анионов бора к центральному атому металла (ребро, грань или вершина полиэдра) и виде связи металл-борный кластер (M-BnHn2-). Для корректного определения вида связи M-BnHn2- выбраны следующие параметры: длина связей M-B(H), M-H(B) и угол MHB. Сопоставление этих данных позволяет для каждого конкретного случая определить группу атомов, участвующих в образовании связи с металлом.
Согласно описанным выше закономерностям образования комплексов [M2BnHn], из реакционных растворов были получены нейтральные координационные соединения Cu(I) и Ag(I) состава: [Cu2B10H10]2(1), [Ag2(ДМФА)В10Н10](2), [Cu2(NCCH3)4B12H12](3) и [Ag2(NCCH3)2B12H12][4]
(4).
Комплексы 1 и 4 известного строения представляют собой полимеры. В комплексе 1 каждый анион В10Н102- координирован к четырем атомам меди, расположенным над апикальными ребрами полиэдра за счет образования трехцентровых двухэлектронных связей (3ц2е) (CuHB), в комплексе 4 семь из 12 ВН-групп икосаэдра принимают участие в образовании 3ц2е-связей (AgHB), образуя трехмерный каркас.
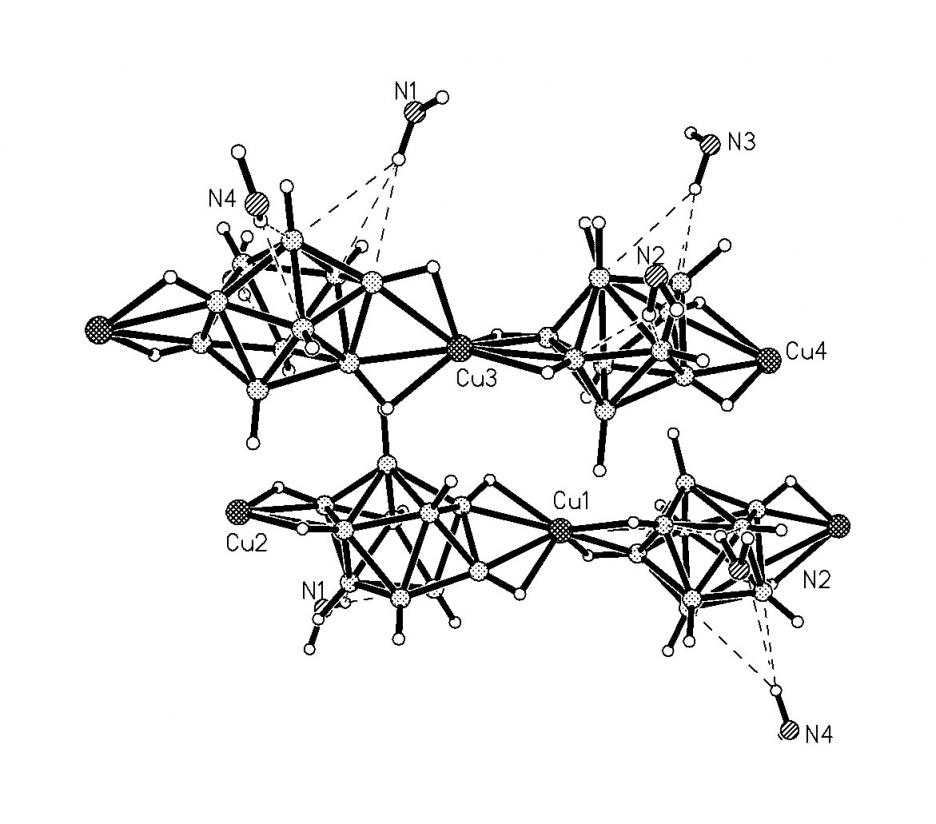
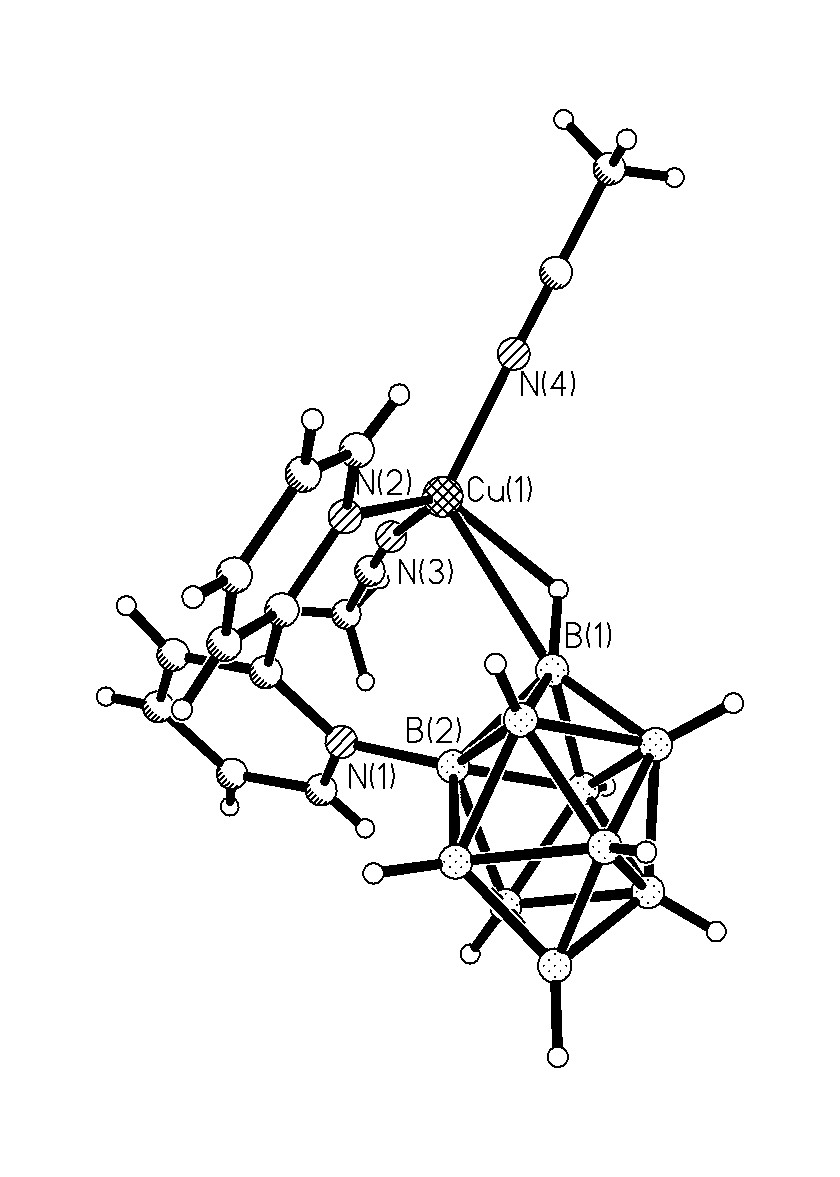
Строение комплекса [M2B10Н10]-типа для Ag(1) определяли по данным РСА монокристалла [Ag2(ДМФА)(В10Н10)] 2, выделенного из ДМФА. Следует отметить, что для комплексов [M2B10Н10], выделенных из органических растворителей, в структуре могут присутствовать молекулы растворителя L, т.е. образуется комплекс состава [M2LnB10Н10] (n = 1-4). Кристалл соединения 2 имеет каркасное строение (рис. 1). Элементарная ячейка содержит четыре независимых атома Ag, два аниона В10Н102- и две молекулы ДМФА. Координационное число всех четырех атомов серебра равно 4+2, в качестве координирующихся лигандов выступают и анионы В10Н102-, и молекулы ДМФА. В структуре 2 лиганды В10Н102- имеют большую координационную емкость. Восемь из десяти ВН-групп участвуют в координации к атомам Ag(I). Два независимых аниона В10Н102- образуют связи с пятью атомами Ag, используя одинаковый набор координирующихся ребер: ребра В(1)-В(5) и В(10)-В(7) образуют по две прочные связи, В(4)-В(8) и В(10)-В(8) – по две слабые связи, В(2)-В(6) – прочную и слабую связи. Ребро В(14)-В(18), в отличие от В(4)-В(8), образует две прочные связи. Следует отметить, что как в основных, так и в дополнительных взаимодействиях участвуют атомы и бора, и водорода, о чем свидетельствуют расстояния Ag-B(H) – 2.469(1)-2.70(1) (2.89(1)-3.25(1) ); Ag-Н(B) – 1.88-2.27 (2.42-2.74 ) и углы AgНВ – 87-116 (90-118), соответственно.
а) б)
б)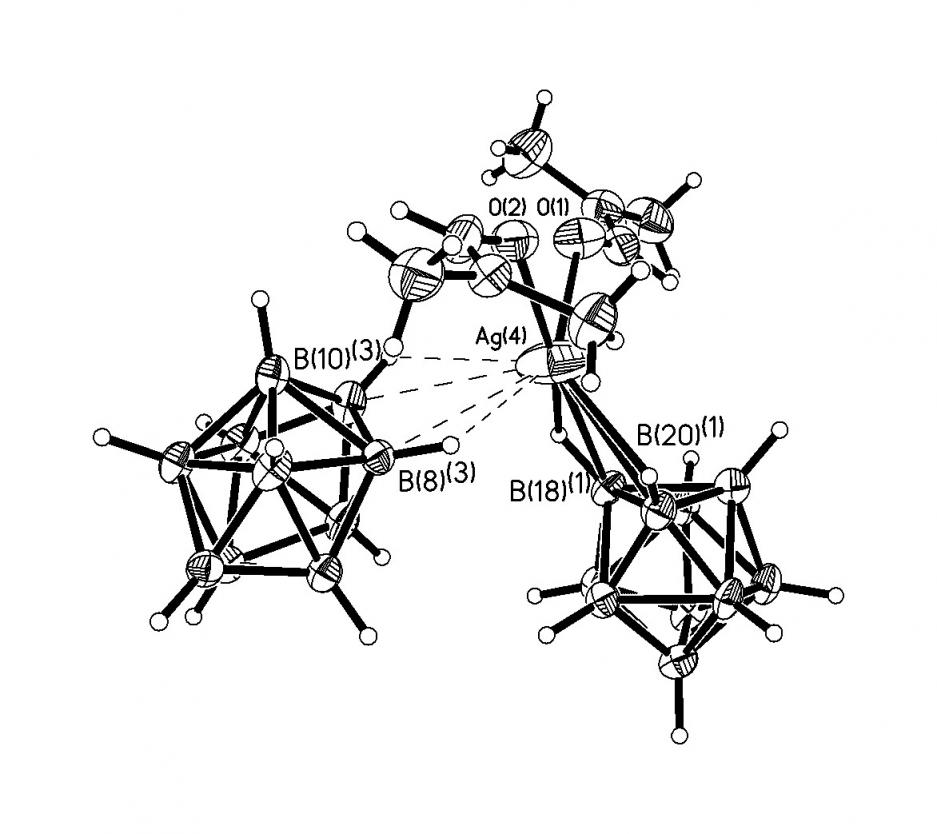 в)
в)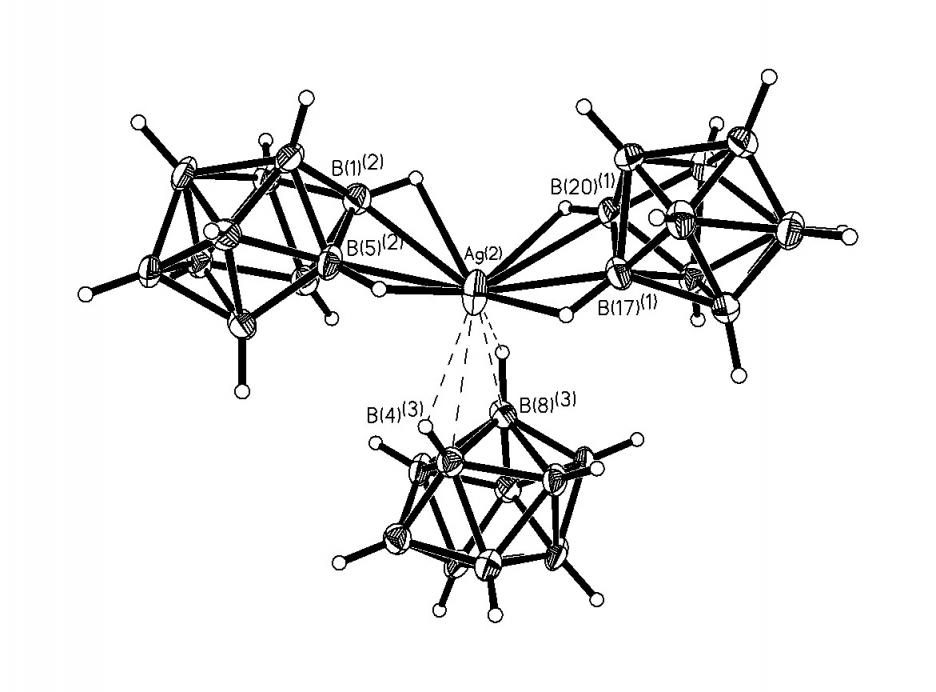 г)
г)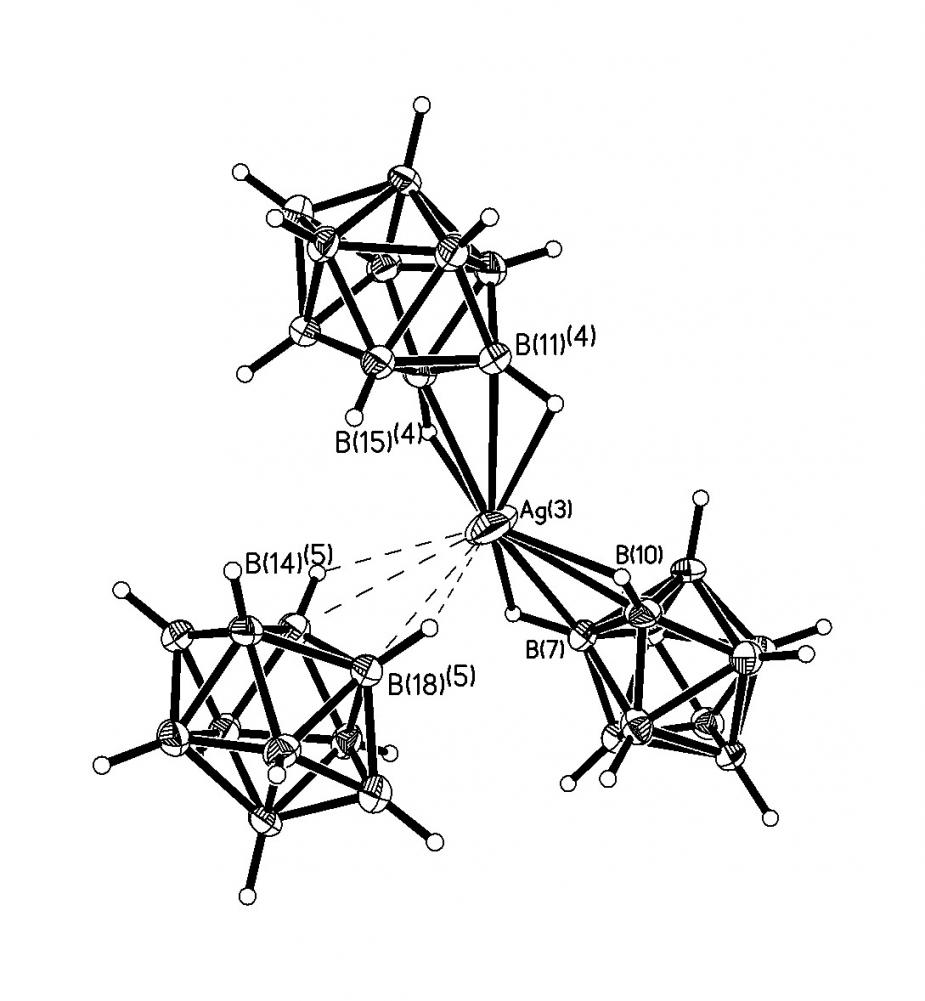
Рис. 1. Окружение атомов серебра Ag(1) (а), Ag(4) (б), Ag(2) (в), Ag(3) (г) в структуре [Ag2(ДМФА)B10H10].
 |
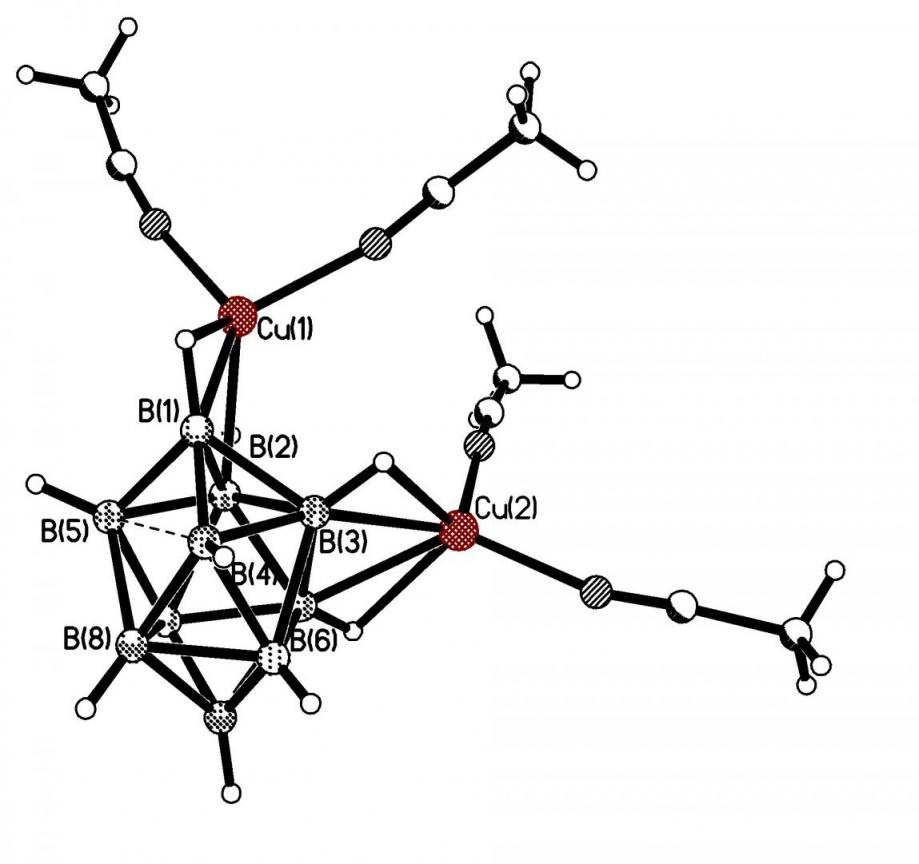
| Рис. 2. Фрагмент кристаллической структуры [Cu2(NCCH3)4B12H12]. |
Комплекс [Cu2(NCCH3)4B12H12] 3 был получен только при взаимодействии Cu2O c (H3O)2B12H12 с обязательной последующей перекристаллизацией из ацетонитрила. В комплексе 3 дискретного строения искаженное тетраэдрическое окружение иона Cu+ образуют атомы N(1) и N(2) молекул ацетонитрила и ВН-группы аниона В12Н122- (рис. 2). Длины связей Cu-N составляют 1.967(3) и 1.948(3). Связывание клозо-додекаборатного аниона с металлом происходит по центросимметричным ребрам икосаэдра за счет образования 3ц2е-связей (CuHB). В координации участвуют атомы бора и водорода, чему соответствуют расстояния Сu-B(Н) 2.288(3), 2.351(4), Сu-Н(B) 1.86, 1.95 и углы СuНB 87-102.
При координация анионов BnНn2- к металлам с образованием трехцентровых связей MHB в ИК-спектрах комплексов [M2BnHn]-типа появляется новая дополнительной уширенной полоса в интервале 2140-2350 см-1, относящаяся2 к (BH)(МНВ) (в спектрах исходных солей Cat2BnHn каких-либо полос поглощения в указанном интервале не наблюдается). Наличие дополнительной полосы в указанной области обусловлено понижением частоты валентных колебаний ВН-групп (BH), анионов BnНn2- в результате образования 3ц2е-связей, при этом зависит от центрального атома металла и хорошо коррелирует с длинами связей М-В и М-Н в комплексах. Полоса валентных колебаний ВН-связей, не участвующих в донорно-акцепторных взаимодействиях, в спектрах комплексов повышается по сравнению с таковой в спектрах исходных солей Cat2BnHn на ~ 50 см-1. Наличию в комплексе 2 координированной молекулы ДМФА соответствует полоса (C=O) при 1675 см-1, на присутствие молекул CH3CN в составе комплексов 3 и 4 указывают полосы (CN) при 2308 и 2277 см-1. Отсутствие в ИК-спектрах 1-4 полос поглощения (NH) и (CH), относящихся к колебаниям исходных ониевых катионов позволяет надежно идентифицировать тип образующегося комплекса – [M2BnHn] (таблица 2).
Таблица 2. Отнесение колебательных частот (BH) см-1 анионов BnHn2- (n = 10, 12) в солях и комплексах Cu(I) и Ag(I).
| соединение | (BH) | (BH)(МНВ) | * |
| [Cu2B10H10] 2 (1) | 2565, 2539, 2512 | 2144 | ~350 |
| [Ag2(ДМФА)В10Н10] (2) | 2556 | 2324 | ~150 |
| [Cu2(NCCH3)4B12H12] (3) | 2516, 2501, 2494, 2479 | 2206 | ~260 |
| [Ag2(NCCH3)2B12H12] 4 (4) | 2481 | 2338 | ~130 |
| Na2B10H10 | 2525**, 2465** | - | - |
| Na2B12H12 | 2470** | - | - |
**2525 - (BH)а, **2465 - (BH)э; * по сравнению с ИК- спектрами Na2BnHn.
II.3. Строение комплексов Cat[MBnHn] (М = Cu(I), Ag(I); n = 10, 12; Cat+ - катионы щелочных металлов и ониевые катионы). Исследование процессов комплексообразования Cu(I) и Ag(I) в присутствии клозо-боратов щелочных металлов Li+-Cs+ показало, что комплексы состава Cat[MB10Н10] удается выделить с катионами K+ и Cs+ в случае Cu(I): К[CuB10H10] и Cs[CuB10H10] (5), а в случае Ag(I) - только с катионом цезия Cs[AgB10H10] (6). Для аниона B12H122- комплексы Cu(I) и Ag(I) образуются только с Cs+: Cs[CuB12H12] (7) и Cs[AgB12H12] (8).
Структура комплекса 5 построена из катионов Сs+ и анионных цепочек ([CuB10H10]-)n (рис. 3а). Атомы Сu+ имеют тетраэдрическое окружение из четырех пар атомов В-Н от двух анионов B10H102-. С одним атомом Cu(I) анион В10Н102- связан по апикальному ребру В(1)-В(2), с другим – по экваториальному ребру В(3)-В(7). Связывание М-BnНn2- происходит по ребрам за счет образования трехцентровых связей (CuHB). Во взаимодействии участвуют атомы бора и водорода, расстояния Сu-B(H) 2.159(3)-2.287(4), Сu-Н(B) 1.90-2.10, углы СuНB 85-90°. Прочную связь (2.159(6) ) атом Cu(I) образует с апикальной группой, слабую (2.287(6) ) - с экваториальной. Окружение атомов Cs+ составляют 12 симметрически связанных атомов Н от четырех анионов В10Н102-; расстояния Cs-H(В) находятся в пределах 2.96-3.44.
а)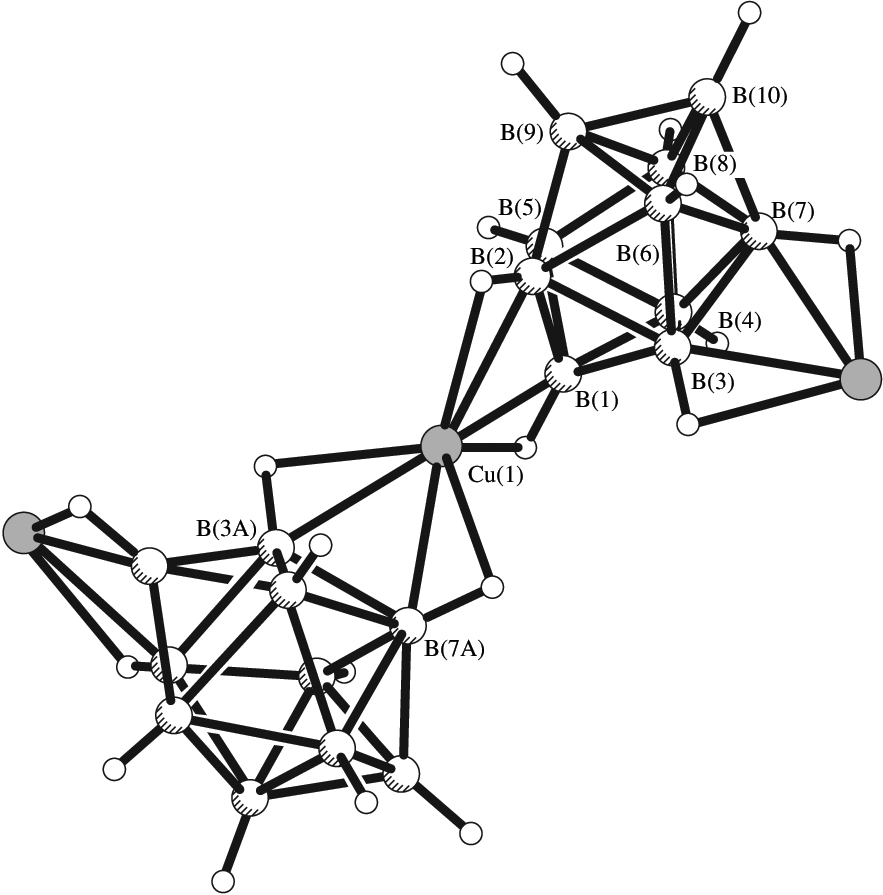 |
б) |
| Рис. 3. Фрагмент цепочки {Cs[CuB10H10]}n(а), {Cs[AgB10H10]}n(б). |
Структура комплекса 6 построена из анионных слоев, образованных цепочками [(AgB10H10)-]n, между которыми располо-жены атомы Cs+. Фрагмент структуры показан на (рис. 3(б)). В координации участвуют апикальные ребра В(1)-В(3) и В(1)-В(5), объединяющие атомы Ag(1) и полиэдры В10Н102- в зигзагообразные цепоч-ки (Ag-B(Н) (2.645(4) и 2.593(6), Ag-Н(В) 1.94-2.41, углы AgНB 89-118°). За счет двух дополнительных взаимодействий с группами В(5)-Н(5) соседних анионов (Ag-B(Н) 3.183(6) и 3.337(6) ) цепочки объединены в слои. Атом Cs(1) окружен 13 атомами Н от шести полиэдров соседних слоев, расстояния Cs-H(В) находятся в пределах 3.21-3.52.
Сравнивая строение однотипных поли-мерных комплексов {Cs[МB10H10]}n (М = Cu(I) (5), Ag(I) (6)), следует отметить, что координация M-ВnНn2- в обоих структурах реализуется за счет 3ц2е-связей (MHB). В комплексе 5 атом Cu(I) связан с анионом В10Н102- по апикальному и экваториальному ребрам, при этом в мономерном фрагменте цепи реализуется координация «вершина-пояс», что обуславливает изгиб полимерной цепи. В аналогичном комплексе 6 координация аниона по экваториальному ребру не реализуется. Связывание осуществляется по ребрам, находящимся при одной вершине полиэдра. В результате чего координация «вершина-вершина», приводит также к изгибу полимерной цепи.
Сравнительный анализ ИК-спектров комплексов 5 и 6 также показал различие в их строении. В ИК-спектре комплекса 5 присутствует сильно расщепленная полоса (ВН) с максимумами при 2551, 2542, 2531, 2518, 2510, 2489, 2467, 2457 см-1, и две уширенные полосы (ВН)(МНВ) около 2158 и 2286 см-1. В спектре комплекса 6 наблюдается полоса (ВН), расщепленная на две компоненты с максимумами при 2470 и 2430 см-1, и уширенная полоса (ВН)(МНВ) при 2340 см-1.
В ИК-спектрах комплексов 7 и 8 в области валентных колебаний присутствуют: интенсивная полоса (ВН) при 2465 см-1 и (ВН)МНВ при 2278 см-1 для комплекса 7, а также 2477 см-1 и 2336 см-1 для комплекса 8, соответственно. В области колебаний (ВВН) в спектрах обоих соединений сохраняется узкая полоса при 1075 см-1.
Среди комплексов состава Сat[МBnHn] с ониевыми катионами наибольший интерес представляют соединения с алкиламмониевыми катионами, содержащими NH- и NH2- группы. Ранее при изучении строения клозо-боратов алкиламмония (RnNH4-n)2BnHn (R = Me, Et, Pr, Bu; n = 0-4) нами было обнаружено, что катионы, содержащие NH- или NH2-группы участвуют во взаимодействиях с бороводородными анионами. Как оказалось, при образовании комплексов металлов с кластерными анионами бора и алкиламмониевыми катионами эти взаимодействия сохраняются. В результате на состояние бороводородных анионов в комплексах оказывают влияние с одной стороны, ионы металла-комплексообразователя, а с другой – катионы, содержащие NH- или NH2-группы.
 |
| Рис. 4. Фрагмент кристаллической структуры {(CH3)2NH2[CuB10H10]}n. |
Изучение строения комплексов Cat[МB10H10]- типа проводили на примере комплексов Cu(I) и Ag(I) с катионами ди-, три- и тетраалкиламмония: {Et2NH2[CuB10H10]}n (9), {Et3NH[CuB10H10]}n (10), {Et3NH[AgB10H10]}n (11) и {(Pr4N)[Ag(B10H10)]}n (12).
В структуре 9 (рис. 4) катионы Cu(I) и полиэдрические анионы образуют цепочку ([CuB10H10]-)n, в которой окружение каждого иона Cu+ образуется за счет четырех пар ВН-групп от двух анионов B10H102-. При этом атомы Cu+ связаны с борным полиэдром по апикальным ребрам B1-B2 и B7(8)-B10, за счет образования 3ц2е-связей (MHB). Расстояния Cu-B(Н) составляют 2.130(7)-2.283(8), Сu-Н(B) 1.90-2.10, углы СuНB 85-90°. Катионы Et2NH2+ расположены между анионными слоями, NH2-группы участвуют во вторичных взаимодействиях, межмолекулярные контакты (Н)N…B(Н) и (N)Н…H(B) составляют 3.30(1)-3.75(1) и 2,04-2,07, соответственно.
Комплекс 10, состоит из анионных цепочек [(CuB10H10)-]n, форма которых определяется чередованием связей атома Cu(I) с апикальным ребром B1-B2 и экваториальным ребром B3-B7 за счет образования 3ц2е-связей (МHB) (Cu-B(H) 2.172-2.234(I), Cu-H(B) 1.82-1.95, CuHB 85-96°) (рис. 5(а)). Катион Et3NH+ участвует с анионом В10Н102- во вторичных взаимодействиях ((N)H…B(H) 2.47(5)-2.82(5), (N)H…H(B) 2.20(6)- 2.92(6) ).
В аналогичном комплексе Ag(I) 11 каждый атом Ag(I) окружен тремя клозо-декаборатными анионами, координация анионов осуществляется двумя типами ребер. Два аниона координируются к атомам металла по апикальным ребрам B1- B2 и B7-B10 за счет образования 3ц2е-связей (MHB). Третий анион – ребром, соединяющим два экваториальных пояса B3-B6 (рис. 5(б)). Расстояния Ag-B(H) находятся в интервале 2.561(5)-2.907(5), Ag-H(B) 1.82-1.95, AgHB 85-90°.

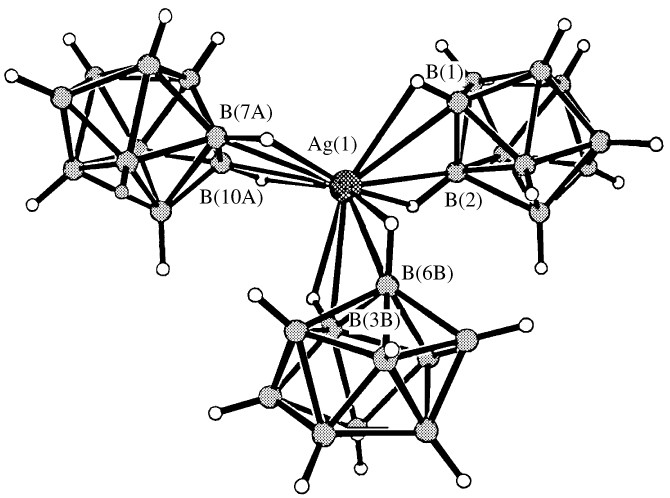
Рис. 5. Фрагмент структуры {(C2H5)3NH[CuB10Н10]}n(а), {(C2H5)3NH[AgB10H10]}n (б).
Третичный аммониевый катион, находящийся в составе комплекса, участвует во вторичных взаимодействиях, расстояния (H)N…H(B) составляют 2.3-2.5.
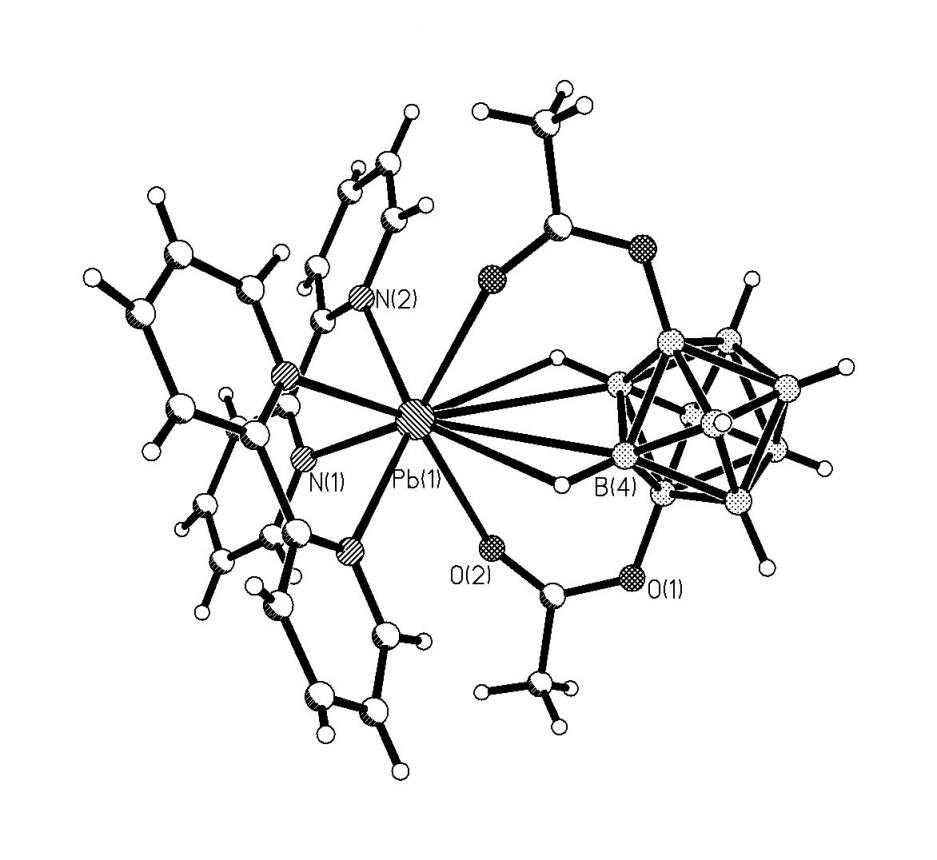
В комплексе 12 к каждому атому Ag(1) клозо-декаборатные анионы координируются асимметрично апикальными гранями полиэдра В(1)В(2)В(3) и В(10)В(9)В(6) (рис.6). Асимметрия заключается в смещении атома Ag(1) в сторону апикальных ребер В(1)-В(2) и В(9)(1)-В(10)(1), так что связи Ag(1)-В(3) и Ag(1)-В(6)(1) (2.761(4) и 2.618(4) ) существенно ослаблены по сравнению с остальными связями Ag(1)-В(Н) (2.424(4)-2.484(4) ). Судя по длинам связей Ag(1)-H(B) (2.16(4)- 2.61(4) ), атомы В(1), В(2), В(6), В(9) и В(10) входят в окружение металла вместе с атомами Н, связанными с ними. Углы Ag(1)HВ составляют 83о-95(2)о. Расстояние Ag(1)…H(3) (2.81(4) ) и угол Ag(1)H(3)B(3) (76(2)o) свидетельствуют о том, что атом Н(3) не участвует в координации Ag(1).
В ИК-спектрах присутствие органического катиона, содержащего NH- и NH2- группы в комплексах, проявляется в виде полного набора полос, относящихся к валентным и деформационным колебаниям соответствующих органических групп; координация клозо-боратных анионов к атому металла подтверждается наличием в спектрах полос (ВН)МНВ в интервале около 2350-2200 см-1. Взаимодействие координированного аниона BnHn2- с алкиламмониевым катионом приводит к расщеплению полосы (ВН) с одновременным понижением (NН) (~100 см-1). Сравнение проводили относительно (NН) соответствующих хлоридов (R3NH)2Cl.
В ИК-спектрах анионных комплексов металлов с четвертичными ониевыми катионами расщепления полосы валентных колебаний связей ВН, (BН) ~ 2480 см-1 не наблюдается. Наряду с указанной полосой в спектре комплексов присутствует уширенная полоса средней интенсивности (ВН)(МНВ) в интервале 2350-2150 см-1.
Строение комплексов состава Cat[MB12H12] проанализировано на примере комплекса {(CH2Naph)PPh3[Ag(B12H12)]}n (13), полученного из ацетонитрила. Кристаллы 13 построены из анионных цепочек [Ag(B12H12)-]n и катионов (CH2Naph)Ph3P+ (рис. 7). Атом Ag(1) имеет искаженное тетраэдрическое окружение из двух пар групп ВН, связанных ребрами B(1)-B(2) и B(7)-B(8). Интервал длин связей Ag-B(H) составляет 2.474(6)-2.580(6). Группы В(6)-Н и В(10)-Н образуют контакты с атомом Ag(1) (Ag(1)…B(6) 2.880(5), Ag(1)…H(6) 2.76, Ag(1)…B(10) 2.780(7), Ag(1)…H(10) 2.60 ), которые можно рассматривать как проявление дополнительного взаимодействия между металлом и борным
 |
| Рис.6. Фрагмент структуры комплекса {(Pr4N)[Ag(B10H10)]}n. |
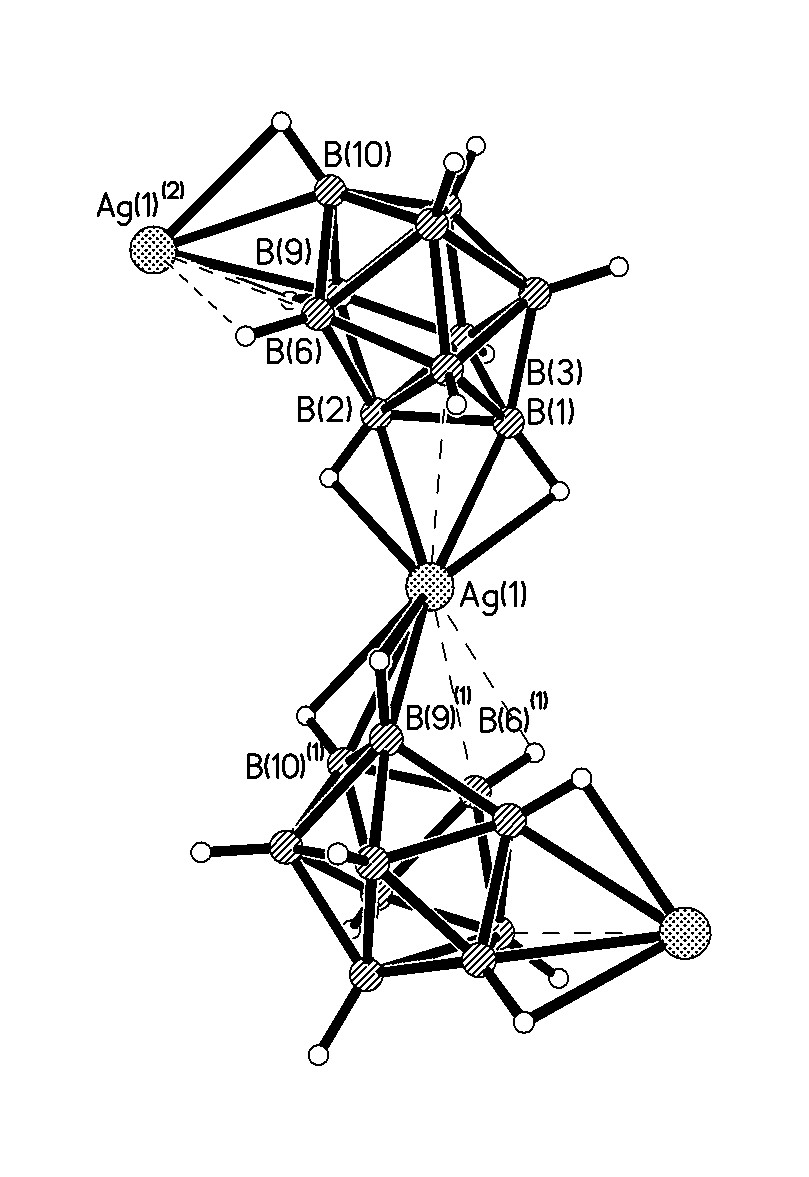
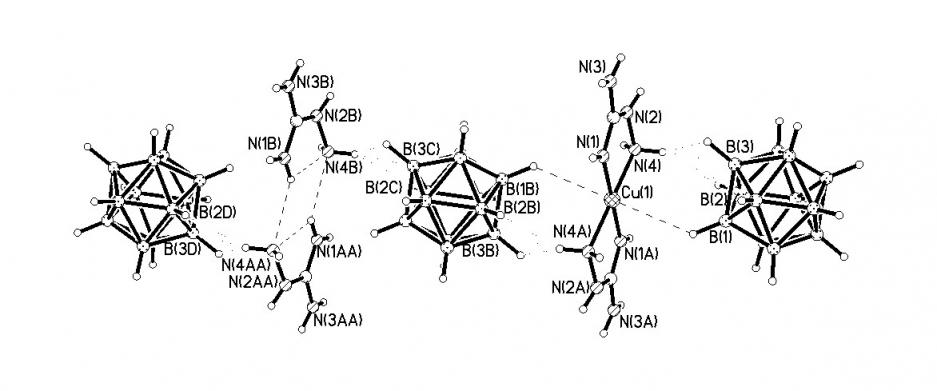
остовом, что приводит к асимметричной координации полиэдрического аниона гранями. В структуре 13 в координации атомов серебра участвуют ВН-группы двух симметрически эквивалентных ребер каждого икосаэдра: в анионе A1 – ребра В(1)-В(2) и В(9)-В(12), в A2 – ребра В(1)-В(2) и В(3)-В(7). Центросимметричный анион А1 обеспечивает линейность фраг-ментов цепи A2-Ag(1)-A1-Ag(1)-A2. В анионе А2 четыре координирующиеся вершины расположены компактно, они образуют две треугольные грани, что определяет резкий изгиб цепочки. Зигзагообразные цепочки образуют слои, между которыми располагаются катионы (CH2Naph)Ph3P+.
![Строение полимерной цепочки [Ag(B12H12)-]n в структуре-11](/images1/277297/stroenie-polimernoy-cepochki-agb12.png) |
| Рис.7. Строение полимерной цепочки [Ag(B12H12)-]n в структуре {(CH2Naph)Ph3P[Ag(B12H12)]}n |
II.4. Синтез и строение комплексов Cu(I) и Ag(I) с BnHn2- (n = 10, 12) в системе СH3СN/CF3COOH. Самостоятельным направлением исследования является изучение реакций комплексообразования Cu(I) и Ag(I) в условиях протонирования кластерных анионов бора. Известно[5], что анион В10Н102- в системе CH3CN/CF3COOH подвергается протонированию с образованием высокореакционной частицы В10Н11-. В растворе дополнительный атом водорода (протон) аниона В10Н11- мигрирует вокруг апикальной вершины клозо-декаборатного аниона, в каждый момент времени находясь над одной из граней борного остова. Проведение реакций комплексообразовани в системе СH3СN/CF3COOH предполагает наличие в реакционной среде одновременно протонов H+ и катионов M+ (Cu(I) или Ag(I)), что в свою очередь обусловливает протекание конкурирующих процессов: с одной стороны процесса протонирования анионов BnHn2-, с другой – комплексообразования. Комплексы Cu(I) и Ag(I) в системе СH3СN/CF3COOH получали по схеме:
[Cu2В10Н10] [Cu2(NCCH3)4B10H10]
CH3CN/CF3COOH(1:1)
[Cu2В10Н10] + [Ag2В10Н10] [Cu(NCCH3)3][AgB10H10]
CH3CN/CF3COOH(1:1)
В дискретном комплексе [Cu2(NCCH3)4B10H10] (14) (рис. 8) анион В10Н102- координируется к одному атому Cu(I) по апикальному ребру B1-B2, а к другому – по ребру, соединяющему два экваториальных пояса B3-B6, за счет образования 3ц2е-связей (MHB) (Cu-B(H) 2.25(2)-2.29(2), Cu-H(B) 1.82-1.95, CuHB 109°). Кроме того, анион В10Н102- существенно искажен со стороны вершин, не участвующих в координации к металлу. Апикальные ребра противоположной вершины полиэдра сильно укорочены (1.50(2) и 1.55(2) ), связь B4-B5 фактически разорвана (2.10(3) ), а фрагмент B1-B4-B5-B8 уплощен (перегиб по линии B4-B5 составляет 13.6°). Для сравнения: параметры аниона В10Н102- обычной геометрии: короткие ребра Ва-Вэ (1.693 - 1.741 ); длинные – в основаниях тетрагональных пирамид Вэ-Вэ (1.806-1.839 ); ребра промежуточной длины располагаются между двумя пирамидами Вэ-Вэ (1.787-1.799 ).
 |
| Рис. 8. Строение комплекса [Cu2(NCCH3)4B10H10]. |
Следует отметить, что соединение 14 является одним из примеров комплекса с анионом В10Н102- необычной геометрии, что впервые было обнаружено нами. В анионе В10Н102- установлено наличие одной четырехугольной грани. Такой вариант геометрии в анионе В10Н102- был рассчитан ранее[6] и предложен в качестве модельного для протонированного аниона В10Н11-. Соединение {[Cu(NCCH3)3][AgB10H10]}n (15), полученное в тех же условиях можно рассматривать как комплекс Ag(I) Cat[МB10H10]-типа. Кристаллы 15 построены из анионных цепочек [AgB10H10-]n и комплексных катионов [Cu(NCCH3)3]+ (рис. 9). Координация трех независимых анионов В10Н102- к атому Ag+ осуществляется двумя ребрами при четырехугольных гранях B(1)-B(2) и B(1A)-B(2A) (от двух анионов) и ребром, общим для двух четырехугольных граней (B(5)-B(5A) от третьего полиэдрического аниона. Длины связей Ag-B(2), Ag-B(1) и Ag-B(5) составляют 2.547(7), 2.656(8) и 2.758(9), соответственно.
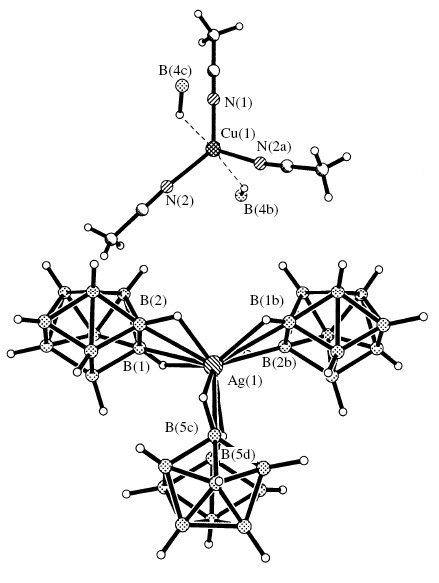 |
| Рис. 9. Фрагмент структуры {Cu(NCCH3)3][AgB10H10]}n. |
Плоскотригональное окружение иона Cu+ образуют атомы N молекул ацетонитрила (Cu-N 1.922(9) и 1.939(7) ). Два удлиненных контакта с группами B(4)-H(4) дополняют координацию иона Cu+ до тригонально-бипирамидальной (Cu-B(H) 3.319(7), Cu-H(B) 2.40(7), угол CuHB 141°), формируя слои. Структура комплекса 15 интересна тем, что в ней реализуется необычная геометрия клозо-декаборатного остова, который сильно искажен. Ребра, участвующие в координации к металлу, укорочены до 1.57(2)-1.63(2). Связи B(2)-B(5) и B(2A)-B(5A) разорваны (2.34(2) ), фрагменты B(1)B(2)B(5A)B(5) и B(1A)B(2A)B(5)B(5A) уплощены (среднее отклонение четырех атомов от их общей плоскости - 0.002 ; перегиб 0.5°).
Необычная искаженная геометрия аниона В10Н102- в 15, как и в случае комплекса 14, обусловлена присутствием в реакционном растворе ТФУ.
Протонирование аниона B12H122-, согласно теоретическим расчетам[7], сопровождается цепочкой превращений. Первоначально образуется коротко-живущий анион B12H13-, который с отщеплением водорода переходит в более устойчивую форму – анион B12H11-. Образовавшийся анион B12H11- в дальнейшем реагирует с клозо-додекаборатным анионом, образуя димер.
B12H122- + H+ B12H13- H2 + B12H11-; B12H122- + B12H11- B24H233-
Изменения в строении комплексов Cat[МBnHn]-типа, в случае аниона B12H122- проанализировано на примерах комплексов {(CH2Naph)PPh3[Ag(B12H12)]}n (13) и {[(CH2Naph)PPh3]2[Ag2(B12H12)2(NCCH3)]}n (16), выделенных из ацетонитрила и системы CH3CN/ТФУ соответственно. Комплекс 16 синтезировали по схеме:
CH3CN/CF3COOH(1:1)
[(CH2Naph)Ph3P]2В12Н12+[Ag2В12Н12] [(CH2Naph)Ph3P]2[Ag2(B12H12)2(NCCH3)]
Кристаллы 16, подобно описанному комплексу 13 (рис. 7), построены из цепочек [(AgB12H12)-]n и катионов (CH2Naph)Ph3P+ (рис. 10). Элементарная ячейка кристалла 16 содержит по два независимых атома Ag+, катиона (CH2Naph)Ph3P+ и
аниона B12H122-, а также одну молекулу CH3CN. В окружение атомов Ag(1) и Ag(2) входят по две пары групп ВН, связанных общим ребром, от двух симметрически неэквивалентных икосаэдров (A3 и A4). Атом Ag(1) связан также с атомом N(1) молекулы СН3СN, что приводит к удлинению связей Ag(1)-B(Н) (2.584(5) - 2.861(4)) и Ag(1)-Н(B) (2.00-2.56 ) по сравнению с Ag(2)-B(Н) (2.456(4) - 2.815(3) ) и Ag(2)-Н(B) (1.80-2.54 ). Длины двух связей Ag(1,2)-B(Н), образуемых одним анионом B12H122-, существенно неэквивалентны: разница в длинах связей составляет 0.165, 0.204 для А3 и 0.277, 0.379 для А4.
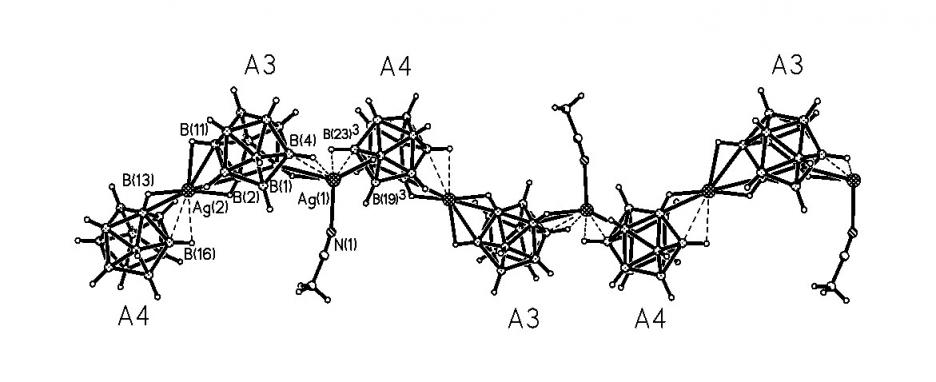 |
| Рис. 10. Строение полимерной цепочки в {[(CH2Naph)Ph3P]2[Ag2(B12H12)2(NCCH3)]}n. |
II.5. Возможные механизмы образования комплексов Cu(I) и Ag(I) с кластерными анионами BnHn2- (n = 10, 12). Обнаруженные в ходе исследования определенные закономерности образования координационных соединений позволили предположить возможные механизмы процессов комплексо-образования Cu(I) и Ag(I) с клозо-боратными анионами в различных средах.
В водном растворе процесс комплексообразования начинается с диссоциации клозо-боратов и образования комплексных анионов состава [МBnHn]- (Cat2BnHn Cat+ + [BnHn]2-; [BnHn]2-+ М+[МBnHn]-);
- при мольных соотношениях М+ : BnHn2- = 1:1 и наличии в растворе крупных катионов образуются малорастворимые в воде комплексные соединения состава Cat[МBnHn] (Cat+ + [МBnHn]- Cat[МBnHn]);
- при мольных соотношениях М+ : BnHn2- = 1:1 и отсутствии в растворе крупных катионов, а также при двукратном избытке металла, независимо от размера катиона исходного клозо-бората выделяются комплексы состава [М2BnHn] (М+ + [МBnHn]- [М2BnHn]).
Анализируя результаты, полученные при исследовании процессов комплексообразования в ацетонитриле следует отметить, что в этих условиях не исключена возможность взаимного замещения лигандов CH3CN - BnHn2-.
Образование комплексов в системе ацетонитрил/ТФУ носит принципиально иной характер по сравнению с процессами, протекающими в воде и ацетонитриле. Оценка очередности протекания конкурирующих процессов, а также степень участия протонированных анионов BnHn+1- в комплексообразовании была проведена на примере протонированной формы аниона B10H102- - ундекагидродекаборатного аниона b10h11-. Были изучены динамические 11B ЯМР и ИК-спектры поглощения для реакционного раствора [Cu2B10H10]/CH3CN/ТФУ. На основании полученных данных установлено, что первоначально наблюдается протонирование клозо-декаборатного аниона (B10H102- + H+ B10H11-) и только потом анион B10H11- вступает в реакцию комплексообразования.
В случае аниона B12H122- можно предположить, что реакции комплексообразования в ацетонитриле и системе CH3CN/ТФУ протекают по-разному, поскольку в последнем случае из реакционного раствора образуются комплексы, строение которых не реализуется в отсутствие ТФУ.
Глава III. Координационные соединения металлов IБ-группы с кластерными анионами BnHn2- (n = 10, 12) и трифенилфосфином Ph3P.
Комплексы, рассмотренные в главе II, представляют собой, как правило, полимерные соединения, где в качестве лиганда выступают в основном кластерные анионы бора. Проявление максимальной дентатности кластерных анионов бора при образовании комплексов полимерного строения приводит к тому, что координация анионов BnHn2- к атомам металла реализуется за счет комбинации различных видов связей M-BnHn2-, что существенно затрудняет определение их характеристик. С целью снижения дентатности полиэдрических анионов и получения комплексов дискретного строения, реакции комплексообразования проводили в присутствии других конкурентноспособных лигандов, например трифенилфосфина и 2,2`-бипиридила - объемных органических молекул, которые соответствуют мягким основаниям по Пирсону.
III.1. Синтез и строение комплексов Cu(I) и Ag(I) с анионами BnHn2- (n = 10, 12) и трифенилфосфином. Комплексные соединения меди(I) и серебра(I) c анионом B10H102- и Ph3P в качестве лигандов получали, варьируя следующие параметры реакции: форма клозо-декаборатного аниона (B10H102- или B10Н11-); форма лиганда (Ph3P использовался как в свободном виде, так и в виде комплексов M(Ph3P)3X (M = Cu(I), Ag(I); X = Cl-, NO3-); температура реакции (комнатная или нагревание до 80 °C); кислотность среды (нейтральная или присутствие ТФУ). В результате проведенных реакций были синтезированы комплексы состава [M2(Ph3P)nB10H10] (M = Cu(I), Ag(I); n = 2, 4) (таблица 2).
Таблица 2. Схемы получения комплексов Cu(I) и Ag(I) c анионом B10Н102- и Ph3P.
| тип реакции | Реагенты | Продукты |
| 1 | (а) Cat2B10Н10 + M(Ph3P)3X | 1-2, 9-10-[M2(Ph3P)4B10Н10] (17) |
| (б) M2B10Н10 + Ph3P | ||
| (в) Cat2B10Н10 + Ph3P + MX | ||
| 2 | CatB10Н11 + Ag(Ph3P)3X | 1-2, 1-4-[Ag2(Ph3P)4B10Н10] (18) |
| 3 | Cat2B10Н10 + Ag(Ph3P)3X, ТФУ/CH3CN(1:1) | 1-2, 5-8-[Ag2(Ph3P)4B10Н10] (19) |
| 4 | Ag2B10Н10 + M(Ph3P)3X, t = 80 °C | [Ag2(Ph3P)2B10Н10]n (20) |
Cat = Ph4P+, Bu4N+, (СH2Naph)Ph3P+; M = Cu(I), Ag(I); X = Cl-, NO3-.
Рентгеноструктурные исследования комплексов 17-19, монокристаллы которых получали из соответствующих реакционных растворов, показали, что во всех соединениях окружение центрального атома идентично. Атом металла (Cu(I) или Ag(I)) находится в квази-тетраэдрическом окружении, образованном ребром клозо-декаборатного аниона и двумя атомами P от двух молекул Ph3P.
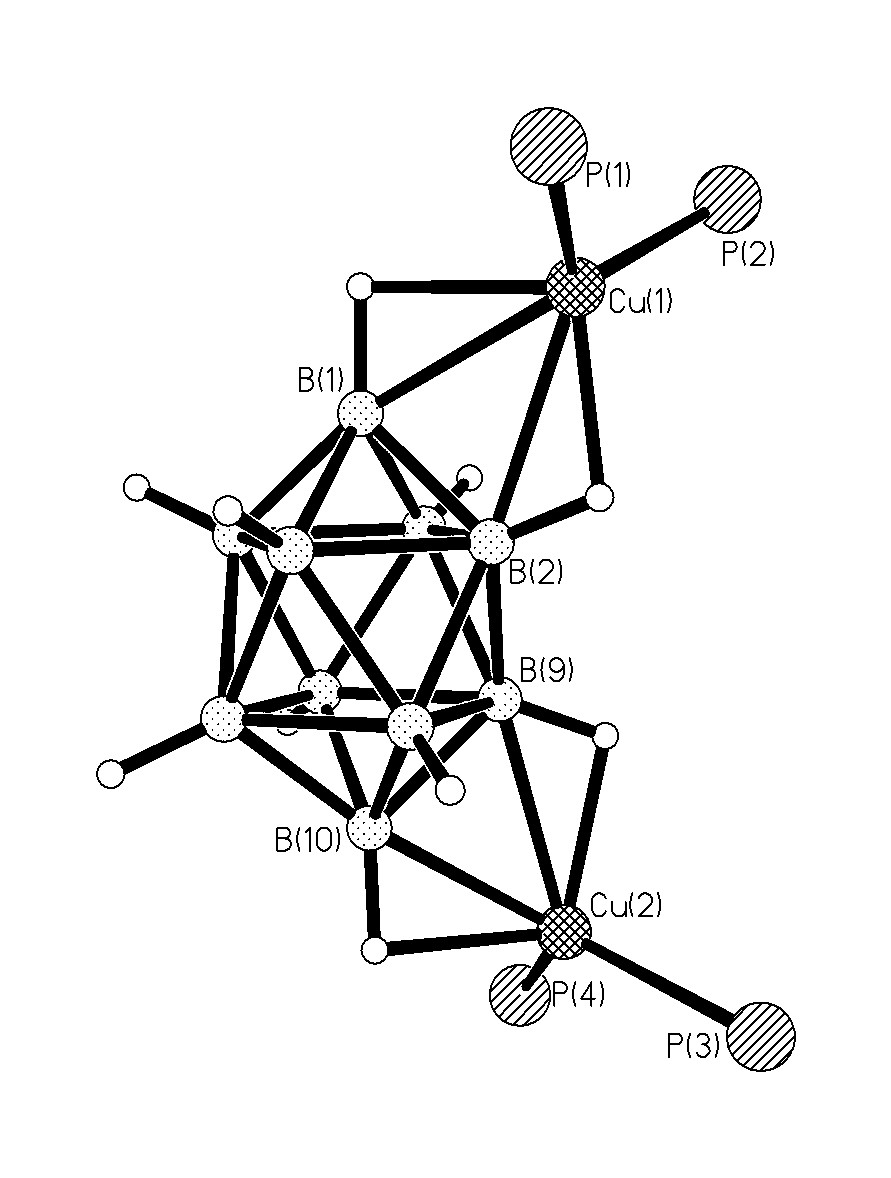 |
| Рис. 11. Строение комплекса 1-2, 9-10-[Cu2(Ph3P)4B10H10]. |
Анион B10Н102- координируется к каждому атому металла за счет образования двух 3ц2е-связей (МНВ).
Особенности строения комплексов 17-19 проявляются во взаимном расположении металла-комплексообразователя относительно клозо-декаборатного аниона. Так по реакции 1, включающей три вида взаимодействий (а-в), во всех случаях образуются комплексы 1-2, 9-10-[М2(Ph3P)4B10H10] (17), в которых координация аниона В10Н102- к металлу осуществляется по апикальным ребрам, находящимся при разных вершинах полиэдра. В комплексах 17 длины связей Cu-B(H) и Ag-B(Н) находятся в интервале 2.260(9)-2.317(9) и 2.561(4)-2.617(4), расстояния Cu-H(B) и Ag-H(В) составляют 1.78-2.05 и 1.97-2.29, соответственно, углы МНВ равны 109-122°.
Следует отметить, что в комплексе [Cu2(Ph3P)4B10Н10] извест-ного строения[8], координация аниона В10Н102- наблюдается по ребрам В1-В2 и В6-В10. Таким образом комплексы 1-2, 9-10 [Cu2(Ph3P)4B10H10] (рис. 11) и 1-2, 6-10 [Cu2(Ph3P)4B10H10] можно рассматривать как зеркальные изомеры.
 |
| Рис. 12. Строение комплекса 1-2, 1-4 [Ag2(Ph3P)4B10H10]. |
По реакции 2 при использовании в качестве исходного реагента ониевых солей ундекагидродекаборатного аниона был получен комплекс 18, в котором координация аниона B10Н102- осуществляется по апикальным ребрам В1-В2 и В1-В4 при одной апикальной вершине борного полиэдра (рис. 12). Длины связей Ag-B(Н) в комплексе находятся в интервале 2.642(3)-2.783(4), Ag-H(В) 2.12-2.55, углы AgНВ составляют 118°. Следует отметить, что клозо-декаборатный анион несколько искажен: связь В(2)-В(3) увеличена и составляет 1.947(10), связь В(5)-B(6) сильно укорочена и составляет 1.543(9). Необычная координация аниона B10Н102- к атому металла с одновременным искажением геометрии координированного аниона возможно обусловлена присутствием в исходном растворе частиц B10Н11-.
По реакции 3 в присутствии ТФУ был получен комплекс [Ag2(Ph3P)4B10H10], в котором координация клозо-декаборатного аниона к металлу осуществляется по апикальному В1-В2 ребру и ребру, соединяющему два экваториальных пояса В5-В8 (рис. 13). Длины связей Ag-B(Н) в комплексе находятся в интервале 2.51-2.80, Ag-H(В) 2.06-2.34, углы AgНВ составляют 103°-112°. Комплекс 1-2, 5-8[Ag2(Ph3P)4B10H10] (19) является одним из немногих примеров, когда координация аниона В10Н102- осущест-вляется в том числе и по ребру, соединяющему два экваториальных пояса.
Суммируя полученные результаты, очевидно, что комплексы Cu(I) и Ag(I) с анионом B10Н102- и Ph3P представляют собой соединения одинакового состава, но различного строения. Клозо-декаборатный анион в [M2(Ph3P)4B10H10] может координироваться ребрами полиэдра при одной апикальной вершине (1-2, 1-4 изомер); апикальным и экваториальным ребром (1-2, 5-8 изомер); или ребрами противоположных апикальных вершин (1-2, 6-10 и 1-2, 9-10 изомеры). Последняя пара соединений является зеркальными изомерами. Подобная позиционная изомерия является новым видом изомерии в координационной химии, свойственна только комплексам с кластерными анионами бора и обусловлена их геометрическим строением.
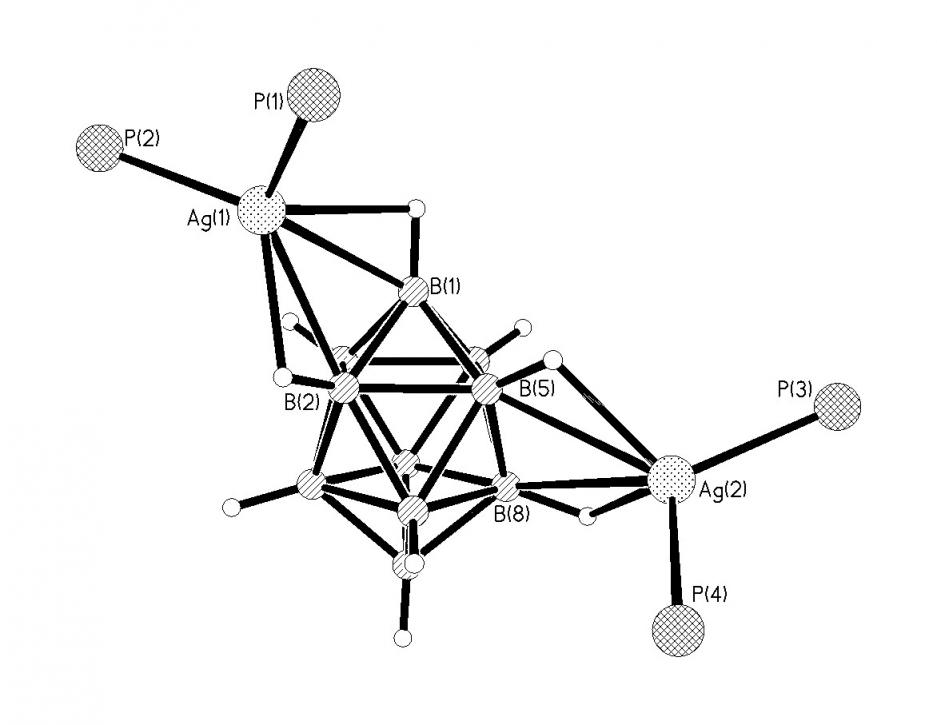 |
| Рис. 13. Строение комплекса 1-2, 5-8 [Ag2(Ph3P)4B10H10]. |
При проведении реакции комплексообразования при t = 80 °C (реакция 4), независимо от катиона металла в M(Ph3P)3X, из реакционного раствора было получено соединение [Ag2(Ph3P)2B10Н10]n (20). Комплекс 20 (рис. 14) имеет полимерное строение, при этом каждый анион образует связи с четырьмя атомами серебра за счет образования 3ц2е-связей (МНВ). Длины связей Ag-B(Н) находятся в интервалах 2.595(8)-2.704(8) и 2.749(7)-2.872(8), Ag-Н(B) 2.08-2.34, угол AgHB составляет 95-113°.
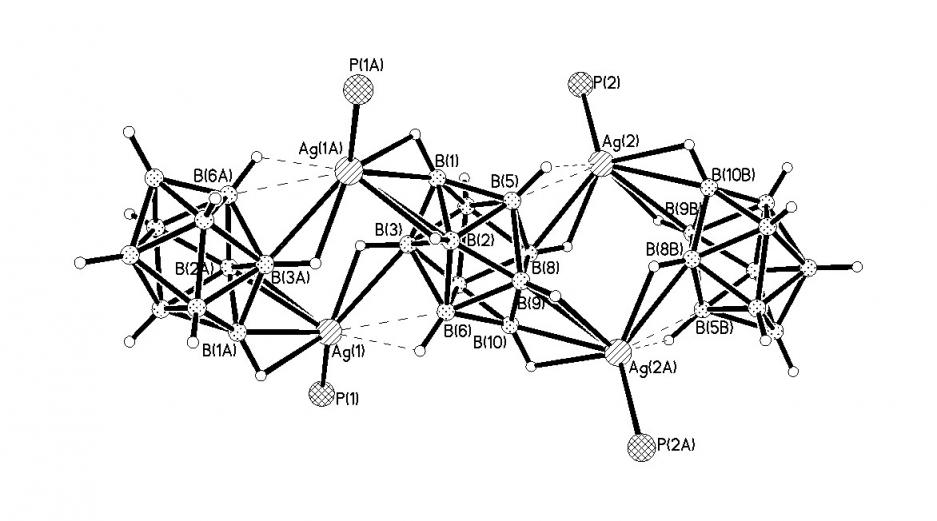 |
| Рис. 14. Фрагмент структуры комплекса [Ag2(Ph3P)2B10Н10]n. |
Координация аниона B10Н102- к двум атомам серебра наблюдается по апикальным ребрам про-тивоположных вершин полиэдра, к двум другими – по противо-положным ребрам, каждое из которых соединяет два эквато-риальных пояса. Каждый атом Ag(I) связан также с молекулой Ph3P.
Смешанолигандные комплексы Cu(I) и Ag(I) c анионом B12H122- и Ph3P синтезировали из клозо-додекаборатов Cat2B12Н12 или [M2B12Н12] с Ph3P или M(Ph3P)3X (M = Cu(I), Ag(I); X = Cl-, NO3-). Методики синтезов представлены в таблице 3. Получены комплексы полимерного [Ag2(Ph3P)2B12Н12]n (22) и дискретного строения [Ag2(Ph3P)4B12Н12] (21), [Cu2(Ph3P)4B12Н12] (23).
Таблица 3. Схемы получения комплексов Cu(I) и Ag(I) c B12H122- и Ph3P.
| тип реакции | Реагенты | Продукты |
| 5 | [Ag2B12Н12] + Ag(Ph3P)3X | [Ag2(Ph3P)4B12Н12] (21) |
| 6 | Cat2B12Н12 + Ph3P + AgX | [Ag2(Ph3P)4B12Н12]n (22) |
| 7 | [Cu2B12Н12] + Cu(Ph3P)3X | [Cu2(Ph3P)4B12Н12] (23) |
| Cat2B12Н12 + Ph3P + CuX |
Cat = Ph4P+, Bu4N+, (СH2Naph)Ph3P+; M = Cu(I), Ag(I); X = Cl-, NO3-
Анализ ИК-спектров комплексов 21-23 свидетельствует о координации аниона B12H122- к центральному атому металла (Cu(I) или Ag(I)), поскольку в спектрах данных соединений в области валентных колебаний связей BH присутствуют как полосы (BH) «свободных» ВН-групп, так и полосы (BH)МBH, координированных. В спектре 21 присутствует интенсивная полоса (BH) при 2515 см-1 и две уширенные полосы (BH)МHB ~2348 и 2290 см-1. В спектре комплекса 22 присутствует интенсивная уширенная полоса (BH)МBH при 2373 см-1 и слабая узкая полоса (BH) при 2539 см-1. Такое распределение интенсивностей указанных полос свидетельствует о том, что большинство ВН-групп участвуют во взаимодействиях с атомами Ag(I), что приводит к образованию комплекса полимерного строения. Данные ИК-спектра 22 хорошо согласуются с изменениями, наблюдаемыми в спектре описанного выше комплекса 20, также имеющего, согласно РСА, полимерное строение.
В случае Cu(I) по реакции 7 образуется комплекс [Cu2(Ph3P)4B12Н12]. ИК-спектр комплекса 23 в области валентных колебаний (BH) и (BH)МHB 2500-2150 см-1 подобен спектру центросимметричного дискретного комплекса [Cu2(NCCH3)4B12Н12] (3), строение которого по данным ИК-спектроскопии и РСА описано в главе II. Такая аналогия, позволяет предположить дискретное строение и для комплекса 23. Следует отметить, что строение центросимметричного дискретного комплекса [Cu2(Ph3P)4B12Н12] известно [9]
.
В результате исследования синтезирован ряд комплексов с клозо-додекаборатным анионом дискретного и полимерного строения 21-23. Как и в случае аниона B10H102-, установлена конкурентоспособность аниона B12H122- в процессе комплексообразования Cu(I) и Ag(I) в присутствии крупных органических лигандов - мягких оснований.
III.2. Координационные соединения Au(I) с анионами BnHn2- (n = 10, 12) и трифенилфосфином. Особенности строения комплексов.
Комплексные соединения золота с анионами BnHn2- и Ph3P были получены при взаимодействии [Au(Ph3P)Cl] с клозо-боратами серебра(I) [Аg2BnHn].
Для клозо-декаборатного аниона независимо от соотношения исходных реагентов комплексообразование в указанных условиях сопровождается окислительно-восстановительной реакцией «соль Au(I)- анион B10H102-». При этом окисление аниона B10Н102- протекает с отщеплением гидридного атома водорода и образованием аниона В10Н9-. При восстановлении Au(I) наблюдается образование металла-кластера Au3.
[Au(Ph3P)Cl] + [Аg2B10H10] АgCl + [1-(Au(Ph3P))3В10Н9] (24)
Ядром комплекса 24 является треугольный фрагмент Au3. Каждый атом Au в металла-кластере связан с двумя другими атомами Au, атомом фосфора молекулы Ph3P и апикальным атомом В(1) полиэдрического аниона В10Н9- (рис. 15). Длины связей составляют: Au-Au 2.7946-2.8504(9), Au-P 2.253-2.281(3), Au-B(1) 2.235-2.262(14). Расстояние от атома В(1) до плоскости Au3 равно 1.548, что сопоставимо с расстоянием от атома Au(I) до грани В3 в комплексе [Au2(-bis-3-B6Н6)(Ph3P)2][10] - 2.10. Один из атомов Au в комплексе 24а образует дополнительную 3ц2е-связь с атомами В(2) и Н(2): Au(3)-B(2) 2.718(14), Au(3)-H(2) 2.52, угол B(2)H(2)Au(3) 88°. Возможность образования связи 3ц2е обусловлено относительным расположением треугольного кластера Au3 над квадратом В(2)-В(3)-В(4)-В(5), при котором только один из атомов золота оказывается приближенным к атому бора В(2). Таким образом, в комплексе 24а связь M-BnHn2- осуществляется в результате прямого взаимодействия апикального атома бора с тремя атомами золота по 3-типу.
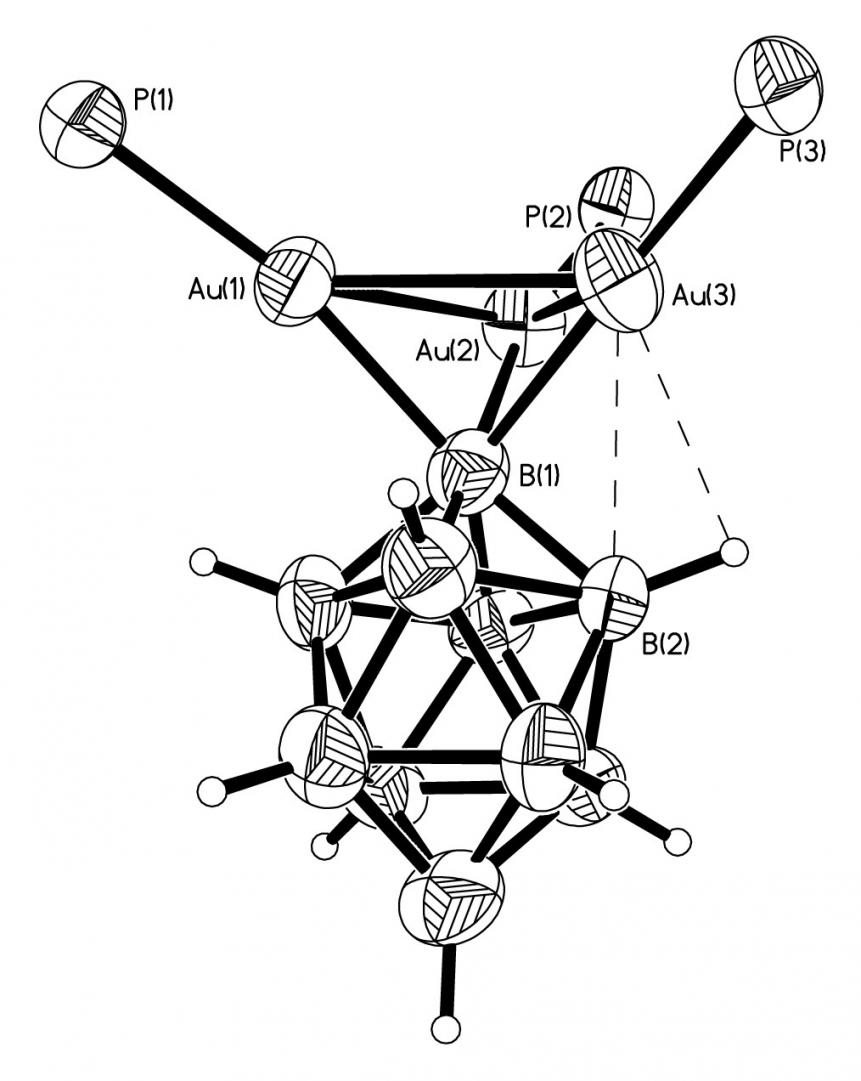  |
| Рис. 15. Фрагмент кристаллической структуры [1-(Au(Ph3P))3В10Н9]. |
В 11B ЯМР спектре комплексного соединения 24 присутствуют четыре сигнала при 0.3, 21.2, 25.2 и 27.9 м.д. с соотношением интегральных интенсивностей 1:4:4:1. В отсутствии широкополосного подавления спин-спинового взаимодействия бор-водород уширенный синглет при 0.3 м.д. не меняет формы сигнала, в то время как остальные сигналы расщепляются в дублеты. Такой вид спектра объясняется отсутствием протона у одной из апикальной вершин аниона В10Н9-, поэтому сигнал при 0.3 м.д. следует отнести к атому бора, связанному с заместителем, каковым является треугольный кластер золота Au3. В ИК-спектрах поглощения 24 наблюдается сильное уширение и расщепление полосы (BH) с максимумами при 2548, 2498, 2485, 2457, 2386 см-1. Низкочастотная полоса с максимумом при 2386 см-1 соответствует колебаниям (BH)МHB трехцентровых связей (AuHB).
При использовании в качестве исходного реагента менее реакционно-способного аниона B12Н122- состав образующихся продуктов реакции зависит от соотношения реагентов. При соотношении B12H122- : Au(I) = 1:1 образуется комплекс [Au(Ph3P)2][AgB12H12]; в избытке Au(Ph3P)Cl протекает окислительно-восстановительная реакция, приводящая к димеризация аниона B12Н122- и образованию кластера золота - Au9, продуктом реакции является комплекс [Au9(Ph3P)8](В24Н23).
Комплекс 25 построен из анионных цепочек [AgB12H12]n- и катионов [Au(Ph3P)2]+ (рис. 16). Атом Ag(1) координирует ребро В(1)-В(2) одного аниона B12H122- и грань В(9)В(10)В(12) другого. Длины связей Ag-B(Н) равны: Ag(1)-В(1) (2.498(11) ), Ag(1)-В(2) (2.630(13) ), Ag(1)-В(12) (2.528(11) ), Ag(1)-В(10) (2.614(11) ) и Ag(1)-В(9) (2.738(11) ). Координация атома Au(1) близка к линейной: угол P(1)AuP(2) 170.91(7)o; Au-P 2.338(2) и 2.341(2).
В ИК-спектре комплекса 25 в области (BH) 2500-2200 см-1 наблюдается картина, типичная для ИК-спектров анионных комплексов Ag(I) с В12Н122-: полоса (BH) при 2488 см-1 и две полосы (BH)МHB трехцентровых (AgНВ) связей, 2123 и 2361 см-1.
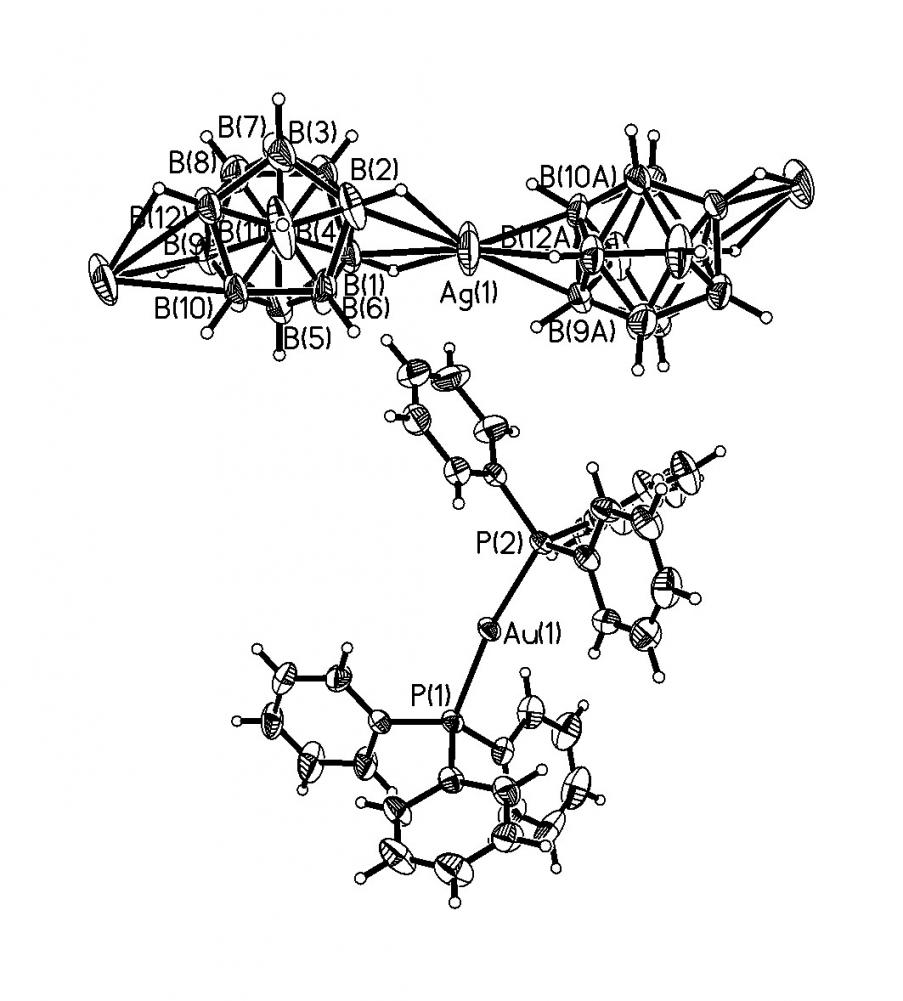 |
| Рис. 16. Фрагмент кристаллической структуры {[Au(Ph3P)2][AgB12H12]}n. |
По данным РСА в составе комплекса 26 (рис. 17) присутствует кластер [Au9(Ph3P)8]3+, находящийся в катионной части (рис. 17, вверху); в качестве противоиона (рис. 17, внизу) выступает димерный трианион В24Н233-, имеющий центросимметричное строение. Мостик В-Н-В' линейный, расстояния В-Н и В…В' составляют 1.08 и 2.154 соответственно. Cтроение димера в 26 существенно отличается от известного[11] : в анионе В24Н233- мостик В-Н-В' не линейный, угол В-Н-В' составляет 128.2°, а расстояния В-Н' и В'-Н' длиннее и равны 1.21(3) и 1.23(3), соответственно. В 11B ЯМР спектре комплекса [Au9(Ph3P)8](В24Н23) присутствуют три сигнала при 9.9 (В1, В1'); 15.6 (В2- B11, B2'-B11') и 16.9 (B12, B12') м.д. с соотношением интегральных интенсивностей 1:10:1. В отсутствии широкополосного подавления спин-спинового взаимодействия бор-водород сигналы при 9.9 и 16.9 м.д. расщепляются в дублеты, а сигнал при 15.6 м.д. сильно уширяется. Такой вид спектра позволяет сделать вывод о том, что все атомы бора в комплексе 26 связаны с атомами водорода, при этом в соединении присутствуют две неравноценные вершины. Подобную картину можно объяснить димеризацией аниона B12H122- через водородный мостик (B12H11-H-B12H11)3-.
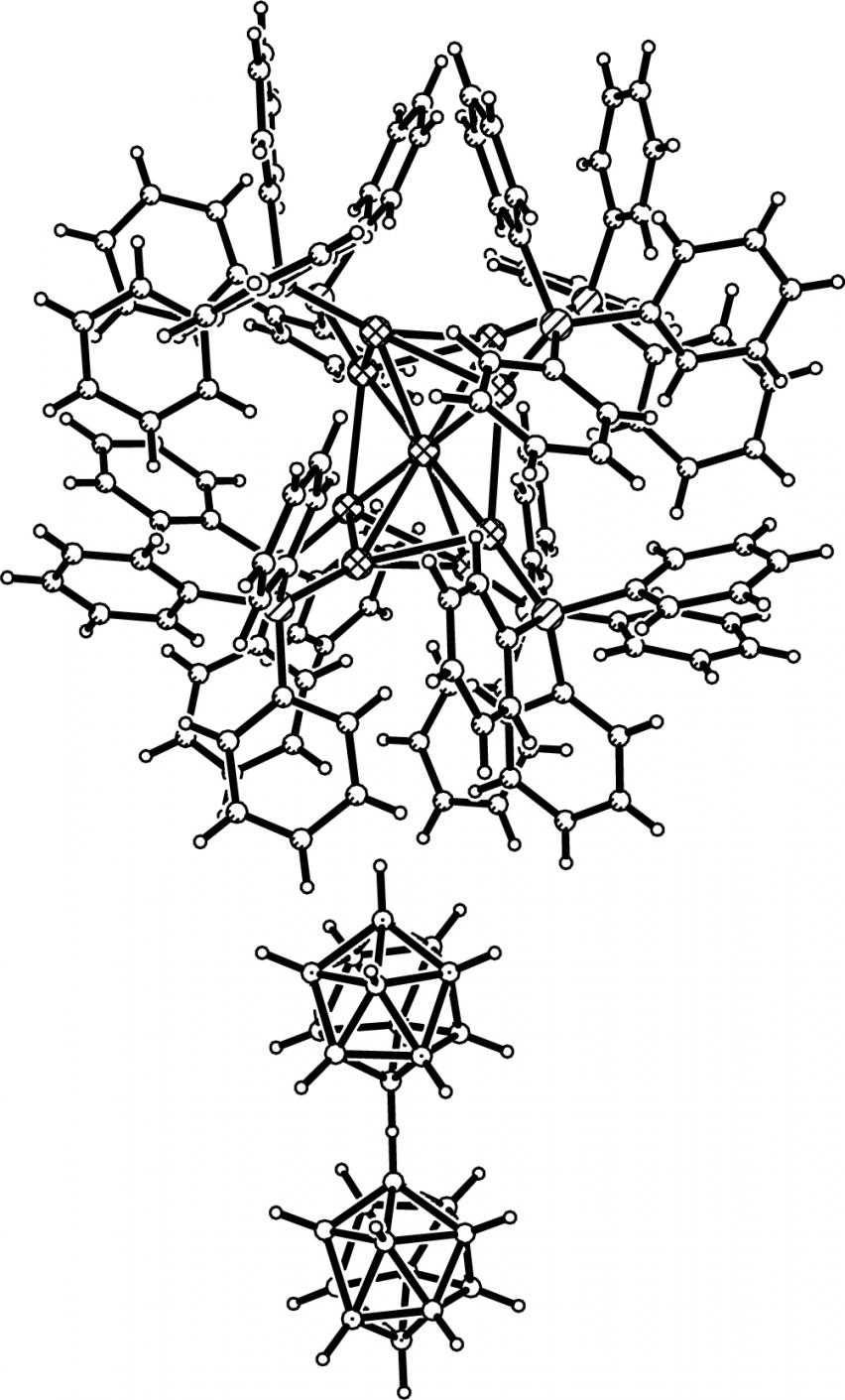 |
| Рис. 17. Фрагмент структуры комплекса [Au9(Ph3P)8](В24Н23). |
В ИК-спектре 26 наблюдается расщепленная полоса (BH), смещенная в высокочастотную область с макси-мумами при 2515, 2503 и 2488 см-1. В спектре присутствует полоса около 1875 см-1, соответствующая валентным колебаниям мостиковой В-Н-В’-группы, образующейся между двумя икосаэдрами в результате димеризации аниона B12H122.
Обобщая результаты исследования, рассмотренные в главе III, следует отметить, что введение конкурентно-способного органического лиганда в систему «металл/BnHn2-» приводит к значительному уменьшению дентатности кластерных анионов бора и образованию преимущественно дискретных комплексов. Именно синтез дискретных комплексов общей формулы [M2(Ph3P)4B10H10] (M = Cu(I), Ag(I)) позволил говорить об изомерии координационных соединений металлов с бороводородными анионами, связанной с взаимным расположением металла-комплексообразователя относительно объемного полиэдрического аниона.
Кроме того, на примере металлов IБ-группы в системе «M(I)/BnHn2-/Ph3P» удалось проследить влияние металла-комплексообразователя на состав и строение образующихся комплексов. Впервые синтезированы и охарактеризованы координационные соединения Au с кластерными анионами бора BnHn2-. Такое разнообразие в строении представленных комплексов обусловлено особенностями строения и различной реакционной способностью самих ацидолигандов – кластерных анионов бора.
Глава IV. Координационные соединения металлов M(II) (Cu(II) и Pb(II)) с анионами BnHn2- (n = 10, 12) и нейтральными органическими лигандами.
IV.1 Синтез и строение комплексов Cu(II) с анионами BnHn2- (n = 10, 12), 2,2`- бипиридилом и аминогуанидином. Как уже было показано в ходе исследования, наличие в реакционном растворе одновременно солей Cu(II) и клозо-декаборатов приводит к протеканию окислительно-восстановительной реакции. С целью ее предупреждения и быстрого выведения образующихся комплексов из реакционной смеси, реакции проводили в присутствии крупного органического лиганда – 2,2`-бипиридила.
B10H102- + Cu2+ + bipy [Cu(bipy)2]B10H10H2O (27) +
[Cu(NCCH3)2(2-B10H9bipy)] (28)
В результате проведенного взаимодействия было выделено два комплексных соединения 27 (~80%) и 28 (~10%).
Соединение [Cu(bipy)2]B10H10H2O 27 представляет собой комплекс Cu(II) с внешнесферным клозо-декаборатным анионом. Состав и строение комплекса 27 определяли исходя из данных элементного анализа, ИК-спектров и магнитной восприимчивости.
 | |
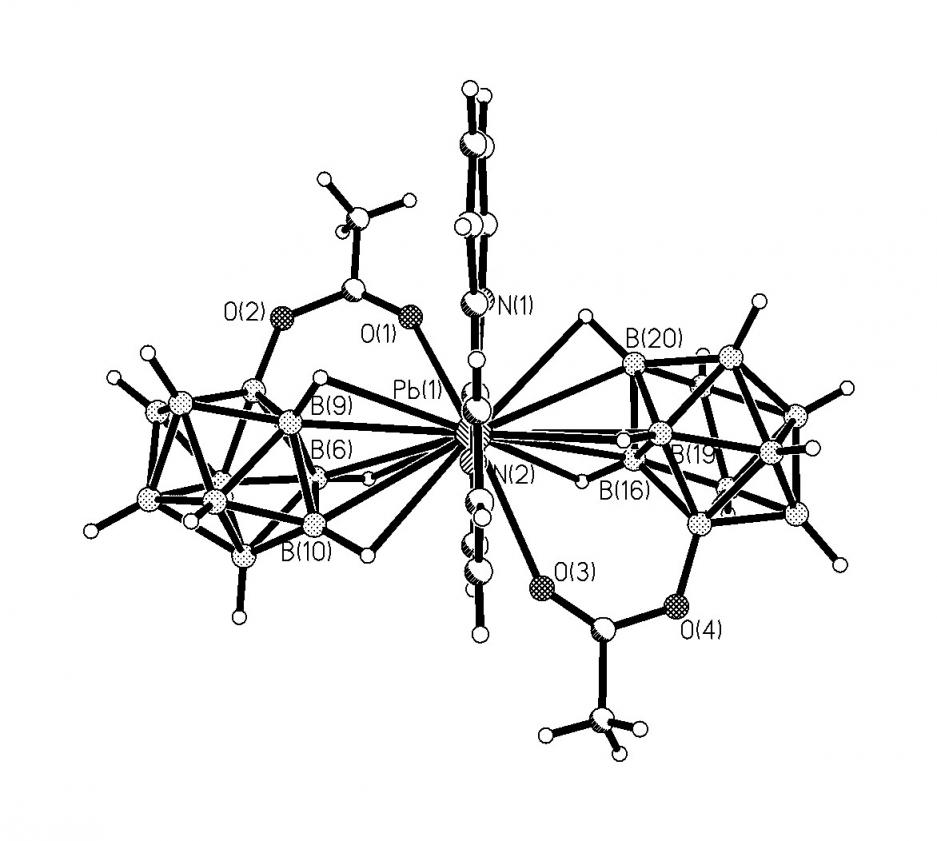
| Рис. 18. Строение комплекса [Cu(NCCH3)2(2-B10H9bipy)]. | |
 | |
| Рис. 19. Строение полимерной цепочки [(HAgu)2Cu(Agu)2(B12H12)2]n. | |
Соединение [Cu(NCCH3)2(2-B10H9bipy)] 28 - комплекс Cu(I) с замещенным анионом (2-B10H9bipy)-. Наличие в продуктах реакции комплекса Cu(I) свидетельствует о частичном участии аниона B10H102- в окислительно-восста-новительной реакции «Cu(II) - анион B10H102-». При этом окисление аниона B10Н102- протекает с отщеплением гидридного атома водорода и образованием аниона В10Н9-. В дискретном комплексе 28 анион (2-B10H9bipy)- содержит заместитель bipy в положении В2. Длина связи B(2)-N(1) равна 1.566(4). Тетраэдрическое окружение атома Cu+ образуют два атома азота N молекул ацетонитрила (Cu-N(3,4) 1.995(3) и 1.976(3) ), атом азота N(2) заместителя bipy (Cu-N(2) 2.028(2) ) и апикальная группа B(1)-Н(1) бороводородного кластера (рис. 18). Следует отметить, что введение заместителя в анион B10H102- существенно снижает его дентатность, и анион (2-B10H9bipy)- координируется к атому Cu(I) только B(1)-Н(1) группой апикальной вершины полиэдра за счет образования 3ц2е-связей (Cu-B(Н) 2.601(3), Cu-Н(B) 1.85(3), угол CuНВ составляет 123(2)°). 11B ЯМР и ИК-спектры комплекса 28 хорошо согласуются с данными РСА.
Комплекс Cu(II) с анионом B12H122- и аминогуанидином (Cu0.61H0.78Agu2)B12H12 (29) получали при взаимодействии (НAgu)2B12H12 и солей Cu2+. Структура 29 построена из комплексного соединения [Cu(Agu)2B12H12] и соли (HAgu)2B12H12 (рис. 19). Атом Cu(II) расположен в центре симметрии,,. Фактор заселенности этой позиции составляет 0.612(1). Плоско-квадратное окружение атома Cu(II) образуют атомы N(1) и N(4) двух молекул Agu, замыкающих пятичленные хелатные циклы (Cu-N 1.9702(13) и 2.0261(10), угол N(1)CuN(4) 81.53(4)). Молекула Agu имеет уплощенное строение. Две дополнительные связи атом Сu(II) образует с атомами Н(1) двух центросимметричных анионов B12H122- (Cu…H(1) 2.805(14), угол CuHB 132.5(10)). Катионы HAgu+ попарно связаны межмолекулярными Н-связями в центросимметричные димеры. В структуре комплексные катионы [CuAgu2]2+ и анионы B12H122- объединены взаимодействиями Сu…H(1) в цепочки. Кроме того, между катионами и анионами осуществляются многочисленные слабые вторичные взаимодействия (N)H…H(B) и (N)H…B, формирующие трехмерный каркас. В ячейках, где позиции Cu вакантны, цепочки сохраняются благодаря вторичным взаимодействиям NH…HB.
Таким образом, образование комплекса 29 можно трактовать как результат изоморфного замещения двух ионов Н+ на ион Cu2+(рис. 20). Это дало основание предположить, что комплекс 29 изоструктурен соли (AguH)2B12H12 (30), что было доказано нами в результате РСА 30. Определение структур 29 и 30 проводили при 160К. Объем элементарной ячейки 30 превышает объем ячейки 29 менее, чем на 5 3 (404.20(5) и 399.64(4) 3, соответственно). По геометрии катион Agu+ в 30 заметно отличается от молекулы Agu в 29. Геометрические различия приводят к единственному заметному структурному различию – изменению размера полости в димерном катионе, который характеризуют внури- и межмолекулярные расстояния N(1)…N(4). В соли 30 эти расстояния (2.685(1) и 3.111(1) ) существенно длиннее, чем в комплексе 29 (2.610(2) и 3.027(2) ). Характеристики вторичных взаимодействий между катионами и анионами в структурах 29 и 30 различаются незначительно.
(а)  (б) (б) |
| Рис. 20. Строение фрагментов [(HAgu)2Cu(Agu)2(B12H12)2]n (а) и (HAgu)2B12H12 (б). |
Анализ ИК-спектра комплекса 29 проводили в сравнении со спектром исходного - (HAgu)2B12H12 30. В ИК-спектрах 29 и 30 состояние аниона B12H122- не меняется, полоса (ВН) расщеплена на две компоненты при 2445 и 2415 см-1. Такое расщепление полосы (ВН) в 30 обусловлено, наличием взаимодействий, возникающих между NH2-группами катиона и BH-группами аниона B12H122-, последнее сохраняется и в комплексе 29. Координация молекул Agu к атому металла проявляется в существенном изменении положения валентных и деформационных колебаний NH2-групп по сравнению с таковыми в спектре 30.
IV.2 Синтез и строение комплексов Pb(II) с анионами BnHn2- (n = 10, 12). Среди непереходных элементов кластерные анионы образуют устойчивые комплексы со свинцом(II), и на сегодняшний день они являются единственными примерами комплексов непереходных металлов с анионами BnHn2-.
IV.3 Клозо-бораты Pb(II) - MBnHn (n = 10, 12). Клозо-бораты Pb(II) получали при взаимодействии карбоната Pb(II) c кислотами (H3O)2BnHn. Образующиеся гидратированные клозо-бораты MBnHnxH2O легко подвергаются процессу дегидратации, что приводит к образованию безводных гигроскопичных соединений. В этом отношении PbBnHnxH2O подобны дегидратированным клозо-боратам легких щелочно-земельных металлов. Соединения PbBnHnxH2O окрашены, легко растворяются в полярных органических растворителях, образуя соответствующие сольваты. Предварительные исследования, базирующиеся на изучении ИК-спектров соединений показали, что клозо-декаборат Pb(II) может быть отнесен к комплексному соединению [Pb(H2O)хB10H10], в котором нельзя исключить взаимодействия аниона В10Н102- с металлом. В ИК-спектре [Pb(H2O)хB10H10] наблюдаются колебания (BH) при 2485 и (BH)МHB при 2414 см-1. Что касается соединения Pb(II) с клозо-додекаборатным анионом, то согласно ИК-спектрам, соединение представляет собой аквакомплекс
[Pb(H2O)6]B12H12 - в ИК-спектрах проявляется уширенная полоса (BH) при ~ 2470 см-1. Отсутствие полосы колебаний (BH)МHB свидетельствует о нахождении аниона B12H122- во внешней сфере комплекса. Внутреннюю координационную сферу металла формируют молекулы воды.
IV.4 Комплексы Pb(II) с анионами BnHn2- и 2,2`-бипиридилом.
Смешанолигандные комплексы Pb(II) с анионами BnHn2- и 2,2`-бипиридилом получали по схеме.
BnHn2- + Pb 2+ + bipy [Pb(bipy)хBnHn]
В результате реакции были получены комплексы [Pb(bipy)B10H10] (31) и [Pb(bipy)2B12H12] (32), причем их состав не зависит от соотношения M : BnНn2- : L.
В комплексе 31 (рис. 21а) окружение атома Pb образуют молекула бипиридила (Pb-N 2.470(6) и 2.500(5) ) и три независимых анионами B10H102-. В свою очередь каждый анион B10H102- координируется одновременно к трем атомам Pb разными способами: два аниона – апикальными гранями при противоположных вершинах полиэдра, третий – по апикальному ребру. В результате в координации участвуют 7 из 10 атомов бора кластерного аниона. Расстояния Pb-B(Н) 3.041(7)-3.376(8), Pb-H(B) 2.66(6)-3.18(5), углы PbHB 90°-125° позволяют говорить о том, что во взаимодействии принимают участие атомы и бора, и водорода.
![(а) (б) Фрагмент структуры [Pb(bipy)(B10H10)]n (а) и димера-27](/images1/277297/a-b-fragment-strukturi-pbbipyb10h.jpg) 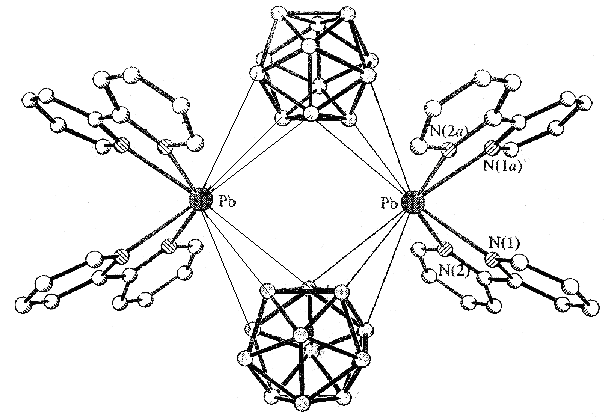 (а) (б) (а) (б) |
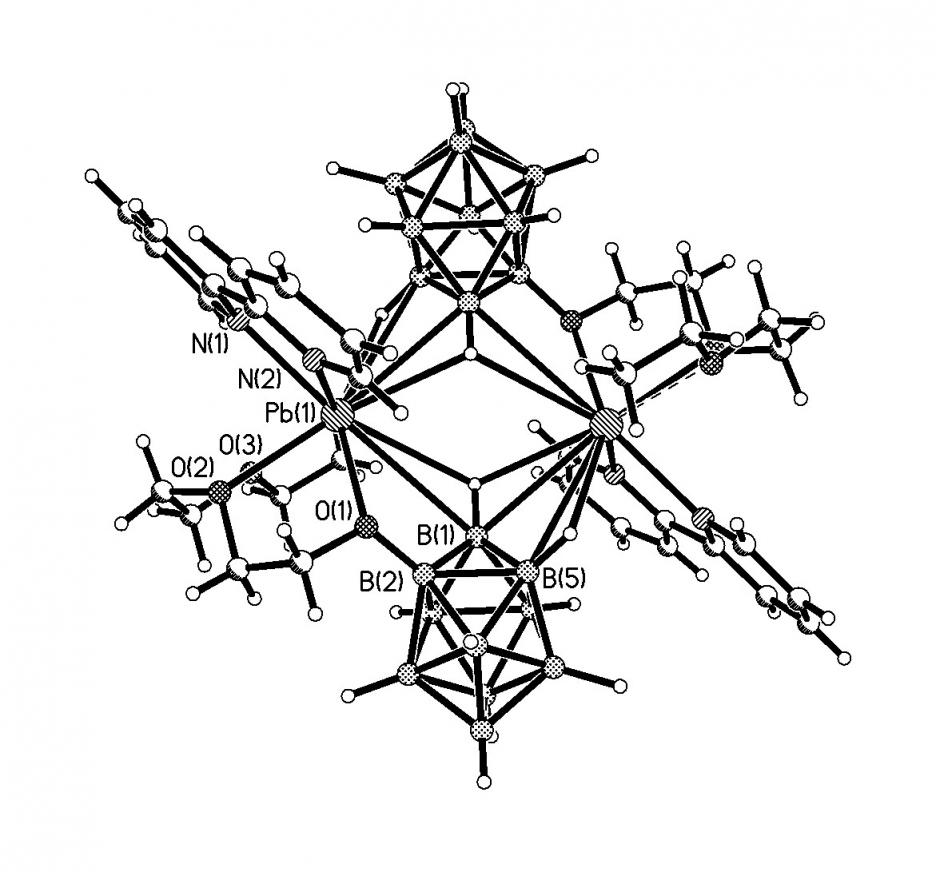
| Рис. 21. Фрагмент структуры [Pb(bipy)(B10H10)]n (а) и димера [Pb(bipy)2(B12H12)]2 (б). |
В комплексе [Pb(bipy)2B12Н12]2 (32) (рис. 21б) атом Pb координирует две кристаллографически эквивалентные молекулы bipy (Pb-N 2.517(7) и 2.532(4) ) и два кристаллографически эквивалентных аниона B12H122-, образуя димер. В свою очередь, каждый анион B12H122- координируется к двум атомам свинца, по соседним граням при одной вершине икосаэдра. Расстояния Pb-B(Н) равны 3.313(6)-3.514(6), Pb-H(B) 2.79(4)-3.07(5), углы PbHB составляют 104(3)-112(3)°. Интервал расстояний Pb-B(Н) в комплексах 31 и 32 отражает наличие в соединениях коротких 3.041(7)-3.073(8) 31, 3.313(6) 32 и длинных контактов 3.105(8)-3.376(8) 31, 3.459(6), 3.514(6) 32.
В ИК-спектрах обоих комплексов наблюдается расщепление полос (BH) на несколько компонент 2517, 2471, 2443 и 2418 см-1 31 и 2507, 2469, 2445, 2413 см-1 32. Низкочастотные полосы при 2418 и 2413 см-1 для анионов B10H102- и B12H122-, соответственно, относятся к валентным колебаниям (BH)МHB. Координирован-ным молекулам bipy в спектрах комплексов 31, 32 соответствует повышение частоты (C-N) гетероцикла до 1610 см-1 и существенное перераспределение интенсивности колебаний в интервале 1600-700 см-1.
Таким образом, на примере комплексов 31 и 32 установлено, что кластерные анионы бора наравне с другими нейтральными органическими лигандами способны образовывать комплексы с непереходными металлами различного состава и строения.
IV.5 Комплексы Pb(II) с замещенными клозо-декабортными анионами B10H10-mXm2- (X = OH, OC(O)CH3, O(CH2CH2)2OEt; m = 1, 2) и 2,2`-бипиридилом. Эффективным методом уменьшения дентантности анионов BnНn2- является введение заместителя в борный остов. В этом случае следует ожидать образование комплексов, в которых борный кластер может быть координирован к металлу-комплексообразователю как с помощью экзо-полиэдрического заместителя, так и с участием BН–групп борного полиэдра. Многообразие продуктов замещения экзо-полиэдрических связей B-H в бороводородных анионах, синтезированное ранее в нашем коллективе, позволило на их основе получить и исследовать комплексы металлов различного состава и строения. Далее будут рассмотрены комплексы Pb(II) с 2,2`-бипиридилом и некоторыми замещенными клозо-декаборатного аниона - B10H10-mXm2- (X = OАс, Ас = C(O)CH3, m = 1, 2; X = OH, O(CH2CH2)2OEt, m = 1). Комплексы Pb(II) с замещенными анионами получали согласно схеме:

 а) а) |
 б) б) |
| Рис. 22. Фрагмент структуры (Ph4P)2[Pb(bipy)(2-B10H9OC(O)CH3)2] (а), [Pb(bipy)2(2,8-B10Н8(OC(O)CH3)2)] (б). |
Соотношение реагентов M : B10H10-mXm2- : L не влияет на состав образу-ющихся продуктов. Для комплексов 33, 34 пригодные для РСА кристаллы были получены из реакционных растворов, в случае комплексов 35, 36 – перекристаллизацией из ДМФА: [Pb(bipy)(2-B10H9O(CH2CH2)2OEt)]0.5ДМФА (35а) и [Pb(bipy)(ДМФА)(2-B10Н9OH)]ДМФА (36а).
Методом РСА монокристаллов было определено строение комплексов 33-36а. В комплексе 33 (рис. 22а) атом свинца, координирует два атомами азота молекулы bipy (Pb-N 2.551(3) и 2.581(3) ), два атома кислорода карбоксилатных групп от двух анионов (2-B10H9OAc)2- (Pb-O 2.749(3) и 2.760(3)) и два полиэдрических аниона (2-B10H9OAc)2-, которые связаны с атомом металла апикальной гранью полиэдра, находящейся в противоположном от заместителя положении. Во взаимодействии участвуют атомы бора и водорода, расстояния Pb-B(Н) 2.989(5)-3.223(5), Pb-H(B) 2.60(4)-2.93(4), углы PbHB 89(2)-102(2)°.
В комплексе 34 (рис. 22б) окружение атома Pb(II) формируется двумя парами атомов азота двух молекул bipy (Pb-N 2.572(5) и 2.616(5) ) и двумя карбонильными атомами кислорода карбоксилатных групп аниона (2,8-B10H8(OAc)2)2- (Pb-O 2.756(5) ). В комплексе 34 наблюдаются также два коротких контакта с BН–группами замещенного аниона, связывание происходит по экваториальному ребру; во взаимодействии участвуют атомы и бора, и водорода (Pb-B(4) 3.263(8), Pb-H(B4) 2.63(5), угол PbHB(4) 116(2)°).
В комплексе 35а (рис. 23) в окружение атома Pb(II) входят два атома азота молекулы bipy (Pb-N 2.470(4) и 2.483(5) ) и три атома кислорода цепочечного заместителя (2-B10H9O(CH2CH2)2OEt)2- (Pb-O 2.497(4), 2.598(4), 2.859(4) ). Кроме того, атом Pb образует связи с апикальным атомом бора B(1) одного замещенного аниона и апикальным ребром B(1)-B(5) другого, которые объединяют комплексы в центросимметричные димеры. Во взаимодействие М-BnНn2- вовлечены атомы
 |
| Рис. 23. Фрагмент структуры [Pb(bipy)(2B10H9O(CH2CH2)2OEt)]20.5ДМФА. |
бора и водорода (Pb-B(Н) 3.128(6) и 3.288(7), Pb-H(B) 2.70(5) и 2.73(6), PbHB 103(3)° и 111(4)°).
В комплексе 36а (рис. 24) кластерный анион (2-B10Н9OH)2- координируется к атому Pb только через атомы кислорода гидроксогруппы, при этом ВН-группы замещенного аниона не вступают в какие-либо взаимодействия с атомом металла.
 |
| Рис. 24. Фрагмент структуры [Pb(bipy)(ДМФА)(2-B10Н9OH)]ДМФА |
В ИК-спектрах комплексов 33-36 присутствует полный набор полос, колебаний координированной молекулы бипиридила. Образованию координационных связей с атомом Pb(II) через донорные атомы кислорода заместителей соответствует понижение полосы валентных колебаний (C=O) при 1628 см-1 в комплексах 33-34, полосы валентного колебания эфирной группы (CO)c-o-c при 1135 см-1 в 35 и (OH) около 1540 см-1 в 36 по сравнению с таковыми в спектрах исходных солей замещенных клозо-декаборатного аниона ( ~ 50 см-1 для 33-35; ~ 100 см-1 для 36). Координация замещенных клозо-декаборатного аниона к атому металла через BH-группы с образованием 3ц2е-связей подтверждается наличием в ИК-спектрах комплексов 33-35 полосы (BH)МHB при 2416, 2432 и 2433 см-1 соответственно. В спектре комплекса 36 с гидроксозамещенным анионом – (2-B10Н9OH)2- полоса (BH)МHB отсутствует.
Таким образом анализ строения комплексов 33-36а показал, что введение заместителя в кластерный анион бора значительно снижает дентатность последнего и приводит к координации М-BnНn2- только по грани, ребру или вершине полиэдра, вплоть до отсутствия координации ацидолиганда через BН–группы замещенного кластерного аниона.
Глава V. Характер и особенности координации кластерных анионов бора BnHn2- (n = 10, 12) в комплексах металлов. Подводя итог систематическому исследованию реакций комплексообразования металлов с кластерными анионами бора, нами были выполнены некоторые обобщения и сформулированы особенности координации кластерных анионов бора B10H102- и B12H122- в исследованных комплексах.
V.1.Многоцентровые связи в комплексах металлов с кластерными анионами бора BnHn2- (n = 10, 12). Исследования, проведенные в работе, показали, что в комплексах металлов анионы BnHn2- координируются к центральному атому с результате различных типов связей М-BnНn2-, при этом во взаимодействие могут быть вовлечены вершина, ребро или грань борного полиэдра. Следует отметить, что координация таких объемных лигандов к металлу может усложняться еще и тем, что кластерные анионы, являясь полидентатными лигандами, склонны образовывать полимерные структуры с координацией к нескольким атомам металла одновременно, при этом возникают смешанные типы связывания, интерпретация которых вызывает определенные затруднения. Как было указано выше, для более точного определения типа связи М-BnНn2- в дискретных комплексах нами были выбраны длины связей М-B(Н), М-H(B) и угол МHB, определенные по данным РСА. Сопоставление этих данных, а также корреляция их с другими методами исследования, позволили для каждого конкретного случая определить группу атомов, участвующую в образовании связи с металлом-комплексообразователем.
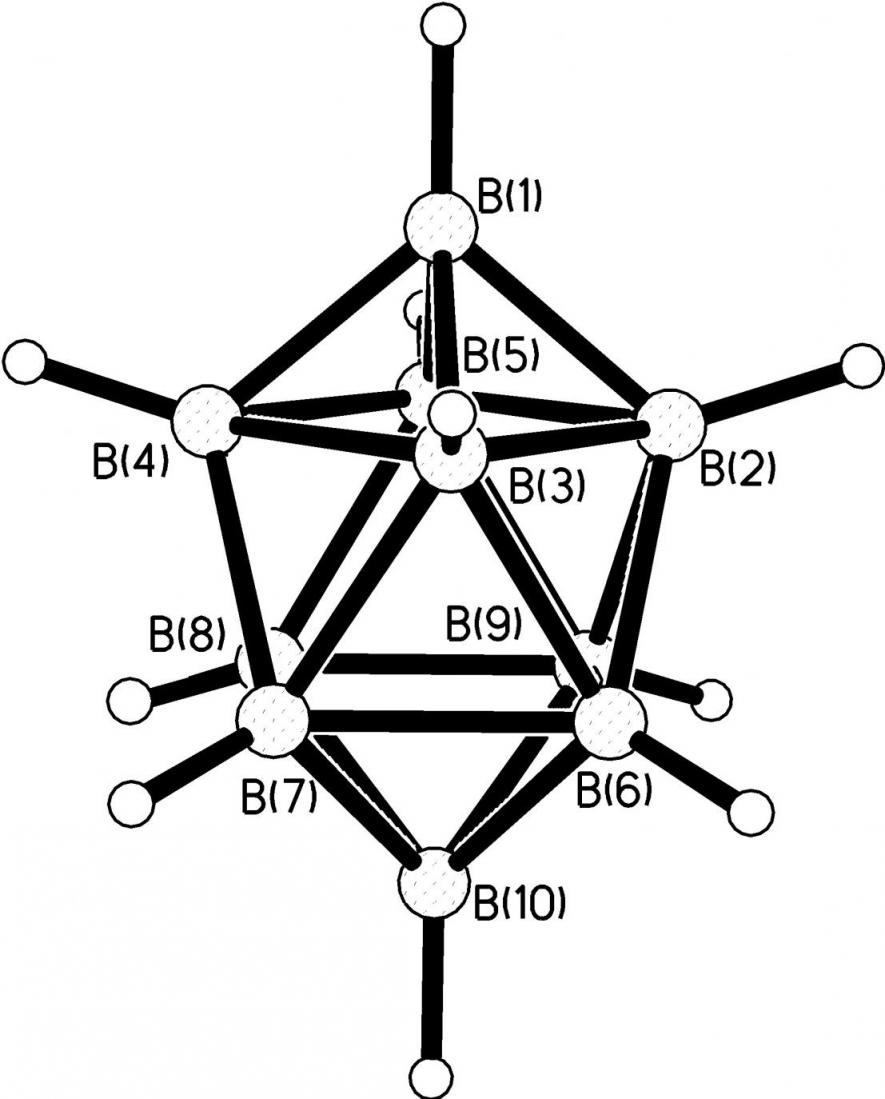 |
| Рис. 25. Строение аниона В10Н102-. |
В силу природы и электронного строения атомов бора, которые формируют скелеты полиэдров BnHn2-, при образовании координационной сферы комплексов наиболее предпочтительным является образование 3ц2е-связей (МНВ), когда в донорно-акцепторные взаимодействия вовлечены атомы бора, водорода и металла одновременно. В этом случае связи М-В(Н) и М-Н(В) соизмеримы, а величина угола МНВ стремиться к 90°. Данный вид связи может быть идентифицирован методом ИК-спектроскопии, наличие трехцентровой связи (МНВ) проявляется в спектрах в области 2400-2150 см-1. Количество 3ц2е-связей, как и их длина, может варьироваться в зависимости от металла-комплексообразователя или ацидолиганда BnHn2-. Действительно, на сегодняшний день удалось синтезировать наибольшее количество комплексов с 3ц2е-связями, образованными BН–группами, расположенными при вершине, ребре или грани борного полиэдра ((МНВ)-, (МНВ)2- или (МНВ)3- соответственно). Строение аниона B10H102- (рис. 25) позволяет выделить по 8 апикальных ребер и апикальных граней при вершинах полиэдра В1 и В10; 8 ребер, образующих два экваториальных пояса и 8 ребер, и 8 граней, соединяющих два экваториальных пояса. Поэтому в образование координационных соединений по (МНВ)2- или (МНВ)3- типу могут быть вовлечены как ребра (грани), находящиеся при апикальных вершинах полиэдра (В1 и В10), так и ребра (грани) при экваториальных вершинах (В2-В9). Различия в координации аниона B10H102- были показаны на примере комплексов Cu(I) и Ag(I) и связаны с условиями проведения синтеза (изменением кислотности среды) или с природой внешнесферного катиона.
Так, проведение процесса комплексообразования в смеси CH3CN/CF3COOH позволило получить комплексы металлов 1-2, 3-6 [Cu2(NCCH3)4B10H10] (рис. 8); 1-2, 5-8 [Ag2(Ph3P)4B10H10] (рис. 13), в которых координация анионов B10H102- к атомам металлов по (МНВ)2-типу, осуществляется апикальным ребром и ребром, соединяющим два экваториальных пояса. В комплексах 1-2, 1-4 [Ag2(Ph3P)4B10H10] (рис. 12); 1-2, 9-10 [Ag2(Ph3P)4B10H10]; 1-2, 9-10 [Cu2(Ph3P)4B10H10] (рис. 11) координация по (МНВ)2-типу осуществляется только по апикальным ребрам полиэдра. В случае аниона B12H122- координация по (МНВ)2-типу отмечена в центросимметричном комплексе 1-2, 9-12 [Cu2(NCCH3)4B12H12] (рис. 2). Среди комплексов с граневой координацией (МНВ)3-типа - комплексы 1-2-3, 6-9-10 {(C3H7)4N[AgB10H10]}n (рис. 6) и 1-2-3, 1-4-5 [Pb(bipy)2B12H12]2 (рис. 21б). Координация по (МНВ)-типу с участием только апикальной вершины полиэдра была зафиксирована в комплексе [Cu(NCCH3)2(2-B10Н9bipy)] (рис. 18). Взаимодействие М-BnНn2- может быть осложнено одновременным участием в координации ребер и граней полиэдра ([Au(Ph3P)2][AgB12H12] (рис. 16)), а также наличием вторичных взаимодействий.
Координация М-BnНn2- может также реализовываться через мостиковый атом водорода М-Н(В) или через атом бора М-В(Н) без участия терминального атома водорода. В случаях, когда в комплексах реализуется связь М-Н(В), нами отмечено относительное удлинение связи М-В(Н) по отношению к длине связи М-Н(В), при этом < МНВ составляет более 120°. В этом случае мы рассматриваем наличие мостикового атома водорода, связывающего атомы металла и бора между собой, тогда как связь М-В в соединении отсутствует. При образовании связи M-B(H) главным критерием является < МНВ, значение которого стремиться к 60°. На сегодняшний день комплексы, синтезированные со связями М-В(Н) и М-Н(В) являются единичными. Так, в комплексе [Cu(Аgu)2B12H12(AguH)2B12H12] (рис. 19) реализуется М-Н(В)-связь.
При образовании М-В-связи в отсутствии терминального атома водорода связь М-BnНn2- реализуется путем -связывания атомов металла и бора. В этом случае атом металла можно рассматривать, как заместитель в кластерном анионе бора. Ввиду отсутствия атома водорода такой тип связи может быть однозначно идентифицирован с помощью метода 11В ЯМР спектроскопии. В литературе известно всего два примера, в которых координация кластерного аниона бора с металлом реализуется за счет прямой связи М-В: (Ph4P)2[2-SnCl2PhB10H9][12] и Cat2[B12H12-n(HgCF3COO)n] (n = 2, 6, 9, 12)[13]. В этих соединениях прямая связь образована атомом бора с одним атомом металла. Как оказалось, прямые связи М-В могут реализовываться и с несколькими атомами металла одновременно. Пример такого взаимодействия – комплекс [1-(Au(Ph3P))3В10Н9] (рис. 15), в котором апикальный атом бора аниона B10Н9- одновременно связан с тремя атомами Au и реализуется М3-В связь.
V.2.Вторичные взаимодействия в комплексах металлов с анионами B10Н102- и B12Н122-. Кластерные анионы бора BnHn2- в силу специфики их строения обладают большими возможностями к образованию наравне с основными координационными связями вторичных взаимодействий. Следует отметить, что в металлорганической и координационной химии основные и вторичные связи возникают между металлом и гетероатомом органического лиганда, при этом вторичные взаимодействия являются следствием электронного и координационного насыщения металла.
В комплексах с кластерными анионами бора в качестве лигандов образование вторичных взаимодействий может быть продиктовано как свойствами металла, так и свойствами ацидолиганда BnHn2-. Впервые взаимодействия такого рода были изучены[14] на примере солей (bipyH)2B10H10 и (bipyH2)B10H10. Было установлено, что перенос заряда с аниона B10H102- на катион (bipyH2)2+ осуществляется в результате взаимодействия между атомами B и N, короткие контакты (N)H…H(B) составляют 1.91(3).
 |
| Рис. 26. Вторичные взаимодействия в соединении ((CH3)3NH)2B10H10. |
Анализ строения целого ряда анионных комплексов, описанных в главе II, позволил более детально подойти к исследованию дальних взаимодействий, возникающих в солях и комплексах металлов с кластерными анионами бора. Первоначально нами были синтезированы соли анионов B10H102- и B12H122- с широким спектром органических катионов (R2NH2+, R3NH+, GuH+, AguH+, где R = CH3, C2H5, C4H9; Gu = CN3H5, Agu = CN4H6), которые были исследованы методом ИК-спектроскопии. Информативность ИК-спектроскопии позволила предварительно идентифицировать соли кластерных анионов бора, в наибольшей степени подверженные дальним взаимодействиям. В ИК-спектрах ряда клозо-боратов отмечали сильное расщепление полосы (BH) на несколько компонент. Помимо этого наблюдалось понижение частоты валентных колебаний (NH). Для монокристалла соединения ((CH3)3NH)2B10H10 (37), в ИК-спектре которого наблюдались наибольшие изменения ((BH) 2495, 2470, 2455, 2445, 2415 см-1), было проведено РС исследование. Было установлено, что в 37 взаимодействие между катионом (CH3)3NH+ и анионом B10H102- носит сложный характер, подобный связыванию дополнительного атома водорода в сверхэлектронодефицитных анионах[15]
B6H7- и B10H11-, где протон полностью принадлежит кластерным анионам бора, расстояния В-H* в обоих случаях равны 1.15 и близки к расстояниям B-Н в анионах B6H62- и B10H102-. В 37 реализуется промежуточное состояние, в котором атом Н алкиламмониевого катиона, как и H*, располагается над центром треугольной грани ВВВ (рис. 26). Связь (N)H…B(H) длиннее связи В-H*, и равна 2.52-2.65, что вполне объяснимо, поскольку протон связан одновременно и с атомом азота катиона, и с атомом бора аниона B10H102-. Расстояния (N)H…H(B) равны 2.36-2.46.
 |
| Рис. 27. Вторичные взаимодействия в комплексе {(C2H5)3NH[CuB10H10]}n |
Описанные взаимодействия, наблюдающиеся между BH-группами аниона и NH-связями NH- и NH2-групп ониевого катиона свойственные простым солям, проявляются и в комплексах металлов с анионами BnHn2- и алкиламмониевыми катионами, и реализуются в различных комбинациях: (H)B…N(H), (H)B…H(N), (B)H…N(H), (B)H…H(N). Наличие алкиламмониевого катиона в {(CH3)2NH2[CuB10H10]}n 9 {(C2H5)3NH[CuB10H10]}n 10 и {(C2H5)3NH[AgB10H10]}n 11 приводит к возникновению вторичных взаимодействий, которые связывают анионные цепочки в комплексах [MB10H10]-n между собой. Межмолекулярные взаимодействия направлены на грани полиэдра (рис. 27), значение соответствующих длин связей составляет 2.04(6)-2.07(6), 2.20(6)-2.27(7) для (11) и (10), соответственно. Значения контактов в (9) равны 3.30(1)-3.75(1). Длины взаимодействий сопоставимы со значениями, определенными для клозо-бороводородов с соответствующими алкиламмониевыми катионами.
V.3. Изомерия в координационных соединениях металлов с анионами B10Н102- и B12Н122-. Проведенные нами исследования привели к получению целого ряда соединений, общая формула которых [M2L(BnHn)] или Cat[ML(BnHn)] (M – атом металла-комплексообразователя в степени окисления +1, BnHn2- – кластерный анион бора, L – нейтральный органический лиганд, Cat+ – однозарядный катион). Было обнаружено, что в комплексах дискретного и полимерного строения ацидолиганды BnHn2- с учетом их геометрических характеристик способны координироваться к металлу-комплексообразователю по-разному, что обусловливает возможность образования большого числа изомерных соединений.
Анализ строения полученных комплексов позволяет нам выделять реберные и граневые изомеры, где координация анионов осуществляется по ребру или грани полиэдра соответственно. Среди реберных изомеров для аниона В10Н102- в силу его геометрических особенностей можно выделить ряд соединений, где координация М-BnHn2- реализуется: за счет апикальных ребер; за счет экваториальных ребер; за счет апикальных и экваториальных ребер. Наглядными примерами реберной изомерии являются дискретные комплексы Ag(I) с анионом В10Н102- и Ph3P с различными видами координации: «вершина-вершина» 1-2, 1-4 [Ag2(Ph3P)4B10H10], 1-2, 9-10 [Ag2(Ph3P)4B10H10]; «вершина-пояс» 1-2, 5-8 [Ag2(Ph3P)4B10H10]; а также комплексы Cu(I) - с координацией «вершина-вершина» 1-2, 6-10 [Cu2(Ph3P)4B10H10]8 и 1-2, 9-10 [Cu2(Ph3P)4B10H10].
Нами получен ряд комплексов Cat[MLBnHn], в которых соотношение металла к лиганду M : ВnНn2- = 1:1; однако в силу их полимерного строения каждый анион BnHn2- связан с двумя атомами металла, как и в дискретных комплексах [M2LBnHn], что позволяет выделять во фрагменте полимерной цепи тот же набор координирующихся ребер и граней, что и в [M2LBnHn]. В некоторых случаях в полимерных цепях реализуется координация бороводородных анионов, не наблюдаемая в полученных дискретных комплексах на настоящий момент; в частности, был получен ряд полимерных комплексов с координацией «вершина-вершина»: 1-2, 8-10 {(C2H5)2NH2[CuB10H10]}n; 1-2, 8-10 {(C2H5)3NH[AgB10H10]}n, а также с координацией «вершина-пояс»: 1-2, 3-7 {Cs[CuB10H10]}n. Что касается комплексов с граневой координацией, то для аниона В10Н102- на сегодняшний день охарактеризован только один комплекс, где в координации участвуют две апикальные грани: 1-2-3, 6-9-10 {(C3H7)4N[AgB10H10]}n. Комплексы, где координация аниона В10Н102- осуществляется только по экваториальным ребрам или экваториальным граням полиэдра, на данный момент не синтезированы.
Геометрия аниона В12Н122- (икосаэдр) также подразумевает наличие в комплексах реберной и граневой координации. Высокая симметрия аниона В12Н122- определяет отсутствие апикальных и экваториальных ребер, что сокращает ряд возможных изомеров. Примером комплекса с различными видами реберной координации является: полимерный комплекс {(С11H9)Ph3P[AgB12H12]}n с чередующимися звеньями, образующими цепь: 1-2, 9-12 {(С11H9)Ph3P[AgB12H12]}n и 1-2, 3-7 {(С11H9)Ph3P[AgB12H12]}n. Наличие в полимерной цепи чередования звеньев с позиционной изомерией, приводит к нарушению линейности общей цепи. Для аниона В12Н122- охарактеризован также комплекс с центросимметричной реберной координацией 1-2, 9-12 [Cu2(NCCH3)4B12H12] (дискретный комплекс). Как и в случае аниона B10H102-, для В12Н122- получен только один комплекс с участием в координации граней икосаэдра: димер 1-2-3, 1-4-5 [Pb(bipy)2B12H12]2. В таблице 4 приведены виды координации анионов ВnНn2- реализуемые в синтезированных комплексах металлов.
Таким образом, мы говорим о наличии изомерии в координационной химии кластерных анионов бора, связанной с расположением центральных атомов металла (двух) относительно объемных борсодержащих лигандов BnHn2- и обусловленной особенностями их геометрии.
В главе VI (экспериментальная часть) приведены разработанные в ходе выполнения работы оригинальные методики синтеза комплексов переходных и непереходных металлов с кластерными анионами бора BnHn2-; приводятся данные химического анализа, спектральные характеристики ( ИК-,11B и 11B {1H} ЯМР спектры) и данные РСА синтезированных комплексов[16].
Таблица 4. Виды координации анионов ВnНn2-, реализуемые в синтезированных комплексах металлов (в координации участвуют два атома металла).
| Реберная координация аниона В10Н102- | ||||||||||
| - координация “вершина- вершина” (по апикальным ребрам) | ||||||||||
| 1 |  |  |  | |||||||
| 2 | 1-2, 6-10 | 1-2, 9-10 | 1-2, 7-10 | 1-2, 8-10 | 1-2, 1-4 | |||||
| 3 | 1-2, 6-10 [Cu2(Ph3P)4B10H10]; 1-2, 9-10 [Cu2(Ph3P)4B10H10]; 1-2, 9-10 [(Ag2(Ph3P)4B10H10]. | 1-2, 8-10{(C2H5)2NH2[CuB10H10]}n; 1-2, 8-10{(C2H5)3NH[AgB10H10]}n. | 1-2,1-4{Cs[AgB10H10]}n; 1-2,1-4 [Ag2(Ph3P)4B10H10]. | |||||||
| - координация “вершина- пояс” (по апикальному ребру и ребру, соединяющему два экваториальных пояса) | ||||||||||
| 1 |  |  | ||||||||
| 2 | 1-2, 3-6 | 1-2, 5-9 | 1-2, 3-7 | 1-2, 5-8 | ||||||
| 3 | 1-2, 3-6 [Cu2(NCCH3)4B10H10]. | 1-2, 3-7 {Cs[CuB10H10]}n ; 1-2, 5-8 {(C2H5)3NH[CuB10H10]}n; 1-2, 5-8 [Ag2(Ph3P)4B10H10]. | ||||||||
| Граневая координация аниона В10Н102- | Граневая координация аниона В12Н122- | |||||||||
| - апикальные грани | ||||||||||
| 1 |  |  | ||||||||
| 2 | 1-2-3, 6-7-10 | 1-2-3, 6-9-10 | 1-2-3, 1-4-5 | |||||||
| 3 | 1-2-3, 6-9-10 {(C3H7)4N[AgB10H10]}n. | 1-2-3, 1-4-5 [Pb(bipy)2B12Н12]2. | ||||||||
| Реберная координация аниона В12Н122- | ||||||||||
| 1 |  |  | ||||||||
| 2 | 1-2, 3-7 | 1-2, 9-12 | ||||||||
| 3 | 1-2, 3-7 {(С11H9)Ph3P[AgB12H12]}n. | 1-2, 9-12 {(С11H9)Ph3P[AgB12H12]}n; 1-2, 9-12 [Cu2(NCCH3)4B12H12]. | ||||||||
1- вид сверху анионов ВnНn2-; 2- ребра, грани анионов ВnНn2-, участвующие в координации с металлом; 3- пример соединений с указанной координацией.
ВЫВОДЫ
- В результате выполнения широкого комплекса синтетических, структурных и физико-химических исследований установлено, что кластерные анионы бора BnHn2- (n = 10,12) – пространственно-ароматические системы с делокализованной электронной плотностью, образуют самостоятельный класс ацидолигандов в координационной химии. Концепция образования комплексов металлов с анионами B10H102- и B12H122- за основу, которой взято отнесение кластерных анионов бора к мягким основаниям по Пирсону, хорошо согласуется с общепринятой, базирующейся на теории жестких и мягких кислот и оснований. Этот подход позволил по оригинальным методикам синтезировать и систематически исследовать серию теоретически важных комплексов металлов с анионами BnHn2-, подойти вплотную к проблемам многоцентровых взаимодействий (образование комплексов с различным типом связи металл-борный кластер), вторичных взаимодействий и изомерии. По результатам исследования реакционной способности анионов B10H102- и B12H122- в реакциях комплексообразования меди(I) и серебра(I) установлено влияние размера катиона исходного клозо-бората, мольного соотношения реагентов на формирование координационной сферы центрального атома, определены виды образующихся комплексов Cat[MBnHn], [M2BnHn] (n = 10,12), закономерности их образования, возможные механизмы реакций.
2. Впервые проведено исследование реакций комплексообразования в условиях протонирования кластерных анионов B10H102- и B12H122. Показано, что в условиях, когда в реакционной среде одновременно находятся протоны H+ и катионы металла М+, образование комплексов протекает через стадию протонирования анионов BnHn2- – образования частиц BnHn+1-, которые затем участвуют в реакции комплексообразования. В указанных условиях синтезированы комплексные соединения с анионом B10H102- необычной геометрии – одной или двумя четырехугольными гранями. Предложена возможность рассмотрения протонирования аниона B10H102- в качестве модели реакции комплексообразования.
3. Исследованы реакции комплексообразования металлов IБ-группы с анионами B10H102- и B12H122 в присутствии конкурентноспособных мягких оснований. Впервые на примере комплексных соединений [M2(Ph3P)4B10H10] (M = Cu(I), Ag(I)) методом РСА установлено строение изомеров, выделенных в результате варьирования параметров реакций (форма клозо-декаборатного аниона – B10H102-/B10H11-; форма органического лиганда – Ph3P/M(Ph3P)3Х; кислотность среды), Для [Cu2(Ph3P)4B10H10] – 1-2, 6-10- и 1-2, 9-10- изомеров, в случае [Ag2(Ph3P)4B10H10] – 1-2, 1-4-; 1-2, 5-8- и 1-2, 9-10- изомеров. Исходя из особенностей геометрического строения анионов BnHn2- и расположения центральных атомов металла (двух) относительно объемного борсодержащего ацидолиганда установлена возможность существования позиционной изомерии.
4. Синтезированы и охарактеризованы новые комплексы золота с кластерными анионами бора BnHn2- различного строения и новым типом связывания М-BnHn2-: в комплексе [1-(Au(Ph3P))3В10Н9] установлена координация металла-кластера к атому бора полиэдрического аниона с образованием прямой связи Au-В в отсутствии атома водорода у вершины борного полиэдра; комплекс [Au(PPh3)2][AgB12H12] относится к анионным комплексам Ag(I) общей формулы Cat[MB12Н12], где в качестве катиона выступает комплексный катион дифенилфосфинзолото(I); в [Au9(PPh3)8](В24Н23) кластер золота состоит из девяти атомов и находится в катионной части комплекса, в качестве противоиона выступает димерный трианион В24Н233-.
5. Синтезированы комплексы Pb(II) с анионами B10H102- и B12H122 в присутствии нейтрального органического лиганда – 2,2`-бипиридила состава: [Pb(bipy)B10H10] и [Pb(bipy)2B12H12]2. Введение заместителя в состав ацидолиганда – (B10H10-mXm)2- (X = OH, OC(O)CH3, O(CH2CH2)2OEt; m = 1, 2) позволяет существенно понизить дентатность полиэдрического лиганда в комплексах Pb(II) и синтезировать комплексы с координацией замещенных анионов только по грани, ребру или вершине полиэдра, вплоть до отсутствия координации ацидолиганда через BН–группы кластерного аниона.
6. По результатам систематического исследования реакций комплексообразования металлов IБ – группы и Pb(II) с анионами B10H102- и B12H122, проведены обобщения и сформулированы особенности координации кластерных анионов бора к металлам. Установлено, что координация анионов BnHn2- к центральному атому в комплексах реализуется вершиной, ребром или гранью борного полиэдра с образованием различных типов связи. Наиболее предпочтительным является образование 3ц2е-связей, когда в донорно-акцепторные взаимодействия вовлечены атомы бора, водорода и металла одновременно; координация через мостиковый атом водорода – реализуется в комплексе [Cu(Аgu)2B12H12(AguH)2B12H12]n; образование прямых связей с несколькими атомами металла одновременно наблюдается в комплексе [1(Au(Ph3P))3В10Н9].
7. В комплексах металлов с кластерными анионами бора помимо основных координационных связей установлена возможность образования вторичных взаимодействий, возникающих между BH-группами кластерных анионов и NH-связями ониевых катионов. Методом РСА для соли ((CH3)3NH)2B10H10 и комплексов состава {(CH3)2NH2[CuB10H10]}n, {(C2H5)3NH[CuB10H10]}n и {(C2H5)3NH[AgB10H10]}n установлено, что образование основных координационных связей и вторичных взаимодействий в комплексах носит многоцентровый характер. Именно, наличие в кластерных анионах бора связей B-H, определяет большие возможности к проявлению вторичных взаимодействий, тем самым расширяя представления об их природе.
8. Впервые получено и охарактеризованно современными структурными и физико-химическими методами исследования более 100 комплексов металлов IБ – группы и свинца(II) с анионами B10H102- и B12H122 в качестве лигандов. Среди них комплексы полимерного и дискретного строения, с различным типом связывания М-BnHn2-, изомерным составом, а также комплексы с клозо-декаборатным анионом измененной геометрии.
Основное содержание работы изложено в следующих публикациях
статьи:
1. Малинина Е.А., Солнцев К.А., Бутман Л.А., Кузнецов Н.Т. – Клозо-декаборат-ный анион как ацидолиганд в координационной химии свинца. – Координационная Химия. 1989. Т.15. №8. 1039-1043.
2. Малинина Е.А., Гоева Л.В., Солнцев К.А., Кузнецов Н.Т. – Локальные взаимо-действия в дека- и додекаборатах триалкиламмония. – Журнал Неорганической Химии. 1991. Т.36. №.9. С.2414-2418.
3. Малинина Е.А., Гоева Л.В., Иванов С.В., Солнцев К.А., Кузнецов Н.Т. – Дека- и додекабораты этилендиаммония. – Координационная Химия. 1992. Т.18. №4. С.387-381.
4. Малинина Е.А., Гоева Л.В., Солнцев К.А., Кузнецов Н.Т. – Алкиламмониевые соли клозо-декаборатов. – Координационная Химия. 1992, т. 18, № 4. С.382-386.
5. Кацер С.Б., Малинина Е.А., Мустяца В.Н., Солнцев К.А., Кузнецов Н.Т. – Кристаллическая структура [(CH3)3NH]2B10H10 и [(CH3)2NH2]2B12H12·2ДМФA. Трехцентровые связи в клозо-борановых анионах. – Координационная Химия. 1992, т. 18, № 4. С.387-392.
6. Е.А.Малинина, Л.В.Гоева, К.А.Солнцев, Н.Т.Кузнецов. – Купра-декабораты щелочных металлов и алкиламмония. – Журнал Неорганической Химии. 1993. Т.38. №1. С.38-41.
7. Е.А.Малинина, Л.В.Гоева, Н.А.Вотинова, К.А.Солнцев, Н.Т.Кузнецов. – Клозо-боратные анионы B10H102- и B12H122- в гидразиновых комплексах Ni(II) и Pb(II) и в солях гидразония. – Журнал Неорганической Химии. 1994. Т.39. №12. С.1997-2000.
8. К.С.Гавричев, В.Е.Горбунов, Е.А.Малинина, К.А.Солнцев, Н.Т.Кузнецов. – Теплоемкость и термодинамические свойства [Ni(N2H4)3]b10h10 в области низких температур. – Координационная Химия. 1997. Т.23. №11. С.822-823.
9. Е.А.Малинина, В.Н.Мустяца, Л.В.Гоева, Т.В.Филлипова, Н.Т.Кузнецов. – Клозо-бораты гуанидиния и их взаимодействие с солями меди (II) в водных растворах. – Журнал Неорганической Химии. 2001. Т.46. №8. С.1268-1272.
10. Е.А.Малинина, В.Н.Мустяца, Л.В.Гоева, Н.Т.Кузнецов. – Клозо-бораты аминогуанидиния, особенности их взаимодействия с солями меди (II) в водных растворах. – Координационная Химия. 2001. Т.27. № 6. С.403-406.
11. Е.А.Малинина, К.Ю.Жижин, Л.В.Гоева, И.Н.Полякова, Н.Т.Кузнецов. – Клозо-декаборатный анион B10H102- – ацидолиганд в координационных соедине-ниях меди (I). – Доклады Академии Наук. 2001. Т.378. № 3. С.351-354.
12. К.Ю.Жижин, О.О.Вовк, Е.А.Малинина, В.Н.Мустяца, Л.В.Гоева, И.Н.Полякова, Н.Т.Кузнецов. – Взаимодействие декагидро-клозо-декаборатно-го(2-) аниона с алифатическими карбоновыми кислотами. – Координационная Химия. 2001. Т.27. №9. С.653-658.
13. К.Ю.Жижин, Е.А.Малинина, И.Н.Полякова, М.В.Лисовский, Н.Т.Кузнецов. – Нуклеофильное кислотно-катализируемое замещение в клозо-декаборатном анионе B10H102-. – Журнал Неорганической Химии. 2002. Т.47. №8. С.1285-1299.
14. Е.А.Малинина, К.Ю.Жижин, И.Н.Полякова, М.В.Лисовский, Н.Т.Кузнецов. – Координационные соединения Ag(I) и Cu(I) с клозо-декаборатным анионом B10H102- в качестве лиганда. – Журнал Неорганической Химии. 2002. Т.47. №8. С.1275-1284.
15. Е.А.Малинина, К.Ю.Жижин, В.Н.Мустяца, Л.В.Гоева, И.Н.Полякова, Н.Т.Кузнецов. – клозо-Декабораты меди(I) и серебра(I) с необычной геометрией борного полиэдра. –Журнал Неорганической Химии. 2003. Т.48. №7. С. 1102-1109.
16. И.Н.Полякова, Е.А.Малинина, Н.Т.Кузнецов. – Кристаллические структуры купрадекаборатов цезия и диметиламмония, Cs[CuB10H10] и (CH3)2NH2[CuB10H10]. – Кристаллография. 2003. Т.48. №1. С.89-96.
17. К.Ю.Жижин, В.Н.Мустяца, Е.А.Малинина, Е.Ю.Матвеев, Л.В.Гоева, И.Н.Полякова, Н.Т.Кузнецов. – Нуклеофильное раскрытие циклических заместителей в производных клозо-декаборатного аниона. – Журнал Неорганической Химии. 2005. Т.50. №2. С.243-249.
18. Е.А.Малинина, В.В.Дроздова, В.Н.Мустяца, Л.В.Гоева, И.Н.Полякова, Н.А.Вотинова, К.Ю.Жижин, Н.Т.Кузнецов. – Координационные соединения Cu(I) с клозо-додекаборатным анионом. – Журнал Неорганической Химии. 2006. T. 51. №11. С. 1832-1836.
19. Е.А.Малинина, В.В.Дроздова, Л.В.Гоева, И.Н.Полякова, Н.Т.Кузнецов. – Синтез и строение комплексного соединения Сd(II) [Сd2(Ph(NH2)2)5(ДМФА)4] (B10H10)2. – Журнал Неорганической Химии. 2007. Т. 52. №6. С. 922-926.
20. Е.А.Малинина, В.В.Дроздова, А.Ю.Быков, О.Н.Белоусова, И.Н.Полякова, К.Ю.Жижин, Н.Т.Кузнецов. – Комплексные соединения кластеров золота с клозо-бороводородными анионами В10Н102- и В12Н122-. – Доклады Академии Наук. 2007. Т. 414. № 4. С. 484-486.
21. Е.А.Малинина, В.В.Дроздова, И.Н.Полякова, Н.Т.Кузнецов. – Анионные комплексы Cu(I) с клозо-декаборатным анионом. – Журнал Неорганической Химии. 2008. Т. 53. № 2. С. 238-242.
22. И.Н.Полякова, Е.А.Малинина, В.В.Дроздова, Н.Т.Кузнецов. – Кристаллли-ческая структура (5-декагидро-клозо-декаборато)(2-O-диметилформамид)ди-серебра(I) [Ag2(В10Н10)(ДМФА)]. – Кристаллография. 2008. Т. 53. № 2. С. 279-282.
23. Е.А. Малинина, В.В. Дроздова, О.Н. Белоусова, И.Н. Полякова, Н.Т. Кузнецов. – Анионные комплексы серебра(I) с клозо-додекаборатным анионом. – Журнал Неорганической Химии. 2008. Т.53. № 7. С. 1105-1114.
24. В.В.Дроздова, Е.А.Малинина, И.Н.Полякова, Н.Т.Кузнецов. – Координацион-ная изомерия в комплексных соединениях металлов IБ-группы с клозо-декаборатным анионом В10Н102- и трифенилфосфином. – Доклады Академии Наук. 2008. Т. 418. № 4. С. 489-492.
сборник научных трудов:
25. E.Malinina, V.Drozdova, I.Polyakova, K.Zhizhin, L.Goeva, N.Kuznetsov. – Unusual Geometry of the closo-Decaborate Anion B10H102- in Complex Compounds of Copper(I) and Silver(I). – In book: Boron Chemistry at the Beginning of XXI Century, the proceedings of the 11th International conference on the Chemistry of Boron. IMEBORON XI. edited by Yu.N. Bubnov. 2002. Р. 136140.
авторское свидетельство:
26. Ю.Н.Милехин, В.Н.Тимошин, С.И.Яковлев, С.В.Лесников, Н.Т.Кузнецов, К.А.Солнцев, Е.А.Малинина. – Авторское свидетельство № 317049. СССР. 1990.
тезисы докладов:
- Е.А.Малинина, К.А.Солнцев, Л.А.Бутман, Н.Т.Кузнецов. – Анион В10Н102- как ацидолиганд в синтезе координационных соединений. – IV Всесоюзное совещание «Химия гидридов». Сборник тезисов. Душанбе. 1987. С.38.
- Е.А.Малинина, Л.В.Гоева, К.А.Солнцев, Н.Т.Кузнецов. – О гидрид-протон-ном взаимодействии в декаборатах алкиламмония. – VI Всесоюзное совещание «Спектроскопия координационных соединений». Сборник тезисов. Краснодар. 1990. С.138.
29. В.Л.Лагун, С.Б.Кацер, Е.А.Малинина, К.А.Солнцев, Н.Т.Кузнецов. – Синтез и кристаллическая структура [Pb(Bipy)B12H12]ДМФА. – V Всесоюзная конференция «Химия гидридов». Сборник тезисов. Душанбе. 1991. С.14.
30. Е.А.Малинина, Л.В.Гоева, К.А.Солнцев, Н.Т.Кузнецов. – Купра-декабораты щелочных металлов и алкиламмониевых катионов. – V Всесоюзная конференция «Химия гидридов». Сборник тезисов. Душанбе. 1991. С.19.
31. Е.А.Малинина, Л.В.Гоева, К.А.Солнцев, Н.Т.Кузнецов. – Алкиламмониевые соли клозо-дека- и додекаборатов. – V Всесоюзная конференция «Химия гидридов». Сборник тезисов. Душанбе. 1991. С.21.
32. N.Kuznetsov, K.Solntsev, Е.Malinina, S.Katzer. – Coordination chemistry of BnHn2- anions (n = 6, 10, 12) and its derivatives. – IX International meeting on boron chemistry. 1996. Heidelberg. Germany. С.40.
33. И.Н.Полякова, Е.А.Малинина, К.Ю.Жижин, Н.Т.Кузнецов. – Строение купрадекаборатов Cs[CuB10H10] и (Me2NH2)[CuB10H10]. – III Национальная конференция по применению РСНЭ. Сборник тезисов. Москва. 2001. С.40.
34. Е.А.Малинина, К.Ю.Жижин, В.Н.Мустяца, И.Н.Полякова, О.О.Вовк, Л.В.Гоева, Н.Т.Кузнецов. – Гидрокси- и ацетилокси-клозо-декаборатные анионы B10H10-n(OH)n2- и B10H10-n(OCOCH3)n2- в комплексах свинца(II). – XX Международная Чугаевская конференция по координационной химии. Сборник тезисов. Ростов-на-Дону. 2001. С. 313.
35. Е.Malinina, K.Zhizhin, L.Goeva, I.Polyakova, N.Kuznetsov. – Close-Decaborate Anion as a Lidand in Complex of Copper(I). – Европейская конференция по химии бора (EUROBORON II). Франция. 2001. Р.24.
36. Е.Malinina, I.Polyakova, L.Goeva, N.Kuznetsov. – Uncommon Geometry of the Closo-Decaborate Anion B10H102- in Complex Compounds of Copper(I) and Silver(I). – Eleventh International Conference on Boron Chemistry Imeboron XI. Moscow. RF. 2002. С.128.
37. И.Н.Полякова, Е.А.Малинина, К.Ю.Жижин, В.Н.Мустяца, Н.Т.Кузнецов. – Строение комплексов серебра (I) с клозо-декаборатным анионом B10H102-. – III Национальная кристаллохимическая конференция. Сборник тезисов. Московская область. Черноголовка. 2003. С.327.
38. Е.А.Малинина, К.Ю.Жижин, В.Н.Мустяца, И.Н. Полякова, Н.Т. Кузнецов. – Соединения клозо-декаборатного аниона с циклическими экзо-полиэдрическими заместителями. – XXI Международная Чугаевская конференция по координа-ционной химии. Сборник тезисов. Киев. 2003. С. 213.
39. Е.А.Малинина, К.Ю.Жижин, В.Н.Мустяца, И.Н.Полякова, Н.Т.Кузнецов. –Комплексообразование клозо-декаборатного аниона с солями меди(I) и серебра(I). – XXII Международная Чугаевская конференция по координационной химии. Сборник тезисов. Кишинев. 2005. С.421.
40. Е.А.Малинина, К.Ю.Жижин, В.Н.Мустяца, Л.В.Гоева, Н.Т.Кузнецов. – Клозо-дека- и додекабораты меди(I). – XXII Международная Чугаевская конференция по координационной химии. Сборник тезисов. Кишинев. 2005. С.422.
41. Е.А.Малинина, А.Ю.Быков, И.Н.Полякова, К.Ю.Жижин, Н.Т.Кузнецов. – Координационные соединения золота(I) с клозо-боратными анионами. – V Всероссийская конференция по химии кластеров и полиядерных комплексов КЛАСТЕРЫ-2006. Сборник тезисов АГТУ. Астрахань. 2006. P57.
42. Н.А.Вотинова, Е.А.Малинина, И.Н.Полякова, К.Ю.Жижин, Н.Т.Кузнецов. – Синтез и строение комплексов меди(I) с клозо-додекаборатным анионом. – V Всероссийская конференция по химии кластеров и полиядерных комплексов КЛАСТЕРЫ-2006. Сборник тезисов АГТУ. Астрахань. 2006. P120.
43. N.Kuznetsov, K.Zhizhin, Е.Malinina, I.Polykova. – Coordination Compounds of Cluster Boron Anions with IB Group Metals. – ICCC37. Cape Town. SAR. 2006. Р.54.
44. Е.А.Малинина, В.В.Дроздова, Л.В.Гоева, И.Н.Полякова, Н.Т. Кузнецов. – Анионные комплексы свинца(II) с клозо-декаборатным анионом. – XXIII Международная Чугаевская конференция по координационной химии. Сборник тезисов. Одесса. 2007. С. 512.
45. Е.А.Малинина, Н.Т. Кузнецов. – Координационные соединения кластерных анионов бора с металлами IБ-группы. – XXIII Международная Чугаевская конференция по координационной химии. Сборник тезисов. Одесса. 2007. С. 177.
46. В.В.Дроздова, Е.А.Малинина. – Комплексные соединения переходных металлов с клозо-боратными анионами и трифенилфосфином в качестве лигандов. – XXIII Международная Чугаевская конференция по координационной химии. Сборник тезисов. Одесса. 2007. С. 120.
47. В.В.Дроздова, Е.А.Малинина, И.Н.Полякова, Н.Т.Кузнецов. – Клозо-додекаборатный анион как ацидолиганд в координационных соединениях Ag(I). –XVIII Менделеевский съезд по общей и прикладной химии. Тезисы докладов. Москва. 2007. Т.1. С.207.
48. В.В.Дроздова, Е.А.Малинина, В.Н.Мустяца, И.Н.Полякова, Н.Т.Кузнецов. – Ундекагидро-декаборатный анион в реакциях комплексообразования с металлами IБ-группы. – XVIII Менделеевский съезд по общей и прикладной химии. Тезисы докладов. Москва. 2007. Т.1. С.206.
49. Л.В.Гоева, О.Н.Белоусова, Е.А.Малинина, Н.Т.Кузнецов. – Колебательные спектры в координационной химии кластерных анионов бора. – XVIII Менделеевский съезд по общей и прикладной химии. Тезисы докладов. Москва. 2007. Т.1. С.177.
50. V.Drozdova, E.Malinina, I.Polyakova, N.Kuznetsov. – Coordination isomerism in complexes of Cu(I) and Ag(I) with the closo-decaborate anion B10H102- and triphenylphosphine. – 38th International Conference on Coordination Chemistry (ICCC 38). Israel. 2008. P. 524.
51. E.Malinina, V.Drozdova, I.Polyakova, N.Kuznetsov. – Bimetallic complexes of the ib-group metals with closo-borate anions. – 38th International Conference on Coordination Chemistry (ICCC 38). Israel. 2008. P. 512.
52. E.Malinina, V.Drozdova, I.Polyakova, N.Kuznetsov. – Specific interactions in common salts and complexes of boron cluster anions BnHn2- (n = 10, 12). – International Conference on Boron Chemistry IMEBORON XIII. Spain. Platja d’Aro. 2008. P. P085.
53. V.Drozdova, E.Malinina, I.Polyakova, N.Kuznetsov. – Super-electron deficient boron cluster anions BnHn+1- (n = 10, 12) in complex formation reactions. – International Conference on Boron Chemistry IMEBORON XIII. Spain. Platja d’Aro, 2008. P. P040.
[1] в дальнейшем – клозо-декаборатный и клозо-додекаборатный анионы, клозо-боратные анионы
[2] W. N. Lipscomb. — J. Chem. Phys., 1962. V.37(8). P.1779-1784; W. N. Lipscomb. — Inorg. Chem., 1974. V.13(11). P.2772-2774.
[3] Кузнецов Н.Т., Климчук Г.С., Канаева О.А. – Журнал неорганической химии. 1975. Т.20. № 4. С.2557.
[4] O. Volkov, Ch. Hu, P. Paetzold. — Z., Anorg., Allg., Chem., 2005. V. 631. P.1107-1112.
[5] Мустяца В.Н., и др. — Доклады АН СССР, 1988, Т.301, №6, С.1396.
[6] Мебель А.М., Чаркин О.П., Солнцев К.А., Кузнецов Н.Т. — Журнал неорганической химии. 1988. Т.33. С.2263.
[7] Mebel A.M. et al. — J. Mol. Struct. (Theochem). 1999. V. 461-462. P.187.
[8] J.T.Gill, S.J.Lippard. — Inorg. Chem. 1975. V.14. No.4. P.751.
[9] Ni Chaozhou, Ma Yilin, Sun Cuifang et al. //Acta Chim. Sinica. 1985. V.43. P.411
[10] Preetz W. et al. // Chem. Ber. 1997. Bd. 130. S. 405;
[11] Volkov O. et al. // Ztschr. anorg. und allg. Chem. 2005. Bd. 631. S. 1909.
[12] W.Preetz et al. // Z. Naturforsch. 1997. 52 b. 975.
[13] Якушев А.Б. и др. // Координационная химия. 1990. Т. 16. № 7. С. 867.
[14] Fuller D.J., Kepert D.L., Skelton B.W. et al. //Australian J.Chem. 1987. V.40. №12. P.2097.
[15] Chantler C.T., Maslen E.N. // Acta Cryst. B. 1989. V.45. №3. P.290.
[16] Элементный анализ осуществляли на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Бор определяли методом атомно-абсорбционной спектроскопии на спектрофотометрах Perkin-Elmer (CША) модель 2100 с электротермическим атомизатором HGA – 700, определение Cu, Ag и Au проводили на ААS-303 в пламени ацетилен-воздух. ИК-спектры записывали на ИК Фурье - спектрометре ИНФРАЛЮМ ФТ-02 в области 400-4000 см-1. Спектры 11B и 11B {1H} ЯМР записывали на спектрометре «Bruker AC 200» на частоте 64.297 МГц. Рентгеноструктурные исследования проводили на автоматических дифрактометрах Enraf-Nonius CAD-4, Bruker AXS P4 и Bruker AXS SMART при комнатной температуре и 160 К. Расчеты по расшифровке структур проводились с использованием программ SHELXS97 и SHELXL97. Структуры расшифрованы прямым методом. Положения атомов водорода полиэдрических анионов найдены из разностных синтезов Фурье и идеализированы или уточнены по модели наездника, R-фактор эксперимента не превышал 5.

