Дитиофосфорильные производные циклических монотерпенов
На правах рукописи
Софронов Артём Владимирович
Дитиофосфорильные производные
циклических монотерпенов
02.00.08 - химия элементоорганических соединений
А в т о р е ф е р а т
диссертации на соискание учёной степени
кандидата химических наук
Казань - 2010
Работа выполнена на кафедре высокомолекулярных и элементоорганических соединений Химического института им. А.М. Бутлерова федерального государственного автономного образовательного учреждения высшего профессионального образования «Казанский (Приволжский) федеральный университет».
| Научный руководитель: | доктор химических наук Низамов Ильяс Саидович |
| Официальные оппоненты: | доктор химических наук, профессор Газизов Мукаттис Бариевич |
| доктор химических наук, профессор Гареев Роберт Давлетшиевич | |
| Ведущая организация: | Санкт-Петербургский технологический институт (технический университет) |
Защита состоится 16 декабря 2010 г. в 1430 ч на заседании диссертационного совета Д 212.081.03 по защите диссертаций на соискание учёной степени доктора и кандидата наук в ФГАОУВПО «Казанский (Приволжский) федеральный университет» по адресу: 420008, г. Казань, ул. Кремлёвская, 18, КГУ, Бутлеровская аудитория.
С диссертацией можно ознакомиться в научной библиотеке им. Н.И. Лобачевского ФГАОУВПО «Казанский (Приволжский) федеральный университет».
Электронный вариант автореферата размещен на сайте ФГАОУВПО «Казанский (Приволжский) федеральный университет» www.ksu.ru
Отзывы на автореферат, заверенные печатью, просим направлять по адресу: 420008, г. Казань, ул. Кремлёвская, 18, ФГАОУВПО «Казанский (Приволжский) федеральный университет», научная часть.
Автореферат разослан 13 ноября 2010 г.
Учёный секретарь диссертационного
совета, кандидат химических наук, доцент Казымова М.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Тиокислоты четырёхкоординированного атома фосфора и их производные привлекают внимание исследователей своим фундаментальным значением в синтезе различных фосфорорганических соединений, обладающих полезными свойствами (присадки к смазочным маслам и топливам, экстрагенты, комплексоны, пестициды, лекарственные препараты, регуляторы вулканизации каучуков и т.п.) и в развитии ряда теоретических проблем химии фосфора (таутомерии, реакционной способности, комплексообразования, стереохимии, конформационного анализа и т.п.). Среди тиокислот четырёхкоординированного атома фосфора и их производных особый интерес представляют соединения с хиральными центрами в качестве потенциальных биологически активных веществ. Источником хиральности при получении этих соединений могут служить такие доступные природные соединения, как терпены. Терпеноиды являются биорегуляторами, играющими важную роль в ферментативном синтезе биополимеров. На основе фосфорсодержащих производных терпеноидов могут быть получены практически полезные вещества для лесохимической, нефтехимической, фармацевтической и парфюмерной промышлености. Субстратами могут служить терпенолы и непредельные терпеновые углеводороды, в том числе оптически активные. В качестве тиофосфорилирующих агентов в диссертационной работе использованы тетрафосфордекасульфид, 1,3,2,4-дитиадифосфетан-2,4-дисульфид и дитиофосфорные кислоты.
Целью работы является синтез тиофосфорилированных производных монотерпенов и изучение их биологической и антикоррозионной активности.
Научная новизна работы. Впервые систематически изучены реакции тетрафосфордекасульфида и 1,3,2,4-дитиадифосфетан-2,4-дисульфидов с циклическими монотерпенолами, в результате которых синтезированы новые О-терпениловые дитиофосфорные и арилдитиофосфоновые кислоты, в том числе оптически активные. Реакции тетрафосфордекасульфида с L-(-)- и и D-(+)-формами ментола приводят к образованию новых оптически деятельных О,О-дитерпениловых дитиофосфорных кислот, из которых получены соответствующие аммониевые соли. Реакции 2,4-диарил-1,3,2,4-дитиадифосфетан-2,4-дисульфидов с энантиочистыми формами ментола открывают путь к новым оптически активным О-терпениловым арилдитиофосфоновым кислотам. Установлено, что рацемизации в реакциях
L-(-)-ментола или D-(+)-ментола с тетрафосфордекасульфидом и 1,3,2,4-дитиадифосфетан-2,4-дисульфидами не происходит.
Впервые установлено, что при тиофосфорилировании энантиочистых бициклических монотерпенолов, таких как (-)-борнеол, (1R)-эндо-(+)-фенхиловый спирт, (1S,2S,3S,5R)-(+)-изопинокамфеол и (1R)-(-)-нопол под действием тетрафосфордекасульфида и 1,3,2,4-дитиадифосфетан-2,4-дисульфидов, перегруппировки Вагнера-Меервейна не происходит. В ходе этих превращений оптическая активность сохраняется. Впервые проведено тиофосфорилирование тимола в качестве ароматического монотерпенола с образованием дитиофосфорных и дитиофосфоновых кислот с фармакофорными О-арильными заместителями.
Полученные дитиофосфорные и дитиофосфоновые кислоты с О-терпениловыми заместителями превращены в соответствующие аммониевые соли, которые в реакциях с бензоилхлоридом, монохлорметилацетатом и эпихлоргидрином привели к образованию новых дитиофосфатов и дитиофосфонатов с фармакофорными группами в S-органическом заместителе. Полученные эфиры являются терпеновыми аналогами важнейших пестицидных препаратов. В процессе этерификации потери оптической активности не происходит.
Впервые установлена структура первичных продуктов присоединения дитиофосфорных кислот к непредельным терпеновым олефинам, таким как камфен и R-(+)-лимонен. В реакциях дитиофосфорных кислот с рацемическим камфеном и R-(+)-лимоненом определена региохимия присоединения по двойным связям. Реакции протекают в соответствии с правилом Марковникова в присутствии кислот Льюиса – хлоридов цинка, никеля, меди и железа(III). Присоединение дитиофосфорных кислот к камфену сопровождается перегруппировкой Вагнера-Меервейна камфановой структуры в борнановую. В случае R-(+)-лимонена присоединение происходит региоспециифически с участием экзоциклической двойной связи.
Практическая значимость работы. Полученные дитиофосфорные и дитиофосфоновые кислоты, их аммониевые соли и эфиры испытаны в качестве биологически активных веществ. Анализ компьютерных прогнозов биологической активности по программе PASS показал, что О,О-диментилдитиофосфорные кислоты и им подобные О,О-дитерпенилдитиофосфорные кислоты могут проявлять потенциальную активность в качестве соединений для укрепления стенок кровеносных сосудов и ингибировать действие ряда ферментов. Экспериментальными исследованиями установлено, что дитиофосфаты, синтезированные на основе камфена и R-(+)-лимонена, мутагенной активностью не обладают и являются генетически безопасными. Дитиофосфорные и арилдитиофосфоновые кислоты с О-терпениловыми заместителями проявляют антимикробную активность.
Дитиофосфаты, полученные на основе монотерпенолов, содержат дитиофосфорильную группу, способную к координации с активными центрами поверхности железа. Эта способность дитиофосфатов монотерпенов использована при изучении их антикоррозионной активности по отношению к изделиям из мягкой стали. Установлено, что эти соединения эффективно ингибируют коррозию мягкой стали с ингибирующей активностью до 91-93 %. Дитиофосфорные кислоты на основе терпенолов позволяют получать длительный защитный эффект при ингибировании углекислотной коррозии железа в меньшей концентрации препаратов (10 мг/л) по сравнению с концентрациями 20-40 мг/л товарных ингибиторов (Lubrizol, Corexit, Азимут, Danox, Рекорд 608).
Апробация работы. Основные результаты работы докладывались и обсуждались на итоговой научной конференции ФГАОУВПО «Казанский (Приволжский) федеральный университет» (2009 гг.); VI-ой и VII-ой научных конференциях молодых учёных, аспирантов и студентов научно-образовательного центра Казанского университета «Материалы и технологии XXI века» (2007 г., 2008 г.); 17-ой международной конференции по химии фосфора (г. Ксиамен, КНР, 2007 г.); региональной научно-практической конференции «Cинтез и перспективы использования новых биологически активных соединений» (г. Казань, 2007 г.); XV-ой международной конференции по химии соединений фосфора (г. Санкт-Петербург, 2008 г.), первом кластере конференций ChemWasteChem. (г. С.-Петербург, 2010 г.) и 18-ой международной конференции по химии соединений фосфора (г. Вроцлав, Польша, 2010 г.).
Публикации. Основное содержание диссертации изложено в 13 публикациях, в том числе в 5 статьях, и тезисах 8 докладов международных и всероссийских конференций.
Объем и структура диссертации. Диссертация состоит из введения, трёх глав, списка литературы и приложения; включает 9 таблиц, 72 рисунка и библиографию из 161 литературных ссылок. В первой главе приведён литературный обзор, посвящённый синтезу фосфорсероорганических соединений на основе сульфидов фосфора и тиокислот фосфора. Во второй главе обсуждаются результаты исследования автора. В третьей главе приводится описание экспериментов.
Диссертационная работа поддержана грантом совместной программы CRDF (REC-007) и министерства образования и науки РФ "Фундаментальные исследования и высшее образование". Автор приносит благодарность научному руководителю доктору химических наук Низамову И.С. за помощь в работе и доктору химических наук профессору Черкасову Р.А., принимавшему участие в обсуждении отдельных результатов работы.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Тиофосфорилирование различных форм ментола
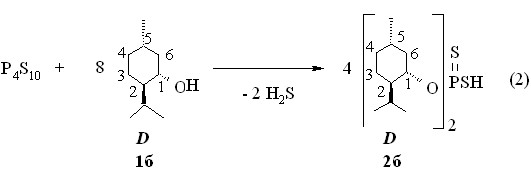
Ранее тетрафосфордекасульфид использовали для определения энантиомерного и диастереомерного избытка спиртов, содержащих хиральные центры, с помощью метода ЯМР 31Р (Feringa B.L., 1987; Альфонсов В.А. с сотр., 1998). До нашей работы изучена реакция L-ментола с тетрафосфордекасульфидом методом спектроскопии ЯМР 31Р. Нами установлено, что О,О-ди-(-)-1R,2S,5R-2-изо-пропил-5-метилциклогекс-1-илдитиофосфорная кислота 2а образуется с выходом 88 % (т. пл. 152 оС) при нагревании смеси L-(-)-ментола 1а с тетрафосфордекасульфидом в молярном соотношении 8:1 в хлороформе при 50 оС в течение 2 ч (реакция 1). Кислота 2а проявляет оптическую активность ([]22D –64.7o (c 1.0, C6H6), что согласуется со знаком угла оптического вращения L-(-)-ментола 1а ([]23D –48o, c 10, EtOH). В спектре ЯМР 31Р в бензоле кислоты 2а имеется синглетный сигнал при Р 81.9 м.д. В ИК спектре продукта 2а валентные колебания связи S-H проявляются в виде слабой широкой полосы поглощения при 2406 см-1. По данным спектров ЯМР 1Н кислоты 2а в CDCl3 установлено смещение в слабое поле сигнала протона фрагмента РОС1H при 4.46 м.д. в виде дублета дублетов триплетов (3JНН 6.6 Гц, 3JРH 11.0 Гц) по сравнению с аналогичным протоном фрагмента ОС1H в спектре ЯМР 1Н L-(-)-ментола 1а ( 3.43 м.д.). В масс-спектре химической ионизации соединения 2а присутствует массовый пик m/z 407.2 его молекулярного иона [M + H]+ (вычислено M 406.6).

Образование изомерной О,О-ди-(+)-1S,2R,5S-2-изо-пропил-5-метилциклогекс-1-илдитиофосфорной кислоты 2б происходит при нагревании смеси D-(+)-ментола с тетрафосфордекасульфидом в хлороформе при 50 °С в течение 1 ч с выходом 88 % (реакция 2). И в случае кислоты 2б сохраняется соответствующий знак угла оптического вращения ([]22D +65.8°, с 1.0, С6Н6) относительно данных D-(+)-ментола 1б ([]23D +48o, c 10, EtOH). Параметры ИК и ЯМР 1Н спектров кислоты 2б идентичны данным L-(-)-изомера 1а.
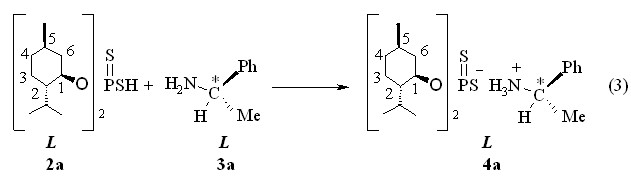
Кислота 2а введена в реакцию с таким хиральным первичным амином, как L-(–)--фенил(этил)амин 3а с экзотермическим эффектом с образованием соответствующей L--фенил(этил)аммониевой соли 4а с выходом 70 % (реакция 3). Соль 4а сохраняет оптическую активность ([]22D – 60.0o, c 1.0, C6H6). В спектре ЯМР 31Р соли 4а в бензоле имеется синглетный сигнал при Р 106.6 м.д. ИК спектр соединения 4а содержит две широкие полосы поглощения при 3345 и 3273 см-1 валентных колебаний группы NH3+. Молекулярный ион [М]+. продукта 4а определяется в виде массового пика m/z 527.3 в масс-спектре электронного удара (вычислено М 527.8).
При замене тетрафосфордекасульфида на 2,4-диарил-1,3,2,4-дитиадифосфетан-2,4-дисульфиды 5а,б в реакции с
L-(-)-ментолом 1а при 50 оС в течение 1 ч в хлороформе или бензоле получены О-(-)-1R,2S,5R-2-изо-пропил-5-метилциклогекс-1-ил(арил)дитиофосфоновые кислоты 6а,б с выходами 87-94 % (реакция 4).
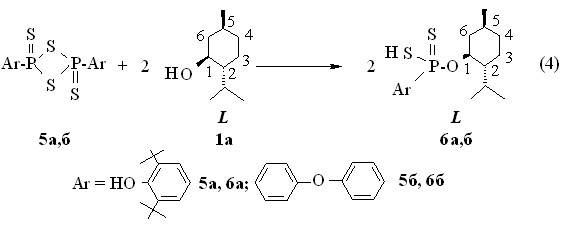
В дитиофосфоновых кислотах 6а,б оптическая активность обусловлена хиральностью О-ментильного заместителя (для кислоты 6а []22D –33.2o, c 1.0, C6H6, для соединения 6б []22D –35.0o, c 1.0, C6H6). В спектрах ЯМР 31Р кислот 6а и 6б в бензоле имеются по одному синглетному сигналу при р 86.1 и 83.7 м.д. В масс-спектрах химической ионизации соединений 6а и 6б имеются массовые пики m/z 457.3 и 421.1, соответственно, их молекулярных ионов [М + Н]+ (вычислено М 456.7 и 420.6, соответственно).
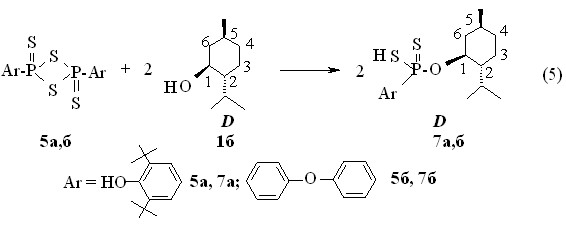
Установлено, что О-(+)-1S,2R,5S-2-изо-пропил-5-метилциклогекс-1-ил-3,5-ди-трет-бутил-4-гидроксифенилдитиофосфоновая кислота 7а и О-(+)-1S,2R,5S-2-изо-пропил-5-метилциклогекс-1-ил-4-феноксифенилдитиофосфоновая кислота 7б образуются с выходами 94-97 % при нагревании D-(+)-ментола 1б с 2,4-диарил-1,3,2,4-дитиадифосфетан-2,4-дисульфиды 5а,б в хлороформе при 50 °С в течение 1 ч (реакция 5). Продукт 7а: []22D +32.4°, с 1,0, С6Н6; кислота 7б: +33.5° (с 1.0, С6Н6). Данные ИК, ЯМР 31Р и31Р 1Н спектров D-(+)-изомеров 7а,б идентичны данным L-(-)-изомеров 6а,б.
L--фенил(этил)аммониевая соль О-(-)-1R,2S,5R-2-изо-пропил-5-метилциклогекс-1-ил-3,5-ди-трет-бутил-4-гидроксифенилдитиофосфоновой кислоты 8 (Р 103.0 м.д., []22D -39.2о, c 1.0, С6Н6) получена при обработке L-(–)--фенил(этил)амином 3а бензольного раствора кислоты 6а при 20 оС (реакция 6). Кислоты 7а и 7б превращены в соответствующие аммониевые соли 9a,б в результате барботажа аммиака через их бензольные растворы при 20 °С (реакция 7). Соль 9б имеет температуру плавления 86-88 оС. В спектрах ЯМР 31Р в бензоле или хлорофоре солей 9a,б содержатся по одному синглетному сигналу при Р 104.0 и 100.4 м.д., соответственно.
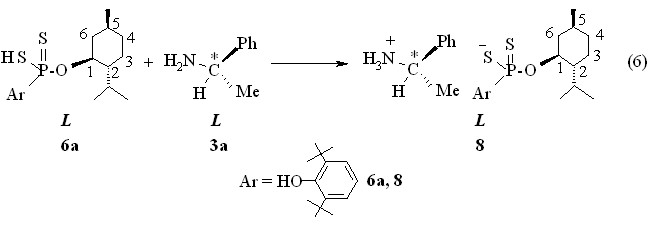
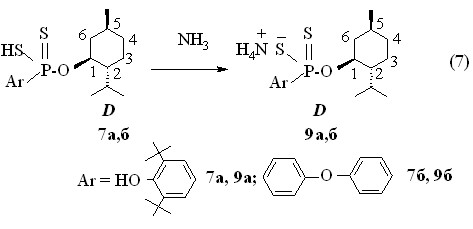
Таким образом, в реакциях 2,4-диарил-1,3,2,4-дитиадифосфетан-2,4-дисульфидов с энантиочистыми ментолами рацемизации образующихся арилдитиофосфоновых кислот и их аммониевых солей не происходит.
2. Тиофосфорилирование (-)-борнеола
Круг оптически деятельных терпенсодержащих дитиофосфорных и дитиофосфоновых кислот расширен путем вовлечения хиральных бициклических монотерпенолов в реакции тиофосфорилирования. Особенностью бициклических терпеновых спиртов является их способность к скелетным перегруппировкам. Установлено, что реакция (-)-борнеола 10 с тетрафосфордекасульфидом протекает в бензоле при 50 oC в течение 1 ч с образованием О,О-ди{эндо-(1S)-триметилбицикло[2.2.1]гепт-2-ил}-(-)-дитиофосфорной кислоты 11 (выход 77 %, очищен колоночной хроматографией, реакция 8). Знак угла оптического вращения кислоты 11 ([]22D -13.2o, c 1.0, C6H6) согласуется со знаком угла []23D (-)-борнеола 10 (–35.6o, c 5, EtOH). Продукт 11: Р 86.9 м.д. в C6H6.
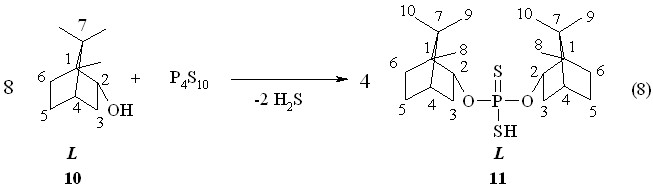
Аммониевая соль О,О-ди{эндо-(1S)-триметилбицикло[2.2.1]гепт-2-ил}-(-)-дитиофосфорной кислоты 12 (т. пл. 182-183 °С; []22D -14.1o, c 1.0, C6H6; Р 112.1 м.д. в С6Н6) образуется при барботаже аммиака через бензольный раствор кислоты 11 в течение 1 ч при 20 oC (реакция 9).
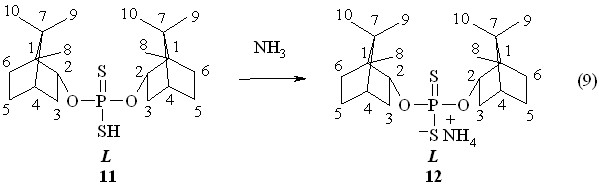
При обработке раствора (-)-борнеола 10 в бензоле 2,4-диарил-1,3,2,4-дитиадифосфетан-2,4-дисульфидами 5а,б при 50 °С в течение 1 ч происходит образование О-{эндо-(1S)-триметилбицикло[2.2.1]гепт-2-ил}-(-)-арилдитиофосфоновых кислот 13а,б с выходами 73-93 % (реакция 10). Кислота 13а: []22D -8.9o (c 1.0, C6H6); Р 86.4 м.д. в С6Н6. Продукт 13б: Р 84.6 м.д. в С6Н6. По данным спектров ЯМР 1Н установлено, что в процессе образования дитиофосфорных и дитиофосфоновых кислот на основе (-)-борнеола скелетных перегруппировок терпенового фрагмента в мягких условиях не происходит.
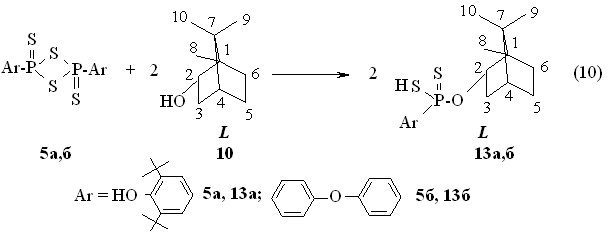
Аммониевая соль О-{эндо-(1S)-триметилбицикло[2.2.1]гепт-2-ил}-(-)-4-феноксифенилдитиофосфоновой кислоты образуется с выхолом 84 % в реакции кислоты 13б с аммиаком при 20 oC (реакция 11). Соль 13б: []22D -10.0o, c 1.0, C6H6: Р 106.7 м.д.
В цепи превращений: энантиочистый (-)-борнеол – тиокислота четырёхкоординированного атома фосфора – её аммониевая соль – рацемизации не происходит.
3. Тиофосфорилирование (1R)-эндо-(+)-фенхилового спирта
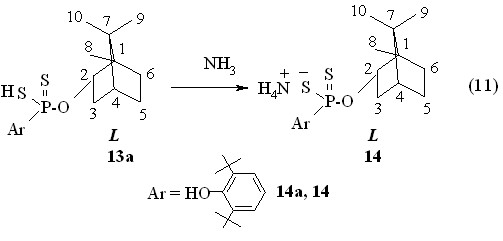
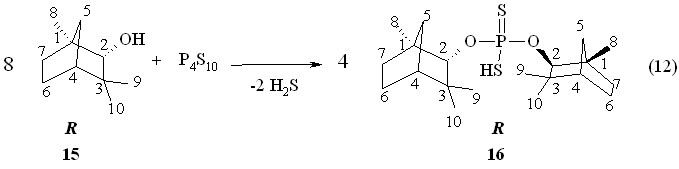
При проведении реакции тетрафосфордекасульфида с (1R)-эндо-(+)-фенхиловым спиртом 15 в бензоле при 50 °С в течение 2 ч синтезирована О,О-ди-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-илдитиофосфорная кислота 16 с выходом 98 % ([]22D +30.0o, c 1.0, C6H6; Р 87.6 м.д. в С6Н6; реакция 12). Отметим низкопольное смещение сигнала ( 3.98 м.д.) метинового протона (фрагмент P-OC2H, 3JРН 15.9 Гц) в спектре ЯМР 1Н кислоты 16 в CDCl3 относительно сигнала ( 3.37 м.д.) аналогичного протона (1R)-эндо-(+)-фенхилового спирта 15 (фрагмент С-OC2H).
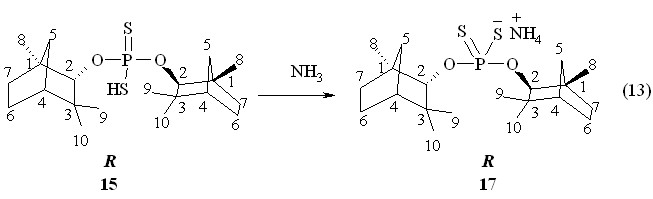
Оптически активная аммониевая соль О,О-ди-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-илдитиофосфорной кислоты 17 (т. пл. 120-121 °С; []22D +16.0o, c 1.0, C6H6; р 112.1 м.д. в С6Н6) получена в реакции 16 с аммиком (20 °С, 1 ч, бензол, реакция 13).
Установлено, что 2,4-диарил-1,3,2,4-дитиадифосфетан-2,4-дисульфиды 5а,б реагируют с (1R)-эндо-(+)-фенхиловым спиртом 15 при 50 °С в течение 1 ч с образованием О-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-ил-арилдитиофосфоновых кислот 18а,б с выходами 87-98 % (реакция 14). Продукты 18а,б очищены колоночной хроматографией. Кислота 18б: []22D +19.5o, 1.0, C6H6; Р 85.3 м.д. в С6Н6).
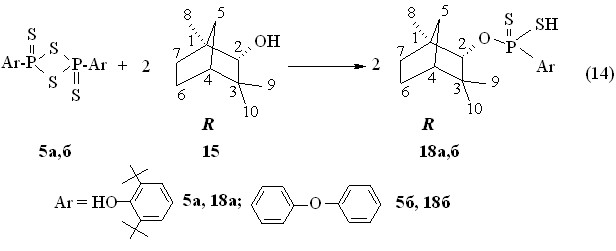
Аммониевая соль О-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-ил-4-феноксифенилдитиофосфоновой кислоты 19 (Р 104.1 м.д. в С6Н6) получена с выходом 82 % при барботаже аммиака через бензольный раствор кислоты 18б при 20 oC (реакция 15).
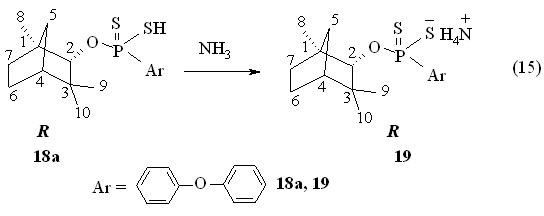
Спектральные данные указывают на сохранение оптической активности, знака угла оптического вращения и отсутствие вторичных превращений в реакциях тиофосфорилироваия (1R)-эндо-(+)-фенхилового спирта.
4. Тиофосфорилирование (1S,2S,3S,5R)-(+)-изопинокамфеола
При обработке (1S,2S,3S,5R)-(+)-изопинокамфеола 20 тетрафосфордекасульфидом при 50 °С в течение 2 ч в бензоле синтезирована О,О-ди(1S,2S,3S,5R)-(+)-триметилбицикло[3.1.1]гепт-3-илдитиофосфорная кислота 21 с выходом 77 % (реакция 16). Кислота 21 очищена хроматографированием на колонке ([]22D +35.0o, c 1.0, C6H6; Р 85.1 м.д. в С6Н6; ИК спектр: 2583 и 2403 см-1 - валентные колебания связи S-H).
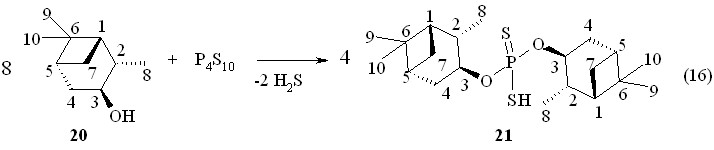
Из кислоты 21 при 20 oC в бензоле получена соответствующая аммониевая соль 22 (т. пл. 154-155 °С; []22D +21.1o, c 1.0, C6H6; Р 110.5 м.д. в С6Н6, реакция 17).

Реакция 2,4-диарил-1,3,2,4-дитиадифосфетан-2,4-дисульфидов 5а,б с (1S,2S,3S,5R)-(+)-изопинокамфеолом 20 в бензоле при 50 °С в течение 1 ч приводит к образованию О-(1S,2S,3S,5R)-(+)-триметилбицикло[3.1.1]гепт-3-ил-арилдитиофосфоновых кислот 23а,б (выходы до 99 %), для очистки которых использовали колоночную хроматографию (реакция 18). Величина []22D кислоты 23б (+50.7o, c 1.0, C6H6) существенно выше значения []22D (1S,2S,3S,5R)-(+)-изопинокамфеола 20 (+35.1o, c 20, EtOH). В спектрах ЯМР 31Р в бензоле соединения 23а сигнал находится при Р 86.0 м.д., а кислоты 23б – при Р 83.4 м.д.
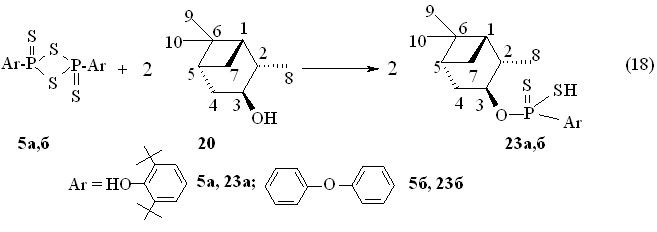
Кислота 23а превращена (20 оС, 1 ч, бензол) в соответствующую аммониевую соль 24 (реакция 19).
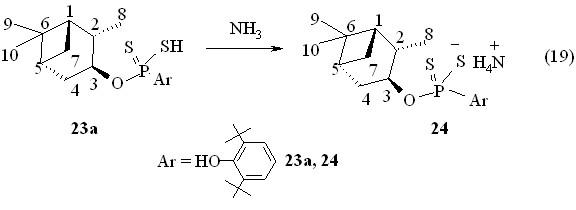
Аммониевая соль О-(1S,2S,3S,5R)-(+)-триметилбицикло[3.1.1]гепт-3-ил-3,5-ди-трет-бутил-4-гидроксифенилдитиофосфоновой кислоты 24 оптически активна (т. пл. 110-111 °С; []22D +18.0o, c 1.0, C6H6; Р 105.7 м.д. в C6H6). В реакциях тиофосфорилирования (1S,2S,3S,5R)-(+)-изопинокамфеола происходит сохранение знака угла оптического вращения.
5. Тиофосфорилирование (1R)-(-)-нопола
В рассмотренных выше реакциях использованы монотерпенолы, содержащие 10 атомов углерода. В то же время, химическое поведение терпеновых спиртов, имеющих в своих молекулах 11 углеродных атомов, в реакциях тиофосфорилирования оставалось неизвестным. Среди них отметим (1R)-(-)-нопол 25 с двойной связью. Найдено, что взаимодействие (1R)-(-)-нопола 25 с 2,4-диарил-1,3,2,4-дитиадифосфетан-2,4-дисульфидами 5а,б в бензоле происходит при 50 °С в течение 1 ч с образованием О-{(1R)-(-)-6,6-диметилбицикло[3.1.1]гепт-2-ен}-2-этил-арилдитиофосфоновых кислот 26а,б с выходами до 98 % (реакция 20). Очистку кислот 26а,б проводили хроматографированием на колонке. Кислота 26а имеет величину []22D -13.0o (c 1.0, C6H6). Спектры ЯМР 31Р (С6Н6) продукта 26а содержит синглетный сигнал при Р 87.1 м.д., а кислоты 26б при Р 84.3 м.д. В ИК спектре кислоты 26а при 1635 см-1 находится полоса поглощения валентных колебаний двойной связи. В спектре ЯМР 1Н соединения в CDCl3 протон при двойной связи С=С3Н проявляется в виде двух мультиплетов при 5.30 и 5.36 м.д.
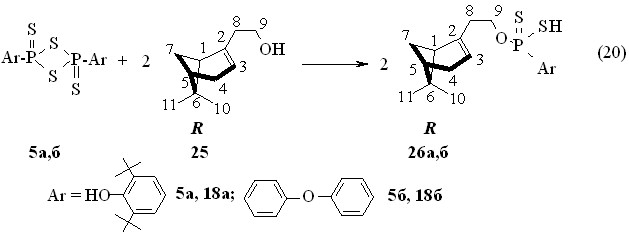
Эти данные свидетельствуют о сохранении структуры нопола как непредельного терпенового спирта в продуктах 26а,б.
6. Тиофосфорилирование тимола
Среди ароматических монотерпениловых спиртов одним из самых доступных является тимол, который ранее в реакции тиофосфорилирования не вводился. Между тем развитие этого направления может открыть путь к новым биологически активным соединениям, содержащим фармакофорные ароматические группы. Нами впервые установлено, что реакция тетрафосфордекасульфида с тимолом 27 при 50 °С в течение 2 ч приводит к образованию О,О-ди(2-изо-пропил)-5-метилфен-1-илдитиофосфорной кислоты 28 с выходом 79 % (реакция 21).
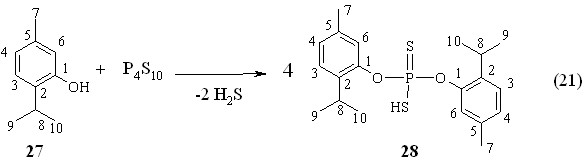
Химический сдвиг кислоты 28 в спектре ЯМР 31Р (Р 76.5 м.д. в C6H6) смещен в сторону высокого поля по сравнению с алифатическим аналогом – кислотой 2а (Р 81.9 м.д.). Спектр ЯМР 1Н соединения 28 в CDCl3 содержит интенсивный дублет при 1.26 м.д протонов двух геминальных метильных групп мостикового фрагмента (СН3)2СН (3JНН 7.0 Гц). Три протона метильного заместителя дают синглет при 2.29 м.д. Септет при 3.18 м.д. относится метиновому протону изо-пропильного заместителя (СН3)2СН (3JНН 7.0 Гц).
Аммониевая соль О,О-ди(2-изо-пропил)-5-метилфен-1-илдитиофосфорной кислоты 29 получена в реакции (22) (т. пл. 50-51 °С; Р 105.8 м.д. в C6H6).
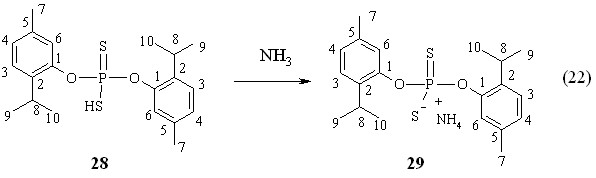
Установлено, что 2,4-бис(3,5-ди-трет-бутил-4-гидроксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид 5а тиофосфорилирует тимол 27 при 50 °С (1 ч) с образованием О-(2-изо-пропил)-5-метилфен-1-ил-3,5-ди-трет-бутил-4-гидроксифенилдитиофосфоновой кислоты 30 с выходом 72 % (Р 86.0 м.д. в C6H6). Спектр ЯМР 1Н продукта 30 в CDCl3 содержит дублет при 7.83 м.д. от двух орто-протонов 3,5-ди-трет-бутил-4-гидроксифенильного заместителя (фрагмент 2,6-С6Н2Р, 3JРН 15.7 Гц).

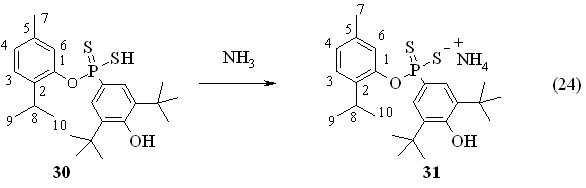
Барботаж аммиака через раствор кислоты 30 в бензоле при 20 °С привел к образованию соответствующей аммониевой соли 31 с выходом 72 % (Р 109.1 м.д. (Р 109.1 м.д. (реакция 24). Полученные аммониевые соли 29 и 31 могут быть использованы для дальнейших превращений, например, в реакциях замещения с целью ввода фармакофрных групп.
7. Реакции аммониевых солей терпениловых дитиофосфорных и дитиофосфосфоновых кислот с бензоилхлоридом
Традиционный подход к синтезу дитиофосфатных пестицидов включает введение фармакофорной группы в S-органический заместитель. В отличие от этого в диссертационной работе предлагается новый подход к физиологически активным соединениям путем введения фармакофорных терпениловых фрагментов в О,О-диорганические заместители у дитиофосфорильного синтона. При этом S-органический заместитель в дитиофосфатах может содержать фармакофорную группу, как и другие обычные дитиофосфатные пестициды. В связи с этим оптически активные дитиофосфорные кислоты 12, 17 и 22, полученные в реакциях (-)-борнеола 10, (1R)-эндо-(+)-фенхилового спирта 15 и (1S,2S,3S,5R)-(+)-изопинокамфеола 20 с тетрафосфордекасульфидом, в виде их аммониевых солей введены в реакции с органическими соединениями, содержащими лабильные связи C-Cl. Впервые установлено, что аммониевые соли О,О-ди{эндо-(1S)-триметилбицикло[2.2.1]гепт-2-ил}-(-)-дитиофосфорной кислоты 12, О,О-ди-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-илдитиофосфорной кислоты 17 и О,О-ди(1S,2S,3S,5R)-(+)-триметилбицикло[3.1.1]гепт-3-илдитиофосфорной кислоты 22 реагируют с бензоилхлоридом в бензоле с образованием О,О-дитерпенил-S-фенилкарбонилдитиофосфатов 32а-в, очищенных колоночной хроматографией (выходы 77-92 %, реакция 25).
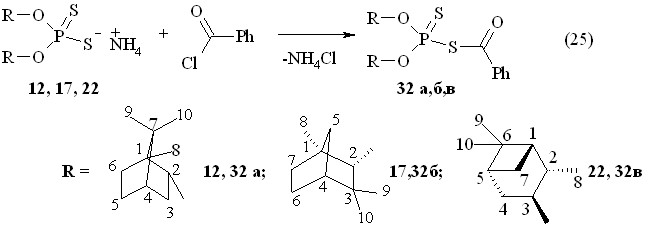
Дитиофосфаты 32а-в оптической активности не теряют (соединение 32а: []22D -9.3o, c 1.0, C6H6; эфир 32б: []22D +37.3o, c 1.0, C6H6). В спектрах ЯМР 31Р соединений 32а-в в бензоле содержатся по одному сигналу в области Р 78-84 м.д. ИК спектр дитиофосфата 32а содержит сильную характеристическую полосу поглощения при 1687 см-1 валентных колебаний связи С=О у фенильного заместителя. Масс-спектр электронного удара соединения 32а содержит массовый ион m/z 506 (вычислено M 506.7).
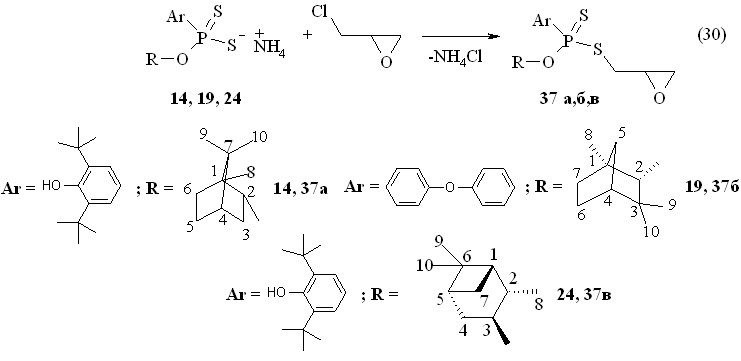
Аммониевые соли О-{эндо-(1S)-триметилбицикло[2.2.1]гепт-2-ил}-(-)-4-феноксифенилдитиофосфоновой кислоты 14, О-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-ил-4-феноксифенилдитиофосфоновой кислоты 19 и О,О-ди(1S,2S,3S,5R)-(+)-триметилбицикло[3.1.1]гепт-3-илдитиофосфорной кислоты 24 реагируют с бензолилхлоридом при 20 °С (1 ч), давая О-терпенил-S-фенилкарбонил(фенил)дитиофосфонаты 33а-в с выходами 89-96 % (реакция 26).
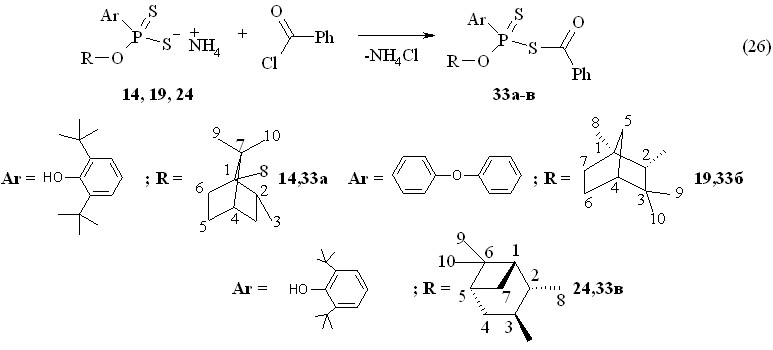
Продукты 33а-в очищены путем хроматографирования на колонке. Они оптически деятельными (соединение 32а: []22D -9.3o; 33б: []22D +23.0o; 33в: +15.2o, для всех случаев c 1.0, C6H6). Масс-спектр электронного удара соединения 33б содержит массовый пик m/z 522.95 его молекулярного иона М+. (вычислено М 522.7). В реакциях аммониевых солей О-терпениларилдитиофосфоновых кислот с бензоилхлоридом происходит образование продуктов этерификации в виде смеси диастереомеров.
8. Реакции аммониевых солей терпениловых дитиофосфорных
и дитиофосфосфоновых кислот с метиловым эфиром
монохлоруксусной кислоты
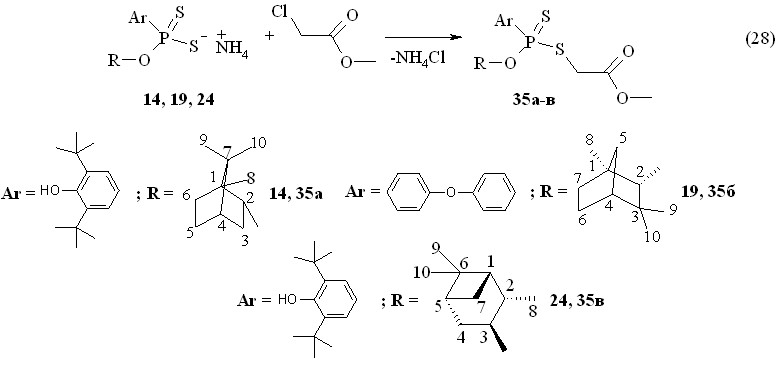
Установлено, что аммониевые соли О,О-ди{эндо-(1S)-триметилбицикло[2.2.1]гепт-2-ил}-(-)-дитиофосфорной кислоты 12, О,О-ди-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-илдитиофосфорной кислоты 17 и О,О-ди(1S,2S,3S,5R)-(+)-триметилбицикло[3.1.1]гепт-3-илдитиофосфорной кислоты 22 вступают во взаимодействие с метиловым эфиром монохлоруксусной кислоты в бензоле при 20-60 °С в течение 1-2 ч, приводя к образованию соответствующих О,О-дитерпенил-S-(метоксикарбонилметил)дитиофосфатов 34а-б с выходами 53-91 % (реакция 27). В спектрах ЯМР 31Р дитиофосфатов 34а-в в бензоле присутствуют по одному сигналу в области Р 92-99 м.д. Спектр ЯМР 1Н продукта 34а в CDCl3 содержит дублет при 3.70 м.д. метиленовых протонов (фрагмент PSCH2C(O), 3JPН 10.5 Гц). Протоны метокси-группы ОСН3 дают синглетный сигнал при 3.76 м.д.

При введении метилового эфира монохлоруксусной кислоты во взаимодействие с аммониевыми солями О-{эндо-(1S)-триметилбицикло[2.2.1]гепт-2-ил}-(-)-4-феноксифенилдитиофосфоновой кислоты 14, О-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-ил-4-феноксифенилдитиофосфоновой кислоты 19 и О-(1S,2S,3S,5R)-(+)-триметилбицикло[3.1.1]гепт-3-ил-3,5-ди-трет-бутил-4-гидроксифенилдитиофосфоновой кислоты 24 в бензоле при 20 °С образуются соответствующие О-терпенил-ил-S-(метоксикарбонилметил)арилдитиофосфонаты 35а-в с выходами 51-95 % (реакция 28). Продукты 35а-в очищены колоночной хроматографией (35а: []22D +22.2o; 35б: []22D +12.0o; 35в: []22D +21.8o, для всех случаев c 1.0, C6H6). Два сигнала при Р 96.8 и 95.7 м.д. (1:1) присутствуют в спектре ЯМР 31Р дитиофосфоната 35в в виде смеси диастереомеров. Масс-спектр электронного удара соединения 35б содержит массовый пик m/z 489.8 его молекулярного иона М+..
9. Реакции аммониевых солей терпениловых дитиофосфорных
и дитиофосфосфоновых кислот с эпихлоргидрином
Установлено, что реакции рацемического эпихлоргидрина с аммониевыми солями О,О-дитерпенилдитиофосфорных кислот 12 и 22 протекают в бензоле с образованием О,О-дитерпенил-S-(2,3-оксиран-мет-1-ил)дитиофосфатов 36а,б с выходами 69-92 % (реакция 29). Продукты 36а,б очищены колоночной хроматографией. В спектрах ЯМР 31Р дитиофосфатов 36а,б в бензоле сигналы находятся в области Р 97-95 м.д.
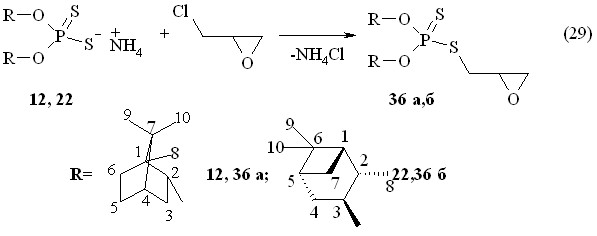
Реакции эпихлоргидрина с аммониевыми солями О-{эндо-(1S)-триметилбицикло[2.2.1]гепт-2-ил}-(-)-4-феноксифенилдитиофосфоновой кислоты 14, О-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-ил-4-феноксифенилдитиофосфоновой кислоты 19 и О-(1S,2S,3S,5R)-(+)-триметилбицикло[3.1.1]гепт-3-ил-3,5-ди-трет-бутил-4-гидроксифенилдитиофосфоновой кислоты 24 в бензоле при 20 °С дают О-терпенилил-S-(метоксикарбонилметил)арилдитиофосфонаты 37а-в (выходы 77-96 %), очищенные колоночной хроматографией (реакция 30). В спектре ЯМР 31Р дитиофосфоната 37б имеется два сигнала при Р 99.1 и 98.0 м.д. в соотношении 1:1 (смесь изомеров). В спектре ЯМР 1Н в CDCl3 соединения 37а при 3.12 и 3.19 м.д. имеются два дублета дублетов метиленовых протонов (фрагмент PSCH2СН, 3JНН 6.4 Гц, 3JРН 16.3 Гц и 3JНН 5.2 Гц, 3JРН 13.6 Гц, соответственно).
Таким образом, разработан новый подход к физиологически активным соединениям дитиофосфатного и дитиофосфонатного строения путем введения фармакофорных групп как в О-, так и S-органические заместители у дитиофосфорильного синтона.
10. Реакции O,O-диалкилдитиофосфорных кислот
с непредельными монотерпенами
В патентах (Barlett J.H. et al. Пат. США 2611728, 1952; Augustine F.B. Пат. США 2665295, 1954) показано, что реакции дитиофосфорных кислот с пиненами и дипентеном при 100-200 оС приводят к образованию смесей фосфорсодержащих продуктов, структура которых установлена не была. В отличие от этого нами найдено, что О,О-диалкилдитиофосфорные кислоты 38а,б присоединяются по двойной связи рацемического камфена 39 в присутствии каталитических количеств безводного хлорида цинка при 50-60 oC в течение 2-3 ч с образованием О,О-диалкил-S-2-(1-метил-7-диметилбицикло[2.2.1]гептил)дитиофосфатов 40а,б (реакция 31).
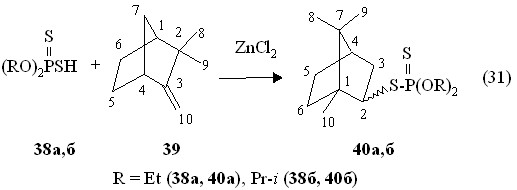
В спектрах ЯМР 31Р дитиофосфатов 40а,б сигналы находятся при Р 94.0 м.д. (соединение 40а) и 92.3 м.д. (продукт 40б). В масс-спектрах электронного удара соединений 40а и 40б имеются массовые пики m/z 322.7 и 350.2, соответственно, их молекулярных ионов [М]+. (вычислено М 322.2 и 350.2). В соответствии со спектрами ЯМР 1Н присоединение О,О-диалкилдитиофосфорных кислот 38а,б по двойной связи камфена 39 протекает по правилу Марковникова и сопровождается скелетной перегруппировкой Вагнера-Меервейна камфановой структуры в борнановую, приводя к смеси экзо- и эндо-изомеров. В спектре ЯМР 1Н протонам трех метильных групп дитиофосфата 40б соответствуют синглеты при 0.84, 0.93 и 1.00 м.д.
Найдено, что присоединение О,О-диалкилдитиофосфорных кислот 38а,б к R-(+)-лимонену 41 протекает в присутствии хлорида цинка при 20-60 °С в течение 2-3 ч с участием экзо-циклической двойной связи, приводя к образованию О,О-диалкил-S-8-[(+)-1-метил-4-изо-пропилциклогек-1-енил]дитиофосфатов 42а,б (реакция 32).
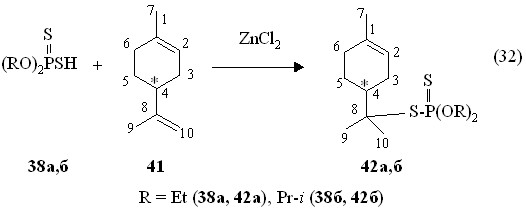
Сигналы в спектрах ЯМР 31Р аддуктов 42а,б расположенв в области Р 87.1-90.4 м.д. Массовый пик m/z 323.2, имеющийся в масс-спектре химической ионизации дитиофосфата 42а, соответствует его молекулярному иону [M + H]+. В масс-спектр электронного удара соединения 42б содержится массовый пик m/z 350.2, соответствующий его молекулярному иону [М]+.. Установлено, что электрофильное присоединение диттиофосфорных кислот 38а,б к камфену и лимонену ускоряется в присутствии и других кислот Льюиса (NiCl2, CuCl, CuCl2, FeCl3) при 20 °С.
11. Практически полезные свойства тиокислот четырёхкоординированного атома фосфора и их производных с терпениловыми заместителями
11.1. Биологическая активность.
Проведенный нами анализ компьютерных прогнозов биологической активности по программе PASS показал, что О,О-диментилдитиофосфорные кислоты и им подобные О,О-дитерпенилдитиофосфорные кислоты могут проявлять потенциальную активность в качестве соединений для укрепления стенок кровеносных сосудов и ингибировать действие ряда ферментов. Экспериментальными исследованиями установлено, что дитиофосфаты, синтезированные на основе камфена и R-(+)-лимонена, мутагенной активностью не обладают и являются генетически безопасными. Дитиофосфорные и арилдитиофосфоновые кислоты с О-терпениловыми заместителями проявляют антимикробную активность.
11.2. Антикоррозионная активность
дитиофосфорных кислот на основе терпенолов
Дитиофосфаты, полученные на основе монотерпенолов, содержат дитиофосфорильную группу, способную к координации с активными центрами поверхности железа. Эта способность дитиофосфатов монотерпенов использована при изучении их антикоррозионной активности по отношению к изделиям из мягкой стали. Установлено, что эти соединения эффективно ингибируют коррозию мягкой стали с ингибирующей активностью до 91-93 % (рис. 1).
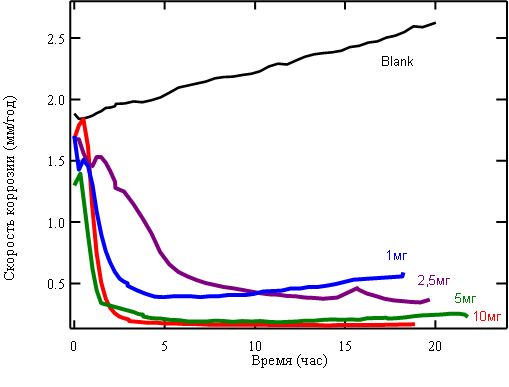
Рис. 1. Динамика изменения скорости коррозии стали под действием О,О-ди-(1R)-эндо-(+)-1,3,3-триметилбицикло[2.2.1]гепт-2-илдитиофосфорной кислоты 16 в зависимости от концентрации ингибитора (для сравнения приведена кривая коррозии в отсутствие добавок).
Дитиофосфорные кислоты на основе терпенолов позволяют получать длительный защитный эффект при ингибировании углекислотной коррозии железа в меньшей концентрации препаратов (10 мг/л) по сравнению с концентрациями 20-40 мг/л товарных ингибиторов (Lubrizol, Corexit, Азимут, Danox, Рекорд 608).
выводы
1. Впервые установлено, что в процессе образования оптически активных дитиофосфорных и арилдитиофосфоновых кислот в реакциях тетрафосфордекасульфида и 2,4-диарил-1,3,2,4-дитиадифосфетан-2,4-дисульфидов с энантиочистыми циклическими монотерпенолами перегруппировки Вагнера-Меервейна не происходит.
2. В ходе превращения дитиофосфорных и арилдитиофосфоновых кислот, полученных на основе нерацемических циклических монотерпенолов, в соответствующие аммониевые соли с последующей этерификацией бензоилхлоридом, монохлорметилацетатом и эпихлоргидрином оптическая активности сохраняется.
3. Впервые осуществлено электрофильное присоединение дитиофосфорных кислот по двойной углерод-углеродной связи неактивированных олефинов в соответствии с правилом Марковникова на примере непредельных циклических монотерпенов с использованием кислот Льюиса. Присоединение дитиофосфорных кислот к камфену сопровождается перегруппировкой Вагнера-Меервейна камфановой структуры в борнановую.
4. Дитиофосфаты, полученные на основе камфена и лимонена, мутагенной активностью не обладают и являются генетически безопасными. Дитиофосфорные и арилдитиофосфоновые кислоты с О-терпениловыми заместителями проявляют антимикробную активность.
5. Дитиофосфорные кислоты на основе терпенолов ингибируют углекислотную коррозию мягкой стали в низких концентрациях.
Основные результаты работы изложены в следующих публикациях
Публикации в изданиях, рекомендованных ВАК РФ,
для размещения материалов кандидатских диссертаций:
1. Низамов И.С., Софронов А.В., Низамов И.Д., Черкасов Р.А., Никитина Л.Е. Реакция O,O-диизопропилдитиофосфорной кислоты с (+)-лимоненом // Журн. oрг. химии. 2007. Т. 43. № 4. С. 621-622.
2. Nizamov I.S., Sofronov A.V., Cherkasov R.A., Nikitina L.E. Dithiophosphorylation of cyclic monoterpenes // Phosphorus, Sulfur, Silicon, and the Related Elements. 2008. V. 183. N 2-3. P. 675-676.
3. Софронов А.В., Альметкина Л.А., Никитин Е.Н., Низамов И.С., Черкасов Р.А. Оптически активные арилдитиофосфоновые кислоты и их соли на основе L-(-)-ментола и D-(+)-ментола // Журн. oрг. химии. 2010. Т. 46. № 2. С. 304-305.
4. Софронов А.В., Низамов И.С., Альметкина Л.А., Никитина Л.Е., Фатыхова Д.Г., Зеленихин П.В., Ильинская О.Н., Черкасов Р.А. Дитиофосфаты монотерпеноидов. Синтез и биологическая активность // Журн. oбщ. химии. 2010. Т. 80. № 7. С. 1101-1105.
5. Низамов И.С., Софронов А.В., Альметкина Л.А., Мусин Р.З., Черкасов Р.А. Синтез оптически активных О,О-ди-L-(-)- и О,О-ди-D-(+)-ментилдитиофосфорных кислот и их аммониевых солей // Журн. oбщ. химии. 2010. Т. 80. № 8. С. 1401-1402.
Тезисы докладов
6. Софронов А.В., Низамов И.С., Мартьянов Е.М., Низамов И.Д., Черкасов Р.А. Дитиофосфорные кислоты в реакциях с монотерпенами // VI Науч. конф. молодых ученых, аспирантов и студентов научно-образовательного центра Казанского госун-та “Материалы и технологии XXI века”. Тез. докл. Казань, 2006. С. 104.
7. Софронов А.В., Шамилов Р.Р., Низамов И.С., Низамов И.Д., Никитина Л.Е., Черкасов Р.А. Тиофосфорилирование терпеноидов // VII Научн. конф. молодых ученых, аспирантов и студентов научно-образовательного центра Казанского госун-та "Материалы и технологии XXI века". Тез. докл. Казань, 2007. С. 118.
8. Nizamov I.S., Sofronov A.V., Cherkasov R.A., Nikitina L.E. Dithiophosphorylation of cyclic monoterpenes // 17th Intern. conf. on phosphorus chemistry. Abstract book. Xiamen. China, 2007. P. 115 (P-165).
9. Софронов А.В., Низамов И.С., Глушко Н.И., Лисовская С.А., Никитина Л.Е., Черкасов Р.А. Монотерпены в реакциях с дитиофосфорными кислотами // Всероссийская научно-практ. конф. “Cинтез и перспективы использования новых биологически активных соединений“. Тез. докл. Казань, 2007. С. 18.
10. Nizamov I.S., Sofronov A.V., Nizamov I.D., Cherkasov R.A. Thiophosphorylation of chiral natural alcohols and diols // XV-th Intern. conf. on the chemistry of phosphorus compounds. Book of abstracts. Saint-Petersburg. Russia, 2008. P. 193. (P-99).
11. Nizamov I.S., Sofronov A.V., Gabdullina G.T., Martianov Ye.M., Al’metkina L.A., Cherkasov R.A. S-Esters and S-organoelement derivatives of monoterpenyl dithiophosphonic acids // Первый кластер конф. ChemWasteChem. Тез. докл. С.-Петербург, 14-18 июня 2010 г. С. 120.
12. Nizamov I.S., Bolshakova O.V., Almetkina L.A., Sofronov A.V., Gabdullina G.T., Martianov Ye.M., Alfonsov V.A., Cherkasov R.A. Phosphorylated monotepenes and tartrates // Первый кластер конф. ChemWasteChem. Тез. докл. С.-Петербург, 14-18 июня 2010 г. С. 119.
13. Cherkasov R.A., Sofronov A.V., Martianov Ye.M., Nizamov I.S., Terenzhev D.A. Terpen analogues of dithiophospate pesticides // 18-th Intern. conf. on the chemistry of phosphorus compounds. Book of abstracts. Wroclaw. Poland, July 11-150th 2010. P. 135. (P2.03.92).

