Физико-химические закономерности адсорбционного извлечения рения из свинецренийосмийсодержащих микродисперсных продуктов медного производства
УДК 544.723 На правах рукописи
ГОГОЛЬ ДАНИИЛ БОРИСОВИЧ
Физико-химические закономерности адсорбционного извлечения рения из свинецренийосмийсодержащих микродисперсных продуктов медного производства
02.00.04 – Физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Республика Казахстан
Караганда, 2007
Работа выполнена в ТОО «Институт проблем комплексного освоения недр»
Научные руководители: академик НАН РК,
доктор технических наук
Бектурганов Н.С.
кандидат химических наук, доцент
Бисенгалиева М.Р.
Официальные оппоненты: доктор химических наук
Агельменев М.Е.
кандидат химических наук
Закарин С.З.
Ведущая организация: АО «Научно-производственный
центр «Фитохимия»
Защита состоится « 1 » октября 2007 г. в 1400 на заседании диссертационного совета ОД 14.07.01 при Карагандинском государственном университете им. Е.А.Букетова по адресу: 100028, г. Караганда, ул. Университетская, 28, химический факультет, актовый зал.
С диссертацией можно ознакомиться в библиотеке КарГУ им. Е.А.Букетова по адресу: г. Караганда, ул. Университетская, 28.
Автореферат разослан « » 2007 г.
Ученый секретарь

диссертационного совета ОД 14.07.01,
доктор химических наук Ш.К.Амерханова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Благодаря ряду ценных физико-химических свойств, рений и осмий занимают важное место в современной научно-технической индустрии как в Казахстане, так и в других странах. Однако, ввиду их крайне редкого распространения в земной коре, особенно важным становится вопрос об альтернативных источниках их получения. В некоторых современных технологических процессах, например при производстве меди и никеля, происходит концентрирование этих элементов в попутных техногенных продуктах, таких как пыли электрофильтров, сернокислотные шламы, промывная серная кислота и т.д. Извлечение полезных компонентов из каждого из этих источников требует особого подхода и знания физико-химических особенностей поведения элементов в процессах их извлечения. Как правило, подобные технологические процессы протекают на границе поверхности раздела фаз, что является предпосылкой для привлечения целого комплекса различных методов их исследования. Особенную сложность для изучения представляют адсорбционные процессы, нередкие в этих условиях, поскольку они сочетают в себе признаки как физического, так и химического взаимодействия.
Несмотря на широкое применение адсорбционных методов при извлечении рения, физико-химическая сторона этого процесса отражена недостаточно. Между тем налицо присутствует значительная потребность в качественном и количественном термодинамическом описании происходящих при этом взаимодействий, в частности для повышения эффективности существующих способов извлечения рения, а также при разработке новых технологических процессов. В данной работе представлены результаты исследования термодинамических и кинетических характеристик процесса адсорбции перренат-иона на активированном угле при различных условиях.
Степень разработанности проблемы. Имеющиеся в научно-технической литературе сведения о термодинамических аспектах адсорбции рения на активированном угле носят в основном прикладной характер. Поэтому всестороннее изучение данного вопроса является одним из приоритетных направлений при освоении вторичных источников редких элементов. На данный момент разработано большое количество разнообразных методов извлечения этих элементов из пылей и шламов медного производства, которые зачастую характеризуются сложностью, низкими значениями показателей извлечения и высокой энергоемкостью. Большей частью это связано с недостаточно изученным физико-химическим поведением рения в соответствующих технологических процессах, а также с весьма сложным составом исходных продуктов.
Цель работы. Целью диссертационной работы являлось определение физико-химических характеристик адсорбции рения на активированном угле как одного из основных процессов в ряде способов его извлечения. При проведении данного исследования объектами служили продукты, образующиеся в результате производства меди, а также экспериментальный активированный уголь, получаемый активацией спецкокса, изготовляемого из шубаркольских углей.
Предметом исследования являлось адсорбционное взаимодействие перренат-иона с поверхностью сорбента в различных условиях. Среди всего прочего к таковым относились повышенные температуры, продолжительность процесса, наличие тех или иных примесей в растворе, в котором происходит адсорбция и т.п. В задачи работы, помимо проведения физико-химических исследований, входило исследование особенностей протекания адсорбции рения на экспериментальном активированном угле.
Научная новизна. Впервые получены термодинамические параметры адсорбции рения на экспериментальном активированном угле, обладающем развитой системой переходных пор. На основании этих данных предложен механизм адсорбции, а также приведено физико-химическое обоснование возможности совмещения нескольких технологических процессов при извлечении рения из конвертерных пылей медеплавильного производства. При моделировании процесса адсорбции перренат-иона на активированном угле по методу вероятностно-детерминированного планирования эксперимента для повышения надежности и корректности описания математических моделей с помощью обобщенных уравнений применялись модифицированные варианты и приемы выведения данных уравнений. При обработке данных по методу равновесно-кинетического анализа использован метод решения кинетического уравнения, позволяющий одновременно найти равновесную концентрацию и сумму констант скоростей прямой и обратной реакции.
Основные положения, выносимые на защиту:
1 Результаты изучения структуры и свойств экспериментального активированного угля, свидетельствующие о наличии у него развитого объема переходных пор, в котором происходит основная адсорбция рения.
2 Термодинамические и кинетические параметры адсорбции перренат-иона на активированном угле, рассчитанные на основании экспериментов по методу матричного планирования.
3 Предложенный на основании расчетных данных механизм адсорбции перренат-иона на экспериментальном активированном угле, отражающий изменение режима протекания процесса при повышении температуры.
Связь работы с планом государственных научных программ. Данная диссертационная работа проводилась в соответствии с тематикой научно-исследовательских работ Института проблем комплексного освоения недр по теме "Изучить физико-химические закономерности селективного обогащения микродисперсий" в рамках фундаментальной программы Ф.0267.
Практическая значимость работы. На основе исследованных физико-химических особенностей адсорбции перренат-иона на активированном угле разработан конкурентноспособный способ извлечения рения из свинцовой конвертерной пыли медного производства, потенциально применимый и к другим видам вторичного техногенного сырья. Определенные в результате проведения работы термодинамические характеристики адсорбции могут применяться при разработке технологических схем и процессов по извлечению рения.
Апробация работы. Результаты диссертационной работы докладывались и обсуждались на республиканских и международных научных конференциях: II Международной научно-практической конференции "Теоретическая и экспериментальная химия", Караганда, 2004; Международной научно-практической конференции "Физико-химические процессы в газовых и жидких средах", Караганда, 2005; XV Международной конференции по химической термодинамике, Москва, 2005.
Публикации. По материалам диссертации опубликовано 9 печатных работ. Из них тезисов докладов в сборниках конференций – 3, статей в периодических научных изданиях – 3, предварительных патентов РК – 3.
Объем и структура диссертации. Диссертационная работа состоит из введения, пяти разделов, заключения и списка использованных источников, включающего 89 наименований. Объем диссертации составляет 135 страниц машинописного текста, работа включает в себя 34 таблицы и 29 рисунков.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Введение
Вводная часть диссертации содержит обоснование актуальности темы и выбора направления исследования. В ней приведена общая характеристика существующей ситуации в изучении физико-химических свойств процессов с участием рения и сформулированы цели и задачи диссертационной работы.
1 Обзор научно-исследовательских работ в области химии и производства рения
В литературном обзоре приводится сравнительный анализ методов извлечения рения из различных технологических продуктов, из которого видно, что непосредственное извлечение из природных руд является затруднительным процессом. Поэтому основное внимание при производстве рения уделяется его извлечению из вторичных техногенных источников, как правило обладающих повышенным содержанием рения по сравнению с исходными продуктами.
2 Экспериментальное исследование физико-химических параметров адсорбции перренат-иона из водных растворов на активированном угле с применением метода вероятностно-детерминированного планирования эксперимента
В качестве основного методологического подхода для исследования физико-химических свойств адсорбции перренат-иона на активированном угле был применен метод вероятностно-детерминированного планирования эксперимента, хорошо зарекомендовавший себя при решении широкого круга научно-практических задач. Одним из преимуществ этого метода является возможность изучения кинетических и термодинамических величин исследуемых процессов.
2.1 Характеристика состава и свойств исходных веществ, используемых в эксперименте
Перед проведением экспериментов были изучены структурные и физико-химические свойства исходных веществ и материалов, использованных в данном исследовании. Одним из них являлась ренийсодержащая пыль электрофильтров конвертерного цеха Жезказганского медеплавильного завода (АО "Корпорация "Казахмыс"). Содержание основных компонентов в пыли составило (мас.%): свинец – 47,3; сера – 12; цинк – 7,74; медь – 2,5, содержание рения в пыли равнялось 100 г/т. Материал содержал 100% частиц класса крупности 0,05 мм.
При обработке конвертерной пыли раствором карбоната натрия происходит переход сульфата свинца в его карбонаты, что подтверждается данными ИК-спектроскопии и рентгенофазового исследования. Кек при этом приобретает характерную голубовато-зеленую окраску, вызванную карбонатами меди. При этом происходит переход в раствор цинка и кадмия, а также рения, причем извлечение рения в раствор закономерно повышается с ростом температуры, достигая максимума при 90°С (см. рисунок 1). Таким образом, температурная обработка является необходимым условием для перевода рения в раствор.

Рисунок 1 - Извлечение рения из пыли при карбонизации
Активированный уголь (АУ) представлял собой экспериментальный сорбент, разработанный в лаборатории чугуна и топлива Химико-металлургического института им. Ж.Абишева. Исходным веществом для его производства является спецкокс, получаемый из шубаркульского угля, мелкая фракция которого подвергается высокотемпературной активации перегретым водяным паром. Характерной особенностью данного активированного угля является наличие развитого объема переходных пор, наиболее предпочтительных по своим размерам для адсорбции перренат-иона (наиболее вероятный эффективный радиус пор сорбента равен 4,37·10-9 м). Средний размер удельной поверхности мезопор, определенной по адсорбции фенола из водных растворов, составляет 430 м2/г, что на порядок превышает ее обычную величину для прочих коксовых углей.
В таблице 1 приведены характеристики экспериментального сорбента в сравнении с характеристиками некоторых марок активированных углей.
Таблица 1 - Характеристики углеродных сорбентов
| Марка угля | БАУ | КАД | АГ | Экспериментальный АУ |
| Кажущаяся плотность, г/см3 | 0,35 | 0,64 | 0,88 | 0,662 |
| Истинная плотность, г/см3 | 1,80 | 1,82 | 1,98 | 1,756 |
| Объем 1 грамма угля, см3/г | 2,85 | 1,56 | 1,14 | 1,51 |
| Объем пор, см3/г | 2,30 | 1,01 | 0,63 | 0,941 |
| Пористость | 0,805 | 0,65 | 0,55 | 0,623 |
| Зольность, % | 0,2 | 10,3 | 6,3 | 7,04 |
Анионообменная емкость использованного в экспериментах образца угля по 0,01 н. HCl составила 0,148 мг-экв/г, при этом катионообменная емкость меньше анионообменной активности, как и у всех свежеприготовленных неокисленных АУ и составляет 0,018 мг-экв/г по 0,01 н. NaOH.
Также была измерена теплота смачивания активированного угля. Тепловой эффект измерялся с использованием метастатического термометра Бекмана. Теплота смачивания экспериментального сорбента в случае дистиллированной воды составила 6,583±0,205 Дж/г, в случае изоамилового спирта 37,446±0,382 Дж/г, что указывает на высокое сродство АУ к гидрофобным жидкостям.
2.2 Подготовка, проведение и результаты экспериментов по исследованию физико-химических параметров адсорбции перренат-иона на активированном угле
Для изучения физико-химических параметров адсорбции перренат-иона на активированном угле были проведен ряд опытов по поглощению рения углеродным сорбентом из модельных растворов по методу вероятностно-детерминированного планирования эксперимента. Для этого был составлен план проведения шестифакторного эксперимента на пяти уровнях, в качестве исследуемых факторов были выбраны температура раствора, концентрация рения и сульфата натрия, продолжительность адсорбции и размер частиц сорбента. Д В таблице 2 приведено распределение варьируемых факторов по уровням.
Таблица 2 - Уровни факторов эксперимента по адсорбции рения
| Фактор | Уровни фактора | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Температура раствора t, С | 20 | 35 | 50 | 70 | 90 |
| Концентрация рения со, г/л | 0,02 | 0,05 | 0,1 | 0,2 | 0,5 |
| Концентрация сульфата натрия сNa, г/л | 0 | 50 | 100 | 150 | 200 |
| Время, час | 0,5 | 1 | 2 | 4 | 8 |
| Средний размер частиц АУ d, мм | 0,025 | 0,062 | 0,137 | 0,300 | 0,515 |
Модельные растворы приготовлялись из перрената аммония NH4ReO4 марки "ч.д.а.", сульфата натрия десятиводного Na2SO4·10H2O марки "х.ч." и воды дистиллированной. Адсорбция проводилась в термостатированной ячейке. Анализ содержания рения в растворе и промывных водах после адсорбции проводился фотометрически с использованием роданидного метода по стандартной методике.
Помимо содержания рения в продуктах при проведении экспериментов определялась также величина рН раствора до и после адсорбции. Концентрация водородных ионов в растворе измерялась на ионометре с помощью хлорсеребряного электрода. Повышение щелочности раствора возникает в соответствии с условной схемой анионообменной адсорбции:
NH4ReO4 + C [OH] C [ReO4]адс + NH4OH.
На основании данных о величине рН исходного модельного раствора и фильтрата найдено число активных центров на единице поверхности АУ и доля перренат-ионов, сорбирующихся на них с образованием химической связи. Для данного экспериментального угля среднее число активных центров составляет 1,21012 см-2. Таким образом, содержание хемособированного рения в АУ может достигать 0,2% по массе, что в несколько раз меньше, чем общее количество перренат-иона, способного сорбироваться на угле. Следовательно, большая часть перренат-ионов сорбируется по молекулярному механизму.
3 Физико-химические и кинетические характеристики адсорбции перренат-иона на активированном угле
В настоящей работе рассмотрены четыре возможных варианта получения математических моделей. Эти варианты включают вычисление среднего арифметического и среднего геометрического данных выборок и объединение найденных частных зависимостей как их суммы и как их произведения.
3.1 Вариации построения математических моделей извлечения рения при его адсорбции активированным углем
При математической обработке результатов матричного эксперимента были получены частные зависимости, описывающие извлечение рения в АУ, его содержание и пр. от какого-либо фактора. Эти зависимости после их проверки на достоверность использованы для выведения обобщенных моделей. Обобщенные уравнения содержания рения в активированном угле имеют следующий вид:

![]()
Графические изображения частных зависимостей, вошедших в состав этих уравнений, представлены на рисунке 2. Значимыми здесь являются температура, концентрация рения в растворе и время адсорбции. При этом точки, рассчитанные по среднему геометрическому, имеют меньшую тенденцию к выбросам.
Результаты расчета по (1-4) и данные эксперимента сравнивались с помощью среднего квадратичного отклонения, коэффициента нелинейной множественной корреляции R и его значимости tR. Величины критериев показывают, что наиболее точно описывает данные эксперимента уравнение (4), где частные функции выводились из данных, найденных через среднее геометрическое выборок, а обобщенное уравнение представлено в виде произведений этих функций.
3.2 Термодинамические характеристики и кинетика адсорбции перренат-иона на активированном угле
Помимо создания математических моделей процесса, обобщенные уравнения используются для описания его кинетических характеристик. Адсорбция рения на АУ является гетерогенной реакцией первого порядка с формальной схемой:
Ств + NH4ReO4(р-р) С(ReO4-)тв + NH4+(р-р).
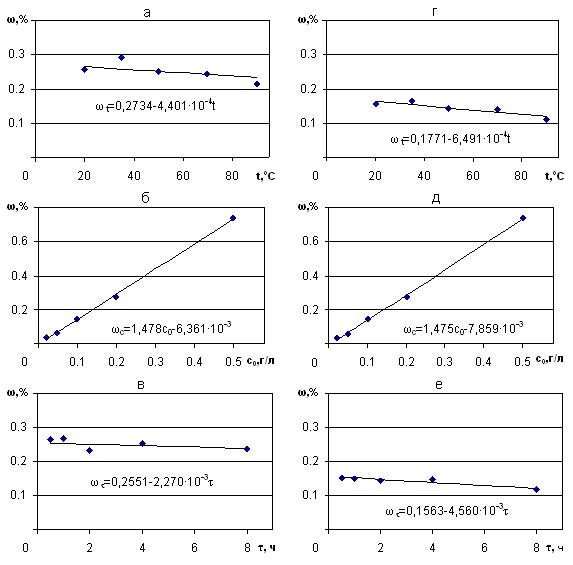
Рисунок 2 - Частные зависимости содержания рения в сорбенте, вычисленные:
а,б,в - по среднему арифметическому; г,д,е - по среднему геометрическому
Скорость реакции определяется частной производной по времени для уравнения, описывающего степень протекания процесса. При этом, поскольку поверхность раздела фаз при адсорбции не изменяется, то нет необходимости в дополнительных преобразованиях обобщенного уравнения. Зависимость изменения скорости реакции от температуры характеризует энергию активации процесса.
Для адсорбции рения на активированном угле одним из показателей степени протекания процесса является содержание рения в угле. При дифференцировании обобщенного уравнения содержания рения получено выражение для скорости
 ,
,
которое позволяет рассчитать значения скоростей адсорбции перренат-иона при разных температурах в условиях постоянства площади поверхности раздела фаз.
Полученный массив скоростей приводился к линеаризованной форме, что показано на рисунке 3. Разные прямые соответствуют разным степеням реагирования в плане многофакторного эксперимента, однако найденные для них энергии активации являются одинаковыми, что достигается независимостью изменения скорости процесса от температуры по степени реагирования. Энергия активации процесса адсорбции рения составляет 22,57±6,34 кДж/моль.
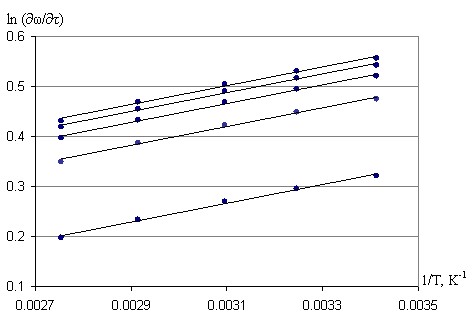
Рисунок 3 - Массив скоростей адсорбции перренат-иона для твердой фазы
Это значение энергии активации вычислено на основании данных о содержании рения в твердой фазе и, следовательно, относится к той части процесса адсорбции перренат-иона, которая протекает непосредственно в глубине зерен активированного угля, то есть к стадии внутренней диффузии.
При расчете энергии активации из данных о содержании рения в растворе имеет место иная картина. Здесь показателем степени протекания процесса для адсорбции рения на активированном угле является отношение начальной концентрации рения в растворе (со) к конечной концентрации (с). После дифференцирования и преобразований было получено выражение для скорости процесса адсорбции перренат-иона из раствора на активированном угле
 .
.
Полученные массивы скоростей и температуры в линеаризованной форме представлены на рисунке 4. На графике наблюдается заметное отклонение от прямолинейности, свидетельствующее об изменении степени реагирования с температурой. Поэтому по методу наименьших квадратов были определены прямолинейные отрезки, в пределах которых соблюдается единый механизм протекания реакции. Для области температур менее 40°С энергия активации составляет Еа=64,13±4,87 кДж/моль, а для температур более 40°С составляет Еа=15,86±1,21 кДж/моль. Это изменение соответствует переходу общего режима протекания процесса из диффузионной области в кинетическую.
Данные матричного эксперимента также использовались для определения термодинамических параметров процесса адсорбции рения на АУ. Для различных концентраций рения при разных температурах был рассчитан массив значений натуральных логарифмов константы равновесия, по которым было определено уравнение зависимости константы равновесия от температуры lnKp=(6064,9±139,5)/T–(12,70±0,29). В этом уравнении коэффициент при температуре равен –H/R, а отрезок, отсекаемый на оси ординат, составляет S°/R и дает значение изменения стандартной энтропии при адсорбции.
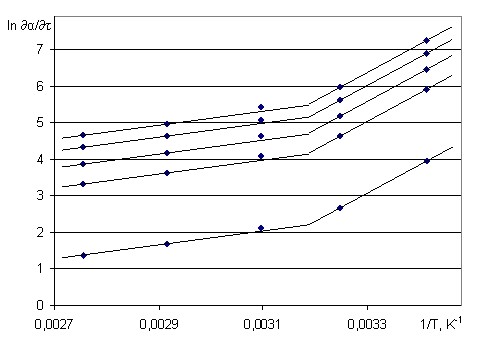
Рисунок 4 - Массив скоростей адсорбции перренат-иона из раствора
Таким образом, для адсорбции перренат-иона на активированном угле изменение энтальпии Нреак=50,43±1,16 кДж/моль, а изменение стандартной энтропии S°реак=105,59±2,43 Дж/мольК. График зависимости константы равновесия от температуры представлен на рисунке 5.
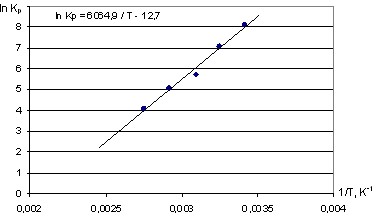
Рисунок 5 - Зависимость логарифма константы равновесия от температуры
Величина Gреак, рассчитанная для температуры 90°С, составляет 12,10±0,28 кДж/моль, что указывает на большую вероятность протекания адсорбции перренат-иона на активированном угле при повышенных температурах.
Для определения прочих кинетических характеристик рения были проведены дополнительные эксперименты по сорбции рения на активированном угле во временном диапазоне до 30 минут. Полученные данные по адсорбции перренат-иона на активированном угле представлены в таблице 3.
Кинетическая кривая адсорбции перренат-иона на активированном угле в интервале до 30 мин изображена на рисунке 6. Также на этом рисунке приведена кривая убыли перренат-иона из раствора, являющаяся величиной, обратной величине адсорбции и определяемая как разность между максимально возможной величиной адсорбции и действительным ее значением в данный момент времени.
Таблица 3 - Кинетические характеристики адсорбции перренат-иона
| № оп | , мин | С/С0 | Величина адсорбции a, г/г | Убыль Re из раствора, г/г | Относительная адсорбция | |
| 1 | 1 | 7,7 | 0,415 | 5,6710-3 | 4,0610-3 | 0,630 |
| 2 | 2 | 11,0 | 0,433 | 5,8010-3 | 3,9910-3 | 0,645 |
| 3 | 3 | 13,4 | 0,427 | 5,8510-3 | 3,9210-3 | 0,650 |
| 4 | 5 | 17,3 | 0,484 | 6,4010-3 | 3,4410-3 | 0,711 |
| 5 | 10 | 24,5 | 0,516 | 6,4810-3 | 3,2510-3 | 0,720 |
| 6 | 15 | 30,0 | 0,532 | 7,3310-3 | 2,4510-3 | 0,815 |
| 7 | 20 | 34,6 | 0,728 | 7,5010-3 | 2,3310-3 | 0,833 |
| 8 | 30 | 42,4 | 0,641 | 7,9910-3 | 1,8610-3 | 0,887 |

- величина адсорбции, - убыль из раствора
Рисунок 6 - Кинетические кривые адсорбции рения
Реакцию комплексообразования в случае анионогенного сорбента и перренат-иона условно можно записать как
![]() ,
,
для которой n – число функциональных групп (лигандов), взаимодействующих с одним перренат-ионом, а R представляет поверхность сорбента, рассматриваемую как один радикал. Константа нестойкости образующегося комплекса:
 . (5)
. (5)
Для расчета величин констант диссоциации Kдисс анионогенных групп на поверхности активированного угля были использованы результаты их кислотно-основного титриметрического определения в присутствии метилового оранжевого. Величина константы основной диссоциации угольного сорбента, рассматриваемого как слабое основание, составляет Kдисс=5,6210-17.
Константа обмена основных групп на перренат-ион KReO4-OH равняется 25,56. Тогда, в соответствии с уравнением (5), константа нестойкости для адсорбционного комплекса перренат-ион – уголь на поверхности сорбента будет составлять Kнест=2,210-18. Эта величина значительно превосходит значение констант нестойкости для железа, меди и РЗЭ, образующих на угле прочные поверхностные комплексы с константами порядка 10-7–10-9.
3.3 Определение внешне- и внутридиффузионных коэффициентов процесса адсорбции перренат-иона на активированном угле
Процесс сорбции в общем случае складывается из трех стадий: приближение молекул сорбируемого вещества ко внешней поверхности зерен (внешняя диффузия), диффузии внутрь зерен (внутренняя диффузия) и закрепление молекул на внутренней поверхности сорбента (собственно акт сорбции). Скорость процесса формально может быть выражена уравнением диффузии с некоторым эффективным значением коэффициента диффузии. Процесс диффузии в однородное сферическое тело описывается дифференциальным уравнением
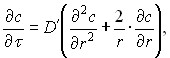
где D' – коэффициент диффузии на единицу сечения пористого тела, r – координата в направлении радиус-вектора. Решение этого уравнения для случая шарообразных зерен сорбента приводит к формуле, по которой вычисляется значение эффективного коэффициента диффузии из экспериментальных данных:

где 0,5 – время достижения относительной величины адсорбции =0,5, которое определяется по точке пересечения кинетических кривых на рисунке 6. Величина эффективного коэффициента диффузии при адсорбции перренат-иона на АУ составляет 4,3910-12 м2/с, ее порядок характерен для процессов, лимитирующей стадией которых является диффузия. Величина коэффициента внутренней диффузии составляет Di=2,3910-11 м2/с. Как видно из полученных значений, коэффициент внутренней диффузии имеет большую величину, чем коэффициент эффективной диффузии. Следовательно, при процессе адсорбции рения на активированном угле лимитирующей стадией является не диффузия перренат-иона в порах, а его диффузия из раствора к поверхности сорбента.
Таким образом, общий характер кинетической картины адсорбции перренат-иона на экспериментальном активированном угле складывается следующим образом. При комнатных и близких к ним температурах процесса на активных центрах углеродного сорбента происходит химическая сорбция перренат-иона, на остальной поверхности активированного угля имеет место молекулярная сорбция с меньшими величинами энергии связи. При этом скорость адсорбции зависит только от скорости подхода перренат-ионов из глубины раствора к поверхности сорбента, поскольку величина скорости диффузии сорбированных ионов от поверхности внутрь пор активированного угля значительно ее превышает.
При повышении температуры проведения процесса до 40С происходит увеличение подвижности перренат-ионов в растворе. В соответствии с этим диффузионная стадия процесса перестает быть лимитирующей и адсорбция перренат-иона на АУ из раствора переходит в кинетическую область.
С дальнейшим возрастанием температуры скорость диффузии перренат-ионов становится сопоставимой со скоростью их диффузии в порах зерен сорбента. При этом благодаря прочности связи поверхностных комплексов перренат-ионов, которые характеризуются высокими значениями констант устойчивости, общая величина адсорбции рения на активированном угле в целом вплоть до температуры 90С уменьшается незначительно.
4 Равновесно-кинетический анализ адсорбции перренат-иона на активированном угле
Данные по адсорбции рения, полученные в результате проведения эксперимента по методу вероятностно-детерминированного планирования, также были использованы для расчета кинетических и физико-химических характеристик адсорбции с применением равновесно-кинетического анализа.
4.1 Вывод равновесно-кинетического уравнения адсорбции перренат-иона на активированном угле
При молекулярной адсорбции перренат-иона на активированном угле в системе протекают как прямая, так и обратная реакции:
ReO4 (р-р) ![]() ReO4 (адс.)
ReO4 (адс.)
следовательно, процесс описывается кинетическим уравнением для обратимой реакции первого порядка. Скорость такой реакции определяется как разность скоростей прямой и обратной реакции с константами k1 и k2 соответственно:

Здесь с0 – начальная концентрация рения в растворе, с – текущая концентрация рения. Окончательное решение данного уравнения имеет вид:

После нахождения неизвестных величин в уравнении – равновесной концентрации и констант скоростей прямой и обратной реакции, по известным соотношениям определяются константа равновесия реакции, энергия Гиббса, изменение энтальпии и энтропии реакции, энергии активации прямой и обратной реакции. Также из полученных выражений были выведены уравнения для расчета текущей концентрации рения в растворе во всем массиве экспериментальных данных при любых значениях времени, начальной концентрации и температуры.
4.2 Расчет исходных данных и определение кинетических и термодинамических величин адсорбции рения по методу равновесно-кинетического анализа
По данным матричного эксперимента были получены выражения для расчета сглаженных значений текущей концентрации рения при адсорбции на АУ для среднего арифметического и для среднего геометрического соответственно:


Поскольку равновесно-кинетическое уравнение процесса адсорбции в логарифмической форме представляет собой уравнение прямой, то для его решения найденные значения концентрации рения для каждой температуры и концентрации наносились на график в координатах ln[(с0-ср)с/(с-ср)с0] – , который приводился к прямолинейному виду путем подбора равновесного значения концентрации рения в растворе. Критерием при этом служил максимум коэффициента детерминированности (величина R-квадрат), определяющий, близость набора данных к описывающей их зависимости. На рисунке 7 представлен пример внешнего вида линеаризованной зависимости до и после численного определения значения равновесной концентрации.
![Зависимость ln[(с0-ср)с/(с-ср)с0]– (с0=2,6910-4 моль/л, t=20С)-21](/images1/247727/zavisimost-ln-s0-srs-s-srs0-s0.jpg)
![Зависимость ln[(с0-ср)с/(с-ср)с0]– (с0=2,6910-4 моль/л, t=20С)-22](/images1/247727/22-zavisimost-ln-s0-srs-s-srs0-s0.jpg)
Рисунок 7 – Зависимость ln[(с0-ср)с/(с-ср)с0]– (с0=2,6910-4 моль/л, t=20С) при произвольном значении равновесной концентрации (ср=210-6 моль/л) и после численного определения (ср=6,06310-7 моль/л)
Критерий, используемый при нахождении равновесной концентрации, имеет один максимум в интервале возможных равновесных концентраций от нуля до текущей концентрации (рисунок 8). Это дает возможность применять данный метод для определения наиболее адекватной равновесной концентрации путем численного решения равновесно-кинетического уравнения, так как величина ср определяется одновременно для всех значений времени.
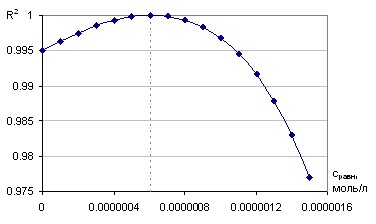
Рисунок 8 – Изменение корреляционного коэффициента при варьировании равновесной концентрации (t=20С)
Из полученного массива найденных значений равновесной концентрации и величины k1+k2 определялись сначала константа скорости обратной реакции, затем константа равновесия и константа скорости прямой реакции. По константе равновесия найдена температурная зависимость энергии Гиббса. Коэффициенты в уравнении прямой соответствуют изменению энтальпии и изменению энтропии реакции на исследованном температурном отрезке (Тср=330К). Значения Hср и Sср адсорбции рения на АУ, полученные из среднего арифметического, равняются соответственно 32,93±0,44 кДж/моль и 61,06±0,81 Дж/(мольК) и для среднего геометрического 35,20±0,65 кДж/моль и 68,34±1,27 Дж/(мольК). Эти значения указывают, что процесс сорбции рения сопровождается закономерным выделением тепла и уменьшением энтропии за счет большей упорядоченности сорбционного состояния.
Энергии активации прямой и обратной реакции определялись по значениям логарифма константы скорости реакции в аррениусовых координатах. Полученные зависимости обрабатывались на уравнение прямой по методу наименьших квадратов (рисунок 9). Среднее значение энергии активации адсорбции рения на АУ для среднего арифметического составляет 30,87±0,37 кДж/моль, и среднее значение энергии активации десорбции 63,81±1,01 кДж/моль. Для набора данных на основе среднего геометрического эти величины составляют 30,38±0,68 кДж/моль и 65,44±1,91 кДж/моль соответственно.
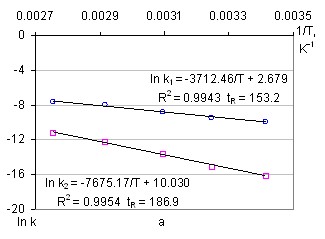
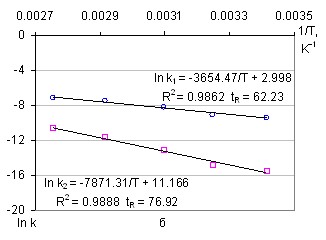
Рисунок 9 – Зависимость констант скорости прямой и обратной реакции от температуры: а – среднее арифметическое, б – среднее геометрическое
4.3 Построение обобщенных зависимостей на основе данных равновесно-кинетического анализа
На основании значений констант скоростей прямой и обратной реакции, а также равновесной концентрации рассчитано изменение концентрации рения по времени при его адсорбции на активированном угле для каждой изотермы.
Для описания процесса изменения текущей концентрации рения в кинетическое уравнение подставлены выражения для зависимостей логарифмов констант скоростей прямой и обратной реакции от температуры. Для среднего арифметического и среднего геометрического получены уравнения:

и

соответственно, в которых с0 – исходная концентрация рения в растворе, моль/л; Т – температура проведения адсорбции, К; – продолжительность процесса, с. Коэффициенты нелинейной множественной корреляции расчетных данных с экспериментом составили 0,8827 и 0,9034 со значимостями 18,32 и 22,51 для среднего арифметического и среднего геометрического соответственно.
5 Контрольные эксперименты по адсорбции рения активированным углем из различных продуктов медного производства
В данном разделе представлены результаты опытов по извлечению рения на экспериментальном сорбенте из различных технологических продуктов.
5.1 Адсорбция рения при карбонизации конвертерных пылей
Извлечение рения производилось при карбонизации конвертерных пылей одновременно с адсорбцией на АУ. Выделение угля с сорбированным рением из пульпы карбонизации проводилось флотацией с применением высших спиртов. Среднее содержание рения во флотационном концентрате составило 0,098%
5.2 Извлечение рения из медного флотационного концентрата
При окислительном выщелачивании из медного концентрата при адсорбцией и последующей флотацией в угольный концентрат переходит до 40% рения.
5.3 Десорбция перренат-иона с активированного угля
Десорбцию перренат-иона с поверхности АУ проводилась раствором гидроксида аммония NH4OH. Вычислен коэффициент эффективной диффузии при десорбции перренат-иона, равный 2,310-12 м2/с. Стадией, определяющей скорость процесса, является диссоциация поверхностных комплексов перренат-иона.
5.4 Поведение осмия при переработке свинцового шлама
Поскольку спутником рения в Жезказганском месторождении является осмий, было исследовано и поведение осмия при карбонизации свинцовых шламов с одновременной адсорбцией на активированном угле. Содержание осмия в шламах сернокислотного цеха достигает 80-90 г/т, что более чем на порядок превышает его среднее содержание в конвертерных пылях медеплавильного производства и в пылях электрофильтров.
В условиях проведения карбонизации некоторая часть осмия способна переходить из свинцового шлама в раствор, откуда затем сорбируется активированным углем. При последующем флотационном разделении АУ и продуктов карбонизации свинцового шлама с помощью изоамилового спирта получается угольный концентрат, содержащий повышенное количество осмия по сравнению с исходным шламом. При этом содержание осмия в фильтратах и промывных водах составляло в большей части случаев менее процента, что говорит о хорошей поглощающей способности АУ по отношению к осмию.
ЗАКЛЮЧЕНИЕ
В результате проведения в рамках данной диссертационной работы физико-химических исследований в области адсорбции перренат-иона на активированном угле получены следующие результаты:
- Установлено, что активированный уголь имеет развитый объем переходных пор, которые по своим размерам наиболее предпочтительны для адсорбции перренат-иона. Адсорбция перренат-иона на данном АУ протекает на анионообменных центрах, на остающейся поверхности при этом происходит адсорбция молекул с более низкими значениями энергии связи.
- Определены следующие физико-химические параметры для адсорбции рения на активированном угле: энергии активации прямой и обратной реакции, константа равновесия и ее температурная зависимость, а также равновесные значения Нреак, S°реак и Gреак адсорбции перренат-иона на АУ. Вычислены коэффициент внутренней диффузии перренат-иона в порах зерен сорбента (Di=2,3910-11 м2/с), а также коэффициент эффективной диффузии (De=4,3910-12 м2/с). Определена средняя величина констант нестойкости для поверхностных адсорбционных комплексов перренат-ион – активированный уголь, равная 2,21018, что свидетельствует о большой устойчивости комплексов рения.
- Предложен механизм адсорбции перренат-иона на активированном угле, объясняющий изменение режима протекания процесса при 40С.
- Предложен способ извлечения рения, основанный на карбонизации исходного продукта одновременно с адсорбцией рения на углеродном сорбенте и последующим флотационным отделением активированного угля.
Оценка полноты решения поставленных задач. При проведении исследований по теме диссертационной работы был успешно решен круг первоначально поставленных задач. При этом теоретические вопросы, касающиеся физико-химических аспектов адсорбции рения на активированном угле проработаны достаточно подробно, в то время как заключения по поводу практического применения полученных результатов носят в целом общий и рекомендательный характер. Тем не менее, эти основы являются плодотворными и перспективными в плане дальнейших исследований. По результатам проведенных исследований была поданы три заявки на получение предварительного патента на изобретение Республики Казахстан.
Разработка рекомендаций и исходных данных по конкретному использованию результатов. Имеющими практическую значимость являются вычисленные по результатам проведения экспериментов термодинамические и кинетические параметры адсорбции перренат-иона на активированном угле. Эти данные целесообразно использовать при разработке и расчете новых способов извлечения рения, а также для оптимизации существующих технологий.
Оценка научного уровня выполненной работы. Все полученные в результате расчетов значения и математические зависимости подвергались проверке на достоверность и значимость с помощью статистических критериев, таких как коэффициент нелинейной множественной корреляции, критерий Налимова, среднее квадратичное отклонение и пр. Подобные приемы и методы используются в ряде научных работ аналогичной направленности. При этом для каждой расчетной термодинамической величины была также вычислена ее погрешность в соответствии с особенностями ее математического нахождения. Таким образом, в целом диссертационная работа была проведена на должном научном уровне с использованием надежной методологической базы.
Список опубликованных работ по теме диссертации
- Гоголь Д.Б., Бисенгалиева М.Р., Беляев С.В., Бектурганов Н.С., Богоявленская О.А. Исследование закономерностей процесса извлечения рения в углеродный сорбент с использованием математического планирования эксперимента // Вестник Евразийского государственного университета им. Л.Н.Гумилева. - 2004. - №2(38). - С.229-233.
- Гоголь Д.Б., Бисенгалиева М.Р. Кинетические закономерности адсорбции рения углеродным сорбентом // Материалы II междунар. научно-практич. конф. "Теоретическая и экспериментальная химия". - Караганда, 2004. - 295 с.
- Гоголь Д.Б., Беляев С.В., Бисенгалиева М.Р. Варианты многофакторного моделирования сорбционного извлечения рения из растворов // Вестник Карагандинского государственного университета им. Е.А.Букетова. Серия Химия. - 2004. - №3. - C.9-14.
- Гоголь Д.Б., Бисенгалиева М.Р. Характеристики углеродного сорбента при адсорбции рения // Материалы Междунар. научно-практич. конф. "Физико-химические процессы в газовых и жидких средах". - Караганда, 2005. - 388 с.
- Гоголь Д.Б., Бисенгалиева М.Р., Бектурганов Н.С. Кинетические и равновесные параметры адсорбции рения на углеродном сорбенте // Вестник Карагандинского государственного университета им. Е.А.Букетова. Серия Химия. - 2005. - №2. - C.6-14.
- Гоголь Д.Б., Бектурганов Н.С., Бисенгалиева М.Р. Диффузия перренат-иона в углеродном сорбенте // Тезисы докл. XV Междунар. конф. по химической термодинамике. - Москва, 2005. - Т.2. - 429 с.
- Предв. пат. 15323 РК, МПК6 С22B 61/00. Способ извлечения рения из медной руды / Беляев С.В., Бектурганов Н.С., Оскембекова Ж.С., Гоголь Д.Б., Шерембаева Р.Т., Габитова Т.М.; заявл. 16.06.03, опубл. 17.01.05, бюл. № 1.
- Предв. пат. 15842 РК, МПК6 С22B 7/02, С22B 61/00. Способ переработки рений,- осмийсодержащих пылей медеплавильного производства / Шерембаева Р.Т., Бектурганов Н.С., Оскембекова Ж.С., Оскембеков И.М., Гоголь Д.Б., Габитова Т.М., Жинова Е.В.; заявл. 07.02.03, опубл. 15.06.05, бюл. № 6.
- Предв. пат. 15323 РК, МПК6 H01G 9/042. Способ извлечения рения из пыли медеплавильного производства / Бектурганов Н.С., Беляев С.В., Гоголь Д.Б., Оскембекова Ж.С., Габитова Т.М., Шерембаева Р.Т., Кузгибекова Х.М., Богоявленская О.А.; заявл. 07.06.04, опубл. 15.12.05, бюл. № 12.
Гоголь Даниил Борисович
МЫС НДІРІСІНДЕГІ РАМЫНДА ОРАСЫН РЕНИЙ ОСМИЙ КОМПОНЕНТТЕРІ БАР МИКРОДИСПЕРСТІ НІМДЕРІНЕН РЕНИЙДІ АДСОРБЦИЯЛЫ ТСІЛМЕН БЛІП АЛУДЫ ФИЗИКА-ХИМИЯЛЫ ЗАДЫЛЫТАРЫ
Химия ылымдарыны кандидаты ылыми дрежесін алу шін
дайындалан диссертацияны авторефераты
02.00.04 - физикалы химия
ТЙІН
Зерттеу объектісі. Шбаркл кмірінен алынатын эксперименттік кокс кміртек сорбентіні физикалы жне химиялы сипаттамалары аныталан. Активтендірілген кмірде рений жне осмийді негізгі адсорбциясы жретіні длелденген, йткені ол дамыан кшпелі саылаулар жйесімен абылеттелінген жне анионоалмасу адсорбциясына жасы икемделінгенін крсетеді.
Жмысты масаты. Жанама техногендік німдерінен рений жне осмий шыарып алу тсілдерін отайландыру масатымен эксперименттік активтендірілген кмірде перренат-ион адсорбциясыны физика-химиялы зерттеуі жргізілді.
Жмысты жргізу дістемесі. Зерттеу жмыстары экспериментті детерменді-ытималдылы жоспарлау жне бірдей салматы-кинетикалы талдау дістерін олданып жасалды.
Жмыс нтижелері. Модельдік эксперимент ткізу нтижесінде активтендірілген кмірде перренат-ион адсорбциясыны термодинамикалы жне кинетикалы параметрлері аныталан: сйы жне атты фазалардаы активация энергиясы, тепе-тедік константасы жне оны температураа туелділігі, жне активтендірілген кмірде перренат-ион адсорбциясыны Нреак, S°реак мен Gреак тепе-тедік шамалары адсорбция жру кезеіндегі химиялы реакциясыны ту фактісін крсетеді. Сонымен атар перренат-ион саылауларындаы сорбент тйірлеріні ішкі диффузия мен эффективтік диффузия еселіктері есептелінген, кмір бетіндегі активтік орталарыны саны мен пайда болатын адсорбциялы комплекстеріні тратылыты бааланан. Алынан мліметтерді анализіні негізінде адсорбцияны ту ерекшеліктерін тсіндіретін механизмі жасалынан. Осыан сйкес перренат-иондарыны бір блігі кмірді активтік орталарында орныты хемосорбцияланады, ал алан перренат-иондар бліктерінде бекітіледі де сорбент тйірлеріні тбіне арай здеріні абелеттілігіні арасында топталып кмірденуін амтамасыз етеді.
олдану саласы. Зерттеу нтижесінде алынан адсорбцияны физика-химиялы параметрлері сирек металдарды алу процестеріні технологиялы лгілерін жасау кезеінде пайдалануа болады.
Зерттеу объектісін дамытудаы алдын-ала болжау жадайлары. сынып отыран механизмні негізгі аидаларын пайдаланып, мыс ндірісіні жанама техногендік німдерінен олдануа потенциалды ммкіндігі ке рений жне осмий алу тсілі жасалынды.
Gogol Daniil Borisovich
PHYSICAL-CHEMICAL REGULARITIES OF ADSORPTIONAL EXTRACTION OF RHENIUM FROM LEAD-RHENIUM-OSMIUM-CONTAINING MICRODISPERSIONAL PRODUCTS OF COPPER PRODUCTION
The report of the dissertation thesis on competition of a scientific degree of candidate of chemical sciences on a trade 02.00.04 – physical chemistry
THE RESUME
Subject of inquiry. The physical and chemical characteristics of experimental coke carbonic sorbent obtained from Shubarkul coals were determined. It was established that the present absorbent carbon have developed system of transitional pores where main rhenium and osmium adsorption is carried out, and also well expressed ability to the anion-exchanged adsorption.
The object of operation. The physical-chemical investigation of perrhenate-ion adsorption on experimental absorbent carbon was carried out on purpose to optimization of the methods of rhenium and osmium extraction from the technogenic by-products.
Methodology of conducting of operation. The investigations were carried out with usage of the methods of stochastic-determined scheduling of an experiment and equilibrium-kinetic analysis.
Results of operation. In result of the carrying of modelling experiments the thermodynamic and kinetic parameters of perrhenate-ion adsorption on absorbent carbon were determined: activation energy in liquid and solid phases, equilibrium constant and its temperature dependence, as well as equilibrium values of Нreac, S°reac and Greac under perrhenate-ion adsorption on absorbent carbon, which magnitudes are pointing at fact of chemical reaction passage in time of adsorption. Also the internal diffusion quotient of perrhenat-ion in pores of sorbent grains and effective diffusion quotient of adsorption were calculated; the quantity of active centres on sorbent surface and stability of nascent adsorptional complexes were estimated. On the ground of obtained data analysis the adsorption passage mechanism was elaborated which explained its peculiarities. In accordance with it, a part of perrhenate-ions is strongly chemically adsorbed on active centres of the sorbent, while other perrhenate-ions are fixed on the surface in molecular adsorption mechanism and provided mass-transfer into depth of sorbent grains on account of their mobility.
Range of application. The physical-chemical parameters of adsorption obtained in results of carrying out of the researches can be used in development of technological schemes in rare metals recovery processes.
Probable proposition on evolution of a subject of inquiry. With using of basic positions of proposed mechanism the method of rhenium and osmium recovery from the technogenic by-products of copper production was developed which have a wide potential abilities of its application.
Подписано в печать 27.06.2007 г.
Печать цифровая
Формат изд. 60х84/16
Объем 1,19 п.л. Тираж 100 экз.
Отпечатано ОО "Граждане Казахстана"
г. Караганда, ул. Ермекова, 32. Тел. 56-15-55

