Трансформация пиридинового ядра в синтезе фотоактивных соединений (
На правах рукописи
Фомина Марина Викторовна
ТРАНСФОРМАЦИЯ ПИРИДИНОВОГО ЯДРА В СИНТЕЗЕ ФОТОАКТИВНЫХ СОЕДИНЕНИЙ
(02.00.03 – Органическая химия)
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
кандидата химических наук
Москва – 2006
Работа выполнена в лаборатории синтеза и супрамолекулярной химии фотоактивных соединений Центра фотохимии РАН (г. Москва)
Научный руководитель: доктор химических наук, профессор
Громов Сергей Пантелеймонович
Официальные оппоненты: доктор химических наук, профессор
Злотин Сергей Григорьевич
(ИОХ им. Н.Д. Зелинского РАН)
кандидат химических наук, доцент
Харитонова Ольга Виленовна
(МИТХТ им. М.В. Ломоносова)
Ведущая организация: НИИ физической и органической химии РГУ
Защита состоится 4 декабря 2006 года в 15 часов на заседании диссертационного совета Д 212.120.01 при Московской государственной академии тонкой химической технологии им. М. В. Ломоносова по адресу: 119571, Москва, проспект Вернадского, д. 86.
С диссертацией можно ознакомиться в библиотеке Московской государственной академии тонкой химической технологии им. М. В. Ломоносова по адресу: 119571, Москва, проспект Вернадского, д. 86.
Автореферат разослан 3 ноября 2006 года
| Ученый секретарь диссертационного совета, кандидат химических наук, старший научный сотрудник | |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Одним из важнейших свойств пиридина и его аннелированных производных является способность к реакциям раскрытия и трансформации цикла. Эти реакции вызывают значительный теоретический интерес, однако большинство из них не используются в препаративных целях. Особенно привлекательными являются реакции трансформации пиридинового ядра под действием С-нуклеофилов. Это связано прежде всего с тем, что карбанионы, имея разнообразные структуру и функциональные группы, обладают потенциальной способностью к различным типам включения в состав образующейся молекулы в реакциях трансформации пиридинового ядра. Мы поставили задачу реализовать потенциал этого типа превращений для синтеза фотоактивных соединений.
Разрабатываемая нами новая методология синтеза фотоактивных соединений с использованием трансформации пиридинового ядра представляется нам в ряде случаев перспективной альтернативой существующим в химии традиционным подходам.
Важной областью применения этой методологии может быть создание молекулярных устройств и машин. Одним из свойств молекул, пригодных для этих целей, должна быть способность к самосборке. Удобным способом управления такими системами является свет, который можно легко регулировать как по длине волны, так и по количеству.
Представляло интерес объединить фрагмент краун-эфира и стириловый краситель, содержащий двойную связь -С=С-, с целью получения соединений, обладающих как способностью к самосборке в комплексы, так и к молекулярному фотопереключению.
Другим перспективным направлением является молекулярное конструирование светоизлучающих супрамолекулярных систем. Такие системы могут быть построены на основе циклодекстринов, которые легко образуют комплексы включения. Циклодекстриновые псевдоротаксановые комплексы с протяженными молекулами “гостей” рассматриваются в качестве прототипов молекулярных машин челночного типа. Однако до сих пор описаны лишь единичные примеры фоточувствительных псевдоротаксановых комплексов. Возможные преимущества фоточувствительных псевдоротаксановых комплексов на основе циклодекстринов и органических люминофоров нафталинового ряда до настоящего времени все еще остаются нереализованными.
Ещё один тип молекулярного светоизлучающего устройства может быть создан на основе супрамолекулярных люминесцентных комплексов с лантанидами. Востребованными в этом отношении являются комплексы Eu(III) и Tb(III) с лигандами пиридинового ряда, обладающие интенсивной флуоресценцией. Несмотря на явную перспективность таких комплексов набор используемых лигандов пиридинового ряда недостаточно широк.
Данная работа выполнена при финансовой поддержке Российской академии наук, Министерства образования и науки РФ (№ 02.435.112.002, № 02.435.111.2010), Международного научно-технического центра (ISIC) (№ 2368), Международного научного фонда (ISF) (№ M8Q000, № M8Q300).
Цель работы. Разработка метода синтеза краунсодержащих стириловых красителей индоленинового ряда с использованием превращения солей нитропиридиния в индолы, изучение их спектральных характеристик, комплексообразующих свойств и транс-цис-фотоизомеризации. Разработка метода синтеза 4нафтилпиридинов и 4-нафтилдипиридила, с использованием новой реакции межмолекулярной трансформации пиридинового ядра, исследование их флуоресцентных свойств и комплексообразования с циклодекстринами и в составе комплексов с лантанидами. Первичное исследование биологической активности полученных 4-нафтилпиридинов с целью выявления нейропротекторных и нейротоксических свойств.
Научная новизна. Предложен метод синтеза неописанных ранее краунсодержащих стириловых красителей индоленинового ряда. За основу подхода к их получению был взят метод синтеза индолов из солей нитропиридиния, ацетона и алкиламинов. Был уточнён механизм начальных стадий трансформации пиридинового цикла в индольный и оптимизирована методика синтеза полиалкилиндолов.
Впервые осуществлено исследование структуры, спектральных, комплексообразующих и фотохимических свойств краунсодержащих стириловых красителей индоленинового ряда. Была установлена способность красителей этого типа образовывать супрамолекулярные комплексы, которые обладают свойствами молекулярных фотопереключателей.
Предсказана и экспериментально реализована новая реакция трансформации пиридинового ядра солей изохинолиния в 4-нафтилпиридины и 4-нафтилдипиридил. Изучен предполагаемый механизм протекания этой реакции. Было установлено, что незамещенный изохинолин также может участвовать в реакциях трансформации пиридинового цикла. На примере солей 2-метилбензотиазолия продемонстрирована возможность распространения найденной реакции на другие гетероциклические системы.
Изучены флуоресцентные свойства и комплексообразование 4-нафтилпиридина и его производных с циклодекстринами и редкоземельными металлами. Исследована нейропротекторная и нейротоксическая активность четвертичных солей нафтилпиридиния.
Практическая ценность. Усовершенствован препаративный метод синтеза индолов из солей нитропиридиния. Разработан удобный и эффективный синтез солей полиметилиндолениния, что в практическом отношении даёт возможность для регулирования гидрофильно-липофильного баланса синтезируемых красителей, увеличения их устойчивости к фотодеградации.
Разработан метод получения краунсодержащих стириловых красителей индоленинового ряда, который стал предметом патента РФ. Синтезированные красители нового типа проявляют значительную селективность к различным катионам металлов.
Разработан простой и удобный метод синтеза 4нафтилпиридинов и 4-нафтилдипиридила с использованием доступных веществ, высокой степени чистоты и с хорошими выходами, который стал предметом патента РФ. Полученные нафтильные производные дипиридила и пиридина перспективны в качестве лигандов и органических люминофоров.
Предложен метод получения комплексов лантанидов с производными нафтилпиридина, которые могут представлять интерес в качестве эффективных металлокомплексных люминофоров.
Разработаны методы синтеза функциональных производных 4-нафтилпиридина, проявляющих нейропротекторные и нейротоксические свойства.
Публикации и апробация работы. По теме диссертационной работы опубликованы 9 статей, получены 2 патента, 1 статья принята в печать. Результаты исследований докладывались и обсуждались на XXVIII Научной конференции факультета физико-математических и естественных наук (Москва, 1992), XL XLI Всероссийских научных конференциях по проблемам математики, информатики, физики, химии и методики преподавания естественных дисциплин Российского университета дружбы народов (Москва, 2004 2005), на Международной конференции по фотохимии содружества независимых государств (Киев, Украина, 1992), The Seventh International Conference on Organized Molecular Films (Numana (Ancona), Italy, 1995), XX International conference on photochemistry (Moscow, Russia, 2001), IX Международной конференции “Проблемы сольватации и комплексообразования в растворах” (Плес, Россия, 2004), X International seminar on inclusion compounds (ISIC-10) (Kazan, Russia, 2005), VIII Молодежной научной школе-конференции по органической химии (Казань, Россия, 2005), Международной конференции по химии гетероциклических соединений, посвященной 90-летию со дня рождения профессора А. Н. Коста (Москва, Россия, 2005), II Молодежной конференции ИОХ РАН (Москва, Россия, 2006).
Структура и объём диссертации. Диссертационная работа общим объёмом 175 страниц состоит из введения, списка используемых в диссертации сокращений, литературного обзора, обсуждения полученных результатов, экспериментальной части, выводов, списка литературы и приложения. Диссертация содержит 149 схем, 43 таблицы и 18 рисунков. Список литературы включает 259 публикаций.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ РАБОТЫ
1. Синтез краунсодержащих стириловых красителей индоленинового ряда
1.1. Синтез индолов
За основу подхода к получению краунсодержащих стириловых красителей индоленинового ряда был взят разработанный ранее способ синтеза N-алкилиндолов из солей нитропиридиния, кетонов и аминов.
В качестве исходных солей нитропиридиния были выбраны соединения 1a,b. Основными продуктами реакции солей 1a,b являются N-метилиндолы 2a-c.
 R = H (a,b), Me (c); R1 = H (a,c), Me (b); R2 = Me (a,c), H (b)
R = H (a,b), Me (c); R1 = H (a,c), Me (b); R2 = Me (a,c), H (b)
Использование водных растворов алкиламинов и изменение температурного режима реакции позволяет упростить методику синтеза индолов и повысить его эффективность.
Найдено, что оптимальной является температура 40 °С, при которой выход индола 2a при взаимодействии 1a с водным раствором метиламина и ацетона составил 56%. Использование этой температуры позволило увеличить выход 2a в реакции 1a с 10%-ным раствором метиламина в ацетоне и достичь выхода 72%.
Однако, при действии н-октадециламина в ацетоне на 1а индол 2d образуется только с выходом 5%. Мы нашли увеличение выхода N-октадецилиндола 2d (до 18%) при использовании добавки поверхностно-активного бромида 1-цетилпиридиния и диспергировании реакционной смеси. Этот результат можно объяснить гомогенизацией в водном ацетоне малорастворимого н-октадециламина и обычным эффектом концентрирования реагирующих веществ в условиях мицеллярного катализа.
Другим продуктом реакции является индол 2а. Помимо индолов мы обнаружили образование орто- и пара-нитроанилинов 3а,b. Отличие этого необычного направления реакции от наблюдаемого ранее заключается в том, что образование 3а,b, по-видимому, происходит без потери одной из содержащихся в пиридиновом кольце метильных групп. Считаем вероятным, что они образуются в результате енаминовой перегруппировки соли 1а.

Мы предположили, что использование аминокислот позволит расширить диапазон применимости исследуемой реакции индолизации. NКарбоксиалкилиндолы 2e-h были получены с выходами до 23% при взаимодействии тетраметиламмонийных солей -, -, и аминокислот c 1а в ацетоне при 40 °С.

2: R = H (e-g), Bn (h); n = 0 (e,h), n = 1 (f), n = 2 (g)
Таким образом, использование более простых реагентов и изменение температурного режима реакции позволяет значительно упростить способ синтеза и повысить выходы индолов.
Изученные превращения демонстрируют новые возможности в использовании солей нитропиридиния в качестве синтонов для синтеза индолов.
1.2. Синтез солей индолениния
Иодиды индолениния 5a,с-e были получены из индолов 2a-d и иодистого метила в метаноле в запаянной ампуле при 100 °С c хорошими выходами (до 70%). Реакция идет, по-видимому, через стадию образования 2,3диметилиндола 4.

5: R = H (a-d,f), Me (e); R1 = H (a,b,e,f), Me (c,d); R2 = Me (a,b,e,f), H (c,d);
R3 = Me (a-e), C18H37 (f); X = I (a,c,e,f), ClO4 (b,d)
Наилучшие результаты получаются при трехкратном избытке иодистого метила и нагревании в течение 70 ч. При этом в случае индола 2b, в котором отсутствует заместитель в положении 4, реакция протекает особенно легко и может быть завершена за 20 ч. Взаимодействием 5a,c с избытком 57%-ной хлорной кислоты были синтезированы также перхлораты 5b,d.
Таким образом, полученные полиалкилиндолы могут быть использованы для синтеза новых производных индоленина, имеющих важное значение в синтезе разнообразных типов красителей.
1.3. Синтез стириловых красителей
Конденсация полученных солей индолениния 5а-d,f с формильными производными бензо-18(15)-краун-6(5)-, фенилаза-15-краун-5- и бензодитиа-18-краун-6-эфиров до наших работ не была известна. Не были описаны в литературе также примеры образования стириловых красителей с вератровым альдегидом, который является наиболее близким по реакционной способности формильным производным бензокраун-эфиров.
Найдено, что краунсодержащие стириловые красители 7a-f образуются с выходами до 100% при нагревании солей 5a-d,f с формильными производными бензокраун-эфиров 6a,b, фенилазакраун-эфира 6d, соли 5f и бензодитиакраун-эфира 6c в присутствии пиридина. Аналогичным образом взаимодействием солей 5a-d с бензальдегидом 6e, вератровым альдегидом 6f и парадиметиламинобензальдегидом 6g были получены красители 7g-k.
 7: R1 = H (a,c-i,k), Me (b,j); R2 = Me (a,c-i,k), H (b,j); R3 = Me (a,b,d,f-k), C18H37 (c,e);
7: R1 = H (a,c-i,k), Me (b,j); R2 = Me (a,c-i,k), H (b,j); R3 = Me (a,b,d,f-k), C18H37 (c,e);
X = ClO4 (a,b,d,f-i,k), I (c,e,j)
Наличие двух реакционных центров в диформилдибензо-18-краун-6-эфире 8 позволяет получить краситель 9 с двумя одинаковыми стириловыми хромофорами, разделенными фрагментом краун-эфира.

Согласно данным спектроскопии ЯМР 1Н, все полученные стириловые красители 7a-k, 9 существуют в транс-форме.
Таким образом, изучена конденсация полученных солей индолениния с формильными производными краун-эфиров с образованием красителей нового типа. Нами впервые разработан синтез амфифильных краунсодержащих стириловых красителей (7c,e). Одновременно изученные превращения демонстрируют возможности в использовании солей нитропиридиния в качестве синтонов для синтеза стириловых красителей индоленинового ряда.
1.4. Спектральные, фотохимические свойства и комплексообразование краунсодержащих стириловых красителей
Cпектры поглощения и флуоресценции соединения транс-7a приведены на рис. 1. Длинноволновое поглощение соответствует полосе, обусловленной переносом заряда с участием эфирного атома кислорода. При облучении растворов транс-7a в воде светом с = 436 нм поглощение в области длинноволновой полосы уменьшается с одновременным увеличением поглощения в коротковолновой части спектра пока не достигается фотостационарное состояние. Обратные изменения спектров происходят при облучении тех же растворов светом с = 365 нм. Эти спектральные изменения можно объяснить протеканием обратимой фотохимической трансцисфотоизомеризации. После облучения 7a в растворах происходит быстрое темновое восстановление спектров. Это связано с протеканием тепловой цис-транс-изомеризации.

Значения квантовых выходов как прямой, так и обратной фотоизомеризации для всех полученных красителей в полярных растворителях находятся в диапазоне 0.4-0.5.
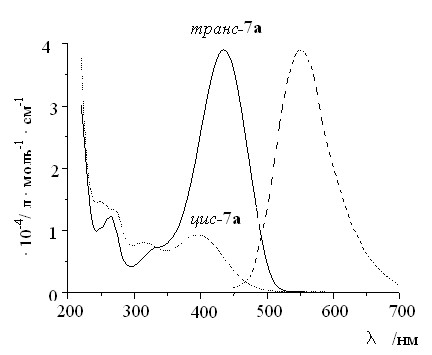 | Рис. 1. Электронные спектры поглощения транс- и цис-изомеров 7а и спектр флуоресценции транс-изомера (интенсивность в произвольных единицах). Вода. Т = 295 К. |
При добавлении в растворы исследуемых соединений перхлоратов щелочных и щелочноземельных металлов (Na, Ca, Mg и др.) наблюдается гипсохромный сдвиг длинноволновой полосы поглощения (ДПП) на 44 нм в случае краунсодержащих 7а-f и на 2-3 нм в случае родственных 7gk, которые не имеют фрагментов краун-эфиров (см. рис. 1).

Таблица 1. Изменения длин волн ДПП красителей 7a,d,f при комплексообразовании в MeCN и в MeOH.
| maxлиг - maxкомп, нм | ||||
| Mn+(ClO4 )n | 7a, | 7d, | 7d, | 7f, |
| MeCN | MeCN | MeOH | MeCN | |
| LiClO4 | 15 | 1 | 0 | 2 |
| NaClO4 | 11 | 8 | 8 | 1 |
| KClO4 | 8 | 13 | 2 | 0 |
| CsClO4 | 3 | 5 | 4 | 1 |
| NH4ClO4 | 4 | 13 | 4 | 0 |
| Mg(ClO4)2 | 42 | 1 | 2 | 0 |
| Ca(ClO4)2 | 39 | 26 | 4 | 1 |
| Sr(ClO4)2 | 33 | 29 | 23 | 0 |
| Ba(ClO4)2 | 28 | 27 | 27 | 1 |
| Eu(ClO4)3 | 2 | 44 | 3 | 0 |
| Tb(ClO4)3 | 1 | 34 | 2 | 1 |
Примечание. Отношение концентрации лиганда к концентрации соли = 0.01.
Величина сдвига ДПП при комплексообразовании зависит в основном от соответствия размеров полости краун-эфира и иона металла, плотности заряда на катионе металла и природы растворителя. Так, было установлено, что ион Мg2+ вызывает сдвиг ДПП красителя 7a в MeCN, превышающий 40 нм. В то же время сдвиг ДПП красителя 7d, который наблюдается при добавлении Mg2+, составляет всего 1 нм. По-видимому, размер полости фрагмента 15-краун-5-эфира красителя 7a в наибольшей степени соответствует размеру иона Mg2+, что и предопределяет эффективное взаимодействие с донорными атомами O краун-эфира, в том числе с атомом O, непосредственно находящимся в сопряжении с хромофором. Наблюдающиеся спектральные эффекты иллюстрирует рис. 2.
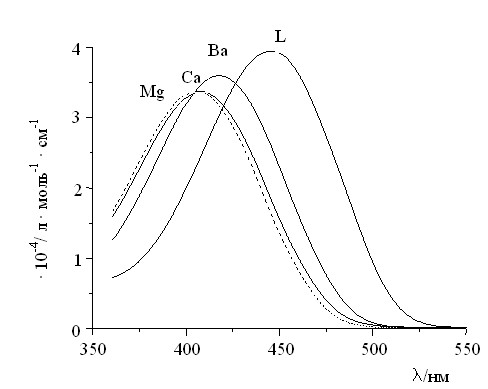 | Рис. 2. Спектры поглощения в MeCN 7а (L) и в присутствии перхлоратов Ва, Са и Mg. CL = 2·10-5 моль·л-1; СM = 1·10-2 моль·л-1. |
Аналогично, при добавлении Eu3+ к раствору красителя 7d, содержащего фрагмент 18-краун-6-эфира, также наблюдается значительный гипсохромный сдвиг ДПП на 44 нм. В то же время сдвиг ДПП 7a в присутствии Eu3+ составляет только 2 нм.
Для изученных красителей наблюдается заметное уменьшение величины сдвига при переходе от MeCN к MeOH. Это, по-видимому, связано с тем, что молекулы MeOH в значительно большей степени, чем молекулы MeCN, могут выступать в качестве конкурирующих с краун-эфирами лигандов при комплексообразовании.
Мы исследовали также комплексообразование красителя 7f, содержащего фрагмент фенилаза-15-краун-5-эфира, и красителя 7k, который имеет в бензольном цикле заместитель NMe2, воспроизводящий в общем виде электронодонорное влияние азакраун-эфирного фрагмента на хромофор. Следовало ожидать, что в отличие от красителя 7f соединение 7k не будет способно в заметной степени к комплексообразованию с ионами металлов. Однако в действительности различий в спектральном поведении обоих соединений при добавлении солей металлов обнаружено не было. По-видимому, участие неподеленной пары электронов “анилинового” атома азота в красителях 7f,k в сопряжении с хромофором исключает возможность образования координационной связи между этим атомом N и катионом металла.
Можно было предположить, что замещение атомов кислорода на атомы серы в краун-эфирном фрагменте красителя 7d снизит сродство к катионам щелочных и щелочноземельных металлов и приведёт к увеличению прочности комплексов с катионами тяжелых металлов. Действительно, сравнение катионов металлов одинакового заряда, и имеющих приблизительно одинаковый ионный радиус показывает, что наибольший гипсохромный сдвиг ДПП 7e вызывают ионы Hg2+ - 25 нм, наименьший ионы Ca2+ - 3 нм (табл. 2).
Таблица 2. Изменения ДПП красителя 7е при комплексообразовании в MeCN.
| Mn+(X-)n | AgNO3 | Cd(ClO4)2·4H2O | Hg(ClO4)2·4H2O | KNO3 | Ca(ClO4)2 |
| maxлиг - maxкомп, нм | 15 | 16 | 25 | 15 | 3 |
Примечание. Отношение концентрации лиганда к концентрации соли = 0.01
Для фотоуправления экстракцией из водных растворов катионов металлов может быть перспективным использование гидрофильной полимерной подложки. С этой целью нами были исследованы фотохимические реакции красителя 7b в плёнках поливинилбутираля (ПВБ) и гидрогелях полиакриламида. Особенность фотоизомеризации 7b из транс-формы в цис-форму и обратно в полимерной плёнке ПВБ состоит в неполном взаимопревращении. Полученный результат хорошо объясняется теорией свободного “объёма”. Фотохимические реакции красителя 7b в геле полиакриламида, как и в растворе, происходили с полным сохранением фотохромных свойств красителя.
Представляло интерес исследовать свойства краунсодержащего красителя в плёнках Ленгмюра-Блоджетт (ЛБ). Мы предположили, что молекулы красителя, имеющего достаточной длины углеводородный радикал, могут быть использованы для самосборки с помощью техники ЛБ на поверхности раздела фаз перспективных супрамолекулярных структур, что позволит управлять комплексообразованием и фотохимическими реакциями.
С этой целью нами были изучены амфифильные стириловые красители 7с,e.

Нам удалось впервые получить из транс-7с,е монослои ЛБ на границе раздела фаз воздух-вода, изучить влияние катионов металлов на их фотохимические и спектральные характеристики. Продемонстрирована высокая, селективная чувствительность плёнок ЛБ на основе транс-7с к ионам Са2+ и на основе транс-7e к парам ртути.
Полученные результаты позволяют говорить о возможности фотоуправления комплексообразованием фотохромного краун-эфира в ЛБ-слоях и создания селективных фотоуправляемых сенсоров на основе хромоионофоров этого класса.
2. Синтез производных нафталина
2.1. Синтез солей пиридиния, изохинолиния и дипиридилия
Необходимым условием протекания реакции нуклеофильной трансформации цикла пиридина или изохинолина является дополнительное активирование пиридинового ядра положительным зарядом на атоме азота. С этой целью были синтезированы четвертичные соли гетероциклических оснований с выходами до 100%.
Синтез солей изохинолиния 11a,b проводили кватернизацией изохинолина и его производного 10b иодистыми алкилами при комнатной температуре.

Кватернизацию 4-(2-нафтил)пиридина (12a) и стерически затруднённых 4-метил-2-фенилпиридина (12b), 4,4’-диметил-2,2’-дипиридила (12c) проводили под действием иодистого метила при нагревании в запаянной ампуле.

2.2. Синтез 4-арилпиридинов.
Недавно в нашей лаборатории было найдено, что соли пиридиния взаимодействуют с солями 4метилпиридиния под действием сульфита метиламмония и образуют 4-фенилпиридины в результате реакции трансформации пиридинового цикла. Можно было предположить, что этот нуклеофильный реагент позволит провести межмолекулярную реакцию трансформации изохинолинового цикла с участием соли пиридиния, содержащей метильную группу в положении 4. Действительно, при нагревании смеси солей 2алкилизохинолиния 11a,c,d и 1алкил-4-метилпиридиния 14a-c с сульфитом метиламмония нами был получен 4нафтилпиридин 12a с выходами 45-62%. Мы предполагаем, что сульфит-ион присоединяется к соли изохинолиния 11a,c,d по положению 6, что приводит к образованию в качестве интермедиата 2,6дигидроизохинолина. Нарушение ароматичности изохинолинового бицикла облегчает его раскрытие. Возникающий при этом нециклический интермедиат конденсируется под действием основания с активной метильной группой соли 4метилпиридиния 14a-c. Последующее электроциклическое замыкание приводит к формированию нафталинового остатка и образованию четвертичной соли 4нафтилпиридиния 13a,15b,c. На последней стадии в результате Nдезалкилирования образуется 4нафтилпиридин 12a.

11: R1 = Et (a), Me (c), i-Pr (d); 14, 15: R2 = Me (a), Et (b), i-Pr (с)
Введение донорной группы в бензольный цикл изохинолина затрудняет присоединение сульфит-иона, что приводит к значительному снижению выхода целевого продукта. Так, при взаимодействии 14a с 11b образуется нафтилпиридин 12d с выходом только 22%. Реакция протекает, по-видимому, в две стадии: на первой возникает гидроксипроизводное 16, на второй происходит замена гидроксигруппы на метиламиногруппу по реакции Бухерера, которая, как известно, легко протекает в нафталиновом ряду.
Можно было предположить, что заключительная стадия изучаемого нами процесса - Nдезалкилирование промежуточной соли 13а,15b,c с образованием 12a. Действительно, нагревание иодида 1-метил-4-нафтилпиридиния 13a в присутствии сульфита метиламмония привело к образованию 12a с выходом 82%.

Найденный метод позволяет проводить трансформацию цикла также самого изохинолина. При длительном нагревании изохинолина и соли 14a с водным раствором сульфита метиламмония можно получить 4нафтилпиридин 12a с выходом до 48%. Довольно высокий выход 12a указывает на то, что пиридиновый цикл изохинолина активирован к нуклеофильной реакции этого типа. Движущей силой этой реакции является, по-видимому, обмен аминного остатка на метиламинный в промежуточной нециклической структуре.

Представляло интерес исследовать влияние заместителей в пиридиновом цикле соли 4-метилпиридиния на реакцию трансформации цикла производных пиридина и изохинолина. В качестве объектов исследования были выбраны соли 4-метил-2-фенилпиридиния 13b и 4,4'-диметил-2,2'-дипиридилия 13c.
При нагревании смеси иодида 17 или 11c и 2-замещенной соли 13b,c с сульфитом метиламмония нами были получены 4-арилпиридины и 4-арилдипиридилы 18a-d с выходами 7–41%. То есть, введение в положение 2 соли 4-метилпиридиния арильных или гетарильных остатков не препятствует протеканию реакции трансформации цикла.

С целью изучения синтетических возможностей изучаемой реакции и для получения новых органических люминофоров мы исследовали возможность осуществления реакции трансформации изохинолинового бицикла под действием четвертичной соли бензотиазолия.
Искомая реакция протекает при нагревании соли бензотиазолия 20 с хлоридом динитрофенилизохинолиния 19 в пиридине, который используется в качестве основания и растворителя, с образованием целевого продукта 21 с выходом 5%.

Таким образом, нами обнаружена новая реакция простейших производных изохинолина, которая может иметь важное значение для химии изохинолина. Реакция основана на взаимодействии солей изохинолиния или самого изохинолина с солями 4метилпиридиния под действием сульфита алкиламмония. Одновременно найден простой и удобный метод синтеза производных 4нафтилпиридина, который позволяет получать производные 4нафтилпиридина из доступных веществ (продукты и отходы коксохимического производства), высокой степени чистоты и с хорошими выходами. Продемонстрировано, что найденная реакция трансформации пиридинового ядра может быть проведена не только с участием четвертичных солей 4-метилпиридиния, но и с участием четвертичных солей других гетероциклических систем.
2.3. Спектральные свойства и строение псевдоротаксановых комплексов нафтилпиридинов и нафтилдипиридила с -циклодекстрином и гидроксипропил--циклодекстрином
Были исследованы спектры электронного поглощения и флуоресценции 4-нафтилпиридина 12a, 4-нафтил-2-фенилпиридина 18c и 4-нафтилдипиридила 18d и их комплексов с -циклодекстрином (-CD) и с гидроксипропил--CD (HP--CD) в растворах. Спектры электронного поглощения всех исследуемых соединений в разных растворителях (гексан, вода) и в нейтральных водных растворах их комплексов с циклодекстринами практически совпадают. Спектры флуоресценции в большей степени зависят от окружения, чувствительны к образованию комплексов включения с циклодекстринами. Спектры флуоресценции 18c,d как и 12a, в неполярных углеводородных растворителях, например, в гексане, имеют хорошо разрешенную структуру, которая исчезает в полярных растворителях (EtOH, MeCN) (рис. 3, спектры 1 и 2).
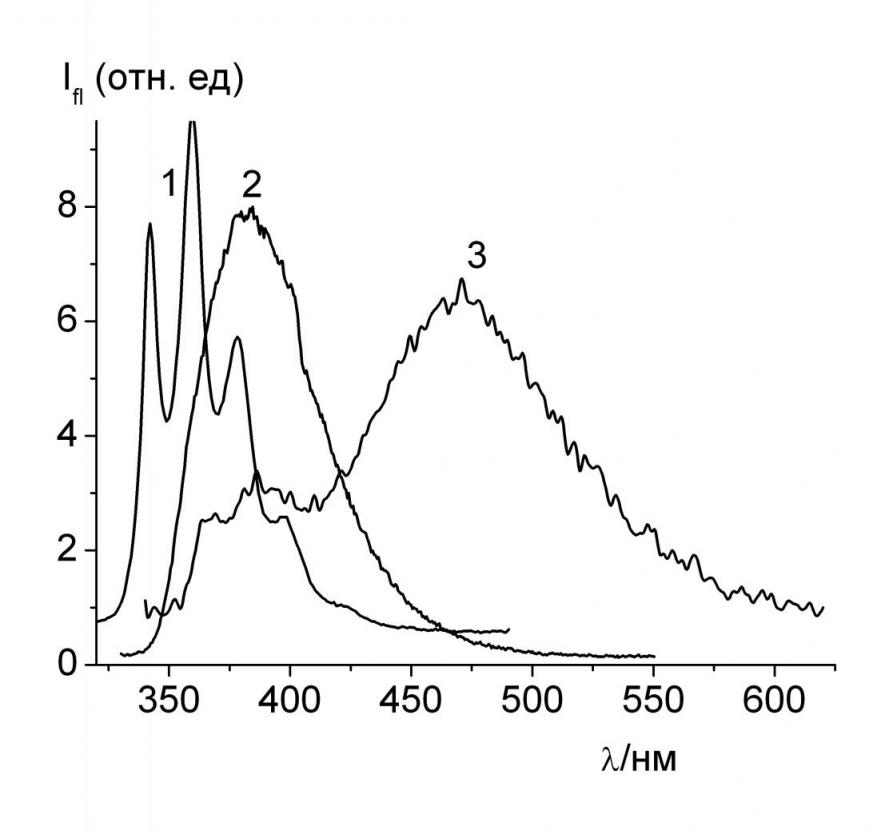 | Рис. 3. Спектры флуоресценции 18d (C = 510-5 мольл-1) при 293 К в гексане (1), в EtOH (2), в воде (3). Коротковолновая часть спектра (3) принадлежит микрокристаллам 18d. |
В водных растворах 12а и 18c,d наблюдается флуоресценция в области 475 нм, которая принадлежит образующимся в возбужденном состоянии протонированным формам этих соединений (рис. 3, спектр 3). Появление этой полосы связано с фотоиндуцированным протонированием пиридинового атома азота (см. на примере 18d).
18d + H2O ![]() (18d·H2O)
(18d·H2O) ![]() (18d *·H2O)
(18d *·H2O) ![]() (18d·H+)* |||| OH-
(18d·H+)* |||| OH-
![]() (18d·H2O) + hn1 (475 нм)
(18d·H2O) + hn1 (475 нм)
В результате взаимодействия -CD и HP--CD с нафтилпиридинами 12a и 18c,d в водном растворе образуются комплексы эквимолекулярного состава с константами устойчивости в интервале от 3425 до 5500 лмоль-1. Образование комплексов включения с CD препятствует протонированию 12a и 18c,d, что проявляется в больших гипсохромных сдвигах максимумов полос в спектрах флуоресценции. Устойчивость комплексов возрастает с увеличением протяженности молекул гостей 18d и их гидрофобности 18c. Схема на примере нафтилдипиридила 18d демонстрирует образование и свойства комплекса HP--CD.
(18d ·H2O) + HP--CD ![]() (18d ·HP--CD) + H2O
(18d ·HP--CD) + H2O ![]() (18d *·HP--CD) + H2O
(18d *·HP--CD) + H2O ![]()
![]() (18d ·HP--CD) + H2O + hn2 (380 нм)
(18d ·HP--CD) + H2O + hn2 (380 нм)
При образовании комплексов этих соединений в полость HP--CD может быть включен нафтильный или пиридиновый остаток молекул.
Измеренные f 18с,d в комплексах с HP--CD составляют 0.34±0.1 и 0.6±0.1, соответственно. Для 12a в водном растворе f протонированной формы близок к единице, а выделить флуоресценцию непротонированной формы 12a в комплексе не удается даже при максимальных концентрациях HP--CD. Для 18d в водном растворе f протонированной формы по меньшей мере на порядок меньше, чем для 12a. В спектрах флуоресценции комплексов состава 1 : 1 наблюдаются два максимума, соответствующие двум типам комплексов с различным расположением молекулы HP--CD относительно протяженной молекулы нафтилпиридина или нафтилдипиридила.
Расчеты показывают, что эти комплексы имеют псевдоротаксановую структуру с преимущественной локализацией циклодекстрина на гидрофобном нафталиновом или пиридиновом остатке. Однако разница между этими двумя расположениями циклодекстрина невелика, что позволяет предположить возможность механических перемещений циклодекстрина вдоль молекулы производного нафтилпиридина в ответ на внешние изменения, что может быть использовано при конструировании на их основе молекулярных машин.
2.4. Синтез комплексов европия(III) и тербия(III) c нафтилпиридином и дипиридилами
Нами были синтезированы модельные комплексы Eu(III) 24a и Tb(III) 25 с дипиридилом 12с и комплексы Eu(III) с нафтилдипиридилом 18d и нафтилпиридином 12a. Все комплексы 24a,b,25,26 были синтезированы по общей методике с хорошими выходами (48-72%) нагреванием спиртового раствора дикетона 22 и пиридинсодержащего лиганда 12с,18d или 12а с хлоридом европия(Ш) или тербия(Ш) в присутствии гидроксида натрия.

R = 2-тиенил (24a,b), Me (25); R1 = Me (12с,24a,25), 2-нафтил (18d, 24b);
M = Eu3+ (24a,b), Tb3+ (25)
По-видимому, реакция протекает в две стадии: на первой образуется трисдикетонатный комплекс 23 который затем присоединяет в качестве дополнительного лиганда производное дипиридила 12с,18d или нафтилпиридина 12а, в результате чего координационное число Eu(III) или Tb(III) возрастает до 8.
Были выращены кристаллы модельного комплекса 25, его молекулярная структура определена методом рентгеноструктурного анализа.
 |  |
| Рис. 4. Молекулярная структура комплекса 25 |
2.5. Синтез функциональных производных 4-нафтилпиридина
Нагреванием нафтилпиридина 12a с 76%-ной азотной кислотой были получены 8-нитронафтилпиридин 27а и 5-нитронафтилпиридин 27b. Последующее восстановление нитропроизводных 27а,b гидразингидратом в присутствии никеля Ренея привело к образованию аминов 28а,b с выходами до 86%.

R1 = NO2 (a), H (b); R2 = H (a), NO2 (b); R3 = NH2 (a), H (b); R4 =H (a), NH2 (b)
С целью получения водорастворимых производных для биологических испытаний были синтезированы четвертичные соли нафтилпиридинов.

Четвертичные соли 29a,b были получены с выходами 77 и 70% взаимодействием 27a,b с иодистым метилом при комнатной температуре.
Поскольку реакция кватернизации аминопроизводных нафтилпиридина 12d,28a,b может протекать также с участием аминогруппы в качестве алкилирующего агента был выбран стерически объёмный метиловый эфир птолуолсульфокислоты.

R1 = NH2 (a), H (b-d); R2 = H (a), NH2 (b), NHMe (c,d)
Реакцию кватернизации 12d,28a,b. проводили сплавлением с метилирующим агентом, что привело к образованию 30а-с с выходами до 68%.
2.6. Исследования биологической активности
Способность веществ защищать нервные клетки от развития нейродегенеративных процессов (нейропротекторная активность) или инициировать гибель нейронов (нейротоксичность) может реализовываться по различным механизмам. Достоверно показано, что ключевую роль в развитии целого ряда неврологических расстройств (таких как болезнь Альцгеймера, склероз и т.п.) играет резкое увеличение внутриклеточного кальция, связанное с гиперактивацией глутаматных рецепторов ЦНС. С другой стороны, показано, что вход ионов Са2+ в клетки в нормальных условиях является обязательным условием реализации процессов памяти и когнитивных функций.
В этой связи, оценка способности экзогенных соединений влиять на процесс входа кальция в клетки рассматривается как адекватная предварительная характеристика нейропротекторного (в случае ингибирования этих процессов), когнитивно-стимулирующего (в случае активации захвата ионов Са2+ до нормального уровня) или нейротоксического (в случае гиперактивации этих процессов) потенциала веществ. Необходимо отметить, что практический интерес представляет проявление всех трёх свойств.
Была проведена сравнительная оценка нейротропных свойств иодида 1-метил-4-(2-нафтил)пиридиния 13а, иодида 1-метил-4-(8-нитро-2-нафтил)пиридиния 29a, иодида 1-метил-4-(5-нитро-2-нафтил)пиридиния 29b, тозилата 4-(8-амино-2-нафтил)-1-метилпиридиния 30a, тозилата 4-(5-амино-2-нафтил)-1-метилпиридиния 30b, тозилата 1-метил-4-(2-(5-метиламинонафтил)пиридиния 30с и модельного нейротоксина МФП (хлорида 1-метил-4-фенилпиридиния) на следующих моделях in vitro:
- Глутамат-индуцированный вход кальция на препаратах синаптосом;
- Модулирование функциональной активности АМРА- и NMDA-глутаматных рецепторов;
- Активность Особых Митохондриальных Пор на препаратах изолированных митохондрий;
- Активность фермента моноаминооксидазы (МАО) типа Б, участвующей в патогенезе паркинсонизма.
В результате проведённых первичных биологических испытаний было показано, что вещества 29b и 30с (см. табл. 3), представляют безусловный интерес для дальнейших исследований на более сложных моделях in vivo, как модельный нейротоксин 29b или как возможный стимулятор памяти 30с.
Таблица 3. Нейротропные свойства производных нафтилпиридина.
| Свойства | 13а | 29а | 29b | 30а | 30b | 30с |
| нейротоксические | + | + | + | - | - | - |
| нейропротекторные | - | - | - | + | + | + |
ЗАКЛЮЧЕНИЕ
Были исследованы два типа реакции трансформации пиридинового ядра под действием С-нуклеофилов в синтезе фотоактивных соединений: трансформация солей нитропиридиния под действием кетонов и аминов и неописанная ранее трансформация пиридинового ядра солей изохинолиния под действием активной метильной группы четвертичной соли гетероциклического основания. В результате выполненного исследования были разработаны методологии синтеза краунсодержащих стириловых красителей индоленинового ряда и производных нафталина.

Был уточнён механизм начальных стадий реакции трансформации пиридинового цикла в индольный. Было показано, что присутствие небольшого количества воды в реакционной смеси и температура 40 °С способствуют протеканию реакции трансформации и увеличению выхода индолов.
Предложен вероятный механизм новой реакции трансформации пиридинового ядра солей изохинолиния и самого изохинолина с участием метильной группы солей 4-метилпиридиния. Было исследовано влияние на эффективность протекания реакции природы и положения заместителей в солях изохинолиния и пиридиния.
Проведённые исследования комплексообразования, фотохимических и флуоресцентных свойств полученных соединений, продемонстрировали возможность применения полученных краунсодержащих стириловых красителей индоленинового ряда в оптических сенсорах для определения катионов металлов и аммония, в качестве фотохромных ионофоров, в полимерных и ЛБ пленках. Гетероциклические производные нафталина могут найти применение в качестве органических люминофоров, в составе электролюминесцентных материалов, при конструировании молекулярных машин и в качестве нейротропных соединений.
ВЫВОДЫ
- Усовершенствован метод синтеза полиалкилиндолов, основанный на реакции трансформации солей нитропиридиния в индолы. Получены неописанные ранее индолы и соли индолениния.
- Разработан синтез красителей нового типа - краунсодержащих стириловых красителей индоленинового ряда, который основан на использовании солей нитропиридиния в качестве синтонов.
- Впервые изучены спектральные, фотохимические свойства и комплексообразование краунсодержащих стириловых красителей индоленинового ряда в растворах и полимерных слоях.
- Разработан синтез неописанных ранее амфифильных краунсодержащих стириловых красителей, изучены их комплексообразование с катионами металлов и фотохимические свойства в растворах и плёнках Ленгмюра-Блоджетт.
- Предсказан и экспериментально реализован новый тип трансформации пиридинового ядра производных изохинолина с участием солей 4метилпиридиния под действием сульфита алкиламмония. Одновременно найден простой и удобный метод синтеза 4нафтилпиридинов и 4-нафтилдипиридила с хорошими выходами. Продемонстрировано, что найденная реакция трансформации может протекать с участием солей 2-метилбензотиазолия.
- Изучены флуоресцентные свойства и комплексообразование 4-нафтилпиридина и его производных с циклодекстринами, продемонстрирована возможность их использования в качестве лигандов в комплексах с редкоземельными металлами.
- Разработан синтез наиболее важных функциональных производных нафтилпиридина. Обнаружена выраженная нейротропная активность четвертичных солей нафтилпиридиния.
Основное содержание диссертации изложено в следующих публикациях:
- Громов С. П., Фомина М. В., Ушаков Е. Н., Леднев И. К., Алфимов М. В. “Синтез, фотоизомеризация и комплексообразование краунсодержащих стириловых красителей.” // ДАН СССР. - 1990. - Т. 314. - № 5. - С. 1135-1138.
- Громов С. П., Фомина М. В., Чудинова Г. К., Барачевский В. А., Алфимов М. В. “Краунсодержащие стириловые красители. 5. Синтез амфифильного хромогенного 15-краун-5-эфира и пленки Ленгмюра-Блоджетт на его основе.” // ДАН СССР. - 1991. - Т. 321. - № 4. - С. 739-744.
- Lednev I. K., Fomina M. V., Gromov S. P., Stanislavsky O. B., Alfimov M. V., Moore J. N., Hester R. E. “A Raman spectroscopic study of indolinium styryl dyes.” // Spectrochim. Acta. - 1992. - Vol. 48A. - N 7. - P. 931-937.
- Громов С. П., Фомина М. В. “Взаимодействие аминокислот с солями нитропиридиния.” // Изв. АН. Сер. хим. - 1993. - № 8. - С. 1505-1506.
- Алфимов М. В., Громов С. П., Назаров В. Б., Пилюгина О. М., Фомина М. В. “Краунсодержащие стириловые красители. Синтез и фотоиндуцированная изомеризация фотохромного 15-краун-5-эфира в полимерных слоях.” // ДАН. - 1993. - Т. 330. - № 4. - С. 453-456.
- Громов С. П., Фомина М. В., Алфимов М. В. “Краунсодержащие стириловые красители. 9. Соли нитропиридиния в синтезе хромогенных краун-эфиров индоленинового ряда.” // Изв. АН. Сер. хим. - 1993. - № 9. - С. 1625-1632.
- Громов С. П., Федорова О. А., Фомина М. В., Алфимов М. В. “18(15)-Краун-6(5)-содержащие стириловые красители в качестве селективных реагентов на катионы аммония, щелочных или щелочноземельных металлов и способ их получения.” // Патент 2012574 РФ; Бюл. изобр., 1994, № 9.
- Громов С. П., Фомина М. В. “4-(2-Нафтил)пиридины и способ их получения.” // Патент 2214401 РФ; Бюл. изобр., 2003, № 29.
- Громов С. П., Фомина М. В. “Взаимодействие производных изохинолина с солями пиридиния с образованием 4-нафтилпиридинов.” // Изв. РАН. Сер. хим. - 2004. - № 4. - C. 864-868.
- Назаров В. Б., Авакян В. Г., Громов С. П., Фомина М. В., Вершинникова Т. Г., Алфимов М. В. “Спектральные свойства и строение супрамолекулярных комплексов нафтилпиридина с -циклодекстрином.” // Изв. РАН. Сер. хим. - 2004. - № 11. – C. 2420-2426.
- Громов С. П., Фомина М. В., Курчавов Н. А., Гришина Ю. Б. “Реакционная способность солей 4-метилпиридиния в новой реакции трансформации цикла производных пиридина и изохинолина.” // ЖорХ. – 2005. - Т. 41. - № 11. – C. 1712-1716.
- Фомина М. В., Громов С. П. “Соли нитропиридиния в синтезе хромогенных краун-эфиров.” // XXVIII Научн. конф. ф-та физ.-мат. и естеств. наук РУДН. - Москва. - 1992. - С. 43.
- Громов С. П., Фомина М. В., Федорова О. А., Алфимов М. В. “Новый класс хромоионофоров и фотохромов.” // Международная конференция по фотохимии содружества независимых государств. - Киев, Украина. - 6-8 октября 1992. - С. 177.
- Fedorova O., Gromov S., Fomina M., Chudinova G., Savransky V., Barachevsky V., Alfimov M. “Synthesis of novel crown ether styryl dyes and their molecular organization in monolayers.” // The Seventh International Conference on Organized Molecular Films. – Numana (Ancona). - Italy. - September, 10-15, 1995. – P - 8.3.-P. 108.
- Nazarov V. B., Avakyan V. G., Gromov S. P., Fomina M. V., Vershinnikova T. G., Alfimov M. V. “Synthesis, structure of complexes with b-cyclodextrin and photophysical properties of naphthylpуridine and its derivatives.” // XX International conference on photochemistry. ICP XX. - Moscow. - Russia. - July 30 - August 4, 2001. – P. 242-243.
- Гришина Ю. Б., Фомина М. В., Громов С. П. “Синтез 4-нафтилпиридина и его функциональных производных.” // XL Всероссийская конференция по проблемам математики, информатики, физики и химии. Москва. - 19-23 апреля 2004. - С. 89-91
- Фомина М. В., Громов С. П., Назаров В. Б., Авакян В. Г., Курчавов Н. А., Вершинникова Т. Г., Алфимов М. В. “Синтез, строение и спектральные свойства супрамолекулярных комплексов нафтилпиридина и его производных с циклодекстрином.” // IX Международная конференция “Проблемы сольватации и комплексообразования в растворах.” - Плес. - 28 июня - 2 июля 2004. - С. 186.
- Черникова В. А., Фомина М. В., Громов С. П. “Синтез стирильных производных дипиридила и нафтилдипиридила.” // XLI Всероссийская конференция по проблемам математики, информатики, физики и химии. Москва. - 18-22 апреля 2005. - С. 76-77.
- Fomina M. V., Gromov S. P., Nazarov V. B., Avakyan V. G., Rudiak V. Yu., Lebedev-Stepanov P. V., Vershinnikova T. G., Alfimov M. V. “Synthesis and Spectral Properties of Naphthylpyridines and Its Complexes with -Cyclodextrin.” // Xth International seminar on inclusion compounds (ISIC-10). – Kazan. – Russia. – September 18-22, 2005. – P-81. – P. 139.
- Рудяк В. Ю., Фомина М. В., Назаров В. Б., Авакян В. Г., Громов С. П., Вершинникова Т. Г., Алфимов М. В. “Синтез, спектральные свойства и строение супрамолекулярных комплексов нафтильных производных пиридина и дипиридила с -циклодекстрином.” // VIII Молодежная научная школа-конференция по органической химии - Казань. - 22-26 июня 2005. - С. 167.
- Фомина М. В., Громов С. П. “Новая реакция трансформации цикла производных изохинолина.” // Международная конференция по химии гетероциклических соединений, посвященная 90-летию со дня рождения профессора А. Н. Коста. – Москва. – Россия. –17-21 октября, 2005. – С240. - C. 338.
- Черникова В. А., Фомина М. В., Громов С. П. “Синтез 4-арилпиридинов и их винилогов.” // II Молодежная конференция ИОХ РАН. - Москва. - 13-14 апреля 2006. - С. 202-204.
------------------------------------------------------------------------------------------------------------------------------------------
Подписано в печать________________ Формат 60х84/16. Бумага писчая. Отпечатано на ризографе. Уч. изд. листов 1,0. Тираж 100 экз. Заказ № _______
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова
Издательско-полиграфический центр 119571 Москва, просп. Вернадского, 86.

